Изобретение относится к области органической химии, в частности к способу получения 11(Е)-тетрадецен-1-илацетата.
11(Е)-Тетрадецен-1-илацетат является половым феромоном лугового мотылька (Loxostege sticticalis), основным компонентом феромонов всеядной листовертки (Archips podana), стеблевого мотылька (Ostrinia nubilalis), еловой листовертки (Choristoneura fumiferana) и некоторых других видов опасных вредителей.
Известен способ получения 11(Е)-тетрадецен-1-илацетата (Р.Е.Sonnet, J.E.Oliver, J. Org. Chem., 1976, vol.41, № 20, p.3279-3283), основанный на инверсии двойной связи (Z)-изомера. Способ заключается в эпоксидировании (11Z)-тетрадецен-1-илацетата, реакции эпоксида с трифенилфосфиндибромидом и восстановлении образующегося дигалогенида активированным цинком. Способ основан на труднодоступном и дорогостоящем (11Z)-тетрадецен-1-илацетате и имеет низкую селективность.
Известен способ получения 11(Е)-тетрадецен-1-илацетата (I.Toshinobu, Y.Akira, Т.Kenichi, патент JP 57024326, 1982), основанный на изомеризации 11(Z)-тетрадецен-1-илацетата в присутствии металлического селена. Способ базируется на труднодоступном и дорогостоящем 11(Z)-тетрадецен-1-илацетате и характеризуется крайне низкой селективностью (E/Z=1.48).
Поскольку уже 1-2% содержание (Z)-изомера ингибирует привлекающие свойства 11(Е)-тетрадецен-1-илацетата, оба способа непригодны для практического применения.
Выбранный нами за прототип способ получения 11(Е)-тетрадецен-1-илацетата (1) (Р.Н.Шахмаев, А.У.Ишбаева, И.С.Шаяхметова, Стереоселективный синтез 11(Е)-тетрадецен-1-илацетата - полового феромона лугового мотылька (Loxostege sticticalis), ЖОХ, 2009, т.79, вып.6, с.999-1002) основан на доступном и дешевом сырье (акролеине), отличается высокой стереоселективностью и включает следующие стадии:
1. реакция Гриньяра акролеина (2) с этилмагнийбромидом с получением 1-пентен-3-ола (3);
2. ортоэфирная перегруппировки Кляйзена с участием 1-пентен-3-ола (3) и триэтилортоацетата с получением этилового эфира 4(Е)-гептеновой кислоты (4);
3. восстановление этилового эфира 4(Е)-гептеновой кислоты (4) литийа-люминийгидридом с получением 4(Е)-гептен-1-ола (5);
4. бромирование 4(Е)-гептен-1-ола (5) комплексом PPh3·Br2 с получением 1-бром-4(Е)-гептена (6);
5. реакция кросс-сочетания 1-бром-4(Е)-гептена (6) с 7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромидом (7) в присутствии каталитической системы CuI-2,2'-бипиридил с получением 11(Е)-тетрадецен-1-ола (8);
6. ацетилирование 11(Е)-тетрадецен-1-ола (8) смесью Ас2О/Ру с получением 11(Е)-тетрадецен-1-илацетата (1).
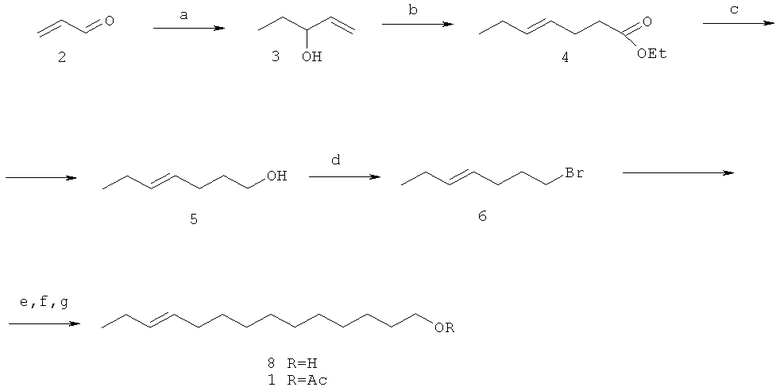
a. EtMgBr; b. СН3С(OEt)3, СН3СООН; с. LiAlH4; d. PPh3-Br2; е. ТГПО (CH2)7MgBr (7), CuI/2,2'-bipy; f. MeOH/TsOH; g. Ас2О/Ру.
Общий выход 11(Е)-тетрадецен-1-илацетата на исходный акролеин составляет 33.5%, в расчете на 1-бром-4(Е)-гептен - 63%.
Способ имеет существенные недостатки на стадии кросс-сочетания 1-бром-4(Е)-гептена с 7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагний-бромидом:
1. Использование дорогостоящего и крайне токсичного катализатора - 2,2'-бипиридила и высокие нормы его расхода (не менее 0.2 моль на 1 моль 1-бром-4(Е)-гептена). По этой причине данный процесс является нетехнологичным и представляет лишь теоретический интерес.
2. Невысокий выход продукта.
Задачей изобретения является создание более дешевого и безопасного способа получения 11(Е)-тетрадецен-1-илацетата с более высоким выходом.
Указанная задача решается тем, что в способе получения 11(Е)-тетрадецен-1-илацетата, включающим реакцию Гриньяра акролеина с этилмагнийбромидом с получением 1-пентен-3-ола, ортоэфирную перегруппировку Кляйзена с участием 1-пентен-3-ола и триэтилортоацетата с получением этилового эфира 4(Е)-гептеновой кислоты, восстановление этилового эфира 4(Е)-гептеновой кислоты с получением 4(Е)-гептен-1-ола, замещение гидроксильной группы 4(Е)-гептен-1-ола на Br с получением 1-бром-4(Е)-гептена, реакцию кросс-сочетания 1-бром-4(Е)-гептена с 7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромидом в присутствии катализатора с получением 11(Е)-тетрадецен-1-ола, ацетилирование 11(Е)-тетрадецен-1-ола с получением 11(Е)-тетрадецен-1-илацетата, согласно изобретению, кросс-сочетание 1-бром-4(Е)-гептена с 7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромидом с получением 11(Е)-тетрадецен-1-ола осуществляется в присутствии катализатора Li2CuCl4 в среде безводного тетрагидрофурана при следующем мольном соотношении [1-бром-4(Е)-гептен]:[7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромид]:[Li2CuCl4]:[тетрагидрофуран]=1:1.2:0.03:20 в течение 1 ч при температуре минус 75°С, затем в течение 1 ч при температуре от минус 75°С до 20°С и в течении 10 ч при 20°С.
Способ осуществляется следующим образом. Смесь 1-бром-4(Е)-гептена, 7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромида и Li2CuCl4 в безводном тетрагидрофуране перемешивают при минус 75°С в течение 1 ч при следующем мольном соотношении реагентов [1-бром-4(Е)-гептен]:[7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромид]:[Li2CuCl4]:[тетрагидрофуран]=1:1.2:0.03:20. Затем температуру реакционной смеси медленно в течение 1 ч повышают до 20°С и перемешивают при этой температуре еще 10 ч. Дальнейшие операции по выделению и очистке 11(Е)-тетрадецен-1-ола не отличаются от прототипа. В результате изобретения выход 11(Е)-тетрадецен-1-ола повышается до 82% (у прототипа - 67%). Общий выход 11(Е)-тетрадецен-1-илацетата на исходный акролеин составляет 41% (у прототипа - 33.5%), в расчете на 1-бром-4(Е)-гептен - 77% (у прототипа - 63%). Содержание (Z)-изомера не превышает 0.5%.
Пример 1. Получение 11 (Е)-тетрадецен-1-ола.
К 7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромиду, полученному из 0.29 г магниевой стружки и 3.35 г 1-бромо-7-[(тетрагидро-2Н-пиран-2-ил)окси] гептана в 6 мл сухого тетрагидрофурана, при -75°С по каплям прибавляли 1.77 г 1-бром-4(Е)-гептена в 7 мл тетрагидрофурана. Затем приливали 3 мл 0.1 М раствора Li2CuCl4 в тетрагидрофуране и смесь перемешивали при -75°С в течение 1 ч. Температуру реакционной смеси медленно в течение 1 ч повышали до 20°С и перемешивали еще 10 ч. Добавляли 20 мл насыщенного раствора NH4Cl, перемешивали 1 ч, органический слой отделяли, а водный экстрагировали эфиром (3×30 мл). Объединенный органический раствор упаривали, остаток растворяли в 20 мл метанола, содержащего 0.05 г TsOH, перемешивали при комнатной температуре 24 ч и снова упаривали. К остатку добавляли 50 мл диэтилового эфира, последовательно промывали насыщенными растворами NaHCO3 и NaCl, сушили Mg2SO4 и концентрировали. Остаток хроматографировали (SiO2, гексан-эфир, 1:1). Выход 1.74 г (82%), nD 20 1.4562. ИК спектр, ν, см-1: 3335 (ОН), 2961, 2926, 2853, 1458, 1057, 964 (транс-НС=). Спектр ЯМР 1Н, δ, м. д.: 0.97 т (3Н, СН3, J 7.3 Гц), 1.21-1.41 м (14Н, СН2), 1.50-1.61 м (2Н, CH 2CH2OH), 1.91-2.06 м (4Н, CH 2CH=), 3.39 с (1Н, ОН), 3.64 т (2Н, СН2ОН, J 6.6 Гц), 5.34-5.48 м (2Н, СН=СН). Спектр ЯМР 13С, δ, м.д.: 13.91 (С14), 25.52 (С13), 25.70 (С3), 29.11 (СН2), 29.39 (СН2), 29.45 (СН2), 29.50 (СН2), 29.55 (CH2), 29.59 (СН2), 32.50 (С10), 32.71 (С2), 62.83 (С1), 129.31 (С11), 131.80 (С12).
Пример 2. Получение 11(Е)-тетрадецен-1-илацетата.
Смесь 0.367 г (1.73 ммоль) 11(Е)-тетрадецен-1-ола, 1.23 г безводного пиридина и 0.88 г уксусного ангидрида перемешивали при комнатной температуре 24 ч, добавляли 20 мл диэтилового эфира, последовательно промывали насыщенными растворами NaHCO3 и NaCl, сушили Mg2SO4 и упаривали. Остаток хроматографировали (SiO2, гексан-эфир, 9:1). Выход 0.414 г (94%), nD 20 1.4481. ИК спектр, ν, см-1: 2957, 2926, 2853, 1744 (С=O), 1366, 1238, 1040, 966 (транс-НС=). Спектр ЯМР 1Н, δ, м. д.: 0.97 т (3Н, СН3, J 7.4 Гц), 1.22-1.43 м (14Н, СН2), 1.58-1.71 м (2Н, СН2 СН 2О), 1.94-2.18 м (7Н, СН3С=O, СН 2СН=), 4.06 т (2Н, СН2О, J 6.6 Гц), 5.34-5.50 м (2Н, СН=СН). Спектр ЯМР 13С, δ, м.д.: 13.91 (С14), 20.86 (СН 3С=О), 25.52 (С13), 25.85 (С3), 28.57 (С2), 29.09 (CH2), 29.18 (CH2), 29.43 (3СН2), 29.59 (СН2), 32.49 (С10). 64.55 (С1), 129.28 (С11), 131.82 (С12), 171.04 (С=О). Масс-спектр, m/z (Iотн, %): 96 (34.41), 82 (72.55), 81 (37.93), 69 (29.43), 68 (77.45), 67 (52.06), 55 (62.13), 43 (100), 41 (58.77).
Предлагаемый способ имеет следующие преимущества:
1. Использование доступного, дешевого и безопасного катализатора с небольшой нормой расхода.
2. Более высокий выход 11(Е)-тетрадецен-1-илацетата.
3. Отсутствие токсичных отходов.
Изобретение относится к усовершенствованному способу получения 11(Е)-тетрадецен-1-илацетата, являющегося половым феромоном лугового мотылька, основным компонентом феромонов всеядной листовертки, стеблевого мотылька, еловой листовертки и некоторых других видов опасных вредителей, включающему реакцию Гриньяра акролеина с этилмагнийбромидом с получением 1-пентен-3-ола, ортоэфирную перегруппировку Кляйзена с участием 1-пентен-3-ола и триэтилортоацетата с получением этилового эфира 4(Е)-гептеновой кислоты, восстановление этилового эфира 4(Е)-гептеновой кислоты с получением 4(Е)-гептен-1-ола, замещение гидроксильной группы 4(Е)-гептен-1-ола на Вr с получением 1-бром-4(Е)-гептена, реакцию кросс-сочетания 1-бром-4(Е)-гептена с 7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромидом в присутствии катализатора с получением 11(Е)-тетрадецен-1-ола, ацетилирование 11(Е)-тетрадецен-1-ола с получением 11(Е)-тетрадецен-1-илацетата, в котором кросс-сочетание 1-бром-4(Е)-гептена с 7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромидом с получением 11(Е)-тетрадецен-1-ола осуществляется в присутствии катализатора Li2CuCl4 в среде тетрагидрофурана при следующем мольном соотношении [1-бром-4(Е)-гептен]: [7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромид]: [Li2CuCl4]: [тетрагидрофуран] = 1:1,2:0,03:20 в течение 1 ч при температуре минус 75°С, затем в течение 1 ч при температуре от минус 75°С до 20°С и в течение 10 ч при 20°С. Поскольку уже содержание 1-2% (2)-изомера ингибирует привлекающие свойства 11(Е)-тетрадецен-1-илацетата, известные способы непригодны для практического применения. Заявленный способ отличается высокой стереоселективностью.
Способ получения 11(Е)-тетрадецен-1-илацетата, включающий реакцию Гриньяра акролеина с этилмагнийбромидом с получением 1-пентен-3-ола, ортоэфирную перегруппировку Кляйзена с участием 1-пентен-3-ола и триэтилортоацетата с получением этилового эфира 4(Е)-гептеновой кислоты, восстановление этилового эфира 4(Е)-гептеновой кислоты с получением 4(Е)-гептен-1-ола, замещение гидроксильной группы 4(Е)-гептен-1-ола на Вr с получением 1-бром-4(Е)-гептена, реакцию кросс-сочетания 1-бром-4(Е)-гептена с 7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромидом в присутствии катализатора с получением 11(Е)-тетрадецен-1-ола, ацетилирование 11(Е)-тетрадецен-1-ола с получением 11(Е)-тетрадецен-1-илацетата, отличающийся тем, что кросс-сочетание 1-бром-4(Е)-гептена с 7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромидом с получением 11(Е)-тетрадецен-1-ола осуществляется в присутствии катализатора Li2CuCl4 в среде тетрагидрофурана при следующем мольном соотношении [1-бром-4(Е)-гептен]: [7-[(тетрагидро-2Н-пиран-2-ил)окси]гептилмагнийбромид]: [Li2CuCl4]: [тетрагидрофуран] = 1:1,2:0,03:20 в течение 1 ч при температуре минус 75°С, затем в течение 1 ч при температуре от минус 75°С до 20°С и в течение 10 ч при 20°С.
| Шахмаев Р.Н | |||
| и др | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Яковлева М.П | |||
| L-Ментол, рицинолевая кислота и 4-метилтетрагидропиран в направленном синтезе эндо- и экзо-гормонов насекомых, Автореферат дисс | |||
| на соиск | |||
| учен | |||
| степени доктора | |||
Авторы
Даты
2011-09-20—Публикация
2010-03-04—Подача