Настоящее изобретение относится к области химии органических пероксидов, конкретно к способу получения циклических геминальных бисгидропероксидов из кетонов с размером цикла С12-С15.
В последние годы проявляется повышенный интерес к органическим геминальным бисгидропероксидам и получаемым на их основе 1,2,4,5-тетраоксанам в связи с высокой антипаразитарной активностью этих соединений [H.-S.Kim, Y.Shibata, Y.Wataya, K.Tsuchiya, A.Masuyama, M.Nojima. Synthesis and Antimalarial Activity of Cyclic Peroxides, 1,2,4,5,7-Pentoxocanes and 1,2,4,5-Tetroxanes. J. Med. Chem., 2604-2609, 42 (1999); J.L.Vennerstrom, H-N.Fu, W.Y.Ellis, A.L.Ager, J.K.Wood, S.L.Andersen, L.Gerena, W.K.Milhous. Dispiro-1,2,4,5-tetraoxanes: a new class of antimalarial peroxides. J. Med. Chem., 3023-3027, 35 (1992); C.W.Jefford. Peroxidic antimalarials. Adv. Drug Res., 271-320, 29 (1997); Y.Dong, H.Matile, J.Chollet, R.Kaminsky, J.K.Wood, J.L.Vennerstrom. Synthesis and Antimalarial Activity of 11 Dispiro-1,2,4,5-tetraoxane Analogues of WR 148999. 7,8,15,16-Tetraoxadispiro[5.2.5.2]hexadecanes Substituted at the 1 and 10 Positions with Unsaturated and Polar Functional Groups. J. Med. Chem., 1477-1480, 42, (1999)]. Кроме того, гем-бисгидропероксиды находят применение в качестве инициаторов радикальной полимеризации [А.А.Сахарова, Я.С.Выгодский, А.О.Терентьев, М.М.Платонов, Д.А.Сапожников, Т.В.Волкова, Г.И.Никишин. Способ получения полиметилметакрилата. Патент РФ 2352587 от 20 апреля 2009 г.] и в синтезе эфиров дикарбоновых кислот [А.О.Terent'ev, М.М.Platonov, A.V.Kutkin. A new oxidation process. Transformation of gembishydroperoxides into esters. Central European Journal of Chemistry, 207-215, 4 (2006)].
Геминальные бисгидропероксиды - производные макроциклических кетонов являются в отличие от своих аналогов со средним размером цикла значительно более труднодоступными соединениями.
Известен способ получения 1,1-бисгидропероксициклододекана взаимодействием циклододеканона с пероксидом водорода (Н2О2) в среде ацетонитрила в присутствии иода в качестве катализатора [K.Zmitek, М.Zupan, S.Stavber, J.Iskra. The Effect of Iodine on the Peroxidation of Carbonyl Compounds. J. Org. Chem. 6534-6540, 72, (2007)]. Реакцию проводят в течение 24 часов при температуре 22°С, выход целевого продукта составляет 60%.
Проблемой использования этого способа является умеренный выход 1,1-бисгидропероксициклододекана, использование в реакции дорогостоящего иода и сложная процедура хроматографической очистки целевого продукта от иода, который нельзя отделить традиционным восстановлением тиосульфатом натрия вследствие одновременного восстановления бисгидропероксида до кетона. Получение циклических бисгидропероксидов с размером цикла С13-С15этим способом не осуществляли.
Известен также способ получения 1,1-бисгидропероксициклододекана взаимодействием циклододеканона с пероксидом водорода в среде ацетонитрила, в качестве катализира использовали оксид рения Re2O7 [Р.Ghorai, P.H.Dussault. Mild and Efficient Re(VII)-Catalyzed Synthesis of 1,1-Dihydroperoxides. Org. Lett. 4577-4579, 10, (2008)]. Реакцию проводят в течение 20 часов с использованием 5% (мольн.) Re2O7, выход целевого продукта составляет 95%.
Существенным недостатком этого способа является использование дорогостоящего и труднодоступного оксида рения. Циклические геминальные бисгидропероксиды с размером цикла С13-С15 этим способом не получали.
1,1-Бисгидропероксициклотридекан (цикл С 13) был получен лишь с выходом 26% реакцией циклотридеканона с пероксидом водорода в муравьиной кислоте [Т.Dåsnes, Т.Ledaal. New Cyclotridecane Peroxides. Acta. Chem. Scand. 1906, 25, (1971)].
Нами принят за прототип двухстадийный способ получения геминальных бисгидропероксидов C12-C15 пероксидированием кетонов через превращение их в кетали с последующим взаимодействием кеталей с пероксидом водорода, катализированным трифторидом бора (BF3) [А.О.Terent'ev, A.V.Kutkin, M.M.Platonov, Yu.N.Ogibin, G.I.Nikishin. A new method for the synthesis of bishydroperoxides based on a reaction of ketals with hydrogen peroxide catalyzed by boron trifluoride complexes. Tetrahedron Lett. 7359, 44, (2003); А.О.Терентьев, А.В.Куткин, M.M.Платонов, З.А.Старикова, Ю.Н.Огибин, Г.И.Никишин. «Синтез 1,1'-бисгидропероксиди(циклоалкил)пероксидов гомоконденсацией 11-15-членных гем-бисгидропероксициклоалканов в присутствии трехфтористого бора». Изв. Ак. Наук. Сер. Хим. 1182 (2005)]. Пероксидирование кетонов проводили в два этапа: сначала кетоны реакцией с триалкилортоформиатом в среде метанола при кипячении превращали в кетали, которые затем выделяли и вводили в катализированную трифторидом бора реакцию с пероксидом водорода при мольном соотношении кеталь:трифторид бора 1:0,2 при комнатной температуре, в результате после выделения с выходом 34-95% в расчете на кеталь (выход 28-80% в расчете на исходный циклоалканон) получали циклические геминальные бисгидропероксиды с размером цикла С12-С15. Общее время проведения двухстадийного синтеза находится в диапазоне 20-24 часов. Для геминального бисгидропероксида с размером цикла С15 из циклопентадеканона - это единственный способ его получения (выход 28% в расчете на взятый циклопентадеканон).
Недостатком известного способа являются его двухстадийность при получении целевых геминальных бисгидропероксидов из кетонов, длительность процесса, а также недостаточно высокий выход бисгидропероксида с размером цикла С15.
Задачей настоящего изобретения является упрощение и удешевление способа получения геминальных бисгидропероксидов из циклоалканонов С12-С15, сокращение длительности процесса, также увеличение выхода бисгидропероксида с размером цикла С15.
Поставленная задача достигается предлагаемым способом получения циклических геминальных бисгидропероксидов С12-С15 из соответствующих циклоалканонов С12-С15 с использованием пероксида водорода, трифторида бора и органического растворителя - простого эфира, отличительной особенностью которого является то, что соответствующие циклоалканоны С12-С15 непосредственно подвергают взаимодействию с перексидом водорода в присутствии трифторида бора в среде простого эфира при мольном соотношения цилоалканон С12-С15:трифторид бора:пероксид водорода 1:0,8-1,2:7-12.
В качестве простого эфира используют диэтиловый эфир или тетрагидрофуран.
Процесс пероксидирования циклических кетонов С12-С15 проводят при температуре 20-25°С в течение 8-10 часов с выходом целевого продукта 69-95% при конверсии кетона 100% согласно следующей схеме:
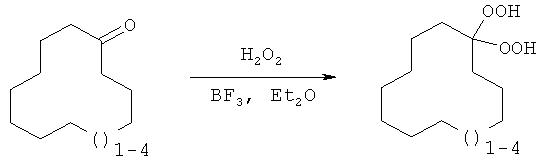
До настоящего времени предложенный одностадийный способ получения геминальных бисгидропероксидов из макроциклических кетонов с использованием трифторида бора не был известен.
Впервые было обнаружено свойство трифторида бора селективно катализировать реакцию макроциклических циклоалканонов С12-С15 с пероксидом водорода с получением геминальных бисгидропероксидов, что явилось неочевидным из-за предполагаемой низкой селективности пероксидирования и возможности протекания перегруппировки Байера-Виллигера (кислотно-катализированное получение лактонов). Так, в работе [А.О.Terent'ev, M.M.Platonov, A.V.Kutkin. A new oxidation process. Transformation of gem-bishydroperoxides in esters. Central European Journal of Chemistry. 207, 4, (2006)] было показано, что различные по размеру цикла геминальные бисгидроперокиды при нагревании в низших спиртах в присутствии эквимолярного количества трифторида бора неустойчивы и превращаются в эфиры дикарбоновых кислот. Также известна работа [J.D.McClure, Р.Н.Williams. Hydrogen Peroxide-Boron Trifluoride Etherate, a New Oxidizing Agent. J. Org. Chem. 24, 27, (1962)], в которой система трифторид бора - пероксид водорода была использована для окисления кетонов (по реакции Байера-Виллигера) с образованием сложных эфиров. Реакция проходит через присоединение только одной молекулы пероксида водорода к кетону, затем трифторид бора катализирует перегруппировку Байера-Виллигера моногидропероксидированного производного кетона. Таким образом, в реакционных условиях этого исследования, в реакции кетонов с пероксидом водорода и трифторидом бора, вторая молекула пероксида водорода не присоединяется к кетону. Исходя из приведенных работ было неочевидным, что геминальные бисгидропероксиды могут быть устойчивы в присутствии трифторида бора.
Таким образом, из уровня техники не являлось очевидным использование трифторида бора для получения геминальных бисгидропероксидов из кетонов напрямую без промежуточной реакции получения кеталей.
Существенным отличием предлагаемого одностадийного способа получения циклических геминальных бисгидропероксидов С12-С15 от принятого за прототип двухстадийного способа также является и увеличенное количество вводимого трифторида бора. В предлагаемом способе соотношение циклоалканон:трифторид бора составляет 1:0,8-1,2; в прототипе соотношение кеталь:трифторида бора составляет 1:0,2. Именно это различие в соотношениях является ключевым для получения циклических геминальных бисгидропероксидов С12-С15 в предлагаемом одностадийном методе и позволило провести реакцию с высоким выходом и высокой селективностью.
Совокупность существенных признаков предлагаемого способа - проведение процесса получения циклических геминальных бисгидропероксидов С12-С15 из соответствующих циклоалканонов С12-С15 в присутствии трифторида бора в среде простого эфира при мольном соотношении цилоалканон С12-С15:трифторид бора:пероксид водород 1:0,8-1,2:7-12 - позволило провести процесс в одну стадию с высоким выходом целевого продукта и высокой его селективностью.
Преимуществом предлагаемого способа является его одностадийность, так как в сравнении с прототипом предлагаемый способ позволяет избежать стадии синтеза и выделения кеталей и, как следствие, позволяет упростить и удешевить процесс, снизить время реакции, материало-, энерго- и трудоемкость получения бисгидропероксидов. Кроме этого, предлагаемый способ позволяет получать целевые продукты с высоким выходом и высокой селективностью, особенно это относится к получению бисгидропероксида с размером цикла С15.
Изобретение иллюстрируется следующим примером.
Пример 1. Синтез 1,1-бисгидропероксициклододекана
Смесь циклододеканона (0.91 г, 5 ммолей) и 20 мл Et2O прибавляют по каплям за ~5 мин к перемешиваемому эфирному раствору H2O2 (35 ммолей; концентрация H2O2 ~ 2.5 моль/л) и BF3·Et2O (0.71 г, 5 ммолей) при 20-25°С. Реакционную массу перемешивают 8 ч, затем добавляют 40 мл Et2O и мелкоизмельченный NaHCO3 (30 ммолей), интенсивно перемешивают образующуюся двухфазную систему 30 мин, фильтруют, осадок на фильтре промывают 20 мл Et2O. Отгоняют растворитель и флэш-хроматографией остатка (градиентное элюирование смесью петролейного эфира и Et2O с возрастающим от 30 до 60% содержанием последнего) выделяют 1,1-бисгидропероксициклододекан (1.102 г, 4.75 ммоля), выход 95%. Бесцветные кристаллы. Т.пл. 138-140°С (Et2O). Спектр ЯМР 1Н (300 МГц, CDCl3), δ, м.д.: 1.21-1.82 м (22Н, СН2), 9.98-10.04 уш. с. (2Н, ООН).
Пример 2. Синтез 1,1-бисгидропероксициклододекана.
Аналогично примеру 1 получают 1,1-бисгидропероксициклододекан, но реакцию проводят в среде тетрагидрофурана. Выход целевого продукта составляет 95%.
Аналогично примерам 1 и 2 получают 1,1-бисгидропероксициклотридекан, 1,1-бисгидропероксициклотетрадекан и 1,1-бисгидропероксициклопентадекан; условия проведения процесса и результаты синтезов приведены в таблице (примеры 3-8).
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЕТОТЕТРАОКСАНОВ | 2013 |
|
RU2537318C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕМИНАЛЬНЫХ ДИГИДРОПЕРОКСИДОВ | 2006 |
|
RU2395494C2 |
| Замещенные трициклические органические монопероксиды и способ их получения | 2020 |
|
RU2752760C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЕТООЗОНИДОВ | 2013 |
|
RU2523014C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2472799C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСИДИРОВАННОГО НАНОРАЗМЕРНОГО СИЛИКАГЕЛЯ | 2008 |
|
RU2380314C1 |
| Способ получения трициклических органических дипероксидов | 2020 |
|
RU2752957C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2494102C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ГИДРОПЕРОКСИ-3,5-ДИМЕТИЛ-1,2-ДИОКСОЛАН-3-ОЛА | 2012 |
|
RU2473548C1 |
Настоящее изобретение относится к области химии органических пероксидов, конкретно к способу получения циклических геминальных бисгидропероксидов из кетонов с размером цикла С12-С15, на основе которых получают 1,2,4,5-тетраоксаны, обладающие высокой антипаразитарной активностью. Кроме того, циклические геминальные бисгидропероксиды находят применение в качестве инициаторов радикальной полимеризации. Предложеннный способ получения циклических геминальных бисгидропероксидов C12-C15 заключается в том, что соответствующие циклоалканоны C12-C15 подвергают взаимодействию с пероксидом водорода в присутствии трифторида бора в среде простого эфира при мольном соотношения цилоалканон С12-C15:трифторид бора:пероксид водорода 1:0,8-1,2:7-12. Предложенный способ позволяет получать циклические геминальные бисгидропероксиды С12-С15 в одну стадию и, как следствие, позволяет упростить и удешевить процесс, снизить время реакции, материало-, энерго- и трудоемкость получения бисгидропероксидов. Кроме этого, предложенный способ позволяет получать целевые продукты с высоким выходом и высокой селективностью, особенно это относится к получению бисгидропероксида с размером цикла С15. 1 табл.
1. Способ получения циклических геминальных бисгидропероксидов С12-С15 из соответствующих циклоалканонов C12-С15 с использованием пероксида водорода, трифторида бора и органического растворителя - простого эфира, отличающийся тем, что соответствующие циклоалканоны С12-С15 непосредственно подвергают взаимодействию с пероксидом водорода в присутствии трифторида бора в среде простого эфира при мольном соотношения цилоалканон С12-С15:трифторид бора:пероксид водорода 1:0,8-1,2:7-12.
2. Способ по п.1, отличающийся тем, что в качестве простого эфира используют диэтиловый эфир или тетрагидрофуран.
| ТЕРЕНТЬЕВ О.А | |||
| И ДР | |||
| Синтез пероксидных соединений реакцией кеталей и эфиров енолов с НO, катализируемый BF3, Изв | |||
| АН, сер | |||
| хим., 2004, №3, с.650-656 | |||
| RU 2006146957 А, 10.07.2008 | |||
| DAS B.KRISHNAIAH ЕТ AL "A simple and efficient synthesis of gem-dihydroperoxides from ketones using aqueous hydrogen peroxide and catalytic |
Авторы
Даты
2011-09-27—Публикация
2010-03-31—Подача