Изобретение относится к области химии органических пероксидов, производных кетонов, конкретно, к способу получения мостиковых 1,2,4,5-тетраоксанов, а именно, замещенных 2,3,5,6-тетраоксабицикло-[2.2.1]гептанов, которые могут найти применение в химии полимеров, а также в медицине и фармакологии.
Химия органических пероксидов насчитывает уже более ста лет (Baeyer, A; Villiger, V. Einwirkung des Caro'schen Reagens auf Ketone. Chemische Berichte,. 1899, 32, 3625-3633; Baeyer, A; Villiger, V. Ueber die Einwirkung des Caro'schen Reagens auf Ketone. Chemische Berichte,. 1900, 33, 858-864). На протяжении этого периода времени кетоны являются ключевыми реагентами в синтезе пероксидов благодаря своей доступности и легкости протекания реакции между углеродным атомом карбонильной группы и высоконуклеофильным атомом кислорода гидропероксидной группы (например, в пероксиде водорода). Пероксиды, полученные из кетонов, производятся в многотоннажном количестве и широко используются как инициаторы радикальной полимеризации непредельных мономеров (Ullman's Encyclopedia of Industrial Chemistry, Elvers, В., Hawkins, S., and Russey, W., Eds., VCH: New York, 1995, 5th ed.).
В последние десятилетия к химии органических пероксидов, в особенности, циклического строения наблюдается значительный всплеск интереса со стороны медицины и фармакологии, вследствие обнаружения у них высокой антималярийной (Jefford, C.W. Peroxidic antimalarials. Adv. Drug Res. 1997, 29, 271-325; O'Neil, P.M.; Posner, G.H. A medicinal chemistry perspective on artemisinin and related endoperoxides. J. Med. Chem. 2004, 47, 2945-2964; Dong, Y. Synthesis and Antimalarial Activity of 1,2,4,5-Tetraoxanes. Mini-Reviews in Med.Chem. 2002, 2, 113-123) и антигельминтной активности (Keiser, J.; Xiao, S. H.; Tanner, M.; Utzinger, J. Artesunate and artemether are effective fasciolicides in the rat model and in vitro. J. Antimicrob. Chemother. 2006, 57, 1139-1145; Keiser, J.; Utzinger, J.; Tanner, M; Dong, Y.; Vennerstrom, J.L. The synthetic peroxide OZ78 is effective against Echinostoma caproni and Fasciola hepatica. J. Antimicrob. Chemother. 2006, 58, 1193-1197; Keiser, J.; Xiao, S.-H.; Dong, Y.; Utzinger, J.; Vennerstrom, J.L. Clonorchicidal properties of the synthetic trioxolane OZ78. J. Parasitol. 2007, 93, 1208-1213). Интерес к получению инициаторов радикальной полимеризации и лекарственных препаратов стимулирует развитие методов синтеза пероксидов, в которых карбонильные соединения, их производные и пероксид водорода (Н2О2) играют ведущую роль как стартовые реагенты.
Анализ научно-технической и патентной литературы за последние сто лет демонстрирует, что количество публикаций, связанных с получением пероксидов в реакции H2O2 с монокетонами исчисляется тысячами. (Žmitek, К.; Zupan, М; Iskra, J. α-Substituted organic peroxides: synthetic strategies for a biologically important class of gem-dihydroperoxide and perketal derivatives. Org. Biomol. Chem. 2007, 5, 3895-3908). Так, например, известны циклические дипероксиды (содержат в молекуле два пероксидных O-O фрагмента) и циклические трипероксиды (содержат в молекуле три пероксидных O-O фрагмента), которые получают взаимодействием монокетонов с H2O2 (Kharasch, М.; Sosnovsky, G. Structure of Peroxides Derived from Cyclohexanone and Hydrogen Peroxide. J. Org. Chem. 1958, 23, 1322-1324) и трипероксиды (Story et al. Macrocyclic synthesis. II. Cyclohexanone peroxides. J. Org. Chem. 1970, 35, 3059-3061) по следующей схеме (1):

Публикаций, связанных с получением бициклических органических дипероксидов (мостиковых 1,2,4,5-тетраоксанов) с двумя пероксидными O-O фрагментами и мостиком из одного углеродного атома, по реакции Н2О2 с β-дикетонами (не с монокетонами) насчитывается несколько.
В работе (Milas, N.A.; Mageli, O.L.; Golubovic, A.; Arndt, R.W.; Но, J.C.J. Studies in Organic Peroxides. XXIX. The Structure of Peroxides Derived from 2,4-Pentanedione and Hydrogen Peroxide. J. Am. Chem. Soc. 1963, 85, 222-226) был получен только один мостиковый тетраоксан - 1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептан с общим выходом 18.5% в расчете на две стадии: образования 5-гидроперокси-3,5-диметил-1,2-диоксолан-3-ола в нейтральной среде из ацетилацетона и пероксида водорода, с последующей его внутримолекулярной циклизацией под действием P2O5 в диэтиловом эфире.
Известен и принят за прототип способ получения мостиковых 1,2,4,5-тетраоксанов - замещенных 2,3,5,6-тетраоксабицикло-[2.2.1]гептанов общей формулы I, где R = адамантил, незамещенный или замещенный бензил, незамещенный или замещенный алкил С1-С6, при этом заместителями могут быть CN, СООМе, COOEt или СН2=СН группа; R1 = низший алкил или водород; R2 = алкил С1-С6, R+R2=-(СН2)4-, взаимодействием соответствующих β-дикетонов общей формулы II с пероксидом водорода (H2O2) в среде органического растворителя, например, EtOH, i-PrOH, THF, Et2O в присутствии сильной кислоты, например, H2SO4, HClO4 или HBF4 в качестве катализатора с выходом от 44 до 77% (Terent'ev, А.О.; Borisov, D.A.; Chemyshev, V.V.; Nikishin. G.I. Facile and Selective Procedure for the Synthesis of Bridged 1,2,4,5-Tetraoxanes; Strong Acids As Cosolvents and Catalysts for Addition of Hydrogen Peroxide to β-Diketones. J.Org.Chem. 2009, 74, 3335-3340) no следующей схеме (2):
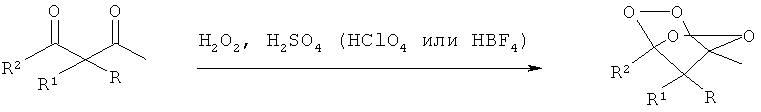
Эта реакция протекает в жестких условиях с использованием очень большого количества катализатора (1-2 г/5 мл реакционной массы) - сильной кислоты, например, H2SO4, HClO4, HBF4. Использование большого количества сильных кислот в реакции требует строгого соблюдения правил техники безопасности и специальной кислотно-стойкой аппаратуры. Кроме того, кислоты H2SO4, HClO4, HBF4 способны разлагать полученные пероксиды, что понижает выход целевого продукта.
Задачей настоящего изобретения является упрощение и удешевление способа получения мостиковых 1,2,4,5-тетраоксанов - замещенных 2,3,5,6-тетраоксабицикло-[2.2.1]гептанов, возможность многократного использования катализатора.
Поставленная задача достигается предлагаемым способом получения замещенных 2,3,5,6-тетраоксабицикло-[2.2.1]гептанов общей формулы I:
 ,
,
где R = адамантил, незамещенный или замещенный бензил, незамещенный или замещенный алкил С1-С6, при этом заместителями могут быть COOEt или СН2=СН группа; R1 = низший алкил или водород; R2 = метил или этил, путем взаимодействия соответствующих β-дикетонов общей формулы II, где R, R1 и R2 имеют вышеуказанные значения, с пероксидом водорода в присутствии кислотного катализатора в среде органического растворителя, отличительной особенностью которого является то, что в качестве кислотного катализатора используют ионообменную смолу Amberlyst-15 в количестве 450-800 граммов на 1 моль β-дикетона, в качестве органического растворителя используют хлористый метилен или хлороформ и процесс проводят при мольном соотношении β-дикетон: пероксид водорода 1:3-5.
Процесс проводят при комнатной температуре (20-25°С) в течение 6-24 часов по следующей схеме:
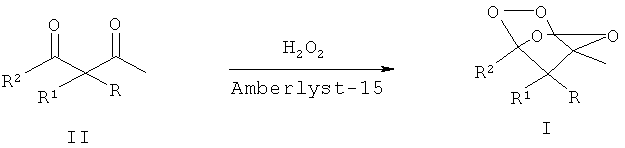
В процессе использовали Amberlyst-15 в виде гранул и водный раствор H2O2 с концентрацией 37%. Amberlyst-15 представляет собой макромолекулярную ионобменную сильнокислую смолу, основанную на кросс-сшитом стироле с сульфоновыми группами. Смола коммерчески доступна и обладает большим набором хороших эксплуатационных характеристик - устойчивостью к растворителям и окислителям.
Проведение процесса в присутствии Amberlyst-15 в среде хлористого метилена или хлороформа и указанных соотношениях реагентов позволило получить целевые продукты с выходом до 80%.
Промышленно производимая и коммерчески доступная марка кислотной смолы Amberlyst-15 позволяет отказаться от использования не регенерируемых кислотных катализаторов H2SO4, HClO4, HBF4, позволяет проводить процесс пероксидирования в гетерогенной системе, вследствие этого выделение продукта основано фактически на фильтровании кислотной смолы от реакционной массы, после чего она снова может быть использована для пероксидирования другого раствора, содержащего пероксид водорода и β-дикетон. По сравнению с гетерогенными системами возникает возможность синтеза тетраоксанов в проточном реакторе.
Технический результат - упрощение и удешевление способа получения мостиковых 1,2,4,5-тетраоксанов, возможность многократного использования катализатора. Мостиковые 1,2,4,5-тетраоксаны получают селективно и с хорошим с выходом от 60 до 80%. При повторном использовании катализатора выход мостиковых 1,2,4,5-тетраоксанов не снижается.
Изобретение соответствует критерию «новизна», так как в известной научно-технической и патентной литературе отсутствует полная совокупность признаков, характеризующих предлагаемое изобретение. Предлагаемое изобретение соответствует критерию «изобретательский уровень», так как до настоящего времени Amberlyst-15 не использовался в реакциях со стадией внутримолекулярной циклизации пероксидов для получения мостиковых 1,2,4,5-тетраоксанов.
Именно предложенное соотношение β-дикетона: пероксида водорода и Amberlyst-15 и найденные реакционные условия позволяют получать мостиковые тетраоксаны, то есть продукты конденсации β-дикетонов с двумя молекулами пероксида водорода, а не с одной, тремя или четырьмя.
В реакциях кетонов с пероксидом водорода может происходить межмолекулярная конденсация с участием карбонильных групп разных молекул с образованием олигомерных и полимерных пероксидов, в настоящем изобретении имеет место только стадия внутримолекулярной конденсации.
Изначально неочевидной была конверсия β-дикетонов, в гетерогенных условиях она могла измеряться всего лишь процентами; в условиях данного изобретения конверсия β-дикетонов по данным ЯМР реакционных смесей превосходит 80%.
Неочевидной являлась возможность использования смолы Amberlyst-15, поскольку номенклатура ионообменных смол очень широка и каждая марка имеет свою специфику реакционной способности. В условиях данного изобретения смола Amberlyst-15 может повторно использоваться как катализатор превращения дикетонов в тетраоксаны, а не только одноразово.
Изобретение соответствует условию «промышленная применимость», так как мостиковые 1,2,4,5-тетраоксаны могут найти применение в химии полимеров для получения инициаторов радикальной полимеризации непредельных мономеров а также в медицине и фармакологии для получения лекарственных препаратов вследствие обнаружения у 1,2,4,5-тетраоксанов высокой антималярийной и антигельминтной активности, сравнимой или превосходящей природный пероксид Артемизинин, используемый как лекарственное средство для лечения этих заболеваний.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1.
Синтез 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана
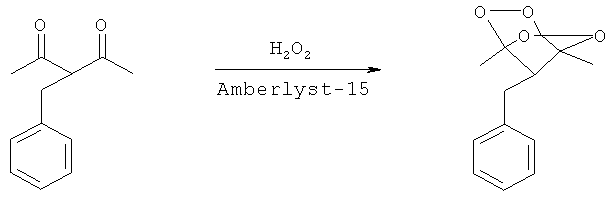
К раствору 3-бензилпентан-2,4-диона (0.3 г, 1.577 ммоль) в CH2Cl2 (5 мл) при перемешивании прибавляли 37% водный раствор Н2О2 (435 мг, 4.731 ммоль, 3 моль Н2О2 / 1 моль 3-бензилпентан-2,4-диона) и ионообменную смолу Amberlyst 15 (1 г, 634 г / 1 моль 3-бензилпентан-2,4-диона). Перемешивали при 20-25°С в течение 6 часов. Реакционную смесь отфильтровывали, осадок промывали CH2Cl2 (30 мл). Органический слой промывали 5% водным раствором NaHCO3 (10 мл), а затем водой (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептан выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат с увеличением доли последнего от 0 до 30 объемных процентов. Получают белые кристаллы с выходом 60% (0.210 г, 0.946 ммоль). Тпл=58-60°С. Rf=0.45 (ТСХ, гексан - этилацетат, 5:1). Спектр ЯМР 1Н (300.13 МГц, δ, м.д): 1.41 (с, 6Н, СН3), 2.96 (д, 2Н, СН2, J=7.3 Гц), 3.13 (т, 1Н, СН, J=7.0 Гц), 7.24-7.40 (м, 4Н, CHar). Спектр ЯМР 13С (75.48 МГц, δ, м.д): 9.92 (СН3), 30.37 (СН2), 59.35 (СН), 110.74 (ОСО), 127.02, 128.41, 128.92, 129.38, 137.32 (Car). Вычислено C12H14O4: С, 64.85; H, 6.35. Найдено: С, 64.96; 6.38.
Пример 2.
Синтез 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана

К раствору 3-бензилпентан-2,4-диона (0.3 г, 1.577 ммоль) в CH2Cl2 (5 мл) при перемешивании прибавляли 37% водный раствор H2O2(435 мг, 435 мг, 4.731 ммоль, 3 моль H2O2 / 1 моль 3-бензилпентан-2,4-диона) и ионообменную смолу Amberlyst 15 (1 г, 634 г / 1 моль 3-бензилпентан-2,4-диона). Перемешивали при 20-25°С в течение 24 часов. Реакционную смесь отфильтровывали, осадок промывали CH2Cl2 (30 мл). Органический слой промывали 5% водным раствором NaHCO3 (10 мл), а затем водой (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептан выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат с увеличением доли последнего от 0 до 30 объемных процентов. Получают белые кристаллы 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана с выходом 70% (0.245 г, 1.104 ммоль). Тпл=58-60°С. Rf=0.45 (ТСХ, гексан - этилацетат, 5:1). Спектр ЯМР 1Н (300.13 МГц, δ, м.д): 1.41 (с, 6Н, СН3), 2.96 (д, 2Н, СН2, J=7.3 Гц), 3.13 (т, 1Н, СН, J=7.0 Гц), 7.24-7.40 (м, 4Н, CHar). Спектр ЯМР 13С (75.48 МГц, δ, м.д): 9.92 (СН3), 30.37 (СН2), 59.35 (СН), 110.74 (ОСО), 127.02, 128.41, 128.92, 129.38, 137.32 (Car). Вычислено C12H14O4: С, 64.85; Н, 6.35. Найдено: С, 64.96; 6.38.
Пример 3.
Синтез 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.11 гептана с повторным использованием ионообменной смолы Amberlyst 15 (из примера 2).

К раствору 3-бензилпентан-2,4-диона (0.3 г, 1.577 ммоль) в CH2Cl2 (5 мл) при перемешивании прибавляли 37% водный раствор H2O2 (435 мг, 435 мг, 4.731 ммоль, 3 моль H2O2 / 1 моль 3-бензилпентан-2,4-диона) и ионообменную смолу Amberlyst 15, отфильтрованную в примере 2 (1 г, 634 г / 1 моль 3-бензилпентан-2,4-диона). Перемешивали при 20-25°С в течение 24 часов. Реакционную смесь отфильтровывали, осадок промывали CH2Cl2 (30 мл). Органический слой промывали 5% водным раствором NaHCO3 (10 мл), а затем водой (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептан выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат с увеличением доли последнего от 0 до 30 объемных процентов. Получают белые кристаллы 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана с выходом 72% (0.252 г, 1,135 ммоль). Тпл=58-60°С. Rf=0.45 (ТСХ, гексан - этилацетат, 5:1). Спектр ЯМР 1Н (300.13 МГц, δ, м.д): 1.41 (с, 6Н, СН3), 2.96 (д, 2Н, СН2, J=7.3 Гц), 3.13 (т, 1Н, СН, J=7.0 Гц), 7.24-7.40 (м, 4Н, CHar). Спектр ЯМР 13С (75.48 МГц, δ, м.д): 9.92 (СН3), 30.37 (СН2), 59.35 (СН), 110.74 (ОСО), 127.02, 128.41, 128.92, 129.38, 137.32 (Car). Вычислено C12H14O4: С, 64.85; Н, 6.35. Найдено: С, 64.96; 6.38.
Пример 4.
Синтез 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана

К раствору 3-бензилпентан-2,4-диона (0.3 г, 1.577 ммоль) в CHCl3 (5 мл) при перемешивании прибавляли 37% водный раствор H2O2(435 мг, 435 мг, 4.731 ммоль, 3 моль H2O2 / 1 моль 3-бензилпентан-2,4-диона) и ионообменную смолу Amberlyst 15 (1 г, 634 г /1 моль 3-бензилпентан-2,4-диона). Перемешивали при 20-25°С в течение 24 часов. Реакционную смесь отфильтровывали, осадок промывали CH2Cl2 (30 мл). Органический слой промывали 5% водным раствором NaHCO3 (10 мл), а затем водой (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептан выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат с увеличением доли последнего от 0 до 30 объемных процентов. Получают белые кристаллы 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана с выходом 80% (0.280 г, 1.262 ммоль). Тпл=58-60°С. Rf=0.45 (ТСХ, гексан - этилацетат, 5:1). Спектр ЯМР 1Н (300.13 МГц, δ, м.д): 1.41 (с, 6Н, СН3), 2.96 (д, 2Н, СН2, J=7.3 Гц), 3.13 (т, 1Н, СН, J=7.0 Гц), 7.24-7.40 (м, 4Н, CHar). Спектр ЯМР 13С (75.48 МГц, δ, м.д): 9.92 (СН3), 30.37 (СН2), 59.35 (СН), 110.74 (ОСО), 127.02, 128.41, 128.92, 129.38, 137.32 (Car). Вычислено C12H14O4: С, 64.85; Н, 6.35. Найдено: С, 64.96; 6.38.
Пример 5.
Синтез 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана

К раствору 3-бензилпентан-2,4-диона (0.3 г, 1.577 ммоль) в CHCl3 (5 мл) при перемешивании прибавляли 37% водный раствор H2O2 (724 мг, 7.885 ммоль, 5 моль H2O2 / 1 моль 3-бензилпентан-2,4-диона) и ионообменную смолу Amberlyst 15 (1 г, 634 г / 1 моль 3-бензилпентан-2,4-диона). Перемешивали при 20-25°С в течение 24 часов. Реакционную смесь отфильтровывали, осадок промывали CH2Cl2 (30 мл). Органический слой промывали 5% водным раствором NaHCO3 (10 мл), а затем водой (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептан выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат с увеличением доли последнего от 0 до 30 объемных процентов. Получают белые кристаллы 7-бензил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана с выходом 80% (0.280 г, 1.262 ммоль). Тпл=58-60°С. Rf=0.45 (ТСХ, гексан - этилацетат, 5:1). Спектр ЯМР 1Н (300.13 МГц, δ, м.д): 1.41 (с, 6Н, СН3), 2.96 (д, 2Н, СН2, J=7.3 Гц), 3.13 (т, 1Н, СН, J=7.0 Гц), 7.24-7.40 (м, 4Н, CHar). Спектр ЯМР 13С (75.48 МГц, 5, м.д): 9.92 (СН3), 30.37 (СН2), 59.35 (СН), 110.74 (ОСО), 127.02, 128.41, 128.92, 129.38, 137.32 (Car). Вычислено C12H14O4: С, 64.85; Н, 6.35. Найдено: С, 64.96; 6.38.
Пример 6.
Синтез 7-аллил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана

К раствору 3-аллилпентан-2,4-диона (0.3 г, 2.14 ммоль) в СН2С12 (5 мл) при перемешивании прибавляли 37% водный раствор H2O2 (590 мг, 6.42 ммоль, 3 моль H2O2 / 1 моль 3-аллилпентан-2,4-диона) и ионообменную смолу Amberlyst 15 (1 г, 467 г / 1 моль 3-аллилпентан-2,4-диона). Перемешивали при 20-25°С в течение 24 часов. Реакционную смесь отфильтровывали, осадок промывали СН2С12 (30 мл). Органический слой промывали 5% водным раствором NaHCO3 (10 мл), а затем водой (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 7-аллил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептан выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат с увеличением доли последнего от 0 до 30 объемных процентов. Получают бесцветное масло 7-аллил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана с выходом 68% (0.25 г, 1.455 ммоль). Rf=0.47 (ТСХ, гексан - этилацетат, 5:1). Спектр ЯМР 1H (300.13 МГц, δ, м.д): 1.50 (с, 6Н, СН3), 2.35 (т, 2Н, СНСН2СН, J=7.0 Гц), 2.75 (т, 1H, СНСО, J=6.6 Гц), 4.96-5.26 (т, 2Н, СН2), 5.65-5.91 (т, 1Н, СН). Спектр ЯМР 13С (75.48 МГц, δ, м.д): 9.78 (СН3), 28.36 (СНСН2СН), 57.62 (СНСО), 110.54 (ОСО), 117.76 (СН2), 133.92 (СН). Вычислено C8H12O4: С, 55.81; Н, 7.02. Найдено: С, 55.97; Н, 7.24.
Пример 7.
Синтез 7-(1-адамантил)-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана
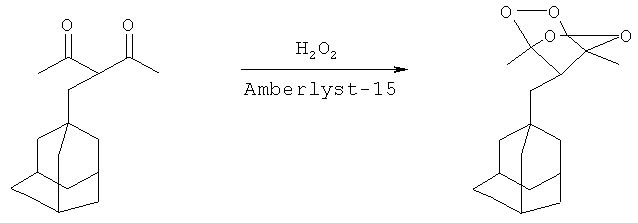
К раствору 3-(1-адамантил)пентан-2,4-диона (0.3 г, 1.28 ммоль) в CH2Cl2 (5 мл) при перемешивании прибавляли 37%) водный раствор H2O2 (590 мг, 6.42 ммоль, 3 моль H2O2 / 1 моль 3-(1-адамантил)пентан-2,4-диона) и катионообменную смолу Amberlyst 15 (1 г, 781 г / 1 моль 3-(1-адамантил)пентан-2,4-диона). Перемешивали при 20-25°С в течение 24 часов. Реакционную смесь отфильтровывали, осадок промывали CH2Cl2 (30 мл). Органический слой промывали 5% водным раствором NaHCO3 (10 мл), а затем водой (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 7-(1-адамантил)-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептан выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат с увеличением доли последнего от 0 до 30 объемных процентов. Получают белые кристаллы 7-(1-адамантил)-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана с выходом 74% (0.252 г, 0.947 ммоль). Тпл=130-131°С (с частичным разложением). Rf=0.60 (ТСХ, гексан - этилацетат, 5:1). Спектр ЯМР 1Н (300.13 МГц, δ, м.д): 1.63-2.04 (м, 21Н, СН3, СН2, СНСН2), 2.37 (с, 1Н, СНСО). Спектр ЯМР 13С (75.48 МГц, δ, м.д): 12.68 (СН3), 28.32 (СН), 32.97 (С), 36.73, 40.61 (СН2), 66.82 (СНСО), 110.69 (ОСО). Вычислено C15H22O4: С, 67.64; Н, 8.33. Найдено: 67.28; Н, 8.69.
Пример 8.
Синтез 7-Бутил-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана.

К раствору 3-(1-бутил)пентан-2,4-диона (0.3 г, 1.921 ммоль) в CH2Cl2 (5 мл) при перемешивании прибавляли 37% водный раствор H2O2 (530 мг, 5.763 ммоль, 3 моль H2O2 / 1 моль 3-(1-бутил)пентан-2,4-диона) и ионообменную смолу Amberlyst 15 (1 г, 450 г / 1 моль 3-(1-бутил)пентан-2,4-диона). Перемешивали при 20-25°С в течение 24 часов. Реакционную смесь отфильтровывали, осадок промывали CH2Cl2 (30 мл). Органический слой промывали 5% водным раствором NaHCO3 (10 мл), а затем водой (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 7-(1-бутил)-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептан выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат с увеличением доли последнего от 0 до 30 объемных процентов. Получают бесцветное масло 7-(1-бутил)-1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептана с выходом 73% (0.263 г, 1.402 ммоль). Rf=0.63 (ТСХ, гексан - этилацетат, 5:1). Спектр ЯМР 1Н (300.13 МГц, δ, м.д): 0.88 (т, 3Н, СН3, J=6.6 Гц), 1.14 (с, 3Н, СН3), 1.28-1.59 (м, 12Н, СН3, СН3). Спектр ЯМР 13С (75.48 МГц, δ, м.д): 8.67 (СН3СО), 13.15 (СН3С), 13.78 (СН3СН2), 23.45, 26.31, 29.99 (СН2), 58.39 (С), 111.90 (ОСО). Вычислено С10Н18О4: С, 59.39; Н, 8.97. Найдено: С, 59.47; Н, 8.76.
Пример 9.
Синтез этил 3-(1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гепт-7-ил)пропаноата.

К раствору этил-4-ацетил-5-оксогексаноата (0.3 г, 1.498 ммоль) в CH2Cl2 (5 мл) при перемешивании прибавляли 37% водный раствор H2O2 (413 мг, 4.494 ммоль, 3 моль H2O2 / 1 моль этил-4-ацетил-5-оксогексаноата) и ионообменную смолу Amberlyst 15 (1 г, 800 г / 1 моль этил-4-ацетил-5-оксогексаноата). Перемешивали при 20-25°С в течение 24 часов. Реакционную смесь отфильтровывали, осадок промывали CH2Cl2 (30 мл). Органический слой промывали 5% водным раствором NaHCO3 (10 мл), а затем водой (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт этил 3-(1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гепт-7-ил)пропаноат выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат с увеличением доли последнего от 0 до 30 объемных процентов. Получают бесцветное масло этил 3-(1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гепт-7-ил)пропаноата с выходом 75% (0.261 г, 1.123 ммоль). Масло. Rf=0.62 (ТСХ, гексан - этилацетат, 2:1). Спектр ЯМР 1Н (300.13 МГц, δ, м.д): 1.22 (т, 3Н, CH3CH2, J=7.1 Гц), 1.51 (с, 6Н, СН3СО), 1.86 (к, 2Н, CH2CH, J=6.8 Гц), 2.45 (т, 2Н, СН2СО, J=7.3 Гц), 2.63 (т, 1H, СН, J=5.9 Гц), 4.11 (к, 2Н, CH2O, J=7.1 Гц). Спектр ЯМР 13С (50.32 МГц, δ, м.д): 9.57 (СН3СО), 14.04 (СН3СН2), 18.89 (СН2СН), 31.56 (СН2СО), 58.01 (СН), 60.67 (CH2O), 110.58 (ОСО), 172.29 (ОССН2). Вычислено С10Н16О6: С, 51.72; Н, 6.94. Найдено: С, 51.72; Н, 6.94.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2472799C1 |
| Применение замещенных 2,3,5,6-тетраоксабицикло[2.2.1]гептанов в качестве фунгицидных средств и фунгицидная композиция на их основе | 2016 |
|
RU2627309C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЕТОТЕТРАОКСАНОВ | 2013 |
|
RU2537318C1 |
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЕТООЗОНИДОВ | 2013 |
|
RU2523014C1 |
| Способ получения N-замещенных мостиковых 1,2,4-диоксазолидинов | 2023 |
|
RU2804396C1 |
| Замещенные 1,5-диметил-6,7,8-триоксабицикло[3.2.1]октаны, применение их в качестве фунгицидных средств и фунгицидные композиции на их основе | 2016 |
|
RU2623431C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОЛЕЙ БИЦИКЛИЧЕСКИХ ДИКЕТОНОВ И ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ | 2003 |
|
RU2315743C2 |
| Замещенные трициклические органические монопероксиды и способ их получения | 2020 |
|
RU2752760C1 |
| Способ получения трициклических органических дипероксидов | 2020 |
|
RU2752957C1 |
Изобретение относится к области химии органических пероксидов, производных кетонов, конкретно к способу получения мостиковых 1,2,4,5-тетраоксанов, а именно замещенных 2,3,5,6-тетраоксабицикло-[2.2.1]гептанов, которые могут найти применение в химии полимеров, а также в медицине и фармакологии. Способ заключается в получении замещенных 2,3,5,6-тетраоксабицикло-[2.2.1]гептанов общей формулы I:
 ,
,
где R = адамантил, незамещенный или замещенный бензил, незамещенный или замещенный алкил С1-С6, при этом заместителями могут быть COOEt, или CH2=CH группа; R1 = низший алкил или водород; R2 = метил или этил, путем взаимодействия соответствующих β-дикетонов с пероксидом водорода в присутствии кислотного катализатора в среде органического растворителя, отличительной особенностью которого является то, что в качестве кислотного катализатора используют ионообменную смолу Amberlyst-15 в количестве 450-800 граммов на 1 моль β-дикетона, в качестве органического растворителя используют хлористый метилен или хлороформ и процесс проводят при мольном соотношении р-дикетон: пероксид водорода 1:3-5. Этот способ позволяет упростить и удешевить процесс в связи с возможностью многократного использования катализатора. Мостиковые 1,2,4,5-тетраоксаны получают селективно и с хорошим выходом от 60 до 80%. 9 пр.
Способ получения замещенных 2,3,5,6-тетраоксабицикло[2.2.1]гептанов формулы I:
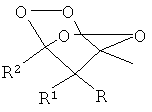
где R - адамантил, незамещенный или замещенный бензил, незамещенный или замещенный алкил С1-С6, при этом заместителями могут быть COOEt или CH
2
=CH группа; R
1
- низший алкил или водород; R
2
- метил или этил, путем взаимодействия соответствующих β-дикетонов общей формулы II:

где R, R
1
, и R
2
имеют вышеуказанные значения, с пероксидом водорода в присутствии кислотного катализатора в среде органического растворителя, отличающийся тем, что в качестве кислотного катализатора используют ионообменную смолу Amberlyst-15 в количестве 450-800 г на 1 моль β-дикетона, в качестве органического растворителя используют хлористый метилен или хлороформ и процесс проводят при мольном соотношении β-дикетон: пероксид водорода 1:3-5.
| A.O.Terenev et al, J.Org.Chem., 2009, v74, p.3335-3340 | |||
| Способ получения 5-метил/-4оксо3,6,8-триоксабицикло/ (3,2,1)-октана | 1978 |
|
SU722912A1 |
| Способ получения производных 2,9-диоксатрицикло (4,3,1,0 )декана или их солей | 1977 |
|
SU791242A3 |
| Способ получения карбаматов 4 -окси-2,9-диоксатрицикло-(4,3,1,0,3,7)-деканов | 1974 |
|
SU576939A3 |
Авторы
Даты
2013-09-27—Публикация
2012-08-15—Подача