Настоящее изобретение относится к области органической химии, к классу органических пероксидов, производных кетонов, конкретно к способу получения как новых неописанных в литературе замещенных трициклическим органических дипероксидов, так и известных. Полученные соединения могут найти применение как инициаторы радикальной полимеризации непредельных мономеров, а также в медицине и фармакологии в качестве антипаразитарных средств.
Химия органических пероксидов насчитывает уже более ста лет [Baeyer, А; Villiger, V. Einwirkung des Caro'schen Reagens auf Ketone. Chemische Berichte,. 1899, 32, 3625-3633; Baeyer, A; Villiger, V. Ueber die Einwirkung des Caro'schen Reagens auf Ketone. Chemische Berichte,. 1900, 33, 858-864]. На протяжении этого периода времени кетоны являются ключевыми реагентами в синтезе пероксидов благодаря своей доступности и легкости протекания реакции между углеродным атомом карбонильной группы и высоконуклеофильным атомом кислорода гидропероксидной группы (например, в пероксиде водорода). Пероксиды, полученные из кетонов, производятся в многотоннажном количестве и широко используются как инициаторы радикальной полимеризации непредельных мономеров [Ullman's Encyclopedia of Industrial Chemistry, Elvers, В., Hawkins, S., and Russey, W., Eds., VCH: New York, 1995, 5th ed.].
В последние десятилетия к химии органических пероксидов, в особенности циклического строения, наблюдается значительный всплеск интереса со стороны медиков и фармакологов, вследствие обнаружения у них высокой антималярийной [(a) Opsenica, D.М.; Solaja, В.A., Antimalarial peroxides. J. Serb. Chem. Soc. 2009, 74, 1155-1193; (b) Jefford, C.W., Synthetic Peroxides as Potent Antimalarials. News and Views. Curr. Top.Med. Chem. 2012, 12, 373-399; (с) Hao, H. D.; Wittlin, S.; Wu, Y., Potent antimalarial 1,2,4-trioxanes through perhydrolysis of epoxides. Chem. - Eur. J. 2013, 19, 7605-7619; (d) Wang, X.; Dong, Y.; Wittlin, S.; Charman, S.A.; Chiu, F. С.K.; Chollet, J.; Katneni, K.; Mannila, J.; Morizzi, J.; Ryan, E.; Scheurer, C.; Steuten, J.; Santo Tomas, J.; Snyder, C.; Vennerstrom, J. L., Comparative antimalarial activities and ADME profiles of ozonides (1,2,4-trioxolanes) OZ277, OZ439, and their 1,2-dioxolane, 1,2,4-trioxane, and 1,2,4,5-tetraoxane isosteres. J. Med. Chem. 2013, 56, 2547-2555], антигельминтной [(a) Ingram, K.; Yaremenko, I.A.; Krylov, I.В.; Hofer, L.; Terentev, A.O.; Keiser, J., Identification of antischistosomal leads by evaluating bridged 1,2,4,5-tetraoxanes, alphaperoxides, and tricyclic monoperoxides. J. Med. Chem. 2012, 55, 8700-8711; (b) Keiser, J.; Ingram, K.; Vargas, M.; Chollet, J.; Wang, X.; Dong, Y.; Vennerstrom, J.L., In vivo activity of aryl ozonides against Schistosoma species. Antimicrob. Agents Chemother. 2012, 56, 1090-1092; (c) Cowan, N.; Yaremenko, I.A.; Krylov, I.В.; Terent'ev, A.O.; Keiser, J., Elucidation of the in vitro and in vivo activities of bridged 1,2,4-trioxolanes, bridged 1,2,4,5-tetraoxanes, tricyclic monoperoxides, silyl peroxides, and hydroxylamine derivatives against Schistosoma mansoni. Bioorg. Med. Chem 2015, 23 (16), 5175-5181; (d) Vil', V.A.; Yaremenko, I.A.; Ilovaisky, A.I.; Terent'ev, A.O., Peroxides with Anthelmintic, Antiprotozoal, Fungicidal and Antiviral Bioactivity: Properties, Synthesis and Reactions. Molecules 2017, 22 (11), 1881], противораковой [(a) Yaremenko, I.A.; Syroeshkin, M.A.; Levitsky, D.O.; Fleury, F.; Terent'ev, A.O., Cyclic peroxides as promising anticancer agents: in vitro cytotoxicity study of synthetic ozonides and tetraoxanes on human prostate cancer cell lines. Med. Chem. Res. 2017, 26 (1), 170-179; (b) Coghi, P.; Yaremenko, I.A.; Prommana, P.; Radulov, P.S.; Syroeshkin, M.A.; Wu, Y.J.; Gao, J.Y.; Gordillo, F.M; Mok, S.; Wong, V.K. W.; Uthaipibull, C.; Terent'ev, A.O., Novel Peroxides as Promising Anticancer Agents with Unexpected Depressed Antimalarial Activity. Chemmedchem 2018, 13 (9), 902-908; (c) Frohlich, Т.; Ndreshkjana, В.; Muenzner, J.K.; Reiter, C.; Hofmeister, E.; Mederer, S.; Fatfat, M; El-Baba, C.; Gali-Muhtasib, H.; Schneider-Stock, R.; Tsogoeva, S.В., Synthesis of Novel Hybrids of Thymoquinone and Artemisinin with High Activity and Selectivity Against Colon Cancer. Chemmedchem 2017, 12 (3), 226-234; (d) Frohlich, Т.; Kiss, A.; Wolfling, J.; Mernyak, E.; Kulmany, A. E.; Minorics, R.; Zupko, I.; Leidenberger, M.; Friedrich, O.; Kappes, В.; Hahn, F.; Marschall, M.; Schneider, G.; Tsogoeva, S.В., Synthesis of Artemisinin-Estrogen Hybrids Highly Active against HCMV, P-falciparum, and Cervical and Breast Cancer. ACS Med. Chem. Lett. 2018, 9 (11), 1128-1133.], противотуберкулезной [(a) Miller, M.J.; Walz, A.J.; Zhu, H.; Wu, C; Moraski, G.;  Tristani, E.M.; Crumbliss, A.L.; Ferdig, M.Т.; Checkley, L.; Edwards, R.L.; Boshoff, H.I., Design, Synthesis, and Study of a Mycobactin-Artemisinin Conjugate That Has Selective and Potent Activity against Tuberculosis and Malaria. J. Am. Chem. Soc. 2011, 133 (7), 2076-2079; (b) Zhou, F.W.; Lei, H. S.; Fan, L.; Jiang, L.; Liu, J.; Peng, X.M.; Xu, X.R.; Chen, L.; Zhou, С.H.; Zou, Y.Y.; Liu, C.P.; He, Z.Q.; Yang, D.C., Design, synthesis, and biological evaluation of dihydroartemisinin- fluoroquinolone conjugates as a novel type of potential antitubercular agents. Bioorg. Med. Chem. Lett. 2014, 24, 1912-1917; (c) Chaudhary, S.; Sharma, V.; Jaiswal, P.K.; Gaikwad, A.N.; Sinha, S.K.; Puri, S. K.; Sharon, A.; Maulik, P.R.; Chaturvedi, V., Stable Tricyclic Antitubercular Ozonides Derived from Artemisinin. Org. Lett. 2015, 17, 4948-4951], противовирусной [(a) Reiter, C; Frohlich, Т.; Gruber, L.; Hutterer, C.; Marschall, M.; Voigtlander, C.; Friedrich, O.; Kappes, В.; Efferth, Т.; Tsogoeva, S. В., Highly potent artemisinin-derived dimers and trimers: Synthesis and evaluation of their antimalarial, antileukemia and antiviral activities. Bioorg. Med. Chem. 2015, 23 (17), 5452-5458; (b) Efferth, Т.; Romero, M.R.; Wolf, D.G.; Stamminger, Т.; Marin, J.J. G.; Marschall, M., The antiviral activities of artemisinin and artesunate. Clin. Infect. Dis. 2008, 47 (6), 804-811], противогрибковой [(a) Vil', V.A.; Yaremenko, I.A.; Ilovaisky, A.I.; Terent'ev, A.O., Peroxides with Anthelmintic, Antiprotozoal, Fungicidal and Antiviral Bioactivity: Properties, Synthesis and Reactions. Molecules 2017, 22 (11), 1881; (b) I.A. Yaremenko, P.S. Radulov, Y.Y. Belyakova, A.A. Demina, D.I. Fomenkov, D.V. Barsukov, I.R. Subbotina, F. Fleury, A.O. Terent'ev. Catalyst Development for the Synthesis of Ozonides and Tetraoxanes Under Heterogeneous Conditions: Disclosure of an Unprecedented Class of Fungicides for Agricultural Application. Chem. Eur. J. 2020, 26, 4734-4751] активности.
Tristani, E.M.; Crumbliss, A.L.; Ferdig, M.Т.; Checkley, L.; Edwards, R.L.; Boshoff, H.I., Design, Synthesis, and Study of a Mycobactin-Artemisinin Conjugate That Has Selective and Potent Activity against Tuberculosis and Malaria. J. Am. Chem. Soc. 2011, 133 (7), 2076-2079; (b) Zhou, F.W.; Lei, H. S.; Fan, L.; Jiang, L.; Liu, J.; Peng, X.M.; Xu, X.R.; Chen, L.; Zhou, С.H.; Zou, Y.Y.; Liu, C.P.; He, Z.Q.; Yang, D.C., Design, synthesis, and biological evaluation of dihydroartemisinin- fluoroquinolone conjugates as a novel type of potential antitubercular agents. Bioorg. Med. Chem. Lett. 2014, 24, 1912-1917; (c) Chaudhary, S.; Sharma, V.; Jaiswal, P.K.; Gaikwad, A.N.; Sinha, S.K.; Puri, S. K.; Sharon, A.; Maulik, P.R.; Chaturvedi, V., Stable Tricyclic Antitubercular Ozonides Derived from Artemisinin. Org. Lett. 2015, 17, 4948-4951], противовирусной [(a) Reiter, C; Frohlich, Т.; Gruber, L.; Hutterer, C.; Marschall, M.; Voigtlander, C.; Friedrich, O.; Kappes, В.; Efferth, Т.; Tsogoeva, S. В., Highly potent artemisinin-derived dimers and trimers: Synthesis and evaluation of their antimalarial, antileukemia and antiviral activities. Bioorg. Med. Chem. 2015, 23 (17), 5452-5458; (b) Efferth, Т.; Romero, M.R.; Wolf, D.G.; Stamminger, Т.; Marin, J.J. G.; Marschall, M., The antiviral activities of artemisinin and artesunate. Clin. Infect. Dis. 2008, 47 (6), 804-811], противогрибковой [(a) Vil', V.A.; Yaremenko, I.A.; Ilovaisky, A.I.; Terent'ev, A.O., Peroxides with Anthelmintic, Antiprotozoal, Fungicidal and Antiviral Bioactivity: Properties, Synthesis and Reactions. Molecules 2017, 22 (11), 1881; (b) I.A. Yaremenko, P.S. Radulov, Y.Y. Belyakova, A.A. Demina, D.I. Fomenkov, D.V. Barsukov, I.R. Subbotina, F. Fleury, A.O. Terent'ev. Catalyst Development for the Synthesis of Ozonides and Tetraoxanes Under Heterogeneous Conditions: Disclosure of an Unprecedented Class of Fungicides for Agricultural Application. Chem. Eur. J. 2020, 26, 4734-4751] активности.
Интерес к получению инициаторов радикальной полимеризации и лекарственных препаратов стимулирует развитие методов синтеза пероксидов, в которых карбонильные соединения, их производные и Н2О2 играют ведущую роль как стартовые реагенты.
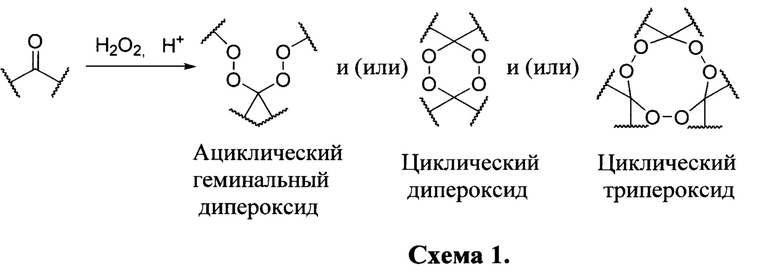
Анализ научно-технической литературы демонстрирует, что количество публикаций, связанных с получением пероксидов в реакции Н2О2 с монокетонами исчисляется тысячами. Например, таким способом получают ациклические геминальные дипероксиды [(a)  Zupan, М; Stavber, S.; Iskra, J., Iodine as a catalyst for efficient conversion of ketones to gem-dihydroperoxides by aqueous hydrogen peroxide. Org. Lett. 2006, 8, 2491-2494; (b) Terent'ev, A.O.; Platonov, M.M.; Ogibin, Y.N.; Nikishin, G.I., Convenient Synthesis of Geminal Bishydroperoxides by the Reaction of Ketones with Hydrogen Peroxide. Synth. Commun. 2007, 37, 1281-1287; (c) Das, В.; Krishnaiah, M.; Veeranjaneyulu, В.; Ravikanth, В., A simple and efficient synthesis of gem-dihydroperoxides from ketones using aqueous hydrogen peroxide and catalytic ceric ammonium nitrate. Tetrahedron Lett. 2007, 48, 6286-6289; (d) Ghorai, P.; Dussault, P.H., Mild and Efficient Re(VII)-Catalyzed Synthesis of 1,1-Dihydroperoxides. Org. Lett. 2008, 10, 4577-4579], циклические дипероксиды [(a) Kharasch, M.; Sosnovsky, G. Structure of Peroxides Derived from Cyclohexanone and Hydrogen Peroxide. J. Org. Chem. 1958, 23, 1322-1324; (b) Ghorai, P.; Dussault, P.H. Broadly Applicable Synthesis of 1,2,4,5-Tetraoxanes. Org. Lett. 2009, 11, 213-216; (c) Amewu, R.; Stachulski, A.V.; Ward, S.A.; Berry, N.G.; Bray, P.G.; Davies, J.; Labat, G.; Vivas, L.; O'Neill, P.M., Design and synthesis of orally active dispiro 1,2,4,5-tetraoxanes; synthetic antimalarials with superior activity to artemisinin. Org. Biomol. Chem. 2006, 4 (24), 4431-4436; (d) Sashidhara, K.V.; Avula, S.R.; Singh, L.R.; Palnati, G.R., A facile and efficient Bi(III) catalyzed synthesis of 1,1-dihydroperoxides and 1,2,4,5-tetraoxanes. Tetrahedron Lett. 2012, 53 (36), 4880-4884] и трипероксиды [(a) Story et al. Macrocyclic synthesis. II. Cyclohexanone peroxides. J. Org. Chem. 1970, 35, 3059-3061; (b) Terent'ev, A.O.; Platonov, M.M.; Sonneveld, E.J.; Peschar, R.; Chernyshev, V.V.; Starikova, Z.A.; Nikishin, G.I., New preparation of 1,2,4,5,7,8-hexaoxonanes. J. Org. Chem. 2007, 72 (19), 7237-7243]. Получение описанных в литературе пероксидов показано на следующей схеме:
Zupan, М; Stavber, S.; Iskra, J., Iodine as a catalyst for efficient conversion of ketones to gem-dihydroperoxides by aqueous hydrogen peroxide. Org. Lett. 2006, 8, 2491-2494; (b) Terent'ev, A.O.; Platonov, M.M.; Ogibin, Y.N.; Nikishin, G.I., Convenient Synthesis of Geminal Bishydroperoxides by the Reaction of Ketones with Hydrogen Peroxide. Synth. Commun. 2007, 37, 1281-1287; (c) Das, В.; Krishnaiah, M.; Veeranjaneyulu, В.; Ravikanth, В., A simple and efficient synthesis of gem-dihydroperoxides from ketones using aqueous hydrogen peroxide and catalytic ceric ammonium nitrate. Tetrahedron Lett. 2007, 48, 6286-6289; (d) Ghorai, P.; Dussault, P.H., Mild and Efficient Re(VII)-Catalyzed Synthesis of 1,1-Dihydroperoxides. Org. Lett. 2008, 10, 4577-4579], циклические дипероксиды [(a) Kharasch, M.; Sosnovsky, G. Structure of Peroxides Derived from Cyclohexanone and Hydrogen Peroxide. J. Org. Chem. 1958, 23, 1322-1324; (b) Ghorai, P.; Dussault, P.H. Broadly Applicable Synthesis of 1,2,4,5-Tetraoxanes. Org. Lett. 2009, 11, 213-216; (c) Amewu, R.; Stachulski, A.V.; Ward, S.A.; Berry, N.G.; Bray, P.G.; Davies, J.; Labat, G.; Vivas, L.; O'Neill, P.M., Design and synthesis of orally active dispiro 1,2,4,5-tetraoxanes; synthetic antimalarials with superior activity to artemisinin. Org. Biomol. Chem. 2006, 4 (24), 4431-4436; (d) Sashidhara, K.V.; Avula, S.R.; Singh, L.R.; Palnati, G.R., A facile and efficient Bi(III) catalyzed synthesis of 1,1-dihydroperoxides and 1,2,4,5-tetraoxanes. Tetrahedron Lett. 2012, 53 (36), 4880-4884] и трипероксиды [(a) Story et al. Macrocyclic synthesis. II. Cyclohexanone peroxides. J. Org. Chem. 1970, 35, 3059-3061; (b) Terent'ev, A.O.; Platonov, M.M.; Sonneveld, E.J.; Peschar, R.; Chernyshev, V.V.; Starikova, Z.A.; Nikishin, G.I., New preparation of 1,2,4,5,7,8-hexaoxonanes. J. Org. Chem. 2007, 72 (19), 7237-7243]. Получение описанных в литературе пероксидов показано на следующей схеме:
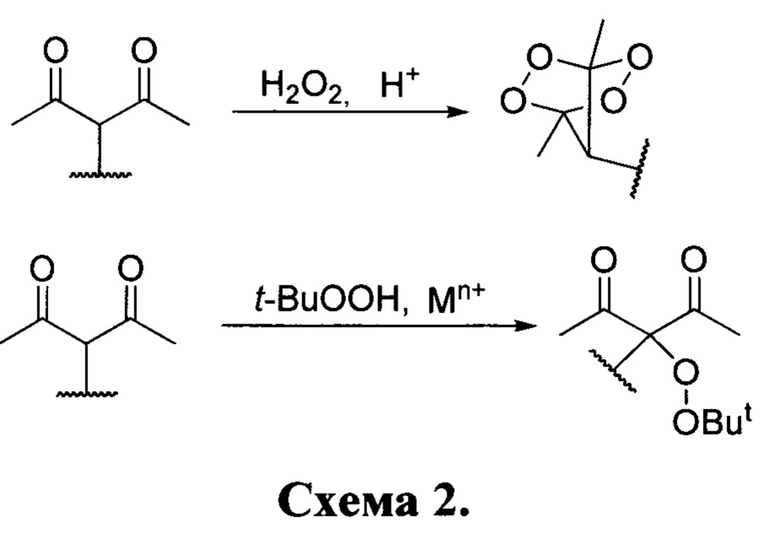
По реакциям Н2О2 с дикетонами насчитывается не более двух десятков публикаций [(a) Terent'ev, А.О.; Borisov, D.A.; Chernyshev, V.V.; Nikishin. G.I. Facile and Selective Procedure for the Synthesis of Bridged 1,2,4,5-Tetraoxanes; Strong Acids As Cosolvents and Catalysts for Addition of Hydrogen Peroxide to β-Diketones. J.Org.Chem. 2009, 74, 3335-3340; (b) Terent'ev, A.O.; Yaremenko, I.A.; Vil, V.A.; Moiseev, I.K.; Kon'kov, S.A.; Dembitsky, V.M.; Levitsky, D.O.; Nikishin, G.I., Phosphomolybdic and phosphotungstic acids as efficient catalysts for the synthesis of bridged 1,2,4,5-tetraoxanes from β-diketones and hydrogen peroxide. Org. Biomol. Chem. 2013, 11, 2613-2623; (c) Novikov, V.L.; Shestak, O.P., Reactions of hydrogen peroxide with acetylacetone and 2-acetylcyclopentanone. Russ. Chem. Bull. Int. Ed. 2013, 62, 2171-2190; (d) Vinogradova, L.P.; Zav'yalov, S.I., β-Dicarbonyl compounds. IX. Reaction of β-dicarbonyl compounds with hydrogen peroxide. Izvest. Akad. Nauk. S.S.S.R. Otdel. Khim. Nauk 1961, 1482-1486 (Chem. Abs. 56 (1962) 338b); (f) Rieche, A.; Bischoff, C., Alkylperoxyde, XXX. Peroxyde Von Diketonen, I. Peroxyde des Acetylacetons. Chem. Ber. 1962, 95 (1), 77-82; (g) Milas, N.A.; Mageli, O.L.; Golubovic, A.; Arndt, R.W.; Ho, J.C. J., Studies in Organic Peroxides. XXIX. The Structure of Peroxides Derived from 2,4-Pentanedione and Hydrogen Peroxide. J. Am. Chem. Soc. 1963, 85 (2), 222-226; (h) Rieche, A.; Bischoff, C.; Prescher, D., Alkylperoxyde, XXXV. Peroxyde des Triacetylmethans "Triacetylmethanperoxyd". Chem. Ber. 1964, 97 (11), 3071-3075; (i) Rieche, A.; Seyfarth, H.E.; Brand, F., Isolierung von Dibenzylather-hydroperoxid aus den Peroxygenaten von Benzylalkohol und Dibenzylather. Liebigs Ann. Chem. 1969, 725 (1), 93-98; (j) Terent'ev, A.O.; Borisov, D.A.; Yaremenko, I.A.; Chernyshev, V.V.; Nikishin, G.I., Synthesis of Asymmetric Peroxides: Transition Metal (Cu, Fe, Mn, Co) Catalyzed Peroxidation of beta-Dicarbonyl Compounds with tert-Butyl Hydroperoxide. J. Org. Chem. 2010, 75 (15), 5065-5071; (k) Terent'ev, A.O.; Borisov, D.A.; Semenov, V.V.; Chernyshev, V.V.; Dembitsky, V.M.; Nikishin, G.I., Selective Synthesis of Unsymmetrical Peroxides: Transition-Metal-Catalyzed Oxidation of Malononitrile and Cyanoacetic Ester Derivatives by tert-Butyl Hydroperoxide at the alpha-Position. Synthesis 2011, (13), 2091-2100; (1) I.A. Yaremenko, P.S. Radulov, Y.Y. Belyakova, A.A. Demina, D.I. Fomenkov, D.V. Barsukov, I.R. Subbotina, F. Fleury, A.O. Terent'ev. Catalyst Development for the Synthesis of Ozonides and Tetraoxanes Under Heterogeneous Conditions: Disclosure of an Unprecedented Class of Fungicides for Agricultural Application. Chem. Eur. J. 2020, 26, 4734-4751]. Получение описанных пероксидов показано на следующей схеме:
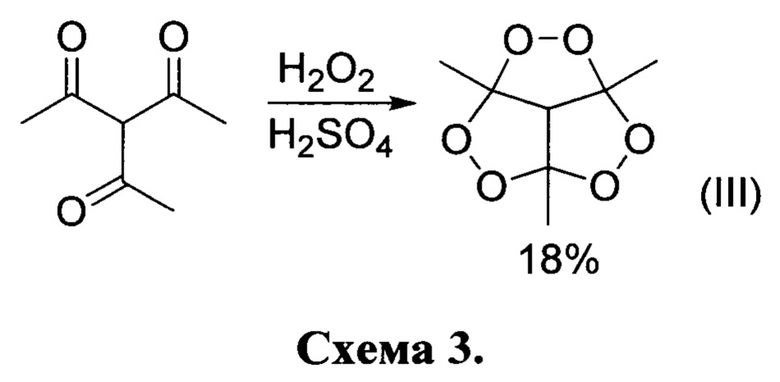
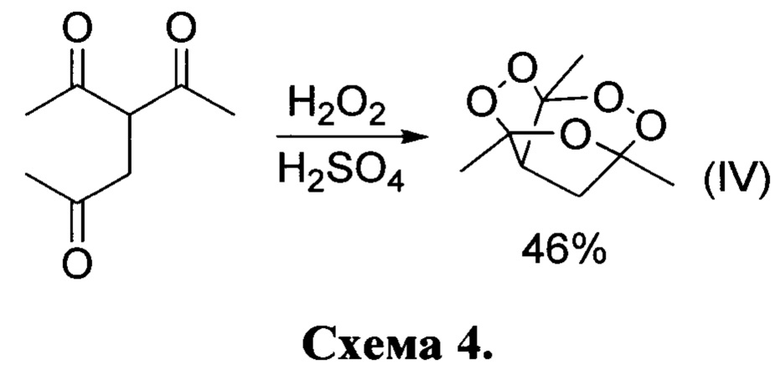
Известно всего несколько единичных примеров получение пероксидов из трикетонов [(a) Rieche, A.; Bischoff, С.; Prescher, D. Alkylperoxyde, XXXV. Peroxyde des Triacetylmethans „Triacetylmethanperoxyd. Chem. Ber. 1964, 97 (11), 3071-3075; (b) Bischoff, C.; Rieche, A. Alkylperoxide, XXXVII  die Bildung cyclischer Peroxide aus Mehrfachketonen. Justus Liebigs Ann. Chem. 1969, 725 (1), 87-92; где из триацетилметана (не относящегося к классу кетонов, исходных для пероксидирования в настоящем патенте) был получен пероксид формулы (III) с тремя фрагментами О-О с выходом 18%. По реакции 3-ацетилгексан-2,5-диона с пероксидом водорода был получен дипероксид формулы (IV) с выходом 46%. Стоит ответить, что синтез пероксидов (III) (схема 3) и (IV) (схема 4) проводился в жестких и небезопасных условиях, где концентрированная серная кислота использовалась в качестве катализатора и растворителя. Другие представители таких классов пероксидов в литературе описаны не были.
die Bildung cyclischer Peroxide aus Mehrfachketonen. Justus Liebigs Ann. Chem. 1969, 725 (1), 87-92; где из триацетилметана (не относящегося к классу кетонов, исходных для пероксидирования в настоящем патенте) был получен пероксид формулы (III) с тремя фрагментами О-О с выходом 18%. По реакции 3-ацетилгексан-2,5-диона с пероксидом водорода был получен дипероксид формулы (IV) с выходом 46%. Стоит ответить, что синтез пероксидов (III) (схема 3) и (IV) (схема 4) проводился в жестких и небезопасных условиях, где концентрированная серная кислота использовалась в качестве катализатора и растворителя. Другие представители таких классов пероксидов в литературе описаны не были.
Сложность использования ди-, три- и поликарбонильных соединений в реакциях пероксидирования обусловлена фундаментальной проблемой синтеза пероксидов из карбонильных соединений и Н2О2 - селективностью этих реакций.
В литературе описан единственный способ получения единственного представителя класса трициклических органических дипероксидов, а именно 3,5,7а-триметилгидро-3Н-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксан структурной формулы IV, принятый за прототип [Bischoff, С.; Rieche, А. Alkylperoxide, XXXVIII) Uber die Bildung cyclischer Peroxide aus Mehrfachketonen. Justus Liebigs Ann. Chem. 1969, 725 (1), 87-92], Известный пероксид был получен путем взаимодействия 3-ацетилгексан-2,5-диона с пероксидом водорода в присутствии концентрированной серной кислоты с выходом 46% по схеме 4. Реакция проводилась в жестких и небезопасных условиях, где концентрированная серная кислота использовалась в качестве катализатора и растворителя. Другие представители такого класса описаны не были в связи с отсутствием общих методом синтеза пероксидов такого строения.
Технической задачей настоящего изобретения является увеличение выхода целевого продукта, повышение безопасности процесса, а также расширение ассортимента трициклических органических дипероксидов. Поставленная техническая задача достигается предлагаемым способом получения трициклических органических дипероксидов общей формулы (I):
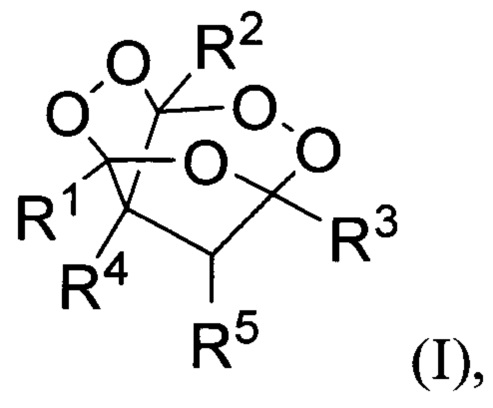
где R1= низший алкил; R2= низший алкил; R3= разветвленный или неразветвленный низший алкил, замещенный или незамещенный фенил;
R4=H, низший алкил, СН2СН=СН2; R5=H, 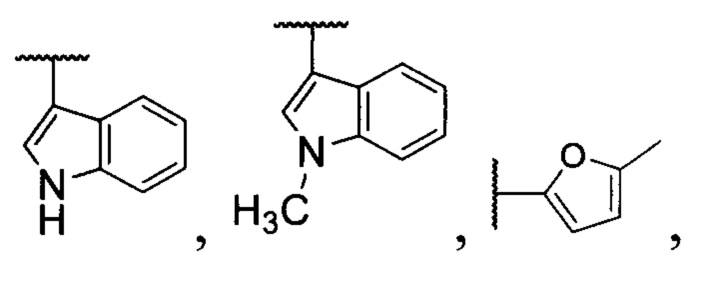 заключающимся в том, что β,γ'-трикетонов общей формулы (II):
заключающимся в том, что β,γ'-трикетонов общей формулы (II):
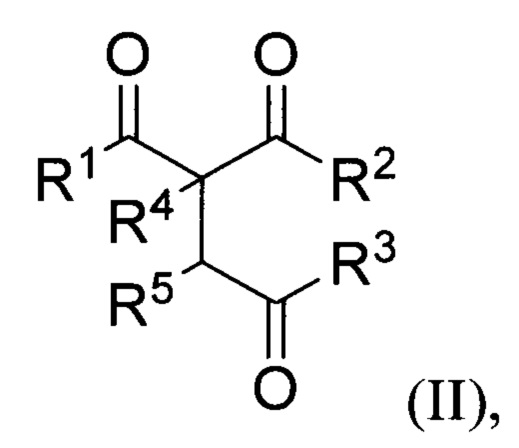
где R1, R2, R3, R4 и R5= имеют вышеуказанные значения, подвергают взаимодействию с пероксидом водорода в присутствии BF3⋅Et2O, HClO4, HBF4 или p-TsOH в качестве катализатора в среде ацетонитрила или этанола. Процесс получения трициклических органических дипероксидов общей формулы (I) проводят при комнатной температуре (20-25°С) в течение 0.5-3 часов и мольном соотношении β,γ'-трикетон II : катализатор : пероксид водорода 1:(0.5-15):(2-5).
Пероксид водорода используют преимущественно в виде водного или эфирного раствора.
Процесс протекает по следующей схеме:
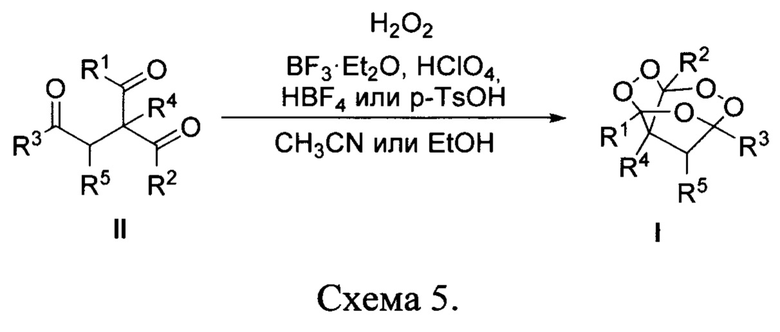
В результате реакции получены новые, неописанные в литературе, трициклические органические дипероксиды общей формулы I с выходом 35-90%.
В случае известного трициклического органического дипероксида общей формулы I, где R1=R2=R3=CH3, R4=R5=H, выход составляет 90%. В настоящем изобретении удалось показать, что фундаментальные органические соединения - β,γ'-трикетоны могут реагировать с Н2О2; в результате происходит селективная сборка нестандартных трициклических дипероксидов по своему строению которые содержат пероксидный и монопероксиацетальный фрагменты. По своим химическим свойствам предлагаемые в заявке трициклы отличаются от соединений с родственными структурными фрагментами (монопероксикетали) тем, что в водном спирте в кислых условиях в присутствии Н2О2 они являются стабильными; не подвергаются дальнейшему пероксидированию, гидролизу или алкоголизу.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1. Получение 3,5,7а-триметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (3,0 моль Н2О2 / 1,0 моль II) и BF3⋅Et2O (0,5 моль BF3⋅Et2O /1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-2,5-гександиона II (0,300 г, 1,92 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3,5,7а-триметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 70%. Т.пл. = 119-121°С. Rf=0,47 (ТСХ, ПЭ : ЭА, 2:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,55 (с, 3Н), 1,56 (с, 6Н), 2,06 (дд, J=12,4, 4,5 Гц, 1Н), 2,43 (д, J=12,4 Гц, 1H), 3,28 (д, J=4,5 Гц, 1Н).,3С ЯМР (75.47 МГц, CDCl3) δ: 19,5, 20,2, 21,2, 33,6, 59,2, 111,6, 112,8, 114,2. Вычислено для C8H12O5: С, 51,06%; Н, 6,43%. Найдено: С, 51,08%; Н, 6,46%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C8H12NaO5]+: 211,0577; Найдено: 211,0583.
Пример 2. Получение 3,5,7а-триметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор H2O2 (2,0 моль H2O2 / 1,0 моль II) и BF3⋅Et2O (0,5 моль BF3⋅Et2O /1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-2,5-гександиона II (0,300 г, 1,92 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3,5,7а-триметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 60%. Т.пл. = 119-121°С. Rf=0,47 (ТСХ, ПЭ : ЭА, 2:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,55 (с, 3Н), 1,56 (с, 6Н), 2,06 (дд, J=12,4, 4,5 Гц, 1Н), 2,43 (д, J=12,4 Гц, 1Н), 3,28 (д, J=4,5 Гц, 1Н). 13С ЯМР (75.47 МГц, CDCl3) δ: 19,5, 20,2, 21,2, 33,6, 59,2, 111,6, 112,8, 114,2. Вычислено для C8H12O5: С, 51,06%; Н, 6,43%. Найдено: С, 51,08%; Н, 6,46%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C8H12NaO5]+: 211,0577; Найдено: 211,0583.
Пример 3. Получение 3,5,7а-триметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
35% водный раствор H2O2 (3,0 моль H2O2 / 1,0 моль II) и HClO4 (15 моль HClO4 / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-2,5-гександиона II (0,300 г, 1,92 ммоль) в EtOH (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли H2O (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ: ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3,5,7а-триметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-c][1,2]диоксина с выходом 63%.
Пример 4. Получение 3,5,7а-триметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
35% водный раствор Н2О2 (3,0 моль H2O2 / 1,0 моль II) и HBF4 (15 моль HBF4 /1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетилгексана-2,5-диона II (0,300 г, 1,92 ммоль) в EtOH (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ: ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3,5,7а-триметилгидро-3H-3,5-эпокси [1,2]диоксоло[3,4-с][1,2]диоксина с выходом 77%.
Пример 5. Получение 3,5,7а-триметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (3,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-2,5-гександиона II (0,300 г, 1,92 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3,5,7а-триметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 90%.
Пример 6. Получение 3,7а-диэтил-5-метилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (3,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 4-пропионил-2,5,гептандиона II (0,300 г, 1,63 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3,7а-диэтил-5-метилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 80%. Т.пл. = 36-38°С. Rf=0,33 (ТСХ, ПЭ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3), δ: 1,02 (т, J=7,3 Гц, 3Н), 1,04 (т, J=7,3 Гц, 3Н), 1,57 (с, 3Н), 1,86 (кв, J=7,3 Гц, 4Н), 2,02 (дд, J=12,2) 4,5 Гц, 1Н), 2,37 (д, J=12,2 Гц, 1H), 3,33 (д, J=4,5 Гц, 1Н). 13С ЯМР (75.47 МГц, CDCl3) δ: 7.6, 8.5, 21.2, 26.7, 27.2, 34.1, 55.5, 111.9, 114.6, 116.3. Вычислено для C10H16O5: С, 55,55%; Н, 7,46%. Найдено: С, 55,56%; Н, 7,47%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C10H16NaO5]+: 239,0890; Найдено: 239,0887.
Пример 7. Получение 5-изопропил-3,7а-диметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (3,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-6-метилгептан-2,5-диона II (0,300 г, 1,63 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 5-изопропил-3,7а-диметилгидро-3Н-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 58%. Т.пл. = 81-83°С. Rf=0,28 (ТСХ, РЕ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,01 (д, J=6,9 Гц, 3Н), 1,03 (д, J=6,9 Гц, 3Н), 1,54 (с, 3Н), 1,56 (с, 3Н), 1,99 (дд, J=12,2, 4,5 Гц, 1Н), 2,03 (септет, J=6,9 Гц, 1Н), 2,30 (д, J=12,2 Гц, 1H), 3,26 (д, J=4,5 Гц, 1H). 13С ЯМР (75.47 МГц, CDCl3) δ: 16,9, 19,3, 20,3, 29,4, 32,9, 58,7, 112,9, 114,1, 116,1. Вычислено для C10H16O5: С, 55,55%; Н, 7,46%. Найдено: С, 55,57%; Н, 7,48%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C10H16NaO5]+: 239,0890; Найдено: 239,0885.
Пример 8. Получение 5-циклопропил-3,7а-диметилгидро-3H-3,5-эпокси[1,2] диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор H2O2 (3,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-1-циклопропилпентан-1,4-диона II (0,300 г, 1,65 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 5-циклопропил-3,7а-диметилгидро-3Н-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 60%. Т.пл. = 84-85°С. Rf=0,27 (ТСХ, ПЭ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 0,44-0,75 (м, 3Н), 0,65-0,72 (м, 1H), 1,15-1,24 (м, 1H), 1,51 (с, 3Н), 1,55 (с, 3Н), 2,05 (дд, J=12,4, 4,4 Гц, 1Н), 2,40 (д, J=12,4 Гц, 1Н), 3,27 (д, J=4,4 Гц, 1Н). 13С ЯМР (75.47 МГц, CDCl3) δ: 1.1, 1.7, 14.2, 19.3, 20.3, 32.9, 58.9, 112.5, 112.9, 113.9. Вычислено для C10H14O5: С, 56,07%; Н, 6,59%. Найдено: С, 56,09%; Н, 6,61%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C10H14NaO5]+: 237,0733; Найдено: 237,0733.
Пример 9. Получение 3,7а-диметил-5-фенилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор H2O2 (3,0 моль H2O2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-1-фенилпентан-1,4-диона II (0,300 г, 1,37 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли H2O (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3,7а-диметил-5-фенилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 45%. Т.пл. = 135-138°С. Rf=0,18 (ТСХ, ПЭ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,66 (с, 3Н), 1,70 (с, 3Н), 2,27 (дд, J=12,4, 4,4 Гц, 1Н), 2,78 (д, J=12,4 Гц, 1Н), 3,44 (д, J=4,4 Гц, 1Н), 7,39-7,42 (м, 3Н), 7,57-7,60 (м, 2Н). 13С ЯМР (75.47 МГц, CDCl3) δ: 19,5, 20,4, 35,5, 59,4, 112,4, 113,1, 114,4, 126,8, 128,4, 129,5, 135,8. Вычислено для C13H14O5: С, 62,39%; Н, 5,64%. Найдено: С, 62,41%; Н, 5,66%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C13H14NaO5]+: 273,0733; Найдено: 273,0730.
Пример 10. Получение 5-(4-бромфенил)-3,7а-диметилтетрагидро-3H-3,5эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (3,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-1-(4-бромфенил)пентан-1,4-диона II (0,300 г, 1,0 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 5-(4-бромфенил)-3,7а-диметилтетрагидро-3H-3,5эпокси[1,2] диоксоло[3,4-с][1,2] диоксина с выходом 43%. Т.пл. = 120-122°С. Rf=0,23 (ТСХ, ПЭ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,64 (с, 3Н), 1,67 (с, 3Н), 2,20 (дд, J=12,4, 4,4 Гц, 1Н), 2,73 (д, J=12,4 Гц, 1Н), 3,41 (д, J=4,4 Гц, 1Н), 7,43 (д, J=8,6 Гц, 2Н), 7,51 (д, J=8,6 Гц, 2Н). 13С ЯМР (75.47 МГц, CDC13), δ: 19.4, 20.3, 35.5, 59.3, 111.9, 113.0, 114.3, 123.9, 128.0, 131.6, 134.8. Вычислено для C13H13BrO5: С, 47,44%; Br, 24,28%; Н, 3,98. Найдено: С, 47,45%; Br, 24,30%; Н, 3,99%. Масс-спектр высокого разрешения (ESI-TOF): m/z [М+Н]+: Вычислено для [C13H14BrO5]+: 329,0019, 330,9999; Найдено: 329,0008, 330,9989.
Пример 11. Получение 3,7а-диметил-5-(n-толил)тетрагидро-3Н-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (3,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-1-(n-толил)пентан-1,4-диона II (0,300 г, 1,29 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3,7а-диметил-5-(n-толил)тетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 37%. Т.пл. = 144-146°С. Rf=0,31 (ТСХ, ПЭ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,65 (с, 3Н), 1,68 (с, 3Н), 2,24 (дд, J=12,4, 4,4 Гц, 1Н), 2,37 (с, 3Н), 2,75 (д, J=12,4 Гц, 1H), 3,41 (д, J=4,4 Гц, 1Н), 7,20 (д, J=8,1 Гц, 2Н), 7,46 (д, J=8,1 Гц, 2Н). 13С ЯМР (75.47 МГц, CDC13) δ: 18.9, 19.9, 20.7, 34.9, 58.9, 112.0, 112.5, 113.8, 125.7, 128.6, 132.5, 138.9. Вычислено для C14H16O5: С, 63,63%; Н, 6,10% Найдено: С, 63,64%; Н, 6,12%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C14H16NaO5]+: 287,0890; Найдено: 287,0885.
Пример 12. Получение 3-(3,5,7а-триметилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксин-4-ил)-1H-индола (I)
6,5 М эфирный раствор Н2О2 (5,0 моль Н2О2/ 1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-4-(1H-индол-3-ил)гексан -2,5-диона II (0,300 г, 1,11 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3-(3,5,7а-триметилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксин-4-ил)-1H-индола с выходом 41%. Т.пл. = 150°С. Rf=0,47 (ТСХ, ПЭ : ЭА, 2:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,56 (с, 3Н), 1,71 (с, 3Н), 1,72 (с, 3Н), 3,31 (с, 1H), 4,23 (с, 1H), 7,20-7,35 (м, 3Н), 7,49 (д, J=). 7,8 Гц, 1Н), 7,62 (д, J=7,8 Гц, 1H), 8,33 (с, 1H). 13С ЯМР (75.47 МГц, CDC13) δ: 19,5, 19,9, 21,1, 41,9, 64,4, 108,4, 111,7, 113,6, 115,2, 115,7, 117,8, 120,3, 122,8, 123,1, 127,1, 135,9. Вычислено для C16H17NO5: С, 63,36%; Н, 5,65%; N, 4,62%. Найдено: С, 63,37%; Н, 5,66%; N, 4,64%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C16H17NaO5]+: 326,0999; Найдено: 326,1002.
Пример 13. Получение 1-метил-3-(3,5,7а-триметилтетрагидро-3H-3,5-эпокси [1,2]диоксоло[3,4-с][1,2] диоксин-4-ил)-1H-индола (I)
6,5 М эфирный раствор Н2О2 (3,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-4-(-1-метил-1H-индол-3-ил)гексан-2,5-диона II (0,300 г, 1,05 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали желтое масло 1-метил-3-(3,5,7а-триметилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксин-4-ил)-1H-индола с выходом 35%. Rf=0.16 (ТСХ, ПЭ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,59 (с, 3Н), 1,72 (с, 6Н), 3,30 (с, 1Н), 3,86 (с, 3Н), 4,23 (с, 1H), 7,05 (с, 1Н), 7,22-7,25 (м, 1H) 7,33-7,43 (м, 2Н), 7,62 (д, J=7,9 Гц, 1H). 13С ЯМР (75.47 МГц, CDCl3) δ: 19.4, 19.8, 21.2, 33.0, 41.9, 64.5, 106.8, 109.8, 113.5, 115.0, 115.6, 117.9, 119.8, 122.6, 127.4, 127.6, 136.7. Вычислено для C17H19NO5: С, 64,34%; Н, 6,04%; N, 4,41%. Найдено: С, 64,37%; Н, 6,06%; N, 4,42%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C17H19NaO5]+: 340,1155; Найдено: 340,1154.
Пример 14. Получение 3,5,7а-триметил-4-(5-метилфуран-2-ил)тетрагидро-3H-3,5-эпокси [1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (3,0 моль Н2О2/ 1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-4-(5-метилфуран-2-ил)гексан-2,5-диона II (0,300 г, 1,30 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали желтое масло 3,5,7а-триметил-4-(5-метилфуран-2-ил)тетрагидро-3H-3,5-эпокси[1,2] диоксоло[3,4-с][1,2] диоксина с выходом 35%. Rf=0,35 (ТСХ, ПЭ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,51 (с, 3Н), 1,60 (с, 3Н), 1,70 (с, 3Н), 2,29 (с, 3Н), 3,49 (с, 1H), 3,82 (с, 1Н), 5,96 (д, J=3,1, 1Н), 6,18 (д, J=3,1 Гц, 1Н). 13С ЯМР (75.47 МГц, CDCl3) δ: 13.,5, 19.4, 19.8, 20.2, 44.7, 62.8, 106.5, 110.3, 113.6, 114.5, 115.1, 146.2, 152.4. Вычислено для C13H16O6: С, 58,20%; Н, 6,01%. Найдено: С, 58,22%; Н, 6,03%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C13H16NaO6]+: 291,0839; Найдено: 291,0842.
Пример 15. Получение 3,7а-диэтил-5-метил-4-(5-метилфуран-2-ил)тетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (3,0 моль Н2О2/ 1,0 моль II) и p-TsOH (2,0 моль p-TsOH /1,0 моль II) последовательно добавляли при перемешивании к раствору 3-(5-метилфуран-2-ил)-4-пропионилгептан-2,5-диона II (0,300 г, 1,13 ммоль) в CH3CN (5 мл) при 20-25°С.Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об.%. Получали желтое масло 3,7а-диэтил-5-метил-4-(5-метилфуран-2-ил)тетрагидро-3H-3,5-эпокси[1,2] диоксоло[3,4-с][1,2]диоксина с выходом 48%. Rf=0,6 (ТСХ, ПЭ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,03 (т, J=7,1 Гц, 2Н), 1,07 (д, J=7,1 Гц, 2Н), 1,54 (с, 3Н), 1,89 (кв, J=7,1 Гц, 2Н), 1,95-2,11 (м, 2Н)), 2,28 (с, 3Н), 3,57 (с, 1Н), 3,80 (с, 1H), 5,95 (д, J=3,2 Гц, 1Н), 6,13 (д, J=3,2 Гц, 1Н). 13С ЯМР (75.47 МГц, CDCl3) δ: 7.6, 8.6, 13.6, 19.6, 26.7, 26.9, 44,7, 58.2, 106.6, 109.9, 114.4, 115.3, 117.3, 146.4, 152.3. Вычислено для C15H20O6: С, 60,80%; Н, 6,80%. Найдено: С, 60,82%; Н, 6,81%. Масс-спектр высокого разрешения (ESI-TOF): m/z [М+K]+: Вычислено для [C15H20KO6]+: 335,0891; Найдено: 335,0881.
Пример 16. Получение 3,3а,5,7а-тетраметилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (5,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-3-метил-2,5-гександиона II (0,300 г, 1,76 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3,3а,5,7а-тетраметилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 87%. Т.пл. = 103-105°С. Rf=0,32 (ТСХ, ПЭ : ЭА, 5:1). 1H ЯМР (300,13 МГц, CDCl3) δ: 1,31 (с, 3Н), 1,40 (с, 3Н), 1,46 (с, 3Н), 1,53 (с, 3Н), 1,83 (д, J=12,2 Гц, 1H), 2,42 (д, J=12,2 Гц, 1Н). 13С ЯМР (75.47 МГц, CDCl3) δ: 15.6, 17.4, 18.1,21.3,40.1,60.2, 110.2, 115.2, 115.3. Вычислено для C9H14O5: С, 53,46%; Н, 6,98%. Найдено: С, 53,42%; Н, 6,83%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C9H14NaO5]+: 225,0733; Найдено: 225,0722.
Пример 17. Получение 3а-этил-3,5,7а-триметилтетрагидро-3H-3,5-эпокси[1,2] диоксоло[3,4-с][1,2]диоксин (I)
6,5 М эфирный раствор Н2О2 (5,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH I 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-3-этил-2,5-гександиона II (0,300 г, 1,63 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 3а-этил-3,5,7а-триметилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 47%. Т.пл. = 52-54°С. Rf=0,5 (ТСХ, ПЭ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 1,10 (т, J=7,5 Гц, 3Н). 1,44 (с, 3Н), 1,53 (с, 6Н), 1,76-1,84 (м, 2Н), 1,84 (д, J=12,2 Гц, 1Н), 2,42 (д, J=12,2 Гц). 13С ЯМР (75,47 МГц, CDCl3) δ: 9.9, 17.6, 18.5, 21.6, 22.2, 37.8, 63.6, 110.0, 115.8. Вычислено для C10H16O5: С, 55,55%; Н, 7,46%. Найдено: С, 55,57%; Н, 7,48%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C10H16NaO5]+: 239,0890; Найдено: 239,0893.
Пример 18. Получение 3а-аллил-3,5,7а-триметилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксин (I)
6,5 М эфирный раствор Н2О2 (5,0 моль Н2О2/ 1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-3-аллил-2,5-гександиона II (0,300 г, 1,53 ммоль) в CH3CN (5 мл) при 20-25°С.Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали светло-желтое масло 3а-аллил-3,5,7а-триметилтетрагидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина с выходом 30%. Rf=0,5 (ТСХ, ПЭ : ЭА, 5:1). 1H ЯМР (300,13 МГц, CDCl3), δ: 1,46 (с, 3Н), 1,54 (с, 3Н), 1,55 (с, 3Н), 1,90 (д, J=12,3 Гц, 1Н), 2,43 (д, J=12,3 Гц, 1Н), 2,56 (д, J=6,6, 2Н), 5,20-5,26 (м, 2Н), 5,81-5,94 (м, 1Н). 13С ЯМР (75,47 МГц, CDCl3), δ: 17.8, 18.5, 21.5, 33.9, 38.6, 62.7, 110.1, 115.6, 115.7, 119.7, 132.5. Вычислено для C11H16O5: С, 57,89%; Н, 7,07%. Найдено: С, 57,91%; Н, 7,09%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C11H16NaO5]+: 251,0890; Найдено: 251,0885.
Пример 19. Получение 5-изопропил-3,3а,7а-триметилтетрагидро-3Н-3,5-эпокси [1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (5,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил-3,6-диметил-2,5-гептандиона II (0,300 г, 1,63 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли H2O (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы За-аллил-5-изопропил-3,3а,7а-триметилтетрагидро-3Н-3,5-эпокси[1,2] диоксоло[3,4-с] [1,2] диоксина с выходом 20%. Т.пл. = 82-84°С. Rf=0,5 (ТСХ, ПЭ : ЭА, 5: 1). 1Н ЯМР (300,13 МГц, CDCl3) δ: 0,97 (д, J=6,5 Гц, 3Н), 0,99 (д, J=6,5 Гц, 3Н), 1,29 (с, 3Н), 1,36 (с, 3Н), 1,42 (с, 3Н), 1,73 (д, J=12,2 Гц, 1Н), 1,98 (септет, J=6,5 Гц, 1Н), 2,26 (д, J=12,2 Гц, 1H). 13С ЯМР (75.47 МГц, CDCl3), δ: 15.2, 16.50, 16.52, 17.0, 17.4, 32.5, 35.5, 59.2, 114.1, 114.7, 115.1. Вычислено для C11H18O5: С, 57,38%; Н, 7,88%. Найдено: С, 57,39%; Н, 7,09%. Масс-спектр высокого разрешения (ESI-TOF): m/z [M+Na]+: Вычислено для [C11H18NaO5]+: 253,1046; Найдено: 253,1051.
Пример 20. Получение 5-циклопропил-3,3а,7а-триметилгидро-3H-3,5-эпокси[1,2]диоксоло[3,4-с][1,2]диоксина (I)
6,5 М эфирный раствор Н2О2 (5,0 моль Н2О2 /1,0 моль II) и p-TsOH (2,0 моль p-TsOH / 1,0 моль II) последовательно добавляли при перемешивании к раствору 3-ацетил- 1-циклопропил-3-метил-1,4-пентандиона II (0,300 г, 1,53 ммоль) в CH3CN (5 мл) при 20-25°С. Реакционную смесь перемешивали при 20-25°С в течение 1 часа. Затем добавляли CHCl3 (40 мл). После этого смесь переносили в делительную воронку и добавляли Н2О (10 мл). Водная фаза была отделена; органическую фазу промывали насыщенным водн. раствором NaHCO3 и затем водой (2 × 10 мл). Органическую фазу сушили над MgSO4 и фильтровали от осадка. Растворитель удаляли в вакууме водоструйного насоса. Трициклический дипероксид I выделяли хроматографией на SiO2 с использованием смеси ПЭ : ЭА в качестве элюента с градиентом ЭА от 5 до 20 об. %. Получали белые кристаллы 5-циклопропил-3,3а,7а-триметилгидро-3H-3,5-эпокси [1,2]диоксоло[3,4-с][1,2]диоксина с выходом 56%. Т.пл. = 88-90°С. Rf=0,33 (ТСХ, ПЭ : ЭА, 5:1). 1Н ЯМР (300,13 МГц, CDCl3), δ: 0,43-0,59 (м, 3Н), 0,66-0,74 (м, 1Н), 1,12-1,19 (м, 1Н), 1,30 (с, 3Н), 1,36 (с, 3Н, СН3), 1,45 (с, 3Н), 1,82 (д, J=12,2 Гц, 1Н), 2,40 (д, J=12,2 Гц, 1Н).13С ЯМР (75.47 МГц, CDCl3), δ: 0.9, 1.6, 14.3, 15.5, 17.5, 17.8, 39.5, 59.9, 111.0, 115.0, 115.5. Вычислено для С11Н16О5: С, 57,89%; Н, 7,07%. Найдено: С, 57,88%; Н, 7,08%. Масс-спектр высокого разрешения (ESI-TOF): m/z [М+Н]+: Вычислено для [C11H16O5]+: 229,1071; Найдено: 229,1067. Наиболее близкими по свойствам к заявленным замещенным трициклическим дипероксидам являются трициклические монопероксиды общей формулы
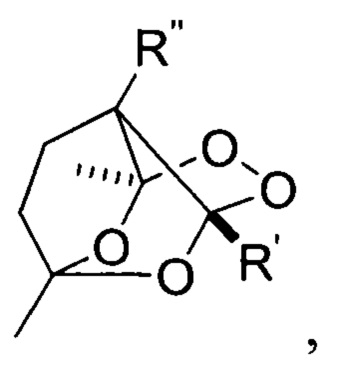
которые обладают противопаразитарной активностью [(a) Ingram, K.; Yaremenko, I.A.; Krylov, I.В.; Hofer, L.; Terentev, А.О.; Keiser, J., Identification of antischistosomal leads by evaluating bridged 1,2,4,5-tetraoxanes, alphaperoxides, and tricyclic monoperoxides. J. Med. Chem. 2012, 55, 8700-8711; (b) Cowan, N.; Yaremenko, I.A.; Krylov, I.В.; Terent'ev, A.O.; Keiser, J., Elucidation of the in vitro and in vivo activities of bridged 1,2,4-trioxolanes, bridged 1,2,4,5-tetraoxanes, tricyclic monoperoxides, silyl peroxides, and hydroxylamine derivatives against Schistosoma mansoni. Bioorg. Med. Chem 2015, 23 (16), 5175-5181; и RU 2466133 C1, 10.11.2012] и цитотоксическим действием по отношению к раковым клеткам печени [Coghi, P.; Yaremenko, I.A.; Prommana, P.; Radulov, P.S.; Syroeshkin, М.A.; Wu, Y.J.; Gao, J.Y.; Gordillo, F.M.; Mok, S.; Wong, V.K. W.; Uthaipibull, C.; Terent'ev, A.O., Novel Peroxides as Promising Anticancer Agents with Unexpected Depressed Antimalarial Activity. Chemmedchem 2018, 13 (9), 902-908]. Предлагаемые в настоящем изобретении трициклические органические пероксиды содержат в своей структуре циклический пероксидный фрагмент, который обеспечивает антипаразитарную активность этого класса соединений, которые в дальнейшем могут найти применение в медицине в качестве антипаразитарных средств, а также как инициаторы радикальной полимеризации непредельных мономеров.
Техническим результатом предлагаемого изобретения является увеличение выхода известного целевого продукта общей формулы I, где R1=R2=R3=CH3, R4=R5=H, до 90%, повышение безопасности процесса за счет исключения агрессивной серной кислоты, а также расширение ассортимента трициклических органических дипероксидов общей формулы I.
| название | год | авторы | номер документа |
|---|---|---|---|
| Замещенные трициклические органические монопероксиды и способ их получения | 2020 |
|
RU2752760C1 |
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
| Способ получения N-замещенных мостиковых 1,2,4-диоксазолидинов | 2023 |
|
RU2804396C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2472799C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2006 |
|
RU2463303C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2012 |
|
RU2608610C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2016 |
|
RU2765714C2 |
| НОВЫЕ ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ И СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ КАМПТОТЕЦИНА (СРТ-11) И РОДСТВЕННЫХ СОЕДИНЕНИЙ | 1996 |
|
RU2164917C2 |
| Способ получения замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов | 2020 |
|
RU2752940C1 |
| МОДУЛЯТОРЫ КАЛЬПАИНА И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2773288C2 |
Изобретение относится к способу получения трициклических органических дипероксидов общей формулы (I), где R1= низший алкил; R2= низший алкил; R3= разветвленный или неразветвленный низший алкил, замещенный или незамещенный фенил; R4=H, низший алкил, СН2СН=СН2; R5=H, 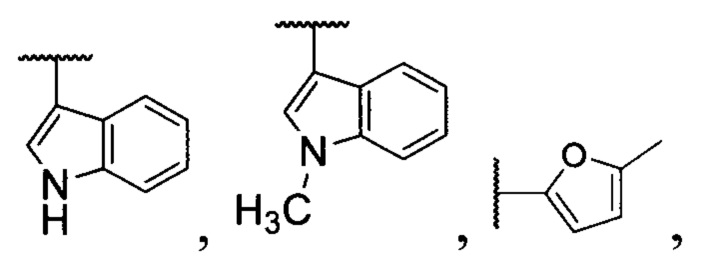 путем взаимодействия β,γ'-трикетонов общей формулы (II) с пероксидом водорода в присутствии BF3⋅Et2O, HClO4, HBF4 или p-TsOH в качестве катализатора в среде ацетонитрила или этанола и процесс проводят преимущественно при мольном соотношении β,γ'-трикетон II : катализатор : пероксид водорода 1:(0.5-15):(2-5) при комнатной температуре. Технический результат - разработан новый способ получения трициклических органических дипероксидов с высоким выходом, а также расширение ассортимента трициклических органических дипероксидов общей формулы I, которые могут найти применение как инициаторы радикальной полимеризации и в медицине в качестве антипаразитарных средств. 1 з.п. ф-лы, 20 пр.
путем взаимодействия β,γ'-трикетонов общей формулы (II) с пероксидом водорода в присутствии BF3⋅Et2O, HClO4, HBF4 или p-TsOH в качестве катализатора в среде ацетонитрила или этанола и процесс проводят преимущественно при мольном соотношении β,γ'-трикетон II : катализатор : пероксид водорода 1:(0.5-15):(2-5) при комнатной температуре. Технический результат - разработан новый способ получения трициклических органических дипероксидов с высоким выходом, а также расширение ассортимента трициклических органических дипероксидов общей формулы I, которые могут найти применение как инициаторы радикальной полимеризации и в медицине в качестве антипаразитарных средств. 1 з.п. ф-лы, 20 пр.
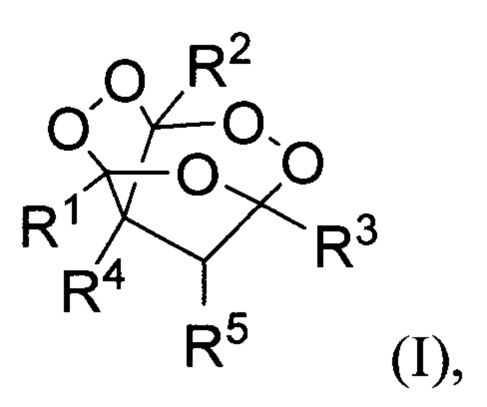

1. Способ получения трициклических органических дипероксидов общей формулы (I)
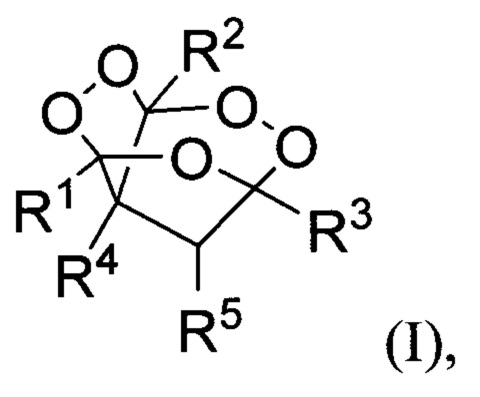
где R1= низший алкил; R2= низший алкил; R3= разветвленный или неразветвленный низший алкил, замещенный или незамещенный фенил; R4=H, низший алкил, СН2СН=СН2; R5=H, 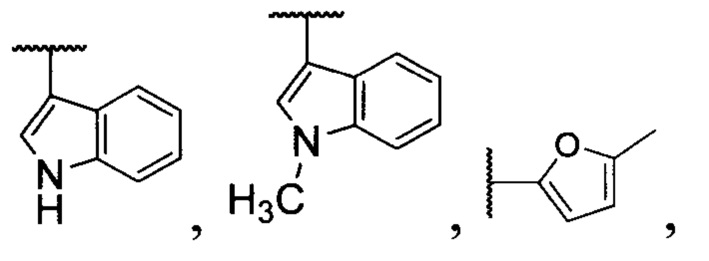
заключающийся в том, что β,γ'-трикетоны общей формулы (II)
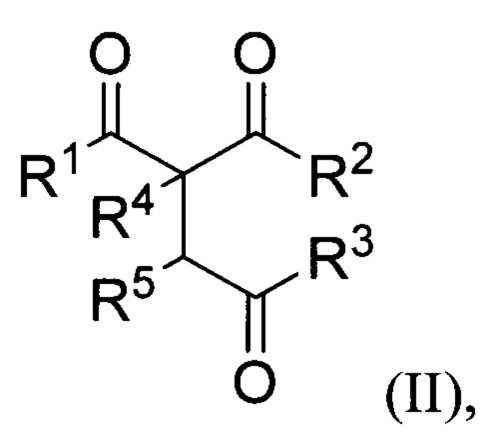
где R1, R2, R3, R4 и R5 имеют вышеуказанные значения, подвергают взаимодействию с пероксидом водорода в присутствии BF3⋅Et2O, HClO4, HBF4 или p-TsOH в качестве катализатора в среде ацетонитрила или этанола.
2. Способ получения трициклических органических дипероксидов общей формулы I по п. 1, отличающийся тем, что процесс проводят при мольном соотношении β,γ'-трикетон II : катализатор : пероксид водорода 1:(0.5-15):(2-5) при комнатной температуре.
| BISCHOFF C | |||
| ET AL, Justus Liebigs Annalen der Chemie, 725, 1969, рр.87-92 | |||
| СПОСОБ ПОЛУЧЕНИЯ 5-ГИДРОПЕРОКСИ-3,5-ДИМЕТИЛ-1,2-ДИОКСОЛАН-3-ОЛА | 2012 |
|
RU2473548C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2472799C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2494102C1 |
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
Авторы
Даты
2021-08-11—Публикация
2020-12-14—Подача