Настоящая заявка притязает на приоритет на основании заявки на выдачу патента США № 12/041581, поданной 3 марта 2008, которая притязает на приоритет на основании предварительной заявки на выдачу патента США № 60/894181, поданной 9 марта 2007, содержания которых включены в настоящее описание в виде ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к способам применения антител к бета-амилоидному пептиду для лечения и/или профилактики глазных болезней, таких как возрастная макулярная дегенерация, а также другие патологии глаз, такие как глаукома, диабетическая ретинопатия (включая диабетический отек желтого пятна), хориоидальная неоваскулярная мембрана (ХНВ), увеит, миопическая дегенерация, глазные опухоли, окклюзия центральной вены сетчатки, покраснение радужки, неоваскуляризация глаз, центральная серозная ретинопатия, болезни поверхности глаза, такие как синдром сухого глаза, окклюзия центральной артерии сетчатки, кистозный макулярный отек и любое другое дегенеративное заболевание сетчатки.
УРОВЕНЬ ТЕХНИКИ
Наиболее распространенной причиной снижения наилучшей корригированной остроты зрения у людей после 65 лет в США является заболевание сетчатки, известное как возрастная макулярная дегенерация (ВМД). По мере прогрессирования ВМД заболевание характеризуется утратой острого центрального зрения. Область глаза, поражаемая ВМД, представляет собой макулу - небольшую область в центре сетчатки, состоящую, главным образом, их фоторецепторных клеток. Так называемая «сухая» ВМД (также называемая «географической атрофией»), на долю которой приходится 85-90% пациентов с ВМД, включает в себя изменения в распределении пигментации глаза, утрату фоторецепторов и снижение функции сетчатки вследствие общей атрофии клеток. Так называемая «влажная» ВМД включает в себя пролиферацию аномальных хориоидальных сосудов, приводящую к сгусткам или рубцам в субретинальном пространстве. Таким образом, появление влажной ВМД происходит вследствие образования аномальной хориоидальной неоваскулярной сети (хориоидальной неоваскуляризации, ХНВ) под невральной сетчаткой. Новообразованные кровеносные сосуды очень сильно просачиваются. Это приводит к накоплению субретинальной жидкости и крови, что ведет к потере остроты зрения. В итоге имеет место общая потеря функциональной сетчатки в пораженной области, так как образуется большой дисковидный рубец, охватывающий хориоид и сетчатку. В то время как при сухой ВМД пациенты могут сохранять зрение пониженного качества, влажная ВМД часто приводит к слепоте (Hamdi and Kenney, Age-related Macular degeneration - a new viewpoint, Frontiers in Bioscience, e305-314, May 2003). ХНВ возникает не только при влажной ВМД, но также при других патологиях глаза, таких как глаукома, диабетическая ретинопатия (включая диабетический макулярный отек), разрывы в оболочке Бруха, миопическая дегенерация, глазные опухоли и другие родственные дегенеративные заболевания сетчатки.
ВМД является распространенным заболеванием, патогенез которого несомненно является многофакторным, при этом генетические факторы и факторы окружающей среды играют роль в его появлении и прогрессировании. В различных проведенных исследованиях было определено несколько факторов риска развития ВМД, таких как курение, возраст, семейный анамнез (Milton, Am. J. Ophthalmol. 88, 269 (1979); Mitchell et al., Ophthalmology 102, 1450-1460 (1995); Smith et al., Ophthalmology 108, 697-704 (2001)), пол (в 7 раз более высокая вероятность у женщин: Klein et al., Ophthalmology 99, 933-943 (1992) и раса (люди с белой кожей являются наиболее чувствительными). Дополнительные факторы риска могут включать характеристики глаз, такие как дальнозоркость (гиперметропия) и светлые глаза, а также сердечно-сосудистое заболевание и гипертония. Доказательство участия генетического компонента в прогрессировании заболевания также представлено в литературе (смотри Hamdi and Kenney выше).
В настоящее время нет общепринятых животных моделей для исследования ВМД. В начальных исследованиях, описанных в публикации Malek et al. PNAS 102, 11900-5 (2005), получена животная модель, имеющая три фактора риска, которые при объединении соответствовали морфологическим признакам ВМД человека. Важно, что разработка такой модели на мышах позволила тестировать новые молекулярные механизмы и терапевтические мишени ВМД. Сохраняется необходимость в идентификации новых мишеней и терапевтических средств, позволяющих лечить и/или предотвращать глазные болезни, такие как возрастная макулярная дегенерация (как влажная, так и сухая), глаукома, диабетическая ретинопатия (включая диабетический отек желтого пятна), хориоидальная неоваскулярная мембрана (ХНВ), увеит, миопическая дегенерация, глазные опухоли, окклюзия центральной вены сетчатки, покраснение радужки, неоваскуляризация глаз, центральная серозная ретинопатия, болезни поверхности глаза, такие как синдром сухого глаза, окклюзия центральной артерии сетчатки, кистозный макулярный отек и любое другое дегенеративное заболевание сетчатки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение раскрывает новые терапевтические мишени, вовлеченные в патогенез глазных болезней. В частности, настоящее изобретение раскрывает способы лечения глазной болезни, включающие в себя введение субъекту эффективного количества ингибитора β-амилоидного (Aβ) пептида. Ингибитор Aβ может быть введен субъектам, страдающим от глазных болезней, таких как возрастная макулярная дегенерация (как влажная, так и сухая ВМД), глаукома, диабетическая ретинопатия (включая диабетический отек желтого пятна), хориоидальная неоваскулярная мембрана (ХНВ), увеит, миопическая дегенерация, глазные опухоли, окклюзия центральной вены сетчатки, покраснение радужки, неоваскуляризация глаз, центральная серозная ретинопатия, болезни поверхности глаза, такие как синдром сухого глаза, окклюзия центральной артерии сетчатки, кистозный макулярный отек и любое другое дегенеративное заболевание сетчатки. В одном варианте ингибитор представляет собой антитело, антисмысловую молекулу, молекулу миРНК, рибозим или низкомолекулярное соединение.
В одном варианте настоящее изобретение относится к способу лечения субъекта, страдающего от возрастной макулярной дегенерации, включающему в себя введение субъекту фармацевтической композиции, содержащей терапевтически эффективное количество ингибитора β-амилоидного (Aβ)-пептида. Другой вариант осуществления настоящего изобретения относится к способу лечения субъекта, страдающего от возрастной макулярной дегенерации (ВМД), включающему в себя введение субъекту фармацевтической композиции, содержащей терапевтически эффективное количество ингибитора Aβ.
Дополнительный вариант осуществления настоящего изобретения относится к применению терапевтически эффективного количества ингибитора Aβ для получения лекарственного средства для стимуляции выздоровления пациента, страдающего от ВМД. В одном аспекте настоящего варианта антитело содержит Fc-область, обладающую нарушенной эффекторной функцией. В следующем аспекте настоящего варианта осуществления заболевание представляет собой ВМД, включая как сухую, так и влажную ВМД.
Изобретение также относится к способам лечения или профилактики заболеваний, связанных с отложением амилоида Aβ, включающим в себя введение субъекту эффективной дозы фармацевтической композиции, содержащей антитело, которое специфично связывается с Aβ-пептидом или агрегированной формой Aβ-пептида. В следующем аспекте настоящего варианта осуществления антитело содержит Fc-область, имеющую изменение по сравнению с встречающейся в природе Fc-областью, при этом изменение приводит к ухудшению эффекторной функции. В некоторых вариантах введение антитела меньше вызывает микрокровотечений в головном мозге, чем введение антитела без изменения.
Антитело и полипептид, используемые в способах согласно изобретению, специфично связываются с Aβ-пептидом или агрегированной формой Aβ-пептида. В одном варианте антитело или полипептид имеют нарушенную эффекторную функцию. В некоторых вариантах антитело или полипептид не являются F(ab')2-фрагментом. В некоторых вариантах антитело или полипептид не являются Fab-фрагментом. В некоторых вариантах антитело или полипептид не являются одноцепочечным антителом scFv.
Полипептиды, которые специфично связываются с Aβ-пептидом или агрегированной формой Aβ-пептида и содержат константную область тяжелой цепи, имеющую нарушенную эффекторную функцию, также могут быть использованы для любого из способов, описанных в настоящей публикации. В некоторых вариантах полипептид содержит последовательность (например, одну или несколько CDR), полученную из антитела 9TL, 6G или их вариантов, показанных в таблице 3 или таблице 8.
В некоторых вариантах антитело или полипептид содержит константную область тяжелой цепи, имеющую нарушенную эффекторную функцию, при этом константная область тяжелой цепи содержит Fc-область. В некоторых вариантах N-гликозилирование в Fc-области удалено. В некоторых вариантах Fc-область содержит мутацию в последовательности, узнаваемой при N-гликозилировании, в силу чего Fc-область антитела или полипептид не N-гликозилируются. В некоторых вариантах Fc-область пегилирована. В некоторых вариантах константная область тяжелой цепи антитела или полипептида представляет собой константную область тяжелой цепи IgG2a человека, содержащую следующие мутации: A330P331 → S330S331 (нумерация аминокислот в соответствии с последовательностью IgG2 дикого типа). В некоторых вариантах антитело или полипептид содержит константную область IgG4, содержащую следующие мутации: E233F234L235 → P233V234A235.
В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 1-16 Aβ-пептида. В некоторых вариантах антитело или полипептид специфично связывается с N-концом Aβ-пептида. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 16-28 Aβ-пептида. В некоторых вариантах антитело специфично связывается с эпитопом с C-концевой стороны Aβ-пептида, таким как эпитоп, начинающийся с аминокислоты 25 или далее. Антитело может специфично связываться с любым из Aβ-пептидов 1-37, 1-38, 1-39, 1-40, 1-41, 1-42, 1-43. В некоторых вариантах антитело может специфично связываться с имеющей свободный C-конец аминокислотой укороченного на C-конце Aβ-пептида, например Aβ 1-37, 1-38, 1-39, 1-40, 1-41, 1-42, 1-43. В одном варианте антитело или полипептид специфично связывается с эпитопом пептида Aβ1-40. В следующем аспекте настоящего варианта антитело или полипептид специфично связывается с эпитопом пептида Aβ1-42. В еще одном аспекте настоящего варианта антитело или полипептид специфично связывается с эпитопом пептида Aβ1-43 пептид. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 28-40 пептида Aβ1-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 28-42 пептида Aβ1-42. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 28-43 пептида Aβ1-43. В некоторых вариантах антитело или полипептид специфично связывается с Aβ-пептидом, не связываясь с полноразмерным белком предшественника амилоида (APP). В некоторых вариантах антитело или полипептид специфично связывается с агрегированной формой Aβ, не связываясь с растворимой формой. В некоторых вариантах антитело или полипептид специфично связывается с растворимой формой Aβ, не связываясь с агрегированной формой. В некоторых вариантах антитело или полипептид специфично связывается как с агрегированной формой, так и с растворимыми формами Aβ.
В некоторых вариантах антитело или полипептид специфично связывается с C-концевым пептидом 33-40 Aβ1-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в Aβ1-40, который включает в себя аминокислоты 35-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в Aβ1-40, который включает в себя аминокислоты 36-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в Aβ1-40, который включает в себя аминокислоты 39 и/или 40. В некоторых вариантах антитело или полипептид специфично связывается с Aβ1-40, но специфично не связывается с Aβ1-42 и/или Aβ1-43. В некоторых вариантах антитело содержит вариабельную область антитела 9TL или антитела, полученного из 9TL, описанного в настоящей публикации. В некоторых вариантах антитело или полипептид конкурентно ингибирует связывание антитела 9TL, 6G и/или антитела или полипептида, полученного из 9TL или 6G, с соответствующим Aβ-пептидом.
В некоторых вариантах антитело или полипептид связывается с Aβ1-40 с более высокой аффинностью, чем в случае его связывания с Aβ1-42 и Aβ1-43. В следующем аспекте настоящего варианта антитело не является антителом 2294. В некоторых вариантах антитело связывается с эпитопом в Aβ1-40, который включает в себя аминокислоты 25-34 и 40. В некоторых вариантах антитело содержит вариабельную область антитела 6G или антитела, полученного из 6G, описанного в настоящей публикации. В некоторых вариантах антитело или полипептид конкурентно ингибирует связывание антитела 6G и/или антитела или полипептида, полученного из 6G, с Aβ.
В некоторых вариантах антитело или полипептид связывается с Aβ-пептидом с аффинностью связывания (KD) примерно 100 нМ или меньше, или 20 нМ или меньше, или 2 нМ или меньше. В одном аспекте настоящего варианта антитело или полипептид связывается с пептидом Aβ1-40 с KD примерно 100 нМ или меньше, 50 нМ или меньше или 2 нМ или меньше. В следующем аспекте настоящего варианта антитело или полипептид также связывается с пептидом Aβ1-42 с KD, составляющей примерно 100 нМ или меньше, 50 нМ или меньше, или 2 нМ или меньше.
Введение антитела или полипептида, который специфично связывается с пептидом Aβ, может быть осуществлено любыми способами, известными в данной области, включая: внутривенное, подкожное, ингаляционное, внутриартериальное, внутримышечное, внутрисердечное, внутрижелудочковое, парентеральное, интратекальное и внутрибрюшинное введение. Введение может быть осуществлено с помощью инъекции и/или системно, например внутривенно, или локально. В общем, указанное также применимо к полипептидам и полинуклеотидам согласно изобретению.
Изобретение также относится к способам лечения глазной болезни посредством введения фармацевтической композиции, содержащей эффективное количество любого из антител или полипептидов, которые специфично связываются с пептидом Aβ или агрегированной формой пептида Aβ и имеют нарушенную эффекторную функцию, или полинуклеотидов, кодирующих антитела или полипептиды, и фармацевтически приемлемый эксципиент.
Изобретение также относится к наборам и композициям, содержащим любую одну или несколько композиций, содержащих эффективное количество любого из антител или полипептидов, которые специфично связываются с пептидом Aβ или агрегированной формой пептида Aβ, или полинуклеотидов, кодирующих антитела или полипептиды. Указанные наборы, как правило, находящиеся в подходящей упаковке и снабженные соответствующими инструкциями, применимы для любого из способов, описанных в настоящей публикации.
Изобретение также относится к способу получения терапевтического гуманизированного антитела для лечения заболевания, связанного с амилоидными отложениями пептида Aβ в головном мозге человека, включающему в себя отбор первого гуманизированного антитела, которое специфично связывается с пептидом Aβ; и изменение Fc-области антитела, чтобы получить терапевтическое гуманизированное антитело, имеющее нарушенную эффекторную функцию по сравнению с первым гуманизированным антителом.
Другой вариант осуществления настоящего изобретения относится к способу профилактики или восстановления функции сетчатки у субъекта, включающему в себя введение субъекту фармацевтической композиции, содержащей терапевтически эффективное количество ингибитора Aβ. В одном варианте ингибитор представляет собой антитело, антисмысловую молекулу, молекулу миРНК, рибозим или низкомолекулярное соединение.
Другой вариант осуществления настоящего изобретения относится к способу профилактики или восстановления остроты зрения у субъекта, включающему в себя введение терапевтически эффективного количества ингибитора Aβ.
В одном аспекте приведенных выше вариантов указанные выше способы применяют для субъектов, которые не подвергаются также лечению в связи с болезнью Альцгеймера, синдромом Дауна или церебральной амилоидной ангиопатией.
В указанных выше способах согласно изобретению применяют ингибитор Aβ, который представляет собой антитело. В одном аспекте изобретение, раскрытое в настоящем описании, относится к антителам, которые связываются с C-концом пептида Aβ1-40 (SEQ ID NO: 15, показанная в таблице 4). Соответственно в одном аспекте способы включают в себя лечение антителом 9TL (взаимозаменяемо называемым «9TL»), которое продуцируется экспрессирующими векторами, имеющими номера доступа ATCC. PTA-6124 и PTA-6125. Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи 9TL показаны на фигуре 1. Части антитела 9TL в виде определяющих комплементарных областей (CDR) (включая CDR согласно Chothia и Kabat) также показаны на фигуре 1. Понятно, что ссылка на любую часть или полную область 9TL охватывает последовательности, продуцируемые экспрессирующими векторами, имеющими номера доступа ATCC PTA-6124 и PTA-6125, и/или последовательности, изображенные на фигуре 1.
В другом аспекте изобретение включает в себя введение вариантов антитела 9TL с аминокислотными последовательностями, изображенными в таблице 3.
В другом аспекте изобретение включает в себя введение антитела, содержащего фрагмент или область антитела 9TL, или его вариантов, показанных в таблице 3. В одном варианте фрагмент представляет собой легкую цепь антитела 9TL. В другом варианте фрагмент представляет собой тяжелую цепь антитела 9TL. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 9TL. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи, показанных на фигуре 1. В еще одном варианте фрагмент содержит одну или несколько CDR из легкой цепи и/или тяжелой цепи антитела 9TL.
В другом аспекте изобретение включает в себя введение полипептидов (которые могут представлять собой антитело или не являются антителом), содержащих любую одну или несколько из следующих частей: a) одну или несколько CDR антитела 9TL или его вариантов, показанных в таблице 3; b) CDR H3 из тяжелой цепи антитела 9TL или его вариантов, показанных в таблице 3; c) CDR L3 из легкой цепи антитела 9TL или его вариантов, показанных в таблице 3; d) три CDR из легкой цепи антитела 9TL или его вариантов, показанных в таблице 3; e) три CDR из тяжелой цепи антитела 9TL или его вариантов, показанных в таблице 3; f) три CDR из легкой цепи и три CDR из тяжелой цепи антитела 9TL или его вариантов, показанных в таблице 3. Изобретение, кроме того, относится к введению полипептидов (которые могут представлять собой антитело или не являются антителом), содержащих любую одну из несколько из следующих частей: a) одну или несколько (одну, две, три, четыре, пять или шесть) CDR, полученных из антитела 9TL или его вариантов, показанных в таблице 3; b) CDR, полученную из CDR H3 из тяжелой цепи антитела 9TL; и/или c) CDR, полученную из CDR L3 из легкой цепи антитела 9TL. В некоторых вариантах CDR представляет собой CDR, показанную на фигуре 1. В некоторых вариантах одна или несколько CDR, полученных из антитела 9TL или его вариантов, показанных в таблице 3, по меньшей мере примерно на 85%, по меньшей мере примерно на 86%, по меньшей мере примерно на 87%, по меньшей мере примерно на 88%, по меньшей мере примерно на 89%, по меньшей мере примерно на 90%, по меньшей мере примерно на 91%, по меньшей мере примерно на 92%, по меньшей мере примерно на 93%, по меньшей мере примерно на 94%, по меньшей мере примерно на 95%, по меньшей мере примерно на 96%, по меньшей мере примерно на 97%, по меньшей мере примерно на 98% или по меньшей мере примерно на 99% идентичны, по меньшей мере одной, по меньшей мере двум, по меньшей мере трем, по меньшей мере четырем, по меньшей мере пяти или по меньшей мере шести CDR 9TL или его вариантов.
В другом аспекте изобретение включает в себя введение антитела 6G (взаимозаменяемо называемого «6G»). Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи 6G показаны на фигуре 8. Части антитела 6G в виде определяющих комплементарность областей (CDR) (включая CDR Chothia и Kabat) также показаны на фигуре 8.
В другом аспекте изобретение включает в себя введение вариантов антитела 6G с аминокислотными последовательностями, изображенными в таблице 8.
В другом аспекте изобретение включает в себя введение антитела, содержащего фрагмент или область антитела 6G или его вариантов, показанных в таблице 8. В одном варианте фрагмент представляет собой легкую цепь антитела 6G. В другом варианте фрагмент представляет собой тяжелую цепь антитела 6G. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 6G. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи, показанных на фигуре 8. В еще одном варианте фрагмент содержит одну или несколько CDR из легкой цепи и/или тяжелой цепи антитела 6G.
В другом аспекте изобретение включает в себя введение полипептидов (которые могут представлять собой антитело или не являются антителом), содержащих любую одну или несколько из следующих частей: a) одну или несколько CDR антитела 6G или его вариантов, показанных в таблице 8; b) CDR H3 из тяжелой цепи антитела 6G или его вариантов, показанных в таблице 8; c) CDR L3 из легкой цепи антитела 6G или его вариантов, показанных в таблице 8; d) три CDR из легкой цепи антитела 6G или его вариантов, показанных в таблице 8; e) три CDR из тяжелой цепи антитела 6G или его вариантов, показанных в таблице 8; f) три CDR из легкой цепи и три CDR из тяжелой цепи антитела 6G или его вариантов, показанных в таблице 8. Изобретение, кроме того, включает в себя введение полипептидов (которые могут представлять собой антитело или не являются антителом), содержащих любую одну или несколько из следующих частей: a) одну или несколько (одну, две, три, четыре, пять или шесть) CDR, полученных из антитела 6G или его вариантов, показанных в таблице 8; b) CDR, полученную из CDR H3 из тяжелой цепи антитела 6G; и/или c) CDR, полученную из CDR L3 из легкой цепи антитела 6G. В некоторых вариантах CDR представляет собой CDR, показанную на фигуре 8. В некоторых вариантах одна или несколько CDR, полученных из антитела 6G или его вариантов, показанных в таблице 8, по меньшей мере, примерно на 85%, по меньшей мере, примерно на 86%, по меньшей мере, примерно на 87%, по меньшей мере, примерно на 88%, по меньшей мере, примерно на 89%, по меньшей мере, примерно на 90%, по меньшей мере, примерно на 91%, по меньшей мере, примерно на 92%, по меньшей мере, примерно на 93%, по меньшей мере, примерно на 94%, по меньшей мере, примерно на 95%, по меньшей мере, примерно на 96%, по меньшей мере, примерно на 97%, по меньшей мере, примерно на 98% или, по меньшей мере, примерно на 99% идентичны, по меньшей мере одной, по меньшей мере двум, по меньшей мере трем, по меньшей мере четырем, по меньшей мере пяти или по меньшей мере шести CDR 6G или его вариантов.
В следующем аспекте изобретение включает в себя введение антитела, содержащего вариабельную область тяжелой цепи, содержащую три CDR из вариабельной области тяжелой цепи антитела 6G, показанной в последовательности SEQ ID NO: 26, и вариабельную области легкой цепи, содержащую три CDR из вариабельной области легкой цепи антитела 6G, показанной в последовательности SEQ ID NO: 27. В другом аспекте изобретение включает в себя введение антитела, содержащего вариабельную область тяжелой цепи, содержащую три CDR, показанных в последовательностях SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30, и вариабельную область легкой цепи, содержащую три CDR, показанных в последовательностях SEQ ID NO: 31, SEQ ID NO: 32 и SEQ ID NO: 33. В еще одном аспекте изобретение относится к вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, показанную в SEQ ID NO: 26, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, показанную в SEQ ID NO: 27. В еще одном аспекте изобретение относится к аминокислотной последовательности тяжелой цепи, показанной в SEQ ID NO: 36, и аминокислотной последовательности легкой цепи, показанной в SEQ ID NO: 37.
В некоторых вариантах CDR представляют собой CDR согласно Kabat. В других вариантах CDR представляют собой CDR согласно Chothia. В других вариантах CDR представляют собой сочетание CDR согласно Kabat и Chothia (также называемые «комбинированными CDR» или «расширенными CDR»). Другими словами, в случае любого данного варианта, содержащего более одной CDR, CDR могут быть CDR согласно Kabat, согласно Chothia и/или являются их сочетанием.
В некоторых вариантах полипептид (такой как антитело) содержит аминокислотную последовательность, показанную в SEQ ID NO: 5, где L1 означает L, V или I; где Y2 означает Y или W; где S3 означает S, T или G; где L4 означает L, R, A, V, S, T, Q или E; где V6 означает V, I, T, P, C, Q, S, N или F и где Y7 означает Y, H, F, W, S, I, V или A. В некоторых вариантах аминокислотная последовательность представляет собой CDR3 в вариабельной области тяжелой цепи. Для удобства в настоящем описании «означает» в контексте или по отношению к аминокислоте относится к выбору аминокислоты (аминокислот) для данного положения, имея в виду положение в последовательности. Например, «L1 означает L, V или I» относится к аминокислоте L в положении 1 в последовательности SEQ ID NO: 5, которая может быть заменена V или I.
В некоторых вариантах полипептид (такой, как антитело) содержит аминокислотную последовательность, показанную в SEQ ID NO: 6, где Y8 означает Y, A или H; где A11 означает A или S и где K12 означает K или A. В некоторых вариантах аминокислотная последовательность представляет собой CDR1 в вариабельной области легкой цепи.
В некоторых вариантах полипептид (такой, как антитело) содержит аминокислотную последовательность, показанную в SEQ ID NO: 8, где L1 означает L, M, N, C, F, V, K, S, Q, G, S; где G3 означает G, S или T; где T4 означает T или S; где H5 означает H или L; где Y6 означает Y, P, A, W, Q, M, S или E; где V8 означает V, L, K, H, T, A, E или M и где L9 означает L, I, T, S или V. В некоторых вариантах аминокислотная последовательность представляет собой CDR3 в вариабельной области легкой цепи.
В некоторых вариантах полипептид (такой, как антитело) содержит вариабельную область тяжелой цепи, содержащую (a) область CDR1, показанную в SEQ ID NO: 3; (b) область CDR2, показанную в SEQ ID NO: 4; и (c) область CDR3, показанную в SEQ ID NO: 5, где L1 означает L, V или I; где Y2 означает Y или W; где S3 означает S, T или G; где L4 означает L, R, A, V, S, T, Q или E; где V6 означает V, I, T, P, C, Q, S, N или F и где Y7 означает Y, H, F, W, S, I, V или A.
В некоторых вариантах полипептид (такой, как антитело) содержит вариабельную область легкой цепи, содержащую (a) область CDR1, показанную в SEQ ID NO: 6, где Y8 означает Y, A или H; где A11 означает A или S; где K12 означает K или A; (b) область CDR2, показанную в SEQ ID NO: 7; и (c) область CDR3, показанную в SEQ ID NO: 8, где L1 означает L, M, N, C, F, V, K, S, Q, G, S; где G3 означает G, S или T; где T4 означает T или S; где H5 означает H или L; где Y6 означает Y, P, A, W, Q, M, S или E; где V8 означает V, L, K, H, T, A, E или M и где L9 означает L, I, T, S или V.
В некоторых вариантах антитело согласно изобретению является человеческим антителом. В других вариантах антитело согласно изобретению является гуманизированным антителом. В некоторых вариантах антитело является моноклональным. В некоторых вариантах антитело (или полипептид) является изолированным. В некоторых вариантах антитело (или полипептид) является по существу очищенным.
Константная область тяжелой цепи антител может быть константной областью из любого типа, такого как IgG, IgM, IgD, IgA и IgE; и любого изотипа, такого как IgG1, IgG2, IgG3 и IgG4.
В некоторых вариантах антитело содержит модифицированную константную область, такую как константная область, которая иммунологически инертна (включая частично иммунологически инертную, и термин используют взаимозаменяемо с термином «имеющая нарушенную эффекторную функцию»), например не запускает опосредованный комплементом лизис, не стимулирует зависимую от антител опосредованную клетками цитотоксичность (ADCC) или не активирует микроглию. В некоторых вариантах константную область модифицируют, как описано в Eur. J. Immunol. (1999) 29: 2613-2624; заявке PCT № PCT/GB99/01441 и/или заявке на выдачу патента Великобритании № 9809951.8. В других вариантах антитело содержит константную область тяжелой цепи IgG2a человека, содержащую следующие мутации: A330P331 → S330S331 (нумерация аминокислот в соответствии с последовательностью IgG2 дикого типа). Eur. J. Immunol. (1999) 29: 2613-2624. В некоторых вариантах антитело содержит константную область IgG4, содержащую следующие мутации: E233F234L235 → P233V234A235. Что касается N-связанного гликозилирования, то в следующих вариантах константная область не гликозилирована. В некоторых вариантах константная область не гликозилирована в результате N-связанного гликозилирования благодаря мутации остатка, с которым связывается олигосахарид (такого как Asn297), и/или фланкирующих остатков, которые являются частью последовательности узнавания при N-гликозилировании в константной области. В некоторых вариантах константная область не гликозилирована в результате N-связанного гликозилирования. Константная область может не иметь N-связанного гликозилирования либо под действием ферментов, либо в результате экспрессии в клетке-хозяине, дефицитной по гликозилированию.
В другом аспекте изобретение относится к полинуклеотиду (который может быть изолированным), содержащему полинуклеотид, кодирующий фрагмент или область антитела 9TL или 6G или их вариантов, показанных в таблице 3 и таблице 8. В одном варианте фрагмент представляет собой легкую цепь антитела 9TL или 6G. В другом варианте фрагмент представляет собой тяжелую цепь антитела 9TL или 6G. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 9TL или 6G. В еще одном варианте фрагмент содержит одну или несколько (т.н. одну, две, три, четыре, пять, шесть) определяющих комплементарность областей (CDR) из легкой цепи и/или тяжелой цепи антитела 9TL или 6G.
КРАТКОЕ ОПИСАНИЕ НЕКОТОРЫХ ИЗОБРАЖЕНИЙ НА ФИГУРАХ
На фигуре 1 показана аминокислотная последовательность вариабельной области тяжелой цепи (SEQ ID NO: 1) и вариабельной области легкой цепи (SEQ ID NO: 2) антитела 9TL. CDR согласно определению Kabat показаны жирным шрифтом, а CDR согласно определению Chothia подчеркнуты. Аминокислотные остатки вариабельной области тяжелой цепи и легкой цепи пронумерованы последовательно.
На фигуре 2 показано картирование эпитопов антитела 9TL способом, основанным на конкуренции пептидов. Пептид Aβ1-40 иммобилизовали на чипе SA. Моноклональное антитело 2289 и Fab-фрагмент 9TL (50 нМ каждого), каждое из которых предварительно инкубировали в течение 1 часа с 10 мкМ различных пептидов (аминокислоты 28-40, 1-40, 1-28, 28-42, 22-35, 1-16, 1-43, 33-40, 1-38 или 17-40 Aβ) или без пептида, затем подавали на чип. Измеряли связывание Fab-фрагмента антитела с иммобилизованным пептидом Aβ1-40.
Фигура 3 представляет собой график, на котором показано картирование эпитопов антитела 2H6 способом, основанным на конкуренции пептидов. Пептид Aβ1-40 иммобилизовали на чипе SA. Моноклональное антитело 2289, 2286 или 2H6 (100 нМ каждого), каждое из которых предварительно инкубировали в течение 1 часа с 16 мкм разных пептидов (аминокислоты 1-16, 1-28, 1-38, 1-40, 1-42, 1-43, 17-40, 17-42, 22-35, 25-35 или 33-40 Aβ) или без пептида, подавали на чип. Измеряли связывание антитела с иммобилизованным пептидом Aβ1-40.
Фигура 4 представляет собой график, на котором показано связывание антитела 2H6, 2286, и 2289 с разными C-концевыми вариантами пептида Aβ. Варианты GST-Aβ (M35A, V36A, G37A, G38A, V39A, или V40A) или пептид GST-Aβ 1-39, 1-41, 1-40, 1-42 иммобилизовали на планшете для ELISA. Моноклональное антитело 2286, 2H6, или 2289 (0,3 нМ каждого mAb) инкубировали с каждым из иммобилизованных пептидов и их связывание регистрировали при последующей инкубации с биотинилированным антителом против IgG мыши (H+L) и затем со стрептавидином-HRP.
На фигуре 5 показан график интенсивности a- и b-волн (A) и электроретинограммы образца (B), полученного от стареющих мышей с изоформой аполипопротеина E4 (APOE4) на нормальной диете по сравнению с диетой с высоким содержанием жира и холестерина.
На фигуре 6 показан график интенсивности только b-волн у мышей APOE4, отложенный против данных из предыдущих исследований животных, находящихся на нормальной диете. Кривая R2 показывает защиту или восстановление функции сетчатки в случае обработки ВМД-подобных мышей (E4-HFC-R2) анти-Aβ-антителом.
На фигуре 7 показана общая иммуногистохимия Aβ в головном мозге ВМД-подобной (APOE4) мыши. На предметном стекле A (ВМД-подобная мышь, обработанная анти-Aβ-антителом) показан негативный результат определения амилоида. На предметных стеклах B, C и D (ВМД-подобная мышь, обработанная с использованием инъекции наполнителя) показан позитивный результат определения амилоида. Предметное стекло E для позитивного контрольного образца, взятого из головного мозга мыши в случае мышиной модели с полученным из тромбоцитов APP (pdAPP, мутантный (V717F) APP человека под контролем промотора тромбоцитарного фактора роста (Games, D. et al, Nature 373: 523-527 (1995)).
На фигуре 8 показана аминокислотная последовательность вариабельной области тяжелой цепи (SEQ ID NO: 1) и вариабельной области легкой цепи (SEQ ID NO: 27) антитела 6G. CDR согласно определению Kabat показаны жирным шрифтом, а CDR согласно определению Chothia подчеркнуты. Аминокислотные остатки вариабельной области тяжелой цепи и легкой цепи пронумерованы последовательно.
На фигуре 9 показано картирование эпитопов антитела 6G, осуществляемое с помощью ELISA. Пептиды Aβ (1-16, 1-28, 17-40, 17-42, 22-35, 28-40, 28-42, 1-38, 1-40, 1-42, 1-43 и 33-40) иммобилизовали на чашках для ELISA. Моноклональное антитело 6G (20 нМ) инкубировали в течение 1 часа с разными иммобилизованными пептидами. Антитело 6G, связанное с иммобилизованными пептидами Aβ, измеряли, используя второе антитело козы против цепи каппа человека, конъюгированное с HRP.
На фигуре 10 показано картирование эпитопов антитела 6G с помощью ELISA. Различные пептиды Aβ иммобилизовали на чашках для ELISA. Антитело 6G инкубировали в течение 1 часа с различными иммобилизованными пептидами. Антитело 6G, связанное с иммобилизованными пептидами Aβ, измеряли, используя второе антитело козы против цепи каппа человека, конъюгированное с HRP. «NB» означает, что связывание не выявлено.
Фигура 11 представляет собой схематичный график, показывающий эпитоп, с которым антитело 6G связывается на Aβ. Показаны относительные положения Aβ в белке-предшественнике амилоида (APP) и часть APP в клеточной мембране. «CT99» относится к C-концевым 99 аминокислотам APP.
На фигуре 12 представлена фотография, показывающая иммунное окрашивание клеток, экспрессирующих APP, моноклональным антителом, направленным к Aβ1-16 (m2324), и антителом 6G. На верхних панелях показаны клетки, видимые в флуоресцентном микроскопе, после инкубации клеток с m2324 или 6G (5 мкг/мл каждого), и связывание выявляли с помощью второго конъюгированного с Cy3 антитела козы против Ig мыши или Ig человека. На нижних панелях показаны клетки, наблюдаемые под микроскопом.
Фигура 13 представляет собой график интенсивности только b-волн для пяти исследуемых групп мышей APOE4: контрольные мыши APOE4 на обычной диете; контрольные мыши APOE4 на диете с высоким содержанием жира и холестерина («HFC») (ВМД-подобная модель); мыши APOE4-HFC, обработанные 7G10; мыши APOE4-HFC, обработанные 2H6; и мыши APOE4-HFC, обработанные 6G.
Фигура 14 представляет собой график интенсивности только b-волн для трех исследованных групп мышей APOE4: контрольные мыши APOE4 на обычной диете; контрольные мыши APOE4-HFC и мыши APOE4-HFC, обработанные 6G.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Мышиная модель ВМД способствовала проверке гипотезы о том, что без какой-либо связи с теорией нарушение регуляции транспорта липидов и амилоидные отложения могут вносить вклад в патогенез наблюдаемых изменений сетчатки при возрастной макулярной дегенерации, глаукоме, диабетической ретинопатии (включая макулярный отек) и других родственных дегенеративных заболеваниях сетчатки. Отложение Aβ широко исследовано у пациентов с болезнью Альцгеймера, и предыдущие исследования показали потенциальную роль Aβ в возрастной макулярной дегенерации (Yoshida, T., et al., J. of Clin. Invest., 115(10): 2793-2800 (2005); Anderson, D. et al., Experimental Eye Research 78: 243-256 (2004); Johnson, L. et al., PNAS, 99(18): 11820-11835(2002)) и глаукоме (McKinnon SJ, Front Biosci 8: 1140-56 (2003); Tatton et al., Surv Ophthalmol. 48: S25-37 (2003)). Однако до настоящего времени не обсуждался вопрос о том, может ли ингибитор Aβ обеспечить терапевтическую пользу при лечении макулярной дегенерации посредством осуществления защиты и/или восстановления сетчатки. Кроме того, не обсуждался вопрос о том, могут ли какие-либо изоформы Aβ дифференциально вносить вклад в патогенез ВМД.
Как обсуждалось выше, Aβ является основной составной частью нейритных бляшек, обнаруженных при болезни Альцгеймера. Aβ является продуктом расщепления белка-предшественника бета-амилоида (βAPP или APP). APP представляет собой трансмембранный гликопротеид типа I, который содержит большой эктопический N-концевой домен, трансмембранный домен и небольшой цитоплазматический C-концевой хвост. Альтернативный сплайсинг транскрипта одного гена APP в хромосоме 21 приводит к образованию нескольких изоформ, которые отличаются по количеству аминокислот. В предыдущих исследованиях болезни Альцгеймера установлено, что изоформа Aβ1-42 необходима для отложения амилоида и что Aβ1-42 в противоположность Aβ1-40 может быть исходной молекулой, которая вносит клад в патогенез болезни Альцгеймера (McGowan, E. et al, Neuron 47: 191-199 (2005). Кроме того, дополнительные исследования болезни Альцгеймера свидетельствуют о том, что изоформа Aβ1-40 может действительно ингибировать отложение амилоида и что ингибитор Aβ1-40 может ухудшать течение болезни Альцгеймера (Kim, J. et al., Neurobiology of Disease, 27(3): 627-633 (2007).
Изобретение, раскрытое в настоящем описании, относится к способам профилактики и/или лечения глазных болезней, таких как возрастная макулярная дегенерация (как влажная, так и сухая), глаукома, диабетическая ретинопатия (включая диабетический отек желтого пятна), разрывы в оболочке Бруха, миопическая дегенерация, глазные опухоли и другие родственные дегенеративные заболевания сетчатки у человека посредством введения терапевтически эффективного количества антитела 9TL или 6G или антитела или полученного из них полипептида. Антитело 9TL и его производные описаны в WO 2006036291, содержание которой включено в настоящее описание в виде ссылки в полном объеме. Антитела и полипептиды, используемые в заявленных способах, связываются с C-концом Aβ1-40. Антитело 6G и его производные описаны в публикациях WO 2006036291 и WO 2006118959, содержание которых включено в настоящее описание в виде ссылки в полном объеме. Подразумевается, что способы согласно изобретению включают в себя использование всех ингибиторов Aβ, включая без ограничения низкомолекулярные соединения и биологические соединения, такие как антитела, антисмысловые молекулы, молекулы миРНК и рибозимы.
Общие способы
При практическом осуществлении настоящего изобретения, если не оговорено особо, будут использованы обычные способы молекулярной биологии (включая способы, основанные на рекомбинации), микробиологии, клеточной биологии, биохимии и иммунологии, которые известны в данной области. Такие способы полно описаны в литературе, например в Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J. E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J. P. Mather and P. E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J. B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D. M. Weir and CC. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J. M. Miller and M. P. Calos, eds., 1987); Current Protocols in Molecular Biology (F. M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J. E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (CA. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995).
Определения
«Ингибитор пептида Aβ» представляет собой средство, способное снижать продукцию и/или отложение Aβ. Ингибитор пептида Aβ включает без ограничения антитело, антисмысловую молекулу, молекулу миРНК, рибозим или низкомолекулярное соединение. Кроме того, ингибитором пептида Aβ является любое средство, способное связывать пептид Aβ и уменьшать отложение Aβ-бляшек, включая любые средства, способные нарушать протеолитическое расщепление белка-предшественника амилоида на продукты, представляющие собой пептиды Aβ. Дополнительными мишенями для ингибирования продукции и отложения пептида Aβ являются без исключения, например, низкомолекулярные терапевтические средства или миРНК, способные ингибировать или приводить к молчанию гена β-секретазы (также называемой BACE1 или мемапсином-2) или комплекса гамма-секретазы (которая состоит минимум из четырех отдельных белков: пресенилина, никастрина, APH-1 (anterior pharynx-defective 1) и энхансера пресенилина 2 (PEN-2).
«Антитело» означает молекулу иммуноглобулина, способную специфично связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., посредством, по меньшей мере, одного сайта узнавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. В используемом в настоящем описании смысле термин охватывает не только интактные поликлональные или моноклональное антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные (ScFv), их мутанты, слитые белки, содержащие часть антитела, и любую другую модифицированную форму молекулы иммуноглобулина, которая содержит сайт узнавания антигена. Антитело включает антитело любого класса, такого как IgG, IgA или IgM (или их подклассов), и антитело не обязательно должно относится к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константного домена тяжелых цепей антител иммуноглобулины можно отнести к разным классам. Существуют пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называют альфа, дельта, эпсилон, гамма и мю соответственно. Субъединичные структуры и трехмерные структуры иммуноглобулинов разных классов хорошо известны.
В используемом в настоящем описании смысле термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение «моноклональное» указывает на характер антитела, как полученного из по существу гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применяемые согласно настоящему изобретению, могут быть получены способом на основе гибридом, впервые описанным Kohler et al., 1975, Nature 256: 495, или могут быть получены способами на основе рекомбинантной ДНК, такими как способ, описанный в патенте США № 4816567. Моноклональные антитела также могут быть выделены из фаговых библиотек, созданных с использованием способов, описанных, например, McCafferty et al., 1990, Nature 348: 552-554.
В используемом в настоящем описании смысле «гуманизированные» антитела относятся к формам антител животных, отличных от человека (например, мышей), которые представляют собой специфичные химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие, как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, полученную из иммуноглобулина животного, отличного от человека. Главным образом, гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены остатками из CDR вида, отличного от человека (донорное антитело), такого как мышь, крыса или кролик, обладающей требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области Fv (FR) иммуноглобулина человека заменяют соответствующими остатками животного, отличного от человека. Кроме того, гуманизированное антитело может содержать остатки, которые не встречаются ни в реципиентном антителе, ни в импортируемых последовательностях CDR или каркасных последовательностях, но введены для того, чтобы дополнительно улучшить или оптимизировать эффективность антитела. В общем, гуманизированное антитело будет содержать по существу целиком, по меньшей мере, один и обычно два вариабельных домена, в которых все или в основном все области CDR соответствуют областям CDR иммуноглобулина животного, отличного от человека, и все или по существу все области FR являются областями FR из консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области или домена (Fc) иммуноглобулина, обычно константной области иммуноглобулина человека. Антитела могут иметь Fc-области, модифицированные, как описано в WO 99/58572. Другие формы гуманизированных антител имеют одну или несколько CDR (одну, две, три, четыре, пять, шесть), которые изменены по сравнению с исходным антителом, которые также называют одной или несколькими CDR, «полученными из» одной или нескольких CDR исходного антитела.
В используемом в настоящем описании смысле термин «человеческое антитело» означает антитело, которое имеет аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, которое продуцируется в организме человека и/или которое получено с использованием любого способа получения человеческих антител, который известен в данной области или описан в данной публикации. Такое определение человеческого антитела включает в себя антитела, содержащие, по меньше мере, один полипептид тяжелой цепи человека или, по меньшей мере, один полипептид легкой цепи человека. Одним из таких примеров является антитело, содержащее полипептиды легкой цепи мыши и тяжелой цепи человека. Человеческие антитела могут быть получены с использованием различных способов, известных в данной области. В одном варианте человеческое антитело выбрано из фаговой библиотеки, при этом такая фаговая библиотека экспрессирует человеческие антитела (Vaughan et al. 1996, Nature Biotechnology 14: 309-314; Sheets et al., 1998, PNAS (USA) 95: 6157-6162; Hoogenboom and Winter, 1991, J. Mol. Biol., 227: 381; Marks et al., 1991, J. Mol. Biol., 222: 581). Человеческие антитела также могут быть получены введением локусов иммуноглобулинов человека в трансгенных животных, например мышей, у которых эндогенные гены иммуноглобулинов были частично или полностью инактивированы. Такой способ описан, например, в патентах США № 5545807, 5545806, 5569825, 5625126, 5633425 и 5661016. Альтернативно человеческое антитело может быть получено посредством иммортализации B-лимфоцитов человека, продуцирующих антитело, направленное против антигена-мишени (такие B-лимфоциты могут быть извлечены из организма человека или могут быть иммунизированы in vitro). Смотри, например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., 1991, J. Immunol., 147 (1): 86-95; и патент США № 5750373.
В используемом в настоящем описании смысле термины «9TL» и «антитело 9TL» используют взаимозаменяемо по отношению к антителу, продуцируемому экспрессирующими векторами, имеющими номера депозитов ATCC PTA-6124 и ATCC PTA-6125. Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи показаны на фигуре 1. CDR-части антитела 9TL (включая CDR согласно Chothia и Kabat) в виде диаграммы изображены на фигуре 1. Полинуклеотиды, кодирующие вариабельные области тяжелой и легкой цепи, показаны в SEQ ID NO: 9 и SEQ ID NO: 10. Характеристика 9TL приведена в примерах.
В используемом в настоящем описании смысле термины «6G» и «антитело 6G» используют взаимозаменяемо по отношению к антителу, имеющему аминокислотную последовательность тяжелой цепи, показанную в SEQ ID NO: 36, и аминокислотную последовательность легкой цепи, показанную в SEQ ID NO: 37. Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи показаны на фигуре 8. CDR-части антитела 6G (включая CDR Chothia и Kabat) в виде диаграммы изображены на фигуре 8. Полинуклеотиды, кодирующие тяжелую и легкую цепь, показаны в SEQ ID NO: 38 и SEQ ID NO: 39. Характеристика 6G приведена в примерах.
Термины «полипептид», «олигопептид», «пептид» и «белок» используют в настоящем описании взаимозаменяемо по отношению к полимерам аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты и он может прерываться структурами, отличными от аминокислот. Термины также охватывают полимер аминокислот, который был модифицирован естественным образом или в результате вмешательства, например в результате образования дисульфидной связи, гликозилирования, липидизации, ацетилирования, фосфорилирования или любой другой обработки или модификации, такой как конъюгирование с метящим компонентом. Также в определение включены, например, полипептиды, содержащие один или несколько аналогов аминокислот (включая, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области. Следует понимать, что поскольку полипептиды согласно изобретению основаны на антителе, полипептиды могут встречаться в виде отдельных цепей или в виде ассоциированных цепей.
Термины «полинуклеотид» или «нуклеиновая кислота», которые используются в настоящем описании взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть введен в полимер ДНК- или РНК-полимеразой. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. При наличии модификация в структуре нуклеотида может быть введена до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, посредством конъюгирования с метящим компонентом. Другие типы модификаций включают, например, «кэпы», замены одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и заряженными связями (например, фосфоротиоаты, фосфородитиоаты, и т.д.), модификации, содержащие боковые остатки, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, ply-L-лизин и т.д.), модификации интеркаляторами (например, акридин, псорален и т.д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, содержащие алкиляторы, полинуклеотиды с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть замещена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами или может быть конъюгирована с твердыми подложками. 5'- и 3'-концевая OH может быть фосфорилирована или замещена аминами или органическими кэпирующими группами из 1-20 атомов углерода. Другие гидроксилы также могут быть дериватизованы стандартными защитными группами. Полинуклеотиды также могут содержать аналогичные формы сахаров рибозы и дезоксирибозы, которые обычно известны в данной области, включая, например, 2'--O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и лишенные основания аналогии нуклеозидов, такие как метилрибозид. Одна или несколько фосфодиэфирных связей могут быть заменены альтернативными связывающими группами. Такие альтернативные связывающие группы включают без ограничения варианты, в которых фосфат заменен P(O)S («тиоатом»), P(S)S («дитиоатом»), (O)NR2 («амидатом»), P(O)R, P(O)OR', CO или CH2 («формацеталем»), где каждый R или R' независимо означает H или замещенный или незамещенный алкил (1-20 C), необязательно содержащий эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание применимо ко всем указанным полинуклеотидам, включая РНК и ДНК.
«Вариабельная область» антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела либо по отдельности, либо в сочетании. Каждая из вариабельных областей тяжелой и легкой цепи состоит из четырех каркасных областей (FR), связанных тремя определяющими комплементарность областями (CDR), также известными как гипервариабельные области. CDR в каждой цепи удерживаются вместе в тесной близости посредством FR и вместе с CDR из другой цепи вносят вклад в образование антигенсвязывающего участка антител. Существует, по меньшей мере, две методики определения CDR: (1) способ, основанный на вариабельности последовательностей разных видов (например, Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda MD)); и (2) способ, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al. (1997) J. Molec. Biol. 273: 927-948)). В используемом в настоящем описании смысле CDR может относиться к CDR, определяемым любым способом или комбинацией обоих способов.
«Константная область» антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела либо по отдельности, либо в сочетании.
Эпитоп, который «предпочтительно связывается» или «специфично связывается» (термины, используемые в настоящем описании взаимозаменяемо) с антителом или полипептидом, является термином, хорошо известным в данной области, и способы определения такого специфичного или предпочтительного связывания также хорошо известны в данной области. Говорят, что молекула проявляет «специфичное связывание» или «предпочтительное связывание», если она взаимодействует или связывается более часто, быстрее, с большей продолжительностью и/или большей аффинностью с конкретной клеткой или веществом, чем с альтернативными клетками или веществами. Антитело «специфично связывается» или «предпочтительно связывается» с мишенью, если оно связывается с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими веществами. Например, антитело, которое специфично или предпочтительно связывается с эпитопом Aβ1-40, представляет собой антитело, которое связывает такой эпитоп с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими эпитопами Aβ1-40 или эпитопами, отличными от Aβ1-40. Также при чтении указанного определения понятно, что, например, антитело (или остаток, или эпитоп), которое специфично или предпочтительно связывается с первой мишенью, может или не может специфично или предпочтительно связываться со второй мишенью. Как таковое «специфичное связывание» или «предпочтительное связывание» не обязательно требует (хотя и может включать в себя) исключительное связывание. В общем, но не обязательно, указание наличия связывания означает предпочтительное связывание.
В используемом в настоящем описании смысле «по существу чистое» относится к веществу, которое, по меньшей мере, на 50% очищено (т.е. не содержит примесей), более предпочтительно, по меньшей мере, на 90% очищено, более предпочтительно, по меньшей мере, на 95% очищено, более предпочтительно, по меньшей мере, на 98% очищено, более предпочтительно, по меньшей мере, на 99% очищено.
«Клетка-хозяин» относится к отдельной клетке или культуре клеток, которые могут быть или стали реципиентами для вектора (векторов) для введения полинуклеотидных вставок. Клетки-хозяева включают потомство отдельной клетки-хозяина, и потомство не обязательно может быть полностью идентичным (по морфологии или комплементарности геномной ДНК) исходной родительской клетке вследствие природной, случайной или преднамеренной мутации. Термин «клетка-хозяин» включает клетки, трансфицированные in vivo полинуклеотидом(ами) согласно настоящему изобретению.
Термин «Fc-область» используют для определения C-концевой области тяжелой цепи иммуноглобулина. Fc-область может представлять собой Fc-область с нативной последовательностью или вариант Fc-области. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьировать, Fc-область тяжелой цепи IgG человека обычно определяют в промежутке от аминокислотного остатка в положении Cys226 или от положения Pro230 до карбоксильного конца Fc-области. Нумерация остатков в Fc-области соответствует индексированию EU, описанному Kabat. Kabat et al., Sequences of Proteins of Imunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991. Fc-область иммуноглобулина обычно содержит два константных домена, домен CH2 и домен CH3.
В используемом в настоящем описании смысле термины «Fc-рецептор» и «FcR» описывают рецептор, который связывается с Fc-областью антитела. Предпочтительным FcR является FcR человека с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывает IgG-антитело (гамма-рецептор), и к предпочтительным рецепторам относятся рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсируемые формы указанных рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, которые отличаются главным образом своими цитоплазматическими доменами. Обзор, посвященный FcR, представлен в Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126: 330-41 (1995). Термин «FcR» также включает неонатальный рецептор FcRn, который отвечает за перенос материнских IgG в плод (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)).
«Комплемент-зависимая цитотоксичность» и «CDC» относятся к лизису мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом) в комплексе со своим антигеном. Чтобы оценить активацию комплемента можно осуществить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
«Функциональная Fc-область» обладает по меньшей мере одной эффекторной функцией Fc-области с нативной последовательностью. Примеры «эффекторных функций» включают связывание C1q; комплемент-зависимую цитотоксичность (CDC); связывание рецептора Fc; зависимую от антител опосредованную клетками цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, B-клеточного рецептора, BCR) и т.д. Такие эффекторные функции обычно требуют комбинирования Fc-области со связывающим доменом (например, вариабельным доменом антитела) и могут быть оценены с использованием различных анализов, известных в данной области для оценки таких эффекторных функций антитела.
«Fc-область с нативной последовательностью» содержит аминокислотную последовательность, идентичную аминокислотной последовательности Fc-области, встречающейся в природе. «Вариант Fc-области» содержит аминокислотную последовательность, которая отличается от аминокислотной последовательности Fc-области с нативной последовательностью вследствие, по меньшей мере, одной аминокислотной модификации, все еще сохраняя при этом, по меньшей мере, одну эффекторную функцию Fc-области с нативной последовательностью. Предпочтительно вариант Fc-области имеет, по меньшей мере, одну аминокислотную замену по сравнению с Fc-областью с нативной последовательностью или с Fc-областью исходного полипептида, например, примерно от одной до примерно десяти аминокислотных замен и предпочтительно примерно от одной до примерно пяти аминокислотных замен в Fc-области с нативной последовательностью или в Fc-области исходного полипептида. Вариант Fc-области согласно настоящему изобретению предпочтительно будет обладать, например, по меньшей мере, примерно 80% идентичностью последовательностей с Fc-областью с нативной последовательностью и/или Fc-областью исходного полипептида и наиболее предпочтительно, по меньшей мере, примерно 90% идентичностью последовательностей, более предпочтительно, по меньшей мере, примерно 95%, по меньшей мере примерно 96%, по меньшей мере, примерно 97%, по меньшей мере, примерно 98%, по меньшей мере, примерно 99% идентичностью последовательностей с ними.
В используемом в настоящем описании смысле «зависимая от антител опосредованная клетками цитотоксичность» и «ADCC» относятся к опосредованному клетками ответу, при котором неспецифичные цитотоксические клетки, которые экспрессируют рецепторы Fc (FcR) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги), узнают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. Активность в ADCC представляющей интерес молекулы можно оценить, используя анализы ADCC in vitro, такие как анализы, описанные в патентах США № 5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и клетки NK. Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы можно оценить in vivo, например, в животной модели, такой как модель, описанная в Clynes et al. PNAS (USA) 95: 652-656 (1998).
В используемом в настоящем описании смысле «эффективная доза» или «эффективное количество» лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для получения полезных или требуемых результатов. В случае профилактического применения полезные или требуемые результаты включают такие результаты, как исключение или уменьшение риска, уменьшение тяжести или замедление появления заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, проявляющиеся в ходе развития заболевания. В случае терапевтического применения полезные или требуемые результаты включают без ограничения клинические результаты, такие как защита или восстановление функции сетчатки или сохранение или восстановление остроты зрения. Эффективная доза может быть введена за одно или несколько введений. В целях настоящего изобретения эффективная доза лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для осуществления профилактического или терапевтического лечения либо прямо, либо опосредованно. Как понятно с клинической точки зрения, эффективная доза лекарственного средства, соединения или фармацевтической композиции может быть достигнута или не достигнута вместе с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом «эффективная доза» может рассматриваться в контексте введения одного или нескольких терапевтических средств, и можно считать, что одно средство введено в эффективном количестве, если вместе с одним или несколькими другими средствами может быть достигнут или достигается требуемый результат.
В используемом в настоящем описании смысле «терапия» или «лечение» означает способ получения полезных или требуемых результатов, включая клинические результаты. В целях настоящего изобретения полезные или требуемые клинические результаты включают без ограничения восстановление, предотвращение или защиту функции сетчатки.
«Биологический эффект пептида Aβ» или «биологическая активность Aβ» означают эффект Aβ в случае глазных болезней, который может быть прямым или опосредованным и включает, если не вдаваться в теорию, участие Aβ в нарушении регуляции транспорта липидов. Опосредованный эффект включает без ограничения влияние Aβ на функцию сетчатки и остроту зрения.
В используемом в настоящем описании смысле «задерживание» развития глазных болезней означает задержку, торможение, замедление, сдерживание, стабилизацию и/или отсрочивание развития заболевания. Такая задержка может быть разной по длительности в зависимости от истории болезни и/или субъекта, подвергаемого лечению. Как понятно специалисту в данной области, достаточная или существенная задержка в действительности может включать в себя предотвращение развития, в случае которого у человека не развивается заболевание. Способ, который «задерживает» развитие глазной болезни, представляет собой способ, который снижает вероятность развития болезни в заданных временных рамках и/или снижает степень заболевания в заданных временных рамках, по сравнению с развитием заболевания в том случае, когда способ не применяют. Такие сравнения обычно основаны на клинических исследованиях, в которых используют статистически значимое количество субъектов.
«Развитие» глазных болезней означает появление и/или прогрессирование глазной болезни у индивидуума. Развитие глазной болезни можно регистрировать, используя стандартные клинические способы, которые описаны в настоящей публикации. Однако развитие также относится к прогрессированию болезни, которая исходно может выявляться. В целях настоящего изобретения прогрессирование относится к биологическому течению патологического состояния, которое в данном случае определяют при стандартном офтальмологическом обследовании или более специализированным тестированием. Различные диагностические тесты включают без ограничения тестирование поля зрения, остроты зрения, ангиографию с использованием флуоресцеина, электроретинограммы, оптическую когерентную томографию (OCT), определение вызванных зрительных потенциалов (VEP), использование индоцианина зеленого, определение цветового зрения, использование сетки Амслера, определение внутриглазного давления и другие диагностические средства, известные специалисту в данной области. Диагностические тесты в отношении ВМД наряду с другими тестами включают без ограничения определение остроты зрения, фундоскопическое исследование, ангиографию с использованием флуоресцеина, использование индоцианина зеленого и оптическую когерентную томографию (OCT). Термин «развитие» включает в себя возникновение, рецидив и начало. В используемом в настоящем описании смысле «начало» или «возникновение» глазной болезни включает начальное появление и/или рецидив.
В используемом в настоящем описании смысле «защита» функции сетчатки относится к стабилизации или сохранению функции сетчатки. В используемом в настоящем описании смысле «восстановление» функции сетчатки относится к восстановлению функции сетчатки после нарушения. Защиту или восстановление функции сетчатки можно определить, измеряя статистически значимые результаты (т.е. p<0,05), которые измеряют любым из указанных выше способов диагностики глазных болезней, таких как определение остроты зрения, электроретинограммы, определение поля зрения, фундоскопическое исследование, ангиографию с использованием флуоресцеина, использование индоцианина зеленого и когерентную томографию глаза (OCT) и другие. Например, как показано в примере 4 ниже, статистически значимое сохранение или восстановление функции сетчатки показано по восстановлению амплитуды b-волн на электроретинограммах (p=0,008).
«Сохранение» или «восстановление» остроты зрения можно измерить с помощью стандартных таблиц для определения зрения, а также различных офтальмологических диагностических средств, хорошо известных в данной области.
В используемом в настоящем описании смысле введение «вместе с» включает одновременное введение и/или введение в разные периоды времени. Введение вместе также охватывает введение в виде совместного препарата или введение в виде отдельных композиций. В используемом в настоящем описании смысле подразумевают, что введение вместе охватывает любой случай, в котором анти-Aβ-антитело и другое средство вводят человеку, и введение может происходить одновременно и/или раздельно. Как обсуждается в настоящем описании далее, понятно, что анти-Aβ-антитело и другое средство могут быть введены с разной частотой дозирования или с интервалами. Например, анти-Aβ-антитело можно вводить еженедельно, тогда как другое средство можно вводить менее часто. Понятно, что анти-Aβ-антитело и другое средство можно вводить, используя один и тот же путь введения или разные пути введения.
Термин «биологический образец» охватывает множество типов образцов, которые получены от человека и которые могут быть использованы в диагностическом или мониторинговом анализе. Определение охватывает образец крови и другие жидкие образцы биологического происхождения, образцы солидных тканей, такие как образцы биопсии, или полученные из них культуры ткани и клетки и их потомство. Определение также включает в себя образцы, которые были обработаны каким-либо образом после их получения, например обработаны реагентами, подвергнуты солюбилизации или обогащены некоторыми компонентами, такими как белки или полинуклеотиды, или залиты в полутвердый или твердый матрикс с целью получения срезов. Термин «биологический образец» охватывает клинический образец, а также включает в себя клетки в культуре, надосадки клеток, лизаты клеток, сыворотку, плазму, биологическую жидкость и образцы ткани.
«Индивидуумом» (альтернативно называемым «субъектом») является млекопитающее, более предпочтительно человек. Млекопитающие также включают без ограничения сельскохозяйственных животных (таких, как коровы), спортивных животных, домашних животных (таких, как кошки, собаки, лошади), приматов, мышей и крыс.
В используемом в настоящем описании смысле «вектор» означает конструкцию, которая способна доставлять и предпочтительно экспрессировать один или несколько представляющих интерес генов или последовательностей в клетке-хозяине. Примеры векторов включают без ограничения вирусные векторы, экспрессирующие векторы на основе «голой» ДНК или РНК, плазмидные, космидные или фаговые векторы, ДНК- или РНК-экспрессирующие векторы, ассоциированные с катионными конденсирующими агентами, ДНК- или РНК-экспрессирующие векторы, инкапсулированные в липосомы, и некоторые эукариотические клетки, такие как клетки-продуценты.
В используемом в настоящем описании смысле «последовательность регуляции экспрессии» означает последовательность нуклеиновой кислоты, которая управляет транскрипцией нуклеиновой кислоты. Последовательность регуляции экспрессии может представлять собой промотор, такой как конститутивный или индуцируемый промотор, или энхансер. Последовательность регуляции экспрессии оперативно связана с транскрибируемой последовательностью нуклеиновой кислоты.
В используемом в настоящем описании смысле «фармацевтически приемлемый носитель означает любое вещество, которое при объединении с активным ингредиентом позволяет ингредиенту сохранять биологическую активность и не взаимодействует с иммунной системой субъекта. Примерами без ограничения являются любые стандартные фармацевтические носители, такие как фосфатно-солевой буферный раствор, вода, эмульсии, такие как эмульсия масло/вода, и различные типы увлажнителей. Предпочтительными разбавителями для аэрозольного или парентерального введения являются фосфатно-солевой буфер или физиологический раствор соли (0,9%). Композиции, содержащие такие носители, готовят хорошо известными обычными способами (смотри, например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; и Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing, 2000).
Подразумевается, что термин «kon» в используемом в настоящем описании смысле относится к константе скорости образования комплекса в случае ассоциации антитела с антигеном.
Подразумевается, что термин «koff» в используемом в настоящем описании смысле относится к константе скорости распада комплекса в случае диссоциации антитела их комплекса антитело/антиген.
Термин «KD» в используемом в настоящем описании смысле относится к равновесной константе диссоциации при взаимодействии антитело-антиген.
Композиции и способы получения композиций
Анти-Aβ-антитела и полипептиды:
I. Антитело 9TL и полученные из 9TL антитела и полипептиды
Настоящее изобретение охватывает композиции, включая фармацевтические композиции, содержащие антитело 9TL и его варианты, показанные в таблице 3, или полипептид, полученный из антитела 9TL и его вариантов, показанных в таблице 3; и полинуклеотиды, содержащие последовательности, кодирующие антитело 9TL в его варианты или полипептид. В используемом в настоящем описании смысле композиции содержат одно или несколько антител или полипептидов (которые могут представлять собой антитело или не являются антителом), которые связываются с C-концом Aβ1-40, и/или один или несколько полинуклеотидов, содержащих последовательности, кодирующие одно или несколько антител или полипептидов, которые связываются с C-концом Aβ1-40. Указанные композиции могут дополнительно содержать подходящие эксципиенты, такие как фармацевтически приемлемые эксципиенты, включая буферы, которые хорошо известны в данной области.
Антитела и полипептиды согласно изобретению характеризуются любым (одним или несколькими) из следующих признаков: (a) связываются с C-концевым пептидом 28-40 Aβ1-40, но по существу не связываются с Aβ1-42 или Aβ1-43; (b) связываются с C-концевым пептидом 33-40 Aβ1-40; (c) подавляют образование амилоидных бляшек у субъекта; (d) уменьшают амилоидные бляшки в глазах субъекта; (e) лечат, предотвращают, ослабляют один или несколько симптомов глазной болезни, включая без ограничения возрастную макулярную дегенерацию (как сухую, так и влажную), глаукому, диабетическую ретинопатию (включая макулярный отек) и другие родственные дегенеративные заболевания сетчатки; (f) вызывают значимую защиту или восстановление функции сетчатки и (g) вызывают сохранение или восстановление остроты зрения.
Антитела и полипептиды согласно изобретению также могут иметь требуемый профиль безопасности в отличие от других анти-Aβ-антител, о которых сообщалось в литературе.
Соответственно, изобретение относится к любому из следующих средств или к композициям (включая фармацевтические композиции), содержащим любое из следующих средств: (a) антитело 9TL или его варианты, показанные в таблице 3; (b) фрагмент или область антитела 9TL или его вариантов, показанных в таблице 3; (c) легкую цепь антитела 9TL или его вариантов, показанных в таблице 3; (d) тяжелую цепь антитела 9TL или его вариантов, показанных в таблице 3; (e) одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 9TL или его вариантов, показанных в таблице 3; (f) одну или несколько CDR (одну, две, три, четыре, пять или шесть CDR) антитела 9TL или его вариантов, показанных в таблице 3; (g) CDR H3 из тяжелой цепи антитела 9TL; (h) CDR L3 из легкой цепи антитела 9TL или его вариантов, показанных в таблице 3; (i) три CDR из легкой цепи антитела 9TL или его вариантов, показанных в таблице 3; (j) три CDR из тяжелой цепи антитела 9TL или его вариантов, показанных в таблице 3; (k) три CDR из легкой цепи и три CDR из тяжелой цепи антитела 9TL или его вариантов, показанных в таблице 3; и (l) антитело, содержащее любой из компонентов (b)-(k). Изобретение также относится к полипептидам, содержащим любой один или несколько из указанных выше компонентов.
CDR-части антитела 9TL (включая CDR согласно Chothia и Kabat) в виде диаграммы изображены на фигуре 1. Определение CDR-областей хорошо известно специалисту в данной области. Понятно, что в некоторых вариантах CDR могут представлять собой сочетание CDR согласно Kabat и Chothia (также называемые «объединенными CDR» или «расширенными CDR»). В некоторых вариантах CDR представляют собой CDR согласно Kabat. В других вариантах CDR представляют собой CDR согласно Chothia. Другими словами, в вариантах, содержащих более одной CDR, CDR могут быть CDR согласно Kabat, согласно Chothia и/или являются их сочетаниями.
В некоторых вариантах изобретение относится к полипептиду (который может представлять собой антитело или не является антителом), который содержит, по меньшей мере, одну CDR, по меньшей мере, две, по меньшей мере, три или, по меньшей мере, четыре, по меньшей мере, пять или все шесть CDR, которые по существу идентичны, по меньшей мере, одной CDR, по меньшей мере, двум, по меньшей мере, трем, по меньшей мере, четырем, по меньшей мере, пяти или всем шести CDR 9TL или его вариантов, показанных в таблице 3. Другие варианты включают антитела, которые имеют, по меньшей мере, две, три, четыре, пять или шесть CDR, которые по существу идентичны, по меньшей мере, двум, трем, четырем, пяти или шести CDR 9TL или антитела, полученного из 9TL. В некоторых вариантах, по меньшей мере, одна, две, три, четыре, пять или шесть CDR, по меньшей мере, примерно на 85%, 86%, 87%, 88%, 89%, 90%, 95%, 96%, 97%, 98% или 99% идентичны, по меньшей мере, одной, двум, трем, четырем, пяти или шести CDR 9TL или его вариантов, показанных в таблице 3. Понятно, что в целях настоящего изобретения специфичность связывания и/или общую активность в общем сохраняют, хотя степень активности может варьировать по сравнению с 9TL или его вариантами, показанными в таблице 3 (может быть выше или ниже).
Изобретение также относится к полипептиду (который может представлять собой антитело или не является антителом), который содержит аминокислотную последовательность 9TL или его вариантов, показанных в таблице 3, которая имеет любой из следующих признаков: по меньшей мере, 5 следующих друг за другом аминокислот, по меньшей мере, 8 следующих друг за другом аминокислот, по меньшей мере, примерно 10 следующих друг за другом аминокислот, по меньшей мере, примерно 15 следующих друг за другом аминокислот, по меньшей мере, примерно 20 следующих друг за другом аминокислот, по меньшей мере, примерно 25 следующих друг за другом аминокислот, по меньшей мере, примерно 30 следующих друг за другом аминокислот последовательности 9TL или его вариантов, показанных в таблице 3, где, по меньшей мере, 3 аминокислоты получены из вариабельной области 9TL (фигура 1) или его вариантов, показанных в таблице 3. В одном варианте вариабельная область получена из легкой цепи 9TL. В другом варианте вариабельная область получена из тяжелой цепи 9TL. Типичный полипептид имеет следующие друг за другом аминокислоты (длиной, описанной выше) из вариабельных областей и тяжелой и легкой цепи 9TL. В другом варианте 5 (или более) следующих друг за другом аминокислот происходят из определяющей комплементарность области (CDR) 9TL, показанной на фигуре 1. В некоторых вариантах следующие друг за другом аминокислоты происходят из вариабельной области 9TL.
II. Антитело 6G и полученные из 6G антитела и полипептиды
Настоящее изобретение, кроме того, относится к способам лечения глазной болезни, включающим в себя введение антитела или полипептида, который связывается с Aβ1-40, Aβ1-42 и Aβ1-43. В некоторых вариантах антитело или полипептид связывается с Aβ1-40 с большей аффинностью, чем аффинность его связывания с Aβ1-42 и Aβ1-43. В некоторых вариантах антитело связывается с Aβ1-36, Aβ1-37, Aβ1-38 и Aβ1-39. В некоторых вариантах антитело связывается с Aβ22-35. В некоторых вариантах антитело связывается с Aβ28-40. В некоторых вариантах антитело или полипептид связывается с эпитопом на Aβ1-40, который включает в себя аминокислоты 25-34 и 40.
Настоящее изобретение также относится к способам лечения глазной болезни, включающим в себя введение фармацевтических композиций, содержащих любое из антител или полипептидов, описанных в настоящей публикации (таких, как антитело 6G и его варианты, показанные в таблице 8, или полипептид, полученный из антитела 6G и его вариантов, показанных в таблице 8); или полинуклеотиды, описанные в настоящей публикации. В используемом в настоящем описании смысле композиции содержат одно или несколько антител или полипептидов (которые могут представлять собой антитело или не являются антителом), которые связываются с C-концом Aβ1-40, и/или один или несколько полинуклеотидов, содержащих последовательности, кодирующие одно или несколько антител или полипептидов, которые связываются с C-концом Aβ1-40. Указанные композиции дополнительно могут содержать подходящие эксципиенты, такие как фармацевтически приемлемые эксципиенты, включая буферы, которые хорошо известны в данной области.
Антитела и полипептиды согласно изобретению характеризуются любым (одним или несколькими) из следующих признаков: (a) связываются с Aβ1-40, Aβ1-42 и Aβ1-43; (b) связываются с Aβ1-40, Aβ1-42 и Aβ1-43, причем с более высокой аффинность связывания с Aβ1-40, чем с Aβ1-42 и Aβ1-43; (c) связываются с эпитопом на Aβ1-40, который включает в себя аминокислоты 25-34 и 40; (d) связываются с Aβ1-36, Aβ1-37, Aβ1-38 и Aβ1-39, но с более низкой аффинностью по сравнению с их связыванием с Aβ1-40; (e) связываются с Aβ22-37 с KD менее чем примерно 1 мкМ; (f) связываются с Aβ22-35; (g) связываются с Aβ28-40; (h) не связываются с APP, экспрессированным в клетке; (i) снижают амилоидные бляшки в глазах субъекта; (j) лечат, предотвращают, ослабляют один или несколько симптомов глазной болезни, включая без ограничения возрастную макулярную дегенерацию (как сухую, так и влажную), глаукому, диабетическую ретинопатию (включая макулярный отек) и другие родственные дегенеративные заболевания сетчатки; (k) вызывают значимую защиту или восстановление функции сетчатки и (l) вызывают значимое сохранение или восстановление остроты зрения. Антитела и полипептиды согласно изобретению также могут иметь нарушенную эффекторную функцию, описанную в настоящей публикации. Антитела и полипептиды, имеющие нарушенную эффекторную функцию, могут иметь требуемый профиль безопасности в отличие от других описанных анти-Aβ-антител. Например, композиции согласно изобретению могут не вызывать появления существенных или неприемлемых уровней одного или нескольких симптомов: кровотечения сосудов головного мозга (церебральной геморрагии); менингоэнцефалита (включая изменение при магнитно-резонансном сканировании); повышенного количества лейкоцитов в цереброспинальной жидкости; воспаления центральной нервной системы.
Соответственно, изобретение относится к любому из следующих средств или к композициям (включая фармацевтические композиции), содержащим любое из следующих средств: (a) антитело 6G или его варианты, показанные в таблице 8; (b) фрагмент или область антитела 6G или его вариантов, показанных в таблице 8; (c) легкую цепь антитела 6G или его вариантов, показанных в таблице 8; (d) тяжелую цепь антитела 6G или его вариантов, показанных в таблице 8; (e) одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 6G или его вариантов, показанных в таблице 8; (f) одну или несколько CDR (одну, две, три, четыре, пять или шесть CDR) антитела 6G или его вариантов, показанных в таблице 8; (g) CDR H3 из тяжелой цепи антитела 6G; (h) CDR L3 из легкой цепи антитела 6G или его вариантов, показанных в таблице 8; (i) три CDR из легкой цепи антитела 6G или его вариантов, показанных в таблице 8; (j) три CDR из тяжелой цепи антитела 6G или его вариантов, показанных в таблице 8; (k) три CDR из легкой цепи и три CDR из тяжелой цепи антитела 6G или его вариантов, показанных в таблице 8; и (l) антитело, содержащее любой из компонентов (b)-(k). Изобретение также относится к полипептидам, содержащим любой один или несколько из указанных выше компонентов.
CDR-части антитела 6G (включая CDR согласно Chothia и Kabat) в виде диаграммы изображены на фигуре 8. Определение CDR-областей хорошо известно специалисту в данной области.
В некоторых вариантах изобретение относится к полипептиду (который может представлять собой антитело или не является антителом), который содержит, по меньшей мере, одну CDR, по меньшей мере, две, по меньшей мере, три или, по меньшей мере, четыре, по меньшей мере, пять или все шесть CDR, которые по существу идентичны, по меньшей мере, одной CDR, по меньшей мере, двум, по меньшей мере, трем, по меньшей мере, четырем, по меньшей мере, пяти или всем шести CDR 6G или его вариантов, показанных в таблице 8. Другие варианты включают антитела, которые имеют, по меньшей мере, две, три, четыре, пять или шесть CDR, которые по существу идентичны, по меньшей мере, двум, трем, четырем, пяти или шести CDR 6G или антитела, полученного из 6G. В некоторых вариантах, по меньшей мере, одна, две, три, четыре, пять или шесть CDR, по меньшей мере, примерно на 85%, 86%, 87%, 88%, 89%, 90%, 95%, 96%, 97%, 98% или 99% идентичны, по меньшей мере, одной, двум, трем, четырем, пяти или шести CDR 6G или его вариантов, показанных в таблице 8. Понятно, что в целях настоящего изобретения специфичность связывания и/или общую активность в общем сохраняют, хотя степень активности может варьировать по сравнению с 6G или его вариантами, показанными в таблице 8 (может быть выше или ниже).
Изобретение также относится к полипептиду (который может представлять собой антитело или не является антителом), который содержит аминокислотную последовательность 6G или его вариантов, показанных в таблице 8, которая имеет любой из следующих признаков: по меньшей мере, 5 следующих друг за другом аминокислот, по меньшей мере, 8 следующих друг за другом аминокислот, по меньшей мере, примерно 10 следующих друг за другом аминокислот, по меньшей мере, примерно 15 следующих друг за другом аминокислот, по меньшей мере, примерно 20 следующих друг за другом аминокислот, по меньшей мере, примерно 25 следующих друг за другом аминокислот, по меньшей мере, примерно 30 следующих друг за другом аминокислот последовательности 6G или его вариантов, показанных в таблице 8, где, по меньшей мере, 3 аминокислоты получены из вариабельной области 6G (фигура) или его вариантов, показанных в таблице 8. В одном варианте вариабельная область получена из легкой цепи 6G. В другом варианте вариабельная область получена из тяжелой цепи 6G. Типичный полипептид имеет следующие друг за другом аминокислоты (длиной, описанной выше) из вариабельных областей и тяжелой и легкой цепи 6G. В другом варианте 5 (или более) следующих друг за другом аминокислот происходят из определяющей комплементарность области (CDR) 6G, показанной на фигуре 8. В некоторых вариантах следующие друг за другом аминокислоты происходят из вариабельной области 6G.
Аффинности связывания антител и полипептидов согласно изобретению могут варьировать и необязательно должны (но могут) иметь конкретное значение или диапазон, как в иллюстративных вариантах, описанных ниже. Аффинность связывания (KD) антител и полипептидов согласно изобретению с пептидом Aβ (включая пептиды Aβ1-40, Aβ1-42 или Aβ1-43) может составлять примерно от 0,10 до примерно 0,80 нМ, примерно от 0,15 до примерно 0,75 нМ и примерно от 0,18 до примерно 0,72 нМ. В некоторых вариантах аффинность связывания составляет примерно 2 пМ, примерно 5 пМ, примерно 10 пМ, примерно 15 пМ, примерно 20 пМ, примерно 40 пМ или больше, чем примерно 40 пМ. В одном варианте аффинность связывания составляет примерно от 2 пМ до 22 пМ. В других вариантах аффинность связывания составляет менее чем примерно 10 нМ, примерно 5 нМ, примерно 1 нМ, примерно 900 пМ, примерно 800 пМ, примерно 700 пМ, примерно 600 пМ, примерно 500 пМ, примерно 400 пМ, примерно 300 пМ, примерно 200 пМ, примерно 150 пМ, примерно 100 пМ, примерно 90 пМ, примерно 80 пМ, примерно 70 пМ, примерно 60 пМ, примерно 50 пМ, примерно 40 пМ, примерно 30 пМ, примерно 10 пМ. В некоторых вариантах аффинность связывания составляет примерно 10 нМ. В других вариантах аффинность связывания составляет менее чем примерно 10 нМ, менее чем примерно 50 нМ, менее чем примерно 100 нМ, менее чем примерно 150 нМ, менее чем примерно 200 нМ, менее чем примерно 250 нМ, менее чем примерно 500 нМ, или менее чем примерно 1000 нМ. В других вариантах аффинность связывания составляет менее чем примерно 5 нМ. В других вариантах аффинность связывания составляет менее чем примерно 1 нМ. В других вариантах аффинность связывания составляет примерно 0,1 нМ или примерно 0,07 нМ. В других вариантах аффинность связывания составляет менее чем примерно 0,1 нМ или менее чем примерно 0,07 нМ. В других вариантах аффинность связывания составляет примерно от 10 нМ, примерно 5 нМ, примерно 1 нМ, примерно 900 пМ, примерно 800 пМ, примерно 700 пМ, примерно 600 пМ, примерно 500 пМ, примерно 400 пМ, примерно 300 пМ, примерно 200 пМ, примерно 150 пМ, примерно 100 пМ, примерно 90 пМ, примерно 80 пМ, примерно 70 пМ, примерно 60 пМ, примерно 50 пМ, примерно 40 пМ, примерно 30 пМ, примерно 10 пМ до примерно 2 пМ, примерно 5 пМ, примерно 10 пМ, примерно 15 пМ, примерно 20 пМ или примерно 40 пМ. В некоторых вариантах аффинность связывания составляет примерно 10 нМ, примерно 5 нМ, примерно 1 нМ, примерно 900 пМ, примерно 800 пМ, примерно 700 пМ, примерно 600 пМ, примерно 500 пМ, примерно 400 пМ, примерно 300 пМ, примерно 200 пМ, примерно 150 пМ, примерно 100 пМ, примерно 90 пМ, примерно 80 пМ, примерно 70 пМ, примерно 60 пМ, примерно 50 пМ, примерно 40 пМ, примерно 30 пМ, примерно 10 пМ. В следующих вариантах аффинность связывания составляет примерно 2 пМ, примерно 5 пМ, примерно 10 пМ, примерно 15 пМ, примерно 20 пМ, примерно 40 пМ или больше чем примерно 40 пМ. Антитело или полипептиды согласно изобретению могут связываться с сочетанием пептидов Aβ1-40, Aβ1-42 и/или Aβ1-42. В одном варианте антитело или полипептиды связываются, по меньшей мере, с пептидами Aβ1-40 и Aβ1-42.
Антитела и полипептиды согласно изобретению также могут связываться с любым одним или несколькими пептидами из Aβ1-36, Aβ1-37, Aβ1-38, Aβ1-39, Aβ1-42 и Aβ1-43, но в некоторых вариантах аффинность связывания с любым одним или несколькими указанными пептидами меньше, чем аффинности их связывания с Aβ1-40. В некоторых вариантах KD антител или полипептидов по отношению к любому одному или нескольким пептидам Aβ1-36, Aβ1-37, Aβ1-38, Aβ1-39, Aβ1-42 и Aβ1-43, по меньшей мере, примерно в 5 раз, по меньшей мере, примерно в 10 раз, по меньшей мере, примерно в 20 раз, по меньшей мере, примерно в 30 раз, по меньшей мере, примерно в 40 раз, по меньшей мере, примерно в 50 раз, по меньшей мере, примерно в 80 раз, по меньшей мере, примерно в 100 раз, по меньшей мере, примерно в 150 раз, по меньшей мере, примерно в 200 раз или, по меньшей мере, примерно в 250 раз выше, чем KD по отношению к Aβ1-40.
Изобретение также относится к способам получения любого из указанных антител или полипептидов. Антитела согласно настоящему изобретению могут быть получены способами, известными в данной области. Полипептиды могут быть получены протеолитическим или другим расщеплением антител, способами, основанными не рекомбинации (т.е. отдельные или слитые полипептиды), которые описаны выше, или с помощью химического синтеза. Полипептиды антител, особенно более короткие полипептиды примерно до 50 аминокислот, обычно получали с помощью химического синтеза. Способы химического синтеза известны в данной области и коммерчески доступны. Например, антитело может быть получено с помощью автоматизированного синтезатора полипептидов, используя твердофазный способ. Также смотри патенты США № 5807715, 4816567 и 6331415.
В другом альтернативном варианте антитела могут быть получены рекомбинантно с использованием способов, которые хорошо известны в данной области. В одном варианте полинуклеотид содержит последовательность, кодирующую вариабельные области тяжелой цепи и/или легкой цепи антитела. В другом варианте полинуклеотид, содержащий нуклеотидную последовательность, клонируют в одном или нескольких векторах для экспрессии или размножения. Последовательность, кодирующая представляющее интерес антитело, может сохраняться в векторе в клетке-хозяине и затем клетка-хозяин может быть размножена и клетки заморожены для применения в будущем. Векторы (включая экспрессирующие векторы) и клетки-хозяева описаны в настоящей публикации ниже.
Изобретение также охватывает одноцепочечные фрагменты вариабельных областей («scFv») антител согласно настоящему изобретению, таких как 9TL и 6G. Одноцепочечные фрагменты вариабельных областей получают связыванием вариабельных областей легкой и/или тяжелой цепей с использованием короткого связывающего пептида. Bird et al. (1988) Science 242: 423-426. Примером связывающего пептида является (GGGGS)3, который образует мостик длиной примерно 3,5 нм между карбоксильным концом одной вариабельной области и амино-концом другой вариабельной области. Сконструированы и используются линкеры с другими последовательностями. Bird et al. (1988). Линкеры в свою очередь могут быть модифицированы для обеспечения дополнительных функций, таких как связывание лекарственных средств или связывание с твердыми подложками. Одноцепочечные варианты могут быть получены либо с использованием рекомбинации, либо синтетически. Для получения scFv путем синтеза можно использовать автоматизированный синтезатор. Для получения scFv основанными на рекомбинации способами подходящая плазмида, содержащая полинуклеотид, который кодирует scFv, может быть введена в подходящую клетку-хозяина либо эукариотическую, такую как клетки дрожжей, растения, насекомого или млекопитающего, либо прокариотическую, такую как E. coli. Полинуклеотиды, кодирующие представляющий интерес scFv, могут быть получены обычными способами обработки, такими как лигирование полинуклеотидов. Полученный в результате scFv может быть выделен с использованием стандартной методики очистки белков, известной в данной области.
Другие формы одноцепочечных антител, такие как диантитела, также входят в объем изобретения. Диантитела представляют собой бивалентные, биспецифичные антитела, в которых домены VH и VL экспрессированы в виде одной полипептидной цепи, но с использованием линкера, который слишком короткий, чтобы обеспечить возможность спаривания между двумя доменами на одной и той же цепи, соответственно, домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих участка (смотри, например, Holliger, P., et al. (1993) Proc. Natl. Acad Sci. USA 90:6444-6448; Poljak, R. J., et al. (1994) Structure 2:1121-1123).
Например, биспецифичные антитела, моноклональные антитела, которые обладают специфичностями связывания, по меньшей мере, с двумя разными антигенами, т.е. Aβ1-40 и Aβ1-42, могут быть получены с использованием антител, раскрытых в настоящем описании. Способы получения биспецифичных антител известны в данной области (смотри, например, Suresh et al., 1986, Methods in Enzymology 121: 210). Традиционно рекомбинантное получение биспецифичных антител было основано на совместной экспрессии двух пар тяжелой цепи-легкой цепи с двумя тяжелыми цепями, имеющими разные специфичности (Millstein and Cuello, 1983, Nature 305, 537-539).
Согласно одному способу получения биспецифичных антител вариабельные домены антител с требуемыми специфичностями связывания (антигенсвязывающие участки антител) сливают с последовательностями константных доменов иммуноглобулина. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим, по меньшей мере, часть шарнира, области CH2 и CH3. Предпочтительно наличие первой константной области тяжелой цепи (CH1), содержащей участок, необходимый для связывания легкой цепи, присутствующей, по меньшей мере, в одном из слияний. ДНК, кодирующие слияния тяжелых цепей иммуноглобулина и при необходимости легкую цепь иммуноглобулина, встраивают в отдельные экспрессирующие векторы и котрансфицируют в подходящий организм-хозян. Это обеспечивает большую гибкость при корректировке взаимных соотношений трех полипептидных фрагментов в тех вариантах, когда неравные соотношения трех полипептидных цепей, используемых при конструировании, обеспечивают оптимальные выходы. Однако можно встроить кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных соотношениях приводит к высоким выходам или когда соотношения не имеют особого значения.
В одном способе биспецифичные антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной пары тяжелой цепи-легкой цепи иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Такая асимметричная структура с легкой цепью иммуноглобулина только в одной половине биспецифичной молекулы облегчает отделение требуемого биспецифичного соединения от нежелательных комбинаций цепей иммуноглобулина. Такой способ описан в публикации PCT WO 94/04690, опубликованной 3 марта 1994.
Гетероконъюгаты антител, содержащие два ковалентно связанных антитела, также входят в объем изобретения. Такие антитела использовали для того, чтобы направить клетки иммунной системы к нежелательным клеткам (патент США № 4676980), и для лечения ВИЧ-инфекции (публикации PCT № WO 91/00360 и WO 92/200373 и EP 03089). Гетероконъюгаты антител могут быть получены с использованием любых способов образования поперечных сшивок. Подходящие поперечно сшивающие агенты и способы хорошо известны в данной области и описаны в патенте США № 4676980.
Химерные или гибридные антитела также могут быть получены in vitro с использованием известных способов химического синтеза белков, включая способы с применением поперечно сшивающих агентов. Например, иммунотоксины могут быть сконструированы с использованием реакции дисульфидного обмена или в результате образования тиоэфирной связи. Примерами подходящих реагентов для указанной цели являются иминотиолат и метил-4-меркаптобутиримидат.
Гуманизированное антитело, содержащее одну или несколько CDR антитела 9TL или одну или несколько CDR, полученных из антитела 9TL, может быть получено с использованием любых способов, известных в данной области. Например, можно использовать четыре общих стадии, чтобы гуманизировать моноклональное антитело. А именно: (1) определение нуклеотидной и расчет аминокислотной последовательности вариабельных доменов легкой и тяжелой цепи исходного антитела; (2) проектирование гуманизированного антитела, т.е. решение вопроса о том, какую каркасную область антитела использовать в ходе процесса гуманизации; (3) выполнение методики/способов гуманизации и (4) трансфекция и экспрессия гуманизированного антитела. Смотри, например, патенты США № 4816567, 5807715, 5866692, 6331415, 5530101, 5693761, 5693762, 5585089, 6180370, 5225539, 6548640.
В рекомбинантных гуманизированных антителах Fc-часть может быть модифицирована, чтобы избежать взаимодействия с рецептором Fcγ и системой комплемента. Указанный тип модификации осуществлен Dr. Mike Clark из Department of Pathology at Cambridge University и методики получения таких антител описаны в WO 99/58572, опубликованной 18 ноября 1999.
Например, константная область может быть сконструирована так, чтобы она больше была похожа на константные области человека, чтобы избежать иммунного ответа в случае применения антитела в клинических испытаниях и при лечении человека. Смотри, например, патенты США № 5997867 и 5866692.
Изобретение охватывает модификации антител 9TL и 6G, включая функционально эквивалентные антитела, которые существенно не влияют на их свойства, и варианты, которые имеют повышенную или пониженную активность и/или аффинность. Например, аминокислотная последовательность антитела 9TL или 6G может быть подвергнута мутагенезу, чтобы получить антитело с требуемой аффинностью связывания с мишенью - пептидом Aβ. Модификация полипептидов является обычной практикой в данной области и не нуждается в подробном описании в данной публикации. Модификация полипептидов проиллюстрирована в примерах. Примеры модифицированных полипептидов включают полипептиды с консервативными заменами аминокислотных остатков, одной или несколькими делециями или добавлениями аминокислот, которые не вносят существенных вредных изменений в функциональную активность, или использование химических аналогов.
Инсерции в аминокислотной последовательности включают слияния на амино- и/или карбоксильном конце, диапазон длины которых составляет от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции внутри последовательности одного или нескольких аминокислотных остатков. Примеры концевых инсерций включают антитело с N-концевым остатком метионила или антитело, слитое с эпитопной меткой. Другие инсерционные варианты молекулы антитела включают слияние N- или C-конца антитела с ферментом или полипептидом, который увеличивает время полужизни антитела в сыворотке.
Варианты с заменами имеют, по меньшей мере, один аминокислотный остаток в молекуле антитела, который удаляют и на его место встраивают другой остаток. Участки, представляющие наибольший интерес для основанного на заменах мутагенеза, включают гипервариабельные области, но также предполагаются изменения FR. Консервативные замены показаны в таблице 1 под заголовком «консервативные замены». Если такие замены приводят к изменению биологической активности, то могут быть введены более существенные изменения, показанные в таблице 1 под заголовком «примеры замен» или дополнительно описанные ниже при описании классов аминокислот, и продукты подвергают скринингу.
Аминокислотные замены
Существенные модификации биологических свойств антитела осуществляют посредством отбора замен, которые в значительной степени отличаются по своему влиянию на сохранение (a) структуры полипептидного остова в области замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в сайте-мишени или (c) объема боковой цепи. Встречающиеся в природе делятся на группы на основании общих свойств боковых цепей:
(1) неполярные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) полярные незаряженные: Cys, Ser, Thr, Asn, Gln;
(3) кислые (отрицательно заряженные): Asp, Glu;
(4) основные (положительно заряженные): Lys, Arg;
(5) остатки, которые влияют на ориентацию цепей: Gly, Pro; и
(6) ароматические: Trp, Tyr, Phe, His.
Неконсервативные замены осуществляют заменой представителя одного из указанных классов представителем другого класса.
Любой остаток цистеина, не вовлеченный в поддержание правильной конформации антитела, также может быть заменен обычно серином, чтобы повысить стабильность молекулы к окислению и предотвратить образование аномальных поперечных сшивок. Наоборот, цистеиновая связь (связи) может быть добавлена к антителу, чтобы повысить стабильность, особенно, когда антитело представляет собой фрагмент антитела, такой как Fv-фрагмент.
Диапазон аминокислотных модификаций может составлять от изменения или модификации одной или нескольких аминокислот до полной реконструкции области, такой как вариабельная область. Изменения в вариабельной области могут изменять аффинность и/или специфичность связывания. В некоторых вариантах в домене CDR осуществляют не более одной-пяти консервативных аминокислотных замен. В других вариантах в домене CDR осуществляют не более одной-трех консервативных аминокислотных замен. В других вариантах домен CDR представляет собой CDR H3 и/или CDR L3.
Модификации также включают гликозилированные и негликозилированные полипептиды, а также полипептиды с другими посттрансляционными модификациями, такими как, например, гликозилирование разными сахарами, ацетилирование и фосфорилирование. Антитела подвергают гликозилированию в консервативных положениях в константных областях (Jefferis and Lund, 1997, Chem. Immunol. 65: 111-128; Wright and Morrison, 1997, TibTECH 15: 26-32). Олигосахаридные боковые цепи иммуноглобулинов влияют на функцию белка (Boyd et al., 1996, Mol. Immunol. 32: 1311-1318; Wittwe and Howard, 1990, Biochem. 29: 4175-4180) и внутримолекулярное взаимодействие между частями гликопротеида, которое может влиять на конформацию и представляемую трехмерную поверхность гликопротеида (Hefferis and Lund, выше; Wyss and Wagner, 1996, Current Opin. Biotech. 7: 409-416). Олигосахариды также могут служить для того, чтобы нацеливать данный гликопротеид на некоторые молекулы на основании специфичных структур для узнавания. Также сообщалось, что гликозилирование антител влияет на зависимую от антител клеточную цитотоксичность (ADCC). В частности, сообщалось, что клетки CHO с регулируемой тетрациклином экспрессией β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), гликозилтрансферазы, катализирующей образование разветвляющегося GlcNAc, имеют повышенную активность ADCC (Umana et al., 1999, Mature Biotech. 17: 176-180).
Гликозилирование антител обычно является либо N-связанным, либо O-связанным. N-связанное относится к связыванию углеводного остатка с боковой цепью остатка аспарагина. Трипептидные последовательности аспарагин-X-серин, аспарагин-X-треонин и аспарагин-X-цистеин, где X означает любую аминокислоту за исключением пролина, представляют собой узнаваемые последовательности для ферментативного связывания углеводного остатка с боковой цепью аспарагина. Таким образом, присутствие любой из указанных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование относится к связыванию одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы с гидроксиаминокислотой, чаще всего серином или треонином, хотя также могут быть использованы 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу обычно сопровождается изменением аминокислотной последовательности, так что она содержит одну или несколько описанных выше трипептидных последовательностей (в случае сайтов N-связанного гликозилирования). Изменение также можно осуществить добавлением или заменой одного или нескольких остатков серина или треонина к последовательности исходного антитела (в случае сайтов O-связанного гликозилирования). Картина гликозилирования антител также может быть изменена без изменения лежащей в основе нуклеотидной последовательности. Гликозилирование в значительной степени зависит от клетки-хозяина, используемой для экспрессии антитела. Так как тип клеток, используемых для экспрессии рекомбинантных гликопротеидов, например антител, в качестве потенциальных терапевтических средств редко представлен нативной клеткой, то можно ожидать изменчивость картины гликозилирования антител (смотри, например, Hse et al., 1997, J. Biol. Chem. 272: 9062-9070).
Кроме выбора клеток-хозяев, факторы, которые влияют на гликозилирование во время рекомбинантного получения антител, включают режим роста, состав среды, плотность культуры, насыщение кислородом, pH, схемы очистки и тому подобное. Предложены различные способы изменения картины гликозилирования, осуществляемого в конкретном организме-хозяине, включая введение или сверхэкспрессию некоторых ферментов, вовлеченных в продукцию олигосахаридов (патенты США № 5047335, 5510261 и 5278299). Гликозилирование или некоторые типы гликозилирования могут быть ферментативно удалены из гликопротеида, например, с использованием эндогликозидазы H (Endo H), N-гликозидазы F, как описано в примере 3, эндогликозидазы F1, эндогликозидазы F2, эндогликозидазы F3. Кроме того, рекомбинантная клетка-хозяин может быть сконструирована генетически так, чтобы она была дефектной по процессингу некоторых типов полисахаридов. Указанные и подобные способы хорошо известны в данной области.
Другие способы модификации включают применение методики связывания, известной в данной области, включая без ограничения ферментативные способы, окислительное замещение и хелатирование. Модификации можно использовать, например, для связывания меток в случае иммуноанализа. Модифицированные полипептиды 9TL получают, используя способы, разработанные в данной области, и они могут быть подвергнуты скринингу с использованием стандартных анализов, известных в данной области, некоторые из которых описаны ниже и в примерах.
В некоторых вариантах осуществления изобретения антитело содержит модифицированную константную область, такую как константная область, которая является иммунологически инертной или частично инертной, например, не запускает опосредованный комплементом лизис, не стимулирует зависимую от антител опосредованную клетками цитотоксичность (ADCC) или не активирует микроглию; или имеет пониженные активности (по сравнению с немодифицированным антителом) в одном или нескольких из следующих процессов: запуске опосредованного комплементом лизиса, стимуляции зависимой от антител опосредованной клетками цитотоксичности (ADCC) или активации микроглии. Можно использовать различные модификации константной области, чтобы достичь оптимального уровня и/или сочетания эффекторных функций. Смотри, например, Morgan et al., Immunology 86: 319-324 (1995); Lund et al., J. Immunology 157: 4963-4969 (1996); Idusogie et al., J. Immunology 164: 4178-4184 (2000); Tao et al., J. Immunology 143: 2595-2601 (1989); и Jefferis et al., Immunological Reviews 163:59-76 (1998). В некоторых вариантах константную область модифицируют, как описано в Eur. J. Immunol. (1999) 29: 2613-2624; в публикации PCT № PCT/GB99/01441 и/или в заявке на выдачу патента Великобритании № 9809951.8. В других вариантах антитело содержит константную область тяжелой цепи IgG2a человека, содержащую следующие мутации: A330P331 → S330S331 (нумерация аминокислот в соответствии с последовательностью IgG2a дикого типа). Eur. J. Immunol. (1999) 29: 2613-2624. В других вариантах константная область не гликозилируется в случае N-связанного гликозилирования. В некоторых вариантах константная область не гликозилируется в случае N-связанного гликозилирования благодаря мутации гликозилируемого аминокислотного остатка и/или фланкирующих остатков, которые являются частью последовательности узнавания при N-гликозилировании в константной области. Например, сайт N-гликозилирования N297 может быть подвергнут мутации с получением A, Q, K или H. Смотри Tao et al., J. Immunology 143: 2595-2601 (1989); и Jefferis et al., Immunological Reviews 163: 59-76 (1998). В некоторых вариантах константная область не гликозируется в случае N-связанного гликозилирования. Константная область может быть не гликозилирована в случае N-связанного гликозилирования в результате действия ферментов (например, в результате удаления углевода ферментом PNG-азой) или в результате экспрессии в клетке-хозяине, дефицитной по гликозилированию.
Другие модификации антител включают антитела, которые были модифицированы, как описано в публикации PCT № WO 99/58572, опубликованной 18 ноября 1999. Такие антитела содержат, кроме связывающего домена, направленного к молекуле-мишени, эффекторный домен, имеющий аминокислотную последовательность, в значительной степени гомологичную всему или части константного домена тяжелой цепи иммуноглобулина человека. Указанные антитела способны связывать молекулу-мишень, не запуская значительный зависимый от комплемента лизис или опосредованное клетками разрушение мишени. В некоторых вариантах эффекторный домен способен специфично связывать FcRn и/или FcγRIIb. Обычно они основаны на химерных доменах, полученных из двух или более доменов CH2 тяжелой цепи иммуноглобулина человека. Модифицированные таким образом антитела являются особенно подходящими для применения в хронической терапии антителами, чтобы избежать воспалительных и других неблагоприятных реакций на обычную терапию антителами.
В изобретении предлагаются варианты, подвергнутые процессу созревания аффинности. Например, антитела с повышенной (зрелой) аффинностью могут быть получены способами, известными в данной области (Marks et al., 1992, Bio/Technology, 10: 779-783; Barbas et al., 1994, Proc Nat. Acad. Sci, USA 91: 3809-3813; Schier et al., 1995, Gene, 169: 147-155; Yelton et al., 1995, J. Immunol., 155: 1994-2004; Jackson et al., 1995, J. Immunol., 154(7): 3310-9; Hawkins et al, 1992, J. Mol. Biol., 226: 889-896 и WO 2004/058184).
Следующие способы можно применять для корректировки аффинности антитела и для характеристики CDR. Один из способов, применяемых для характеристики CDR антитела и/или изменения (например, повышения) аффинности связывания полипептида, такого как антитело, назван «мутагенезом на основе сканирования библиотеки». В общем, мутагенез на основе сканирования библиотеки работает следующим образом. Аминокислоты в одном или нескольких положениях в CDR заменяют двумя или более (например, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) аминокислотами, используя известные в данной области способы. Таким образом создают небольшие библиотеки клонов (в некоторых вариантах одну для каждого положения аминокислоты, которое анализируют), при этом комплексность каждой библиотеки состоит из двух или более членов (если в каждом положении вводят замену двумя или более аминокислотами). Обычно библиотека также включает в себя клон, содержащий нативную (незамененную) аминокислоту. Небольшое количество клонов, например около 20-80 клонов (в зависимости от комплексности бибилиотеки), из каждой библиотеки подвергают скринингу в отношении аффинности связывания с полипептидом-мишенью (или другой мишенью связывания) и идентифицируют кандидатов с повышенным, таким же пониженным связыванием или не связывающихся. Способы определения аффинности связывания хорошо известны в данной области. Аффинность связывания можно определять, используя анализ поверхностного плазмонного резонанса BIAcore, в котором выявляют различия в аффинности связывания примерно в 2 раза или выше. BIAcore особенно применим, когда исходное антитело уже связывается с относительно высокой аффинностью, например с KD примерно 10 нМ или ниже. Скрининг с использованием поверхностного плазмонного резонанса BIAcore описан в примерах в настоящей публикации.
Аффинность связывания можно определять, используя Kinexa Biocensor, сцинтилляционный анализ близости, ELISA, иммуноанализ ORIGEN (IGEN), гашение флуоресценции, перенос энергии флуоресценции и/или дрожжевой дисплей. Аффинность связывания также можно подвергать скринингу, используя подходящий биоанализ.
В некоторых вариантах заменяют аминокислоту в каждом положении в CDR (в некоторых вариантах поочередно) всеми 20 природными аминокислотами, используя известные в данной области способы мутагенеза (некоторые из которых описаны в настоящей публикации). При этом создают небольшие библиотеки клонов (в некоторых вариантах одну для каждого положения аминокислоты, которое анализируют), сложность каждой из которых составляет 20 членов (если в каждом положении производят замены всеми 20 аминокислотами).
В некоторых вариантах библиотека, подвергаемая скринингу, содержит замены в двух или более положениях, которые могут быть в одной и той же CDR или в двух или более CDR. Таким образом, библиотека может содержать замены в двух или более положениях в одной CDR. Библиотека может содержать замену в двух или более положениях в двух или более CDR. Библиотека может содержать замену в 3, 4, 5 или более положениях, при этом указанные положения находятся в двух, трех, четырех, пяти или шести CDR. Замена может быть получена с использованием кодонов с низкой вырожденностью. Смотри, например, таблицу 2 в Balint et al., (1993) Gene 137(1): 109-18).
CDR может представлять собой CDRH3 и/или CDRL3. CDR могут представлять собой одну или несколько из CDRL1, CDRL2, CDRL3, CDRH1, CDRH2 и/или CDRH3. CDR может представлять собой CDR согласно Kabat, CDR согласно Chothia или расширенную CDR.
Кандидаты с повышенным связыванием могут быть подвергнуты секвенированию, чтобы при этом идентифицировать мутант с заменой в CDR, который приводит к повышенной аффинности (также называемой «улучшенной» заменой). Кандидаты, которые связываются, также могут быть подвергнуты секвенированию, чтобы при этом идентифицировать замену в CDR, которая сохраняет связывание.
Могут быть проведены множественные раунды скрининга. Например, кандидаты (каждый из которых содержит аминокислотную замену в одном или нескольких положениях одной или нескольких CDR) с улучшенным связыванием также применимы для конструирования второй библиотеки, содержащей, по меньшей мере, исходную и замененную аминокислоту в каждом улучшаемом положении CDR (т.е. положении аминокислоты в CDR, мутация на основе замены в котором приводит к улучшенному связыванию). Получение и скрининг или селекция такой библиотеки обсуждается ниже.
Мутагенез на основе сканирования библиотеки также обеспечивает средства для характеристики CDR, поскольку частота клонов с повышенным связыванием, таким же связыванием, пониженным связыванием или не проявляющим связывания также обеспечивает информацию о значении каждого положения аминокислоты для стабильности комплекса антитело-антиген. Например, если положение в CDR сохраняет связывание при изменении на все 20 аминокислот, то такое положение идентифицируют как положение, которое, вероятно, не требуется для связывания антигена. Наоборот, если положение в CDR сохраняет связывание только в небольшом проценте случаев замены, то такое положение идентифицируют как положение, которое имеет важное значение для функционирования CDR. Таким образом, способы мутагенеза на основе сканирования библиотек дают информацию, имеющую отношение к положениям в CDR, которые могут быть заменены множеством разных аминокислот (включая все 20 аминокислот), и положениям в CDR, которые не могут быть изменены или которые могут быть заменены только не некоторые аминокислоты.
Кандидаты с повышенной аффинностью можно сочетать во второй библиотеке, которая включает в себя варианты с улучшенной аминокислотой, исходной аминокислотой в данном положении и может дополнительно включать в себя варианты с дополнительными заменами в данном положении в зависимости от комплексности библиотеки, которая требуется или которая возможна при использовании требуемого способа скрининга или селекции. Кроме того, при необходимости соседнее положение аминокислоты может быть рандомизировано, по меньшей мере, до двух или более аминокислот. Рандомизация соседних аминокислот может обеспечить возможность дополнительной конформационной гибкости в мутантной CDR, которая в свою очередь может обеспечить возможность или облегчить введение большего количества улучшающих мутаций. Библиотека также может содержать замену в положениях, которые не привели к повышенной аффинности в первом раунде скрининга.
Вторую библиотеку подвергали скринингу или селекции в отношении представителей библиотеки с улучшенной и/или измененной аффинностью связывания, используя любой способ, известный в данной области, включая скрининг с использованием анализа поверхностного плазмонного резонанса и селекцию с использованием любого способа селекции, известного в данной области, включая фаговый дисплей, дрожжевой дисплей и рибосомный дисплей.
Изобретение также охватывает слитые белки, содержащие один или несколько фрагментов или областей из антител (таких, как 9TL и 6G) или полипептидов согласно настоящему изобретению. В одном варианте предлагается слитый полипептид, который содержит, по меньшей мере, 10 следующих друг за другом аминокислот вариабельной области легкой цепи и/или, по меньшей мере, 10 аминокислот вариабельной области тяжелой цепи. В других вариантах предлагается слитый полипептид, который содержит, по меньшей мере, примерно 10, по меньшей мере, примерно 15, по меньшей мере, примерно 20, по меньшей мере, примерно 25 или, по меньшей мере, примерно 30 следующих друг за другом аминокислот вариабельной области легкой цепи; и/или, по меньшей мере, примерно 10, по меньшей мере, примерно 15, по меньшей мере, примерно 20, по меньшей мере, примерно 25 или, по меньшей мере, примерно 30 следующих друг за другом аминокислот вариабельной области тяжелой цепи. В другом варианте слитый полипептид содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи 9TL или 6G. В другом варианте слитый полипептид содержит одну или несколько CDR 9TL или 6G. В следующих вариантах слитый полипептид содержит CDR H3 и/или CDR L3 антитела 9TL или 6G. В целях настоящего изобретения слитый белок 9TL или 6G содержит одно или несколько антител 9TL или 6G соответственно и другую аминокислотную последовательность, с которой оно не связано в нативной молекуле, например гетерологичную последовательность или гомологичную последовательность из другой области. Примеры гетерологичных последовательностей включают без ограничения «метку», такую как FLAG-метка или 6His-метка. Метки хорошо известны в данной области.
Слитый полипептид может быть создан способами, известными в данной области, например, синтетически или с помощью рекомбинации. Обычно слитые белки согласно настоящему изобретению получают, обеспечивая экспрессию кодирующего его полинуклеотида с использованием основанных на рекомбинации способов, описанных в настоящей публикации, хотя их также можно получить другими способами, известными в данной области, включая, например, химический синтез.
Настоящее изобретение также относится к композициям, содержащим антитела или полипептиды, конъюгированные (например, связанные) с агентом, который способствует связыванию с твердой подложкой (таким, как биотин или авидин). Для упрощения описание в общем будет относиться к антителам, при этом подразумевается, что такие способы применимы к любому из связывающих Aβ вариантов, описанных в настоящей публикации. Конъюгирование в общем относится к связыванию таких компонентов, как описано в настоящей публикации. Связывание (которое обычно фиксирует такие компоненты в близкой ассоциации, по меньшей мере, для введения) может быть достигнуто любым из множества способов. Например, прямое взаимодействие между агентом и антителом возможно в том случае, когда каждый из них имеет заместитель, способный взаимодействовать с другим заместителем. Например, нуклеофильная группа, такая как аминогруппа или сульфгидрильная группа, на одном может быть способна взаимодействовать с содержащей карбонил группой, такой как ангидрид или галогенангидрид, или с алкильной группой, содержащей легко удаляемую группу (например, галогенид), на другом.
Антитело или полипептид согласно настоящему изобретению могут быть связаны с метящим агентом (альтернативно называемым «меткой»), таким как флуоресцирующая молекула, радиоактивная молекула или любые другие метки, известные в данной области. В данной области известны метки, которые обычно обеспечивают (либо прямо, либо опосредованно) сигнал.
Изобретение также относится к композициям (включая фармацевтические композиции) и наборам, содержащим антитело 9TL или 6G, и, как понятно из настоящего описания, к любым или всем антителам и/или полипептидам, описанным в настоящей публикации.
Антитела против пептида Aβ и полипептиды, имеющие нарушенную эффекторную функцию
В способах согласно изобретению используют антитела или полипептиды (включая фармацевтические композиции, содержащие антитела или полипептиды), которые специфично связываются с пептидом β-амилоида (Aβ) и имеют нарушенную эффекторную функцию. Антитела и полипептиды дополнительно характеризуются любым (одним или несколькими) из следующих свойств: (a) подавляют образование амилоидных бляшек у субъекта; (b) уменьшают амилоидные бляшки в глазах субъекта; (c) лечат, предотвращают, ослабляют один или несколько симптомов глазной болезни, включая без ограничения возрастную макулярную дегенерацию (как сухую, так и влажную), глаукому, диабетическую ретинопатию (включая макулярный отек) и другие родственные дегенеративные заболевания сетчатки; (d) в значительной степени вызывают защиту или восстановление функции сетчатки и (e) в значительной степени вызывают сохранение или восстановление остроты зрения.
Антитела и полипептиды, описанные в настоящей публикации, могут иметь требуемый профиль безопасности, например, композиции согласно изобретению не вызывают появления существенных или неприемлемых уровней или приводят к пониженному уровню одного или нескольких симптомов: кровотечения сосудов головного мозга (церебральной геморрагии); менингоэнцефалита (включая изменение при магнитно-резонансном сканировании); повышенного количества лейкоцитов в цереброспинальной жидкости; воспаления центральной нервной системы.
В используемом в настоящем описании смысле антитело или полипептид, имеющий «нарушенную эффекторную функцию» (термин используется взаимозаменяемо с терминами «иммунологически инертный» или «частично иммунологически инертный»), относится к антителам или полипептидам, которые не имеют какой-либо эффекторной функции или имеют пониженную активность или активности эффекторной функции (по сравнению с антителом или полипептидом, имеющим немодифицированную или встречающуюся в природе константную область), например, не имеют активности или имеют пониженную активность в одном или нескольких из следующих процессов: a) запуске опосредованного комплементом лизиса; b) стимуляции зависимой от антител опосредованной клетками цитотоксичности (ADCC) и с) активации микроглии. Активность эффекторной функции может быть снижена примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% и 100%. В некоторых вариантах антитело связывается с бета-амилоидным пептидом, не запуская существенный зависимый от комплемента лизис или опосредованное клетками разрушение мишени. Например, участок связывания Fc-рецептора в константной области может быть модифицирован или подвергнут мутации, чтобы устранить или уменьшить аффинность связывания с некоторыми Fc-рецепторами, такими как FcγRI, FcγRII и/или FcγRIII. Для упрощения будет приведено описание антител, но при этом подразумевают, что такие варианты также применимы к полипептидам. Используют систему нумерации EU (Kabat et al., Sequences of Proteins of Immunological Interest; 5th ed. Public Health Service, National Institutes of Healthy, Bethesda, Md., 1991) для указания того, какой аминокислотный остаток (остатки) константной области (например, антитела IgG) изменен или подвергнут мутации. Нумерацию можно использовать по отношению к конкретному типу антител (например, IgG1) или виду (например, человеку), понимая при этом, что сходные изменения могут быть осуществлены среди других типов антител и видов.
В некоторых вариантах антитело, которое специфично связывается с пептидом Aβ, содержит константную область тяжелой цепи, имеющую нарушенную эффекторную функцию. Константная область тяжелой цепи может иметь встречающуюся в природе последовательность или является вариантом. В некоторых вариантах аминокислотную последовательность встречающейся в природе константной области тяжелой цепи подвергают мутации, например осуществляют замену, инсерцию и/или делецию аминокислот, нарушая при этом эффекторную функцию константной области. В некоторых вариантах N-гликозилирование Fc-области константной области тяжелой цепи также может быть изменено, например, может быть полностью или частично удалено, тем самым можно нарушить эффекторную функцию константной области.
В некоторых вариантах эффекторную функцию нарушают удалением N-гликозилирования Fc-области (например, в домене CH2 IgG) анти-Aβ-пептида. В некоторых вариантах N-гликозилирование Fc-области удаляют в результате мутагенеза гликозилируемого аминокислотного остатка или фланкирующих остатков, которые являются частью последовательности узнавания при гликозилировании в константной области. Трипептидные последовательности аспарагин-X-серин (N-X-S), аспарагин-X-треонин (N-X-T) и аспарагин-X-цистеин (N-X-C), где X означает любую аминокислоту за исключением пролина, представляют собой последовательности узнавания для ферментативного связывания углеводного остатка с боковой цепью аспарагина в случае N-гликозилирования. Мутирование любой из аминокислот в трипептидных последовательностях в константной области дает негликозилированный IgG. Например, сайт N-гликозилирования N297 IgG1 и IgG3 человека может быть подвергнут мутации с получением A, D, Q, K или H. Смотри Tao et al., J. Immunology 143: 2595-2601 (1989); и Jefferis et al., Immunological Reviews 163: 59-76 (1998). Сообщалось, что IgG1 и IgG3 человека с заменой Asn-297 аминокислотами Gln, His или Lys не связываются с FcγRI человека и не активируют комплемент, при этом способность связывания C1q полностью утрачивается в случае IgG1 и сильно снижается в случае IgG3. В некоторых вариантах аминокислота N в трипептидных последовательностях мутирована с получением любой из аминокислот A, C, D, E, F, G, H, I, K, L, M, P, Q, R, S, T, V, W, Y. В некоторых вариантах аминокислота N в трипептидных последовательностях мутирована с получением консервативной замены. В некоторых вариантах аминокислота X в трипептидных последовательностях мутирована с получением пролина. В некоторых вариантах аминокислота S в трипептидных последовательностях мутирована до A, D, E, F, G, H, I, K, L, M, N, P, Q, R, V, W, Y. В некоторых вариантах аминокислота T в трипептидных последовательностях мутирована до A, D, E, F, G, H, I, K, L, M, N, P, Q, R, V, W, Y. В некоторых вариантах аминокислота C в трипептидных последовательностях мутирована до A, D, E, F, G, H, I, K, L, M, N, P, Q, R, V, W, Y. В некоторых вариантах аминокислота, следующая за трипептидом, мутирована с получением P. В некоторых вариантах N-гликозилирование в константной области удаляют ферментативно (например, с помощью N-гликозидазы F, как описано в примере 3, эндогликозидазы F1, эндогликозидазы F2, эндогликозидазы F3 и эндогликозидазы H). Удаление N-гликозилирования также можно осуществить в результате продуцирования антитела в клеточной линии, дефицитной по N-гликозилированию. Wright et al., J Immunol. 160(7): 3393-402 (1998).
В некоторых вариантах аминокислотный остаток, взаимодействующий с олигосахаридом, связанным с сайтом N-гликозилирования константной области, подвергают мутагенезу, чтобы уменьшить аффинность связывания с FcγRI. Например, F241, V264, D265 IgG3 человека могут быть подвергнуты мутагенезу. Смотри, Lund et al., J. Immunology 157: 4963-4969 (1996).
В некоторых вариантах эффекторную функцию нарушают посредством модификации областей, таких как 233-236, 297 и/или 327-331 IgG человека, как описано в PCT WO 99/58572 и Armour et al., Molecular Immunology 40: 585-593 (2003); Reddy et al., J. Immunology 164: 1925-1933 (2000). Антитела, описанные в PCT WO 99/58572 и Armour et al., содержат, кроме связывающего домена, направленного к молекуле-мишени, эффекторный домен, имеющий аминокислотную последовательность, по существу гомологичную всей или части константной области тяжелой цепи иммуноглобулина человека. Указанные антитела способны связывать молекулу-мишень без запуска существенного зависимого от комплемента лизиса или опосредованного клетками разрушения мишени. В некоторых вариантах эффекторный домен имеет пониженную аффинность по отношению к FcγRI, FcγRIIa и FcγRIII. В некоторых вариантах эффекторный домен способен специфично связывать FcRn и/или FcγRIIb. Такие варианты обычно основаны на химерных доменах, полученных из двух или более доменов CH2 тяжелой цепи иммуноглобулина человека. Модифицированные таким образом антитела являются особенно подходящими для применения в хронической терапии антителами, чтобы избежать воспалительных и других неблагоприятных реакций на обычную терапию антителами. В некоторых вариантах константная область тяжелой цепи антитела представляет собой тяжелую цепь IgG1 человека с любой из следующих мутаций: 1) A327A330P331 → G327S330S331; 2) E233L234L235G236 → P233V234A235 с делетированным G236; 3) E233L234L235 → P233V234A235; 4) E233L234L235G236A327A330P331 → P233V234A235G327S330S331 с делетированным G236; 5) E233L234L235A327A330P331 → P233V234A235G327S330S331; и 6) N297 → A297 или любой другой аминокислотой за исключением N. В некоторых вариантах константная область тяжелой цепи антитела представляет собой тяжелую цепь IgG2 человека со следующими мутациями: A330P331 → S330S331. В некоторых вариантах константная область тяжелой цепи антитела представляет собой тяжелую цепь IgG4 человека с любой из следующих мутаций: E233F234L235G236 → P233V234A235 с делетированным G236; E233F234L235 → P233V234A235 и S228L235 → P228E235.
Константную область антител также можно модифицировать, чтобы нарушить активацию комплемента. Например, активация комплемента в случае IgG-антител после связывания C1-компонента комплемента может быть снижена в результате мутирования аминокислотных остатков в константной области в C1-связывающем мотиве (например, в мотиве связывания C1q). Сообщалось, что Ala-мутация для каждого из остатков D270, K322, P329, P331 IgG1 человека значительно снижала способность антител связываться с C1q и активировать комплемент. В случае мышиного IgG2b мотив связывания C1q составляют остатки E318, K320 и K322. Idusogie et al., J. Immunology 164: 4178-4184 (2000); Duncan et al., Nature 322: 738-740 (1988).
Полагают, что мотив связывания C1q: E318, K320 и K322, идентифицированный для мышиного IgG2b, является общим для других изотипов антител. Duncan et al., Nature 322: 738-740 (1988). Активность связывания C1q в случае IgG2b может быть устранена в результате замены любого одного из трех указанных остатков остатком, имеющим неподходящую функциональную группу на своей боковой цепи. Необязательно заменять ионные остатки только Ala, чтобы устранить связывание C1q. Также можно использовать другие алкилзамещенные неионные остатки, такие как Gly, Ile, Leu или Val, или такие ароматические неполярные остатки, как Phe, Tyr, Trp и Pro вместо любого одного из трех остатков, чтобы устранить связывание Clq. Кроме того, также можно использовать такие полярные неионные остатки, как Ser, Thr, Cys, и Met, вместо остатков 320 и 322, но не вместо 318, чтобы устранить активность связывания Clq.
Изобретение также относится к антителам, имеющим нарушенную эффекторную функцию, при этом антитело имеет модифицированную шарнирную область. Аффинность связывания IgG человека по отношению к Fc-рецепторам можно модулировать в результате модификации шарнирной области. Canfield et al., J. Exp. Med. 173: 1483-1491 (1991); Hezareh et al., J. Virol. 75: 12161-12168 (2001); Redpath et al., Human Immunology 59: 720-727 (1998). Специфичные аминокислотные остатки могут быть мутированы или делетированы. Модифицированная шарнирная область может содержать полную шарнирную область, полученную из антитела, относящегося к другому классу или подклассу антител, чем антитело, из которого происходит домен CH1. Например, константный домен (CH1) антитела класса IgG может быть связан с шарнирной областью антитела класса IgG4. Альтернативно, новая шарнирная область может содержать часть природного шарнира или повторяющуюся единицу, при этом каждая повторяющаяся единица в повторе получена из природной шарнирной области. В некоторых вариантах природную шарнирную область изменяют, превращая один или несколько остатков цистеина в нейтральный остаток, такой как аланин, или превращая соответствующим образом расположенные остатки в остатки цистеина. Патент США № 5677425. Такие изменения осуществляют, используя известные в данной области способы химии белков и предпочтительно способы генетической инженерии, и как описано в настоящей публикации.
Полипептиды, которые специфично связываются с пептидом Aβ и которые слиты с константной областью тяжелой цепи, имеющей нарушенную эффекторную функцию, также могут быть использованы в способах, описанных в настоящей публикации. В некоторых вариантах полипептид содержит последовательность, полученную из антитела 9TL или его вариантов, показанных в таблице 3. В некоторых вариантах полипептид получен из однодоменного антитела, которое связывается с пептидом Aβ. Однодоменные антитела могут быть созданы с использованием способов, известных в данной области. Omidfar et al., Tumour Biol. 25: 296-305 (2004); Herring et al., Trends in Biotechnology 21: 484-489 (2003).
В некоторых вариантах антитело или полипептид не являются F(ab')2-фрагментом. В некоторых вариантах антитело или полипептид не являются Fab-фрагментом. В некоторых вариантах антитело или полипептид не являются одноцепочечным антителом scFv. В некоторых вариантах антитело или полипептид представляет собой пегилированный F(ab')2-фрагмент. В некоторых вариантах антитело или полипептид представляет собой пегилированный Fab-фрагмент. В некоторых вариантах антитело или полипептид представляет собой пегилированное одноцепочечное антитело scFv.
Также можно использовать другие способы получения антител, имеющих нарушенную эффекторную функцию, известные в данной области.
Антитела и полипептиды с модифицированными константными областями можно тестировать в одном или нескольких анализах, чтобы повысить уровень снижения эффекторной функции в биологической активности по сравнению с исходным антителом. Например, способность антитела или полипептида с измененной Fc-областью связывать комплемент или Fc-рецепторы (например, Fc-рецепторы микроглии), или с измененной шарнирной областью можно оценить, используя анализы, раскрытые в настоящем описании, а также любой известный в данной области анализ. PCT WO 99/58572; Armour et al., Molecular Immunology 40: 585-593 (2003); Reddy et al., J. Immunology 164: 1925-1933 (2000); Song et al., Infection and Immunity 70: 5177-5184 (2002).
В некоторых вариантах антитело, которое специфично связывается с β-амилоидным пептидом, представляет собой поликлональное антитело. В некоторых вариантах антитело является моноклональным антителом. В некоторых вариантах антитело является человеческим антителом. В некоторых вариантах антитело является химерным антителом. В некоторых вариантах антитело является гуманизированным антителом. В некоторых вариантах антитело является приматизированным антителом. Смотри, например, Yocum et al., J. Rheumatol. 25: 1257-62 (1998); Bugelski et al., Human and Experimental Toxicology 19: 230-243 (2000). В некоторых вариантах антитело деиммунизировано в результате мутации, так что антитело не активирует иммунную систему человека. Смотри, например, Nanus, et al., J. Urology 170: S84-S89 (2003).
В используемом в настоящем описании смысле пептид Aβ включает в себя любые фрагменты продуктов ферментативного расщепления белка-предшественника амилоида. Например, пептид Aβ включает в себя любые фрагменты Aβ1-40, Aβ1-42 или Aβ1-43; и пептиды, которые укорочены на разное количество аминокислот на N-конце или C-конце, Aβ1-40, Aβ1-42 или Aβ1-43. Нумерация аминокислот, используемая в настоящем описании, основана на нумерации для Aβ1-43 (SEQ ID NO: 17).
В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 1-16 пептида Aβ. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 16-28 пептида Aβ. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 28-40 пептида Aβ1-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 28-42 пептида Aβ1-42. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 28-43 пептида Aβ1-43. В некоторых вариантах антитело или полипептид специфично связывается с пептидом Aβ, не связываясь с полноразмерным белком-предшественником амилоида (APP). В некоторых вариантах антитело или полипептид специфично связывается с агрегированной формой Aβ, не связываясь с растворимой формой. В некоторых вариантах антитело или полипептид специфично связывается с растворимой формой Aβ, не связываясь с агрегированной формой. В некоторых вариантах антитело или полипептид специфично связывается как с агрегированной формой, так и с растворимой формой Aβ. Антитела, которые связываются с различными агрегированными формами Aβ, известны в данной области, например, антитела, которые связываются с полученными из амилоида-бета способными к диффузии лигандами (ADDL); антитела, которые связываются с фибриллами и/или отложением амилоида. WO 03/104437, публикация патента США № 2003/0147887, публикация патента США № 2004/0219146.
В некоторых вариантах антитело или полипептид содержит одну, две или три CDR из легкой цепи иммуноглобулина 3D6 (SEQ ID NO: 2 в публикациях патентов США № 2003/0165496 или 2004/0087777) и/или одну, две или три CDR из тяжелой цепи иммуноглобулина 3D6 (SEQ ID NO: 4 в публикациях патентов США № 2003/0165496 или 2004/0087777). В некоторых вариантах антитело или полипептид содержит вариабельную область тяжелой цепи, которая указана в SEQ ID NO: 8 в публикации патента США № 2003/0165496, и вариабельную область легкой цепи, которая указана в SEQ ID NO: 5 в публикации патента США № 2003/0165496. В некоторых вариантах антитело или полипептид содержит вариабельную область тяжелой цепи, которая указана в SEQ ID NO: 12 в публикации патента США № 2003/0165496, и вариабельную область легкой цепи, которая указана в SEQ ID NO: 11 в публикации патента США № 2003/0165496. В некоторых вариантах антитело или полипептид содержит одну, две или три CDR из легкой цепи иммуноглобулина 10D5 (SEQ ID NO: 14 в публикациях патентов США № 2003/0165496 или 2004/0087777) и/или одну, две или три CDR из тяжелой цепи иммуноглобулина 10D5 (SEQ ID NO: 16 в публикациях патентов США № 2003/0165496 или 2004/0087777).
В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 33-40 Aβ1-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом на Aβ1-40, который включает в себя аминокислоты 35-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом на Aβ1-40, который включает в себя аминокислоты 36-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом на Aβ1-40, который включает в себя аминокислоты 39 и/или 40. В некоторых вариантах антитело или полипептид специфично связывается с Aβ1-40, но специфично не связывается с Aβ1-42 и/или Aβ1-43. В некоторых вариантах антитело или полипептид представляет собой антитело 9TL или антитело или полипептид, полученный из 9TL, описанный в настоящей публикации. В некоторых вариантах антитело или полипептид конкурентно ингибирует связывание антитела 9TL и/или антитела или полипептида, полученного из 9TL, с Aβ1-40. В некоторых вариантах антитело не является антителом 2286, описанным в PCT WO 2004/032868. В других вариантах антитело или полипептид представляет собой антитело 6G или антитело или полипептид, полученный из 6G, описанного в настоящей публикации. В некоторых вариантах антитело или полипептид конкурентно ингибирует связывание антитела 6G и/или антитела или полипептида, полученного из 6G, с Aβ1-40 и Aβ1-42. В некоторых вариантах антитело не является антителом 2294, описанным в US 2004/0146512 и WO 04/032868. Как описано в WO2006118959, антитело 2294 связывается с эпитопом очень сходно с антителом 6G.
Способы получения антител и полипептидов известны в данной области и описаны в настоящей публикации.
Анализы конкуренции можно использовать для определения того, связывают ли два антитела один и тот же эпитоп, узнавая идентичные или стерически перекрывающиеся эпитопы, или одно антитело конкурентно ингибирует связывание другого антитела с антигеном. Такие анализы известны в данной области. Обычно антиген иммобилизуют на многолуночном планшете и измеряют способность немеченых антител блокировать связывание меченых антител. Обычными метками для таких анализов конкуренции являются радиоактивные метки или ферментативные метки.
Полинуклеотиды, векторы и клетки-хозяева
Изобретение также относится к изолированным полинуклеотидам, кодирующим антитела и полипептиды согласно изобретению (включая антитело, содержащее полипептидные последовательности вариабельных областей легкой цепи и тяжелой цепи, показанные на фигурах 1 и 8), и векторам и клеткам-хозяевам, содержащим полинуклеотид.
Соответственно, изобретение относится к полинуклеотидам (или композициям, включая фармацевтические композиции), содержащим полинуклеотиды, кодирующие любой из следующих продуктов: (a) антитело 9TL или 6G или их варианты, показанные в таблицах 3 и 8; (b) фрагмент или область антитела 9TL или 6G или их вариантов, показанных в таблицах 3 и 8; (c) легкую цепь антитела 9TL или 6G или их вариантов, показанных в таблицах 3 и 8; (d) тяжелую цепь антитела 9TL или 6G или их вариантов, показанных в таблицах 3 и 8; (e) одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 9TL или 6G или их вариантов, показанных в таблицах 3 и 8; (f) одну или несколько CDR (одну, две, три, четыре, пять или шесть CDR) антитела 9TL или 6G или их вариантов, показанных в таблицах 3 и 8; (g) CDR H3 из тяжелой цепи антитела 9TL или 6G; (h) CDR L3 из легкой цепи антитела 9TL или 6G или их вариантов, показанных в таблицах 3 и 8; (i) три CDR из легкой цепи антитела 9TL или 6G или их вариантов, показанных в таблицах 3 и 8; (j) три CDR из тяжелой цепи антитела 9TL или 6G или их вариантов, показанных в таблицах 3 и 8; (k) три CDR из легкой цепи и три CDR из тяжелой цепи антитела 6G или его вариантов, показанных в таблицах 3 и 8; и (l) антитело, содержащее любой из компонентов (b)-(k). В некоторых вариантах полинуклеотид включает в себя любой или оба полинуклеотида, показанных в SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 34 и SEQ ID NO: 35.
В другом аспекте изобретение относится к полинуклеотидам, кодирующим любое из антител (включая фрагменты антитела) и полипептидов, описанных в настоящей публикации, такие как антитела и полипептиды, имеющие нарушенную эффекторную функцию. Полинуклеотиды могут быть получены способами, известными в данной области.
В другом аспекте изобретение относится к композициям (таким, как фармацевтические композиции), содержащим любой из полинуклеотидов согласно изобретению. В некоторых вариантах композиция содержит экспрессирующий вектор, содержащий полинуклеотид, кодирующий антитело 9TL, которое описано в настоящей публикации. В другом варианте композиция содержит экспрессирующий вектор, содержащий полинуклеотид, кодирующий любое из антител или полипептидов, описанных в настоящей публикации. В следующих вариантах композиция содержит любой или оба полинуклеотида, показанных в SEQ ID NO: 9 и SEQ ID NO: 10. Экспрессирующие векторы и введение композиций полинуклеотидов описаны далее в настоящей публикации.
В другом аспекте изобретение относится к способу получения любого из полинуклеотидов, описанных в настоящей публикации.
Полинуклеотиды, комплементарные любым таким последовательностям, также входят в объем настоящего изобретения. Полинуклеотиды могут быть однонитевыми (кодирующими или антисмысловыми) или двунитевыми и могут представлять собой молекулы ДНК (геномной, кДНК или синтетической) или РНК. Молекулы РНК включают молекулы гяРНК, которые содержат интроны и соответствуют молекуле ДНК один в один, и молекулы мРНК, которые не содержат интронов. Дополнительные кодирующие или некодирующие последовательности могут, но не обязательно, присутствовать в полинуклеотиде согласно настоящему изобретению, и полинуклеотид может, но не обязательно, быть связан с другими молекулами и/или веществами подложки.
Полинуклеотиды могут содержать нативную последовательность (т.е. эндогенную последовательность, которая кодирует антитело или его часть) или могут содержать вариант такой последовательности. Полинуклеотидные варианты содержат одну или несколько замен, добавлений, делеций и/или инсерций так, чтобы иммунореактивность кодируемого полипептида не была снижена по сравнению с нативной иммунореактивной молекулой. Влияние на иммунореактивность кодируемого полипептида в общем можно оценить, как описано в настоящей публикации. Варианты предпочтительно имеют, по меньшей мере, примерно 70% идентичность, более предпочтительно, по меньшей мере, примерно 80% идентичность и наиболее предпочтительно, по меньшей мере, примерно 90% идентичность с полинуклеотидной последовательностью, которая кодирует нативное антитело или его часть.
Говорят, что две полинуклеотидные или полипептидные последовательности «идентичны», если последовательность нуклеотидов или аминокислот в двух последовательностях одинакова при выравнивании в отношении максимального соответствия, как описано ниже. Сравнения между двумя последовательностями обычно осуществляют, сравнивая последовательности на протяжении окна сравнения, чтобы идентифицировать и сравнить локальные области сходства последовательностей. «Окно сравнения» в используемом в настоящем описании смысле относится к участку длиной, по меньшей мере, примерно 20 следующих друг за другом положений, обычно от 30 до примерно 75, от 40 до примерно 50, на котором последовательность можно сравнить с эталонной последовательностью с таким же количеством следующих друг за другом положений после того, как две последовательности оптимально выровнены.
Оптимальное выравнивание последовательностей для сравнения можно осуществить, используя программу Megalign в пакете компьютерных программ по биоинформатике Lasergene (DNASTAR, Inc., Madison, WI), применяя параметры по умолчанию. Указанная программа осуществляет несколько схем выравнивания, описанных в следующих публикациях: Dayhoff, M. O. (1978) A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M. O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J., 1990, Unified Approach to Alignment and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D. G. and Sharp, P.M., 1989, CABIOS 5:151-153; Myers, E.W. and Muller W., 1988, CABIOS 4:11-17; Robinson, E. D., 1971, Comb. Theor. 11:105; Santou, N., Nes, M., 1987, Mol. Biol. Evol. 4:406-425; Sneath, P.H.A. and Sokal, R. R., 1973, Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and Lipman, D. J., 1983, Proc. Natl. Acad. Sci. USA 80:726-730.
Предпочтительно «идентичность последовательностей в процентах» определяют сравнением двух оптимально выровненных последовательностей на протяжении окна сравнения длиной, по меньшей мере, 20 положений, при этом часть полинуклеотидной или полипептидной последовательности в окне сравнения может содержать добавления или делеции (т.е. пробелы), составляющие 20 процентов или меньше, обычно от 5 до 15 процентов или от 10 до 12 процентов, по сравнению с эталонными последовательностями (которые не содержат добавлений или делеций) в случае оптимального выравнивания двух последовательностей. Процент рассчитывают, определяя количество положений, в которых идентичное основание нуклеиновой кислоты или аминокислотный остаток встречаются в обеих последовательностях, получая количество совпадающих положений, делят количество совпадающих положений на общее количество положений в эталонной последовательности (т.е. на размер окна) и умножают результаты на 100, получая процент идентичности последовательностей.
Варианты также или альтернативно могут быть гомологичны нативному гену или его части или его комплементу. Такие варианты полинуклеотидов способны гибридизоваться в условиях умеренной жесткости с встречающейся в природе последовательностью ДНК, кодирующей нативное антитело (или с комплементарной последовательностью).
Подходящие «условия умеренной жесткости» включают в себя предварительную промывку в растворе 5 X SSC, 0,5% SDS, 1,0 мМ EDTA (pH 8,0); гибридизацию при 50°C-65°C, 5 X SSC, в течение ночи; затем промывку два раза при 65°C в течение 20 минут 2X, 0,5X и 0,2X SSC, содержащим 0,1% SDS.
В используемом в настоящем описании смысле «очень жесткие условия» или «условия высокой жесткости» означают, что: (1) используют низкую ионную силу и высокую температуру для промывки, например 0,015 М хлорид натрия/0,0015 М цитрат натрия/0,1% додецилсульфат натрия при 50°C; (2) используют денатурирующее средство во время гибридизации, такое как формамид, например, 50% (об./об.) формамид с 0,1% бычьим сывороточным альбумином/0,1% фиколом/0,1% поливинилпирролидоном/50 мМ натрий-фосфатным буфером при pH 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°C; или (3) используют 50% формамид, 5 X SSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфат натрия (pH 6,8), 0,1% пирофосфат натрия, 5 x раствор Денхардта, обработанную ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% SDS и 10% сульфат декстрана при 42°C, с промывками при 42°C в 0,2 X SSC (хлорид натрия/цитрат натрия) и 50% формамиде при 55°C с последующей очень жесткой промывкой, состоящей из 0,1 X SSC, содержащего EDTA, при 55°C. Специалисту в данной области будет понятно, как скорректировать температуру, ионную силу и т.д., которые необходимо подобрать для таких факторов, как длина зонда и тому подобные.
Специалистам в данной области будет понятно, что в результате вырожденности генетического кода существует много нуклеотидных последовательностей, которые кодируют полипептид, описанный в данной публикации. Некоторые из таких полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью какого-либо нативного гена. Таким образом, полинуклеотиды, которые варьируют вследствие различий в использовании кодонов, специально включены в настоящее изобретение. Кроме того, аллели генов, содержащие полинуклеотидные последовательности, представленные в настоящем описании, входят в объем настоящего изобретения. Аллели представляют собой эндогенные гены, которые изменены в результате одной или нескольких мутаций, таких как делеции, добавления и/или замены нуклеотидов. Получаемые в результате мРНК и белок могут, но не обязательно, иметь измененную структуру или функцию. Аллели могут быть идентифицированы с использованием стандартных способов (таких, как гибридизация, амплификация и/или сравнение последовательностей в базе данных).
Полинуклеотиды согласно настоящему изобретению могут быть получены с использованием химического синтеза, способов рекомбинации или ПЦР. Способы химического синтеза полинуклеотидов хорошо известны в данной области и не требуют подробного описания в данной публикации. Специалист в данной области может использовать последовательности, предлагаемые в настоящем изобретении, и коммерческий синтезатор ДНК для получения требуемой последовательности ДНК.
РНК может быть получена с использованием изолированной ДНК в подходящем векторе, который встраивают в подходящую клетку-хозяина. После репликации в клетке и транскрипции ДНК в РНК полученная РНК может быть выделена способами, хорошо известными специалистам в данной области, которые описаны, например, в Sambrook et al. (1989).
Подходящие клонирующие векторы могут быть сконструированы согласно стандартным способам или могут быть выбраны из большого количества клонирующих векторов, доступных в данной области.
Экспрессирующие векторы, в общем, представляют собой реплицируемые полинуклеотидные конструкции, которые содержат полинуклеотид согласно изобретению. Предполагается, что экспрессирующий вектор должен реплицироваться в клетках-хозяевах либо в виде эписом, либо в виде составной части хромосомной ДНК. Подходящие экспрессирующие векторы включают без ограничения плазмиды, вирусные векторы, включая аденовирусы, аденоассоциированные вирусы, ретровирусы, космиды и экспрессирующий вектор (векторы), описанный в публикации PCT № WO 87/04462.
Векторы, содержащие представляющие интерес полинуклеотиды, могут быть введены в клетку-хозяина любым из множества подходящих способов, включая электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; бомбардировку микрочастицами; липофекцию и инфекцию (например, в том случае, когда вектором является инфекционный агент, такой как вирус вакцинии).
Изобретение также относится к клеткам-хозяевам, содержащим любой из полинуклеотидов или векторов, описанных в данной публикации. Любые клетки-хозяева, способные сверхэкспрессировать гетерологичные ДНК, можно использовать в целях выделения генов, кодирующих представляющее интерес антитело, полипептид или белок. Не ограничивающие примеры клеток-хозяев млекопитающих включают без ограничения клетки COS, HeLa и CHO. Смотри также публикацию PCT № WO 87/04462. Подходящие клетки-хозяева, отличные от клеток млекопитающих, включают прокариоты (такие, как E. coli или B. subtillis) и дрожжи (такие, как S. cerevisae, S. pombe или K. lactis). Предпочтительно клетки-хозяева экспрессируют кДНК на уровне, примерно в 5 раз более высоком, более предпочтительно в 10 раз более высоком, еще более предпочтительно в 20 раз более высоком, чем уровень для соответствующего представляющего интерес эндогенного антитела или белка, если таковой присутствует в клетках-хозяевах. Скрининг клеток-хозяев в отношении специфичного связывания с Aβ1-40 осуществляют с помощью иммуноанализа или FACS. Может быть идентифицирована клетка, сверхэкспрессирующая представляющее интерес антитело или белок.
Диагностические применения полученных из 9TL или 6G антител и анти-Aβ-антител, имеющих нарушенную эффекторную функцию
Антитело 9TL или 6G, которое связывается с C-концом одного или нескольких пептидов Aβ, можно использовать для идентификации или выявления присутствия или отсутствия целевого Aβ в глазах. Для упрощения в общем будут упоминаться антитела 9TL или 6G, при этом подразумевается, что такие способы применимы к любому из связывающих Aβ вариантов (таких, как полипептиды), описанные в настоящей публикации. Выявление в общем включает в себя осуществление контакта биологического образца с антителом, описанным в настоящей публикации, которое связывается с Aβ1-40, и образование комплекса между Aβ1-40 и антителом (например, 9TL), которое специфично связывается с Aβ1-40. Образование такого комплекса может быть осуществлено in vitro или in vivo. Термин «выявление» в используемом в настоящем описании смысле включает в себя качественную и/или количественную регистрацию (измерение уровней) в сравнении или без сравнения с контролем.
Любой из множества известных способов можно использовать для выявления, включая без ограничения иммуноанализ с использованием антитела, которое связывает полипептид, например твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (РИА) и тому подобные; и функциональный анализ кодируемого полипептида, например анализ активности связывания или ферментный анализ. В некоторых вариантах антитело метят регистрируемой меткой. Другие варианты известны в данной области и описаны в настоящей публикации.
Антитела и полипептиды согласно изобретению можно использовать для выявления, диагностики и мониторинга глазного заболевания, состояния или расстройства, при котором имеет место нарушенная или аномальная экспрессия Aβ или βAPP. Таким образом, в некоторых вариантах изобретение относится к способам, которые включают в себя осуществление контакта образца, взятого у человека, у которого подозревается наличие измененной или аномальной экспрессии Aβ в глазах, с антителом или полипептидом согласно изобретению и определение того, отличается ли уровень пептида Aβ от уровня в контроле или в сравниваемом образце. В других вариантах изобретение относится к способам, включающим в себя осуществление контакта образца, взятого у человека, и определение уровня экспрессии Aβ.
Для диагностических применений антитело можно метить регистрируемым остатком, включая без ограничения радиоактивные изотопы, флуоресцирующие метки и различные фермент-субстратные метки. Способы конъюгирования меток с антителом известны в данной области. В другом варианте осуществления изобретения антитела согласно изобретению не нужно метить и их присутствие можно регистрировать, используя меченое антитело, которое связывается с антителами согласно изобретению.
Антитела согласно настоящему изобретению можно использовать в любом известном способе анализа, таком как анализы конкурентного связывания, прямые или непрямые анализы типа «сэндвич» и анализы иммунопреципитации. Zola, A Monoclonal Antibodies: A Manual of Techniques, pp. 147-158, (CRC Press, Inc. 1987).
Антитела также можно использовать в диагностических анализах in vivo, например, для визуализации in vivo. В общем, антитело метят радионуклидом (таким, как 111In, 99Tc, 14C, 131I, 125I или 3H), так что представляющие интерес клетки или ткань могут быть локализованы с использованием иммуносцинтиографии. Антитело также можно использовать в качестве красителя при исследовании патологии, следуя методикам, хорошо известным в данной области.
Анти-Aβ-антитела, имеющие нарушенную эффекторную функцию, можно использовать для измерения функции сетчатки для диагностики субъекта, для которого существует риск или у которого диагностировано дегенеративное заболевание глаз, связанное с сетчаткой, и для оценки успешности лечения и стадии заболевания. В некоторых вариантах анти-Aβ-антитело, имеющее нарушенную эффекторную функцию, вводят субъекту и измеряют уровень Aβ в плазме, при этом увеличение уровня Aβ в плазме свидетельствует о наличии и/или уровне амилоидной нагрузки в головном мозге субъекта. Такие способы можно применять для мониторинга эффективности лечения и стадии заболевания и для определения будущих доз и частоты введения. Антитела, имеющие нарушенную эффекторную функцию, могут иметь улучшенный профиль безопасности и имеют преимущества при таких диагностических применениях.
Способы применения анти-Aβ-антитела для терапевтических целей
Антитела (включая полипептиды), полинуклеотиды и фармацевтические композиции, описанные в настоящей публикации, можно использовать в способах лечения, профилактики и подавления развития глазной болезни, характеризуемой связанной с сетчаткой дегенерацией. Способы включают в себя введение субъекту эффективного количества антитела, которое специфично связывается с белком или отложением белка или полинуклеотидом, кодирующим антитело, при этом антитело имеет нарушенную эффекторную функцию.
Антитела (включая полипептиды), полинуклеотиды и фармацевтические композиции, описанные в настоящей публикации, можно использовать в способах лечения, профилактики и подавления развития возрастной макулярной дегенерации и других глазных болезней, таких как возрастная макулярная дегенерация (как влажная, так и сухая), глаукома, диабетическая ретинопатия (включая диабетический макулярный отек), разрывы в оболочке Бруха, миопическая дегенерация, глазные опухоли и другие родственные дегенеративные заболевания сетчатки. Такие способы включают в себя введение субъекту антител, полипептидов или полинуклеотидов или фармацевтической композиции. В профилактических применениях фармацевтические композиции или лекарственные средства вводят пациенту, восприимчивому или иным образом подверженному риску развития глазной болезни, в количестве, достаточном для устранения или уменьшения риска, уменьшения тяжести или замедления наступления болезни, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, имеющие место при развитии заболевания. В случае терапевтических применений композиции или лекарственные средства вводят пациенту, у которого предполагается или который уже страдает от такого заболевания, в количестве, достаточном для исцеления или, по меньшей мере, частично задержки симптомов заболевания (биохимических, гистологических и/или поведенческих), включая его осложнения и промежуточные патологические фенотипы при развитии заболевания.
Осложнения и промежуточные патологические фенотипы возрастной макулярной дегенерации включают мощные диффузные отложения под пигментным эпителием сетчатки (ПЭС), богатые липидами друзоподобные отложения, утолщение оболочки Бруха, очаговые области атрофии ПЭС и хориоидальную неоваскуляризацию.
Изобретение также относится к способам замедления развития дегенерации сетчатки и/или ее симптомов у субъекта, включающим в себя введение субъекту эффективной дозы фармацевтической композиции, содержащей антитело, полипептид или полинуклеотид, описанный в настоящей публикации.
Настоящее изобретение также относится к способам восстановления или защиты функции сетчатки у субъекта, включающим в себя введение субъекту эффективной дозы фармацевтической композиции, содержащей антитело, полипептид или полинуклеотид, описанный в настоящей публикации.
Настоящее изобретение также относится к способам уменьшения амилоидных бляшек и/или снижения или замедления накопления Aβ в сетчатке субъекта, включающим в себя введение субъекту эффективной дозы фармацевтической композиции, содержащей антитело, полипептид или полинуклеотид, описанный в настоящей публикации.
Настоящее изобретение также относится к способам удаления или очистки от амилоидных бляшек и/или от накопления Aβ в сетчатке субъекта, включающим в себя введение субъекту эффективной дозы фармацевтической композиции, содержащей антитело, полипептид или полинуклеотид, описанный в настоящей публикации. В некоторых вариантах амилоидные бляшки находятся в головном мозге субъекта.
Настоящее изобретение также относится к способам уменьшения количества пептида Aβ в ткани сетчатки, ингибирования и/или снижения накопления пептида Aβ в ткани сетчатки, включающим в себя введение субъекту эффективной дозы фармацевтической композиции, содержащей антитело, полипептид или полинуклеотид, описанный в настоящей публикации. Полипептид Aβ может быть в растворимой, олигомерной или осажденной форме. Олигомерная форма Aβ может состоять из 2-50 полипептидов Aβ, которые могут представлять собой смесь полноразмерных пептидов 1-40 и 1-42 и/или любого укороченного варианта указанных пептидов.
Изобретение также относится к способам улучшения или возвращения к нормальному состоянию в случае дегенерации при глазных болезнях, включающим в себя введение субъекту эффективной дозы фармацевтической композиции, содержащей антитело, полипептид или полинуклеотид, описанный в настоящей публикации.
Изобретение также относится к способам лечения или профилактики заболеваний, ассоциированных с дегенерацией сетчатки, включающим в себя введение субъекту эффективной дозы фармацевтической композиции, содержащей антитело, которое специфично связывается с бета-амилоидным пептидом или агрегированной формой бета-амилоидного пептида, при этом антитело содержит Fc-область с изменением по сравнению с встречающейся в природе Fc-областью, причем изменение приводит к нарушенной эффекторной функции, и введение антитела меньше вызывает церебральные кровотечения, чем введение антитела без такого изменения.
Способы, описанные в настоящей публикации (включая профилактику или терапию), могут быть осуществлены посредством прямой инъекции в одной временной точке или нескольких временных точках в одно или несколько мест. Введение также может быть осуществлено почти одновременно в несколько мест. Частота введения может быть определена и скорректирована в ходе терапии и зависит от достижения требуемых результатов. В некоторых случаях могут быть подходящими препараты длительного непрерывного высвобождения антител (включая полипептиды), полинуклеотидов и фармацевтических композиций согласно изобретению. Различные препараты и устройства для достижения длительного высвобождения известны в данной области.
Пациенты, субъекты и индивидуумы включают млекопитающих, таких как человек, крупный рогатый скот, лошади, собаки, кошки, свиньи и овцы. Субъектом предпочтительно является человек, и он может быть поражен или не поражен заболеванием или у него в данный момент проявляются симптомы заболевания. Способы согласно изобретению можно применять профилактически на общей популяции без необходимости в какой-либо оценке риска для пациента. Способы согласно изобретению применимы для индивидуумов, которые повергаются известному генетическому риску возрастной макулярной дегенерации. Такие индивидуумы включают пациентов, имеющих больных родственников, и пациентов, риск для которых определяют в анализе, основанном на генетических и биохимических маркерах.
Фармацевтическая композиция, которая может быть использована в указанных выше способах, включает в себя любое из антител, полипептидов и/или полинуклеотидов, описанных в настоящей публикации. В некоторых вариантах антитело представляет собой антитело 9TL или 6G или их варианты, показанные в таблицах 3 и 8. В некоторых вариантах антитело представляет собой антитело, которое специфично связывается с пептидом Aβ и содержит константную область, имеющую нарушенную эффекторную функцию.
Введение и дозы
Антитело предпочтительно вводят млекопитающему в носителе, предпочтительно в фармацевтически приемлемом носителе. Подходящие носители и их препараты описаны в Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; и Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing, 2000. Обычно в препарате используют подходящее количество фармацевтически приемлемой соли, чтобы сделать препарат изотоничным. Примеры носителя включают физиологический раствор соли, раствор Рингера и раствор декстрозы. Значение pH раствора предпочтительно составляет примерно от 5 до примерно 8 и более предпочтительно примерно от 7 до примерно 7,5. Дополнительные носители включают препараты для длительного высвобождения, такие как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, такие матрицы могут быть в виде изделий с определенной формой, например пленок, липосом или микрочастиц. Специалистам в данной области будет понятно, что некоторые носители могут быть более предпочтительными в зависимости, например, от пути введения и концентрации вводимых антител.
Антитело может быть введено млекопитающему посредством инъекции (например, системной, внутривенной, внутрибрюшинной, подкожной, внутримышечной, внутрипортальной, интрацеребральной, интрацеребровентрикулярной и интраназальной) или другими способами, такими как инфузия, которая обеспечивает доставку в кровоток в эффективной форме. Антитело также можно вводить с использованием методики изолированной перфузии, например изолированной перфузии ткани, чтобы оказать локальное терапевтическое воздействие. Кроме того, антитело согласно настоящему изобретению можно вводить в глаза местно или в форме инъекции, такой как инъекция в стекловидное тело, инъекция под сетчатку или билатеральная инъекция. Дополнительную информацию о введении соединений в глаза можно найти в Tolentino et al., Retina 24 (2004) 132-138; Reich et al., Molecular vision 9 (2003) 210-216.
Эффективные дозы и схемы введения антитела можно определить эмпирически, и проведение таких определений известно специалистам в данной области. Специалистам в данной области будет понятно, что доза антитела, которую необходимо ввести, будет варьировать в зависимости, например, от млекопитающего, которое будет получать антитело, пути введения, конкретного типа используемого антитела и других лекарственных средств, которые вводят млекопитающему. Руководство относительно подбора подходящих доз антитела можно найти в литературе, посвященной терапевтическим применениям антител, например Handbook of Monoclonal Antibodies, Ferrone et al., eds., Noges Publications, Park Ridge, N.J., 1985, ch. 22, pp. 303-357; Smith et al., Antibodies in Human Diagnosis and Therapy, Haber et al., eds., Raven Press, New York, 1977, pp. 365-389. Обычная суточная доза антитела, используемого отдельно, может быть в диапазоне примерно от 1 мкг/кг до 100 мг/кг массы тела или больше в сутки в зависимости от указанных выше факторов. В общем, можно использовать любую из следующих доз: дозу, по меньшей мере, примерно 50 мг/кг массы тела; по меньшей мере, примерно 10 мг/кг массы тела; по меньшей мере, примерно 3 мг/кг массы тела; по меньшей мере, примерно 1 мг/кг массы тела; по меньшей мере, примерно 750 мкг/кг массы тела; по меньшей мере, примерно 500 мкг/кг массы тела; по меньшей мере примерно, 250 мкг/кг массы тела; по меньшей мере, примерно 100 мкг/кг массы тела; по меньшей мере, примерно 50 мкг/кг массы тела; по меньшей мере, примерно 10 мкг/кг массы тела; по меньшей мере, примерно 1 мкг/кг массы тела или больше для введения. Антитела можно вводить в более низких дозах или менее часто в начале лечения, чтобы избежать возможных побочных эффектов, таких как временная церебральная амилоидная ангиопатия (CAA).
В некоторых вариантах может присутствовать более одного антитела. Такие композиции могут содержать, по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять разных антител (включая полипептиды) согласно изобретению.
Антитело также можно вводить млекопитающему в сочетании с эффективными количествами одного или нескольких других терапевтических средств. Антитело можно вводить последовательно или одновременно с одним или несколькими другими терапевтическими средствами. Количества антитела и терапевтического средства зависят, например, от того, какой тип лекарственных средств используется, от патологического состояния, подвергаемого лечению, и схем и путей введения, но в общем будет не меньше, чем при использовании каждого средства по отдельности.
После введения антитела млекопитающему физиологическое состояние млекопитающего можно контролировать разными способами, хорошо известными специалисту.
Указанные выше принципы введения и дозы могут быть адаптированы для полипептидов, описанных в настоящей публикации.
Полинуклеотид, кодирующий антитело или полипептид, описанный в настоящей публикации, также можно использовать для доставки и экспрессии антитела или полипептида в требуемой клетке. Понятно, что можно использовать экспрессирующий вектор для управления экспрессией антитела. Экспрессирующий вектор можно вводить системно, внутрибрюшинно, внутривенно, внутримышечно, подкожно, интратекально, интравентрикулярно, перорально, энтерально, парентерально, интраназально, дермально или с помощью ингаляции. Например, введение экспрессирующих векторов может представлять собой локальное или системное введение, включая инъекцию, пероральное введение, введение с помощью бомбардировки частицами или с помощью катетера и местное введение. Специалист в данной области знаком с введением экспрессирующих векторов для получения экспрессии экзогенного белка in vivo. Смотри, например, патенты США № 6436908, 6413942 и 6376471.
Также можно использовать целенаправленную доставку терапевтических композиций, содержащих полинуклеотид, кодирующий любое из антител или полипептидов согласно настоящему изобретению. Способы опосредованной рецепторами доставки ДНК описаны, например, в Findeis et al., Trends Biotechnol. (1993) 11: 202; Chiou et al., Gene Therapeutics: Methods and Applications of Direct Gene Transfer (J. A. Wolff, ed.) (1994); Wu et al., J. Biol. Chem. (1988) 263: 621; Wu et al., J. Biol. Chem. (1994) 269: 542; Zenke et al. (1990), Proc. Natl. Acad. Sci. USA, 87: 3655; Wu et al. (1991), J. Biol. Chem. 266: 338. Терапевтические композиции, содержащие полинуклеотид, вводят в диапазоне примерно от 100 нг до примерно 200 мг ДНК в случае локального введения согласно протоколу генной терапии. В протоколе генной терапии также можно использовать диапазоны концентраций примерно от 500 нг до примерно 50 мг, примерно от 1 мкг до примерно 2 мг, примерно от 5 мкг до примерно 500 мкг и примерно от 20 мкг до примерно 100 мкг ДНК. Терапевтические полинуклеотиды и полипептиды согласно настоящему изобретению можно доставлять, используя носители для доставки генов. Носитель для доставки генов может быть вирусного или невирусного происхождения (в общем, смотри Jolly (1994), Cancer Gene Therapy 1: 51; Kimura (1994), Human Gene Therapy 5: 845; Connelly (1985), Human Gene Therapy 1: 185; и Kaplitt (1994), Nature Genetics 6: 148). Экспрессия таких кодирующих последовательностей может быть индуцирована с использованием эндогенных промоторов млекопитающих и гетерологичных промоторов. Экспрессия кодирующей последовательности может быть либо конститутивной, либо регулируемой.
Основанные на вирусах векторы для доставки требуемого полинуклеотида и экспрессии в требуемой клетке хорошо известны в данной области. Примеры основанных на вирусах носителей включают без ограничения рекомбинантные ретровирусы, например описанные в публикациях PCT № WO 90/07936, WO 94/03622, WO 93/25698, WO 93/25234, WO 93/11230, WO 93/10218, WO 91/02805; патентах США № 5219740, 4777127, патенте GB № 2200651 и патенте EP № 0345242, основанные на альфавирусах векторы (например, векторы на основе вируса Синдбис, вируса леса Семлики (ATCC VR-67; ATCC VR-1247), вируса реки Росс (ATCC VR-373; ATCC VR-1246) и вируса венесуэльского энцефалита лошадей (ATCC VR-923; ATCC VR-1250; ATCC VR 1249; ATCC VR-532)), и векторы на основе аденоассоциированного вируса (AAV) (смотри, например, публикации PCT № WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/11984 и WO 95/00655. Также можно использовать введение ДНК, связанной с инактивированным аденовирусом, которое описано в Curiel (1992), Hum. Gene Ther. 3: 147.
Также можно использовать невирусные носители для доставки и способы, включая без ограничения поликатионную конденсированную ДНК, связанную или не связанную с инактивированным аденовирусом (смотри, например, Curiel (1992), Hum. Gene Ther. 3: 147); связанную с лигандом ДНК (смотри, например, Wu (1989), J. Biol. Chem. 264: 16985); носители для доставки в эукариотические клетки (смотри, например, патент США № 5814482, публикации PCT № WO 95/07994, WO 96/17072, WO 95/30763 и WO 97/42338) и нейтрализацию заряда нуклеиновой кислоты или слияние с клеточными мембранами. Также можно использовать «голую» ДНК. Примеры способов введения голой ДНК описаны в публикации PCT № WO 90/11092 и патенте США № 5580859. Липосомы, которые могут действовать в качестве носителей для доставки генов, описаны в патенте США № 5422120, публикации PCT № WO 95/13796, WO 94/23697, WO 91/14445 и патенте EP № 0524968. Дополнительные способы описаны в Philip (1994), Mol. Cell Biol. 14: 2411 и в Woffendin (1994), Proc. Natl. Acad. Sci. 91: 1581.
Наборы
Изобретение также относится к изделиям производства и наборам, содержащим материалы, применимые для лечения глазных болезней, описанных в настоящей публикации, таких как возрастная макулярная дегенерация (как влажная, так и сухая), глаукома, диабетическая ретинопатия (включая диабетический макулярный отек), разрывы в оболочке Бруха, миопическая дегенерация, глазные опухоли и другие родственные дегенеративные заболевания сетчатки. Изделие производства содержит емкость с этикеткой. Подходящими емкостями являются, например, бутыли, флаконы и пробирки. Емкости могут быть сделаны из различных материалов, таких как стекло или пластик. В емкости находится композиция, содержащая активное средство, которое эффективно для лечения патологических состояний глаз или для выявления или очистки Aβ или βAPP. Активным средством в композиции является антитело и предпочтительно представляет собой моноклональное антитело, специфичное по отношению к Aβ или βAPP. В некоторых вариантах активное средство содержит антитело 9TL или 6G или любые полученные из них антитела или полипептиды. В некоторых вариантах активное средство содержит анти-Aβ-антитело или полипептид, имеющий нарушенную эффекторную функцию. В некоторых вариантах анти-Aβ-антитело или полипептид содержит константную область тяжелой цепи, при этом константная область имеет нарушенную эффекторную функцию. В этикетке на емкости указано, что композиции применяют для лечения патологических состояний глаз, таких как ВМД, а также могут быть приведены инструкции по применению либо in vivo, либо in vitro, такие как инструкции, описанные выше.
Изобретение также относится к наборам, содержащим любое из антител (такое как 9TL или 6G), полипептидов, полинуклеотидов, описанных в настоящей публикации. В некоторых вариантах набор согласно изобретению содержит емкость, описанную выше. В других вариантах набор согласно изобретению содержит емкость, описанную выше и вторую емкость, содержащую буфер. Она может дополнительно содержать другие материалы, необходимые с коммерческой точки зрения или с точки зрения потребителя, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями по осуществлению любого из способов, описанных в настоящей публикации (таких, как способы лечения ВМД и способы подавления или уменьшения накопления пептида Aβ в головном мозге). В наборах, используемых для выявления или очистки Aβ или βAPP, антитело обычно метят регистрируемым маркером, таким как, например, радиоактивный изотоп, флуоресцирующее соединение, биолюминесцентное соединение, хемилюминесцентное соединение, средство, хелатирующее металлы, или фермент.
В некоторых вариантах изобретение относится к композициям (описанным в настоящей публикации) для применения в любом из способов, описанных в настоящей публикации, либо в контексте применения в качестве лекарственного средства и/либо применения для производства лекарственного средства.
Следующие примеры приведены для иллюстрации, но не для ограничения изобретения.
ПРИМЕРЫ
Пример 1. Определение аффинности связывания антитела 9TL и его вариантов
A. Общие способы
В данном примере использовали следующие общие способы.
Экспрессирующий вектор, используемый при характеристике клона
Экспрессия Fab-фрагмента антител была под контролем IPTG-индуцируемого промотора lacZ подобно экспрессии, описанной в Barbas (2001) Phage display: a laboratory manual, Cold Spring Harbor, NY, Cold Spring Harbor Laboratory Press pg 2.10. Однако модификации вектора pComb3X) включали добавление и экспрессию следующих дополнительных доменов: константный домен легкой цепи каппа человека и константный домен CH1 иммуноглобулина IgG2a человека, C-область цепи гамма-2 Ig, белок с номером доступа P01859; легкая цепь каппа иммуноглобулина (homo sapiens), белок с номером доступа CAA09181.
Получение Fab в небольшом масштабе
Экспрессию Fab в небольшом масштабе в 96-луночных планшетах осуществляли следующим образом. Начиная с E. coli, трансформированной библиотекой Fab, отбирали колонии для инокуляции как на основной планшет (агар LB + ампициллин (50 мкг/мл) + 2% глюкоза), так и на рабочий планшет (2 мл/лунку, 96 лунок/планшет, содержащие 1,5 мл LB + ампициллин (50 мкг/мл) + 2% глюкоза). Клетки на двух планшетах выращивали при 30°C в течение 8-12 часов. Основной планшет хранили при 4°C, а клетки из рабочего планшета осаждали при 5000 об/мин и ресуспендировали в 1 мл LB + ампициллин (50 мкг/мл) + 1 мМ IPTG, чтобы индуцировать экспрессию Fab. Клетки собирали центрифугированием после 5-часовой экспрессии при 30°C, затем ресуспендировали в 500 мкл буфера HBS-P (10 мМ HEPES-буфер pH 7,4, 150 мМ NaCl, 0,005% P20). Лизиса ресуспендированных в HBS-P клеток достигали за один цикл замораживания (-80°C), затем оттаивания при 37°C. Лизаты клеток центрифугировали при 5000 об/мин в течение 30 минут, чтобы отделить остатки клеток от надосадков, содержащих Fab-фрагменты. Затем надосадки вводили в устройство для анализа плазмонного резонанса BIAcore, чтобы получить информацию об аффинности для каждого Fab. Клоны, экспрессирующие Fab, собирали из основного планшета, чтобы секвенировать ДНК и использовать для крупномасштабного получения Fab и подробной характеристики, как описано ниже.
Крупномасштабное получение Fab
Чтобы получить подробные кинетические параметры, Fab экспрессировали и очищали из культур большого объема. В колбы Эрленмейера, содержащие 200 мл LB + ампициллин (50 мкг/мл) + 2% глюкозы, инокулировали 5 мл ночной культуры выбранного Fab-экспрессирующего клона E. coli. Клоны инкубировали при 30°C вплоть до достижения OD550нм 1,0 и затем индуцировали заменой среды на 200 мл LB + ампициллин (50 мкг/мл) + 1 мМ IPTG. После 5-часового периода экспрессии при 30°C клетки осаждали центрифугированием, затем ресуспендировали в 10 мл PBS (pH 8). Лизис клеток получали, проводя два цикла замораживания/оттаивания (при -80°C и 37°C соответственно). Надосадок клеточных лизатов наносили на колонки с Ni-NTA-сефарозой Superflow (Qiagen, Valencia. CA), уравновешенные PBS, pH 8, затем промывали 5 объемами колонки PBS, pH 8. Отдельные Fab элюировались в разных фракциях при использовании PBS (pH 8) + 300 мМ имидазол. Фракции, содержащие Fab, объединяли и диализовали против PBS, затем количественно оценивали в ELISA перед характеристикой аффинности.
Получение полного антитела
Для экспрессии полноразмерных антител вариабельные области тяжелой и легкой цепи клонировали в экспрессирующих векторах млекопитающих и трансфицировали, используя липофектамин, в клетки HEK 293 для временной экспрессии. Антитела очищали стандартными способами, используя белок A. Вектор pDb.9TL.hFc2a представляет собой экспрессирующий вектор, содержащий тяжелую цепь антитела 9TL, и подходит для временной или стабильной экспрессии тяжелой цепи. Вектор pDb.9TL.hFc2a имеет нуклеотидные последовательности, соответствующие следующим областям: промоторная область цитомегаловируса мышей (нуклеотиды 1-612); синтетический интрон (нуклеотиды 619-1507); кодирующая область DHFR (нуклеотиды 707-1267); сигнальный пептид гормона роста человека (нуклеотиды 1525-1602); вариабельная область тяжелой цепи 9TL (нуклеотиды 1603-1951); константная область тяжелой цепи IgG2a человека, содержащая следующие мутации: A330P331 → S330S331 (нумерация аминокислот в соответствии с последовательностью IgG2 дикого типа; смотри Eur. J. Immunol. (1999) 29: 2613-2624); поздний сигнал полиаденилирования SV40 (нуклеотиды 2960-3203); область энхансера SV40 (нуклеотиды 3204-3449); область фага f1 (нуклеотиды 3537-4992) и кодирующая область бета-лактамазы (AmpR) (нуклеотиды 4429-5286). Вектор pDb.9TL.hFc2a депонировали в ATCC 20 июля 2004, ему присвоен номер доступа в ATCC № PTA-6124.
Вектор pEb.9TL.hK представляет собой экспрессирующий вектор, содержащий легкую цепь антитела 9TL, и подходит для временной экспрессии легкой цепи. Вектор pEb.9TL.hK имеет нуклеотидные последовательности, соответствующие следующим областям: промоторная область цитомегаловируса мышей (нуклеотиды 1-612); интрон EF-1 человека (нуклеотиды 619-1142); сигнальный пептид гормона роста человека (нуклеотиды 1173-1150); вариабельная область легкой цепи антитела 9TL (нуклеотиды 1251-1593); константная область цепи каппа человека (нуклеотиды 1594-1914); поздний сигнал полиаденилирования SV40 (нуклеотиды 1932-2175); область энхансера SV40 (нуклеотиды 2176-2421); область фага f1 (нуклеотиды 2509-2964) и кодирующая область бета-лактамазы (AmpR) (нуклеотиды 3401-4258). Вектор pEb.9TL.hK депонировали в ATCC 20 июля 2004 и присвоили ему номер доступа в ATCC № PTA-6125.
Анализ Biacore
Аффинности моноклонального антитела 9TL определяли, используя систему поверхностного плазмонного резонанса (SPR) BIAcore3000™ (BIAcore, INC, Piscaway NJ). Один из способов определения аффинности заключался в иммобилизации 9TL на чипе CM5 и измерении кинетики связывания пептида Aβ1-40 с антителом. Чипы CM5 активировали гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антитело 9TL или его варианты разбавляли в 10 мМ ацетате натрия с pH 4,0 или 5,0 и подавали на активированный чип в концентрации 0,005 мг/мл. Используя переменное время протекания через отдельные каналы чипа, достигали плотности антител в диапазоне: 1000-2000 или 2000-3000 единиц ответного сигнала (RU). Чип блокировали этаноламином. Исследования регенерации показали, что раствор, содержащий 2 объема буфера для элюирования PIERCE и 1 объем 4 М NaCl, эффективно удалял связанный пептид Aβ1-40, при этом сохраняя активность 9TL на чипе на протяжении более 200 инъекций. Буфер HBS-EP (0,01 М HEPES, pH 7,4, 0,15 М NaCl, 3 мМ EDTA, 0,005% поверхностно-активное вещество P20) использовали в качестве рабочего буфера для всех анализов BIAcore. Серийные разведения (0,1-10 x определяемого значения KD) очищенных образцов синтетических пептидов Aβ1-40 инъецировали в течение 1 мин со скоростью 100 мкл/мин и давали время для диссоциации 10 минут. Кинетические константы скорости ассоциации (kon) и скорости диссоциации (koff) получали одновременно в результате подгонки данных к модели связывания Лэнгмюра 1:1 (Karlsson, R. Roos, H. Fagerstam, L. Petersson, B. (1994). Methods Enzymology 6. 99-110), используя программу BIAevaluation. Значения равновесной константы диссоциации (KD) вычисляли в виде koff/kon.
Альтернативно аффинность определяли посредством иммобилизации пептида Aβ1-40 на чип SA и измерения кинетики связывания Fab 9TL и Fab вариантов 9TL с иммобилизованным пептидом Aβ1-40. Аффинности Fab-фрагмента 9TL и Fab-фрагментов его вариантов определяли, используя систему поверхностного плазмонного резонанса (SPR) (BIAcore 3000TM, BIAcore, Inc., Piscaway, NJ). Чипы SA (стрептавидин) применяли согласно инструкциям поставщика. Биотинилированный пептид Aβ 1-40 разбавляли в HBS-EP (10 мМ HEPES pH 7,4, 150 мМ NaCl, 3 мМ EDTA, 0,005% P20) и инъецировали на чип в концентрации 0,005 мг/мл. Используя переменное время протекания через отдельные каналы чипа, достигали двух диапазонов плотности антигена: 10-200 единиц ответного сигнала (RU) для подробных кинетических исследований и 500-600 RU для концентрационных исследований и скрининга. Исследования регенерации показали, что 100 мМ фосфорная кислота (также с последующим использованием раствора, содержащего 2 объема 50 мМ NaOH и 1 объем 70% этанола) эффективно удаляла связанный Fab, сохраняя при этом активность пептида Aβ на чипе на протяжении более 200 инъекций. Буфер HBS-EP использовали в качестве рабочего буфера для всех анализов BIAcore. Серийные разведения (0,1-10x определяемого значения KD) очищенных образцов Fab инъецировали в течение 2 минут со скоростью 100 мкл/мин и давали время для диссоциации 10 минут. Концентрации белков Fab определяли в ELISA и/или с помощью SDS-ПААГ-электрофореза, используя стандартный Fab с известной концентрацией (определяемой в аминокислотном анализе). Кинетические константы скорости ассоциации (kon) и скорости диссоциации (koff) получали одновременно в результате подгонки данных к модели связывания Лэнгмюра 1:1 (Karlsson, R. Roos, H. Fagerstam, L. Petersson, B. (1994). Methods Enzymology 6. 99-110), используя программу BIAevaluation. Значения равновесной константы диссоциации (KD) вычисляли в виде koff/kon.
B. Аффинность связывания антитела 9TL и его вариантов с Aβ 1-40
Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи антитела 9TL показаны на фигуре 1. Аффинность связывания антитела 9TL с Aβ1-40, определяемая с использованием двух способов Biacore, описанных выше, показана в таблице 2 ниже.
Аффинность связывания антитела 9TL и Fab-фрагмента
Аминокислотная последовательность вариантов 9TL показана в таблице 3 ниже. Все аминокислотные замены вариантов, показанных в таблице 3, описаны относительно последовательности 9TL. Аффинности связывания Fab-фрагментов вариантов 9TL также показаны в таблице 3. KD и другие кинетические параметры определяли в анализе BIAcore, описанном выше, используя Aβ1-40, иммобилизованный на чипе SA.
Аминокислотные последовательности и кинетические данные для вариантов антитела 9TL
(1)
(Мсек-1)
(2)
(сек-1)
(нМ)
(3)
2 = подчеркнутые kon определяли экспериментально. Другие оценивали как такие же, как в случае 9TL.
3 = значения KD вычисляли в виде KD = koff/kon.
Пример 2: Характеристика эпитопа на пептиде Aβ1-40, который связывается антителом 9TL
Чтобы определить эпитоп на полипептиде Aβ, который узнается антителом 9TL, использовали анализ связывания на основе поверхностного плазмонного резонанса (SPR, Biacore 3000). Полипептид Aβ1-40, связанный с биотином (Global Peptide Services, CO), иммобилизовали на покрытом стрептавидином чипе (чип SA). Связывание Fab-фрагментов антител к Aβ (при 50 нМ) с иммобилизованным Aβ1-40 осуществляли в отсутствие или в присутствии разных растворимых фрагментов пептида Aβ (при 10 мкМ, из American Peptide Company Inc., CA). Аминокислотные последовательности Aβ1-40, Aβ1-42 и Aβ1-43 показаны ниже в таблице 4. Пептиды Aβ, которые вытесняли Fab-фрагмент антитела 9TL из связывания с Aβ1-40, представляли собой пептиды Aβ28-40, Aβ1-40, Aβ33-40 и Aβ17-40 соответственно (фигура 2). Таким образом, антитело 9TL связывается с C-концевым пептидом (33-40) Aβ1-40. Как показано на фигуре 2, пептиды Aβ1-28, Aβ28-42, Aβ22-35, Aβ1-16, Aβ1-43 и Aβ1-38 не ингибировали связывание Fab-фрагмента антитела 9TL, что свидетельствует о том, что антитело 9TL связывается с C-концом пептида Aβ1-40.
Кроме того, пептиды Aβ28-42 и Aβ1-43 не ингибировали связывание антитела 9TL с Aβ1-40, хотя они легко могли ингибировать связывание Aβ1-40 с контрольным антителом (антителом 2289, указанное антитело описано в публикации заявки на выдачу патента США № 2004/0146512 и WO 04/032868), которое связывается с 16-28 в Aβ1-40. Полученные результаты показывают, что антитело 9TL предпочтительно связывается с Aβ1-40, но не с Aβ1-42 и Aβ1-43.
Аминокислотные последовательности
бета-амилоидных пептидов
Пример 3. Создание моноклонального антитела 2H6 и дегликозилированного 2H6
A. Создание и характеристика моноклонального антитела 2H6
Мышей иммунизировали 25-100 мкг пептида (аминокислоты 28-40 Aβ1-40), конъюгированного с KLH в адъюванте (50 мкл в подушечку лапы, всего 100 мкл на мышь) примерно на протяжении 16 непрерывно следующих друг за другом недель, как описано в Geerligs HJ et al., 1989, J. Immunol. Methods 124: 95-102; Kenney JS et al., 1989, J. Immunol. Methods 121: 157-166; и Wicher K et al., 1989, Int. Arch. Allergy Appl. Immunol. 89: 128-135. Мышей сначала иммунизировали 50 мкг пептида в CFA (полный адъювант Фрейнда). Через 21 день мышей иммунизировали второй раз 25 мкг пептида в IFA (неполный адъювант Фрейнда). Через двадцать три дня после второй иммунизации осуществляли третью иммунизацию 25 мкг пептида в IFA. Через десять дней проверяли титры антител, используя ELISA. Четвертую иммунизацию осуществляли, используя 25 мкг пептида в IFA через 34 дня после третьей иммунизации. Конечную бустер-иммунизацию осуществляли, используя 100 мкг растворимого пептида через 32 дня после четвертой иммунизации.
От иммунизированной мыши получали спленоциты и сливали с клетками миеломы NSO в соотношении 10:1, используя полиэтиленгликоль 1500. Гибриды высевали с 96-луночные планшеты в среду DMEM, содержащую 20% лошадиную сыворотку и 2-оксалоацетат/пируват/инсулин (Sigma), и начинали селекцию на гипоксантине/аминоптерине/тимидине. На 8 день во все лунки добавляли 100 мкл DMEM, содержащей 20% лошадиную сыворотку. Проводили скрининг надосадков гибридов, используя иммуноанализ на основе улавливания антител. Определение класса антител осуществляли с использованием специфичных для классов вторых антител.
Отбирали панель клеточных линий, продуцирующих моноклональные антитела, для характеристики. Одна отобранная клеточная линия продуцировала антитело, названное 2H6. Определили, что указанное антитело имеет тяжелую цепь IgG2b.
Определяли аффинность антитела 2H6 по отношению к Aβ1-40. Моноклональное антитело 2H6 очищали из надосадков гибридомных культур с помощью аффинной хроматографии на основе белка A. Надосадки уравновешивали до pH 8. Затем надосадки наносили на колонку с белком A MabSelect (Amersham Biosciences № 17-5199-02), уравновешенную PBS до pH 8. Колонку промывали 5 объемами колонки PBS, pH 8. Антитело элюировали, используя 50 мМ цитратно-фосфатный буфер, pH 3. Элюированное антитело нейтрализовали 1 М фосфатным буфером, pH 8. Очищенное антитело диализовали в PBS. Концентрацию антител определяли в SDS-ПААГ, используя стандартную кривую для мышиного mAb.
Fab 2H6 получали в результате протеолиза папаином полноразмерного антитела 2H6, используя набор для получения Fab Immunopure (Pierce № 44885), и очищали, пропуская через колонку для хроматографии с белком A, следуя инструкциям производителя. Концентрацию определяли с помощью SDS-ПААГ и A280, используя 1 OD=0,6 мг/мл.
Аффинности моноклонального антитела 2H6 определяли, используя систему поверхностного плазмонного резонанса (SPR) BIAcore3000™ (BIAcore, INC, Piscaway NJ). Один из способов определения аффинности заключался в иммобилизации антитела 2H6 на чипе CM5 и измерении кинетики связывания пептида Aβ1-40 с антителом. Чипы CM5 активировали гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Моноклональное антитело 2H6 разбавляли в 10 мМ ацетате натрия с pH 4,0 или 5,0 и подавали на активированный чип в концентрации 0,005 мг/мл. Используя переменное время протекания через отдельные каналы чипа, достигали плотности антител в диапазоне: 1000-2000 или 2000-3000 единиц ответного сигнала (RU). Чип блокировали этаноламином. Исследования регенерации показали, что смесь буфера для элюирования Pierce (продукт № 21004, Pierce Biotechnology, Rockford, IL) и 4 М NaCl (2:1) эффективно удаляла связанный пептид Aβ1-40, при этом сохраняя активность антитела 2H6 на чипе на протяжении более 200 инъекций. Буфер HBS-EP (0,01 М HEPES, pH 7,4, 0,15 М NaCl, 3 мМ EDTA, 0,005% поверхностно-активное вещество P20) использовали в качестве рабочего буфера для всех анализов BIAcore. Серийные разведения (0,1-10× определяемого значения KD) очищенных образцов синтетического пептида Aβ1-40 инъецировали в течение 1 минуты со скоростью 100 мкл/мин и давали время для диссоциации 10 минут. Кинетические константы скорости ассоциации (kon) и скорости диссоциации (koff) получали одновременно в результате подгонки данных к модели связывания Лэнгмюра 1:1 (Karlsson, R. Roos, H. Fagerstam, L. Petersson, B. (1994). Methods Enzymology 6. 99-110), используя программу BIAevaluation. Значения равновесной константы диссоциации (KD) вычисляли в виде koff/kon.
Альтернативно аффинность определяли посредством иммобилизации пептида Aβ1-40 на чип SA и измерения кинетики связывания Fab 2H6 с иммобилизованным пептидом Aβ1-40. Аффинности Fab-фрагмента 2H6 определяли, используя систему поверхностного плазмонного резонанса (SPR) (BIAcore 3000TM, BIAcore, Inc., Piscaway, NJ). Чипы SA (стрептавидин) использовали согласно инструкциям поставщика. Биотинилированный пептид Aβ 1-40 9SEQ ID NO: 15) разбавляли в HBS-EP (10 мМ HEPES pH 7,4, 150 мМ NaCl, 3 мМ EDTA, 0,005% P20) и инъецировали на чип в концентрации 0,005 мг/мл. Используя переменное время протекания через отдельные каналы чипа, достигали двух диапазонов плотности антигена: 10-200 единиц ответного сигнала (RU) для подробных кинетических исследований и 500-600 RU для исследований концентрации. Исследования регенерации показали, что смесь буфера для элюирования Pierce и 4 М NaCl (2:1) эффективно удаляла связанный Fab, сохраняя при этом активность пептида Aβ на чипе на протяжении более 200 инъекций. Буфер HBS-EP использовали в качестве рабочего буфера для всех анализов BIAcore. Серийные разведения (0,1-10× определяемого значения KD) очищенных образцов Fab инъецировали в течение 2 минут со скоростью 100 мкл/мин и давали время для диссоциации 10 минут. Концентрации белков Fab определяли в ELISA и/или с помощью SDS-ПААГ-электрофореза, используя стандартный Fab с известной концентрацией (определяемой в аминокислотном анализе). Кинетические константы скорости ассоциации (kon) и скорости диссоциации (koff) получали одновременно в результате подгонки данных к модели связывания Лэнгмюра 1:1 (Karlsson, R. Roos, H. Fagerstam, L. Petersson, B. (1994). Methods Enzymology 6, 99-110), используя программу BIAevaluation. Значения равновесной константы диссоциации (KD) вычисляли в виде koff/kon. Аффинность антитела 2H6, определенная с использованием обоих описанных выше способов, показана в таблице 5 ниже.
Аффинность мышиного антитела 2286, которое связывается с пептидом из аминокислот 28-40 Aβ1-40, тестировали, как описано выше. Антитело 2286 описано в заявке на выдачу патента США с регистрационным номером 10/683815 и в PCT/US03/32080.
Аффинность связывания антител 2H6 и 2286
Чтобы определить эпитоп на полипептиде Aβ, который узнается антителом 2H6, использовали анализ связывания на основе поверхностного плазмонного резонанса (SPR, Biacore 3000). Полипептид Aβ1-40 (SEQ ID NO: 15), связанный с биотином (Global Peptide Services, CO), иммобилизовали на покрытом стрептавидином чипе (чип SA). Связывание антител к Aβ (при 100 нМ) с иммобилизованным Aβ1-40 осуществляли в отсутствие или в присутствии разных растворимых фрагментов пептида Aβ (16 мкМ, из American Peptide Company Inc., CA). Пептиды Aβ, которые вытесняли антитела 2H6 из связывания с Aβ1-40, представляли собой пептиды Aβ17-40, Aβ33-40 и Aβ1-40 соответственно (фигура 3). Таким образом, антитело 2H6 связывается с C-концевым пептидом (33-40) Aβ1-40. Однако указанный C-концевой пептид (33-40) Aβ1-40 не вытеснял антитела 2286 из связывания с Aβ1-40 в тестированной концентрации. Как показано на фигуре 3, пептид Aβ1-38 не ингибировал связывание антитела 2H6 или антитела 2286 с Aβ1-40, что свидетельствует о том, что подобно ситуации при использовании антитела 2286 эпитоп, который связывается антителом 2H6, содержит аминокислоты 39 и/или 40 пептида Aβ1-40 (фигура 3).
Кроме того, пептиды Aβ1-42 и Aβ1-43 не ингибировали связывание антитела 2H6 с Aβ1-40, хотя они легко могли ингибировать связывание Aβ1-40 с контрольным антителом (антитело 2289, указанное антитело описано в заявке на выдачу патента США с регистрационным номером 10/683815 и в PCT/US03/32080), которое связывается с 16-28 в Aβ1-40 (фигура 3). Полученные результаты показывают, что антитело 2H6 предпочтительно связывается с Aβ1-40, но не с Aβ1-42 и Aβ1-43.
Чтобы дополнительно оценить участие отдельных аминокислотных остатков β-амилоидного пептида, которые связываются антителом 2H6, с помощью сайт-специфичного мутагенеза создавали разные варианты Aβ1-40, в которых каждую из последних 6 аминокислот (аминокислотные остатки 35-40 в Aβ1-40) по отдельности заменяли аланином (мутагенез на основе сканирования аланином). Полученные варианты Aβ1-40 (последовательности показаны в таблице 6) экспрессировали в E. coli в виде белков, слитых с глутатион-S-трансферазой (GST) (Amersham Pharmacia Biotech, Piscataway, NJ USA) с последующей аффинной очисткой на глутатион-агарозных шариках (Sigma-Aldrich Corp., St. Louis, MO, USA). В качестве контроля Aβ1-40 дикого типа (WT), а также Aβ1-41, Aβ1-42 и Aβ1-39 также экспрессировали в виде слитых с GST белков. Aβ1-40, Aβ1-41, Aβ1-42, Aβ1-39, а также шесть разных вариантов (M35A(1-40), V36A(1-40), G37A(1-40), G38A(1-40), V39A(1-40), V40A(1-40), показанных в таблице 6) затем иммобилизовали (100 мкл 0,025 мкг/мкл GST-пептида на лунку) на планшетах для анализа ELISA и инкубировали либо с mAb 2286, 2289 и 2H6 в серийных разведениях от 0,3 нМ и ниже (данные, полученные при использовании 0,3 нМ mAb, показаны на фигуре 4). После 10 последовательных промывок планшеты для анализа инкубировали с 100 мкл 0,03 мкг/мл на лунку конъюгированного с биотином козьего антитела против (H+L) мыши (Vector Laboratories, вектор №BA-9200, Burllingame CA, USA), затем с 100 мкл 0,025 мкг/мл на лунку конъюгированного с HRP стрептавидина (Amersham Biosciences Corp., № RPN4401V, NJ, USA). Оптическую плотность в планшете регистрировали при 450 нм.
Аминокислотные последовательности
бета-амилоидных пептидов и вариантов
Как показано на фигуре 4, mAb 2289, которое направлено к аминокислотам 16-28 Aβ, узнавало все варианты с одной и той же интенсивностью и служило в качестве внутреннего позитивного контроля при оценке концентрации белка и целостности белка на планшете. Антитело 2H6 не узнавало Aβ1-41, Aβ1-39 или Aβ1-42, как показано на фиг.4. Варианты Aβ1-40 V40A, V39A, G38A, G37A, V36A и M35A имели пониженное связывание с антителом 2H6, что свидетельствует о том, что эпитоп антитела 2H6 занимал, по меньшей мере, 6 аминокислот на C-конце Aβ1-40. Мутации V и G на A являются очень консервативными и вероятно не вызывают важных конформационных изменений в белках, поэтому большое влияние таких мутаций на связывание антитела 2H6 может быть следствием способности антитела различать указанные аминокислоты в контексте Aβ, и полученные данные демонстрируют очень высокую степень специфичности такого антитела.
Чтобы определить, конкурируют ли 2H6 и 9TL за связывание с Aβ1-40, проводили эксперименты, основанные на конкуренции, используя анализ Biacore. Антитела 2H6, 9TL и 2289 иммобилизовали на разных каналах чипа CM5. Каналы чипа CM5 активировали гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Каждое из антител 2H6, 9TL и 2289 разбавляли в 10 мМ ацетате натрия pH 4,0 и инъецировали на активированный чип в концентрации 0,005 мг/мл. Плотность антител составляла 1625 единиц ответного сигнала (RU) в случае 2H6, 4000 RU в случае 9TL и 2200 RU в случае 2289. Каждый канал блокировали этаноламином. Пептид Aβ1-40 (150 мкМ) подавали на чип в течение 2 минут. Затем антитело 2H6 (тестируемое в отношении конкуренции за связывание) в концентрации 0,6 мкМ подавали на чип в течение 1 минуты. Буфер HBS-EP (0,01 М HEPES, pH 7,4, 0,15 М NaCl, 3 мМ EDTA, 0,005% поверхностно-активное вещество P20) использовали в качестве рабочего буфера для всех анализов BIAcore. После измерения связывания Aβ1-40 все каналы на чипе регенерировали, дважды промывая смесью буфера для элюирования Pierce (продукт № 21004, Pierce Biotechnology, Rockford, IL) и 4 M NaCl (2:1) в течение 6 секунд. Затем осуществляли конкурентное связывание в случае антитела 9TL и затем антитела 2289. Наблюдали конкуренцию между 9TL и 2H6 за связывание с Aβ1-40, но не наблюдали конкуренции между 9TL и 2289 или между 2H6 и 2289. Наблюдения конкуренции между иммобилизованным антителом и таким же антителом, которое подается на чип, служили в качестве позитивного контроля.
B. Антитело 2H6 не связывается с APP
Чтобы определить, связывается ли 2H6 с белками-предшественниками амилоида (APP), определяли связывание 2H6 с клетками, трансфицированными APP дикого типа. Клетки 293 трансфицировали кДНК, кодирующей белок-предшественник амилоида дикого типа человека. Через сорок восемь часов после трансфекции клетки инкубировали на льду в течение 45 минут с моноклональными антителами анти-Aβ1-16, анти-Aβ16-28 или 2H6 (5 мкг/мл в DMEM с 10% FCS). Затем клетки промывали три раза по 5 минут в PBS, фиксировали в 4% PFA. Клетки промывали три раза снова в PBS и регистрировали связывание антител с использованием второго конъюгированного с Cy3 антитела козы против Ig мыши (разведение 1:500) из Jackson Immunoresearch в флуоресцентном микроскопе.
Антитела анти-Aβ1-16 и анти-Aβ16-28, которые узнают N-концевой или центральный эпитопы в Aβ, в значительной степени связывались с белками-предшественниками APP, экспрессированными на клетках. Напротив, антитело 2H6 не связывалось с клетками, экспрессирующими APP.
C. Создание дегликозилированного антитела 2H6
Чтобы создать дегликозилированное антитело 2H6, очищенное антитело 2H6 инкубировали при 37°C в течение 7 суток с пептид-N-гликозидазой F (Prozyme, 0,05 единиц на мг антитела) в 20 мМ трис-HCl pH 8,0. Завершение дегликозилирования подтверждали с использованием MALDI-TOF-МС и гель-электрофореза белка. Дегликозилированные антитела очищали хроматографией на белке A и эндотоксин удаляли на Q-сефарозе. Аффинность связывания с Aβ1-40 дегликозилированного 2H6 тестировали, используя анализ Biacore, описанный выше, и обнаружено, что аффинность связывания дегликозилированного 2H6 с Aβ1-40, идентичная аффинности связывания интактного антитела 2H6.
Пример 4: Влияние дегликозилированного антитела 2H6 (2H6-D) на защиту и восстановление функции сетчатки в животной модели возрастной макулярной дегенерации
Начальные исследования (Malek, G. et al., PNAS 102: 11900-5 (2005)) показали, что сочетание трех факторов риска: (1) генотип изоформы E4 аполипопротеида (APOE4), (2) пожилой возраст (более 65 недель) и (3) диета с высоким содержанием жира и холестерина (HF-C) позволяет получать животную модель, которая очень сходна по клиническим признакам с ВМД человека. С возрастом у мышей APOE4 развивались патологические изменения, сходные с морфологическими признаками, наблюдаемыми при сухой и влажной ВМД человека, включая пигментные изменения в пигментном эпителии сетчатки (ПЭС), мощные диффузные отложения под ПЭС, богатые липидами друзоподобные отложения, утолщение оболочки Бруха, очаговые области атрофии ПЭС, налагающиеся на дегенерацию фоторецепторов и хориоидальную неоваскуляризацию (ХНВ). Указанные изменения не выявлены ни у одной из контрольных мышей, экспрессирующих APOE3 человека, независимо от схемы питания, никаких патологий не выявлено у молодых животных APOE4. Функциональную недостаточность идентифицировали на основании скотопических электроретинограмм всего поля. У пораженных животных наблюдали значительное уменьшение амплитуд a- и b-волн по сравнению с контролями. Важно, что указанные гистопатологические и функциональные изменения требовали присутствия всех трех факторов риска. Указанная животная модель спонтанно возникающей ХНВ является первой моделью, в которую включены физиологически подходящие факторы заболевания человека.
A. Экспериментальный протокол
Введение антител. Для экспериментов использовали мышей с целенаправленной заменой, экспрессирующих ApoE4 человека (в возрасте более 65 недель). ВМД-подобный фенотип, имеющийся у таких мышей, описан ранее (Malek, G. et al., PNAS 102: 11900-5 (2005)). Для исследования восьминедельной обработки ApoE4-трансгенных мышей в возрасте 65 недель или более распределяли в одну из четырех групп. Первую группу (E4-ND) постоянно содержали на обычной диете (n=2). Вторая группа (E4-HFC-R1) получала корм с высоким содержанием жиров, обогащенный холестерином (HF-C), 8 недель (n=2). Третья группа (E4-HFC-R1) получала корм HF-C в течение 8 недель и еженедельно получала внутрибрюшинные инъекции Rinat 1 (3 мг/кг) (n=5). Четвертая группа (E4-HFC-R2) получала корм HF-C в течение 8 недель и еженедельно получала внутрибрюшинные инъекции Rinat 2 (3 мг/кг) (n=5). После завершения исследования раскрывали кодировку групп: Rinat 1 представлял собой наполнитель PBS, а Rinat 2 представлял собой дегликозилированное анти-Aβ-антитело 2H6 (мышиное моноклональное антитело против Aβ28-40 человека, IgG2b, «2H6-D», которое описано в примере 3).
Оценка in vivo. Оценку глазного дна проводили на 0 неделе, тогда как исследования дна и ангиограммы с использованием флуоресцеина получали на 8 неделе. Фотографии получали, используя фундус-камеру (TRC-50EX Retina Camera). Изображения улавливали, используя систему TOPCON IMAGEnetTM. Флуоресцеиновый краситель (10% флуоресцеин натрия, примерно 0,1 мл/кг) инъецировали через порты для сосудистого доступа. Фотографии получали в нескольких временных точках после инъекции красителя, включая артериальную фазу, раннюю артериовенозную фазу и несколько поздних артериовенозных фаз, чтобы оценить неоваскуляризацию и наблюдать просачивание флуоресцеина, связанное с ХНВ-повреждениями. Интерпретацию и анализ флуоресцеиновых ангиограмм независимо проводил офтальмолог.
Общие уровни холестерина в плазме регистрировали в цельной крови мышей (голодавших в течение 5 часов) до и после введения 8-недельной диеты HF-C.
Ангиография с использованием флуоресцеина (FA). У одного животного E4-HFC-R2 наблюдалось возможное просачивание в поздних фазах ангиограммы. Животное погибло после FA, но до получения электроретинограмм и невозможно было извлечь ткань.
Регистрация электроретинограмм. На девятой неделе получали записи электроретинограмм (ЭРГ) для животных, адаптированных в темноте в течение, по меньшей мере, 12 часов. Каждое животное анестезировали смесью кетамин/ксилазин, зрачки расширяли и после стабилизации животного на нагретой до 37°C согревающей подушке регистрировали линии ЭРГ, используя индикаторный электрод из серебряной проволоки, помещаемый в контакте с глазом вместе с каплей 2,5% гидроксипропилметилцеллюлозы. Мышей помещали в камеру фотопического стимулятора, где животное подвергали воздействию вспышек света (максимальная интенсивность 1000 кд-сек/м2 затухает ступенчато по 1 log, начиная с 0,0005). Амплитуду a-волны измеряли от исходного уровня до минимума a-волны, и амплитуду b-волны измеряли от минимума a-волны до пика b-волны.
Гистологический анализ. В день умерщвления мышей взвешивали, давали большую дозу авертина (0,2 мкл/10 г массы тела) и затем интракардиально перфузировали 20 мл физиологического раствора. Быстро извлекали головной мозг и левую половину головного мозга иммерсионно фиксировали в течение 16 часов в свежеприготовленном 10% формалине для исследования гистопатологии. Сделанные на вибратоме срезы толщиной тридцать микрон предварительно обрабатывали 10% MeOH, 1 X PBS и 2% H2O2, промывали PBS, инкубировали в 88% муравьиной кислоте в течение 1 минуты для восстановления антигена и блокировали 5% нормальной сывороткой козы (NGS) и PBS. Среды инкубировали в течение ночи в разведении 1:1000 биотинилированного первого антитела 4G8 (Signet 4G8, моноклональное мышиное IgG2b-антитело против аминокислотных остатков 17-24 B-амилоида) в 1% NGS/PBS и визуализировали, используя набор ABC Vectastain (Vector Labs), описаный производителем.
B. Результаты
Восстановление/защита функции сетчатки посредством введения дегликозилированного антитела
Как показано на фигуре 5, имеет место статистически значимое уменьшение амплитуды a- и b-волн у мышей ApoE4, получающих корм с высоким содержанием жиров и обогащенный холестерином (E4-HFC) по сравнению с мышами на нормальной диете (E4-ND) (a-волна p=0,0106, b-волна p=0,008). ЭРГ, полученные на инъецированных животных, сравнивали с имеющимся у авторов набором исходных ЭРГ. Не обнаружено значимых различий в амплитудах a-волн между любой инъецированной группой (E4-HFC-R1 и E4-HFC-R2) и E4-HFC (не показано). Напротив, амплитуды b-волн свидетельствуют о поразительном восстановлении и/или защите функции сетчатки в группе E4-HFC-R2 (фигура 6).
Уменьшение отложений Aβ у мышей APOE4 на диете HF-C, которым инъецировали анти-Aβ-антитело 2H6-D. Как показано на фигуре 7, общее иммуноокрашивание Aβ у мышей E4-HFC уменьшалось после 8 недель иммунотерапии антителом 2H6-D, по сравнению с контрольной группой, получавшей носитель.
C. Заключение
Приведенные выше данные демонстрируют: 1) восстановление/защиту функции сетчатки, которые показаны с помощью ЭРГ мышей, которым инъецировали анти-Aβ-антитело 2H6-D; и 2) уменьшение амилоидного отложения при лечении антителом 2H6-D в головном мозге мышей по сравнению с необработанной группой ВМД-мышей.
Пример 5. Определение аффинности связывания антитела 6G и его вариантов
A. Общие способы
В данном примере и других примерах использовали следующие общие способы.
Экспрессирующий вектор, используемый при характеристике клона
Экспрессия Fab-фрагмента антител была под контролем IPTG-индуцируемого промотора lacZ, подобно экспрессии, описанной в Barbas (2001) Phage display: a laboratory manual, Cold Spring Harbor, NY, Cold Spring Harbor Laboratory Press pg 2.10. Однако модификации вектора pComb3X) включали добавление и экспрессию следующих дополнительных доменов: константный домен легкой цепи каппа человека и константный домен CH1 иммуноглобулина IgG2a человека, C-область цепи гамма-2 Ig, белок с номером доступа P01859; легкая цепь каппа иммуноглобулина (homo sapiens), белок с номером доступа CAA09181.
Получение Fab в небольшом масштабе
Экспрессию Fab в небольшом масштабе в 96-луночных планшетах осуществляли следующим образом. Начиная с E. coli, трансформированной библиотекой Fab, отбирали колонии для инокуляции как на основной планшет (агар LB + ампициллин (50 мкг/мл) + 2% глюкоза), так и на рабочий планшет (2 мл/лунку, 96 лунок/планшет, содержащие 1,5 мл LB + ампициллин (50 мкг/мл) + 2% глюкоза). Клетки на двух планшетах выращивали при 30°C в течение 8-12 часов. Основной планшет хранили при 4°C, а клетки из рабочего планшета осаждали при 5000 об/мин и ресуспендировали в 1 мл LB + ампициллин (50 мкг/мл) + 1 мМ IPTG, чтобы индуцировать экспрессию Fab. Клетки собирали центрифугированием после 5-часовой экспрессии при 30°C, затем ресуспендировали в 500 мкл буфера HBS-P (10 мМ HEPES-буфер pH 7,4, 150 мМ NaCl, 0,005% P20). Лизиса ресуспендированных в HBS-P клеток достигали за один цикл замораживания (-80°C), затем оттаивания при 37°C. Лизаты клеток центрифугировали при 5000 об/мин в течение 30 минут, чтобы отделить остатки клеток от надосадков, содержащих Fab-фрагменты. Затем надосадки вводили в устройство для анализа плазмонного резонанса BIAcore, чтобы получить информацию об аффинности для каждого Fab. Клоны, экспрессирующие Fab, собирали из основного планшета, чтобы секвенировать ДНК и использовать для крупномасштабного получения Fab и подробной характеристики, как описано ниже.
Крупномасштабное получение Fab
Чтобы получить подробные кинетические параметры, Fab экспрессировали и очищали из культур большого объема. В колбы Эрленмейера, содержащие 200 мл LB + ампициллин (50 мкг/мл) + 2% глюкозы, инокулировали 5 мл ночной культуры выбранного Fab-экспрессирующего клона E. coli. Клоны инкубировали при 30°C вплоть до достижения OD550нм 1,0 и затем индуцировали заменой среды на 200 мл LB + ампициллин (50 мкг/мл) + 1 мМ IPTG. После 5-часового периода экспрессии при 30°C клетки осаждали центрифугированием, затем ресуспендировали в 10 мл PBS (pH 8). Лизис клеток получали, проводя два цикла замораживания/оттаивания (при -80°C и 37°C соответственно). Надосадок клеточных лизатов наносили на колонки с Ni-NTA-сефарозой Superflow (Qiagen, Valencia. CA), уравновешенные PBS, pH 8, затем промывали 5 объемами колонки PBS, pH 8. Отдельные Fab элюировались в разных фракциях при использовании PBS (pH 8) + 300 мМ имидазол. Фракции, содержащие Fab, объединяли и диализовали против PBS, затем количественно оценивали в ELISA перед характеристикой аффинности.
Получение полного антитела
Для экспрессии полноразмерных антител вариабельные области тяжелой и легкой цепи клонировали в экспрессирующих векторах млекопитающих и трансфицировали, используя липофектамин, в клетки HEK 293 для временной экспрессии. Антитела очищали стандартными способами, используя белок A.
Вектор pDb.6G.hFc2a представляет собой экспрессирующий вектор, содержащий тяжелую цепь антитела 6G, и подходит для временной или стабильной экспрессии тяжелой цепи. Вектор pDb.6G.hFc2a имеет нуклеотидные последовательности, соответствующие следующим областям: промоторная область цитомегаловируса мышей (нуклеотиды 1-612); синтетический интрон (нуклеотиды 619-1507); кодирующая область DHFR (нуклеотиды 707-1267); сигнальный пептид гормона роста человека (нуклеотиды 1525-1602); вариабельная область тяжелой цепи 6G; константная область тяжелой цепи IgG2a человека, содержащая следующие мутации: A330P331 → S330S331 (нумерация аминокислот в соответствии с последовательностью IgG2 дикого типа; смотри Eur. J. Immunol. (1999) 29: 2613-2624); поздний сигнал полиаденилирования SV40; область энхансера SV40; область фага f1 и кодирующая область бета-лактамазы (AmpR).
Вектор pEb.6G.hK представляет собой экспрессирующий вектор, содержащий легкую цепь антитела 6G, и подходит для временной экспрессии легкой цепи. Вектор pEb.6G.hK имеет нуклеотидные последовательности, соответствующие следующим областям: промоторная область цитомегаловируса мышей (нуклеотиды 1-612); интрон EF-1 человека (нуклеотиды 619-1142); сигнальный пептид гормона роста человека (нуклеотиды 1173-1150); вариабельная область легкой цепи антитела 6G; константная область цепи каппа человека; поздний сигнал полиаденилирования SV40; область энхансера SV40; область фага f1 и кодирующая область бета-лактамазы (AmpR).
Анализ Biacore
Аффинности моноклонального антитела 6G определяли, используя систему поверхностного плазмонного резонанса (SPR) BIAcore3000™ (BIAcore, INC, Piscaway NJ) способами, описанными в примере 1 выше.
АНАЛИЗ ELISA
ELISA использовали для измерения связывания антитела 6G и его вариантов с небиотинилированными пептидами Aβ. Планшеты NUNC maxisorp покрывали 2,5 мкг/мл пептидов Aβ в PBS, pH 7,4, в течение более 1 часа при 4°C. Планшеты блокировали 1% БСА в PBS-буфере pH 7,4. Первое антитело (из надосадков клеток, содержащее сыворотку анти-Aβ-антитело или очищенное полноразмерное антитело или Fab в требуемом разведении) инкубировали с иммобилизованными пептидами Aβ в течение 1 часа при комнатной температуре. После промывки планшеты инкубировали со вторым антителом, конъюгированным с HRP антителом козы против цепи каппа человека (MP Biomedicals, 55233) в разведении 1:5000. После промывки измеряли второе антитело, добавляя субстрат TMB (KPL, 50-76-02, 50-65-02). Реакцию HRP останавливали добавлением 1 М фосфорной кислоты и измеряли оптическую плотность при 450 нм.
ELISA использовали для измерения связывания антитела 6G и его вариантов с биотинилированными пептидами Aβ. Планшеты NUNC maxisorp покрывали 6 мкг/мл стрептавидина (Pierce, 21122) в PBS, pH 7,4, в течение более 1 часа при 4°C. Планшеты блокировали 1% БСА в PBS-буфере, pH 7,4. После промывки биотинилированные пептиды Aβ в PBS, pH 7,4, инкубировали 1 час при комнатной температуре. Первое антитело (из надосадков клеток, содержащее сыворотку анти-Aβ-антитело или очищенное полноразмерное антитело или Fab в разных разведениях) инкубировали с иммобилизованными пептидами Aβ в течение 1 часа при комнатной температуре. После промывки планшеты инкубировали со вторым антителом, конъюгированным с HRP антителом козы против цепи каппа человека (MP Biomedicals, 55233) в разведении 1:5000. После промывки связанное второе антитело измеряли, добавляя субстрат TMB (KPL, 50-76-02, 50-65-02). Реакцию HRP останавливали добавлением 1 М фосфорной кислоты и оптическую плотность измеряли при 450 нм.
B. Аффинность связывания антитела 6G и его вариантов с пептидами Aβ1-40, Aβ1-42 и другими пептидами Aβ
Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи антитела 6G показаны на фигуре 8. Аффинность связывания антитела 6G с Aβ1-40, Aβ1-42 и Aβ22-37, определяемая с использованием Biacore, описанного выше, показана в таблице 7 ниже.
Аффинность связывания Fab-фрагмента антитела 6G
Аминокислотная последовательность вариантов 6G показана в таблице 8 ниже. Все аминокислотные замены в вариантах, показанных в таблице 8, описаны относительно последовательности 6G. Относительное связывание вариантов 6G также показано в таблице 8. Связывание определяли в ELISA, описанном выше, используя небиотинилированный Aβ1-40 или Aβ1-42, иммобилизованный на поверхности планшета для ELISA.
Аминокислотные последовательности и данные о связывании вариантов антитела 6G
Пример 6: Характеристика эпитопа на пептиде Aβ, с которым связывается антитело 6G
Чтобы определить эпитоп на пептиде Aβ, который узнается антителом 6G, использовали анализ связывания ELISA. Различные пептиды Aβ (Global Peptide Services, CO) иммобилизовали на планшете для ELISA. Связывание полного антитела 6G (20 нМ) с иммобилизованным Aβ определяли в ELISA, как описано выше. Аминокислотные последовательности Aβ1-40, Aβ1-42 и Aβ1-43 показаны в таблице 9 ниже. Как показано на фигуре 9, антитело 6G связывается с пептидами Aβ 17-40, 17-42, 22-35, 28-40, 1-38, 1-40, 1-42, 1-43 и 28-42; но связывание с 28-42 намного слабее, чем связывание с другими пептидами Aβ. Антитело 6G не связывалось с пептидами Aβ 1-16, 1-28 и 33-40. Таким образом, антитело 6G связывается с C-концом различных укороченных пептидов Aβ, например 22-35, 1-38, 1-40, 1-42 и 1-43.
В таблице 9 показано сравнение аффинности связывания 6G с Aβ1-40 и другими пептидами Aβ, которую измеряли на основании koff (1/сек), используя анализ Biacore. Антитело 6G связывается с Aβ1-40 с наибольшей аффинностью по сравнению с другими пептидами со значительно более низкой аффинностью по отношению к укороченному Aβ1-40 (такому, как 1-36, 1-37, 1-38 и 1-39), к Aβ1-42 и Aβ1-43. Полученные данные свидетельствуют, что боковая цепь или остов аминокислоты 40 (валина) Aβ вовлечены в связывание 6G с Aβ1-40; и связывание значительно снижается (например, аффинность примерно от 10 до 50-250 раз меньше) в отсутствие указанной аминокислоты. Связывание с более низкой аффинностью с амидированным на карбоксильном конце Aβ1-40 показывает, что в связывание 6G с Aβ1-40 вовлечен свободный C-конец Aβ1-40, но связывание не зависит от него. Связывание с более низкой аффинностью с Aβ1-42 и Aβ1-43 может быть следствием конформационных различий между мономерными формами Aβ1-40 и Aβ1-42 или Aβ1-43. Показано, что мономер Aβ1-42 имеет конформацию, отличающуюся от конформации мономера Aβ1-40 в растворе. Смотри координаты структуры мономера Aβ1-42, показанные в базе данных о белках (pdb files) с номером доступа 1IYT, и координаты структуры мономера Aβ1-40, показанные в базе данных о белках (pdb files) с номером доступа 1BA6 и 1BA4.
# пептид с амидированнным карбоксильным концом
Картирование эпитопов антитела 6G осуществляли, используя анализ ELISA. Биотинилированный 15-мер или 10-мер различных пептидов Aβ (указанные пептиды имеют глицин, добавленный к C-концу) иммобилизовали на планшетах, покрытых стрептавидином. Антитело 6G (от 2,5 мкг/мл до 10 мкг/мл) инкубировали с иммобилизованными пептидами и измеряли связывание, как описано выше. Как показано на фигуре 10, антитело 6G связывается с пептидами Aβ, содержащими аминокислоты 20-34, 21-35, 22-36, 23-37, 24-38, 25-39 и 25-34 с глицином на C-конце; но не связыванием с пептидами Aβ, содержащими аминокислоты 19-33, 26-40, 27-41, 24-33 и 26-35, имеющими глицин на C-конце указанных пептидов. Полученные результаты свидетельствуют, что эпитоп, с которым связывается антитело 6G, включает в себя аминокислоты 25-34.
На основании приведенных выше данных сделан вывод, что эпитоп, с которым связывается антитело 6G, по-видимому, включает в себя аминокислоты 25-34 и 40. Фигура 11 является схемой, на которой показан эпитоп антитела 6G.
B. Антитело 6G не связывается с APP
Чтобы определить, связывается ли 6G с белками-предшественниками амилоида (APP), определяли связывание 6G с клетками, трансфицированными APP дикого типа. Клетки HEK293 трансфицировали кДНК, кодирующей белок-предшественник амилоида дикого типа человека. Через сорок восемь часов после трансфекции клетки инкубировали на льду в течение 45 минут с моноклональными антителами анти-Aβ1-16 (m2324) или 6G (5 мкг/мл в DMEM с 10% FCS). Затем клетки промывали три раза по 5 минут в PBS, фиксировали в 4% PFA. Клетки промывали три раза снова в PBS и регистрировали связывание антител с использованием второго конъюгированного с Cy3 антитела козы против Ig мыши (разведение 1:500) из Jackson Immunoresearch в флуоресцентном микроскопе.
Как показано на фигуре 12, анти-Aβ1-16-антитело, которое узнает N-концевые эпитопы в Aβ, проявляет значительную степень связывания с белками-предшественниками APP, экспрессированными на клетках. Напротив, 6G не связывается с клетками, экспрессирующими APP.
Пример 7: Получение и характеристика мышиного антитела 7G10 (анти-Aβ1-42/Aβ1-43)
Мышей иммунизировали ~100 мкг пептида, конъюгированного с KLH в адъювант, как описано в Konig, G. et al, Annals New York Academy of Sciences. 777: 344-55 (1996). Так как положения 29-42 пептида BA4 полностью лежат в предполагаемой трансмембранной области APP и являются гидрофобными по своей природе, то пептид KLH конъюгировали с гидрофильным спейсером. KLH-HDGDGD-MVGGVVIA синтезировали в Anaspec, и спейсер из 5 остатков был достаточным, чтобы преодолеть проблемы нерастворимости и продлить C-конец дальше от носителя. В первый день мышей иммунизировали 100 мкг пептида 35-42/KLH с CFA (полный адъювант Фрейнда) подкожно. На 15 день мышей иммунизировали 100 мкг пептида/KLH Ribi/квасцами. На 55 день мышей иммунизировали, как на 15 день. На 95 день мышей подвергали бустер-иммунизации 100 мкг пептида/KLH внутривенно.
От иммунизированной мыши получали спленоциты и на 99 день сливали с клетками миеломы P3x63Ag8.653, ATCC CRL 1580, в соотношении 10:1, используя полиэтиленгликоль 1500. Слитые клетки высевали в 96-луночные планшеты в DMEM, содержащую 20% сыворотки лошади и 2-оксалоацетат/пируват/инсулин (Sigma), и анализировали надосадки, начиная с 10 дня после слияния, используя анализ ELISA, в котором планшеты покрывали 2 мкг/мл Aβ1-42 (Anaspec). Позитивные клоны отбирали, размножали и далее характеризовали.
Титр в сыворотке мышей в день слияния составлял 1/9000 в случае тестирования по отношению к свободном пептиду Aβ1-42. Аффинность связывания 7G10 с Aβ1-40, 1-42 и 1-43 анализировали в Biacore.
Анализ Biacore
Аффинности антитела 7G10 определяли, используя BIAcore3000®, как описано ранее в примере 1. N-биотинилированный Aβ1-40, 1-42 и 1-43 улавливали на чипе SA. Инъецировали трехкратные серийные разведения Fab анти-Aβ1-40, Fab анти-Aβ1-42 и Fab анти-Aβ1-43 соответственно, начиная с разведения 1/6 исходного раствора 7G10, описанного выше. Чип регенерировали, используя 18-секундную импульсную промывку 6% EtOH + 6 мМ NaOH.
(мг/мл)
(мг/мл)
(мл)
Как указано выше, 7G10 имело KD 37,6 нМ по отношению к пептиду Aβ1-42 и KD 41 нМ по отношению к пептиду Aβ1-43. Не выявляли измеряемого связывания с пептидом Aβ1-40.
Пример 10: Сравнительные эффекты антител 9TL, 6G и 7G10 в отношении защиты и восстановления функции сетчатки в животной модели возрастной макулярной дегенерации.
A. Экспериментальный протокол
Введение антител. Повторяли протокол, который описан в примере 4 выше. ApoE4-трансгенных мышей 65-недельного или более старшего возраста распределяли в одну из 5 групп на восемь недель. Первую группу (E4-ND) постоянно содержали на обычной диете (n=6). Вторая группа (E4-HFC-R1) получала корм с высоким содержанием жиров, обогащенный холестерином (HF-C), в течение 8 недель (n=12). Третья группа (E4-HFC-R1) получала корм HF-C в течение 8 недель и еженедельно получала внутрибрюшинные инъекции Rinat 3 (3 мг/кг) (n=12). Четвертая группа (E4-HFC-R2) получала корм HF-C в течение 8 недель и еженедельно получала внутрибрюшинные инъекции Rinat 4 (3 мг/кг) (n=12). Пятая группа (E4-HFC-R) получала корм HF-C в течение 8 недель и еженедельно получала внутрибрюшинные инъекции Rinat 5 (3 мг/кг) (n=12). После завершения исследования раскрывали кодировку групп: Rinat 3 представлял собой 7G10; Rinat 4 представлял собой дегликозилированное анти-Aβ-антитело 2H6; и Rinat 5 представлял собой 6G.
Исследования дна и ангиограммы с использованием флуоресцеина получали, как описано ранее в примере 4 выше. Регистрацию ЭРГ осуществляли через восемь недель, как описано ранее в примере 4 выше.
Результаты
Восстановление/защита функции сетчатки посредством введения дегликозилированного антитела
Как показано на фигуре 13, амплитуды b-волн подтверждают значимое восстановление и/или защиту функции сетчатки в группе, обработанной 2H6 (E4-HFC анти-Aβ1-40). Амплитуды b-волн свидетельствуют о небольшом восстановлении или об отсутствии восстановления в группе, обработанной 7G10 (E4-HFC анти-Aβ1-42/Aβ1-43). Неожиданно амплитуды b-волн свидетельствуют о еще большем восстановлении и/или защите функции сетчатки в группе, обработанной 6G (E4-HFC анти-Aβ1-40/Aβ1-42). Как показано на фигуре 14, амплитуда b-волн в группе, обработанной 6G, была сравнима с контрольной группой нормальных мышей, что свидетельствует о полном восстановлении и/или защите функции сетчатки.
Заключение
Приведенные выше данные демонстрируют, 1) что амилоид под ПЭС является патогенным и/или токсичным при ВМД; 2) значимое восстановление/защиту функции сетчатки, как показано с использованием ЭРГ, у мышей, которым инъецировали анти-Aβ-антитело 2H6-D; и 3) полное восстановление/защиту функции сетчатки, как показано с помощью ЭРГ, у мышей, которым инъецировали биспецифичное анти-Aβ1-40/Aβ1-42-антитело 6G.
Понятно, что примеры и варианты осуществления изобретения, описанные в настоящей публикации, являются только иллюстративными и что различные модификации или изменения в свете приведенного описания могут быть осуществлены специалистами в данной области и не являются отклонением от сути и объема настоящей заявки. Все публикации, патенты и заявки на выдачу патента, цитированные в настоящем описании, включены в виде ссылки в полном объеме для всех целей в такой же степени, как и в том случае, если бы специально и по отдельности было указано, что каждая отдельная публикация, патент или заявка на выдачу патента включены в виде ссылки.
Депозит биологического материала
Следующие материалы были депонированы в Американской коллекции типов культур, 10801 University Boulevard, Manassas, Virginia 20110-2209, USA (ATCC):
Вектор pEb.9TL.hK является полинуклеотидом, кодирующим вариабельную область легкой цепи 9TL и константную область легкой цепи каппа; и вектор pDb.9TL.hFc2a является полинуклеотидом, кодирующим вариабельную область тяжелой цепи 9TL и константную область тяжелой цепи IgG2a, содержащую следующие мутации: A330P331 → S330S331 (нумерация аминокислот в соответствии с последовательностью IgG2 дикого типа; смотри Eur. J. Immunol. (1999) 29: 2613-2624).
Вектор pEb.6G.hK является полинуклеотидом, кодирующим вариабельную область легкой цепи 6G и константную область легкой цепи каппа; и вектор pDb.6G.hFc2a является полинуклеотидом, кодирующим вариабельную область тяжелой цепи 6G и константную область тяжелой цепи IgG2a, содержащую следующие мутации: A330P331 → S330S331 (нумерация аминокислот в соответствии с последовательностью IgG2 дикого типа; смотри Eur. J. Immunol. (1999) 29: 2613-2624).
Указанное депонирование осуществляли по условиям Будапештского договора о признании депонирования микроорганизмов для целей патентной процедуры и нормативных актов на его основе (Будапештский договор). Это гарантирует поддержание жизнеспособной культуры депозита в течение 30 лет от даты депонирования. Депозит будет доступен в ATCC по условиям Будапештского договора и с учетом соглашения между Rinat Neuroscience Corp. и ATCC, которая гарантирует постоянную и неограниченную доступность потомства культуры депозита для общественности после опубликования соответствующего патента США или после выкладки для общественности любой заявки на выдачу патента США или заявки на выдачу патента другой страны, какая бы не появилась первой, и гарантирует доступность потомства лицу, определяемому руководителем ведомства США по патентам и торговым маркам как лицо, имеющее на это право согласно 35 USC, статья 122, и согласно соответствующим правилам руководителя ведомства (включая 37 CFR, статья 1.14 с конкретной ссылкой на 886 OG 638).
Правопреемник настоящей заявки согласен, что если культура депонированного материала погибнет или будет утрачена или разрушена при культивировании в подходящих условиях, то при уведомлении материалы будут быстро заменены другими такими же материалами. Доступность депонированного материала не следует толковать как право на практическое использование изобретения в нарушение прав, предоставляемых ведомством любого государства в соответствии с его патентными законами.
Последовательности антител
Аминокислотная последовательность вариабельной области тяжелой цепи 9TL (SEQ ID NO: 1)
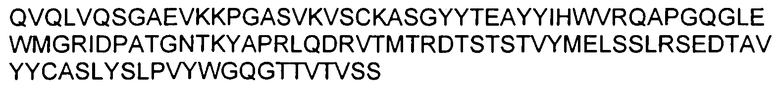
Аминокислотная последовательность вариабельной области легкой цепи 9TL (SEQ ID NO: 2)
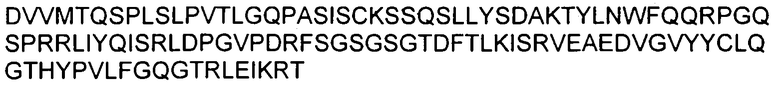
9TL CDR H1 (расширенная CDR) (SEQ ID NO: 3)

9TL CDR H2 (расширенная CDR) (SEQ ID NO: 4)

9TL CDR H3 (расширенная CDR) (SEQ ID NO: 5)
9TL CDR L1 (расширенная CDR) (SEQ ID NO: 6)

9TL CDR L2 (расширенная CDR) (SEQ ID NO: 7)
9TL CDR L3 (расширенная CDR) (SEQ ID NO: 8)

Нуклеотидная последовательность вариабельной области тяжелой цепи 9TL (SEQ ID NO: 9)
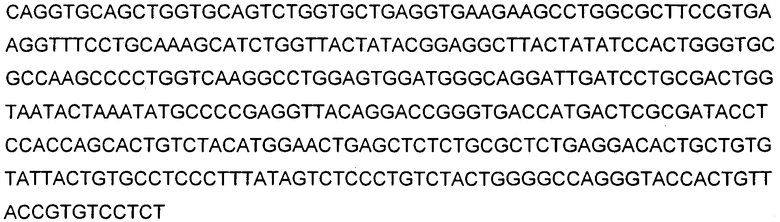
Нуклеотидная последовательность вариабельной области легкой цепи 9TL (SEQ ID NO: 10)
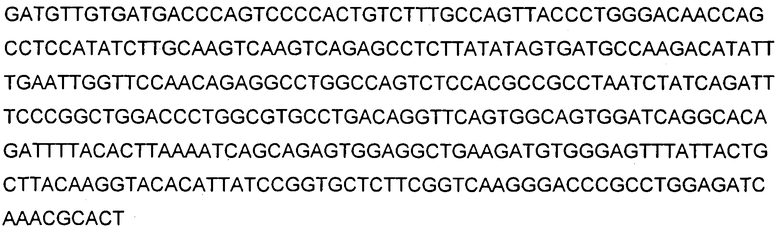
Аминокислотная последовательность тяжелой цепи полного антитела 9TL (включая модифицированный IgG2A, который описан в настоящей публикации) (SEQ ID NO: 11)


Аминокислотная последовательность легкой цепи полного антитела 9TL (SEQ ID NO: 12)

Нуклеотидная последовательность тяжелой цепи полного антитела 9TL (включая модифицированный IgG2A, который описан в настоящей публикации) (SEQ ID NO: 13)

Нуклеотидная последовательность легкой цепи полного антитела 9TL (SEQ ID NO: 14)

Аминокислотная последовательность вариабельной области тяжелой цепи 6G (SEQ ID NO: 26)

Аминокислотная последовательность вариабельной области легкой цепи 6G (SEQ ID NO: 27)

6G CDR H1 (расширенная CDR) (SEQ ID NO: 28)

6G CDR H2 (расширенная CDR) (SEQ ID NO: 29)

6G CDR H3 (расширенная CDR) (SEQ ID NO: 30)
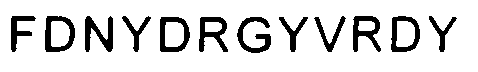
6G CDR L1 (расширенная CDR) (SEQ ID NO: 31)

6G CDR L2 (расширенная CDR) (SEQ ID NO: 32)
6G CDR L3 (расширенная CDR) (SEQ ID NO: 33)

Нуклеотидная последовательность вариабельной области тяжелой цепи 6G (SEQ ID NO: 34)
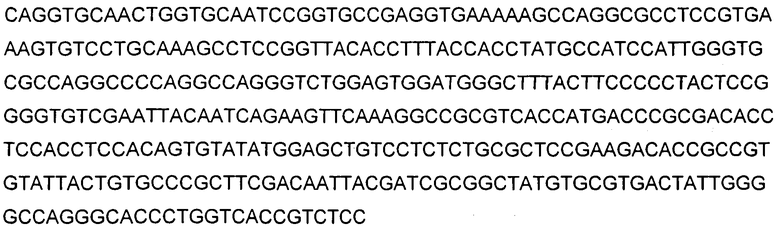
Нуклеотидная последовательность вариабельной области легкой цепи 6G (SEQ ID NO: 35)
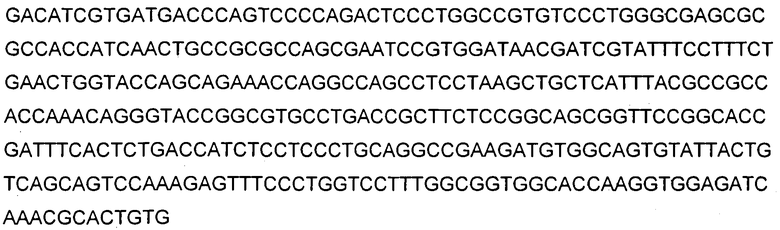
Аминокислотная последовательность тяжелой цепи полного антитела 6G (включая модифицированный IgG2A, который описан в настоящей публикации) (SEQ ID NO: 36)

Аминокислотная последовательность легкой цепи полного антитела 6G (SEQ ID NO: 37)
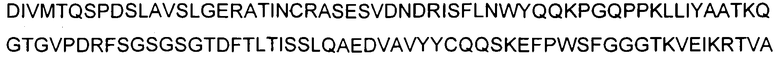

Нуклеотидная последовательность тяжелой цепи полного антитела 6G (включая модифицированный IgG2A, который описан в настоящей публикации) (SEQ ID NO: 38)

Нуклеотидная последовательность легкой цепи полного антитела 6G (SEQ ID NO: 39)

Аминокислотная последовательность тяжелой цепи m7G10 (SEQ ID NO: 40)
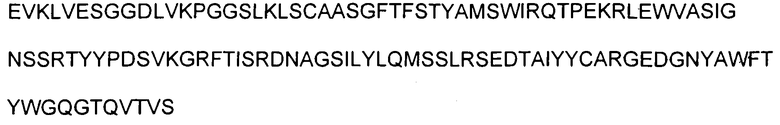
Аминокислотная последовательность легкой цепи m7G10 (SEQ ID NO: 41)
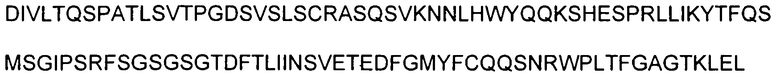
Аминокислотная последовательность CDR H1 m7G10 (SEQ ID NO: 42)

Аминокислотная последовательность CDR H2 m7G10 (SEQ ID NO: 43)

Аминокислотная последовательность CDR H3 m7G10 (SEQ ID NO: 44)

Аминокислотная последовательность L1 m7G10 (SEQ ID NO: 45)
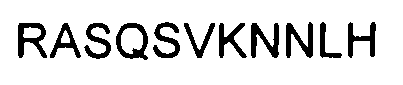
Аминокислотная последовательность L2 m7G10 (SEQ ID NO: 46)

Аминокислотная последовательность L3 m7G10 (SEQ ID NO: 47)

Нуклеотидная последовательность тяжелой цепи m7G10HC (SEQ ID NO: 48)
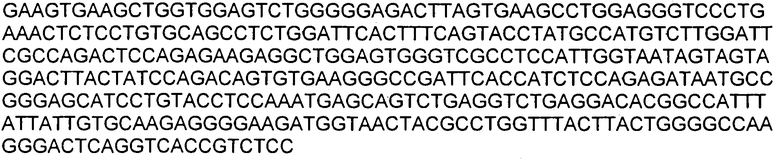
Нуклеотидная последовательность легкой цепи m7G10HC (SEQ ID NO: 49)

| название | год | авторы | номер документа |
|---|---|---|---|
| БЕЗОПАСНЫЕ И ФУНКЦИОНАЛЬНЫЕ ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА | 2011 |
|
RU2607368C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ КОНЕЧНЫХ ПРОДУКТОВ ГЛУБОКОГО ГЛИКИРОВАНИЯ (RAGE) И ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2518351C2 |
| АНТИТЕЛА К БЕТА-АМИЛОИДУ | 2013 |
|
RU2689674C2 |
| МОНОКЛОНАЛЬНОЕ ТЕЛО ПРОТИВ АМИЛОИДА БЕТА | 2008 |
|
RU2571856C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО | 2008 |
|
RU2538709C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К АМИЛОИДУ БЕТА | 2013 |
|
RU2668161C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К АМИЛОИДУ БЕТА | 2008 |
|
RU2567151C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2432362C2 |
| ГУМАНИЗИРОВАННОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ Aβ и ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2783528C1 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА-БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2571859C2 |

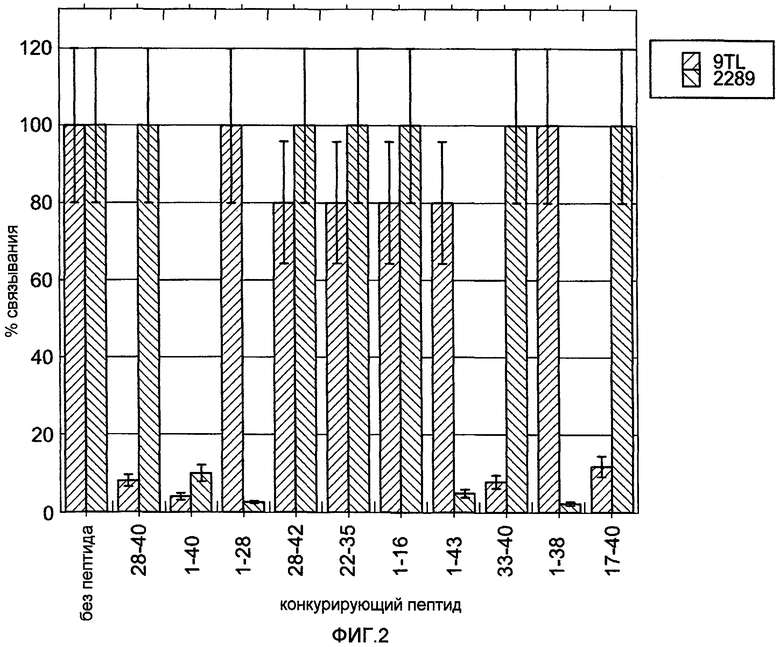
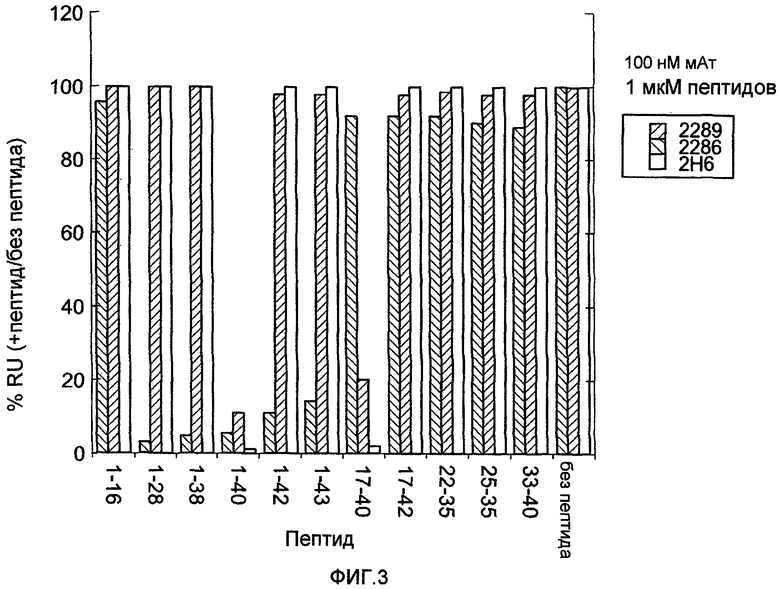
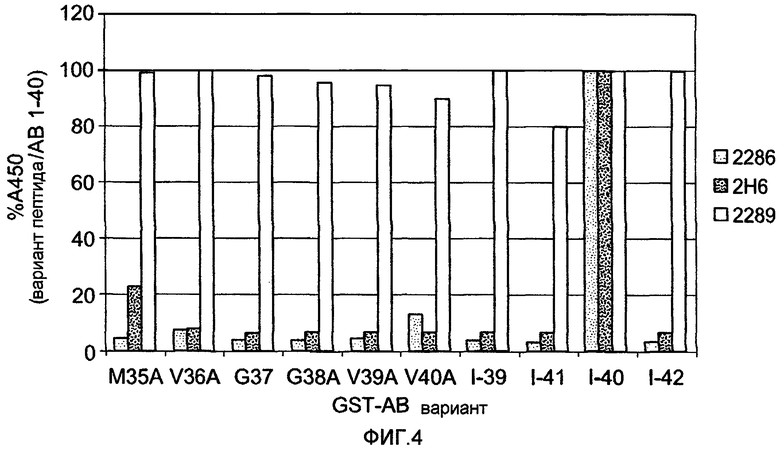
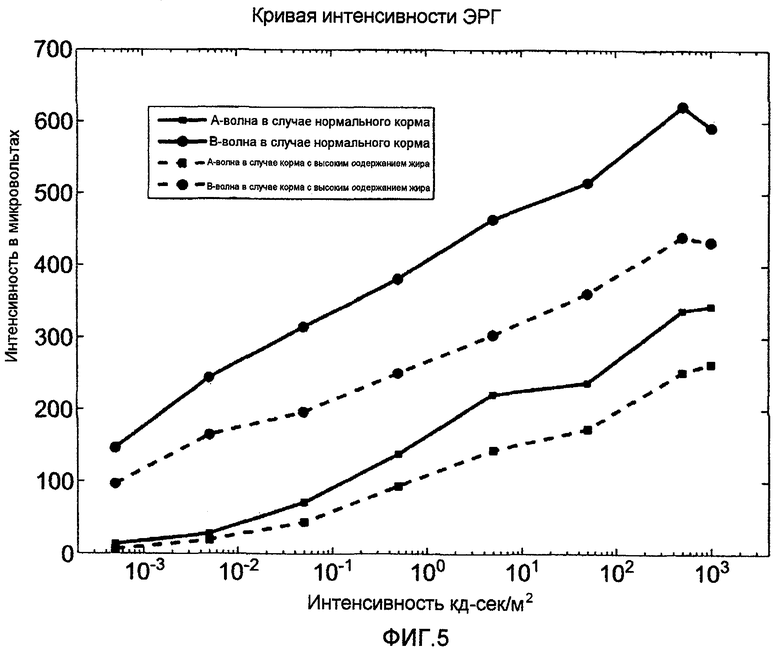
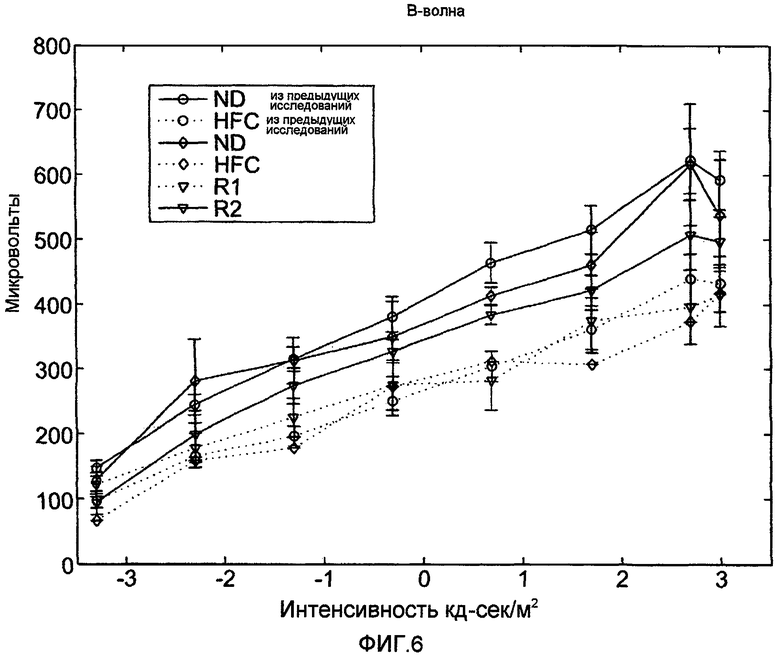
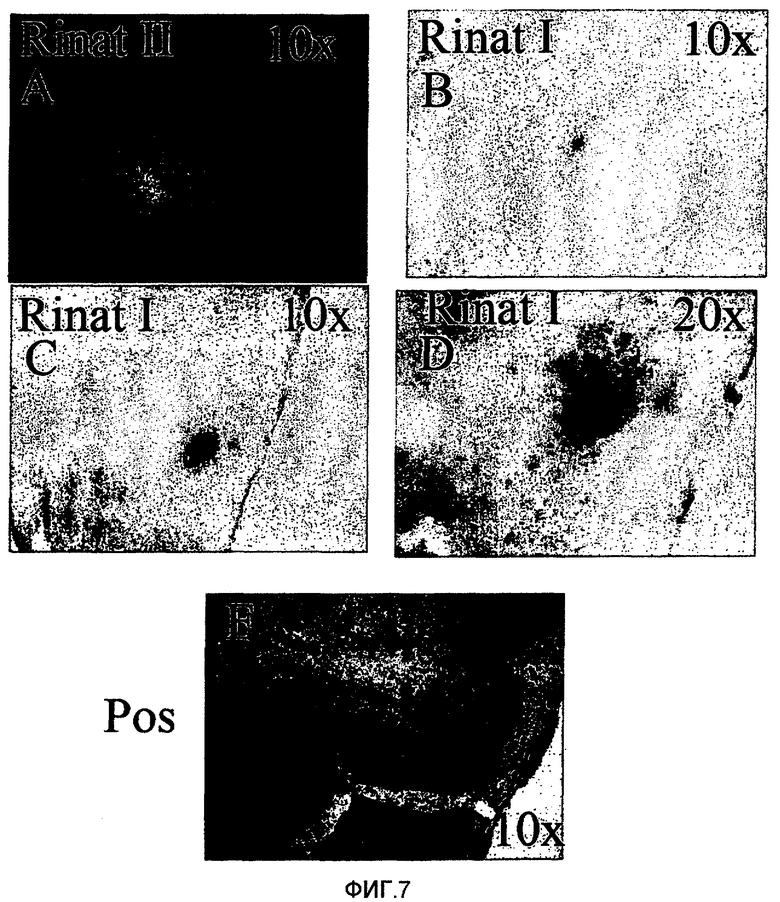

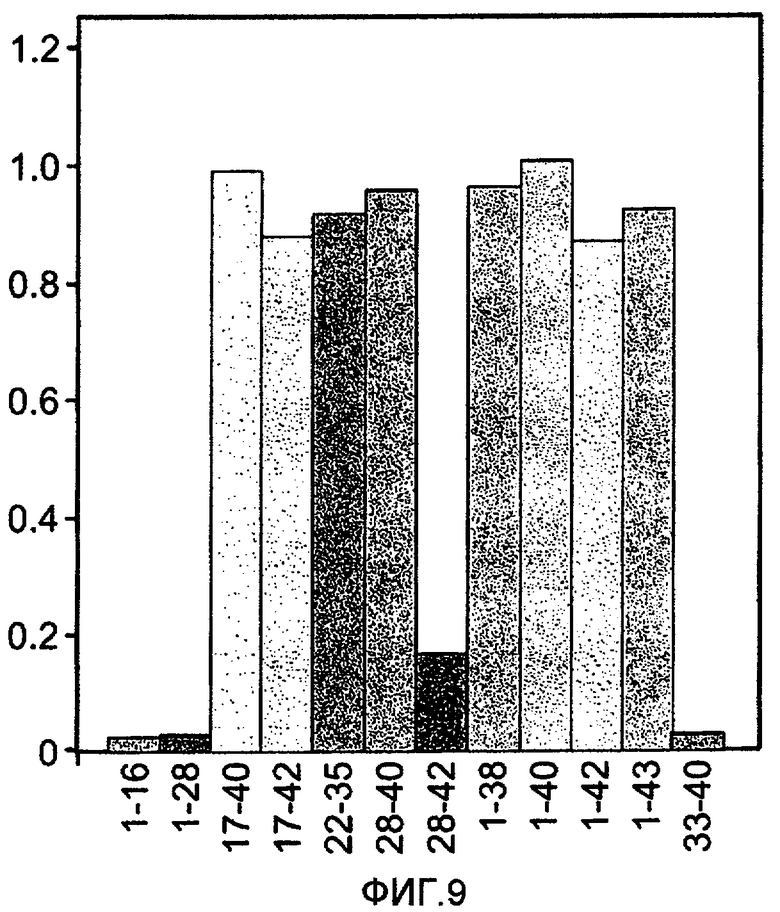

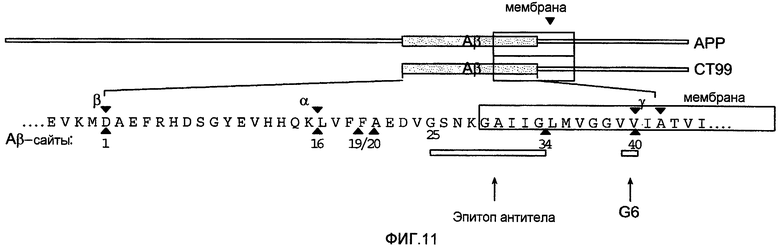
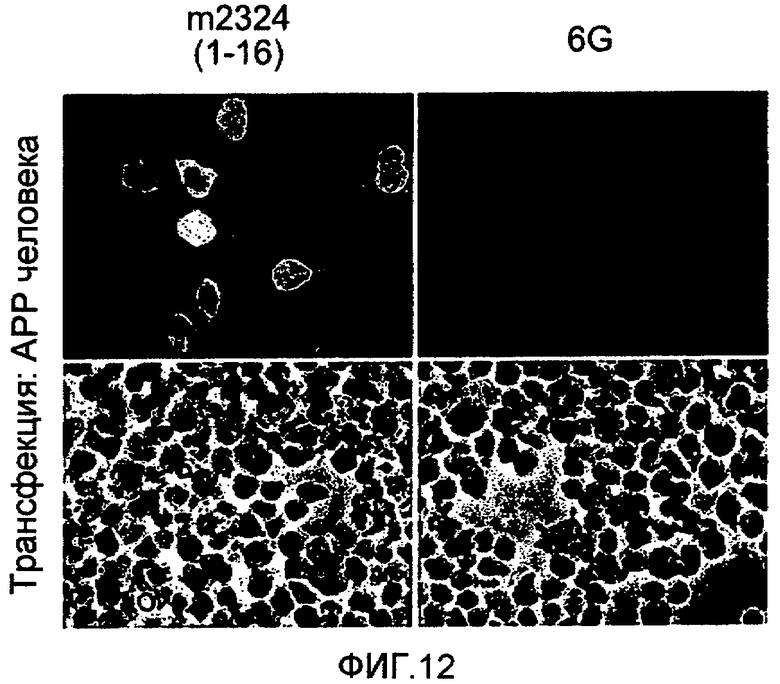
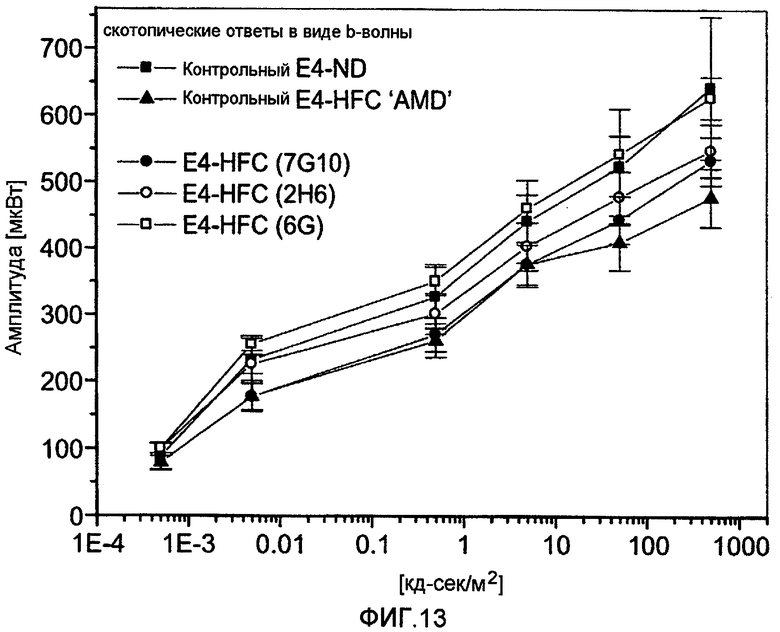
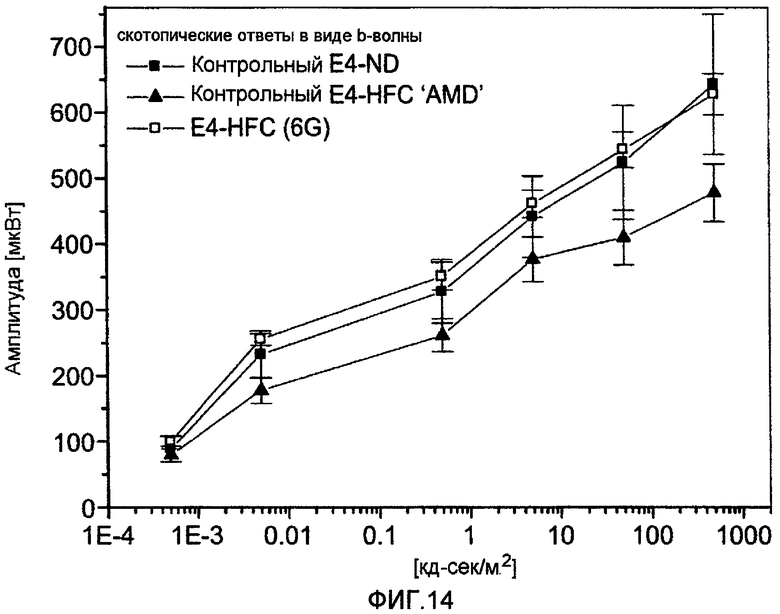
Группа изобретений относится к медицине, а именно к офтальмологии, и может быть использована для лечения возрастной макулярной дегенерации. Для этого вводят эффективное количество антитела, которое специфично связывается с пептидом Аβ1-40, или антитела, которое специфично связывается с эпитопом на Аβ1-40 и Aβ1-42. Введение антител позволяет восстановить функции сетчатки. 2 н. и 11 з.п.ф-лы, 9 табл., 14 ил.
1. Способ лечения субъекта, страдающего от возрастной макулярной дегенерации, включающий введение субъекту эффективного количества антитела, которое специфично связывается с пептидом Aβ1-40.
2. Способ по п.1, в котором антитело также специфично связывается с эпитопом на Aβ1-42.
3. Способ по п.1, в котором антитело связывается с пептидом Aβ1-40 с KD примерно 100 нМ или меньше.
4. Способ по п.2, в котором антитело также связывается с пептидом Aβ1-42 с KD примерно 100 нМ или меньше.
5. Способ по п.1, в котором антитело связывается с С-концом пептида Аβ.
6. Способ по п.1, в котором антитело связывается с эпитопом на Aβ1-40, который включает в себя аминокислоты 25-34 и 40.
7. Способ по п.1, в котором антитело связывается с Aβ1-40 с более высокой аффинностью, чем его связывание с Аβ1-42 и Aβ1-43, и в котором антитело не является антителом 2294.
8. Способ по п.1, в котором Fc-область антитела не N-гликозилирована или имеет картину N-гликозилирования, которая изменена по сравнению с нативной Fc-областью.
9. Способ по п.1, в котором антитело имеет вариабельную область тяжелой цепи, содержащую три определяющих комплементарность области (CDR) из вариабельной области тяжелой цепи антитела 6G, показанной в SEQ ID NO:26, и вариабельную область легкой цепи, содержащую три CDR из вариабельной области легкой цепи антитела 6G, показанной в SEQ ID NO:27.
10. Способ по п.1, в котором антитело имеет вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, показанную в SEQ ID NO:26, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, показанную в SEQ ID NO:27.
11. Способ по п.1, в котором антитело имеет аминокислотную последовательность тяжелой цепи, показанную в SEQ ID NO:36, и аминокислотную последовательность легкой цепи, показанную в SEQ ID NO:37.
12. Способ лечения субъекта, страдающего от возрастной макулярной дегенерации, включающий в себя введение субъекту эффективного количества антитела, при этом антитело специфично связывается с эпитопом на Aβ1-40 и Aβ1-42.
13. Способ по п.12, в котором введение антитела вызывает существенное восстановление функции сетчатки.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СПОСОБ ЛЕЧЕНИЯ СЕНИЛЬНОЙ МАКУЛЯРНОЙ ДЕГЕНЕРАЦИИ С НЕОВАСКУЛЯРНЫМ СИНДРОМОМ | 2003 |
|
RU2271208C2 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
Авторы
Даты
2011-11-27—Публикация
2008-03-06—Подача