Изобретение относится к органической химии, а именно к дигидрохлоридам N-[β -(1,2,5-триметил-4-арилпиперидин-4-ил)-этил)-N-алкил-N-(3,4-диметоксибензил) аминобщей формулы
CH3N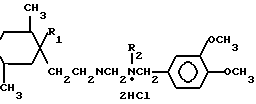 где R1 CH2Ph, R2 CH2CN a);
где R1 CH2Ph, R2 CH2CN a);
R1 Ph, R2 CH2CN (б);
R1 Ph, R2 CH3 (в), являющимся ингибиторами кальций-кальмодулинзависимых процессов, которые могут найти применение в медицине.
Целью изобретения является поиск малотоксичных соединений,ингибирующих кальций-кальмодулинзависимые процессы и обладающих способностью оказывать антифибрилляторное действие.
Поставленная цель достигается предлагаемыми дигидрохлоридами N-[ β-(1,2,5-триметил-4-арилпиперидин-4-ил)этил] -N-алкил-N-(3,4- диметоксибензил)аминов, которые получают восстановлением алюмогидридом лития 1,2,5-триметил-4-арил-4-цианометилпиперидинов в N-[ β-(1,2,5-триметил-4-арилпиперидин-4-ил)этил] амины, конденсацией последних с вератролальдегидом, восстановлением полученных N-[ β-(1,2,5-триметил-4-арилпиперидин-4-ил)этил]-N-β -(3,4-диметокси)бензальдиминов до N-[β-(1,2,5-триметил-4-арилпиперидин-4-ил)этил] -N-β-(3,4-диметоксибензил)ами нов, цианометилированием последних с образованием N-[ β-(1,2,5-триметил-4-арилпиперидин-4-ил)этил] -N-цианометил-N-(3,4- диметокси)бензиламинов и метилированием N-[ β-(1,2,5-триметил-4-фенилпиперидин-4-ил)этил] -N-3,4-диметоксибензил)амина с последующим действием на полученные соединения эфирным раствором хлористого водорода по схеме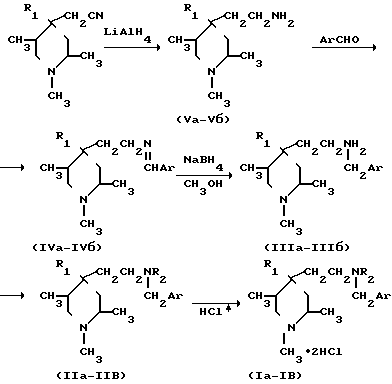
 где
где
Ar  H3
H3
R1 CH2P R2 CH2CN (a);
R1 Ph, R2 CH2CN (б);
R1 Ph, R2 CH3 (в)-.
Исходные 1,2,5-триметил-4-арил-4-цианометилпиперидины в качестве полупродуктов для синтеза биологически активных соединений являются предметом самостоятельной заявки на изобретение.
Строение полученных соединений доказано методом элементного анализа, ИК-МПР-спектроскопией и масс-спектрометрически. Чистота определена на Silufol UV-254, проявитель пары йода.
Дигидрохлориды N-[ β-(1,2,5-триметил-4-бензилпиперидин-4-ил)-этил-N-цианометил-N-(3,4-диметокси бенз(соединение 1а), N-[ β-(1,2,5-триметил-4-фенилпиперидин-4-ил)этил]-N-цианометил-N-(3,4-диметоксиб ензи(соединение 1б) и N-[β -(1,2,5-триметил-4-фенилпиперидин-4-ил)этил]-N-метил-N-(3,4-диметоксибензил) амин(соединение 1в) представляют собой белые порошкообразные вещества со слабым запахом, растворимые в воде, этаноле, нерастворимые в эфире.
П р и м е р 1. N-[β -(1,2,5-Триметил-4-бензилпиперидин-4-ил)этиламин (Vа).
К охлажденному раствору 4,8 г (0,12 моль) алюмогидрида лития в 100 мл сухого эфира по каплям прибавляют раствор 22 г (0,084 моль) N-[ β-(1,2,5-триметил-4-бензилпиперидин-4-ил)] -ацетонитрила в 120 мл сухого эфира, поддерживая температуру реакционной среды при 0оС. После охлаждения смесью льда и соли последовательно прибавляют 4,8 мл 15%-ного раствора гидроокиси натрия и 14,5 мл воды, отфильтровывают неорганический осадок и после отгонки эфира остаток перегоняют в вакууме. Выход 18,8 г (85,4%), т.кип. 169-171оС/2 мм рт.ст. Rf 0,53 (н-бутанол:уксусная кислота:вода, 4:2:5).
Найдено, М 78,28; Н 10,90; N 10,67;
С17Н28N2
Вычислено, С 78,41; Н 10,84; N 10,76.
ИК-спектр, ν см-1: 1590, 1610 (СC аром.), 3300, 3370 (NH2).
Спектр ПМР (CDCl3 + ТМС), δ м.д. 7,20 с (5Н, Ph); 3,20,-2,37 м (4Н, СН2NH2, СН2Ph); 2. 22 с (3Н, NCH3); 2,35-2,00 м (2Н, 2,5 СН); 1,60 с (2Н, NH2); 1,45-1,25 (4Н, 6-СН2, СН2СН2NH2); 1,35-0,80 м (8Н, 3-СН2, 2,5-СН3).
П р и м е р 2. N-[ β-(1,2,5-Триметил-4-фенилпиперидин-4-ил)этил]-амин (Vб).
Пpоцесс ведут аналогично примеру 1 с 8,5 г (0,22 моль) алюмогидрида лития и 30 г (0,12 моль) 1,2,5-триметил-4-фенилпиперидин-4-илацетонитрила. Выход 27,5 г (90,4% ), т.кип. 142оС/мм рт.ст. Rf 0,58 (н-бутанол:уксусная кислота: вода, 4:2:5).
Найдено, С 78,14; Н 10,48; N 11,28.
С16Н26N2
Вычислено, С 77,87; Н 10,63; N 11,37.
ИК-спектр, ν см-1: 1570, 1590 (С С аром.): 3270, 3350 (NH2).
Спектр ПМР (ССl4, ГМДС), δ м.д. 7,20 (5Н, Ph), 2,62-2,40 м (2Н, 2,5-СН); 2,35-1,40 м (8Н, 3,6-СН2, СН2СН2NH2); 1,0 д (3Н, J 6 Гц, 2-СН3); 0,7 с (2Н, NH2); 0,6 д (3Н, J 6 Гц, 5-СН3).
Масс-спектр, м/z (%): 245 (М+) (14); 231 (15); 203 (60); 200 (14); 188 (68); 124 (15); 98 (15); 91 (15); 84 (29); 72 (20); 71 (20); 70 (33); 58 (33); 57 (32); 56 (20); 44 (20); 43 (20); 42 (35); 38 (35); 36 (100).
П р и м е р 3. N-[ β-(1,2,5-Триметил-4-бензилпиперидин-4-ил)этил]-N-(3,4-диметокси)-бензальдими н (IVа).
Смесь 21 г (0,085 моль) N-[ β-(1,2,5-триметил-4-бензилпиперидин-4-ил)этил] амина (Vа), 14,5 г (0,085 моль)вератролальдегида и 80 мл бензола кипятят 3 ч с ловушкой Дина-старка до полного водоотделения. Растворитель удаляют, остальную массу перегоняют в вакууме. Выход 27 г (80,3%), т.кип. 232-233оС/1,5 мм рт.ст.
Найдено, С 77,34; Н 8,97; N 6,90.
С26Н36N2O2
Вычислено, С 76,43; Н 8,88; N 6,86.
ИК-спектр, ν см-1: 1580, 1600 (С=С аром.); 1640 (С=N).
Спектр ПМР (CCl4 ТМС), δ м. д. 8,20 с (1Н, N=CH); 7,35 с (5Н, С6Н5); 7,10-6,65 (3Н, С6Н6); 3,85 с (6Н, 2-ОСН3); 3.35-2,40 м (6Н, СН2СН2N, СН2С6Н5); 2,25 с (3Н, NCH3); 1,80-1,40 м (2Н, 2,5-СН); 1,40-1,0 м (10Н, 3,6-СН2, 2,5-СН3).
П р и м е р 4. N-[ β-(1,2,5-триметил-4-фенилпиперидин-4-ил)этил]-N-(3,4-диметоксибензальдимин (IVб).
Смесь 20 г (0,08 моль) N-[ β-(1,2,5-триметил-4-фенилпиперидин-4-ил)этил] амина (Vб), 13,3 г (0,08 моль) вератролальдегида и 80 мл бензола кипятят 3 ч с ловушкой Дина-Старка до полного водоотделения. Удаляют растворитель, оставшуюся массу перегоняют в вакууме. Выход 25,2 г (79,8%), т.кип. 236оС/2 мм рт.ст.
Найдено, С 76,0; Н 8,75; N 7,22.
С25Н34N2O2
Вычислено, С 76,10; Н 8,69; N 7,10.
ИК-спектр, ν, см-1: 1690, 1605 (С=С аром.); 1650 (С=N).
Спектр ПМР, δ м.д. 7,8 с (1Н, N=СН); 7,40-7,0 м (5Н, Ph); 7,0-6,6 м (3Н, С6Н3); 3,30 с и 3,7 с (по 3Н, 2СН3О); 3,4-2,25 м (6Н, СН2СН2N, 6-СН2); 2,10-1,63 м (4Н, 3-СН2, 2,5-СН); 2,20 с (3Н, NCH3); 1,20 д (3Н, 2-СН3, J 7 Гц); 0,7 д (3Н, 5-СН3, J 7 Гц).
Масс-спектр, м/z (% ): 394(М+) (50); 381 (19); 367 (10); 317 (19); 245 (17); 214 (10); 203 (100); 200 (24); 188 (66); 151 (89).
П р и м е р 5. N-[β- (1,2,5-Триметил-4-бензилпиперидин-4-ил)этил]-N-(3,4-диметоксибензил)амин (IIIа).
К раствору 25 г (0,06 моль) N-[ β-(1,2,5-триметил-4-бензилпиперидин-4-ил)этил] -N-(3,4-диметокси)бензальдимин а (IУа) в 100 мл метанола при перемешивании добавляют по порциям 3,5 г (0,09 моль) боргидрида натрия так, чтобы температура реакционной смеси не превышала 20оС. Перемешивают при комнатной температуре 1 ч, отгоняют метанол, подщелачивают концентрированным раствором гидроокиси натрия, экстрагируют эфиром. После высушивания сульфатом магния отгоняют эфир, оставшуюся массу перегоняют в вакууме. Выход 24 г (95,5%), т.кип. 238оС/2 мм рт.ст.
Найдено, С 76,17; Н 9,45; N 6,93.
С26Н38N2O2
Вычислено, С 76,06; Н 9,33; N 6,82.
ИК-спектр, ν, см-1: 1590, 1600 (С=С аром.); 3320 (NH).
Спектр ПМР (ССl4, ТМС), δ м.д. 7,35-7,05 м (5Н, PH); 6,90-6,60 м (3Н, С6Н5); 3,8 с (6Н, 2СН3О); 3,45 с (2Н, СН2С6Н3); 2,40-1,80 м (10Н, СН2СН2N, 2,5-СН, 3,6-СН2); 2,2 с (3Н, NCH3); 1,60 с (1Н, NH); 1,20-0,8 м (6Н, 2,5-СН3).
П р и м е р 6. N-[ β-(1,2,5-Триметил-4-фенилпиперидин-4-ил)этил]-N-(3,4-диметоксибензил)амин (IIIб).
Процесс проводят аналогично примеру 5 исходя из 25 г (0,06 моль) N-[ β-(1,2,5-триметил-4-фенилпиперидин-4-ил)этил]-N-(3,4-диметокси)бензальдимина (IVб). Выход 21,0 г (87,1%), т.кип. 235оС/2 мм, рт.ст.
Найдено, С 75,80; Н 9,12; N 6,95.
С25Н36B2O2.
Вычислено, C 75,72; Н 9,15; N 7,06.
ИК-спектр, ν, см-1: 1590, 1600 (С=С аром.); 3300 (NH).
Спектр ПМР (CCl4, ТМС), δ м. д. 7,22 с (5Н, С6Н5); 6,80-6,60 м (3Н, С6Н5); 3,80 с (6Н, 2СН3О); 3,63 с (2Н, СН2С6Н3); 2,22 с (3Н, NCH3); 2,73-1,90 м (10Н, СН2СН2N, 2,5-СН, 3,6-СН2); 2,22 с (3Н, NСН3); 1,84 с (1Н, NH); 1,20 д (3Н, 2-СН3, J 6 Гц); 0,73 с (3Н, 5-СН3, J 7 Гц).
П р и м е р 7. N-[ β-(1,2,5-Триметил-4-бензилпиперидин-4-ил)этил]-N-цианометил-N-(3,4- диметоксибензил)амин (IIа).
Смесь 20,5 г (0,05 моль) N-[ β-(1,2,5-триметил-4-бензилпиперидин-4-ил)этил] -N-(3,4-диметоксибензил)амина (IIIа) и 66,4 г (1,1 моль) ледяной уксусной кислоты нагревают при перемешивании до 100оС и поддерживают эту температуру в течение 5-7 мин, охлаждают до 15оС и прибавляют 1,4 г (0,047 моль) параформа, затем 3,7 г (0,057 моль) цианистого калия, растворенного в 6,6 мл воды. Реакционную смесь перемешивают еще 20 ч, при 40-42оС, отгоняют уксусную кислоту, к остатку добавляют эфир, сушат сульфатом магния и после отгонки эфира остаток перегоняют в вакууме. Выход 18,5 г (90%), т.кип. 232оC/1 мм рт.ст. Реакционная масса после перегонки кристаллизуется, т.пл. 115оС.
Найдено, С 75,0; Н 8,81; N 9,26.
С28Н39N3O2
Вычислено, 74,90; Н 8,74; N 9,34.
ИК-спектр, ν, см-1: 1590, 1600 (С=С аром.); 2250 (СN).
Спектр ПМР (CCl4, ГМДС), δ м.д. 7,22 (5Н, С6Н6); 7,0-6,8 м (3Н, С6Н3); 3,80 с (6Н, 2СН3О); 3,78 с (2Н, СН2CN); 3,42 с (2Н, СН2С6Н3); 3,0-2,35 м (8Н, СН2СН2N 2,5-СН); 2,30 с (3Н, NCН3); 2,65-0,90 м (10Н, 2,5-СН3, 3,6-СН2, 2,5-СН).
П р и м е р 8. N-[ β-(1,2,5-Триметил-4-фенилпиперидин-4-ил)этил]-N-цианометил-N-(3,4- диметоксибензил)амин (IIб).
Процесс ведут аналогично примеру 7 исходя из 19,5 г (0,05 моль) N-[ β-(1,2,5-триметил-4-фенилпиперидин-4-ил)этил] -N-(3,4-диметоксибензил)амина (IIIб). Выход 15,7 г (73,4%), т.кип. 250-252оС/2,5 мм рт.ст.
Найдено, С 74,54; Н 8,50; N 9,57.
С27Н37N3O2
Вычислено, С 74,45; Н 8,56; N 9,64.
ИК-спектр, ν, см-1: 1590, 1600 (С=С аром.); 2250 (СN).
Спектр ПМР (CCl4, ГМДМ), δ м.д. 7,20 с (5Н, С6Н5; 6,67 с (3Н, С6Н5); 3,80 с (6Н, 2СН3О); 3,40 с (2Н, СН2CN); 3,20 с (2Н, СН2С6Н3); 3,0-1,30 м (10Н, СН2СН2N, 2,5-СН, 3,6-СН2); 2,35 с (3Н, NCH3); 1.20 д (3Н, 2-СН3, J 7 Гц); 0,7 д (3Н, 5-СН3, J 7 Гц).
П р и м е р 9. N-[ β-(1,2,5-Триметил-4-фенилпиперидин-4-ил)этил]-N-метил-N-(3,4- диметоксибензил)амин (IIв).
К 7,9 г (0,02 моль) N-[ β-1,2,5-триметил-4-фенилпиперидин-4-ил)этил]-N-(3,4-диметоксибензил)амина (IIIа) при охлаждении и перемешивании прибавляют 8 г (0,15 моль) 90%-ной муравьиной кислоты и 3,4 г (0,046 моль) 40%-ного раствора формалина. Смесь нагревают 8 ч. при 96-98оС, охлаждают и прибавляют 12,3 мл 40%-ного раствора гидроокиси натрия, экстрагируют эфиром, сушат сернокислым магнием, эфир отгоняют, остаток перегоняют. Выход 4,5 г (55%), т.кип. 228оС/мм рт.ст.
Найдено, С 76,12; Н 9,42; N 6,74.
С26Н38N2O2
Вычислено, С 76,05; Н 9,32; Т 6,82.
ИК-спектр, ν, см-1: 1590, 1600 (С=С, аром.).
Спектр ПМР (дигидрохлорид, CН3ОН, ТМС), δ м.д. 7,80-7,20 м (5Н, С6Н5); 7,20-6,90 м (3Н, С6Н3); 4,20 с (2Н, СН2С6Н3); 3,85 с (6Н, 2СН3О); 2,85-2,63 м (6Н, 2СН3N); 2,60-1,80 (10Н, 2,5-СН, 3,6-СН2, СН2СН2N); 1,80-0,80 м (6Н, 2,5-СН3).
П р и м е р 10. Дигидрохлорид N-[ β-(1,2,5-Триметил-4-бензилпиперидин-4-ил) этил]-N-цианометил-N-(3,4- диметоксибензил)амина (Iа).
К раствору 4,5 г (0,01 моль) N-[ β-(1,2,5-триметил-4-бензилпиперидин-4-ил)этил-N-цианометил-N-(3,4-диметоксиб ензи(IIа) в 200 мл сухого эфира добавляют эфирный раствор хлористого водорода до слабокислой реакции. Фильтруют, промывают абсолютным эфиром, сушат в вакуум-эксикаторе. Выход 4,8 г (93,2%), т.пл. 196-197оС, Rf 0,62 (вода:спирт:ацетон, 0,5:1:3).
Найдено, С 64,42; Н 8,0; N 8,10; Cl 13,65.
С28Н41N3O2Cl2.
Вычислено, С 64,35; Н 7,90. N 8,03; Cl 13,57.
Масс-спектр, м/z (% ): 449(М+) (6); 434 (10); 409 (67); 298 (57); 202 (33); 151 (100); 59 (21); 31 (49).
П р и м е р 11. Дигидрохлорид N-[ β-(1,2,5-триметил-4-фенилпиперидин-4-ил)этил]-N-цианометил-N-(3,4- диметоксибензил)амина (Iб).
Процесс ведут аналогично примеру 10 исходя из 4,4 г (0,01 моль) N-[ β-(1,2,5-триметил-4-фенилпиперидин-4-ил)этил] -N-цианометил-N-(3,4- диметоксибензил)амина (IIб). Выход 4,8 г (94%), т.пл. 151-152оС, Rf 0,63 (вода: этанол:ацетон, 1:2:3).
Найдено, С 63,82; Н 7,64; N 8,16; Cl 14,12.
С27H39N3O2Cl2
Вычислено, С 63,78; Н 7,71; N 8,26; Сl 13,94.
Масс-спектр, м/z (% ): 435(М+) (10); 420 (10); 395 (38); 284 (47); 256 (11); 230 (13); 220 (14); 216 (20); 203 (100). 200 (32); 188 (100); 186 (22) 152 (33); 151 (100); 98 (32); 91 (15); 84 (16); 70 (20); 58 (18).
П р и м е р 12. Дигидрохлорид N-[ β-(1,2,5-триметил-4-фенилпиперидин-4-ил) этил]-N-метил-N-(3,4-диметоксибензил)амина (Iв).
Процесс проводят аналогично примеру 10 исходя из 4,1 г (0,01 моль) N-[ β-(1,2,5-триметил-4-фенилпиперидин-4-ил)этил]-N-метил-N(3,4- диметоксибензил)амина (IIв). Выход 4,2 г (91%)т.пл. 184-186оС, Rf 0,61 (вода:этанол:ацетон, 1:2:3).
Найдено, С 64,46; Н 8,47; N 5,68; Сl 14,57.
С26Н40N2O2Cl2.
Вычислено, С 64,58; Н 8,38; N 5,689; Cl 14,66.
Масс-спектр, м/z (% ): 410(М+) (33); 395 (7); 312 (12); 260 (17); 259 (100); 230 (34); 229 (50); 228 (47); 216 (41); 214 (100); 208 (100); 209 (15); 2= 3 (100); 201 (53); 200 (100); 194 (27); 189 (43); 188 (100); 186 (41); 181 (13); 180 (26); 172 (12); 152 (100); 151 (100); 124 (17); 117 (18); 107 (21); 99 (17); 98 (43); 91 (23); 70 (20); 58 (45).
Биологические свойства соединений Ia-Iв исследовали в опытах in vitro и in vivo.
В опытах in vitro испытания проводили на изолированным роге матки крысы, на отрезке портальной вены крысы и на полоске аорты кролика. Степень активности соединения определяли по величине молярной концентрации, ингибирующей сокращения гладкой мускулатуры на 50%
Испытания показали, что спонтанные сокращения рога матки крысы соединения Ia-Iв и пропиламин ингибируют на 50% в концентрациях 2· 10-7, 2,5· 10-7, 2,5· 10-7, 8· 10-7- М соответственно. Сокращения, вызываемые окситоцином, соединения Ia-Iв и прениламин ингибируют на 50% в концентрациях 2,5 ·10-7, 3 ·10-7 и 1 ·10-6 М соответственно.
Спонтанные сокращения портальной вены крысы, соединения Ia-Iв и прениламин ингибируют на 50% в концентрациях 2 ·10-7, 3· 10-7, 3· 10-7 и 1·10-7 М соответственно.
Изучали действие соединений и на сократительную способность полоски грудной аорты кролика в бескальциевом 80 мМ KCl деполяризующем кребс-бикарбонатном растворе. Кальций хлористый добавляли в концентрации 10-4 М, что вызывало сокращение полоски аорты, которое принималось за 100% Соединения добавляли за 20 мин до добавления хлорида кальция. Соединения Ia-Iв и прениламин ингибируют на 50% сократительную способность аорты в концентрациях 8 ·10-8, 1 ·10-7, 1· 10-7 и 5·10-7 М соответственно.
Действие соединений Ia-Iв на активность кальций-кальмодулин (Ca-КМ) зависимой фосфодиэстеразы, выделенной по методу, определяли согласно. Соединения Ia-Iв и прениламин в концентрациях 12, 100, 100 и 15 мкМ соответственно ингибируют на 50%-ную Са-КМзависимую фосфодиэстеразу.
Соединения Ia-Iв действуют на фосфолирование легких цепей миозина, выделенного из мышц кролика. Включение фосфата в легкие цепи миозина регистрировали по увеличению электрофоретической подвижности легких цепей при электрофорезе в полиакриламидном геле в присутствии 8М мочевины. Соединения Ia-Iв и прениламин ингибируют фосфорилирование легких цепей миозина в концентрациях 50, 100, 90, 80 мкМ на 50% соответственно.
Известно, что антагонисты кальмодулина могут влиять на пролиферативную активность клеток, что обусловлено ингибированием периодов I и интерфазы, и тем самым и на синтез ДНК. В связи с этим исследовали воздействие соединений Ia-Iв на клеточную пролиферацию в культуре. Для этого использовали линию клеток яичника китайского хомяка. Интенсивность синтеза ДНК в клетках определяли по включению 3Н-тимидина. Установлено, что соединения Ia-Iв в концентрациях 1· 10-4, 1·10-4 и 2,5· 10-4 М ингибируют пролиферацию на 50% Прениламин аналогичный эффект вызывает в концентрации 2 ·10-4 М.
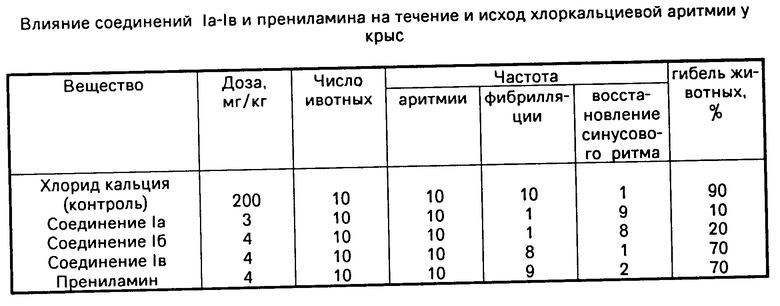
Изучено также влияние соединений Ia-Iв на течение и исход аритмии у крыс, вызванной внутривенным введением хлорида кальция. У контрольных животных, получивших хлористый кальций, наступает аритмия спустя несколько секунд после его введения. Вслед за этим начинается фибрилляция желудочков, приводящая, в основном, к гибели животного. Установлено, что соединение Iа в дозе 3 мг/кг предупреждает развитие фибрилляции у 9 из 10 крыс (90%-ный эффект). Соединение Iб такой же эффект оказывает в дозе 4 мг/кг, однако в этом случае число выживших животных меньше по сравнению с соединением Iа. Соединение Iв и прениламин обладают слабой антифибрилляторной активностью.
Острая токсичность соединений Ia-Iв и прениламина изучена на белых мышах массой 18-20 г при внутривенном введении в виде водных растворов. Установлено, что ЛД50 соединения Ia равна 50,3, соединения Iб 45,6, соединения Iв 31,7 мг/кг. ЛД50 прениламина равна 16,1 мг/кг.
Таким образом, по влиянию на сократительную способность гладкой мускулатуры матки, спонтанные сокращения отрезка портальной вены крысы, а также на сократительную способность полоски грудной аорты кролика соединения Ia-Iв более активны, чем прениламин. В отношении влияния на Са-КМ-зависимые процессы соединение Ia активнее прениламина, в то время как соединения Iб и Iв несколько уступают ему. Соединения Iа и Iб на модели аритмии, вызываемой внутривенным введением хлористого кальция, обладают антиаритмическим действием и предупреждают развитие фибрилляции желудочков сердца. Соединение Iв и прениламин обладают слабым антиаритмическим действием и почти не обладают антифибрилляторной активностью. Соединения Ia-Iв по сравнению с прениламином менее токсичны.
| название | год | авторы | номер документа |
|---|---|---|---|
| Замещенные 1,2,5-триметил- и 2,2,6,6-тетраметил-4-аминопиперидины, обладающие антиишемическим действием | 2015 |
|
RU2686317C2 |
| 2-СТИРИЛ-5,5-ДИМЕТИЛ-4(5Н)-ОКСАЗОЛОНЫ, ОБЛАДАЮЩИЕ АНТИГИПОКСИЧЕСКИМ ДЕЙСТВИЕМ | 1978 |
|
SU738331A1 |
| СПОСОБ ПОЛУЧЕНИЯ 3, 4-БИС(3-АМИНОФУРАЗАН-4-ИЛ)-ФУРАЗАНА И ЕГО N, N'-ДИАЦИЛЬНЫХ ПРОИЗВОДНЫХ | 2012 |
|
RU2489428C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ЗАМЕЩЕННЫХ 3,3-ДИМЕТИЛ-3,4-ДИГИДРОИЗОХИНОЛИНОВ | 2001 |
|
RU2213735C2 |
| СУКЦИНАТ N-(2,4,6-ТРИМЕТИЛФЕНИЛ)АМИДА 2-(БЕТА-N, N-ДИЭТИЛАМИНОЭТИЛАМИНО)-4-ОКСО-4-(4-МЕТИЛФЕНИЛ)-2-БУТЕНОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩУЮ И ПРОТИВОМИКРОБНУЮ АКТИВНОСТЬ | 2009 |
|
RU2428412C2 |
| 1-АМИНО-8,9- ДИГИДРО-5,8,8- ТРИМЕТИЛ-3,6Н- ПИРАЗОЛО[3,4-B] ТИОПИРАНО [4,3-D]ПИРИДИН ИЛИ ЕГО ГИДРОХЛОРИД, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 1989 |
|
SU1626648A1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДРАЗОНОВ 4-R-1,2,5-ОКСАДИАЗОЛ-3-КАРБОНОВОЙ КИСЛОТЫ | 2014 |
|
RU2557659C1 |
| 2-МЕТИЛАМИНО-4-ОКСО-3,6,6-ТРИМЕТИЛ-5,6-ДИГИДРО-8Н-ПИРАНО[4′,3′ : 4,5]ТИЕНО[2,3-D]ПИРИМИДИН ИЛИ ЕГО СОЛИ, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 1983 |
|
SU1132513A1 |
| N-2-ГИДРОКСИЭТИЛ-О-АЛКИЛОКСАМАТЫ, ОБЛАДАЮЩИЕ РОСТРЕГУЛЯТОРНОЙ АКТИВНОСТЬЮ | 2021 |
|
RU2804141C2 |
| 5-ЗАМЕЩЕННЫЕ 1-АМИНО -8,9-ДИГИДРО -8,8-ДИМЕТИЛ-3,6Н- ПИРАЗОЛО [3,4-B] ПИРАНО[[4′,3′-d]] ПИРИДИНА ИЛИ ИХ ГИДРОХЛОРИДЫ, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 1988 |
|
SU1540240A1 |
Использование изобретения: в качестве ингибиторов кальций-кальмодулин зависимых процессов в медицине. Сущность изобретения: продукт - дигидрохлориды N-[1, 2, 5 -триметил-4-арилпиперидин-4-ил)этил]-N-алкил-N-(3, 4-диметоксибензил)амины формулы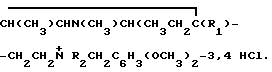
Указано соединение, R1, R2, БФ, выход, %, т. пл., oС, ЛД5 0, мг/кг: 1а, CH2Ph, CH2CN, C2 8H4 1N3, O2Cl2, 196 - 197; 16, Ph, CH2CN, C2 7H3 9N3O2Cl2, 94, 151 - 152, 45: 1b, Ph, Ch3, C2 6H4 0N2O2Cl2, 91, 184 - 186, 32. Реагент 1: 1, 2, 5 -триметил-4-арил-4-цианометилпиперидин. Реагент 2: LiAlH4. Условия реакции: в сухом эфире. Реагент 3: вератролальдегид. Условия реакции: в бензоле при кипячении. Реагент 4: NaBH4. Условия реакции: в метаноле при 20oС. Реагент 5: формалин. Условия реакции: при 95 - 98oС в среде муравьиной кислоты. Реагент 6: HCl. Условия реакции: в среде эфира. 1 табл.
Дигидрохлориды N-[ b -(1,2,5-триметил-4-арилпиперидин-4-ил)этил]-N-алкил-N-(3,4-диметоксибензил)аминов общей формулы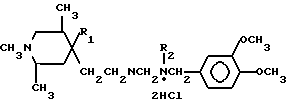
где R1=CH2Ph, R2=CH2CN;
R1=Ph, R2=CH2CH;
R1=Ph, R1=CH3,
являющиеся ингибиторами кальций-кальмодулинзависимых процессов.
| Машковский М.Д | |||
| Лекарственные средства | |||
| М.: Медицина, т.1, 1984, с.427. |
Авторы
Даты
1996-01-10—Публикация
1991-04-01—Подача