Изобретение относится к медицине и фармакологии и касается композиции для лечения легочных инфекций, а именно туберкулеза.
Сегодня одним из наиболее распространенных инфекционных заболеваний стал туберкулез. Согласно данным Всемирной Организации Здравоохранения (ВОЗ) каждый год туберкулезом заболевают примерно 3.5 млн человек, а к 2020 году количество вновь инфицированных туберкулезом достигнет 1 миллиарда, а уже к 2010 году более 70 млн жителей планеты умрет от этой болезни, если не будут найдены новые более эффективные средства лечения. Вместе с тем, за последние 10 лет арсенал противомикробных средств для лечения туберкулеза практически не изменился. По-прежнему используют изониазид, рифампицин, этамбутол и ряд других известных субстанций или их композиций (патенты РФ №№2185162, 2182483, 2195937, 2002; 2197965, 2247560, 2247561, 2247559, 2003; 2240795, 2004; 2272616, 2006; 2327459, 2008; 2372914, 2009 и др.).
Изониазид - эффективное противотуберкулезное средство, широко применяемое в медицинской практике (Машковский М.Д. «Лекарственные средства», М. Медицина, 1993, с.367-369). Однако он обладает рядом недостатков, к числу которых следует отнести прежде всего высокую токсичность и нерастворимость в воде.
С целью снижения токсичности и придания свойства растворимости разработан способ получения его производного - 1-изоникотинил-2-глюкозилгидразона дигидрата (изоглюкозил). Данный препарат обладает существенно пониженной токсичностью и способностью к растворению в воде. (Патент РФ №2279438, 2006).
Одна из серьезнейших проблем в лечении туберкулеза состоит в необходимости поддержания постоянной высокой концентрации противотуберкулезного препарата не только в кровотоке, но и в специальных клетках - макрофагах. Обычное лечение направлено на уничтожение возбудителя - Mycobacterium tuberculosis - только в кровотоке, поэтому оно малоэффективно и требует серьезной химиотерапии с использованием чрезвычайно высоких дозировок лекарственных препаратов в течение длительного времени, как в случае использования изониазида и изоглюкозила.
При введении в организм только незначительная часть лекарственного вещества попадает в орган/клетку-мишень; в связи с этим возникают серьезные побочные эффекты в виде нарушения гемопоэза, функции печени, почек. Кроме того, большая часть вводимых лекарственных веществ подвергается биотрансформации, не оказав антибактериального действия.
Одним из путей преодоления этих негативных последствий является разработка лекарственных препаратов направленного действия на базе иммобилизованных полимеров. В медицине применяется значительное количество наименований полимерных материалов (полиалкилцианоакрилаты, поликапролактоны, полиметакрилаты, хитозаны, твердые липиды и др.). Так, для рифампицина известны противомикробные препараты, содержащие в качестве полимерной основы целлюлозу (патент GB №32135879), для изониазида - крахмал (патент РФ №2146130, 1997) и декстран (патенты РФ №№2087146, 1997, 2143900, 2000, 2327459, 2008) для ампициллина, гентамицина, рифампицина и их смеси - полиалкилцианоакрилаты (патент РФ №2185818, 2002).
Полимерсодержащие системы обеспечивают внутриклеточную локализацию лекарств в альвеолярных макрофагах в эффективных для терапии количествах и обладают пролонгированным действием за счет регулировки скорости высвобождения субстанции из полимерной матрицы (патент РФ №№2087146, 1997; 2143900, 2000 - химически связанный изониазид с декстраном; 2185818, 2002 - полимерный носитель - полиалкилцианоакрилат и декстран). Происходит уменьшение токсических эффектов. Более того, лекарственные формы с замедленным высвобождением активно действующих веществ позволяют обеспечить однократный прием пациентом всей суточной дозы препарата.
Задачей изобретения является разработка эффективного и доступного средства для лечения туберкулеза.
Технический результат заключается в расширении круга лекарственных веществ, способствующих локализации лекарства в макрофагах.
Технический результат достигается предложенным способом получения полимерного комплекса, включающего в себя 1-изоникотинил-2-глюкозил-гидразона дигидрата и низкомолекулярный хитозан. В соответствии с предлагаемым способом получения полимерного комплекса 0,1 масс.% низкомолекулярного хитозана (средняя молекулярная масса 3, или 10, или 30 кДа) растворяют в отфильтрованном 2%-ном водном растворе уксусной кислоты. Полученный таким образом раствор хитозана в водном растворе СН3СООН перед синтезом предварительно очищаем путем его фильтрования через фильтровальную ткань. Затем в предварительно очищенный таким образом раствор хитозана при его перемешивании с помощью механической мешалки со скоростью 200-300 об/мин при температуре 20°С прибавляют со скоростью 0,2 мл/мин 0,1 масс.% изоглюкозила в виде его водного раствора с концентрацией 5 масс.%. Полученную смесь перемешивают со скоростью 200-300 об/мин в течение 5 часов. После этого в реакционную смесь при ее перемешивании прибавляют 0,1 н. раствора NaOH или водный раствор триполифосфат натрия с концентрацией 0,25 масс.% до рН=7,5, еще перемешивают в течение 1 часа. Полученную дисперсию центрифугируют со скоростью 10000 об/мин, твердый осадок промывают дистиллированной водой и сушат при 20°С в вакууме.
Пример 1. 0,1 г (0,1 масс.%) хитозана (средняя молекулярная масса 3 кДа) растворяют в 100 мл 2%-ного водного раствора СН3СООН, предварительно отфильтрованного через фильтр с диаметром пор 0,45 мкм. Полученный таким образом раствор хитозана в водном растворе СН3СООН перед синтезом предварительно очищаем путем его фильтрования через фильтровальную ткань на воронке Бюхнера с использованием водоструйного насоса. В очищенный таким образом раствор хитозана при перемешивании его с помощью механической мешалки (200 об/мин) в течение 2 часов прибавляют 0,1 г изоглюкозила в виде его водного раствора с концентрацией 5 масс.% со скоростью 0,2 мл/мин при температуре 20°С. Полученную таким образом смесь перемешивают со скоростью 200 об/мин в течение 5 часов. После этого со скоростью 0,2 мл/мин добавляют 0,1 н. раствор NaOH при температуре 20°С до рН=7,5 и перемешивают в течение 1 часа. Полученную дисперсию центрифугируют со скоростью 10000 об/мин и твердый остаток промывают дистиллированной водой и сушат при температуре 20°С в вакууме.
Пример 2. 0,1 г (0,1 масс.%) хитозана (средняя молекулярная масса 10 кДа) растворяют в 100 мл 2%-ного водного раствора СН3СООН, предварительно отфильтрованного через фильтр с диаметром пор 0,45 мкм. Полученный таким образом раствор хитозана в водном растворе СН3СООН перед синтезом предварительно очищаем путем его фильтрования через фильтровальную ткань на воронке Бюхнера с использованием водоструйного насоса. В очищенный таким образом раствор хитозана при перемешивании его с помощью механической мешалки (200 об/мин) в течение 2 часов прибавляют 0,1 г изоглюкозила в виде его водного раствора с концентрацией 5 масс.% со скоростью 0,2 мл/мин при температуре 20°С. Полученную таким образом смесь перемешивают со скоростью 200 об/мин в течение 5 часов. После этого со скоростью 0,2 мл/мин добавляют 0,1 н. раствор NaOH при температуре 20°С до рН=7,5 и перемешивают в течение 1 часа. Полученную дисперсию центрифугируют со скоростью 10000 об/мин и твердый остаток промывают дистиллированной водой и сушат при температуре 20°С в вакууме.
Пример 3. 0,1 г (0,1 масс.%) хитозана (средняя молекулярная масса 30 кДа) растворяют в 100 мл 2%-ного водного раствора СН3СООН, предварительно отфильтрованного через фильтр с диаметром пор 0,45 мкм. Полученный таким образом раствор хитозана в водном растворе СН3СООН перед синтезом предварительно очищаем путем его фильтрования через фильтровальную ткань на воронке Бюхнера с использованием водоструйного насоса. В очищенный таким образом раствор при перемешивании с помощью механической мешалки (300 об/мин) в течение 2 часов прибавляют 0,1 г изоглюкозила в виде его водного раствора с концентрацией 5 масс.% со скоростью 0,2 мл/мин при температуре 20°С. Полученную таким образом смесь перемешивают со скоростью 300 об/мин в течение 5 часов. После этого со скоростью 0,2 мл/мин добавляют 0,1 н. раствор NaOH при температуре 20°С до рН=7,5 и перемешивают в течение 1 часа. Полученную дисперсию центрифугируют со скоростью 10000 об/мин и твердый остаток промывают дистиллированной водой и сушат при температуре 20°С в вакууме.
Пример 4. 0,1 г (0,1 масс.%) хитозана (средняя молекулярная масса 10 кДа) растворяют в 100 мл 2%-ного водного, раствора СН3СООН, предварительно отфильтрованного через фильтр с диаметром пор 0,45 мкм. Полученный таким образом раствор хитозана в водном растворе СН3СООН перед синтезом предварительно очищаем путем его фильтрования через фильтровальную ткань на воронке Бюхнера с использованием водоструйного насоса. В очищенный таким образом раствор при перемешивании с помощью механической мешалки (200 об/мин) в течение 2 часов прибавляют 0,1 г изоглюкозила в виде его водного раствора с концентрацией 5 масс.% со скоростью 0,2 мл/мин при температуре 20°С. Полученную таким образом смесь перемешивают со скоростью 200 об/мин в течение 5 часов. После этого со скоростью 0,2 мл/мин добавляют 0,25 масс.% водного раствора триполифосфата натрия при температуре 20°С до рН=7,5 и перемешивают в течение 1 часа. Полученную дисперсию центрифугируют со скоростью 10000 об/мин и твердый остаток промывают дистиллированной водой и сушат при температуре 20°С в вакууме.
Существенным преимуществом использования хитозана в качестве матрицы для изоглюкозила является то, что благодаря своей химической природе он имеет значительное сродство к клеточной мембране, что способствует увеличению адсорбции лекарства внутрь макрофагов.
Противотуберкулезную активность Хитозоглюкозила (ММ 3 кДа, 10 кДа, 30 кДа) оценивали in vitro по уровню минимальной подавляющей концентрации (МПК) и минимальной бактерицидной концентрации (МБК).
Для определения МПК и МБК использовали стандартную методику, рекомендованную для доклинических исследований ("Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ», М., 2000, с.287-292).
Оценка противотуберкулезной активности исследуемых препаратов произведена на стандартном лабораторном штамме Mycobacterium tuberculosis H37Rv, чувствительном к противотуберкулезным препаратам.
Все этапы эксперимента in vitro проводились в условиях строгого соблюдения стерильности.
Бактериостатическую концентрацию изучаемых препаратов определяли методом серийных разведений в жидкой полусинтетической среде Школьниковой.
Приготовление исходных разведений изучаемых веществ
Взвешивание навесок испытуемых веществ производилось на весах с точностью 0,1 мг.
Исходные растворы готовились с использованием растворителя, предложенного разработчиками препаратов - 1%-ный водный раствор уксусной кислоты.
Температура жидкостей и растворов, используемых в исследовании, 22°С.
Хитоизоглюкозил, ММ 3 кДа.
I разведение: к навеске 20,1 мг добавили 3 мл 1%-ного водного раствора уксусной кислоты, встряхнули. Получен прозрачный раствор слабой светло-коричневой окраски. После этого добавили 15,6 мл дистиллированной воды, получили 20 мл раствора концентрации 1000 мкг/мл.
II разведение: к 1 мл I разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 100 мкг/мл.
III разведение: к 1 мл II разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 10 мкг/мл - исходное рабочее разведение.
Хитоизоглюкозил, ММ 10 кДа.
I разведение: к навеске 20,2 мг добавили 3 мл 1%-ного водного раствора уксусной кислоты, встряхнули. Получен прозрачный раствор слабой светло-коричневой окраски. После этого добавили 15,4 мл дистиллированной воды, получили 20 мл раствора концентрации 1000 мкг/мл.
II разведение: к 1 мл I разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 100 мкг/мл.
III разведение: к 1 мл II разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 10 мкг/мл - исходное рабочее разведение.
Хитоизоглюкозил, MM 30 кДа.
I разведение: к навеске 20,1 мг добавили 3 мл 1%-ного водного раствора уксусной кислоты, встряхивали в течение 10 минут. Получен прозрачный раствор светло-коричневой окраски. После этого добавили 15,4 мл дистиллированной воды, получили 20 мл раствора концентрации 1000 мкг/мл.
II разведение: к 1 мл I разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 100 мкг/мл.
III разведение: к 1 мл II разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 10 мкг/мл - исходное рабочее разведение.
Приготовление опытных рядов разведений изучаемых веществ.
Ряды разведений готовили с использованием жидкой питательной среды Школьниковой с добавлением 10% стерильной плазмы крови человека.
Хитоизоглюкозил, ММ 3 кДа.
Приготовление серии разведений от 2,0 до 0,015625 мкг/мл.
Сформировали ряд из 8 стеклянных пробирок. В первую пробирку добавили 4,0 мл жидкой питательной среды Школьниковой, в остальные 7 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 1,0 мл III разведения, получили 5 мл раствора хитоизоглюкозила ММ 3 кДа концентрации 2 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 8-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений хитоизоглюкозила ММ 3 кДа от 2,0 до 0,015625 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Приготовление серии разведений от 1,6 до 0,025 мкг/мл.
Сформировали ряд из 7 стеклянных пробирок. В первую пробирку добавили 4,2 мл жидкой питательной среды Школьниковой, в остальные 6 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 0,8 мл III разведения, получили 5 мл раствора хитоизоглюкозила ММ 3 кДа концентрации 1,6 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 7-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений хитоизоглюкозила ММ 3 кДа от 1,6 до 0,025 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Из двух серий сформировали опытный ряд разведений хитоизоглюкозила ММ 3 кДа с уменьшающимися концентрациями: 2,0 мкг/мл, 1,6 мкг/мл, 1,0 мкг/мл, 0,8 мкг/мл, 0,5 мкг/мл, 0,4 мкг/мл, 0,25 мкг/мл, 0,2 мкг/мл, 0,125 мкг/мл, 0,1 мкг/мл, 0,0625 мкг/мл, 0,05 мкг/мл, 0,03125 мкг/мл, 0,025 мкг/мл, 0,015625 мкг/мл. В качестве контрольных к ряду прибавлены 2 пробирки по 2 мл среды Школьниковой в каждой.
Хитоизоглюкозил, ММ 10 кДа.
Приготовление серии разведений от 2,0 до 0,015625 мкг/мл.
Сформировали ряд из 8 стеклянных пробирок. В первую пробирку добавили 4,0 мл жидкой питательной среды Школьниковой, в остальные 7 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 1,0 мл III разведения, получили 5 мл раствора хитоизоглюкозила ММ 10 кДа концентрации 2 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 8-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений хитоизоглюкозила ММ 10 кДа от 2,0 до 0,015625 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Приготовление серии разведений от 1,6 до 0,025 мкг/мл.
Сформировали ряд из 7 стеклянных пробирок. В первую пробирку добавили 4,2 мл жидкой питательной среды Школьниковой, в остальные 6 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 0,8 мл III разведения, получили 5 мл раствора хитоизоглюкозила ММ 10 кДа концентрации 1,6 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 7-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений хитоизоглюкозила ММ 10 кДа от 1,6 до 0,025 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Из двух серий сформировали опытный ряд разведений хитоизоглюкозила ММ 10 кДа с уменьшающимися концентрациями: 2,0 мкг/мл, 1,6 мкг/мл, 1,0 мкг/мл, 0,8 мкг/мл, 0,5 мкг/мл, 0,4 мкг/мл, 0,25 мкг/мл, 0,2 мкг/мл, 0,125 мкг/мл, 0,1 мкг/мл, 0,0625 мкг/мл, 0,05 мкг/мл, 0,03125 мкг/мл, 0,025 мкг/мл, 0,015625 мкг/мл. В качестве контрольных к ряду прибавлены 2 пробирки по 2 мл среды Школьниковой в каждой.
Хитоизоглюкозил, ММ 30 кДа.
Приготовление серии разведений от 2,0 до 0,015625 мкг/мл.
Сформировали ряд из 8 стеклянных пробирок. В первую пробирку добавили 4,0 мл жидкой питательной среды Школьниковой, в остальные 7 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 1,0 мл III разведения, получили 5 мл раствора хитоизоглюкозила ММ 30 кДа концентрации 2 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 8-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений хитоизоглюкозила MM 30 кДа от 2,0 до 0,015625 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Приготовление серии разведений от 1,6 до 0,025 мкг/мл.
Сформировали ряд из 7 стеклянных пробирок. В первую пробирку добавили 4,2 мл жидкой питательной среды Школьниковой, в остальные 6 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 0,8 мл III разведения, получили 5 мл раствора хитоизоглюкозила ММ 30 кДа концентрации 1,6 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 7-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений хитоизоглюкозила ММ 30 кДа от 1,6 до 0,025 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Из двух серий сформировали опытный ряд разведений хитоизоглюкозила ММ 30 кДа с уменьшающимися концентрациями: 2,0 мкг/мл, 1,6 мкг/мл, 1,0 мкг/мл, 0,8 мкг/мл, 0,5 мкг/мл, 0,4 мкг/мл, 0,25 мкг/мл, 0,2 мкг/мл, 0,125 мкг/мл, 0,1 мкг/мл, 0,0625 мкг/мл, 0,05 мкг/мл, 0,03125 мкг/мл, 0,025 мкг/мл, 0,015625 мкг/мл. В качестве контрольных к ряду прибавлены 2 пробирки по 2 мл среды Школьниковой в каждой.
Приготовление серии разведений от 2,0 до 0,015625 мкг/мл.
Сформировали ряд из 8 стеклянных пробирок. В первую пробирку добавили 4,0 мл жидкой питательной среды Школьниковой, в остальные 7 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 1,0 мл III разведения, получили 5 мл раствора изониазида концентрации 2 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 8-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений изониазида от 2,0 до 0,015625 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Приготовление серии разведений от 1,6 до 0,025 мкг/мл.
Сформировали ряд из 7 стеклянных пробирок. В первую пробирку добавили 4,2 мл жидкой питательной среды Школьниковой, в остальные 6 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 0,8 мл III разведения, получили 5 мл раствора изониазида концентрации 1,6 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 7-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений изониазида от 1,6 до 0,025 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Из двух серий сформировали опытный ряд разведений изониазида с уменьшающимися концентрациями: 2,0 мкг/мл, 1,6 мкг/мл, 1,0 мкг/мл, 0,8 мкг/мл, 0,5 мкг/мл, 0,4 мкг/мл, 0,25 мкг/мл, 0,2 мкг/мл, 0,125 мкг/мл, 0,1 мкг/мл, 0,0625 мкг/мл, 0,05 мкг/мл, 0,03125 мкг/мл, 0,025 мкг/мл, 0,015625 мкг/мл. В качестве контрольных к ряду прибавлены 2 пробирки по 2 мл среды Школьниковой в каждой.
Приготовление стандартной бактериальной суспензии.
Культуры микобактерий стандартного лабораторного штамма Mycobacterium tuberculosis H37Rv, чувствительного к противотуберкулезным препаратам, выращенные на плотной питательной среде в течение 4-х недель, снимали одноразовой бактериологической петлей, растирали в стеклянной пробирке и суспендировали в 0,9% растворе хлорида натрия. Полученную суспензию выдерживали при комнатной температуре в течение 30 минут для самопроизвольного осаждения наиболее крупных конгломератов микобактерий.
Затем взвесь микобактерий (надосадочную жидкость) переносили в другую пробирку, добавляли изотонический раствор хлорида натрия, сравнивая с оптическим стандартом мутности №5. Подготовленная таким образом бактериальная взвесь соответствует содержанию 5×108 КОЕ в 1 мл жидкости.
Далее во все пробирки рядов разведений исследуемых препаратов, включая контрольные пробирки, засевали по 0,2 мл бактериальной суспензии, что соответствует 108 КОЕ. Пробирки закрыли силиконовыми пробками и инкубировали в термостате при 37°С, просматривая ежедневно.
На 10-й день инкубации в контрольных пробирках всех рядов без препарата определено визуально начало глубинного роста культуры штамма H37Rv как хлопьевидный осадок на дне пробирки. На 14 день инкубации из осадка всех опытных и контрольных пробирок приготовлены мазки и окрашены по Цилю-Нильсену. Результаты оценивались по количеству кислотоустойчивых микобактерий в полях зрения и по интенсивности «косообразования» при микроскопии мазков по следующей схеме:
На основании полученных результатов определяли минимальную бактериостатическую концентрацию препарата, приводящую к частичному (+-) МПК50 или полному (0) МПК90 подавлению роста микобактерий.
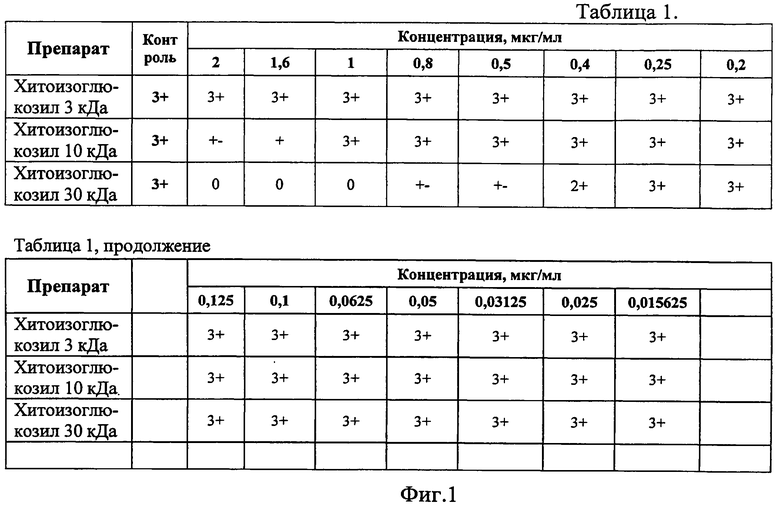
Как следует из таблицы 1 (фиг.1), содержащую результаты микроскопии осадков опытных и контрольных пробирок рядов разведений препаратов (фиг.1), МПК50 хитоизоглюкозила ММ 30 кДа для лекарственно-чувствительного лабораторного штамма H37Rv составила 0,5 мкг/мл, МПК90 - 1,0 мкг/мл, что в 4-5 раз выше, чем аналогичные концентрации для изониазида (МПК50 изониазида - 0,125 мкг/мл, МПК90 изониазида - 0,2 мкг/мл).
Для хитоизоглюкозила ММ 3 и 10 кДа в интервале разведений от 2 мкг/мл до 0,015625 мкг/мл не определяется минимальной подавляющей концентрации.
Определение in vitro минимальной бактерицидной концентрации.
Приготовление исходных разведений и опытных рядов разведений изучаемых веществ, приготовление стандартной бактериальной суспензии, культивирование микобактерий производили по описанной выше схеме опытов.
Для определения жизнеспособности культур микобактерий туберкулеза H37Rv их подвергали воздействию изучаемых веществ в течение 10 суток в условиях инкубирования в термостате при 37°С.
Действие веществ останавливали путем отмывания культуры. Для этого пробирки с культурой центрифугировали при 3000 об/мин в течение 10 минут, надосадочную жидкость сливали, осажденные микобактерии дважды отмывали 0,9% раствором NaCl.
Отмытые от изучаемых веществ микобактерии суспендировали в 1,0 мл 0,9% раствора NaCl. Из полученной суспензии приготовляли мазки и окрашивали их по Цилю-Нильсену, далее суспензию засевали по 0,2 мл на 2 пробирки с плотными яичными средами Левенштейна-Йенсена и Финна-2, культивировали в термостате при 37°С.
Результат микроскопии мазков оценивали как по количеству микобактерий в полях зрения, так и по интенсивности косообразования в соответствии с приведенной выше схемой.
Учет результатов культуральных исследований проводили через 28 дней и 2,5 месяца (12 недель).
Интенсивность роста МБТ оценивали по следующей схеме:
Отсутствие роста 99% микробной популяции (0) расценивали как наличие бактерицидной активности у исследуемых препаратов. Минимальную бактерицидную концентрацию (МБК) препарата устанавливали по суммарным данным культурального и микроскопического исследований.
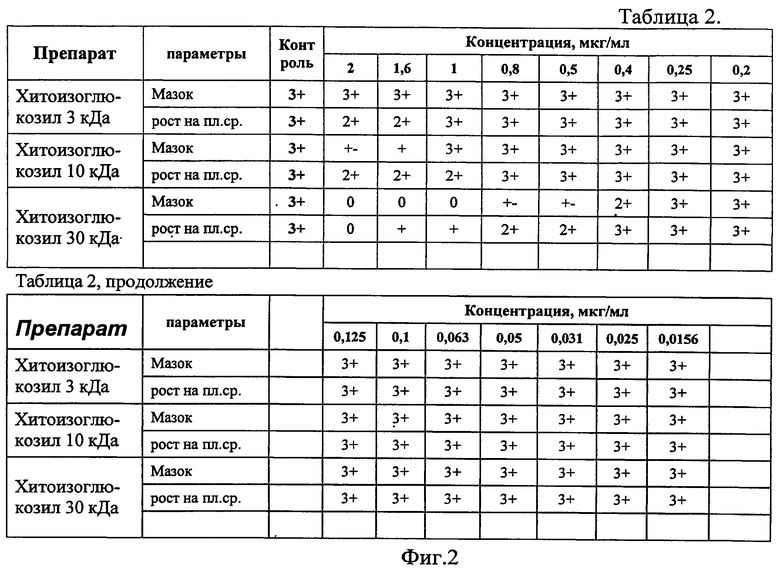
Результаты определения МПК и МБК Хитоизоглюкозила ММ 3 кДа, 10 кДа, 30 кДа и изониазида представлены в таблице 2 (фиг.2), содержащей результаты микроскопического и культурального исследований осадка опытных и контрольных пробирок рядов разведений.
Как следует из таблицы 2, МБК хитоизоглюкозила ММ 30 кДа для лекарственно-чувствительного лабораторного штамма H37Rv составила 2,0 мкг/мл, что в 8 раз больше, чем у изониазида - 0,25 мкг/мл.
Для хитоизоглюкозила MM 3 и 10 кДа в интервале разведений от 2 мкг/мл до 0,015625 мкг/мл не определяется минимальной бактерицидной концентрации.
Результаты определения МПК и МБК (в мкг/мл) Хитоизоглюкозила 3 кДа, 10 кДа и 30 кДа в отношении лекарственно-чувствительного лабораторного штамма МБТ H37Rv представлены в таблице 3 (фиг.3).
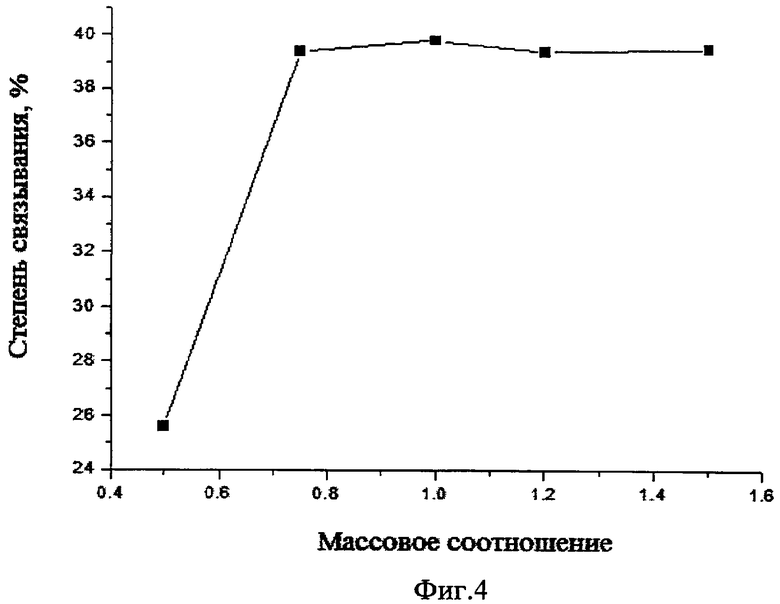
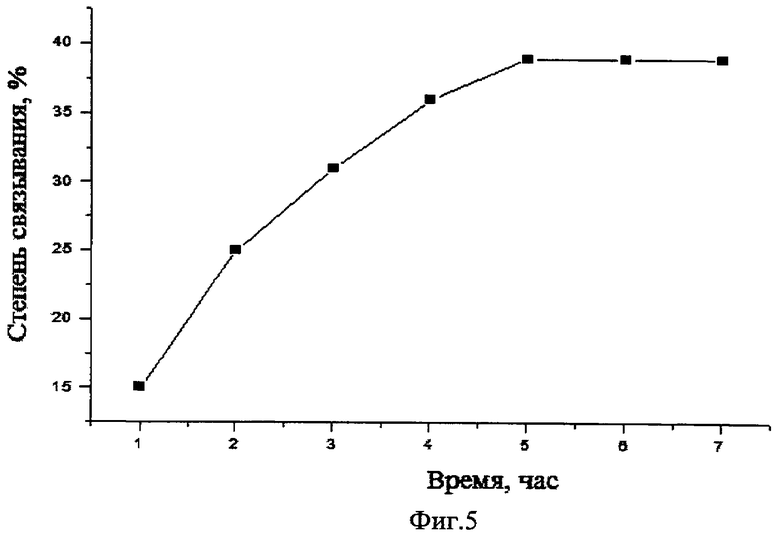
На фиг.4 - зависимость степени связывания изоглюкозила от массового отношения хитозан:изоглюкозил; на фиг.5 - зависимость степени связывания изоглюкозила от времени проведения процесса.
Максимальная массовая концентрация изоглюкозила, присоединенного к хитозану отмечена при использовании в качестве матриц олигомерных гомологов аминоглюкана. Взаимодействие лекарственной субстанции с полимером производилось при использовании в качестве матриц N-хлоргидроксипропил и N-гидроксиметил-аналогов олигохитозанов с СД более 90%, присутствовавших в реакционной системе в виде ацетатов или гидрохлоридов.
С целью увеличения массовой доли лекарственного средства в полимерном носителе проведена иммобилизация 1-изоникотинил-2-глюкозил-гидразона дигидрата (изоглюкозила) в структуру низкомолекулярного хитозана. Иммобилизация изоглюкозила в структуру низкомолекулярного хитозана с участием раствора NaOH или раствора триполифосфата натрия позволила обеспечить максимально возможную массовую долю в полимерном носителе. В данном случае происходит образование полимерного комплекса за счет кооперативного физического взаимодействия, включающего дисперсионные, ориентационные и электростатические.
Исследование влияния массового соотношения исходного хитозана и изоглюкозила на степень связывания показало, что оптимальным является соотношение 1:0,75. Дальнейшее увеличение изоглюкозила к хитозану не приводит к росту его содержания в полимерном комплексе (фиг.4).
Помимо этого изучено влияние времени взаимодействия на степень связывания изоглюкозила в полимерный комплекс. Найдено, что с увеличением времени реакции степень связывания возрастает, достигает максимального значения и выходит на плато (фиг.5).
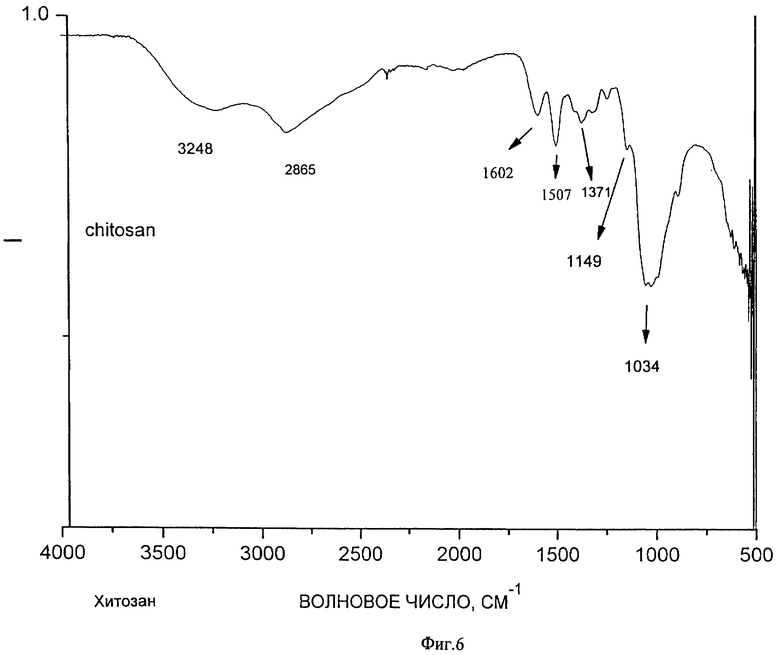
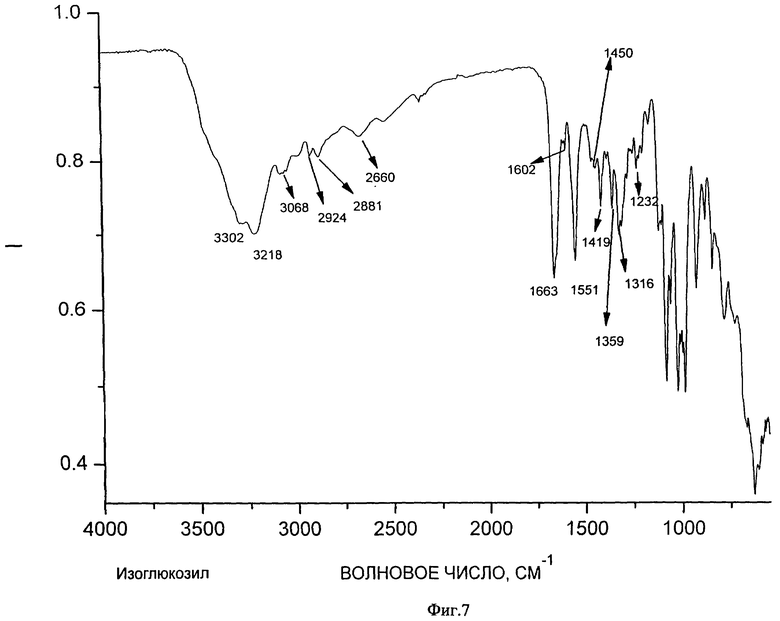
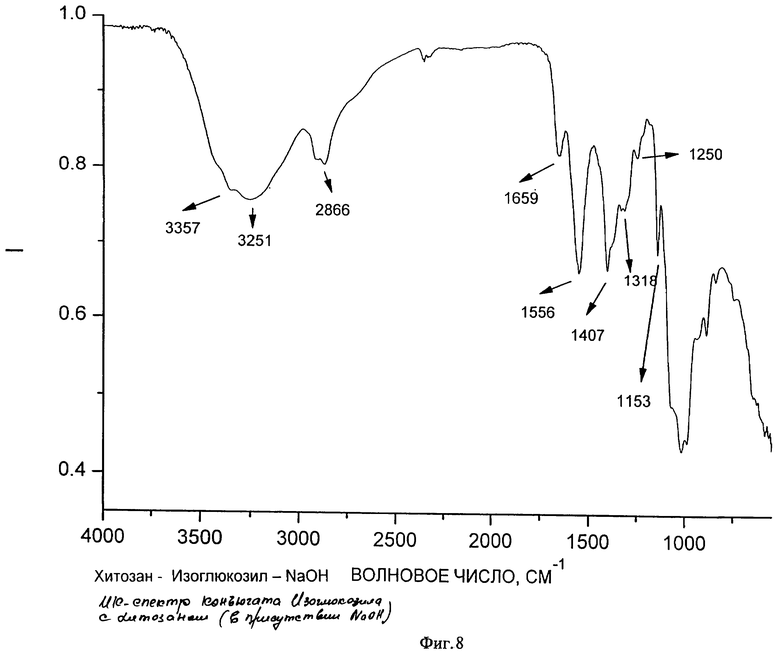
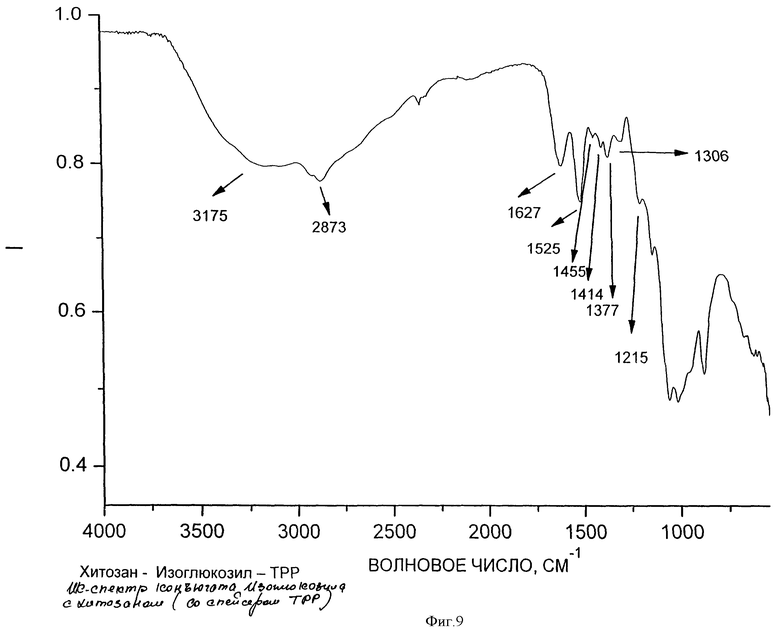
На образование полимерного комплекса указывают данные ИК-спектроскопии (ИК-спектры соответственно фигуры 6, 7, 8, 9), согласно которым происходит изменение интенсивности и смещение расщепленной полосы поглощения, соответствующее валентным колебаниям связи С=O, как гидразонового в фрагменте изоникотинилгидразона, так и карбонильной группы в макромолекуле хитозана, в области 1640-1670 см-1. Кроме этого в образовании комплекса участвует пиридиновый атом азота в фрагменте изоникотинилгидразона, о чем свидетельствует смещение полосы поглощения в области 1460-1470 см-1. Образование комплекса осуществляется как за счет электростатического взаимодействия положительно заряженных атомов азота первичных аминогрупп в структуре хитозана с отрицательно заряженными атомами кислорода карбонильной группы 1-изоникотинил-2-глюкозилгидразона, атомов кислорода первичных гидроксильных групп хитозана и глюкозного фрагмента изоглюкозила, так и через систему водородных связей и дисперсионных взаимодействий.
На фиг.6 - ИК-спектр низкомолекулярного хитозана;
на фиг.7 - ИК-спектр изоглюкозила;
на фиг.8 - ИК-спектр полимерного комплекса на основе хитозана и изоглюкозила в присутствии NaOH;
на фиг.9 - ИК-спектр полимерного комплекса на основе хитозана и изоглюкозила в присутствии триполифосфата натрия (ТРР).
Структуру полученного комплекса в общем виде можно представить в следующем виде:
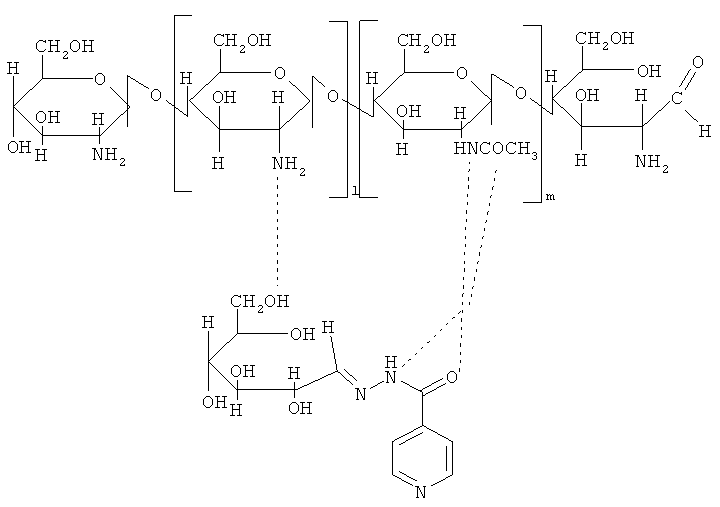
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРАСТВОРИМОГО ПАРА-АМИНОСАЛИЦИЛАТА ХИТОЗАНА | 2010 |
|
RU2440111C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛЕКАРСТВЕННОЙ ЧУВСТВИТЕЛЬНОСТИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА | 2003 |
|
RU2255977C1 |
| ПРОТИВОТУБЕРКУЛЕЗНОЕ СРЕДСТВО В ВИДЕ РАСТВОРА ДЛЯ ИНЪЕКЦИИ | 2007 |
|
RU2358742C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНОГО КОНЪЮГАТА ГИДРАЗОНА ИЗОНИКОТИНОВОЙ КИСЛОТЫ | 2010 |
|
RU2454226C1 |
| СУЛЬФОННЫЕ ПРОИЗВОДНЫЕ 2-НИТРО-2-(3-АРИЛ-1,2,4-ОКСАДИАЗОЛ-5-ИЛ)ЭТАНА, ОБЛАДАЮЩИЕ ПРОТИВОЛЕПРОЗНОЙ И ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2415845C1 |
| ПРОТИВОЛЕПРОЗНОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ БАКТЕРИОСТАТИЧЕСКОЙ И БАКТЕРИЦИДНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ M. LUFU, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ ПРОИЗВОДНОЕ O-БЕНЗОИЛАМИНОБЕНЗОЙНОЙ КИСЛОТЫ | 2016 |
|
RU2638926C2 |
| СПОСОБ ИНДИКАЦИИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА В ВОЗДУШНОЙ СРЕДЕ | 2000 |
|
RU2162709C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРАСТВОРИМЫХ ОЛИГОМЕРНЫХ ГОМОЛОГОВ ХИТОЗАНА В ГЕТЕРОГЕННОЙ СИСТЕМЕ | 2011 |
|
RU2479590C1 |
| КОМБИНИРОВАННАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2413517C1 |
| ТРИАЗИНЫ, ОБЛАДАЮЩИЕ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2431633C1 |

Способ получения полимерного комплекса, состоящего из 1-изоникотинил-2-глюкозилгидразона дигидрата (изоглюкозила) и низкомолекулярного хитозана, заключается в том, что к предварительно очищенному раствору 0,1 мас.% низкомолекулярного хитозана (средняя молекулярная масса 3, или 10, или 30 кДа) в фильтрованной 2 мас.% водной уксусной кислоте прибавляют со скоростью 0,2 мл/мин 0,1 мас.% изоглюкозила в виде его водного раствора с концентрацией 5 мас.%. Полученную систему диспергируют с помощью механической мешалки со скоростью 200-300 об/мин в течение 5 часов. Затем прибавляют 0,1 н. раствор NaOH или водный раствор триполифосфата натрия с концентрацией 0,25 мас.% до доведения в системе рН=7,5 при перемешивании в течение 1 часа. По окончании процесса дисперсию центрифугируют со скоростью 10000 об/мин и полученный твердый остаток промывают дистиллированной водой и сушат при температуре 20°С в вакууме. Технический результат заключается в расширении круга лекарственных веществ, способствующих локализации лекарства в макрофагах при лечении туберкулеза. 9 ил.
Способ получения полимерного комплекса, состоящего из 1-изоникотинил-2-глюкозилгидразона дигидрата (изоглюкозила) и низкомолекулярного хитозана, характеризующийся тем, что к предварительно очищенному раствору 0,1 мас.% низкомолекулярного хитозана (средняя молекулярная масса 3, или 10, или 30 кДа) в фильтрованной 2 мас.% водной уксусной кислоте прибавляют со скоростью 0,2 мл/мин 0,1 мас.% изоглюкозила в виде его водного раствора с концентрацией 5 мас.%, с последующим диспергированием системы с помощью механической мешалки со скоростью 200-300 об/мин в течение 5 ч, прибавлением 0,1н. раствора NaOH или водного раствора триполифосфата натрия с концентрацией 0,25 мас.% до доведения в системе pH 7,5 при перемешивании в течение 1 ч, по окончании процесса дисперсию центрифугируют со скоростью 10000 об/мин и полученный твердый остаток промывают дистиллированной водой и сушат при температуре 20°С в вакууме.
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ПРОТИВОТУБЕРКУЛЕЗНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СПОСОБ ИХ ИЗГОТОВЛЕНИЯ | 2001 |
|
RU2240795C9 |
| ТАБЛЕТКА ПРОТИВОТУБЕРКУЛЕЗНОГО ДЕЙСТВИЯ | 2007 |
|
RU2363475C2 |
| КУЗНЕЦОВ В.А | |||
| и др | |||
| Хитозан и дезоксикрахмал в качестве полимерных матриц для иммобилизации биологически активных компонентов, Вестн | |||
| МИТХТ, 2009, 4, №3, с.97-102, 119 | |||
| СПОСОБ ЛЕЧЕНИЯ ГЕНЕРАЛИЗОВАННОГО ТУБЕРКУЛЕЗНОГО ПРОЦЕССА В ЭКСПЕРИМЕНТЕ | 1993 |
|
RU2087146C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗОНИАЗИДА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ | 1999 |
|
RU2143900C1 |
| СЛИВКИН А.И | |||
| и др | |||
| Полимерные комплексы изониазида: Докл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
2011-12-10—Публикация
2010-05-17—Подача