Изобретение относится к области синтеза биологически активных аналогов стероидных эстрогенов, в частности к получению метилового эфира 16,16-диметил-2-фтор-D-гомо-8α-эстрона, обладающего гиполипидемической и кардиопротекторной активностью при отсутствии утеротропного и антигонадотропного действия, что предполагает его применение в медицине для лечения кардиоваскулярных болезней.
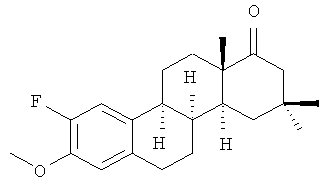
Модифицированные стероидные эстрогены с такими свойствами очень редки. Ими обладает метиловый эфир 16,16-диметил-D-гомо-8α-эстрона (I) (Фиг.1) [1], который является наиболее близким к заявленному изобретению и принят в качестве прототипа.
Недостатком прототипа является его гормональное действие.
Техническим результатом заявляемого изобретения является синтез нового аналога стероидных эстрогенов, обладающего гиполипидемической и кардиопротекторной активностью при отсутствии утеротропного действия.
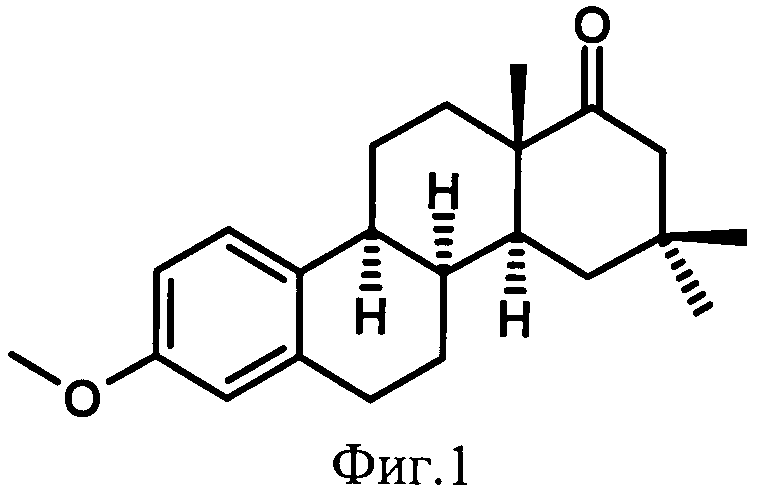
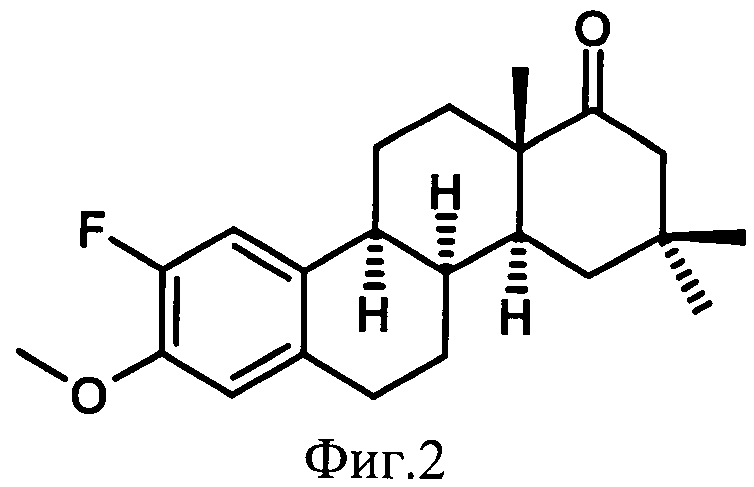
Технический результат достигается синтезом рацемического 16,16-диметил-2-фтор-D-гомо-8α-эстрона формулы (II) (Фиг.2), отличающегося от соединения (I) наличием фтора в положении 2. Эта модификация должна привести к снижению потенциальной канцерогенности по аналогии со стероидами природного ряда [2, 3].
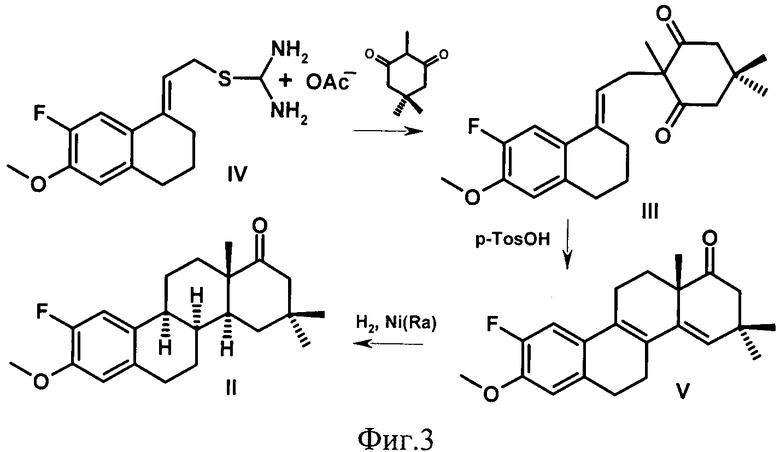
Лабораторный синтез метилового эфира 16,16-диметил-2-фтор-D-гомо-8α-эстрона, обладающего гиполипидемической и кардиопротекторной активностью (Фиг.2) был осуществлен на лабораторной базе Санкт-Петербургского государственного университета. Ниже приведен пример синтеза в соответствии со схемой, представленной на Фиг.3.
Пример.
а) 16,16-Диметил-3-метокси-2-фтор-D-гомо-8,14-секоэстра-1,3,5(10),9(11)-тетраен-14,17а-дион (III). К раствору 3 г известной изотиурониевой соли (IV) в 60 мл смеси этанол-вода (1:1) присыпают 2 г мелко растертого 2,5,5-триметилциклогексан-1,3-диона, реакционную смесь перемешивают 7 суток при температуре 20°C. Выпавший осадок отфильтровывают, промывают 50 мл смеси этанол-вода (1:1), сушат на воздухе. Получают 2.15 г (68%) секостероида (III), т.пл. 151-152°C. Спектр ЯМР13C, δ, м.д.: 19.66, 23.51, 26.69, 28.48, 29.53, 30.48, 31.01, 36.08, 52.14, 56.53, 64.94, 111.45, 113.50, 116.55, 128.88, 133.80, 136.91, 146.99, 151.36,210.38.
Найдено, %: C 73.62; Н 7.60. C22H27FO3. Вычислено, %; C 73.72; Н 7.59.
б) 16,16-Диметил-3-метокси-2-фтор-D-гомоэстра-1,3,5(10),8,14-пентаен-17а-он (V). К раствору 2.3 г секосоединения (III) в 200 мл толуола добавляют 0.25 г моногидрата п-толуол-сульфокислоты, реакционную смесь кипятят 30 мин, затем охлаждают до комнатной температуры, промывают равным объемом 5%-ного раствора карбоната натрия и равным объемом воды. После отгонки растворителя в вакууме остаток кристаллизуют из метанола, получают 1.65 г (75%) стероида (V), т.пл. 119.5-121.5°C. Спектр ЯМР 13С, δ, м.д.: 22.73, 23.35, 24.98, 28.53, 29.77, 30.51, 30.75, 37.16, 45.11, 50.14, 56.74, 111.38, 112.96, 127.67, 128.95, 129.36, 130.71, 132.61, 139.01, 146.14, 151.40, 215.51.
Найдено, %: С 77.48; Н 7.46. C22H25FO2. Вычислено, %; С 77.62; Н 7.40.
в) Метиловый эфир 16,16-диметил-2-фтор-D-гомо-8α-эстрона (II). К раствору 5 г эстрапентаена (V) в 270 мл бензола добавляют 5 г свежеприготовленного никеля Ренея W-6, гидрирование проводят при температуре 80-160°C до поглощения 75 л водорода. По окончании гидрирования реакционную смесь охлаждают до комнатной температуры, катализатор отфильтровывают, растворитель удаляют на ротационном испарителе. Остаток растворяют в 100 мл пиридина, к полученному раствору прикапывают реактив Саретта, приготовленный из 100 мл пиридина и 4.5 хромового ангидрида. Через 24 ч реакционную смесь выливают, при сильном перемешивании, в 700 мл 10%-ной соляной кислоты. Продукты реакции экстрагируют пятью порциями этилацетата. Органические фазы объединяют, промывают последовательно равными объемами воды, 5%-ным раствором бикарбоната натрия, насыщенным раствором хлористого натрия, сушат сульфатом натрия. Растворители удаляют в вакууме, остаток хроматографируют на колонке с силикагелем в системе петролейный эфир-этилацетат (30:1). Получают 1.64 г целевого стероида (II) (32%), т.пл. 163-165°C. Спектр ЯМР 13C, δ, м.д.: 18.49, 21.27, 26.41, 30.92, 32.50, 32.55, 34.90, 39.37, 40.41, 42.19, 46.76, 50.83, 56.05, 113.13, 115.74, 131.59, 133.84, 145.22, 150.62.
Масс-спектр, m/z (Iотн, %): 344 (100, М+), 311 (5), 259 (16), 245 (33), 231 (31), 217 (13), 203 (6), 192 (12), 191 (18), 190 (14), 189 (20), 179 (11), 178 (35), 177 (24), 176 (11), 165 (19), 152 (10), 139(17).
Найдено, %: С 77.39; Н 8.54. C22H29FO2. Вычислено, %; C 77.49; Н 8.20.
Гиполипидемическое и кардиопротекторное действие стероида (II) исследовали в опытах на овариэктомированных крысах линии Wistar в условиях, предложенных в «Методических рекомендациях» [4]. Получено (таблица 1-2), что 16,16-диметил-2-фтор-D-гомо-8α-эстрон обладает гиполипидемической и кардиопротекторной активностями при отсутствии утеротропного и антигонадотропного действия, что предполагает его применение в медицине для лечения кардиоваскулярных болезней.
Гиполипидемическое действие метилового эфира 16,16-диметил-2-фтор-D-гомо-8α-эстрона (II) в опытах на кроликах-самцах, получавших с пищей холестерин (500 мг/кг веса тела в день) в течение 60 дней. Стероиды использовали в дозе 15 мг/кг веса тела в день.
Гиполипидемическое действие метилового эфира 16,16-диметил-2-фтор-D-гомо-8α-эстрона (II) в опытах на морских свинках, получавших с пищей холестерин (500 мг/кг веса тела в день) в течение 60 дней. Стероиды использовали в дозе 10 мг/кг веса тела в день
Антигонадотропную активность стероида (II) изучали в опытах на крысах с односторонней овариэктомией массой 100-110 г, которым вводили препарат в течение 5 дней, начиная со дня удаления яичника. Через сутки после введения последней порции препарата животных забивали и взвешивали оставшийся яичник, массу последнего сравнивали с массой яичника контрольных животных (таблица 3). В качестве эталона в данной серии опытов использовали эстрон. Показателем антигонадотропной активности активности служило изменение массы яичников. Представленные данные указывают на отсутствие антигонадотропной активности у стероида (II).
Исследование антигонадотропной активности стероида (II) в опытах по влиянию на компенсаторную гипертрофию яичника.
Заявленное изобретение, как показывают результаты проведенных исследований, достигает указанный технический результат и позволяет синтезировать метиловый эфир 16,16-диметил-2-фтор-D-гомо-8α-эстрона, обладающий гиполипидемической и кардиопротекторной активностью при отсутствии утеротропного и антигонадотропного действия. Изобретение - метиловый эфир 16,16-диметил-2-фтор-D-гомо-8α-эстрона - может быть применено в медицине для лечения кардиоваскулярных болезней:
Литература
[1] Белов В.Н., Дудкин В.Ю., Урусова Е.А., Старова Г.Л., Селиванов СИ., Николаев СВ., Ещенко Н.Д., Морозкина С.Н., Шавва А.Г. // Биоорг. химия. 2007. Т.33. №3. С.315-323 (прототип).
[2] Liehr J.G. // Mol. Pharm. 1983. V.23. P.278-281.
[3] Патент США 4522758 (1985). - Chem. Abstr. 1985. V.103. 123790 k.
[4] Экспериментальное изучение гиполипидемических и антиатеросклеротических средств: Методические рекомендации. // Составители А.Н.Климов, В.Е.Рыженков. Москва, 1998, с.6.
Изобретение относится к области синтеза биологически активных аналогов стероидных эстрогенов. Синтезирован метиловый эфир 16,16-диметил-2-фтор-D-гомо-8α-эстрона, обладающий гиполипидемической и кардиопротекторной активностью при отсутствии утеротропного и антигонадотропного действия. Изобретение - метиловый эфир 16,16-диметил-2-фтор-D-гомо-8α-эстрона - может быть использовано в медицине для лечения кардиоваскулярных болезней. 3 ил., 3 табл.
Метиловый эфир 16,16-диметил-2-фтор-D-гомо-8α-эстрона формулы
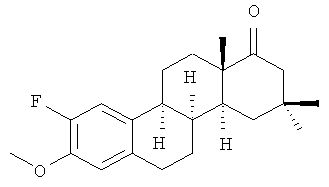
обладающий гиполипидемической и кардиопротекторной активностью.
| БЕЛОВ В.Н., ДУДКИН В.Ю | |||
| и др | |||
| Биоорганич | |||
| химия, 2007, т.33, №3 с.315-323 | |||
| Liehr J.G | |||
| et al | |||
| Mol.Pharm | |||
| Гребенчатая передача | 1916 |
|
SU1983A1 |
| US 4522758 A, 11.06.1985. | |||
Авторы
Даты
2011-12-20—Публикация
2010-05-27—Подача