Изобретение относится к биотехнологии, в частности к новым антителам, способу подавления роста опухоли, основанному на блокировании пути «человеческий фактор роста фибробластов/человеческий рецептор 1 типа фактора роста фибробластов (домены II и IIIc)», а также к способу диагностики злокачественных новообразований. Указанный патологический путь приводит к избыточной пролиферации опухолевых клеток и образованию новых сосудов, что сопровождается ростом первичной опухоли и метастазов. Кроме того, описанный путь является независимым механизмом устойчивости опухоли к препаратам, воздействующим на другие патологические пути. Блокирование пути «фактор роста фибробластов/рецетор 1 типа фактора роста фибробластов» различными субстанциями, нейтрализующими рецептор через связывание с его доменами II и IIIc, приводит к остановке или замедлению роста опухоли. Кроме того, данный рецептор может использоваться как мишень для целенаправленной доставки диагностических препаратов, т.к. находится в большом количестве на клетках многих опухолей. Преимущество изобретения заключается в разработке новых препаратов для диагностики и лечения заболеваний, связанных с избыточной пролиферацией и неоваскуляризацией.
Известно, что в основе развития злокачественных новообразований лежит избыточная пролиферация клеток, а также образование кровеносных сосудов в опухоли, через которые происходит ее питание (ангиогенез).
Образование новых кровеносных сосудов происходит из уже существующего эндотелия и является важным компонентом многих заболеваний и нарушений, в том числе таких, как рост и метастазирование опухолей, ревматоидный артрит, псориаз, атеросклероз, диабетическая ретипопатия, ретролентальная фиброплазия, неоваскулярная глаукома, гемангиомы, иммунное отторжение трансплантированной роговицы и других тканей, а также хронические воспаления.
В случае роста опухолей ангиогенез имеет особенно важное значение при переходе от гиперплазии к неоплазии, а также для обеспечения питания растущей солидной опухоли (J.Folkman et al. Nature; 339, 58 (1989)). Ангиогенез также позволяет опухолям находиться в контакте с кровеносной системой хозяина, в результате чего могут быть определены направления метастазирования для клеток опухоли. Данные, подтверждающие роль ангиогепеза в метастазировании клеток опухоли, были получены, в частности, в результате исследований, показавших зависимость между количеством и плотностью микрососудов в инвазивном раке молочной железы и фактическим наличием дистантных метастазов (N.Weidner et al. New Eng. J. Med., 324: 1 (1991)).
По многочисленным имеющимся данным пролиферация клеток опухоли, равно как и эндотелиальных клеток, может быть вызвана различными полипептидами, которые естественным образом встречаются в природе. Одним из них является семейство факторов роста фибробластов (ФРФ). Впервые ФРФ был обнаружен в экстрактах гипофиза в 1973 году (Н.Armelin. PNAS 70, 9 (1973)).
ФРФ относятся к семейству гепарин-связывающих полипептидов, модулирующих функции различных клеток. ФРФ оказывает сильное влияние на пролиферацию и дифференцировку опухолевых и эндотелиальных клеток. В настоящее время выделяют 23 члена семейства ФРФ (ФРФ 1-23). Каждый член семейства имеет свои функциональные особенности. Наиболее хорошо изучены ФРФ 1 и 2 типов (кислый и основной). Для того чтобы оказать воздействие на клетки, ФРФ должен связаться с рецептором на ее поверхности. Существуют 4 типа рецепторов ФРФ (ФРФР 1-4). С ФРФР1 связываются не только ФРФ 1 и 2, но и большинство других членов этого семейства, поэтому роль этого рецептора в проведении сигнала в клетку считается наиболее значимой.
ФРФР1 состоит из надмембранной, внутримембранной и внутриклеточной частей. Надмембранная часть рецептора состоит из 3 доменов (Д I-III), подобных иммуноглобулину. ФРФ, как правило, взаимодействуют с Д II и III; гепаран-сульфат, участвующий в формировании комплекса ФРФ/ФРФР1, взаимодействует с Д3. Альтернативный мРНК сплайсинг способствует образованию на поверхности клетки нескольких вариантов ФРФР1 (D Johnson, L.Williams. J Adv. Cancer Res., 60, 1 (1993); McKeehan et al. J Prog Nucleic Acid Res. Mol. Biol., 59, 135 (1998)). Внутриклеточная часть рецептора представлена тирозинкиназой, при аутофосфорилировании которой происходит дальнейшее проведение сигнала в ядро и деление клетки.
Изучая в рандомизированном исследовании эффекты низкомолекулярного гепарина (НМГ) у пациентов с метастатическим почечноклеточным раком (ПКР), авторы доказали, что гепарин влияет на выживаемость пациентов и частоту ответов на иммунотерапию. Мы предположили, что НМГ может связывать ФРФ, взаимодействовать с его рецептором (ФРФР1), другими гепаран/гепарин-связываюшими факторами (И.В.Тимофеев и соав. Российский онкологический журнал, №5 (2008); I.Tsimafeyeu et al. J. Clin. Oncology 25, 18S (2007)). В другом исследовании мы показали, что у пациентов с метастатическим ПКР в 40% случаев встречаются нарушения в системе гемостаза, что также может быть вызвано повышенным образованием ФРФ и экспрессией ФРФР1 (I.Tsimafeyeu et al. J. Experimental & Clinical Cancer Research, 28, 30 (2009)).
В дальнейших собственных исследованиях KCRB-L01 и KCRB-L02 мы изучали значение комплекса ФРФ/ФРФР1 в развитии ПКР.
KCRB-L01: Изучение экспрессии ФРФР у пациентов с почечноклеточным раком Иммуногистохимический анализ проводили на срезах с парафиновых блоков опухолей 140 больных ПКР. Результаты сравнивали с экспрессией ФРФР у 40 здоровых доноров, которым ранее была произведена биопсия почки по разным причинам без последующего обнаружения заболеваний органа. Была выявлена экспрессия ФРФР1 в 98% случаев на клетках первичной опухоли почки и в 82,5% случаев на клетках метастазов ПКР. Во всех случаях интенсивность окрашивания при иммуногистохимическом анализе была высокой (3+), что свидетельствует о сильной экспрессии рецептора. В 68% - получено ядерное окрашивание. Экспрессия ФРФР1 на клетках здоровой ткани почки выявлена в 1 случае (2,5%) за счет окрашивания сосудов. Таким образом, данное исследование подтвердило предположение о появлении и высокой экспрессии ФРФР1 как на клетках первичной опухоли, так и в метастазах ПКР (I.Tsimafeyeu et al. ESMO-ECCO 09 (2009)): таблица 1.
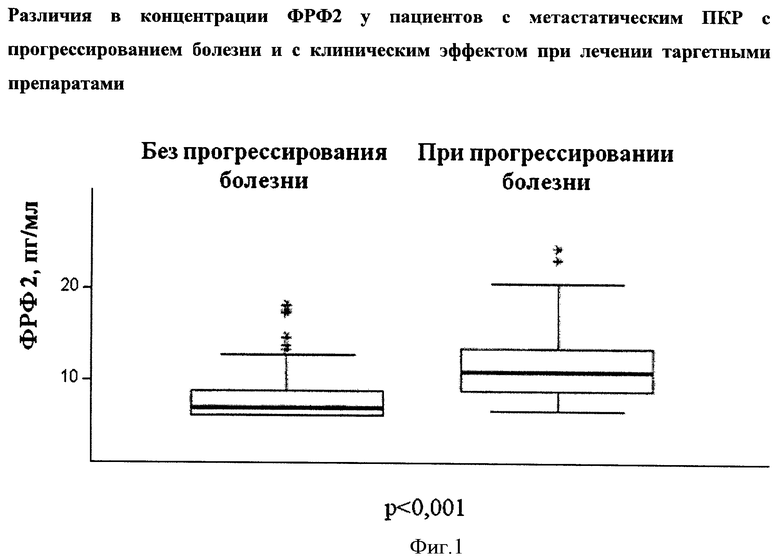
В исследовании KCRB-L02 определяли концентрацию ФРФ 1 и 2, как основных факторов, обладающих митогенной активностью при связывании с ФРФР1, в плазме крови 38 больных метастатическим ПКР до начала таргетной терапии, при прогрессировании болезни на таргетной терапии, а также в плазме крови 38 здоровых добровольцев (методом ELISA). Было установлено, что в крови здоровых людей уровни обоих ФРФ были достоверно ниже по сравнению с больными метастатическим ПКР (таблица 2). Наибольшие различия были продемонстрированы для ФРФ 2 (р<0,001).
При прогрессировании заболевания на таргетной терапии (сунитиниб, сорафениб) происходило достоверное повышение ФРФ 2 - более чем на 50% (р<0,001) и ФРФ 1 -более чем на 30% (р<0,05) по сравнению с исходным уровнем ФРФ. При эффективности таргетной терапии изменение уровня обоих ФРФ достоверно не наблюдалось (р=0,3). Медиана концентрации ФРФ 2 в плазме пациентов при прогрессировании болезни и без достоверно отличалась (р<0,001, фигура 1).
Кроме того, в этом исследовании анализировался уровень мишени для сунитиниба/сорафениба - фактора роста эндотелия сосудов (ФРЭС). Статистических различий в концентрации ФРЭС в плазме пациентов с ПКР при прогрессировании болезни на терапии и исходным уровнем (р=0,2), а также корреляции с обоими ФРФ (р>0,1) не выявлено.
Таким образом, результаты исследований KCRB-L01 и KCRB-L02 свидетельствуют о том, что патологический путь ФРФ/ФРФР1 является не только независимым в развитии ПКР, но может определять устойчивость к существующей таргетной терапии опухолей.
Другие авторы также показали значение ФРФ/ФРФР1 при развитии таких опухолей, как немелкоклеточный рак легкого, рак молочной железы, рак желудка и пищевода, рак предстательной железы, рак мочевого пузыря, опухоли головы и шеи, меланома (С.Behrens et al. J Clinical cancer research 14, 19 (2008); M.Koziczak et al. J Oncogene, 23, 20 (2004); К.Freier J Oral Oncology 43, 1 (2007); E.Shin et al. J Cancer Res Clin Oncol. 126, 9 (2000); К. Sugiura et al. J Oncology reports 17, 3 (2007); E.Devilard et al. J BMC Cancer 6, 272 (2006); G.Lefevre et al. J Investigative Ophthalmology and Visual Science 50 (2009)).
Основываясь на вышеизложенном, мы предположили, что блокирование пути ФРФ/ФРФР1 может привести к нарушению пролиферации опухолевых клеток и ингибированию ангиогенеза. Антагонисты ФРФР1, в том числе человеческие моноклональные антитела, могут быть использованы для подавления роста опухоли и ее метастазов. Кроме того, создание конъюгатов моноклонального антитела (его фрагментов) к ФРФР1 и контрастных веществ может использоваться в диагностике злокачественных и других образований, клетки которых экспрессируют ФРФР1 в большом количестве.
Целью изобретения являлся создание новых антител для использования в способе подавления роста опухоли, заключающемся в блокировании (нейтрализации) доменов II и IIIc ФРФР1, а также в способе диагностики опухолей, клетки которых экспрессируют ФРФР1.
Для проверки гипотезы и достижения целей были проведены исследования KCRB-L03, KCRB-L04 и KCRB-L05.
Во всех указанных исследованиях для блокирования ФРФР1 (под ФРФР1 далее понимается рецептор, соответствующий регистрационным номерам в международных базах Uniprot - P11362 и Entrez - 2260, а именно его домены II и IIIc (аминокислотная последовательность которых представлена на фигуре 2)) в качестве веществ-антагонистов использовались синтезированные нами высокоспецифичные нейтрализующие моноклональные антитела: 1) против доменов ФРФР1 II и IIIc (IO-1); 2) против ФРФР1 и гепаран-сульфата (IO-2).
Термин "моноклональное антитело" используется здесь и далее для обозначения антитела, полученного из популяции достаточно однородных антител, т.е. индивидуальные антитела, составляющие популяцию, идентичны в своей специфичности и сродству, за исключением возможных, естественно встречающихся мутаций, которые могут присутствовать в незначительных количествах. Необходимо обратить внимание на то, что в результате подобных, естественно встречающихся, мутаций состав моноклональных антител в данном изобретении, в большинстве своем содержит антитела, способные специфически связывать ФРФР1 или же комплекс ФРФР1/гепаран-сульфат или комплексы ФРФ/ФРФР1 или препятствовать связыванию ФРФ с ФРФР1.
Таким образом, термин "моноклональное" указывает на характер антитела, происходящего из достаточно однородной популяции антител, но здесь не имеется в виду, что антитела должны производиться каким-либо определенным путем. Например, моноклональные антитела, описанные в данном изобретении, могут быть получены гибридомным методом (G.Кöhler, С.Milstein. J Nature 256, 495 (1975)) или с применением методов, использующих рекомбинантную ДНК (S.Cabilly et al. U.S. Patent № 4816567).
При получении моноклональных антител гибридомным методом мышь или другое подходящее животное-хозяин иммунизируется антигеном посредством подкожной, внутриперитонеальной или внутримышечной инъекции с целью выявить лимфоциты, которые производят или же способны производить антитела, специфически связывающиеся с белком(ами), использованным(и) для иммунизации. В качестве альтернативы, лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с клетками миеломы с использованием соответствующего агента, например такого, как полиэтиленгликоль, чтобы создать гибридомную клетку (J.Goding. Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
В данном изобретении таким антигеном является ФРФР1 (домены II и IIIc) или же комплекс ФРФР1/гепаран-сульфат. Антиген может представлять собой фрагмент или часть ФРФР1, обладающие одним или несколькими аминокислотными остатками, которые участвуют в связывании ФРФ.
Приготовленные таким образом гибридомные клетки высеваются и выращиваются в подходящей культуральной среде, которая предпочтительно должна содержать одно или несколько веществ, которые ингибируют рост или выживание неслитых, родительских клеток миеломы. Например, в случае, если в родительских клетках миеломы отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (ГГФРТ или ГФРТ), кулътуральная среда для гибридом обычно будет содержать гипоксантин, аминоптерин и тимидин (среда HAT), каковые вещества препятствуют росту клеток, не обладающих ГГФРТ.
Предпочтительно выбирать такие клетки миеломы, которые эффективно сливаются, поддерживают стабильный высокий уровень экспрессии антител в отобранных клетках, производящих антитела, и являются чувствительными к средам, таким, например, как среда HAT. Среди таких клеток предпочтительными клеточными линиями являются: мышиные линии миеломы, такие как линии, происходящие от мышиных опухолей МОРС-21 и МРС-11, которые можно получить из Центра распределения клеток Института им. Солка в Сан-Диего (Калифорния, США); клетки SP-2, которые можно получить из Американской коллекции типовых культур в Роквилле (Мэриленд, США); и клетки P3X63Ag8U.1, описанные Йелтоном и др. (J Curr. Top. Microbiol. Immunol. 81, 1 (1978)). Кроме того, были описаны клеточные линии человеческой миеломы и человеческо-мышиной гетеромиеломы, способные производить человеческие моноклональные антитела (D.Kozbor et al. J Immunol. 133, 3001 (1984); В.Brodeur, P.Tsang Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker Inc., New York, 1987)).
Культурная среда, в которой выращиваются клетки гибридомы, подвергается анализу для производства моноклональных антител, направленных против соответствующего антигена. Предпочтительно, чтобы специфичность связывания моноклональных антител, производимых клетками гибридомы, была высокой.
Данное изобретение включает те моноклональные антитела, например, IO-1/IO-2, которые показали высокую специфичность (5×10-9) связывания с указанными антигенами, определенную по стандартной методике «BIOCORE». Обязательным условием для указанных антител является наличие гипервариабельных участков CDRs 1-3 с последовательностями, представленными в списке последовательностей под номерами 1-3. Последовательности вариабельных доменов тяжелых цепей могут варьировать в зависимости от того, представляют ли они части мышиного, химерного, гуманизированного или полностью человеческого антитела. Такие варианты последовательностей представлены, например, SEQ ID NO:4, 5, 6. SEQ ID NO:7 представляет константный домен тяжелой цепи антитела человека IgG1. SEQ ID NO:8 представляет константный домен тяжелой цепи антитела мыши IgG1. SEQ ID NO:9-11 представляют собой варианты легких цепей, которые могут входить в состав антител, подходящих для осуществления изобретения. Другими словами, антитела связывают по меньшей мере один из этих антигенов при анализе связывания и способны ингибировать биологическую активность ФРФР1. Высокая специфичность и сильное блокирование пути обеспечиваются благодаря одновременному связыванию с доменами II и IIIc данного рецептора,
После определения клеток гибридомы, которые производят антагонистические антитела желаемой специфичности, сродства и активности, клоны могут быть субклонированы методом ограниченных разбавлений и выращены стандартными методами (J.Goding. Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). К подходящим культуральным средам относятся, например, среда Игла, модифицированная Дулбекко (СИМД), или среда RPMI-1640. Кроме того, клетки гибридомы могут выращиваться in vivo в животных как асцитные опухоли.
Моноклональные антитела, продуцированные субклонами, отделяются от культуральной среды, асцитной жидкости или плазмы путем использования обычных методов иммуноглобулинной очистки, таких как, например, белок А-Сефароза, гидроксилапатитная хроматография, электрофорез в гелях, диализ или аффинная хроматография.
ДНК, кодирующая моноклональные антитела, описанные в данном изобретении, может быть с легкостью выделена и секвенирована обычными методами (например, с использованием олигонуклеотидных проб, способных связываться специфически с генами, кодирующими тяжелую и легкую цепу мышиных антител). В качестве источника ДНК использовались клетки гибридомы. После выделения ДНК может быть помещена в векторы экспрессии, которые затем трансфецируются в клетки хозяина, такие как обезьяньи клетки линии COS, клетки яичника китайского хомячка (СНО) или клетки миеломы, которые в иной ситуации не продуцируют иммуноглобулинный белок, для того чтобы достигнуть синтеза моноклональных антител в рекомбинантных клетках хозяина.
ДНК может быть модифицирована по выбору для того, чтобы изменить характер иммуноглобулина, продуцируемого экспрессией этой ДНК. Так, например, могут быть получены гуманизированные формы мышиных антител. В некоторых вариантах отдельные аминокислоты из базовой области (FR) мышиного антитела также замещаются на соответствующие аминокислотные остатки человеческого антитела (Р.Carter et al. Proc. Nat. Acad. Sci. 89, 4285 (1992); P.Carter et al. J Biotechnology 10, 163 (1992)). Химерные формы мышиных антител могут быть получены также путем замещения гомологичных мышиных последовательностей ДНК на последовательность, кодирующую отдельные области человеческих постоянных цепей иммуноглобулина (тяжелой и легкой) (S.Cabilly et al. U.S. Patent N 4816567; S.Morrison et al. Proc. Nat. Acad. Sci. 81, 6851 (1984)).
Антитела по данному изобретению включают мышиные антитела (IgG). Однако могут быть получены другие формы антител - «гуманизированные», а также полностью человеческие, что лишь отражает процент человеческого белка и не влияет на специфичность связывания с антигеном, т.е. доказательства способа настоящего изобретения.
Кроме того, для блокирования ФРФР1 и его доменов могут быть легко получены все виды, классы антител (например, IgA, IgD, IgE, IgG и IgM) и подклассы иммуноглобулинов, а также и фрагменты антител (например. Fab, F(ab')2 и Fv), обладающие способностью связывать ФРФР1 и проявляющие антагонизм по отношению к биологической активности пути ФРФ/ФРФР1, которая проверена в данном изобретении. В случае предпочитаемого варианта данного изобретения моноклональные антитела будут проявлять сродство к иммунизирующему антигену в размере, по меньшей мере, 10-9 (Р.Munson, D.Rodbard. J Anal. Biochem. 107, 220 (1980)). Кроме того, моноклональные антитела будут ингибировать митогенную или ангиогенную активность ФРФР1 по крайней мере на 90%, как определяется, например, анализом выживания или пролиферации клеток in vitro, подобно описанному в наших исследованиях KCRB-L03 (Пример 1) и KCRB-L04 (Пример 2).
Для терапевтических и диагностических применений желательно, чтобы моноклональные антитела реагировали не со всеми компонентами и молекулярными формами ФРФР1. Например, желательно получить моноклональное антитело, которое способно специфически связываться только с доменами ФРФР1 II и IIIc, а не с доменом I или другими доменами и изоформами рецептора. Для этого иммунизация производилась экстрацеллюлярной частью ФРФР1, включающей домены II и IIIс. Необходимые молекулярные формы антитела легко определяются путем сравнения анализов ELISA или путем сравнения иммуноприпитации различных полипептидов ФРФР1. Это дает возможность иммунизации различными изоформами ФРФР1.
ФРФР1 может быть заблокирован и другими известными способами, в частности, ингибиторами, созданными путем химического синтеза.
Терапевтическое использование способа блокирования пути ФРФ/ФРФР1
Для использования способа, описанного в настоящем изобретении, в терапевтической практике любые антагонисты ФРФ/ФРФР1 вводятся млекопитающему, предпочтительно человеку, в фармацевтически приемлемой форме, включая введение внутривенно, а также следующими путями: внутримышечным, интраперитонеальным, интрацереброспинальным, подкожным, внутрисуставным, внутрисиновиальным, внутриоболочечным, оральным, локальным или ингаляционным.
Антагонисты также могут вводиться внутриопухолевым, околоопухолевым, внутриочаговым и околоочаговым путями для обеспечения локального действия наряду с системным терапевтическим действием. Подобные формы введения включают фармацевтически приемлемые носители, которые по своей природе не обладают ни токсическим, ни терапевтическим действием. Примерами таких носителей являются ионообменные вещества, квасцы, стеарат алюминия, лецитин, белки плазмы (такие, как белок плазмы человека), буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, частичные глицеридные смеси насыщенных овощных жирных кислот, вода, соли или электролиты, такие как сульфат протамина, гидрофосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидная окись кремния, трисиликат магния, поливинилпирролидон, вещества с целлюлозной основой и полиэтиленгликоль.
Носители для локальной или основанной на геле форм антагонистов включают полисахариды, такие как натриевая соль карбоксиметилцеллюлозы или метилцеллюлозы, поливинилпирролидон, полиакрилаты, полимеры полиоксиэтиленполиоксипропиленового блока, полиэтиленгликоль и спирты. Для введения во всех случаях используются обычные лекарственные формы. К таким формам относятся, например, микрокапсулы, нанокапсулы, липосомы, пластыри, ингаляционные препараты, аэрозоли, подъязычные таблетки и препараты с постоянным высвобождением вещества. Антагонист в таких препаратах будет обычно содержаться в концентрации примерно от 0,1 до 100 мг/мл.
Подходящие примеры препаратов с постоянным высвобождением вещества включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антагонист; подобные матрицы имеют определенную форму, например это могут быть пленки или микрокапсулы. К примерам матриц с постоянным высвобождением относятся полиэфиры, гидрогели [например, поли(2-гидроксиэтил-метакрилат)], описанные Лангером и др. (J. Biomed. Mater. Res. 15, 167 (1981) и Лангером (Chem. Tech. 12 (1982)), или поли(винилалкоголь), полилактиды (Патент США № 3773919), сополимеры L-глутаминовой кислоты и гаммаэтил-L-глутамата, описанные Сидман и др. (Biopolymers 22, 547 (1983)), недеградируемый этиленвинилацетат (Лангер и др. см. выше), деградируемые сополимеры молочной и гликолевой кислот, такие как Lupron Depot™ (инъецируемые микросферы, состоящие из полимеров молочной и гликолевой кислот и ацетата лейпролида), и поли-D-(-)-3-гидроксибутировой кислоты. В то время как такие полимеры, как этиленвинилацетат и сополимер молочной и гликолевой кислот, способны к постоянному высвобождению молекул в течение более 100 дней, определенные гидрогели высвобождают белки за более короткие периоды времени. Когда инкапсулированные полипептидные антагонисты остаются в организме на долгое время, они могут денатурировать или агрегироваться в результате воздействия влаги при температуре 37°С, что ведет к потере биологической активности и возможным изменениям в иммуногенности. С целью стабилизации могут быть разработаны разумные стратегии, в зависимости от действующего механизма. Например, если обнаружен механизм агрегации, выражающийся в формировании межмолекулярной S-S-связи посредством тиодисульфидного обмена, стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации с целью удаления кислых растворов, контролирования влажности, использования соответствующих добавок и разработки специфических полимерных матричных составов.
Антагонистические составы с постоянным высвобождением анти-ФРФР1 агента включают также антагонистические антитела, заключенные в липосомах. Липосомы, содержащие антагонисты, могут быть получены известными в данной области методами, например, описанными Эпстейном и др. (Proc. Nat. Acad. Sci. 82, 3688 (1985)); Хуанг и др. (Procc. Nat. Acad. Sci. 77, 4030 (1980)); Патент США № 4485045 и Патент США № 4544545. Липосомы, как правило, имеют небольшую величину (величиной около 200-800 ангстрем) и принадлежат к однослойному типу, в котором содержание липидов выше, чем 30 мол.% холестерина; выбранное соотношение может изменяться для подбора оптимальных условий терапии. Липосомы с продолжительным сроком циркуляции покрываются Патентом США № 5013556.
Еще одним путем использования данного изобретения является инкорпорирование антагониста пути ФРФ/ФРФР1 внутрь изделий, имеющих определенную форму. Такие изделия могут быть использованы для модулирования роста клеток эндотелия и ангиогенеза. Кроме того, такие изделия могут быть использованы для модулирования инвазии опухолей и метастазов.
Возможна конъюгация антагониста пути ФРФ/ФРФР1 и другого лечебного средства.
При профилактике или лечении заболевания необходимая доза антагониста будет зависеть от типа заболевания, от его степени серьезности и протекания, от того, вводятся ли антитела с профилактической или терапевтической целью, от предыдущей терапии, от истории болезни пациента и его реакции на антагонист и от указаний лечащего врача. Антагонист может вводиться пациенту различными способами, единовременно или в качестве серии назначений.
Антагонисты ФРФ/ФРФР1 могут быть использованы для лечения различных неопластических и ненеопластическпх заболеваний и нарушений. Неоплазмы и близкие состояния, которые поддаются такому лечению, включают почечноклеточный рак, рак легких, рак желудка, рак пищевода, колоректальный рак, рак печени, рак яичников, рак шейки матки, рак эндометрия, гиперплазию эндометрия, эндометриоз, фибросаркомы, хориосаркомы, опухоли головы и шеи, гепатобластому, саркому Капоши, меланому, рак кожи, гемангиому, кавернозную гемангиому, гемангиобластому, рак поджелудочной железы, ретинобластомы, астроцитому, глиобластому, шванному, олигодендроглиому, медуллобластому, нейробластому, рабдомиосаркому, остеогенную саркому, лейомиосаркому, рак мочевого пузыря и другие уротелиальные опухоли, опухоль Вильмса, рак предстательной железы, аномальную пролиферацию сосудов, связанную с факоматозами.
Возможно применение способа при неонкологических заболеваниях, которые поддаются лечению, включая такие, как ревматоидный артрит, псориаз, атеросклероз, диабетические и другие ретинопатии, фиброплазии, неоваскулярную глаукому, тироидные гиперплазии (в том числе болезнь Граве), трансплантацию роговицы и других тканей, хронические воспаления, воспаление легких, нефротический синдром, асцит, преэклампсию, перикардиальный выпот (например, связанный с перикардитом) и плевральный выпот. В зависимости от типа заболевания и от степени его серьезности первоначальная доза для введения пациенту будет составлять от 1 мкг/кг до 15 мг/кг и может вводиться путем одного или многих отдельных введений или путем постоянного вливания. Обычная дневная доза может варьировать примерно от 1 мкг/кг до 100 мг/кг и более, в зависимости от вышеупомянутых факторов. Для повторного введения в течение нескольких дней и более, в зависимости от условий, лечение повторяется, пока не будет достигнуто желаемое подавление симптомов болезни. Однако могут использоваться и другие режимы дозировки. Успех лечения легко определяется обычными методами и анализами, например методами рентгено-визуализации опухолей.
В соответствии с другим применением изобретения эффективность антагониста пути ФРФ/ФРФР1 в предотвращении или лечении болезней может быть улучшена путем введения антагониста серийно или же в комбинации с другим веществом, эффективным для данной цели, таким как фактор некроза опухоли, интерфероны, интерлейкины; антитела и ингибиторы, способные нейтрализовать или ингибировать ангиогенную активность фактора роста эндотелиальных клеток кровеносных сосудов и его рецепторов и/или фактора роста гепатоцитов и/или эпидермального фактора роста и его рецепторов и/или фактора роста плаценты и/или mTOR и/или других внутриклеточных киназ или одно или более обычных терапевтических веществ, таких как, например, алкилирующие соединения, антагонисты фолиевой кислоты, антиметаболиты метаболизма нуклеиновых кислот, антибиотики, аналоги пиримидинов, 5-флюороурацил, пуриновые нуклеозиды, амины, аминокислоты, триазольные нуклеозиды или кортикостероиды. Подобные вещества могут присутствовать во вводимом составе или могут вводиться отдельно. Кроме того, антагонист пути ФРФ/ФРФР1 может вводиться серийно или же в комбинации с радиологическим лечением, которое может включать как иррадиацию, так и введение радиоактивных веществ.
В соответствии с одним из применений изобретения при комбинированной терапии подвергается атаке васкуляризация опухоли. Один или более антагонист ФРФ/ФРФР1 вводятся пациенту с опухолью в терапевтически эффективных дозах, определенных, например, при наблюдении некроза опухоли или ее метастазных фокусов, если они имеются. Такая терапия продолжается до тех пор, пока не перестает наблюдаться дальнейшее улучшение или клиническое обследование показывает, что опухоль или ее метастазы исчезли. При прогрессировании болезни вводится одно или несколько описанных выше веществ(о) и применяется гипертермия или лучевая терапия. Поскольку эффективность дополнительных веществ будет варьировать, желательно сравнить их влияние на опухоль путем стандартного матричного скрининга. Производится повторное введение антагониста ФРФ/ФРФР1 и дополнительного агента, пока не будет достигнут желаемый клинический эффект. В альтернативном случае антагонист(ы) ФРФ/ФРФР1 вводятся совместно и, при желании, вместе с дополнительными веществами.
Использование в диагностике
В диагностике могут быть использованы антитела к ФРФР1 и также к его доменам II и IIIc. Антитела обычно должны быть помечены остатком, который легко обнаружить. Это может быть любой остаток, который, прямо или косвенно, может продуцировать обнаруживаемый сигнал. Например, это могут быть радиоизотопы, такие как 3Н, 14С, 32P, 35S, 125I; флюоресцентное или хемилюминесцентное соединение, такое как изотиоцианат флюоресцеина, родамин или люциферин; метки, помеченные радиоизотопами, такими как, например, 125I, 32P, 14С или 3H, или ферменты, такие как щелочная фосфатаза, бетагалактозидаза или пероксидаза хрена.
Здесь может применяться любой известный в данной области метод для конъюгирования отдельных антител к обнаруживаемым остаткам, включая описанные методы Хантером и др. (J Nature 144, 945 (1962)); Дэвидом и др. (J Biochemistry 13, 1014 (1974)); Пейном и др. (J Immunol. Meth. 40, 219 (1981)) и Нигреном (J.Histochem. and Cytochem. 30, 407 (1982)). Антитела данного изобретения или ФРФР1 могут быть использованы в диагностике опухолей человека и млекопитающих. При этом антитело или ФРФР1, помеченные обнаруживаемым остатком, вводится пациенту, предпочтительно в кровеносную систему, и анализируется присутствие и местонахождение меченого антитела или рецептора в организме пациента. Такая визуализация может использоваться, например, при определении стадии заболевания и при лечении неоплазм. Антитело или ФРФР1 метятся любым остатком, обнаружимым в организме млекопитающих, известными в этой области методами, например ядерным магнитным резонансом, радиологическим методом и т.д.
Ниже в качестве примеров представлены некоторые доказательства способа подавления роста опухоли, заключающегося в блокировании (нейтрализации) ФРФР1, а также способа диагностики опухолей, клетки которых экспрессируют ФРФР1. Нижеследующие примеры предлагаются только в качестве иллюстрации и не должны восприниматься как в чем-либо ограничивающие настоящее изобретение.
Пример 1 (Результаты исследования KCRB-L03): анализ выживания или пролиферации клеток in vitro, нарушение функции ФРФР1 при добавлении моноклонального антитела, блокирующего ФРФР1 домены II и IIIc
Для выбора модели клеточной линии были изучены различные линии клеток на предмет гиперэкспрессии ФРФР1:
1) человеческого почечноклеточного рака Caki-1
2) человеческого рака молочной железы MCF7
3) человеческого рака предстательной железы Du145
4) человеческого немелкоклеточного рака легкого А549
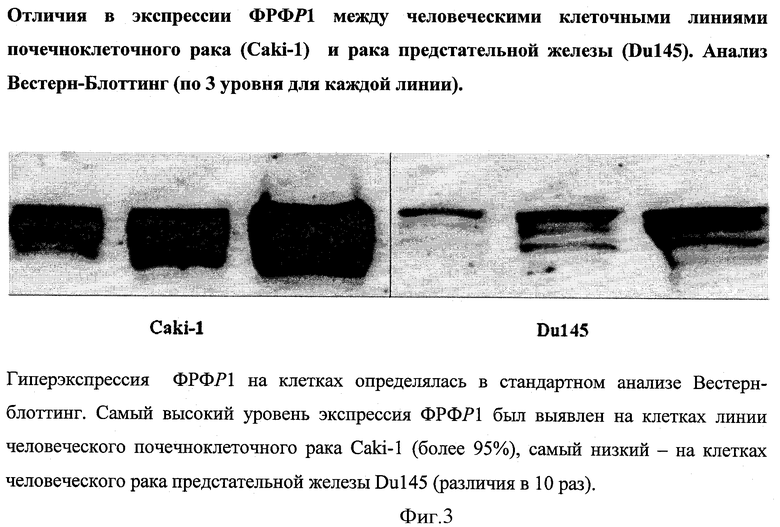
Гиперэкслрессия ФРФР1 на клетках определялась в стандартном анализе Вестерн-блоттинг. Общий уровень экспрессии ФРФР1 на клетках составил 40%. Самый высокий уровень экспрессия ФРФР1 был выявлен на клетках линии человеческого почечноклеточного рака Caki-1, самый низкий - на клетках человеческого рака предстательной железы Du145 (различия в 10 раз): фигура 3.
Основываясь на полученных данных, линия человеческого почечноклеточного рака Caki-1 была отобрана для дальнейших исследований.
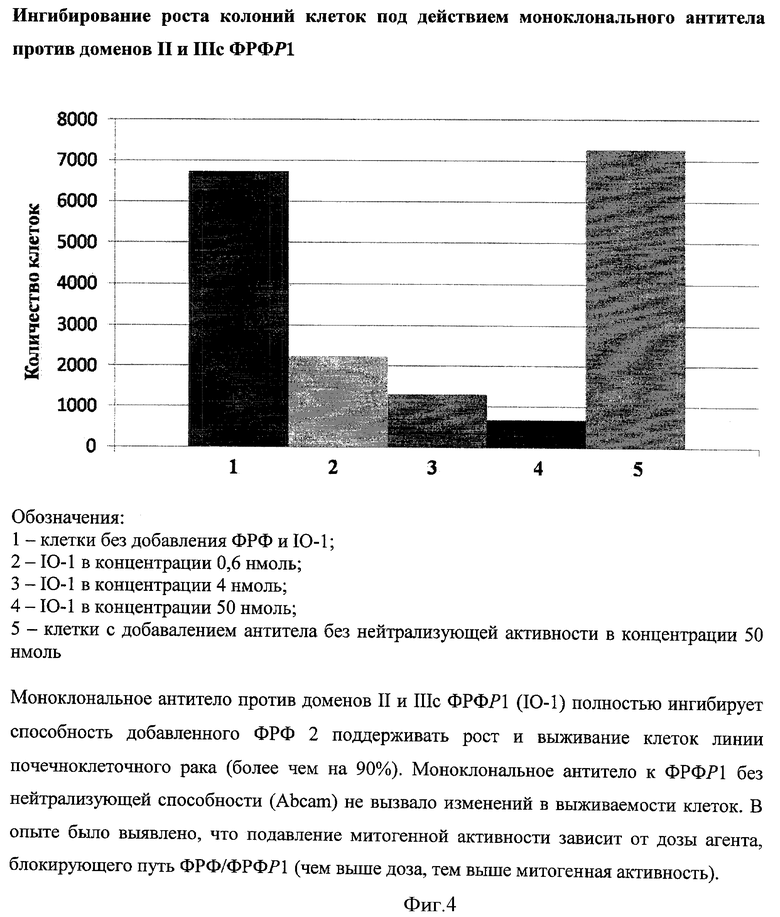
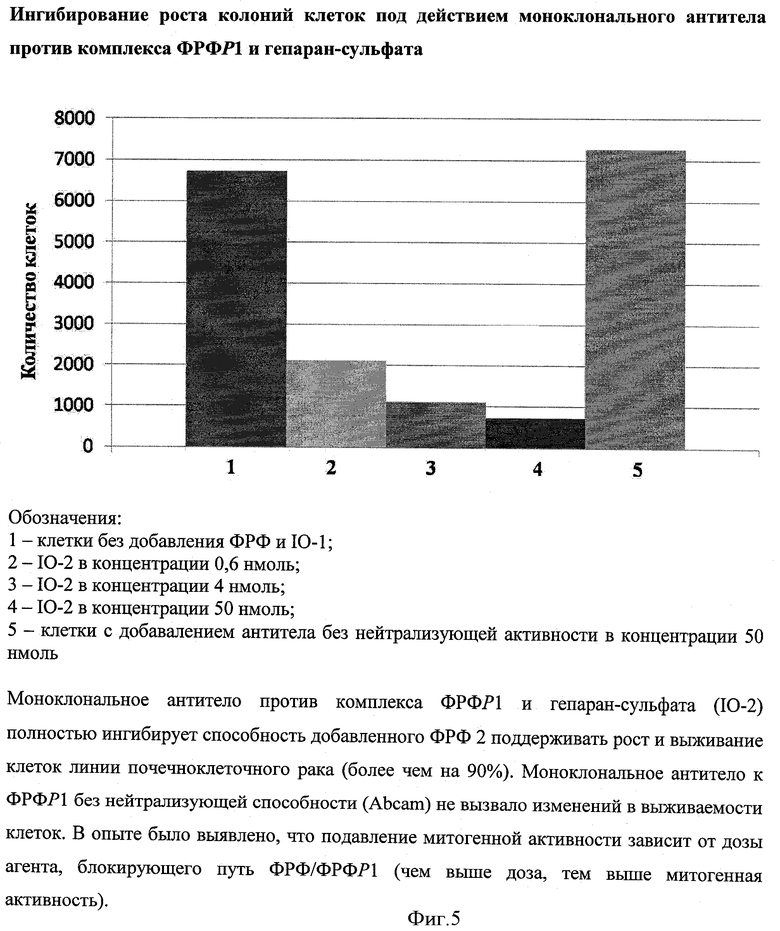
Клетки были высеяны с плотностью 104 клеток/мл в 6-луночных пластинках. В каждую лунку были добавлены нейтрализующие моноклональные антитела IO-1 и IO-2 в равном объеме и различных концентрациях. Также в качестве контроля к части культуры было добавлено постороннее моноклональное антитело без нейтрализующей способности (приобретенное в Abcam). После инкубации в каждую лунку был добавлен ФРФР2 по 10 нг/мл. В качестве дополнительного контроля часть клеток выращивалась в отсутствие как атител, так и ФРФ 2. После роста культуры в течение 3 недель клетки в каждой лунке были подсчитаны с помощью компьютерной программы на анализаторе Hewlett Packard Scanjet (США).
Как показано на фигурах 4 и 5, оба моноклональных антитела (IO-1 и IO-2) полностью ингибировали способность добавленного ФРФ 2 поддерживать рост и выживание клеток линии почечноклеточпого рака (более чем на 90%). Достоверных различий в активности IO-1 и IO-2 выявлено не было. Моноклональное антитело к ФРФР1 без нейтрализующей способности (Abcam) не вызвало изменений в выживаемости клеток. В опыте было выявлено, что подавление митогенной активности зависит от дозы агента, блокирующего путь ФРФ/ФРФР1 (чем выше доза, тем ниже митогенная активность). Общий вывод по данному примеру: при одновременном блокировании доменов II и IIIc ФРФР1 достигается сильное ингибирование роста опухолевых клеток.
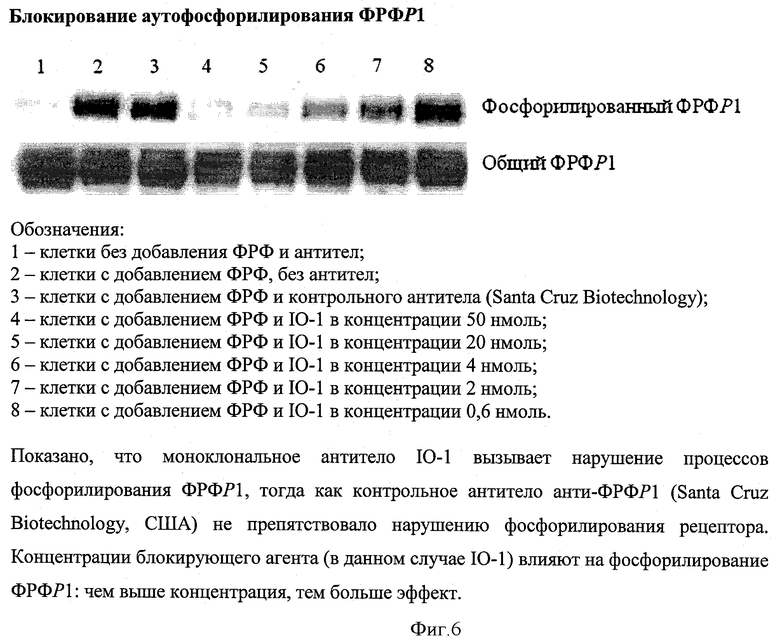
Также в данном примере мы показываем, что блокирование рецептора фактора роста фибробластов приводит к нарушению аутофосфорилирования рецептора, что отражает его функциональное значение.
Для этого к описанным клеткам было добавлено антитело IO-1 и через 1,5 часа - ФРФ 2, 10 нг/мл. Культивирование происходило в течение 5 минут при температуре 37°С. Затем клетки были промыты и лизированы в специальном буффере для лизиса (50 ммоль HEPES (рН 7,4), 150 ммоль NaCl, 10% глицерол, 1% Тритон Х-100, 1,5 ммоль MgCl2, ингибиторы протеазы и 2 ммоль натрия ванадат). Инкубация лизата проводилась на льду в течение 30 минут, а затем он был центрифугирован (13000 оборотов в минуту, в течение 10 минут при температуре 4°С). Концентрация белка в лизате была измерена в анализе Кумасси Плюс (Pierce). После этого проводились иммунопреципитация/Вестерн-блоттинг. Эти методы выполнялись по стандартному протоколу (Santa Cruz Biotechnology, США) с использованием 1 мг моноклонального антитела для связывания ФРФР1 (контрольное антитело; Santa Cruz Biotechnology), и анти-фосфотирозин (4G10) антител. Полученные пробы использовали для электрофореза с последующим выявлением копреципитированных белков в Вестерн-блоттинге. Часть клеток без добавления ФРФ2 и антител использовалась для контроля.
Результаты представлены на фигуре 6. Показано, что моноклональное антитело IO-1 вызывает нарушение процессов фосфорилирования ФРФР1, тогда как контрольное антитело анти-ФРФР1 (Santa Cruz Biotechnology, США) не препятствовало нарушению фосфорилирования рецептора. Концентрации блокирующего агента (в данном случае IO-1) влияют на фосфорилирование ФРФР1: чем выше концентрация, тем больше эффект.
Таким образом, пример 1 (исследование KCRB-L03) показывает, что клетки человеческого почечноклеточного рака в присутствии ФРФ2 пролифирируют, а при блокировании рецептора-мишени ФРФР1 (только доменов II и IIIc) и нарушении его функции перестают размножаться и теряют митогеннуто активность. Более того, в примере 1 продемонстрировано, что клетки в отсутствие ФРФ2 также не пролиферируют и это свидетельствует о его митогенном значении (если ФРФ2 связать, клетки также не будут пролиферировать).
Пример 2 (Результаты исследования KCRB-L04): анализ выживания или пролиферации эндотелиальных клеток in vitro, нарушение функции ФРФР1 на эндотелиоцитах при добавлении моноклонального антитела, блокирующего ФРФР1
Для анализа выживания эндотелиальных клеток в среде ФРФ и при блокировании ФРФР1 был проведен подобный эксперимент, что и при блокировании фактора роста эндотелиальных клеток сосудов, описанный в документе (Rockwell; Patricia et al. US 20090022716).
В качестве модели эндотелиоцитов использовались бычьи клетки капиллярного эндотелия коры надпочечников (КЭКН) (N. Ferrara et al. Proc. Nat. Acad. Sci. 84: 5773 (1987)).
В начале мы выявили высокую экспрессию ФРФР1 на КЭКН в стандартном анализе Вестерн-блоттинг (фигура 7).
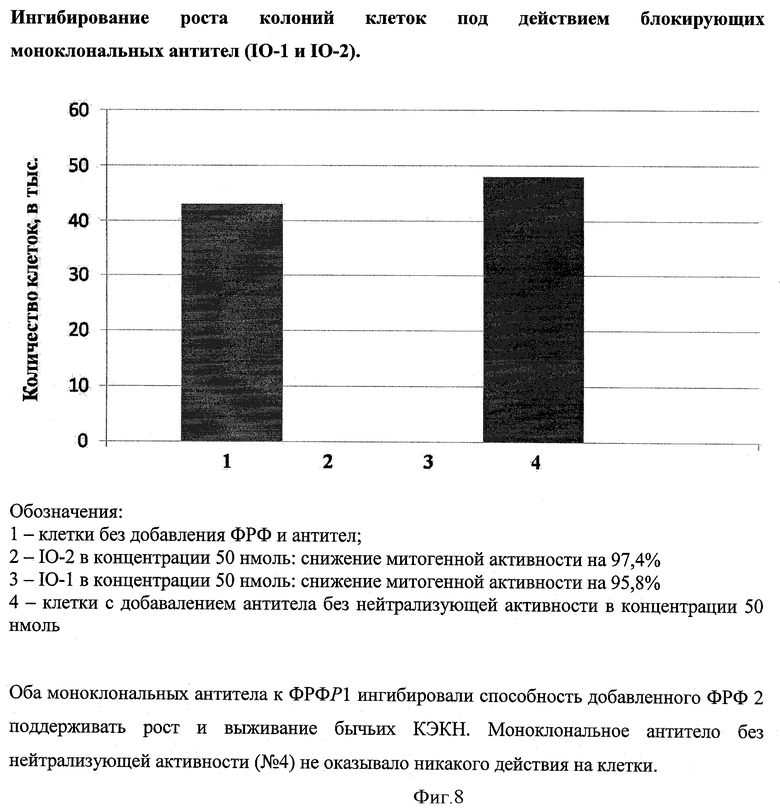
Затем КЭКН были высеяны с плотностью 5×104 клеток/мл в 12-луночных пластинках. В каждую лунку было добавлено 10 нг/мл ФРФ2 в присутствии или в отсутствие различных концентраций моноклональных антител к ФРФР1, а также постороннего моноклонального антитела без нейтрализующей активности к ФРФР1 (Abcam). После роста культуры в течение 5 дней клетки в каждой лунке были подсчитаны с помощью компьютерной программы на анализаторе Hewlett Packard Scanjet (США). В качестве дополнительного контроля КЭКН выращивались в отсутствие ФРФ2.
Как показано на фигуре 8, оба моноклональных антитела к ФРФР1 ингибировали способность добавленного ФРФ2 поддерживать рост и выживание бычьих КЭКН. Моноклональное антитело без нейтрализующей активности (Abcam) не оказывало никакого действия на клетки.
Таким образом, пример 2 демонстрирует, что при блокировании пути ФРФ/ФРФР1 эндотелиальные клетки перестают размножаться и теряют митогенную активность, что может приводить к нарушению ангиогенеза в опухоли.
Пример 3 (Результаты исследования KCRB-L05): Ингибирование роста опухоли in vivo при блокировании пути ФРФ/ФРФР1
Самкам мышей (Beige/nude) возрастом 5-6 недель (приобретенным в Harlan Sprague Dawley, Inc. (Индианаполис, США)) были подкожно введены 2×106 опухолевых клеток линии человеческого почечноклеточного рака Caki-1 в 100 мкл физиологического раствора с фосфатным буфером (ФРФБ). После того, как установился рост опухоли, мыши были разделены на 3 группы.
Первой (лечебной) группе мышей вводили интраперитонеально 2 раза в неделю моноклональное антитело IO-1 к ФРФР1 в дозе 100 мкг/кг. Второй (лечебной) группе мышей вводили интраперитонеально 2 раза в неделю моноклональное антитело IO-2 к ФРФР1/гепаран-сульфату в дозе 100 мкг/кг. Третьей (контрольной) группе мышей вводился физиологический раствор. Каждая группа включала 15 мышей.
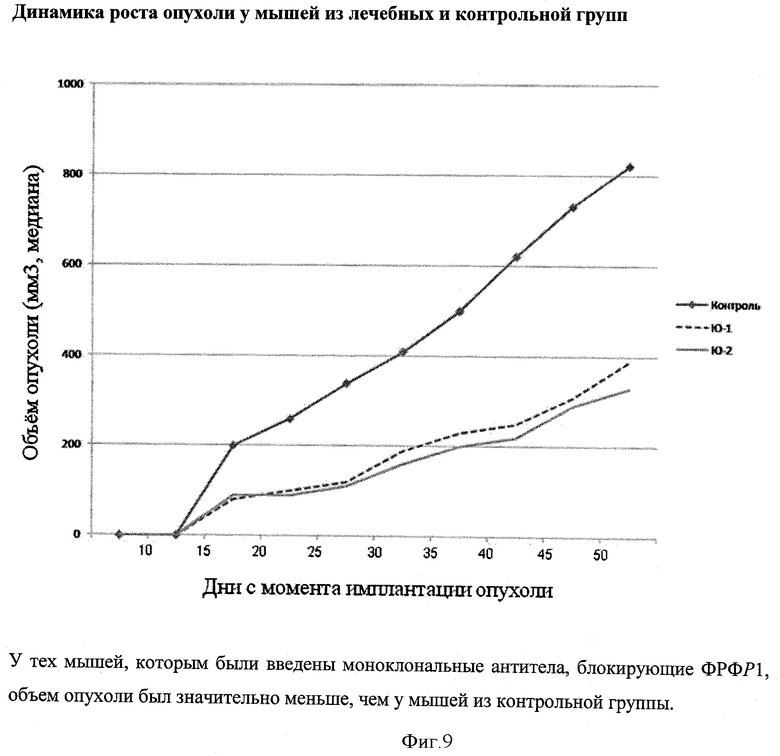
Величина опухоли измерялась каждые 5 дней, и по завершении исследования опухоли были вырезаны и взвешены.
Влияние моноклональных антител/физиологического раствора на рост (объем) опухолей показан на фигуре 9, на которой видно, что у тех мышей, которым были введены моноклональные антитела, блокирующие ФРФР1, объем опухоли был значительно меньше, чем у мышей из контрольной группы.
Вес (медиана) опухоли мышей контрольной группы был достоверно выше по сравнению с мышами лечебных групп (р<0,001). Количество метастазов в легкие также было достоверно выше у мышей контрольной группы (р<0,01).
У тех мышей, которые получали нейтрализующие моноклональные антитела, начиная с первой недели после инокуляции клетками Caki-1, скорость роста опухолей была значительно более медленной, чем у мышей, которым вводили физиологический раствор.
На основании этих данных был сделал вывод об эффективности способа подавления роста опухоли in vivo путем блокирования пути ФРФ/ФРФР1 (через блокирование доменов II и IIIc ФРФР1).
Заявитель подтверждает, что он получил несколько гибридомных линий, продуцирующих антитела, пригодные для реализации заявленного изобретения. Ниже заявитель приводит последовательности, относящиеся к полученным им антителам. Антитела включают как мышиные, так и химерные и гуманизированные.




Изобретение относится к биотехнологии. Описано антитело, специфически связывающее домены II и IIIc ФРФР1 или комплекс рецептора 1 типа фактора роста фибробластов и гепаран-сульфата. Представлен способ подавления роста опухоли, основанный на блокировании пути «человеческий фактор роста фибробластов/человеческий рецептор 1 типа фактора роста фибробластов (домены II и IIIc)», включающий введение описанного антитела. Предложен конъюгат моноклонального описанного антитела и контрастных веществ, предназначенный для использования в диагностике злокачественных и других образований, клетки которых экспрессируют ФРФР1 в большом количестве. Также предложен способ диагностики злокачественных новообразований. Изобретение позволяет блокировать путь «фактор роста фибробластов/рецептор 1 типа фактора роста фибробластов» через связывание с доменами II и IIIc ФРФР1, что приводит к остановке или замедлению роста опухоли. Изобретение предоставляет новые препараты для диагностики и лечения заболеваний, связанных с избыточной пролиферацией и неоваскуляризацией. 5 н. и 8 з.п. ф-лы, 9 ил., 2 табл.
1. Моноклональное антитело или его фрагмент, содержащее антигенсвязывающую область, гипервариабельный участок которой CDRs 1-3 представлен соответствующей аминокислотной последовательностью SEQ ID NO: 1, и/или 2, и/или 3, обладающее аффинностью не менее 2·10-9 в отношении доменов II и IIIc рецептора 1 типа фактора роста фибробластов, что приводит к остановке или торможению роста опухоли.
2. Моноклональное антитело по п.1, отличающееся тем, что ингибирует митогенную активность рецептора 1 типа фактора роста фибробластов не менее чем на 90%.
3. Моноклональное антитело по п.1, отличающееся тем, что содержит аминокислотную последовательность домена Fc тяжелой цепи одного из: IgA, IgG1, IgG2, IgG3, IgG4 или IgM.
4. Моноклональное антитело по п.1, отличающееся тем, что оно является химерным, или гуманизированным, или полностью человеческим антителом.
5. Моноклональное антитело по п.1, отличающееся тем, что является антагонистом взаимодействия фактора роста фибробластов и рецептора 1 типа фактора роста фибробластов.
6. Моноклональное антитело или его фрагмент, содержащее антигенсвязывающую область, гипервариабельный участок которой CDRs 1-3 представлен соответствующей аминокислотной последовательностью SEQ ID NO: 1, и/или 2, и/или 3, обладающее аффинностью не менее 2·10-9 в отношении комплекса рецептора 1 типа фактора роста фибробластов и гепаран-сульфата, что приводит к остановке или торможению роста опухоли.
7. Моноклональное антитело по п.6, отличающееся тем, что ингибирует митогенную активность рецептора 1 типа фактора роста фибробластов или его комплекса с гепаран-сульфатом не менее чем на 90%.
8. Моноклональное антитело по п.6, отличающееся тем, что содержит аминокислотную последовательность домена Fc тяжелой цепи одного из: IgA, IgG1, IgG2, IgG3, IgG4 или IgM.
9. Моноклональное антитело по п.6, отличающееся тем, что оно является химерным, или гуманизированным, или полностью человеческим антителом.
10. Моноклональное антитело по п.6, отличающееся тем, что является антагонистом взаимодействия фактора роста фибробластов и рецептора 1 типа фактора роста фибробластов.
11. Способ подавления роста опухоли, заключающийся в блокировании (нейтрализации) доменов II и IIIc рецептора 1 типа фактора роста фибробластов или комплекса рецептора 1 типа фактора роста фибробластов и гепаран-сульфата путем введения реципиенту моноклонального антитела или его фрагмента по п.1 или 6.
12. Конъюгат моноклонального антитела или его фрагмента, содержащее антигенсвязывающую область, по п.1 или 6 и контрастных веществ, предназначенный для использования в диагностике злокачественных и других образований, клетки которых экспрессируют ФРФР1 в большом количестве.
13. Применение антитела по п.1 или 6 или конъюгата по п.12 для диагностики злокачественных новообразований у человека самостоятельно или в сочетании с другими диагностическими процедурами.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| МОДИФИЦИРОВАННОЕ АГОНИСТИЧЕСКОЕ АНТИТЕЛО | 2001 |
|
RU2295537C2 |
Авторы
Даты
2012-01-20—Публикация
2011-02-07—Подача