Предлагаемое изобретение относится к органической химии, а точнее к способам получения соединений инденового ряда. Эти соединения находят широкое применение в качестве биологически активных препаратов, в каталитических системах, в качестве компонентов аккумуляторных батарей.
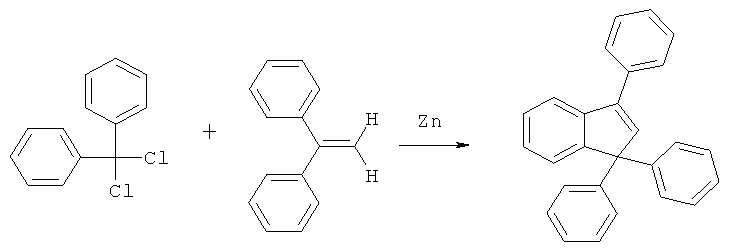
Известен способ получения 1,1,3-трифенилиндена с выходом 70%, основанный на взаимодействии дифенилдихлорметана с 1,1-дифенилэтиленом в присутствии цинковой пыли [Hodgkins J., Hughes M. Divalent carbon: some reaction in the diphenylmethyl series. J. Org. Chem. 1962. - Vol.27. - p.4187-4191]:
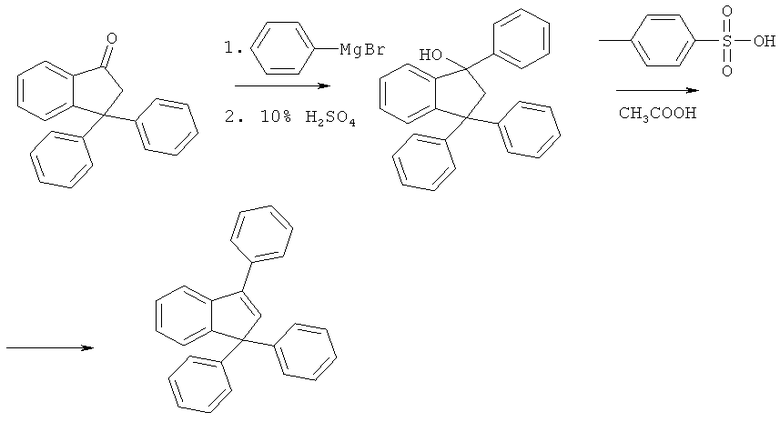
Известен способ получения 1,1,3-трифенилиндена с выходом 50%, заключающийся в двухстадийном синтезе из 3,3-дифенилинданона. На первой стадии 3,3-дифенилинданон обрабатывают фенилмагний бромидом и после гидролиза реакционной массы выделяют 1,3,3-трифенилинданол-1, который далее подвергают дегидратации при нагревании с раствором 4-толуолсульфокислоты в уксусной кислоте [Miller L.L., Boyer R.F. The thermolysis of substituted indenes. Sigmatropic phenyl and hydrogen migrations. J. Am. Chem. Soc. - 1971. - Vol.93. - p.650-656]:
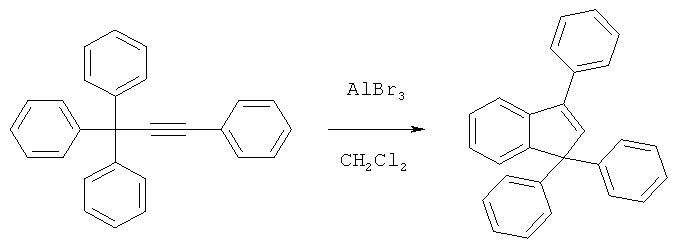
Известен способ получения 1,1,3-трифенилиндена с выходом 47% из тетрафенилпропина и трехбромистого алюминия в растворе в хлористом метилене [А.О.Щукин, А.В.Васильев, Е.В.Гриненко. Реакции арилацетиленовых соединений с аренами под действием галогенидов алюминия. Журн. органической химии, 2010, - том 46, вып.1, с.81-97]:
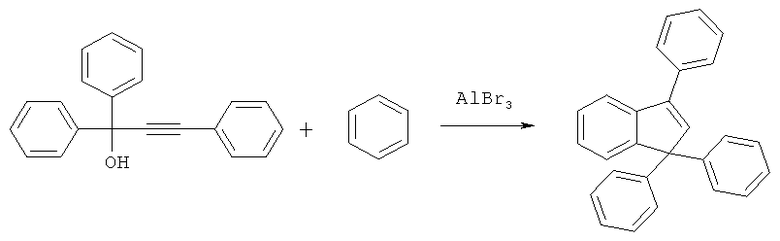
Известен способ получения 1,1,3-трифенилидена с выходом 50% по реакции 1,1,3-трифенилпроп-2-ин-1-ола с бензолом в присутствии 5 эквивалентов трибромида алюминия [А.О.Щукин, А.В.Васильев. Синтез замещенных интенов из производных 3-фенилпроп-2-ин-1-ола. Журн. органической химии, 2007, том 43, вып.5, с.785-787]
Известен способ получения 1,1,3-трифенилиндена с выходом 12% по реакции 1,3-дифенилпропинона с бензолом в присутствии 5 эквивалентов трибромида алюминия [А.В.Васильев, А.О.Щукин. Реакция ацетиленовых карбонильных соединений с бензолом в присутствии бромида алюминия - новый метод синтеза замещенных инденов. Журн. органической химии, 2006, том 42, вып.8, с.1256-1258]:
Наиболее близким к заявляемому является способ получения 1,1,3-трифенилиндена из перхлората трифенилкарбения и фенилацетилена в среде абсолютного диметилсульфоксида с выходом 92% [D.Martin, A.Weise. Cyansaureester. XII. Tritylierung von cyanverbindungen in dimethylsulfoxid. Liebigs. Ann. Chem. 1967. - 702, p.86-93]
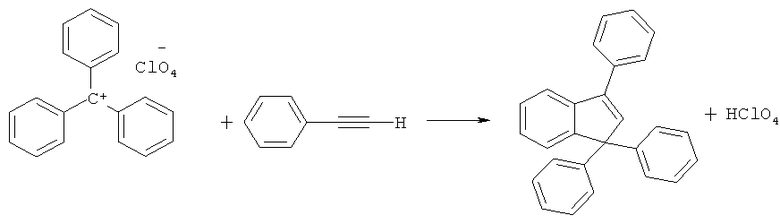
Использование в качестве производного трифенилметана перхлората трифенилкарбения сопряжено с рядом трудностей, а именно: требуется его приготовление из трифенилметанола и хлорной кислоты. Использование хлорной кислоты - взрывоопасного вещества - в свою очередь требует применения особых условий работы.
Технической задачей заявляемого способа является разработка безопасного простого способа получения 1,1,3-трифенилиндена за счет использования более дешевых и доступных реагентов.
Поставленная задача решается путем использования в качестве исходного соединения, содержащего трифенилметановый фрагмент, трифенилметанол, который вводится в реакцию с фенилацетиленом в присутствии кислоты Льюиса, в среде органического растворителя, обеспечивающего возможность отделения образующейся в ходе реакции воды в виде азеотропной смеси. Реакция протекает в соответствии со схемой:
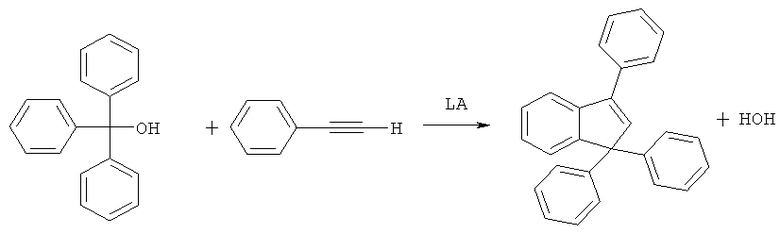
LA=ZnI2, Sc(OTf)3, Yb(OTf)3, In(OTf)3, Ga(OTf)3
Способ включает нагревание эквимолекулярных количеств реагентов в среде растворителя, обеспечивающего возможность отделения образующейся в ходе реакции воды в виде азеотропной смеси, в присутствии каталитических количеств кислоты Льюиса, сохраняющей свою активность в присутствии воды. В качестве таких кислот Льюиса могут быть использованы: иодид цинка, трифлат скандия, трифлат иттербия, трифлат индия, трифлат галлия. В качестве растворителя может быть использован толуол, бензол, 1,2-дихлорэтан, хлороформ, дихлорметан. Продукт реакции выделяют перекристаллизацией из этилового или изопропилового спирта, после предварительной обработки реакционной массы раствором соляной кислоты, отделения органической фазы и удаления растворителя.
Пример получения 1,1,3-трифенилиндена
В круглодонную колбу, снабженную насадкой для отделения воды в виде азеотропной смеси, с обратным холодильником, помещают 50 мл органического растворителя и 0,0025 моль кислоты Льюиса, приливают раствор 13,02 г (0,05 моль) трифенилкарбинола в 50 мл растворителя и 5,10 г (0,05 моль) фенилацетилена. Нагревают при кипении до прекращения отделения воды. Затем остывшую реакционную массу переносят в делительную воронку, содержащую 100 мл 2 М соляной кислоты, встряхивают, органический слой отделяют, водный экстрагируют трижды порциями хлороформа по 20 мл. Из объединенных органических фаз удаляют растворитель, а остаток перекристаллизовывают из этилового спирта. Получают 1,1,3-трифенилинден в виде бесцветных кристаллов с Тпл 135°С.
ИК-спектр (ν, см-1 KBr): 3056, 3025, 3074 (CAr-H), 1594, 1488 (CAr -CAr)
ЯМР 1Н (CDCl3, 400 MHz): 6,84 (1H), 7,29-7,75 (м, 19Н)
ЯМР 13С (CDCl3, 75,43 MHz): 65,7 (Csp3); 121,44, 125,797, 125,93, 126,77, 127,05; 127,85, 127,96, 128,49, 128,64, 135,38, 141,74; 142,56, 143,83, 151,27
Масс-спектр (ЭУ 70 эВ, m/z, I %): 344 (100) M+, 329 (7), 267 (50), 165 (9), 149 (13), 133 (9).
Выход продукта в зависимости от используемого растворителя и кислоты Льюиса приведен в таблице.
Таким образом, взаимодействие трифенилкарбинола с фенилацетиленом в присутствии кислот Льюиса, в качестве которых применяли иодид цинка, трифлат скандия, трифлат иттербия, трифлат галлия, трифлат индия (III), обеспечивает получение 1,1,3-трифенилиндена - целевого вещества с хорошим выходом, при этом применяют более доступные исходные соединения, что делает способ промышленно применимым.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 1-АЛКИНИЛАДАМАНТАНОВ | 2012 |
|
RU2507189C1 |
| Способ получения 1-адамантилферроцена | 2018 |
|
RU2691998C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ДИБЕНЗОСУБЕРЕНИЛЬНЫЙ ФРАГМЕНТ | 2014 |
|
RU2560727C1 |
| СПОСОБ СИНТЕЗА N-(ФОСФОНОМЕТИЛ)ГЛИЦИНА | 2013 |
|
RU2674023C9 |
| Способ получения тетраалкинилсиланов | 2019 |
|
RU2724877C1 |
| СПОСОБ ПОЛУЧЕНИЯ 7-ЗАМЕЩЕННЫХ СТЕРОИДНЫХ СОЕДИНЕНИЙ, СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ ЭПЛЕРЕНОНА, ПРОДУКТ | 2003 |
|
RU2289586C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,1,1,3-ТЕТРАФЕНИЛПРОПИНА | 2011 |
|
RU2473531C1 |
| ПРОИЗВОДНЫЕ БЕНЗОЛА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2000 |
|
RU2248964C2 |
| СПОСОБ СИНТЕЗА N-(ФОСФОНОМЕТИЛ)ГЛИЦИНА | 2013 |
|
RU2674021C9 |
| СПОСОБ ПОЛУЧЕНИЯ N-АЛКИЛАЗИРИДИНО[2',3':1,9]ФУЛЛЕРЕНОВ[60] | 2014 |
|
RU2594561C2 |
Изобретение относится к способу получения 1,1,3-трифенилиндена из фенилацетилена и производного трифенилметана, характеризующемуся тем, что в качестве производного трифенилметана используется трифенилметанол в присутствии каталитических количеств кислоты Льюиса в среде органического растворителя, обеспечивающего возможность отделения образующейся воды, в виде азеотропной смеси. Данный способ является безопасным и простым способом получения 1,1,3-трифенилиндена за счет использования более дешевых и доступных реагентов. 9 з.п. ф-лы, 1 табл.
1. Способ получения 1,1,3-трифенилиндена из фенилацетилена и производного трифенилметана, отличающийся тем, что в качестве производного трифенилметана используется трифенилметанол в присутствии каталитических количеств кислоты Льюиса в среде органического растворителя, обеспечивающего возможность отделения образующейся воды, в виде азеотропной смеси.
2. Способ по п.1, отличающийся тем, что в качестве кислоты Льюиса используют иодид цинка.
3. Способ по п.1, отличающийся тем, что в качестве кислоты Льюиса используют трифлат скандия.
4. Способ по п.1, отличающийся тем, что в качестве кислоты Льюиса используют трифлат индия.
5. Способ по п.1, отличающийся тем, что в качестве кислоты Льюиса используют трифлат иттербия.
6. Способ по п.1, отличающийся тем, что в качестве кислоты Льюиса используют трифлат галлия.
7. Способ по любому из пп.1-6, отличающийся тем, что в качестве органического растворителя используют толуол.
8. Способ по любому из пп.1-6, отличающийся тем, что в качестве органического растворителя используют бензол.
9. Способ по любому из пп.1-6, отличающийся тем, что в качестве органического растворителя используют дихлорметан.
10. Способ по любому из пп.1-6, отличающийся тем, что в качестве органического растворителя используют 1,2-дихлорэтан.
| D.MARTIN., A.WEISE | |||
| CYANSAUREESTER | |||
| XII | |||
| TRITYLIERUNG VON CYANVERBINDUNGEN IN DIMETHYLSULFOXID | |||
| LIEBIGS | |||
| ANN | |||
| CHEM | |||
| Запальная свеча для двигателей | 1924 |
|
SU1967A1 |
| RU 2004132850 A, 10.07.2005 | |||
| JP 2003261466 A, 16.09.2003. | |||
Авторы
Даты
2012-01-27—Публикация
2010-09-07—Подача