Предлагаемое изобретение относится к органической химии, а точнее к способам получения ацетиленовых соединений, являющихся полупродуктами для органического синтеза.
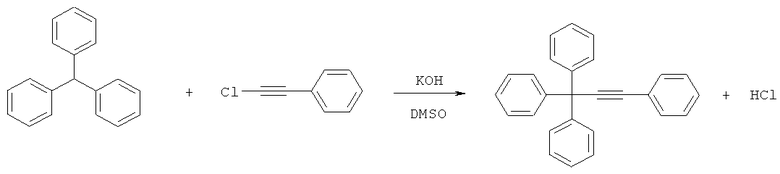
Известен способ получения 1,1,1,3-тетрафенилпропина с выходом конечного продукта 12% из трифенилметана и хлорфенилацетилена в среде диметилсульфоксид-гидроксид калия [Izumi Т., Miller S.I. Competing nucleophilic processes in haloalkynes. Carbanionic attacks. - J. Org. Chem. - 1978. - Vol.43, №5. - P.871-875]:
Известен способ получения 1,1,1,3-тетрафенилпропина с выходом конечного продукта 78%, заключающийся во взаимодействии диметилфенилэтинилталлия, полученного предварительно по реакции фенилацетиленида лития, с диметилталлий хлоридом в среде абсолютного диэтилового эфира, с трифенилхлорметаном [Marko I.E, Kantam M.L., 2007, - Том 43, вып.5, с.785-787.]:
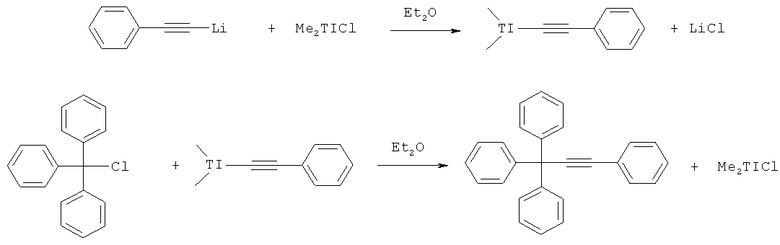
Использование в качестве металлпроизводного фенилацетилена в синтезе тетрафенилпропина таллийорганических соединений сопряжено с необходимостью работы с высокотоксичными таллийорганическими соединениями.
Известен способ получения 1,1,1,3-тетрафенилпропина с выходом конечного продукта 52%, включающий на первой стадии нагревание бромстирола с фениллитием в среде абсолютного диэтилового эфира, приводящее к получению фенилацетиленида лития, который на второй стадии нагревают при 50°C в течение двух дней с трифенилхлорметаном [Wittig V.G., Schloeder Н. / Uber die addition des triryl-natriums an butadiene in gegenwart von triphenyl-bor. - Justus Liebigs Ann. Chem. - 1955. - Vol.592. - P.38-53]:
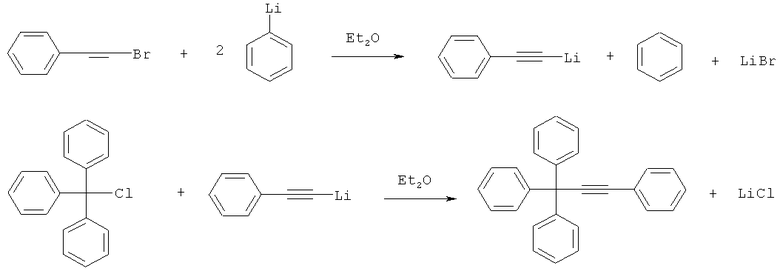
Недостатком предложенного способа является длительность проведения реакции.
Наиболее близким аналогом к заявляемому изобретению является способ получения 1,1,1,3-тетрафенилпропина из магнийорганического производного фенилацетилена и трифенилхлорметана с выходом конечного продукта 86%, заключающийся во взаимодействии избытка фенилэтинилмагнийбромида, предварительно полученного реакцией фенилацетилена с этилмагнийбромидом, с трифенилхлорметаном в среде диэтилового эфира [Wieland Н., Kloss Н. Uber einige neue Abkommlinge des Triphenylmethans. - Justus Liebigs Ann. Chem. - 1929. - Vol.470. - P.201-223]:
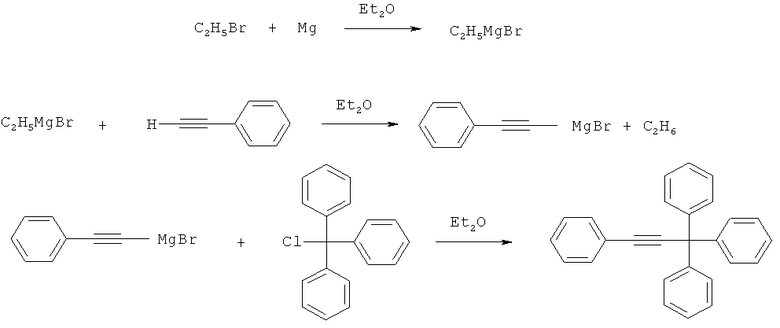
Использование способа, предложенного в прототипе, заключающегося в применении в качестве металлпроизводного фенилацетилена магнийорганических соединений, не обеспечивает воспроизводимость выходов целевого вещества, о чем свидетельствуют источники информации (выход 95% [Shi М, Shouki К., Okamoto Y., Takamuku S. Photolysis of 1,1,1-triarylalk-2-enes and l,l,l-triarylhept-2-ynes. A novel generation of aryl(alk-l-enyl)carbenes and aryl(alk-l-ynyl)carbenes. - J. Chem. Soc. Perkin Trans I. - 1990. - №9. - P.2443-2450]; выход 10% [Щукин A.O., Васильев A.B., Гриненко Е.В. Реакции арилацетиленовых соединений с аренами под действием галогенидов алюминия. Журн. орган. Химии, 2010, том 46, вып.1, с.81-97]; выход 40% [Masson J-C, Quan М., Cadiot P. Composes acetyleniques des elements de la colonne IVb. Etude cinetique de coupure de la liaison heteroatome-carbon acetylenique. - Bull. Soc. Chim. Fr. - 1968. - №3 - P.1085-1088]).
Техническим решением является разработка способа получения 1,1,1,3-тетрафенилпропина, обеспечивающего воспроизводимые результаты с хорошим выходом конечного продукта.
Технический результат достигается использованием в качестве металлпроизводного фенилацетилена тетрафенилэтинилаланата лития, получаемого из эквимольных количеств фенилацетилена и алюмогидрида лития в среде абсолютного 1,4-диоксана при температуре кипения растворителя в течение 30 мин, с последующей реакцией с трифенилхлорметаном в течение 1 часа в соответствии со схемой:
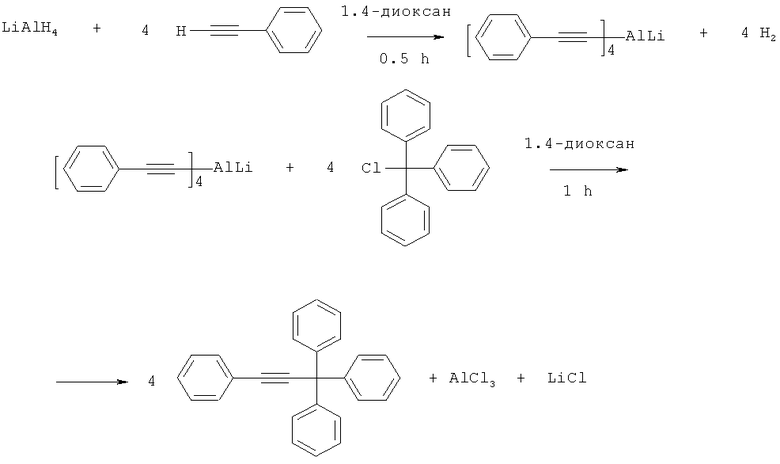
После нагревания реакционную массу обрабатывают раствором соляной кислоты, отделяют органическую фазу и удаляют растворитель. Очистку осуществляют перекристаллизацией из смеси этилового спирта и этилацетата.
Контроль хода реакции с использованием тонкослойной хроматографии позволил определить, что для максимальной конверсии исходных соединений необходимо осуществлять реакции в течение 1 часа.
Пример получения 1,1,1,3-тетрафенилпропина
В трехгорлую колбу, снабженную обратным холодильником, защищенным хлоркальциевой трубкой с едким калием, трубкой для ввода инертного газа и септой, помещают 30 мл абсолютного 1,4-диоксана и 0,15 г (0,00395 моль) алюмогидрида лития, перемешивают. Через септу вводят 1,73 мл (0,015 моль) фенилацетилена. Затем реакционную массу нагревают при температуре кипения растворителя 30 мин.
К полученной реакционной массе прибавляют раствор 4,2 г (0,015 моль) трифенилхлорметана в 25 мл абсолютного 1,4-диоксана и нагревают при кипении растворителя 1 час. Далее к реакционной массе прибавляют 100 мл 2М раствора соляной кислоты и продукт экстрагируют трижды порциями дихлорметана по 30 мл. Из объединенных органических фаз отгоняют растворитель, а остаток перекристаллизовывают из смеси этанол : этил ацетат. Получают 1,1,1,3-тетрафенилпропин в виде бесцветных кристаллов с Тпл 139°C. Выход 74%.
ИК-спектр (ν, см-1, KBr): 3080, 3055, 3020 (CAr-H), 1597, 1489 (CAr-CAr)
Спектр ЯМР 1H (CDCl3, 400 MHz): 7.27-7.39 (м) 13 Н, 7,53-7,56 (м) 2Н
Спектр ЯМР 13C (CDCl3, 75,43 MHz): 56.23 (Csp3); 85.27, 95.78 (C≡C); 123.72, 126.96, 128.16, 128.72, 129.32, 131.76, 145.48
Масс-спектр (ЭУ 70 эВ, m/z, I%): 344 (100) М+, 329 (3), 265 (40), 165 (25), 133 (5).
Таким образом, взаимодействие трифенилхлорметана с тетрафенилэтинилаланатом лития в среде абсолютного 1,4-диоксана обеспечивает получение 1,1,1,3-тетрафенилпропина - целевого вещества с хорошим выходом, при этом применяют коммерчески доступные реагенты, что делает способ промышленно применимым.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АЛКИНИЛСИЛАНОВ | 2008 |
|
RU2368615C1 |
| СПОСОБ ПОЛУЧЕНИЯ 9, 10-БИС(ФЕНИЛЭТИНИЛ)АНТРАЦЕНА И ЕГО ПРОИЗВОДНЫХ | 1992 |
|
RU2054406C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТИЛЕНИДОВ ОЛОВА | 2017 |
|
RU2649148C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,1,3-ТРИФЕНИЛИНДЕНА | 2010 |
|
RU2440963C1 |
| Способ получения натриевых солей сн-кислот | 1980 |
|
SU910638A1 |
| СССРПриоритет 08.V.1970, № р 2022503.0, ФРГ 23.IX.1970, № Р 2046848.8, ФРГОпубликовано 16.1.1973. Бюллетень № 7 Дата опубликования описания 11.VI.1973М. Кл. С 07f 9/50 С 07d 53/06УДК 547.341.07(088.8) | 1973 |
|
SU366615A1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРИ- И ТЕТРАОРГАНИЛАЛКИНИЛОЛОВА | 2006 |
|
RU2317993C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРИСТОГО КООРДИНАЦИОННОГО ПОЛИМЕРА NH-MIL-101(Al) И ПОРИСТЫЙ КООРДИНАЦИОННЫЙ ПОЛИМЕР NH-MIL-101(Al), ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2015 |
|
RU2578599C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЕННЫХ-2-ЦИАНОФУРАНОВ | 2000 |
|
RU2189978C2 |
| СПОСОБ ПОЛУЧЕНИЯ а-АЦЕТИЛЕНОВЫХ АМИНОВ | 1964 |
|
SU164293A1 |
Изобретение относится к способу получения 1,1,1,3-тетрафенилпропина из металлпроизводного фенилацетилена и трифенилхлорметана в среде органического растворителя. Способ характеризуется тем, что в качестве металлпроизводного фенилацетилена используют тетрафенилэтинилаланат лития, а в качестве органического растворителя используют абсолютный 1,4-диоксан, реакцию осуществляют при нагревании при температуре кипения растворителя в течение 1 часа. Настоящее изобретение предоставляет способ получения 1,1,1,3-тетрафенилпропина, обеспечивающий воспроизводимые результаты с хорошим выходом конечного продукта. 1 пр.
Способ получения 1,1,1,3-тетрафенилпропина из металлпроизводного фенилацетилена и трифенилхлорметана в среде органического растворителя, отличающийся тем, что в качестве металлпроизводного фенилацетилена используют тетрафенилэтинилаланат лития, а в качестве органического растворителя используют абсолютный 1,4-диоксан, реакцию осуществляют при нагревании при температуре кипения растворителя в течение 1 ч.
| Wieland Н., Kloss Н | |||
| "Uber einige neue Abkommlinge des Triphenylmethans", Justus Liebigs Ann | |||
| Chem., 1929, Vol.470, P.201-223 | |||
| Способ получения 4,4-дифенилбутина-1 | 1988 |
|
SU1675295A1 |
Авторы
Даты
2013-01-27—Публикация
2011-12-05—Подача