Область техники, к которой относится изобретение
Настоящее изобретение относится к новым солям ингибитора фактора Ха, их полиморфам и способам получения ингибитора фактора Ха.
Уровень техники
Гемостаз, контроль кровотечения, осуществляют хирургическими средствами или с использованием физиологических свойств сокращения сосудов (вазоконстрикции) и коагуляции. В особенности, настоящее изобретение касается коагуляции крови и того, как эта коагуляция способствует поддержанию целостности системы кровообращения млекопитающего после повреждения, воспаления, заболевания, врожденного дефекта, дисфункции или другого повреждения. Хотя в восстановлении гемостаза и в развитии тромботических заболеваний принимают участие и тромбоциты, и система коагуляции крови, некоторые компоненты каскада коагуляции более всего определяют усиление и ускорение процессов агрегации тромбоцитов и отложения фибрина, а последние являются основными событиями в тромбозе и гемостазе.
Образование тромба включает превращение фибриногена в фибрин, который полимеризуется в сетчатую структуру, восстанавливающую гемостаз после повреждения. Похожий процесс приводит к закупорке кровеносных сосудов при тромботических заболеваниях. Превращение фибриногена в фибрин катализируется тромбином, конечным продуктом серии реакции каскада свертывания крови. Тромбин является также ключевым участником процесса активации тромбоцитов, внося тем самым свой вклад в тромбоз в условиях артериального и венозного кровотоков. По этим причинам постулируется, что эффективная регуляция тромбина может вести к эффективной регуляции тромбоза. Несколько классов антикоагулянтов, используемых в настоящее время, прямо или косвенно влияют на тромбин (то есть нефракционированные гепарины, гепарины низкого молекулярного веса, гепарин-подобные соединения, пентасахариды и варфарин). Прямое или косвенное ингибирование тромбина является также основной действия большого количества антикоагулянтов, проходящих в настоящее время клинические испытания (обзор Eriksson and Quinlan, Drugs 11: 1411-1429, 2006).
Протромбин, предшественник тромбина, превращается в активный фермент под действием фактора Ха. Локализованная активация генерации фактора Ха, опосредуемая тканевым фактором/фактором VIIa, усиливается комплексом фактора IXa/фактора VIIa и ведет к сборке протромбиназы на активированных тромбоцитах. Фактор Ха, как часть протромбиназного комплекса, является ключевым ферментом, отвечающим за длительное образование тромбина в кровеносных сосудах. Фактор Ха представляет собой сериновую протеазу, активированную форму своего предшественника Фактора X, и является членом семейства факторов свертывания крови, связывающих ионы кальция, содержащих гамма-карбоксиглутаминовую кислоту (gamma carboxyglutamic acid (GLA)) и зависящих от витамина К. В отличие от тромбина, действующего на большое количество протеиновых субстратов, включая фибриноген и рецепторы PAR (рецепторы, активируемые протеазами, protease activated receptors, Coughlin, J.Thrombosis Haemostasis 3: 1800-1814, 2005), у фактора Ха, вероятно, имеется только один физиологический субстрат, а именно, протромбин. Так как одна молекула Ха может генерировать более 1000 молекул тромбина (Mann, et al., J. Thrombosis. Haemostasis 1: 1504-1514, 2003), прямое ингибирование фактора Ха как способ косвенного ингибирования процесса образования тромбина может быть эффективной стратегией антикоагулирования. Это утверждение основано на ключевой роли протромбиназы в синтезе тромбина и на том, что ингибирование протромбиназы оказывает продолжительный эффект на общую агрегацию тромбоцитов и пути образования тромба.
Сами по себе активированные протеазы, такие как фактор VIIa, фактор IXa или фактор Ха, обладают плохой протеолитической активностью. Однако сборка этих протеаз в зависящий от кофактора, связанный с мембраной комплекс значительно усиливает их каталитическую эффективность. Этот эффект особенно заметен для фактора Ха, где эффективность возрастает на пять порядков (Mann, et al., Blood 76(1): 1-16, 1990). Благодаря более высокой концентрации зимогенов в крови (1,4 мкМ, по сравнению с 150 нМ фактора Ха) и кинетики активации, для достижения противосвертывающего эффекта необходимо заингибировать меньшее количество фактора Ха, чем протромбина. Косвенное свидетельство правоты гипотезы о главенстве фактора Ха как терапевтической мишени, по сравнению с тромбином, дают результаты клинических исследований методов профилактики глубокого венозного тромбоза. В четырех исследованиях методов ортопедической хирургии показано, что фондапаринукс, зависящий от антитромбина III ингибитор фактора Ха, проявляет больший эффект, по сравнению с эноксапарином (низкомолекулярным гепарином, ингибирующим как тромбин, так и фактор Ха) (Turpie, et al., Archives Internal Medicine 162 (16): 1833-1840, 2002). Таким образом, предполагается, что соединения, селективно ингибирующие фактор Ха, могут быть полезны как диагностические агенты in vitro или для терапевтического введения при некоторых тромботических расстройствах (см., например, WO 94/13693).
Сообщалось о нескольких ингибиторах фактора Ха. Они представляют собой полипептиды, выделенные из питающихся кровью организмов, а также меньшие по размеру ингибиторы полипептидного типа. Другие ингибиторы фактора Ха включают низкомолекулярные органические соединения, такие как азот-содержащие органические соединения с амидино-группами в качестве заместителей, причем две функциональные группы соединений могут связываться с фактором Ха по двум его активным сайтам. Например, в публикации WO 98/28269 описаны пиразольные соединения с терминальной амидиногруппой (-С(=NН)-NН2); в публикации WO 97/21437 описаны бензимидазольные соединения, замещенные основным радикалом, соединенным с нафтильной группой через прямой или разветвленный алкилен, мостиковую группу -С(=O)- или -S(=O)2-; в публикации WO 99/10316 описаны соединения с 4-фенил-М-алкиламидино-пиперидином или 4-фенокси-N-алкиламидино-пиперидином, соединенным с 3-амидинофенильной группой через карбоксиамидалкиленаминовый мостик; в патенте ЕР 798295 описаны соединения с 4-фенокси-N-алкиламидино-пиперидиновой группой, соединенной с амидинонафтильной группой через замещенную или незамещенную сульфонамидную или карбоксамидную мостиковую группу.
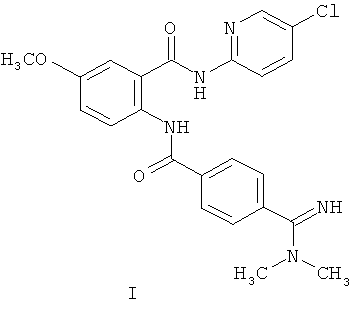
Кроме того, к числу ингибиторов фактора Ха относятся такие, структура которых содержит фенил-амидино, фенил и галофенил, соединенный через амидные связи (патент США №6844367 В1). У других ингибиторов фактора Ха галофенил замещен галопиридилом (см. патенты США №6376515 В2 и 6835739 В2). В патенте США №6376515 В2 раскрывается специфический ингибитор фактора Ха (см. пример 206), он также описан в патенте США №6835739 В2 (пример 206), а здесь идентифицирован как соединение формулы I. Структурная формула соединения формулы I следующая:

Продолжающаяся работа по разработке селективных ингибиторов фактора Ха привела к неожиданному открытию, что некоторые соли этого соединения демонстрируют лучшую термическую и гидролитическую стабильность, по сравнению со свободными основаниями или с другими солями, наилучшей наблюдаемой стабильностью характеризуются малеаты.
Раскрытие изобретения
В соответствии с одним аспектом, изобретение относится к солям, содержащим соединение формулы I:

и кислоту, где кислота выбрана из группы, состоящей из соляной, молочной, малеиновой, феноксиуксусной, пропионовой, янтарной, адипиновой, аскорбиновой, камфорной, глюконовой, фосфорной, винной, лимонной, метансульфоновой, фумаровой, гликолевой, нафталин-1,5-дисульфоновой, гентизиновой и бензолсульфоновой кислоты.
В соответствии с предпочтительным аспектом, кислота выбрана из группы, состоящей из соляной, молочной, малеиновой, феноксиуксусной, пропионовой, янтарной, адипиновой, аскорбиновой, камфорной, глюконовой, фосфорной, винной, лимонной и метансульфоновой кислот.
В соответствии с еще одним предпочтительным аспектом кислота выбрана из группы, состоящей из соляной, малеиновой, феноксиуксусной, пропионовой и янтарной кислот. В соответствии с одним аспектом соль представляет собой малеат или пропионат. Предполагается, что малеат соединения формулы I можно получить протонированием одного или более атомов азота соединения формулы I. В соответствии с одним аспектом, азот амидино-группы (=NН) соединения формулы I протонирован (=NH2 +) с образованием соли.
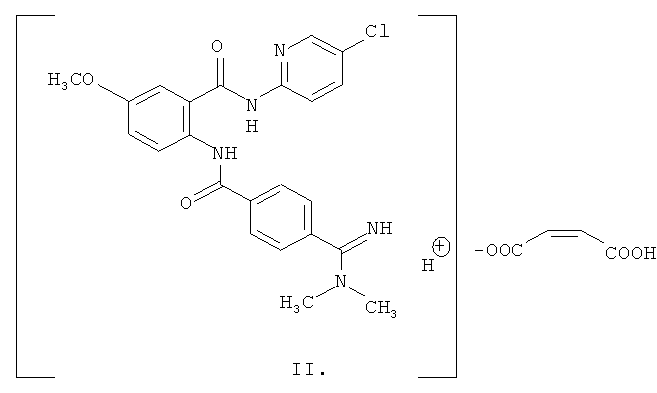
В соответствии с одним предпочтительным аспектом, малеат соединения формулы I может быть представлен структурной формулой II:
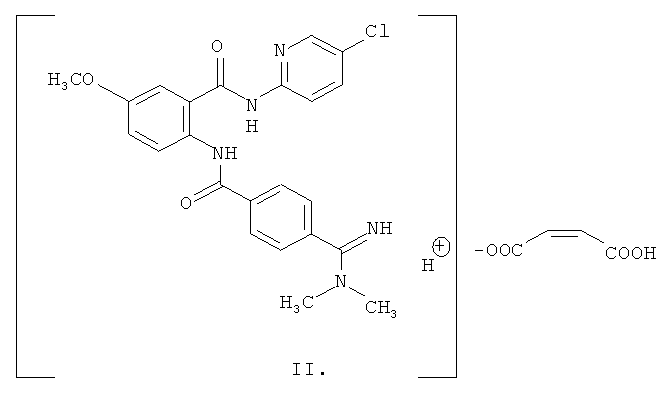
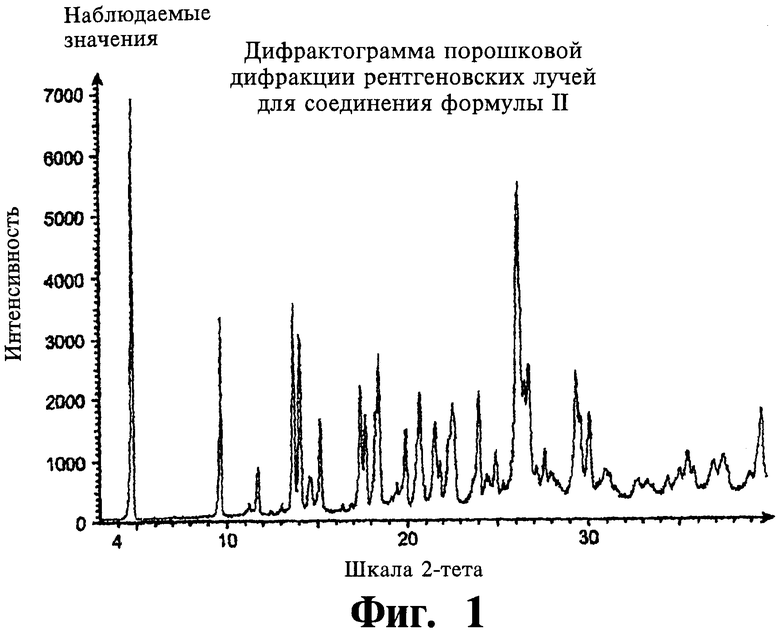
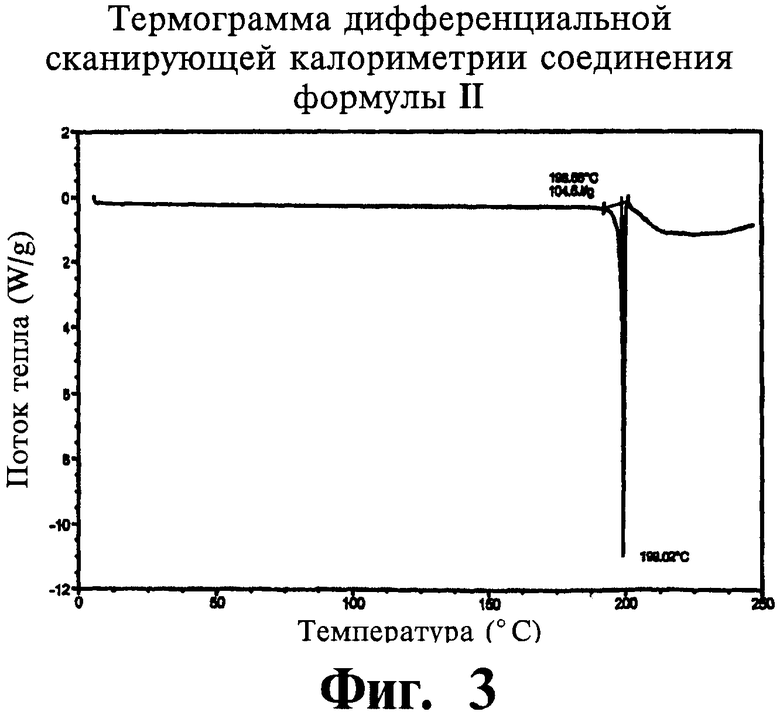
В соответствии с другим аспектом настоящее изобретение относится к соли формулы II, имеющей кристаллическую полиморфную форму. В соответствии с предпочтительными аспектами, кристаллическая полиморфная форма демонстрирует картину порошковой дифракции рентгеновских лучей излучения СuКα1, включающую, по меньшей мере, четыре, а предпочтительно, восемь характеристических пиков при следующих приблизительных значениях угла рассеяния 2θ (градусы): 4,9, 9,7, 13,8, 14,1, 15,2, 17,6, 18,5, 20,8, 21,6, 22,7, 24,1, 26,3, 26,8. В соответствии с еще одним аспектом картина порошковой дифракции рентгеновских лучей излучения СuКα1 содержит характеристические пики при следующих значениях угла рассеяния 2θ (градусы): 4,9, 9,7, 11,8, 13,8, 14,1, 15,2, 17,6, 18,5, 19,9, 20,8, 21,6, 22,7, 24,1, 25,0, 26,3, 26,8. Предполагается, что положения характеристических пиков могут меняться вплоть до ±0,2 градусов угла рассеяния 2.θ. В соответствии с еще одним аспектом, дифрактограмма порошковой дифракции рентгеновских лучей приблизительно соответствует той, что показана на фигуре 1. В соответствии с другими аспектами, настоящее изобретение относится к соли формулы II, содержащей кристаллическую полиморфную форму, термограмма дифференциальной сканирующей калориметрии которой приблизительно соответствует той, что показана на фигуре 3. Этот кристаллический полиморф соли формулы II позволяет получить воспроизводимую форму данного соединения, подходящую для клинических исследований.
В соответствии с другим аспектом настоящее изобретение относится к фармацевтической композиции для профилактики или лечения состояний у млекопитающих, характеризующихся нежелательным тромбозом, включающей фармацевтически приемлемый носитель и терапевтически эффективное количество соли, содержащей соединение формулы I, малеат соединения формулы I, соль формулы II или соль формулы II, характеризующуюся кристаллической полиморфной формой. В соответствии с другим аспектом фармацевтическая композиция находится в форме таблетки. В соответствии с еще одним аспектом фармацевтическая композиция находится в форме капсулы. В соответствии с еще одним аспектом фармацевтическая композиция находится в форме лепешек. В соответствии с другими аспектами фармацевтическая композиция находится в форме, подходящей для инфузии, инъекции или трансдермального введения.
В соответствии с другими аспектами настоящее изобретение относится к способу профилактики или лечения состояний у млекопитающих, характеризующихся нежелательным тромбозом, включающему введение млекопитающему терапевтически эффективного количества соли, содержащей соединение формулы I, малеат соединения формулы I, соль формулы II или соль формулы II, характеризующуюся кристаллической полиморфной формой. В соответствии с еще одним аспектом состояние выбрано из группы, состоящей из острого коронарного синдрома, инфаркта сердечной мышцы, нестабильной и рефракторной ангины, окклюзивного коронарного тромбоза, включающего пост-тромболитическую терапию или пост-коронарную ангиопластику, опосредуемого тромболизом цереброваскулярного синдрома, эмболического и тромболитического инсульта, временных приступов ишемии, венозного тромбоза, глубокого венозного тромбоза, легочной эмболии, коагулопатии, диссеминированной внутрисосудистой коагуляции, тромболитической тромбоцитопенической пурпуры, облитерирующего тромбоангиита, тромболитического заболевания, связанного с индуцированной гепарином тромбоцитопенией, тромболитических осложнений, связанных с экстракорпоральным кровообращением, тромболитических осложнений, связанных с хирургической операцией, и тромболитических осложнений, связанных с установкой протезных устройств.
В соответствии с еще одним аспектом настоящее изобретение относится к способу ингибирования коагуляции образца крови, включающему этап приведения образца в контакт с солью, содержащей соединение формулы I, малеат соединения формулы I, соль формулы II или соль формулы II, характеризующуюся кристаллической полиморфной формой.
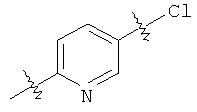
В соответствии с еще одним аспектом настоящее изобретение относится к способу получения соединения формулы I, включающему взаимодействие LiN(СН3)2 с соединением формулы III:
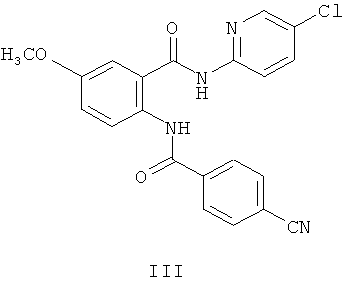
или солью этого соединения в условиях, ведущих к образованию соединения формулы I.
В соответствии с некоторыми аспектами условия представляют собой условия нуклеофильного присоединения и предусматривают применение неполярного, апротонного растворителя. В соответствии с некоторыми другими аспектами растворитель выбирают из группы, состоящей из тетрагидрофурана, диэтилового эфира, диметоксиметана, диоксана, гексана, метил трет-бутилового эфира, гептана и циклогексана. В соответствии с некоторыми аспектами, соль соединения формулы III представляет собой соль НСl.
В соответствии с некоторыми аспектами настоящее изобретение относится к способу приготовления соединения формулы I, где способ предполагает проведение требуемых реакций при температуре ниже 10°С.
В соответствии с еще одним аспектом настоящее изобретение относится к способу получения соединения формулы I, где соединение этой формулы получают с выходом по меньшей мере 50%. В соответствии с другим аспектом соединение формулы I получают с выходом по меньшей мере 65%. В соответствии с еще одним аспектом соединение формулы I получают с выходом по меньшей мере 75%.
В соответствии с еще одним аспектом настоящее изобретение относится к способу получения соединения формулы 1 в масштабах граммов или килограммов.
Краткое описание чертежей
На фигуре 1 показана наблюдаемая дифрактограмма порошковой дифракции рентгеновских лучей (ПДРЛ) для формы формулы II (соль малеата).
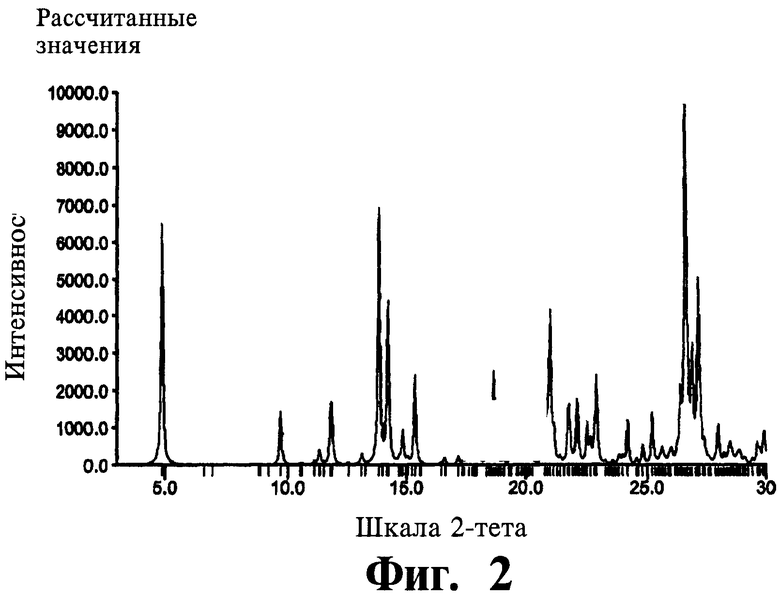
На фигуре 2 представлена рассчитанная теоретически дифрактограмма порошковой дифракции рентгеновских лучей (ПДРЛ) для формы формулы II (соль малеата).
На фигуре 3 показана термограмма дифференциальной сканирующей калориметрии (ДСК) для соли малеата формулы II.
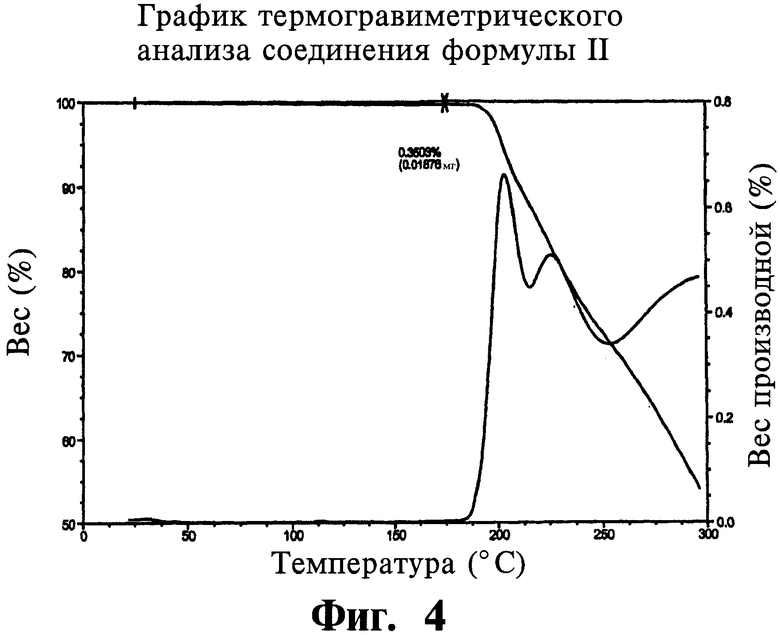
На фигуре 4 показан график термогравиметрического анализа (ТГА) соли малеата формулы II.
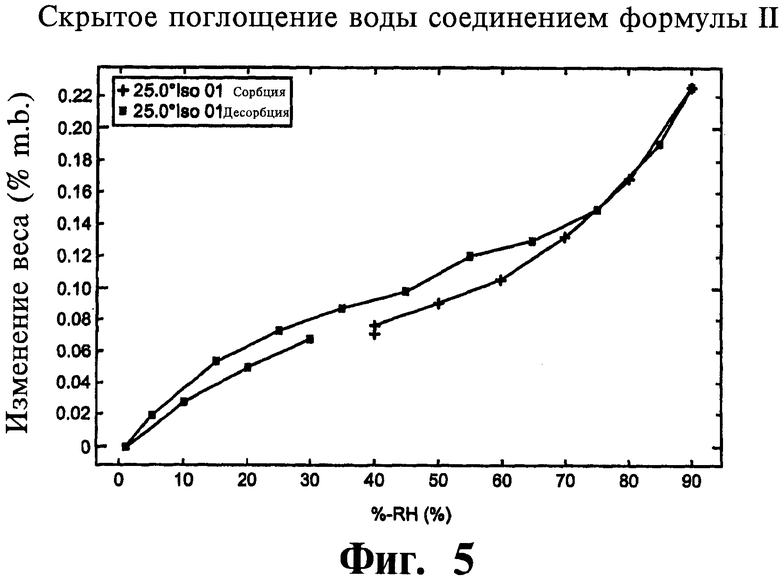
На фигуре 5 показан график гравиметрической сорбции паров (ГСП) воды соли малеата формулы II.
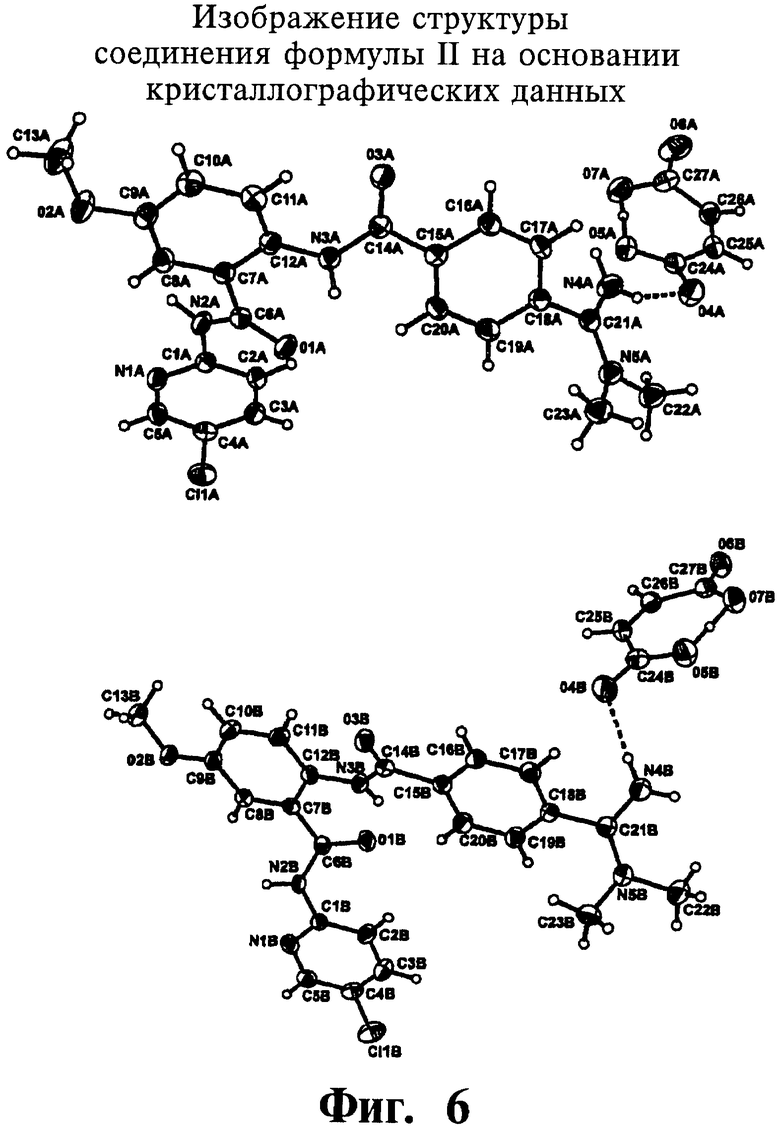
На фигуре 6 показаны два изображения структуры молекулы соли малеата формулы II, полученные на основании полученных кристаллографических данных и показывающие схему нумерации атомов. Эллипсоиды анизотропного замещения не-водородных атомов показаны с уровнем вероятности 50%. Атомы водорода показаны в виде сфер произвольного малого радиуса.
Осуществление изобретения
Как рассматривается в патенте США №6376515 В2, соединение формулы I представляет собой мощный ингибитор фактора Ха. Однако оно не обладает оптимальной растворимостью или упорядоченностью структуры.
Обнаружено, что полученный ацетат соединения формулы I характеризуется хорошей упорядоченностью структуры, но не отличается нужной термической и гидролитической стабильностью. К своему удивлению, авторы неожиданно обнаружили, что некоторые соли отличаются хорошей упорядоченностью структуры, а также термической и гидролитической стабильностью, включая, например, соль соляной кислоты, лактат, малеат, феноксиацетат, пропионат, сукцинат, адипат, аскорбат, камфорат, глюконат, фосфат, тартрат, цитрат, мезилат, фумарат, гликолат, нафталин-1,5-дисульфонат, гентизат и бензолсульфонат.
В частности, соль малеата формулы II демонстрирует превосходную упорядоченность структуры, термическую и гидролитическую стабильность и чистоту. Соль малеата формулы II настоящего изобретения полезна для лечения нежелательного тромбоза у млекопитающих.
I. Определения
Термин "полиморф" в настоящей заявке означает кристаллическую форму вещества, которая отличается от другой кристаллической формы, но обладает такой же химической формулой.
Термин "лечение" означает любое лечение заболевания или расстройства у субъекта, такого как млекопитающее, включающее:
- профилактику или защиту от заболевания или расстройства, то есть недопущение развития клинических симптомов;
- ингибирование заболевания или расстройства, то есть остановку или подавление клинических симптомов; а также
- облегчение заболевания или расстройства, то есть регрессию клинических симптомов.
Термин "профилактика" в настоящей заявке означает профилактическое лечение нуждающегося в этом пациента. Профилактическое лечение можно проводить, вводя соответствующую дозу терапевтического агента субъекту, у которого может развиться заболевание, тем самым в значительной степени не допуская развитие заболевания.
Специалисты в области медицины понимают, что не всегда возможно провести границу между понятиями "профилактика" и "подавление", так как самое первое событие болезни может быть неизвестно, латентно, или пациент не уверен до четкого проявления события или событий. Таким образом, термин "лечение" охватывает понятие "профилактика", и включает как предотвращение, так и подавление болезни в описанном здесь смысле. Термин "защита" здесь включает понятие "профилактика".
Термин "терапевтически эффективное количество" означает такое количество соли настоящего изобретения, обычно, вводимой в виде фармацевтической композиции, которой достаточно, чтобы повлиять на лечение (в описанном здесь смысле) при введении нуждающемуся в этом пациенту. Терапевтически эффективное количество зависит от субъекта и заболевания, возраста и веса субъекта, тяжести заболевания, конкретного выбранного соединения, режима дозировки, времени введения, способа введения и т.д., компетентный специалист легко может определить все эти факторы.
Термин "состояние" в настоящей заявке означает болезненное состояние, против которого применяются соединения, соли, композиции и способы настоящего изобретения.
Термин "образец крови" в настоящей заявке означает всю кровь, взятую у субъекта, или любую ее фракцию, включая плазму или сыворотку.
II. Полиморфные соединения
Один аспект настоящего изобретения представляет собой соль, содержащую соединение формулы I. Специалист понимает, что в настоящем изобретении могут быть использованы и другие соли свободного основания формулы I. Эти другие соли можно получить с использованием неорганических и органических кислот, обеспечивающих необходимую термическую и гидролитическую стабильность, включая, но не ограничиваясь, соляную, молочную, малеиновую, феноксиуксусную, пропионовую, янтарную, адипиновую, аскорбиновую, камфорную, глюконовую, фосфорную, винную, лимонную, метансульфоновую, фумаровую, гликолевую,
нафталин- 1,5-дисульфоновую, гентизиновую и бензолсульфоновую кислоты. В соответствии с одним аспектом малеат соединения формулы II можно представить следующим образом:

Соли настоящего изобретения, такие как соль формулы II, могут принимать несколько различных кристаллических форм. Способность соединения принимать одну из нескольких кристаллических форм называется полиморфизмом. Кристаллический полиморф данного соединения химически идентичен любому другому кристаллическому полиморфу этого соединения, так как он содержит те же самые атомы, связанные друг с другом тем же способом, но он отличается по своей кристаллической форме. Различные кристаллические формы одного соединения могут влиять на одно или несколько физических свойств, таких как стабильность, растворимость, температура плавления, объемная плотность, свойства текучести, биодоступность и т.д.
Полиморфы можно охарактеризовать кристаллической структурой (дифрактограмма дифракции рентгеновских лучей), термическими свойствами (определяемыми с помощью ДСК и ТГА), стабильностью, растворимостью и т.д. Картину дифракции рентгеновских лучей выражают в виде характеристических пиков с точностью ±0,2 градуса угла рассеяния 2θ. Дифрактограмма дифракции рентгеновских лучей одного из полиморфов соли формулы II показана на фигурах 1 и 2, данные ДСК/ТГА показаны на фигурах 3 и 4, а данные поглощения воды - на фигуре 5. Полиморф может быть охарактеризован любым сочетанием двух или всех этих свойств. Специалист понимает, что другие полиморфы соли формулы II также полезны для настоящего изобретения.
III. Фармацевтические композиции
Фармацевтические композиции настоящего изобретения могут использоваться для профилактики или лечения субъекта, страдающего от состояния, характеризующегося нежелательным тромбозом. Фармацевтические композиции настоящего изобретения состоят из фармацевтически приемлемого носителя и терапевтически приемлемого количества соли, включая соединение формулы I, малеат соединения формулы I, соль формулы II или соль формулы II, обладающую кристаллической полиморфной формой.
А. Фармацевтически приемлемые носители
В диагностических применениях солей настоящего изобретения, как правило, используются такие составы, как растворы или суспензии.
При работе с тромботическими заболеваниями соли настоящего изобретения могут применяться в виде таблеток, капсул, лепешек или эликсиров для орального применения, а также в виде суппозиториев, стерильных растворов или супензий для инъекций и т.д., а могут входить в состав объектов конкретной формы. Нуждающимся пациентам (как правило, млекопитающим) можно вводить такие дозы соединений изобретения, которые обеспечивают оптимальную эффективность. Доза и способ введения зависит от субъекта, в том числе от таких факторов, как вид млекопитающего, его пол, вес, режим питания, параллельное лечение, общее клиническое состояние, конкретные используемые соли, конкретное применение этих солей, а также другие факторы, которые сможет определить специалист.
Капсулы, полезные для целей настоящего изобретения, можно изготовить с помощью традиционных и известных методов инкапсулирования, таких как описаны в патенте США №5735105 (Stroud et al.). Как правило, капсула представляет собой полую оболочку, обычно, цилиндрической формы, диаметр и длина которой достаточны для раствора фармацевтической композиции с подходящей дозой активного агента. Капсула может содержать пластификатор, воду, желатин, модифицированные крахмалы, камеди, каррагенаны и их смеси. Компетентный специалист сможет выбрать подходящую композицию.
Кроме активного агента, таблетки, полезные для настоящего изобретения, могут содержать наполнители, связующие компоненты, уплотнители, лубриканты, дезинтегранты, красители, воду, тальк и другие элементы, которые легко может определить специалист. Таблетки могут быть гомогенными и содержать в ядре один слой, либо содержать несколько слоев, что позволит реализовать предпочтительные профили высвобождения. Иногда таблетки настоящего изобретения могут содержать покрытие, например энтеральное покрытие. Компетентный специалист понимает, что для таблеток изобретения могут использоваться и другие наполнители.
Лепешки настоящего изобретения включают соответствующее количество активного агента, а также любые наполнители, связующие составы, дезинтегранты, растворители, солюбилизирующие агенты, подсластители, вкусовые добавки и любые другие ингредиенты, которые при необходимости сможет определить компетентный специалист. Лепешки настоящего изобретения разработаны так, чтобы они растворялись и высвобождали активный компонент, находясь во рту пациента. Специалист понимает, что для настоящего изобретения будут полезны и другие методы введения.
Для приготовления рецептур солей настоящего изобретения с целью их хранения или введения соль нужной степени чистоты смешивают с физиологически приемлемыми носителями, наполнителями, стабилизаторыми и т.д. Можно приготовить состав замедленного высвобождения или высвобождения в заданный момент времени. Приемлемые носители или разбавители для терапевтического использования хорошо известны в фармацевтике и описаны, например, в руководстве Remington′s Pharmaceutical Sciences, Mack Publishing Co., (A.R.Gennaro Ed. 1985). Такие вещества должны быть нетоксичны реципиентам в используемых дозировках и концентрациях; они включают: буферы, такие как фосфат, цитрат, ацетат и другие соли органических кислот; антиоксиданты, такие как аскорбиновая кислота; низкомолекулярные пептиды (менее десяти остатков), такие как полиаргинин; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутаминовая кислота, аспарагиновая кислота или аргинин; моносахариды, дисахариды и другие углеводы, включая целлюлозу и ее производные, глюкозу, маннозу и декстрины; хелатирующие агенты, такие как ЭДТА; спиртосахара, такие как маннит или сорбит; противоионы, такие как ион натрия, и/или неионные поверхностно-активные вещества, такие как Твин, Плюроник или полиэтиленгликоль.
Дозируемые составы солей настоящего изобретения, используемых для терапевтического применения, должны быть стерильны. Стерильности легко можно добиться фильтрованием через стерильные мембраны, например, с размером пор 0,2 мкм, или другими традиционными способами. Как правило, составы хранят в лиофилизированной форме или в виде водного раствора. рН составов настоящего изобретения, как правило, колеблется от 3 до 11, более предпочтительно, от 5 до 9, и наиболее предпочтительно, от 7 до 8. Необходимо понимать, что применение некоторых из описанных наполнителей, носителей или стабилизаторов приводит к образованию циклических полипептидных солей. Хотя предпочтительно осуществлять введение инъекцией, подходят и другие способы, такие как внутривенное (болюсное или инфузией), подкожное, внутримышечное, колоникальное, ректальное, назальное или внутрибрюшинное, при этом используется большое количество форм, например суппозитории, имплантируемые капсулы (пеллеты) или маленькие цилиндры, аэрозоли, составы для орального введения (такие как таблетки, капсулы или капсулы под язык) и для местного введения, например мази, капли и кожные пластыри. Стерильные препараты настоящего изобретения желательно заключать в оболочки, например импланты, в которых могут использоваться инертные материалы, такие как биодеградируемые полимеры или синтетические силиконы, например силастик (Silastic), силиконовая резина или другие коммерчески доступные полимеры.
Соли настоящего изобретения можно также вводить в форме системы доставки липосом, таких как маленькие униламелярные везикулы, большие униламелярные везикулы и мультиламелярные везикулы. Липосомы можно приготовить с использованием большого количества липидов, таких как холестерин, стеариламин или фосфатидилхолины.
Соли настоящего изобретения могут доставляться также с помощью антител, фрагментов антител, факторов роста, гормонов или других нацеливающих групп, с которыми молекула соли может быть конъюгирована. Соли настоящего изобретения могут быть также конъюгированы с подходящими полимерами, если последние могут выступать в роли носителей лекарств. Подобные полимеры могут включать поливинилпирролидон, пирановый сополимер, полигидрокси-пропил-метакриламид-фенол, полигидрокси-этил-аспартамид-фенол или полиэтиленоксид-полилизин, замещенный остатками пальмитоила. Более того, соли изобретения могут быть конъюгированы с классом биодеградируемых полимеров, полезных для обеспечения контролируемого высвобождения лекарства, например с полимолочной кислотой, полигликолевой кислотой, сополимерами полимолочной и полигликолевой кислот, полиэпсилон капролактоном, полигидрокси масляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами, а также могут быть конъюгированы с классом амфипатических блок-сополимеров гидрогелей. Полимеры и полупроницаемые полимерные матрицы можно приготовить в виде формованных изделий, таких как клапаны, стенты, пробирки, протезы и т.п.
В. Дозы
Как правило, приблизительно, от 0,5 до 500 мг соли или смеси солей настоящего изобретения смешивают с физиологически приемлемым носителем, наполнителем, связующим составом, консервантом, стабилизатором, красителем, вкусовыми добавками и т.д., соответствующие способы известны в фармацевтике. Количество активного ингредиента в этих композициях позволяет получить подходящую дозировку в указанном диапазоне.
Предполагается, что типичная доза колеблется в диапазоне, приблизительно, от 0,001 мг/кг до 1000 мг/кг, предпочтительно, приблизительно, от 0,01 мг/кг до 100 мг/кг, и еще более предпочтительно, приблизительно, от 0,10 мг/кг до 20 мг/кг. Соединения настоящего изобретения можно вводить один или несколько раз в день; также могут использоваться и другие режимы дозировки.
IV. Способы
А. Профилактика и лечение болезненных состояний, характеризующихся нежелательным тромбозом
Соль настоящего изобретения можно использовать для профилактики или лечения состояния у млекопитающих, характеризующегося нежелательным тромбозом, путем введения млекопитающему терапевтически эффективного количества соли соединения формулы I, малеата соли соединения формулы I, соли формулы II или соли формулы II в кристаллической полиморфной форме. Соли можно использовать либо самостоятельно, либо совместно с фармацевтически приемлемыми наполнителями, что позволит предотвратить наступление заболевания, характеризующегося нежелательным тромбозом. Профилактическое лечение пациента, рискующего заболеть, характеризуется дополнительными преимуществами, поскольку при этом впоследствии снижается медицинское лечение и связанные с ним умственные и физические нагрузки, а также денежные затраты на продолжительное лечение пациента. Для пациентов, состояние которых не удается определить настолько рано, чтобы предотвратить начало болезни, соль настоящего изобретения может использоваться самостоятельно или совместно с фармацевтически приемлемыми наполнителями для лечения состояния.
Предпочтительные соли настоящего изобретения характеризуются по своей способности ингибировать образование тромбов, оказывая приемлемые эффекты на классические характеристики параметров коагуляции, образование и функцию тромбоцитов, причем связанные с их использованием побочные кровотечения не выходят за приемлемые пределы, и они демонстрируют приемлемую стабильность. Состояния, характеризующиеся нежелательным тромбозом, включают вовлекающие артериальные и венозные кровеносные сосуды.
По отношению к сосудам коронарной артерии ненормальное образование тромбов характеризуется появлением атеросклеротических бляшек, которые являются основной причиной острого инфаркта миокарда и нестабильной ангины, а в результате тромболитической терапии или транслюминальной коронарной ангиопластики могут образовываться окклюзивные коронарные тромбы.
По отношению к венозным сосудам ненормальное образование тромбов характеризует состояние, встречающееся у пациентов, перенесших крупную операцию на нижних конечностях или брюшной полости и часто страдающих образованием тромбов в венах, что приводит к уменьшению кровотока в поврежденной конечности и предрасположенности к легочной эмболии. Ненормальное образование тромбов характеризует также диссеминированную внутрисосудистую коагулопатию, часто наблюдаемую в обеих сосудистых системах при септическом шоке, некоторых вирусных инфекциях и раке, при этом состоянии наблюдается быстрое выделение факторов коагуляции и системная коагуляция, приводящая к образованию угрожающих жизни тромбов в микрососудах, что, в свою очередь, приводит к обширному поражению органов.
Полагают, что соли настоящего изобретения, отобранные и используемые как описано в настоящей заявке, полезны для профилактики и лечения заболеваний, характеризующихся нежелательным тромбозом, таких как (а) лечение любого острого опосредуемого тромбозом коронарного синдрома, включая инфаркт миокарда, нестабильную ангину, рефрактерную ангину, окклюзивный коронарный тромбоз, возникающих в результате пост-тромболитической терапии или пост-коронарной ангиопластики, (b) лечение любого опосредуемого тромбозом цереброваскулярного синдрома, включая эмболический инсульт, тромботический инсульт или приступы ишемии, (с) лечение любого тромботического синдрома в венозной системе, включая глубокий венозный тромбоз или легочную эмболию, возникающую спонтанно или в результате злокачественной опухоли, хирургии или травмы, (d) лечение любой коагулопатии, включая диссеминированную внутрисосудистую коагуляцию (включая вызванную септическим шоком или другой инфекцией, хирургией, беременностью, травмой или злокачественной опухолью и связанную или не связанную с недостаточностью в работе органов), тромботическую тромбоцитопеническую пурпуру, облитерирующий тромбоангиит, а также тромботические заболевания, связанные с индуцированной гепарином тромбоцитопенией, (е) лечение тромботических осложнений, связанных с экстракорпоральным кровообращением (например, почечный диализ, сердечные, легочные нарушения или другие процедуры оксигенирования и плазмафореза), (f) лечение тромботических осложнений после хирургии (например, сердечной или другой внутрисосудистой катетеризации, баллонирования внутри аорты, введение коронарных шунтов или сердечных клапанов) и (g) проблемы, связанные с установкой протезов.
Соответственно, способ лечения состояний у млекопитающих, характеризующихся нежелательным тромбозом, включает введение млекопитающему терапевтически эффективного количества соли настоящего изобретения. Заболевания, которые можно лечить солями настоящего изобретения, включают, но не ограничиваются, острый коронарный синдром, инфаркт миокарда, нестабильную ангину, рефракторную ангину, окклюзивные коронарные тромбы, включая пост-тромболитическую терапию или пост-коронарную ангиопластику, тромболитически опосредуемый цереброваскулярный синдром, эмболический инсульт, тромботический инсульт, приступы ишемии, венозный тромбоз, глубокий венозный тромбоз, легочную эмболию, коагулопатию, диссеминированную внутрисосудистую коагуляцию, тромботическую тромбоцитопеническую пурпуру, облитерирующий тромбоангиит, тромботические заболевания, связанные с индуцированной гепарином тромбоцитопенией, тромботические осложнения, связанные с экстракорпоральным кровообращением, тромботические осложнения, связанные с хирургическими операциями, тромботические осложнения, связанные с установкой протезных устройств, окклюзивное коронарное образование тромбов, вызванное тромболитической терапией или транслюминальной коронарной ангиопластией, образование тромбов в венах, диссеминированную внутрисосудистую коагулопатию, при которой наблюдается быстрое поглощение факторов коагуляции и системная коагуляция, приводящая к образованию угрожающих жизни тромбов в микрососудах, что, в свою очередь, приводит к обширному поражению органов, геморрагический инсульт, почечный диализ, оксигенирование крови и катетеризацию сердца.
Соль малеата соединения формулы I или соль формулы II можно также использовать, если требуется осуществить ингибирование коагуляции крови, например, чтобы не допустить коагуляцию цельной крови при ее хранении или чтобы не допустить коагуляции других биологических образцов для тестирования или хранения. Таким образом, ингибиторы коагуляции настоящего изобретения можно добавить или привести в контакт с цельной кровью при ее хранении, либо к другой среде, содержащей или предположительно содержащей факторы коагуляции плазмы, если желательно заингибировать коагуляцию крови, например, при взаимодействии крови млекопитающих с материалами, выбранными из группы, состоящей из заменителей сосудов, шунтов, ортопедических протезов и экстракорпоральных систем кровообращения.
Помимо лечения людей, эти соли могут использоваться также в ветеринарии для лечения животных компаньонов, экзотических животных и животных на фермах, включая млекопитающих, грызунов и подобных им. Более предпочтительные животные включают лошадей, собак и кошек.
В. Введение
Терапевтические жидкие составы, обычно, помещают в контейнер со стерильным портом доступа, например емкость с внутривенным раствором или сосуд с пробкой, которую можно проткнуть гиподермической иглой для инъекций.
Терапевтически эффективные дозы можно определить способами in vitro или in vivo. Для каждой конкретной соли настоящего изобретения можно провести отдельные исследования, чтобы определить оптимальную дозу. На диапазон терапевтически эффективных доз влияет путь введения, терапевтические цели и состояние пациента. В случае инъекции гиподермической иглой препарат вводят в жидкости тела. В случае других путей введения эффективность абсорбции определяют индивидуально для каждого соединения способами, хорошо известными в фармакологии. Соответственно, врач может оттитровать дозу или изменить путь введения, чтобы получить оптимальный терапевтический эффект. Специалист легко сможет определить эффективную дозу, то есть дозу, необходимую для достижения желаемого результата. Как правило, соли начинают вводить с небольших дозах, и затем дозы постепенно увеличивают до достижения желаемого эффекта.
Типичными вспомогательными веществами, которые можно включать в таблетки, капсулы, лепешки и подобные им, представляют собой такие связующие составы, как гуммиарабик, кукурузный крахмал или желатин, и наполнители, такие как микрокристалическая целлюлоза, дезинтегрирующие агенты, как кукурузный крахмал или альгиновая кислота, лубриканты, такие как стеарат магния, подсластители, например сахароза или лактоза, а также красители. Если дозированная форма представляет собой капсулу, то, помимо упомянутых выше веществ, она может содержать еще жидкие носители, например воду, физиологический раствор или жирные масла. Другие вещества различных типов можно использовать в качестве покрытий или модификаторов физической формы единиц дозировки. В соответствии с распространенными способами фармацевтической практики можно приготовить стерильные композиции для инъекций. Например, возможно приготовление растворов или суспензий активного соединения в таком носителе, как масло или синтетический жир, например этил олеат, или в липосомах. Буферы, консерванты, антиоксиданты и подобные им можно включать в соответствии с принятыми методами фармацевтической практики.
С. Комбинированная терапия
Соли настоящего изобретения можно также использовать совместно с другими терапевтическими или диагностическими агентами. В соответствии с некоторыми предпочтительными аспектами, соли этого изобретения можно вводить совместно с другими соединениями, обычно, прописываемыми при этих состояниях в соответствии с общепринятой медицинской практикой, такими как антикоагулянты, тромболитические агенты или другие антитромботики, включая ингибиторы агрегации тромбоцитов, активаторы плазминогена тканей, урокиназу, проурокиназу, стрептокиназу, гепарин, аспирин или варфарин. Соли настоящего изобретения могут проявлять синергизм с ними, не допуская начала реокклюзии после успешной тромболитической терапии и/или снижая время реперфузии. Эти соли могут также позволить понизить дозу используемых тромболитических агентов и, тем самым, уменьшить потенциальные геморрагические побочные эффекты. Соли настоящего изобретения можно использовать in vivo, обычно, для млекопитающих, таких как приматы, люди, лошади, овцы, коровы, свиньи, собаки, кошки, крысы и мыши, а также in vitro.
D. Получение соединений
1. Соли малеата соединения формулы I
Соединение формулы I можно превратить в соли различных неорганических и органических кислот, включая, но не ограничиваясь, соли соляной кислоты, лактаты, малеаты, феноксиацетаты, пропионаты, сукцинаты, адипаты, аскорбаты, камфораты, глюконаты, фосфаты, тартраты, цитраты, мезилаты, фумараты, гликоляты, нафталин-1,5-дисульфонаты, гентизаты и бензол сульфонаты. Специалист понимает, что для приготовления солей соединения формулы I, полезных для настоящего изобретения, можно использовать и другие кислоты. Следует понимать также, что соли настоящего изобретения можно легко преобразовать в другие соли изобретения.
Чтобы определить термическую и гидролитическую стабильность соли, можно выполнить тесты, известные специалистам в соответствующей области. Эти тесты более подробно описаны в приводимом ниже примере 4.
Для приготовления описанных выше солей существует большое количество методов, они хорошо известны специалистам. Например, можно провести реакцию соединения формулы I с одним или больше молярными эквивалентами желаемой кислоты в растворителе или смеси растворителей, в которых полученная соль нерастворима, или в таком растворителе, как вода, с последующим удалением растворителя методом упаривания, дистилляции или лиофильной сушки. Альтернативно, соединение формулы I можно пропустить через ион-обменную смолу с образованием желаемой соли, или одну солевую форму продукта можно превратить в другую с помощью такого же общего процесса.
Соединение формулы I было получено в соответствии с описанной ниже процедурой. Малеат соединения формулы I был выбран благодаря превосходной кристалличности, термической и гидролитической стабильности и высокой чистоте.
2. Формула I
Соединение формулы I может быть получено по одному из нескольких различных способов, либо в масштабах граммов (<1 кг), либо в масштабах килограммов (>1 кг). Граммовый способ описан в примере 2. Еще один граммовый способ описан в патенте США №6844367 В1, см. пример 266, который включен сюда посредством ссылки.
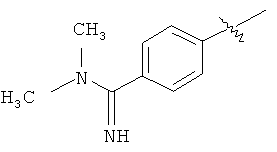
Альтернативно, соединение формулы I может быть получено в масштабах килограммов способом, также описанным в примере 2. Образование диметил амидина формулы I включает нуклеофильную атаку цианогруппы депротонированным амином, причем депротонированный амин образуется из вторичного амина действием алкил лития. Термин "алкил" в настоящей заявке означает углеводородный радикал длиной от 1 до 8 атомов углерода. Специалист понимает, что депротонированный амин можно получить и другими способами, образование амидиновой функциональной группы формулы I также можно осуществить множеством другим способов.
Полезный для способа настоящего изобретения растворитель, описанный здесь, представляет собой неполярный, апротонный растворитель, такой как тетрагидрофуран (ТГФ), диэтиловый эфир, диметоксиметан, диоксан, гексан, метил трет-бутиловый эфир, гептан и циклогексан. Кроме того, образование депротонированного амина можно проводить при температуре ниже 10°С. Нуклеофильное присоединение амина с образованием соединения формулы I также можно проводить при температуре ниже 10°С. Компетентный специалист понимает, что способы настоящего изобретения можно практиковать с использованием различных других растворителей, реагентов и температур реакции.
Соединение формулы I можно получить способами настоящего изобретения с выходом более 50%. В некоторых случаях соединения формулы I можно получить с выходом более 65%. В других случаях соединения формулы I можно получить с выходом более 75%.
Кроме того, хотя способ настоящего изобретения для получения соединения формулы I в граммовом масштабе аналогичен процедуре, используемой для килограммового масштаба, масштаб возрастает более чем на 3400%. В некоторых случаях увеличенные выходы удается получить с использованием уменьшенного количества реагентов, берущихся в избытке. Компетентный специалист понимает, что соединение формулы I можно получить и другими химическими методами как в масштабе граммов, так и килограммов.
V. Примеры
Если не указано иначе, то значение используемых далее спецификаций следующее:
Å = ангстрем
А% = процент от общей площади
aq. = водный (aqueous)
см = сантиметр
d = дублет (doublet)
ДМСО = диметилсульфоксид
ДСК = дифференциальная сканирующая калориметрия
EDTA = этилендиаминтетрауксусная кислота
(ethylenediaminetetraacetic acid)
eq. = equivalent (эквив., эквивалент)
EtOH = этанол
г = грамм
ВЭЖХ = высокоэффективная жидкостная хроматография
ч = час
Гц = Герц
ИК = инфракрасный
J = константа сопряжения (coupling constant)
кг = килограмм
кВ = киловольты
л = литр
LOD = предел детекции (limit of detection)
M = молярная концентрация
m = мультиплет (multiplet)
мА = миллиаптер
Ме = метил
MeO = метокси
МеОН = метанол
мг = миллиграмм
мин = минута
мл = миллилитр
мм = миллиметр
МТБЭ = метиловый трет-бутиловый эфир
Н = нормальная концентрация
нМ = наномолярная концентрация
ЯМР = ядерный магнитный резонанс (nuclear magnetic resonance)
s = синглет (singlet)
TDS = общее количество растворенных твердых веществ (total dissolved solids)
ТГА = термогравиметрический анализ
ТГФ = тетрагидрофуран
мкМ = микромолярная концентрация
Пример 1: Получение кристаллической полиморфной соли соединения со структурной формулой II.
Получение граммовых количеств
В трехгорлую круглодонную колбу объемом 1500 мл, оснащенную холодильником, добавили соединение со структурной формулой I в виде свободного основания (25 г, 1 эквивалент) и при перемешивании добавили смесь ЕtOH/вода (500 мл) с соотношением 9:1. Полученную суспензию нагревали до 70°С. Затем добавляли по каплям малеиновую кислоту (12,77 г, 2 эквивалента) в виде раствора (100 мл смеси ЕtOH/вода с соотношением 9:1). После того, как было добавлено 50 мл, раствор стал заметно прозрачнее. После завершения добавления малеиновой кислоты, смесь выдержали при температуре 80°С 5 минут. После этого смеси дали медленно остыть при 45°С и добавили 400 мл МТБЭ. Раствор перемешивали в течение 12 часов. Полученный осадок отфильтровали и высушили под вакуумом. Соль соединения со структурной формулой II получена с выходом 45% (14,2 г).
Получение килограммовых количеств
В GLMS реактор объемом 760 л (реактор А) добавили соединение со структурной формулой I в виде свободного основания (24,6 кг), затем добавили малеиновую кислоту (12,7 кг, 2,0 эквивалента), ЕtOH (445 кг, 18,1 частей), воду высокой чистоты (140 кг, 5,7 частей). После того, как температура реакционной смеси установилась около 22°С (от 19 до 25°С), ее перемешивали при этой температуре около 1 часа. Затем смесь перенесли через барьерный фильтр в термостатируемый реактор Хастеллоя объемом 780 л (реактор В). Насос реактора А, фильтр и шланги промыли дополнительным количеством этанола (около 45 кг). Фильтрат сконцентрировали в вакууме, приблизительно, до 140 л (5,7 частей объема) при температуре гликолевой рубашки реактора 45°С. ЯМР-анализ показал, что молярное соотношение этанол:формула II составляло 26. В реактор В добавили высокоочищенную воду (49 кг, 2,0 части), и продолжали концентрирование до достижения, приблизительно, 140 л (5,7 частей объема). ЯМР-анализ показал, что молярное соотношение этанол:соль формулы II составляло 14. В реактор В еще раз добавили высокоочищенную воду (49 кг, 2,0 части), и продолжали концентрирование до достижения, приблизительно, 140 л. ЯМР-анализ показал, что молярное соотношение этанол: соль формулы II составляло 5. Содержимое реактора охладили до 22°С (от 19 до 25°С), при этом наблюдали образование суспензии. Реакционную смесь перемешивали при 22°С (от 19 до 25°С), в течение, приблизительно, 2 часов, и профильтровали на 30" центрифуге с мембраной из фильтровальной ткани F-53. Насос реактора В, фильтр и шланги промыли по направлению к 30" центрифуге двумя порциями высокоочищенной воды (около 30 кг каждая). ВЭЖХ-анализ отфильтрованного осадка показал, что его чистота 99,1 А%, наибольшая примесь составляет 0,26 А%, поэтому перекристаллизация не требуется. Отфильтрованный осадок (33,1 кг) сушили в вакууме при максимальной температуре гликолевой рубашки реактора 40°С. Приблизительно, через 30,5 часов, входящий в процесс анализ LOD показал, что содержание растворителя составляло 0%. Сухой продукт выгрузили из реактора в количестве 26,4 кг и хранили при температуре 2-8°С. Выход продукта был даже несколько больше ожидаемого - он составил 85% (ожидаемый выход 50-80%).
Соль формулы II охарактеризовали способами, описанными в примере 4. Дифрактограмма рентгеновской дифракции излучения СuКα1 соли формулы II показана на фигуре 1, их характерные пики расположены, приблизительно, в 4,9, 9,7, 11,8, 13,8, 14,1, 15,2, 17,6, 18,5, 19,9, 20,8, 21,6, 22,7, 24,1, 25,0, 26,3 и 26,8 градусов угла рассеяния 2θ. Температура плавления (между 197 и 201°С) измерена способом дифференциальной сканирующей калориметрии (см. термограмму на фигуре 3). Кроме того, с помощью термогравиметрического анализа (ТГА, см. график на фигуре 4) обнаружено уменьшение веса на 0,62% при температуре 100°С для соли формулы II. Сорбция воды для соли формулы II была обратима, поглощение воды составило от 0,1 до 3% (фигура 5). Чистоту формулы II определили по появлению гидролизованного амидина, что удалось обнаружить с помощью ВЭЖХ, а чистота продукта составляла больше 99%.
1H ЯМР (ДМСО-d6): δ 3,0 (s, 3Н), 3,2 (s, 3H), 3,82 (s, 3H), 7,2 (d, 1H, J=9,0 Гц), 7,42 (s, 1H), 7,68 (d, 1H, J=8,0 Гц), 7,95-8,15 (m, 2H), 8,12 (m). 8,18 (m, 1H), 8,42 (s, 1H), 9,0 (s, 1Н), 11,0 (s, 1Н), 11,2 (s, 1Н); ИК (КВr, см-1): 3300, 1685, 1600, 1515, 1380, 1270, 1200, 1100, 1050, 880, 800, 710.
Пример 2: Получение соединения формулы I
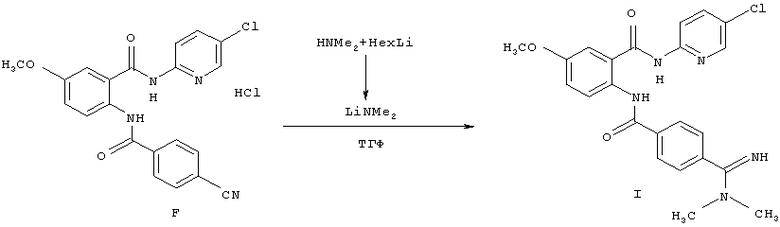
Граммовый масштаб
Взвесь осадка соединения формулы F (455 г, 1,0 эквив.) в ТГФ (4,67 кг, 10,3 частей) приготовили и охладили до температуры <10°С. Диметиламид лития приготовили следующим образом: гексиллитий (2,3 Н/гексан, 2,45 л, 5,5 эквив.) смешали с раствором диметиламина (2 Н/ТГФ, 2,8 л, 5,5 эквив.) при температуре <10°С. Этот раствор смешали со взвесью соединения F, поддерживая температуру <10°С. За ходом реакции непрерывно следили с помощью ВЭЖХ, которая показала, что количество оставшегося соединения F стало <1,0 А%. После этого приготовили буферный раствор NаНСО3 (490 г, 1,1 частей, 5,7 эквив.) и Nа2СО3 (490 г, 1,1 частей, 4,5 эквив.) в деионизированной воде (6,6 кг, 14,51 частей), и описанную выше реакционную смесь перенесли в этот раствор при температуре <5°С. Продукт реакции выпал в осадок, и температуру полученной взвеси довели до 20°С в течение 12 часов. Осадок отфильтровали, осадок на фильтре промыли 3,5 кг (7,7 частей) деионизированной воды. Твердый осадок отфильтровали на грубом фильтре из спекшегося стекла и промыли холодным (0-5°С) абсолютным этанолом (628 г, 1,4 частей). Продукт высушили при 30-35°С. Количество полученного сухого продукта составляло 458 г (выход 73%).
Килограммовый масштаб
Взвесь соединения формулы F (31,5 кг, 1,0 эквив.) в ТГФ (251 кг, 8,0 частей) поместили в реактор Хастеллоя (реактор А, 780 л) и охладили до 0°С (от -3 до 3°С). 2М раствор диметиламина в ТГФ (161,0 кг, 5,0 эквив.) и ТГФ (63 кг, 2 частей) поместили в 1900 л реактор GLMS (реактор В) и охладили до 0°С (от -3 до 3°С) при максимально интенсивном перемешивании. В реактор В медленно ввели гексиллитий (2,3 М, 97,2 кг, 4,5 эквив.), при этом максимальная температура поддерживалась на уровне 10°С. Насос и трубы, ведущие к реактору В, промыли ТГФ (3,2 кг). Содержимое реактора В охладили до 0°С (от -3 до 3°С), после чего перенесли в реактор А при температуре последнего ≤10°С. Насос и трубы, ведущие к реактору В, промыли ТГФ (31,4 кг, 1,0 часть). Содержимое реактора А охладили до 0°С (от -3 до 3°С) и перемешивали при этой температуре до завершения реакции по данным ВЭЖХ (1-2 часа). Приблизительно через час перемешивания ВЭЖХ показала 0 А% исходных материалов (внутренний критерий: макс. 1 А%). Содержимое реактора А охладили до -5°С (от -8 до -3°С). После этого выполнили входящую в процесс очистку реактора В. Два заранее приготовленных водных раствора, первый из которых представляет собой раствор NаНСО3 (35,0 кг, 1,1 частей) в воде (236 кг, 7,5 частей), а второй представляет собой раствор Nа2СО3 (35,0 кг, 1,1 частей) в воде (236 кг, 7,5 частей), поместили в реактор В и охладили до -3°С (от 0 до -6°С). Содержимое реактора А перенесли в реактор В по изолированной линии, поддерживая температуру реактора В на уровне -8°С (максимум 5°С). Насос и трубы реактора А промыли холодным (-5 градусов (от -8 до -3°С)), ТГФ (31,4 кг, 1,0 часть). Содержимое реактора В нагрели до 22°С (от 19 до 25°С) и перемешивали, приблизительно, 3 часа. Образование взвеси подтвердили визуально, и содержимое реактора В профильтровали на центрифугу 30" с фильтровальной тканью F-16. Насос и трубы реактора В промыли на центрифугу 30" с фильтровальной тканью F-16 питьевой водой (63 кг, 2 частей). Сырой осадок на фильтре (66,5 кг) перенесли обратно в реактор В и снова промыли питьевой водой (1005 кг, 32 частей) при 22°С (от 19 до 25°С) в течение, приблизительно, одного часа. Продукт профильтровали на центрифуге 30" (после являющейся частью процесса очистки и установки фильтра F-53), после чего трубы и насос реактора В промыли питьевой водой (63 кг, 2 части). Промывную воду отобрали для исследования TDS, которое составило 0,46%. Насос, трубы и осадок на фильтре реактора В далее промыли холодным (0°С (от -3 до +3°С)) этанолом (44 кг, 1,39 частей). Сырой осадок на фильтре высушили под вакуумом с максимальной температурой водяной бани (или тепловой рубашки реактора) 35°С. После, приблизительно, 24 часов сушки входящий в состав процесса LOD составил 0%, и продукт (24,8 кг) был получен с выходом 76,7%. ВЭЖХ показал 98% чистоту, содержание дехлоринированных примесей составляло 1,14%.
Пример 3: Получение соединения формулы F
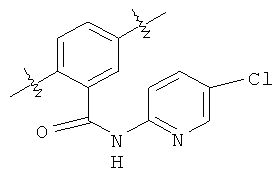
Этап 1. Синтез 2-нитро-N-(5-хлоро-пиридин-2-ил)-5-метокси-бензамида (С)

5-Метокси-2-нитробензойную кислоту (А) (25,0 кг, 1,0 эквив.), 2-амино-5-хлоропиридин (В) (16,3 кг, 1,0 эквив.) и ацетонитрил (87,5 кг, 3,5 частей) поместили в реактор GLMS на 380 л. Температуру реакционной смеси подняли до 22°С (19-25°С), и в систему добавили безводный пиридин (30,0 кг, 3,0 эквив.). Насос и трубы промыли ацетонитрилом (22,5 кг, 0,9 частей), и содержимое реактора нагрели до 19-22°С. В реактор ввели оксихлорид фосфора (23,3 кг, 1,20 эквив.) через метрический насос, поддерживая температуру смеси 25°С (22-28°С). Насос и трубы промыли ацетонитрилом (12,5 кг, 0,5 частей), поддерживая температуру на уровне 25°С (22-28°С).
Обычно, смесь из взвеси твердых частиц становилась раствором после добавления около 1/3 объема РОСl3. В конце добавления она становилась мутной. По завершении добавления смесь перемешивали около 1 часа при температуре 25°С (22-28°С), после чего анализ ВЭЖХ показал завершение реакции. Раствор охладили до 15°С (12-18°С), после чего в реакцию медленно ввели питьевую воду (156,3 кг, 6,25 частей), поддерживая температуру реакционной смеси между 12 и 30°С. Температуру реакции довели до 22°С (19-25°С), и смесь перемешивали еще около 5 часов, пока не прекратилось выделение теплоты. Образование суспензии подтвердили визуально, после чего содержимое реактора профильтровали через вакуумную воронку с фильтром F-19. Реактор, насос и трубы промыли питьевой водой, вылив ее на вакуумную воронку. Воду подавали двумя порциями (62,5 кг, 2,5 частей каждая). рН фильтрата составил 7. Продукт (41,8 кг) высушили под вакуумом с максимальной температурой водяной бани (или тепловой оболочки реактора) 50°С. Приблизительно, через 12 часов входящий в состав процесса анализ LOD показал содержание растворителя на уровне 0,72%. Количество сухого продукта (С) было 34,4 кг, выход составил 88,2%, по данным ВЭЖХ чистота продукта была 99,1%.
Этап 2. Синтез
2-амино-N-(5-хлоро-пиридин-2-ил)-5-метокси-бензамида (D)
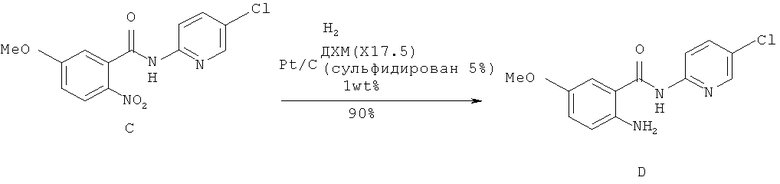
В реактор Хастеллоя емкостью 780 л поместили соединение С (33 кг, 1,0 эквив.), 5% платины на углероде (сульфидированного, 0,33 кг, 0,010 частей) и дихлорометан (578 кг, 17,5 частей). Начали перемешивание, и температуру реактора довели до 22°С (19-25°С). В реакторе создали давление около 30 psi водорода, и смесь постепенно нагрели до 28°С (25-31°С). Гидрирование содержимого реактора проводили под давлением, приблизительно, 30 psi при 28°С (25-31°С, максимальная температура 31°С) до завершения реакции по данным ВЭЖХ. Через 16,5 часов реакция была признана завершенной, так как было подтверждено исчезновение исходного вещества (0,472 А%). Содержимое реактора пропускали через подготовленную прослойку из целита (0,2-0,5 кг целита, подготовленную с помощью 20-55 кг дихлорометана), помещенную в 8" фильтр типа sparkler, с целью удаления платинового катализатора. Реактор и целитную прослойку промыли двумя порциями дихлорометана (83 кг, 2,5 частей каждая). Фильтрат перенесли в реактор GLMS объемом 570 л и сконцентрировали под атмосферным давлением, приблизительно, до 132 л (4 объемные части). В реактор поместили этанол (69 кг, 2,1 части), и продолжали концентрирование под атмосферным давлением, приблизительно, до 99 л (3 объемные части). По данным включенного в процесс спектра ЯМР, содержимое дихлорометана было 5%. Температуру смеси довели до 3°С (0-6°С), перемешивали 1 час, и полученный осадок профильтровали через вакуумную воронку с оболочкой и с фильтром F-19. Реактор, насос и трубы промыли холодным (3°С (0-6°С)) этанолом (26 кг, 0,8 частей). Влажный осадок на фильтре (36,6 кг) высушили под вакуумом при 40-50°С с максимальной температурой водяной бани (или тепловой рубашки реактора) 50°С. Анализ LOD через 12,5 часов показал, что содержание растворителя составляло около 0,1%. Сухой продукт (D) в количестве 26,4 кг был получен с выходом 89,5%. ВЭЖХ показала чистоту 98,4 А%, содержание дехлоринированных примесей составило 0,083%.
Этап 3. Синтез
N-(5-хлоро-пиридин-2-ил)-2-(4-циано-бензоил-амино)-5-метокси-бензамид гидрохлорида (F)
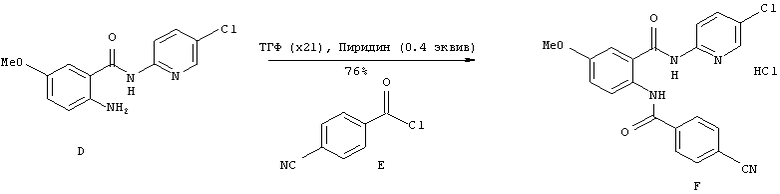
В реактор Хастеллояна 780 л поместили 4-цианобензоил хлорид (Е) (17,2 кг, 1,1 эквив.) и ТГФ (92 кг, 3,5 частей). Содержимое реактора перемешивали при 22°С (19-25°С), пока твердый осадок не растворился. Полученный раствор перенесли в нижний приемник, и реактор промыли ТГФ (26 кг, 1 часть). В чистый реактор ввели соединение D (26,4 кг, 1 эквив.), ТГФ (396 кг, 15 частей) и пиридин (2,90 кг, 0,4 эквив.). Насос и трубы промыли ТГФ (34 кг, 1,3 часть). Через метрический насос в реактор ввели 4-цианобензоил хлорид/ТГФ, поддерживая температуру меньше ≤30°С, и промыли систему ТГФ (около 10 кг). Полученную желтую взвесь перемешивали два часа при 22°С (19-25°С). Поданным входящего в процесс анализа ВЭЖХ через 2 часа содержание соединения формулы D составило 0%, что означало полное завершение реакции. Осадок профильтровали через вакуумную воронку с фильтром F-19. Реактор, насос, трубы и осадок промыли тремя порциями этанола (около 15 кг каждая). Осадок (65,4 кг) вынули и снова поместили в реактор, чтобы промыть его этанолом (317 кг, 12 частей) при 22°С (19-25°С) в течение, приблизительно, одного часа. После этого осадок выгрузили на вакуумную воронку, и промыли его, реактор, насос и трубы двумя порциями этанола (около 15 кг каждая) и двумя порциями ТГФ (около 15 кг каждая). Влажный осадок высушили под вакуумом при максимальной температуре теплой гликолевой бани (или тепловой рубашки реактора) 40°С. Через 14,5 часов сушки LOD составил 0,75%. Высушенное вещество размололи (сито 0,125"), получив 31,8 кг продукта, который затем сушили под вакуумом еще 10,5 часов. После сушки LOD составил 1,8%, и продукт (31,5 кг) был получен с 74,8% выходом (ожидаемый выход 60-90%). Анализ ВЭЖХ показал чистоту 100%.
Пример 4: Анализ солей
Первичный анализ
К 20 мг свободного основания в 3 мл 10% (водн.) смеси ТГФ добавили 1,1 эквивалента кислоты в 1 мл этанола. Смесь перемешивали (трясли) 2 часа, а затем добавили 2 мл трет-бутилового метилового эфира, чтобы индуцировать выпадение осадка, и трясли еще 2 часа. Образцы затем отфильтровали, высушили и затем проанализировали, чтобы определить их чистоту, упорядоченность структуры (кристалличность) и стабильность. Результаты и список исследовавшихся кислот представлены в приводимой далее таблице 1.
+++, кристаллическая форма, нет фазовых переходов, хорошая чистота; ++, аморфная, незначительный фазовый переход, умеренная или хорошая чистота; +, незначительная кристалличность или ее отсутствие, фазовый переход к менее кристаллической форме, низкая чистота; -, не осаждается.
Вторичный анализ
Вторичная оценка нескольких солевых форм проводили с использованием описанных далее методов, результаты приведены в таблице 5 и на фигурах 1, 2, 3, 4 и 5.
Дифференциальная сканирующая калориметрия (ДСК)
Данные ДСК были получены на инструменте ТА Q1000 с автосэмплером на 50 положений. Стандартом калибровки энергии и температуры был индий.
Образцы нагревали от 25 до 350°С со скоростью 10°С в минуту. Над образцом продували азот со скоростью 30 мл/мин. Если не указано по-другому, использовались от 1 до 3 мг образца, причем все образцы хранили в герметически запечатанном алюминиевом сосуде.
Термогравиметрический анализ (ТГА)
Данные ТГА собирали на инструменте ТА Q500 TGA, откалиброванном с помощью системы никель/алюмель, скорость сканирования составляла 10°С/минуту. Над образцом продували азот со скоростью 60 мл/мин. Как правило, 10-20 мг образца загружали в заранее заготовленные платиновые сосуды.
Порошковая дифракция рентгеновских лучей (ПДРЛ)
Картины дифракции рентгеновских лучей собирали на диффрактометре Siemens D5000 с использованием излучения СuКα (40 кВ, 40 мА), θ-θ гониометра, автоматически раздвигающихся и приемных щелей, графитового вторичного монохроматора и сцинтилляционного счетчика. Калибровку инструмента проверяли по сертифицированному стандарту Corundum (NIST 1976).
Образцы исследовали при условиях окружающей среды, их готовили в виде плоских пластин из порошка. Приблизительно, 35 мг образца мягко упаковали в полость, прорезанную в отполированной силиконовой пластине с нулевым фоном (510). В ходе анализа образец вращали в своей собственной плоскости. Детали условий сбора данных приведены в приводимой далее таблице 2:
Данные дифракции выводились с использованием СuКα1 (λ=1,5406 Å), после отсечения компонента Кα2 с помощью EVA (программное обеспечение для оценки) картины для порошков были проиндексированы методом ITO с помощью WIN-INDEX, а необработанные константы решетки уточнили с помощью WIN-METRIC.
Анализ рентгеновской дифракции одиночного кристалла
Данные были получены на дифрактометре Bruker AXS 1К SMART CCD с устройством охлаждения Oxford Cryosystems Cryostream. Для определения структур использовали программы SHELXS или SHELXD, данные уточняли программой SHELXL, входящей в комплект поставки Bruker AXS SHELXTL Если не указано иначе, связанные с углеродами атомы водорода располагали геометрически и уточняли с помощью скользящего параметра изотропного замещения. Связанные с гетероатомами атомы водорода были обнаружены методом дифференциального синтеза Фурье, их положение уточняли с параметром изотропного замещения.
Гравиметрическое исследование сорбции паров воды (ГСП)
Все образцы исследовали на сорбционном анализаторе влаги Hiden IGASorp с программным обеспечением CFRSorp. Размеры образцов, как правило, составляли 10 мг. Изотерму адсорбции и десорбции влаги получили, как описано ниже (2 скана дают один полный цикл). Все образцы загружали/выгружали при комнатной влажности и температуре в комнатных условиях (40% RH, 25°С). Образцы анализировали пост-ГСП анализом ПДРЛ. Стандартную изотерму получили при 25°C с 10% интервалами RH и диапазоне 0-90% RH. Соль формулы II продемонстрировала прекрасную влагостойкость.
Растворимость
Для определения растворимости достаточное количество соли суспендировали в 0,25 мл растворителя (воды) с получением максимальной конечной концентрации ≤10 мг/мл родительской свободной формы соли. Суспензию уравновесили в течение 24 часов при температуре 25°C с последующей проверкой рН и фильтрованием через стекловолоконный фильтр С в 96-луночную плату. Фильтрат затем разбавили в 101 раз. Количественное измерение проводили на ВЭЖХ по сравнению со стандартом, растворенный в ДМСО в концентрации, приблизительно, 0,1 мг/мл. Вводили различные объемы стандарта, а также разбавленные и неразбавленные тестовые растворы. Растворимость подсчитывали, интегрируя площадь под пиком при том же времени удержания, что и максимум пика при стандартной инъекции. Если в фильтровальной плате оставалось достаточное количество твердого осадка, то, обычно, методом ПДРЛ определяли фазовые переходы, образование гидратов, аморфизацию, кристаллизацию и т.д.
Соль ацетата показала растворимость ≤10 мл/мл, растворимость соли малеата составила около 2,05-2,27 мг/мл.
Определение рКа
Анализ проводили на инструменте Sirius GIpKa с D-PAS. Измерения делали в ультрафиолете в водном растворе, и потенциометрически в смесях метанола и воды при 25°С. Ионная сила среды титрования была доведена с помощью 0,15М раствора KCl. Значения, полученные в водно-метанольных смесях, были скорректированы на 0% ко-растворителя с помощью экстраполяции Yasuda-Shedlovsky. Данные уточнили на программном обеспечении Refinement Pro версии 1,0. Предсказание значений рКа проводили с помощью программного обеспечения ACD по предсказанию рКа версии 8,08. Данные для солей формулы II представлены ниже в таблице 3.
Определение LogP
Анализ проводили способом потенциометрического титрования на инструменте Sirius GlpKa с использованием трех соотношений октанол:ISA вода, чтобы получить значения Log P, Log Рион и Log D. Данные уточнили на программном обеспечении Refinement Pro версии 1.0. Предсказание LogP провели с использованием программного обеспечения ACD версии 8.08 и Syracuse KNOWWIN версии 1.67. Данные для соли малеата приведены в таблице 4 ниже.
Определение содержания воды по Карлу Фишеру
Содержание определяли на коулометре Mettler Toledo DL39 с помощью реагента Hydranal Coulomat AG и продувки аргоном. Образцы вводили в виде твердых частиц в платиновой кювете для ТГА, которая соединена с устройством так, чтобы избежать попадания воды. На одно титрование расходовали около 10 мг образца, и каждый анализ выполняли дважды.
Стабильность
В качестве характеристики стабильности с помощью ВЭЖХ (Agilent HPI 100) (время удержания 34 минуты) было измерено содержание гидролизованных амидинов после пребывания образца при температуре 57°С и 75% влажности. В качестве растворителя использовали метанол, а модификатором мобильной фазы была 0,1% трифторуксусная кислота. Данные собирали через 3, 6 и 10 дней, за исключением данных для пропионата, которые собирали через 0, 3 и 8 дней. Результаты представлены в таблице 5, они выражены как процент продукта кислого гидролиза (процент брался от основного пика). Все остальные пики примесей не учитывались.
Данные по кристаллам для соли формулы II
Все эксперименты проводили на дифрактометре Bruker-Nonius Kappa CCD, оборудованном устройством охлаждения Oxford Cryosystems Cryostream. Структуры, обычно, определяли программным обеспечением SIR-97 или SHELXS-97 и уточняли SHELXL-97. Если не указано по-другому, атомы водорода располагали геометрически и уточняли с помощью параметров изотропного замещения. Следующие таблицы (таблица 6 и 7) содержат данные по кристаллам и уточнения структур для соли формулы II.
Хотя настоящее изобретение было подробно описано для иллюстрации, а примеры приведены для ясности понимания, специалисту должно быть ясно, что в область следующей далее формулы изобретения входят также и некоторые изменения и модификации. Кроме того, все упомянутые здесь ссылки включены сюда посредством ссылки во всей своей полноте, точно так же, как если бы каждая ссылка была бы включена по отдельности.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ | 2019 |
|
RU2813780C2 |
| СТАНДАРТНЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ И СПОСОБЫ ЛЕЧЕНИЯ ТРОМБОЗА ПЕРОРАЛЬНЫМ ВВЕДЕНИЕМ ИНГИБИТОРА ФАКТОРА ХА | 2007 |
|
RU2452484C2 |
| БЕНЗОЙНОКИСЛАЯ СОЛЬ ОТАМИКСАБАНА | 2012 |
|
RU2597423C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ИЗВЕСТНОГО ПИРРОЛИДИНОВОГО ИНГИБИТОРА ФАКТОРА XA | 2006 |
|
RU2368610C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА | 2003 |
|
RU2339634C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ | 2019 |
|
RU2817800C2 |
| ТРОМБОЛИТИЧЕСКИЕ СРЕДСТВА | 1995 |
|
RU2142799C1 |
| НОВАЯ КРИСТАЛЛИЧЕСКАЯ ФОРМА ТРИАЗОЛО (4,5-d) ПИРИМИДИНА | 2005 |
|
RU2418802C2 |
| ПРИМЕНЕНИЕ 2-ФЕНИЛ-3-АРОИЛБЕНЗОТИОФЕНОВ ДЛЯ ИНГИБИРОВАНИЯ ТРОМБОТИЧЕСКОГО РАССТРОЙСТВА, ДЛЯ УВЕЛИЧЕНИЯ АКТИВАЦИИ ПРОТЕИНА С | 1994 |
|
RU2190405C2 |
| ИНГИБИТОРЫ ФАКТОРА XIa | 2016 |
|
RU2712268C2 |
Изобретение относится к соли ингибитора фактора Ха, включающая соединение, имеющее структурную формулу I:
и малеиновую кислоту.
Изобретение также относится к фармацевтической композиции, к таблетке, к капсуле, к лепешке, к способу профилактики или лечения, характеризующегося нежелательным тромбозом состояния у млекопитающего, к способу ингибирования коагуляции образцов крови, а также к способу получения соединения, имеющего структурную формулу I. Технический результат - получение нового биологически активного соединения, для профилактики или лечения характеризующихся нежелательным тромбозом состояний у млекопитающих. 8 н. и 20 з.п. ф-лы, 7 табл., 6 ил.
1. Соль ингибитора фактора Ха, включающая соединение, имеющее структурную формулу I:

и малеиновую кислоту.
2. Соль по п.1, имеющая структурную формулу II:
3. Соль по п.1 или 2, характеризующаяся кристаллической полиморфной формой.
4. Соль по п.3, идентифицирующаяся дифрактограммой порошковой рентгеновской дифракции излучения CuKα1, включающей, по меньшей мере, четыре характеристических пика при углах рассеяния 2θ, выбранных из группы, включающей приблизительно 4,9, 9,7, 13,8, 14,1, 15,2, 17,6, 18,5, 20,8, 21,6, 22,7, 24,1, 26,3 и 26,8 градуса.
5. Соль по п.3, идентифицирующаяся дифрактограммой порошковой рентгеновской дифракции излучения CuKα1, включающей, по меньшей мере, восемь характеристических пика при углах рассеяния 2θ, выбранных из группы, включающей приблизительно 4,9, 9,7, 11,8, 13,8, 14,1, 15,2, 17,6, 18,5, 19,9, 20,8, 21,6, 22,7, 24,1, 25,0, 26,3 и 26,8 градуса.
6. Соль по п.3, идентифицирующаяся дифрактограммой порошковой рентгеновской дифракции, эквивалентной таковой, изображенной на фигурах 1 или 2.
7. Соль по п.3, идентифицирующаяся термограммой, дифференциальной сканирующей калориметрии, эквивалентной таковой, изображенной на фигуре 3.
8. Фармацевтическая композиция для профилактики или лечения характеризующихся нежелательным тромбозом состояний у млекопитающих, включающая фармацевтически приемлемый носитель и терапевтически эффективное количество соли по любому из пп.1-7.
9. Фармацевтическая композиция по п.8 в форме, пригодной для инфузии, инъекции или трансдермального введения.
10. Фармацевтическая композиция по п.8 или 9, которая дополнительно содержит второе вещество, выбранное из группы, включающей антикоагулянты, тромболитические агенты, антитромботики, ингибиторы агрегации тромбоцитов и активаторы плазминогена тканей.
11. Фармацевтическая композиция по п.8 или 9, которая дополнительно содержит второе вещество, выбранное из группы, включающей урокиназу, проурокиназу, стрептокиназу, гепарин, аспирин и варфарин.
12. Таблетка, состоящая из фармацевтической композиции по п.8.
13. Капсула, состоящая из фармацевтической композиции по п.8.
14. Лепешка, состоящая из фармацевтической композиции по п.8.
15. Способ профилактики или лечения характеризующегося нежелательным тромбозом состояния у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соли по любому из пп.1-7.
16. Способ по п.15, в котором проводят лечение упомянутого состояния, выбранного из группы, включающей в себя острый коронарный синдром, инфаркт миокарда, нестабильную ангину, рефракторную ангину, окклюзивные коронарные тромбы, сопровождающие пост-тромболитическую терапию или пост-коронарную ангиопластику, тромболитически опосредуемый цереброваскулярный синдром, эмболический инсульт, тромботический инсульт, приступы ишемии, венозный тромбоз, глубокий венозный тромбоз, легочную эмболию, коагулопатию, диссеминированную внутрисосудистую коагуляцию, тромботическую тромбоцитопеническую пурпуру, облитерирующий тромбоангиит, тромботические заболевания, связанные с индуцированной гепариномтромбоцитопенией, тромботические осложнения, связанные с экстракорпоральным кровообращением, тромботические осложнения, связанные с хирургическими операциями, тромботические осложнения, связанные с установкой протезных устройств.
17. Способ по п.15 или 16, дополнительно включающий введение указанному млекопитающему второго вещества, выбранного из группы, включающей антикоагулянты, тромболитические агенты, антитромботики, ингибиторы агрегации тромбоцитов и активаторы плазминогена тканей.
18. Способ по п.15 или 16, дополнительно включающий введение указанному млекопитающему второго вещества, выбранного из группы, включающей урокиназу, проурокиназу, стрептокиназу, гепарин, аспирин и варфарин.
19. Способ ингибирования коагуляции образцов крови, включающий взаимодействие указанных образцов с указанной солью по любому из пп.1-7.
20. Способ получения соединения, имеющего структурную формулу I:

включающий взаимодействие LiN(CH3)2 с соединением, имеющим структурную формулу III:

или с его солью в условиях, способствующих образованию соединения формулы I.
21. Способ по п.20, в котором в качестве соли соединения формулы III используют соль соляной кислоты.
22. Способ по п.20, в котором условия, способствующие образованию соединения формулы I, характеризуются использованием неполярного апротонного растворителя.
23. Способ по п.22, в котором неполярный апротонный растворитель выбран из группы, включающей тетрагидрофуран, диэтиловый эфир, диметоксиметан, диоксан, гексан, метил трет-бутиловый эфир, гептан и циклогексан.
24. Способ по п.20, в котором упомянутое взаимодействие проводят при температуре ниже 10°С.
25. Способ по п.20, в котором соединение формулы I получают с выходом не менее 50%.
26. Способ по п.20, в котором соединение формулы I получают с выходом не менее 65%.
27. Способ по п.20, в котором соединение формулы I получают с выходом не менее 75%.
28. Способ по п.20, в котором соединение формулы I получают в масштабе граммов или в масштабе килограммов.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| RU 200121018 А, 27.12.2004. | |||
Авторы
Даты
2012-01-27—Публикация
2006-11-07—Подача