ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет U.S.S.N. 62/752,503, поданной 30 октября 2018, которая включена в настоящий документ посредством ссылки полностью.
УРОВЕНЬ ТЕХНИКИ
Свертывание крови представляет собой первую линию защиты от потери крови в результате травмы. «Каскад» свертывания крови включает ряд циркулирующих зимогенов сериновых протеаз, регуляторных кофакторов и ингибиторов. Каждый фермент, после образования из своего зимогена, специфически расщепляет следующий зимоген в каскаде с образованием активной протеазы. Этот процесс повторяется до тех пор, пока, наконец, тромбин не отщепит фибринопептиды от фибриногена с образованием фибрина, который полимеризуется с образованием сгустка крови. Хотя эффективное свертывание ограничивает потерю крови в месте травмы, оно также создает риск системной коагуляции, приводящей к массивному тромбозу. В нормальных условиях гемостаз поддерживает баланс между образованием сгустка (коагуляцией) и растворением сгустка (фибринолизом). Однако при некоторых болезненных состояниях, таких как острый инфаркт миокарда и нестабильная стенокардия, разрыв сформировавшейся атеросклеротической бляшки приводит к аномальному образованию тромба в сосудистой сети коронарных артерий.
Заболевания, которые являются следствием свертывания крови, такие как инфаркт миокарда, нестабильная стенокардия, фибрилляция предсердий, инсульт, тромбоэмболия легочной артерии и тромбоз глубоких вен, являются одними из основных причин смерти в развитых странах. Современные методы лечения антикоагулянтами, такие как инъекционный нефракционированный и низкомолекулярный (LMW) гепарин и пероральный варфарин (кумадин), несут в себе риск эпизодов кровотечений и демонстрируют вариабельность от пациента к пациенту, что приводит к необходимости тщательного мониторинга и титрования дозы терапевтических средств. Следовательно, существует большая медицинская потребность в новых антикоагулянтных лекарственных средствах, в которых отсутствуют некоторые или все побочные эффекты доступных в настоящее время лекарственных средств.
Фактор XIa является привлекательной терапевтической целью, вовлеченной в путь, ассоциированный с этими заболеваниями. Повышенные уровни активности Фактора XIa или Фактора XIa наблюдались при некоторых тромбоэмболических расстройствах, включая тромбоз вен (Meijers et al., N. Engl. J. Med. 342:696, 2000), острый инфаркт миокарда (Minnema et al., Arterioscler Thromb Vasc Biol 20:2489, 2000), острый коронарный синдром (Butenas et al., Thromb Haemost 99:142, 2008), ишемическую болезнь сердца (Butenas et al., Thromb Haemost 99:142, 2008), хроническую обструктивную болезнь легких (Jankowski et al., Thromb Res 127:242, 2011), аортальный стеноз (Blood Coagul Fibrinolysis, 22:473, 2011), острую цереброваскулярную ишемию (Undas et al., Eur J Clin Invest, 42:123, 2012) и систолическую сердечную недостаточность из-за ишемической кардиомиопатии (Zabcyk et al., Pol Arch Med Wewn. 120:334, 2010). Пациенты, которые не имеют Фактор XI из-за генетического дефицита Фактора XI, демонстрируют незначительное количество, если вообще имеются, ишемических инсультов (Salomon et al., Blood, 111:4113, 2008). В то же время, потеря активности Фактора XIa, при которой один из путей, инициирующих коагуляцию, остается нетронутым, не нарушает гемостаз. У людей дефицит Фактора XI может привести к нарушению свертываемости крови от легкой до умеренной, особенно в тканях с высоким уровнем местной фибринолитической активности, таких как мочевыводящие пути, нос, полость рта и миндалины. Более того, гемостаз почти нормален у мышей с дефицитом фактора XI (Gailani, Blood Coagul Fibrinolysis, 8:134, 1997). Более того, также было обнаружено, что ингибирование Фактора XI ослабляет артериальную гипертензию и другие заболевания и дисфункции, включая васкулярное воспаление (Kossmann et al. Sci. Transl. Med. 9, eaah4923 (2017)).
Следовательно, соединения, которые ингибируют Фактор XIa, могут предотвращать или лечить широкий спектр расстройств, избегая при этом побочных эффектов и терапевтических проблем, которые мешают лекарственным средствам, которые ингибируют другие компоненты пути коагуляции. Более того, из-за ограниченной эффективности и неблагоприятных побочных эффектов некоторых современных терапевтических средств для ингибирования нежелательного тромбоза (например, тромбоза глубоких вен, тромбоза печеночных вен и инсульта), улучшенные соединения и способы (например, связанные с Фактором XIa) необходимы для профилактики или лечения нежелательного тромбоза.
Другой терапевтической мишенью является фермент калликреин. Калликреин плазмы человека представляет собой сериновую протеазу, которая может отвечать за активацию нескольких нижестоящих факторов (например, брадикинина и плазмина), которые являются критическими для свертывания крови и контроля, например, артериального давления, воспаления и боли. Калликреины экспрессируются, например, в простате, эпидермисе и центральной нервной системе (ЦНС) и могут участвовать, например, в регуляции разжижения спермы, расщепления белков адгезии клеток и пластичности нейронов в ЦНС. Более того, калликреины могут участвовать в онкогенезе и развитии рака и ангионевротического отека, например, наследственного ангионевротического отека. Сверхактивация пути калликреин-кинин может привести к ряду расстройств, включая ангионевротический отек, например, наследственный ангионевротический отек (Schneider et al., J. Allergy Clin. Immunol. 120:2, 416, 2007). На сегодняшний день возможности лечения НАО ограничены (например, WO2003/076458). Как таковые, необходимы терапевтические средства для профилактики или лечения этих заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям, которые ингибируют Фактор XIa или калликреин, и к способам профилактики или лечения нежелательного тромбоза или ангионевротического отека (например, наследственного ангионевротического отека) путем введения млекопитающему одного или нескольких из этих соединений по отдельности или в комбинации с другими молекулами. В изобретении также предложены способы создания или выбора дополнительных ингибиторов Фактора XIa или калликреина с использованием этих структур. Желательно, чтобы эти соединения имели определенные структурные, физические и пространственные характеристики, которые позволяют соединениям взаимодействовать с конкретными остатками активного центра Фактора XIa или калликреина.
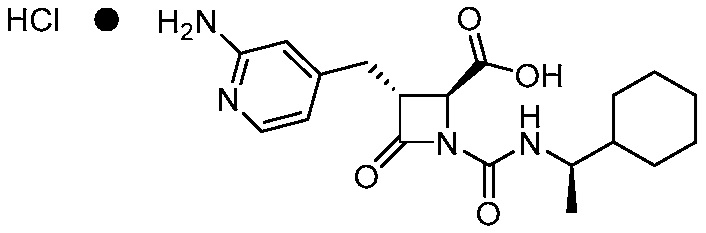
В одном аспекте, настоящее изобретение относится к соединению 1:
 (Соединение 1)
(Соединение 1)
или его фармацевтически приемлемой соли, например, гидрохлориду соединения 1. В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемая соль является кристаллической. В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемая соль существует в виде по существу чистой кристаллической твердой формы.
В одном аспекте, в настоящем документе предоставлена фармацевтически приемлемая соль формулы (I):
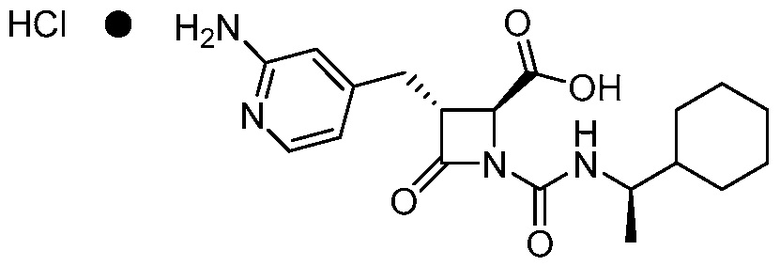 (I).
(I).
Фармацевтически приемлемой солью формулы (I) является гидрохлорид соединения 1, также названный в настоящем документе соединение 1•HCl. В некоторых вариантах осуществления соединение 1•HCl является кристаллическим. В некоторых вариантах осуществления соединение 1•HCl существует в виде по существу чистой кристаллической твердой формы. В некоторых вариантах осуществления соединение 1•HCl имеет рентгенограмму XRPD по существу такую, как изображена на ФИГ. 9.
В одном аспекте, в настоящем документе предоставлен способ получения фармацевтически приемлемой соли формулы (I):
 (I).
(I).
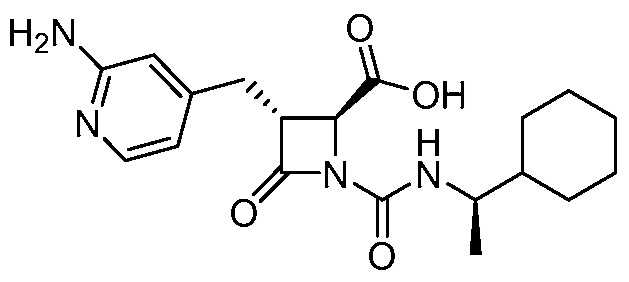
или ее сольвата (например, гидрата), включающий растворение соли формулы (II)
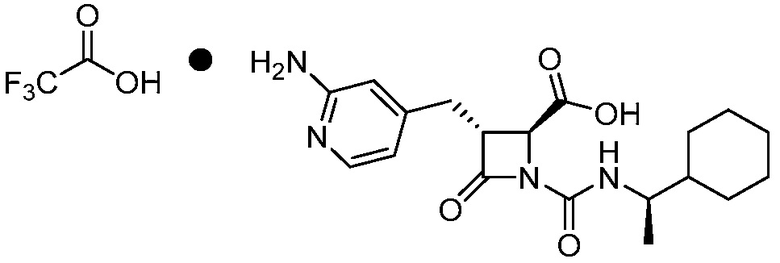 (II)
(II)
или ее сольвата (например, гидрата) в растворителе, тем самым получая первый раствор, и добавлением хлороводорода к первому раствору, с получением фармацевтически приемлемой соли формулы (I).
В некоторых вариантах осуществления соль формулы (II) растворяют в апротонном растворителе. В некоторых вариантах осуществления растворитель содержит (например, состоит из или состоит по существу из) ацетонитрил. В некоторых вариантах осуществления хлороводород добавляют к первому раствору барботированием газообразного HCl в первый раствор или добавлением отдельного раствора, содержащего HCl (например, эфирного раствора хлористоводородной кислоты) к первому раствору.
В некоторых вариантах осуществления исходное количество соли формулы (II) или ее сольвата (например, гидрата) больше или равно 500 граммам. В некоторых вариантах осуществления исходное количество соли формулы (II) или ее сольвата (например, гидрата) больше или равно 1 килограмма. В некоторых вариантах осуществления способ дает более 300 граммов (например, более примерно 350 граммов (например, примерно 368 граммов)) фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата).
В некоторых вариантах осуществления способ дает фармацевтически приемлемую соль формулы (I) или ее сольват (например, гидрат) с выходом более примерно 50% (например, примерно 55% выходом). В некоторых вариантах осуществления способ дает фармацевтически приемлемую соль формулы (I) или ее сольват (например, гидрат) с выходом более примерно 75%. В некоторых вариантах осуществления способ дает фармацевтически приемлемую соль формулы (I) или ее сольват (например, гидрат) с выходом более примерно 90%. В некоторых вариантах осуществления способ дает фармацевтически приемлемую соль формулы (I) или ее сольват (например, гидрат) с выходом более примерно 99%. В некоторых вариантах осуществления, чистота фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) составляет примерно 80%. В некоторых вариантах осуществления чистота фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) составляет примерно 81%.
В некоторых вариантах осуществления способ дополнительно включает очистку фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрат) растворением фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) в растворителе (например, изопропиловом спирте) с последующим осаждением растворенной фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) с применением другого растворителя (например, метил-трет-бутилового эфира). В некоторых вариантах осуществления чистота фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) после осаждения составляет более 98%. В некоторых вариантах осуществления чистота фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) после осаждения составляет примерно 98%.
В некоторых вариантах осуществления способ дополнительно включает очистку фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) суспендированием фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) в растворителе (например, изопропиловом спирте) с последующей фильтрацией фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) для отделения фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) от растворителя. В некоторых вариантах осуществления чистота фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) после суспендирования и отделения составляет более 98%. В некоторых вариантах осуществления чистота фармацевтически приемлемой соли формулы (I) или ее сольват (например, гидрат) после суспендирования и отделения составляет примерно 98%.
В некоторых вариантах осуществления способ включает получение соли формулы (II) контактированием соединения формулы (III)
 (III)
(III)
с трифторуксусной кислотой.
В некоторых вариантах осуществления способ дополнительно включает контакт соединения формулы (III) с силаном (например, триэтилсиланом).
В некоторых вариантах осуществления способ дает более 500 граммов соединения формулы (III) (например, более 1 кг).
В некоторых вариантах осуществления способ включает получение соединения формулы (III) контактированием соединения формулы (IV)
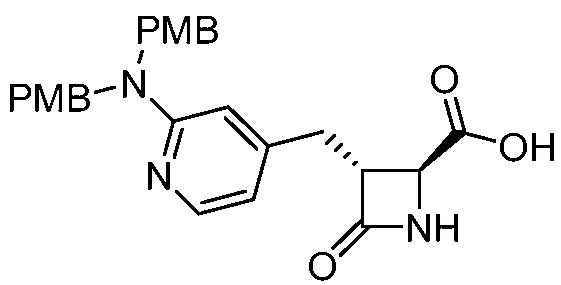 (IV)
(IV)
с соединением формулы (V)
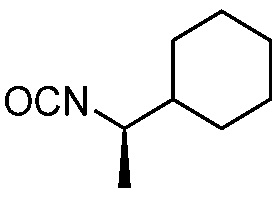 (V).
(V).
В некоторых вариантах осуществления способ дает более 1 килограмма соединения формулы (III) (например, примерно 1,3 кг). В некоторых вариантах осуществления способ проводят в присутствии растворителя. В некоторых вариантах осуществления способ проводят в присутствии основания (например, 1,8-диазабицикло(5.4.0)ундец-7-ена).
В некоторых вариантах осуществления способ включает получение соединения формулы (IV) контактированием соединения формулы (VI)
 (VI)
(VI)
с соединением формулы (VII)
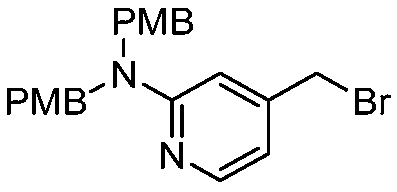 (VII).
(VII).
В некоторых вариантах осуществления способ дает более 500 граммов соединения формулы (IV) (например, более 900 граммов).
В некоторых вариантах осуществления соединение формулы (III) очищают способом очистки, который не является хроматографией. В некоторых вариантах осуществления способ очистки включает суспендирование соединения формулы (III) в растворителе (например, гептане) с последующей фильтрацией соединения формулы (III) для отделения соединения формулы (III) от растворителя. В некоторых вариантах осуществления чистота соединения формулы (III) составляет более 90%.
В некоторых вариантах осуществления соединение формулы (I) очищают способом очистки, который не является хроматографией.
В одном аспекте, в настоящем документе предоставлена кристаллическая фармацевтически приемлемая соль формулы (I):
 (I).
(I).
В одном аспекте, настоящее изобретение относится к фармацевтической композиции, содержащей соединение 1 или его фармацевтически приемлемую соль и один или несколько фармацевтически приемлемых эксципиентов. В некоторых вариантах осуществления композиция представлена в виде жидкого состава (например, раствора). В некоторых вариантах осуществления композиция представлена в виде твердого состава (например, капсулы, пилюли, таблетки или порошка).
В некоторых вариантах осуществления каждая кристаллическая твердая форма охарактеризована и идентифицирована с помощью параметров, полученных одним или более из вышеупомянутых аналитических методов: процентное содержание АФИ (свободного основания) и расчетная чистота каждого образца, определенная с помощью анализа ВЭЖХ; порошковые дифракционные рентгенограммы, представленные с градусами 2-тета (2θ) по оси абсцисс и интенсивностью пиков по оси ординат, как определено анализом с помощью XRPD. Эти рентгенограммы также называются в настоящем документе рентгенограммами XRPD.
В некоторых вариантах осуществления твердую форму определяют как кристаллическую по присутствию острых отдельных пиков, найденных в соответствующей рентгенограмме XRPD.
В одном аспекте, в настоящем документе предоставлен способ лечения тромбоэмболического расстройства у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, представленного
или его фармацевтически приемлемой соли, где кровь субъекта контактирует с искусственной поверхностью.
В одном аспекте, в настоящем документе предоставлен способ снижения риска тромбоэмболического расстройства у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, представленного

или его фармацевтически приемлемой соли, где кровь субъекта контактирует с искусственной поверхностью.
В одном аспекте, в настоящем документе предоставлен способ профилактики тромбоэмболического расстройства у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, представленного

или его фармацевтически приемлемой соли, где кровь субъекта контактирует с искусственной поверхностью.
В некоторых вариантах осуществления способов, представленных в настоящем документе, искусственная поверхность находится в контакте с кровью в кровотоке субъекта. В некоторых вариантах осуществления искусственной поверхностью является имплантируемое устройство, диализный катетер, система искусственного кровообращения, искусственный сердечный клапан, желудочковый аппарат вспомогательного кровообращения, трансплантат мелкого калибра, центральный венозный катетер или аппарат экстракорпоральной мембранной оксигенации (ЭКМО). В некоторых вариантах осуществления искусственная поверхность вызывает или ассоциирована с тромбоэмболическим расстройством. В некоторых вариантах осуществления тромбоэмболическим расстройством является венозная тромбоэмболия, тромбоз глубоких вен или легочная эмболия. В некоторых вариантах осуществления тромбоэмболическим расстройством является сгусток крови.
В некоторых вариантах осуществления способы дополнительно включают кондиционирование искусственной поверхности отдельной дозой соединения или его фармацевтически приемлемой соли перед контактированием искусственной поверхности с кровью в системе кровообращения субъекта. В некоторых вариантах осуществления способы дополнительно включают кондиционирование искусственной поверхности отдельной дозой соединения или его фармацевтически приемлемой соли до или во время введения соединения или его фармацевтически приемлемой соли субъекту. В некоторых вариантах осуществления способы дополнительно включают кондиционирование искусственной поверхности отдельной дозой соединения или его фармацевтически приемлемой соли до и во время введения соединения или его фармацевтически приемлемой соли субъекту.
В одном аспекте, в настоящем документе предоставлен способ лечения крови субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, представленного

или его фармацевтически приемлемой соли.
В одном аспекте, в настоящем документе предоставлен способ поддержания в плазме уровня соединения, представленного

или его фармацевтически приемлемой соли, в крови субъекта в контакте с искусственной поверхностью, где способ включает:
(i) введение соединения или его фармацевтически приемлемой соли субъекту до или во время контакта искусственной поверхности с кровью субъекта; и
(ii) кондиционирование искусственной поверхности соединением или его фармацевтически приемлемой солью до или во время контакта искусственной поверхности с кровью субъекта;
тем самым поддерживая уровень соединения или его фармацевтически приемлемой соли в плазме крови субъекта.
В некоторых вариантах осуществления способов, описанных в настоящем документе, соединение или его фармацевтически приемлемая соль сохраняет постоянное активированное частичное тромбопластиновое время (аЧТВ) в крови субъекта до и после контакта с искусственной поверхностью. В некоторых вариантах осуществления соединение или его фармацевтически приемлемую соль вводят субъекту до и во время искусственной поверхности с кровью субъекта.
В некоторых вариантах осуществления искусственную поверхность кондиционируют соединением или его фармацевтически приемлемой солью до и во время контакта искусственной поверхности с кровью субъекта. В некоторых вариантах осуществления способ дополнительно предотвращает или снижает риск образования сгустка крови в крови субъекта, контактирующей с искусственной поверхностью.
В некоторых вариантах осуществления искусственной поверхностью является система искусственного кровообращения. В некоторых вариантах осуществления искусственной поверхностью является аппарат экстракорпоральной мембранной оксигенации (ЭКМО). В некоторых вариантах осуществления аппаратом ЭКМО является аппарат веновенозной ЭКМО или аппарат веноартериальной ЭКМО.
В одном аспекте, в настоящем документе предоставлен способ профилактики или снижения риска тромбоэмболического расстройства у субъекта во время или после медицинской процедуры, включающий
(i) введение субъекту эффективного количества соединения, представленного:

или его фармацевтически приемлемой соли, до, во время или после медицинской процедуры; и
(ii) контакт крови субъекта с искусственной поверхностью;
тем самым предотвращая или снижая риск тромбоэмболического расстройства во время или после медицинской процедуры.
В некоторых вариантах осуществления искусственная поверхность кондиционируется соединением или его фармацевтически приемлемой солью перед введением соединения субъекту до, во время или после медицинской процедуры.
В некоторых вариантах осуществления искусственная поверхность кондиционируется раствором, содержащим соединение или его фармацевтически приемлемую соль, перед введением соединения или его фармацевтически приемлемой соли субъекту до, во время или после медицинской процедуры. В некоторых вариантах осуществления раствором является солевой раствор, раствор Рингера или кровь. В некоторых вариантах осуществления раствор дополнительно содержит кровь. В некоторых вариантах осуществления кровь получена от субъекта или донора.
В некоторых вариантах осуществления тромбоэмболическим расстройством является сгусток крови.
В некоторых вариантах осуществления медицинская процедура включает одно или несколько из i) искусственного кровообращения, ii) оксигенации и перекачивания крови через экстракорпоральную мембранную оксигенацию, iii) вспомогательного перекачивания крови (внутреннего или внешнего), iv) диализа крови, v) экстракорпоральной фильтрации крови, vi) сбора крови у субъекта в хранилище для последующего использования у животного или человека, vii) использования венозного или артериального внутрипросветного катетера(ов), viii) использования устройств(а) для диагностической или интервенционной катетеризации сердца, ix) использования внутрисосудистого устройств(а), x) использования искусственного сердечного клапана(ов) и xi) использования искусственного трансплантата(ов).
В некоторых вариантах осуществления медицинской процедурой является искусственное кровообращение. В некоторых вариантах осуществления медицинская процедура включает оксигенацию и перекачивание крови через экстракорпоральную мембранную оксигенацию (ЭКМО). В некоторых вариантах осуществления ЭКМО является веновенозной ЭКМО или веноартериальной ЭКМО.
В одном аспекте, настоящее изобретение относится к способу снижения риска инсульта (например, ишемии, например, временного ишемического события, острого ишемического инсульта крупного сосуда) у субъекта, перенесшего ишемическое событие (например, временное ишемическое событие), включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления введение снижает риск инсульта (например, острого ишемического инсульта крупного сосуда) у субъекта по сравнению с субъектом, которому не вводят соединение. В некоторых вариантах осуществления введение снижает риск фибрилляции предсердий у субъекта по сравнению с субъектом, которому не вводят соединение.
В одном аспекте, настоящее изобретение относится к способу уменьшения системной эмболии не центральной нервной системы (например, ишемии, например, временного ишемического события) у субъекта, перенесшего ишемическое событие (например, временное ишемическое событие), включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления введение снижает системную эмболию не центральной нервной системы у субъекта по сравнению с субъектом, которому не вводят соединение.
В одном аспекте, настоящее изобретение относится к способу лечения тромбоза глубоких вен, включающий введение субъекту, который страдает ишемическим событием (например, временные ишемическим событием), эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу профилактики тромбоза глубоких вен, включающий введение субъекту, который страдает тромбозом глубоких вен (например, субъекту, которого ранее лечили от тромбоза глубоких вен), эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В одном аспекте, настоящее изобретение относится к способу снижения риска рецидива тромбоза глубоких вен включающий введение субъекту который страдает тромбоз глубоких вен (например, субъекту, которого ранее лечили от тромбоза глубоких вен), эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления введение снижает риск рецидива тромбоза глубоких вен у субъекта по сравнению с субъектом, которому не вводят соединение.
В одном аспекте, настоящее изобретение относится к способу профилактики венозной тромбоэмболии, например, тромбоза глубоких вен или легочной эмболии у субъекта, включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления у субъекта было хирургическое вмешательство. В некоторых вариантах осуществления субъекту вводят соединение, его фармацевтически приемлемую соль, до, во время или после хирургического вмешательства. В некоторых вариантах осуществления субъект подвергался операции по замене коленного или тазобедренного сустава. В некоторых вариантах осуществления субъект подвергался ортопедической операции. В некоторых вариантах осуществления субъект подвергался операции на легком. В некоторых вариантах осуществления субъекта лечили от рака, например, хирургическим путем. В некоторых вариантах осуществления субъект страдает хроническим медицинским состоянием. В некоторых вариантах осуществления венозная тромбоэмболия связана с раком. В некоторых вариантах осуществления соединение, его фармацевтически приемлемая соль или композиция, описанные в настоящем документе, являются основным средством профилактики тромбоза глубоких вен или венозной тромбоэмболии. В некоторых вариантах осуществления соединение, его фармацевтически приемлемую соль или композицию, описанные в настоящем документе, используют в качестве расширенной терапии. В одном аспекте, настоящее изобретение относится к способу снижения риска венозной тромбоэмболии, например, тромбоза глубоких вен, или легочной эмболии, у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления субъект подвергался хирургическому вмешательству. В некоторых вариантах осуществления субъекту вводят соединение, его фармацевтически приемлемую соль или композицию после хирургического вмешательства. В некоторых вариантах осуществления субъект подвергался операции по замене коленного или тазобедренного сустава. В некоторых вариантах осуществления субъект подвергался ортопедической операции. В некоторых вариантах осуществления субъект подвергался операции на легком. В некоторых вариантах осуществления субъект лечился от рака, например, хирургическим путем. В некоторых вариантах осуществления субъект страдает хроническим медицинским состоянием. В некоторых вариантах осуществления тромбоэмболическое расстройство связано с раком. В некоторых вариантах осуществления соединение, его фармацевтически приемлемая соль или композиция, описанные в настоящем документе, являются основным агентом для снижения риска тромбоэмболического расстройства. В некоторых вариантах осуществления соединение, его фармацевтически приемлемую соль или композицию, описанные в настоящем документе, используют в качестве расширенной терапии.
В одном аспекте, настоящее изобретение относится к способу снижения риска инсульта (например, острого ишемического инсульта крупного сосуда) или системной эмболии у субъекта, нуждающегося в этом, включающему введение субъекту эффективного количества соединения, описанного в настоящем документе, например, соединения 1 или его фармацевтически приемлемой соли или композиции, описанной в настоящем документе, например, композиции, содержащей соединение 1. В некоторых вариантах осуществления субъект страдает фибрилляцией предсердий (например, неклапанной фибрилляцией предсердий). В некоторых вариантах осуществления субъект страдает почечным расстройством (например, терминальной стадией почечной недостаточности).
В одном аспекте, настоящее изобретение относится к способу профилактики инсульта (например, острого ишемического инсульта крупного сосуда) или системной эмболии у субъекта, нуждающегося в этом, включающему введение субъекту эффективного количества соединения, описанного в настоящем документе, например, соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе, например, композиции, содержащей соединение 1. В некоторых вариантах осуществления, субъект страдает фибрилляцией предсердий (например, неклапанной фибрилляцией предсердий). В некоторых вариантах осуществления субъект страдает почечным расстройством (например, терминальной стадией почечной недостаточности).
В одном аспекте, настоящее изобретение относится к способу снижения риска рецидива легочной эмболии (например, симптоматической легочной эмболии), включающему введение субъекту, который страдает легочной эмболией (например, субъекту, которого ранее лечили от легочной эмболии), эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления введение снижает рецидив легочной эмболии у субъекта по сравнению с субъектом, которому не вводят соединение.
В одном аспекте, настоящее изобретение относится к способу профилактики легочной эмболии у субъекта который страдает легочной эмболией (например, субъекту, которого ранее лечили от легочной эмболии), включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу снижения риска рецидива легочной эмболии (например, симптоматической легочной эмболии), включающему введение субъекту который страдает тромбозом глубоких вен (например, субъекту, которого ранее лечили от тромбоза глубоких вен), эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления введение снижает риск рецидива легочной эмболии у субъекта по сравнению с субъектом, которому не вводят соединение.
В одном аспекте, настоящее изобретение относится к способу профилактики легочной эмболии у субъекта который страдает тромбозом глубоких вен (например, субъекту, которого ранее лечили от тромбоза глубоких вен), включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу лечения тромбоза глубоких вен у субъекта, которому ранее вводили антикоагулянт, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления антикоагулянт вводили парентерально в течение 5-10 дней.
В одном аспекте, настоящее изобретение относится к способу лечения легочной эмболии у субъекта, которому ранее вводили антикоагулянт, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления антикоагулянт вводили парентерально в течение 5-10 дней.
В одном аспекте, настоящее изобретение относится к способу лечения субъекта, у которого было ишемическое событие (например, временная ишемия), включающему: введение соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль) субъекту. В некоторых вариантах осуществления соединение вводят субъекту в течение 24 часов или менее, например, 12, 10, 9, 8, 7, 6 часов или менее, после наступления ишемического события у субъекта.
В одном аспекте, настоящее изобретение относится к способу лечения субъекта, у которого было ишемическое событие (например, временная ишемия), включающему: введение соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль) субъекту. В некоторых вариантах осуществления соединение вводят субъекту в течение более 2 часов до 12 часов, например, более 2 часов до 10 часов или менее, более 2 часов до 8 часов или менее, после наступления ишемического события у субъекта.
В одном аспекте, настоящее изобретение относится к способу лечения гипертензии, например, артериальной гипертензии, у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления гипертензия, например артериальная гипертензия, вызывает атеросклероз. В некоторых вариантах осуществления гипертензией является легочная артериальная гипертензия.
В одном аспекте, настоящее изобретение относится к способу снижения риска гипертензии, например, артериальной гипертензии, у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления гипертензия, например, артериальная гипертензия, вызывает атеросклероз. В некоторых вариантах осуществления гипертензией является легочная артериальная гипертензия.
В одном аспекте, настоящее изобретение относится к способу профилактики гипертензии, например, артериальной гипертензии, у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления гипертензия, например, артериальная гипертензия, вызывает атеросклероз. В некоторых вариантах осуществления гипертензией является легочная артериальная гипертензия.
В одном аспекте, настоящее изобретение относится к способу снижения воспаления у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления воспалением является васкулярное воспаление. В некоторых вариантах осуществления васкулярное воспаление сопровождается атеросклерозом. В некоторых вариантах осуществления васкулярное воспаление сопровождается тромбоэмболическим заболеванием у субъекта. В некоторых вариантах осуществления васкулярным воспалением является васкулярное воспаление, вызванное ангиотензином II.
В одном аспекте, настоящее изобретение относится к способу профилактики инфильтрации лейкоцитов в сосуды у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу профилактики эндотелиальной дисфункции, вызванной ангиотензином II у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу профилактики репродукции тромбина у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления репродукция тромбина происходит на тромбоцитах.
В одном аспекте, настоящее изобретение относится к способу лечения вызванной гипертензией почечной дисфункции у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу профилактики вызванной гипертензией почечной дисфункции у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу снижения риска вызванной гипертензией почечной дисфункции у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу лечения фиброза почек у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу профилактики фиброза почек у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу снижения риска фиброза почек у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу лечения почечной недостаточности у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу профилактики почечной недостаточности у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу снижения риска почечной недостаточности у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В одном аспекте, настоящее изобретение относится к способу ингибирования Фактора XIa у субъекта, включающему введение субъекту, который страдает ишемией, эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления ишемией является коронарная ишемия. В некоторых вариантах осуществления субъектом является млекопитающее (например, человек). В некоторых вариантах осуществления субъекту было сделано хирургическое вмешательство (например, операция по замене коленного тазобедренного сустава). В некоторых вариантах осуществления ишемией является коронарная ишемия. В некоторых вариантах осуществления субъектом является субъект с неклапанной фибрилляцией предсердий. В некоторых вариантах осуществления субъект имеет один или несколько из следующих факторов риска инсульта: предыдущий инсульт (например, ишемический, неизвестный, геморрагический), временный ишемический приступ, или системная эмболия не ЦНС. В некоторых вариантах осуществления субъект имеет один или несколько из следующих факторов риска инсульта: 75 лет или старше, гипертензия, сердечная недостаточность или фракция выброса левого желудочка (например, менее или равная 35%) или сахарный диабет.
В некоторых вариантах осуществления соединение вводят перорально или парентерально (например, внутривенно). В некоторых вариантах осуществления соединение вводят перорально. В некоторых вариантах осуществления соединение вводят парентерально (например, внутривенно). В некоторых вариантах осуществления соединение вводят подкожно.
В некоторых вариантах осуществления соединение вводят до ишемического события (например, субъекту, находящемуся в группе риска ишемического события).
В некоторых вариантах осуществления соединение вводят после ишемического события (например, временного ишемического события). В некоторых вариантах осуществления соединение вводят примерно через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней или более после ишемического события (например, временного ишемического события). В некоторых вариантах осуществления соединение вводят примерно через 1, 2, 3, 4, 5, 6, 7 или 8 недель или более после ишемического события (например, временного ишемического события).
В некоторых вариантах осуществления соединение вводят в комбинации с дополнительным терапевтическим агентом. В некоторых вариантах осуществления дополнительный терапевтический агент вводят после введения соединения. В некоторых вариантах осуществления дополнительный терапевтический агент вводят перорально. В некоторых вариантах осуществления дополнительный терапевтический агент вводят, по меньшей мере, через 1, 2, 3, 4, 5, 6, 7, 8, 10, 12, 14, 16, 18, 20 или 24 часа или более после введения соединения.
В некоторых вариантах осуществления дополнительный терапевтический агент вводят, по меньшей мере, через 1, 2, 3, 4, 5, 6, 7, 14, 21 или 28 дней или более после введения соединения. В некоторых вариантах осуществления дополнительный терапевтический агент вводят примерно через 1 день, примерно 2 дня, примерно 3 дня, примерно 4 дня, примерно 5 дней, примерно 6 дней, примерно 7 дней или более после введения соединения.
В некоторых вариантах осуществления дополнительный терапевтический агент вводят длительно (например, в течение примерно 1 дня, примерно 2 дней, примерно 3 дней, примерно 4 дней, примерно 5 дней, примерно 6 дней, примерно 7 дней, примерно 8 дней, примерно 9 дней, примерно 10 дней, примерно 11 дней, примерно 12 дней, примерно 13 дней или примерно 14 дней или более) после введения соединения.
В некоторых вариантах осуществления дополнительный терапевтический агент лечит побочный эффект (например, активное патологическое кровотечение или тяжелые реакции гиперчувствительности (например, анафилактические реакции), спинальную и/или эпидуральную гематому, желудочно-кишечное расстройство (например, боль в верхней части живота, диспепсию, зубную боль), общие расстройства и состояния в месте введения (например, слабость), инфекции и инвазии (например, синусит, инфекции мочевыводящих путей), расстройства опорно-двигательного аппарата и соединительной ткани (например, боли в спине, остеоартрит), респираторные, грудные и средостенные расстройства (например, боль в ротоглотке), травмы, отравления и процедурные осложнения (например, секрецию раны), расстройства костно-мышечной системы и соединительной ткани (например, боль в конечностях, мышечные спазмы), расстройства нервной системы (например, обмороки), кожи и подкожных тканей (например, зуд, волдыри), расстройства крови и лимфатической системы (например, агранулоцитоз), желудочно-кишечные расстройства (например, забрюшинное кровоизлияние), гепатобилиарные расстройства (например, желтуху, холестаз, цитолитический гепатит), расстройства иммунной системы (например, гиперчувствительность, анафилактическую реакцию, анафилактический шок, ангионевротический отек), расстройства нервной системы (например, кровоизлияние в мозг, субдуральную гематому, эпидуральную гематому, гемипарез), заболевания кожи и подкожной ткани (например, синдром Стивенса-Джонсона).
В некоторых вариантах осуществления дополнительным терапевтическим агентом является НПВП (например, аспирин или напроксен), ингибитор агрегации тромбоцитов (например, клопидогрел) или антикоагулянт (например, варфарин или эноксапарин).
В некоторых вариантах осуществления дополнительный терапевтический агент дает аддитивный терапевтический эффект. В некоторых вариантах осуществления дополнительный терапевтический агент дает синергетический терапевтический эффект.
В другом аспекте, настоящее изобретение относится к фармацевтической композиции, содержащей соединение, описанное в настоящем документе (например, соединение 1), и фармацевтически приемлемый эксципиент.
В другом аспекте, настоящее изобретение относится к способу модулирования (например, ингибирования) Фактора XIa у субъекта. Способ включает стадию введения эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль) пациенту, нуждающемуся в этом, тем самым модулируя (например, ингибируя) Фактор XIa.
В другом аспекте, настоящее изобретение относится к способу лечения у субъекта, нуждающегося в этом, тромбоэмболического расстройства. Способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). Тромбоэмболическим расстройством может быть артериальное сердечнососудистое тромбоэмболическое расстройство, артериальный тромбоз, венозное сердечнососудистое тромбоэмболическое расстройство и тромбоэмболическое расстройство в камерах сердца; включая нестабильную стенокардию, острый коронарный синдром, первый инфаркт миокарда, рецидивирующий инфаркт миокарда, ишемию (например, коронарную ишемию, внезапную ишемическую смерть или временную ишемическую атаку), инсульт (например, острый ишемический инсульт крупного сосуда), атеросклероз, окклюзионную болезнь периферических артерий, венозную тромбоэмболию, венозный тромбоз, тромбоз глубоких вен, тромбофлебит, артериальную эмболию, коронарный артериальный тромбоз, церебральный артериальный тромбоз, церебральную эмболию, эмболию почки, легочную эмболию или тромбоз, возникающий при (а) искусственных клапанах или других имплантатах, (b) полостных катетерах, (c) стентах, (d) искусственном кровообращении, (e) гемодиализе или (f) других процедурах, при которых кровь подвергается воздействию искусственной поверхности, что способствует тромбозу.
В другом аспекте, в настоящем изобретении представлен способ профилактики тромбоэмболического расстройства у субъекта. Способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). Тромбоэмболическим расстройством может быть артериальное сердечнососудистое тромбоэмболическое расстройство, артериальный тромбоз, венозное сердечнососудистое тромбоэмболическое расстройство и тромбоэмболическое расстройство в камерах сердца; включая нестабильную стенокардию, острый коронарный синдром, первый инфаркт миокарда, рецидивирующий инфаркт миокарда, ишемию (например, коронарную ишемию, внезапную ишемическую смерть или временную ишемическую атаку), инсульт (например, острый ишемический инсульт крупного сосуда), атеросклероз, окклюзионную болезнь периферических артерий, венозную тромбоэмболию, венозный тромбоз, тромбоз глубоких вен, тромбофлебит, артериальную эмболию, коронарный артериальный тромбоз, церебральный артериальный тромбоз, церебральную эмболию, эмболию почки, легочную эмболию или тромбоз, возникающий при (а) искусственных клапанах или других имплантатах, (b) полостных катетерах, (c) стентах, (d) искусственном кровообращении, (e) гемодиализе или (f) других процедурах, при которых кровь подвергается воздействию искусственной поверхности, что способствует тромбозу.
В другом аспекте, в настоящем изобретении представлен способ снижения риска тромбоэмболического расстройства у субъекта. Способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). Тромбоэмболическим расстройством может быть артериальное сердечнососудистое тромбоэмболическое расстройство, артериальный тромбоз, венозное сердечнососудистое тромбоэмболическое расстройство и тромбоэмболическое расстройство в камерах сердца; включая нестабильную стенокардию, острый коронарный синдром, первый инфаркт миокарда, рецидивирующий инфаркт миокарда, ишемию (например, коронарную ишемию, внезапную ишемическую смерть или временную ишемическую атаку), инсульт (например, острый ишемический инсульт крупного сосуда), атеросклероз, окклюзионную болезнь периферических артерий, венозную тромбоэмболию, венозный тромбоз, тромбоз глубоких вен, тромбофлебит, артериальную эмболию, коронарный артериальный тромбоз, церебральный артериальный тромбоз, церебральную эмболию, эмболию почки, легочную эмболию или тромбоз, возникающий при (а) искусственных клапанах или других имплантатах, (b) полостных катетерах, (c) стентах, (d) искусственном кровообращении, (e) гемодиализе или (f) других процедурах, при которых кровь подвергается воздействию искусственной поверхности, что способствует тромбозу.
В одном аспекте, настоящее изобретение относится к способу лечения терминальной стадии почечной недостаточности у субъекта, включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу профилактики терминальной стадии почечной недостаточности у субъекта, включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В одном аспекте, настоящее изобретение относится к способу снижения риска терминальной стадии почечной недостаточности у субъекта, включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, настоящее изобретение относится к способу лечения тромбоэмболического расстройства у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль), где субъект подвергается воздействию искусственной поверхности. В некоторых вариантах осуществления искусственная поверхность контактирует с кровью субъекта. В некоторых вариантах осуществления искусственной поверхностью является экстракорпоральная поверхность. В некоторых вариантах осуществления искусственной поверхностью является поверхность имплантируемого устройства, например, механического клапана. В некоторых вариантах осуществления искусственной поверхностью является поверхность диализного катетера. В некоторых вариантах осуществления искусственной поверхностью является поверхность системы искусственного кровообращения. В некоторых вариантах осуществления искусственной поверхностью является поверхность искусственного сердечного клапана. В некоторых вариантах осуществления искусственной поверхностью является поверхность желудочкового аппарата вспомогательного кровообращения. В некоторых вариантах осуществления искусственной поверхностью является поверхность трансплантата мелкого калибра. В некоторых вариантах осуществления искусственной поверхностью является поверхность центрального венозного катетера. В некоторых вариантах осуществления искусственной поверхностью является поверхность аппарата экстракорпоральной мембранной оксигенации (ЭКМО). В некоторых вариантах осуществления искусственная поверхность вызывает или связана с тромбоэмболическим расстройством. В некоторых вариантах осуществления тромбоэмболическим расстройством является венозная тромбоэмболия. В некоторых вариантах осуществления тромбоэмболическим расстройством является тромбоз глубоких вен. В некоторых вариантах осуществления тромбоэмболическим расстройством является легочная эмболия.
В другом аспекте, в настоящем изобретении представлен способ снижения риска тромбоэмболического расстройства у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль), где субъект подвергается воздействию искусственной поверхности. В некоторых вариантах осуществления искусственная поверхность контактирует с кровью субъекта. В некоторых вариантах осуществления искусственной поверхностью является экстракорпоральная поверхность. В некоторых вариантах осуществления искусственной поверхностью является поверхность имплантируемого устройства, например, механического клапана. В некоторых вариантах осуществления искусственной поверхностью является поверхность диализного катетера. В некоторых вариантах осуществления искусственной поверхностью является поверхность системы искусственного кровообращения. В некоторых вариантах осуществления искусственной поверхностью является поверхность искусственного сердечного клапана. В некоторых вариантах осуществления искусственной поверхностью является поверхность желудочкового аппарата вспомогательного кровообращения. В некоторых вариантах осуществления искусственной поверхностью является поверхность трансплантата мелкого калибра. В некоторых вариантах осуществления искусственной поверхностью является поверхность центрального венозного катетера. В некоторых вариантах осуществления искусственной поверхностью является поверхность аппарата экстракорпоральной мембранной оксигенации (ЭКМО). В некоторых вариантах осуществления, искусственная поверхность вызывает или связана с тромбоэмболическим расстройством. В некоторых вариантах осуществления тромбоэмболическим расстройством является венозная тромбоэмболия. В некоторых вариантах осуществления тромбоэмболическим расстройством является тромбоз глубоких вен. В некоторых вариантах осуществления тромбоэмболическим расстройством является легочная эмболия.
В другом аспекте, в настоящем изобретении представлен способ профилактики тромбоэмболического расстройства у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль), где субъект подвергается воздействию искусственной поверхности. В некоторых вариантах осуществления искусственная поверхность контактирует с кровью субъекта. В некоторых вариантах осуществления искусственной поверхностью является экстракорпоральная поверхность. В некоторых вариантах осуществления искусственной поверхностью является поверхность имплантируемого устройства, например, механического клапана. В некоторых вариантах осуществления искусственной поверхностью является поверхность диализного катетера. В некоторых вариантах осуществления искусственной поверхностью является поверхность системы искусственного кровообращения. В некоторых вариантах осуществления искусственной поверхностью является поверхность искусственного сердечного клапана. В некоторых вариантах осуществления искусственной поверхностью является поверхность желудочкового аппарата вспомогательного кровообращения. В некоторых вариантах осуществления искусственной поверхностью является поверхность трансплантата мелкого калибра. В некоторых вариантах осуществления искусственной поверхностью является поверхность центрального венозного катетера. В некоторых вариантах осуществления искусственной поверхностью является поверхность аппарата экстракорпоральной мембранной оксигенации (ЭКМО). В некоторых вариантах осуществления искусственная поверхность вызывает или связана с тромбоэмболическим расстройством. В некоторых вариантах осуществления тромбоэмболическим расстройством является венозная тромбоэмболия. В некоторых вариантах осуществления тромбоэмболическим расстройством является тромбоз глубоких вен. В некоторых вариантах осуществления тромбоэмболическим расстройством является легочная эмболия.
В другом аспекте, настоящее изобретение относится к способу лечения фибрилляцией предсердий, у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления субъект также нуждается в диализе, например, гемодиализе. В некоторых вариантах осуществления соединение, описанное в настоящем документе, вводят субъекту, пока субъект находится на диализе. В некоторых вариантах осуществления соединение или его фармацевтически приемлемую соль или композицию вводят субъекту до или после диализа. В некоторых вариантах осуществления, пациент имеет терминальную стадию почечной недостаточности. В некоторых вариантах осуществления не нуждается в диализе, например, гемодиализе. В некоторых вариантах осуществления у субъекта имеется высокий риск кровотечения. В некоторых вариантах осуществления фибрилляция предсердий связана с другим тромбоэмболическим расстройством, например, сгустком крови.
В другом аспекте, в настоящем изобретении представлен способ снижения риска фибрилляцией предсердий у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления субъект имеет высокий риск развития фибрилляции предсердий. В некоторых вариантах осуществления субъект также нуждается в диализе, например, гемодиализе. В некоторых вариантах осуществления соединение, описанное в настоящем документе, вводят субъекту, пока субъект находится на диализе. В некоторых вариантах осуществления соединение или его фармацевтически приемлемую соль или композицию вводят субъекту до или после диализа. В некоторых вариантах осуществления пациент имеет терминальную стадию почечной недостаточности. В некоторых вариантах осуществления не нуждается в диализе, например, гемодиализе. В некоторых вариантах осуществления у субъекта имеется высокий риск кровотечения. В некоторых вариантах осуществления фибрилляция предсердий связана с другим тромбоэмболическим расстройством, например, сгустком крови.
В другом аспекте, в настоящем изобретении представлен способ профилактики фибрилляцией предсердий у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления субъект имеет высокий риск развития фибрилляции предсердий. В некоторых вариантах осуществления субъект также нуждается в диализе, например, гемодиализе. В некоторых вариантах осуществления соединение, описанное в настоящем документе, вводят субъекту, пока субъект находится на диализе. В некоторых вариантах осуществления соединение или его фармацевтически приемлемую соль или композицию вводят субъекту до или после диализа. В некоторых вариантах осуществления пациент имеет терминальную стадию почечной недостаточности. В некоторых вариантах осуществления не нуждается в диализе, например, гемодиализе. В некоторых вариантах осуществления у субъекта имеется высокий риск кровотечения. В некоторых вариантах осуществления фибрилляция предсердий связана с другим тромбоэмболическим расстройством, например, сгустком крови.
В другом аспекте, настоящее изобретение относится к способу лечения вызванной гепарином тромбоцитопении у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, в настоящем изобретении представлен способ снижения риска вызванной гепарином тромбоцитопении у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, в настоящем изобретении представлен способ профилактики вызванной гепарином тромбоцитопении у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, настоящее изобретение относится к способу лечения вызванного гепарином тромбоза-тромбоцитопении у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, в настоящем изобретении представлен способ снижения риска вызванного гепарином тромбоза-тромбоцитопении у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, в настоящем изобретении представлен способ профилактики вызванного гепарином тромбоза-тромбоцитопении у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, в настоящем изобретении представлен способ профилактики тромбоэмболического расстройства у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль), где субъект имеет рак или проходит химиотерапию. В некоторых вариантах осуществления субъект одновременно получает химиотерапию. В некоторых вариантах осуществления субъект имеет повышенные уровни лактатдегидрогеназы. В некоторых вариантах осуществления тромбоэмболическим расстройством является венозная тромбоэмболия. В некоторых вариантах осуществления тромбоэмболическим расстройством является тромбоз глубоких вен. В некоторых вариантах осуществления тромбоэмболическим расстройством является легочная эмболия.
В другом аспекте, настоящее изобретение относится к способу лечения тромботической микроангиопатии у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления тромботической микроангиопатией является гемолитический уремический синдром (ГУС). В некоторых вариантах осуществления тромботической микроангиопатией является тромботическая тромбоцитопеническая пурпура (ТТП).
В другом аспекте, в настоящем изобретении представлен способ снижения риска тромботической микроангиопатии у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления тромботической микроангиопатией является гемолитический уремический синдром (ГУС). В некоторых вариантах осуществления тромботической микроангиопатией является тромботическая тромбоцитопеническая пурпура (ТТП).
В другом аспекте, в настоящем изобретении представлен способ профилактики тромботической микроангиопатии у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления тромботической микроангиопатией является гемолитический уремический синдром (ГУС). В некоторых вариантах осуществления тромботической микроангиопатией является тромботическая тромбоцитопеническая пурпура (ТТП).
В другом аспекте, в настоящем изобретении представлен способ профилактики рецидивирующей ишемии у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль), где субъект имеет острый коронарный синдром. В некоторых вариантах осуществления субъект имеет фибрилляцию предсердий. В некоторых вариантах осуществления субъект не имеет фибрилляцию предсердий. В другом аспекте, настоящее изобретение относится к способу лечения субъекта, идентифицированного как находящегося в группе риска, например, высокого риска инсульта (например, острого ишемического инсульта крупного сосуда) или тромбоза, снижающему вероятность инсульта (например, острого ишемического инсульта крупного сосуда) или тромбоза у субъекта. В некоторых вариантах осуществления субъекта, идентифицирован как находящийся в группе риска кровотечения (например, обильного кровотечения) или сепсиса. В некоторых вариантах осуществления лечение эффективно без кровотечения. В некоторых вариантах осуществления лечение эффективно для поддержания проходимости инфузионных портов и линий. Кроме того, соединения, описанные в настоящем документе (например, соединение 1), полезны для лечения и профилактики других заболеваний, в которых образование тромбина играет физиологическую роль. Например, тромбин вносит свой вклад в заболеваемость и смертность от хронических и дегенеративных заболеваний, таких как рак, артрит, атеросклероз, сосудистая деменция и болезнь Альцгеймера, благодаря своей способности регулировать множество различных типов клеток через специфическое расщепление и активацию поверхностноклеточного рецептора тромбина, митогенные эффекты, различные клеточные функции, такие как пролиферация клеток, например аномальная пролиферация сосудистых клеток, приводящая к рестенозу или ангиогенезу, высвобождение PDGF и синтез ДНК. Ингибирование Фактора XIa эффективно блокирует образование тромбина и, следовательно, нейтрализует любые физиологические эффекты тромбина на различные типы клеток. Типовые показания, описанные выше, включают некоторые, но не все, из потенциальных клинических ситуаций, поддающихся лечению ингибитором Фактора XIa.
В другом аспекте, настоящее изобретение относится к способу лечения субъекта, который имеет отек (например, ангионевротический отек, например, наследственный ангионевротический отек), включающему введение соединения 1 или его фармацевтически приемлемой соли или композиции, описанной в настоящем документе, например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль) субъекту.
В другом аспекте, в настоящем изобретении представлен способ профилактики отека (например, ангионевротического отека, например, наследственного ангионевротического отека), включающий введение соединения 1 или его фармацевтически приемлемой соли или композиции, описанной в настоящем документе, например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль) субъекту.
В другом аспекте, в настоящем изобретении представлен способ снижения риска отека (например, ангионевротического отека, например, наследственного ангионевротического отека), включающий введение соединения 1 или его фармацевтически приемлемой соли или композиции, описанной в настоящем документе, например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль) субъекту.
В другом аспекте, настоящее изобретение относится к способу ингибирования калликреина у субъекта, включающий введение субъекту с отеком (например, ангионевротическим отеком, например, наследственным ангионевротическим отеком), эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, настоящее изобретение относится к способу лечения тромбоэмболических последствий или осложнений у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления тромбоэмболическое последствие или осложнение связано с вмешательством на периферических сосудах (например, конечностей), гемодиализом, катетерной абляцией, цереброваскулярным вмешательством, трансплантацией органа (например, печени), хирургическим вмешательством (например, ортопедической операцией, операцией на легких, абдоминальной операцией или операцией на сердце (например, операцией на открытом сердце)), транскатетерной имплантацией аортального клапана, крупнокалиберным вмешательством, используемым для лечения аневризмы, чрескожным коронарным вмешательством или терапией гемофилии. В некоторых вариантах осуществления операцией является ортопедическая операцию, операция на легких, абдоминальная операцию или операция на сердце. В некоторых вариантах осуществления операцией на сердце является сложная операция на сердце или операция на сердце с низким риском. В некоторых вариантах осуществления тромбоэмболическое последствие или осложнение связано с чрескожным коронарным вмешательством.
В другом аспекте, в настоящем изобретении представлен способ профилактики тромбоэмболических последствий или осложнений у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления тромбоэмболическое последствие или осложнение связано с вмешательством на периферических сосудах (например, конечностей), гемодиализом, катетерной абляцией, цереброваскулярным вмешательством, трансплантацией органа (например, печени), хирургическим вмешательством (например, ортопедической операцией, операцией на легких, абдоминальной операцией или операцией на сердце (например, операцией на открытом сердце)), транскатетерной имплантацией аортального клапана, крупнокалиберным вмешательством, используемым для лечения аневризмы, чрескожным коронарным вмешательством или терапией гемофилии. В некоторых вариантах осуществления операцией является ортопедическая операцию, операция на легких, абдоминальная операцию или операция на сердце. В некоторых вариантах осуществления, операцией на сердце является сложная операция на сердце или операция на сердце с низким риском. В некоторых вариантах осуществления, тромбоэмболическое последствие или осложнение связано с чрескожным коронарным вмешательством.
В другом аспекте, в настоящем изобретении представлен способ снижения риска тромбоэмболических последствий или осложнений у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления тромбоэмболическое последствие или осложнение связано с вмешательством на периферических сосудах (например, конечностей), гемодиализом, катетерной абляцией, цереброваскулярным вмешательством, трансплантацией органа (например, печени), хирургическим вмешательством (например, ортопедической операцией, операцией на легких, абдоминальной операцией или операцией на сердце (например, операцией на открытом сердце)), транскатетерной имплантацией аортального клапана, крупнокалиберным вмешательством, используемым для лечения аневризмы, чрескожным коронарным вмешательством или терапией гемофилии. В некоторых вариантах осуществления операцией является ортопедическая операцию, операция на легких, абдоминальная операцию или операция на сердце. В некоторых вариантах осуществления,операцией на сердце является сложная операция на сердце или операция на сердце с низким риском. В некоторых вариантах осуществления тромбоэмболическое последствие или осложнение связано с чрескожным коронарным вмешательством.
В другом аспекте, в изобретении представлен способ лечения рестеноза после повреждения артерии у субъекта, включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления повреждение артерии возникает после стентирования краниальной артерии.
В другом аспекте, в настоящем изобретении представлен способ профилактики рестеноза после повреждения артерии у субъекта, включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления повреждение артерии возникает после стентирования краниальной артерии.
В другом аспекте, в настоящем изобретении представлен способ снижения риска рестеноза после повреждения артерии у субъекта, включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления повреждение артерии возникает после стентирования краниальной артерии.
В другом аспекте, настоящее изобретение относится к способу лечения тромбоза сосудов печени у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, в настоящем изобретении представлен способ профилактики тромбоза сосудов печени у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, в настоящем изобретении представлен способ снижения риска тромбоза сосудов печени у субъекта, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, настоящее изобретение относится к способу лечения инфаркта миокарда без повышения ST-сегмента или инфаркта миокарда с повышением ST-сегмента, включающему введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, в настоящем изобретении представлен способ профилактики инфаркта миокарда без повышения ST-сегмента или инфаркта миокарда с повышением ST-сегмента у субъекта, включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, в настоящем изобретении представлен способ снижения риска инфаркта миокарда без повышения ST-сегмента или инфаркта миокарда с повышением ST-сегмента у субъекта, включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль).
В другом аспекте, в настоящем изобретении представлен способ сохранения проходимости кровяных сосудов, включающий введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли, или композиции, описанной в настоящем документе (например, композиции, содержащей соединение 1 или его фармацевтически приемлемую соль). В некоторых вариантах осуществления субъект имеет острую почечную недостаточность. В некоторых вариантах осуществления субъект дополнительно получает непрерывную заместительную почечную терапию.
В некоторых вариантах осуществления любого из вышеизложенного, соединение, описанное в настоящем документе, или его композицию вводят перорально или парентерально. В некоторых вариантах реализации соединение или его композицию вводят перорально. В некоторых вариантах реализации соединение или его композицию вводят после того, как субъект прервал получение прямого перорального антикоагулянта. В некоторых вариантах реализации, субъект принимал прямой пероральный антикоагулянт в течение примерно 2,5 лет. В некоторых вариантах осуществления субъектом является млекопитающее, например, человек.
В некоторых вариантах осуществления способов, описанных в настоящем документе, фармацевтически приемлемой солью соединения является гидрохлорид. В некоторых вариантах осуществления соединение вводят субъекту внутривенно. В некоторых вариантах осуществления соединение вводят субъекту подкожно. В некоторых вариантах осуществления, соединение вводят субъекту в виде непрерывной внутривенной инфузии. В некоторых вариантах осуществления соединение вводят субъекту в виде болюса. В некоторых вариантах осуществления субъектом является человек. В некоторых вариантах осуществления субъект имеет повышенный риск тромбоэмболического расстройства. В некоторых вариантах осуществления тромбоэмболическое расстройство является результатом осложнения при хирургическом вмешательстве.
В некоторых вариантах осуществления субъект чувствителен или у него развилась чувствительность к гепарину. В некоторых вариантах осуществления субъект резистентен или у него развилась резистентность к гепарину.
В некоторых вариантах осуществления субъект находится в контакте с искусственной поверхностью в течение, по меньшей мере, 1 дня (например, примерно 2 дней, примерно 3 дней, примерно 4 дней, примерно 5 дней, примерно 6 дней, примерно 1 недели, примерно 10 дней, примерно 2 недель, примерно 3 недель, примерно 4 недель, примерно 2 месяцев, примерно 3 месяцев, примерно 6 месяцев, примерно 9 месяцев, примерно 1 года).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ. 1 изображен типовой спектр 1H ЯМР образца №4, полученного по методике из примера 1.
На ФИГ. 2 изображен типовой спектр 1H ЯМР образца №8, полученного по методике из примера 3, стадия 1.
На ФИГ. 3 изображен типовой спектр 1H ЯМР неочищенного продукта, полученного по методике из примера 3, стадия 2.
На ФИГ. 4 изображен типовой спектр 1H ЯМР очищенного продукта, полученного по методике из примера 3, стадия 2.
На ФИГ. 5 изображен типовой спектр 1H ЯМР продукта полученного по методике из примера 3, стадия 3.
На ФИГ. 6 изображен типовой спектр 1H ЯМР продукта, полученного по методике из примера 3, стадия 4.
На ФИГ. 7 изображен типовой спектр 13C ЯМР продукта, полученного по методике из примера 3, стадия 4.
На ФИГ. 8 изображено расширение спектра 13C ЯМР в области 105-180 м.д. с ФИГ. 7.
На ФИГ. 9 изображена типовая рентгенограмма XRPD для продукта, полученного по методике из примера 3, стадия 4.
На ФИГ. 10 изображен градиент давления на мембранном оксигенаторе для эксперимента по искусственному кровообращению, проводимого в модели на гончей собаке.
На ФИГ. 11 изображено сравнение соотношения концентраций в плазме и активированного частичного тромбопластинового времени (аЧТВ), измеренное в модели на гончей собаке.
На ФИГ. 12 изображено активированное частичное тромбопластиновое время (аЧТВ) измеренное в модели на гончей собаке поле введения соединения 1.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Используемый в настоящем документе термин «перемешиваемый» относится к любому движению макроскопического компонента реакционной смеси, которое индуцируется извне, относительно другого макроскопического компонента реакционной смеси. Используемый в настоящем документе термин «перемешивание» относится к любому движению макроскопического компонента реакционной смеси, которое вызывается извне с помощью перемешивающего устройства, относительно другого макроскопического компонента реакционной смеси, например, индукционному перемешиванию, и может включать обычные процедуры внутреннего перемешивания, известные специалисту в данной области техники. В настоящем документе, «XRPD» относится к порошковой рентгеновской дифракции.
Используемый в настоящем документе термин «суспендирование» относится к способу, при котором соединение, описанное в настоящем документе, суспендируют в растворителе (например, полярном апротонном растворителе или не полярном растворителе) и снова собирают (например, фильтрацией) после перемешивания суспензии.
Используемый в настоящем документе термин «кристаллическое» относится к твердому веществу, имеющему высоко регулярную химическую структуру. Молекулы расположены регулярным, периодическим образом в трехмерном пространстве решетки.
Термин «по существу кристаллическая» относится к формам, которые могут быть кристаллическими, по меньшей мере, до конкретного массового процента. Конкретные массовые проценты составляют 70%, 75%, 80%, 85%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98. %, 99%, 99,5%, 99,9% или любой процент от 70% до 100%. В некоторых вариантах осуществления конкретный массовый процент кристалличности составляет, по меньшей мере, 90%. В некоторых других вариантах осуществления конкретный массовый процент кристалличности составляет, по меньшей мере, 95%. В некоторых вариантах осуществления соединение 1 может представлять собой по существу кристаллический образец любой из кристаллических твердых форм, описанных в настоящем документе.
Термин «по существу чистая» относится к составу конкретной кристаллической твердой формы соединения 1, которая может быть, по меньшей мере, на определенный массовый процент свободной от примесей и/или других твердых форм соединения 1 или его фармацевтически приемлемой соли. Конкретные массовые проценты составляют 70%, 75%, 80%, 85%, 90%, 95%, 99% или любой процент от 70% до 100%. В некоторых вариантах осуществления кристаллическая твердая форма соединения 1 или его фармацевтически приемлемой соли, как описано в настоящем документе, является по существу чистой при массовом проценте от 95% до 100%, например, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99% или примерно 99,9%.
В контексте настоящего документа, если не указано иное, термины «лечить», «лечение» и «лечение» подразумевают действие, которое происходит, когда субъект страдает указанным заболеванием, расстройством или состоянием, которое снижает тяжесть заболевания, расстройства или состояния или затормаживает или замедляет прогрессирование заболевания, расстройства или состояния (также «терапевтическое лечение»).
В контексте настоящего документа, и если не указано иное, «терапевтически эффективное количество» соединения представляет собой количество, достаточное для обеспечения терапевтического эффекта при лечении заболевания, расстройства или состояния, или для отсрочки или минимизации одного или нескольких симптомов, связанных с заболеванием, расстройством или состоянием. Терапевтически эффективное количество соединения означает количество терапевтического агента, отдельно или в комбинации с другими терапиями, которое обеспечивает терапевтический эффект при лечении заболевания, расстройства или состояния. Термин «терапевтически эффективное количество» может включать количество, которое улучшает общую терапию, уменьшает или устраняет симптомы или причины заболевания или состояния или увеличивает терапевтическую эффективность другого терапевтического агента.
В контексте настоящего документа, и если не указано иное, «профилактически эффективное количество» соединения представляет собой количество, достаточное для профилактики заболевания, расстройства или состояния, или одного или нескольких симптомов, связанных с заболеванием, расстройством или состоянием, или профилактики его повторения. Профилактически эффективное количество соединения означает количество терапевтического агента, отдельно или в комбинации с другими агентами, которое обеспечивает профилактический эффект при профилактике заболевания, расстройства или состояния. Термин «профилактически эффективное количество» может включать количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического агента.
Заболевание, расстройство или состояние применяются взаимозаменяемо в настоящем документе.
«Субъект», которому предполагается введение, включает, но не ограничивается ими, человека (например, мужчину или женщину любой возрастной группы, например, педиатрического субъекта (например, младенца, ребенка, подростка) или взрослого субъекта (например, молодой взрослого, взрослого среднего возраста или пожилого взрослого)) и/или животное, не относящееся к человеку, например, млекопитающее, такое как приматы (например, яванские макаки, макаки-резус), крупный рогатый скот, свиньи, лошади, овцы, козы, грызуны, кошки и/или собаки. В некоторых вариантах осуществления субъектом является человек. В некоторых вариантах осуществления субъект не является человеком. В некоторых вариантах осуществления педиатрический субъект находится в возрасте от 0 до 18 лет. В некоторых вариантах осуществления взрослый субъект имеет возраст старше 18 лет.
Используемый в настоящем документе термин «искусственная поверхность» относится к любой поверхности, не относящейся к человеку или животному, которая вступает в контакт с кровью субъекта, например, во время медицинской процедуры. Это может быть сосуд для сбора или циркуляции крови субъекта вне тела субъекта. Также это может быть стент, клапан, внутрипросветный катетер или система для перекачивания крови. В качестве неограничивающего примера, такие искусственные поверхности могут быть из стали, любого типа пластика, стекла, силикона, резины и т.д. В некоторых вариантах осуществления искусственная поверхность подвергается воздействию, по меньшей мере, 50%, 60%, 70%, 80%, 90% или 100% крови субъекта.
Используемый в настоящем документе термин «кондиционирование» или «кондиционированная» в отношении искусственной поверхности относится к грунтовке или промыванию искусственной поверхности (например, экстракорпоральной поверхности) с помощью соединения, описанного в настоящем документе (например, соединения 1) или его фармацевтически приемлемой соли, уже в грунтовочном или промывочном растворе (например, крови, солевом растворе, растворе Рингера) или в виде отдельного введения на искусственную поверхность до, во время или после медицинской процедуры.
Соединения
В настоящем документе описаны соединения, которые ингибируют Фактор XIa или калликреин.
В одном аспекте, настоящее изобретение относится к соединению 1:
 (Соединение 1)
(Соединение 1)
или его фармацевтически приемлемой соли, например, гидрохлориду соединения 1. В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемая соль является кристаллическим. В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемая соль существует в виде по существу чистой кристаллической твердой формы.
В одном аспекте, в настоящем документе представлена фармацевтически приемлемая соль формулы (I):
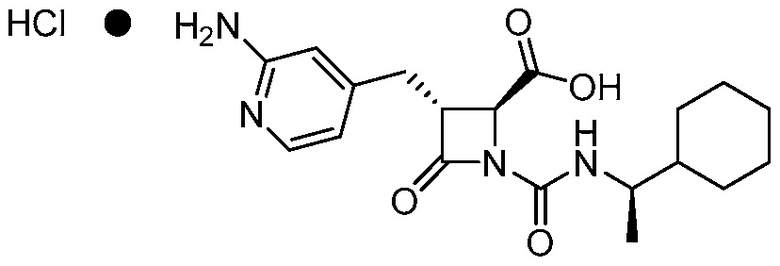 (I)
(I)
Фармацевтически приемлемой солью формулы (I) является гидрохлорид соединения 1, также называемый в настоящем документе соединение 1•HCl. В некоторых вариантах осуществления соединение 1•HCl является кристаллическим. В некоторых вариантах осуществления соединение 1•HCl существует в виде по существу чистой кристаллической твердой формы. В некоторых вариантах осуществления соединение 1•HCl имеет рентгенограмму XRPD по существу как изображена на ФИГ. 9.
В одном аспекте, в настоящем документе представлена кристаллическая фармацевтически приемлемая соль формулы (I):
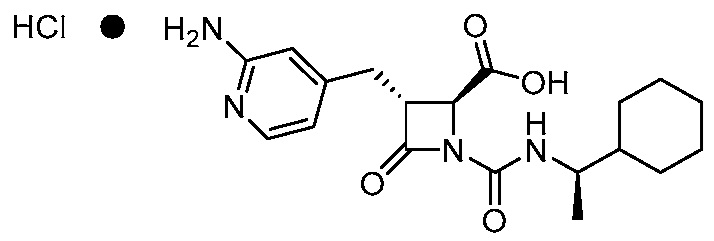 (I).
(I).
В некоторых вариантах осуществления соединение, описанное в настоящем документе, преобразовано в соль. Соединение, описанное в настоящем документе, можно вводить в виде свободной кислоты, цвиттериона или соли. Соль также может быть образована между катионом и отрицательно заряженным заместителем в соединении, описанном в настоящем документе, например, группе депротонированной карбоновой кислоты соединения 1. Подходящие катионные противоионы включают ионы натрия, ионы калия, ионы магния, ион кальция и ионы аммония (например, катион тетраалкиламмония, такой как ион тетраметиламмония). В кислотно-аддитивных солях, соль может быть образована между анионом и положительно заряженным заместителем (например, аминогруппой) или основным заместителем (например, пиридилом) в соединении, описанном в настоящем документе. Подходящие анионы включают хлорид, бромид, йодид, сульфат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат и ацетат.
Фармацевтически приемлемые соли соединений, описанных в настоящем документе (например, фармацевтически приемлемые соли соединения 1), также включают соли, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислотных солей включают ацетат, 4-ацетамидобензоат, адипат, альгинат, 4-аминосалицилат, аспартат, аскорбат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, карбонат, циннамат, цикламат, деканоат, декандиоат, 2,2-дихлорацетат, диглюконат, додецилсульфат, этансульфонат, этан-1,2-дисульфонат, формиат, фумарат, галактарат, глюкогептаноат, глюконат, глюкогептонат, глюкуронат, глутамат, глутарат, глицерофосфат, гликолят, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидроиодид, 1-гидрокси-2-нафтоат, 2-гидроксиэтансульфонат, изобутират, лактат, лактобионат, лаурат, малат, малеат, малонат, миндалят, метансульфонат, нафталин-1,5-дисульфонат, 2-нафталинсульфонат, никотинат, нитрат, октаноат, олеат, оксалат, 2-оксоглутарат, пальмитат, пальмоат, пектинат, 3-фенилпропионат, фосфат, фосфонат, пикрат, пивалат, пропионат, пироглутамат, салицилат, себакат, сукцинат, стеарат, сульфат, тартрат, тиоцианат, толуолсульфонат, тозилат и ундеканоат.
Соли, полученные из соответствующих оснований, включают соли щелочных металлов (например, натрия), щелочноземельных металлов (например, магния), аммония и (алкил)4N+. Настоящее изобретение также предусматривает кватернизацию любых основных азотсодержащих групп соединений, описанных в настоящем документе. Путем такой кватернизации можно получить продукты, растворимые или диспергируемые в воде или масле.
В настоящем документе, соединения по настоящему изобретению, включая соединение 1, определены как включающие их фармацевтически приемлемые производные или пролекарства. «Фармацевтически приемлемое производное или пролекарство» означает любую фармацевтически приемлемую соль, сложный эфир, соль сложного эфира или другое производное соединения по настоящему изобретению, которое при введении реципиенту способно предоставлять (прямо или косвенно) соединение по настоящему изобретению. Особенно предпочтительными производными и пролекарствами являются такие, которые увеличивают биодоступность соединений по настоящему изобретению, когда такие соединения вводят млекопитающему (например, позволяя перорально введенному соединению более легко всасываться в кровь) или которые улучшают доставку исходного соединения в биологический компартмент (например, мозг или лимфатическую систему) относительно исходных видов. Предпочтительные пролекарства включают производные, в которых группа, которая усиливает растворимость в воде или активный транспорт через кишечную мембрану, добавлена к структуре формулы, описанной в настоящем документе.
Любая формула или соединение, описанные в настоящем документе, также предназначены для представления не меченых форм, а также изотопно-меченых форм соединений, меченые изотопами соединения имеют структуры, изображенные формулами, приведенными в настоящем документе, за исключением того, что один или несколько атомов замещены атомом, имеющим выбранную атомную массу или массовое число. Примеры изотопов, которые могут быть введены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 11C, 13C, 14C, 15N, 18F, 51P, 32P, 35S, 36Cl, 125I, соответственно. Изобретение включает различные меченые изотопами соединения, как определено в настоящем документе, например те, в которых присутствуют радиоактивные изотопы, такие как 3H, 13C и 14C. Такие меченые изотопами соединения полезны в исследованиях метаболизма (с 14C), исследованиях кинетики реакций (например, с 'H или 3H), в способах обнаружения или визуализации, таких как позитронно-эмиссионная томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОФЭКТ), включая анализы распределения лекарств или субстратов в тканях, или при радиоактивном лечении пациентов. В частности, 18F или меченое соединение могут быть особенно желательными для исследований ПЭТ или ОФЭКТ, меченые изотопами соединения по настоящему изобретению и их пролекарства обычно могут быть получены путем проведения процедур, описанных на схемах или в примерах и примерах получения, описанных ниже, путем замещения легкодоступным изотопно-меченым реагентом не изотопно-меченого реагента.
Кроме того, замещение более тяжелыми изотопами, в частности дейтерием (т.е. 2H или D), может дать определенные терапевтические преимущества, обусловленные большей метаболической стабильностью, например, увеличение периода полужизни in vivo или снижение требований к дозировке или улучшение терапевтического индекса. Понятно, что дейтерий в этом контексте рассматривается как заместитель соединения формулы, описанной в настоящем документе. Концентрация такого более тяжелого изотопа, в частности дейтерия, может определяться коэффициентом изотопного обогащения. Термин «коэффициент изотопного обогащения», используемый в настоящем документе, означает соотношение между распространенностью изотопа и распространенностью указанного изотопа в природе. Если заместителем в соединении по настоящему изобретению является дейтерий, такое соединение имеет коэффициент изотопного обогащения для каждого обозначенного атома дейтерия, по меньшей мере, 3500 (52,5% введения дейтерия в каждый обозначенный атом дейтерия), по меньшей мере, 4500 (67,5% введения дейтерия), по меньшей мере, 5000 (75% введения дейтерия), по меньшей мере, 5500 (82,5% введения дейтерия), по меньшей мере, 6000 (90% введения дейтерия), по меньшей мере, 6333,3 (95% введения дейтерия), по меньшей мере, 6466,7 (97% введения дейтерия), по меньшей мере, 6600 (99% введения дейтерия) или, по меньшей мере, 8633,3 (99,5% введения дейтерия).
Меченые изотопами соединения, описанные в настоящем документе, обычно могут быть получены обычными методами, известными специалистам в данной области техники, или способами, аналогичными тем, которые описаны в прилагаемых примерах и примерах получения, с использованием подходящих меченых изотопами реагентов вместо не меченого реагента, применяемого ранее. Фармацевтически приемлемые сольваты в соответствии с изобретением включают такие, в которых растворитель кристаллизации может быть изотопно замещенным, например, D2O, D6-ацетон, D6-ДМСО.
Любой асимметричный атом (например, углерод или подобный) соединения по настоящему изобретению может присутствовать в рацемической или энантиомерно обогащенной, например, (R)-, (S)- или (RS)- конфигурации, в определенных вариантах осуществления, где каждый асимметричный атом имеет, по меньшей мере, 50% энантиомерный избыток, по меньшей мере, 60% энантиомерный избыток, по меньшей мере, 70% энантиомерный избыток, по меньшей мере, 80% энантиомерный избыток, по меньшей мере, 90% энантиомерный избыток, по меньшей мере, 95% энантиомерный избыток или, по меньшей мере, 99% энантиомерный избыток в (R)- или (S)- конфигурации. Заместители на атомах с ненасыщенными связями могут, если возможно, присутствовать в цис-(Z)- или транс-(E)- форме. Соответственно, как используется в настоящем документе, соединение по настоящему изобретению может быть в форме одного из возможных изомеров, ротамеров, атропоизомеров, таутомеров или их смесей, например, в виде по существу чистых геометрических (цис или транс) изомеров, диастереомеров, оптических изомеров (антиподов), рацематов или их смесей. Любые полученные смеси изомеров могут быть разделены на основе физико-химических различий компонентов на чистые или по существу чистые геометрические или оптические изомеры, диастереомеры, рацематы, например, с помощью хроматографии или фракционной кристаллизации.
Любые полученные рацематы конечных продуктов или промежуточных продуктов могут быть разделены на оптические антиподы известными способами, например, разделением их диастереомерных солей, полученных с оптически активной кислотой или основанием, и высвобождением оптически активного кислотного или основного соединения. Таким образом, кислотная группа может применяться для разделения соединений по настоящему изобретению на их оптические антиподы, например, фракционной кристаллизацией соли, образованной с оптически активной кислотой, например, винной кислотой, дибензоилвинной кислотой, диацетилвинной кислотой, (+)-O, O'-ди-п-толуоил-D-винной кислотой, миндальной кислотой, яблочной кислотой или камфор-10-сульфоновой кислотой. Рацемические продукты также могут быть разделены с помощью хиральной хроматографии, например, жидкостной хроматографии высокого давления (ЖХВД) с использованием хирального адсорбента.
Соединения, описанные в настоящем документе (например, соединение 1), также могут быть представлены во множестве таутомерных форм. В таких случаях изобретение намеренно включает все таутомерные формы соединений, описанных в настоящем документе. Все кристаллические формы соединений, описанных в настоящем документе, намеренно включены в это изобретение.
Соединение, описанное в настоящем документе (например, соединение 1), могут быть оценены на предмет его способности модулировать (например, ингибировать) Фактор XIa или калликреин.
Надлежащая производственная практика
Надлежащая производственная практика (НПП) относится ко всем применимым стандартам, относящимся к производству фармацевтических продуктов, поскольку они применяются к производству поставляемого материала, и включает (i) стандарты, опубликованные любым регулирующим органом, обладающим юрисдикцией в отношении производства поставляемого материала, в форме Применимых законов, включая действующие правила Надлежащей производственной практики США, принятые FDA, как описано в 21 USC 351, 21 C.F.R. части 210 и 211 с поправками, а также любые последующие положения к ним и ICH Q7 - Good Manufacturing Practice for Active Pharmaceutical Ingredients; (ii) стандарты, опубликованные любым регулирующим органом, обладающим юрисдикцией в отношении производства поставляемого материала, в форме проектов или окончательных руководящих документов (включая консультативные заключения, руководства по политике соответствия и методические указания); и (iii) подобные другие отраслевые стандарты, которые могут быть согласованы Сторонами в Спецификациях (как они определены и изложены в Соглашении о качестве).
Способы синтеза соединений
Соединения, описанные в настоящем документе, могут быть синтезированы не ограничивающими обычными способами с применением коммерчески доступных исходных материалов и реагентов. Например, соединения могут быть синтезированы с применением способов, указанных в патенте США № 7,501,404, который включен в настоящий документ посредством ссылки, или с применением способов, описанных в примерах в настоящем документе.
Соединения, описанные в настоящем документе, могут быть очищены с использованием различных методов синтетической органической химии. Соединение, описанное в настоящем документе, например, соединение любой формулы I, II, III, IV, V, VI или VII, может быть очищено с использованием одного или нескольких хроматографических способов, например, колоночной хроматографии или ЖХВД. Соединение, описанное в настоящем документе, например, соединение любой формулы I, II, III, IV, V, VI или VII, может быть очищено способом очистки, который не является хроматографией, например, перекристаллизацией или суспендированием. В одном варианте соединение, описанное в настоящем документе, можно очистить с помощью перекристаллизации. В другом варианте соединение, описанное в настоящем документе, также может быть очищено путем суспендирования.
В некоторых вариантах осуществления, соединение, описанное в настоящем документе, которое было очищено хроматографией, также может быть очищено перекристаллизацией. Соединение, описанное в настоящем документе, также может быть очищено суспендированием (или ресуспендированием) соединения с одним или несколькими растворителями, например, суспензией, описанной в настоящем документе. Соединение, описанное в настоящем документе, также может быть очищено растиранием с одним или несколькими растворителями, например, растиранием, описанным в настоящем документе. Например, соединение, описанное в настоящем документе, которое было очищено хроматографией, также может быть очищено растиранием. В химическом реакторе на процесс растирания может влиять суспендирование или ресуспендирование твердого продукта в растворителе или смеси растворителей при механическом перемешивании. В одном из вариантов осуществления, соединение, описанное в настоящем документе, также может быть очищено осаждением из раствора с использованием одного или более антирастворителей. Например, соединение, описанное в настоящем документе, которое было очищено хроматографией, также может быть очищено осаждением. В одном варианте осуществления, соединение, описанное в настоящем документе, очищают хроматографией с псевдодвижущимся слоем (ПДС). В одном варианте осуществления, соединение, описанное в настоящем документе, очищают с помощью сверхкритической жидкостной хроматографии, например, сверхкритической жидкостной хроматографии с жидким диоксидом углерода. В одном варианте осуществления, соединение, описанное в настоящем документе, очищают хиральной хроматографией, например, жидкостной хроматографией высокого давления (ЖХВД) с использованием хирального адсорбента.
В одном аспекте, в настоящем документе предоставлен способ получения фармацевтически приемлемой соли формулы (I):
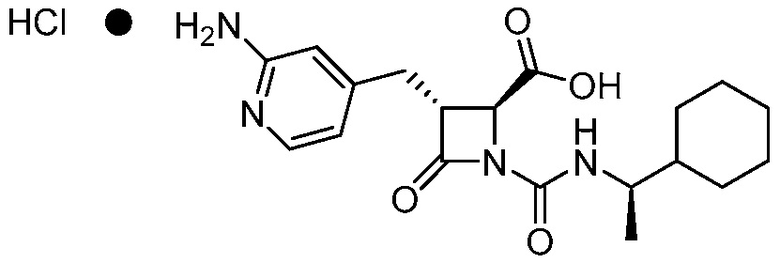 (I)
(I)
или ее сольвата (например, гидрата), включающий растворение соли формулы (II)
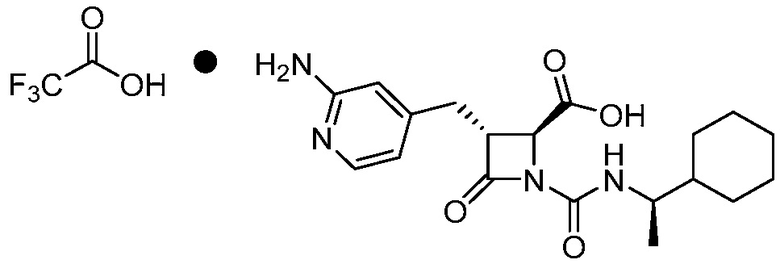 (II)
(II)
или ее сольвата (например, гидрата) в растворителе, с получением первого раствора, и добавление хлороводорода к первому раствору с получением фармацевтически приемлемой соли формулы (I).
В некоторых вариантах осуществления соль формулы (II) растворяют в апротонном растворителе. В некоторых вариантах осуществления растворитель содержит (например, состоит или состоит по существу из) ацетонитрила. В некоторых вариантах осуществления хлороводород добавляют в первый раствор барботированием газа HCl в первый раствор или добавлением отдельного раствора, содержащего HCl (например, эфирного раствора хлористоводородной кислоты) в первый раствор.
В некоторых вариантах осуществления исходное количество соли формулы (II) или ее сольвата (например, гидрата) больше или равно 500 граммам. В некоторых вариантах осуществления исходное количество соли формулы (II) или ее сольвата (например, гидрата) больше или равно 1 килограмму. В некоторых вариантах осуществления способ дает более 300 граммов (например, более примерно 350 граммов (например, примерно 368 граммов)) фармацевтически приемлемой формулы соли (I) или ее сольвата (например, гидрата).
В некоторых вариантах осуществления способ дает фармацевтически приемлемую соль формулы (I) или ее сольват (например, гидрат) с выходом более примерно 50% (примерно 55% выходом). В некоторых вариантах осуществления способ дает фармацевтически приемлемую соль формулы (I) или ее сольват (например, гидрат) с выходом более примерно 75%. В некоторых вариантах осуществления способ дает фармацевтически приемлемую соль формулы (I) или ее сольват (например, гидрат) с выходом более примерно 90%. В некоторых вариантах осуществления, способ дает фармацевтически приемлемую соль формулы (I) или ее сольват (например, гидрат) с выходом более примерно 99%. В некоторых вариантах осуществления чистота фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) составляет примерно 80%. В некоторых вариантах осуществления чистота фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) составляет примерно 81%.
В некоторых вариантах осуществления способ дополнительно включает очистку фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) растворением фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) в растворителе (например, изопропиловом спирте) с последующим осаждением растворенной фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) с использованием другого растворителя (например, метил-трет-бутилового эфира). В некоторых вариантах осуществления чистота фармацевтически приемлемой формулы (I) или ее сольвата (например, гидрата) после осаждения составляет более 98%. В некоторых вариантах осуществления чистота фармацевтически приемлемой формулы (I) или ее сольвата (например, гидрата) после осаждения составляет примерно 98%.
В некоторых вариантах осуществления способ дополнительно включает очистку фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) суспендированием фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) в растворителе (например, изопропиловом спирте) с последующей фильтрацией фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) для отделения фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) от растворителя. В некоторых вариантах осуществления чистота фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) после суспендирования и отделения составляет более 98%. В некоторых вариантах осуществления чистота фармацевтически приемлемой соли формулы (I) или ее сольвата (например, гидрата) после суспендирования и отделения составляет примерно 98%.
В некоторых вариантах осуществления способ включает получение соли формулы (II) контактированием соединения формулы (III)
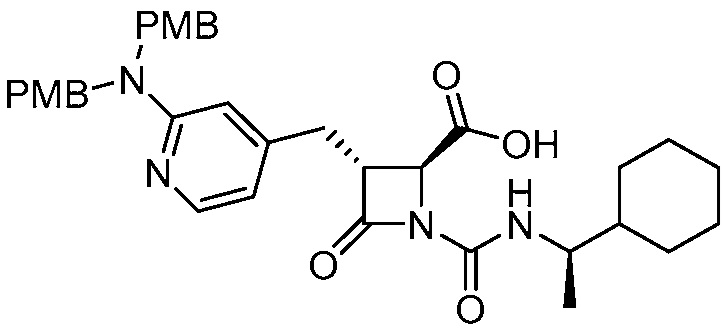 (III)
(III)
с трифторуксусной кислотой.
В некоторых вариантах осуществления способ дополнительно включает контакт соединения формулы (III) с силаном (например, триэтилсиланом).
В некоторых вариантах осуществления способ дает более 500 граммов соединения формулы (III) (например, более 1 кг).
В некоторых вариантах осуществления способ включает получение соединения формулы (III) контактированием соединения формулы (IV)
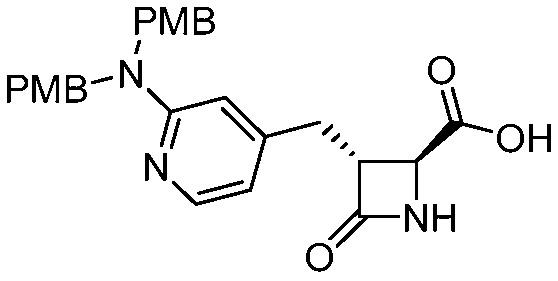 (IV)
(IV)
с соединением формулы (V)
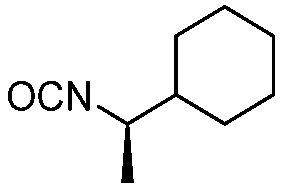 (V).
(V).
В некоторых вариантах осуществления способ дает более 1 килограмма соединения формулы (III) (например, примерно 1,3 кг). В некоторых вариантах осуществления способ проводят в присутствии растворителя. В некоторых вариантах осуществления способ проводят в присутствии основания, (например, 1,8-диазабицикло(5.4.0)ундец-7-ена).
В некоторых вариантах осуществления способ включает получение соединения формулы (IV) контактированием соединения формулы (VI)
 (VI)
(VI)
с соединением формулы (VII)
 (VII).
(VII).
В некоторых вариантах осуществления способ дает более 500 граммов соединения формулы (IV) (например, более 900 граммов).
В некоторых вариантах осуществления соединение формулы (III) очищают способом очистки, который не является хроматографией. В некоторых вариантах осуществления способ очистки включает суспендирование соединения формулы (III) в растворителе (например, гептане) с последующей фильтрацией соединения формулы (III) для отделения соединения формулы (III) от растворителя. В некоторых вариантах осуществления чистота соединения формулы (III) составляет более 90%.
В некоторых вариантах осуществления соединение формулы (I) очищают способом очистки, который не является хроматографией.
Способы лечения, профилактики или снижения риска
Соединения, описанные в настоящем документе (например, соединение 1 или его фармацевтически приемлемая соль), могут ингибировать Фактор XIa или калликреин. В некоторых вариантах осуществления, соединение, описанное в настоящем документе, может ингибировать как Фактор XIa, так и калликреин. В результате эти соединения могут быть полезны для лечения, профилактики или снижения риска расстройства, описанного в настоящем документе.
Типовые расстройства включают тромботические события, связанные с коронарной артерией и цереброваскулярным заболеванием, венозный или артериальный тромбоз, синдромы коагуляции, ишемиею (например, коронарную ишемию) и стенокардию (стабильную и нестабильную), тромбоз глубоких вен (ТГВ), тромбоз печеночной вены, диссеминированную внутрисосудистую коагулопатию, синдром Касабаха-Мерритта, легочную эмболию, инфаркт миокарда (например, инфаркт миокарда с повышением ST-сегмента или инфаркт миокарда без повышения ST-сегмента (например, инфаркт миокарда без повышения ST-сегмента до катетеризации), инфаркт мозга, церебральный тромбоз, временные ишемические атаки, фибрилляциею предсердий (например, неклапанную фибрилляцию предсердий), церебральную эмболию, тромбоэмболические осложнения хирургических вмешательств (например, замены тазобедренного или коленного сустава, ортопедической хирургии, кардиохирургии, хирургии легких, абдоминальной хирургии или эндартерэктомии) и закупоривание периферических артерий, а также могут быть полезны при лечении или профилактике инфаркта миокарда, инсульта (например, острого ишемического инсульта крупного сосуда), стенокардии и других последствий обрыва атеросклеротических бляшек. Соединения по настоящему изобретению, обладающие активностью ингибирования Фактора XIa или калликреина, также могут быть полезны для профилактики тромбоэмболических расстройств, например, венозных тромбоэмболий у онкологических пациентов, в том числе получающих химиотерапию, и/или пациентов с повышенным уровнем лактатдегидрогеназы (ЛДГ), а также для профилактики тромбоэмболических явлений во время или после восстановления проходимости кровеносных сосудов с применением активатора плазминогена тканей или механического способа. Соединения по изобретению, обладающие активностью ингибирования Фактора XIa или калликреина, также могут быть полезны в качестве ингибиторов свертывания крови, например, во время приготовления, хранения и фракционирования цельной крови. Кроме того, соединения, описанные в настоящем документе, можно использовать в больницах неотложной помощи или перипроцедурно, когда пациент подвержен риску тромбоэмболического расстройства или осложнения, а также у пациентов, которые находятся в состоянии повышенной коагуляции, например, у онкологических больных.
Ингибирование Фактора XIa согласно настоящему изобретению может быть более эффективным и безопасным способом ингибирования тромбоза по сравнению с ингибированием других сериновых протеаз свертывания, таких как тромбин или Фактор Xa. Введение низкомолекулярного ингибитора Фактора XIa должно иметь эффект ингибирования образования тромбина и образования сгустков, при этом не влияя или по существу не влияя на время кровотечения и незначительно или не ухудшая гемостаз. Эти результаты существенно отличаются от результатов других ингибиторов протеазы «прямого действия» (например, ингибиторов активного центра тромбина и Фактора Xa), которые демонстрируют увеличение времени кровотечения и меньшее разделение между антитромботической эффективностью и увеличением времени кровотечения. Предпочтительный способ по изобретению включает введение млекопитающему фармацевтической композиции, содержащей, по меньшей мере, одно соединение по изобретению.
Соединения, описанные в настоящем документе (например, соединение 1 или его фармацевтически приемлемые соли), могут ингибировать калликреин. В результате эти соединения могут быть полезны для лечения, профилактики или снижения риска заболеваний, связанных с воспалением, таких как отек (например, отек мозга, отек желтого пятна и ангионевротический отек (например, наследственный ангионевротический отек)). В некоторых вариантах осуществления соединения по изобретению могут быть полезны при лечении или профилактике наследственного ангионевротического отека. Соединения, описанные в настоящем документе (например, соединение 1), также могут быть полезны для лечения, профилактики или снижения риска, например, инсульта, ишемии (например, коронарной ишемии) и периоперационной кровопотери, например, Соединение 1 или его фармацевтически приемлемые соли. Способы по настоящему изобретению полезны для лечения или профилактики таких состояний, которые включают действие Фактора XIa или калликреина. Соответственно, способы по настоящему изобретению полезны при лечении последствий отрыва атеросклеротической бляшки, включая сердечнососудистые заболевания, связанные с активацией каскада коагуляции в тромботических или тромбофильных состояниях.
Более конкретно, способы по настоящему изобретению могут применяться для лечения, профилактики или снижения риска острых коронарных синдромов, таких как ишемическая болезнь сердца, инфаркт миокарда, нестабильная стенокардия (включая нарастающую стенокардию), ишемия (например, ишемия, возникающая при закупорке сосудов) и инфаркт мозга. Способы по настоящему изобретению, кроме того, могут быть полезны для лечения, профилактики или снижения риска инсульта (например, острого ишемического инсульта крупного сосуда) и связанных с ними сосудистых заболеваний головного мозга (включая нарушение мозгового кровообращения, сосудистую деменцию и временную ишемическую атаку); венозного тромбоза и тромбоэмболии, такой как тромбоз глубоких вен (ТГВ) и легочная эмболия; тромбоза, связанного с фибрилляцией предсердий, увеличением желудочков, дилатационной сердечной миопатией или сердечной недостаточностью; заболевания периферических артерий и перемежающейся хромоты; образования атеросклеротических бляшек и атеросклероза трансплантата; рестеноза после повреждения артерии, вызванного эндогенно (отрыва атеросклеротической бляшки) или экзогенно (инвазивными кардиологическими процедурами, такими как повреждение стенки сосуда в результате ангиопластики или посткраниального стентирования артерии); диссеминированной внутрисосудистой коагулопатии, синдрома Касабаха-Мерритта, церебрального тромбоза и церебральной эмболии.
Кроме того, способы по настоящему изобретению могут применяться для лечения, профилактики (например, предотвращения) или снижения риска тромбоэмболических последствий или осложнений, связанных с раком, тромбэктомией, хирургическим вмешательством (например, протезированием тазобедренного сустава, ортопедической хирургией), эндартерэктомией, введением искусственных сердечных клапанов, вмешательством на периферических сосудах (например, конечностей), цереброваскулярными вмешательствами, вмешательствами большого диаметра, используемыми при лечении аневризм, сосудистыми трансплантатами, механическими органами и имплантацией (например, транскатетерной имплантацией аортального клапана) или трансплантацией органов (например, трансплантацией печени), ткани или клеток); чрескожными коронарными вмешательствами; катетерной аблацией; терапией гемофилии; гемодиализом; лекарственными средствами (такими как активатор плазминогена тканей или аналогичные агенты и хирургическим восстановлением проходимости кровеносных сосудов) у пациентов, страдающих инфарктом миокарда, инсультом (например, острым ишемическим инсультом крупного сосуда), легочной эмболией и подобными состояниями; лекарственными средствами (такими как пероральные контрацептивы, заместительная гормонотерапия и гепарин, например, для лечения тромбоцитопении, вызванной гепарином); сепсисом (например, сепсисом, связанным с диссеминированным внутрисосудистым свертыванием); беременностью или родами; и другими хроническими заболеваниями. Способы по настоящему изобретению могут применяться для лечения тромбоза, вызванного ограничением свободы (например, иммобилизацией, госпитализацией, постельным режимом или иммобилизацией конечностей, например, с помощью иммобилизующих повязок и т. д.). В некоторых вариантах осуществления, тромбоэмболическое последствие или осложнение связано с чрескожным коронарным вмешательством.
Кроме того, соединения, описанные в настоящем документе (например, соединение 1), или их фармацевтически приемлемые соли или их композиции могут быть полезны для лечения, профилактики и снижения риска тромбоэмболического расстройства, например, венозной тромбоэмболии, тромбоза глубоких вен или легочной эмболии, или сопутствующего осложнения у субъекта, где субъект подвергается воздействию искусственной поверхности. Искусственная поверхность может контактировать с кровью субъекта, например, как экстракорпоральная поверхность или поверхность имплантируемого устройства. Такие искусственные поверхности включают, но не ограничиваются ими, поверхности диализных катетеров, контуров искусственного кровообращения, искусственных клапанов сердца, например, механических сердечных клапанов (МСК), устройств поддержки желудочка, трансплантатов мелкого калибра, центральных венозных катетеров, аппаратов экстракорпоральной мембранной оксигенации (ЭКМО). Кроме того, тромбоэмболическое расстройство или связанное с ним осложнение может быть вызвано искусственной поверхностью или связано с искусственной поверхностью. Например, инородные поверхности и различные компоненты механических сердечных клапанов (МСК) являются протромботическими и способствуют образованию тромбина через внутренний путь коагуляции. Кроме того, ингибиторы Тромбина и FXa противопоказаны при тромбоэмболических расстройствах или связанных с ними осложнениях, вызванных искусственными поверхностями, такими как МСК, поскольку эти ингибиторы неэффективны при блокировании внутреннего пути на уровне плазмы, который не вызывает сильного кровотечения. Таким образом, соединения по настоящему изобретению, которые можно использовать в качестве, например, ингибиторов Фактора XIa, рассматриваются в качестве альтернативных терапевтических средств для этих целей.
Соединения, описанные в настоящем документе (например, соединение 1), или их фармацевтически приемлемые соли или их композиции также могут быть полезны для лечения, профилактики или снижения риска фибрилляцией предсердий у субъекта, нуждающегося в этом. Например, у субъекта может быть высокий риск развития фибрилляцией предсердий. Субъект также может нуждаться в диализе, таком как гемодиализ. Соединения, описанные в настоящем документе (например, соединение 1), или их фармацевтически приемлемые соли или их композиции, можно вводить до, во время или после диализа. Пероральные антикоагулянты прямого действия (ПАПД), доступные в настоящее время на рынке, такие как определенные ингибиторы FXa или тромбина, противопоказаны при фибрилляции предсердий в таких условиях. Таким образом, соединения по настоящему изобретению, которые могут применяться в качестве ингибиторов Фактора XIa, рассматриваются в качестве альтернативных терапевтических средств для этих целей. Кроме того, у субъекта может быть высокий риск кровотечения. В некоторых вариантах осуществления, субъект может иметь терминальную стадию почечной недостаточности. В других случаях пациенту не требуется диализ, например гемодиализ. Кроме того, фибрилляция предсердий может быть связана с другим тромбоэмболическим расстройством, таким как сгусток крови.
Кроме того, соединения, описанные в настоящем документе (например, соединение 1), или их фармацевтически приемлемые соли или их композиции, могут быть использованы для лечения, профилактики или снижения риска гипертензии, например, артериальной гипертензии, у субъекта. В некоторых вариантах осуществления, гипертензия, например, артериальная гипертензия, может привести к атеросклерозу. В некоторых вариантах осуществления, гипертензия может быть легочной артериальной гипертензией.
Кроме того, соединения, описанные в настоящем документе (например, соединение 1), или их фармацевтически приемлемые соли или их композиции, можно использовать для лечения, профилактики или снижения риска таких расстройств, как тромбоцитопения, вызванная гепарином, тромбоз-тромбоцитопения, вызванная гепарином, или тромботическая микроангиопатия, например, гемолитико-уремический синдром (ГУС) или тромботическая тромбоцитопеническая пурпура (ТТП).
В некоторых вариантах осуществления, субъект чувствителен к гепарину или у него развилась чувствительность. Гепарин-индуцированная тромбоцитопения (ГИТ) представляет собой развитие (низкого количества тромбоцитов) из-за введения различных форм гепарина. ГИТ вызывается образованием аномальных антител, активирующих тромбоциты. ГИТ можно подтвердить с помощью специальных анализов крови. В некоторых вариантах осуществления, субъект резистентен или у него развилась резистентность к гепарину. Например, тест на активированное время свертывания (АВС) может быть проведен субъекту для тестирования на чувствительность или резистентность к гепарину. Тест АВС является мерой внутреннего пути коагуляции, который определяет наличие образования фибрина. Субъект, который чувствителен и/или резистентен к стандартной дозе гепарина, обычно не достигает целевого времени антикоагуляции. Общие корреляты резистентности к гепарину включают, но не ограничиваются ими, предыдущие капельные вливания гепарина и/или нитроглицерина и пониженные уровни антитромбина III. В некоторых вариантах осуществления, субъекту ранее вводили антикоагулянт (например, бивалирудин/Ангиомакс).
Соединения, описанные в настоящем документе (например, соединение 1), или их фармацевтически приемлемые соли или их композиции, можно использовать для уменьшения воспаления у субъекта. В некоторых вариантах осуществления, воспалением может быть васкулярное воспаление. В некоторых вариантах осуществления, васкулярное воспаление может сопровождаться атеросклерозом. В некоторых вариантах осуществления васкулярное воспаление может сопровождаться тромбоэмболическим заболеванием у субъекта. В некоторых вариантах осуществления, васкулярным воспалением может быть васкулярное воспаление, индуцированное ангиотензином II.
Соединения, описанные в настоящем документе (например, соединение 1), или их фармацевтически приемлемые соли или их композиции могут использоваться для лечения, профилактики или снижения риска почечных нарушений или дисфункций, включая терминальную стадию почечной недостаточности, связанную с гипертензией почечную дисфункцию у субъекта, фиброз почек и повреждение почек.
Способы по настоящему изобретению также могут применяться для поддержания проходимости кровеносных сосудов, например, у пациентов, подвергающихся тромбэктомии, транслюминальной коронарной ангиопластике или в связи с сосудистой хирургией, такой как шунтирование, реконструкция артерии, атерэктомия, сосудистые трансплантаты, проходимость стента, и имплантации и трансплантации органов, тканей или клеток. Способы по изобретению можно использовать для ингибирования свертывания крови в связи с приготовлением, хранением, фракционированием или использованием цельной крови. Например, способы по настоящему изобретению можно использовать для поддержания цельной и фракционированной крови в жидкой фазе, что требуется для аналитических и биологических тестов, например, для ex vivo исследований тромбоцитов и других функций клеток, биоаналитических процедур и количественного определения компонентов крови, или для поддержания экстракорпоральных кровеносных сосудов, как в растворе для заместительной почечной терапии (например, гемодиализа) или при хирургическом вмешательстве (например, операции на открытом сердце, например, операции шунтирования коронарной артерии). В некоторых вариантах осуществления, раствор для заместительной почечной терапии можно использовать для лечения пациентов с острым повреждением почек. В некоторых вариантах осуществления, раствор для заместительной почечной терапии может представлять собой непрерывную заместительную почечную терапию.
Кроме того, способы по настоящему изобретению могут быть полезны для лечения и профилактики протромботических осложнений рака. Способы могут быть полезны при лечении роста опухоли в качестве дополнения к химиотерапии для предотвращения ангиогенеза, и для лечения рака, в частности рака легких, простаты, толстой кишки, груди, яичников и костей.
Экстракорпоральная мембранная оксигенация (ЭКМО)
“Экстракорпоральная мембранная оксигенация” (или “ЭКМО”) в настоящем документе относится к экстракорпоральному жизнеобеспечению с помощью насоса для крови, искусственного легкого и канюли для сосудистого доступа, способных обеспечивать поддержку кровообращения или генерировать скорости кровотока, адаптированные для поддержки оксигенации крови и, необязательно, удаления углекислого газа. При веновенозной ЭКМО экстракорпоральный газообмен обеспечивается кровью, отобранной из венозной системы; затем кровь повторно вводится в венозную систему. При веноартериальной ЭКМО газообмен обеспечивается кровью, которая отбирается из венозной системы и затем вводится непосредственно в артериальную систему для обеспечения частичной или полной поддержки кровообращения или сердца. Веноартериальная ЭКМО допускает различную степень респираторной поддержки.
Используемые в настоящем документе термины «экстракорпоральная мембранная оксигенация» или «ЭКМО» относятся к экстракорпоральной системе жизнеобеспечения, которая обеспечивает поддержку кровообращения или генерирует скорость кровотока, достаточную для поддержания оксигенации крови. В некоторых вариантах осуществления ЭКМО включает удаление диоксида углерода из крови субъекта. В некоторых вариантах осуществления ЭКМО выполняется с использованием экстракорпорального аппарата, выбранного из группы, состоящей из кровяного насоса, искусственного легкого и канюли для сосудистого доступа.
В настоящем документе «веновенозная ЭКМО» относится к типу ЭКМО, в котором кровь отбирается из венозной системы субъекта в устройство ЭКМО и подвергается газообмену (включая оксигенацию крови) с последующим повторным вливанием забранной крови в венозную систему. В настоящем документе «веноартериальная ЭКМО» относится к типу ЭКМО, в котором кровь отбирается из венозной системы субъекта в устройство ЭКМО и подвергается газообмену (включая оксигенацию крови) с последующим вливанием забранной крови непосредственно в артериальную систему. В некоторых вариантах осуществления веноартериальная ЭКМО выполняется для обеспечения частичной поддержки кровообращения или сердечной деятельности субъекта, нуждающегося в этом. В некоторых вариантах осуществления веноартериальную ЭКМО проводят для обеспечения полной поддержки кровообращения или сердца субъекта, нуждающегося в этом.
Соединения по настоящему изобретению могут использоваться для лечения, профилактики или снижения риска тромбоэмболического расстройства у субъекта, нуждающегося в этом, где субъект подвергается воздействию искусственной поверхности, такой как аппарат экстракорпоральной мембранной оксигенации (ЭКМО) (см. выше), который может использоваться в качестве резервной терапии при сердечной или легочной недостаточности. Поверхность аппарата ЭКМО, которая непосредственно контактирует с субъектом, может быть протромботической поверхностью, которая может вызвать тромбоэмболическое расстройство, например, венозную тромбоэмболию, например, тромбоз глубоких вен или легочную эмболию, что приводит к трудностям в лечении пациента, нуждающегося в ЭКМО. Сгустки в кровотоке являются наиболее частым механическим осложнением (19%). Крупные сгустки могут вызвать отказ оксигенатора и легочную или системную эмболию.
ЭКМО часто проводят с непрерывным вливанием гепарина в качестве антикоагулянта для предотвращения образования сгустков. Однако установка канюли может вызвать повреждение внутренней яремной вены, что приведет к массивному внутреннему кровотечению. Кровотечение возникает у 30-40% больных, получающих ЭКМО, и может быть опасным для жизни. Это сильное кровотечение связано как с необходимым продолжительным вливанием гепарина, так и с дисфункцией тромбоцитов. Примерно 50% зарегистрированных смертей вызваны тяжелыми кровотечениями. Aubron et al. Critical Care, 2013, 17: R73 рассмотрел факторы, связанные с исходами ЭКМО.
Таким образом, соединения по настоящему изобретению, которые можно использовать в качестве ингибиторов Фактора XIa, рассматриваются как альтернативная замена гепарину в терапии ЭКМО. Соединения по настоящему изобретению рассматриваются как эффективные агенты блокирования внутреннего пути на уровне плазмы, которые обеспечат эффективную антикоагуляцию/антитромбоз без заметной склонности к кровотечению. В некоторых вариантах осуществления субъект чувствителен к или у него развилась чувствительность к гепарину. В некоторых вариантах осуществления субъект резистентен или у него развилась резистентность к гепарину.
Ишемия
«Ишемия» или «ишемическое событие» представляет собой сосудистое заболевание, обычно включающее закупорку сосудов или ограничение кровоснабжения тканей. Ишемия может вызвать нехватку кислорода и глюкозы, необходимых для клеточного метаболизма. Ишемия обычно вызывается проблемными кровеносными сосудами, которые приводят к повреждению или дисфункции тканей. Ишемия также может относиться к местной потере крови или кислорода в определенной части тела в результате застоя (например, сужения сосудов, тромбоза или эмболии). Причины включают эмболию, тромбоз атеросклеротической артерии, травму, венозные проблемы, аневризму, сердечные заболевания (например, инфаркт миокарда, заболевание митрального клапана, хроническую фибрилляцию артерий, кардиомиопатии и протезирование), травму или травматическое повреждение (например, конечностей, вызывающее частичную или полную закупорку сосуда), синдром грудного выхода, атеросклероз, гипогликемию, тахикардию, гипотензию, внешнее сжатие кровеносного сосуда (например, опухолью), серповидноклеточную анемию, локализованный сильный холод (например, при обморожении), наложение жгута, стимуляцию рецептора глутамата, артериовенозные мальформации, разрыв значительных кровеносных сосудов, снабжающих ткань или орган, и анемию.
Временные ишемические события обычно относятся к временному (например, краткосрочному) эпизоду неврологической дисфункции, вызванному потерей кровотока (например, в фокальном головном мозге, спинном мозге или сетчатке) без острого инфаркта (например, смерти ткани). В некоторых вариантах осуществления временное ишемическое событие длится в течение или менее чем 72 часа, 48 часов, 24 часа, 12 часов, 10 часов, 8 часов, 4 часа, 2 часа, 1 час, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут, 5 минут, 4 минуты, 3 минуты, 2 минуты или 1 минуты.
Ангионевротический отек
Ангионевротический отек представляет собой быстрое разбухание дермы, подкожной ткани, слизистой и подслизистых тканей. Ангионевротический отек обычно классифицируют как либо наследственный, либо приобретенный.
«Приобретенный ангионевротический отек» может быть иммунологическим, не иммунологическим или идиопатическим; вызванным, например, аллергией, в качестве побочного эффекта лекарственных средств, например, лекарственных средств с ингибиторами АПФ.
«Наследственный ангионевротический отек» или «НАО» относится к генетическому расстройству, которое приводит к острым периодам отека (например, опухания), который может возникать почти во всех частях тела, включая лицо, конечности, шею, горло, гортань, конечности, желудочно-кишечный тракт и гениталии. Приступы НАО часто могут быть опасными для жизни, их тяжесть зависит от пораженной области, например, приступы в брюшной полости могут привести к кишечной непроходимости, а опухание гортани и верхних дыхательных путей может привести к удушью. Патогенез наследственного ангионевротического отека может быть связан с безальтернативной активацией контактного пути начальным образованием калликреина или факторов свертывания (например, Фактора XII).
Признаки и симптомы включают опухание, например, лица, слизистой оболочки рта или горла и языка. Зуд, боль, снижение чувствительности в пораженных участках, крапивница (то есть сыпь) или стридор дыхательных путей также могут быть признаками ангионевротического отека. Однако при наследственном ангионевротическом отеке не может быть ассоциированного зуда или крапивницы, например. Субъекты с НАО могут испытывать боль в животе (например, боль в животе продолжительностью от одного до пяти дней, приступы в брюшной полости, увеличивающие количество лейкоцитов у субъекта), рвоту, слабость, водянистую диарею или сыпь.
Брадикинин играет важную роль в ангионевротическом отеке, особенно наследственном ангионевротическом отеке. Брадикинин высвобождается различными типами клеток в ответ на множество различных стимулов и является медиатором боли. Вмешательство в продуцирование или деградацию брадикинина может привести к ангионевротическому отеку. При наследственном ангионевротическом отеке непрерывное продуцирование фермента калликреина может способствовать образованию брадикинина. Ингибирование калликреина может препятствовать продуцированию брадикинина; и лечит или предотвращает ангионевротический отек.
Способы, описанные в настоящем документе, могут включать такие, в которых кровь субъекта находится в контакте с искусственной последовательностью. Например, в одном аспекте, в настоящем документе предоставлен способ лечения тромбоэмболического расстройства у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, представленного
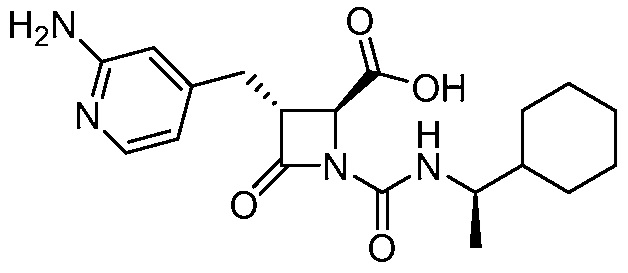
или его фармацевтически приемлемой соли, где кровь субъекта контактирует с искусственной поверхностью.
В одном аспекте, в настоящем документе предоставлен способ снижения риска тромбоэмболического расстройства у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, представленного

или его фармацевтически приемлемой соли, где кровь субъекта контактирует с искусственной поверхностью.
В одном аспекте, в настоящем документе предоставлен способ профилактики тромбоэмболического расстройства у субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, представленного

или его фармацевтически приемлемой соли, где кровь субъекта контактирует с искусственной поверхностью.
В некоторых вариантах осуществления способов, представленных в настоящем документе, искусственная поверхность находится в контакте с кровью в системе кровообращения субъекта. В некоторых вариантах осуществления искусственной поверхностью является имплантируемое устройство, диализный катетер, система искусственного кровообращения, искусственный сердечный клапан, желудочковый аппарат вспомогательного кровообращения, трансплантат мелкого калибра, центральный венозный катетер или аппарат экстракорпоральной мембранной оксигенации (ЭКМО). В некоторых вариантах осуществления искусственная поверхность вызывает или связана с тромбоэмболическим расстройством. В некоторых вариантах осуществления тромбоэмболическим расстройством является венозная тромбоэмболия, тромбоз глубоких вен или легочная эмболия. В некоторых вариантах осуществления тромбоэмболическим расстройством является сгусток крови.
В некоторых вариантах осуществления способы дополнительно включают кондиционирование искусственной поверхности отдельной дозой соединения или его фармацевтически приемлемой соли перед контактированием искусственной поверхности с кровью в системе кровообращения субъекта. В некоторых вариантах осуществления способы дополнительно включают кондиционирование искусственной поверхности отдельной дозой соединения или его фармацевтически приемлемой соли до или во время введения соединения или его фармацевтически приемлемой соли субъекту. В некоторых вариантах осуществления способы дополнительно включают кондиционирование искусственной поверхности отдельной дозой соединения или его фармацевтически приемлемой соли до и во время введения соединения или его фармацевтически приемлемой соли субъекту.
В одном аспекте, в настоящем документе предоставлен способ лечения крови субъекта, нуждающегося в этом, где способ включает введение субъекту эффективного количества соединения, представленного

или его фармацевтически приемлемой соли.
В одном аспекте, в настоящем документе предоставлен способ сохранения уровня в плазме соединения, представленного

или его фармацевтически приемлемой соли, в крови субъекта, контактирующего с искусственной поверхностью, где способ включает:
(i) введение соединения или его фармацевтически приемлемой соли субъекту до или во время контакта искусственной поверхности с кровью субъекта; и
(ii) кондиционирование искусственной поверхности с соединением или его фармацевтически приемлемой солью до или во время контакта искусственной поверхности с кровью субъекта;
тем самым поддерживая уровень в плазме соединения или его фармацевтически приемлемой соли, в крови субъекта.
В некоторых вариантах осуществления способов, описанных в настоящем документе, соединение или его фармацевтически приемлемая соль поддерживает постоянное активированное частичное тромбопластиновое время (аЧТВ) в крови субъекта до и после контакта с искусственной поверхностью. В некоторых вариантах осуществления соединение или его фармацевтически приемлемую соль вводят субъекту до и во время контакта искусственной поверхности с кровью субъекта.
В некоторых вариантах осуществления искусственную поверхность кондиционируют соединением или его фармацевтически приемлемой солью до во время контакта искусственной поверхности с кровью субъекта. В некоторых вариантах осуществления способ дополнительно предотвращает или снижает риск образования сгустков крови в крови субъекта, находящейся в контакте с искусственной поверхностью.
В некоторых вариантах осуществления искусственной поверхностью является система искусственного кровообращения. В некоторых вариантах осуществления искусственной поверхностью является аппарат экстракорпоральной мембранной оксигенации (ЭКМО). В некоторых вариантах осуществления аппаратом ЭКМО является аппарат веновенозной ЭКМО или аппарат веноартериальной ЭКМО.
В одном аспекте, в настоящем документе предоставлен способ профилактики или снижения риска тромбоэмболического расстройства у субъекта во время или после медицинской процедуры, включающий:
(i) введение субъекту эффективного количества соединения, представленного:

или его фармацевтически приемлемой соли, до, во время или после медицинской процедуры; и
(ii) контакт крови субъекта с искусственной поверхностью;
тем самым предотвращая или снижая риск тромбоэмболического расстройства во время или после медицинской процедуры.
В некоторых вариантах осуществления искусственную поверхность кондиционируют соединением или его фармацевтически приемлемой солью перед введением соединения субъекту до, во время или после медицинской процедуры.
В некоторых вариантах осуществления фармацевтическую поверхность кондиционируют раствором, содержащим соединение или его фармацевтически приемлемую соль, перед введением соединения или его фармацевтически приемлемой соли субъекту до, во время или после медицинской процедуры. В некоторых вариантах осуществления раствором является солевой раствор, раствор Рингера или кровь. В некоторых вариантах осуществления раствор дополнительно содержит кровь. В некоторых вариантах осуществления кровь взята у субъекта или донора.
В некоторых вариантах осуществления тромбоэмболическим расстройством является сгусток крови.
В некоторых вариантах осуществления медицинская процедура включает одно или несколько из: i) искусственного кровообращения, ii) оксигенации и перекачивания крови посредством экстракорпоральной мембранной оксигенации, iii) вспомогательного перекачивания крови (внутреннего или внешнего), iv) диализа крови, v) экстракорпоральной фильтрации крови, vi) сбора крови у субъекта в хранилище для последующего использования у животного или человека, vii) использования венозного или артериального внутрипросветного катетера(ов), viii) использования устройств(а) для диагностической или интервенционной сердечной катетеризации, ix) использования внутрисосудистого устройств(а), x) использования искусственного сердечного клапана(ов) и xi) использования искусственного трансплантата(ов).
В некоторых вариантах осуществления медицинская процедура включает искусственное кровообращение. В некоторых вариантах осуществления медицинская процедура включает оксигенацию и перекачивание крови посредством экстракорпоральной мембранной оксигенации (ЭКМО). В некоторых вариантах осуществления ЭКМО является веновенозная ЭКМО или веноартериальная ЭКМО.
В некоторых вариантах осуществления способов, описанных в настоящем документе, фармацевтически приемлемой солью соединения является гидрохлорид. В некоторых вариантах осуществления субъектом является человек. В некоторых вариантах осуществления субъект имеет повышенный риск тромбоэмболического расстройства. В некоторых вариантах осуществления тромбоэмболическое расстройство является результатом осложнения при хирургическом вмешательстве.
В некоторых вариантах осуществления субъект чувствителен или у него развилась чувствительность к гепарину. В некоторых вариантах осуществления субъект резистентен или у него развилась резистентность к гепарину.
В некоторых вариантах осуществления субъект находится в контакте с искусственной поверхностью в течение, по меньшей мере, 1 дня (например, примерно 2 дней, примерно 3 дней, примерно 4 дней, примерно 5 дней, примерно 6 дней, примерно 1 недели, примерно 10 дней, примерно 2 недель, примерно 3 недель, примерно 4 недель, примерно 2 месяцев, примерно 3 месяцев, примерно 6 месяцев, примерно 9 месяцев, примерно 1 года).
Фармацевтические композиции
Композиции, описанные в настоящем документе, включают соединение, описанное в настоящем документе (например, соединение 1), а также дополнительные терапевтические агенты, если они присутствуют, в количествах, эффективных для лечения заболевания или симптомов заболевания (например, такого как заболевание, связанное с Фактором XIa или калликреином).
Фармацевтически приемлемые носители, адъюванты и наполнители, которые могут использоваться в фармацевтических композициях, представленных в настоящем документе, включают, но не ограничиваются ими, ионообменники, оксид алюминия, стеарат алюминия, лецитин, самоэмульгирующиеся системы доставки лекарственных средств (SEDDS), такие как d-α-токоферол полиэтиленгликоль 1000 сукцинат, поверхностно-активные вещества, используемые в фармацевтических дозированных формах, такие как Tweens или другие аналогичные полимерные матрицы доставки, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси неполных глицеридов насыщенных жирных кислот растительного происхождения, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлозу натрия, полиакрилаты, воски, блок-полимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и шерстяной жир. Циклодекстрины, такие как α-, β- и γ-циклодекстрин, или химически модифицированные производные, такие как гидроксиалкилциклодекстрины, включая 2- и 3-гидроксипропил-β-циклодекстрины, или другие солюбилизированные производные также могут быть успешно использованы для улучшения доставки соединений формул, описанных в настоящем документе.
Фармацевтические композиции могут быть в форме твердой лиофилизированной композиции, которая может быть восстановлена путем добавления совместимого восстанавливающего разбавителя перед парентеральным введением, или в форме замороженной композиции, адаптированной для оттаивания и, при желании, разбавления совместимым разбавителем перед парентеральным введением. В некоторых вариантах осуществления фармацевтическая композиция включает порошок (например, лиофилизированную композицию), растворенный в водной среде, например, солевом растворе, в пакете или флаконе с ВВ единичной дозой в концентрации, подходящей для внутривенного введения субъекту. В некоторых вариантах осуществления ингредиенты фармацевтической композиции, подходящей для внутривенного введения, отделены друг от друга в одном контейнере, например, порошок, содержащий соединение, описанное в настоящем документе, или его фармацевтически приемлемую соль, отделен от водной среды, такой как солевой раствор. В этом последнем примере, различные компоненты разделены перегородкой, которую можно сломать для контакта ингредиентов друг с другом с образованием фармацевтической композиции, подходящей для внутривенного введения.
Способы введения
Предлагаемые здесь фармацевтические композиции могут быть введены перорально, ректально или парентерально (например, внутривенной инфузией, внутривенной болюсной инъекцией, ингаляцией, имплантацией). Термин парентеральная, используемый в настоящем документе, включает подкожную, внутрикожную, внутривенную (например, внутривенную инфузию, внутривенную болюсную инъекцию), интраназальную, ингаляционную, легочную, трансдермальную, внутримышечную, внутрисуставную, внутриартериальную, интрасиновиальную, внутригрудную, интратекальную, внутриочаговую и внутричерепную инъекцию или другие инфузионные техники. Предлагаемые здесь фармацевтические композиции могут содержать любые обычные нетоксичные фармацевтически приемлемые носители, адъюванты или носители. В некоторых случаях, pH композиции можно регулировать с помощью фармацевтически приемлемых кислот, оснований или буферов для повышения стабильности соединения или формы его доставки.
Фармацевтические композиции могут быть в форме стерильного препарата для инъекций, например, в виде стерильного водного или масляного раствора или суспензии для инъекций. Эта суспензия может быть составлена согласно методикам, известным в данной области техники, с использованием подходящих диспергирующих или смачивающих агентов (таких как, например, Tween 80) и суспендирующих агентов. Стерильным препаратом для инъекций также может быть стерильный раствор или суспензия для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут применяться, можно назвать маннит, воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, полезны при приготовлении препаратов для инъекций, как и натуральные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных версиях. Эти масляные растворы или суспензии могут также содержать разбавитель или диспергатор на основе длинноцепочечного спирта, карбоксиметилцеллюлозу или аналогичные диспергирующие агенты, которые обычно используют при составлении фармацевтически приемлемых дозированных форм, таких как эмульсии и/или суспензии. Другие обычно используемые поверхностно-активные вещества, такие как Tweens или Spans, или другие подобные эмульгирующие агенты или усилители биодоступности, которые обычно используются при производстве фармацевтически приемлемых твердых, жидких или других дозированных форм, также могут быть использованы для целей составления. В некоторых вариантах осуществления фармацевтическая композиция для внутривенного введения содержит носитель, выбранный из группы, состоящей из 5% масс./масс. воды с декстрозой («5DW») и солевого раствора.
Представленные здесь фармацевтические композиции можно вводить перорально в любой перорально приемлемой дозированной форме, включая, но не ограничиваясь ими, капсулы, таблетки, эмульсии и водные суспензии, дисперсии и растворы. В случае таблеток для перорального применения, обычно используемые носители включают лактозу и кукурузный крахмал. Также обычно добавляют смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул подходящие разбавители включают лактозу и высушенный кукурузный крахмал. Если водные суспензии или эмульсии вводят перорально, активный ингредиент может быть суспендирован или растворен в масляной фазе в комбинации с эмульгирующими или суспендирующими агентами. При желании могут быть добавлены определенные подслащивающие или ароматизирующие или красящие или маскирующие вкус агенты.
Соединения, описанные в настоящем документе, могут быть введены, например, инъекцией, внутривенно (например, внутривенной инфузией, внутривенной болюсной инъекцией), внутриартериально, подкожно, внутрибрюшинно, внутримышечно или подкожно; или перорально, трансбуккально, назально, через слизистую, местно, в дозе от примерно 0,5 до примерно 100 мг/кг массы тела, альтернативно, в дозе от 1 мг до 1000 мг/дозу, каждые 4-120 часов или в соответствии с требованиями конкретного препарата. Способы в настоящем документе предполагают введение эффективных количеств соединения или композиции соединения для достижения желаемого или заявленного эффекта. Обычно фармацевтические композиции, представленные в настоящем документе, вводят от примерно 1 до примерно 6 раз в день (например, внутривенной болюсной инъекцией) или, альтернативно, непрерывной инфузией. Такое введение можно использовать в качестве постоянной или интенсивной терапии. Количество активного ингредиента, которое может быть объединено с материалами носителя для получения однократной дозированной формы, будет варьироваться в зависимости от пациента, которого лечат, и конкретного способа введения. Типовой препарат содержит от примерно 5% до примерно 95% активного соединения (масс./масс.). Альтернативно, такие препараты содержат от примерно 20% до примерно 80% активного соединения.
В некоторых вариантах осуществления фармацевтическую композицию, составленную для перорального, подкожного или внутривенного введения, вводят субъекту от 1 раза в день до 6 раз в день (например, 2 раза в день или 4 раза в день). В некоторых вариантах осуществления фармацевтическую композицию, составленную для перорального введения, вводят субъекту от 1 раза в день до 6 раз в день (например, 2 раза в день или 4 раза в день) в течение примерно от 3 до 9 месяцев. В некоторых вариантах осуществления фармацевтическую композицию, составленную для перорального введения, вводят субъекту от 1 раза в день до 6 раз в день (например, 2 раза в день или 4 раза в день) в течение примерно 1 года. В некоторых вариантах осуществления фармацевтическую композицию, составленную для перорального введения, вводят субъекту от 1 раза в день до 6 раз в день (например, 2 раза в день или 4 раза в день) до конца его или ее жизни.
В некоторых вариантах осуществления соединение или фармацевтическую композицию вводят субъекту внутривенно. В некоторых вариантах осуществления соединение или фармацевтическую композицию вводят субъекту подкожно. В некоторых вариантах осуществления соединение или фармацевтическую композицию вводят субъекту в виде непрерывной внутривенной инфузии. В некоторых вариантах осуществления соединение или фармацевтическую композицию вводят субъекту в виде болюса. В некоторых вариантах осуществления соединение или фармацевтическую композицию вводят субъекту в виде болюса с последующей непрерывной внутривенной инфузией.
Комбинации
При осуществлении способов по настоящему изобретению может быть желательно вводить соединения по настоящему изобретению (например, ингибиторы Фактора XIa или калликреина) в комбинации друг с другом и одним или несколькими другими агентами для достижения терапевтической пользы, такими как антитромботические или антикоагулянтные агенты, антигипертензивные агенты, противоишемические агенты, антиаритмические агенты, ингибиторы функции тромбоцитов и так далее. Например, способы по настоящему изобретению могут осуществляться введением низкомолекулярных ингибиторов Фактора XIa или калликреина в комбинации с низкомолекулярными ингибиторами Фактора XIa или калликреина. Более конкретно, способы по настоящему изобретению можно осуществлять введением низкомолекулярных ингибиторов Фактора XIa или калликреина в комбинации с аспирином, клопидогрелом, тиклопидином или CS-747, варфарином, низкомолекулярными гепаринами (такими как LOVENOX), блокаторами GPIIb/GPIIIa, ингибиторами PAI-1, такими как антагонисты рецепторов XR-330 и Т-686, P2Y1 и P2Y12; антагонистами тромбоксанового рецептора (такими как ифетробан), миметиками простациклина, ингибиторами тромбоксан А синтетазы (такими как пикотамид), антагонистами серотонин-2-рецептора (такими как кетансерин); соединениями, которые ингибируют другие факторы свертывания крови, такие как FVII, FVIII, FIX, FX, протромбин, TAFI и фибриноген, или другими соединениями, которые ингибируют FXI или калликреин; фибринолитиками, такими как TPA, стрептокиназой, ингибиторами PAI-1 и ингибиторами α-2-антиплазмина, такими как антагонисты рецептора фибриногена на основе анти-α-2-антиплазминового антитела, ингибиторами α-1-антитрипсина, гиполипидемическими агентами, такими как ингибиторы HMG-CoA редуктазы (например, правастатин, симвастатин, аторвастатин, флувастатин, церивастатин, AZ4522 и итавастатин) и ингибиторами микросомальных белков-переносчиков триглицеридов (например, раскрытыми в патентах США № 5,739,135, 5,712,279 и 5,760,246); антигипертензивными агентами, такими как ингибиторы ангиотензинпревращающего фермента (например, каптоприл, лизиноприл или фозиноприл); антагонисты рецепторов ангиотензина-II (например, ирбесартан, лозартан или валсартан); ингибиторы ACE/NEP (например, омапатрилат и гемопатрилат); или β-блокаторы (такие как пропранолол, надолол и карведилол). Способы по изобретению можно осуществлять введением низкомолекулярных ингибиторов Фактора XIa или калликреина в комбинации с антиаритмическими агентами, например, при фибрилляции предсердий, например, амиодароном или дофетилидом. Способы по настоящему изобретению также можно осуществлять в комбинации с непрерывной заместительной почечной терапией для лечения, например, острого повреждения почек.
При осуществлении способов по настоящему изобретению может оказаться желательным введение соединений по настоящему изобретению (ингибиторов Фактора XIa или калликреина) в сочетании с агентами, которые увеличивают уровни цАМФ или цГМФ в клетках для терапевтической пользы. Например, соединения по настоящему изобретению могут иметь благоприятные эффекты при использовании в комбинации с ингибиторами фосфодиэстеразы, включая ингибиторы ФДЭ1 (например, описанные в Journal of Medicinal Chemistry, Vol. 40, pp. 2196-2210 [1997]), ингибиторами ФДЭ2, ингибиторами ФДЭ3 (такими как ревизинон, пимобендан или олпринон), ингибиторами ФДЭ4 (такими как ролипрам, циломиласт или пикламиласт), ингибиторами ФДЭ7 или другими ингибиторами ФДЭ, такими как дипиридамол, цилостазол, силденафил, денбутилин, теофиллин (1,2-диметилксантин), ARIFLOT™ (т.е. цис-4-циано-4-[3-(циклопентилоксy)-4-метоксифенил]циклогексан-1-карбоксильная кислота), арофилин, рофлумиласт, C-11294A, CDC-801, BAY-19-8004, ципамфиллин, SCH351591, YM-976, PD-189659, мезиопрам, пумафентрин, CDC-998, IC-485 и KW-4490.
Способы по изобретению могут осуществляться введением соединений по изобретению в комбинации с протромболитическими агентами, такими как активатор плазминогена тканей (природный или рекомбинантный), стрептокиназа, ретеплаза, активаза, ланотеплаза, урокиназа, проурокиназа, комплекс активатора плазминогена с выделенной стрептокиназой (ASPAC), активаторы плазминогена слюнных желез животных и подобные.
Способы по изобретению можно осуществлять введением соединений по изобретению в комбинации с β-адренергическими агонистами, такими как альбутерол, тербуталин, формотерол, салметерол, битолтерол, пильбутерол или фенотерол; антихолинергическими средствами, такими как бромид ипратропия; противовоспалительными кортиокостероидами, такими как беклометазон, триамцинолон, будесонид, флутиказон, флунизолид или дексаметазон; и противовоспалительными агентами, такими как кромолин, недокромил, теофиллин, зилеутон, зафирлукаст, монтелейкаст и пранлейкаст.
Низкомолекулярные ингибиторы Фактора XIa или калликреина могут действовать синергетически с одним или несколькими из указанных выше агентов. Таким образом, можно использовать уменьшенные дозы тромболитического агента(ов), что дает преимущества от введения этих соединений при минимизации возможных геморрагических и других побочных эффектов.
Курс лечения
Композиции, описанные в настоящем документе, включают эффективное количество соединения по настоящему изобретению (например, ингибитора Фактора XIa или калликреина) в комбинации и одного или нескольких других агентов (например, дополнительного терапевтического агента), таких как антитромботические или антикоагулянтные агенты, антигипертензивные агенты, противоишемические агенты, антиаритмические агенты, ингибиторы функции тромбоцитов и так далее, для достижения терапевтической пользы.
В некоторых вариантах осуществления дополнительный терапевтический агент вводят после введения соединения по изобретению (например, ингибитора Фактора XIa или калликреина). В некоторых вариантах осуществления дополнительный терапевтический агент вводят через 15 минут, 30 минут, 1 час, 2 часов, 4 часов, 6 часов, 8 часов, 10 часов, 12 часов, 14 часов, 18 часов, 24 часов, 48 часов, 72 часов или дольше после введения соединения по изобретению (например, ингибитора Фактора XIa или калликреина). В некоторых вариантах осуществления дополнительный терапевтический агент вводят (например, перорально) после выписки из медицинского учреждения (например, больницы).
В некоторых вариантах осуществления соединение по изобретению (например, ингибитор Фактора XIa или калликреина) и дополнительный терапевтический агент составляют вместе с одну композицию или дозированную форму. В некоторых вариантах осуществления соединение по изобретению (например, ингибитор Фактора XIa или калликреина) и дополнительный терапевтический агент вводят по отдельности. В некоторых вариантах осуществления соединение по изобретению (например, ингибитор Фактора XIa или калликреина) и дополнительный терапевтический агент вводят последовательно. В некоторых вариантах осуществления соединение по изобретению (например, ингибитор Фактора XIa или калликреина) и дополнительный терапевтический агент вводят по отдельности и последовательно. В общем, по меньшей мере, один из соединения по изобретению (например, ингибитора Фактора XIa или калликреина) и дополнительного терапевтического агента вводят парентерально (например, интраназально, внутримышечно, буккально, ингаляцией, имплантацией, трансдермально, внутривенно (например, внутривенной инфузией, внутривенной болюсной инъекцией), подкожной, внутрикожно, интраназально, легочно, трансдермально, внутрисуставно, внутриартериально, интрасиновиально, внутричерепно и интратекально, инъекцией или другими инфузионными техниками); перорально; или ректально, например, внутримышечной инъекцией или внутривенно (например, внутривенной инфузией, внутривенной болюсной инъекцией)). В некоторых вариантах осуществления соединение по изобретению вводят патентерально (например, интраназально, буккально, внутривенно (например, внутривенной инфузией, внутривенной болюсной инъекцией) или внутримышечно). В некоторых вариантах осуществления дополнительный терапевтический агент вводят перорально. В некоторых вариантах осуществления соединение по изобретению (например, ингибитор Фактора XIa или калликреина) вводят парентерально (например, интраназально, буккально, внутривенно (например, внутривенной инфузией, внутривенной болюсной инъекцией) или внутримышечно), и дополнительный терапевтический агент вводят перорально.
В некоторых вариантах осуществления соединение по изобретению (например, ингибитор Фактора XIa или калликреина) можно вводить один или несколько раз в день. Продолжительность лечения может составлять, например, один раз в день в течение примерно 1, 2, 3, 4, 5, 6, 7 дней или более. В некоторых вариантах осуществления лечение является постоянным (например, пожизненным). В некоторых вариантах осуществления вводят либо разовую дозу в форме индивидуальной дозированной единицы, либо несколько меньших дозированных единиц, либо путем многократного введения разделенных доз с определенными интервалами. Например, можно вводить дозированную единицу от примерно 0 часов до примерно 1 ч, от примерно 1 ч до примерно 24 ч, от примерно 1 до примерно 72 часов, от примерно 1 до примерно 120 часов, или от примерно 24 часов до по меньшей мере, от примерно 120 часов после повреждения. Альтернативно, дозированная единица может быть введена от примерно 0,5, 1, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 30, 40, 48, 72, 96, 120 часов или дольше после повреждения. Последующие дозированные единицы можно вводить в любое время после первоначального введения, так чтобы достигался терапевтический эффект. В некоторых вариантах осуществления начальную дозу вводят перорально. В некоторых вариантах осуществления дозы после начальной дозы вводят парентерально (например, интраназально, внутримышечно, буккально, ингаляцией, имплантацией, трансдермально, внутривенно (например, внутривенной инфузией, внутривенной болюсной инъекцией), подкожно, внутрикожно, интраназально, ингаляционно, трансдермальной, внутрисуставной, внутриартериальной, интрасиновиальной, внутригрудинной, интратекальной, внутриочаговой и внутричерепной инъекцией или другими методами инфузии); перорально; или ректально.
В некоторых вариантах осуществления соединения по изобретению (например, ингибитор Фактора XIa или калликреина) вводят перорально, например, в виде жидкой или твердой дозированной формы для переваривания, в течение от примерно 5 минут до примерно 1 недели; от примерно 30 минут до примерно 24 часов, от примерно 1 часа до примерно 12 часов, от примерно 2 часов до примерно 12 часов, от примерно 4 часов до примерно 12 часов, от примерно 6 часов до примерно 12 часов, от примерно 6 часов до примерно 10 часов; от примерно 5 минут до примерно 1 часа, от примерно 5 минут до примерно 30 минут; от примерно 12 часов до примерно 1 недели, от примерно 24 часов до примерно 1 недели, от примерно 2 дней до примерно 5 дней, или от примерно 3 дней до примерно 5 дней. В одном варианте осуществления соединение по изобретению (например, ингибитор Фактора XIa или калликреина) вводят перорально в виде жидкой дозированной формы. В другом варианте осуществления соединение по изобретению (например, ингибитор Фактора XIa или калликреина) вводят перорально в виде твердой дозированной формы.
Если у субъекта, проходящего терапию, наблюдается частичный ответ или рецидив после завершения первого цикла терапии, могут потребоваться последующие курсы терапии для достижения частичного или полного терапевтического ответа (например, постоянное лечение, например, пожизненное).
В некоторых вариантах осуществления соединение по изобретению (например, ингибитор Фактора XIa или калликреина) вводят внутривенно, например, в виде внутривенной инфузии или внутривенной болюсной инъекции, в течение от примерно 5 минут до примерно 1 недели; от примерно 30 минут до примерно 24 часов, от примерно 1 часа до примерно 12 часов, от примерно 2 часов до примерно 12 часов, от примерно 4 часов до примерно 12 часов, от примерно 6 часов до примерно 12 часов, от примерно 6 часов до примерно 10 часов; от примерно 5 минут до примерно 1 часа, от примерно 5 минут до примерно 30 минут; от примерно 12 часов до примерно 1 недели, от примерно 24 часов до примерно 1 недели, от примерно 2 дней до примерно 5 дней, или от примерно 3 дней до примерно 5 дней. В одном варианте, соединение по изобретению (например, ингибитор Фактора XIa или калликреина) вводят в виде внутривенной инфузии в течение примерно 5, 10, 15, 30, 45 или 60 минут или дольше; примерно 1, 2, 4, 6, 8, 10, 12, 16 или 24 часов или дольше; примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или дольше.
Дозы и схемы дозирования
Эффективное количество низкомолекулярного ингибитора Фактора XIa или калликреина, вводимое согласно настоящему изобретению, может определить специалист в данной области техники. Конкретный уровень дозы и частота дозирования для любого конкретного субъекта могут варьироваться и будут зависеть от множества факторов, включая активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия этого соединения, вид, возраст, массу тела, общее состояние здоровья, пол и диету субъекта, способ и время введения, скорость выведения, комбинацию лекарственных средств и тяжесть конкретного состояния.
При улучшении состояния пациента при необходимости может быть введена поддерживающая доза соединения, композиции или комбинации, представленных здесь. Впоследствии дозировка или частота введения, или и то, и другое могут быть уменьшены в зависимости от симптомов до уровня, при котором улучшенное состояние сохраняется, когда симптомы ослабляются до желаемого уровня. Однако пациентам может потребоваться прерывистое лечение на длительной основе при повторном появлении симптомов заболевания.
ПРИМЕРЫ
Исходные материалы и различные промежуточные соединения, описанные в следующих примерах, могут быть получены из коммерческих источников, приготовлены из коммерчески доступных органических соединений или приготовлены с использованием известных способов синтеза. Приведенные ниже примеры не ограничивают объем и включают определенные способы получения промежуточных продуктов и конечных продуктов, включая их соответствующие способы очистки.
Общие методики
Все неводные реакции проводят в атмосфере азота, чтобы поддерживать безводную атмосферу и максимизировать выходы. Все реакционные смеси перемешивают, используя верхнюю мешалку или магнитным способом, с помощью стержня для перемешивания с тефлоновым покрытием. Описание «сушат над» относится к сушке раствора продукта реакции над определенным осушающим агентом с последующей фильтрацией раствора через подходящую фильтровальную бумагу или через воронку из спеченного стекла. Описания «концентрируют», «концентрируют при пониженном давлении» или «выпаривают» относится к удалению растворителей при пониженном давлении с использованием роторного испарителя. Под хроматографией или хроматографированным понимается использование колоночной флэш-хроматографии на силикагеле, если не указано иное. Флэш-хроматография относится к колоночной хроматографии под давлением газа (например, азота) или с использованием механического насоса для подачи растворителя под давлением, например, такого как коммерческая система, поставляемая Biotage или другими поставщиками. Если не указано иное, протонные ЯМР спектры (1H) измеряют при 400 МГц, а углеродные ЯМР спектры (13C) измеряют при 100 МГц в указанном растворителе.
Сокращения, использованные в экспериментальных примерах, перечислены в таблице сокращений ниже.
Таблица сокращений
Схема 1
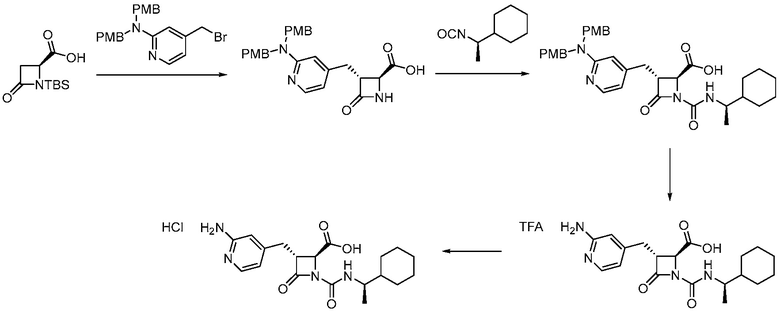
Схема 1 иллюстрирует общий способ получения соединения 1•HCl.
Пример 1. Получение промежуточного соединения (R)-(1-изоцианатоэтил)циклогексана
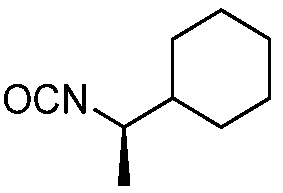
(R)-1-циклогексилэтанамин растворяют в ДХМ и добавляют водный раствор NaHCO3. Гетерогенную смесь охлаждают до -2°C и обрабатывают трифосгеном в течение примерно 6 ч, сохраняя температуру реакции ниже 5°C. Воду добавляют к смеси и фазы разделяют. Водную фазу повторно дважды экстрагируют ДХМ. Объединенные ДХМ фазы концентрируют с получением остатка. Остаток обрабатывают гептаном и охлаждают до 5-10°C с получением осадка. Осадок собирают и сушат с получением указанного в заголовке соединения в 74% выходом.
Ниже представлена типовая методика примера 1.
К раствору (R)-1-циклогексилэтанамина (0,50 кг, 3,93 моль) в ДХМ (10,0 л) добавляют 9% водный раствор NaHCO3 (10,0 л), и смесь охлаждают до 0°C. Трифосген (0,38 кг, 1,30 моль) добавляют к смеси, сохраняя температуру реакции и перемешивая в течение 1 ч при 0°C. Реакцию отслеживают ТСХ (100% ЭА элюент). Воду (10 л) добавляют к смеси и фазы разделяют. Водный слой экстрагируют ДХМ (2×5,0 л). Органическую фазу концентрируют досуха не превышая 45°C. Гептан (2×1 л) добавляют к остатку, и смесь концентрируют с получением твердого вещества. Твердое вещество помещают в гептан (6,0 л), сушат над MgSO4, промывают гептаном (0,5 л) и концентрируют с получением (R)-(1-изоцианатоэтил)циклогексана. Типовые выходы даны в таблице 1. ЯМР спектр образца № 4, растворенного в CDCl3, изображен на ФИГ.1.
Таблица 1. Типовые выходы при получении (R)-(1-изоцианатоэтил)циклогексана
Пример 2. Получение 4-(бромметил)-N,N-бис(4-метоксибензил)пиридин-2-амина

Стадия 1. Получение метилового эфира 2-[Бис-(4-метоксибензил)амино]изоникотиновой кислоты
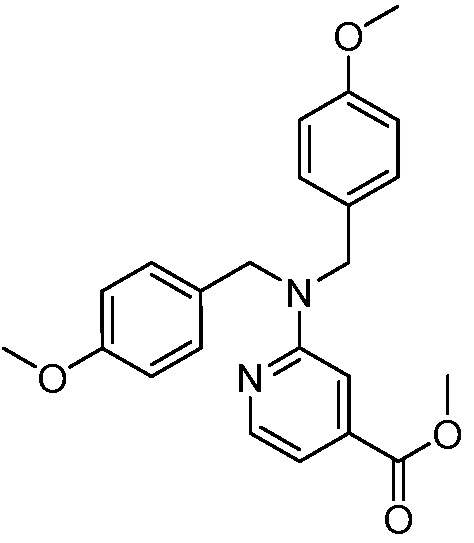
Смесь метилового эфира 2-аминопиридин-4-карбоновой кислоты (5,5 кг) и 4-метоксибензилхлорида (14,64 кг) в 33 л ацетонитрила нагревают до кипения с обратным холодильником в течение 3 ч, затем медленно добавляют 7,3 кг Et3N в кипящую с обратным холодильником смесь; затем реакционную смесь охлаждают до комнатной температуры и перемешивают в течение ночи. После удаления ацетонитрила и Et3N, большое количество воды добавляют к смеси, вызывая выпадение в осадок твердого вещества. После центрифугирования и перекристаллизации твердого вещества в 5-10 л изопропанола, реакция дает метиловый эфир 2-[бис-(4-метоксибензил)амино]изоникотиновой кислоты (3 кг, 21%) в виде белого твердого вещества.
Стадия 2. Получение {2-[Бис-(4-метоксибензил)амино]пиридин-4-ил}метанола

В 50 л реактор добавляют LiAlH4 (388 г) в 16 л сухого ТГФ (0°C) партиями. Затем 4 кг метилового эфира -[бис-(4-метоксибензил)амино]изоникотиновой кислоты в ТГФ (16 л) добавляют к смеси по каплям, сохраняя температуру реакции -5°C. Этилацетат (900 г), воду (388 г) и 15% водный раствор NaOH (388 г) последовательность медленно добавляют в реакционную смесь. Через 10 мин промешивания, безводный Na2SO4 (1,3 кг) добавляют к смеси, и соответствующую смесь перемешивают в течение 30 мин. Смесь фильтруют в вакууме, и фильтровальную лепешку промывают ТГФ (12 л), и затем фильтруют. Объединенный фильтрат концентрируют. Полученный раствор, который содержит {2-[бис-(4-метоксибензил)амино]пиридин-4-ил}метанол, применяют непосредственно на следующей стадии без очистки.
Стадия 3. Получение 4-(бромметил)-N,N-бис(4-метоксибензил)пиридин-2-амина

{2-[Бис(4-метоксибензил)амино]пиридин-4-ил}метанол (5 кг) и CBr4 (5 кг) добавляют в 25 л ДХМ, и реакционный раствор выдерживают при 0-10°C. Затем раствор PPh3 (4,32 кг) в 10 л ДХМ добавляют к реакционному раствору по каплям. Реакцию отслеживают ТСХ, и если {2-[бис-(4-метоксибензил)амино]пиридин-4-ил}метанол израсходован не полностью; PPh3 добавляют в реакционную смесь до полного расходования {2-[бис-(4-метоксибензил)амино]пиридин-4-ил}метанола. После удаления ДХМ, реакция дает маслоподобный продукт. Это масло перемешивают в 50% водном растворе EtOH (16 л) при комнатной температуре в течение 1 ч. Затем смесь фильтруют, и фильтровальную лепешку промывают небольшим количеством 50% водного раствора EtOH. Полученную фильтровальную лепешку затем перемешивают в 50% водном растворе EtOH (8 л) при комнатной температуре в течение еще 1 ч, фильтруют и сушат с получением кристаллического твердого продукта (5,2 кг). 1H ЯМР (CDCl3) δ 3,78 (с, 6H), 4,22 (с, 2H), 4,69 (с, 4H), 6,45 (с, 1H), 5,58 (с, 1H), 6.82 (д, 4H), 7,13 (д, 4H), 8,15 (д, 1H).
Пример 3. Получение гидрохлорида (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты (соединение 1•HCl)
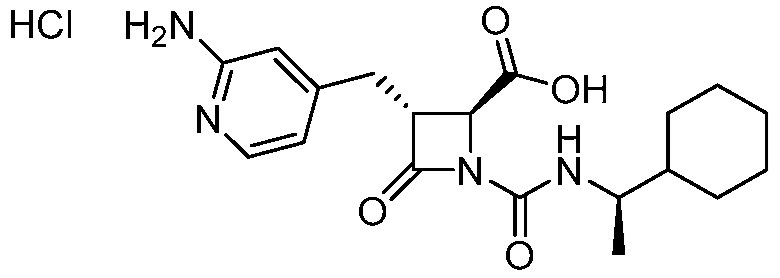
Стадия 1. Получение (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-4-оксоазетидин-2-карбоновой кислоты

(S)-1-(трет-бутилдиметилсилил)-4-оксоазетидин-2-карбоновую кислоту растворяют в ТГФ и охлаждают до -20°C. Лактам депротонируют с ДАЛ в ТГФ при примерно от -10 до -20°C и обрабатывают 4-(бромметил)-N,N-бис(4-метоксибензил)пиридин-2-амином, сохраняя температуру реакции ниже -10°C. Реакционную смесь перемешивают в течение нескольких часов при -15°C и затем нагревают до КТ и перемешивают еще несколько часов. Смесь гасят водой и затем кипятят с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают до КТ и обрабатывают 5% водным раствором трикалийфосфата. Фазы разделяют, и водный слой экстрагируют ЭА для удаления примесей. Водную фазу подкисляют до pH 3,1 6 N HCl и экстрагируют ЭА. Эту органическую фазу сушат и концентрируют. Остаточный ЭА выдавливают гептаном с получением суспензии, которую охлаждают и фильтруют. Фильтровальную лепешку помещают в 40 объемов ИПС и кипятят с обратным холодильником примерно 1 ч. Смесь охлаждают до КТ, и нерастворенные твердые примеси удаляют фильтрацией. ИПС растворитель в фильтрате меняют на гептан, вызывая выпадение продукта в осадок. Суспензию охлаждают до 5-10°C и фильтруют. Фильтровальную лепешку сушат с получением указанного в заголовке соединения с 59% выходом.
Ниже представлена типовая методика из примера 3, стадия 1.
К раствору (4S)-N-(трет-бутилдиметилсилил))-4-оксоазетидин-2-карбоновой кислоты (1,30 кг, 5,67 моль) в безводном ТГФ (20,8 л) при -20°C добавляют ДАЛ (2M в ТГФ, 6,06 л, 12,13 моль), затем раствор 4-(бромметил)-N,N-бис(4-метоксибензил)пиридин-2-амина (2765,9 г, 6,47 моль) в ТГФ (10,4 л). Полученную смесь перемешивают при -20°C в течение 5 ч, затем медленно нагревают до КТ в течение 16 ч. Реакцию отслеживают ЖХВД. Добавляют воду (2,6 л) и смесь нагревают до 60°C и перемешивают в течение 3 ч. ЖХВД показывает, что исходный материал был израсходован. Смесь охлаждают до КТ и обрабатывают 5% водным раствором трикалийфосфата (38,0 л). Фазы разделяют, и водный слой экстрагируют ЭА (3×19,5 л). Водный слой подкисляют до pH 3,1 добавлением 6 N HCl (50 мл) и экстрагируют ЭА (2×39,0 л). Органическую фазу сушат над MgSO4 и концентрируют. Остаточный ЭА выдавливают гептаном (2×2,6 л) с получением суспензии, которую фильтруют, промывают гептаном (2,6 л) и концентрируют. ИПС (39,0 L) добавляют к твердому веществу, и смесь кипятят с обратным холодильником в течение 1 ч. Смесь охлаждают до КТ, фильтруют, промывают ИПС (2,6 л), и фильтрат концентрируют. Гептан (18,2 л) добавляют к концентрированному раствору, который выдавливают, что заставляет продукт выпадать в осадок из раствора. Твердый осадок фильтруют, промывают гептаном (3,9 л) и сушат с получением (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-4-оксоазетидин-2-карбоновой кислоты. Типовые выходы и чистота указаны в таблице 2. ЯМР спектр образца № 8, растворенного в CDCl3, показан на ФИГ.2.
Таблица 2. Выходы и чистота (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-4-оксоазетидин-2-карбоновой кислоты
Стадия 2. Получение (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты
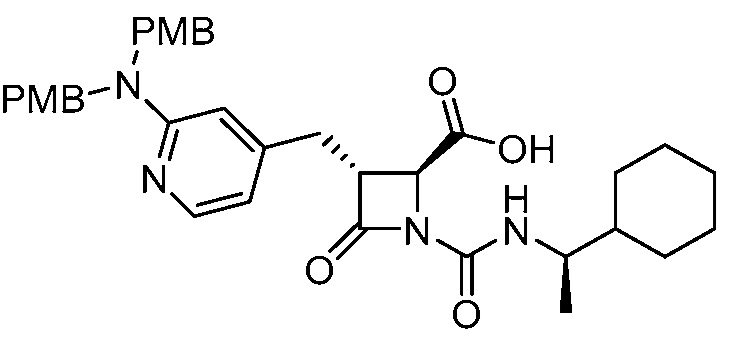
(2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-4-оксоазетидин-2-карбоновую кислоту растворяют в ДХМ и обрабатывают ДБУ, затем (R)-(1-изоцианатоэтил)циклогексаном (полученным в примере 1) при температуре окружающей среды. После перемешивания реакционной смеси в течение нескольких часов, добавляют еще (R)-(1-изоцианатоэтил)циклогексан и перемешивают в течение еще нескольких часов. Образовавшийся осадок фильтруют. Фильтровальную лепешку промывают несколькими порциями 10% водной лимонной кислоты до отсутствия определяемого ДБУ в фазе ДХМ по данным ЖХВД. Фазу ДХМ сушат и концентрируют с получением указанного в заголовке соединения с 100% выходом.
Ниже представлена типовая методика из примера 3, стадия 2.
Раствор (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-4-оксоазетидин-2-карбоновой кислоты (1868,0 г, 4,55 моль) в ДХМ (9,34 л) охлаждают до 10°C и обрабатывают ДБУ (2156,7 г, 15,93 моль), затем (R)-(1-изоцианатоэтил)циклогексаном (1240,3 г, 8,09 моль), сохраняя температуру реакции. Реакционную смесь нагревают до КТ и перемешивают в течение 22 ч. Реакцию отслеживают ЖХВД. Добавляют дополнительный (R)-(1-изоцианатоэтил)циклогексан (620,2 г, 4,04 г) и смесь перемешивают при КТ. Через 4 ч, ЖХВД анализ показывает полный расход исходного материала. Образовавшийся осадок фильтруют и промывают ДХМ (1,9 л). Фильтрат экстрагируют 10% водной лимонной кислотой (3×9,34 л). Органический слой сушат над Na2SO4, промывают ДХМ (0,5 л) и концентрируют с получением неочищенного продукта. Неочищенный продукт хроматографируют с получением (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты. Типовые выходы и чистота даны в таблице 3. ЯМР спектр неочищенного и очищенного продукта, растворенного в CDCl3, показаны на ФИГ.3 и ФИГ.4, соответственно.
Таблица 3. Выходы и чистота (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты
Стадия 3. Получение трифторацетата (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты
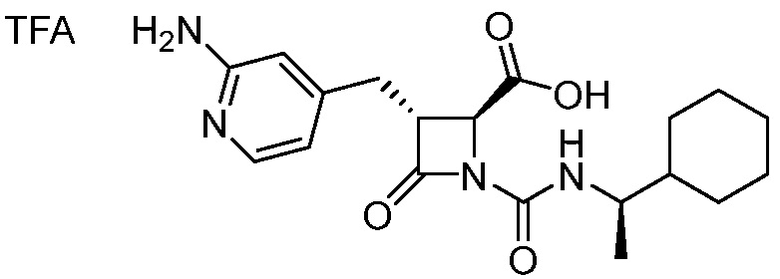
(2S,3R)-3-((2-(Бис(4-метоксибензил)амино)пиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновую кислоту растворяют в ТФК и обрабатывают триэтилсиланом при КТ. После перемешивания в течение нескольких часов, реакционную смесь концентрируют с получением остатка. Остаток растворяют в АЦН и экстрагируют гексаном. Смесь снова концентрируют с получением остатка. Остаток растворяют в ДХМ и дважды экстрагируют солевым раствором. Органическую фазу концентрируют с получением указанного в заголовке соединения с 100% выходом.
Ниже представлена типовая методика из примера 3, стадия 3.
(2S,3R)-3-((2-(Бис(4-метоксибензил)амино)пиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновую кислоту (1,3 кг, 4,55 моль) добавляют к ТФК (13,0 л) при 0°C. К раствору добавляют триэтилсилан (0,74 кг, 6,36 моль), сохраняя температуру реакции. Реакционную смесь нагревают до КТ и перемешивают в течение 24 ч. Реакцию отслеживают ЖХВД. Добавляют еще триэтилсилан (0,25 кг, 2,15 моль), и реакционную смесь перемешивают. Через 4 ч, ЖХВД анализ показывает расход исходного материала. Смесь концентрируют с получением остатка. Остаток растворяют в АЦН (13,0 л) и экстрагируют гексаном (4×13,0 л). Слой АЦН концентрируют с получением остатка. Остаток растворяют в ДХМ (13,0 л) и экстрагируют 13% раствором NaCl (2×13,0 л). Органический слой сушат над Na2SO4 и концентрируют с получением трифторацетата (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты. Типовой выход и чистота даны в таблице 4. ЯМР спектр продукта, растворенного в CDCl3, показан на ФИГ. 5.
Таблица 4. Выход и чистота трифторацетата (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты
Стадия 4. Получение гидрохлорида (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты (соединение 1•HCl)
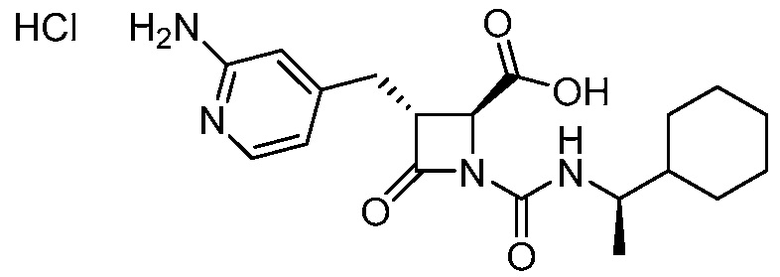
Ниже представлена типовая методика из примера 3, стадия 4.
Трифторацетат (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты растворяют в АЦН при КТ и обрабатывают 1M эфирной HCl. После перемешивания в течение нескольких часов, добавляют затравочные кристаллы и смесь охлаждают до 0°C. Кристаллический продукт собирают фильтрацией и сушат с получением указанного в заголовке соединения в виде белого твердого вещества с 55% выходом.
Ниже представлена типовая методика из примера 3, стадия 4.
Трифторацетат (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты (1,03 кг, 3,28 моль) растворяют в АЦН (4,84 л), фильтруют через слой Celite®, обрабатывают раствором HCl (1M в диэтиловом эфире, 8,43 л, 13,10 моль) и перемешивают при КТ в течение 42 ч. Образовавшийся осадок фильтруют и промывают диэтиловым эфиром (3×0,26 л). Твердое вещество собирают и сушат в печи. Типовой выход и чистота даны в таблице 5.
Таблица 5. Выход и чистота гидрохлорида (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты
Стадия 5. Очистка гидрохлорида (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты (соединения 1•HCl)
Ниже представлена типовая методика из примера 3, стадия 5.
Неочищенное соединение 1•HCl перемешивают при КТ в ИПС (6,3 л) до растворения. МТБЭ (6,3 л) добавляют к раствору, и смесь перемешивают в течение 10 ч. Образовавшийся осадок фильтруют и промывают МТБЭ (2,89 л, 2×1,26 л). Твердое вещество повторно растворяют в ИПС (4,8 л), и МТБЭ (2,4 л) добавляют по каплям к раствору и перемешивают в течение 131 ч. Образовавшийся осадок фильтруют, промывают МТБЭ (0,96 л, 2×0,64 л), и сушат до постоянного веса. Типовой выход и чистота даны в таблице 6. Твердое вещество затем растирают с МТБЭ (1,47 л), фильтруют, промывают МТБЭ (3×0,74 л) и сушат в печи до постоянного веса с получением соединения 1•HCl. Типовой выход и чистота даны в таблице 7. 1H ЯМР спектр указанного в заголовке соединения, растворенного в CD3OD, изображен на ФИГ. 6, и 13C ЯМР спектр указанного в заголовке соединения, растворенного в CD3OD, изображен на 7 (расширенный 13C ЯМР спектр в области 105-180 м.д. изображен на ФИГ. 8).
Таблица 6. Типовые выходы и чистота очищенного гидрохлорида (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты
Таблица 7. Типовые выходы и чистота очищенного соединения 1•HCl
Очищенный образец дополнительно анализировали методом порошковой рентгеновской дифракции (XRPD), дифрактограмма для которого приведена в ФИГ. 9. Рентгенограмму XRPD получают с помощью дифрактометра PANalytical X'Pert PRO MPD с использованием падающего пучка Cu-излучения, полученного с помощью длинного остро сфокусированного источника Optix. Эллиптически градуированное многослойное зеркало используют для фокусировки рентгеновских лучей Cu Kα через образец и на детектор. Перед анализом был проанализирован образец кремния (NIST SRM 640e), чтобы убедиться, что наблюдаемое положение пика Si 111 соответствует положению, утвержденному NIST. Образец образца зажимают между пленками толщиной 3 слоя и анализируют в геометрии пропускания. Для минимизации фона, создаваемого воздухом, используют ограничитель луча, короткий удлинитель, предотвращающий рассеяние, и режущую кромку, предотвращающую рассеяние. Щели Соллера для падающего и отклоненного лучей используют, чтобы минимизировать расширение из-за осевого расхождения. Дифракционный профиль собирают с помощью сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного на расстоянии 240 мм от образца, и программного обеспечения Data Collector v. 2,2b. Параметры сбора данных для профиля отображаются над изображением в разделе «Данные» этого отчета, включая щель расходимости (ЩР) перед зеркалом.
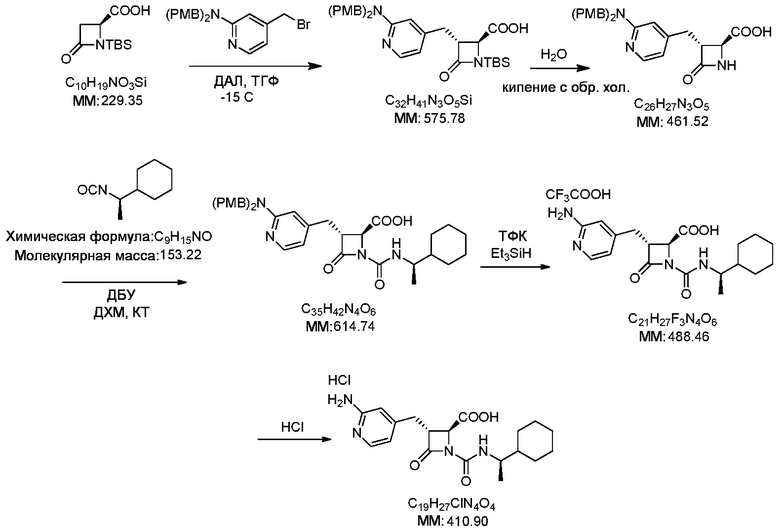
Схема 2 иллюстрирует альтернативный способ получения соединения 1•HCl.
Пример 4. Синтез гидрохлорида (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновйо кислоты
Этот пример описывает гидрохлорида (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты в дополнение к примерам, описанным выше.
Стадия 1 (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-4-оксоазетидин-2-карбоновая кислота

Коммерческую (S)-1-(трет-бутилдиметилсилил)-4-оксоазетидин-2-карбоновую кислоту (56,5 г, 0,246 моль) растворяют в ТГФ (850 мл) и охлаждают до -40°C. Лактам депротонируют диизопропиламидом лития (252,5 мл, 0,505 моль, 2M в ТГФ) при примерно от -40 до -20°C. Полученную смесь перемешивают при -40±5°C в течение 1 ч, охлаждают до -60±5°C и затем обрабатывают предварительно охлажденным раствором 4-(бромметил)-N,N-бис(4-метоксибензил)пиридин-2-амина (100 г, 0,234 моль) в ТГФ (450 мл), сохраняя температуру ниже -40°C. Реакционную смесь перемешивают в течение нескольких часов при -40±5°C и нагревают до КТ и перемешивают в течение ночи. Затем смесь гасят водой (565 мл) и нагревают до 60±5°C в течение 1 ч. Реакционную смесь охлаждают до КТ, и ТГФ удаляют при пониженном давлении. Водную фазу экстрагируют ЭА (565 мл x 3) для удаления примесей. Водную фазу подкисляют до pH 3,1-3,3 добавлением 6 N водного раствора HCl и экстрагируют ЭА (850 мл и затем 565 мл). Эту объединенную органическую фазу сушат и концентрируют с получением (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-4-оксоазетидин-2-карбоновой кислоты (84,1 г) с 74% выходом с чистотой более 95% (ЖХ способ 1).
Стадия 2 (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновая кислота

(2S,3R)-3-((2-(Бис(4-метоксибензил)амино)пиридин-4-ил)метил)-4-оксоазетидин-2-карбоновую кислоту (84 г, 0,182 моль) растворяют в ДХМ (210 мл) и обрабатывают ДБУ (97 г, 0,637 моль), затем (R)-(1-изоцианатоэтил)циклогексаном (55,8 г, 0,364 моль) при КТ. Реакционную смесь перемешивают при КТ в течение ночи. Смесь разбавляют гептаном (2500 мл) и перемешивают при КТ в течение, по меньшей мере, 30 мин, затем фильтруют и сушат в вакууме. Неочищенный продукт повторно суспендируют в гептане (1000 мл) при КТ в течение, по меньшей мере, 4 ч. Твердые вещества фильтруют и сушат с получением неочищенного продукта. Неочищенный продукт растворяют в ДХМ (2250 мл) и промывают 10% водной лимонной кислотой (1000 мл x 3). ДХМ фазу сушат и концентрируют досуха с получением (2S,3R)-3-((2-(бис(4-метоксибензил)амино)пиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты (106 г) с 94,7% выходом и чистотой более 95% (ЖХ способ 1).
Стадия 3 трифторацетат (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты
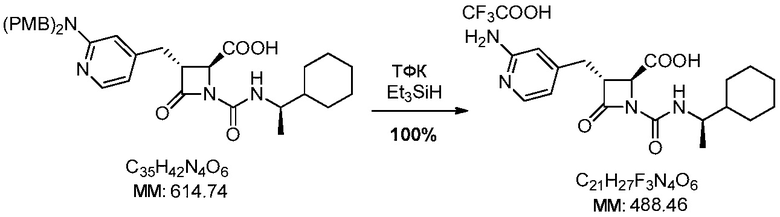
(2S,3R)-3-((2-(Бис(4-метоксибензил)амино)пиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновую кислоту (100 г, 0,163 моль) растворяют в трифторуксусной кислоте (500 ил) и обрабатывают триэтилсиланом (75,7 г, 0,65 моль) при КТ. После перемешивания в течение ночи при КТ реакционную смесь концентрируют с получением остатка. Остаток растворяют в АЦН и экстрагируют гексаном (3×500 мл). Смесь (слой АЦН) снова концентрируют досуха (сушат в высоком вакууме в течение, по меньшей мере, 4 ч) с получением (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты со 100% выходом в виде трифторацетата.
Стадия 4 гидрохлорид (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты

Трифторацетат (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты растворяют в АЦН (350 мл) при КТ. Мутный раствор фильтруют, и нерастворимые вещества промывают АЦН (50 мл). Фильтрат охлаждают до 5±5°C и обрабатывают хлористоводородной кислотой (488 мл, 1 N эфирный раствор). Смесь перемешивают при КТ в течение ночи. Кристаллический продукт собирают фильтрацией и сушат. Неочищенный продукт суспендируют в изопропиловом спирте (100 мл) при КТ в течение ночи, фильтруют, и твердые вещества промывают МТБЭ (2×50 мл) с получением гидрохлорида (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты в виде белого твердого вещества (34,8 г) с 71% выходом и 98,1% чистотой (ЖХ способ 2).
Пример 5. Методика ЖХВД для анализа чистоты (% площади)
ЖХ способ 1
Сущность: Образцы разбавляют в подходящем разбавителе. Полученные растворы анализируют с применением ЖХВД с обращенной фазой с УФ определением при 215 нм.
Оборудование и материалы:
ЖХВД система Agilent 1100/1200 или эквивалент
Колонка: Agilent Eclipse Plus C18, 4,6×100 мм, 3,5 мкм
Трифторуксусная кислота (ТФК), EMD или эквивалент
ЖХВД степени очистки ацетонитрил (АЦН), Fisher или эквивалент
ЖХВД степени очистки вода (H2O), Fisher или эквивалент
0,45 мкм ПТФЭ шприцевой фильтр
Приготовление раствора:
Подвижная фаза A: 0,1% ТФК в H2O
Добавляют 1,0 мл ТФК к 1,0 л H2O. Тщательно смешивают. Масштабируют при необходимости.
Подвижная фаза B: 0,1% ТФК в АЦН
Добавляют 1,0 мл ТФК к 1,0 л АЦН. Тщательно смешивают. Масштабируют при необходимости.
Разбавитель A: 1:1 АЦН/H2O
Объединяют равные объемы АЦН и воды. Тщательно смешивают. Масштабируют при необходимости.
Разбавитель B: АЦН
Таблица 7. Условия хроматографии для ЖХ способа 1
*Если применяют DAD, Ref.= нет, Bw=8 нм, щель=16 нм.
Таблица 8. Градиент для ЖХ способа 1
+ 5,0 минут время для ре-уравновешивания
ЖХ способ 2
Сущность: Образцы разбавляют в 1:1 ацетонитриле:воде. Полученные растворы анализируют с применением ЖХВД с обращенной фазой с УФ определением при 215 нм.
Оборудование и материалы:
ЖХВД система Agilent 1100/1200 или эквивалент
Колонка: Agilent Eclipse Plus C18, 4,6×100 мм, 3,5 мкм
Фосфорная кислота, 85% (H3PO4), Macron или эквивалент
ЖХВД степени очистки ацетонитрил (АЦН), Fisher или эквивалент
ЖХВД степени очистки вода (H2O), Fisher или эквивалент
Приготовление раствора:
Подвижная фаза A: 0,1% H3PO4 in H2O
Добавляют 1,0 мл H3PO4 к 1,0 л H2O. Тщательно смешивают. Масштабируют при необходимости.
Подвижная фаза B: 0,1% H3PO4 в АЦН
Добавляют 1,0 мл H3PO4 к 1,0 л АЦН. Тщательно смешивают. Масштабируют при необходимости.
Разбавитель A: 1:1 АЦН/H2O
Объединяют равные объемы АЦН и воды. Тщательно смешивают. Масштабируют при необходимости.
Таблица 9. Условия хроматографии для ЖХ способа 2
*Если применяют DAD, Ref.= нет, Bw=8 нм, щель=16 нм.
Таблица 10. Градиент для ЖХ способа 2
+ 5,0 минут время для ре-уравновешивания
Пример 6. Исследование эффективности соединения 1 в модели искусственного кровообращения на модели гончей собаки
Целью этого исследования было продемонстрировать эффективность соединения 1 по сравнению со стандартом лечения (SOC), гепарином, для предотвращения активации компонентов свертывания крови при использовании цепи искусственного кровообращения (CPB) в течение длительного времени пробега в день 1 в модели гончей собаки смешанной породы. Дизайн исследования показан в таблице 11:
Таблица 11. Дизайн эксперимента (целевые дозы соединения 1b)
3 мг/млa
НП - не применяется
a Животное № 1001 получало 0,6 мкг/мл и животное № 1004 получало 3 мг/мл.
b Показанные дозы является целевыми для дозирования в этом исследовании; актуальные значения доз показаны в разделе результатов.
В этом исследовании оценивались следующие параметры и конечные точки: смертность, масса тела, физические параметры, параметры клинической патологии (гематология и коагуляция), 1212время коагуляции и биоаналитические параметры.
Дизайн эксперимента
Введение
Носитель и тестируемое изделие вводят внутривенной (ВВ) инфузией один раз в день 1 в течение 135 минут (начинают за 30 минут до начала искусственного кровообращения (CPB) и продолжают в течение 105 минут CPB). Животные группы 2 получают ВВ болюсную дозу 0,6 мкг/мл или 3,0 мг/мл непосредственно перед началом ВВ инфузии. Животные групп 3, 4 и 5 получают ВВ болюсную дозу 10 мг/кг до начала ВВ инфузии; с помощью машины CPB, заполненной испытуемым образцом в дозе 10 мкг/мл.
Хирургическая процедура
Группа 1 имеет установку инфузионного насоса с открытой системой/резервуаром. Инфузию соединения 1 начинают за 30 минут до помещения животного на насос CPB. Насос CPB был заполнен 0,9% солевым раствором.
Группы 2, 3 и 4 имеют установку инфузионного насоса с открытой системой/резервуаром. Венозные и артериальные оболочки промывают соединением 1 в концентрации 10 мкг/мл. ВВ болюсную дозу тестируемого продукта вводят непосредственно перед началом инфузии. Инфузию соединения 1 начинают за 30 минут до помещения животного на насос CPB. Пациенту с CPB вводят 10 мкг/мл соединения 1 до включения насоса CPB.
Группа 5 имеет установку инфузионного насоса с закрытой системой/«мешком». Венозные и артериальные оболочки затем промывают соединением 1 в концентрации 10 мкг/мл. ВВ болюсную дозу Соединения 1 вводят непосредственно перед началом инфузии. Инфузию соединения 1 начинают за 30 минут до помещения животного на насос CPB.
Результаты
На ФИГ. 10 показаны градиенты давления, оцениваемые через мембрану оксигенатора. Исследования, проведенные ранее без антикоагулянта, показали, что давление через мембрану оксигенатора создается в течение 15 минут после запуска насоса и экспоненциально возрастает в течение следующих 30 минут, так что оксигенатор закупоривается и циркуляция прекращается, тогда как с Соединением 1 при многократных дозах, градиент давления через мембрану оксигенатора остается постоянным на протяжении всего цикла, указывая на то, что тестируемый продукт успешно поддерживает антикоагуляцию, что позволяет продолжать работу насоса на протяжении всего протокола.
На ФИГ. 11 показана корреляция между концентрацией Соединения 1 в плазме и аЧТВ. Все животные дожили до окончания исследования. В целом, соединение 1 не было связано с каким-либо увеличением заболеваемости или смертности при уровнях доз, используемых в этом исследовании во время протокола Искусственного кровообращения/ЭКМО.
Во время инфузии Соединения 1 и до CPB аЧТВ было от умеренного до заметно продленного у всех животных (ФИГ. 12). Продление аЧТВ сохраняется на протяжении всей инфузии Соединения 1 и CPB. В группах, которые получали нагрузочную дозу Соединения 1 (Группы 2-5), продление аЧТВ наиболее выражено до (Группы 3-5) или в течение первых 30 минут CPB (Группа 2), но затем немного улучшается до достижения устойчивого состояния. Животные группы 1 не получают ударную дозу соединения 1, и продление аЧТВ остается относительно постоянным во все измеренные моменты времени во время инфузии соединения 1 в этой группе. Во всех группах после прекращения инфузии соединения 1 и CPB аЧТВ стремилось к исходным значениям, но оставалось умеренно продленным по завершении исследования.
Выводы
Введение Соединения 1 в модели позволило предотвратить активацию свертывания крови в компонентах искусственного кровообращения. Антикоагулянтное действие Соединения 1 было избирательным по отношению к ингибированию активированного частичного тромбопластинового времени (аЧТВ). Кроме того, данные продемонстрировали, что добавление болюсной дозы непосредственно перед началом инфузии позволяет быстро достичь целевых уровней соединения 1 в плазме, наряду с желаемыми устойчивыми уровнями, и было достаточным для достижения успешного 105-минутного прогона CPB и предотвращения коагуляции в большинстве компонентов цепи.
В целом эти данные показывают, что соединение 1 может быть приемлемой альтернативой гепарину в предотвращении свертывания крови в компонентах искусственного кровообращения.
ЭКВИВАЛЕНТЫ
Хотя обсуждались конкретные варианты осуществления настоящего описания, приведенное выше описание является иллюстративным, а не ограничивающим. Многие варианты раскрытия станут очевидными для специалистов в данной области техники после ознакомления с этим описанием. Полный объем описания должен определяться формулой изобретения вместе с полным объемом ее эквивалентов и описанием вместе с такими вариациями.
Если не указано иное, все числа, выражающие количества ингредиентов, условия реакции и так далее, используемые в описании и формуле изобретения, следует понимать как модифицированные во всех случаях термином «примерно». Соответственно, если не указано иное, числовые параметры, изложенные в этом описании и прилагаемой формуле изобретения, являются приблизительными, которые могут варьироваться в зависимости от желаемых свойств, которые должны быть получены с помощью настоящего описания.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ | 2019 |
|
RU2817800C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ | 2015 |
|
RU2733405C2 |
| АНТИТЕЛА К ФАКТОРУ XI И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2739946C2 |
| ИНГИБИТОРЫ ФАКТОРА XIa | 2016 |
|
RU2712268C2 |
| ВОЗБУЖДЕНИЕ ВАЗОДИЛАТАЦИИ ПЕРИФЕРИЧЕСКИХ КРОВЕНОСНЫХ СОСУДОВ | 2006 |
|
RU2435578C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2017 |
|
RU2754507C2 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО МИЕЛОИДНОГО ЛЕЙКОЗА | 2020 |
|
RU2812782C2 |
| ВОЗБУЖДЕНИЕ ВАЗОДИЛАТАЦИИ ПЕРИФЕРИЧЕСКИХ КРОВЕНОСНЫХ СОСУДОВ | 2011 |
|
RU2587321C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ, СВЯЗАННЫХ С ИЗБЫТОЧНЫМ ОТЛОЖЕНИЕМ ФИБРИНА И/ИЛИ ОБРАЗОВАНИЕМ ТРОМБОВ | 2015 |
|
RU2732761C2 |
| ПРИМЕНЕНИЕ ЧЕТВЕРТИЧНЫХ СОЛЕЙ ПИРИДИНИЯ В КАЧЕСТВЕ ВАЗОПРОТЕКТОРНЫХ СРЕДСТВ | 2005 |
|
RU2366420C2 |
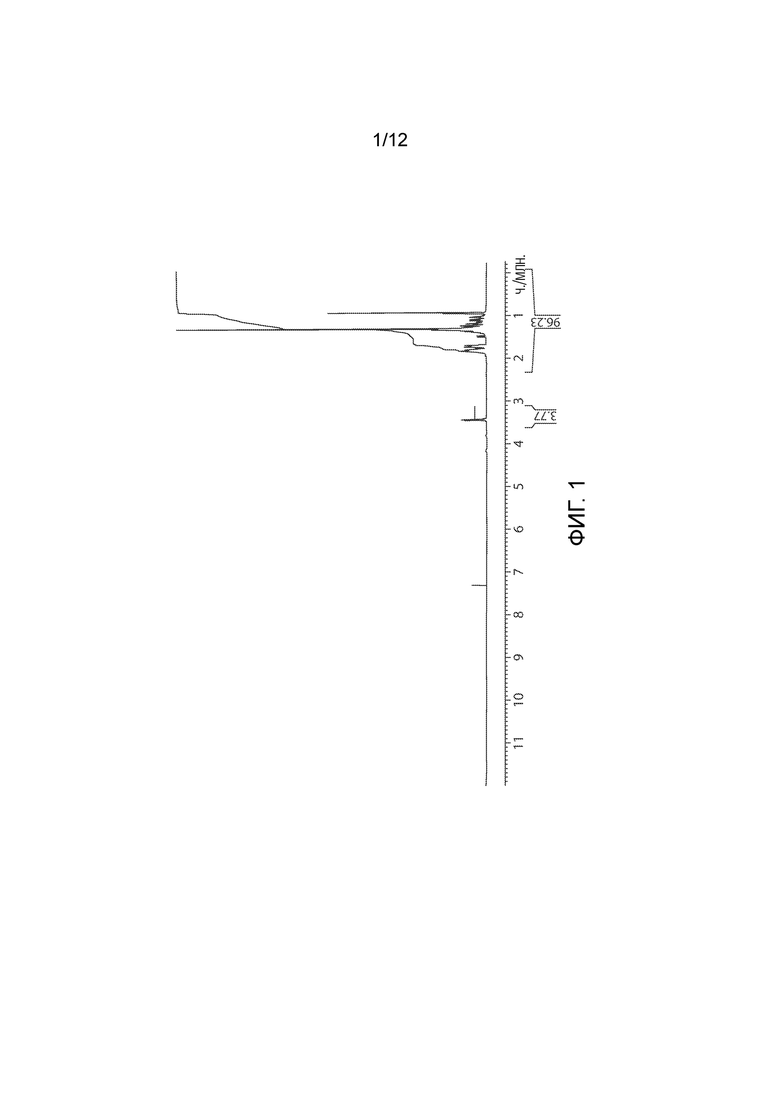
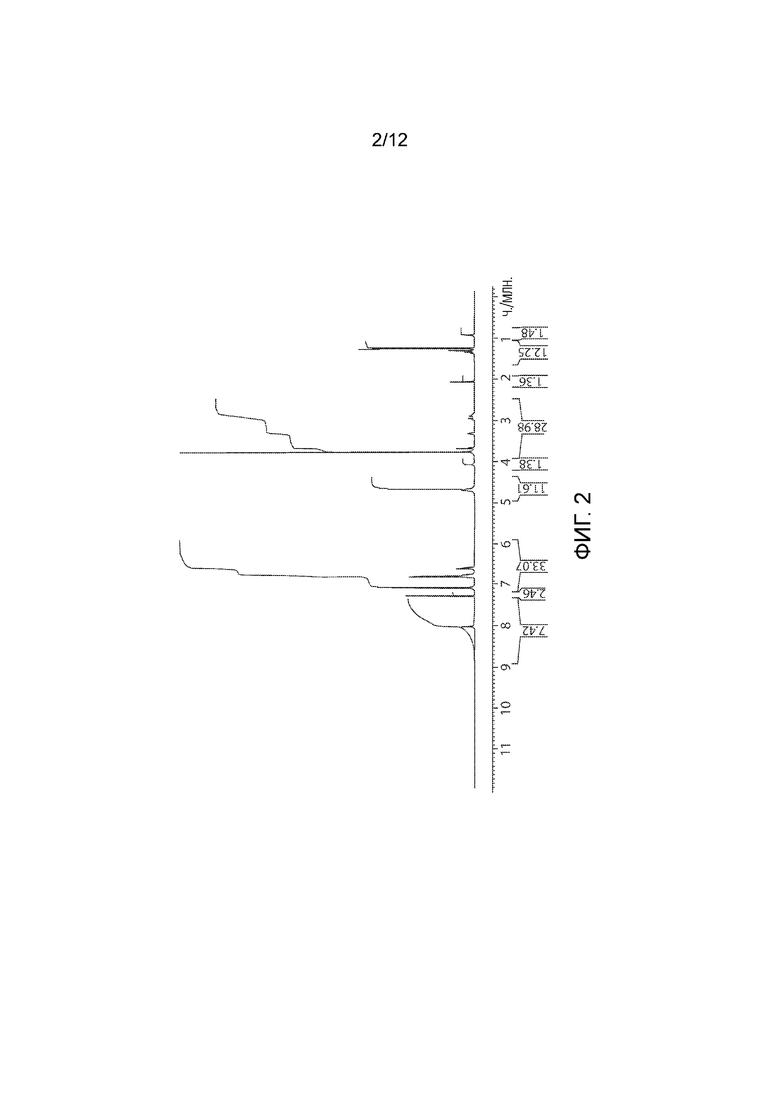
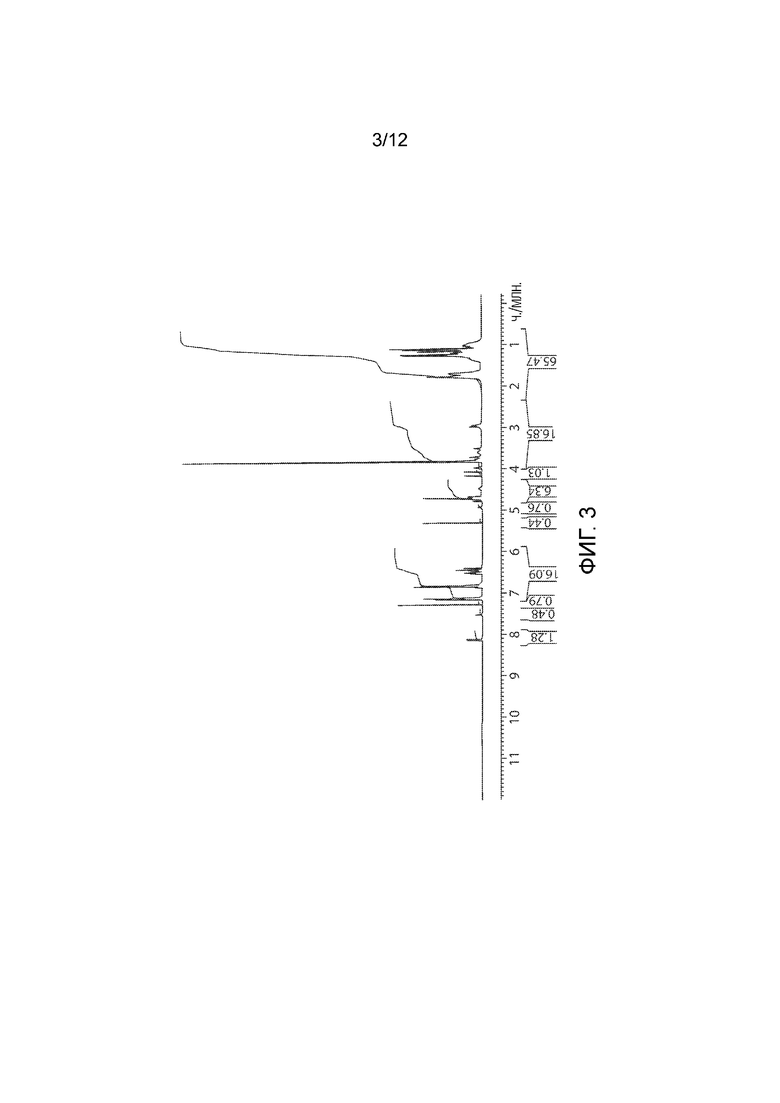




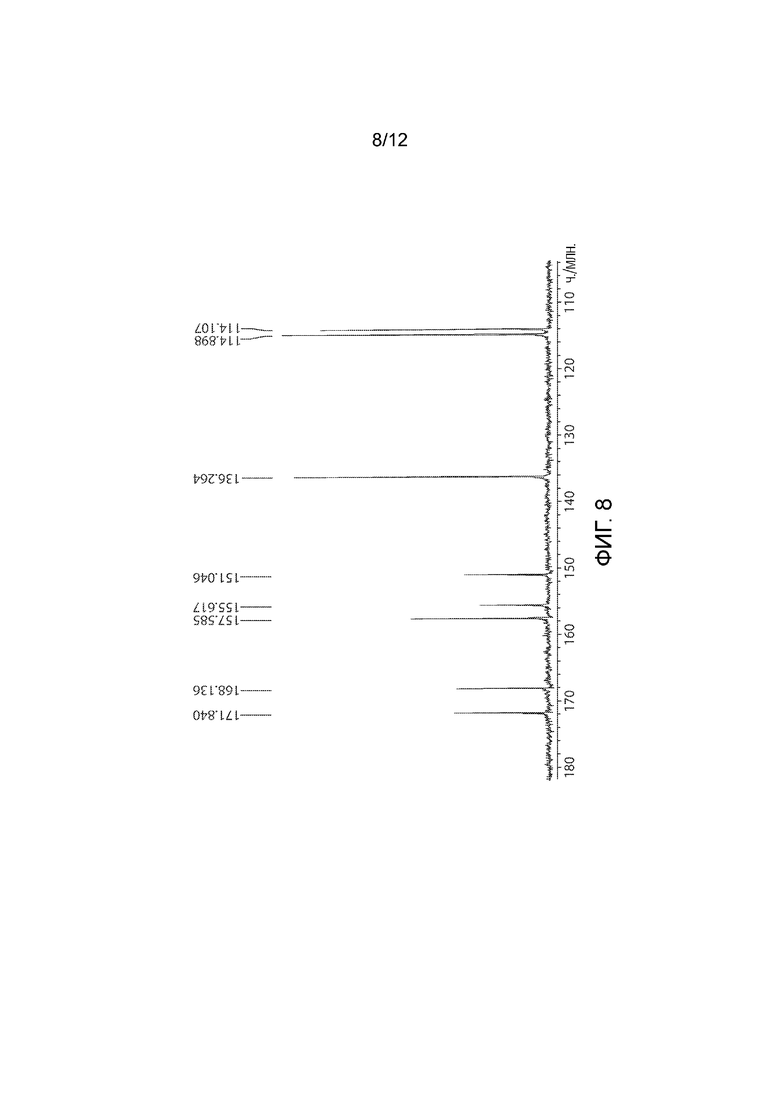
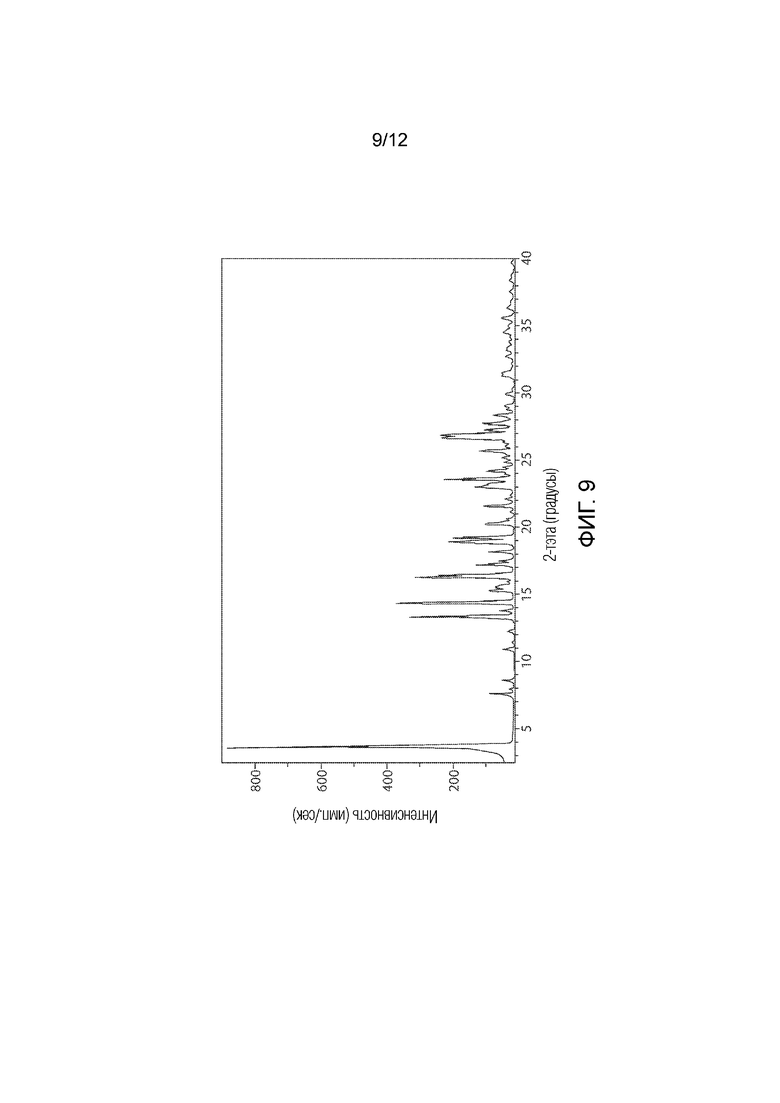

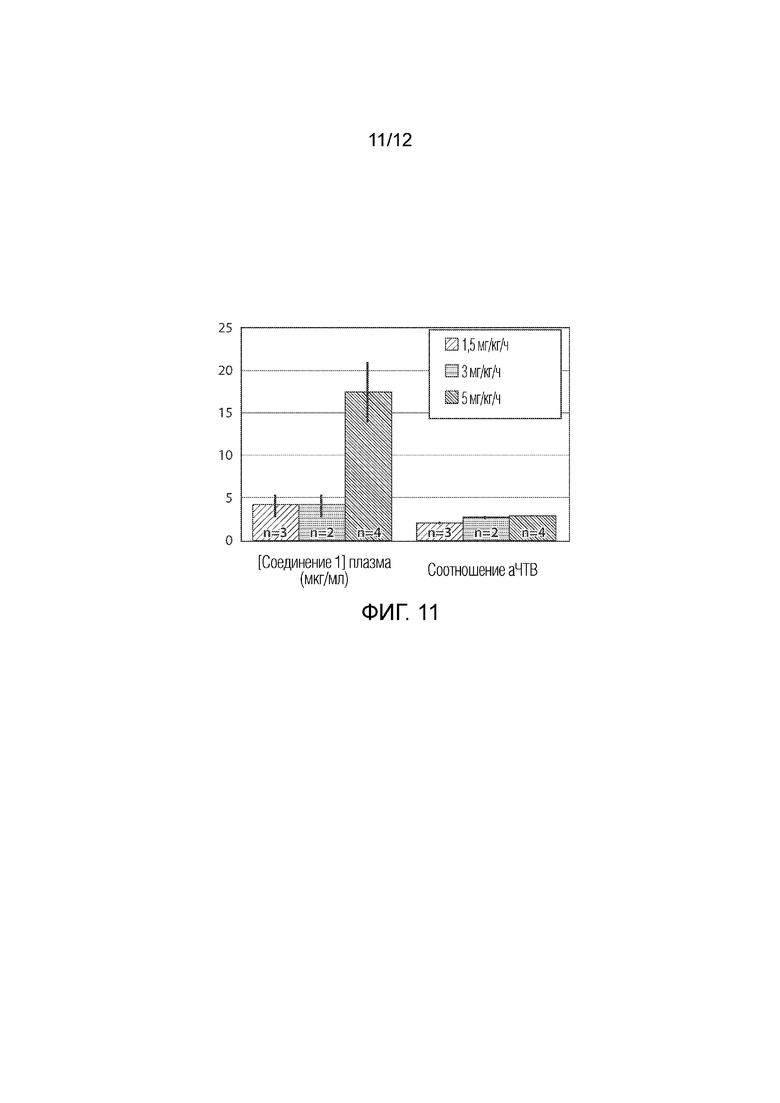

Изобретение относится к способу получения фармацевтически приемлемой соли формулы (I). Способ осуществляют путем растворения соли формулы (II) в растворителе, с получением раствора и добавления хлороводорода к раствору, с получением соединения формулы (I). Технический результат – получение гидрохлорида (2S,3R)-3-((2-аминопиридин-4-ил)метил)-1-(((R)-1-циклогексилэтил)карбамоил)-4-оксоазетидин-2-карбоновой кислоты. 23 з.п. ф-лы, 12 табл., 12 ил., 5 пр.
 (I)
(I)
 (II)
(II)
1. Способ получения фармацевтически приемлемой соли формулы (I)
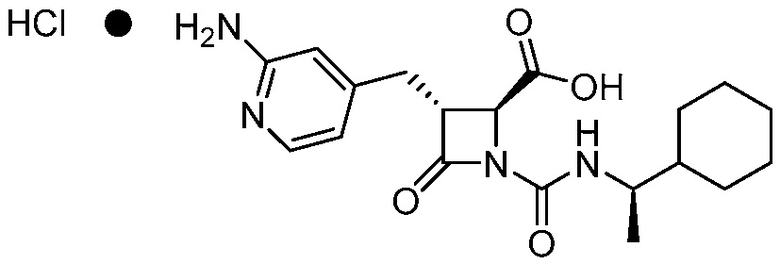 (I)
(I)
включающий растворение соли формулы (II)
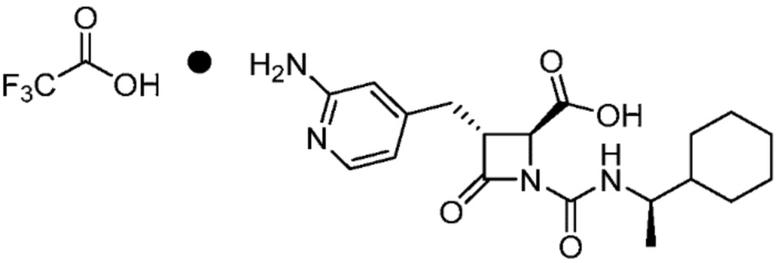 (II)
(II)
в растворителе, с получением раствора, и добавление хлороводорода к раствору,
с получением фармацевтически приемлемой соли формулы (I).
2. Способ по п. 1, где соль формулы (II) растворяют в апротонном растворителе.
3. Способ по п. 1 или 2, где растворитель представляет собой ацетонитрил.
4. Способ по любому из пп. 1-3, где хлороводород добавляют в раствор барботированием газообразного HCl в раствор или добавлением второго раствора, содержащего HCl в раствор, в котором растворена соль формулы (II).
5. Способ по п. 4, где второй раствор, содержащий HCl, представляет собой эфирный раствор хлористоводородной кислоты.
6. Способ по любому из пп. 1-5, где исходное количество соли формулы (II) больше или равно 500 граммов.
7. Способ по любому из пп. 1-6, где исходное количество соли формулы (II) больше или равно 1 килограмму.
8. Способ по любому из пп. 1-7, дополнительно включающий очистку фармацевтически приемлемой соли формулы (I) растворением фармацевтически приемлемой соли формулы (I) в растворителе с последующим осаждением растворенной фармацевтически приемлемой соли формулы (I) с применением другого растворителя.
9. Способ по п. 8, где растворитель, в котором растворяют фармацевтически приемлемую соль формулы (I), представляет собой изопропиловый спирт.
10. Способ по п. 8 или 9, где растворитель, используемый для осаждения растворенной фармацевтически приемлемой соли формулы (I), представляет собой метил-трет-бутиловый эфир.
11. Способ по любому из пп. 1-10, дополнительно включающий очистку фармацевтически приемлемой соли формулы (I) суспендированием фармацевтически приемлемой соли формулы (I) в растворителе и затем фильтрованием фармацевтически приемлемой соли формулы (I) для отделения фармацевтически приемлемой соли формулы (I) от растворителя.
12. Способ по п. 11, где растворитель, в котором суспендируют фармацевтически приемлемую соль формулы (I), представляет собой изопропиловый спирт.
13. Способ по любому из пп. 1-12, включающий получение соли формулы (II) контактированием соединения формулы (III)
 (III)
(III)
с трифторуксусной кислотой.
14. Способ по п. 13, дополнительно включающий контакт соединения формулы (III) с силаном.
15. Способ по п. 14, где силан представляет собой триэтилсилан.
16. Способ по любому из пп. 13-15, включающий получение соединения формулы (III) контактированием соединения формулы (IV)
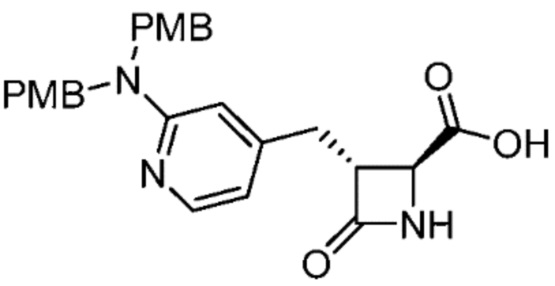 (IV)
(IV)
с соединением формулы (V)
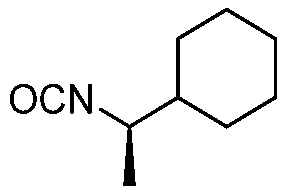 (V).
(V).
17. Способ по п. 16, где способ проводят в присутствии растворителя.
18. Способ по п. 16 или 17, где способ проводят в присутствии основания.
19. Способ по п. 18, где основание представляет собой 1,8-диазабицикло(5,4,0)ундец-7-ен.
20. Способ по любому из пп. 16-19, включающий получение соединения формулы (IV) контактированием соединения формулы (VI)
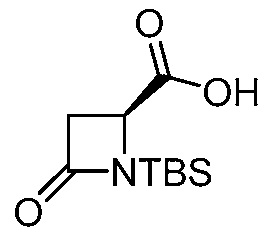 (VI)
(VI)
с соединением формулы (VII)
 (VII).
(VII).
21. Способ по любому из пп. 13-20, где соединение формулы (III) очищают способом очистки, который не является хроматографией.
22. Способ по п. 21, где способ очистки включает суспендирование соединения формулы (III) в растворителе с последующей фильтрацией соединения формулы (III) для отделения соединения формулы (III) от растворителя.
23. Способ по п. 22, где растворитель, в котором суспендируют соединение формулы (III), представляет собой гептан.
24. Способ по любому из пп. 1-23, где соединение формулы (I) очищают способом очистки, который не является хроматографией.
| WO 2015120062 A2, 13.08.2015 | |||
| Karol Sikora et al., Citropin 1.1 Trifluoroacetate to Chloride Counter-Ion Exchange in HCl-saturated organic solutions: An Alternative Approach | |||
| International Journal of Peptide Research and Therapeutics., 2017, vol.24(2), p.265-270 | |||
| WO 2018118705 A1, 28.06.2018 | |||
| US 20150157624 A1, 11.06.2015 | |||
| US 7501404 B2, |
Авторы
Даты
2024-02-16—Публикация
2019-10-30—Подача