Настоящее изобретение относится к производным имидазо[1,2-α]пиридин-2-карбоксамидов, к их применению в терапии для лечения или профилактики заболеваний, связанных с нуклеарными рецепторами Nurr-1, называемыми также NR4A2, NOT, TINUR, RNR-1 и HZF3.
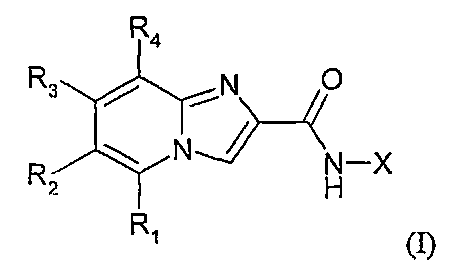
Объектом настоящего изобретения являются соединения, отвечающие формуле (I):
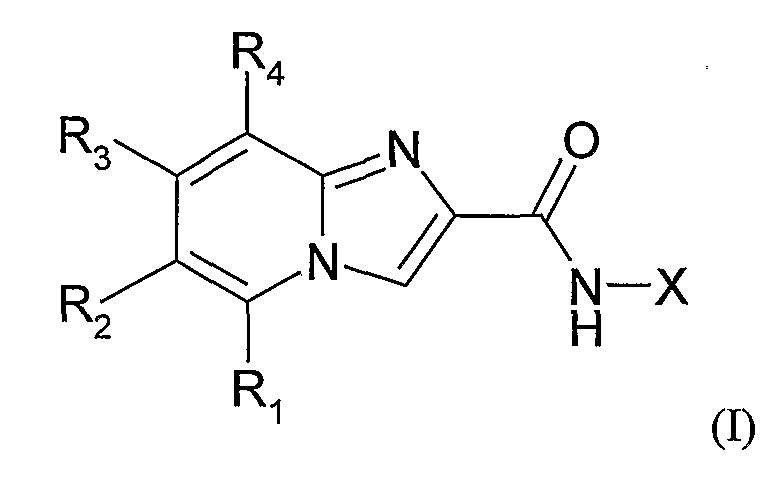
где
Х представляет собой одну из следующих групп:
- фенильную группу, необязательно замещенную одной или несколькими группами, независимо выбранными из следующих атомов или групп: галогена, (С1-С6)алкокси, (С1-С6)алкила, (С3-С7)циклоалкил(С1-С6)алкила, (С3-С7)циклоалкил(С1-С6)алкокси, NRaRb,
R1 представляет собой атом водорода, галоген, (С1-С6)алкокси, (С1-С6)алкил, (С3-С7)циклоалкил(С1-С6)алкил, (С3-С7)циклоалкил(С1-С6)алкокси, амино, группу NRcRd; причем алкильные и алкоксигруппы могут быть необязательно замещены одним или несколькими галогенами, гидрокси, амино или (С1-С6)алкокси,
R2 представляет собой одну из следующих групп:
- атом водорода,
- (С1-С6)алкил, необязательно замещенный одной или несколькими группами, независимо выбранными из гидрокси, галогена, амино, группы NRaRb, фенильной группы,
- (С1-С6)алкокси, необязательно замещенный одной или несколькими группами, независимо выбранными из гидрокси, галогена, амино, группы NRaRb,
- (С3-С7)циклоалкил(С1-С6)алкил,
- (С3-С7)циклоалкил(С1-С6)алкокси,
- (С2-С6)алкенил,
- (С2-С6)алкинил,
- группу -CO-R5,
- группу -CO-NR6R7,
- группу -CO-O-R8,
- группу -NR9-CO-R10,
- группу -NR11R12,
- атом галогена,
- цианогруппу,
- фенильную группу, необязательно замещенную одной или несколькими группами, независимо выбранными из следующих атомов или групп: галогена, (С1-С6)алкокси, NRaRb, -CO-R5, -CO-NR6R7, -CO-O-R8, (С3-С7)циклоалкил(С1-С6)алкила, (С3-С7)циклоалкил(С1-С6)алкокси, (С1-С6)алкила, необязательно замещенного одной или несколькими гидроксигруппами или NRaRb,
R3 представляет собой атом водорода, (С1-С6)алкил, (С1-С6)алкокси или атом галогена,
R4 представляет собой атом водорода, (С1-С4)алкил, (С1-С4)алкокси или атом фтора,
R5 представляет собой атом водорода, фенильную группу или (С1-С6)алкил,
R6 и R7, одинаковые или различные, представляют собой атом водорода или (С1-С6)алкил, или вместе с атомом азота образуют 4-7-членный цикл, необязательно включающий другой гетероатом, выбранный из N, O или S,
R8 представляет собой (С1-С6)алкил,
R9 и R10, одинаковые или различные, представляют собой атом водорода или (С1-С6)алкил,
R11 и R12, одинаковые или различные, представляют собой (С1-С6)алкил, или вместе с атомом азота образуют 4-7-членный цикл, необязательно включающий другой гетероатом, выбранный из N, O или S,
Ra и Rb независимо друг от друга представляют собой водород, (С1-С6)алкил или вместе с атомом азота образуют 4-7-членный цикл,
Rc представляет собой водород, и Rd представляет собой (С1-С6)алкил,
и, по меньшей мере, один из заместителей R1, R2, R3 и R4 отличен от водорода;
и когда R3 означает метил, Х является незамещенным;
когда R1 означает метил, Х является незамещенным;
когда R2 означает хлор, Х не является парафторфенилом;
в форме основания или соли присоединения кислоты.
Соединения формулы (I) могут включать один или несколько асимметрических атомов углерода. Они могут быть, таким образом, в виде энантиомеров или диастереоизомеров. Данные энантиомеры, диастереоизомеры, а также их соли, включая рацемические смеси, составляют часть настоящего изобретения.
Соединения формулы (I) могут быть в виде оснований или солей присоединения кислот. Данные соли присоединения составляют часть настоящего изобретения.
Упомянутые соли могут быть получены из фармацевтически приемлемых кислот, но соли других кислот, пригодных, например, для очистки или выделения соединений формулы (I), также составляют часть настоящего изобретения.
Соединения формулы (I) могут быть также в виде гидратов или сольватов, а именно в виде ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Данные гидраты и сольваты также составляют часть настоящего изобретения.
В рамках настоящего изобретения подразумевают:
- под атомом галогена: фтор, хлор, бром или йод;
- под алкильной группой: алифатическую насыщенную группу, линейную, разветвленную или циклическую. В качестве примеров можно назвать группы метил, этил, пропил, изопропил, бутил, изобутил, третбутил, циклопропил, циклобутил, циклопентил, циклогексил и т.д.;
- под алкенильной группой: алифатическую моно- или полиненасыщенную группу, линейную или разветвленную, содержащую, например, одну или несколько этиленовоненасыщенных связей;
- под алкоксигруппой: радикал -О-алкил, где алкильная группа, определена ранее;
- под алкинильной группой: алифатическую моно- или полиненасыщенную группу, линейную или разветвленную, содержащую, например, одну или несколько ацетиленовоненасыщенных связей.
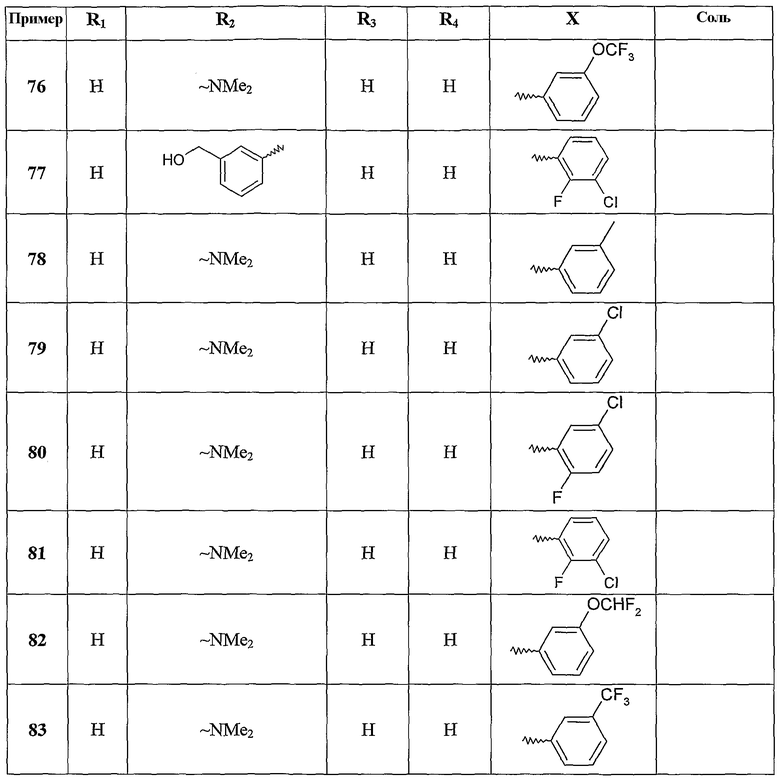
Среди соединений формулы (I), составляющих объект настоящего изобретения, первая группа состоит из соединений, где Х означает фенильную группу.
Среди соединений формулы (I), составляющих объект настоящего изобретения, вторая группа состоит из соединений, где R1, R3 и R4 означают атомы водорода.
Среди соединений формулы (I), составляющих объект настоящего изобретения, можно, в частности, назвать следующие:
6-хлор-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
8-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(1-гидрокси-1-метилэтил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
N-(4-фторфенил)-6-изопропенилимидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-(2-хлорфенил)имидазо[1,2-α]пиридин-2-карбоксамид
N,6-дифенилимидазо[1,2-α]пиридин-2-карбоксамид
N-фенил-6-винилимидазо[1,2-α]пиридин-2-карбоксамид
6-этил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-формил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-этинил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[3-(1-гидрокси-1-метилэтил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[гидрокси(фенил)метил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
гидрохлорид (1:1) 6-ацетил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида
6-изопропил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(1-гидроксиэтил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-ацетамидо-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-5-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
5-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
7-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-бром-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-фтор-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6,8-дифтор-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-бром-5-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-иод-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-циано-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(гидроксиметил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-метокси-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
N-(4-фторфенил)-6-(1-гидрокси-1-метилэтил)имидазо[1,2-α]пиридин-2-карбоксамид
6-бензоил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-изопропенил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-(3-фторфенил)имидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-(3-хлорфенил)имидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-(3-метоксифенил)имидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-[4-(диметиламино)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-(4-хлорфенил)имидазо[1,2-α]пиридин-2-карбоксамид
6-[2-(гидроксиметил)фенил)]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[3-(гидроксиметил)фенил)]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[4-(гидроксиметил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(2-формилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-формилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
5,6-диметил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
метил 3-[2-(анилинкарбонил)имидазо[1,2-α]пиридин-6-ил]бензоат
6-(3-ацетилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-фторфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(4-метилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-метоксифенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[3-(аминометил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-хлорфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-карбамоилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[3-(1-гидроксиэтил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-метилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(диэтиламино)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид и его гидрохлорид (1:1)
6-[3-(метилкарбамоил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид и его гидрохлорид (1:1)
6-карбамоил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-(3-фторфенил)имидазо[1,2-α]пиридин-2-карбоксамид
N-(2,5-дифторфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
N-(2,3-дифторфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-(2-фторфенил)имидазо[1,2-α]пиридин-2-карбоксамид
N-(3-фторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(3,5-дифторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(2-хлорфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
6-[3-(гидроксиметил)фенил]-N-(3-метилфенил)имидазо[1,2-α]пиридин-2-карбоксамид
N-(2,5-дифторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(2,3-дифторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(2-фторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(5-хлор-2-фторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
6-морфолин-4-ил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид и его гидрохлорид (1:1)
6-азетидин-1-ил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-йод-5-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
N-(3,5-дифторфенил)-6-йодимидазо[1,2-α]пиридин-2-карбоксамид
N-(3-хлорфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(3,5-дифторфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
N-(2-хлорфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-[3-(трифторметокси)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(3-хлор-2-фторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-(3-метилфенил)мидазо[1,2-α]пиридин-2-карбоксамид
N-(3-хлорфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
N-(5-хлор-2-фторфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
N-(3-хлор-2-фторфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
N-[3-(дифторметокси)фенил]-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-[3-(трифторметил)фенил]мидазо[1,2-α]пиридин-2-карбоксамид
В соответствии с изобретением можно получить соединения общей формулы (I) способом, представленным на схеме 1.
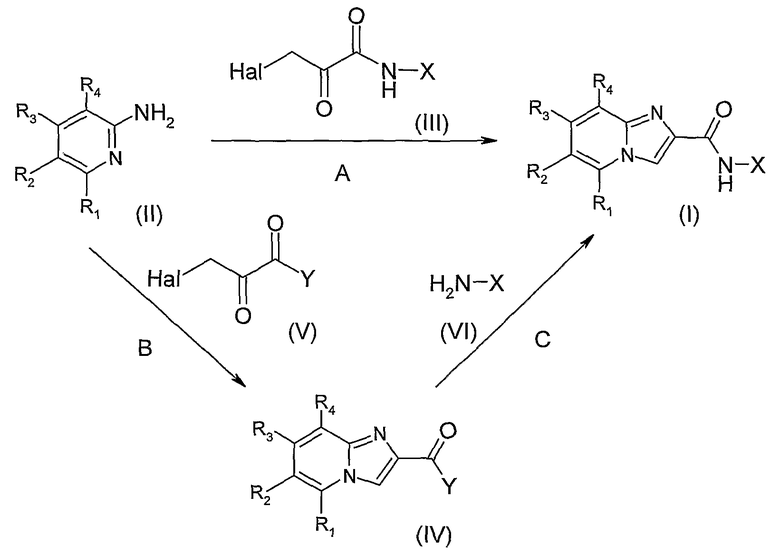
Путь А состоит в получении 2-аминопиридинов формулы (II) способами, известными специалисту в данной области, и в образовании цикла имидазо[1,2-α]пиридина конденсацией с производным 2-оксо-N-арилпропионамида (III), где Hal представляет собой атом хлора, брома или йода, и Х определен ранее аналогично методикам, описанным, например, J-J. Bourguignon et coll. в Aust. J. Chem. 1997, 50, 719-725 и J.G. Lombardino, J. Org. Chem. (1965), 30(7), 2403. Галогенированные производные 2-оксо-N-арилпропионамида (III) могут быть получены согласно методике, описанной Kluger et coll. Dans J.Am.Chem.Soc., (1984) 106(14), 4017.
Второй путь синтеза В, C состоит во взаимодействии имидазопиридин-2-карбоновой кислоты или одного из ее производных, общей формулы (IV), где Y означает ОН или галоген или (С1-С6)алкокси, с ариламином X-NH2 (VI), где Х определен ранее согласно методикам, известным специалисту в данной области. Так, кислота может быть предварительно преобразована в свои реакционно-способные производные, такие как галогенид кислоты, ангидрид, смешанный ангидрид или активный эфир, затем подвергнута взаимодействию с амином (VI) в присутствии основания, такого как диизопропилэтиламин, триэтиламин или пиридин, в инертном растворителе, таком как ТГФ, ДМФ или дихлорметан. Сочетание можно проводить также в присутствии связывающего агента, такого как CDI, EDCI, HATU или HBTU в тех же условиях без отделения реакционно-способного промежуточного соединения. Альтернативным образом можно подвергнуть взаимодействию амин (VI) с эфиром кислоты формулы (IV) в присутствии катализатора, такого как триметилалюминий, согласно методике Weinreb, S. et coll (Tet. Lett. (1977), 18, 4171) или третбутилат циркония. Имидазопиридин-2-карбоновые кислоты и их производные формулы (IV) могут быть получены конденсацией соответствующих 2-аминопиридинов со сложным эфиром 3-галогено-2-оксо-пропионовой кислоты согласно методике, описанной J.G. Lombardino в J. Org. Chem.., 30(7), 2403 (1965), с последующим превращением эфира в кислоту и, в случае необходимости, превращением кислоты в одно из производных.
Для получения продуктов формулы (I), продукты формулы (I) и их предшественники формул (II) или (IV) могут быть, по желанию или в случае необходимости, превращены в другие продукты формулы (I) с помощью одного или нескольких следующих превращений в любом порядке:
а) этерификация или амидирование кислотной группы,
в) амидирование аминной группы,
с) гидролиз эфирной группы в кислотную группу,
d) превращение гидроксильной группы в алкоксигруппу,
е) окисление спиртовой группы в альдегидную или кетонную группы,
f) превращение альдегидной или кетонной групп в спиртовую группу восстановлением или действием металлорганического соединения, такого как магнийорганическое,
g) превращение нитрильного радикала в альдегидную группу,
h) превращение нитрильного радикала в кетонную группу,
i) окисление алкенильной группы в альдегидную или кетонную группу,
j) олефинирование альдегидной или кетонной группы в алкенильную группу,
k) дегидратация гидроксиалькильной группы в алкенильную группу,
l) полное или частичное гидрирование алкенильной или алкинильных групп в алкенильную или алкильную группу,
m) каталитическое сочетание галогенсодержащего производного и металлорганического производного, такого как производное бора, олова или кремния, для введения алкильного, алкенильного, алкинильного или арильного заместителя,
n) восстановление нитрогруппы в первичную аминогруппу,
o) превращение первичной или вторичной аминогруппы в первичную или третичную аминогруппу восстановительным аминированием или алкилированием,
p) защита реакционно-способных групп,
q) элиминирование защитных групп, которые могут защищать реакционно-способные группы,
r) солеобразование посредством минеральной или органической кислоты или основания для получения соответствующей соли,
s) разделение рацемических смесей на энантиомеры,
причем указанные продукты формулы (I), полученные таким образом, находятся по необходимости в любых возможных изомерных рацемических формах, в формах энантиомеров и диастереоизомеров.
Исходные соединения и реактивы, способ получения которых не представлен на схеме 1, являются коммерчески доступными, или описаны в литературе, или могут быть получены по методикам, описанным в литературе или известным специалисту в данной области.
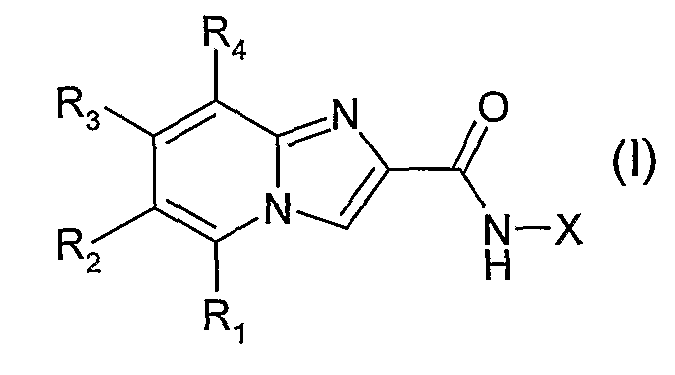
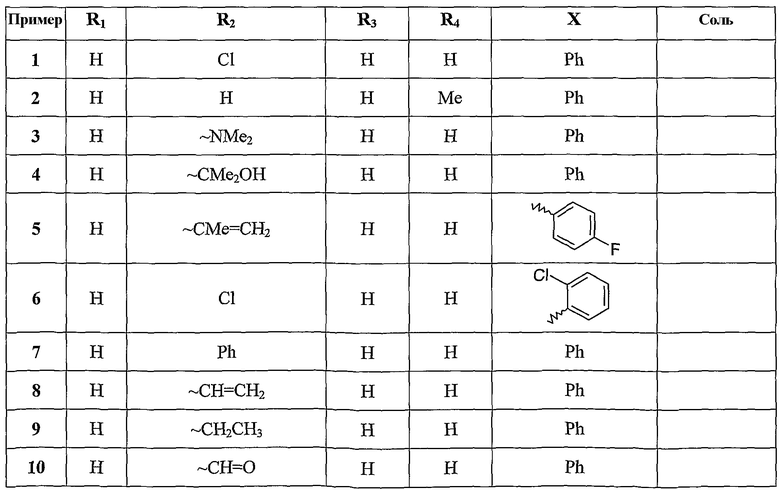
Следующие примеры раскрывают получение некоторых соединений по изобретению. Данные примеры не носят ограничительного характера и лишь иллюстрируют настоящее изобретение. Номера соединений из примеров соответствуют номерам, приведенным в нижеследующих таблицах, иллюстрирующих химические структуры и физические свойства нескольких соединений по изобретению.
Пример 1: 6-хлор-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
К раствору 0,196 г 6-хлоримидазо[1,2-α]пиридин-2-карбоновой кислоты в 3 мл дихлорметана и 0,146 мл тионилхлорида добавляют 1 мл диметилформамида. Реакционную смесь перемешивают в течение 3 часов при комнатной температуре. Добавляют 0,273 мл анилина и перемешивают при комнатной температуре в течение 22 часов. Добавляют 20 мл дихлорметана и 10 мл воды. После декантации органическую фазу сушат над сульфатом магния, фильтруют, упаривают досуха при пониженном давлении, затем очищают на колонке с силикагелем, используя дихлорметан в качестве элюента. Фракции, содержащие продукт, объединяют и концентрируют досуха при пониженном давлении, получая 0,204 г 6-хлор-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде белого твердого вещества.
Пример 2: 8-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
К раствору 0,176 г 8-метилимидазо[1,2-α]пиридин-2-карбоновой кислоты в 12 мл дихлорметана добавляют 1,67 мл триэтиламина, 1,53 г гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида и 1,08 г гидроксибензотриазола. Реакционную смесь перемешивают в течение 20 минут при комнатной температуре. Добавляют 0,090 мл анилина. Реакционную смесь перемешивают в течение 4 часов при комнатной температуре. Добавляют 60 мл дихлорметана и 30 мл воды. После декантации органическую фазу сушат над сульфатом магния, фильтруют, упаривают досуха при пониженном давлении. После очищения флэш-хроматографией (силикагель, элюент дихлорметан/этилацетат 98/02 по объему) получают 0,193 г 8-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде белого твердого вещества.
Пример 3: 6-(диметиламино)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
К раствору 60,8 мкл анилина в 3 мл толуола, охлажденному до 0°С, добавляют по каплям 0,46 мл раствора триметилалюминия 2М в толуоле, затем при 20°С 76 мг этил-6-диметиламиноимидазо[1,2-α]пиридин-2-этилкарбоксилата. Реакционную смесь перемешивают в течение 15 минут при комнатной температуре. Охлаждают до 0°С, затем добавляют 20 мл насыщенного раствора хлорида аммония. Органическую фазу сушат над сульфатом магния, фильтруют на целите, упаривают досуха при пониженном давлении. Остаток хроматографируют на патроне с силикагелем, используя в качестве элюента смесь дихлорметана и этилацетата. Фракции, содержащие продукт, объединяют и концентрируют досуха при пониженном давлении. Полученный остаток перекристаллизовывают из метанола, получая 36 мг 6-(диметиламино)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде порошка серого цвета.
Пример 4: 6-(1-гидрокси-1-метилэтил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
Раствор 100 мг 2-(6-аминопиридин-3-ил)пропан-2-ола в 10 мл 1,2-диметоксиэтана обрабатывают 190 мг 3-бром-2-оксо-N-фенилпропионамида, затем перемешивают в течение 15 часов при 25°С и нагревают с обратным холодильником 3 часа. Реакционную смесь концентрируют досуха при пониженном давлении, и остаток извлекают 40 мл этилацетата и 40 мл насыщенного раствора карбоната натрия. Водную фазу дважды промывают 40 мл этилацетата. Объединенные органические фазы сушат досуха и концентрируют при пониженном давлении. Остаток хроматографируют на патроне с 40 г силикагеля, используя в качестве элюента дихлорметан, затем смеси дихлорметана и метанола 97/3, затем 95/5. Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха, получают 63 мг 6-(1-гидрокси-1-метилэтил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде белого твердого вещества.
Пример 5: N-(4-фторфенил)-6-изопропенилимидазо[1,2-α]пиридин-2-карбоксамид
Раствор 110 мг N-(4-фторфенил)-6-(1-гидрокси-1-метилэтил)имидазо[1,2-α]пиридин-2-карбоксамида и 3,3 мг паратолуолсульфоновой кислоты в 5 мл ксилола кипятят с обратным холодильником в течение 6 часов, затем упаривают досуха при пониженном давлении. Остаток извлекают 200 мл дихлорметана и 20 мл воды. Органическую фазу сушат и концентрируют, и остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь дихлорметана и этилацетата (95/5). Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха. Остаток растирают и промывают в этиловом эфире, фильтруют и сушат, получая 68 мг N-(4-фторфенил)-6-изопропенилимидазо[1,2-α]пиридин-2-карбоксамида в виде твердого вещества бежевого цвета.
Пример 6: 6-хлор-N-(2-хлорфенил)имидазо[1,2-α]пиридин-2-карбоксамид
К раствору 100 мг 6-хлоримидазо[1,2-α]пиридин-2-карбоновой кислоты в 1 мл N,N-диметилформамида добавляют 54 мкл 2-хлоранилина, 211 мг HATU, 75 мг 1-гидроксиаминотриазола и 237 мкл N,N-диизопропилэтиламина. Реакционную смесь нагревают при 70°С в течение 16 часов, разбавляют насыщенным раствором бикарбоната натрия и экстрагируют этилацетатом. Объединенные органические фазы сушат и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексан/этилацетат 70/30, получая 62 мг 6-хлор-N-(2-хлорфенил)имидазо[1,2-α]пиридин-2-карбоксамида в виде белого твердого вещества.
Пример 7: N,6-дифенилимидазо[1,2-α]пиридин-2-карбоксамид
В пробирку для микроволнового излучения добавляют 0,391 г 6-йод-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида, 0,237 г фенилбороновой кислоты, 45 мг тетракис(трифенилфосфин)палладия, 4 мл водного раствора 2М карбоната натрия, 6 мл ацетонитрила и 6 мл толуола. Смесь нагревают 20 минут в микроволновом аппарате, настроенном на 150°С. После охлаждения органическую фазу отделяют, сушат и упаривают. Остаток извлекают из смеси дихлорметана и пентана. Твердое вещество фильтруют и затем очищают растиранием в метаноле, получают 0,22 г N,6-дифенилимидазо[1,2-α]пиридин-2-карбоксамида в виде твердого вещества цвета небеленого полотна.
Пример 8: N-фенил-6-винилимидазо[1,2-α]пиридин-2-карбоксамид
Смесь 0,73 г 6-иод-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида, 209 мг тетракис(трифенилфосфин)палладия(0), 587 мкл трибутилвинилолова и 17 мл ДМФ нагревают в течение 10 минут при 130°С в микроволновом аппарате, затем концентрируют досуха. Остаток извлекают 100 мл воды и дважды экстрагируют 70 мл этилацетата. Объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и упаривают досуха при пониженном давлении. Твердое вещество растирают в этилацетате, отжимают и промывают этилацетатом, затем изопропиловым эфиром, извлекают смесью метанола и дихлорметана. Нерастворившуюся часть фильтруют и промывают метанолом. Фильтрат концентрируют досуха при пониженном давлении, получая 0,29 г N-фенил-6-винилимидазо[1,2-α]пиридин-2-карбоксамида в виде белого твердого вещества.
Пример 9: 6-этил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
Раствор 60 мг N-фенил-6-винилимидазо[1,2-α]пиридин-2-карбоксамида в 15 мл метанола гидрируют в течение 45 минут при 25°С при давлении водорода в 1 бар (105 Па) в присутствии 24 мг 10% палладия на угле. При неполном протекании реакции продукт рециркулируется при тех же условиях. После фильтрации реакционную смесь концентрируют досуха при пониженном давлении. Остаток извлекают 50 мл этилацетата. Органическую фазу промывают водой, декантируют, сушат и концентрируют досуха при пониженном давлении, получая 60 мг 6-этил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде белого твердого вещества.
Пример 10: 6-формил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
Суспензию 150 мг N-фенил-6-винилимидазо[1,2-α]пиридин-2-карбоксамида, 232 мкл тетроксида осмия и 167,5 мг перйодата натрия в смеси 6 мл ТГФ, 3 мл трет-бутанола и 3 мл воды перемешивают 20 часов при 20°С, затем еще 48 часов, прибавляя за 4 повтора 100 мкл тетроксида осмия и 80 мг перйодата натрия. Реакционную смесь выливают в 50 мл воды и дважды экстрагируют 50 мл этилацетата. Объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, декантируют, сушат и концентрируют досуха при пониженном давлении. Остаток хроматографируют на колонке с силикагелем, используя в качестве элюента смесь циклогексана и этилацетата (градиент 0-50%), получая 100 мг 6-формил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде твердого белого вещества.
Пример 11: 6-этинил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
В пробирку для микроволнового излучения емкостью 20 мл помещают 0,2 г 6-иод-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида, 156 мкл триметилсилилацетилена, 20 мг дихлорбис(трифенилфосфин)палладия и 2 мл пиперидина. Смесь нагревают 15 минут в микроволновом аппарате, настроенном на температуру 130°С. После охлаждения смесь выливают в 50 мл насыщенного водного раствора хлорида аммония. Дважды экстрагируют 70 мл этилового эфира. Объединенные органические фазы декантируют, сушат и концентрируют досуха при пониженном давлении. Остаток извлекают 4 мл раствора 1М фторида тетрабутиламмония в ТГФ и перемешивают в течение 16 часов при 25°С. После упаривания досуха реакционной смеси, остаток хроматографируют на колонке с силикагелем, используя в качестве элюента смесь циклогексана и этилацетата (градиент 0-35%), получают 30 мг 6-этинил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде твердого вещества бежевого цвета.
Пример 12: 6-[3-(1-гидрокси-1-метилэтил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
К суспензии 87 мг метил 3-[2-(анилинкарбонил)имидазо[1,2-α]пиридин-6-ил]бензоата в 5 мл ТГФ, помещенной в атмосферу аргона и охлажденной до 10°С, медленно добавляют 781 мкл раствора 3М метилмагнийхлорида в ТГФ. Смесь перемешивают в течение 16 часов, давая возможность температуре повыситься до 20°С, затем выливают в 30 мл водного насыщенного раствора аммонийхлорида. Экстрагируют 100 мл этилацетата. Органическую фазу декантируют, сушат и концентрируют досуха при пониженном давлении. Остаток хроматографируют на колонке с силикагелем, используя в качестве элюента смесь дихлорметана и этилацетата (75/25), получают 22 мг 6-[3-(1-гидрокси-1-метилэтил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде твердого вещества цвета небеленого полотна.
Пример 13: 6-[гидрокси(фенил)метил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
К суспензии 157 мг 6-бензоил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в 10 мл метанола, охлажденной до 0°С, добавляют 17,4 мг боргидрида натрия. Реакционную смесь перемешивают в течение 16 часов, давая возможность температуре повыситься до 20°С. Добавляют 20 мг боргидрида натрия и перемешивают еще 1,5 часа при 20°С. После упаривания досуха остаток извлекают 50 мл воды и 200 мл этилацетата. Органическую фазу декантируют, сушат и концентрируют досуха при пониженном давлении, получая 122 мг 6-[гидрокси(фенил)метил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде белого твердого вещества.
Пример 14: гидрохлорид (1:1) 6-ацетил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
Раствор 90 мг 6-(1-этоксивинил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в 2 мл дихлорметана перемешивают в течение 18 часов при 20°С с 1 мл 2N соляной кислоты. Твердое вещество фильтруют, промывают дихлорметаном, затем диизопропиловым эфиром и сушат, получая 67 мг гидрохлорида (1:1) 6-ацетил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде белого твердого вещества.
Пример 15: 6-изопропил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
15.1 Этил 6-изопропилимидазо[1,2-α]пиридин-2-карбоксилат
Этил 6-изопропилимидазо[1,2-α]пиридин-2-карбоксилат получают конденсацией 2-амино-5-изопропилпиридина (PCT Int. Appl. WO 2005028444) c этил 3-бромпируватом согласно методике, описанной J.G. Lombardino, J. Org. Chem.. (1965), 30(7), 2403.
1Н ЯМР-спектр (ДМСО-d6, δ в м.д.): 1,24 (д, J=7,0 Гц, 6Н); 1,32 (т, J=7,0 Гц, 3Н); 2,91 (м, 1Н); 4,30 (кв, J=7,0 Гц, 2Н); 7,33 (дд, J=1,5 и 9,5 Гц, 1Н); 7,54 (д, J=9,5 Гц, 1Н); 8,39 (с широкий, 1Н); 8,45 (с, 1Н).
15.2 6-Изопропил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
Раствор 344 мг этил 6-изопропилимидазо[1,2-α]пиридин-2-карбоксилата, 152 мг анилина, 40 мг 1-гидркоси-7-азабензотриазола (HOAt) и 316 мг третбутилата циркония в 5 мл толуола перемешивают в течение 16 часов при комнатной температуре в пробирке для микроволнового излучения. Смесь концентрируют досуха при пониженном давлении, и остаток хроматографируют на патроне с силикагелем, используя в качестве элюента смесь дихлорметана и этилацетата 50/50. Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 63 мг 6-изопропил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде белого твердого вещества.
Пример 16: 6-[(RS)-1-гидроксиэтил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
Суспензию 150 мг 6-формил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в 10 мл тетрагидрофурана охлаждают до 5°С. Добавляют по каплям 1,9 мл раствора 3М метилмагнийхлорида в тетрагидрофуране. Реакционную смесь перемешивают в течение 4 часов при 5°С, затем растирают в 20 мл насыщенного раствора аммонийхлорида, перемешивают, затем разбавляют 30 мл этилацетата. Водную фазу экстрагируют этилацетатом, и объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат, концентрируют досуха при пониженном давлении. Хроматографируют на колонке с силикагелем, используя в качестве элюента дихлорметан, затем смеси дихлорметана и этилацетата 85/15, затем 60/40, фракции, содержащие ожидаемый продукт, объединяют и упаривают досуха при пониженном давлении, получая 59 мг 6-[(RS)-1-гидроксиэтил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде белого твердого вещества.
Пример 17: 6-ацетамидо-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
65.1 Этил-6-ацетамидоимидазо[1,2-α]пиридин-2-карбоксилат
Суспензию 0,2 г этил-6-аминоимидазо[1,2-α]пиридин-2-карбоксилата (Heterocycles 38(7), 1527 (1994)) в 1 мл уксусного ангидрида кипятят с обратным холодильником в течение 45 минут. Реакционную смесь концентрируют при пониженном давлении; остаток извлекают водой и подщелачивают добавлением раствора 1N гидроксида натрия. Твердое вещество отфильтровывают и сушат, получая 150 мг этил-6-ацетамидоимидазо[1,2-α]пиридин-2-карбоксилата в виде твердого вещества цвета небеленого полотна.
1Н ЯМР-спектр (ДМСО-d6, δ в м.д.): 1,31 (т, J=7,0 Гц, 3Н); 2,09 (с, 3Н); 4,30 (кв, J=7,0 Гц, 2Н); 7,24 (дд, J=1,5 и 9,5 Гц, 1Н); 7,59 (д, J=9,5 Гц, 1Н); 8,60 (с, 1Н); 9,23 (с широкий, 1Н); 10,1 (с, 1Н).
Масс-спектр (IE): m/z=246 [M-H]-, m/z=248 [M+H]+.
65.2 6-Ацетамидо-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
Действуя аналогично примеру 3, из 150 мг этил-6-ацетамидоимидазо[1,2-α]пиридин-2-карбоксилата получают 53 мг 6-ацетамидо-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде твердого вещества цвета небеленого полотна.
Пример 18: 6-диметиламино-5-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
69.1 Этил-6-диметиламино-5-метилимидазо[1,2-α]пиридин-2-карбоксилат
К раствору 235 мг этил-6-амино-5-метилимидазо[1,2-α]пиридин-2-карбоксилата (Heterocycles 38(7), 1527 (1994)) в 4 мл муравьиной кислоты добавляют 1 мл водного раствора формальдегида (формалин), затем нагревают на бане при 100°С в течение 4 часов. После охлаждения реакционную смесь нейтрализуют добавлением раствора 5N гидроксида натрия и экстрагируют этилацетатом. Органическую фазу сушат и упаривают досуха при пониженном давлении. Остаток хроматографируют на патроне с силикагелем, используя в качестве элюента смесь дихлорметана и этилацетата 75/52. Фракции, содержащие ожидаемый продукт, объединяют и упаривают досуха при пониженном давлении, получают 113 мг этил-6-диметиламино-5-метилимидазо[1,2-α]пиридин-2-карбоксилата в виде твердого вещества цвета небеленого полотна.
1H ЯМР-спектр (ДМСО-d6, δ в м.д.): 1,32 (т, J=7,0 Гц, 3Н); 2,61 (с, 3Н); 2,64 (с, 6Н); 4,32 (кв, J=7,0 Гц, 2Н); 7,49 (д, J=9,5 Гц, 1Н); 7,52 (д, J=9,5 Гц, 1Н); 8,32 (с, 1Н).
Масс-спектр (IE): (LC-MS-DAD-ELSD) m/z=248 [M+H]+, m/z=220 [MH-C2H5]+.
69.2 6-Диметиламино-5-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
Действуя аналогично примеру 3, из 112 мг этил-6-диметиламино-5-метилимидазо[1,2-α]пиридин-2-карбоксилата получают 86 мг 5-метил-6-нитро-N-фенилимидазо[1,2-α]пиридин-2-карбоксамида в виде твердого вещества цвета небеленого полотна.
Приведенные ниже промежуточные соединения подходят для получения соединений по настоящему изобретению.
2-Аминопиридины общей формулы (II)
2-(6-Аминопиридин-3-ил)-пропан-2-ол
К раствору 0,7 г метил 6-аминоникотината в 65 мл ТГФ, охлажденному до 10°С в атмосфере аргона, добавляют по каплям 15 мл раствора 3М метилмагнийхлорида в ТГФ. Реакционную смесь перемешивают в течение 15 часов, давая возможность температуре повыситься до 20°С, затем снова охлаждают на ледяной бане. Медленно добавляют 100 мл насыщенного раствора аммонийхлорида, затем 200 мл этилацетата. Органическую фазу сушат и концентрируют досуха. Остаток извлекают этилацетатом. Осадок отжимают и сушат, получая 0,4 г 2-(6-Аминопиридин-3-ил)-пропан-2-ола в виде бледно-желтого твердого вещества.
1H ЯМР-спектр (ДМСО-d6, δ в м.д.): 1,36 (с, 6Н); 4,82 (с, 1Н); 5,67 (с широкий, 2Н); 6,37 (д, J=9,0 Гц, 1Н); 7,42 (дд, J=2,5 и 9,0 Гц, 1Н); 7,98 (д, J=2,5 Гц, 1Н).
Масс-спектр (IE): m/z=152 [M+], m/z=137: [M+]-СН3 (пик молекулярного иона).
5-Диметиламинопиридин-2-амин
Диметил-6-нитропиридин-3-амин
К раствору 1 г 5-бром-2-нитропиридина в 5 мл этанола добавляют 6 мл раствора 2М диметиламина в тетрагидрофуране. Реакционную смесь нагревают в течение 2 часов при 140°С в микроволновом аппарате. После охлаждения образовавшееся твердое вещество отделяют и промывают этиловым эфиром, получают 850 мг диметил-6-нитропиридин-3-амина в виде желтого твердого вещества.
1H ЯМР-спектр (ДМСО-d6, δ в м.д.): 3,12 (с, 6Н); 7,21 (дд, J=3,0 и 9,5 Гц, 1Н); 8,02 (д, J=3,0 Гц, 1Н); 8,15 (д, J=9,5 Гц, 1Н).
Масс-спектр (IE): m/z=167 (пик молекулярного иона): [M+], m/z=137: [M+]-NO, m/z=121: [M+]-NO2.
5-Диметиламинопиридин-2-амин
Диметил-6-нитропиридин-3-амин, полученный по вышеприведенной методике, извлекают 25 мл этанола. После добавления 4,8 г хлорида олова реакционную смесь кипятят с обратным холодильником в течение 30 минут, затем концентрируют досуха. Остаток хроматографируют на колонке с силикагелем (40-63 мкм), используя в качестве элюента смесь дихлорметана и аммиачного раствора метанола 90/10. Фракции, содержащие ожидаемый продукт, объединяют и концентрируют, получая 750 мг 5-диметиламинопиридин-2-амина в виде бледно-желтого твердого вещества.
1H ЯМР-спектр: (ДМСО-d6, δ в м.д.): 2,80 (с, 6Н); 6,94 (д, J=9,5 Гц, 1Н); 7,18 (д, J=3,0 Гц, 1Н); 7,32 (с широкий, 2Н); 7,83 (дд, J=3,0 и 9,5 Гц, 1Н).
Масс-спектр (IE): m/z=137 (пик молекулярного иона): [M+], m/z=122: [M+]-СН3.
5-(Азетидин-1-ил)пиридин-2-амин
5-Азетидин-1-ил-6-нитропиридин
В пробирку для микроволнового излучения помещают 1 г 5-бром-2-нитропиридина, 3,5 г карбоната цезия, 825 мг бис(дифенилфосфино)ферроцена, 110 мг ацетата палладия и 15 мл толуола, затем добавляют 424 мг азетидина. Содержимое пробирки перемешивают и нагревают на бане до 105°С, затем оставляют на 16 часов при комнатной температуре. Реакционную смесь фильтруют, твердое вещество промывают дихлорметаном. Объединенные фильтраты концентрируют досуха при пониженном давлении, и остаток хроматографируют на патроне с силикагелем, используя в качестве элюента дихлорметан. Фракции, содержащие ожидаемый продукт, объединяют и концентрируют досуха при пониженном давлении, получая 550 мг 5-азетидин-1-ил-6-нитропиридина в виде желтого твердого вещества.
5-(Азетидин-1-ил)пиридин-2-амин
5-(Азетидин-1-ил)-6-нитропиридин, полученный по вышеприведенной методике, извлекают 10 мл этанола и гидрируют в присутствии 65 мг палладия (10%) на угле под давлением в 1 бар (105 Па) и при 30°С. Реакционную смесь фильтруют, фильтрат разбавляют 7N аммиачным раствором метанола, затем концентрируют досуха при 30°С при пониженном давлении. Остаток извлекают дихлорметаном, нерастворившееся вещество удаляют, и остаток, полученный после упаривания досуха, хроматографируют на патроне с силикагелем, используя в качестве элюента смесь дихлорметана и 7N аммиачного раствора метанола 90/10. Фракции, содержащие ожидаемый продукт, объединяют и концентрируют, получая 185 мг 5-(азетидин-1-ил)пиридин-2-амина в виде масла красного цвета.
1H ЯМР-спектр: (ДМСО-d6, δ в м.д.): 2,23 (м, 2Н); 3,65 (т, J=7,5 Гц, 4Н); 5,12 (с широкий, 2Н); 6,37 (д, J=9,0 Гц, 1Н); 6,68 (дд, J=3,0 и 9,0 Гц, 1Н); 7,21 (д, J=3,0 Гц, 1Н).
Масс-спектр (IE): m/z 226[M+].
Производные имидазо[1,2-α]пиридин-2-карбоновых кислот общей формулы (IV)
Этил-6-диметиламиноимидазо[1,2-α]пиридин-2-карбоксилат
К суспензии 0,2 г 5-диметиламинопиридин-2-амина в 3 мл DME добавляют 215 мкл этилбромпирувата. Реакционную смесь перемешивают при 20°С в течение 16 часов, затем после добавления 3 мл этанола кипятят в течение 16 часов с обратным холодильником и, наконец, концентрируют при пониженном давлении. Остаток фильтруют на патроне с 15 г силикагеля, используя в качестве элюента смесь дихлорметана и метанола (98/2). Фракции, содержащие ожидаемый продукт, объединяют и промывают насыщенным раствором бикарбоната натрия. Органическую фазу сушат и концентрируют досуха при пониженном давлении, получая 76 мг этил-6-диметиламиноимидазо[1,2-α]пиридин-2-карбоксилата в виде зеленого масла, используемого в следующем синтезе.
Действуя аналогичным образом, получают этил-6,8-дифтор-имидазо[1,2-α]пиридин-2-карбоксилат.
1H ЯМР-спектр (ДМСО-d6, δ в м.д.): 1,33 (т, J=7,5 Гц, 3Н); 4,36 (кв, J=7,5 Гц, 2Н); 7,66 (ддд, J=2,0-9,0 и 11,5 Гц, 1Н); 8,65 (д, J=3,0 Гц, 1Н); 8,70 (м, 1Н).
Масс-спектр(IE): m/z=226 [M]+, m/z=181 [M-OC2H5]+, m/z=154 [M-C3H4O2]+ (пик молекулярного иона).
6-(1-Этоксивинил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
Действуя аналогично примеру 8, заменив трибутилвинилолово на трибутил(1-этоксивинил)олово, получают 6-(1-этоксивинил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид в виде бежевого твердого вещества.
1H ЯМР-спектр (ДМСО-d6, δ в м.д.): 1,40 (т, J=7,0 Гц, 3Н); 3,97 (кв, J=7,0 Гц, 2Н); 4,46 (д, J=3,0 Гц, 1Н); 4,90 (д, J=3,0 Гц, 1Н); 7,09 (т, J=8,0 Гц, 1Н); 7,34 (т широкий, J=8,0 Гц, 2Н); 7,61 (д, J=9,5 Гц, 1Н); 7,66 (дд, J=2,0 и 9,5 Гц, 1Н); 7,89 (д широкий, J=8,0 Гц, 2Н); 8,57 (с, 1Н); 8,83 (с широкий, 1Н); 10,2 (с, 1Н).
Следующие таблицы иллюстрируют химические структуры (таблица 1) и спектроскопические характеристики (таблица 2) некоторых примеров соединений по изобретению.
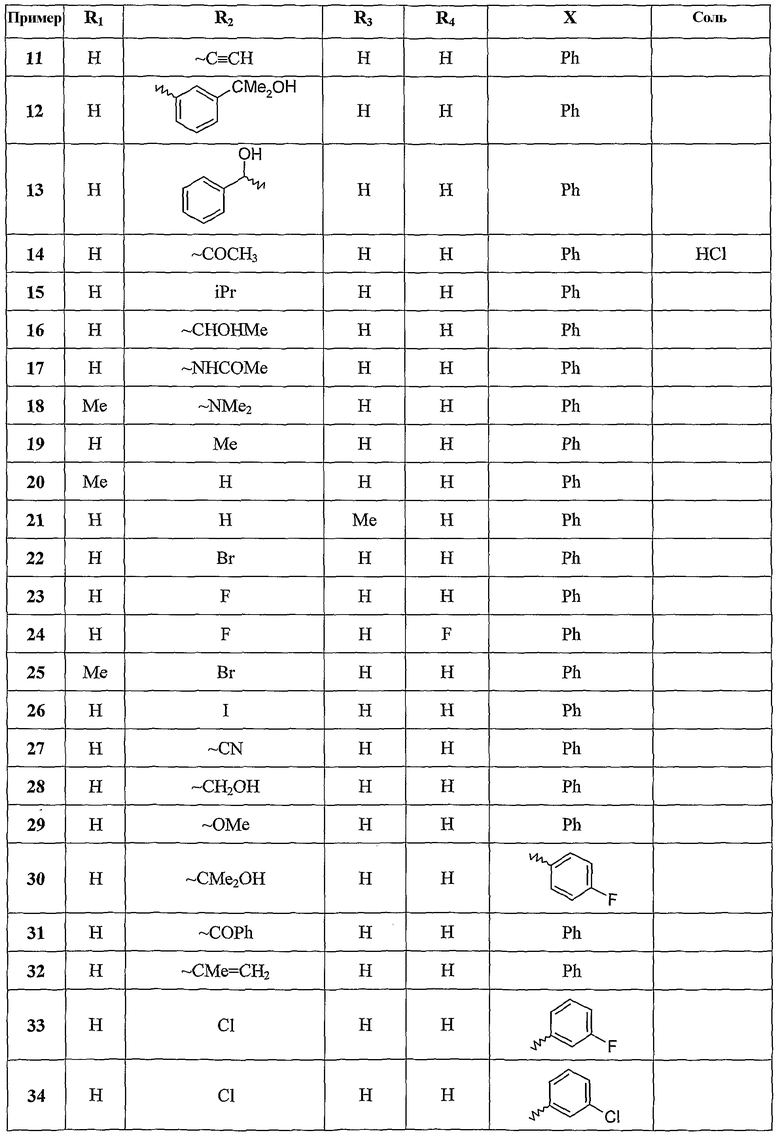
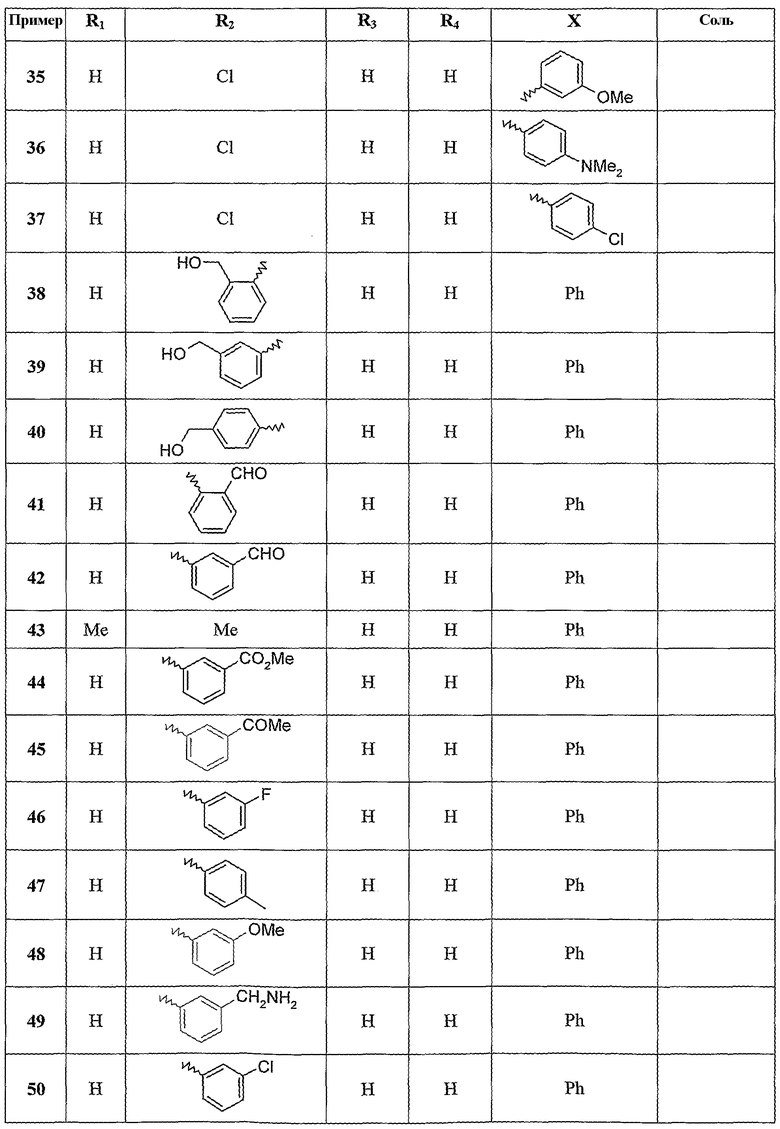
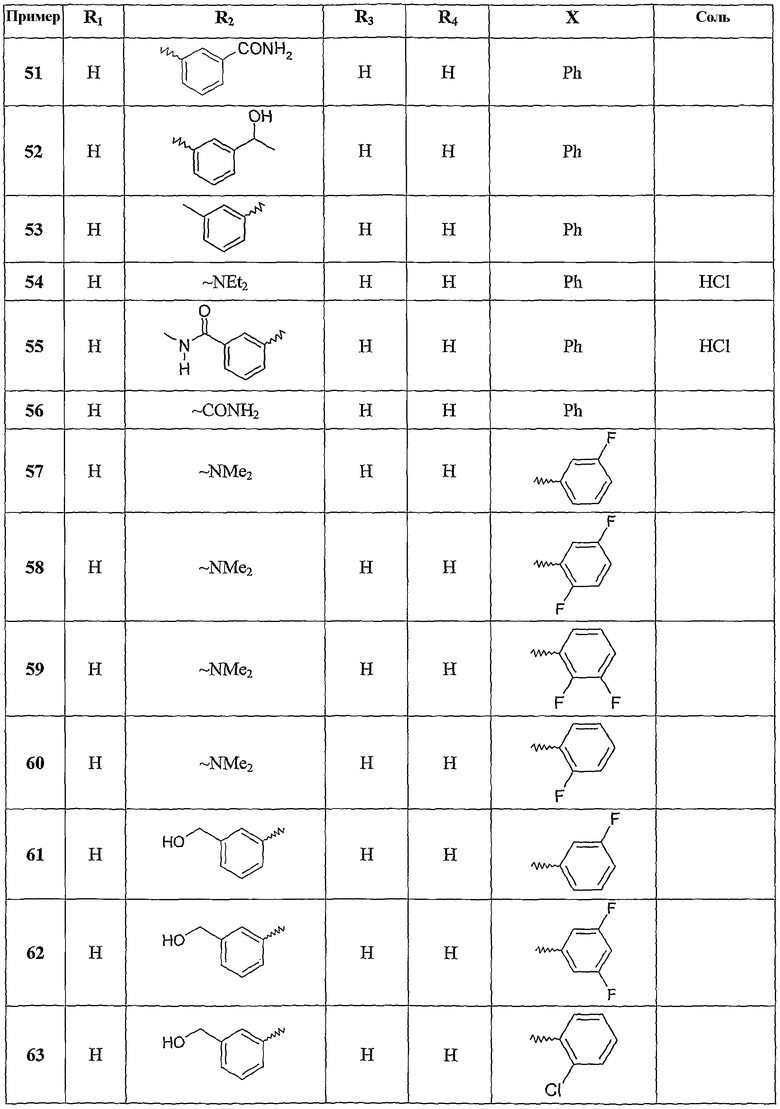
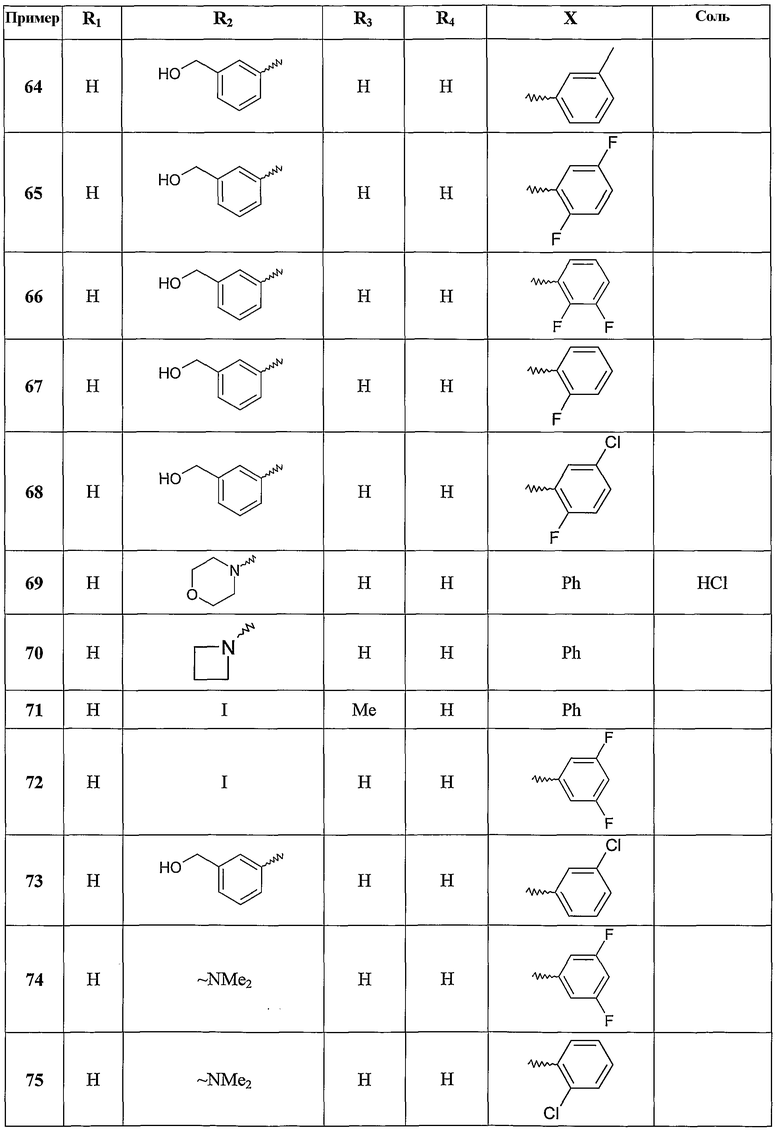
Масс-спектр (IE): m/z 271: [M+], m/z 179 (пик молекулярного иона): [M+]-NHPh, m/z 243: [M+]-[CO].
Масс-спектр (IE): m/z 251 (пик молекулярного иона): [M]+, m/z 159: [M-NHPh]+, m/z 223: [M-CO]+.
Масс-спектр (ES): m/z 281 [M+H]+.
ИК-спектр (KBr): 3345; 3140; 2803; 1665; 1643; 1594; 1552; 1523; 1503; 1443; 1310; 1208; 920; 798; 753 и 692 см-1.
ИК-спектр (KBr): 3363; 1666; 1597; 1559; 1527; 1504; 1443; 1319; 1204 и 757 см-1.
Масс-спектр (IE): m/z=295 [M]+; m/z=203 [M-NHPh]+ (пик молекулярного иона); m/z=43 CH3CO+.
Масс-спектр (LC/MS): m/z 296, [M+H]+.
Масс-спектр (IC): m/z 307: [M+H]+.
ИК-спектр (KBr): 3360; 1677; 1597; 1556; 1525; 1505; 1489; 1443; 1421; 1314; 1226; 762 и 693 см-1.
Масс-спектр (IE): m/z=313 [M]+, m/z=221 [M-NHPh]+ (пик молекулярного иона).
Масс-спектр (IE): m/z 263 [M]+.
Масс-спектр (LC/MS): m/z 266, [M+H+].
Масс-спектр (IE): m/z 261 [M]+ (пик молекулярного иона), m/z=221 [M-NHPh]+.
Масс-спектр (ES): m/z 372, [M+H]+ (пик молекулярного иона).
Масс-спектр (LC/MS): m/z 344, [M+H]+.
Масс-спектр (ES): m/z 280, [M+H]+ (пик молекулярного иона).
Масс-спектр (LC-MS-DAD-ELSD): m/z 280 [M+H]+.
[Масс-спектр (LC-MS-DAD-ELSD): m/z 282 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 295 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 295 [M+H]+, m/z 220 [MH-Ph]+, m/z 202 [MH-NHPh]+.
Масс-спектр (IE): m/z 251 [M+], m/z 159 (пик молекулярного иона): [M-NHPh]+, m/z 223: [M-CO]+.
Масс-спектр (IE): m/z 251 (пик молекулярного иона): [M+], m/z 159: [M]-NHPh.
Масс-спектр (IE): m/z 251 (пик молекулярного иона): [M]+, m/z 159: [M-NHPh]+, m/z 223: [M-CO]+.
Масс-спектр (IE): m/z 315 (пик молекулярного иона): [M]+, m/z 223: [M-NHPh]+, m/z 287: [M-CO]+.
Масс-спектр (IE): m/z 255 (пик молекулярного иона): [M]+, m/z 163: [M-NHPh]+, m/z 227: [M-CO]+.
ИК-спектр (KBr): 3384; 3136; 1674; 1559; 1504; 1222; 1167; 797; 756, 687 см-1.
Масс-спектр (IE): m/z 273: [M]+, m/z 181 (пик молекулярного иона): [M-NHPh]+, m/z 245: [M-CO]+.
ИК-спектр (KBr): 3366; 3149; 1676; 1596; 1559; 1503; 1437; 1335; 1224; 1142; 1109; 883; 851 и 767 см-1.
Масс-спектр (IE): m/z 329 (пик молекулярного иона): [M+], m/z 237: [M-NHPh]+, m/z 301: [M-CO]+.
ИК-спектр (KBr): 3380; 1674; 1596; 1557; 1523; 1442; 1314 и 790 см-1.
Масс-спектр (IE): m/z=363 [M]+ (пик молекулярного иона), m/z=271 [M - C6H6N]+, m/z=144 [m/z=271-I]+.
ИК-спектр (KBr): 3364; 2234; 1671; 1599; 1560; 1527; 1504; 1433 и 748 см-1.
Масс-спектр (IE): m/z=262 [M]+ (пик молекулярного иона), m/z=170 [M-NHPh]+, m/z=143 [m/z=170-HCN]+.
Масс-спектр (ES): m/z 268 [M+H]+.
ИК-спектр (KBr) 3344; 3140; 2841; 1664; 1594; 1552; 1539; 1505; 1446; 1319; 1215; 1022; 986; 801; 762 и 692 см-1.
Масс-спектр (ES): m/z = 203 [M - C6H5FN]+ (пик молекулярного иона), m/z=313 [M]+.
ИК-спектр (KBr): 3331; 1673; 1594; 1533; 1524; 1504; 1443; 1428; 1314; 1207; 756 и 692 см-1.
Масс-спектр (IE): m/z=277 [M]Vm/z=185 [M-NHPh]+ (пик молекулярного иона).
Масс-спектр (IC): m/z 289, (M]+.
Масс-спектр (IC): m/z 305, [M]+.
Масс-спектр (IC): m/z 301, [M]+.
Масс-спектр (IC): m/z 315, [M+H]+.
Масс-спектр (IC): m/z 305, [M]+.
ИК-спектр(KBr): 3374; 1668; 1602; 1560; 1526; 1502; 1444; 1420; 1317; 754 и 691 см-1.
Масс-спектр (ES): m/z=344 [M+H]+ (пик молекулярного иона).
ИК-спектр (KBr): 3373; 1667; 1602; 1560; 1535; 1503; 1443; 1413; 1320; 1208 и 755 см-1.
Масс-спектр (ES): m/z=344 [M+H]+ (пик молекулярного иона).
ИК-спектр (KBr): 3353; 1664; 1599; 1558; 1529; 1500; 1443; 1432; 1316; 1244; 802 и 755 см-1.
Масс-спектр (ES): m/z=344 [M+H]+ (пик молекулярного иона).
Масс-спектр (ES): m/z 342 [M+H]+.
ИК-спектр (KBr): 3353; 3155; 2858; 2735; 1695; 1670; 1599; 1556; 1526; 1504; 1441; 1315; 1207; 797; 745 и 690 см-1.
Масс-спектр (IE): m/z 341 [M]+.
Масс-спектр (IE): m/z 265 (пик молекулярного иона): [M+], m/z 173: [M+]-NHPh, m/z 237: [M+]-[CO].
Масс-спектр (ES): m/z=372 [M+H]+ (пик молекулярного иона).
Масс-спектр (ES): m/z=356 [M+H]+ (пик молекулярного иона).
Масс-спектр (IE): m/z 239: [M-C6H6N+] (пик молекулярного иона), m/z 331: [M+].
Масс-спектр (IE): m/z 235: [M-NHPh]+ (пик молекулярного иона), m/z 327: [M]+.
Масс-спектр (IE): m/z 251:[M-NHPh]+ пик молекулярного иона), m/z 343: [M]+.
Масс-спектр (ES): m/z 343, [M+H]+ (пик молекулярного иона).
Масс-спектр (ES): m/z 348, [M+H]+ (пик молекулярного иона).
Масс-спектр (ES): m/z 357, [M+H]+ (пик молекулярного иона).
Масс-спектр (ES): m/z 358, [M+H+] (пик молекулярного иона).
Масс-спектр (LC-MS-DAD-ELSD): m/z 328 [M+H]+
Масс-спектр (LC-MS-DAD-ELSD): m/z 309 [M+H]+
Масс-спектр (LC-MS-DAD-ELSD): m/z 371 [M+H]+, m/z 415 [M+HCO2]-
Масс-спектр (LC-MS-DAD-ELSD): m/z 299 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 317 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 317 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 299 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 362 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 380 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 378 [M+H]+, присутствие 1 Cl.
Масс-спектр (LC-MS-DAD-ELSD): m/z 358 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 380 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 380 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 362 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 396 [M+H]+, присутствие 1 Cl.
Масс-спектр (LC-MS-DAD-ELSD): m/z 323 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 293 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 378 [M+H]+.
Масс-спектр (LC-MS-DAD-ELSD): m/z 398 [M+H]-; m/z 400 [M+H]+.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 376 [M+H]-; m/z 378 [M+H]+, присутствие 1 Cl.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 317 [M+H]+.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 315 [M+H]+, присутствие 1 Cl.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 365 [M+H]+.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 394 [M+H]-; m/z 396 [M+H]+, присутствие 1 Cl.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 295 [M+H]+.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 315 [M+H]+, присутствие 1 Cl.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 333 [M+H]+, присутствие 1 Cl.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 333 [M+H]+, присутствие 1 Cl.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 347 [M+H]+.
Масс-спектр (UPLC-MS-DAD-ELSD): m/z 349 [M+H]+.
Соединения по изобретению составляют объект фармакологических исследований, позволяющих определить их модулирующее действие на NOT.
Оценка активности in vitro на клетках N2A
Исследования состояли в определении активности in vitro соединений по изобретению на клеточной линии (N2A), выделенной путем извлечения эндогенным образом рецептора мыши Nurr1 и стабильно трансфицированной со связующим элементом ответа NOT (NBRE), связанным с геном рапортером люциферазой. Значения ЕС50 составляли 0,01-1000 нМ. Испытания проводили согласно процедуре, описанной ниже.
Клеточная линия Neuro-2A была получена из коммерческого стандартного источника (АТСС). Клон Neuro-2A, полученный из спонтанной опухоли, выделен из штамма мыши А альбиноса, R.J. Klebe et col. Данная линия Neuro-2A далее стабильно трансфицирована с 8NBRE-люциферазой. Клетки N2A-8NBRE культивировали до достижения конфлюентности в чашках для культивирования площадью 75 см2, содержащих среду DMEM с добавлением 10% сыворотки бычьего эмбриона, 4,5 г/л глюкозы и 0,4 мг/мл генетицина. Через неделю культивирования клетки рекуперировали трипсином (0,25%) в течение 30 секунд, затем переводили в суспензию в DMEM без фенолового красного, содержащую 4,5 г/л глюкозы, 10% делипидированной сыворотки Hyclone, и помещали в белые 96-луночные планшеты с прозрачным дном. Клетки помещали в расчете 60000 в 75 мкл на лунку на 24 часа до добавления продуктов. Продукты были внесены в объеме 25 мкл, и инкубация продолжалась еще 24 часа. В день измерения в каждую лунку добавляли эквивалентный объем (100 мкл) Steadylite, затем оставляли на 30 минут, чтобы добиться полного лизиса клеток и получения максимального сигнала. Затем образцы в планшетах, закрепленных клейкой пленкой, анализировали с помощью люминесцентного счетчика для микропланшет. Продукты готовили в виде основного раствора в концентрации 10-2 М, затем разбавляли в 100% ДМСО. Продукты каждой концентрации перед инкубацией с клетками предварительно разбавляли в культурной среде, содержащей в конечном итоге 0,625% ДМСО.
Например, соединения № 4, 7, 19, 29, 32, 43, 58, 67 и 70 показали величины ЕС50, равные, соответственно, 0,66 нМ, 0,9 нМ, 0,6 нМ, 1,3 нМ, 0,06 нМ, 0,3 нМ, 1,3 нМ, 0,7 нМ и 0,16 нМ.
Оценка связи с рецептором NOT человека
Прямая связь между соединениями по изобретению и рецептором NOT человека была определена с помощью технологии SPR (surface plasmon resonance). В этом исследовании белок ковалентно иммобилизировали на матрице, и изучаемую молекулу впрыскивали в камеру, содержащую сенсорный чип. Сигнал прямо пропорционален количеству продукта, зафиксированного на белке. Исследования связи проводили на приборе BIACORE S51 (Biacore Inc., Piscataway N.J.). Полный белок GST-NOT (NOT-FL) был поставлен фирмой Invitrogen (PV3265). Домен связи с лигандом NOT (His-Thr-NOT 329-598) был выделен и очищен, как описано в Nature 423, 555-560. Два белка, разбавленные до концентрации 20 мкг/мл в ацетатном буфере с рН 5,0, содержащем 5 мМ DTT, были иммобилизированы на поверхности карбоксиметил 5' декстрана (СМ5 сенсорный чип, Biacor Incor.) взаимодействием с аминной частью согласно рецептуре, рекомендованной Biacore, элюируя буфером HBS-N (10 мМ HEPES, 0,15 М NaCl, 3 мМ EDTA, pH 7,4). Количество белков, захваченных на поверхности сенсорного чипа СМ5, составляло примерно 10000-15000 единиц резонанса (RU). Основные растворы изучаемых соединений, 1,5 мМ в ДМСО, разбавляли порциями в элюирующем буфере (50 мМ HEPES pH 8; 150 мМ NaCl; 10 мМ MgCl2; 2% ДМСО, 1 мМ DTT) до концентраций, составляющих от 3,75 до 0,1 мкМ. Продукт каждой концентрации впрыскивали при 4°С в течение 1 минуты со скоростью 30 мкл/мин. Диссоциация была зарегистрирована в течение 5 минут в отсутствие другой процедуры регенерации поверхности. Полученные сигналы корректировались в результате анализа продукта каждой концентрации на поверхности немодифицированного декстрана (белый). Сигнал, полученный от миграционного буфера, вычитался из общего сигнала («двойная ссылка»), так же как сигнал от ДМСО. Анализ сигналов проводили с помощью программного обеспечения для анализа Biacore S51 (версия 1.2.1). Затем соединения классифицировали в зависимости от их уровня максимальной фиксации и кинетических параметров связи с иммобилизированным белком.
Например, соединения № 19 и 7 обладали соответственно слабым и средним сродством.
Представляется ясным, что соединения по изобретению обладают модулирующим действием на NOT.
Таким образом, соединения по изобретению могут быть использованы для получения лекарственных средств для их применения в терапии для лечения или профилактики заболеваний, связанных с рецепторами NOT.
Таким образом, в соответствии с другим аспектом, объектом изобретения являются лекарственные средства, содержащие соединение формулы (I), или его фармацевтически приемлемую соль присоединения кислоты.
Названные лекарственные средства находят применение в терапии, в частности, для лечения и профилактики нейродегенеративных заболеваний, таких как, например, болезнь Паркинсона, болезнь Альцгеймера, тауопатии (точнее, прогрессирующий надъядерный паралич), рассеянный склероз; церебральных повреждений, таких как ишемия, черепно-мозговые травмы и эпилепсия; психиатрических заболеваний, таких как шизофрения, депрессия, зависимость от вещества, нарушения, связанные с дефицитом внимания и гиперактивностью; воспалительных заболеваний, таких как сосудистые патологии, атеросклероз, воспаления суставов, артроз, ревматоидный артрит, остеоартрит; заболеваний, связанных с аллергическим воспалением, таких как астма, и, наконец, для лечения остеопороза, раков.
Данные соединения могут быть также использованы для обработок, связанных с пересадками и/или трансплантациями клеточных штаммов.
В соответствии с другим аспектом настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве действующего начала соединение по изобретению. Данные фармацевтические композиции содержат эффективную дозу, по меньшей мере, одного соединения по изобретению или одной фармацевтически приемлемой соли названного соединения, наряду с, по меньшей мере, одним фармацевтически приемлемым эксципиентом.
Названные эксципиенты выбраны, в соответствии с фармацевтической формой и желаемым способом введения, из обычных эксципиентов, известных специалисту в данной области.
В фармацевтических композициях по настоящему изобретению при оральном, подъязычном, подкожном, внутримышечном, внутривенном, местном, локальном, внутритрахеальном, внутриносовом, трансдермальном или ректальном способах введения действующее начало вышеприведенной формулы (I) или его соль можно вводить животным и людям в единичной форме, в смеси с классическими фармацевтическими экспициентами для профилактики или лечения вышеназванных нарушений или заболеваний.
Соответствующие единичные формы введения включают формы для орального введения, такие как таблетки, желатиновые капсулы, мягкие или твердые, порошки, гранулы и растворы или оральные суспензии, формы для подъязычного, защечного, внутритрахельного, внутриглазного, внутриносового введения, введения путем ингаляции, формы для местного, трансдермального, подкожного, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для местного применения можно использовать соединения по изобретению в виде кремов, гелей, мазей или лосьонов.
В качестве примера, единичная форма введения соединения по изобретению в виде таблетки может содержать следующие компоненты:
Могут иметь место особые случаи, когда подходят более высокие или более низкие дозы; такие дозы не выходят за рамки изобретения. Согласно обычной практике доза, подходящая каждому пациенту, определяется врачом в зависимости от способа введения, веса и ответа данного пациента.
Настоящее изобретение, в соответствии с другим аспектом, относится также к способу лечения вышеупомянутых патологий, который заключается во введении пациенту эффективной дозы соединения по изобретению или одной из его фармацевтически приемлемых солей.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2020 |
|
RU2840815C2 |
| СОЕДИНЕНИЯ | 2016 |
|
RU2734877C2 |
| ПРОТИВОИНФЕКЦИОННЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2576662C2 |
| 5-ЗАМЕЩЕННЫЕ ИНДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2008 |
|
RU2487873C2 |
| Способ синтеза пиридо[1,2-а]имидазо[4,5-f]бензимидазола и его производных | 2017 |
|
RU2645917C1 |
| ПРОИЗВОДНОЕ ГЛУТАРИМИДОВ, ЕГО ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2610274C2 |
| ПРОИЗВОДНОЕ ГЛУТАРИМИДОВ, ЕГО ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2610275C2 |
| ПРОИЗВОДНОЕ ГЛУТАРИМИДОВ, ЕГО ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2610276C1 |
| ИМИДАЗОПИРИМИДИНЫ КАК ИНГИБИТОРЫ EED И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2836176C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВОЗНИКАЮЩИХ ВСЛЕДСТВИЕ ДИСФУНКЦИИ НИКОТИНОВЫХ РЕЦЕПТОРОВ АЛЬФА7 | 2004 |
|
RU2376290C2 |
Изобретение относится к соединениям, отвечающим формуле
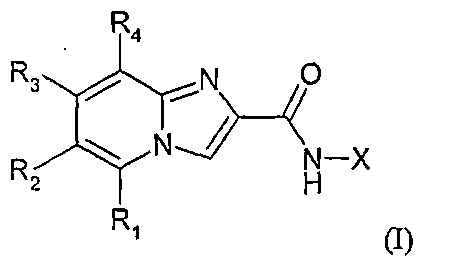
в которой X представляет собой одну из следующих групп: - фенильную группу, необязательно замещенную одной или несколькими группами, независимо выбранными из следующих атомов или групп: галогена, (С1-С6)алкокси, (С1-С6)алкила, (С3-С7)циклоалкил(С1-С6)алкила, (С3-С7)циклоалкил(С1-С6)алкокси, NRaRb, R1 представляет собой атом водорода, галоген, (С1-С6)алкокси, (С1-С6)алкил, (С3-С7)циклоалкил(С1-С6)алкил, (С3-С7)циклоалкил(С1-С6)алкокси, амино, группу NRcRd; причем алкильные и алкоксигруппы могут быть необязательно замещены одним или несколькими галогенами, гидрокси, амино или (С1-С6)алкокси, R2 представляет собой одну из следующих групп: атом водорода, (С1-С6)алкильиую группу, необязательно замещенную одной или несколькими группами, независимо выбранными из гидрокси, галогена, амино, группы NRaRb, фенильной группы, - (С1-С6)алкоксигруппу, необязательно замещенную одной или несколькими группами, независимо выбранными из гидрокси, галогена, амино, группы NRaRb, - (С2-С7)циклоалкил(С1-С6)алкил, - (С3-С7)циклоалкил(С1-С6)алкокси, - (С2-С6)алкенил, - (С1-С6)алкинил, - группу -CO-R5, - группу -CO-NR6R7, - группу -СО-О-R8, - группу -NR9-CO-R10, - группу -NR11R12, - атом галогена, - цианогруппу, - фенильную группу, необязательно замещенную одной или несколькими группами, независимо выбранными из следующих атомов или групп: галогена, (С1-С6)алкокси, NRaRb, -CO-R5, -CO-NR6R7, -CO-O-R8, (С3-С7)циклоалкил(С1-С6)алкила, (С3-С7)циклоалкил(С1-С6)алкокси, (С1-С6)алкильной группы, необязательно замещенной одной или несколькими гидроксигруппами или NRaRb, R3 представляет собой атом водорода, (С1-С6)алкил, (C1-С6)алкокси или атом галогена, R4 представляет собой атом водорода, (С1-С4)алкил, (С1-С4)алкокси или атом фтора, R5 представляет собой атом водорода, фенильную группу или (С1-С6)алкил, R6 и R7, одинаковые или различные, представляют собой атом водорода или (С1-С6)алкил, или вместе с атомом азота образуют 4-7-членный цикл, необязательно включающий другой гетероатом, выбранный из N, О или S, R8 представляет собой (С1-С6)алкил, R9 и R10, одинаковые или различные, представляют собой атом водорода или (С1-С6)алкил, R11 и R12, одинаковые или различные, представляют собой (С1-С6)алкил, или вместе с атомом азота образуют 4-7-членный цикл, необязательно включающий другой гетероатом, выбранный из N, О или S, Ra и Rb независимо друг от друга представляют собой атом водорода, (С1-С6)алкил или вместе с атомом азота образуют 4-7-членный цикл, Rc представляет собой атом водорода, и Rd представляет собой (С1-С6)алкил и, по меньшей мере, один из заместителей R1, R2, R3 и R4 отличен от водорода; и когда R3 означает метил, X является незамещенным; когда R1 означает метил, X является незамещенным; когда R2 означает хлор, X не является парафторфенилом; в форме основания или соли присоединения кислоты. Изобретение также относится к соединениям, выбранным из группы, к лекарственному средству, к фармацевтической композиции, а также к применению соединений формулы (I) по любому из пп.1-4. Технический результат - получение новых биологически активных соединений, для лечения или профилактики заболеваний, связанных с ядерным рецептором NOT. 11 н. и 2 з.п. ф-лы, 2 табл.
1. Соединения, отвечающие формуле:
в которой X представляет собой одну из следующих групп:
- фенильную группу, необязательно замещенную одной или несколькими группами, независимо выбранными из следующих атомов или групп: галогена, (С1-С6)алкокси, (С1-С6)алкила, (С3-С7)циклоалкил(С1-С6)алкила, (С3-С7)циклоалкил(С1-С6)алкокси, NRaRb,
R1 представляет собой атом водорода, галоген, (С1-С6)алкокси, (С1-С6)алкил, (С3-С7)циклоалкил(С1-С6)алкил, (С3-С7)циклоалкил(С1-С6)алкокси, амино, группу NRcRd; причем алкильные и алкокси группы могут быть необязательно замещены одним или несколькими галогенами, гидрокси, амино или (С1-С6)алкокси,
R2 представляет собой одну из следующих групп:
- атом водорода,
- (С1-С6)алкильную группу, необязательно замещенную одной или несколькими группами, независимо выбранными из гидрокси, галогена, амино, группы NRaRb, фенильной группы,
- (С1-С6)алкоксигруппу, необязательно замещенную одной или несколькими группами, независимо выбранными из гидрокси, галогена, амино, группы NRaRb,
- (С3-С7)циклоалкил(С1-С6)алкил,
- (С3-С7)циклоалкил(С1-С6)алкокси,
- (С1-С6)алкенил,
- (С2-С6)алкинил,
- группу -CO-R5,
- группу -CO-NR6R7,
- группу -CO-O-R8,
- группу -NR9-CO-R10,
- группу -NR11R12,
- атом галогена,
- цианогруппу,
- фенильную группу, необязательно замещенную одной или несколькими группами, независимо выбранными из следующих атомов или групп: галогена, (С1-С6)алкокси, NRaRb, -CO-R5, -CO-NR6R7, -CO-O-R8, (С3-С7)циклоалкил(С1-С6)алкила, (С3-С7)циклоалкил(С1-С6)алкокси, (С1-С6)алкильной группы, необязательно замещенной одной или несколькими гидроксигруппами или NRaRb,
R3 представляет собой атом водорода, (С1-С6)алкил, (С1-С6)алкокси или атом галогена,
R4 представляет собой атом водорода, (С1-С4)алкил, (С1-С4)алкокси или атом фтора,
R5 представляет собой атом водорода, фенильную группу или (С1-С6)алкил,
R6 и R7, одинаковые или различные, представляют собой атом водорода или (С1-С6)алкил, или вместе с атомом азота образуют 4-7-членный цикл, необязательно включающий другой гетероатом, выбранный из N, О или S,
R8 представляет собой (С1-С6)алкил,
R9 и R10, одинаковые или различные, представляют собой атом водорода или (С1-С6)алкил,
R11 и R12, одинаковые или различные, представляют собой (С1-С6)алкил,
или вместе с атомом азота образуют 4-7-членный цикл, необязательно включающий другой гетероатом, выбранный из N, О или S,
Ra и Rb независимо друг от друга представляют собой атом водорода, (С1-С6)алкил или вместе с атомом азота образуют 4-7-членный цикл,
Rc представляет собой атом водорода, и Rd представляет собой (С1-С6)алкил
и, по меньшей мере, один из заместителей R1, R2, R3 и R4 отличен от водорода;
и когда R3 означает метил, X является незамещенным;
когда R1 означает метил, X является незамещенным;
когда R2 означает хлор, X не является пара-фторфенилом;
в форме основания или соли присоединения кислоты.
2. Соединение формулы (I) по п.1, отличающееся тем, что в соединении формулы (I) X представляет собой фенил,
и его основание или соль присоединения кислоты.
3. Соединение формулы (I) по п.1, отличающееся тем, что в соединении формулы (I) R1, R3 и R4 представляют собой атомы водорода,
и его основание или соль присоединения кислоты.
4. Соединения
6-хлор-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
8-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(1-гидрокси-1-метилэтил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
N-(4-фторфенил)-6-изопропенилимидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-(2-хлорфенил)имидазо[1,2-α]пиридин-2-карбоксамид
N,6-дифенилимидазо[1,2-α]пиридин-2-карбоксамид
N-фенил-6-винилимидазо[1,2-α]пиридин-2-карбоксамид
6-этил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-формил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-этинил-N[-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[3-(1-гидрокси-1-метилэтил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[гидрокси(фенил)метил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид гидрохлорид (1:1) 6-ацетил-N-фенилимидазо[1,2-α]-2-карбоксамид
6-изопропил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(1-гидроксиэтил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-ацетамидо-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-5-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
5-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
7-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-бром-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-фтор-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6,8-дифтор-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-бром-5-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-иодо-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-циано-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(гидроксиметил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-метокси-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
N-(4-фторфенил)-6-(1-гидрокси-1-метилэтил)имидазо[1,2-α]пиридин-2-карбоксамид
6-бензоил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-изопропенил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-(3-фторфенил)имидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-(3-хлорфенил)имидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-(3-метоксифенил)имидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-[4-(диметиламино)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
6-хлор-N-(4-хлорфенил)имидазо[1,2-α]пиридин-2-карбоксамид
6-[2-(гидроксиметил)фенил)]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[3-(гидроксиметил)фенил)]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[4-(гидроксиметил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(2-формилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-формилфенил)-N[-фенилимидазо[1,2-α]пиридин-2-карбоксамид
5,6-диметил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
метил 3-[2-(анилинкарбонил)имидазо[1,2-α]пиридин-6-ил]бензоат
6-(3-ацетилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-фторфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(4-метилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-метоксифенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[3-(аминометил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-хлорфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-карбамоилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-[3-(1-гидроксиэтил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(3-метилфенил)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(диэтиламино)-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид и его гидрохлорид (1:1)
6-[3-(метилкарбамоил)фенил]-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид и его гидрохлорид (1:1)
6-карбамоил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-(3-фторфенил)имидазо[1,2-α]пиридин-2-карбоксамид
N-(2,5-дифторфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
N-(2,3-дифторфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-(2-фторфенил)имидазо[1,2-α]пиридин-2-карбоксамид
N-(3-фторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(3,5-дифторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(2-хлорфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
6-[3-(гидроксиметил)фенил]-N-(3-метилфенил)имидазо[1,2-α]пиридин-2-карбоксамид
N-(2,5-дифторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(2,3-дифторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(2-фторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(5-хлор-2-фторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
6-морфолин-4-ил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид и его гидрохлорид (1:1)
6-азетидин-1-ил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
6-иодо-5-метил-N-фенилимидазо[1,2-α]пиридин-2-карбоксамид
N-(3,5-дифторфенил)-6-иодимидазо[1,2-α]пиридин-2-карбоксамид
N-(3-хлорфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(3,5-дифторфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
N-(2-хлорфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-[3-(трифторметокси)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
N-(3-хлор-2-фторфенил)-6-[3-(гидроксиметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-(3-метилфенил)имидазо[1,2-α]пиридин-2-карбоксамид
N-(3-хлорфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
N-(5-хлор-2-фторфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
N-(3-хлор-2-фторфенил)-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
N-[3-(дифторметокси)фенил]-6-(диметиламино)имидазо[1,2-α]пиридин-2-карбоксамид
6-(диметиламино)-N-[3-(трифторметил)фенил]имидазо[1,2-α]пиридин-2-карбоксамид
в форме основания или соли присоединения кислоты.
5. Лекарственное средство для лечения или профилактики заболеваний, связанных с ядерным рецептором NOT, отличающееся тем, что содержит соединение формулы (I) по любому из пп.1-4 или фармацевтически приемлемую соль присоединения кислоты данного соединения.
6. Фармацевтическая композиция для лечения или профилактики заболеваний, связанных с ядерным рецептором NOT, отличающаяся тем, что содержит соединение формулы (I) по любому из пп.1-4 или фармацевтически приемлемую соль данного соединения наряду с, по меньшей мере, одним фармацевтически приемлемым эксципиентом.
7. Применение соединения формулы (I) по любому из пп.1-4 для получения лекарственного средства, предназначенного для лечения и профилактики нейродегенеративных заболеваний.
8. Применение соединения формулы (I) по любому из пп.1-4 для получения лекарственного средства, предназначенного для лечения и профилактики рассеянного склероза; черепно-мозговых травм и эпилепсии.
9. Применение соединения формулы (I) по любому из пп.1-4 для получения лекарственного средства, предназначенного для лечения и профилактики психиатрических заболеваний.
10. Применение соединения формулы (I) по любому из пп.1-4 для получения лекарственного средства, предназначенного для лечения и профилактики воспалительных заболеваний.
11. Применение соединения формулы (I) по любому из пп.1-4 для получения лекарственного средства, предназначенного для лечения и профилактики остеопороза и раков.
12. Применение соединения формулы (I) по любому из пп.1-4 для получения лекарственного средства, предназначенного для лечения и профилактики болезни Паркинсона, Альцгеймера, тауопатий.
13. Применение соединения формулы (I) по любому из пп.1-4 для получения лекарственного средства, предназначенного для лечения и профилактики шизофрении, депрессии, зависимости от вещества, нарушений, связанных с дефицитом внимания и гиперактивностью.
| СПОСОБ ПЕРЕДАЧИ ПРЯМЫХ СИГНАЛОВ УПРАВЛЕНИЯ В СИСТЕМАХ РАДИОСВЯЗИ | 2014 |
|
RU2638161C2 |
| WO 2006024834 А1, 09.03.2006 | |||
| WO 2005048948 А2, 02.06.2005 | |||
| WO 2006067445 А2, 29.06.2006 | |||
| WO 2006067446 А1, 29.06.2006 | |||
| ПРОИЗВОДНЫЕ ИМИДАЗО[1,2-А]ПИРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ, СПОСОБ ИНГИБИРОВАНИЯ СЕКРЕЦИИ ЖЕЛУДОЧНОЙ КИСЛОТЫ, СПОСОБ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И СПОСОБ ЛЕЧЕНИЯ СОСТОЯНИЙ, В КОТОРЫЕ ВОВЛЕЧЕНО ИНФИЦИРОВАНИЕ H.PYLORI | 1998 |
|
RU2193036C2 |
Авторы
Даты
2012-01-27—Публикация
2007-07-03—Подача