Изобретение относится к способу синтеза конденсированных полиазагетероциклов общей формулы
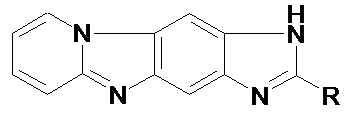
где R = а) H, б) CH3, в) CF3,
которые применяются в качестве флуоресцентных меток. Последние используются для контроля за состоянием продуцентов в современных биотехнологических процессах (Hyka, P. Combined Use of Fluorescent Dyes and Flow Cytometry To Quantify the Physiological State of Pichia pastoris during the Production of Heterologous Proteins in High-Cell-Density Fed-Batch Cultures / P. Hyka, T. Züllig, C. Ruth et al. // Applied and Environmental Microbiology. – 2010. – V.76, is. 13. – pp. 4486-4496). Это позволяет отслеживать возможный стресс клеток и их культур и вовремя реагировать на возникшие изменения для поддержания максимальной продуктивности. Флуоресцентные метки также широко применяются в ПЦР в реальном времени, что позволяет одновременно проводить детекцию и количественно измерять содержание специфических последовательностей ДНК в образце исследуемого биообъекта (Navarro, E. Real-time PCR detection chemistry / E. Navarro, G. Serrano-Heras, M.J. Castaño et al. // Clinica Chimica Acta. – 2015. – V. 439. – pp. 231-250).
Известен многостадийный способ синтеза аналогичной структуры - 1H-имидазо[4',5':5,6]пиридо[1,2-a]бензимидазола, включающий синтез 1',3'-дигидроспиро[циклогексан-1,2'-имидазо[4,5-b]пиридина] при кипячении пиридин-2,3-диамина с циклогексаноном 71 ч в изопропаноле, окисление 1',3'-дигидроспиро[циклогексан-1,2'-имидазо[4,5-b]пиридина] оксидом марганца в течение 12 ч, взаимодействие полученного спиро[циклогексан-1,2'-имидазо[4,5-b]пиридина] с бензтриазолом в течение 14 ч, кипячение в толуоле 5-(бензотриазолил)спиро[2H-имидазо[4,5-b]пиридин-2,1′-циклогесана] в присутствии N-этилдиизопропиламина, приводящее к спиро[(2Н-имидазо[4,5:2,4]пиридо[1,2-а]бензимидазол)-2,1′-циклогексану], который восстанавливается дитионитом натрия в водном тетрагидрофуране с получением пиридо[1,2-а]бензимидазола-1,2-диамина, который при кипячении в течение 4 ч в муравьиной кислоте дает целевой 1H-имидазо[4',5':5,6]пиридо[1,2-a]бензимидазол. Суммарный выход целевого соединения менее 10 % (Huu Phuoc Le, Anna Kelbig, Andreas Lindauer, Richard Neidlein and Hans Suschitzky Synthesis of indolo-quinonediimine derivatives by the thermolysis of 5-(1-benzotriazolyl)-substituted spiro[2H-benzimidazole-2,1'-cyclohexane] // Journal of Chemical Research.-2004/-July, 453–456).
Недостатками известного способа синтеза конденсированных производных пиридо[1,2-a]бензимидазола являются: использование дорогостоящих реагентов, многостадийность процесса и низкий выход продукта.
Цель изобретения – снижение стоимости синтеза, сокращение времени и температуры проведения процесса, повышение выхода конденсированных производных пиридо[1,2-a]бензимидазола.
Поставленная цель достигается тем, что в качестве субстрата вместо пиридин-2,3-диамина используется 7-нитропиридо[1,2-a]бензимидазол, легко получаемый в 2 стадии из продуктов многотоннажного производства – пиридина и 2,4-динитрохлорбензола (Патент РФ № 2556001. Бегунов Р.С., Соколов А.А., Калина С.А. Бездиафрагменный электросинтез замещенных пиридо[1,2-а]бензимидазолов. Опубликован 10.07.2015. Бюл. № 19). В результате количество стадий синтеза конденсированных производных пиридо[1,2-a]бензимидазола уменьшается с 6 до 3 и отпадает необходимость в применении дорогостоящего пиридин-2,3-диамина. Все стадии протекают в мягких условиях и с хорошим выходом. Причем нитрование 7-нитропиридо[1,2-a]бензимидазола KNO3 проводят в концентрированной серной кислоте при температуре 25 ºС и мольном соотношении 7-нитропиридо[1,2-a]бензимидазол : KNO3 = 1 : 1.1 в течение 1 часа, восстановление спиртового раствора 7,8-динитропиридо[1,2-a]бензимидазола осуществляют 15% раствором хлорида титана (III) в 10%-ной соляной кислоте и мольном соотношении 7,8-динитропиридо[1,2-a]бензимидазол : TiCl3 = 1:15 при температуре 40 °С в течение 0.5 ч, конденсацию пиридо[1,2-a]бензимидазол-7,8-диамина с алифатическими кислотами проводят при температуре 100 °С и мольном соотношении пиридо[1,2-a]бензимидазол-7,8-диамин : алифатическая кислота = 1 : 10 в течение 1 часа в присутствии каталитических количеств HCl. Реализация предложенного метода синтеза пиридо[1,2-a]имидазо[4,5-f]бензимидазола и его производных позволяет уменьшить температуру и сократить общее операционное время процесса со 105 ч до 2.5 ч. Суммарный выход целевых продуктов больше 70 %.
Строение и чистоту синтезированных соединений анализировали методом ЯМР-спектроскопии и масс-спектрометрии высокого разрешения, определением температуры плавления.
Изобретение иллюстрируется следующими примерами.
Пример 1. 7,8-Динитропиридо[1,2-а]бензимидазол.
К раствору 21.30 г (0.100 моль) 7-нитропиридо[1,2-a]бензимидазола в 30 мл H2SO4 при 25 ºС медленно прикапывают 11.11 г (0.110 ммоль) KNO3 в 30 мл H2SO4 и перемешивают в течение 1 часа. Реакционную массу выливают в воду, нейтрализуют NH4OH. Выпавший осадок отфильтровывают, несколько раз промывают водой на фильтре и сушат. Выход 7,8-динитропиридо[1,2-а]бензимидазола 23.48 г (91%). Т. пл. 276-278 °C.
Спектр 1H ЯМР (ДМСО-d6, δ, м.д., J/Гц): 7.30 (тд, 1H, H2, J 6.5, 1.5 Гц); 7.85 (ддд, 1H, H3, J 9.0, 6.5, 0.9 Гц); 7.87 (д, 1H, H4, J 9.0 Гц); 8.54 (с, 1H, H6); 9.39 (д, 1H, H1, J 6.9 Гц); 9.48 с (1H, H9).
Спектр 13C ЯМР (ДМСО-d6, δ, м.д.): 112.5 (C9), 113.3 (C2), 115.6 (C6), 117.5 (C4), 128.6 (C1), 128.8 (C9a), 133.8 (C7), 134.1 (C3), 141.9 (C8), 145.6 (C5a), 152.9 (C4a).
HRMS: m/z вычислено C11H7N4O4+ 259.0469 [M+H]+, найдено: 259.0463.
Пример 2. Пиридо[1,2-a]бензимидазол-7,8-диамин.
В трёхгорлую колбу помещают 0.078 ммоль 7,8-динитропиридо[1,2-а]бензимидазола, приливают 1200 мл (1.163 моль) 15% раствора хлорида титана (III) в 10% HCl. Синтез ведут 30 минут при температуре 40 °С. После окончания синтеза реакционную смесь охлаждают, обрабатывают NH4OH до pH=7 и экстрагируют горячим хлороформом (∑=150 мл). После отгонки хлороформа получают 12.05 г (78%) пиридо[1,2-a]бензимидазол-7,8-диамина. Т. пл. 241-243 ºС.
Спектр 1H ЯМР (ДМСО-d6, δ, м.д., J/Гц): 4.67 (c, 4H, NH2); 6.73 (тд, 1H, H2, J 6.6, 1.0 Гц); 6.94 (с, 1H, H6); 7.21 (ддд, 1H, H3, J = 9.2 Гц, 6.6 Гц, 1.3 Гц); 7.22 (с, 1H, H9); 7.42 (дт, 1H, H4, J 9.2 Гц, 1.0 Гц); 8.54 (дт, 1H, H1, J 6.8 Гц, 1.0 Гц).
Спектр 13C ЯМР (ДМСО-d6, δ, м.д.): 94.2 (C9), 101.3 (C6), 108.8 (C2), 115.8 (C4), 121.4 (C9a), 125.0 (C1), 125.6 (C3), 133.0 (C8), 136.7 (C7), 138.0 (C5a), 145.3 (C4a).
HRMS: m/z вычислено C11H11N4 199.0984 [M+H]+, найдено: 199.0981.
Пример 3. Пиридо[1,2-а]имидазо[4,5-f]бензимидазол (а).
В круглодонную колбу помещают 4 г (0.020 моль) пиридо[1,2-а]бензимидазол-7,8-диамина и приливают 7.55 мл (0.2 моль) муравьиной кислоты и 0.05 мл 36 % соляной кислоты. Реакционную массу нагревают при 100 °С в течение 1 часа, после охлаждают и выливают в воду. Раствор нейтрализуют NH4ОН до pH=8 и отфильтровывают выпавший осадок. Выход 4.08 г (98 %). Т.пл. 296-298 ºС.
Спектр 1H ЯМР (ДМСО-d6, δ, м.д., J/Гц): 6.91 (т, 1Н, Н2, J 6.2 Гц); 7.43-7.54 (м, 1H, H3); 7.59 (д, 1H, H4, J 9.3 Гц); 7.86 (с, 1H, H6); 8.34 (с, 1H, H8); 8.52 (с, 1H, H10); 9.12 (д, 1H, Н1, J 6.9 Гц); 12.46 (с, 1H, Н12).
Спектр 13C ЯМР (ДМСО-d6, δ, м.д.): 109.54, 116.95, 126.75, 127.59, 130.18, 141.78, 144.17, 148.71.
HRMS: m/z вычислено C12H8N4 209.0828 [M+H]+ , найдено: 209.0822.
Примеры 4-5. Другие конденсированные производные пиридо[1,2-а]бензимидазола получают аналогично примеру 3.
8-метилпиридо[1,2-а]имидазо[4,5-f]бензимидазол (б). Выход 4.22 г (95 %). Т.пл. > 320 ºС.
Спектр 1H ЯМР (ДМСО-d6, δ, м.д., J/Гц): 2.54 (с, 3H, CH3); 6.89 (т, 1Н, Н2, J 6.5 Гц); 7.41-7.51 (м, 1H, H3); 7.57 (д, 1H, H4, J 9.2 Гц); 7.68 (с, 1H, H6); 8.39 (с, 1H, H10); 9.09 (д, 1H, Н1, J 6.8 Гц); 12.19 (с, 1H, NН).
Спектр 13C ЯМР (ДМСО-d6, δ, м.д.): 14.92, 108.95, 116.54, 125.81, 126.79, 128.99, 141.04, 147.99, 153.26.
HRMS: m/z вычислено C13H11N4 223.0984 [M+H]+, найдено: 223.0980.
8-(трифторметил)пиридо[1,2-а]имидазо[4,5-f]бензимидазол (в). Выход 5.13 г (93 %). Т.пл. > 320 ºС.
Спектр 1H ЯМР (ДМСО-d6, δ, м.д., J/Гц): 6.98 (т, 1Н, Н2, J 6.5 Гц); 7.55-7.65 (м, 2H, H3,4); 7.95 (c, 1H, H6); 8.71 (с, 1H, H10); 9.20 (д, 1H, H1, J 6.9 Гц); 13.93 (с, 1H, NН).
HRMS: m/z вычислено C13H7F3N4 277.0702 [M+H]+, найдено: 277.0700.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения дигалогенпроизводного 1,2,3,4-тетрагидропиридо- или пиридо[1,2-а]бензимидазол-6,9-диона | 2023 |
|
RU2828349C1 |
| Способ получения N-арилзамещенных 3H-имидазо[4,5-b]пиридинов | 2016 |
|
RU2642456C2 |
| Домино-синтез 1-(2-аминофенил)-5-нитробензимидазола | 2023 |
|
RU2830548C1 |
| Способ синтеза 1-(2-амино-4-нитрофенил)-2-R-бензимидазолов | 2024 |
|
RU2825732C1 |
| БЕЗДИАФРАГМЕННЫЙ ЭЛЕКТРОСИНТЕЗ ЗАМЕЩЕННЫХ ПИРИДО[1,2-а]БЕНЗИМИДАЗОЛОВ | 2014 |
|
RU2556001C1 |
| ГЕТЕРОЦИКЛИЛЭФИРЗАМЕЩЕННЫЕ ИМИДАЗОХИНОЛИНЫ | 2001 |
|
RU2351598C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОПИРИДИН-2-ОНА, ОБЛАДАЮЩИЕ mTOR ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 2009 |
|
RU2478636C2 |
| ИНГИБИТОРЫ ТРАНСГЛУТАМИНАЗЫ 2 (TG2) | 2019 |
|
RU2781370C2 |
| 1Н-ПИРАЗОЛО[3,4-B]ПИРИДИНЫ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2689141C2 |
| Способ получения N-[2-амино-4-(трифторметил)фенил]-N-фенил-4-(трифторметил)бензол-1,2-диамина и его производных | 2016 |
|
RU2645922C2 |
Изобретение относится к способу получения пиридо[1,2-a]имидазо[4,5-f]бензимидазола и его производных, который включает стадии нитрования 7-нитропиридо[1,2-a]бензимидазола KNO3 в концентрированной серной кислоте, восстановления 7,8-динитропиридо[1,2-a]бензимидазола TiCl3 и аннелировании имидазольного цикла к бензольному фрагменту пиридо[1,2-a]бензимидазола, причем взаимодействие 7-нитропиридо[1,2-a]бензимидазола с KNO3 проводят при температуре 25 ºС и мольном соотношении 7-нитропиридо[1,2-a]бензимидазол : KNO3 = 1 : 1.1 в течение 1 часа, восстановление спиртового раствора 7,8-динитропиридо[1,2-a]бензимидазола осуществляют 15% раствором хлорида титана (III) в 10%-ной соляной кислоте и мольном соотношении 7,8-динитропиридо[1,2-a]бензимидазол : TiCl3 = 1:15 при температуре 40 °С в течение 0.5 ч, конденсацию пиридо[1,2-a]бензимидазол-7,8-диамина с алифатическими кислотами проводят при температуре 100 °С и мольном соотношении пиридо[1,2-a]бензимидазол-7,8-диамин : алифатическая кислота = 1 : 10 в течение 1 часа в присутствии каталитических количеств HCl. Технический результат: разработан способ получения пиридо[1,2-a]имидазо[4,5-f]бензимидазола и его производных, позволяющий снизить стоимость синтеза, уменьшить время и температуру проведения процесса и повысить выход целевого продукта. 5 пр.
Способ синтеза пиридо[1,2-a]имидазо[4,5-f]бензимидазола и его производных
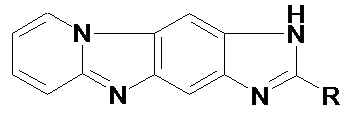
где R = а) H, б) CH3, в) CF3,
заключающийся в том, что нитрование 7-нитропиридо[1,2-a]бензимидазола нитратом калия проводят в концентрированной серной кислоте при температуре 25 ºС и мольном соотношении 7-нитропиридо[1,2-a]бензимидазол: KNO3 = 1: 1.1 в течение 1 часа, восстановление спиртового раствора 7,8-динитропиридо[1,2-a]бензимидазола осуществляют 15% раствором хлорида титана (III) в 10%-ной соляной кислоте и мольном соотношении 7,8-динитропиридо[1,2-a]бензимидазол: TiCl3 = 1:15 при температуре 40 °С в течение 0.5 ч, конденсацию пиридо[1,2-a]бензимидазол-7,8-диамина с алифатическими кислотами проводят при температуре 100 °С и мольном соотношении пиридо[1,2-a]бензимидазол-7,8-диамин: алифатическая кислота = 1: 10 в течение 1 часа в присутствии каталитических количеств HCl.
| HUU PHUOC LE ET AL, Journal of Chemical Research, 2004, vol.7, pp.453-456 | |||
| US 4585775 A1, 29.04.1986 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ПИРИДО[1,2-А][1,3]БЕНЗИМИДАЗОЛОВ | 2003 |
|
RU2241710C1 |
| СПОСОБ ПОЛУЧЕНИЯ 7-R-ПИРИДО[1,2-а]БЕНЗИМИДАЗОЛОВ | 2012 |
|
RU2522549C1 |
Авторы
Даты
2018-03-01—Публикация
2017-04-12—Подача