Заявление о приоритете
По настоящей заявке испрашивается приоритет на основании временной заявки на патент США, серийный № 60/704772, от 2 августа 2005 года, которая включена в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям, которые ингибируют активность серинпротеазы, в частности, активность протеазы NS3-NS4A вируса гепатита C. Как таковые, они действуют посредством вмешательства в жизненный цикл вируса гепатита C и являются пригодными в качестве противовирусных агентов. Настоящее изобретение, кроме того, относится к композициям, содержащим эти соединения, либо для использования ex vivo, либо для введения пациенту, страдающему инфекцией HCV (вируса гепатита C). Настоящее изобретение также относится к способам лечения инфекции HCV у пациента посредством введения композиции, содержащей соединение по настоящему изобретению.
Уровень техники
Инфекция вируса гепатита C ("HCV") представляет собой непреодолимую проблему медицины человека. HCV распознается как агент, вызывающий большинство случаев гепатита, иного чем гепатит A, гепатит B, с оцениваемым глобальным преобладанием у 3% людей [A. Alberti et al., "Natural History of Hepatitis C," J. Hepatology, 31., (Suppl.1), pp.17-24 (1999)]. Примерно четыре миллиона индивидуумов могут быть инфицированы только в Соединенных Штатах [M.J. Alter et al., "The Epidemiology of Viral Hepatitis in United States, Gastroenterol. Clin. North Am., 23, pp.437-455 (1994); M.J. Alter "Hepatitis C Virus Infection in the United States," J. Hepatology, 31., (Suppl.1), pp.88-91 (1999)].
При первом соприкосновении с HCV только примерно 20% инфицируемых индивидуумов получают острый клинический гепатит, в то время как другие, видимо, справляются с инфекцией самопроизвольно. Однако почти в 70% случаев вирус вызывает хроническую инфекцию, которая длится в течение десятилетий [S. Iwarson, "The Natural Course of Chronic Hepatitis," FEMS Microbiology Reviews, 14, pp.201-204 (1994); D. Lavanchy, "Global Surveillance and Control of Hepatitis C," J. Viral Hepatitis, 6, pp.35-47 (1999)]. Это обычно приводит к возобновляющемуся и постепенно ухудшающемуся воспалению печени, которое часто приводит к более серьезным болезненным состояниям, таким как цирроз и гепатоклеточная карцинома [M.C. Kew, "Hepatitis C and Hepatocellular Carcinoma", FEMS Microbiology Reviews, 14, pp.211-220 (1994); I. Saito et. al., "Hepatitis C Virus Infection is Associated with the Development of Hepatocellular Carcinoma," Proc. Natl. Acad. Sci. USA, 87, pp.6547-6549 (1990)]. К сожалению, нет широко распространенных эффективных способов лечения изнуряющего развития хронического HCV.
Геном HCV кодирует полипротеин из 3010-3033 аминокислот [Q.L. Choo, et. al., "Genetic Organization and Diversity of the Hepatitis C Virus." Proc. Natl. Acad. Sci. USA, 88, pp.2451-2455 (1991); N. Kato et al., "Molecular Cloning of the Human Hepatitis C Virus Genome From Japanese Patients with Non-A, Non-B Hepatitis," Proc. Natl. Acad. Sci. USA, 87, pp.9524-9528 (1990); A. Takamizawa et al., "Structure and Organization of the Hepatitis C Virus Genome Isolated From Human Carriers," J. Virol., 65, pp.1105-1113 (1991)]. Неструктурные (NS) белки HCV, как предполагается, обеспечивают основные каталитические механизмы для репликации вируса. NS белки получают посредством протеолитического расщепления полипротеина [R. Bartenschlager et al., "Nonstructural Protein 3 of the Hepatitis C Virus Encodes a Serine-Type Proteinase Required for Cleavage at the NS3/4 and NS4/5 Junctions," J. Virol., 67, pp.3835-3844 (1993); A. Grakoui et al., "Characterization of the Hepatitis C Virus-Encoded Serine Proteinase: Determination of Proteinase-Dependent Polyprotein Cleavage Sites," J. Virol., 67, pp.2832-2843 (1993); A. Grakoui et al., "Expression and Identification of Hepatitis C Virus Polyprotein Cleavage Products," J. Virol., 67, pp.1385-1395 (1993); L. Tomei et al., "NS3 is a serine protease required for processing of hepatitis C virus polyprotein", J. Virol., 67, pp.4017-4026 (1993)].
NS белок 3 HCV (NS3) является основным для репликации и инфекционности вируса [Kolykhalov, Journal of Virology, Vol.74, pp.2046-2051 2000 "Mutations at the HCV NS3 Serine Protease Catalytic Triad abolish infectivity of HCV RNA in Chimpanzees]. Известно, что мутации протеазы вируса желтой лихорадки NS3 понижают инфекционность вируса [Chambers, T.J. et al., "Evidence, that the N-Terminal Domain of Nonstructural Protein NS3 From Yellow Fever Virus is a Serine Protease Responsible for Site-Specific Cleavages in the Viral Polyprotein", Proc. Natl. Acad. Sci. USA, 87, pp.8898-8902 (1990)]. Первые 181 аминокислота NS3 (остатки 1027-1207 полипротеина вируса), как показано, содержат домен серинпротеазы NS3, который осуществляет процессинг всех четырех последующих сайтов полипротеина HCV [C. Lin et al., "Hepatitis C Virus NS3 Serine Proteinase: Trans-Cleavage Requirements and Processing Kinetics", J. Virol., 68, pp.8147-8157 (1994)].
Серинпротеаза HCV NS3 и ее ассоциированный кофактор, NS4A, помогают осуществлять процессинг всех вирусных ферментов и, таким образом, считаются основными для репликации вируса. Этот процессинг, видимо, является аналогичным тому, который осуществляется посредством аспартилпротеазы вируса иммунодефицита человека, которая также вовлечена в процессинг вирусных ферментов. Ингибиторы ВИЧ протеазы, которые ингибируют процессинг вирусных белков, являются сильнодействующими противовирусными агентами у человека, показывая, что прерывание этой стадии жизненного цикла вируса приводит к получению терапевтически активных агентов. Как следствие, серинпротеаза HCV NS3 также является привлекательной целью при поиске и разработке лекарственных средств.
До последнего времени единственной установленной терапией для заболевания HCV было лечение интерфероном. Однако интерфероны имеют значительные побочные воздействия [M.A. Walker et al., "Hepatitis C Virus: An Overview of Current Approaches and Progress," DDT, 4, pp.518-29 (1999); D. Moradpour et al., "Current and Evolving Therapies for Hepatitis C," Eur. J. Gastroenterol. Hepatol., 11, pp.1199-1202 (1999); H.L.A. Janssen et al. "Suicide Associated with Alfa-Interferon Therapy for Chronic Viral Hepatitis," J. Hepatol., 21, pp.241-243 (1994); P.F. Renault et al., "Side Effects of Alpha Interferon," Seminars in Liver Disease, 9, pp.273-277. (1989)] и вызывают долговременную ремиссию только для части (~25%) случаев [O. Weiland, "Interferon Therapy in Chronic Hepatitis C Virus Infection", FEMS Microbiol. Rev., 14, pp.279-288 (1994)]. Недавнее введение пегилированных форм интерферона (PEG-TNTRON® и PEGASYS®) и сочетанной терапии рибавирина и интерферона (REBETROL®) приводит только к небольшим улучшениям доли ремиссии и только к частичным уменьшениям побочных воздействий. Кроме того, перспективы относительно эффективных вакцин анти-HCV остаются неопределенными.
Таким образом, имеется необходимость в более эффективных анти-HCV терапиях. Такие ингибиторы должны иметь терапевтический потенциал в качестве ингибиторов протеазы, в частности в качестве ингибиторов серинпротеазы, а более конкретно, в качестве ингибиторов протеазы HCV NS3. Конкретно, такие соединения могут быть пригодными для использования в качестве противовирусных средств, в частности, в качестве анти-HCV средств.
Краткая сущность изобретения
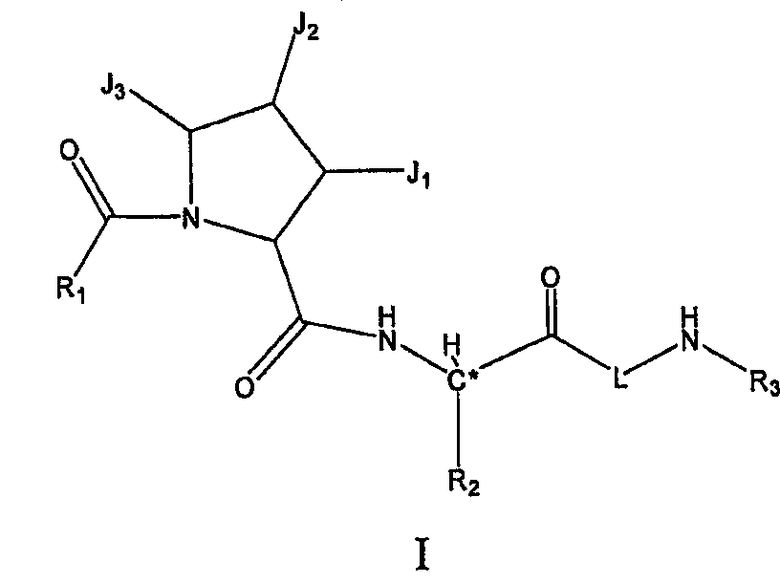
Настоящее изобретение относится к соединениям формулы I, или их фармацевтически приемлемым солям, или их смесям, охарактеризованным следующей формулой.
В другом аспекте настоящее изобретение также относится к фармацевтическим композициям, которые содержат указанные выше соединения и к их использованиям. Такие композиции могут использоваться для устройств для предварительного лечения, которые должны вводиться пациенту, для обработки биологических образцов и для непосредственного введения пациенту. В каждом случае композиция будет использоваться для уменьшения риска или тяжести инфекции HCV.
Преимущественно смеси соединений формулы I, где R-изомер в положении C∗ присутствует в количестве, большем чем 50%, неожиданно имеют существенно более высокую биологическую доступность, чем смеси, где S-изомер в положении C∗ присутствует в количестве 50% или больше. Неожиданно, R-изомер в С∗ положении является примерно в 2 раза более биологически доступным, чем S-изомер в положении C∗. В дополнение к этому, R-изомер в положении C∗ преобразуется in vivo в S-изомер в положении C∗ с более высоким процентом, чем S-изомер преобразуется, in vivo, в R-изомер в положении C∗. Эти свойства усиливают терапевтическую эффективность соединений формулы I с более чем 50% R-изомера в положении C∗, в качестве ингибиторов активности серинпротеазы, например, ингибирование активности протеазы вируса гепатита C NS3-NS4A.
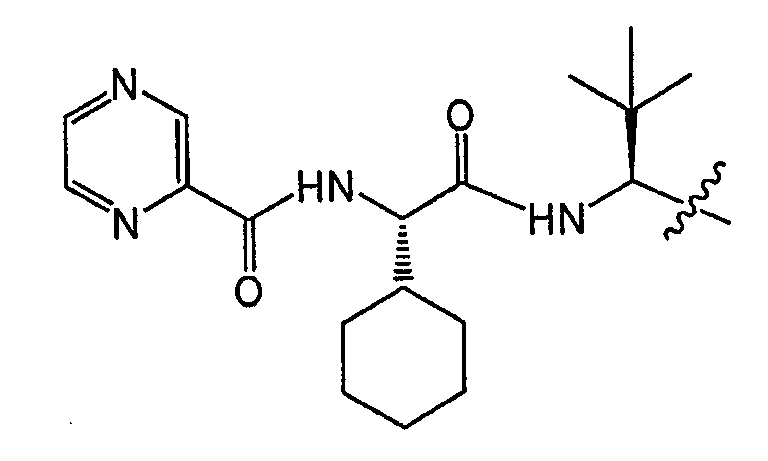
Высокая биологическая доступность и благоприятные свойства преобразования изомеров в положении C∗ придают повышенную терапевтическую эффективность соединениям по настоящему изобретению, таким как (1S,3aR,6aS)-2-[(2S)-2-[[(2S)-2-циклогексил-1-оксо-2-[(пиразинилкарбонил)амино]этил]амино]-3,3-диметил-1-оксобутил]-N-[(1R)-1-[2-(циклопропиламино)-1,2-диоксоэтил]бутил]октагидроциклопента[c]пиррол-1-карбоксамид, по сравнению с соединениями с 50% или более S-изомера в положении C∗.
Подробное описание фигур
На фиг.1A-B представлены графики средних (±SD (среднеквадратичное отклонение)) концентраций в плазме соединений формулы (I) с более чем 50% R-изомера в положении C∗ и соединений с 50% или меньше R-изомера в положении C∗ в зависимости от времени после перорального введения соединения.
На фиг.2A-B представлены графики средних (±SD) концентраций в плазме соединений формулы (I) с более чем 50% R-изомера в положении C∗ и соединения с 50% или меньше R-изомера в положении C∗ в зависимости от времени после перорального введения соединения.
На фиг.3A-B представлены графики средних (±SD) концентраций в плазме соединений формулы (I) с более чем 50% R-изомера в положении C∗ и соединения с 50% или меньше R-изомера в положении C∗ в зависимости от времени после перорального введения соединения.
Подробное описание изобретения
I. Определения
Для целей настоящего изобретения химические элементы определяется в соответствии с Периодической таблицей элементов, CAS version, Handbook of Chemistry and Physics, 75th Ed. В дополнение к этому, общие принципы органической химии описаны в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999, и "March's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M.B. and March, J., John Wiley & Sons, New York: 2001, полное содержание которых тем самым включается в качестве ссылок.
Как здесь описывается, соединения по настоящему изобретению могут необязательно быть замещенными одним или несколькими заместителями, такими как те, которые иллюстрируются в целом выше, или как иллюстрируется посредством конкретных классов, подклассов и видов настоящего изобретения.
Как используется в настоящем описании, термин "алифатический остаток" охватывает термины "алкил", "алкенил", "алкинил", каждый из которых является необязательно замещенным, как приведено ниже.
Как используется в настоящем описании, "алкильная" группа относится к насыщенной алифатической углеводородной группе, содержащей 1-8 (например, 1-6 или 1-4) атомов углерода. Алкильная группа может быть прямой или разветвленной. Примеры алкильных групп включают, но не ограничиваясь этим, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гептил или 2-этилгексил. Алкильная группа может быть замещенной (т.е. необязательно замещенной) одним или несколькими заместителями, такими как галоген, циклоалифатический остаток [например, циклоалкил или циклоалкенил], гетероциклоалифатический остаток [например, гетероциклоалкил или гетероциклоалкенил], арил, гетероарил, алкокси, ароил, гетероароил, ацил [например, (алифатический)карбонил, (циклоалифатический)карбонил или (гетероциклоалифатический)карбонил], нитро, циано, амидо [например, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино алкиламинокарбонил, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, ариламинокарбонил или гетероариламинокарбонил], амино [например, алифатическая амино, циклоалифатическая амино или гетероциклоалифатическая амино], сульфонил [например, алифатический остаток-SO2-], сульфинил, сульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо, карбокси, карбамоил, циклоалифатическая окси, гетероциклоалифатическая окси, арилокси, гетероарилокси, аралкилокси, гетероарилалкокси, алкоксикарбонил, алкилкарбонилокси или гидрокси. Без ограничения, некоторые примеры замещенных алкилов включают карбоксиалкил (такой как HOOC-алкил, алкоксикарбонилалкил и алкилкарбонилоксиалкил), цианоалкил, гидроксиалкил, алкоксиалкил, ацилалкил, аралкил, (алкоксиарил)алкил, (сульфониламино)алкил (такой как (алкил-SO2-амино)алкил), аминоалкил, амидоалкил, (циклоалифатический)алкил или галогеналкил.
Как используется в настоящем описании, "алкенильная" группа относится к алифатической углеродной группе, которая содержит 2-8 (например, 2-6 или 2-4) атомов углерода и, по меньшей мере, одну двойную связь. Подобно алкильной группе алкенильная группа может быть прямой или разветвленной. Примеры алкенильной группы включают, но не ограничиваясь этим, аллил, изопренил, 2-бутенил и 2-гексенил. Алкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как галоген, циклоалифатический остаток [например, циклоалкил или циклоалкенил], гетероциклоалифатический остаток [например, гетероциклоалкил или гетероциклоалкенил], арил, гетероарил, алкокси, ароил, гетероароил, ацил [например, (алифатический)карбонил, (циклоалифатический)карбонил или (гетероциклоалифатический)карбонил], нитро, циано, амидо [например, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино алкиламинокарбонил, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, ариламинокарбонил или гетероариламинокарбонил], амино [например, алифатическая амино, циклоалифатическая амино, гетероциклоалифатическая амино или алифатическая сульфониламино], сульфонил [например, алкил-SO2-, циклоалифатический остаток-SO2- или арил-SO2-], сульфинил, сульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо, карбокси, карбамоил, циклоалифаческая окси, гетероциклоалифатическая окси, арилокси, гетероарилокси, аралкилокси, гетероаралкокси, алкоксикарбонил, алкилкарбонилокси или гидрокси. Без ограничения, некоторые примеры замещенных алкенилов включают цианоалкенил, алкоксиалкенил, ацилалкенил, гидроксиалкенил, аралкенил, (алкоксиарил)алкенил, (сульфониламино)алкенил (такой как (алкил-SO2-амино)алкенил), аминоалкенил, амидоалкенил, (циклоалифатический)алкенил или галогеналкенил.
Как используется в настоящем описании, "алкинильная" группа относится к алифатической углеродной группе, которая содержит 2-8 (например, 2-6 или 2-4) атомов углерода и имеет, по меньшей мере, одну тройную связь. Алкинильная группа может быть прямой или разветвленной. Примеры алкинильной группы включают, но не ограничиваясь этим, пропаргил и бутинил. Алкинильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как ароил, гетероароил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, нитро, карбокси, циано, галоген, гидрокси, сульфо, меркапто, сульфанил [например, алифатический сульфанил или циклоалифатический сульфанил], сульфинил [например, алифатический сульфинил или циклоалифатический сульфинил], сульфонил [например, алифатический остаток-SO2-, алифатическая амино-SO2- или циклоалифатическая-SO2-], амидо [например, аминокарбонил, алкиламинокарбонил, алкилкарбониламино, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, циклоалкилкарбониламино, ариламинокарбонил, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (циклоалкилалкил)карбониламино, гетероаралкилкарбониламино, гетероарилкарбониламино или гетероариламинокарбонил], мочевина, тиомочевина, сульфамоил, сульфамид, алкоксикарбонил, алкилкарбонилокси, циклоалифатический остаток, гетероциклоалифатический остаток, арил, гетероарил, ацил [например, (циклоалифатический)карбонил или (гетероциклоалифатический)карбонил], амино [например, алифатическая амино], сульфокси, оксо, карбокси, карбамоил, (циклоалифатическая)окси, (гетероциклоалифатическая)окси или (гетероарил)алкокси.
Как используется в настоящем описании, "амидо" охватывает как "аминокарбонил", так и "карбониламино". Эти термины, когда используются сами по себе или в сочетании с другой группой, относятся к амидогруппе, такой как -N(RX)-C(O)-RY или -C(O)-N(RX)2, когда используются для концевой группы, и -C(O)-N(RX)- или -N(RX)-C(O)-, когда используются внутри группы, где RX и RY определены ниже.
Примеры амидогрупп включают алкиламидо (такую как алкилкарбониламино или алкиламинокарбонил), (гетероциклоалифатическая)амидо, (гетероаралкил)амидо, (гетероарил)амидо, (гетероциклоалкил)алкиламидо, ариламидо, аралкиламидо, (циклоалкил)алкиламидо или циклоалкиламидо.
Как используется в настоящем описании, "амино" группа относится к -NRXRY, где каждый из RX и RY независимо представляет собой водород, алифатический остаток, циклоалифатический остаток, (циклоалифатический)алифатический остаток, арил, аралифатический остаток, гетероциклоалифатический остаток, (гетероциклоалифатический)алифатический остаток, гетероарил, карбокси, сульфанил, сульфинил, сульфонил, (алифатический)карбонил, (циклоалифатический)карбонил, ((циклоалифатический)алифатический)карбонил, арилкарбонил, (аралифатический)карбонил, (гетероциклоалифатический)карбонил, ((гетероциклоалифатический)алифатический)карбонил, (гетероарил)карбонил или (гетероаралифатический)карбонил, каждый из которых определен в настоящем описании и является необязательно замещенным. Примеры аминогрупп включают алкиламино, диалкиламино или ариламино. Когда термин "амино" группа не представляет собой концевую группу (например, алкилкарбониламино), то она представлена как -NRX-, где RX имеет такое же значение, как определено выше.
Как используется в настоящем описании, "арильная" группа используется сама по себе или как часть большего остатка, как в "аралкиле", "аралкокси" или "арилоксиалкиле", относится к моноциклическим (например, фенил); бициклическим (например, инденил, нафталенил, тетрагидронафтил, тетрагидроинденил); и трициклическим (например, флуоренил, тетрагидрофлуоренил или тетрагидроантраценил, антраценил) кольцевым системам, в которых моноциклическая кольцевая система является ароматической или, по меньшей мере, одно из колец в бициклической или трициклической кольцевой системе является ароматическим. Бициклические и трициклические группы включают бензоконденсированные 2-3-членные карбоциклические кольца. Например, бензоконденсированная группа включает фенил, конденсированный с двумя или более C4-8-карбоциклическими остатками. Арил является необязательно замещенным одним или несколькими заместителями, включая алифатический остаток [например, алкил, алкенил, или алкинил]; циклоалифатический остаток; (циклоалифатический)алифатический остаток; гетероциклоалифатический остаток; (гетероциклоалифатический)алифатический остаток; арил; гетероарил; алкокси; (циклоалифатическую)окси; (гетероциклоалифатическую)окси; арилокси; гетероарилокси; (аралифатическую)окси; (гетероаралифатическую)окси; ароил; гетероароил; амино; оксо (на неароматическом карбоциклическом кольце бензоконденсированного бициклического или трициклического арила); нитро; карбокси; амидо; ацил [например, алифатический карбонил; (циклоалифатический)карбонил; ((циклоалифатический)алифатический)карбонил; (аралифатический)карбонил; (гетероциклоалифатический)карбонил; ((гетероциклоалифатический)алифатический)карбонил; или (гетероаралифатический)карбонил]; сульфонил [например, алифатический остаток-SO2- или амино-SO2-]; сульфинил [например, алифатический остаток-S(O)- или циклоалифатический остаток-S(O)-]; сульфанил [например, алифатический остаток-S-]; циано; галоген; гидрокси; меркапто; сульфокси; мочевину; тиомочевину; сульфамоил; сульфамид; или карбамоил. Альтернативно, арил может быть незамещенным.
Неограничивающие примеры замещенных арилов включают галогенарил [например, моно-, ди- (такой как пара,м-дигалогенарил), и (тригалоген)арил]; (карбокси)арил [например, (алкоксикарбонил)арил, ((аралкил)карбонилокси)арил и (алкоксикарбонил)арил]; (амидо)арил [например, (аминокарбонил)арил, (((алкиламино)алкил)аминокарбонил)арил, (алкилкарбонил)аминоарил, (ариламинокарбонил)арил и (((гетероарил)амино)карбонил)арил]; аминоарил [например, ((алкилсульфонил)амино)арил или ((диалкил)амино)арил]; (цианоалкил)арил; (алкокси)арил; (сульфамоил)арил [например, (аминосульфонил)арил]; (алкилсульфонил)арил; (циано)арил; (гидроксиалкил)арил; ((алкокси)алкил)арил; (гидрокси)арил, ((карбокси)алкил)арил; (((диалкил)амино)алкил)арил; (нитроалкил)арил; (((алкилсульфонил)амино)алкил)арил; ((гетероциклоалифатический)карбонил)арил; ((алкилсульфонил)алкил)арил; (цианоалкил)арил; (гидроксиалкил)арил; (алкилкарбонил)арил; алкиларил; (тригалогеналкил)арил; пара-амино-м-алкоксикарбониларил; пара-амино-м-цианоарил; пара-галоген-м-аминоарил; или (м-(гетероциклоалифатический)-o-(алкил))арил.
Как используется в настоящем описании, "аралифатическая группа", такая как "аралкильная" группа, относится к алифатической группе (например, C1-4 алкильной группе), которая является замещенной арильной группой. "Алифатическая группа", "алкильная группа" и "арильная группа" определяются в настоящем описании. Пример аралифатической группы, такой как аралкильная группа, представляет собой бензил.
Как используется в настоящем описании, "аралкильная" группа относится к алкильной группе (например, C1-4 алкильной группе), которая является замещенной арильной группой. Как "алкил", так и "арил" определяются выше. Пример аралкильной группы представляет собой бензил. Аралкил является необязательно замещенным одним или несколькими заместителями, такими как алифатический остаток [например, алкил, алкенил или алкинил, включая карбоксиалкил, гидроксиалкил или галогеналкил, такой как трифторметил], циклоалифатический остаток [например, циклоалкил или циклоалкенил], (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, амидо [например, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклoалкилалкил)карбониламино, гетероарилкарбониламино, или гетероаралкилкарбониламино], циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Как используется в настоящем описании, "бициклическая кольцевая система" включает 8-12 (например, 9, 10 или 11)-членные структуры, которые формируют два кольца, где два кольца имеют, по меньшей мере, один общий атом (например, 2 общих атома). Бициклические кольцевые системы включают бициклоалифатические системы (например, бициклоалкил или бициклоалкенил), бициклогетероалифатические системы, бициклические арилы и бициклические гетероарилы.
Как используется в настоящем описании, "циклоалифатическая" группа охватывает "циклоалкильную" группу и "циклоалкенильную" группу, каждая из которых является необязательно замещенной, как приведено ниже.
Как используется в настоящем описании, "циклоалкильная" группа относится к насыщенному карбоциклическому моно- или бициклическому (конденсированному или соединенному мостиком) кольцу из 3-10 (например, 5-10) атомов углерода. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, норборнил, кубил, октагидроинденил, декагидронафтил, бицикло[3.2.1]октил, бицикло[2.2.2]октил, бицикло[3.3.1]нонил, бицикло[3.3.2.]децил, бицикло[2.2.2]октил, адамантил, азациклоалкил или ((аминокарбонил)циклоалкил)циклоалкил. "Циклоалкенильная" группа, как используется в настоящем описании, относится к неароматическому карбоциклическому кольцу из 3-10 (например, 4-8) атомов углерода, имеющему одну или несколько двойных связей. Примеры циклоалкенильных групп включают циклопентенил, 1,4-циклогексадиенил, циклогептенил, циклооктенил, гексагидро-инденил, октагидронафтил, циклогексенил, циклопентенил, бицикло[2.2.2]октенил или бицикло[3.3.1]ноненил. Циклоалкильная или циклоалкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как алифатический остаток [например, алкил, алкенил или алкинил], циклоалифатический остаток, (циклоалифатический)алифатический остаток, гетероциклоалифатический остаток, (гетероциклоалифатический)алифатический остаток, арил, гетероарил, алкокси, (циклоалифатическая)окси, (гетероциклоалифатическая)окси, арилокси, гетероарилокси, (аралифатическая)окси, (гетероаралифатическая)окси, ароил, гетероароил, амино, амидо [например, (алифатическая)карбониламино, (циклоалифатическая)карбониламино, ((циклоалифатическая)алифатическая)карбониламино, (арил)карбониламино, (аралифатическая)карбониламино, (гетероциклоалифатическая)карбониламино, ((гетероциклоалифатическая)алифатическая)карбониламино, (гетероарил)карбониламино или (гетероаралифатическая)карбониламино], нитро, карбокси [например, HOOC-, алкоксикарбонил или алкилкарбонилокси], ацил [например, (циклоалифатический)карбонил, ((циклоалифатический) алифатический)карбонил, (аралифатический)карбонил, (гетероциклоалифатический)карбонил, ((гетероциклоалифатический)алифатический)карбонил или (гетероаралифатический)карбонил], циано, галоген, гидрокси, меркапто, сульфонил [например, алкил-SO2- и арил-SO2-], сульфинил [например, алкил-S(O)-], сульфанил [например, алкил-S-], сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Как используется в настоящем описании, "циклический остаток" включает циклоалифатический остаток, гетероциклоалифатический остаток, арил или гетероарил, каждый из которых определен ранее.
Как используется в настоящем описании, термин "гетероциклоалифатическая группа" охватывает гетероциклоалкильную группу и гетероциклоалкенильную группу, каждая из которых является необязательно замещенной, как приведено ниже.
Как используется в настоящем описании, "гетероциклоалкильная" группа относится к 3-10-членной моно- или бициклической (конденсированной или соединенной мостиком) (например, 5-10-членной моно- или бициклической) насыщенной кольцевой структуре, в которой один или несколько атомов кольца представляет собой гетероатомы (например, N, O, S, или их сочетание). Примеры гетероциклоалкильной группы включают пиперидил, пиперазил, тетрагидропиранил, тетрагидрофурил, 1,4-диоксоланил, 1,4-дитианил, 1,3-диоксоланил, оксазолидил, изоксазолидил, морфолинил, тиоморфолил, октагидробензофурил, октагидрохроменил, октагидротиохроменил, октагидроиндолил, октагидропиридинил, декагидрохинолинил, октагидробензо[b]тиофенеил, 2-окса-бицикло[2.2.2]октил, 1-аза-бицикло[2.2.2]октил, 3-аза-бицикло[3.2.1]октил и 2,6-диокса-трицикло[3.3.1.03,7]нонил. Моноциклическая гетероциклоалкильная группа может быть конденсированной с фенильным остатком, таким как тетрагидроизохинолин. "Гетероциклоалкенильная" группа, как используется в настоящем описании, относится к моно- или бициклической (например, 5-10-членной моно- или бициклической) неароматической кольцевой структуре, имеющей одну или несколько двойных связей, и где один или несколько атомов кольца представляют собой гетероатомы (например, N, O или S). Моноциклические и бициклогетероалифатические группы нумеруются в соответствии со стандартной химической номенклатурой.
Гетероциклоалкильная или гетероциклоалкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как алифатический остаток [например, алкил, алкенил или алкинил], циклоалифатический остаток, (циклоалифатический)алифатический остаток, гетероциклоалифатический остаток, (гетероциклоалифатический)алифатический остаток, арил, гетероарил, алкокси, (циклоалифатическая)окси, (гетероциклоалифатическая)окси, арилокси, гетероарилокси, (аралифатическая)окси, (гетероаралифатическая)окси, ароил, гетероароил, амино, амидо [например, (алифатическая)карбониламино, (циклоалифатическая)карбониламино, ((циклоалифатическая)алифатическая)карбониламино, (арил)карбониламино, (аралифатическая)карбониламино, (гетероциклоалифатическая)карбониламино, ((гетероциклоалифатическая)алифатическая)карбониламино, (гетероарил)карбониламино или (гетероаралифатическая)карбониламино], нитро, карбокси [например, HOOC-, алкоксикарбонил или алкилкарбонилокси], ацил [например, (циклоалифатический)карбонил, ((циклоалифатический) алифатический)карбонил, (аралифатический)карбонил, (гетероциклоалифатический)карбонил, ((гетероциклоалифатический)алифатический)карбонил или (гетероаралифатический)карбонил], нитро, циано, галогеном, гидрокси, меркапто, сульфонил [например, алкилсульфонил или арилсульфонил], сульфинил [например, алкилсульфинил], сульфанил [например, алкилсульфанил], сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
"Гетероарильная группа", как используется в настоящем описании, относится к моноциклической, бициклической или трициклической кольцевой системе, имеющей 4-15 атомов кольца, где один или несколько атомов кольца представляют собой гетероатомы (например, N, O, S, или их сочетания), и в которой моноциклическая кольцевая система является ароматической или, по меньшей мере, одно из колец в бициклической или трициклической кольцевых системах является ароматическим. Гетероарильная группа включает бензоконденсированную кольцевую систему, имеющую 2-3 кольца. Например, бензоконденсированная группа включает бензо, конденсированную с одним или двумя 4-8-членными гетероциклоалифатическими остатками (например, индолизил, индолил, изоиндолил, 3H-индолил, индолинил, бензо[b]фурил, бензо[b]тиофенил, хинолинил или изохинолинил). Некоторые примеры гетероарила представляют собой азетидинил, пиридил, 1H-индазолил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, тетразолил, бензофурил, изохинолинил, бензтиазолил, ксантен, тиоксантен, фенотиазин, дигидроиндол, бензо[1,3]диоксол, бензо[b]фурил, бензо[b]тиофенил, индазолил, бензимидазолил, бензтиазолил, пурил, циннолил, хинолил, хиназолил, циннолил, фталазил, хиназолил, хиноксалил, изохинолил, 4H-хинолизил, бензо-1,2,5-тиадиазолил или 1,8-нафтиридил.
Без ограничения, моноциклические гетероарилы включают фурил, тиофенил, 2H-пирролил, пирролил, оксазоил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, 1,3,4-тиадиазолил, 2H-пиранил, 4-H-пранил, пиридил, пиридазил, пиримидил, пиразолил, пиразил или 1,3,5-триазил. Моноциклические гетероарилы нумеруются в соответствии со стандартной химической номенклатурой.
Без ограничения, бициклические гетероарилы включают индолизил, индолил, изоиндолил, 3H-индолил, индолинил, бензо[b]фурил, бензо[b]тиофенил, хинолинил, изохинолинил, индолизил, изоиндолил, индолил, бензо[b]фурил, бензо[b]тиофенил, индазолил, бензимидазил, бентиазолил, пуринил, 4H-хинолизил, хинолил, изохинолил, циннолил, фталазил, хиназолил, хиноксалил, 1,8-нафтиридил или птеридил. Бициклические гетероарилы нумеруются в соответствии со стандартной химической номенклатурой.
Гетероарил является необязательно замещенным одним или несколькими заместителями, такими как алифатический остаток [например, алкил, алкенил или алкинил]; циклоалифатический остаток; (циклоалифатический)алифатический остаток; гетероциклоалифатический остаток; (гетероциклоалифатический)алифатический остаток; арил; гетероарил; алкокси; (циклоалифатическая)окси; (гетероциклоалифатическая)окси; арилокси; гетероарилокси; (аралифатическая)окси; (гетероаралифатическая)окси; ароил; гетероароил; амино; оксо (на неароматическом карбоциклическом или гетероциклическом кольце бициклического или трициклического гетероарила); карбокси; амидо; ацил [например, алифатический карбонил; (циклоалифатический)карбонил; ((циклоалифатический)алифатический)карбонил; (аралифатический)карбонил; (гетероциклоалифатический)карбонил; ((гетероциклоалифатический)алифатический)карбонил; или (гетероаралифатический)карбонил]; сульфонил [например, алифатический сульфонил или аминосульфонил]; сульфинил [например, алифатический сульфинил]; сульфанил [например, алифатический сульфанил]; нитро; циано; галоген; гидрокси; меркапто; сульфокси; мочевина; тиомочевина; сульфамоил; сульфамид; или карбамоил. Альтернативно, гетероарил может быть незамещенным.
Неограничивающие примеры замещенных гетероарилов включают (галоген)гетероарил [например, моно- и ди(галоген)гетероарил]; (карбокси)гетероарил [например, (алкоксикарбонил)гетероарил]; цианогетероарил; аминогетероарил [например, ((алкилсульфонил)амино)гетероарил и ((диалкил)амино)гетероарил]; (амидо)гетероарил [например, аминокарбонилгетероарил, ((алкилкарбонил)амино)гетероарил, ((((алкил)амино)алкил)аминокарбонил)гетероарил, (((гетероарил)амино)карбонил)гетероарил, ((гетероциклоалифатический)карбонил)гетероарил, и ((алкилкарбонил)амино)гетероарил]; (цианоалкил)гетероарил; (алкокси)гетероарил; (сулфамоил)гетероарил [например, (аминосульфонил)гетероарил]; (сульфонил)гетероарил [например, (алкилсульфонил)гетероарил]; (гидроксиалкил)гетероарил; (алкоксиалкил)гетероарил; (гидрокси)гетероарил; ((карбокси)алкил)гетероарил; (((диалкил)амино)алкил]гетероарил; (гетероциклоалифатический)гетероарил; (циклоалифатический)гетероарил; (нитроалкил)гетероарил; (((алкилсульфонил)амино)алкил)гетероарил; ((алкилсульфонил)алкил)гетероарил; (цианоалкил)гетероарил; (ацил)гетероарил [например, (алкилкарбонил)гетероарил]; (алкил)гетероарил и (галогеналкил)гетероарил [например, тригалогеналкилгетероарил].
"Гетероаралифатическая группа" (такая как гетероаралкильная группа), как используется в настоящем описании, относится к алифатической группе (например, C1-4-алкильной группе), которая является замещенной гетероарильной группой. "Алифатический остаток", "алкил" и "гетероарил" определены выше.
"Гетероаралкильная" группа, как используется в настоящем описании, относится к алкильной группе (например, C1-4-алкильной группе), которая является замещенной гетероарильной группой. Как "алкил", так и "гетероарил" определены выше. Гетероаралкил является необязательно замещенным одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил, и галогеналкилы, такие как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, алкилсулфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Как используется в настоящем описании, "ацильная" группа относится к формильной группе или RX-C(O)- (такой как алкил-C(O)-, также упоминаемой как "алкилкарбонил"), где RX и "алкил" определены ранее. Ацетил и пивалоил представляют собой примеры ацильных групп.
Как используется в настоящем описании, "ароил" или "гетероароил" относится к арил-C(O)- или гетероарил-C(O)-. Арильная и гетероарильная часть ароила или гетероароила является необязательно замещенной, как определено ранее.
Как используется в настоящем описании, "алкокси" группа относится к группе алкил-O-, где "алкил" определен ранее.
Как используется в настоящем описании, "карбамоильная" группа относится к группе, имеющей структуру -O-CO-NRXRY или -NRX-CO-O-RZ, где RX и RY определены выше, а RZ может представлять собой алифатический остаток, арил, аралифатический остаток, гетероциклоалифатический остаток, гетероарил или гетероаралифатический остаток.
Как используется в настоящем описании, "карбокси" группа относится к -COOH, -COORA, -OC(O)H, -OC(O)RA, когда используется в качестве концевой группы; или -OC(O)- или -C(O)O-, когда используется внутри группы.
Как используется в настоящем описании, "галогеналифатическая" группа относится к алифатической группе, замещенной 1-3 галогенами. Например, термин "галогеналкил" включает группу -CF3.
Как используется в настоящем описании, "меркапто" группа относится к -SH.
Как используется в настоящем описании, "сульфо" группа относится к -SO3H или -SO3RX, когда используется в качестве концевой группы, или S(O)3-, когда используется внутри группы.
Как используется в настоящем описании, "сульфамидная" группа относится к структуре -NRX-S(O)2-NRYRZ, когда используется в качестве концевой группы, и к -NRX-S(O)2-NRY-, когда используется внутри группы, где RX, RY и RZ определены выше.
Как используется в настоящем описании, "сульфонамидная" группа относится к структуре -S(O)2-NRXRY или -NRX-S(O)2-RZ, когда используется в качестве концевой группы, или к -S(O)2-NRX- или -NRX-S(O)2-, когда используется внутри группы, где RX, RY и RZ определены выше.
Как используется в настоящем описании, "сульфанильная" группа относится к -S-RX, когда используется в качестве концевой группы, и к -S-, когда используется внутри группы, где RX определен выше. Примеры сульфанилов включают алифатический остаток-S-, циклоалифатический остаток-S-, арил-S- или что-либо подобное.
Как используется в настоящем описании, "сульфинильная" группа относится к -S(O)-RX, когда используется в качестве концевой группы, и к -S(O)-, когда используется внутри группы, где RX определен выше. Примеры сульфинильных групп включают алифатический остаток-S(O)-, арил-S(O)-, (циклоалифатический(алифатический остаток))-S(O)-, циклоалкил-S(O)-, гетероциклоалифатический остаток-S(O)-, гетероарил-S(O)- или что-либо подобное.
Как используется в настоящем описании, "сульфонильная" группа относится к -S(O)2-RX, когда используется в качестве концевой группы, и к -S(O)2-, когда используется внутри группы, где RX определен выше. Примеры сульфонильных групп включают алифатический остаток-S(O)2-, арил-S(O)2-, (циклоалифатический(алифатический остаток))-S(O)2-, циклоалифатический остаток-S(O)2-, гетероциклоалифатический остаток-S(O)2-, гетероарил-S(O)2-, (циклоалифатический(амидо(алифатический остаток)))-S(O)2- или что-либо подобное.
Как используется в настоящем описании, "сульфокси" группа относится к -O-SO-RX или -SO-O-RX, когда используется в качестве концевой группы, и к -O-S(O)- или -S(O)-O-, когда используется внутри группы, где RX определен выше.
Как используется в настоящем описании, "галоген" или "галогеновая" группа относится к фтору, хлору, брому или йоду.
Как используется в настоящем описании, "алкоксикарбонил", который охватывается термином "карбокси", используемый сам по себе или в связи с другой группой, относится к такой группе, как алкил-O-C(O)-.
Как используется в настоящем описании, "алкоксиалкил" относится к алкильной группе, такой как алкил-O-алкил-, где алкил определен выше.
Как используется в настоящем описании, "карбонил" относится к -C(O)-.
Как используется в настоящем описании, "оксо" относится к =O.
Как используется в настоящем описании, "аминоалкил" относится к структуре (RX)2N-алкил-.
Как используется в настоящем описании, "цианоалкил" относится к структуре (NC)-алкил-.
Как используется в настоящем описании, группа "мочевины" относится к структуре -NRX-CO-NRYRZ и группа "тиомочевины" относится к структуре -NRX-CS-NRYRZ, когда используется в качестве концевой группы, и к -NRX-CO-NRY- или -NRX-CS-NRY-, когда используется внутри группы, где RX, RY и RZ определены выше.
Как используется в настоящем описании, "гуанидиновая" группа относится к структуре -N=C(N(RXRY))N(RXRY) или -NRX-C(=NRX)NRXRY, где RX и RY определены выше.
Как используется в настоящем описании, термин "амидино" группа относится к структуре -C=(NRX)N(RXRY), где RX и RY определены выше.
В целом, термин "вицинальный" относится к расположению заместителей в группе, которая содержит два или более атомов углерода, где заместители присоединены к соседним атомам углерода.
В целом, термин "геминальный" относится к расположению заместителей в группе, которая содержит два или более атомов углерода, где заместители присоединены к одному и тому же атому углерода.
Термины "в качестве концевой группы" и "внутри группы" относятся к положению группы в заместителе. Группа является концевой, когда группа присутствует на конце заместителя, не связанного дополнительно с оставшейся частью химической структуры. Карбоксиалкил, т.е. RXO(O)C-алкил, представляет собой пример карбоксигруппы, используемой в качестве концевой группы. Группа находится внутри группы, когда группа расположена в положении от середины заместителя до конца заместителя, связанного с остальной частью химической структуры. Алкилкарбокси (например, алкил-C(O)O- или алкил-OC(O)-) и алкилкарбоксиарил (например, алкил-C(O)O-арил- или алкил-O(CO)-арил-) представляют собой примеры карбоксигрупп, используемых внутри группы.
Как используется в настоящем описании, "циклическая группа" включает моно-, би- и трициклические кольцевые системы, включая циклоалифатический остаток, гетероциклоалифатический остаток, арил или гетероарил, каждый из которых определен ранее.
Как используется в настоящем описании, "соединенная мостиком бициклическая кольцевая система" относится к бициклической гетероциклоалифатической кольцевой системе или бициклической циклоалифатической кольцевой системе, в которой кольца соединяются мостиками. Примеры соединенных мостиком бициклических кольцевых систем включают, но не ограничиваясь этим, адамантанил, норборнанил, бицикло[3.2.1]октил, бицикло[2.2.2]октил, бицикло[3.3.1]нонил, бицикло[3.2.3]нонил, 2-оксабицикло[2.2.2]октил, 1-азабицикло[2.2.2]октил, 3-азабицикло[3.2.1]октил и 2,6-диокса-трицикло[3.3.1.03,7]нонил. Соединенная мостиком бициклическая кольцевая система необязательно может быть замещенной одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Как используется в настоящем описании, "алифатическая цепь" относится к алифатической группе с разветвленной или прямой цепью (например, алкильные группы, алкенильные группы или алкинильные группы). Прямая алифатическая цепь имеет структуру -[CH2]V-, где V равно 1-6. Разветвленная алифатическая цепь представляет собой прямую алифатическую цепь, которая является замещенной одной или несколькими алифатическими группами. Разветвленная алифатическая цепь имеет структуру -[CHQ]V- где Q представляет собой водород или алифатическую группу; однако Q должен представлять собой алифатическую группу, по меньшей мере, в одном случае. Термин "алифатическая цепь" включает алкильные цепи, алкенильные цепи и алкинильные цепи, где алкил, алкенил и алкинил определены выше.
Термин "трициклическая конденсированная кольцевая система" относится к циклоалифатической, гетероциклоалифатической, арильной или гетероарильной системе, содержащей три кольца, каждое кольцо разделяет, по меньшей мере, два общих атома, по меньшей мере, с одним другим кольцом. Неограничивающие примеры трициклической конденсированный кольцевой системы включают антрацен, ксантен, 1H-фенален, тетрадекагидрофенантрен, акридин и фенотиазин.
Фраза "необязательно замещенный" используется взаимозаменяемо с фразой "замещенный или незамещенный". Как описано в настоящем описании, соединения по настоящему изобретению могут необязательно быть замещенными одним или несколькими заместителями, такими как иллюстрируется в целом выше, или как иллюстрируется с помощью конкретных классов, подклассов и видов по настоящему изобретению. Как описано в настоящем описании, переменные в формуле I, например R1, R2 и R3, и другие переменные, содержащиеся в ней, охватывают конкретные группы, такие как алкил и арил. Если не отмечено иного, каждая из конкретных групп для переменных R1, R2 и R3, и других переменных, содержащихся в ней, может быть необязательно замещенной одним или несколькими заместителями, описанными в настоящем описании. Каждый заместитель конкретной группы дополнительно является необязательно замещенным одним- тремя заместителями, выбранными из галогена, циано, оксо, алкокси, гидрокси, амино, нитро, арила, галогеналкила и алкила. Например, алкильная группа может быть замещенной алкилсульфанилом, и алкилсульфанил может быть необязательно замещенным одним-тремя заместителями, выбранными из галогена, циано, оксо, алкокси, гидрокси, амино, нитро, арила, галогеналкила и алкила. В качестве дополнительного примера, циклоалкильная часть (циклоалкил)карбониламино может быть необязательно замещенной одним-тремя заместителями, выбранными из галогена, циано, алкокси, гидрокси, нитро, галогеналкила и алкила. Когда две алкоксигруппы связаны с одним и тем же атомом или с соседними атомами, две алкоксигруппы могут образовывать кольцо вместе с атомом(ами), к которому они присоединены.
В целом, термин "замещенный", предшествует ли ему термин "необязательно" или нет, относится к замене водородных радикалов в данной структуре радикалом указанного заместителя. Конкретные заместители описаны выше в определениях и ниже в описаниях соединений и их примеров. Если не определено иного, необязательно замещенная группа может иметь заместитель в каждом замещаемом положении группы, и когда более одного положения в любой данной структуре может быть замещенным более чем одним заместителем, выбранным из указанной группы, заместитель в каждом положении может быть одинаковым или отличным от других. Кольцевой заместитель, такой как гетероциклоалкил, может быть связан с другим кольцом, таким как циклоалкил, с образованием спиро-бициклической кольцевой системы, например, оба кольца разделяют один общий атом. Как заметит специалист в данной области, сочетания заместителей, рассматриваемые настоящим изобретением, представляют собой такие сочетания, которые приводят к образованию стабильных или химически пригодных для использования соединений.
Фраза "стабильное или химически пригодное для использования", как используется в настоящем описании, относится к соединениям, которые по существу не изменяются, когда подвергаются воздействию условий, дающих возможность для их получения, детектирования и, предпочтительно, для их извлечения, очистки и использования для одной или нескольких целей, описанных в настоящем описании. В некоторых вариантах осуществления стабильное соединение или химически подходящее соединение представляет собой такое, которое по существу не изменяется, когда выдерживается при температуре 40°C или меньше, в отсутствие влажности или других химически активных условий, в течение, по меньшей мере, недели.
Как используется в настоящем описании, эффективное количество определяется как количество, необходимое для оказания терапевтического воздействия на подвергающегося лечению пациента, и, как правило, определяется на основе возраста, площади поверхности тела, массы и состояния пациента. Соотношение доз для животных и людей (в миллиграммах на квадратный метр поверхности тела) описывается Freireich et al., Cancer Chemother. Rep., 50: 219 (1966). Площадь поверхности тела может приблизительно определяться по росту и массе пациента. См., например, Scientific Tables, Geigy Pharmaceuticals, Ardsley, New York, 537 (1970). Как используется в настоящем описании, "пациент" относится к млекопитающему, включая человека.
Если не утверждается иного, структуры, изображенные здесь, также, как подразумевается, включают все изомерные (например, энантиомерные, диастереомерные и геометрические (или конформационные)) формы структуры; например, R- и S-конфигурации для каждого асимметричного центра, (Z)- и (E)-изомеры двойной связи и (Z)- и (E)-конформационные изомеры. По этой причине отдельные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси настоящих соединений находятся в рамках настоящего изобретения. Если не утверждается иного, все таутомерные формы соединений по настоящему изобретению находятся в рамках настоящего изобретения. В дополнение к этому, если не утверждается иного, структуры, изображенные в настоящем описании, также, как подразумевается, включают соединения, которые отличаются только присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие настоящие структуры, за исключением замены водорода дейтерием или тритием, или замены углерода 13C- или 14C-обогащенным углеродом находятся в рамках настоящего изобретения. Такие соединения являются пригодными для использования, например, в качестве аналитических инструментов или зондов при биологических анализах.
Соединение формулы (I), которое является кислотным по природе (например, имеющим карбоксильную или фенольную гидроксильную группу), может образовывать фармацевтически приемлемую соль, такую как соль натрия, калия, кальция или золота. Также в рамках настоящего изобретения находятся соли, полученные с фармацевтически приемлемыми аминами, такими как аммиак, алкиламины, гидроксиалкиламины и N-метилгликамин. Соединение формулы I может обрабатываться кислотой с образованием кислотно-аддитивных солей. Примеры таких кислот включают хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, метансульфоновую кислоту, фосфорную кислоту, пара-бромфенилсульфоновую кислоту, угольную кислоту, янтарную кислоту, лимонную кислоту, бензойную кислоту, щавелевую кислоту, малоновую кислоту, салициловую кислоту, яблочную кислоту, фумаровую кислоту, аскорбиновую кислоту, малеиновую кислоту, уксусную кислоту и другие минеральные и органические кислоты, хорошо известные специалистам в данной области. Кислотно-аддитивные соли могут быть получены посредством обработки соединения формулы I в форме ее свободного основания достаточным количеством кислоты (например, хлористоводородной кислоты) для получения кислотно-аддитивной соли (например, гидрохлоридной соли). Кислотно-аддитивная соль может преобразовываться обратно в форму ее свободного основания посредством обработки соли соответствующим разбавленным водным основным раствором (например, раствором гидроксида натрия, бикарбоната натрия, карбоната калия или аммония). Соединения формулы (I) могут также находиться, например, в форме ахиральных соединений, рацемических смесей, оптически активных соединений, чистых диастереомеров или смеси диастереомеров.
Термин "50% или менее R-изомера" используется взаимозаменяемо с "50% или более S-изомера".
Следующие далее сокращения имеют следующие значения. Если сокращение не определяется, оно имеет повсеместно принятое значение.
BEMP = 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорин
Boc = трет-бутоксикарбонил
BOP = гексафторфосфат бензотриазол-1-илокси-трис(диметиламино)фосфония
bd = уширенный дублет
bs = уширенный синглет
d = дублет
dd = дублет дублетов
DIC = диизопропилкарбодиимид
DMF = диметилформамид
DMAP = диметиламинопиридин
DMSO = диметилсульфоксид
EDC = этил-1-(3-диметиламинопропил)карбодиимид
экв. = эквиваленты
EtOAc = этилацетат
г = грамм
HOBT = 1-гидроксибензотриазол
DIPEA = основание Хунига = диизопропилэтиламин
л = литр
m = мультиплет
M = моль
max = максимальный
мэкв. = миллиэквивалент
мг = миллиграмм
мл = миллилитр
мм = миллиметр
ммоль = миллимоль
MOC = метоксиоксикарбонил
н = нормальный
нг = нанограмм
нм = нанометр
OD = оптическая плотность
PEPC = 1-(3-(1-пирролидинил)пропил)-3-этилкарбодиимид
PP-HOBT = пиперидин-пиперидин-1-гидроксибензотриазол
psi = фунт/кв.дюйм = фунт на квадратный дюйм
Ph = фенил
q = квартет
quint. = квинтет
об/мин = обороты в минуту
s = синглет
t = триплет
TFA = трифторуксусная кислота
THF = тетрагидрофуран
tlc = ТСХ = тонкослойная хроматография
мкл = микролитр
УФ = ультрафиолет
II. Соединения
Соединения по настоящему изобретению обеспечивают желаемое терапевтическое лечение, поскольку они, как наблюдается, имеют более высокую биологическую доступность, когда R-изомер в положении C∗ составляет более 50% смеси (например, примерно 60%, примерно 70%, примерно 80%, примерно 85%, примерно 90%, примерно 95% или примерно 98%). Неожиданно, R-изомер в положении C∗ является примерно в 2 раза более доступным биологически, чем S-изомер в положении C∗. В дополнение к этому, R-изомер в положении C∗ преобразуется in vivo в S-изомер в положении C∗ с более высоким процентным отношением, чем S в положении C∗. Эти свойства усиливают терапевтическую эффективность соединений формулы I при более чем 50% R-изомера в положении C∗ в качестве ингибиторов активности серинпротеазы, таких как ингибиторы активности протеазы вируса гепатита C NS3-NS4A. Например, некоторые варианты осуществления настоящего изобретения, где имеется более чем 50% R-изомера на С∗, измеряют значение Ki(app) (видимой константы ингибирования), меньшее, чем 3 мкМ (например, примерно 2 мкМ, примерно 1,5 мкМ или примерно 1,190 мкМ), IC50 менее, примерно, чем 0,9 мкМ (например, примерно 0,883 мкМ), и CC50, большее, чем 100 мкМ.
Высокая биологическая доступность и благоприятные свойства преобразования изомера в положении C∗ придают повышенную терапевтическую эффективность соединениям по настоящему изобретению, таким как (1S,3aR,6aS)-2-[(2S)-2-{[(2S)-2-циклогексил-1-оксо-2-[(пиразинилкарбонил)амино]этил]амино]-3,3-диметил-1-оксобутил]-N-[(1R)-1-[2-(циклопропиламино)-1,2-диоксоэтил]бутил]октагидроциклопента[c]пиррол-1-карбоксамид, по сравнению с соединениями с 50% или более S-изомера в положении C∗.
Настоящее изобретение предлагает соединение формулы I
или его фармацевтически приемлемую соль, или их смеси, где C∗ представляет собой диастереомерный атом углерода; и
R-изомер составляет более 50% смеси по отношению к S-изомеру в положении C∗.
R1 представляет собой RW-, P3- или P4-L2-P3-.
R представляет собой необязательно замещенный алифатический остаток, необязательно замещенный циклоалифатический остаток, необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный арил или необязательно замещенный гетероарил.
W представляет собой связь, -NR4-, -O- или -S-.
R4 представляет собой H, необязательно замещенный алифатический остаток, необязательно замещенный циклоалифатический остаток, необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный арил или необязательно замещенный гетероарил.
P3- представляет собой 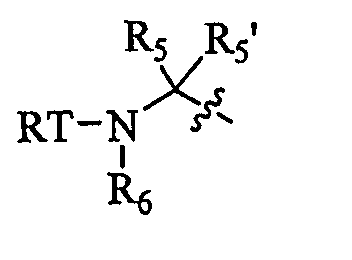
T представляет собой -C(O)-, -OC(O)-, -NHC(O)-, -C(O)C(O)- или -SO2-.
Каждый из R5 и R5' независимо представляют собой H, необязательно замещенный алифатический остаток, необязательно замещенный циклоалифатический остаток, необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный фенил или необязательно замещенный гетероарил.
R6 представляет собой необязательно замещенный алифатический остаток, необязательно замещенный гетероарил, необязательно замещенный фенил; или R5 и R6 вместе с атомами, к которым они присоединены, могут образовывать 5-7-членный необязательно замещенный моноциклический гетероциклоалифатический остаток или 6-12-членный необязательно замещенный бициклический гетероциклоалифатический остаток, в котором каждое гетероциклоалифатическое кольцо необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR50-.
R50 представляет собой H, необязательно замещенный алифатический остаток, необязательно замещенный гетероарил или необязательно замещенный фенил.
P4-L2-P3 представляет собой 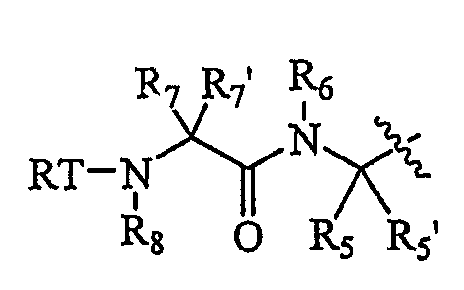
Каждый из R7 и R7' независимо представляет собой H, необязательно замещенный алифатический остаток, необязательно замещенный циклоалифатический остаток, необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный фенил или необязательно замещенный гетероарил; или R7 и R7' вместе с атомом, к которому они присоединены, могут образовывать 3-7-членное циклоалифатическое или гетероциклоалифатическое кольцо; или R7 и R6 вместе с атомами, к которым они присоединены, могут образовывать 5-7-членный необязательно замещенный моноциклический гетероциклоалифатический остаток, 5-7-членный необязательно замещенный моноциклический гетероарил, 6-12-членный необязательно замещенный бициклический гетероциклоалифатический остаток или 6-12-членный необязательно замещенный бициклический гетероарил, в котором каждое гетероциклоалифатическое или гетероарильное кольцо необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR50-, или когда R5 и R6 вместе с атомами, к которым они присоединены, могут образовывать кольцо; R7 и кольцевая система, образованная R5 и R6, могут образовывать 8-14-членную необязательно замещенную бициклическую конденсированную кольцевую систему, где бициклическая конденсированная кольцевая система является необязательно дополнительно конденсированной с необязательно замещенным фенилом с образованием необязательно замещенной 10-16-членной трициклической конденсированной кольцевой системы.
R8 представляет собой Н или защитную группу.
R2 представляет собой необязательно замещенный алифатический остаток, необязательно замещенный циклоалифатический остаток, необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный гетероарил или необязательно замещенный фенил.
R3 представляет собой Н, необязательно замещенный алифатический остаток, необязательно замещенный циклоалифатический остаток, необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный арил или необязательно замещенный гетероарил.
L представляет собой связь, -CF2-, -С(О)- или -SO2-.
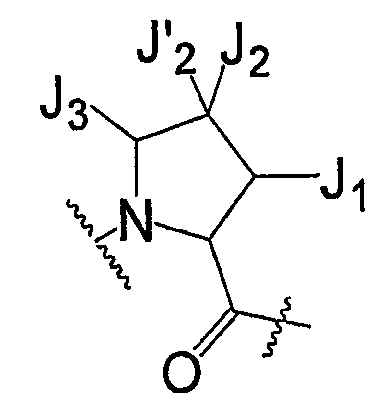
Каждый из J1, J2, J′2 и J3 независимо представляют собой галоген, -OR′, -ОС(O)N(R′)2, -NO2, -CN, -CF3, -OCF3, -R′, оксо, тиоксо, -N(R′)2, -SR′, -COR′, -SO2R′, -SO2N(R′)2, -SO3R′, -C(O)R′, -C(O)C(O)R', -C(O)CH2C(O)R', -C(S)R', -C(O)OR', -OC(O)R', -C(O)N(R')2, -OC(O)N(R')2, -C(S)N(R')2, -(CH2)0-2NHC(O)R', -N(R')N(R')COR', -N(R')N(R')C(O)OR', -N(R')N(R')CON(R')2, -N(R')SO2R', -N(R')SO2N(R')2, -N(R')C(O)OR', -N(R')C(O)R', -N(R')C(S)R', -N(R')C(O)N(R')2, -N(R')C(S)N(R')2, -N(COR')COR', -N(OR')R', -C(=NH)N(R')2, -C(O)N(OR')R', -C(=NOR')R', -OP(O)(OR')2, -P(O)(R')2, -P(O)(OR')2 или -P(O)(H)(OR'), или один из J2 и J'2 представляет собой H, где две группы R' вместе с атомами, к которым они присоединены, могут образовывать 3-10-членную ароматическую или неароматическую кольцевую систему, имеющую до 3 гетероатомов, независимо выбранных из N, O или S, где кольцо является необязательно конденсированным с C6-C10 арилом, C5-C10 гетероарилом, C3-C10 циклоалкилом или C3-C10 гетероциклоалифатическим остатком и где любое кольцо имеет до 3 заместителей, каждый из них является независимо выбранным из J2, или один из J2 или J'2 представляют собой водород.
Каждый R' независимо выбирается из H, C1-C12 алифатического остатка, C3-C10 циклоалкила или C3-C10 циклоалкенила, C3-C10 циклоалкил-C1-C12 алифатического остатка, C3-C10 циклоалкенил-C1-C12 алифатического остатка, C6-C10 арила, C6-C10 арил-C1-C12 алифатического остатка, 3-10-членного гетероциклоалифатического остатка, 6-10-членного гетероциклоалифатического остатка-C1-C12 алифатического остатка, 5-10-членного гетероарила или 5-10-членного гетероарил-C1-C12 алифатического остатка, где R' имеет до 3 заместителей, каждый из которых независимо выбран из J2.
В некоторых вариантах осуществления J1 и J2 вместе с атомами, к которым они присоединены, могут образовывать C8-C12 необязательно замещенное бициклическое кольцо.
В некоторых вариантах осуществления J1 и J3 вместе с атомами, к которым они присоединены, могут образовывать C8-C12 необязательно замещенное бициклическое кольцо.
В некоторых вариантах осуществления J2 и J'2 вместе с атомом углерода, к которому они присоединены, могут образовывать необязательно замещенное 5-10-членное циклоалифатическое или необязательно замещенное 5-10-членное гетероциклоалифатическое кольцо.
В некоторых вариантах осуществления J2 и J3 вместе с атомами, к которым они присоединены, могут образовывать C8-C12 необязательно замещенное бициклическое кольцо.
Соединения по настоящему изобретению могут содержать один или несколько асимметричных центров. Эти асимметричные центры могут независимо находиться либо в R-, либо в S-конфигурации. Определенные соединения по настоящему изобретению могут также демонстрировать геометрическую изомерию. Настоящее изобретение также включает индивидуальные геометрические изомеры и стереоизомеры и их смеси, включая рацемические смеси соединений в соответствии с настоящим изобретением.
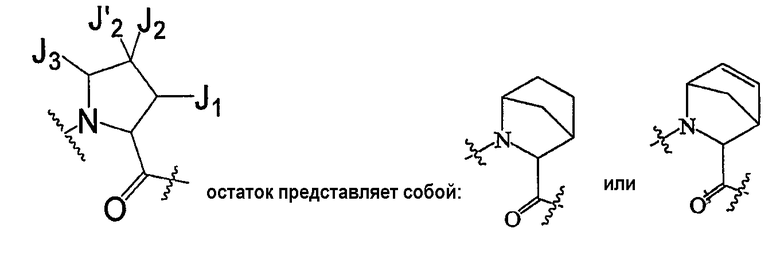
В некоторых вариантах осуществления соединение по настоящему изобретению включает остаток
который представляет собой остаток, выбранный из
где n равен 0 или 1 и каждый из Z и Z' независимо представляет собой -CR'R'-, -S- или -O-.
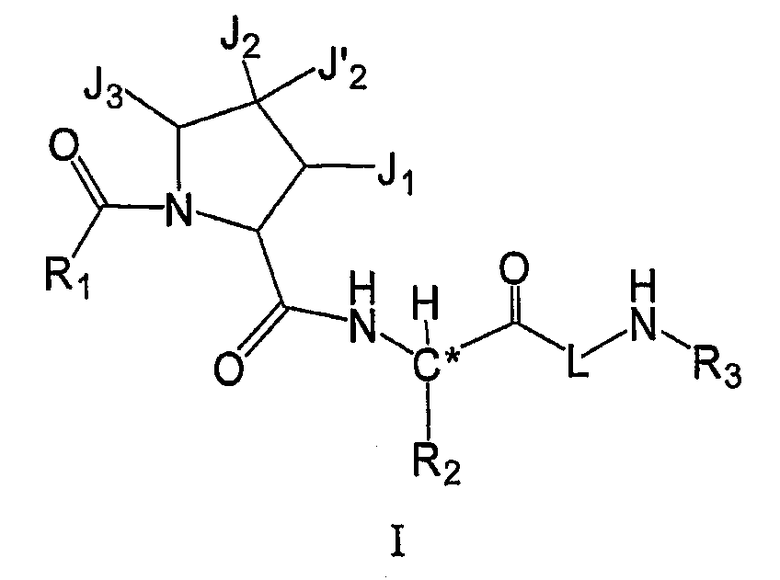
В некоторых вариантах осуществления соединение формулы I включает структуру, где J1 и J2 вместе с атомами, к которым они присоединены, образуют необязательно замещенное моно- или бициклическое кольцо, так что 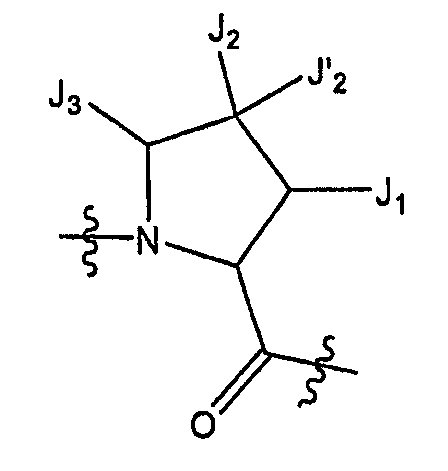 остаток представляет собой
остаток представляет собой
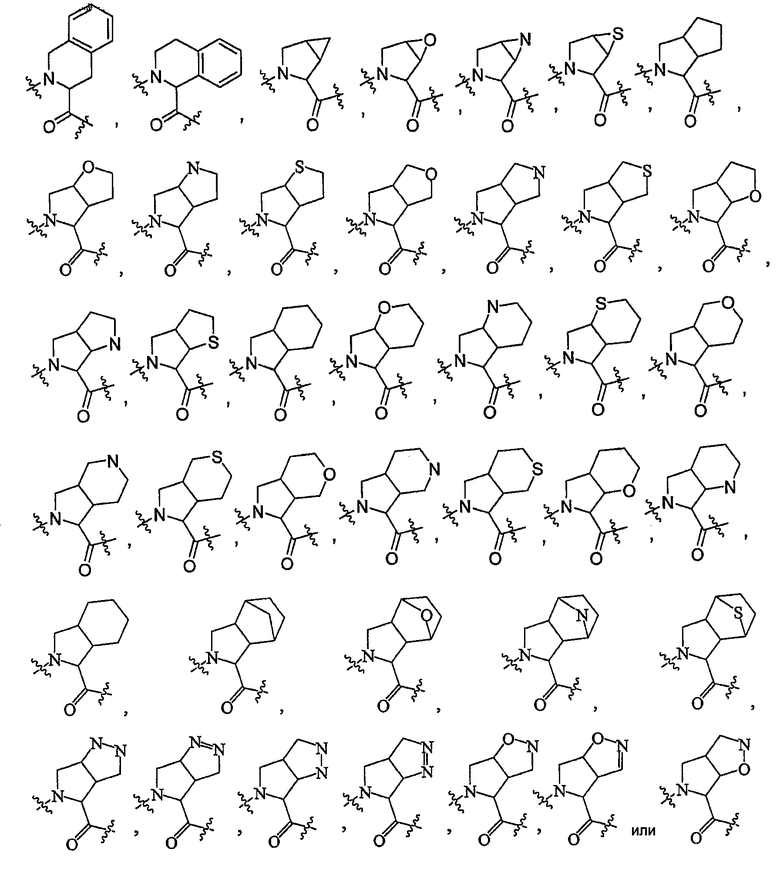
В некоторых вариантах осуществления соединение формулы I включает структуру, где J1 и J2 вместе с атомами, к которым они присоединены, образуют необязательно замещенное моно- или бициклическое кольцо, так что 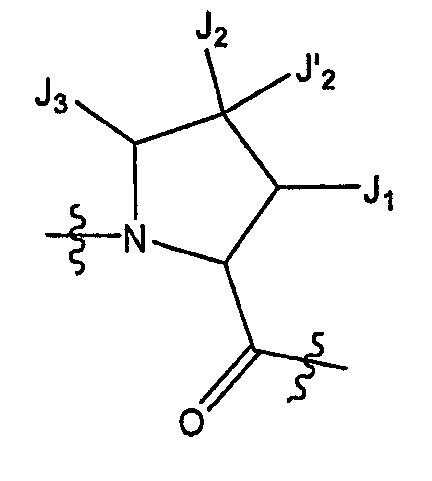 остаток представляет собой
остаток представляет собой
В некоторых вариантах осуществления J1 и J3 вместе с атомами, к которым они присоединены, образуют необязательно замещенное моноциклическое кольцо, так что
В некоторых вариантах осуществления соединение формулы I включает структуру, где J1 и J2 вместе с атомами, к которым они присоединены, образуют моноциклическое кольцо, так что 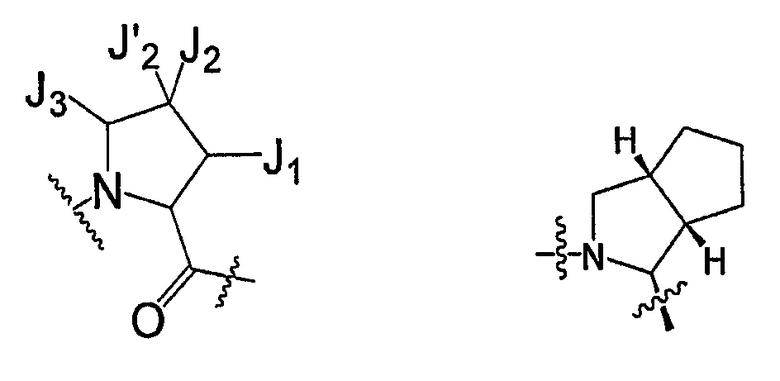 остаток представляет собой
остаток представляет собой 
В некоторых вариантах осуществления L представляет собой -C(O)-.
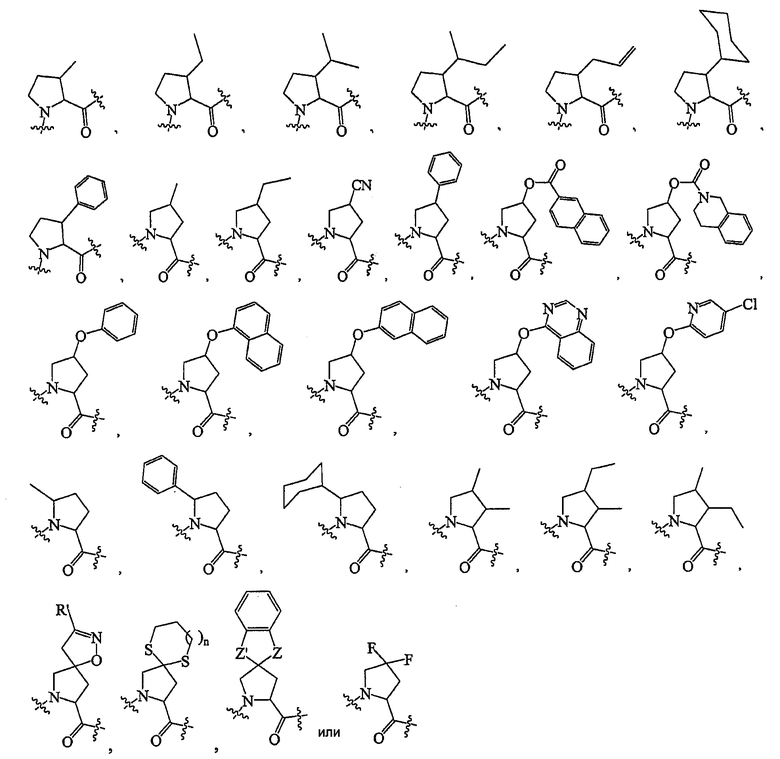
В некоторых вариантах осуществления R1 представляет собой RW-. Например, R1 представляет собой RW-, где R представляет собой необязательно замещенный арил или необязательно замещенный гетероарил и W представляет собой -O-. В других вариантах осуществления R представляет собой необязательно замещенный алифатический остаток или необязательно замещенный циклоалифатический остаток.
Например, R представляет собой необязательно замещенный аралкил или необязательно замещенный гетероаралкил.
В некоторых вариантах осуществления R1 представляет собой
В некоторых вариантах осуществления R1 представляет собой RW-.
В некоторых вариантах осуществления R представляет собой необязательно замещенный алифатический остаток, необязательно замещенный циклоалифатический остаток, необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный арил или необязательно замещенный гетероарил; и W представляет собой связь, -O-, -S- или -NR4-.
В некоторых вариантах осуществления R представляет собой необязательно замещенный алифатический остаток или необязательно замещенный циклоалифатический остаток.
В некоторых вариантах осуществления R представляет собой необязательно замещенный аралкил или необязательно замещенный гетероаралкил.
В некоторых вариантах осуществления R представляет собой
В других вариантах осуществления R представляет собой
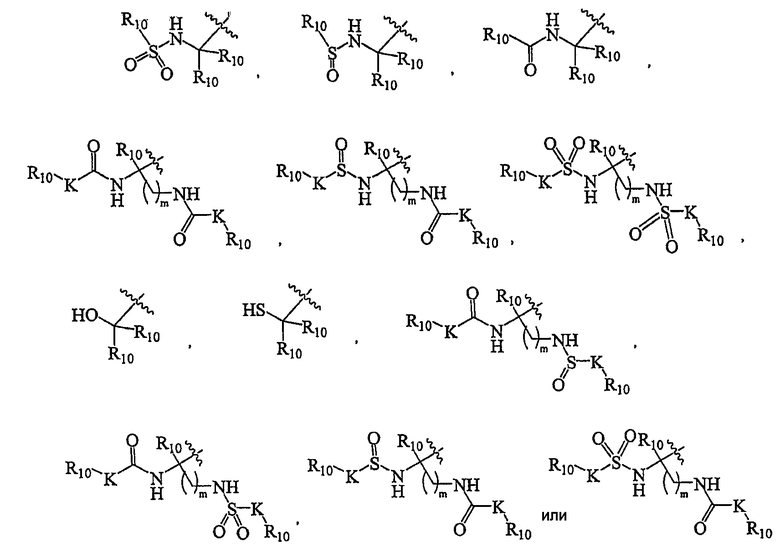
где R10 независимо представляет собой H, (C1-C12)алифатический остаток, (C6-C10)арил, (C6-C10)арил-(C1-C12)алифатический остаток, (C3-C10)циклоалкил или -циклоалкенил, [(C3-C10)циклоалкил или -циклоалкенил]-(C1-C12)алифатический остаток, (3-10-членный)гетероциклоалифатический остаток-, (6-10-членный)гетероциклоалифатический-(C1-C12)алифатический остаток-, (5-10-членный)гетероарил-, или (5-10-членный)гетероарил-(C1-C12-алифатический остаток-.
Каждый K представляет собой связь, (C1-C12)алифатический остаток, -O-, -S-, -NR9-, -C(O) или -C(O)NR9-, где R9 представляет собой водород или (C1-C12)алифатический остаток; и m равен 1-3.
В некоторых вариантах осуществления R представляет собой
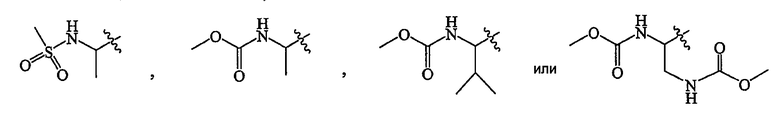
В дополнительных вариантах осуществления R представляет собой
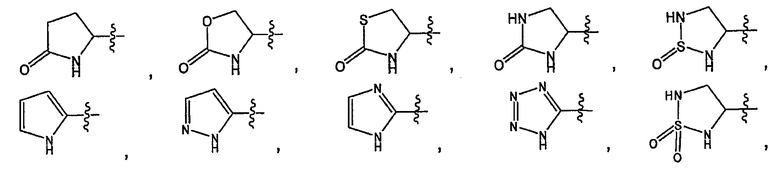
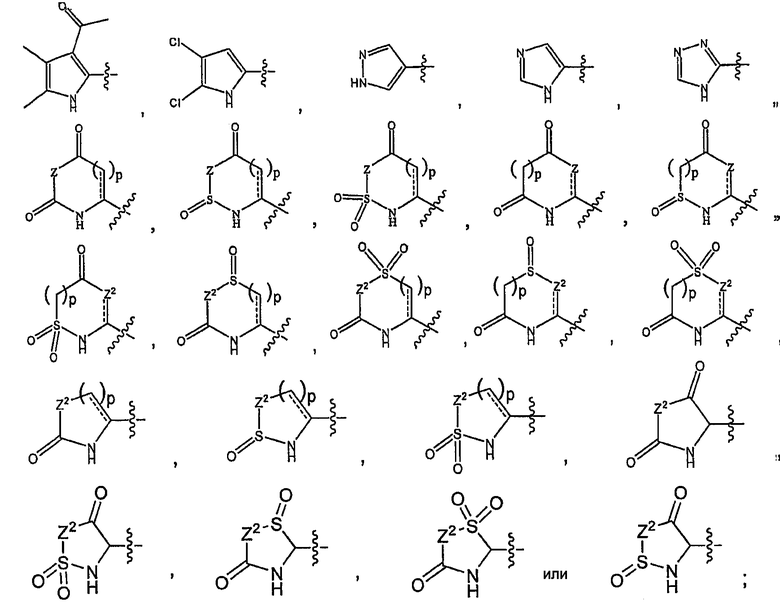
где каждый Z2 независимо представляет собой O, S, NR10 или C(R10)2.
Каждый R10 представляет собой водород, (C1-C12)-алифатический остаток, (C6-C10)арил, (C6-C10)арил-(C1-C12)алифатический остаток, (C3-10)-циклоалкил или -циклоалкенил, [(C3-10)циклоалкил или -циклоалкенил]-(C1-C12)алифатический остаток, (3-10-членный)гетероциклоалифатический остаток-, (6-10-членный)гетероциклоалифатический-(C1-C12)алифатический остаток-, (5-10-членный)гетероарил-, или (5-10-членный)гетероарил-(C1-C12)алифатический остаток-; p независимо равен 1 или 2; и  независимо представляет собой одинарную связь или двойную связь.
независимо представляет собой одинарную связь или двойную связь.
В некоторых вариантах осуществления RW- представляет собой
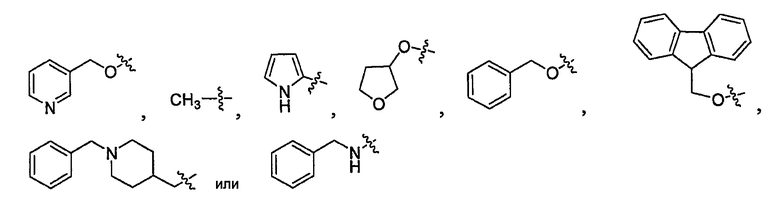
В некоторых вариантах осуществления R1 представляет собой P3, P3 представляет собой 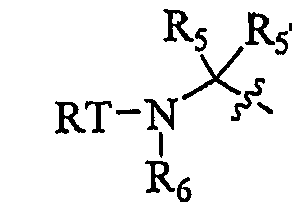 и каждый из R5 и R5' независимо представляет собой необязательно замещенный алифатический остаток, необязательно замещенный циклоалифатический остаток, необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный арил или необязательно замещенный гетероарил; R6 необязательно представляет собой замещенный алифатический остаток, необязательно замещенный гетероарил, необязательно замещенный фенил, или R5 и R6 вместе с атомами, к которым они присоединены, образуют 5-7-членный необязательно замещенный моноциклический гетероцикл, или 6-12-членный необязательно замещенный бициклический гетероцикл, в котором каждое кольцо гетероцикла необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR50-; и T представляет собой -C(O)-, -OC(O)-, -NHC(O)-, -C(O)C(O)- или -SO2-.
и каждый из R5 и R5' независимо представляет собой необязательно замещенный алифатический остаток, необязательно замещенный циклоалифатический остаток, необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный арил или необязательно замещенный гетероарил; R6 необязательно представляет собой замещенный алифатический остаток, необязательно замещенный гетероарил, необязательно замещенный фенил, или R5 и R6 вместе с атомами, к которым они присоединены, образуют 5-7-членный необязательно замещенный моноциклический гетероцикл, или 6-12-членный необязательно замещенный бициклический гетероцикл, в котором каждое кольцо гетероцикла необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR50-; и T представляет собой -C(O)-, -OC(O)-, -NHC(O)-, -C(O)C(O)- или -SO2-.
В некоторых вариантах осуществления T представляет собой -C(O)-.
В некоторых вариантах осуществления T представляет собой -OC(O)-.
В некоторых вариантах осуществления T представляет собой -NHC(O)-.
В некоторых вариантах осуществления T представляет собой -C(O)C(O)-.
В некоторых вариантах осуществления T представляет собой -S(O)2-.
Смесь диастереомерных соединений по п.6 формулы изобретения, где R1 представляет собой P4-L2-P3- и P4-L2-P3- представляет собой 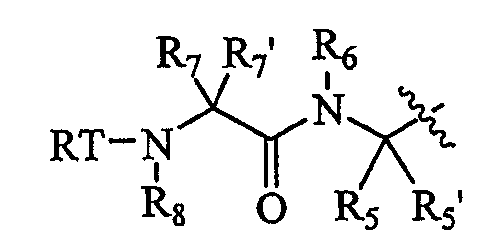 , где каждый из R7 и R7' независимо представляет собой H, необязательно замещенный алифатический остаток, необязательно замещенный гетероарил или необязательно замещенный фенил; или R7 и R7' вместе с атомом, к которому они присоединены, могут образовывать 3-7-членное циклоалифатическое или гетероциклоалифатическое кольцо; или R7 и R6 вместе с атомами, к которым они присоединены, могут образовывать 5-7-членный необязательно замещенный моноциклический гетероциклоалифатический остаток, 5-7-членный необязательно замещенный моноциклический гетероарил, 6-12-членный необязательно замещенный бициклический гетероциклоалифатический остаток или 6-12-членный необязательно замещенный бициклический гетероарил, в котором каждое гетероциклоалифатическое или гетероарильное кольцо необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR50-; или когда R5 и R6 вместе с атомами, к которым они присоединены, образуют кольцо, R7 и кольцевая система, образованная R5 и R6, может образовывать 8-4-членную необязательно замещенную бициклическую конденсированную кольцевую систему, где бициклическая конденсированная кольцевая система является необязательно дополнительно конденсированной с необязательно замещенным фенилом, с образованием необязательно замещенной 10-16-членной трициклической конденсированный кольцевой системы; R8 представляет собой H или защитную группу; R50 представляет собой H, необязательно замещенный алифатический остаток, необязательно замещенный гетероарил или необязательно замещенный фенил.
, где каждый из R7 и R7' независимо представляет собой H, необязательно замещенный алифатический остаток, необязательно замещенный гетероарил или необязательно замещенный фенил; или R7 и R7' вместе с атомом, к которому они присоединены, могут образовывать 3-7-членное циклоалифатическое или гетероциклоалифатическое кольцо; или R7 и R6 вместе с атомами, к которым они присоединены, могут образовывать 5-7-членный необязательно замещенный моноциклический гетероциклоалифатический остаток, 5-7-членный необязательно замещенный моноциклический гетероарил, 6-12-членный необязательно замещенный бициклический гетероциклоалифатический остаток или 6-12-членный необязательно замещенный бициклический гетероарил, в котором каждое гетероциклоалифатическое или гетероарильное кольцо необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR50-; или когда R5 и R6 вместе с атомами, к которым они присоединены, образуют кольцо, R7 и кольцевая система, образованная R5 и R6, может образовывать 8-4-членную необязательно замещенную бициклическую конденсированную кольцевую систему, где бициклическая конденсированная кольцевая система является необязательно дополнительно конденсированной с необязательно замещенным фенилом, с образованием необязательно замещенной 10-16-членной трициклической конденсированный кольцевой системы; R8 представляет собой H или защитную группу; R50 представляет собой H, необязательно замещенный алифатический остаток, необязательно замещенный гетероарил или необязательно замещенный фенил.
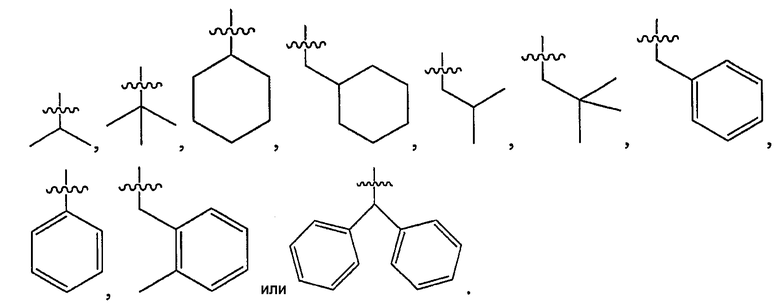
В некоторых вариантах осуществления R7' представляет собой H и R7 представляет собой C1-C6 алкил, C3-C10 циклоалкил, C3-C10 циклоалкил-C1-12 алкил, C6-C10 арил, C6-C10 арил-C1-C6 алкил, 3-10-членный гетероциклоалифатический остаток, 6-10-членный гетероциклоалифатический-C1-C12 алкил, 5-10-членный гетероарил, или 5-10-членный гетероарил-C1-C12 алкил.
Смесь диастереомерных соединений по п.22 формулы изобретения, где R7 представляет собой
В некоторых вариантах осуществления R7 и R7' вместе с атомом, к которому они присоединены, образуют 3-7-членное необязательно замещенное циклоалифатическое кольцо.
В некоторых вариантах осуществления R7 и R7' вместе с атомом, к которому они присоединены, образуют
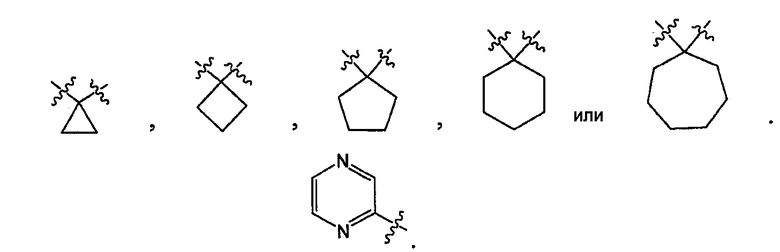
В некоторых вариантах осуществления R представляет собой 
В некоторых вариантах осуществления соединение формулы I включает структуру, где R3 представляет собой необязательно замещенный алифатический остаток (например, необязательно замещенный (C1-C6)алкил), необязательно замещенный циклоалифатический остаток (например, необязательно замещенный (C1-C6циклоалкил), необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный арил или необязательно замещенный гетероарил.
В некоторых вариантах осуществления R2 представляет собой необязательно замещенный алифатический остаток, необязательно замещенный фенил, необязательно замещенный циклоалифатический остаток или необязательно замещенный гетероциклоалифатический остаток.
В некоторых вариантах осуществления R2 представляет собой необязательно замещенный алифатический остаток или необязательно замещенный фенил.
В некоторых вариантах осуществления R2 представляет собой необязательно замещенный алифатический остаток, необязательно замещенный циклоалифатический остаток или необязательно замещенный гетероциклоалифатический остаток.
В некоторых вариантах осуществления R2 представляет собой
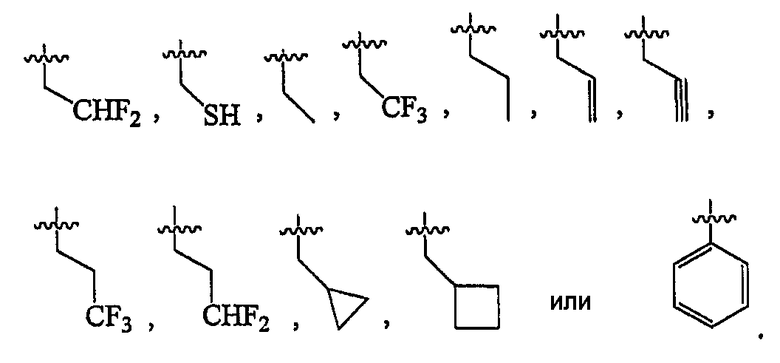
В некоторых вариантах осуществления R2 представляет собой н-пропил.
В некоторых вариантах осуществления R3 необязательно представляет собой замещенный (C1-C6)алкил или необязательно замещенный (C1-C6)циклоалкил.
В некоторых вариантах осуществления соединение формулы I включает структуру, где R2 необязательно представляет собой замещенный (C1-C6)алифатический остаток (например, необязательно замещенный (C1-C6)алкил), необязательно замещенный (C1-C6)циклоалифатический остаток (например, необязательно замещенный (C1-C6)циклоалкил), необязательно замещенный гетероциклоалифатический остаток, необязательно замещенный арил или необязательно замещенный гетероарил.
В некоторых вариантах осуществления R3 необязательно представляет собой замещенный (C1-C7)алифатический остаток, необязательно замещенный циклоалифатический остаток, необязательно замещенный арил или необязательно замещенный гетероарил.
В некоторых вариантах осуществления R3 представляет собой
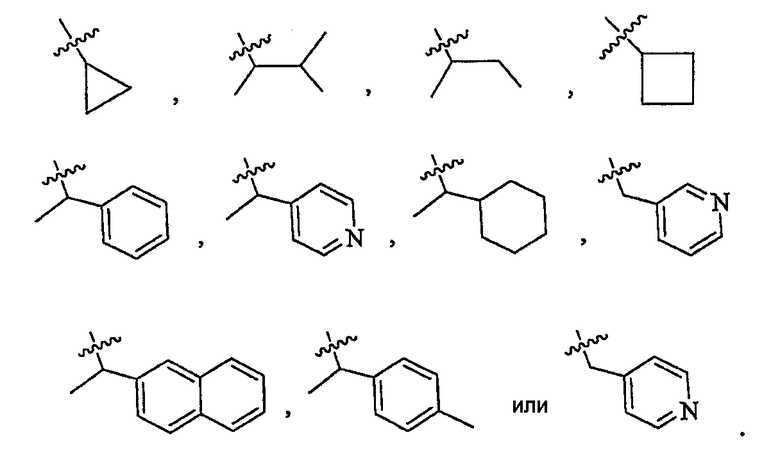
В некоторых вариантах осуществления R3 представляет собой циклопропил.
В некоторых вариантах осуществления T представляет собой связь и R представляет собой необязательно замещенный (гетероциклоалифатический)алифатический остаток. В других примерах T представляет собой связь и R представляет собой необязательно замещенный арил или необязательно замещенный гетероарил.
В некоторых вариантах осуществления T представляет собой -C(O)- и R представляет собой необязательно замещенный гетероарил, необязательно замещенный арил.
В некоторых вариантах осуществления соединение формулы I включает 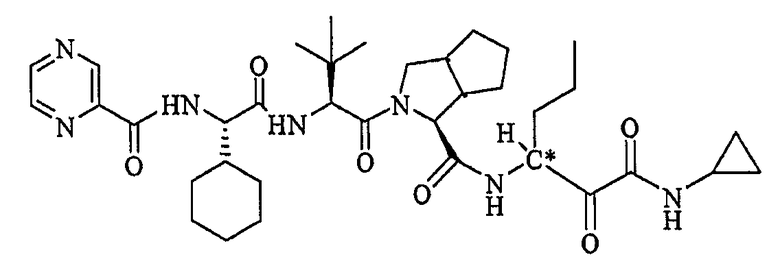
где C∗ представляет собой смесь R- и S-изомеров и где R-изомер составляет, по меньшей мере, 50% смеси.
В некоторых вариантах осуществления процент R-изомера в смеси составляет больше 60% (например, больше, чем 70%, больше, чем 80%, больше, чем 90%, больше, чем 95%, больше, чем 98%, или больше, чем 99%).
В некоторых вариантах осуществления отношение R- и S-изомеров на С∗ составляет больше 60/40.
В некоторых вариантах осуществления отношение R- и S-изомеров на С∗ составляет больше 70/30.
В некоторых вариантах осуществления отношение R- и S-изомеров на С∗ составляет больше 80/20.
В некоторых вариантах осуществления отношение R- и S-изомеров на С∗ составляет больше 90/10.
В некоторых вариантах осуществления отношение R- и S-изомеров на С∗ составляет больше 95/5.
В некоторых вариантах осуществления отношение R- и S-изомеров на С∗ составляет больше 98/2.
В некоторых вариантах осуществления отношение R- и S-изомеров на С∗ составляет больше 99/1.
Настоящее изобретение, как предполагается, включает соединения, где R1 и R2 содержат структурные элементы ингибитора серинпротеазы. Соединения, имеющие структурные элементы ингибитора серинпротеазы, включают, но не ограничиваясь этим, соединения следующих далее публикаций: WO 97/43310, US 20020016294, WO 01/81325, WO 02/08198, WO 01/77113, WO 02/08187, WO 02/08256, WO 02/08244, WO 03/006490, WO 01/74768, WO 99/50230, WO 98/17679, WO 02/48157, US 20020177725, WO 02/060926, US 20030008828, WO 02/48116, WO 01/64678, WO 01/07407, WO 98/46630, WO 00/59929, WO 99/07733, WO 00/09588, US 20020016442, WO 00/09543, WO 99/07734, US № 6018020, US № 6265380, US № 6608027, US № 20020032175, US 20050080017, WO 98/22496, US № 5866684, WO 02/079234, WO 00/31129, WO 99/38888, WO 99/64442, WO 2004072243 и WO 02/18369, которые включаются в настоящее описание в качестве ссылок.
Неограничивающие примеры соединений по настоящему изобретению включают (1S,3aR,6aS)-2-[(2S)-2-[[(2S)-2-циклогексил-1-оксо-2-[(пиразинилкарбонил)амино]этил]амино]-3,3-диметил-1-оксобутил]-N-[(1R)-1-[2-(циклопропиламино)-1,2-диоксоэтил]бутил]октагидроциклопента[c]пиррол-1-карбоксамид.
В некоторых вариантах осуществления по настоящему изобретению R-изомера в положении C∗ больше 50% смеси, и смесь имеет Ki(app) меньше, чем 1,5 мкМ, когда определяют с использованием двухдневного (48 часов) анализа инкубирования репликона HCV, как описано в настоящем описании.
В некоторых вариантах осуществления R-изомера в положении C* больше 50% смеси, и смесь имеет IC50 меньше, чем 1 мкМ, и CC50 больше, чем 90 мкМ, когда определяют с использованием двухдневного (48 часов) анализа инкубирования репликона HCV.
В некоторых вариантах осуществления R-изомера в положении C∗ больше 50% смеси, и смесь имеет Ki(app) примерно 1,190 мкМ, IC50 примерно 0,883 мкМ и CC50 больше, чем 100 мкМ, когда определяют с использованием двухдневного (48 часов) анализа инкубирования репликона HCV.
В некоторых вариантах осуществления смеси, содержащие более чем 50% R-изомера в положении C∗, имеют более высокую биологическую доступность, чем смеси с 50% или менее R-изомера в положении C∗.
В некоторых вариантах осуществления R-изомера в положении C∗ больше 50% смеси и смесь имеет биологическую доступность больше, чем 90%.
В некоторых вариантах осуществления R-изомер в положении C∗ примерно в 2 раза более доступен биологически, чем S-изомер в положении C∗.
В некоторых вариантах осуществления R-изомера в положении C∗ больше 50% смеси и смесь легче поглощается, чем смесь, содержащая 50% или меньше R-изомера в положении C∗.
В некоторых вариантах осуществления R-изомера в положении C∗ больше 50% смеси и смесь имеет более продолжительное время полужизни, чем смеси с 50% или менее R-изомера в положении C∗.
III. Схемы синтеза
Соединения по настоящему изобретению могут быть получены с помощью известных способов. Пример таких способов иллюстрируется на схеме 1.
Схема 1
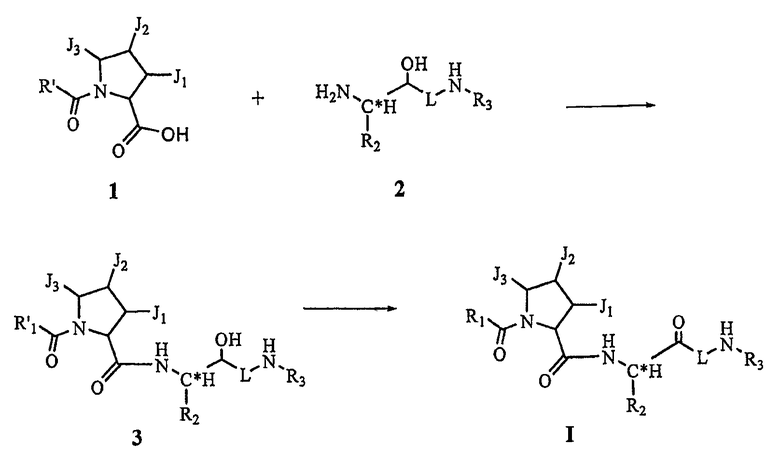
Обращаясь к схеме 1, пирролидиновая кислота формулы 1 взаимодействует с аминоспиртом формулы 2 в присутствии связывающего реагента, такого, например, как EDC и HOBt, с получением соответствующего амида формулы 3. Окисление амида 3 дает соединения формулы I. Соответствующие окисляющие агенты включают, например, периодан Десса-Мартина и гипохлорит натрия в присутствии TEMPO. Пирролидиновые кислоты формулы 1, используемые на схеме 1, могут быть получены посредством способов, описанных в WO 03/006490 и WO 02/18369. Аминоспирты формулы 2, где L представляет собой -C(O)-, могут быть получены посредством способов, описанных в WO 02/18369. В формуле I R'1 представляет собой N-защитную группу, которая может удаляться для дополнительной обработки R'1 в соответствии с известными способами. Альтернативно, R'1 представляет собой R1. Таким образом, присоединение аминоспирта формулы 2 может достигаться до или после обработки остатка R1.
Смеси R- и S-изомеров в положении C∗ по настоящему изобретению могут обрабатываться с помощью известных методик. Один из примеров таких методик включает разбавление чистого R- или S-изомера (в положении C∗) соответствующим количеством S- или R-изомера, соответственно. Другой пример таких методик включает разбавление смеси с известным отношением R к S (в положении C∗) соответствующим объемом чистого R-изомера на С∗, объемом чистого S-изомера на С∗ или объемом смеси с известным отношением R- и S-изомеров (в C∗). Другая методика включает осуществление пути синтеза, который обеспечивает желаемое отношение R-изомера на С∗ к S-изомеру на С∗.
Получение чистого R-изомера или S-изомера на С∗ описывается в WO 02/18369 и иллюстрируется на схеме 2.
Схема 2
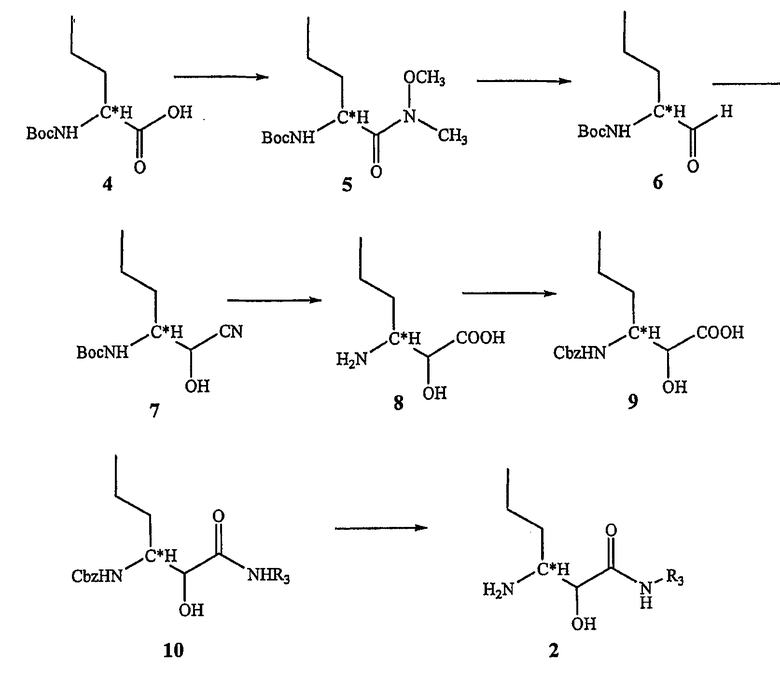
Обращаясь к схеме 2, оптический изомер Boc-норвалина формулы 4 сначала преобразуется в соответствующий N-метил(метокси)амид формулы 5 посредством взаимодействия с диметилгидроксиламином в присутствии CDI. Восстановление амида 5 с помощью литий алюминий гидрида дает норвалинал формулы 6. Цианогидрин формулы 7 получают посредством преобразования норвалинала 6 в комплекс добавления бисульфита (не показан), с последующей реакцией с цианидом калия. Реакция цианогидрина формулы 7 с концентрированной хлористоводородной кислотой приводит к гидролизу цианогруппы и снятию защиты с получением аминогидроксикислоты формулы 8. Реакция полученной аминогидроксикислоты 8 с N-(бензилоксикарбонилокси)сукцинимидом дает Cbz производное формулы 9, которое может в дальнейшем преобразовываться в амид формулы 10 посредством реакции с амином R3NH2 в присутствии связывающего реагента PyBOP и HOBT. Гидрирование амида 10 с помощью 10% Pd/C дает амин формулы 2.
Смеси соединений формулы I могут необязательно разделяться на составляющие их стереоизомеры, например, с помощью процедур хроматографического разделения. См. таблицы 1 и 2.
Пример разделения R- и S-изомеров на C∗ соединений формулы I
Диаметр: 4,6 мм
Размер частиц: 5 мкм
Конкретное разделение смеси, содержащей R- и S-изомеры соединений формулы 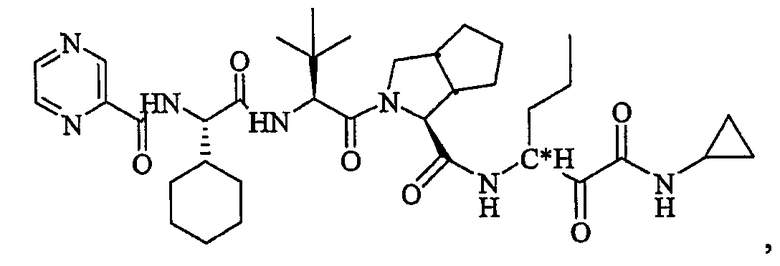 в которой C∗ представляет собой смесь R- и S-изомеров, осуществляют в соответствии с таблицей 1. Времена удерживания, согласно измерениям, равны 8 минут 27 секунд для R-изомера на С∗ и 6 минут 35 секунд для S-изомера на С∗, как иллюстрируется в таблице 2.
в которой C∗ представляет собой смесь R- и S-изомеров, осуществляют в соответствии с таблицей 1. Времена удерживания, согласно измерениям, равны 8 минут 27 секунд для R-изомера на С∗ и 6 минут 35 секунд для S-изомера на С∗, как иллюстрируется в таблице 2.
Разделение R и S-изомеров в положении C∗ соединений формулы I
с помощью ВЭЖХ
для автоматического отбора проб
для автоматического отбора проб
для автоматического отбора проб
для автоматического отбора проб
для автоматического отбора проб
PreClnSlvl 0
PreClnSlvl 5
PreClnSlvl 0
PreClnSlvl 5
PreClnSlvl 0
При использовании способов разделения, иллюстрируемых в таблице 2, измеряют время удерживания 3,6 минуты для R-изомера в положении C∗ и измеряют время удерживания 4,0 минуты для S-изомера в положении C∗.
IV. Препараты, применение и способы введения
Соединения по настоящему изобретению могут представлять собой желательные терапевтические средства, поскольку они, как наблюдается, имеют большую биологическую доступность, когда R-изомера в положении C∗ больше 50% смеси (например, примерно 60%, примерно 70%, примерно 80%, примерно 85%, примерно 90%, примерно 95% или примерно 99%). Смеси с более чем 50% R-изомера в положении C∗ являются примерно в 2 раза более доступными биологически, чем S-изомер в положении C∗. Конкретно, общая биологическая доступность равна примерно 98% для перорально дозируемого R-изомера на С∗ и 50% для перорального дозируемого S-изомера на С∗, когда они представлены посредством объединенного экспонирования 2 изомеров. Кроме того, после перорального дозирования преобразование R-изомера на C∗ в S-изомер на C∗ является более выраженным, чем преобразование S-изомера на C∗ в R-изомер на C∗. Взаимное преобразование осуществляется до большей степени после перорального дозирования, если сравнивать с ситуацией после внутривенного дозирования.
Соединения по настоящему изобретению могут быть полезны для терапевтического лечения инфекции HCV, поскольку эти соединения ингибируют активность серинпротеазы, в частности, активность протеазы вируса гепатита C NS3-NS4A. Некоторые варианты осуществления настоящего изобретения, где имеется более 50% R-изомера на C∗, имеют измеренную Ki(app) менее чем 3 мкМ (например, примерно 2 мкМ, примерно 1,5 мкМ или примерно 1,190 мкМ), IC50 менее, примерно, чем 0,9 мкМ (например, примерно 0,883 мкМ) и CC50 больше, чем 100 мкМ.
Настоящее изобретение включает способы введения смесей соединений формулы (I) для лечения HCV, в которых смесь содержит более 50% R-изомера в положении C∗.
Один из вариантов осуществления настоящего изобретения предусматривает фармацевтическую композицию, содержащую соединение формулы I, или ее фармацевтически приемлемые соли, или смеси солей. В соответствии с другим вариантом осуществления соединение формулы I присутствует в количестве, эффективном для уменьшения нагрузки вируса в образце или у пациента, где указанный вирус кодирует серинпротеазу, необходимую для жизненного цикла вируса, вместе с фармацевтически приемлемым носителем.
Если фармацевтически приемлемые соли соединений по настоящему изобретению используются в этих композициях, эти соли предпочтительно получают из неорганических или органических кислот и оснований. Рассматриваемыми среди таких солей кислот являются следующие: ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пиопионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Соли оснований включают соли аммония, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-D-глюкамина, и соли с аминокислотами, такие как аргинин, лизин и т.д.
Также группы, содержащие основной азот, могут кватернизироваться с помощью таких агентов, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлорид, -бромиды и -йодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты, длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -иодиды, аралкилгалогениды, такие как бензил- и фенетилбромиды, и другие. При этом получают растворимые или диспергируемые в воде или масле продукты.
Соединения, используемые в композициях и способах по настоящему изобретению, могут также модифицироваться посредством применения соответствующих функциональных групп для улучшения селективных биологических свойств. Такие модификации известны в данной области и включают такие, которые увеличивают биологическое проникновение в данную биологическую систему (например, кровь, лимфатическую систему, центральную нервную систему), увеличивают пероральную доступность, увеличивают растворимость, давая возможность для введения посредством инъекций, изменяют метаболизм и изменяют скорость экскреции.
Фармацевтически приемлемые носители, которые могут использоваться в этих композициях, включают, но не ограничиваясь этим, ионообменники, окись алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси парциальных глицеридов насыщенных растительных жирных кислот, вода, соли или электролиты, такие как протамин сульфат, динатрий гидрофосфат, калий гидрофосфат, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий-карбоксиметилцеллюлоза, полиакрилаты, воски, полиэтилен-полиоксипропиленовые блок-полимеры, полиэтиленгликоль и говяжий жир.
В соответствии с другим вариантом осуществления композиции по настоящему изобретению приготавливаются для фармацевтического введения млекопитающему. В одном из вариантов осуществления указанное млекопитающее представляет собой человека.
Такие фармацевтические композиции по настоящему изобретению могут вводиться перорально, парентерально, посредством вдыхания спрея, местным образом, ректально, назально, буккально, вагинально или посредством имплантируемого резервуара. Термин "парентеральный", как используется в настоящем описании, включает методики подкожной, внутривенной, внутримышечной, внутрисуставной, интрасиновиальной, интрастернальной, интратекальной, внутрипеченочной, внутрираневой и интракраниальной инъекции или вливания. Предпочтительно, композиции вводятся перорально или внутривенно.
Стерильные формы для инъекций композиций по настоящему изобретению могут представлять собой водную или масляную суспензию. Эти суспензии могут приготавливаться в соответствии с методиками, известными в данной области, с использованием соответствующих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекций может также представлять собой стерильный раствор или суспензию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут использоваться, находятся вода, раствор Рингера и изотонический раствор хлорида натрия. В дополнение к этому, стерильные, фиксированные масла обычно используются в качестве растворителя или суспендирующей среды. Для этой цели может использоваться любое легкое нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота, и их глицеридные производные, являются пригодными для приготовления препаратов для инъекций, поскольку представляют собой природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, в особенности в их полиоксиэтилированных версиях. Эти масляные растворы или суспензии могут также содержать разбавитель или дисперсант из длинноцепочечного спирта, такой как карбоксиметилцеллюлоза или сходные диспергирующие агенты, которые обычно используются при приготовлении фармацевтически приемлемых дозированных форм, включая эмульсии и суспензии. Другие обычно используемые поверхностно-активные вещества, такие как Tweens, Spans и другие эмульсифицирующие агенты или усилители биологической доступности, которые повсеместно используются при приготовлении фармацевтически приемлемых твердых, жидких или иных дозированных форм, также могут использоваться для целей приготовления.
В одном из вариантов осуществления уровни дозировки в пределах от примерно 0,01 до примерно 100 мг/кг массы тела в день соединений ингибиторов протеаз, описанных в настоящем описании, являются пригодными для использования при монотерапии для предотвращения и лечения вирусного, в частности, опосредуемого HCV заболевания. В другом варианте осуществления уровни дозировки в пределах от примерно 0,5 до примерно 75 мг/кг массы тела в день соединений ингибиторов протеаз, описанных в настоящем описании, являются пригодными для использования при монотерапии для предотвращения и лечения вирусного, в частности опосредуемого HCV, заболевания. Как правило, фармацевтические композиции по настоящему изобретению будут вводиться от примерно 1 до примерно 5 раз в день или, альтернативно, как непрерывное вливание. Такое введение может использоваться в качестве хронической или острой терапии. Количество активного ингредиента, который может объединяться с материалами-носителями, с получением стандартной дозированной формы, будет изменяться в зависимости от объекта лечения и конкретного способа введения. Типичный препарат будет содержать от примерно 5% до примерно 95% активного соединения (мас./мас.). В одном из вариантов осуществления такие препараты содержат от примерно 20% до примерно 80% активного соединения.
Когда композиции по настоящему изобретению содержат сочетание соединения формулы I и одного или нескольких дополнительных терапевтических или профилактических агентов, как соединение, так и дополнительный агент должны присутствовать при уровнях дозировки в пределах от примерно 10 до 100% от дозы, обычно вводимой в режиме монотерапии. В другом варианте осуществления дополнительный агент должен присутствовать при уровнях дозировки в пределах от примерно 10 до 80% от дозы, обычно вводимой в режиме монотерапии. Фармацевтические композиции по настоящему изобретению могут вводиться перорально, в любой перорально приемлемой дозированной форме, включая, но не ограничиваясь этим, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального использования, носители, которые обычно используются, включают лактозу и кукурузный крахмал. Также, как правило, добавляются смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсулы пригодные для использования разбавители включают лактозу и высушенный кукурузный крахмал. Когда водные суспензии требуются для перорального применения, активный ингредиент объединяется с эмульсифицирующими и суспендирующими агентами. Если это желательно, могут также добавляться определенные подслащивающие, ароматизирующие или окрашивающие агенты.
Альтернативно, фармацевтические композиции по настоящему изобретению могут вводиться в форме суппозиториев для ректального введения. Они могут быть получены посредством смешивания агента с соответствующим нераздражающим наполнителем, который является твердым при комнатной температуре, но жидким при ректальной температуре, и по этой причине будет расплавляться в заднем проходе с высвобождением лекарственного средства. Такие материалы включают масло какао, пчелиный воск и полиэтиленгликоли.
Фармацевтические композиции по настоящему изобретению могут также вводиться местно, в особенности, когда цель лечения включает области или органы, легко доступные для местного нанесения, включая заболевания глаз, кожи или нижнего отдела кишечного тракта. Соответствующие препараты для местного применения легко приготавливаются для каждой из этих областей или для каждого из этих органов.
Местное применение для нижнего отдела кишечного тракта может осуществляться в препарате ректального суппозитория (см. выше) или в соответствующем препарате для клизмы. Также могут использоваться местным образом трансдермальные пластыри.
Для местных применений фармацевтические композиции могут приготавливаться в виде соответствующей мази, содержащей активный компонент, суспендированный или растворенный в одном или нескольких носителях. Носители для местного введения соединений по настоящему изобретению включают, но не ограничиваясь этим, минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль, полиоксиэтилен, соединение полиоксипропилена, эмульсифицирующий воски и воду. Альтернативно, фармацевтические композиции могут приготавливаться в виде соответствующей примочки или крема, содержащих активные компоненты, суспендированные или растворенные в одном или нескольких фармацевтически приемлемых носителях. Соответствующие носители включают, но не ограничиваясь этим, минеральное масло, сорбитан моностеарат, полисорбат 60, воск сложных цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
Для офтальмологического использования фармацевтические композиции могут приготавливаться в виде микронизированных суспензий в изотоническом, стерильном солевом растворе с установленным pH или, предпочтительно, в виде растворов в изотоническом, стерильном солевом растворе с установленным pH, либо с консервантом, таким как хлорид бензилалкония, либо без него. Альтернативно, для офтальмологического использования фармацевтические композиции могут приготавливаться в виде мази, такой как вазелин.
Фармацевтические композиции по настоящему изобретению могут также вводиться посредством назального аэрозоля или ингаляции. Такие композиции приготавливают в соответствии с методиками, хорошо известными в области фармацевтических препаратов, и могут приготавливаться в виде растворов в солевом растворе, с использованием бензилового спирта или других пригодных для использования консервантов, усилителей поглощения для повышения биологической доступности, фторуглеродов и/или других обычных солюбилизирующих или диспергирующих агентов.
В одном из вариантов осуществления фармацевтические композиции приготавливаются для перорального введения.
В другом варианте осуществления композиции по настоящему изобретению дополнительно содержат другое антивирусное средство, предпочтительно анти-HCV средство. Такие антивирусные средства включают, но не ограничиваясь этим, иммуномодуляторные средства, такие как α-, β- и γ-интерфероны, пегилированные соединения дериватизированного интерферона α и тимозин; другие антивирусные средства, такие как рибавирин, амантадин и тельбивудин; другие ингибиторы протеаз гепатита C (ингибиторы NS2-NS3 и ингибиторы NS3-NS4A); ингибиторы других мишеней в жизненном цикле HCV, включая ингибиторы геликазы и полимеразы; ингибиторы внутреннего входа рибосомы; ингибиторы вирусов широкого спектра, такие как ингибиторы IMPDH (например, соединения патента Соединенных Штатов №№ 5807876, 6498178, 6344465, 6054472, WO 97/40028, WO 98/40381, WO 00/56331), и микофенольную кислоту, и ее производную, и включая, но не ограничиваясь этим, соединение XX; или любое сочетание любых соединений, указанных выше. См. также W. Markland et al., Antimicrobial & Antiviral Chemotherapy, 44, p.859 (2000) и патент США № 6541496.
Соединение XX
В настоящем описании используются следующие определения (с торговыми наименованиями, относящимися к продуктам, доступным на дату регистрации настоящей заявки).
"Peg-Intron" означает PEG-INTRON®, пегинтерферон альфа-2b, доступный от Schering Corporation, Kenilworth, NJ;
"Intron" означает INTRON-A®, интерферон альфа-2b, доступный от Schering Corporation, Kenilworth, NJ;
"Рибавирин" означает рибавирин (1-бета-D-рибофуранозил-1H-1,2,4-триазол-3-карбоксамид, доступный от ICN Pharmaceuticals, Inc., Costa Mesa, CA; описанный в Merck Index, entry 8365, Twelfth Edition; также доступный как REBETROL® от Schering Corporation, Kenilworth, NJ, или как COPEGASUS® от Hoffmann-La Roche, Nutley, NJ;
"Pagasys" означает PEGASYS®, пегинтерферон альфа-2a, доступный от Hoffmann-La Roche, Nutley, NJ;
"Roferon" означает ROFERON®, рекомбинантный интерферон альфа-2a, доступный от Hoffmann-La Roche, Nutley, NJ;
"Berefor" означает BEREFOR®, интерферон альфа-2, доступный от Boehringer Ingelheim Pharmaceutical, Inc., Ridgefield, CT;
SUMIFERON®, очищенная смесь природных альфа-интерферонов, также как Sumiferon, доступный от Sumitomo, Japan;
WELLFERON®, интерферон альфа-n1, доступный от Glaxo Wellcome Ltd., Great Britain;
ALFERON®, смесь природных альфа-интерферонов, изготавливаемая Interferon Sciences и доступная от Purdue Frederick Co., CT.
Термин "интерферон", как используется в настоящем описании, означает член семейства высокогомологичных вид-специфичных белков, которые ингибируют репликацию вирусов и пролиферацию клеток и модулируют иммунную реакцию, такой как интерферон альфа, интерферон бета или интерферон гамма. The Merck Index, entry 5015, Twelfth Edition.
В соответствии с одним из вариантов осуществления по настоящему изобретению интерферон представляет собой α-интерферон. В соответствии с другим вариантом осуществления терапевтическое сочетание по настоящему изобретению использует природный альфа-интерферон 2a. Или терапевтическое сочетание по настоящему изобретению использует природный альфа-интерферон 2b. В другом варианте осуществления терапевтическое сочетание по настоящему изобретению использует рекомбинантный альфа-интерферон 2a или 2b. Еще в одном варианте осуществления интерферон представляет собой пегилированный альфа-интерферон 2a или 2b. Интерфероны, пригодные для настоящего изобретения, включают:
(a) INTRON-A® (интерферон-альфа 2B, Schering Plough),
(b) PEG-INTRON®,
(c) PEGASYS®,
(d) ROFERON®,
(e) BEREFOR®,
(f) SUMIFERON®,
(g) WELLFERON®,
(h) консенсусный альфа интерферон, доступный от Amgen, Inc., Newbury Park, CA,
(i) ALFERON®;
(j) VIRAFERON®;
(k) INFERGEN®; и
(l) ALBUFERONTM
Как видно специалистам в данной области, ингибитор протеазы предпочтительно должен вводиться перорально. Интерферон, как правило, не вводится перорально. Тем не менее, ничто здесь не ограничивает способы или сочетания по настоящему изобретению конкретными формами или режимом дозирования. Таким образом, каждый компонент сочетания в соответствии с настоящим изобретением может вводиться отдельно, вместе с другими или в любом их сочетании.
В одном из вариантов осуществления ингибитор протеазы и интерферон вводятся в раздельных дозированных формах. В одном из вариантов осуществления любое дополнительное средство вводится как часть стандартной дозированной формы с ингибитором протеазы или как отдельная дозированная форма. Поскольку настоящее изобретение включает сочетание соединений, конкретные количества каждого соединения могут зависеть от конкретных количеств каждого другого соединения в сочетании. Как видно специалистам в данной области, дозировки интерферона, как правило, измеряются в М.Е. (например, от примерно 4 млн М.Е. до примерно 12 млн М.Е.).
Соответственно, средства (либо действующие в качестве иммуномодуляторного агента, либо другим образом), которые могут использоваться в сочетании с соединением по настоящему изобретению, включают, но не ограничиваясь этим, Albuferon™ (альбумин-интерферон альфа), доступный от Human Genome Sciences; интерферон-альфа 2B (INTRON-A®, Schering Plough); REBETRON® (Schering Plough, интерферон-альфа 2B + рибавирин); пегилированный интерферон альфа (Reddy, K.R. et al. "Efficacy and Safety of Pegylated (40-kd) interferon alpha-2a compared with interferon alpha-2a in noncirrhotic patients with chronic hepatitis C (Hepatology, 33, pp.433-438 (2001); консенсусный интерферон (Kao, J.H., et al., "Efficacy of Consensus interferon in the Treatment of Chronic Hepatitis" J. Gastroenterol. Hepatol. 15, pp.1418-1423 (2000), интерферон-альфа 2A (Roferon A; Roche), лимфобластоидный или "природный" интерферон; интерферон тау (Clayette, P. et al., "IFN-tau, A New interferon Type I with Antiretroviral activity" Pathol. Biol. (Paris) 47, pp.553-559 (1999); интерлейкин 2 (Davis, G.L. et al., "Future Options for the Management of Hepatitis C". Seminars in Liver Disease, 19, pp. 103-112 (1999); интерлейкин 6 (Davis et al. "Future Options for the Management of Hepatitis C". Seminars in Liver Disease 19, pp.103-112 (1999); интерлейкин 12 (Davis, G.L. et al., "Future Options for the Management of Hepatitis C". Seminars in Liver Disease, 19, pp.103-112 (1999); рибавирин; и соединения, которые усиливают развитие реакции хелперных T-лимфоцитов типа 1 (Davis et al., "Future Options for the Management of Hepatitis C". Seminars in Liver Disease, 19, pp.103-112 (1999). Интерфероны могут ослаблять вирусные инфекции посредством оказания непосредственных противовирусных воздействий и/или посредством модифицирования иммунной реакции на инфекцию. Противовирусные воздействия интерферонов часто опосредуются через ингибирование проникновения вируса или устранение его белковой оболочки, синтеза вирусной РНК, трансляции вирусных белков и/или сборки и высвобождения вируса.
Соединения, которые стимулируют синтез интерферона в клетках (Tazulakhova, E.B. et al., "Russian Experience in Screening, analysis, and Clinical Application of Novel Interferon Inducers" J. Interferon Cytokine Res., 21 pp.65-73), включают, но не ограничиваясь этим, двухцепочечную РНК, отдельно или в сочетании с тобрамицином и имиквимодом (3M Pharmaceuticals; Sauder, D.N. "Immunomodulatory and Pharmacologic Properties of Imiquimod" J. Am. Acad. Dermatol., 43, pp.S6-11 (2000).
Другие неиммуномодуляторные или иммуномодуляторные соединения могут использоваться в сочетании с соединением по настоящему изобретению, включая, но не ограничиваясь этим, те, которые описаны в WO 02/18369, который включается сюда в качестве в описании (см., например, стр.273, строки 9-22 и от стр.274, строка 4 до стр.276, строка 11).
Настоящее изобретение может также включать введение ингибитора монооксигеназы цитохрома P450. Ингибиторы CYP могут быть пригодными при повышении концентраций в печени и/или повышении уровней в крови соединений, которые ингибируются CYP.
Если один из вариантов осуществления по настоящему изобретению включает ингибитор CYP, и любой ингибитор CYP, который улучшает фармакокинетику релевантной протеазы NS3/4A, может использоваться в способе по настоящему изобретению. Эти ингибиторы CYP включают, но не ограничиваясь этим, ритонавир (WO 94/14436), кетоконазол, тролеандомицин, 4-метилпиразол, циклоспорин, клометиазол, циметидин, итраконазол, флуконазол, миконазол, флувоксамин, флуоксетин, нефазодон, сертралин, индинавир, нелфинавир, ампренавир, фозампренавир, саквинавир, лопинавир, делавирдин, эритромицин, VX-944 и соединение XX. Предпочтительные ингибиторы CYP включают ритонавир, кетоконазол, тролеандомицин, 4-метилпиразол, циклоспорин и клометиазол. Относительно предпочтительных дозированных форм ритонавира, см. патент Соединенных Штатов № 6037157 и документы, цитируемые в нем: патент Соединенных Штатов № 5484801, заявка на патент Соединенных Штатов 08/402690 и заявки на международный патент WO 95/07696 и WO 95/09614).
Способы измерения способности соединения к ингибированию активности монооксигеназы цитохрома P450 известны (см. US № 6037157 и Yun, et al. Drug Metabolism & Disposition, vol.21, pp.403-407 (1993).
При улучшении состояния пациента может вводиться поддерживающая доза соединения, композиции или сочетания по настоящему изобретению, если это необходимо. Впоследствии дозировка или частота введения, или обе они, могут уменьшаться, в зависимости от симптомов, до такого уровня, при котором сохраняется улучшение состояния, когда симптомы облегчаются до желаемого уровня, лечение должно прекратиться. Пациенты могут, однако, потребовать периодического лечения на долговременной основе при любом возобновлении симптомов заболевания.
Необходимо также понять, что конкретная дозировка и режим лечения для любого конкретного пациента будет зависеть от множества факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, диету, время введения, скорость экскреции, сочетание лекарственных средств и суждение лечащего врача, и тяжесть конкретного заболевания, которое должно лечиться. Количество активных ингредиентов будет также зависеть от конкретного описываемого соединения и присутствия или отсутствия и природы дополнительного антивирусного агента в композиции.
В соответствии с другим вариантом осуществления настоящее изобретение предусматривает способ лечения пациента, инфицированного вирусом, отличающимся кодируемой вирусом серинпротеазой, которая является необходимой для жизненного цикла вируса, посредством введения указанному пациенту фармацевтически приемлемой композиции по настоящему изобретению. В одном из вариантов осуществления способы по настоящему изобретению используются для лечения пациента, страдающего от инфекции HCV. Такое лечение может полностью устранить вирусную инфекцию или уменьшить ее тяжесть. В другом варианте осуществления пациент представляет собой человека.
В альтернативном варианте осуществления способы по настоящему изобретению дополнительно включают стадию введения указанному пациенту антивирусного вещества, предпочтительно, вещества анти-HCV. Такие антивирусные вещества включают, но не ограничиваясь этим, иммуномодуляторные вещества, такие как α-, β- или γ-интерфероны, пегилированные соединения дериватизированного интерферона-α и тимозин; другие антивирусные вещества, такие как рибавирин, амантадин и телбивудин; другие ингибиторы протеаз гепатита C (NS2-NS3 ингибиторы и NS3-NS4A ингибиторы); ингибиторы других мишеней в жизненном цикле HCV, включая, но не ограничиваясь этим, ингибиторы геликазы и полимеразы; ингибиторы внутреннего входа в рибосому, ингибиторы вирусов широкого спектра, такие как ингибиторы IMPDH (например, соединение XX и другие ингибиторы IMPDH, описанные в патентах Соединенных Штатов № 5807876 и 6498178, микофенольную кислоту и ее производные); ингибиторы цитохрома P-450, такие как ритонавир, или сочетания любых соединений из указанных выше.
Дополнительные средства могут вводиться пациенту как часть стандартной дозированной формы, содержащей как соединение по настоящему изобретению, так и дополнительный антивирусный агент. Альтернативно, дополнительный агент может вводиться отдельно от соединения по настоящему изобретению как часть множественной дозированной формы, где указанный дополнительный агент вводится до композиции, содержащей соединение по настоящему изобретению, одновременно с ней или после нее.
Еще в одном варианте осуществления настоящего изобретения предусматривается способ предварительного приготовления биологического вещества, предназначенного для введения пациенту, включающий стадию приведения в контакт указанного биологического вещества с фармацевтически приемлемой композицией, содержащей соединение по настоящему изобретению. Такие биологические вещества включают, но не ограничиваясь этим, кровь и ее компоненты, такие как плазма, тромбоциты, субпопуляции клеток крови, и тому подобное; органы, такие как почки, печень, сердце, легкие, и тому подобное; сперму и яйцеклетки; костный мозг и его компоненты и другие текучие среды, которые должны вливаться пациенту, такие как солевой раствор, декстроза, и тому подобное.
В соответствии с другим вариантом осуществления настоящее изобретение предусматривает способы обработки материалов, которые могут потенциально вступать в контакт с вирусом, отличающимся кодируемой вирусом серинпротеазой, необходимой для его жизненного цикла. Этот способ включает стадию приведения в контакт указанного материала с соединением в соответствии с настоящим изобретением. Такие материалы включают, но не ограничиваясь этим, хирургические инструменты и одежду (например, одежду, перчатки, фартуки, халаты, маски, очки, обувь и тому подобное); лабораторные инструменты и одежду (например, одежду, перчатки, фартуки, халаты, маски, очки, обувь и тому подобное); устройства и материалы для сбора крови; и инвазивные устройства, такие, например, как шунты и стенты.
В другом варианте осуществления соединения по настоящему изобретению могут использоваться в качестве лабораторных инструментов, чтобы помочь в выделении кодируемой вирусом серинпротеазы. Это способ включает стадии создания соединения по настоящему изобретению, присоединенного к твердой подложке; приведения в контакт указанной твердой подложки с образцом, содержащим серинпротеазу вируса, при условиях, которые заставляют указанную протеазу связываться с указанной твердой подложкой; и элюирование указанной серинпротеазы с указанной твердой подложки. В одном из вариантов осуществления серинпротеаза вируса, выделяемая с помощью этого способа, представляет собой протеазу HCV NS3-NS4A.
V. Анализ
Пример 1
Биологическая доступность R- и S-изомеров в положении C∗ соединения формулы I
Трем группам самцов крыс Sprague Dawley (n=6-7/группа) перорально вводят соединение формулы I, где смесь содержит примерно 92% R-изомера в положении C∗ и примерно 8% S-изомера в положении C∗; смесь, которая содержит примерно 7% R-изомера в положении C∗ и примерно 93% S-изомера в положении C∗; или соединение формулы I, где смесь содержит примерно 54% R-изомера в положении C∗ и примерно 46% S-изомера в положении C∗; при номинальной дозе 30 мг/кг. Последовательные образцы крови собирают вплоть до 24 часов (час) после дозирования. Полученные образцы плазмы (100 мкл) подкисляют посредством добавления 5 мкл муравьиной кислоты для предотвращения внутреннего преобразования in vitro.
Определение концентраций как R-изомера, так и S-изомера, в положении C∗, в плазме и в растворах для дозирования осуществляют с использованием метода хиральной жидкостной хроматографии/масс-спектрометрии (ЖХ/МС/МС, например, ЖХ/тандемной масс-спектрометрии). Соединения для перорального введения крысам включают те, которые перечислены в таблице 3.
Соединения для перорального введения крысам
на C* (%)
Препараты твердых дисперсий, содержащих либо 10% смесь R:S, либо R-изомер, либо S-изомер, получают в соответствии с таблицей 4.
Композиции препаратов твердых дисперсий
на С∗
на С∗
на C∗
Для каждого препарата активный ингредиент растворяют в общем объеме абсолютного этанола в круглодонной испарительной колбе, затем нагревают при 40°C и озвучивают в течение приблизительно 5-6 минут (мин) до растворения. Лаурилсульфат натрия и PVP добавляют в колбу, содержащую раствор лекарственного средства, а затем перемешивают до растворения. Смеси сушат на роторном испарителе в течение примерно 15 мин.
После получения сухого порошка твердый продукт затем соскребают с колбы и переносят в стеклянный контейнер. Твердый продукт сушат в течение 24 часов при 55°C в вакуумной печи с пропусканием азота. Затем сухой твердый продукт измельчают с помощью ступки и пестика и хранят в плотно закрытом флаконе. Перед дозированием крысам 30 миллилитров (мл) воды добавляют к сухому твердому продукту с получением 3 мг/мл R-изомера на C∗, S-изомера на C∗ или смеси R:S на C∗.
Самцы крыс Sprague Dawley (Charles River Laboratories, Kingston, RI; n=6-7/группа) используются в исследованиях. В день перед дозированием крысам вставляют канюлю в каротидную артерию для сбора образцов крови. Каждой крысе вводят перорально номинальную дозу 30 мг/мл либо R-изомера на C∗, либо S-изомера на C∗, либо смеси R:S на C∗. Эксперименты осуществляют в системе параллельных исследований, как 6 отдельных исследований с одной дозой, как описано в таблице 5.
Система эксперимента
(мл/кг)
на C∗
После внутривенной инъекции и перорального введения собирают последовательно образцы крови до дозирования и через 0,25, 0,5, 1, 1,5, 2, 3, 4, 6, 8 и 24 часа после перорального введения. Образцы крови собирают в пробирки, содержащие EDTA калия, и центрифугируют до получения плазмы в пределах 15 мин после сбора. Разбавленный раствор муравьиной кислоты приготавливают посредством разбавления 1 мл муравьиной кислоты в 9 мл воды. В целом 5 микролитров (мкл) этой разбавленной муравьиной кислоты помещают в каждую пробирку с плазмой. Аликвоту плазмы (100 мкл на пробирку) помещают в соответствующим образом меченные пробирки, содержащие муравьиную кислоту, и подкисленную плазму хранят при замораживании при -70°C до осуществления анализа. Стадия подкисления осуществляется для предотвращения внутреннего преобразования in vitro.
Обращаясь к таблице 6, несколько параметров биологической доступности для соединений, подвергающихся обратимому метаболизму, могут оцениваться с помощью следующих далее описаний. Все символы содержат верхний индекс, представляющий измеренную величину, и верхний индекс, представляющий дозируемую величину:
FRR представляет собой биологическую доступность R-изомера на C∗ после дозирования R-изомера на C∗;
FSS представляет собой биологическую доступность S-изомера на C∗ после дозирования S-изомера;
FR+SR представляет собой оцененную общую биологическую доступность на основе сочетанного экспонирования для R- и S-изомеров (в положении C∗) после дозирования R-изомера;
FS+RS представляет собой оцененную общую биологическую доступность на основе сочетанного экспонирования для R- и S-изомеров (в положении C∗) после дозирования S-изомера;
FSR представляет собой биологическую доступность S-изомера на C∗ после дозирования R-изомера на C∗, которая представляет собой относительное отношение нормированного на дозу AUCS (площадь под кривой зависимости концентрации от времени для S-изомера) после перорального дозирования R-изомера, по сравнению с этой же величиной после внутривенного дозирования R-изомера; и
FRS представляет собой биологическую доступность R-изомера на C∗ после дозирования S-изомера на C∗, которая представляет собой относительное отношение нормированного на дозу AUCR (площадь под кривой зависимости концентрации от времени для R-изомера) после перорального дозирования S-изомера по сравнению с этой же величиной после внутривенного дозирования S-изомера.
Сводка всех параметров биологической доступности
Обращаясь также к фиг.1A-B, 2A-B, и 3A-B, R-изомер на C∗ легче поглощается, чем S-изомер на С∗, поскольку значение FRR больше, чем значение FSS, и значение FR+SR больше, чем значение FR+SS (приблизительно в 2 раза). Фиг.1A, 2A и 3A представляют собой графики в прямоугольных координатах для зависимости концентраций в плазме соединения формулы (I) с более 50% R-изомера в положении C∗ и соединения с 50% или менее R-изомера в положении C∗ в зависимости от времени после перорального введения соединения. Фиг.1B, 2B и 3B представляют собой полулогарифмические графики концентраций в плазме соединения формулы (I) с более 50% R-изомера в положении C∗ и соединения с 50% или менее R-изомера в положении C∗ в зависимости от времени после перорального введения соединения. Концентрации в плазме на фиг.1A и 1B измеряют на крысах после перорального введения при номинальной дозе 30 мг/кг (R-изомер на С∗). Концентрации в плазме на фиг.2A и 2B измеряют на крысах после введения при номинальной дозе 30 мг/кг (S-изомер на С∗). Концентрации в плазме на фиг.3A и 3B измеряют на крысах после перорального введения при номинальной дозе 30 мг/кг (смесь R:S в положении C∗).
Преобразование R в S в положении C∗ наблюдают после перорального дозирования R-изомера на С∗, а преобразование S в R в положении C∗ наблюдают после перорального дозирования S-изомера на С∗. Вклад S-изомера в общую биологическую доступность после дозирования R-изомера оценивают по разнице между FR+SR и FRR, которая равна 15,76%. Подобным же образом, вклад R-изомера на С∗ в общую биологическую доступность после дозирования S-изомера на С∗ оценивают по разнице между FR+SS и FRS, которая равна 6,35%.
Степень преобразования R в S в положении C∗ больше для перорально введенной дозы R-изомера на С∗, по сравнению с внутривенным введением дозы R-изомера на С∗. Значение FSR равно 139,99%, что означает, что AUCINF (площадь под кривой от времени дозирования до бесконечности) для S-изомера, наблюдаемого после перорального дозирования, в 1,39 раза больше, чем наблюдается после таких же доз, вводимых внутривенно. Подобным же образом, значение FRS равно 157,88%, показывая, что преобразование S в R в положении C∗ больше (приблизительно в 1,57 раза) для перорально вводимого S-изомера, чем для внутривенно вводимого S-изомера.
Преобразование R в S в положении C∗ является более выраженным, чем преобразование S в R в положении C∗. DN_AUCINF (нормированная на дозу AUCINF) S-изомера на С∗ от дозирования R-изомера на С∗ выше, чем от дозирования S-изомера на С∗ (примерно в 10 раз). Хотя подобный тренд наблюдается для экспонирования R-изомера на С∗, DN_AUCINF R-изомера от дозирования S-изомера на С∗ выше, чем от дозирования R-изомера на С∗ (в 2 раза), как показано в таблице 6.
Сводка нормированной на дозу AUCINF R-изомера и S-изомера
Среднее (± SD)
C∗
Обращаясь к таблице 8, сходное экспонирование S-изомера в положении C∗ может быть достигнуто посредством введения либо дозы R-изомера на С∗, либо дозы S-изомера на С∗. Значения DN_AUCINF S-изомера на С∗ являются сходными (0,13 час·мкг/мл по сравнению с 0,14 час·мкг/мл), основываясь на предположении, что присутствие S-изомера на С∗ (8% от общего количества) в дозе R-изомера на С∗ дает незначительный вклад в общее экспонирование S-изомера на С∗. Доза S-изомера на С∗ достигает гораздо меньшего экспонирования R-изомера на С∗ (приблизительно одна седьмая), чем доза R-изомера на С∗.
Сводка DN_AUCIMF R-изомера на С∗ и S-изомера на С∗ при нормировании
на дозу главного изомера
Среднее (± SD)
bn=2; у оставшихся крыс AUCINF оцениваться не может.
Примечание: Вклад меньшего диастереоизомера в AUCINF. предполагается пренебрежимо малым.
После введения смеси R:S на С∗, имеется большее преобразование R в S на С∗, чем преобразование S в R. Значение DN_AUCINF S-изомера (0,30 час·мкг/мл) выше, чем ожидается для отдельной пероральной дозы S-изомера (0,14 час·мкг/мл). Кроме того, значение DN_AUCINF 0,30 час·мкг/мл приблизительно соответствует сумме значений DN_AUCINF от дозы S-изомера и значения DN_AUCINF от дозы R-изомера.
Значение DN_AUCINF для R-изомера от пероральной дозы смеси R:S не проявляет различий по сравнению с тем, которое наблюдают после перорального дозирования R-изомера.
Имеется высокий разброс наблюдаемых времен достижения максимальных концентраций R-изомера и S-изомера. Средние (±SD) значения Tmax равны 2,11 (±1,24) час, 3,39 (±2,38) час и 4,88 (±3,53) час для R-изомера после перорального введения R-изомера, S-изомера и смеси R:S, соответственно. Соответствующие средние (±SD) для S-изомера значения Tmax равны 2,27 (±1,44) час, 2,52 (±2,19) час и 4,88 (±3,53) час.
После перорального дозирования R-изомера гармоническое среднее значение t1/2 для R-изомера равно 2,18 час, что больше, чем значение t1/2 для внутривенного введения, 0,75 час. После перорального дозирования S-изомера гармоническое среднее значение для S-изомера t1/2 равно 3,60 час, что больше, чем значение t1/2 для внутривенного введения, 1,73 час.
Следовательно, у крыс биологическая доступность R-изомера в положении C∗ примерно в 2 раза больше, чем для S-изомера в положении C∗. Общая биологическая доступность равна примерно 98% для перорально дозируемого R-изомера в положении C∗ и примерно 50% для перорально дозируемого S-изомера в положении C∗, когда они представляются посредством сочетанного экспонирования 2-х изомеров. Кроме того, после перорального дозирования преобразование R на С∗ в S на С∗ является более выраженным, чем преобразование S на С∗ в R на С∗. Внутреннее преобразование осуществляется до большей степени после перорального дозирования, по сравнению с тем, что после внутривенного дозирования.
Пример 2
Протокол ферментного анализа HCV
Способ микроколоночной ВЭЖХ для разделения субстрата 5AB и продуктов
Субстрат:
NH2-Glu-Asp-Val-Val-(альфа)Abu-Cys-Ser-Met-Ser-Tyr-COOH
Исходный раствор 20 мМ 5AB приготавливают в DMSO w/0,2M DTT. Его хранят в аликвотах при -20°C.
Буфер:
50 мМ HEPES, pH 7,8; 20% глицерина; 100 мМ NaCl
Общий объем анализа равен 100 мкл.
при анализе
Буфер, KK4A, DTT и tNS3 объединяют; распределяют по 78 мкл каждого в лунки 96-луночного планшета. Его инкубируют при 30°C в течение ~5-10 мин.
2,5 мкл соответствующей концентрации исследуемого соединения растворяют в DMSO (для контроля - только DMSO) и добавляют в каждую лунку. Их инкубируют при комнатной температуре в течение 15 мин.
Реакцию инициируют посредством добавления 20 мкл 250 мкМ субстрата 5AB (концентрация 25 мкМ эквивалента или чуть ниже, чем Km для 5AB).
Инкубируют в течение 20 мин при 30°C.
Останавливают реакцию посредством добавления 25 мкл 10% TFA
Переносят 120 мкл аликвоты во флаконы для ВЭЖХ
Отделяют SMSY продукт от субстрата и KK4A с помощью следующего способа:
Способ микроколоночного разделения:
Инструмент: Agilent 1100
Дегазатор G1322A
Двойной насос G1312A
Устройство для автоматического отбора образцов G1313A
Термостатированная камера для колонки G1316A
Детектор с диодной матрицей G1315A
Колонка:
Phenomenex Jupiter; 5 микрон C18; 300 ангстрем; 150×2 мм; P/O 00F-4053-B0
Термостат колонки: 40°C
Инжектируемый объем: 100 мкл
Растворитель A = вода качества ВЭЖХ + 0,1% TFA
Растворитель B = ацетонитрил качества ВЭЖХ + 0,1% TFA
Время остановки: 17 мин.
Время после опыта: 10 мин.
Соединения с Ki ниже 1 мкМ обозначают A. Соединения с Ki в пределах от 1 мкМ до 5 мкМ обозначают B. Соединения с Ki выше 5 мкМ обозначают C.
Таблица 2 ниже изображает данные масс-спектрометрии, ВЭЖХ, 1H-ЯМР и Ki для определенных соединений по настоящему изобретению. "ND" означает, что данных нет. Спектр 1H-ЯМР регистрируют на 500 МГц с использованием инструмента Bruker AMX 500.
После 15-минутного периода инкубирования S-изомер демонстрирует Ki в категории A и R-изомер демонстрирует Ki в категории B. Ki определяют по флуоресцентному анализу расщепления пептидов для протеазы HCV NS3 и с помощью анализа расщепления пептидов на основе ВЭЖХ для серинпротеазы HCV NS3, описанного в примерах 3 и 4.
Фармакокинетические анализы:
Пример 3
Флуоресцентный анализ расщепления пептидов для протеазы HCV NS3
Стационарную константу ингибирования, Ki∗, некоторых соединений формулы I определяют в анализе, который представляет собой незначительно модифицированный флуоресцентный анализ расщепления пептидов, описанный в Taliani, M., E. Bianchi, F. Narjes, M. Fossatelli, A. Rubani, C. Steinkuhler, R. De Francesco, and A. Pessi. 1996. A Continuous Assay of Hepatitis C Virus Protease Based on Resonance Energy Transfer Depsipeptide Substrates. Anal. Biochem. 240: 60-67; которая тем самым включается в качестве ссылки.
Анализ осуществляют в буфере, содержащем 50 мМ HEPES (pH 7,8), 100 мМ NaCl, 20% глицерина и 5 мМ дитиотреитола (буфер A), с использованием флуоресцентного пептида RET-S1 в качестве субстрата. Реакции непрерывно отслеживаются с использованием устройства для флуоресцентного считывания микротитровальных планшетов fMax (Molecular Devices; Sunnyvale, CA), термостатированного при 30°C, с фильтрами возбуждения и испускания на 355 нм и 495 нм, соответственно. Исходный раствор протеазы HCV NS3 в буфере A, содержащий 25 мкМ пептида KK4A, предварительно инкубируют в течение 10 мин при комнатной температуре, а затем дополнительные 10 мин инкубируют при 30°C. Аликвоту соединения формулы I с 50% или менее R-изомера, растворенного в 100% диметилсульфоксиде (DMSO), добавляют к раствору RET-S1 в буфере A, содержащем 25 мкМ пептида KK4A, и предварительно инкубируют при 30°C в течение 10 мин. Реакцию инициируют посредством добавления аликвоты исходного раствора протеазы NS3/KK4А к смеси соединение/RET-Sl/KK4A/буфер A с получением конечной концентрации 12 мкМ RET-S1, 2% (об./об.) DMSO, 25 мкМ пептида KK4A и 0,5-1,0 нМ протеазы HCV NS3. Стационарные скорости реакции определяют по линейной регрессии зависимости флуоресценции от точек данных времени, полученных в 5-минутном окне при времени реакции 4 час. Ki∗ соединений определяют посредством подгонки данных по активности как функции концентрации ингибитора с помощью уравнения Моррисона для ингибирования фермента сильной связью. См. Morrison, J.F. 1969. Kinetics of reversible inhibition of enzyme-catalyzed reactions by tight-binding inhibitors. Biochim. Biophys. Acta 185: 269-86; тем самым включаемую в качестве ссылки.
Константа скорости диссоциации комплекса протеазы HCV NS3 и соединений определяют с использованием субстрата RET-S1 следующим образом. Исходный раствор протеазы HCV NS3 в буфере A, содержащем 25 мкМ пептида KK4A, приготавливают, как описано выше. 1 мкл аликвоты 100 мкМ соединения формулы I с 50% или менее R-изомера, растворенного в 100% DMSO, добавляют к 49 мкл аликвоте предварительно нагретого исходного раствора фермента с получением смеси 320 нМ фермента и 2 мкМ соединения, которые затем инкубируют при 30°C в течение 4 час, чтобы дать возможность образованию комплекса фермент-ингибитор для достижения равновесия. Реакцию диссоциации инициируют посредством последовательного разбавления 8 мкл аликвоты смеси фермент-ингибитор в 192 мкл буфера A, содержащего 25 мкМ пептида KK4A и 2% DMSO (об./об.), а затем в 192 мкл RET-S1 в буфере A, содержащем 25 мкМ пептида KK4A и 2% DMSO, оба предварительно нагреваются до 30°C. Конечные концентрации равны 0,5 нМ протеазы HCV NS3, 25 мкМ пептида KK4A, 12 мкМ RET-S1 и 3 нМ (1S,3aR,6aS)-2-[(2S)-2-[[(2S)-2-циклогексил-1-оксо-2-[(пиразинилкарбонил)амино]этил]амино]-3,3-диметил-1-оксобутил]-N-[(1R)-1-[2-(циклопропиламино)-1,2-диоксоэтил]бутил]октагидроциклопента[c]пиррол-1-карбоксамида. Изменение флуоресценции отслеживают в 4-часовом окне и графики данных зависимости флуоресценции от времени подгоняют с помощью следующего уравнения: F(t) = Vs × t + (Vi-Vs)×(1-exp (-kobs × t))/kobs + C посредством нелинейной регрессии. Контрольные скорости определяют из реакции, содержащей чистый DMSO. При этих экспериментальных условиях kobs находится в пределах 20% от koff. Время полужизни комплекса (t1/2) вычисляют из koff, используя следующее уравнение: t1/2 = 0,693/koff.
Пример 4
Анализ расщепления пептидов на основе ВЭЖХ для серинпротеазы HCV NS3
Этот анализ представляет собой незначительно модифицированную версию того, который был ранее описан в Landro, J.A., S.A. Raybuck, Y.P. Luong, E.T. O'Malley, S.L. Harbeson, K.A. Morgenstern, G. Rao and D.J. Livingston. 1997. Mechanistic Role of an NS4A Peptide Cofactor with the Truncated NS3 Protease of Hepatitis C Virus: Elucidation of NS4A Stimulatory Effect via Kinetic Analysis and Inhibitor Mapping. Biochemistry 36: 9340-9348; тем самым включаемый в настоящее описание в качестве ссылки.
Протеазу NS3 (10-25 нМ) и 25 нМ KK-4A предварительно инкубируют в течение 5 мин в буфере, содержащем 50 мМ HEPES (pH 7,8), 100 мМ NaCl, 20% глицерина и 5 мМ дитиотреитола, при комнатной температуре. Ингибиторы протеазы HCV, растворенные в DMSO, добавляют к смеси ферментов, при конечной концентрации в DMSO 2% (об./об.), и инкубируют в течение 15 мин при комнатной температуре. Реакция протеолиза инициируется посредством добавления субстрата NS5A/NS5B при концентрации, равной его Km (25 мкМ) и инкубируется в течение 15 мин при 30°C. Реакцию гасят посредством добавления одной четвертой объема 10% трифторуксусной кислоты и анализируют на колонке ВЭЖХ с обращенной фазой. Анализ образца завершают в пределах 24 часов после завершения реакции. Видимую константу ингибирования, Ki(app), ингибиторов протеазы HCV вычисляют с использованием способа подгонки методом наименьших квадратов нелинейной регрессии на основе уравнения Моррисона для конкурентного ингибирования с сильной связью. См. Morrison, et al.
Пример 5
Определение IC 50 в клетках с репликоном HCV
Несколько соединений формулы I имеют концентрации, при которых уровень РНК HCV в клетках с репликоном уменьшается на 50% (IC50) или на 90% (IC90), или выживаемость клеток понижается на 50% (CC50), определяют в клетках с субгеномным репликоном HCV Con1 (Lohmann, V., F. Komer, J. Koch, U. Herian, L. Theilmann, and R. Bartenschlager. 1999. Replication of subgenomic hepatitis C virus RNAs in hepatoma cell line. Science 285: 110 - 3.16; тем самым включаемая в настоящее описание в качестве ссылки) с использованием подгонки с помощью четырехпараметрической кривой (SoftMax Pro). Вкратце, клетки с репликоном инкубируют с соединениями, разбавленными в среде, содержащей 2% фетальной сыворотки теленка (FBS) и 0,5% DMSO при 37°C. Общее клеточное содержание РНК экстрагируют с использованием набора RNeasy-96 (Qiagen, Valencia, CA), и количество копий РНК HCV определяют в количественном анализе с помощью мультиплексной PCR с обратной транскрипцией в реальном времени (QRT-PCR или Taqman). Цитотоксичность соединений клеток с репликоном HCV измеряют при таких же экспериментальных настройках, используя анализ выживаемости клеток на основе тетразолия, как описано ранее. См. Lin, C., K. Lin, Y.P. Luong, B.G. Rao, Y.Y. Wei, D.L. Brennan, J.R. Fulghum, H.M. Hsiao, S. Ma, J.P. Maxwell, К.M. Cottrell, R.B. Perni, C.A. Gates, and A.D. Kwong. 2004. In vitro resistance studies of hepatitis C virus serine protease inhibitors, (1S,3aR,6aS)-2-[(2S)-2-[[(2S)-2-cyclohexyl-1-oxo-2-[(pyrazinylcarbonyl)amino]ethyl]amino]-3,3-dimethyl-1-oxobutyl]-N-[(1R)-1-[2-(cyclopropylamino)-1,2-dooxoethyl]butyl]octahydro-cyclopenta[c]pyrrole-1-carboxamide.
Пример 6
Фармакокинетические исследования на животных
Внутривенная фармакокинетика соединений формулы I оценивается на крысах и собаках. Группе из 3 самцов крыс Sprague-Dawley массой 250-300 г вводят внутривенную болюсную дозу 0,95 мг/кг S-диастереомера формулы I, в носителе, состоящем из 15% этанола, 10% диметилизосорбида, 35% PEG400 и 40% D5W (5% декстрозы в воде). Последовательные образцы крови собирают в гепаринизированных пробирках в момент 0 (перед дозированием), 0,083, 0,167, 0,25, 0,5, 1, 1,5, 2, 3, 4, 6 и 8 часов, после введения дозы. Группе из 3 самцов собак породы бигль (8-12 кг; Charles River, MA) вводят внутривенную болюсную дозу 3,5 мг/кг диастереомера в 10% этанола, 40% PEG400 и 50% D5W. Последовательные образцы крови собирают в гепаринизированных пробирках перед дозированием, и в моменты 0,083, 0,167, 0,25, 0,5, 1, 1,5, 2, 4, 6, 8, 12 и 24 часа после введения дозы. Для пероральных исследований на крысах и собаках S-диастереомер соединения формулы I приготавливают в поливинилпирролидоне (PVP) K30 плюс 2% лаурилсульфат натрия, а затем дозируют как пероральный зонд. Группе из 3 самцов крыс Sprague-Dowly (250-300 г, Harlan, MD) дозируют перорально 40 мг/кг соединения, а группе из 3 самцов собак (10,9-12,0 кг) вводят пероральную дозу 13,2 мг/кг соединения. В обоих пероральных исследованиях образцы крови отбирают перед дозировкой, в моменты 0,25, 0,5, 1, 1,5, 2, 3, 4, 6, 8, 12 и 24 часа после введения дозы. Как во внутривенных, так и в пероральных исследованиях образцы плазмы получают посредством центрифугирования и хранят при -70°C до осуществления анализа. Образцы, полученные от внутривенных исследований крыс, подвергают анализу с помощью хиральной жидкостной хроматографии/масс-спектрометрии (ЖХ/МС/МС), в то время как образцы ото всех других исследований анализируют с использованием нехирального метода ЖХ/МС/МС. Стандартные методики используют для осуществления неклассифицированного анализа данных с использованием WinNonlin Enterprise/Pro Version 4.0.1 (Pharsight Corporation, Mountain View, CA) для вычисления следующих фармакокинетических параметров, таких как Cmax, или Cmin, или Cavg (максимальная, или минимальная, или средняя концентрация лекарственного средства в сыворотке, соответственно), AUC0-8 или AUC0-inf (общая площадь под кривой зависимости концентрации от 0 до 8 час или от 0 до бесконечности, соответственно), t1/2 (время полужизни до выведения), CL (общее выделение из организма), и Vss (объем распределения в стационарном состоянии).
Пример 7
Оценка отношения нескольких соединений формулы I в печени и плазме крыс
Отношение диастереомера соединения формулы I в печени и плазме оценивается у крыс после перорального введения раствора соединения в пропиленгликоле. Шести группам (по 3 животных в группе) самцов крыс Fisher перорально вводят номинальную дозу 30 мг/кг диастереомера соединения формулы I. В момент 0 (перед дозированием), 0,5, 1, 2, 4 или 8 час после введения дозы, одну группу из 3 животных умерщвляют в один момент времени и получают по одному образцу крови и соответствующей печени от каждого животного. Образцы плазмы получают посредством центрифугирования образцов крови. Цельная печень удаляется у животного и перфузируется нормальным солевым раствором для удаления следов крови. После взвешивания печень разрезают на маленькие кусочки и гомогенизируют вместе с равным объемом воды. Образцы плазмы и печени хранят при -70°C до анализа с использованием метода нехиральной ЖХ/МС/МС.
Пример 8
Модель мышей для серинпротеазы HCV NS3-4А
Подробности относительно этой модели мышей для серинпротеазы HCV NS3-4A будут описаны в другом месте. Здесь приводится краткое описание этой модели. Фрагмент кДНК HCV, кодирующий кодон инициирования Met, His-таг (SHHHHHHAM), полноразмерные 631 аминокислота белка NS3 HCV, полноразмерные 54 остатка белка NS4A HCV и 6 (ASHLPY) аминокислот N-окончания белка NS4B HCV сливаются с полноразмерным геном, секретирующим плацентальную щелочную фосфатазу (SEAP), посредством PCR с перекрыванием от плазмиды pYes2-NS3-4A и pSEAP2 (Clontech, Palo Alto, CA), а затем клонируют в вектор экспрессии аденовируса, pAdenovirus (Clontech), для генерирования pAd-WT-HCVpro-SEAP. Соответствующая версия этого гена слияния с Ala замещением каталитического Ser-139 в активной триаде серинпротеазы HCV NS3-4А, pAd-MT-HCVpro-SEAP генерируется посредством такого же PCR с перекрыванием и метода субклонирования с использованием pYes2/NS3-4A, содержащего мутацию от Ser139 до Ala. Аденовирус упаковывается посредством трансфицирования клеток HEK293 (ATCC, Rockville, MD) PacI-линеаризованной плазмидой pAdenovirus, pAd-WT-HCVpro-SEAP или pAd-MT-HCVpro-SEAP в присутствии Lipofectamine 2000 (Invitrogen). Рекомбинантные аденовирусы очищают с помощью центрифугирования в градиенте плотности хлорида цезия и обессоливают посредством диафильтрации с помощью фильтров Centriprep YM-50 (Millipore, Bedford, MA). Наборы для быстрого титрования аденовируса (Clontech) используются для определения количества инфекционных единиц (IFU) исходных растворов рекомбинантного аденовируса. Мышам SCID в возрасте шесть недель (~20 г, Charles River, Wilmington, MA) дозируют посредством перорального зонда соединение формулы (I) с 50% или менее R-изомера или с одним только носителем. Через два часа после дозирования рекомбинантный аденовирус, Ad-WT-HCVpro-SEAP или Ad-MT-HCVpro-SEAP, вводят как инъекцию в латеральную хвостовую вену мыши.
Экспериментальные критерии в перспективе утверждают, что животные с незавершенными инъекциями не должны включаться в анализ данных. Мыши анестезируются с помощью изофлуорана, и образцы крови отбирают в различные моменты времени после инъекции, с использованием ретроорбитальных глазных кровоизвлечений, или в конечный момент времени, посредством пункции сердца. Сыворотку мышей разбавляют 5-кратно дистиллированной водой, и активность SEAP в сыворотке измеряют с использованием системы детектирования Phospha-Light (Applied Biosystems, Foster City, CA) и микропланшетного люминометра Tropix TR717 (Tropix, Bedford, MA). Для фармакокинетического анализа образцы плазмы хранят при -80°C до анализа. Образцы печени мышей смешивают с 2 объемами (об./мас.) 2M муравьиной кислоты, гомогенизируют и хранят при -80°C до анализа. Образцы анализируют с использованием системы хиральной ЖХ/МС/МС.
Пример 9
Фармацевтические композиции
Смесь диастереомерных соединений по настоящему изобретению может приготавливаться любым способом, пригодным для доставки терапевтически эффективного количества смеси соединений субъекту (например, млекопитающему). В некоторых вариантах осуществления смесь диастереомерных соединений формулы I может приготавливаться в поливинилпирролидоне (PVP) K-30 плюс лаурилсульфат натрия (SLS).
Смесь диастереомерных соединений: 49,5%
PVP K30: 49,5%
SLS: 1%
Композиция может приготавливаться посредством растворения смеси диастереомерных соединений, PVP K30 и суспендирования SLS в растворителе, таком как метанол:метиленхлорид, с последующей сушкой распылением для удаления растворителя. Другие фармацевтические композиции содержат различные количества смеси диастереомерных соединений формулы I (49%), PVP K-30 (49%) и SLS (2%).
Дополнительные примеры фармацевтических композиций диастереомерных соединений формулы I могут приготавливаться подобно композициям, описанным в WO 2005/123076, полное содержание которой тем самым включается в качестве ссылки.
VI. Другие варианты осуществления
Необходимо понять, что хотя настоящее изобретение описывается в связи с его конкретным описанием, предшествующее описание предназначается для иллюстрации, но не ограничения рамок настоящего изобретения, которое определяется рамками прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в рамках следующей далее формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДЕЙТЕРИРОВАННЫЕ ИНГИБИТОРЫ ПРОТЕАЗЫ ГЕПАТИТА С | 2007 |
|
RU2465264C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2006 |
|
RU2446171C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2010 |
|
RU2531588C2 |
| СОЛИ ТИАЗОЛИДИНДИОНА СО СНИЖЕННЫМ СРОДСТВОМ К PPAR ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ ОБМЕНА ВЕЩЕСТВ | 2010 |
|
RU2564661C2 |
| АНАЛОГИ ТИАЗОЛИДИНДИОНА ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА И ДИСЛИПИДЕМИИ | 2008 |
|
RU2486179C2 |
| НОВЫЙ СПОСОБ СИНТЕЗА СОЕДИНЕНИЙ ТИАЗОЛИДИНДИОНА | 2011 |
|
RU2593370C2 |
| СИНТЕЗ СОЕДИНЕНИЙ ТИАЗОЛИДИНДИОНА | 2011 |
|
RU2594725C2 |
| АНАЛОГИ ТИАЗОЛИДИНДИОНА | 2007 |
|
RU2445957C2 |
| МОДУЛЯТОРЫ КИНАЗЫ, АССОЦИИРОВАННОЙ С РЕЦЕПТОРОМ ИНТЕРЛЕЙКИНА-1 | 2007 |
|
RU2459821C2 |
| 2-АМИДО-4-АРИЛОКСИ-1-КАРБОНИЛПИРРОЛИДИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ СЕРИНПРОТЕАЗ, В ЧАСТНОСТИ ПРОТЕАЗЫ NS3-NS4A HCV | 2004 |
|
RU2440368C2 |
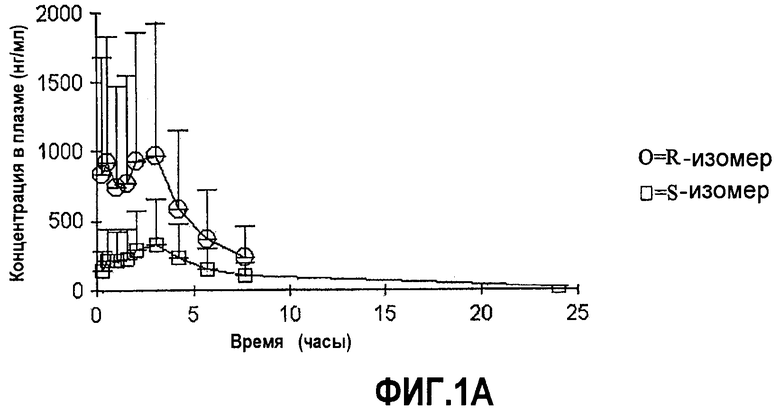
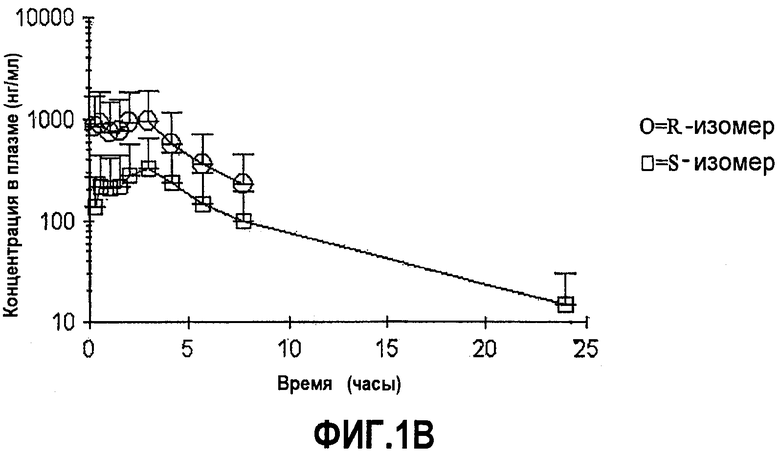
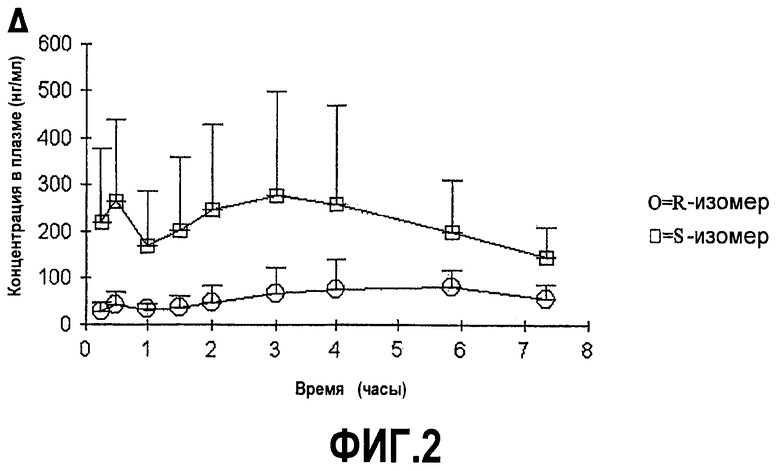
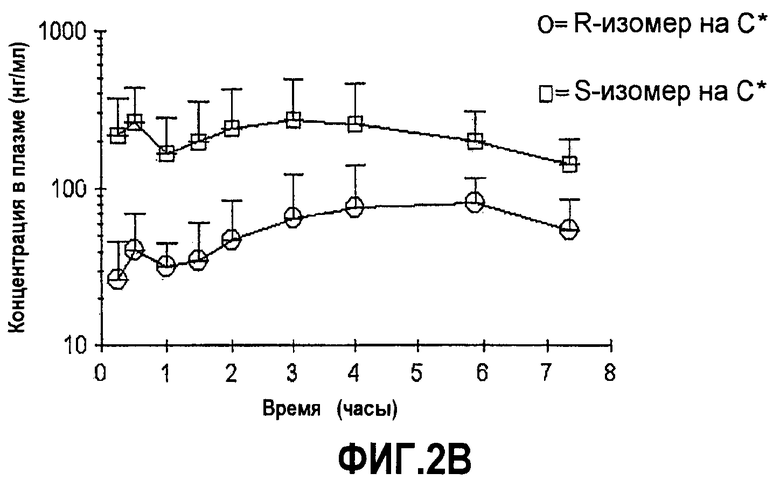
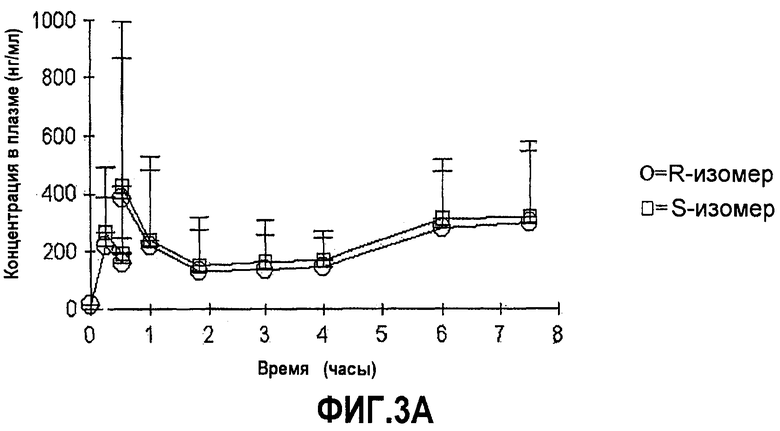
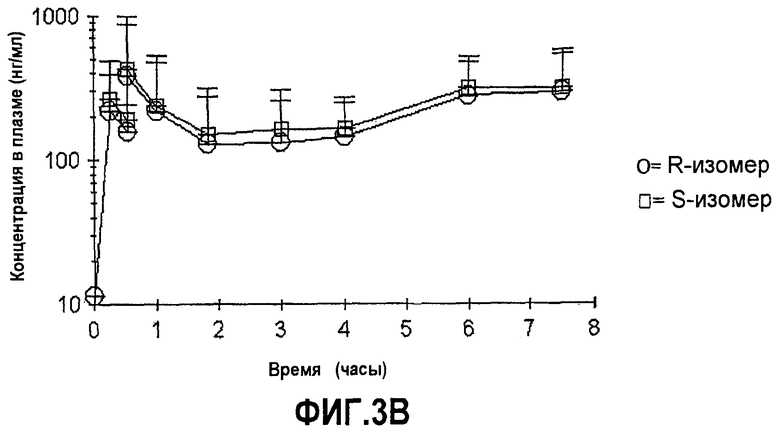
Изобретение относится смеси диастереомерных соединений, где С* представляет собой смесь R- и S-изомеров; и R-изомер составляет больше 50% смеси по отношению к S-изомеру в положении С*. Указанная смесь эффективна для ингибирования серинпротеазы. 6 н. и 10 з.п. ф-лы, 8 табл., 6 ил.
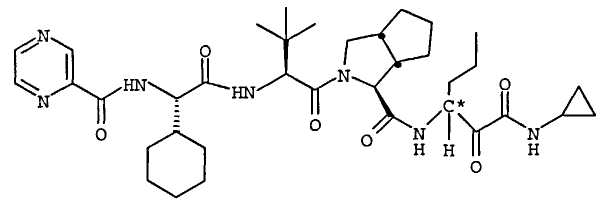
1. Смесь диастереомерных соединений, содержащая
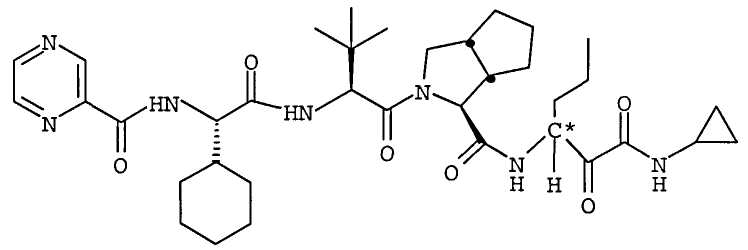
или их фармацевтически приемлемую соль, или их смеси, где С* представляет собой смесь R- и S-изомеров; и R-изомер составляет больше 50% смеси по отношению к S-изомеру в положении С*.
2. Смесь диастереомерных соединений по п.1, где процент R-изомера в смеси составляет больше 60%.
3. Смесь диастереомерных соединений по п.2, где процент R-изомера в смеси составляет больше 70%.
4. Смесь диастереомерных соединений по п.3, где процент R-изомера в смеси составляет больше 80%.
5. Смесь диастереомерных соединений по п.4, где процент R-изомера в смеси составляет больше 90%.
6. Смесь диастереомерных соединений по п.5, где процент R-изомера в смеси составляет больше 95%.
7. Смесь диастереомерных соединений по п.6, где процент R-изомера в смеси составляет больше 98%.
8. Смесь диастереомерных соединений по п.7, где процент R-изомера в смеси составляет больше 99%.
9. Фармацевтическая композиция, содержащая смесь диастереомерных соединений по п.1, в количестве, эффективном для ингибирования серинпротеазы; и приемлемый носитель, вспомогательное вещество или наполнитель.
10. Способ ингибирования активности серинпротеазы, включающий стадию контактирования указанной серинпротеазы со смесью диастереомерных соединений по п.1 или композиции по п.9 в фармацевтически эффективном количестве.
11. Способ по п.10, где указанная серинпротеаза представляет собой протеазу HCV NS3.
12. Способ устранения или уменьшения HCV загрязнения биологического образца или медицинского или лабораторного оборудования, включающий стадию контактирования указанного биологического образца или медицинского или лабораторного оборудования со смесью диастереомерных соединений по п.1 или композиции по п.9.
13. Способ по п.12, где указанный образец или оборудование выбирают из крови, других жидкостей организма, биологической ткани, хирургического инструмента, хирургической одежды, лабораторного инструмента, лабораторной одежды, устройства для сбора крови или других жидкостей организма; сохраняемого материала крови или других жидкостей организма.
14. Способ по п.13, где указанная жидкость организма представляет собой кровь.
15. Фармацевтическая композиция для лечения инфекции HCV у пациента, содержащая (1S,3aR,6aS)-2-[(2S)-2-[[(2S)-2-циклогексил-1-оксо-2-[(пиразинилкарбонил)амино]этил]амино]-3,3-диметил-1-оксобутил]-N-[(1R)-1-[2-(циклопропиламино)-1,2-диоксоэтил]бутил]октагидроциклопента[с]пиррол-1-карбоксамид в количестве, эффективном для ингибирования серинпротеазы; и приемлемый носитель, вспомогательное вещество или наполнитель.
16. Способ ингибирования активности серинпротеазы, включающий стадию контактирования указанной серинпротеазы с композицией по п.15.
| RU 2006105002 А, 27.08.2006 | |||
| WO 9611697 А1, 25.04.1996 | |||
| МАШИНА ДЛЯ ПОЛУЧЕНИЯ ВИСКОЗНОГО ВОЛОКНА | 0 |
|
SU218369A1 |
| 0 |
|
SU208244A1 | |
| WO 03087092 А2, 23.10.2003 | |||
| WO 2005035525 А2, 21.04.2005 | |||
| WO 2005042570 А1, 12.05.2005 | |||
| HAN W ET AL: "alpha-Ketoamides, alpha-ketoesters and alpha-diketones as HCV NS3 protease inhibitors" BIOORGANIC & MEDICINAL CHEMISTRY LETTERS, 2000, | |||
Авторы
Даты
2012-01-27—Публикация
2006-08-01—Подача