Изобретение относится к области химии, химико-фамацевтической промышленности и медицины и касается соединений, имеющих клозапинподобные структуры и которые могут быть полезны в качестве антипсихотических средств.
Хорошо известно, что производные бензодиазепинов широко используются как физиологически активные субстраты для создания лекарственных препаратов, использующихся для лечения психических заболеваний и состояний, таких как расстройства центральной нервной системы, глюцинация, шизофрения, острая мания и др. [U.S. Pat. №5605897; US Pat. №5627178; U.S. Pat. №5817655].
В настоящий момент существует довольно много производных бензодиазепинов из группы нейролептиков и антипсихотиков, такие как локсапин(I), клотиапин(II), клозапин (III), октоклосепин (IV), доклосепин (V), HF-2046(VI), оланзапин (VII), флюмезапин(VIII) [J. Med. Chem., 1980, 23 (8), 878-884; US Pat. №4115568; US Pat. №6008216; U.S. Pat. №6271225; WO 03082877 A1; WO 03101997 A1; WO 03104239 A1; WO 2004000847 A1; WO 2004014895 A1; Molecules 1999, 4, 329-332; DE Pat. №4341987; J. Lob. Соmр. Radiopharm.,1988, Vol. XW, №9, 1027-1033; Bioorg. Med. Chem. Lett., 2006, 16, 4543-4547; Aust. J. Chem., 2003, 56, 875-886, Aust. J. Chem., 2002, 55, 565-576, WO 2004056182 A1; WO 2005070937 A1; WO 2005090359 A2; WO 2006010620 A2; WO 2006053870 A1; WO 2007077134 A1], а также производные бензодиазепинпиразолов [J. Med. Chem., 1989,32, 2573-2582], бензодиазепинтриазолов [UK Pat. № GB 2091246], пиперазинилпироло[2,1-c][1,4]бензодиазепинов [J. Med. Chem. 1980, 23, 462-465] и подобные им структуры.
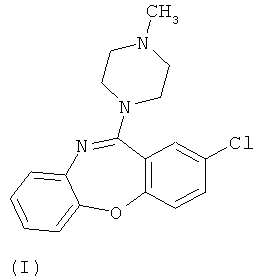
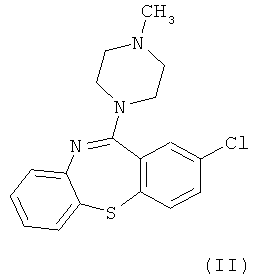
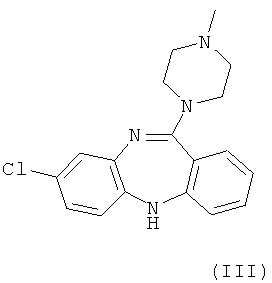
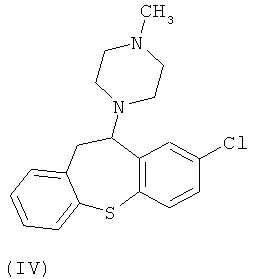
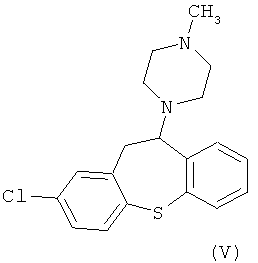
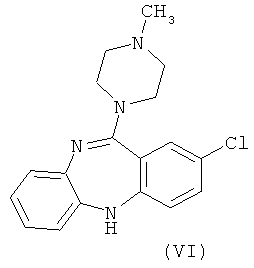
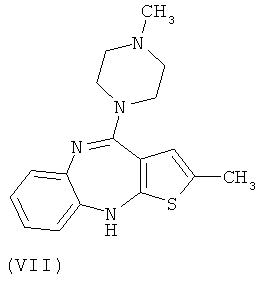

Вместе с тем потребность в эффективных психотропных средствах все более возрастает. Нарастание темпов жизни, социальные потрясения, войны, революции, стихийные бедствия и многое другое привело к увеличению потребности в средствах для эффективной терапии психических и нервных заболеваний. Эти требования медицины не могли не быть и продолжают сейчас оставаться весьма важной задачей для фармакологов и специалистов смежных областей знаний.
Целью настоящего изобретения являются новые производные 5Н-дибензо[b,е][1,4]диазепина, в том числе оснований и их солей с фармакологически приемлемыми кислотами, что в совокупности представлено общей формулой (1):
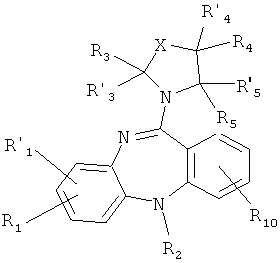
в которой:
R1, R1' и R10 представляет собой каждый независимо Н, C1-С6 алкил, C1-С10 алкокси, тиенил, гидроксил, галоген, амино, нитро-группу, нитрил;
R2 представляет Н, C1-С6 алкил, тиенил;
R3, R'3, R4, R'4, R5 и R'5 могут быть одинаковыми или различными и каждый независимо представляет Н, C1-С6 алкил, C1-С10алкокси, ацил;
Х представляет либо группу общей формулы:

в которой n=0-4;
R6 представляет Н, C1-С6 алкил, ацил;
R7 и R'7 представляет Н, C1-С6 алкил, C1-С10алкокси;
a Q выбран либо из группы, состоящей из:
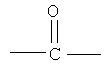 ,
, 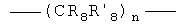 ,
, 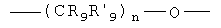 ;
;
R8, R'8, R9 и R'9 могут быть одинаковыми или различными и каждый независимо представляет Н, C1-С6 алкил, C1-С10алкокси;
либо Q представляет валентную связь;
либо Х представляет группу общей формулы:
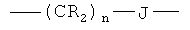 ,
,
в которой n=1-3, a J выбран из группы, состоящей из:
 ,
, 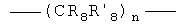 ,
, 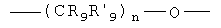 ;
;
R8, R'8, R9 и R'9 могут быть одинаковыми или различными и каждый независимо представляет Н, С1-С6 алкил, C1-С10алкокси, ацил;
либо J представляет валентную связь;
при условии, что когда Q представляет собой связь, R6- метил, R2, R'3, R4, R'4, R5 и R'5 - Н, а один из R1' и R1 является Н или Cl, то другой R1' и R1 не является Cl или Н соответственно, а также при условии, что когда Х представляет либо группу общей формулы:
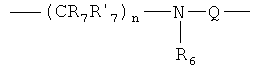
где R7 и R'7 представляет Н, n=1, Q представляет связь, R'3, R4, R'4, R5 и R'5 представляют собой Н, то R10 во втором положении не представляет собой амино или нитро-группу.
Под используемым здесь термином "галоген" имеется в виду фтор, хлор, бром или иод.
Термин "алкокси" означает группу AlkO-, в которой алкильный фрагмент является таким, как определенная выше алкильная группа. Примеры алкокси групп включают метокси, бутокси, изопропилокси и аналогичные группы.
Термин "ацил" означает группу C(O)R (в которой R имеет значения Н, алкил, арил и аралкил, определенные выше). Примеры ацильных групп включают формильную, ацетильную, бензоильную, фенилацетильную и аналогичные группы.
Термин "амино" означает группу NR'R" (в которой R' и R" могут быть одинаковыми или различными, и каждый независимо представляет Н, алкил, циклоалкил, арил, аралкил, гетероциклоалкил, тиенил, галоген, определенные выше). Примеры амино-групп включают диизопропиламин, дифениламин, метилэтиламин и т.д.
Термин "фармакологически приемлемые кислоты" охватывает все фармакологически приемлемые кислоты, как неорганические (например, соляную, серную, фосфорную и т.д.), так и органические (например, муравьиную, уксусную, щавелевую, лимонную, винную, малеиновую, янтарную, п-толуол-сульфокислоту, метилсерную и т.д.).
Предпочтительные варианты воплощения изобретения.
Среди соединений формулы (1), составляющих один из объектов настоящего изобретения, предпочтительными являются следующие четыре группы соединений, который могут быть представлены формулами (1.1), (1.2) и (1.3), приведенными ниже. В частности предпочтительными соединениями являются:
1.1. производные 5Н-дибензо[b,е][1,4]диазепина общей формулы(1.1):
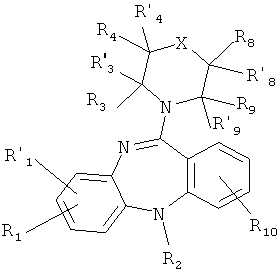
или его фармакологически приемлемую соль с кислотой, где:
X, R1, R'1, R2, R3, R'3, R4, R'4, R8, R'8, R9, R'9 и R10 имеют значения, определенные выше для формулы 1.
1.2. производные 5Н-дибензо[b,е][1,4]диазепина общей формулы (1.2):
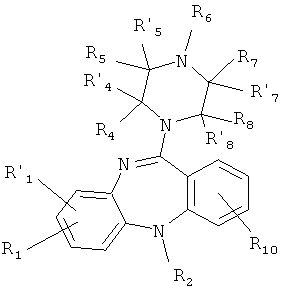
или его фармакологически приемлемую соль с кислотой, где:
R1, R'1, R2, R4, R'4, R5, R'5, R6, R7, R'7, R8, R'8, и R10 имеют значения, определенные выше для формулы 1.
1.3. производные 5Н-дибензо[b,е][1,4]диазепина общей формулы (1.3):
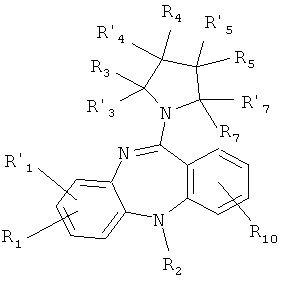
или его фармакологически приемлемую соль с кислотой, где:
R1, R'1, R2, R3, R'3, R4, R'4, R5, R'5, R7, R'7, и R10 имеют значения, определенные выше для формулы 1.
Наиболее предпочтительными соединениями формулы 1.1 (в виде фармакологически приемлемых солей и/или свободных оснований) являются:
11-(пиперидин-1-ил)-7-фтор-8-хлор-3-этил-5Н-дибензо[b,е][1,4]диазепин,
11-(морфолин-4-ил)-7-фтор-3,8-дихлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-2-метокси-11-(пиперидин-1-ил)-7-фтор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-2-метокси-11-(морфолин-4-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-11-(морфолин-4-ил)-7,9-дифтор-2,8-дихлор-5Н-дибензо[b,е][1,4]диазепин,
11-(морфолин-4-ил)-8-нитро-2-фтор-5Н-дибензо[b,е][1,4]диазепин,
11-((пиперидин-4-он)-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин.
Наиболее предпочтительными соединениями формулы 1.2 (в виде фармакологически приемлемых солей и/или свободных оснований) являются:
11-(пиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
11-(4-метилпиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-11-(4-метилпиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
11-(4-ацетилпиперазин-1-ил)-3,7-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
7-гидрокси-3-метил-11-(пиперазин-1-ил)-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-11-(4-метилпиперазин-1-ил)-2-(3-тиенил)-7,9-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
11-(пиперазин-1-ил)-7,9-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-(3-тиенил)-11-(4-метилпиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин.
Наиболее предпочтительными соединениями формулы 1.3 (в виде фармакологически приемлемых солей и/или свободных оснований) являются:
11-(пирролидин-1-ил)-3,7-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
3-бром-5-метил-2-метокси-11-(пирролидин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-2-нитро-11-(пирролидин-1-ил)-7,9-дифтор-8-хлор-5Н-дибензо[b,e][1,4]диазепин,
2-диметиламино-5-метил-11-(пирролидин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-2-метокси-11-(пирролидин-1-ил)-7-(3-тиенил)-5Н-дибензо[b,е][1,4]диазепин,
7-гидрокси-11-(пирролидин-1-ил)-2-циано-5Н-дибензо[b,е][1,4]диазепин,
8-диметиламино-11-(пирролидин-1-ил)-3,7-дифтор-5Н-дибензо[b,е][1,4]диазепин,
11-(3,4-диметилпирролидин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин.
Предлагается также применение вышеуказанных соединений в качестве активного начала для получения антипсихотического средства.
Ниже данное изобретение описывается более подробно с помощью примеров получения конкретных соединений. Исходные реагенты, как и конечные продукты, получаются известными в литературе способами или являются промышленно доступными. Схемы синтеза конечных соединений представлена ниже:
Схема 1:
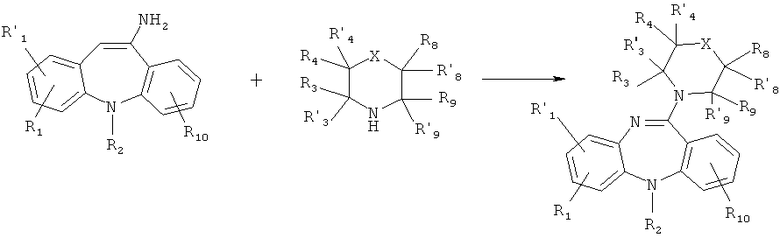
Схема 2:
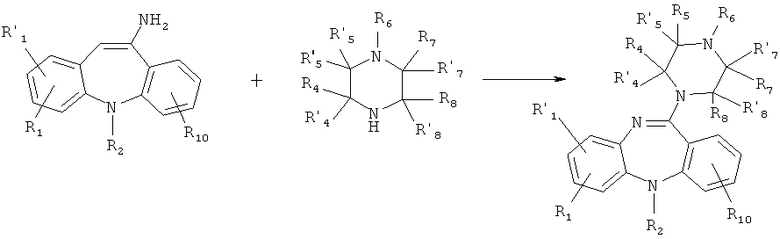
Схема 3:
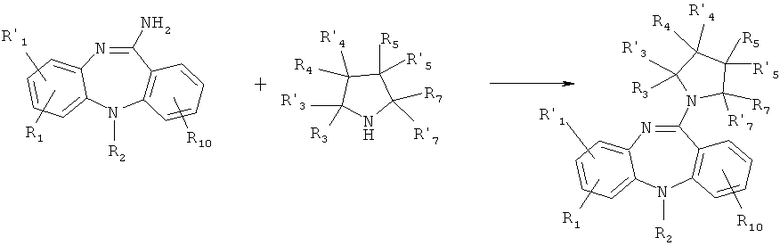
где X, R1, R'1, R2, R3, R'3, R4, R'4, R5, R'5, R6, R7, R'7, R8, R'8, R9, R'9 и R10 имеют значения, определенные выше для формулы 1.
Структуры полученных соединений подтверждались данными химического, спектрального анализов и других физико-химических характеристик.
На схеме 4 приводится пример синтеза одного из производных безодиазепинамина (эта структура участвует во всех вышеприведенных схемах), которое иллюстрирует, но не ограничивает данное изобретение:
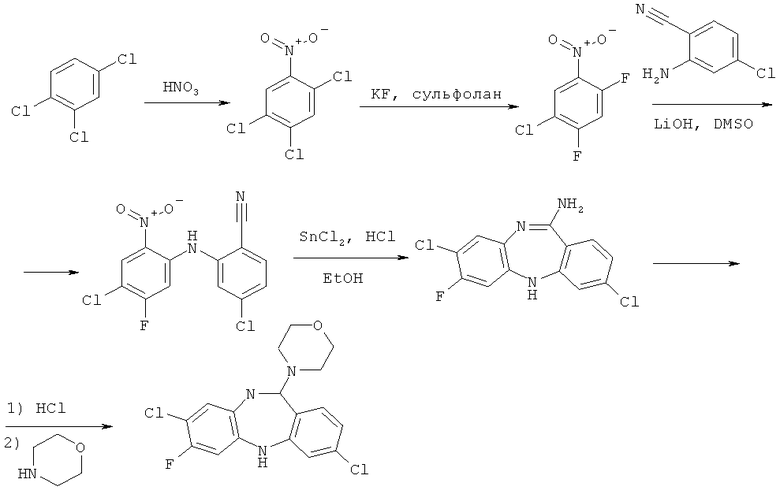
1. Получение 2,4,5-трихлорнитробензола.
Безводную азотную кислоту (280 мл) поместили в колбу объемом 500 мл и охладили до 0°С. 1,2,4-Трихлорбензол (70 мл) медленно по каплям прилили в колбу с азотной кислотой при перемешивании. Через 45 минут реакционную массу вылили в стакан со льдом (1 кг). Выпавший осадок отфильтровали и промыли водой до нейтральной среды раствора. Получили 127 г продукта в виде светло-желтого порошка.
2. Получение 2,4-дифтор-5-хлорнитробензола.
2,4,5-трихлорнитробензол (51.9 г) и фторид калия (38.4 г) растворили в сульфолане (100 мл). Полученный раствор нагрели при перемешивании до 180°С. Через 40 ч реакционную массу перегнали при 10 ммHg. Собрали фракцию с температурой кипения 95-115°С. Получили 28 г (63%) продукта в виде желтой жидкости.
3. Получение 2-(5-фтор-4-хлор-2-нитрофениламино)-4-хлорбензонитрила
2,4-дифтор-5-хлорнитробензол (12.0 г), 2-амино-4-хлорбензонитрил (9.5 г) и LiOH·H2O (5.2 г) растворили в 60 мл ДМСО. Полученный раствор нагрели при перемешивании до 80°С. Через 6 ч реакционную массу вылили в 200 мл воды, осадок отфильтровали. Очистку проводили методом колоночной хроматографии на силикагеле (элюент: гексан-бензол 1:1). Получили 7.4 г (37%) продукта в виде оранжевого порошка.
4. Получение 7-фтор-3,8-дихлор-5Н-дибензо[b,е][1,4]диазепин-11-амина.
2-(5-фтор-4-хлор-2-нитрофениламино)-4-хлорбензонитрил (3.7 г) и SnCl2·2H2O (12.0 г) растворили в смеси 17 мл концентрированной HCl и 75 мл этанола. Полученный раствор перемешивали при кипячении в течение 7 ч. Реакционную массу подщелочили раствором NaOH (20%) до рН 12-13, проэкстрагировали бензолом. После упаривания растворителя получили 2.8 г (84%) продукта в виде желтого порошка. Полученное вещество ввели на следующую стадию без дополнительной очистки.
5. Получение 7-фтор-3,8-дихлор-11-(морфолин-4-ил)-5Н дибензо[b,е][1,4]диазепина.
7-фтор-3,8-дихлор-5Н-дибензо[b,е][1,4]диазепин-11-амин растворили (2.0 г) в 10 мл концентрированной HCl и 10 мл этанола, затем упарили досуха. К полученному гидрохлориду прибавили по каплям раствор морфолина (4.4 мл) в смеси ДМСО (10 мл) и толуола (10 мл). Реакционную массу перемешивали при 120°С в течение 48 ч. После отгонки растворителя и избытка морфолина провели очистку методом колоночной хроматографии на силикагеле (элюент: хлороформ-этанол 20:1). Получили 1.6 г (64%) продукта в виде светло-желтого порошка.
Пример 1
Этот пример иллюстрирует способ получения соединений формулы I с использованием синтетической схемы, приведенной ниже:
2-(2-фторбензолсульфонил)-4-пиперазин-1-ил-1Н-индол
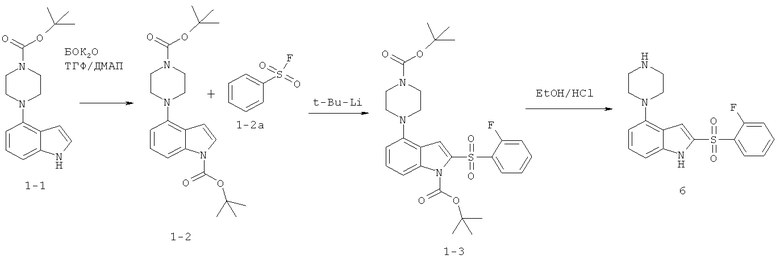
Стадия 1
К раствору индола 1-1 (1,38 г, 4,6 ммоль) в ТГФ (35 мл) при комнатной температуре (к.т.) добавляют ди-трет-бутилдикарбонат (1,0 г, 4,6 ммоль), а затем 4-диметиламинопиридин (ДМАП) (56 мг, 0,46 ммоль). Реакционную смесь перемешивают при к.т. в атмосфере азота в течение 1 часа, после чего реакционную смесь концентрируют в вакууме. Остаток распределяют между этилацетатом (50 мл) и насыщенным водным раствором бикарбоната натрия (50 мл). Органический слой промывают насыщенным раствором бикарбоната натрия (2×25 мл), затем солевым раствором (раствором хлорида натрия) (25 мл). Органический слой сушат (MgSO4), фильтруют и концентрируют с получением прозрачного масла. Масло кристаллизуют из гексана с получением 1,65 г (89%) трет-бутилоксикарбонилпиперазин-трет-бутилоксикарбонил-индола (бок-пиперазин-бок-индола) (1-2) в виде твердого вещества белого цвета.
(M+H)+=402,2.
Стадия 2а

Фторид калия (99%) (12 г, 216 ммоль) добавляют к раствору 2-фторбензолсульфонил хлорида (10 г, 51 ммоль) в 1,4-диоксане (35 мл). Реакционную смесь кипятят в течение 24 часов, затем охлаждают до комнатной температуры и выливают в ледяную воду (200 мл). Ледяную воду экстрагируют хлороформом (3×50 мл). Объединенные слои хлороформа сушат (MgSO4), фильтруют и концентрируют с получением 2-фторбензолсульфонилфторида (2а) в виде бесцветного масла 6,7 г (74%). (M+H)+=177.
Стадия 2
К охлажденному до -75°С раствору бис-бок-индола 2 (500 мг, 1,25 ммоль) в ТГФ (25 мл) медленно добавляют трет-бутиллитий (1,47 мл, 2,5 ммоль). Реакционную смесь перемешивают в течение 30 минут с добавлением в это время 2-фторбензолсульфонил фторида 2а (222 мг, 1,5 ммоль). Реакционную смесь перемешивают 1,5 часа, в это время убирают ледяную баню и позволяют реакционной смеси согреться в течение более 45 минут. Реакционную смесь гасят насыщенным раствором хлорида аммония (55 мл). Затем смесь экстрагируют этилацетатом (3х20 мл). Объединенные слои этилацетата промывают солевым раствором (25 мл). Органический слой сушат (MgSO4), фильтруют и концентрируют с получением масла желтого цвета. Масло подвергают хроматографированию на силикагеле при элюировании гексаном/этилацетатом (17:3) с получением 300 мг (43%) 2-фенилсульфонил-4-пиперазин-1-ил-индола (1-3).
Стадия 3
2-Фенилсульфонил-4-пиперазин-1-ил индол (1-3) (300 мг, 0,54 ммоль) растворяют в 1М этанольном растворе HCl (30 мл) и нагревают до кипения. Через 2,5 часа реакционную смесь охлаждают до комнатной температуры и добавляют простой эфир (30 мл). Осадок серого цвета собирают с получением 150 мг (65%) дигидрохлорида продукта (6). (M+H)+=360.
Следующие примеры иллюстрируют, но не ограничивают данное изобретение.
2. Синтез 11-(пиперазин-1-ил)-7-фтор-8-хлор-5Н дибензо[b,е][1,4]диазепина:
Светло-желтое кристаллическое вещество. Выход 47.6%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.95 у.с.(1Н), 2.97 т.(4Н, J=4.6 Гц), 3.38-3.42 м. (4Н), 4.96 с. (1Н), 6.55 д. (1Н, J=9.3 Гц), 6.83 д. (1Н, J=7.8 Гц), 7.03-7.09 м. (2Н), 7.28-7.33 м. (2Н) [М+]: 330 (35Cl), 332 (37Cl); (C17H16FClN4).
3. Синтез 11-(4-метилпиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Светло-коричневое аморфное вещество. Выход 56.2%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 2.36 с. (3H), 2.50-2.54 м. (4Н), 3.61-3.64 м. (4Н), 5.02 с. (1Н), 6.55 д. (1Н, J=9.3 Гц), 6.83 д. (1Н, J=7.8 Гц), 7.03-7.09 м. (2Н), 7.27-7.34 м. (2Н) [M+]: 344 (35Cl), 346 (37Cl); (C18H18FClN3).
4. Синтез 5-метил-1 1-(4-метилпиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Темно-желтое масло. Выход 51.6%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 2.36 с. (3H), 2.51-2.54 м. (4Н), 3.41 с. (3H), 3.60-3.63 м. (4Н), 6.55 д. (1Н, J=9.3 Гц), 6.83 д. (1Н, J=7.8 Гц), 7.03-7.10 м. (2Н), 7.27-7.34 м. (2Н)
[М+]: 358 (35Cl), 360 (37Cl); (C19H20FClN4).
5. Синтез 11-(пиперидин-1-ил)-7-фтор-8-хлор-3-этил-5Н-дибензо[b,е][1,4]диазепина:
Светло-желтое кристаллическое вещество. Выход 43.7%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.18 т. (3H, J=7.4 Гц), 1.39-1.42 м. (2Н), 1.57-1.59 м. (4Н), 2.59 кв. (2Н, J=7.4 Гц), 3.58-3.62 м. (4Н), 6.55 д. (1Н, J=9.3 Гц), 6.88-6.91 м. (3H), 7.26-7.33 м. (2Н)
[М+]: 357 (35Cl), 359 (37Cl); (C20H21FClN3).
6. Синтез 11-(морфолин-4-ил)-7-фтор-3,8-дихлор-5Н-дибензо[b,е][1,4]диазепина:
Светло-желтое кристаллическое вещество. Выход 40.3%
1H-ЯМР спектр (CDCl3, δ, м.д.): 3.13-3.16 м. (4Н), 3.83-3.85 м. (4Н), 6.55 д. (1Н, J=9.3 Гц), 6.92 дд. (1Н, J=8.7 Гц, 1.9 Гц), 7.02-7.09 м. (3H), 7.36 д. (1Н, J=8.7 Гц)
[M+]: 365 (35Cl, 35Cl), 367 (35Cl, 37Cl); (C17H14FCl2N3O).
7. Синтез 11-(пирролидин-1-ил)-3,7-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Светло-желтое масло. Выход 49.5%
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.91-1.96 м. (4Н), 3.45-3.51 м. (4Н), 6.53-6.55 м. (2Н), 6.96 дд. (1Н, J-9.2 Гц, 8.7 Гц), 7.08 д. (1Н, J=7.3 Гц), 7.32-7.35 м. (2Н)
[M+]: 333 (35Cl), 335 (37Cl); (C17H14F2ClN3).
8. Синтез 11-(4-ацетилпиперазин-1-ил)-3,7-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Светло-желтое кристаллическое вещество. Выход 56.2%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 2.10 с. (3H), 2.71-2.74 м. (4Н), 3.55-3.60 м. (4Н), 4.99 с. (1Н), 6.52-6.55 м. (2Н), 6.96 дд. (1Н, J-9.2 Гц, 8.7 Гц), 7.08 д. (1Н, J=7.3 Гц), 7.31-7.34 м. (1Н)
[М+]: 390 (35Cl), 392 (37Cl); (C19H17F2ClN4O).
9. Синтез 7-гидрокси-3-метил-11-(пиперазин-1-ил)-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Светло-желтое кристаллическое вещество. Выход 52.8%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 2.01 у.с. (1Н), 2.36 с. (3H), 2.96-2.99 м. (4Н), 3.38-3.42 м. (4Н), 5.08 с. (1Н), 5.80 у.с. (1Н), 6.61-6.64 м. (2Н), 6.90 д. (1H J=1.9 Гц), 7.05 с. (1Н), 7.28 д. (1Н, J=8.7 Гц)
[М+]: 342 (35Cl), 344 (37Cl); (C18H19ClN4O).
10. Синтез 3-бром-5-метил-2-метокси-11-(пирролидин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Темно-желтое масло. Выход 43.7%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.92-1.98 м. (4Н), 3.39 с. (3H), 3.47-3.53 м. (4Н), 3.98 с. (3H), 6.56 д. (1Н, J=9.3 Гц), 7.00 с. (1Н), 7.08 д. (1Н, J=7.3 Гц), 7.38 с. (1Н)
[М+]: 437 (35Cl, 79Br), 439 (35Cl, 81Br), 441 (37Cl, 79Br); (C19H18FClBrN3O).
11. Синтез 5-метил-2-метокси-11-(пиперидин-1-ил)-7-фтор-5Н-дибензо[b,е][1,4]диазепина:
Светло-желтое кристаллическое вещество. Выход 57.3%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.39-1.42 м. (2Н), 1.57-1.59 м. (4Н), 3.37 с. (3H), 3.59-3.64 м. (4Н), 3.91 с. (3H), 6.53 дд. (1Н, J=9.3 Гц, 1.8 Гц), 6.77 дд. (1Н, J=8.3 Гц, 1.9 Гц), 6.93-6.99 м. (2Н), 7.30-7.36 м. (2Н)
[M+]: 339; (C20H22FN3O).
12. Синтез 5-метил-2-метокси-11-(морфолин-4-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Светло-желтое кристаллическое вещество. Выход 54.3%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 3.12-3.16 м. (4Н), 3.38 с. (3H), 3.82-3.84 м. (4Н), 3.87 с. (3H), 6.55 д. (1Н, J=9.3 Гц), 6.93-6.99 м. (2Н), 7.08 д. (1Н, J=7.3 Гц),7.29д.(1Н, J=1.9 Гц).
[M+]: 375 (35Cl), 377 (37Cl); (C19H19FClN3O2).
13. Синтез 5-метил-2-нитро-11-(пирролидин-1-ил)-7,9-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Ярко-желтое кристаллическое вещество. Выход 58%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.94-1.99 м. (4Н), 3.39 с. (3H), 3.50-3.56 м. (4Н), 6.64 д. (1Н, J=9.3 Гц), 7.32 д. (1Н, J=8.8 Гц), 7.94 дд. (1Н, J=8.8 Гц, 1.8 Гц), 8.41-8.43 м. (1Н)
[М+]: 392 (35Cl), 394 (37Cl); (C18H15F2ClN4O2).
14. Синтез 5-метил-11-(морфолин-4-ил)-7,9-дифтор-2,8-дихлор-5Н-дибензо[b,е][1,4]диазепина:
Кристаллическое вещество бежевого цвета. Выход 54.3%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 3.13-3.16 м. (4Н), 3.37 с. (3H), 3.80-3.83 м. (4Н), 6.64 д. (1Н, J=9.3 Гц), 6.85-6.90 м. (2Н), 7.16 дд. (1Н, J=8.8 Гц, 1.8 Гц)
[M+]: 397 (35Cl, 35Cl), 399 (37Cl, 37Cl); (C18H15F2Cl2N3O)
15. Синтез 5-метил-11-(4-метилпиперазин-1-ил)-2-(3-тиенил)-7,9-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Темно-желтое масло. Выход 49.3%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 2.38 с. (3H), 2.50-2.53 м. (4Н), 3.38 с. (3H), 3.61-3.64 м. (4Н), 6.64 д. (1Н, J=9.3 Гц), 6.88 д. (1Н, J=8.8 Гц), 7.08-7.13 м. (3H), 7.29 д. (1Н, J=1.8 Гц), 7.70 д. (1Н, J=1.9 Гц)
[М+]: 458 (35Cl), 460 (37Cl); (C23H21F2ClN4S).
16. Синтез 2-диметиламино-5-метил-11-(пирролидин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Темно-желтое масло. Выход 58.7%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.96-1.99 м. (4Н), 2.98 с. (6Н), 3.37 с. (3H), 3.45-3.49 м. (4Н), 6.55 д. (1Н, J=9.3 Гц), 6.73-6.79 м. (2Н), 6.89 д. (1Н, J=1.9 Гц), 7.08 д. (1Н, J=7.3 Гц)
[М+]: 372 (35Cl), 374 (37Cl); (C20H22FClN4).
17. Синтез 5-метил-2-метокси-11-(пирролидин-1-ил)-7-(3-тиенил)-5Н-дибензо[b,е][1,4]диазепина:
Темно-желтое масло. Выход 50.8%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.94-1.98 м. (4Н), 3.38 с. (3H), 3.44-3.49 м. (4Н), 3.90 с. (3H), 6.65-6.75 м. (3H), 6.96 д. (1Н, J=8.7 Гц), 6.99 д. (1Н, J=2.0 Гц), 7.11-7.18 м. (2Н), 7.35 д. (1Н, J=2.0 Гц), 7.68 д. (1Н, J=1.9 Гц)
[М+]: 389; (C23H23N3OS).
18. Синтез 7-гидрокси-11-(пирролидин-1-ил)-2-циано-5Н-дибензо[b,е][1,4]диазепина:
Светло-желтое кристаллическое вещество. Выход 45.3%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.95-1.99 м. (4Н), 3.49-3.61 м. (4Н), 5.08 с. (1H), 5.77 у.с. (1Н), 6.38-6.42 м. (1Н), 6.67 д. (1Н, J=8.3 Гц), 6.88 д. (1Н, J=1.9 Гц), 6.99 д. (1Н, J=8.4 Гц), 7.29 дд. (1Н, J=8.4 Гц, 1.9 Гц), 7.59 м. (1Н)
[M+]: 304; (C18H16N4O).
19. Синтез 11-(морфолин-4-ил)-8-нитро-2-фтор-5Н-дибензо[b,е][1,4]диазепина:
Ярко-желтое кристаллическое вещество. Выход 45.3%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 3.13-3.16 м. (4Н), 3.80-3.83 м. (4Н), 4.98 с. (1Н), 6.63-6.68 м. (1Н), 6.87-6.90 м. (1Н), 7.02 д. (1Н, J=8.4 Гц), 7.38 дд. (1Н, J=7.3 Гц, 2.0 Гц), 7.93 дд. (1Н, J=8.4 Гц, 1.9 Гц), 8.38 д. (1Н, J=1.9 Гц)
[M+]: 342; (C17H15FN4O3).
20. Синтез 8-диметиламино-11-(пирролидин-1-ил)-3,7-дифтор-5Н-дибензо[b,е][1,4]диазепина:
Темно-желтое масло. Выход 50.8%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.95-1.99 м. (4Н), 2.99 с. (6Н), 3.49-3.61 м. (4Н), 4.96 с. (1Н), 6.55-6.58 м. (2Н), 6.65 д. (1Н, J=7.3 Гц), 6.94 дд. (1Н, J=8.7 Гц, 1.9 Гц), 7.32-7.35 м. (1Н)
[M+]: 342; (C19H20F2N4).
21. Синтез 11-(пиперазин-1-ил)-7,9-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Светло-желтое кристаллическое вещество. Выход 48.6%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.98 у.с. (1Н), 2.96-2.99 м. (4Н), 3.38-3.42 м. (4Н), 4.97 с. (1Н), 6.56 д. (1Н, J=9.3 Гц), 6.83 д. (1Н, J=7.8 Гц), 7.03-7.06 м. (1Н), 7.28-7.34 м. (2Н)
[М+]: 348 (35Cl), 350 (37Cl); (C17H15F2ClN4).
22. Синтез 11-((пиперидин-4-он)-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Светло-желтое кристаллическое вещество. Выход 54.6%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 2.55-2.75 (м, 4Н), 3.35-3.72 (м, 4Н), 4.94 (с, 1Н), 6.55 (д, 1Н, J=9.1 Гц), 6.82 (д, 1Н, J=7.8 Гц), 7.03-7.12 (м, 2Н), 7.29-7.37 (м, 2Н)
[M+]: 343 (35Cl), 345 (37Cl); (C18H15FClN3O).
23. Синтез 5-(3-тиенил)-11-(4-метилпиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Темно-желтое масло. Выход 58.4%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 2.35 (с, 3H), 2.48-2.55 (м, 4Н), 3.42-3.51 (м, 4Н), 6.52 (д, 1Н, J=9.1 Гц), 6.78 (д, 1Н, J=1.8 Гц), 6.82-6.90 (м, 2Н), 7.07-7.15 (м, 2Н), 7.27 (дд, J=6.8 Гц, J=1.8 Гц), 7.30-7.35 (м, 2Н)
[M+]: 426 (35Cl), 428 (37Cl); (C22H20FClN4S).
24. Синтез 11-(3,4-диметилпирролидин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепина:
Темно-желтое масло. Выход 53.4%.
1H-ЯМР спектр (CDCl3, δ, м.д.): 1.13 (д, J=5.2 Гц) 1.85-1.94 (м, 2Н), 3.86-4.02 (м, 4Н), 4.92 (с, 1Н), 6.54 (д, 1Н, J=9.1 Гц), 6.81 (д, 1Н, J=7.8 Гц), 7.03-7.12 (м, 2Н), 7.28-7.33 (м, 2Н)
[М+]: 343 (35Cl), 345 (37Cl); (C19H19FClN3).
Изучение фармакологической активности соединений.
Оценка влияния на агрессивное поведение крыс, спровоцированное электроболевым раздражением через электрический пол.
Результаты опытов, иллюстрирующих влияние исследуемых препаратов на спровоцированное агрессивное поведение, представлены в таблице 1.

Показано, что клозапин вызывает увеличение латентного периода наступления агрессии и достоверное уменьшение общего времени пребывания в «стойках». Подобные эффекты зарегистрированы при введении заявляемых соединений.
Оценка влияния на поведение в «открытом поле».
Полученные результаты, иллюстрирующие влияние исследованных препаратов на поведение крыс в «открытом поле», представлены в таблице 2.
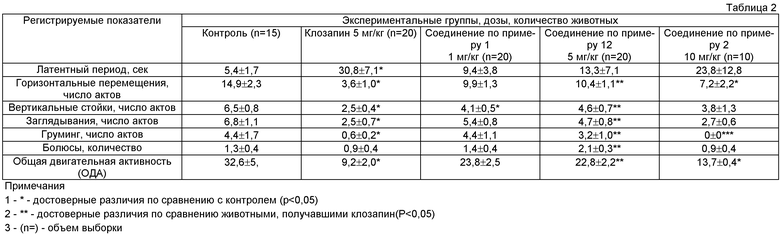
Как следует из данных, приведенных в таблице 2, клозапин обладает выраженным седативным действием, достоверно снижая практически все показатели двигательной активности. Наиболее близким к клозапину по седативному действию было соединение 2 в дозе 10 мг/кг, введение которого также обусловило снижение всех показателей двигательной активности, достоверное для ОДА и горизонтальных перемещений.
Изучение предстимульного торможения акустической стартл-реакции (АСР).
Данный тест является общепринятым в данной области для установления атипичной нейролептической активности.
В ходе эксперимента животных адаптировали в течение 5 минут в экспериментальной камере, на фоне воздействия фонового широкополосного шума интенсивностью 60 дБ. После окончания адаптации проводили сеанс тестирования, состоявший из трех серий. В первой и третьей сериях животным предъявляли по 5 сигналов, вызывающих стартл-реакцию (основной стимул), интенсивностью 110 дБ и длительностью 40 мс.
В ходе второй серии животным кроме основного стимула предъявляли сочетания предстимула (сигнала, не вызывающего стартл-реакции) с основным стимулом. Длительность предстимула составляла 100 мс, а интервал опережения (время между началом предстимула и началом основного стимула) составлял 120 мс.
Исходный уровень АСР оценивали как среднюю величину амплитуды реакций в течение первой серии. Показатель угашения АСР рассчитывали по формуле H=(m1-m3)/m1·100%, где m1 - среднее значение амплитуды в первой серии, a m3 - среднее значение амплитуды в четвертой серии. Предстимульное торможение АСР (ПСТ) оценивали по формуле:
(Ао-Ар)/Ао·100%, где Ao - средняя амплитуда АСР в пробах, не включающих предстимул, Ар - средняя амплитуда АСР в пробах, включающих предстимул. Величину ПСТ оценивали совокупно для предстимулов всех интенсивностей.
Кетамин вводили внутрибрюшинно в дозе 10 мг/кг в физиологическом растворе в объеме 1 мл/кг. Апоморфин вводили подкожно в дозе 1 мг/кг в физиологическом растворе, содержащем 0,1% аскорбиновую кислоту.
Клозапин и соединение согласно изобретению («препарат») предварительно растворяли в Tween-80 и доводили до конечного объема физиологическим раствором (концентрация Tween-80 составила 4%). Контрольным животным вводили 4% Tween-80. Клозапин и препарат вводили внутрибрюшинно за 30 минут до тестирования. Кетамин и апоморфин вводили за 15 минут до тестирования.
В эксперименте были использованы следующие группы животных:
1 - пассивный контроль (4% Tween-80 + физ. раствор) (n=6);
2. - активный контроль действия кетамина (4% Tween-80 + кетамин) (n=6);
3. - активный контроль действия апоморфина (4% Tween-80 + апоморфин) (n=7);
4. клозапин 10 мг/кг + кетамин (n=7);
5. клозапин 5 мг/кг + кетамин (n=6);
6. клозапин 10 мг/кг + апоморфин (n=6);
7. клозапин 5 мг/кг + апоморфин (n=6);
8. препарат по примеру 2 5 мг/кг + кетамин (n=7);
9. препарат по примеру 1 2 мг/кг + кетамин (n=6;
10. препарат по примеру 16 1 мг/кг + кетамин (n=6);
11. препарат по примеру 14 5 мг/кг + апоморфин (n=7);
12. препарат по примеру 10 2 мг/кг + апоморфин (n=6);
13. препарат по примеру 2 1 мг/кг + апоморфин (n=6).
Поскольку, по крайней мере, для апоморфина установлено влияние не только на уровень ПСТ, но и на исходную амплитуду, а также процесс угашения АСР (Sensory gating in rats depleted of dopamine as neonates: potential relevance to findings in schizophrenic patients. Schwarzkopf SB, Mitra T, Bruno JP Biol Psychiatry. 1992 Apr 15; 31(8):759-73), в ходе исследования эффективности препаратов указанные параметры также оценивались наряду с ПСТ.
Было обнаружено, что кетамин снижает базовый уровень АСР, нарушает процесс угашения реакции, а также подавляет предстимульное торможение (ПСТ). Исследуемые препараты в дозах 5 и 2 мг/кг восстанавливали уровень реакции, в дозе 5 мг/кг нормализовали угашение АСР и повышали ПСТ до значений, не демонстрирующих достоверных отличий от контрольных. В дозе 1 мг/кг препарат не оказывал существенного влияния ни на один из эффектов кетамина.
Апоморфин вызывает повышение базового уровня АСР, нарушает процесс угашения реакции, а также подавляет ПСТ. Препараты в дозе 5 мг/кг восстанавливали практически до контрольного уровня все оцениваемые параметры поведения, в дозе 2 мг/кг полностью нормализовали исходный уровень и угашение АСР, а также повышали ПСТ, которое, однако, не достигало контрольного уровня. В дозе 1 мг/кг препараты частично восстанавливали ПСТ, но не оказывали влияния на исходную амплитуду и угашение АСР.
Клозапин при введении с кетамином восстанавливал все исследуемые показатели АСР, а в дозе 5 мг/кг не был эффективен ни по одному из параметров.
При введении с апоморфином клозапин в дозе 10 мг/кг полностью восстанавливал базовую амплитуду и угашение АСР и частично - уровень ПСТ, а в дозе 5 мг/кг был неэффективен.
Таким образом, соединения согласно изобретению более эффективны, чем клозапин.
Соединение может быть применено в виде активного начала антипсихотического средства, которое представляет собой либо собственно вещество в виде субстанции, либо фармацевтическую композицию. Для того чтобы приготовить такие фармацевтические композиции, эффективное количество конкретного соединения в виде соли продукта присоединения кислоты или основания в качестве активного ингредиента тщательно смешивают с фармацевтически приемлемым носителем.
Носитель может находиться в разнообразных формах в зависимости от вида введения. Указанные фармацевтические композиции желательно изготавливать в виде единичной дозированной формы, пригодной, предпочтительно, для перорального или парентерального введения. Для получении композиций может быть использован любой из известных в фармацевтике носителей, таких как вода, гликоли, масла, спирты и подобные им вещества, крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, способствующие распаду лекарственной формы и подобные им вещества. В случае композиций для парентерального введения носитель обычно включает стерильную воду, по меньшей мере, большей частью, хотя могут быть включены и другие ингредиенты, например, для того, чтобы достичь растворимости. Например, могут быть приготовлены растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или нейтральные масла.
Суточные дозы от 0,01 до 20 мг/кг.
Исследованные соединения являются нетоксичными или малотоксичны.
Раствор для инъекций.
Соединение по примеру 2 50 мг
Гидроксианизол 0,5 мг
лауриновая кислота 0.5 мг
растительное масло 2 мл.
Соединения согласно изобретению могут быть полезны для получения препаратов для взрослых при острых и хронических формах шизофрении (особенно в период острых приступов), маниакальных состояниях (классическая мания, непродуктивная мания с бредом, атипичная мания), маниакально-депрессивном психозе, психомоторном возбуждении, различных психотических состояниях.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| АМИНОЗАМЕЩЕННЫЕ АНАЛОГИ ДИАРИЛ [a,d] ЦИКЛОГЕПТЕНА В КАЧЕСТВЕ МУСКАРИНОВЫХ АГОНИСТОВ И СПОСОБЫ ЛЕЧЕНИЯ ПСИХОНЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2004 |
|
RU2394030C2 |
| ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[1,5-a]ПИРИМИДИН-7-ИЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE2 | 2015 |
|
RU2659070C9 |
| ПРОИЗВОДНЫЕ ДИАРИЛАЛКАНОВ, СОДЕРЖАЩИЕ АЛИЦИКЛИЧЕСКУЮ ГРУППУ, ПРОЯВЛЯЮЩИЕ АНТАГОНИЗМ В ОТНОШЕНИИ СЕРОТОНИН-2-РЕЦЕПТОРОВ И/ИЛИ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ СКВАЛЕН-СИНТАЗЫ, КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ | 1997 |
|
RU2139277C1 |
| ЗАМЕЩЕННЫЕ СОЕДИНЕНИЯ ТИОФЕН- И ФУРАН-КОНДЕНСИРОВАННОГО АЗОЛОПИРИМИДИН-5-(6Н)-ОНА | 2013 |
|
RU2659779C2 |
| α,ω ДИАРИЛАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2105752C1 |
| 6,7-ДИГИДРО-5H-ПИРИДО[2,3-C]ПИРИДАЗИНОВЫЕ ПРОИЗВОДНЫЕ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ БЕЛКОВ BCLXL И ПРОАПОПТОТИЧЕСКИХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2020 |
|
RU2832191C2 |
| ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2013 |
|
RU2623221C2 |
| ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА КАК ИНГИБИТОРЫ RSV | 2016 |
|
RU2738232C2 |
| БИЦИКЛИЧЕСКИЕ КЕТОНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2797922C2 |
Изобретение относится к области химии, химико-фамацевтической промышленности и медицины и касается соединений формулы (1), которые могут быть полезны в качестве антипсихотических средств. Описанные соединения формулы (1) представляют собой производные 5Н-дибензо[b,е][1,4]диазепина или его фармакологически приемлемые соли с кислотой и применение этих соединений. Соединения формулы (1) обладают более высокой активностью по сравнению с клозапином. 2 н. и 6 з.п. ф-лы, 2 табл.
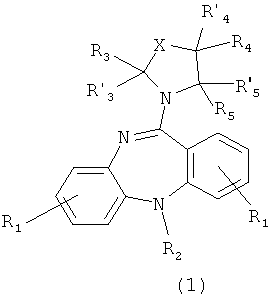
1. Соединение, представляющее собой производное 5Н-дибензо[b,е]1,4]диазепина общей формулы (I)
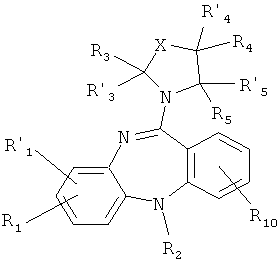
или его фармакологически приемлемую соль с кислотой, где
R1, R1 ' и R10 представляет собой каждый независимо H, C1-С6алкил, С1-С10алкокси, тиенил, гидроксил, галоген, амино, нитро-группу, нитрил;
R2 представляет Н, С1-С6алкил, тиенил;
R3, R' 3, R4, R' 4, R5 и R' 5 могут быть одинаковыми или различными и каждый независимо представляет Н, C1-С6алкил, С1-С10алкокси;
Х представляет либо группу общей формулы
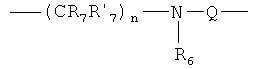
в которой n=0-4;
R6 представляет Н, C1-С6алкил;
R7 и R' 7 представляет Н, C1-С6алкил, C1-С10алкокси;
a Q выбран либо из группы, состоящей из:
 ,
, 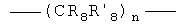 ,
, 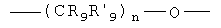 ;
;
R8, R' 8, R9 и R' 9 могут быть одинаковыми или различными и каждый независимо представляет Н, C1-С6алкил, C1-С10алкокси;
либо Q представляет валентную связь;
либо Х представляет группу общей формулы
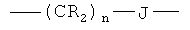 ,
,
в которой n=1-3, a J выбран из группы, состоящей из:
 ,
, 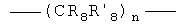 ,
, 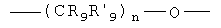 ;
;
R8, R' 8, R9 и R' 9 могут быть одинаковыми или различными и каждый независимо представляет Н, C1-С6алкил, С1-С10алкокси;
либо J представляет валентную связь;
при условии, что когда Q представляет собой связь, R6 - метил, R2, R3, R' 3, R4, R' 4, R5 и R' 5 - Н, а один из R1 ' и R1 является Н или Cl, то другой R1 ' и R1 не является Cl или Н соответственно, а также при условии, что когда Х представляет собой группу общей формулы
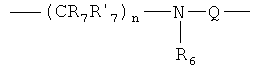
где R7 и R' 7 представляют собой Н, n=1, Q представляет собой связь, R3, R' 3, R4, R' 4, R5 и R' 5 представляют собой Н, то R10 во втором положении не представляет собой амино или нитро-группу.
2. Соединение по п.1, представляющее собой производное 5Н-дибензо[b,е][1,4]диазепина общей формулы (1.1)
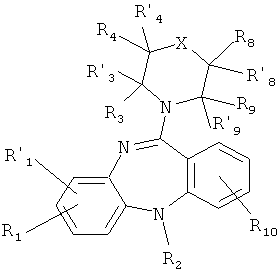
или его фармакологически приемлемую соль с кислотой, где
X, R1, R' 1, R2, R3, R' 3, R4, R' 4, R8, R' 8, R9, R' 9 и R10 имеют значения, определенные выше для формулы 1.
3. Соединение по п.1, представляющее собой производное 5Н-дибензо[b,е][1,4]диазепина общей формулы (1.2)
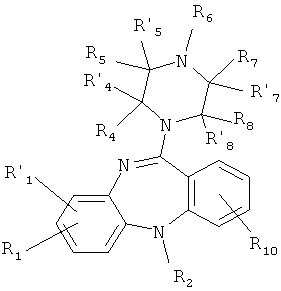
или его фармакологически приемлемую соль с кислотой, где
R1, R' 1, R2, R4, R' 4, R5, R' 5, R6, R7, R' 7, R8, R' 8 и R10 имеют значения, определенные выше для формулы 1.
4. Соединение по п.1, представляющее производное 5Н-дибензо[b,е][1,4]диазепина общей формулы (1.3)
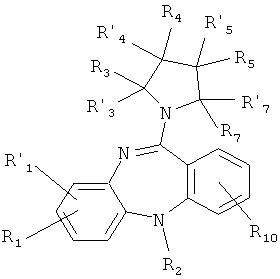
или его фармакологически приемлемую соль с кислотой, где
R1, R' 1, R2, R3, R' 3, R4, R' 4, R5, R' 5, R7, R' 7 и R10 имеют значения, определенные выше для формулы 1.
5. Соединение по п.2, представляющее собой соединение, выбранное из группы:
11-(пиперидин-1-ил)-7-фтор-8-хлор-3-этил-5Н-дибензо[b,е][1,4]диазепин,
11-(морфолин-4-ил)-7-фтор-3,8-дихлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-2-метокси-11-(пиперидин-1-ил)-7-фтор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-2-метокси-11-(морфолин-4-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-11-(морфолин-4-ил)-7,9-дифтор-2,8-дихлор-5Н-дибензо[b,е][1,4]диазепин,
11-(морфолин-4-ил)-8-нитро-2-фтор-5Н-дибензо[b,е][1,4]диазепин,
11-((пиперидин-4-он)-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин.
6. Соединения по п.3, представляющие собой соединение, выбранное из группы:
11-(пиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин (7-фтор-N-десметилклозапин),
11-(4-метилпиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин(7-фторклозапин),
5-метил-11-(4-метилпиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
11-(4-ацетилпиперазин-1-ил)-3,7-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
7-гидрокси-3-метил-11-(пиперазин-1-ил)-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-11-(4-метилпиперазин-1-ил)-2-(3-тиенил)-7,9-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
11-(пиперазин-1-ил)-7,9-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-(3-тиенил)-11-(4-метилпиперазин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин.
7. Соединения по п.4, представляющие собой соединение, выбранное из группы:
11-(пирролидин-1-ил)-3,7-дифтор-8-хлор-5Ндибензо[b,е][1,4]диазепин,
3-бром-5-метил-2-метокси-11-(пирролидин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-2-нитро-11-(пирролидин-1-ил)-7,9-дифтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
2-диметиламино-5-метил-11-(пирролидин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин,
5-метил-2-метокси-11-(пирролидин-1-ил)-7-(3-тиенил)-5Н-дибензо[b,е][1,4]диазепин,
7-гидрокси-11-(пирролидин-1-ил)-2-циано-5Н-дибензо[b,е][1,4]диазепин,
8-диметиламино-11-(пирролидин-1-ил)-3,7-дифтор-5Н-дибензо[b,е][1,4]диазепин,
11-(3,4-диметилпирролидин-1-ил)-7-фтор-8-хлор-5Н-дибензо[b,е][1,4]диазепин.
8. Применение соединения по любому из пп.1-7 в качестве активного начала для получения антипсихотического средства.
| Способ очистки пирогаза | 1978 |
|
SU712114A1 |
| ЭНЕРГОПРЕОБРАЗУЮЩЕЕ ГЕЛИОУСТРОЙСТВО | 1991 |
|
RU2006674C1 |
| Орудие для предпосевной обработки почвы | 1978 |
|
SU1042634A1 |
| NL 6715650 A, 17.06.1968 | |||
| SU 1713245 A, 27.02.1996. | |||
Авторы
Даты
2012-02-10—Публикация
2010-05-13—Подача