ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям, которые могут быть использованы в качестве ингибиторов киназ Janus (JAK). Настоящее изобретение также относится к соединениям, которые могут быть использованы в качестве ингибиторов киназы Aurora-2, киназы Flt3, киназы GSK-3 и KDR. Изобретение также включает фармацевтически приемлемые композиции, содержащие соединения изобретения, а также способы применения композиций в лечении различных расстройств.
УРОВЕНЬ ТЕХНИКИ
Киназы Janus (JAK) - семейство тирозин-киназ, включающее JAK1, JAK2, JAK3 и TYK2. Киназы JAK играют важную роль в передаче сигналов посредством цитокинов. Субстратами киназ семейства JAK, нижерасположенными по каскаду, являются белки - переносчики сигнала и активаторы транскрипции (STAT). JAK/STAT сигнализация опосредует многие виды ненормальных иммунных реакций, таких как аллергия, астма, аутоиммунные заболевания, так же как отторжение трансплантата, ревматоидный артрит, боковой амиотрофический склероз и рассеянный склероз, а также солидных и гематологических злокачественных процессов, таких как лейкемии и лимфомы. JAK2 также участвуют в развитии миелопролиферативных заболеваний, включающих истинную полицитемию, эссенциальную тромбоцитемию, хронический идиопатический миелофиброз, миелоидную метаплазию с миелофиброзом, хронический миелолейкоз, хронический моноцитарный миелолейкоз, хронический эозинофильный лейкоз, синдром гиперэозинофилии и системный мастоцитоз.
WO2004/046120 раскрывает диаминотриазолы, которые могут быть использованы в качестве ингибиторов протеинкиназ, включая Flt3, FMS, c-Kit, PDGFR, JAK, подсемейство протеинкиназ AGC, CDK, GSK, Src, ROCK и/или Syk. Тем не менее существует необходимость в разработке соединений, которые являются более избирательными ингибиторами протеинкиназ, в частности ингибиторами Aurora-2, Flt3, KDR, JAK2 и JAK3. В особенности желаемой представляется разработка соединений, которые могут быть использованы в качестве ингибиторов киназ семейства JAK.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Известно, что соединения по настоящему изобретению, а также фармацевтически приемлемые композиции на их основе, эффективны в качестве ингибиторов протеинкиназ. В некоторых воплощениях, соединения по настоящему изобретению и фармацевтически приемлемые композиции на их основе эффективны в качестве ингибиторов протеинкиназ GSK-3, JAK-2, JAK-3, Flt3, KDR или Aurora-2. В предпочтительных воплощениях указанные соединения по настоящему изобретению и фармацевтически приемлемые композиции являются ингибиторами JAK-2 или JAK-3. Эти соединения имеют общую формулу I:
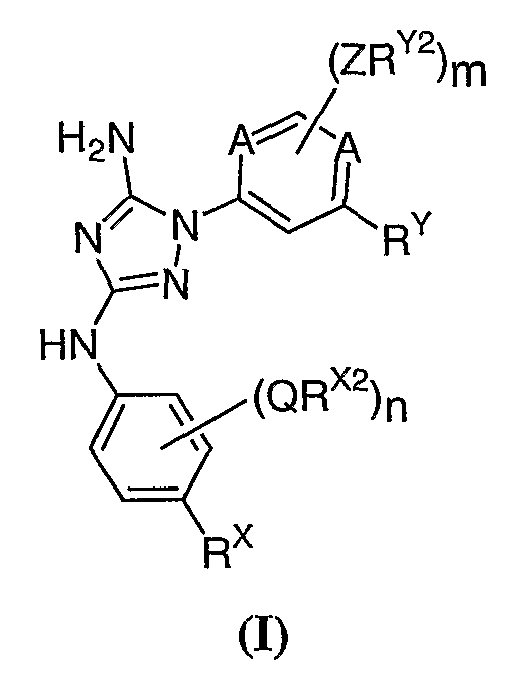
или их фармацевтически приемлемые производные с различными значениями заместителей, которые указаны в настоящем описании.
Указанные соединения и фармацевтические композиции на их основе применимы для лечения или профилактики различных заболеваний, включая, без ограничения, аллергии, астму, аутоиммунные заболевания, такие как отторжение трансплантата, ревматоидный артрит, боковой амиотрофический склероз и рассеянный склероз, а также солидные и гематологические злокачественные процессы, такие как лейкозы и лимфомы. Соединения и фармацевтические композиции на их основе также могут быть использованы для лечения или профилактики миелопролиферативных заболеваний, включающих истинную полицитемию, эссенциальную тромбоцитемию, хронический идиопатический миелофиброз, миелоидную метаплазию с миелофиброзом, хронический миелолейкоз, хронический моноцитарный миелолейкоз, хронический эозинофильный лейкоз, синдром гиперэозинофилии и системный мастоцитоз.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения и общая терминология
Как используют в настоящем описании, следующие определения будут представлены, если иное не определено. Для осуществления задач настоящего изобретения химические элементы определяют в соответствии с Периодической системой элементов Менделеева, CAS version, Handbook of Chemistry and Physics, 75th Ed. Дополнительно, общие принципы органической химии описаны в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999; "March's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M.B. и March, J., John Wiley & Sons, New York: 2001; "Encyclopedia of Organic Transformations"; Ed.: Richard C. Larock, John Wiley & Sons, New York: 1999; "Encyclopedia of Reagents for Organic Synthesis" Ed.: Leo A. Paquette, John Wiley & Sons, New York: 1995; T.W. Greene & P.G.M Wutz, "Protective Groups в Organic Synthesis", 3rd Edition, John Wiley & Sons, Inc. (1999)(и более ранние издания), полное содержание которых при этом включено в виде ссылки.
Как представлено в настоящем описании, соединения по изобретению могут необязательно быть замещены с помощью одного или большего числа заместителей, таких как представленные в целом выше, или как показано с помощью отдельных классов, подклассов и групп по изобретению. Определено, что выражение "необязательно замещенный" используют поочередно с выражением "замещенный или незамещенный". В целом, термин "замещенный", или предшествует термину "необязательно" или нет, относится к замещению радикалов водорода в установленной структуре радикалом конкретного заместителя. Если иное не обозначено, необязательно замещенная группа может иметь заместитель по каждому подходящему положению группы, и, когда более чем одно положение в любой установленной структуре может быть замещено с помощью большего числа, чем один заместитель, выбранный из конкретной группы, заместитель может быть или одинаковым или различным на каждом положении. Комбинации заместителей, представленные с помощью настоящего изобретения, являются предпочтительными, вследствие того что результатом является образование стабильных или химически осуществимых соединений. Термин "стабильный", как его используют в настоящем изобретении, относится к соединениям, которые существенно не изменяются в условиях их получения, определения и предпочтительно их выделения, очистки и применения для одного или большего числа целей, раскрытых в настоящем изобретении. В некоторых воплощениях, стабильное соединение или химически осуществимое соединение то, которое существенно не изменяется при температуре 40°C или меньше в отсутствие влажности или других химически реактивных условий, по крайней мере, в течение недели.
Термин "алифатический" или "алифатическая группа", как его используют в настоящем описании, означает прямую (то есть неразветвленную) или разветвленную, замещенную или незамещенную углеводородную цепь, которая является полностью насыщенной или которая содержит одно или большее число единиц ненасыщенности, или моноциклический углеводород или бициклический углеводород, который является полностью насыщенным или который содержит одно или большее число единиц ненасыщенностей, но который не является ароматическим (также указанный в настоящем изобретении как термины "карбоцикл", "циклоалифатический" или "циклоалкил"), который имеет единственное место присоединения к остатку молекулы. Если иное не указано, алифатические группы содержат 1-20 алифатических атомов углерода. В некоторых воплощениях, алифатические группы содержат 1-10 алифатических атомов углерода. В других воплощениях алифатические группы содержат 1-8 алифатических атомов углерода. В еще других воплощениях, алифатические группы содержат 1-6 алифатических атомов углерода, и в еще других воплощениях алифатические группы содержат 1-4 алифатических атомов углерода. В некоторых воплощениях, термин "циклоалифатический" (или "карбоцикл", или "циклоалкил") относится к моноциклическому С3-8 углеводороду или бициклическому C8-12 углеводороду, который является полностью насыщенным или который содержит одно или большее число единиц ненасыщенностей, но который не является ароматическим, который имеет единственное место присоединения к остатку молекулы, где любое отдельное кольцо в указанной бициклической кольцевой системе имеет 3-7 членов. Подходящие алифатические группы включают, но без ограничения, линейные или разветвленные, замещенные или незамещенные алкильные, алкенильные, алкинильные группы и их гибриды, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил.
Термин "гетероалифатический", как его используют в настоящем изобретении, означает алифатические группы, где один или два атома углерода независимо замещены с помощью одного или большего числа атомов кислорода, серы, азота, фосфора или кремния. Гетероалифатические группы могут быть замещенными или незамещенными, разветвленными или неразветвленными, циклическими или нециклическими и включают "гетероцикл", "гетероциклильную", "гетероциклоалифатическую" или "гетероциклическую" группы.
Термин "гетероцикл", "гетероциклил", "гетероциклоалифатический" или "гетероциклический", как его используют в настоящем описании, означает неароматическую, моноциклическую, бициклическую или трициклическую кольцевую систему, в которой один или большее число членов кольца является независимо выбранным из гетероатома. В некоторых воплощениях "гетероцикл", "гетероциклил", "гетероциклоалифатический" или "гетероциклическая" группа имеет от трех до четырнадцати членов кольца, в которых одно или большее число членов кольца является гетероатомом, независимо выбранным из кислорода, серы, азота, или фосфора, и каждое кольцо в системе содержит от 3 дo 7 членов кольца.
Примеры гетероциклических колец включают бензимидазолон (например, 3-1H-бензимидазол-2-он, 3-(1-алкил)-бензимидазол-2-он), тетрагидрофуранил (например, 2-тетрагидрофуранил, 3-тетрагидрофуранил), тетрагидротиофенил (например, 2-тетрагидротиофенил, 3-тетрагидротиофенил), морфолино (например, 2-морфолино, 3-5-морфолино, 4-морфолино), тиоморфолино (например, 2-тиоморфолино, 3-тиоморфолино, 4-тиоморфолино), пирролидинил (например, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил), тетрагидропиперазинил (например, 1-тетрагидропиперазинил, 2-тетрагидропиперазинил, 3-тетрагидропиперазинил), пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил), пиразолинил (например, 1-пиразолинил, 3-пиразолинил, 4-пиразолинил, 5-пиразолинил), тиазолидинил (например, 2-тиазолидинил, 3-тиазолидинил, 4-тиазолидинил), имидазолидинил (например, 1-имидазолидинил, 2-имидазолидинил, 4-имидазолидинил, 5-имидазолидинил), индолинил, тетрагидрохинолинил, тетрагидроизохинолинил, бензотиолан, бензодитиан и дигидроимидазол-2-он (1,3-дигидроимидазол-2-он).
Термин "гетероатом" означает одно или большее число атомов кислорода, серы, азота, фосфора или кремния (включая любую окисленную форму атомов азота, серы, фосфора или кремния; кватернизированную форму любого основного атома азота или замещаемого атома азота гетероциклического кольца, например N (как в 3,4-дигидро-2Н-пирролиле), NН (как в пирролидиниле) или NR+ (как в N-замещенном пирролидиниле)).
Термин "ненасыщенный", как его используют в настоящем изобретении, означает, что остаток имеет одно или большее число единиц ненасыщенностей.
Термин "алкокси" или "тиоалкил", как его используют в настоящем изобретении, относится к алкильной группе, как ранее определено, присоединенной к основной углеродной цепи через атом кислорода ("алкокси") или атом серы ("тиоалкил").
Термины "галогеналкил", "галогеналкенил" и "галогеналкокси" означают алкил, алкенил или алкокси, которые могут быть замещены с помощью одного или большего числа атомов галогена. Термин "галоген" означает F, Cl, Br или I.
Термин "арил", используемый сам по себе или как часть большого остатка, как в терминах "аралкил", "аралкокси" или "арилоксиалкил", относится к моноциклическим, бициклическим и трициклическим кольцевым системам, имеющим, как правило, от пяти до четырнадцати членов кольца, где, по крайней мере, одно кольцо в системе является ароматическим и где каждое кольцо в системе содержит от 3 до 7 членов кольца. Термин "арил" может быть взаимозаменяемым с термином "арильное кольцо". Термин "арил" также относится к гетероарильной кольцевой системе, как определено в настоящем описании ниже.
Термин "гетероарил", используемый сам по себе или как часть большого остатка, как в терминах "гетероаралкил" или "гетероарилалкокси", относится к моноциклическим, бициклическим и трициклическим кольцевым системам, имеющим, как правило, от пяти до четырнадцати членов кольца, где, по крайней мере, одно кольцо в системе является ароматическим, по крайней мере, одно кольцо в системе содержит одно или большее число гетероатомов, и где каждое кольцо в системе содержит от 3 до 7 членов кольца. Термин "гетероарил" может быть использован поочередно с термином "гетероарильное кольцо" или термином "гетероароматический".
Примеры гетероарильных колец включают фуранил (например, 2-фуранил, 3-фуранил), имидазолил (например, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил) бензимидазолил, изоксазолил (например, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил), оксазолил (например, 2-оксазолил, 4-оксазолил, 5-оксазолил), пирролил (например, N-пирролил, 2-пирролил, 3-пирролил), пиридил (например, 2-пиридил, 3-пиридил, 4-пиридил), пиримидинил (например, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил), пиридазинил (например, 3-пиридазинил), тиазолил (например, 2-тиазолил, 4-тиазолил, 5-тиазолил), тетразолил (например, 5-тетразолил), триазолил (например, 2-триазолил и 5-триазолил), тиенил, (например, 2-тиенил, 3-тиенил), бензофурил, тиофенил, бензотиофенил, индолил (например, 2-индолил), пиразолил (например, 2-пиразолил), изотиазолил, оксадиазолил (например, 1,2,3-оксадиазолил), оксадиазолил (например, 1,2,5-оксадиазолил), оксадиазолил (например, 1,2,4-оксадиазолил), триазолил (например, 1,2,3-триазолил), тиадиазолил (например, 1,2,3-тиадиазолил), тиадиазолил (например, 1,3,4-тиадиазолил), тиадиазолил (например, 1,2,5-тиадиазолил), пуринил, пиразинил, триазинил (например, 1,3,5-триазинил), хинолинил (например, 2-хинолинил, 3-хинолинил, 4-хинолинил) и изохинолинил (например, 1-изохинолинил, 3-изохинолинил или 4-изохинолинил).
Арильная (включая аралкил, аралкокси, арилоксиалкил и им подобные) или гетероарильная (включая гетероаралкил и гетероарилалкокси и им подобные) группа может содержать одно или большее число заместителей. Подходящие заместители на ненасыщенном атоме углерода арильной или гетероарильной группы выбраны из галогена; -R°; -OR°; -SR°; 1,2-метилендиокси; 1,2-этилендиокси; фенила (Ph), необязательно замещенного с помощью R°; -O(Ph), необязательно замещенного с помощью R°; -(CH2)1-2(Ph), необязательно замещенного с помощью R°; -CH=CH(Ph), необязательно замещенного с помощью R°; -NO2; -CN; -N(R°)2; -NR°C(O)R°; -NR°C(S)R°; -NR°C(O)N(R°)2; -NR°C(S)N(R°)2; -NR°CO2R°; -NR°NR°C(O)R°; -NR°NR°C(O)N(R°)2; -NR°NR°CO2R°; -C(O)C(O)R°; -C(O)CH2C(O)R°; -CO2R°; -C(O)R°; -C(S)R°; -C(О)N(R°)2; -C(S)N(R°)2; -C(=NH)-N(R°)2, -OC(O)N(R°)2; -OC(O)R°; -C(O)N(OR°)R°; -C(NOR°)R°; -S(O)2R°; -S(O)3R°; -SO2N(R°)2; -S(O)R°; -NR°SO2N(R°)2; -NR°SO2R°; -N(OR°)R°; -C(=NH)-N(R°)2 или -(CH2)0-2NHC(O)R°, где при каждом независимом появлении R° выбран из водорода, необязательно замещенного С1-6 алифатического, незамещенного 5-6-членного гетероарильного или гетероциклического кольца, фенила, -O(Ph), или -CH2(Ph), или, несмотря на то, как определено выше, при двух независимых появлениях R°, на одном и том же самом заместителе или на различных заместителях, взятых вместе с атомом(атомами), с которым каждая R° группа связана, образуется 5-8-членный гетероцикл, арил или гетероарильное кольцо или 3-8-членное циклоалкильное кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы. Необязательные заместители на алифатической группе R° выбраны из NH2, NH(C1-4 алифатической группы), N(C1-4 алифатической группы)2, галогена, C1-4 алифатической группы, OH, O(C1-4 алифатической группы), NO2, CN, CO2H, CO2(C1-4 алифатической группы), O(галоген C1-4 алифатической группы) или галоген(C1-4 алифатической группы), где каждая из вышеупомянутых C1-4 алифатических групп R° является незамещенной.
Алифатическая или гетероалифатическая группа или неароматическое гетероциклическое кольцо может содержать одно или большее число заместителей. Подходящие заместители на насыщенной углеродной алифатической или гетероалифатической группе или неароматическом гетероциклическом кольце выбраны из тех, которые перечислены выше для ненасыщенной углеродной арильной или гетероарильной группы и дополнительно включают следующие: =O, =S, =NNHR*, =NN(R*)2, =NNHC(O)R*, =NNHCO2(алкил), =NNHSO2(алкил) или =NR*, где каждый R* независимо выбран из водорода или необязательно замещенной C1-6 алифатической группы. Необязательные заместители на алифатической группе R* выбраны из NH2, NH(C1-4 алифатической группы), N(C1-4 алифатической группы)2, галогена, C1-4 алифатической группы, OH, O(C1-4 алифатической группы), NO2, CN, CO2H, CO2(C1-4 алифатической группы), O(галоген C1-4 алифатической группы) или галоген(C1-4 алифатической группы), где каждая из вышеупомянутых C1-4 алифатических групп R* является незамещенной.
Необязательные заместители при атоме азота неароматического гетероциклического кольца выбраны из -R+,-N(R+)2, -C(O)R+, -CO2R+, -C(O)C(O)R+, -C(O)CH2C(O)R+, -SO2R+, -SО2N(R+)2, -C(=S)N(R+)2, -C(=NH)-N(R+)2 или -NR+SO2R+; где R+ представляют собой водород, необязательно замещенную С1-6 алифатическую группу, необязательно замещенный фенил, необязательно замещенный -O(Ph), необязательно замещенный -CH2(Ph), необязательно замещенный -(CH2)1-2(Ph); необязательно замещенный -CH=CH(Ph) или незамещенное 5-6-членное гетероарильное или гетероциклическое кольцо, имеющее от одного до четырех гетероатомов, независимо выбранных из кислорода, азота или серы, или, несмотря на то, как определено выше, два независимых появления R+ на одном и том же самом заместителе или различных заместителях, взятые вместе с атомом(атомами), с которым каждая R+ группа связана, образуют 5-8-членный гетероцикл, арил или гетероарильное кольцо или 3-8-членное циклоалкильное кольцо, имеющее 0-3 гетероатомов, независимо выбранных из азота, кислорода или серы. Необязательные заместители на алифатической группе или фенильном кольце R+ выбраны из NН2, NH(C1-4 алифатической группы), N(C1-4 алифатической группы)2, галогена, C1-4 алифатической группы, OH, O(C1-4 алифатической группы), NO2, CN, CO2H, CO2(C1-4 алифатической группы), O(галоген C1-4 алифатической группы) или галоген(C1-4 алифатической группы), где каждая из вышеупомянутых C1-4 алифатических групп R+ является незамещенной.
Термин "алкилиденовая цепь" относится к прямой или разветвленной углеродной цепи, которая может быть полностью насыщенной или иметь одно или большее число единиц ненасыщенности и иметь две точки присоединения к остальной молекуле.
Как определено выше, в некоторых воплощениях, два независимых появления R° (или R+, или любого другого переменного, аналогично определенного в настоящем изобретении), взятые вместе с атомом(атомами), с которым каждая переменная связана, образуют 5-8-членный гетероцикл, арил или гетероарильное кольцо или 3-8-членное циклоалкильное кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы. Примеры колец, которые образуются при двух независимых появлениях R° (или R+, или любого другого переменного, аналогично определенного в настоящем изобретении), взятые вместе с атомом(атомами), с которым каждая переменная связана, включают, но без ограничения следующие: а) два независимых появления R° (или R+, любого другого переменного, аналогично определенного в настоящем изобретении), которые связаны с одним и тем же атомом и взяты вместе с тем атомом, чтобы образовать кольцо, например N(R°)2, где оба появления R°, взятые вместе с атомом азота, образуют пиперидин-1-иловую, пиперазин-1-иловую или морфолин-4-иловую группу; и b) два независимых появления R° (или R+, любого другого переменного, аналогично определенного в настоящем изобретении), которые связаны с различными атомами и взяты вместе с обоими этими атомами, образуют кольцо, например, где фенильная группа замещена с помощью двух заместителей OR°
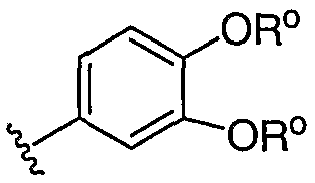 ,
,
эти два появления R°, взятые вместе с атомами кислорода, с которыми они связаны, образуют конденсированное 6-членное содержащее атом кислорода кольцо
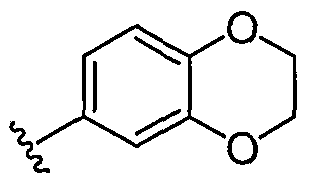 .
.
Необходимо понимать, что может быть сформировано многообразие других колец, когда два независимых появления R° (или R+, любого другого переменного, аналогично определенного в настоящем изобретении) взяты вместе с атомом(атомами), с которым каждая переменная связана, и примеры которых, конкретизированные выше, не предназначены для ограничения.
Если иное не установлено, структуры, описанные в настоящем изобретении, также означают включение всех изомерных (например, энантиомерных, диастереомерных и геометрических (или конформационных)) форм структуры; например R и S конфигурации каждого асимметричного центра, (Z) и (E) изомеры с двойной связью и (Z) и (E) конформационные изомеры. Следовательно, одиночные стереохимические изомеры, так же как энантиомерные, диастереомерные и геометрические (или конформационные) смеси представленных соединений, находятся в границах настоящего изобретения. Если иное не установлено, все таутомерные формы соединений по изобретению находятся в границах настоящего изобретения. Кроме того, если иное не установлено, структуры, описанные в настоящем изобретении, также означают включение соединений, которые отличаются только в присутствии одного или большего числа изотопически обогащенных атомов. Например, соединения, имеющие настоящие структуры, за исключением замещения водорода с помощью дейтерия или трития или замещения 12C углерода с помощью 13C или 14C углерода, находятся в границах настоящего изобретения. Такие соединения являются полезными, например, в качестве аналитических инструментов или проб в биологических опытах.
Описание соединений по изобретению
Изобретение обеспечивает соединение формулы I:
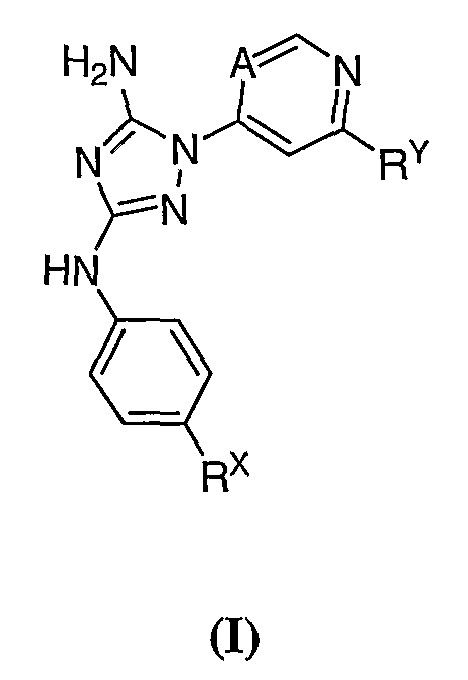
или его фармацевтически приемлемую соль, производное или пролекарство,
где A представляет собой N или CR1;
R1 представляет собой Н, галоген или С1-6 алкил;
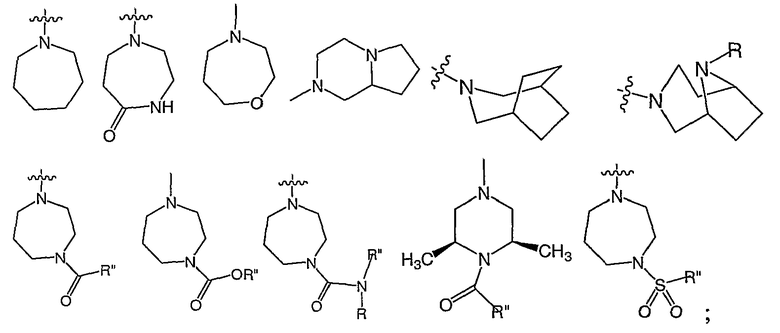
RХ выбран из
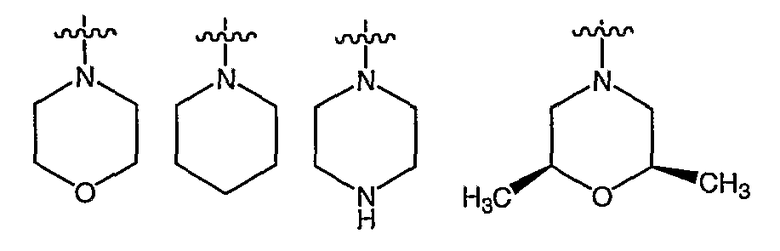
RУ выбран из
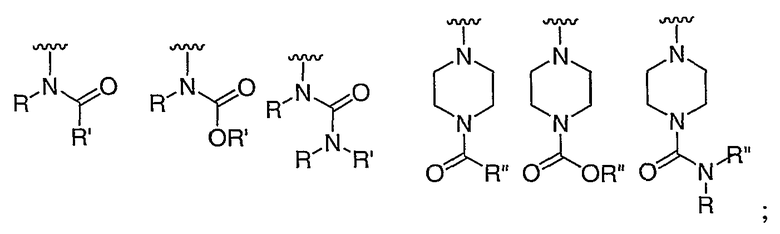
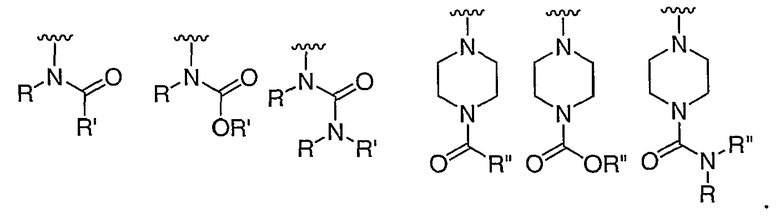
при каждом появлении R его независимо выбирают из водорода или C1-6 алифатической группы, необязательно замещенной с помощью J или J'; и
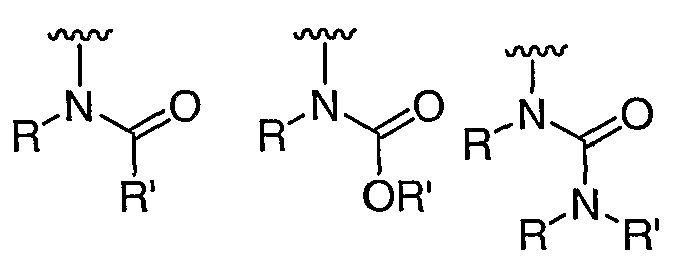
R' независимо выбран из водорода или группы, выбранной из C1-8 алифатической группы, необязательно замещенной с помощью вплоть до трех заместителей J или J', C6-10 арила, необязательно замещенного с помощью вплоть до трех заместителей J, гетероарильного кольца, имеющего 5-10 атомов кольца, необязательно замещенного с помощью вплоть до трех заместителей J, или гетероциклического кольца, имеющего 3-10 атомов кольца, необязательно замещенного с помощью вплоть до трех заместителей J или J', или где R и R', взятые вместе, образуют 5-8-членный циклоалкил, гетероцикл, арил или гетероарильное кольцо, имеющее 0-3 гетероатомов, независимо выбранных из азота, кислорода или серы, каждое кольцо необязательно и независимо замещено с помощью вплоть до трех заместителей J;
при каждом появлении R" его независимо выбирают из водорода или группы, выбранной из C1-8 алифатической группы, необязательно замещенной с помощью вплоть до трех заместителей J или J', C6-10 арила, необязательно замещенного с помощью вплоть до трех заместителей J, гетероарильного кольца, имеющего 5-10 атомов кольца, необязательно замещенного с помощью вплоть до трех заместителей J, или гетероциклического кольца, имеющего 3-10 атомов кольца, необязательно замещенного с помощью вплоть до трех заместителей J или J',
или, где R и R", взятые вместе, образуют 5-8-членный циклоалкил, гетероцикл, арил или гетероарильное кольцо, имеющее 0-3 гетероатомов, независимо выбранных из азота, кислорода или серы, каждое кольцо необязательно и независимо замещено с помощью вплоть до трех заместителей J;
при каждом появлении J его независимо выбирают из галогена; -R°; -OR°; -SR°; 1,2-метилендиокси; 1,2-этилендиокси; фенила (Ph), необязательно замещенного с помощью R°; -О(Ph), необязательно замещенного с помощью R°; -(CH2)1-2(Ph), необязательно замещенного с помощью R°; -CH=CH(Ph), необязательно замещенного с помощью R°; -NO2; -CN; -N(R°)2; -NR°C(O)R°; -NR°C(S)R°; -NR°C(O)N(R°)2; -NR°C(S)N(R°)2; -NR°CO2R°; -NR°NR°C(O)R°; -NR°NR°C(O)N(R°)2; -NR°NR°CO2R°; -C(O)C(O)R°; -C(O)C(O)OR°, -C(О)C(О)N(R°)2, -C(O)CH2C(O)R°; -CO2R°; -C(O)R°; -C(S)R°; -C(S)OR°, -C(О)N(R°)2; -C(S)N(R°)2; -C(=NH)-N(R°)2, -OC(O)N(R°)2; -OC(O)R°; -C(O)N(OR°)R°; -C(NOR°)R°; -S(O)2R°; -S(O)3R°; -SO2N(R°)2; -S(O)R°; -NR°SO2N(R°)2; -NR°SO2R°; -N(OR°)R°; -C(=NH)-N(R°)2; C(=NOR°)R°; (CH2)0-2NHC(O)R°; -P(O)2R°; -PO(R°)2; -OPO(R°)2 или -P(O)(H)(OR°);
где при каждом независимом появлении R° его выбирают из водорода, необязательно замещенной C1-6 алифатической группы, необязательно замещенного 5-6-членного гетероарильного или гетероциклического кольца, необязательно замещенного фенила (Ph); необязательно замещенного -O(Ph); необязательно замещенного -(CH2)1-2(Ph); необязательно замещенного -CH=CH(Ph); или, два независимых появления R° на одном и том же самом заместителе или различных заместителях, взятые вместе с атомом(атомами), с которым каждая R° группа связана, образуют 5-8-членный гетероцикл, арил или гетероарильное кольцо или 3-8-членное циклоалкильное кольцо, имеющее 0-3 гетероатомов, независимо выбранных из азота, кислорода или серы;
где заместитель для алифатической группы R° представляет собой необязательно замещенный гетероарил, необязательно замещенную гетероциклическую группу, NH2, NH(C1-6 алифатическую группу), N(C1-6 алифатическую группу)2, галоген, C1-6 алифатическую группу, OH, O(C1-6 алифатическую группу), NO2, CN, CO2H, CO2(C1-6 алифатическую группу), O(галоген С1-6 алифатическую группу) или галоген(C1-6 алифатическую группу), где каждая из указанных алифатических групп R° является незамещенной;
где заместитель для фенильной, гетероарильной или гетероциклической группы R° представляет собой C1-6 алифатическую группу, NH2, NH(C1-4 алифатическую группу), N(C1-6 алифатическую группу)2, галоген, C1-6 алифатическую группу, OH, O(C1-6 алифатическую группу), NO2, CN, CO2H, CO2(C1-6 алифатическую группу), O(галоген C1-6 алифатическую группу) или галоген(C1-6 алифатическую группу), где каждая из указанных C1-6 алифатических групп R° является незамещенной;
при каждом появлении J' его независимо выбрают из =O, =S, =NNHR*, =NN(R*)2, =NNHC(O)R*, =NNHCO2(алкила), =NNHSO2(алкила) или =NR*, где каждый R* независимо выбран из водорода или необязательно замещенной C1-6 алифатической группы; где алифатическая группа R* является необязательно замещенной с помощью NH2, NH(C1-4 алифатической группы), N(C1-4 алифатической группы)2, галогена, С1-4 алифатической группы, OH, O(C1-4 алифатической группы), NO2, CN, CO2H, CO2(C1-4 алифатической группы), O(галоген C1-4 алифатической группы) или галоген(C1-4 алифатической группы), где каждая из C1-4 алифатических групп R является незамещенной.
В определенных воплощениях RХ выбран из
В определенных воплощениях по изобретению RY представляет собой
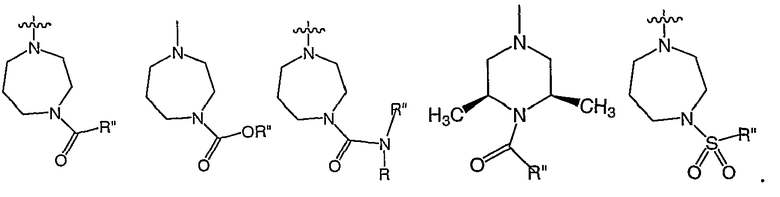
В определенных воплощениях A представляет собой N.
В других воплощениях A представляет собой CR2. В последующих воплощениях A представляет собой CH.
В некоторых воплощениях RХ выбран из
В последующих воплощениях R' представляет собой С1-6 алифатическую группу, фенил или 5-8-членную гетероарильную группу, где R' является необязательно замещенным с помощью вплоть до одного заместителя J. В последующих воплощениях R' является С1-6 алифатической группой или фенилом, где R' является необязательно замещенным с помощью вплоть до одного заместителя J, где J представляет собой -COOR°, -OR°, R° или -CF3, и где R° является С1-3 алифатической группой. В еще последующих воплощениях R' представляет собой метил, этил, пропил, изопропил, -CH2-изопропил, бутил, трет-бутил, -CH2-трет-бутил или циклогексил, где R' является необязательно замещенным с помощью -COOR°, -OR° или R°. В определенных воплощениях R представляет собой водород или метил.
В некоторых воплощениях RХ выбран из
В последующих воплощениях R" независимо выбран из C1-6 алифатической группы, фенила или 5-8-членной гетероциклической группы, где R" является необязательно замещенным с помощью вплоть до одного заместителя J. В последующих воплощениях R" независимо выбран из С1-6 алифатической группы или фенила, где R" является необязательно замещенным с помощью вплоть до одного заместителя J, где J выбран из галогена, -CF3, -CN, -COOR°, -COR° или -OR°, где R° представляет собой С1-3 алифатическую группу. В еще последующих воплощениях R" представляет собой метил, этил, пропил, изопропил, -CH2-изопропил, бутил, трет-бутил или -CH2-трет-бутил, где R" является необязательно замещенным с помощью -CN, -COOR° или -OR°. В определенных воплощениях R представляет собой водород или метил.
Конкретные воплощения RХ представлены для соединений в Таблице 1 (см. в конце описания).
В некоторых воплощениях RY выбран из
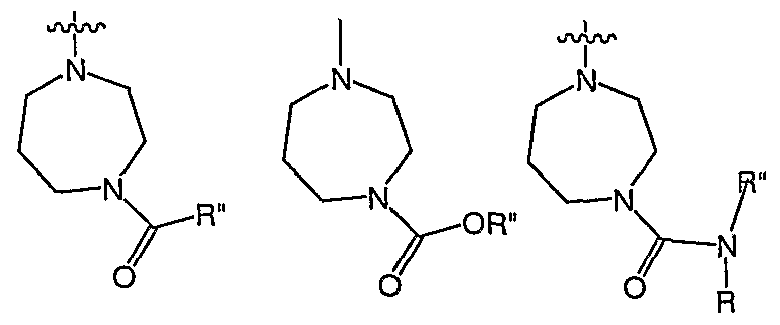
или
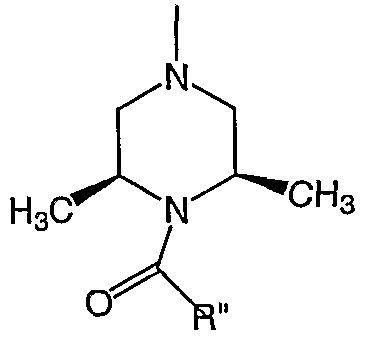
В последующих воплощениях R" независимо выбран из С1-6 алифатической группы, фенила или 5-8-членной гетероциклической группы, где R" является необязательно замещенным с помощью вплоть до одного заместителя J. В последующих воплощениях R" независимо выбран из С1-6 алифатической группы, фенила, где R" является необязательно замещенным с помощью вплоть до одного заместителя J, где J выбран из галогена, -CF3, -CN, -COOR°, -COR° или -OR°, где R° представляет собой С1-3 алифатическую группу. В еще последующих воплощениях R" представляет собой метил, этил, пропил, изопропил, -CH2-изопропил, бутил, трет-бутил или -CH2-трет-бутил, где R" является необязательно замещенным с помощью CN, -COOR° или -OR°. В определенных воплощениях R представляет собой водород или метил.
Конкретные воплощения RY приведены для соединений в Таблице 1.
Типичные примеры соединений формулы I представлены в Таблице 1.
Общая методика синтеза
Соединения по настоящему изобретению могут быть получены с помощью методик, известных специалисту среднего уровня в данной области для аналогичных соединений, с помощью методик, представленных ниже, с помощью общих схем синтеза и с помощью примеров получения, которые представлены ниже. Процессы получения соединений по настоящему изобретению описаны на схемах и в примерах. На схемах переменные являются такими, как описано для соединений (например, формула I) по изобретению, или являются реально узнаваемыми с помощью ссылок на эти соединения.
Схема 7 описывает синтез ряда примерных соединений, где Ar1 и Ar2 являются замещенными.
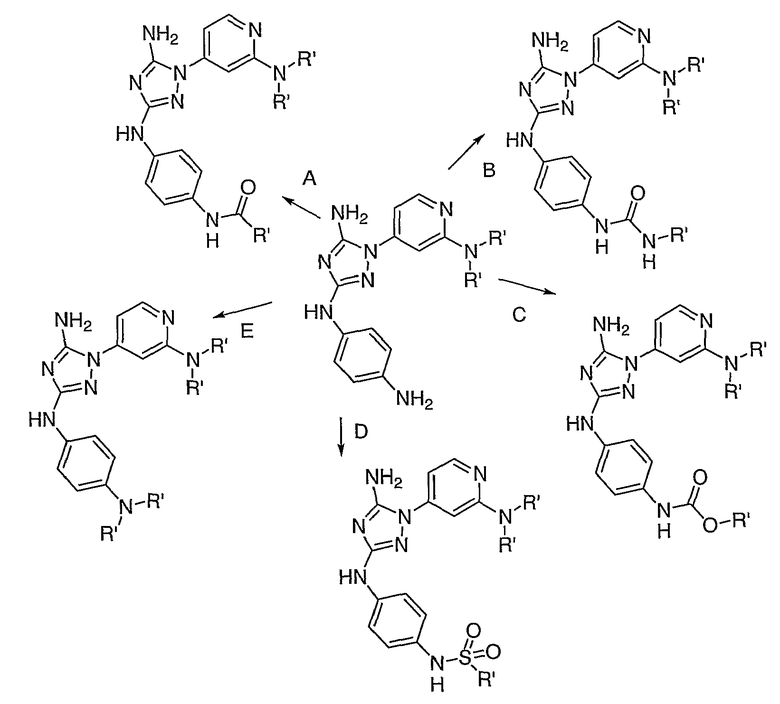
Общие условия: растворитель, основание, подходящий агент связывания, например: A. ДМФА, DIEA, RCOCl; B. ДМФА, DEA, изоцианат; C. ДМФА, DIEA, хлорформиат; D. ДМФА, DIEA, 1SO2R; E. iPrOH, алкилгалоид, нагревание.
Схема 7 отражает маршрут к получению соединений настоящего изобретения, где
Ar1 замещен с помощью аминного производного, в частности, где R2 представляет собой (T)nAr1, и Ar1 замещен с помощью аминного производного. На Схеме 7 аминная группа взаимодействует в обычных условиях связывания, чтобы обеспечить производное амина. Должно быть понятно, что описанный синтез может быть модифицирован, что также обеспечивает другие производные амина. Кроме того, могут быть использованы другие условия связывания, чем те, которые описаны. Такие методики хорошо известны специалисту среднего уровня в данной области (см. например, Greene или Greene & Wutz, Protective Groups in Organic Synthesis; WO 01/81330). Должно быть понятно, что условия должны быть выбраны так, чтобы быть совместимыми (то есть инертными) с оставшимися заместителями (например, -NR1R2).
Схема 1: Маршрут получения диаминотриазольных производных
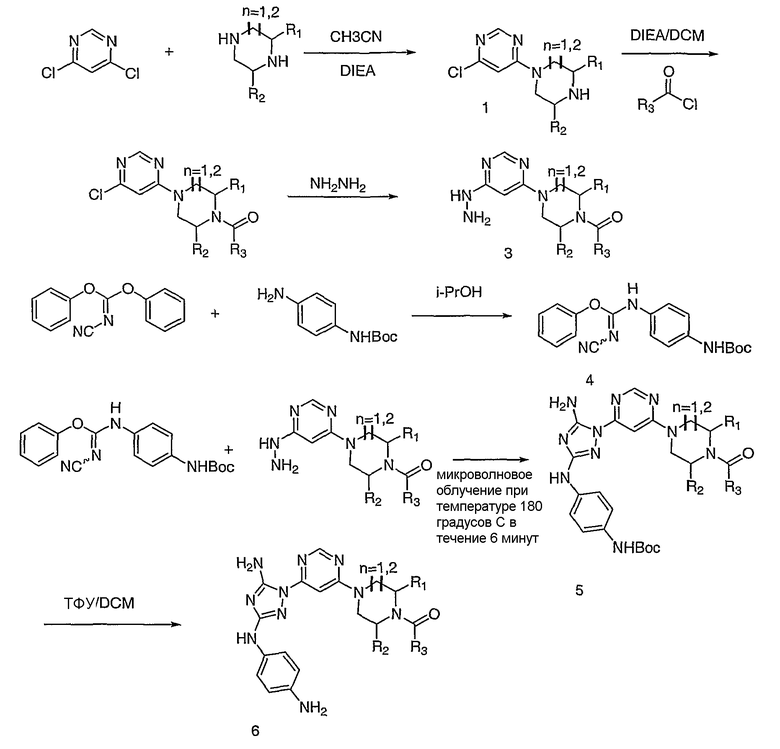
Схема 2: Маршрут получения производных диаминотриазольных соединений
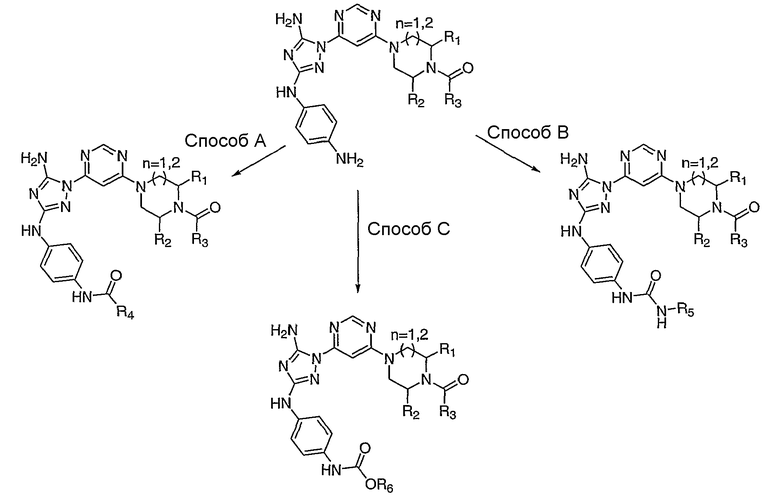
Способ A: ДМФА, DIEA, комнатная температура, карбоксилатхлорид.
Способ B: ДМФА, DIEA, комнатная температура, изоцианат.
Способ C: ДМФА, DIEA, комнатная температура, хлорформиат.
Схема 3: Маршрут получения диаминотриазольных производных
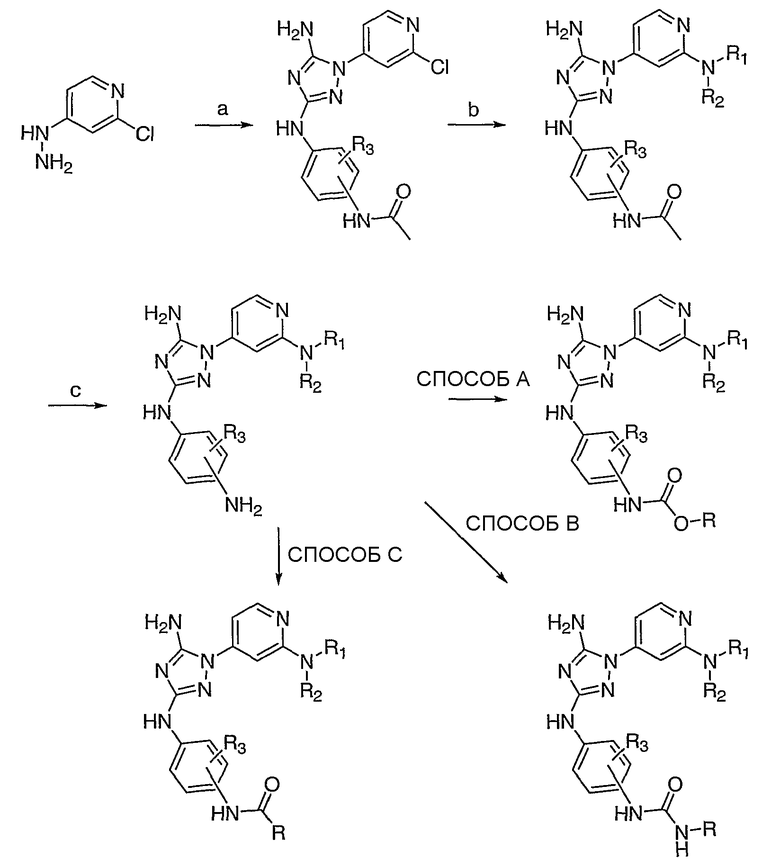
(a) N-циано-N'-арил-O-фенилизомочевина, NMP (N-метилпирролидон), DIEA, М.в., 160-220°C, 6-15 минут; (b) HNR1R2, NMP, М.в., 220-250°C, 6-15 минут; (c) 6N HCl, 95°C; СПОСОБ A: ClCO2R (хлорформиат), DIEA, ДМФА; СПОСОБ B: OCN-R (изоцианат), DIEA (диизопропилэтиламин), ДМФА; СПОСОБ C: RCO2H (карбоновая кислота), DCC (дициклогексилкарбодиимид), DCM (дихлорметан) или RCOCl (хлорангидрид кислоты), DIEA или пиридин, ДМФА.
Другое общее направление к соединениям по настоящему изобретению изображено на Схеме 3. Хотя конкретные реагенты изображены на Схеме 3, специалист среднего уровня в данной области должен понимать, что могут быть использованы другие стадии и реагенты, чтобы осуществить изображенный синтез. Схемы 4 и 5, представленные ниже, отражают эту общую схему более конкретно.
Хотя определенные типичные воплощения описаны и изображены выше и в описании, должно быть принято во внимание, что соединения по изобретению могут быть получены в соответствии с методиками, изображенными в общем выше, используя подходящие исходные продукты с помощью методик, в целом доступных специалисту среднего уровня в данной области.
Применение, препараты и введение
Фармацевтически приемлемые композиции
Как указано выше, настоящее изобретение охватывает соединения, которые являются ингибиторами протеинкиназ, и, соответственно, соединения по настоящему изобретению могут быть использованы для лечения заболеваний, расстройств и состояний, включающих, помимо прочего, аллергические заболевания, пролиферативные заболевания, аутоиммунные заболевания, состояния, связанные с пересадкой органов, воспалительные заболевания, иммунологически опосредованные заболевания, вирусные заболевания или деструктивные заболевания костей (такие как расстройства костной резорбции). Таким образом, другой аспект настоящего изобретения охватывает фармацевтически приемлемые композиции, которые содержат какие-либо соединения, описанные выше, а также по необходимости содержат фармацевтически приемлемый носитель, адъювант или наполнитель. В некоторых воплощениях эти композиции содержат, кроме того, один или более дополнительных терапевтических агентов.
Также должно быть принято во внимание, что конкретные соединения по настоящему изобретению могут существовать в свободной форме или, когда это целесообразно, в виде их фармацевтически приемлемых производных. В отношении настоящего изобретения фармацевтически приемлемые производные включают, помимо прочего, фармацевтически приемлемые соли, эфиры, соли этих эфиров или любой другой продукт присоединения или производное, которое при введении пациенту способно прямо или опосредованно обеспечить присутствие в организме соединения, приведенного в настоящем описании, или его метаболита, или остатка.
Используемый в настоящем описании термин «фармацевтически приемлемая соль» относится к тем солям, которые на основании грамотного медицинского заключения могут быть использованы в контакте с тканями человека и низших животных без проявления чрезмерной токсичности, гиперчувствительности, аллергического ответа и подобных явлений, а также с приемлемым соотношением польза/риск. «Фармацевтически приемлемая соль» означает любую нетоксичную соль или соль эфира соединения по настоящему изобретению, которая при назначении реципиенту способна обеспечить прямо или косвенно соединение этого изобретения, его метаболит или остаток, который ингибирует выбранную киназу, включая Aurora-2, Flt3, KDR, JAK2 и JAK3. В конкретных воплощениях соединение или его фармацевтически приемлемая соль ингибирует JAK2 или JAK3.
Фармацевтически приемлемые соли хорошо известны специалистам в соответствующей области. Например, S. M. Berge и др. детально описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, включенном в данное описание в качестве ссылки. Фармацевтически приемлемые соли соединений настоящего изобретения включают как полученные из подходящих неорганических, так и органических кислот и оснований. Примерами фармацевтически приемлемых нетоксичных солей с кислотными остатками являются соли, которые образованы при взаимодействии аминогрупп с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и хлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, а также с использованием других методов, применяемых в данной области, таких как ионообмен.
Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталенсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерианаты и подобные. Соли, полученные из подходящих оснований, включают соли щелочных металлов, щелочно-земельных металлов, аммония и N+(C1-4 алкил)4.
Настоящее изобретение также охватывает кватернизацию любых основных азотосодержащих групп соединений, представленных в настоящем описании. Водо- или жирорастворимые или диспергируемые продукты могут быть получены кватернизацией. Типичные соли щелочных или щелочно-земельных металлов включают натриевые, литиевые, калиевые, кальциевые, магниевые и подобные. Более того, фармацевтически приемлемые соли включают, если это целесообразно, нетоксичные аммониевые, четвертичные аммониевые и аминовые катионы, которые получают с помощью противоионов, таких как галоид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низкоалкилированный сульфонат и арилсульфонат.
Как указано выше, фармацевтически приемлемые композиции настоящего изобретения дополнительно содержат фармацевтически приемлемый носитель, адъювант или наполнитель, которые, в настоящем случае, включают все без исключения растворители, разбавители или другие жидкие носители, диспергирующие или суспендирующие средства, поверхностно активные агенты, изотонические агенты, загустители или эмульгаторы, консерванты, твердые связующие вещества, лубриканты и подобные, которые соответствуют конкретным требуемым лекарственным формам. Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) раскрывает разнообразные носители, используемые в приготовлении фармацевтически приемлемых композиций, а также известные методики их приготовления. Использование любого из традиционных носителей, за исключением тех, которые несовместимы с соединениями настоящего изобретения из-за развития каких-либо нежелательных биологических эффектов или иного вредного взаимодействия с другим(и) компонентом(ами) фармацевтически приемлемой композиции, рассматривается в рамках настоящего изобретения.
Несколько примеров веществ, которые пригодны в качестве фармацевтически приемлемых носителей, включают, помимо прочего, ионообменные вещества, оксид алюминия, стеарат алюминия, лецитин, белки плазмы, такие как человеческий альбумин плазмы, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота или сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, вода, соли или электролиты, такие как протамин сульфат, динатрийфосфат, дикалийфосфат, хлорид натрия, соли цинка, коллоидная окись кремния, трисиликат магния, поливинилпирролидон, полиакрилаты, воск, полиэтилен-полиоксипропиленовые сополимеры, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетатцеллюлоза; измельченный трагакант; солод; желатин; тальк; формообразующие вещества, такие как масло какао и воск для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль или полиэтиленгликоль; эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический раствор; раствор Рингера; этиловый спирт и растворы фосфатного буфера, также как и другие нетоксичные совместимые лубриканты, такие как лаурилсульфат натрия и стеарат магния, а также красители, антиадгезивы, вещества оболочки, подсластители, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в композиции в соответствии с решением фармацевта.
Применение соединений и фармацевтически приемлемых композиций
Другой аспект настоящего изобретения охватывает способ лечения или уменьшения тяжести аллергических заболеваний, пролиферативных заболеваний, аутоиммунных заболеваний, состояний, ассоциированных с пересадкой органов, воспалительных заболеваний, иммунологически опосредованных заболеваний, вирусных заболеваний или костнодеструктивных заболеваний (таких как болезни костной резорбции), включающий введение эффективного количества соединения или фармацевтически приемлемой композиции субъекту, который нуждается в лечении. В конкретных воплощениях настоящего изобретения под «эффективным количеством» соединения или фармацевтически приемлемой композиции понимают количество, эффективное для лечения или уменьшения тяжести заболевания, расстройства или патологического состояния, требующего лечения. Соединения и композиции, относящиеся к способу настоящего изобретения, могут быть введены с использованием любого количества и любого пути введения, которые эффективны для лечения или уменьшения тяжести заболевания, расстройства или состояния, требующего лечения. Необходимое количество варьирует от субъекта к субъекту в зависимости от биологического вида, возраста, общего состояния субъекта, тяжести инфекции, конкретного агента, способа его введения и т.п. Соединения по настоящему изобретению предпочтительно назначают в виде форм для однократного приема для удобства введения и равномерности дозирования. Выражение «форма для однократного приема», используемая в настоящем описании, относится к физически дискретной форме агента, предназначенной для пациента, проходящего лечение. Однако необходимо понимать, что общая суточная доза соединений или композиций настоящего изобретения назначается лечащим врачом на основании грамотного медицинского заключения. Индивидуальная доза для любого конкретного пациента или организма будет зависеть от различных факторов, включающих заболевание, по поводу которого проводится лечение, тяжесть этого заболевания; активность конкретного используемого соединения; конкретную используемую композицию; возраст, вес, общее состояние здоровья, пол и диету пациента; время введения, маршрут введения и скорость экскреции конкретного используемого соединения; продолжительность лечения; препараты, используемые в комбинации или совместно с конкретным используемым соединением, а также подобные факторы, хорошо известные специалистам в соответствующей области. Термин «пациент», используемый в настоящем описании, подразумевает животных, предпочтительно млекопитающих, наиболее предпочтительно человека.
Фармацевтически приемлемые композиции настоящего изобретения могут быть назначены людям и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, местно (в виде порошков, мазей или капель), защечно, в виде орального или назального спрея или подобным образом в зависимости от тяжести инфекционного процесса, по поводу которого проводится лечение. В конкретных воплощениях, соединения по настоящему изобретению могут быть назначены перорально или парентерально в дозах от около 0,01 мг/кг до около 50 мг/кг, предпочтительнее от около 1 мг/кг до около 25 мг/кг массы тела субъекта в сутки, на один или более приемов для достижения желаемого терапевтического эффекта.
Жидкие лекарственные формы для перорального назначения включают, помимо прочего, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений, жидкие лекарственные формы могут содержать инертные наполнители, наиболее часто используемые в данной области, например воду или другие растворители, повышающие растворимость агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, масло пшеничных зародышей, оливковое, касторовое и кунжутовое масла), глицерол, тетрагидрофурфуриловый спирт, полиэтиленгликоль и эфиры жирных кислот и сорбита, и их смеси. Помимо инертных наполнителей, в композиции для перорального введения могут быть добавлены адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подсластители, вкусовые добавки и ароматизаторы.
Препараты для инъекционного введения, например стерильные водные или масляные суспензии для инъекций, могут быть приготовлены с использованием известных в данной области приемлемых диспергирующих или увлажняющих агентов, а также суспендирующих агентов. Стерильные препараты для инъекционного введения также могут представлять собой стерильный раствор для инъекций, суспензию или эмульсию в нетоксичном, приемлемом для парентерального введения наполнителе или растворителе, например раствор в 1,3-бутандиоле. Приемлемыми носителями и растворителями, которые могут быть использованы, являются вода, раствор Рингера, раствор U.S.P. и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используются в качестве среды для растворения или суспендирования. Для этой цели может быть использовано любое мягкое нелетучее масло, включая синтетические моно- и диглицериды. Кроме того, такие жирные кислоты, как олеиновая кислота, используют для приготовления инъекционных препаратов.
Препараты для инъекционного введения могут быть стерилизованы, например, путем фильтрации через бактериальные фильтры или путем добавления стерилизующих агентов к стерильной твердой композиции, которая может быть растворена или диспергирована в стерильной воде или другой стерильной среде, пригодной для инъекций, перед введением.
Для того чтобы продлить эффект действия соединения по настоящему изобретению, желательным является замедление всасывания соединения из места подкожной или внутримышечной инъекции. Это может быть достигнуто использованием жидкой суспензии кристаллических или аморфных веществ, плохо растворимых в воде. Скорость всасывания соединения в этом случае будет зависеть от скорости его растворения, что, в свою очередь, зависит от размеров кристаллов и кристаллической структуры. В качестве альтернативы, замедленное всасывание парентерально вводимого соединения достигается путем растворения или суспендирования соединения в масляном растворителе. Инъекционные депо-формы получают путем формирования микрокапсульных матриц соединения на биодеградируемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения соединения и полимера, а также природы конкретного используемого полимера, может регулироваться скорость высвобождения соединения. Примеры других биодеградируемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъекционные депо-формы также готовят путем заключения соединения в липосомы или микроэмульсии, совместимые с тканями тела.
Композиции для ректального или вагинального введения преимущественно являются суппозиториями, которые могут быть приготовлены смешиванием соединений настоящего изобретения с приемлемыми не вызывающими раздражения наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые находятся в твердом состоянии при комнатной температуре, но становятся жидкими при температуре тела и, как следствие, тают в прямой кишке или влагалище, и высвобождают активное соединение.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых формах активное соединение смешивают, по крайней мере, с одним инертным фармацевтически приемлемым наполнителем или носителем, таким как цитрат или дикальция фосфат и/или a) наполнители или сухие разбавители, такие как крахмалы, лактоза, глюкоза, маннитол и кремниевая кислота, б) связующие вещества, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик, в) увлажнители, такие как глицерол, г) дезинтегрирующие агенты, такие как агар-агар, карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия, д) замедляющие растворение агенты, такие как парафин, е) вещества, ускоряющие всасывание, такие как соединения четвертичного аммония, ж) смачивающие агенты, такие, например, как цетиловый спирт и глицерол моностеарат, з) адсорбенты, такие как каолин и бентонитовая глина, и и) лубриканты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смесь. В случае капсул, таблеток и пилюль, лекарственная форма может содержать также буферные агенты.
Твердые композиции подобного типа могут быть также заключены в мягкие и твердые желатиновые капсулы с использованием таких наполнителей, как лактоза или молочный сахар, так же как и высокомолекулярные полиэтиленгликоли и т.п. Твердые лекарственные формы - таблетки, драже, капсулы, пилюли и гранулы - могут быть приготовлены с использованием покрытий и оболочек, таких как кишечнорастворимые оболочки и другие оболочки, хорошо известные специалистам в области фармации. Они могут по необходимости содержать опалесцирующие агенты и также включать композиции, которые высвобождают активный(е) компонент(ы) только или предпочтительно в определенной части желудочно-кишечного тракта по необходимости в замедленном темпе. Примеры «встраиваемых» композиций, которые могут быть использованы, включают полимерные субстанции и воск. Твердые композиции подобного типа могут быть также заключены в мягкие и твердые желатиновые капсулы с использованием таких наполнителей, как лактоза или молочный сахар, так же как и высокомолекулярные полиэтиленгликоли и подобные им.
Активные соединения могут быть также в форме микрокапсул с одним или более наполнителями, описанных выше. Твердые лекарственные формы - таблетки, драже, капсулы, пилюли и гранулы - могут быть приготовлены с использованием покрытий и оболочек, таких как кишечнорастворимые оболочки, оболочки, контролирующие высвобождение препарата, и другие оболочки, хорошо известные специалистам в области фармации. В подобных твердых лекарственных формах активное соединение может быть смешано с, по крайней мере, одним инертным наполнителем, таким как сахароза, лактоза или крахмал. Подобные лекарственные формы также обычно могут содержать дополнительные вещества помимо инертных наполнителей, например лубриканты для таблеток и другие вспомогательные вещества для таблеток, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, лекарственные формы могут содержать также буферные агенты. Они могут по необходимости содержать опалесцирующие агенты и также включать композиции, которые высвобождают активный(е) компонент(ы) только или предпочтительно в определенной части желудочно-кишечного тракта по необходимости в замедленном темпе. Примеры «встраиваемых» композиций, которые могут быть использованы, включают полимерные субстанции и воск.
Лекарственные формы для местного или чрескожного использования соединения по настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингаляторы или пластыри. Активный компонент в стерильном виде смешивается с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, если это требуется. Офтальмологические препараты, ушные капли и глазные капли также рассматриваются как включенные в рамки настоящего изобретения. Кроме того, настоящее изобретение включает использование чрескожных пластырей, имеющих дополнительное преимущество для обеспечения контролируемой доставки препарата в ткани. Подобные лекарственные формы могут быть приготовлены путем растворения и диспергирования соединения в соответствующей среде. Ускорители всасывания могут быть использованы для повышения проникновения соединения через кожу. Скорость может регулироваться как с помощью контролирующих скорость мембран, так и путем распределения соединения в полимерном матриксе или геле.
Как указано выше, соединения по настоящему изобретению могут быть использованы в качестве ингибиторов протеинкиназ. В одном из воплощений соединения и композиции настоящего изобретения являются ингибиторами одной или более киназ, таких как Aurora-2, Flt3, KDR, JAK2 и JAK3. В некоторых предпочтительных воплощениях, соединения по настоящему изобретению эффективны в качестве ингибиторов JAK2 и JAK3. Таким образом, не ограничиваясь какой-либо частной теорией, соединения и композиции, в частности, полезны для лечения или уменьшения тяжести заболевания, патологического состояния или расстройства, развитие которых связано с активацией одной или более протеинкиназ, включая киназы Aurora-2, Flt3, KDR, JAK2 и JAK3. В том случае, когда активация киназ Aurora-2, Flt3, KDR, JAK2 и JAK3 влечет за собой конкретное заболевание, патологическое состояние или расстройство; заболевание, патологическое состояние или расстройство могут быть также обозначены как «Aurora-2, Flt3, KDR, JAK2 или JAK3-опосредованное заболевание» или симптом заболевания. Таким образом, в другом аспекте настоящее изобретение охватывает способ лечения или уменьшения тяжести заболевания, патологического состояния или расстройства, где в развитие патологического состояния вовлечена активация одной или более протеинкиназ, включая киназы Aurora-2, Flt3, KDR, JAK2 и JAK3.
Активность соединения, используемого в изобретении в качестве ингибитора протеинкиназ, может быть исследована in vitro, in vivo или на клеточных линиях. In vitro исследования включают исследования, определяющие как фосфорилазную активность, так и АТФазную активность, например, киназ Aurora-2, FltS, KDR, JAK2 и JAK3. В альтернативных исследованиях in vitro количественно определяют способность ингибитора связывать протеинкиназу. Связывание ингибитора может быть измерено введением радиоактивной метки в ингибитор до связывания с последующим выделением комплекса ингибитор/фермент и определением количества связанной радиоактивной метки. Альтернативно связывание ингибитора может быть определено путем проведения эксперимента с конкурентным связыванием, где новые ингибиторы инкубируют, например, с киназами Aurora-2, Flt3, KDR, JAK2 и JAK3, связанными с известными радиолигандами.
Термин «измеряемое ингибирование», используемый в настоящем описании, подразумевает измеряемую разницу активности киназ между образцом, содержащим композицию и киназу, и эквивалентным образцом, содержащим киназу без композиции.
Термин "FLT-3-опосредованное заболевание", используемый в настоящем описании, подразумевает любое заболевание или патологическое состояние, про которое известно, что в его развитии играет роль семейство киназ FLT-3. Данные состояния включают, помимо прочего, гематопоэтические заболевания, в частности острый миелобластный лейкоз (AML), острый промиелоцитарный лейкоз (APL) и острый лимфоцитарный лейкоз (ALL).
Термин "JAK-опосредованное заболевание", используемый в настоящем описании, подразумевает любое заболевание или патологическое состояние, про которое известно, что в его развитии играет роль семейство киназ JAK. Данные состояния включают, помимо прочего, иммунные реакции, такие как аллергический или I тип реакций гиперчувствительности, астму, аутоиммунные заболевания, такие как отторжение трансплантата, болезни «трансплантат против хозяина», ревматоидный артрит, боковой амиотрофический склероз и рассеянный склероз, нейродегенеративные заболевания, такие как семейный боковой амиотрофический склероз (FALS), так же как и солидные и гематологические новообразования, такие как лейкозы и лимфомы. Состояния, в развитии которых играет роль JAK2, включают миелопролиферативные заболевания, такие как истинная полицитемия, эссенциальная тромбоцитемия, хронический идиопатический миелофиброз, хронический миелолейкоз, миелоидная метаплазия с миелофиброзом, хронический миелолейкоз, хронический миеломоноцитарный лейкоз, хронический эозинофильный лейкоз и системный мастоцитоз.
Термин "AUR-опосредованное заболевание" или "AUR-опосредованное состояние", используемый в настоящем описании, подразумевает любое заболевание или патологическое состояние, про которое известно, что в его развитии играет роль семейство киназ AUR. Данные состояния включают, помимо прочего, аллергические заболевания, в первую очередь астму.
Необходимо понимать, что соединения и фармацевтически приемлемые композиции настоящего изобретения могут быть использованы в комбинированной терапии, что означает, что соединения и фармацевтически приемлемые композиции могут быть назначены одновременно, до или после одного или более необходимого препарата или медицинской процедуры. Конкретное комбинирование лечебных воздействий (препаратов или процедур) для использования в режиме комбинированного лечения должно выполняться с учетом совместимости выбранных препаратов и/или процедур, а также желаемого эффекта. Также должно быть понятно, что препараты могут приводить к ожидаемому эффекту в отношении этого же заболевания (например, соединение изобретения может быть назначено одновременно с другим агентом, используемым для лечения данного заболевания), либо они могут вызывать другие эффекты (например, контроль любых побочных эффектов). В настоящем описании дополнительные терапевтические агенты, которые обычно назначают для лечения или профилактики конкретного заболевания или патологического состояния, обозначены как «подходящие для заболеваний или патологических состояний, по поводу которых назначено лечение».
Например, химиотерапевтические агенты или другие антипролиферативные агенты могут быть комбинированы с соединениями настоящего изобретения для лечения пролиферативных заболеваний или рака. Примеры известных химиотерапевтических агентов включают помимо прочего другие лекарственные препараты или противоопухолевые агенты, которые могут быть использованы в комбинации с противоопухолевыми агентами настоящего изобретения, включая хирургическое лечение, лучевую терапию (в т.ч. гамма-излучение, лучевая терапия пучком нейтронов, протонная терапия, брахитерапия, а также системное применение радиоактивных изотопов и т.д.), эндокринологическую терапию, модификаторы биологического ответа (интерфероны, интерлейкины и фактор некроза опухолей (ФНО) и т.д.), гипертермию и криотерапию, агенты, ослабляющие любые побочные эффекты (например, противорвотные средства), и другие испытанные химиотерапевтические препараты, включающие, помимо прочего, алкилирующие препараты (мехлоэтамин, хлорамбуцил, циклофосфамид, мелфалан, ифосфамид), антиметаболиты (метатрексат), пуриновые антагонисты и пиримидиновые антагонисты (6-меркаптопурин, 5-флюороурацил, цитарабил, гемцитабин), ингибиторы веретена деления (винбластин, винкристин, винорелбин, паклитаксел), подофиллотоксины (этопозид, иринотекан, топотекан), антибиотики (доксорубицин, блеомицин, митомицин), препараты нитрозомочевины (кармустин, ломустин), неорганические ионы (цисплатин, карбоплатин), ферменты (аспарагиназа) и гормоны (тамоксифен, леупролид, флутамид и мегестрол), гливек, адриамицин, дексаметазон и циклофосфамид. Для более исчерпывающей информации о современных методах лечения рака смотри http://www.nci.nih.gov/, раздел FDA, посвященный онкологическим препаратам на странице http://www.fda.gov/cder/cancer/druglistframe.htm, а также The Merck Manual, Seventeenth Ed. 1999, полное содержание которого включено в качестве ссылки.
Другие примеры агентов, с которыми могут быть комбинированы ингибиторы настоящего изобретения, включают, помимо прочего, препараты для лечения болезни Альцгеймера, такие как арицепт и экселон, препараты для лечения болезни Паркинсона, такие как L-DOPA/карбидопа, энтакапон, ропинрол, прамипексол, бромокриптин, перголид, тригексефендил и амантадин; агенты для лечения рассеянного склероза, такие как бета-интерферон (например, авонекс и ребиф), копаксон и митоксанторн; препараты для лечения астмы, такие как альбутерол и сингуляр; агенты для лечения шизофрении, такие как зипрекса, риспердал, сероквель и галоперидол; противовоспалительные агенты, такие как кортикостероиды, ФНО-блокаторы, IL-1 RA, азатиоприн, циклофосфамид и сульфасалазин; иммуномодулирующие и иммуносупрессивные агенты, такие как циклоспорин, такролимус, рапамицин, микофенолатмофетил, интерфероны, кортикостероиды, циклофосфамид, азатиоприн и сульфасалазин; нейротрофические факторы, такие как ингибиторы ацетилхолинэстеразы, ингибиторы MAO, интерфероны, антиконвульсанты, блокаторы ионных каналов, рилузол, противопаркинсонические агенты; агенты для лечения сердечно-сосудистых заболеваний, такие как бета-блокаторы, ингибиторы АПФ, диуретики, нитраты, блокаторы кальциевых каналов и статины; агенты для лечения заболеваний печени, такие как кортикостероиды, холестирамин, интерфероны и противовирусные агенты; агенты для лечения заболеваний крови, такие как кортикостероиды, противолейкемические агенты и факторы роста; агенты для лечения иммунодефицитов, такие как гамма-глобулин.
Количество дополнительного терапевтического агента, присутствующего в композиции настоящего изобретения, должно быть не больше, чем количество, которое обычно назначается в композиции, содержащей в качестве активного агента только этот терапевтический агент. Предпочтительно количество дополнительного терапевтического агента в раскрытой в этом описании композиции должно колебаться в пределах от около 50% до 100% количества, обычно присутствующего в композиции, содержащей агент в качестве единственного терапевтически активного агента.
Соединения по настоящему изобретению или его фармацевтически приемлемые соли также могут быть включены в композиции для «покрытых» имплантируемых медицинских устройств, таких как протезы, искусственные клапаны, сосудистые протезы, стенты и катетеры. Таким образом, настоящее изобретение, в другом аспекте, включает композиции для покрытия имплантируемых устройств, содержащие соединение настоящего изобретения, описанное ранее, а также в пунктах и подпунктах данного описания, и носитель, подходящий для покрытия указанных имплантируемых устройств. В другом аспекте настоящее изобретение включает имплантируемые устройства, покрытые композицией, содержащей соединение настоящего изобретения, как описано ранее, а также в пунктах и подпунктах данного описания, а также носитель, подходящий для покрытия указанных имплантируемых устройств.
Сосудистые стенты, например, используют для предотвращения развития рестенозов (повторных сужений просвета артерии после вмешательства). Однако у пациентов, у которых используют стенты или другие имплантируемые устройства, повышен риск формирования тромбов или активации тромбоцитов. Нежелательные эффекты могут быть предотвращены или ослаблены предварительным покрытием устройства фармацевтически приемлемой композицией, содержащей ингибитор киназ. Приемлемые покрытия и принципы производства «покрытых» имплантируемых устройств описаны в US Patents 6099562; 5886026 и 5304121. Материалы покрытия обычно являются биологически совместимыми материалами, такими как полимер гидрогель, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, этиленвинилацетат и их смеси. На покрытия по необходимости может быть дополнительно нанесено подходящее верхнее покрытие из фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их комбинации для придания композиции свойства контролируемого высвобождения.
Другой аспект настоящего изобретения относится к ингибированию протеинкиназной (например, Aurora-2) активности в биологическом образце или у пациента; этот способ включает введение пациенту или контакт с указанным биологическим образцом соединения формулы I или композиции, содержащей это соединение. Термин «биологический образец», используемый в настоящем описании, включает, помимо прочего, клеточные культуры и их экстракты; материал для биопсии, полученный от млекопитающих или его экстракты; а также кровь, слюну, мочу, кал, сперму, слезную жидкость или другие жидкости тела или их экстракты.
Ингибирование активности киназ, включая киназную активность Aurora-2, Flt3, KDR, JAK2 и JAK3, в биологических образцах может быть использована для большого количества целей, известных специалистам в данной области. Примеры подобных целей включают, помимо прочего, переливание крови, пересадку органов, хранение биологических образцов и биологические исследования.
ПРИМЕРЫ
Соединения общей формулы I получают в соответствии с общими методиками, описанными в схемах и примерах по настоящему изобретению.
Пример 1. Получение 4-хлор-6-(3S,5R)-3,5-диметилпиперазин-1-ил)пиримидина (1)
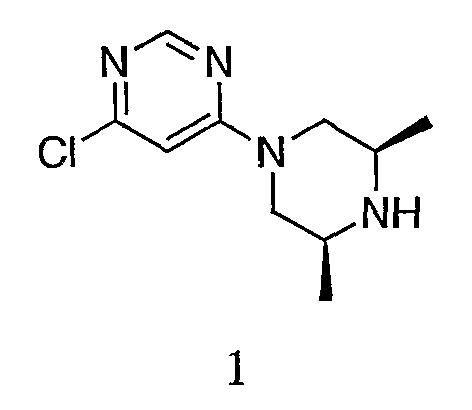
К раствору 4,6-дихлорпиримидина (14,9 г, 100,0 ммоль) в 150 мл безводного ацетонитрила добавляют (2S,6R)-2,6-диметилпиперазин (22,8 г, 200,0 ммоль) порциями в течение примерно 10 минут. Реакционную смесь оставляют при комнатной температуре, используя водяную баню, и перемешивают в течение еще 20 минут. Твердое вещество выпадает в осадок из раствора по мере проведения реакции. Твердое вещество удаляют фильтрованием. Фильтрат концентрируют до получения маслянистого продукта. Полученный продукт растворяют в EtOAc (300 мл), и органический слой промывают водой (100 мл×3). Органический слой сушат над Na2SO4. Удаление растворителя обеспечивает масляный продукт в виде желаемого продукта, что устанавливается с помощью ЖХ/MС (MС+1=227,1). Полученный продукт весит 22,1 г (выход 97,6%).
Пример 2. Получение 1-((2S,6R)-4-(6-хлорпиримидин-4-ил)-2,6-диметилпиперазин-1-ил)этанона (2)
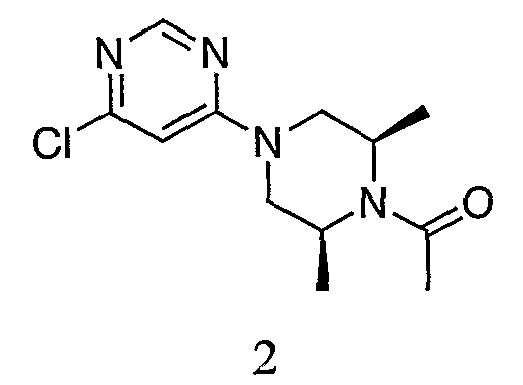
К раствору 4-хлор-6-((3S,5R)-3,5-диметилпиперазин-1-ил)пиримидина (l, 10,29 г, 45,4 ммоль) и DIEA (8,80 г, 68,1 ммоль, 1,50 экв.) в 100 мл дихлорметана добавляют порциями ацетилхлорид (4,03 мл, 56,7 ммоль, 1,25 экв.) при комнатной температуре в течение примерно 10 минут. Реакционную смесь перемешивают при комнатной температуре в течение еще 30 минут. К реакционной смеси добавляют водный раствор NaHCO3, и органический слой промывают NaHCO3 (100 мл×2), а затем насыщенным водным раствором NaCl. Органический слой сушат над Na2SO4. Удаление растворителя приводит к получению масла желтого цвета. Полученный маслянистый продукт растирают в порошок в диэтиловом эфире, чтобы получить твердое вещество белого цвета. Твердое вещество собирают фильтрованием и промывают снова диэтиловым эфиром. Твердое вещество сушат в вакууме, и вес определяют равным 11,95 г. Выход составляет 98,2%. ЖХ/MС (M+1=269,1).
Пример 3. Получение 3
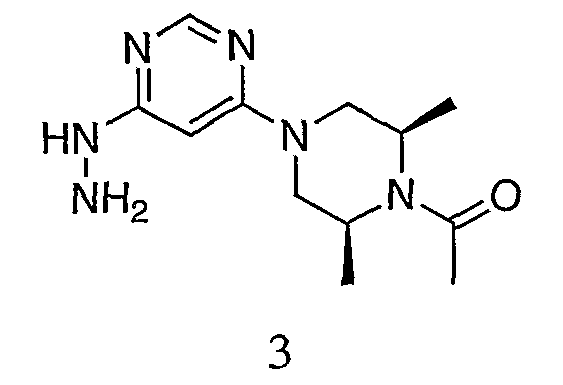
К раствору 1-((2S,6R)-4-(6-хлорпиримидин-4-ил)-2,6-диметилпиперазин-1-ил)этанона (2, 9,61 г, 35,7 ммоль) в 75 мл безводного ТГФ добавляют гидразин (5,72 г, 5,60 мл, 178,8 ммоль, 5,0 экв.). Твердое вещество выпадает в осадок раствора по мере проведения реакции. Реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры. Твердое вещество собирают фильтрованием и промывают холодным метанолом (25 мл×3), чтобы избавить от избытка гидразина и его HCl соли. Твердое вещество сушат в вакууме, и вес определяют равным 8,95 г (83,3% выход). ЖХ/MС (M+1=265,2).
Пример 4. Получение трет-бутил 4-((Z)-1-циано-2-фенилизоуреидо)фенилкарбамата(4)
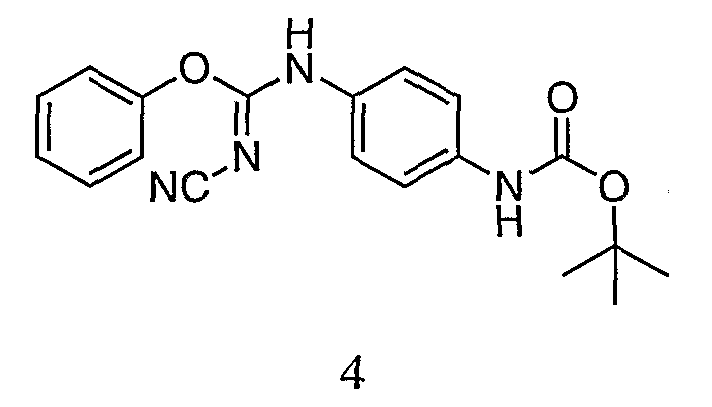
К суспензии дифенилцианокарбонимидата (11,04 г, 46,4 ммоль) в 130 мл изопропанола добавляют трет-бутил 4-аминофенилкарбамат (9,20 г, 44,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, и твердое вещество собирают фильтрованием. Твердое вещество сушат в вакууме, и оно весит 10,85 г (69,7% выход). ЖХ/MС (M+1=353,2).
Пример 5. Получение соединения 5
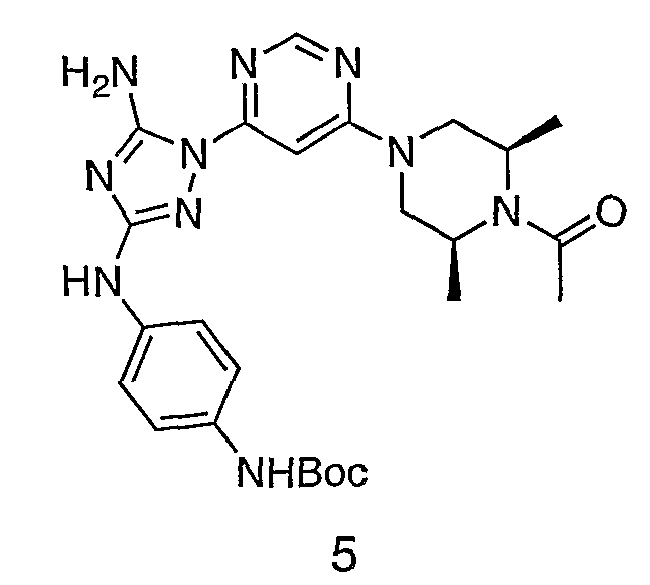
К раствору соединения 3 (3,17 г, 12,0 ммоль) и трет-бутил 4-((Z)-1-циано-2-фенилизоуреидо)фенилкарбамата (4, 3,52 г, 10,0 ммоль) в 6 мл NMP добавляют 1 мл DIEA. Реакционную смесь герметизируют в реакционной колбе для микроволнового облучения и нагревают в реакторе с микроволновым облучением при температуре 180°С в течение примерно 6 минут. Реакционную смесь охлаждают до комнатной температуры и распределяют между этилацетатом и водой. Органический слой промывают водой дважды и сушат над Na2SO4. Удаление растворителя приводит к получению твердого вещества желтого цвета. Полученное твердое вещество промывают дихлорметаном, чтобы получить твердое вещество белого цвета. ЯМР: ДМСО-d6: 8,98 (ушир.с, 1H); 8,94 (с, 1H); 8,38 (с, 1H); 7,72 (ушир.с, 2H); 7,45 (д, 2H); 7,25 (д, 2H); 6,73 (с, 1Н); 4,60-4,10 (м, 4H); 3,20 (м, 2H); 2,02 (с, 3H); 1,40 (с, 9H); 1,15 (м, 6H). ЖХ/MС (M+1=523,3).
Пример 6. Получение 1-((2S,6R)-4-(6-(3-(4-аминофениламино)-5-амино-1Н-1,2,4-триазол-1-ил)пиримидин-4-ил)-2,6-диметилпиперазин-1-ил)этанона(6)
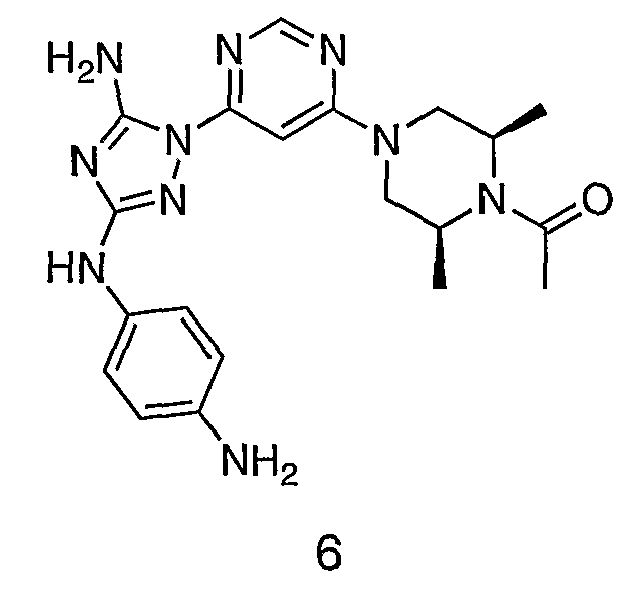
К раствору соединения 6 (2,0 г, 3,83 ммоль) в 15 мл дихлорметана добавляют 5 мл трифторуксусной кислоты. Реакционную смесь перемешивают при комнатной температуре в течение примерно 30 минут. HPLC показывает завершение реакции. Растворитель удаляют в вакууме, и полученный маслянистый продукт распределяют между дихлорметаном и водным раствором NaHCO3. Органический слой промывают водным раствором NaHCO3 несколько раз и сушат над Na2SO4. Удаление растворителя дает 1,56 г желаемого продукта (выход составляет 96,9%).
Пример 7. Общий способ формирования карбамата. В последующем представляется характерный пример формирования карбамата. Получение соединения I-76
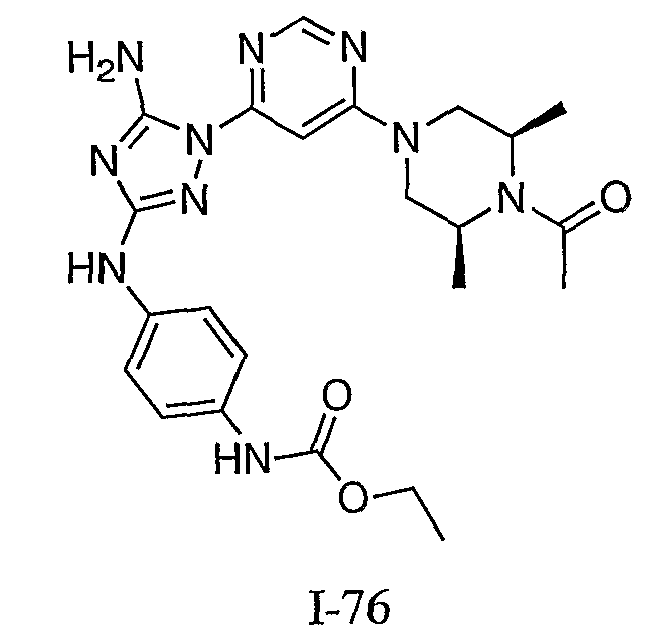
К раствору 1-((2S,6R)-4-(6-(3-(4-аминофениламино)-5-амино-1Н-1,2,4-триазол-1-ил)пиримидин-4-ил)-2,6-диметилпиперазин-1-ил)этанона (21 мг, 0,05 ммоль) в 2 мл ДМФА добавляют этилхлорформиат (6,5 мг, 0,06 ммоль, 1,2 экв.). Также к реакционной смеси добавляют каплю DIEA. Реакционную смесь перемешивают при комнатной температуре в течение примерно 20 минут. Реакционный сырой продукт впрыскивают на P-HPLC, и 18 мг желаемого продукта получают в виде соли трифторуксусной кислоты.
Пример 8. Общий способ формирования молекулы производного мочевины
В последующем представляется характерный пример формирования молекулы производного мочевины:
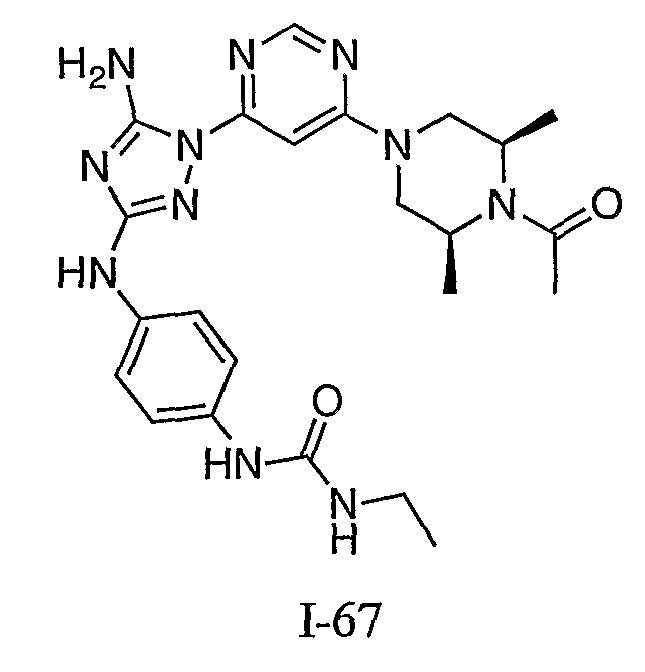
К раствору 1-((2S,6R)-4-(6-(3-(4-аминофениламино)-5-амино-1H-1,2,4-триазол-1-ил)пиримидин-4-ил)-2,6-диметилпиперазин-1-ил)этанона (21 мг, 0,05 ммоль) в 2 мл ДМФА добавляют изоцианатоэтан (4,2 мг, 0,06 ммоль, 1,2 экв.). Также к реакционной смеси добавляют каплю DIEA. Реакционную смесь перемешивают при комнатной температуре в течение примерно 20 минут. Реакционный сырой продукт впрыскивают на P-HPLC, и 17 мг желаемого продукта получают в виде соли трифторуксусной кислоты.
Пример 9. Получение соединения 9
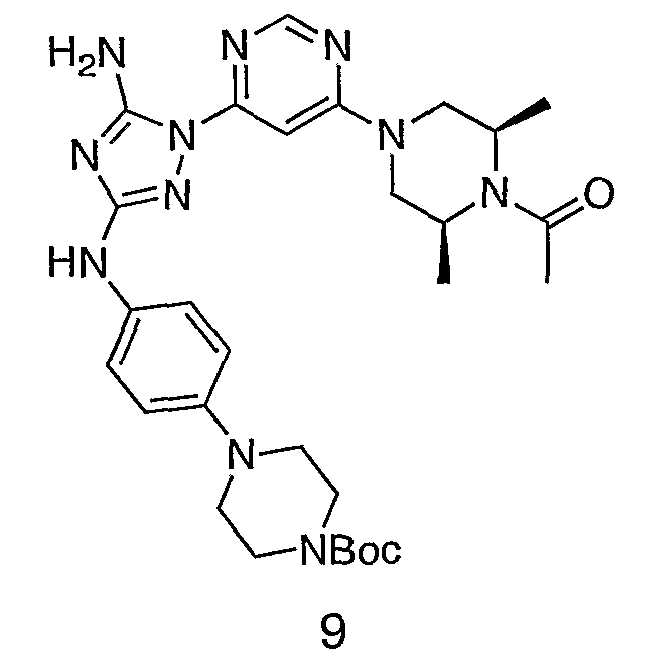
К раствору соединения 3 (1,58 г, 12,0 ммоль) и трет-бутил 4-(4-((Z)-1-циано-2-фенилизоуреидо)фенил)пиперазин-1-карбоксилата (2,10 г, 5,0 ммоль) в 6 мл NMP добавляют 1 мл DIEA. Реакционную смесь герметизируют в реакционной колбе для микроволнового облучения и нагревают в реакторе с микроволновым облучением при температуре 180 градусов в течение примерно 6 минут. Реакционную смесь охлаждают до комнатной температуры и распределяют между этилацетатом и водой. Органический слой промывают водой дважды и сушат над Na2SO4. Удаление растворителя приводит к получению твердого вещества желтого цвета. Полученное твердое вещество прмывают дихлорметаном, чтобы получить твердое вещество белого цвета. ЯМР в DMSO-d6: 8,86 (с, 1Н); 8,38 (с, 1H); 7,70 (ушир.с, 2H); 7,48 (д, 2H); 6,90 (д, 2H); 6,70 (с, 1H); 4,65-4,15 (м, 4H); 3,45 (м, 4H); 3,18 (м, 2H); 2,98 (м, 4H); 2,20 (с, 3H); 1,38 (с, 9H); 1,22 (м, 6H); ЖХ/МС (M+1=592,3).
Пример 10. Получение 1-((2S,6R)-4-(6-(3-(4-(пиперазин-1-ил)фениламино)-5-амино-1Н-1,2,4-триазол-1-ил)пиримидин-4-ил)-2,6-диметилпиперазин-1-ил)этанона (10)
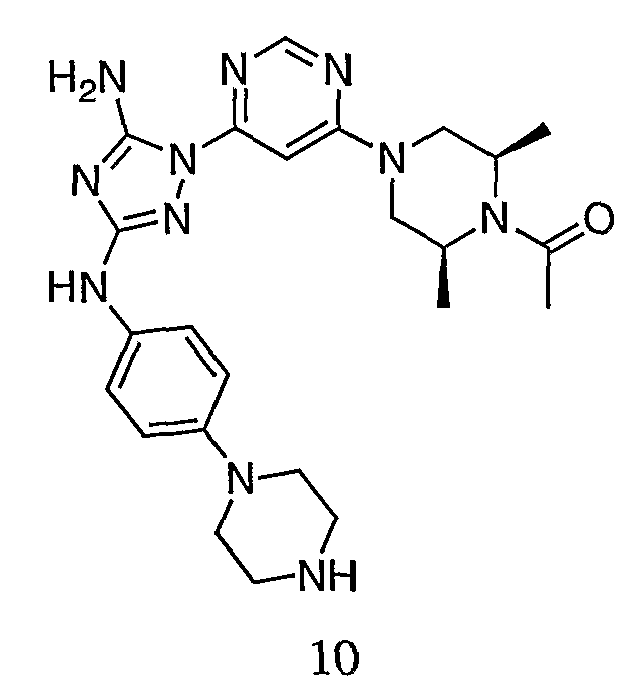
К раствору соединения 9 (1,0 г, 1,70 ммоль) в 15 мл дихлорметана добавляют 5 мл трифторуксусной кислоты. Реакционную смесь перемешивают при комнатной температуре в течение примерно 30 минут. HPLC показывает завершение реакции. Растворитель удаляют в вакууме, и полученный маслянистый продукт распределяют между дихлорметаном и водным раствором NaHCO3. Органический слой промывают водным раствором NaHCO3 несколько раз и сушат над Na2SO4. Удаление растворителя дает 805 мг желаемого продукта (выход составляет 96,9%).
Пример 11. Получение соединения I-113
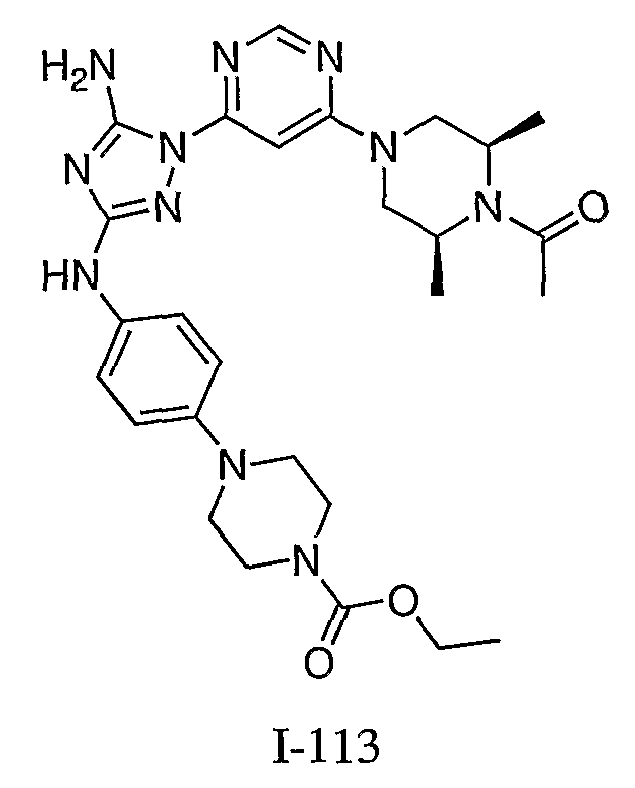
Общий способ формирования молекулы карбамата в соответствии с методикой, аналогичной методике, описанной для получения соединения I-113.
Пример 12. Получение соединения I-60
Общий способ формирования молекулы производного мочевины в соответствии с методикой, аналогичной методике, описанной для получения соединения I-60.
Схема 4: Маршрут получения диаминотриазольных соединений.
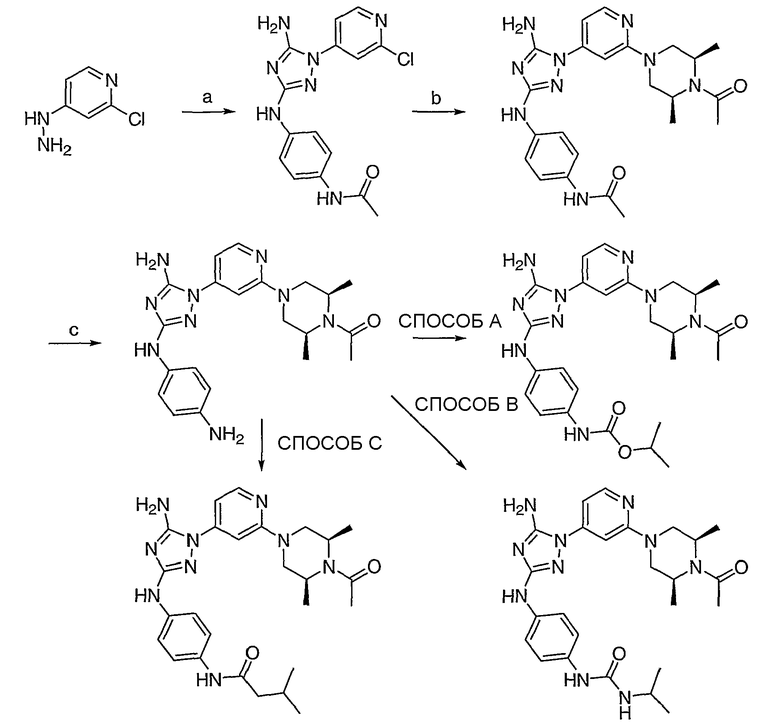
(а) N-циано-N'-(4-ацетамидофенил)-O-фенилизомочевина, NMP, DIEA, М.в., 220°C; (b) i: цис-2,6-диметилпиперазин, NMP, М.в., 250°C, ii: Ac2O, основание; (c) 6N HCl, 95°C; СПОСОБ A: изопропилхлорформиат, DIEA, ДМФА; СПОСОБ B: изопропилизоцианат, DIEA, ДМФА; СПОСОБ C: изовалериановая кислота, дициклогексилкарбодиимид, дихлорметан.
Схема 5: Маршрут получения диаминотриазольных соединений.
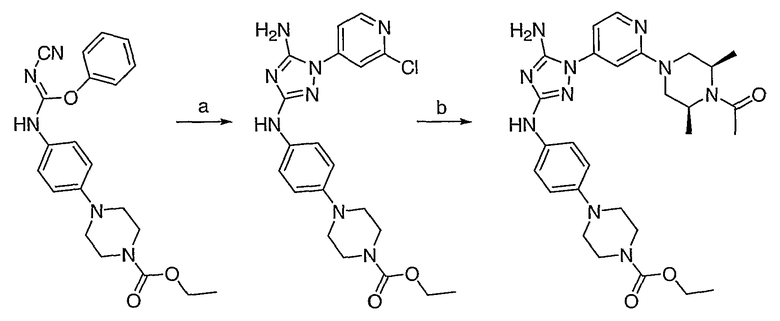
1-(2-хлорпиридин-4-ил)-гидразин, NMP, М.в., 220°C; (b) цис-2,6-диметилпиперазин, NMP, М.в., 250°C.
Пример 13
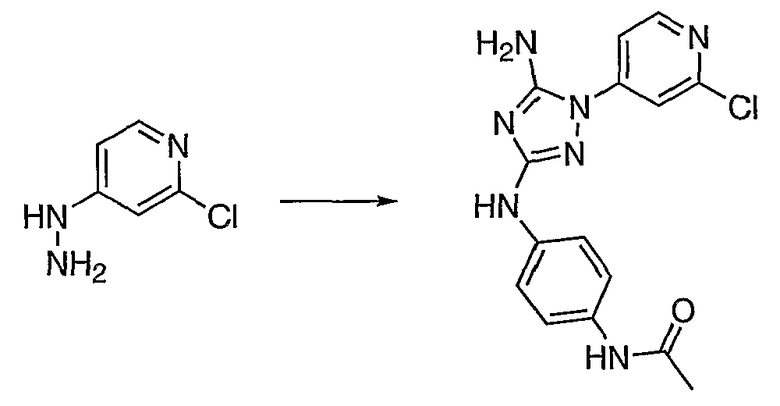
N-{4-[5-Амино-1-(2-хлор-пиридин-4-ил)-1H-[l,2,4]триазол-3-иламино]-фенил}-ацетамид. Реакционную колбу для микроволнового облучения загружают 1,34 г (2-хлорпиридин-4-ил)-гидразина (7,48 ммоль, 1,1 экв.) и 2,00 г N-циано-N'-(4-ацетамидофенил)-O-фенилизомочевины (6,80 ммоль, 1 экв.). Твердые вещества растворяют в 40 мл NMP и 8 мл DIEA. Герметизированную колбу нагревают до температуры 220°C в течение 6 минут при микроволновом облучении. После охлаждения полученный раствор выливают в 200 мл насыщенного раствора бикарбоната натрия. Осадок собирают и промывают 3×100 мл воды. После высушивания азеотропной перегонкой (3×50 мл ацетонитрила) твердое вещество темно-желтого цвета (2,0 г, 5,80 ммоль, 85% выход) используют без дополнительной очистки. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,68 (1H, с), 9,00 (1H, с), 8,40 (1H, д), 7,67 (2H, м), 7,50 (2H, д), 7,40 (2H, д), 6,95 (2H, с), 2,0 (3H, с) м.д. ЖХ/МС: 2,16 минут/343,95 (M+H).
Пример 14. Получение соединения I-35
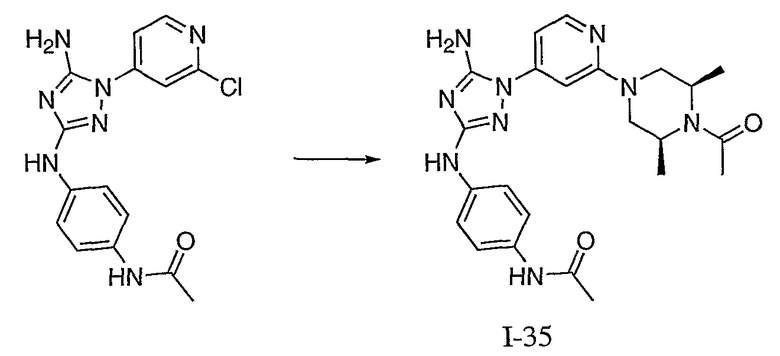
N-(4-{-1-[2-(4-Ацетил-3,5-диметилпиперазин-1-ил)-пиридин-4-ил]-5-амино-1Н-[l,2,4]триазол-3-иламино}-фенил)-ацетамид. К раствору 100 мг N-{4-[5-амино-1-(2-хлор-пиридин-4-ил)-1Н-[1,2,4]триазол-3-иламино]-фенил}-ацетамида (0,291 ммоль, 1 экв.) в 5 мл NMP добавляют 100 мг цис-2,6-диметилпиперазина (0,877 ммоль, 3,0 экв.). Перемешиваемый раствор нагревают до температуры 250°C при микроволновом облучении в течение 15 минут. Реакционную смесь концентрируют выпариванием в вакууме и затем повторно растворяют в 5 мл CH2Cl2 и 5 мл ДМФА. В перемешиваемый раствор добавляют последовательно 1 мл основания Ханига и 100 мкл уксусного ангидрида. Через 3 часа при температуре 25°C реакционную смесь концентрируют до масла темного цвета и очищают с помощью флеш-хроматографии (EtOAc), получая на выходе 15 мг N-(4-{-1-[2-(4-ацетил-3,5-диметилпиперазин-1-ил)-пиридин-4-ил]-5-амино-1H-[l,2,4]триазол-3-иламино}-фенил)-ацетамида (0,0323 ммоль, 11% выход) в виде твердого вещества желтого цвета.
Пример 15. Получение соединения I-41
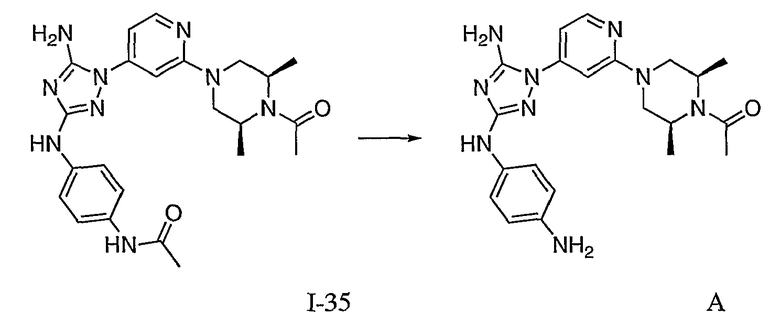
Соединение A: 223,4 мг (0,48 ммоль) соединения I-7 растворяют в 2,0 мл 6N HCl. Реакционную смесь нагревают до температуры 95 градусов. Через час реакционной смеси дают возможность остыть до комнатной температуры. Все летучие вещества удаляют при пониженном давлении. Последние следовые количества воды азеотропнно удаляют с помощью совместной перегонки с толуолом. Остаток отгоняют с помощью высокого вакуума в течение ночи. Выход: предполагаемый 100%. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,36 (ушир.c, 1H), 8,11 (ушир.c, 1H), 7,25 (ушир.c, 2H), 6,90 (ушир.д, 2H), 6,53 (ушир.д, 4H), 4,59-3,98 (м, 6H), 3,04 (ушир.c, 2H), 2,03 (м, 3H), 1,20 (ушир.с, 6H), ЖХ/МС: ЖХ/MС: 1,51 минут/422,2 (M+H).
Пример 16. Получение соединения I-103
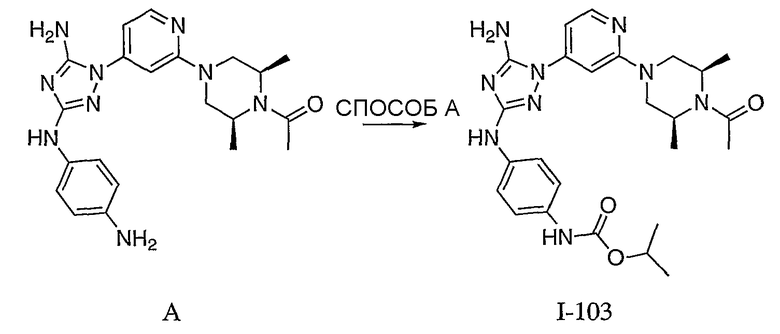
СПОСОБ A: соединение I-103: 46,0 мг (0,10 ммоль) соединения I-7, 80 мкл (0,46 ммоль) DIEA и 120 мкл 1,0 M раствора изопропилхлорформиата (0,12 ммоль) растворяют в 1,0 мл ДМФА. Реакционной смеси дают возможность перемешиваться при комнатной температуре в течение ночи. Реакционную смесь разбавляют 2,0 мл H2O и фильтруют через 0,45 мкм пластинку. Полученный раствор затем впрыскивают на приготовленную HPLC систему (в 2 объема) и элюируют смесью 5-95% ацетонитрил/вода. Выход: 8,8 мг, приблизительно 14%.
Пример 17. Получение соединения I-107
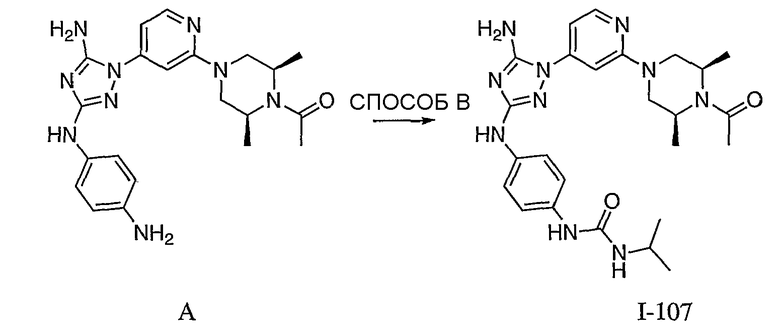
СПОСОБ B: соединение I-107: 55,0 мг (0,12 ммоль) соединения I-7, 100 мкл (0,56 ммоль) DIEA и 12,3 мг (0,14 ммоль) изопропилизоцианата растворяют в 1,0 мл ДМФА. Реакционной смеси дают возможность перемешиваться при комнатной температуре в течение ночи. Реакционную смесь разбавляют 2,0 мл H2O и фильтруют через 0,45 мкм пластинку. Полученный раствор затем впрыскивают на приготовленную HPLC систему (в 2 объема) и элюируют смесью 5%-95% ацетонитрил/вода. Выход: 35,3 мг, приблизительно 47%.
Пример 18. Получение соединения I-111
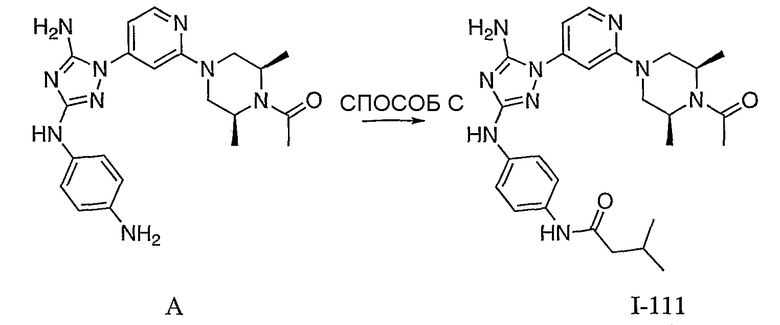
СПОСОБ C: соединение I-111: 31,2 мг (0,30 ммоль) изовалериановой кислоты растворяют в 850 мкл CH2Cl2. Добавляют 150 мкл (0,15 ммоль) 1,0 M раствора дициклогексилкарбодиимида в CH2C12. После перемешивания в течение 15 минут при комнатной температуре раствор фильтруют на 55,6 мг (0,121 ммоль) соединения I-7. Продукт фильтрата промывают через 2,0 мл ДМФА. Полученной реакционной смеси дают возможность перемешиваться при комнатной температуре в течение ночи. Реакционную смесь разбавляют 2,0 мл H2O и фильтруют через 0,45 мкм пластинку. Полученный раствор затем впрыскивают на приготовленную HPLC систему (в 2 объема) и элюируют смесью 10%-90% ацетонитрил/вода. Выход: 23,6 мг, приблизительно 40 %.
Пример 19. Получение соединения I-111
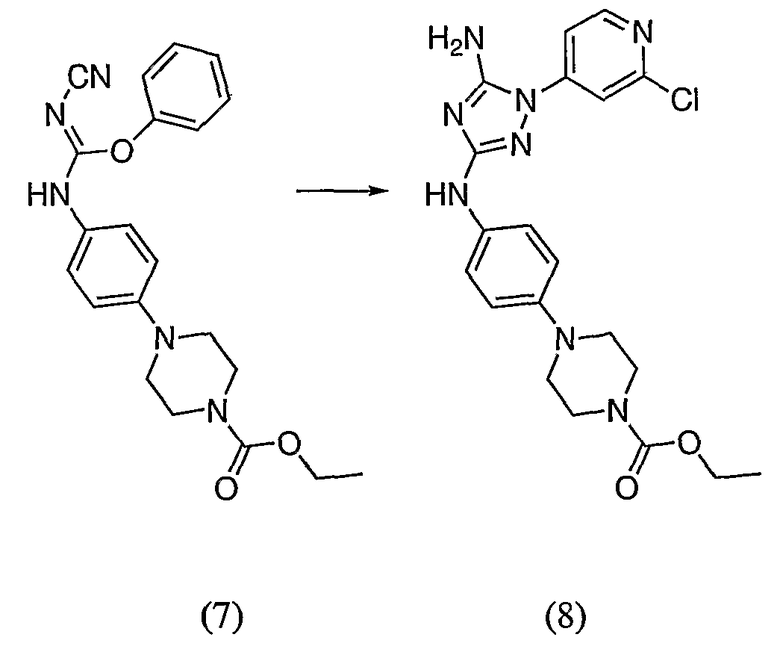
Соединение(8): 5,25 г (13,3 ммоль) соединения (7), 3,78 г (17,5 ммоль) (2-хлорпиридин-4-ил)-гидразина и 13,3 мл (74,7 ммоль) DIEA суспендируют в 26,6 мл NMP. Реакционную смесь герметизируют и нагревают до температуры 220°C при микроволновом облучении. Через 6 минут реакционной смеси дают возможность остыть до комнатной температуры. Реакционную смесь затем выливают на насыщенный водный раствор бикарбоната натрия. Полученную водную фазу разбавляют EtOAc и слои отделяют. Органический слой сушат над MgSO4, фильтруют и выпаривают досуха. Полученный сырой продукт хроматографируют с 6-дюймовым силикагелем и элюируют смесью 5-9% MeOH/CH2Cl2. Еще сравнительно сырой продукт перекристаллизовывают из смеси EtOAc/гексан. Выход: 1,38 г, приблизительно 23%.
Пример 20. Получение соединения I-113
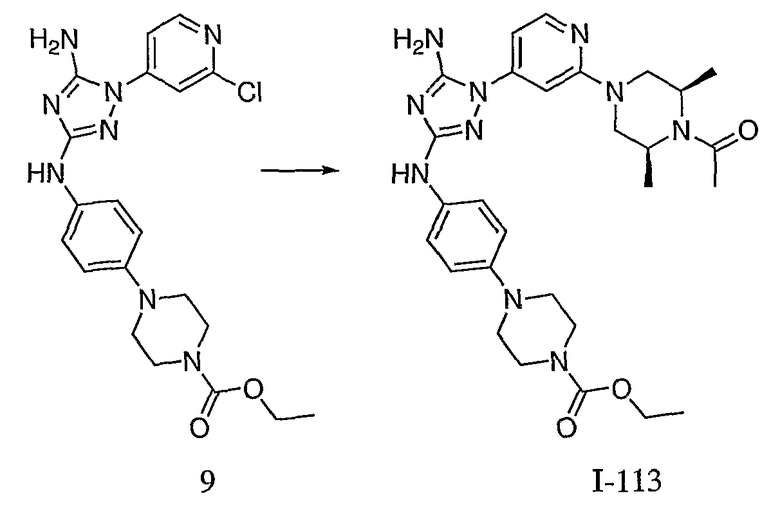
Соединение I-55: 603,6 мг (1,36 ммоль) соединения (9) и 622,5 мг (5,5 ммоль) 2,6-диметилпиперазина суспендируют в NMP. Реакционную смесь нагревают до температуры 250 градусов при микроволновом облучении. Через 15 минут реакционной смеси дают возможность остыть до комнатной температуры. Добавляют 130 мкл (1,6 ммоль) пиридина, а затем 1,3 мл (13,8 ммоль) уксусного ангидрида. Через 30 минут реакционную смесь медленно добавляют к насыщенному раствору бикарбоната натрия. Продукт экстрагируют с помощью EtOAc, сушат над MgSO4, фильтруют и выпаривают досуха. Полученный сырой продукт хроматографируют с 6-дюймовым силикагелем и элюируют смесью 5-9% MeOH/CH2Cl2. Выход: 108 мг, приблизительно 14%.
Пример 21. ЯМР и Масс-спектрометрия соединений
Аналитические данные для определенных соединений по настоящему изобретению собирают и регистрируют следующим образом. Данные протонного ЯМР собирают, используя прибор Bruker AMX 500 и подходящий растворитель. Для ЖХ/MС способа используют колонку Hypersil BDS С18 5 мкм 2,1×50 мм со скоростью потока 1,0 мл/мин с подходящим градиентом. Масс-спектрометрию образцов анализируют на MicroMass ZQ или Quattro II, масс-спектрометр функционирует в одиночном MС режиме с помощью электроспрейной ионизации. Образцы вносят в масс-спектрометр, используя проточное впрыскивание (FIA) или хроматографию. Мобильная фаза для всех масс-спектрометрических анализов содержит ацетонитрил-водную смесь. В отдельных случаях, трифторуксусную кислоту. Таблица 2, (см. в конце описания) изображает характерные LC масс-спектрометрические данные (ЖХ/MС), время задержки (RT) и 1H-ЯМР данные для определенных соединений по настоящему изобретению, где номер соединения в Таблице 2 соответствует соединениям, описанным в Таблице 1 (пустые клетки показывают, что тестирование не проводилось).
Пример 22. Ингибирование FLT-3
Соединения изучают на предмет их способности ингибировать активность FLT-3 при помощи радиометрического фильтр-связывающего исследования. В этом исследовании отслеживается включение 33P в субстрат поли(Glu, Tyr) 4:1 (pE4Y). Реакции проводят в растворе, содержащем 100 мМ HEPES (pH 7,5), 10 мМ MgCl2, 25 мМ NaCl, 1 мМ DTT, 0,01% BSA и 2,5% DMSO. Конечные концентрации субстрата в исследовании составляют 90 мкМ АТФ и 0,5 мг/мл pE4Y (оба реактива - из Sigma Chemicals, St Louis, MO). Конечная концентрация соединений обычно находится в пределах от 0,01 до 5 мкМ. Как правило, 12-точечное титрование проводят путем приготовления серийных разведений из исходного 10 мМ раствора тестируемого соединения в ДМСО. Реакции проводят при комнатной температуре. Раствор 1 содержит 100 мМ HEPES (pH 7,5), 10 мМ MgCl2, 25 мМ NaCl, 1 мг/мл pE4Y и 180 мкМ АТФ (содержащих 0,3 мкКи [Y-33P]АТФ для каждой реакции). Раствор 2 содержит 100 мМ HEPES (pH 7,5), 10 мМ MgCl2, 25 мМ NaCl, 2 мМ DTT, 0,02% BSA и 3 нМ FLT-3. Исследование проводится на 96-луночном планшете путем смешивания 50 мкл раствора 1 и 2,5 мл тестируемых соединений. Реакции инициируют раствором 2. После инкубации в течение 20 минут при комнатной температуре реакцию останавливают 50 мкл 20% TCA, содержащими 0,4 мМ АТФ. Весь объем реакции затем переносят на фильтровальную пластину и отмывают 5% TCA с помощью устройства Harvester-9600 от TOMTEC (Hamden, CT). Величину включения 33P в pE4y анализируют с помощью сцинтилляционного счетчика Packard TopCount Microplate Scintillation Counter (Meriden, CT). Данные обсчитывают с помощью программы Prism для вычисления значений IC50 or Ki.
Многие соединения изобретения, включая соединения в таблице 1, ингибируют FLT-3.
Пример 23: Ингибирование AUR-2
Соединения оценивают следующим образом на их способность ингибировать Aurora-2 с помощью стандартного парного ферментного исследования (Fox et al (1998) Protein Sci 7, 2249). В исходный буферный раствор исследования, содержащий 0,1 М HEPES 7,5, 10 мМ MgCl2, 1 мМ DTT, 25 мМ NaCl, 2,5 мМ фосфоенолпирувата, 300 мМ NADH, 30 мг/мл пируваткиназы, 10 мг/мл лактатдегидрогеназы, 40 мМ АТФ и 800 мкМ пептида (LRRASLG, American Peptide, Sunnyvale, CA), добавляют раствор соединения настоящего изобретения в ДМСО до конечной концентрации 30 мкМ. Полученную смесь инкубируют при 30°C в течение 10 минут. Реакцию инициируют добавлением 10 мкл маточного раствора Aurora-2 до получения конечной концентрации в исследовании 70 нМ. Скорости реакции вычисляют путем контроля интенсивности поглощения при 340 нм в течение 5-минутного периода при 30°C с помощью планшетного считывающего устройства BioRad Ultramark (Hercules, CA). Значения Ki определяют по данным скорости как функцию концентрации ингибитора.
Многие соединения изобретения, включая соединения в таблице 1, ингибируют AUR-2 со значениями Ki менее 50 нМ.
Пример 24: Ингибирование KDR
Соединения оценивают на предмет их способности ингибировать KDR с помощью стандартного парного ферментного исследования (Fox et al., Protein Sci, (1998) 7, 2249). Исследования проводят в смеси 200 мМ HEPES 7,5, 10 мМ MgC12, 25 мМ NaCl, 1 мМ DTT и 1,5% ДМСО. Конечные концентрации субстратов в исследовании составляют 300 мкМ АТФ (Sigma Chemicals) и 10 мкМ поли E4Y (Sigma). Исследования проводят при 37°C и 30 нМ KDR. Конечные концентрации компонентов системы парных ферментов составляют 2,5 мМ фосфоенолпирувата, 200 мкМ NADH, 30 мкг/мл пируваткиназы и 10 мкг/мл лактатдегидрогеназы. Маточный буферный раствор исследования получают содержащим все реактивы, перечисленные выше, за исключением АТФ и тестируемого соединения. 177 мкл маточного раствора помещают в 96-луночный планшет, после чего добавляют 3 мкл 2 мМ маточного раствора ДМСО, содержащего тестируемое соединение (конечная концентрация соединения 30 мкМ). Планшет предварительно инкубируют примерно в течение 10 минут при 37°C, и реакцию инициируют добавлением 20 мкл АТФ (конечная концентрация 300 мкМ). Скорости реакции определяют с помощью считывающего планшетного устройства Molecular Devices (Sunnyvale, CA) в течение 5-минутного периода считывания при 37°C. Соединения, проявляющие более чем 50%-ное ингибирование относительно контрольных лунок, содержащих смесь исследования и ДМСО без тестируемого соединения, титруют для определения значений IC50.
Некоторые соединения изобретения, включая соединения в таблице 1, ингибируют KDR со значениями Ki менее 50 нМ.
Пример 25. Исследование ингибирования JAK3
Соединения оценивают на предмет их способности ингибировать JAK с помощью вышеуказанного исследования. Реакции проводят в киназном буфере, содержащем 100 мМ HEPES (pH 7,4), 1 мМ DTT, 10 мМ MgCl2, 25 мМ NaCl и 0,01% BSA.
Концентрации субстратов в исследовании составляют 5 мкМ АТФ (200 мкКи/мкмоль АТФ) и 1 мкМ поли(Glu)4Tyr. Реакции проводят при 25°С и 1 нМ JAK3.
В каждую лунку 96-луночного поликарбонатного планшета добавляют 1,5 мкл предположительного ингибитора JAK3 с 50 мкл киназного буфера, который содержит 2 мкМ поли(Glu)4Tyr и 10 мкМ АТФ. Затем реакцию перемешивают, и 50 мкл киназного буфера, содержащего 2 нМ фермента JAK3, добавляют для запуска реакции. Через 20 минут инкубации при комнатной температуре (25°С) реакцию останавливают 50 мкл 20% трихлоруксусной кислоты (TCA), которая также содержит 0,4 мМ АТФ. Все содержимое каждой лунки затем переносят в 96-луночный планшет со стекловолоконным фильтром с помощью устройства TomTek Cell Harvester. После отмывания добавляют 60 мкл сцинтилляционной жидкости и определяют включение 33P с помощью счетчика Perkin Elmer TopCount.
Пример 26. Исследование ингибирования JAK2
Исследования проводят так же, как описано выше в примере 25, за исключением того, что используется фермент JAK-2, конечная концентрация поли(Glu)4Tyr составляет 15 мкМ, конечная концентрация АТФ составляет 12 мкМ.
Таблица 3 отражает данные ингибирования JAK2 и JAK3 (Ki) для соединений-образцов. Номера соединений в таблице 3 соответствуют номерам в таблице 1. В таблице 3 «А» означает значение Ki менее чем 0,05 мкМ, «B» означает значение Ki в пределах от 0,05 до 0,5 мкМ для указанного фермента.
В то время как некоторое число воплощений настоящего изобретения описано, очевидно, что основные примеры могут быть видоизменены для получения других воплощений, в которых используются соединения и способы настоящего изобретения. Поэтому следует понимать, что объем настоящего изобретения в большей степени определяется прилагаемой формулой изобретения, нежели частными воплощениями, которые представлены с целью иллюстрации.
Таблица 1. Примеры соединений формулы 1.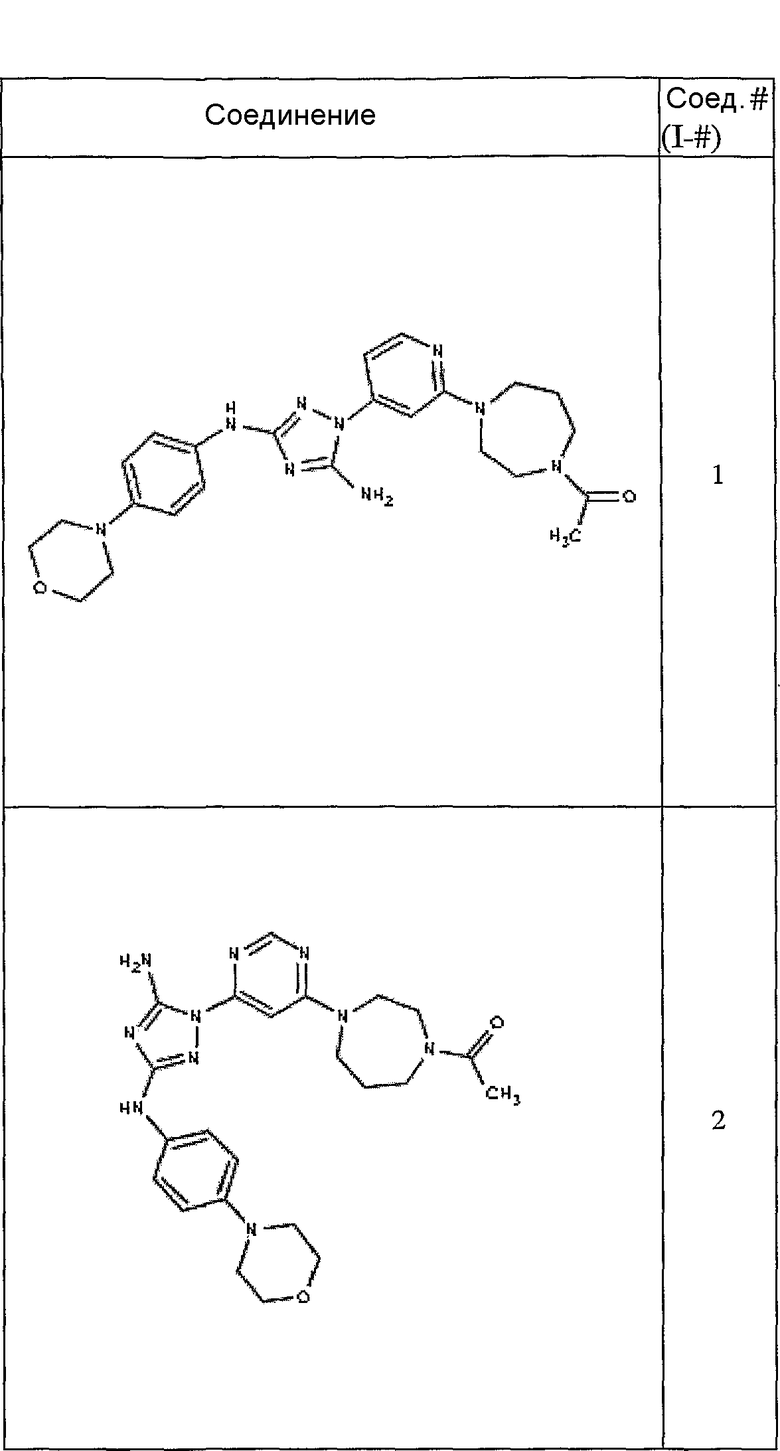
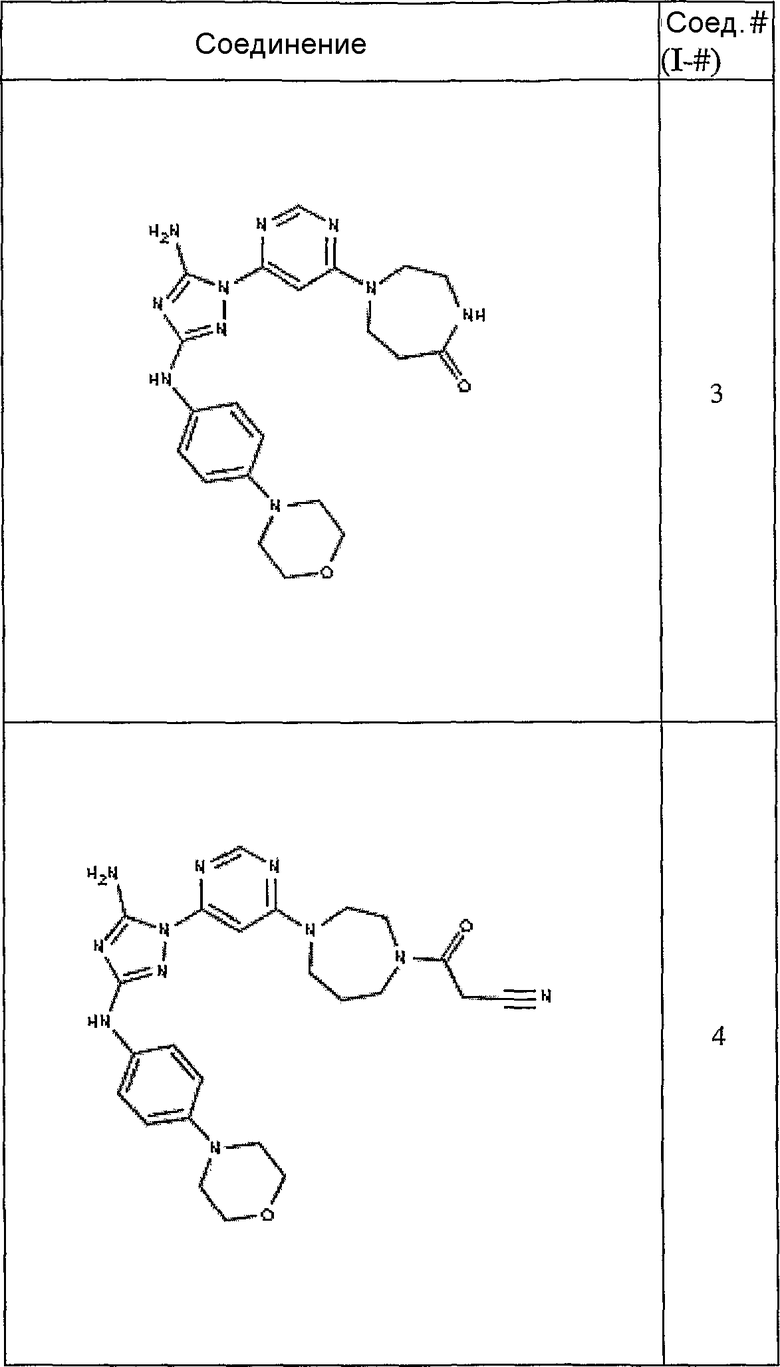
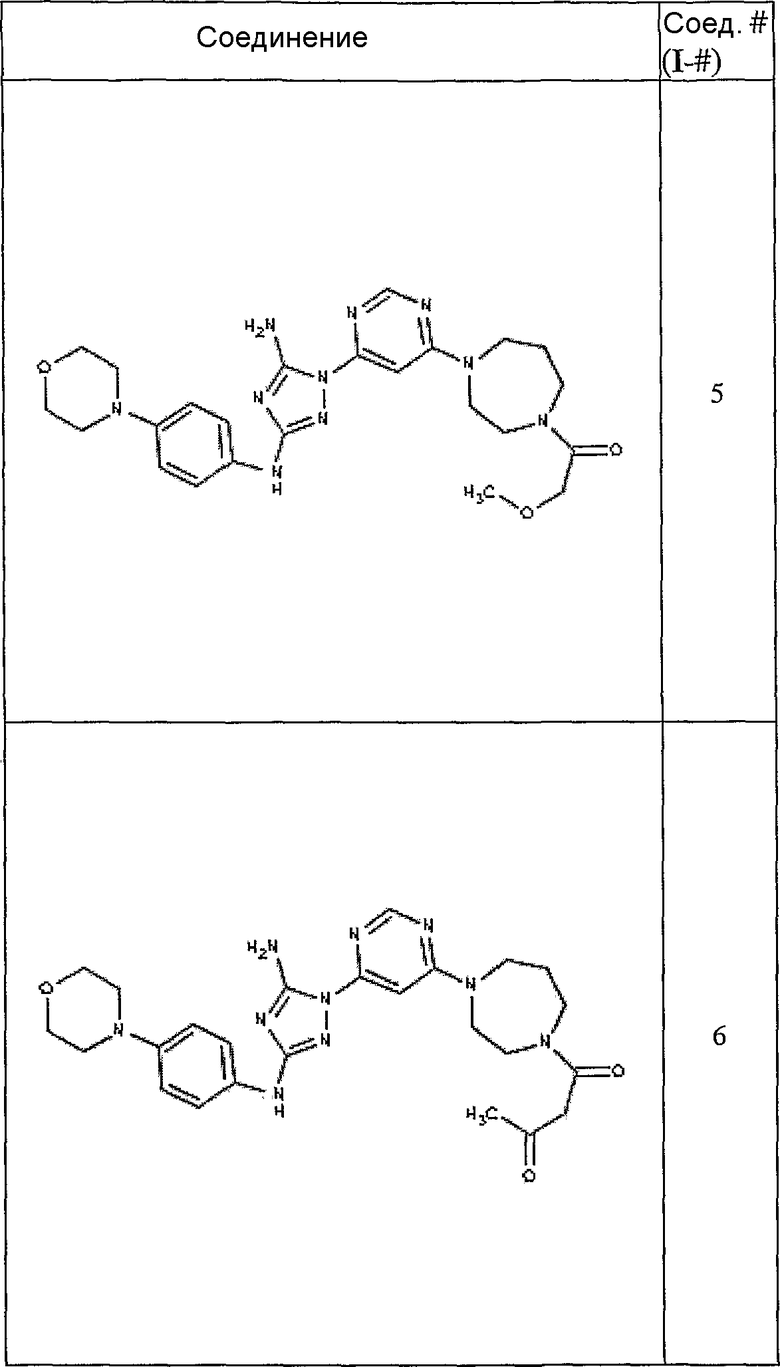
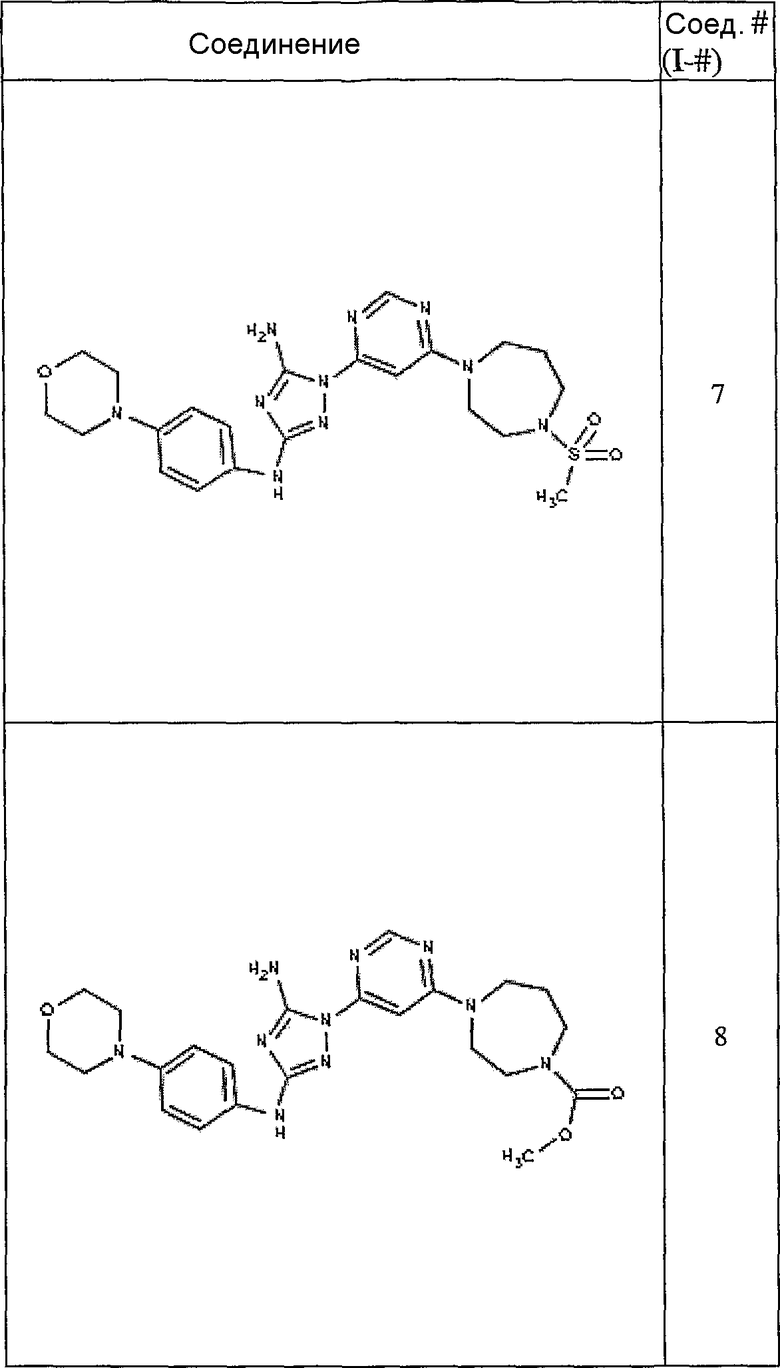
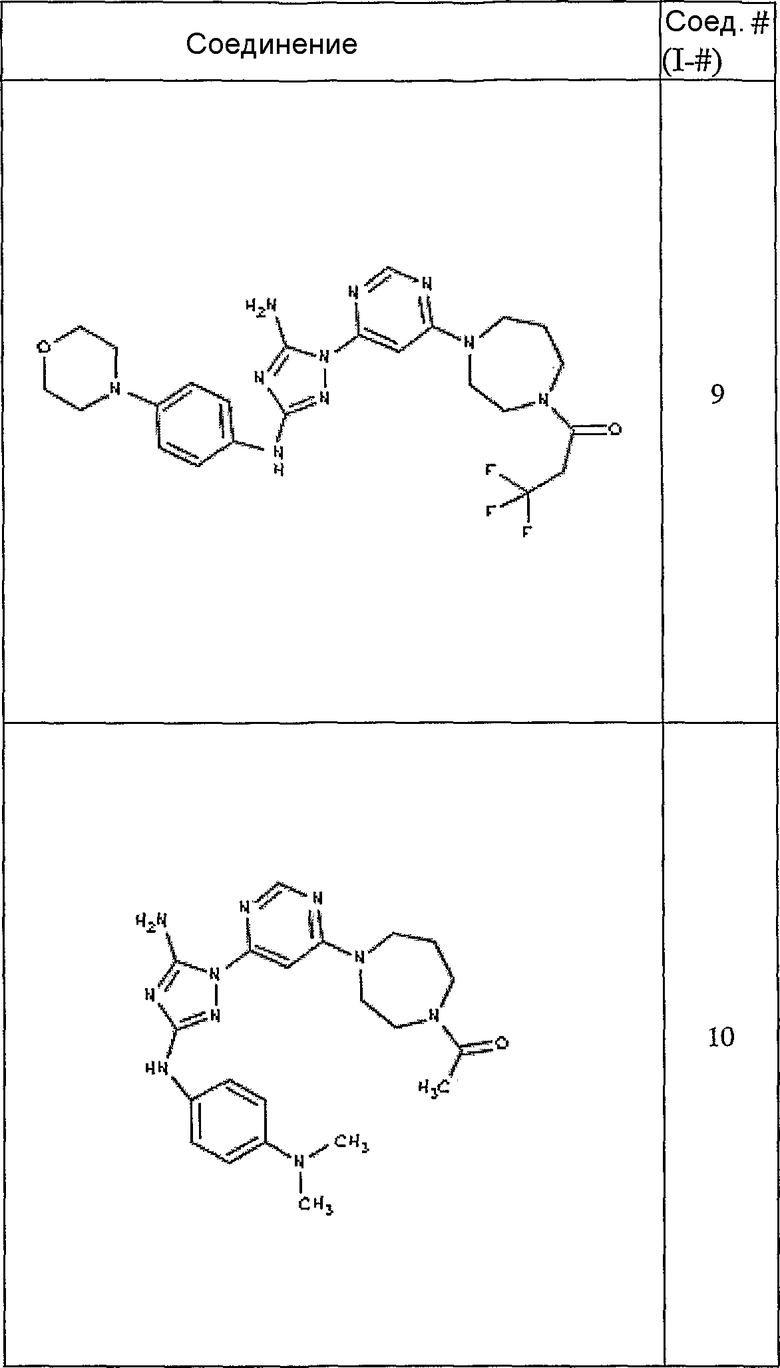
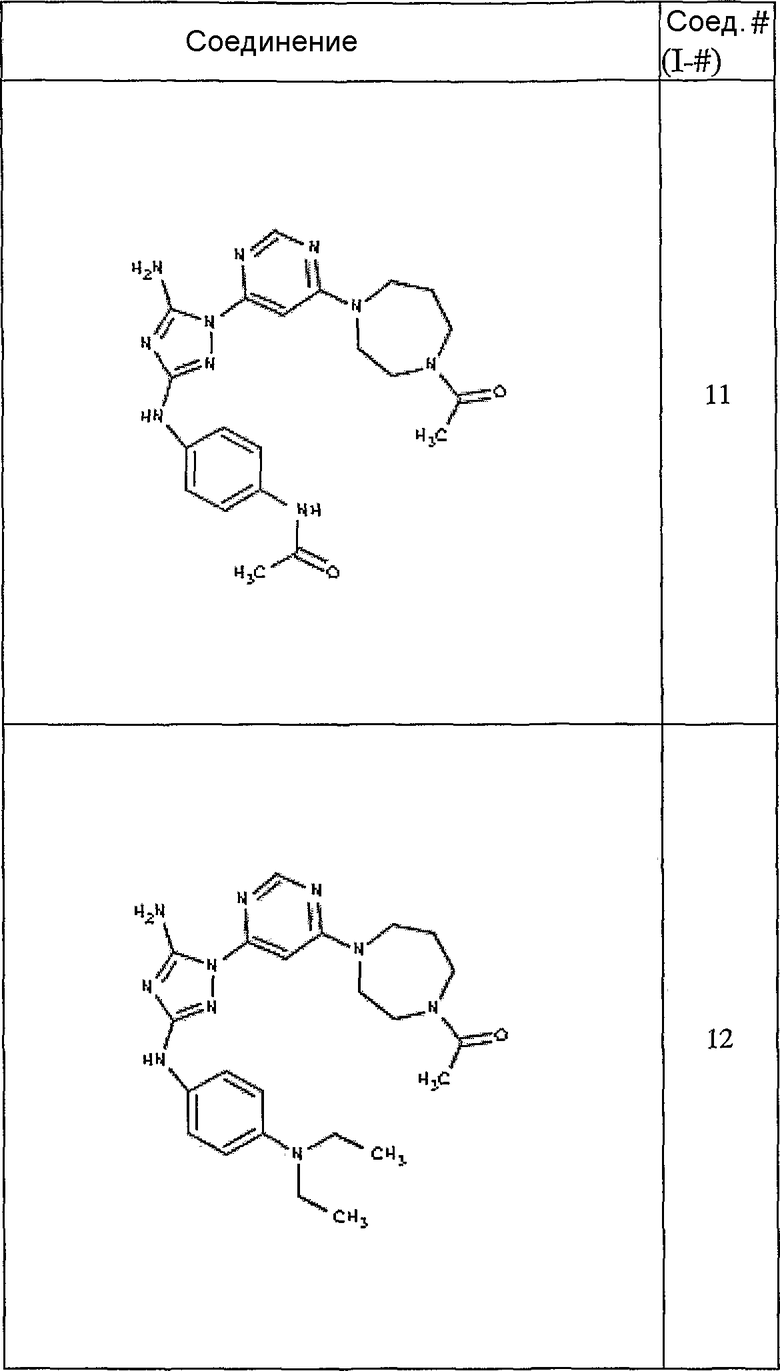
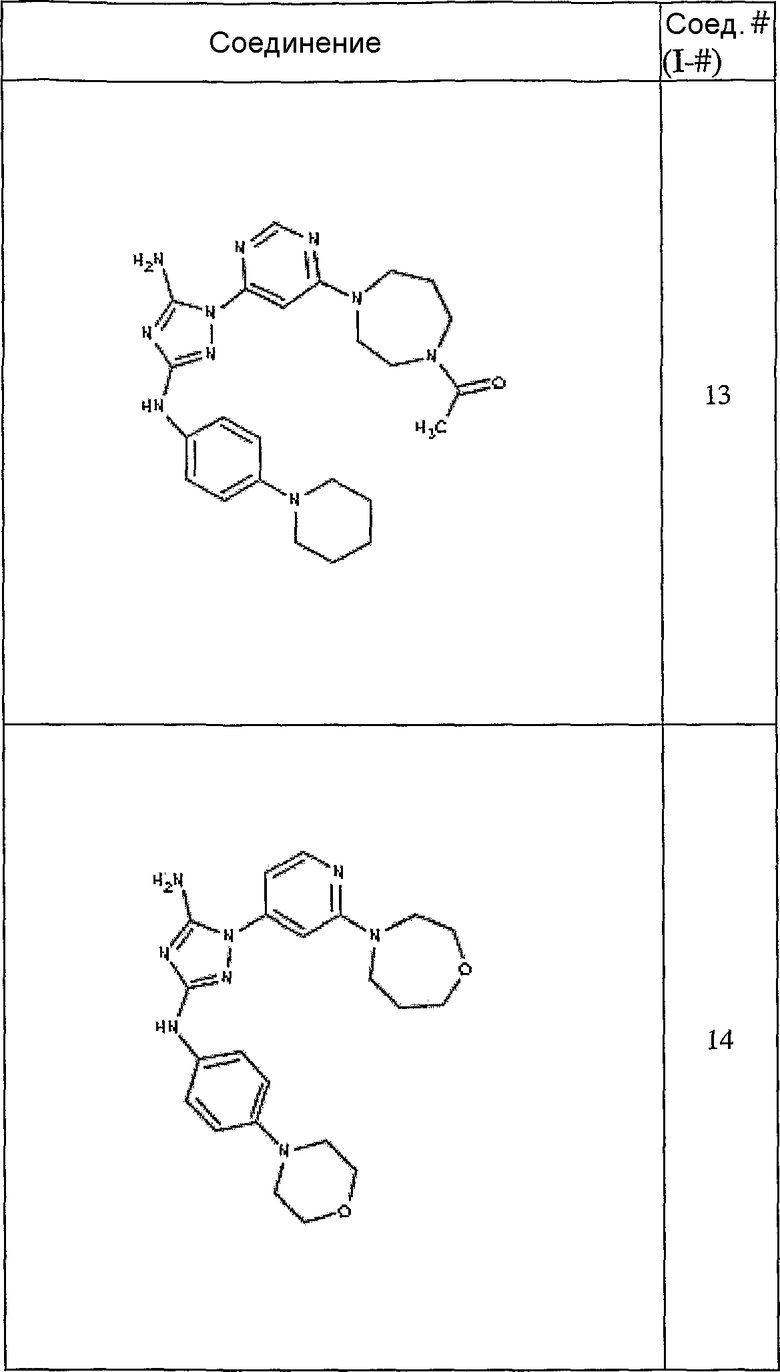
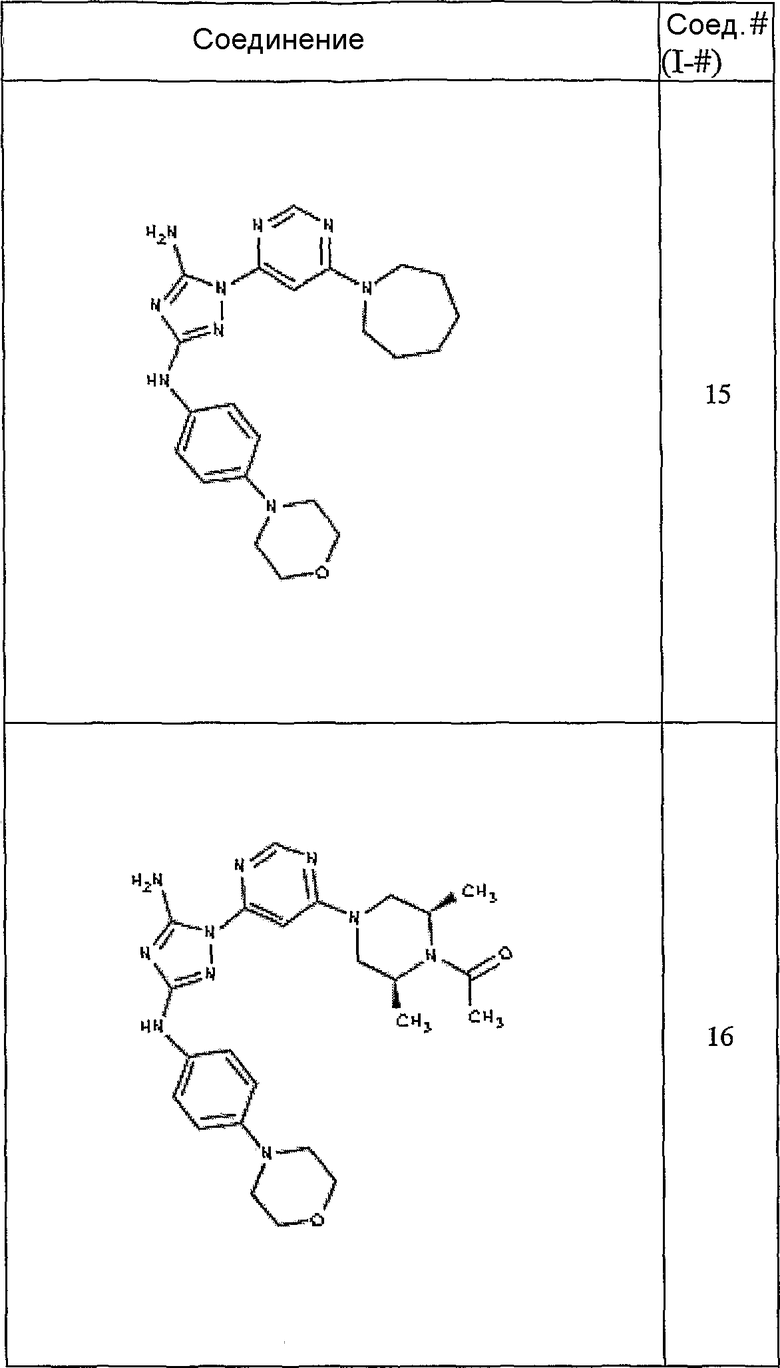
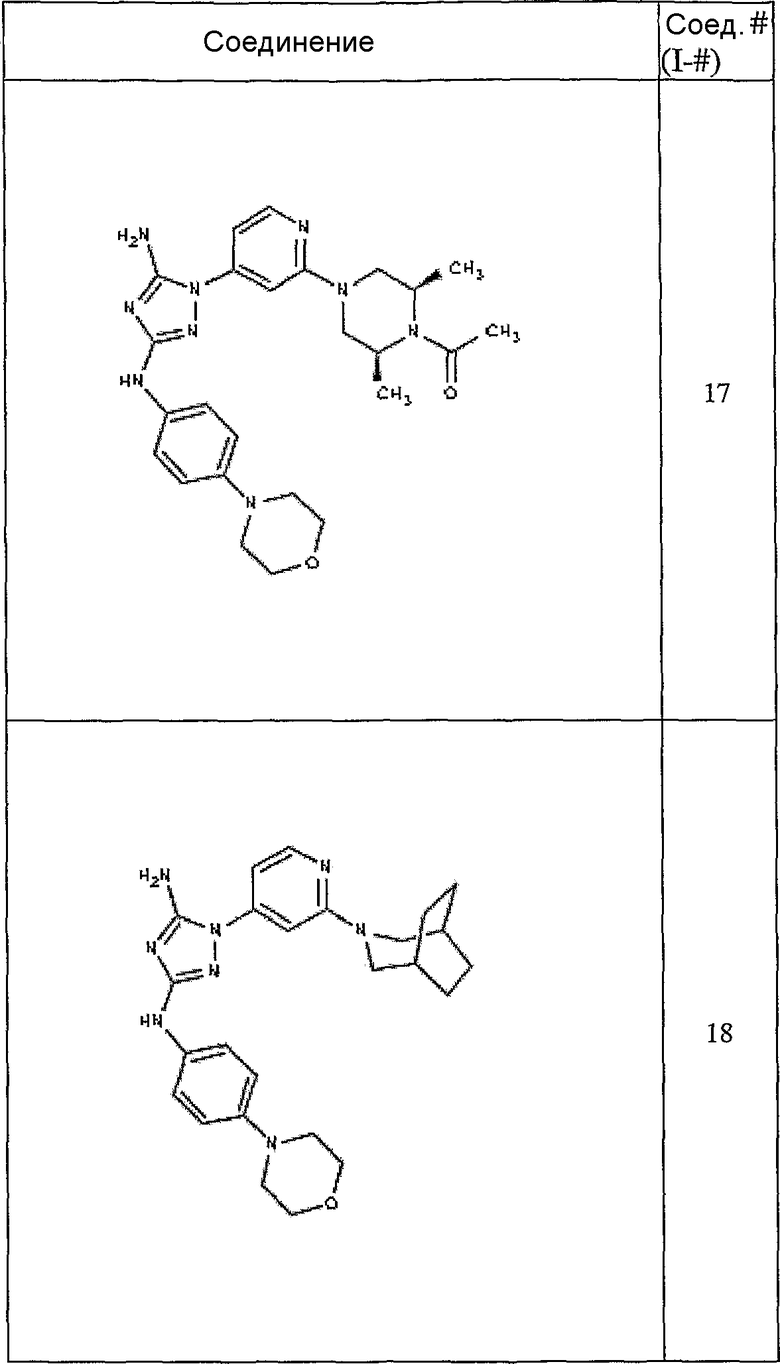
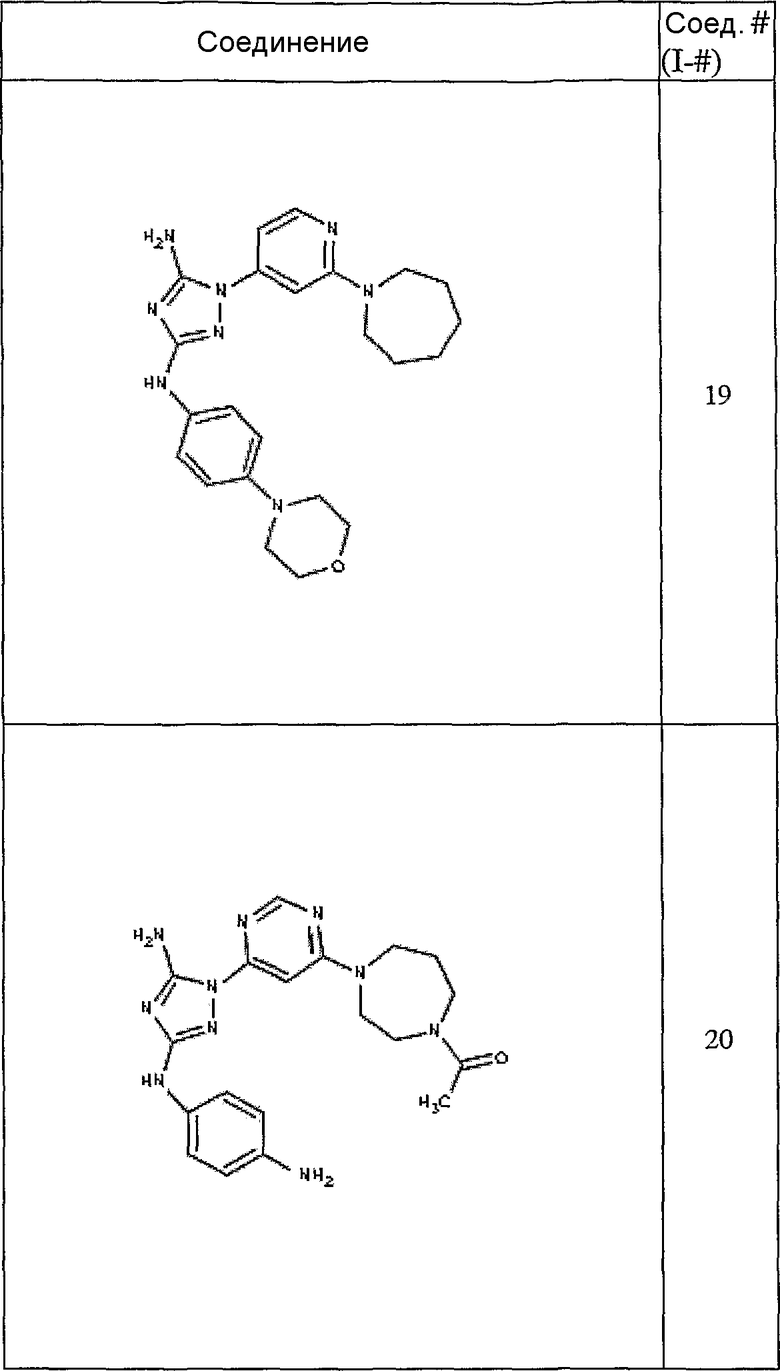
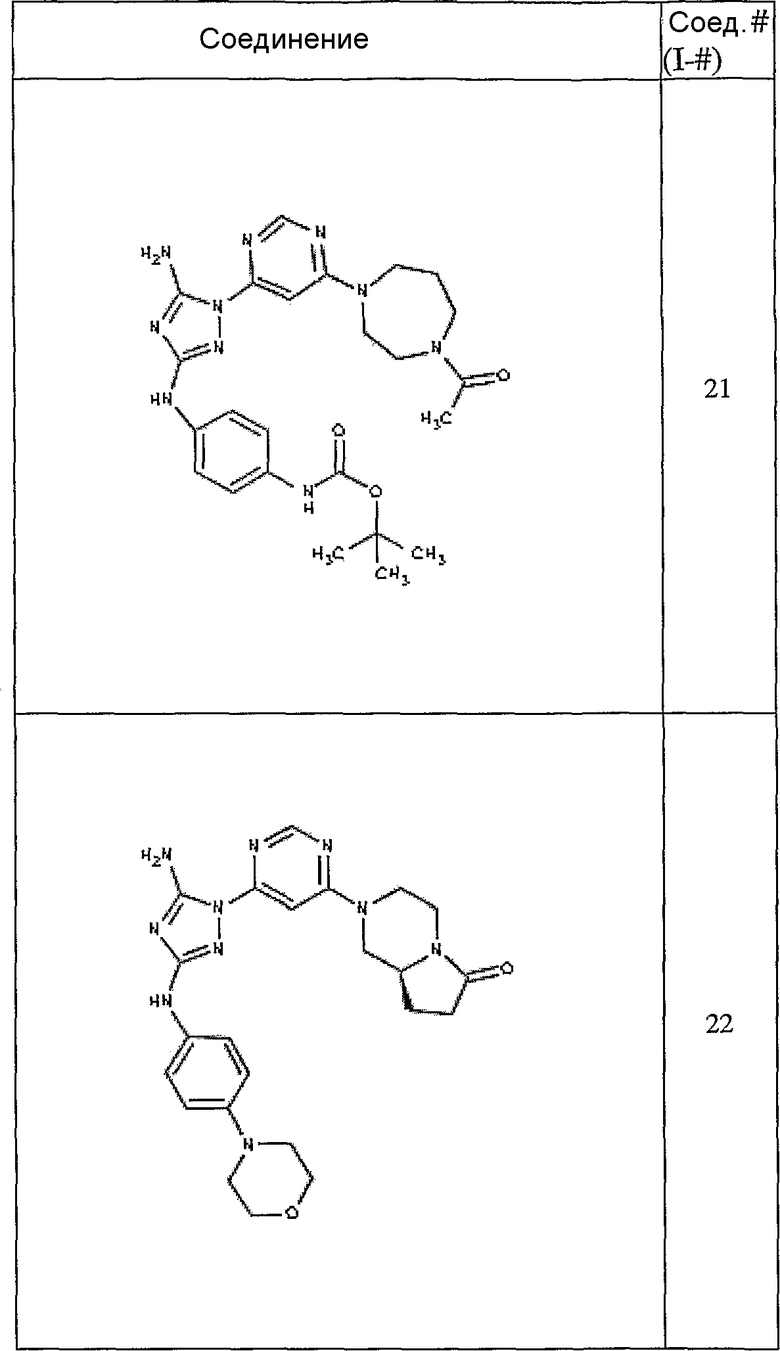
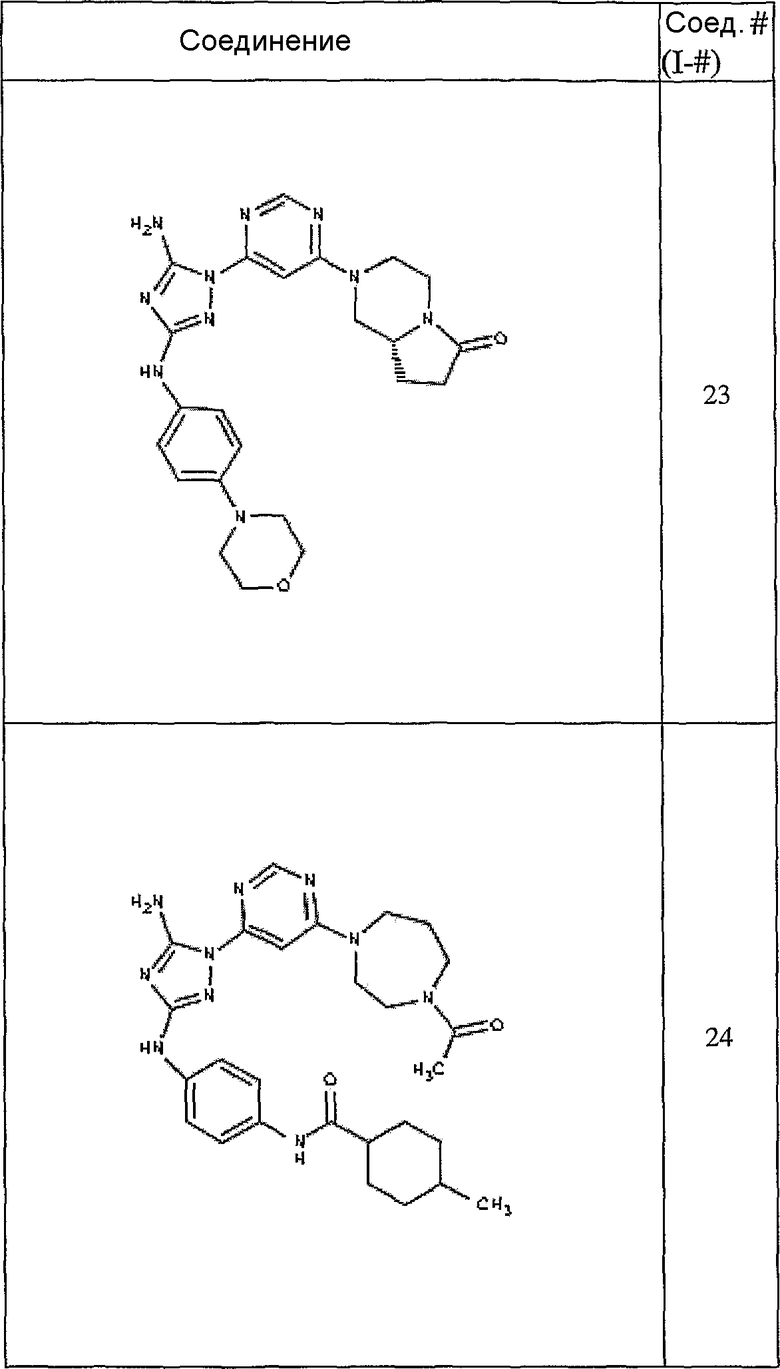
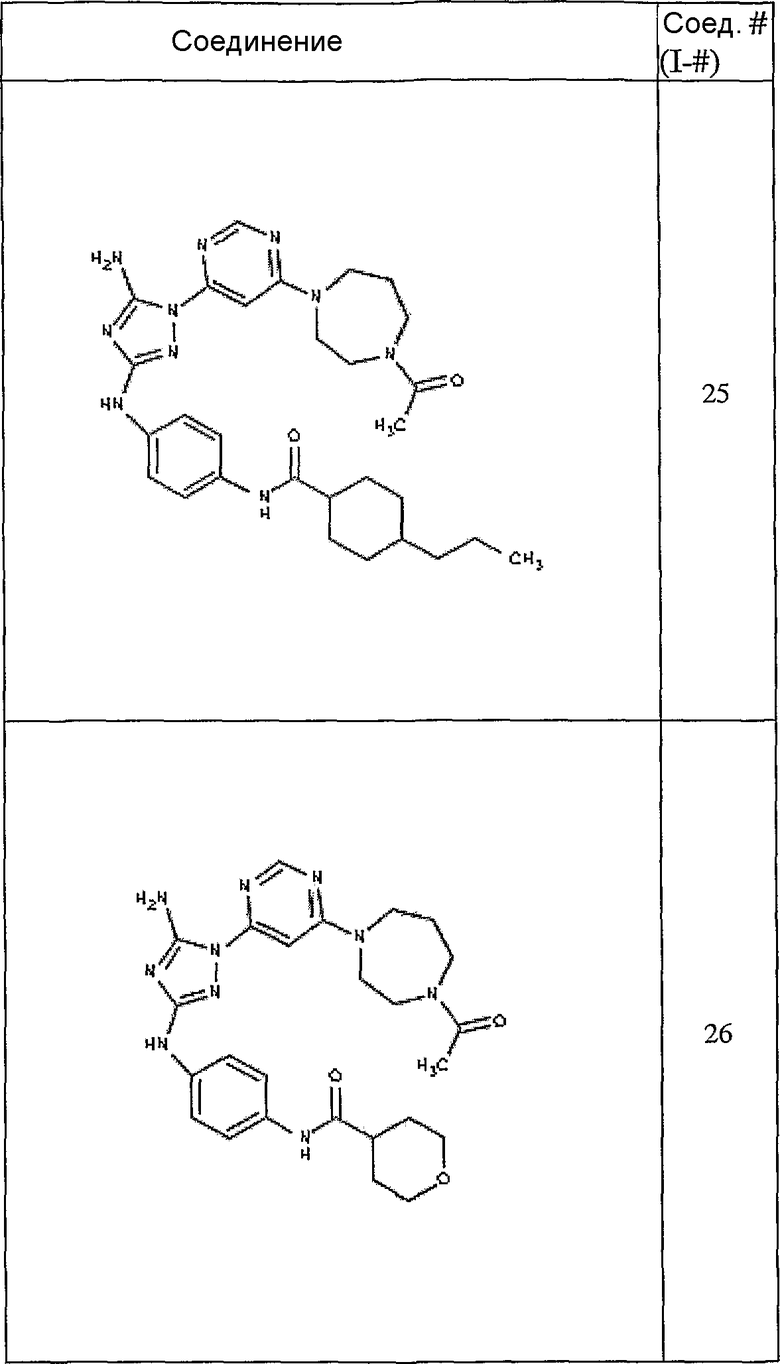
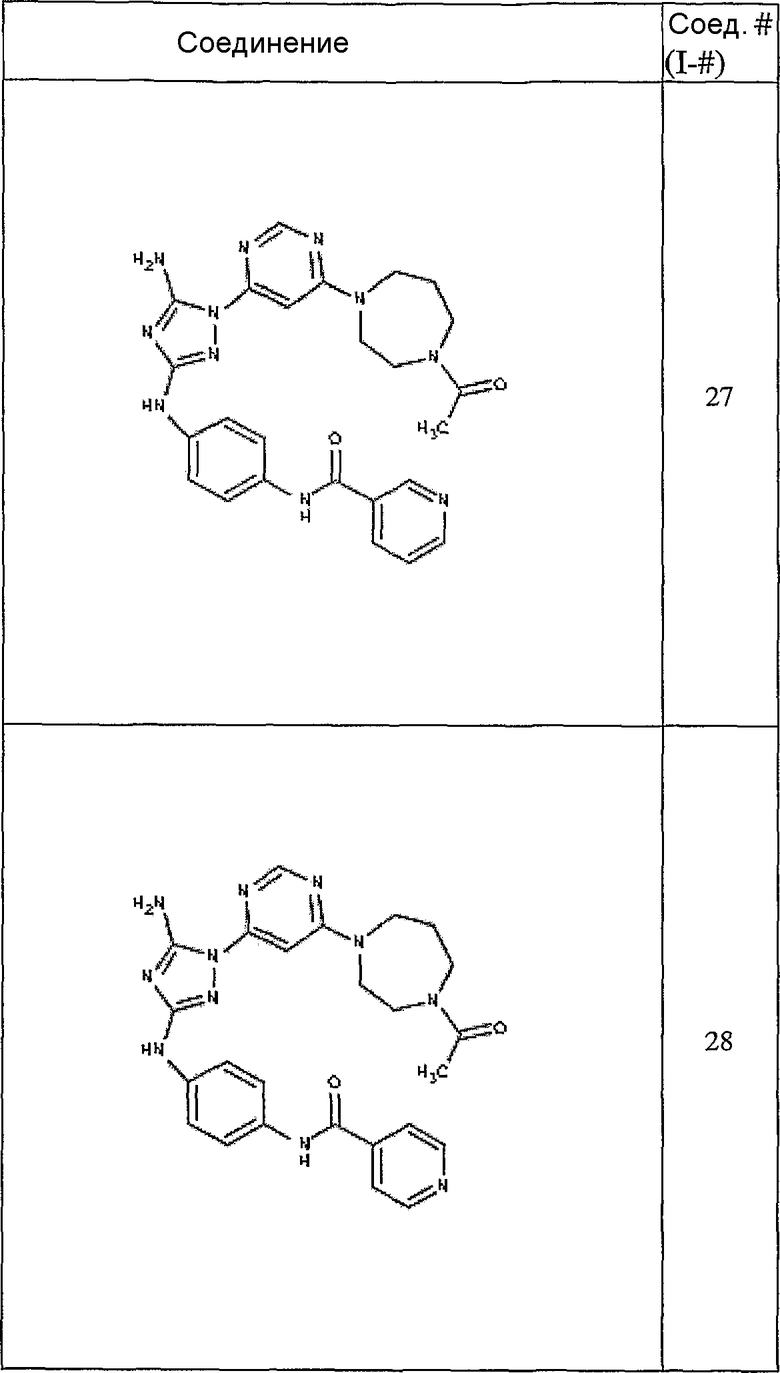
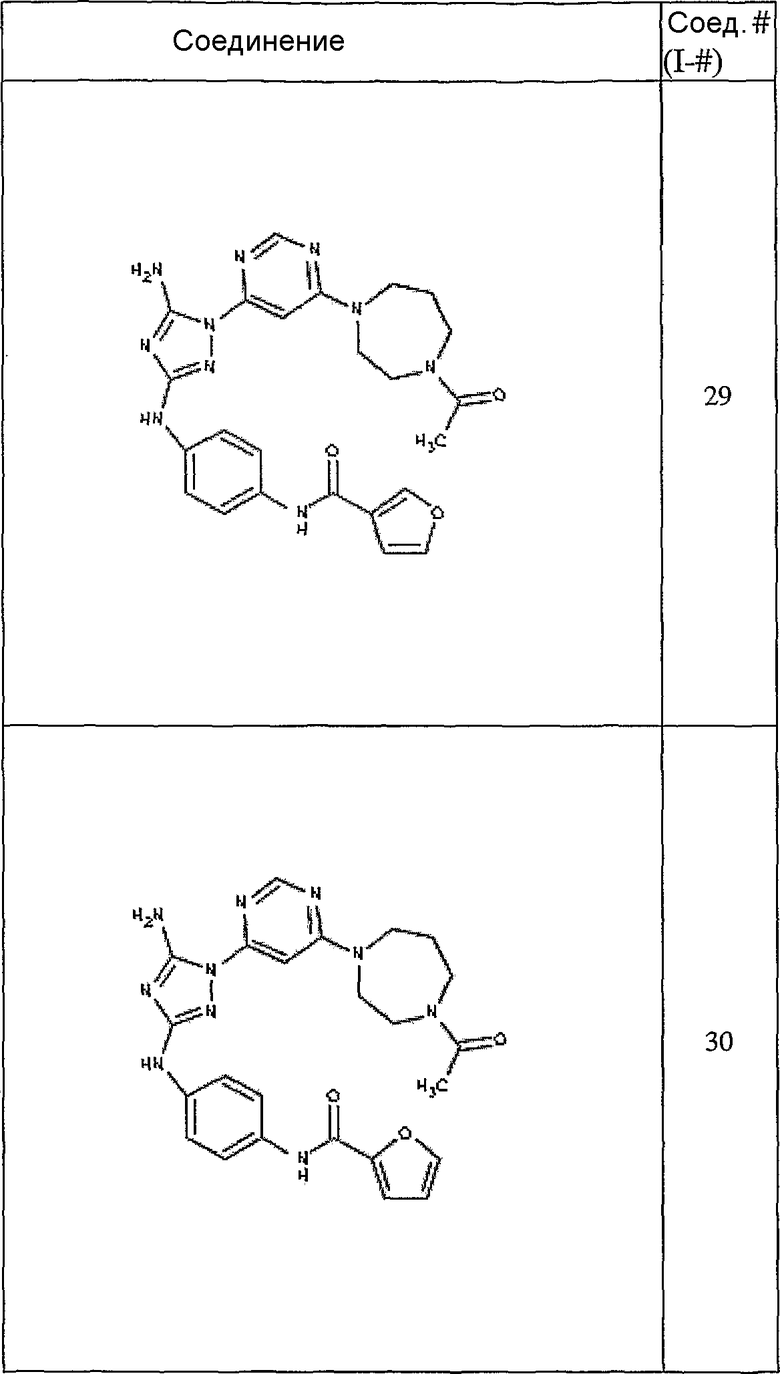
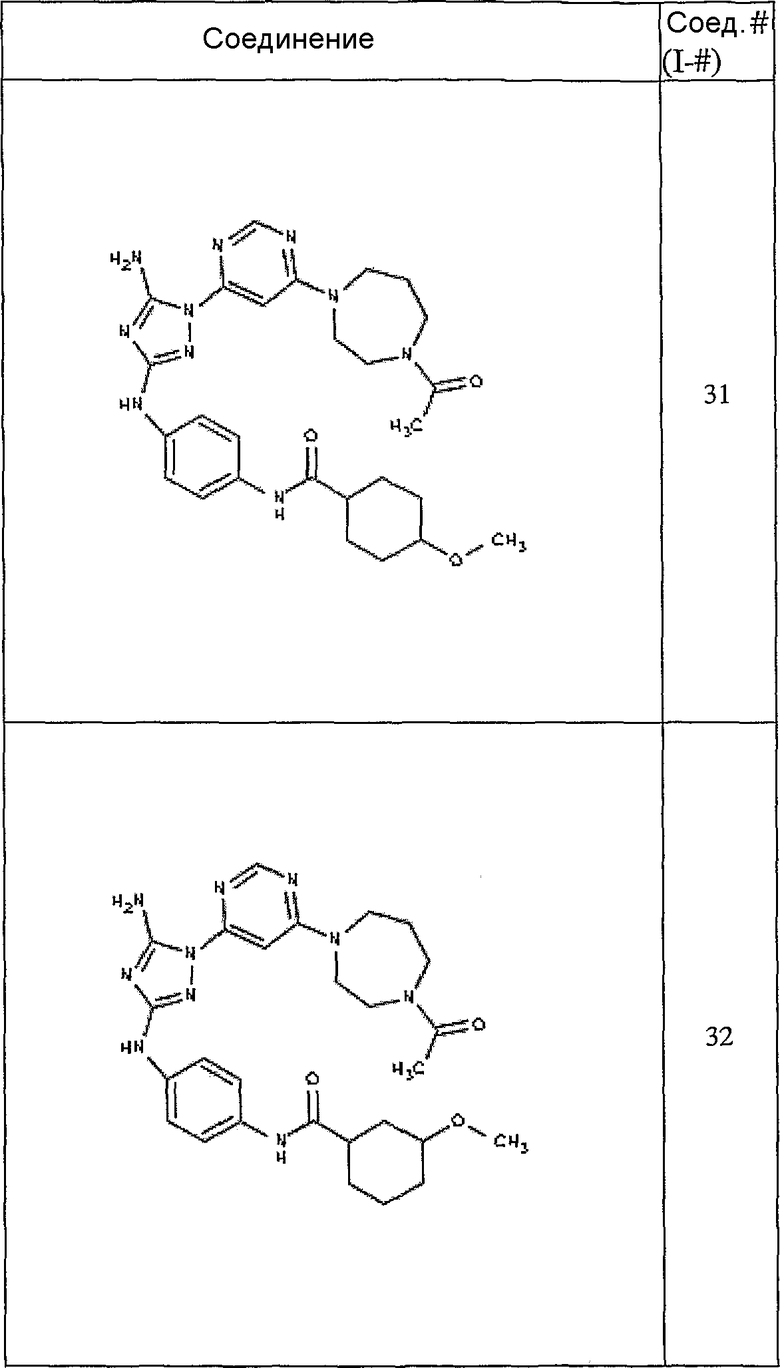
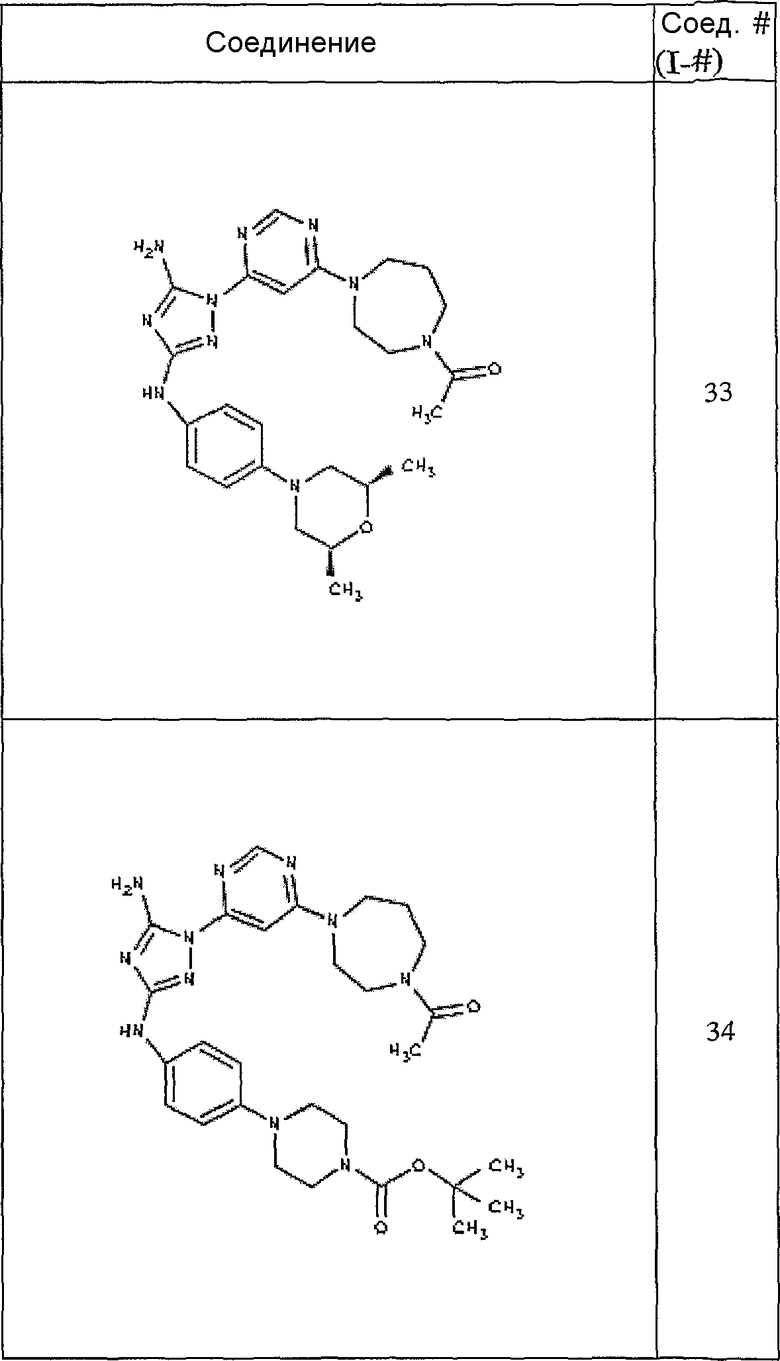

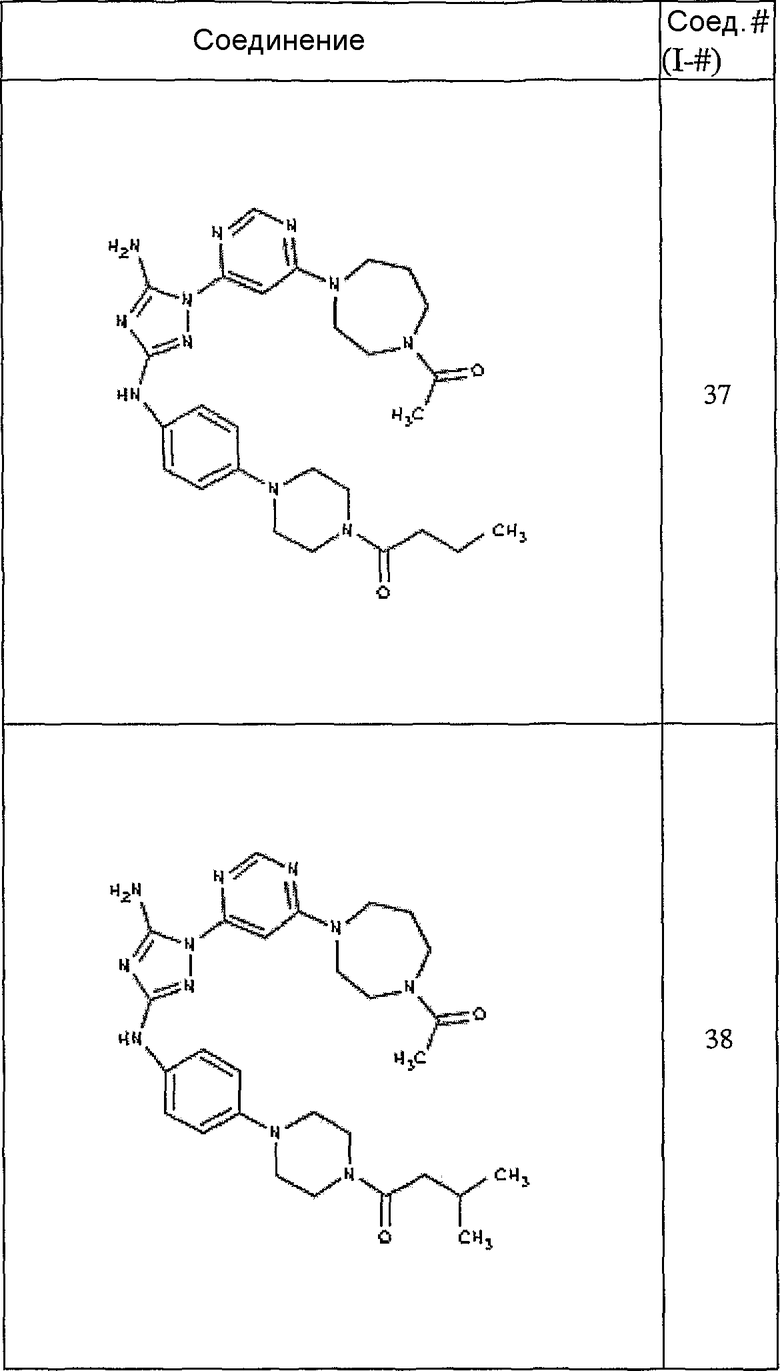
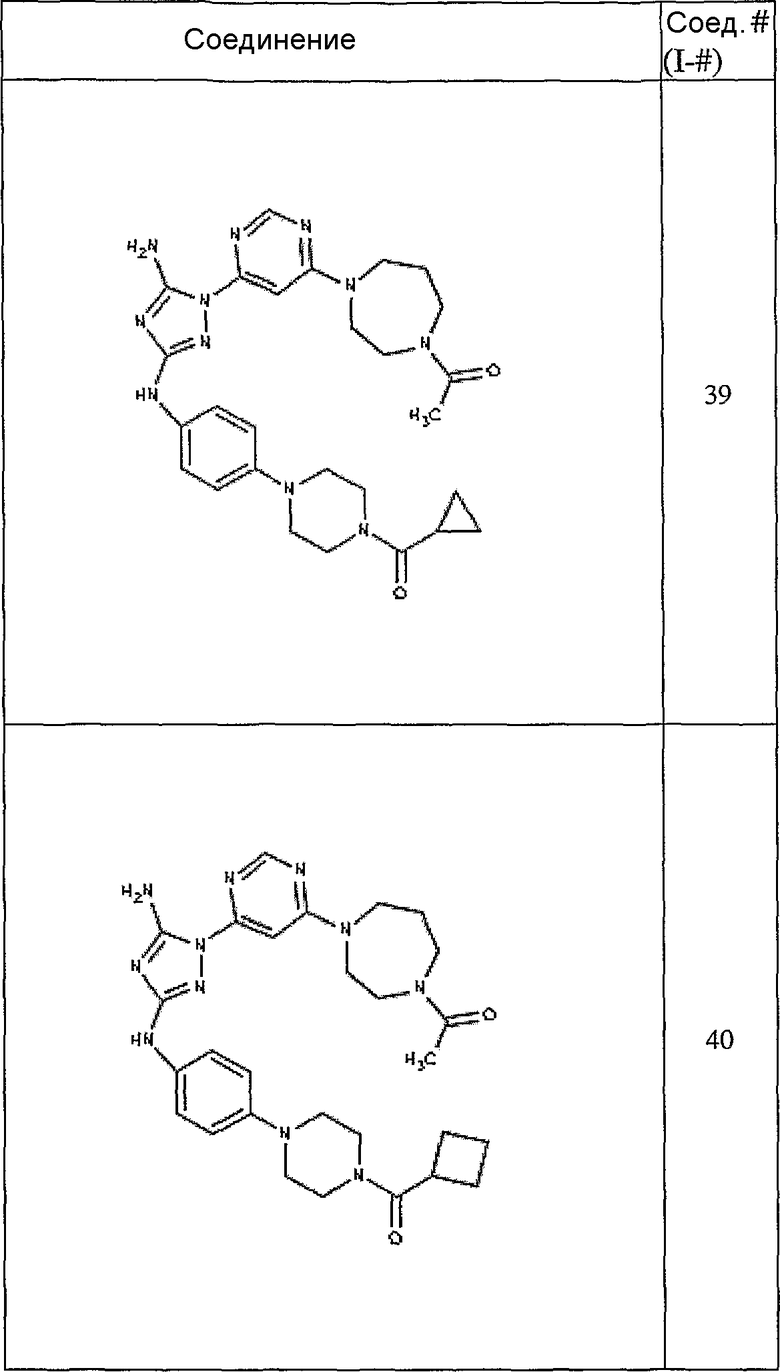
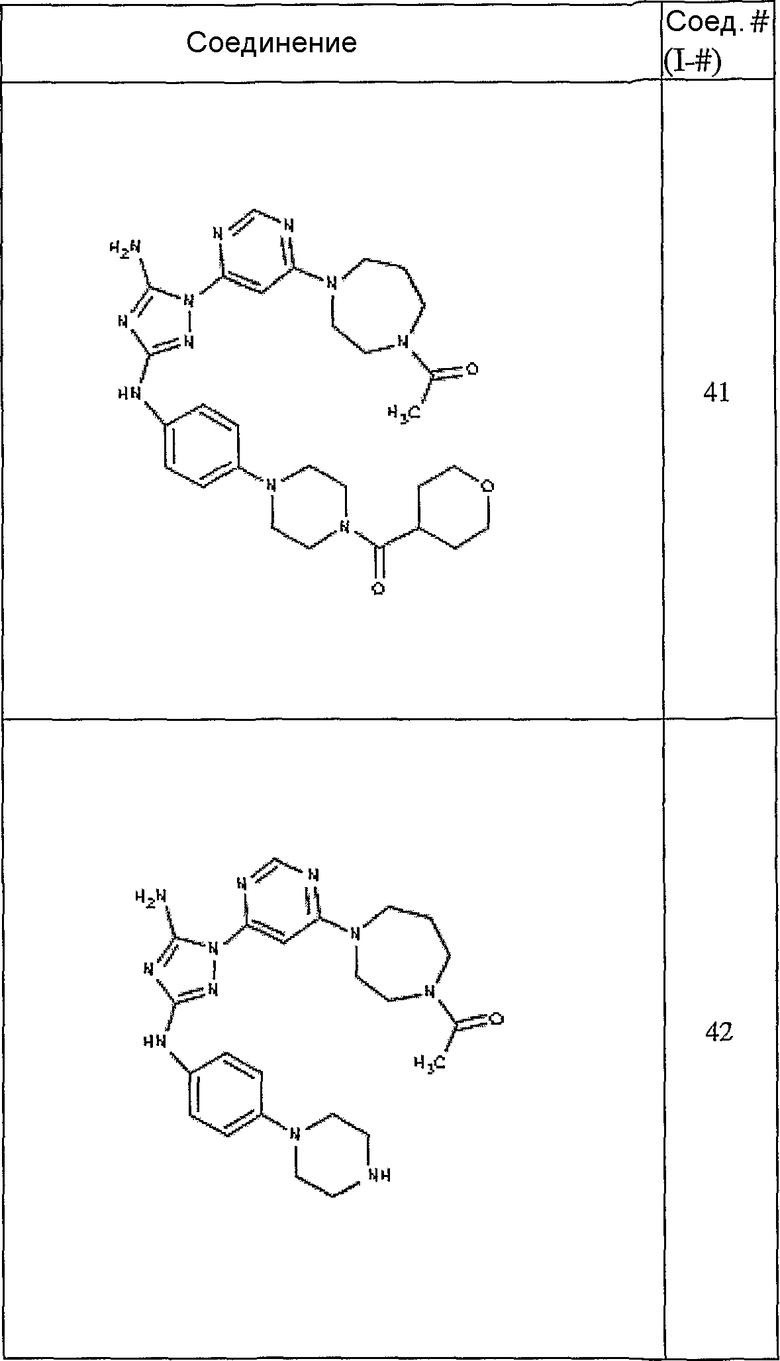
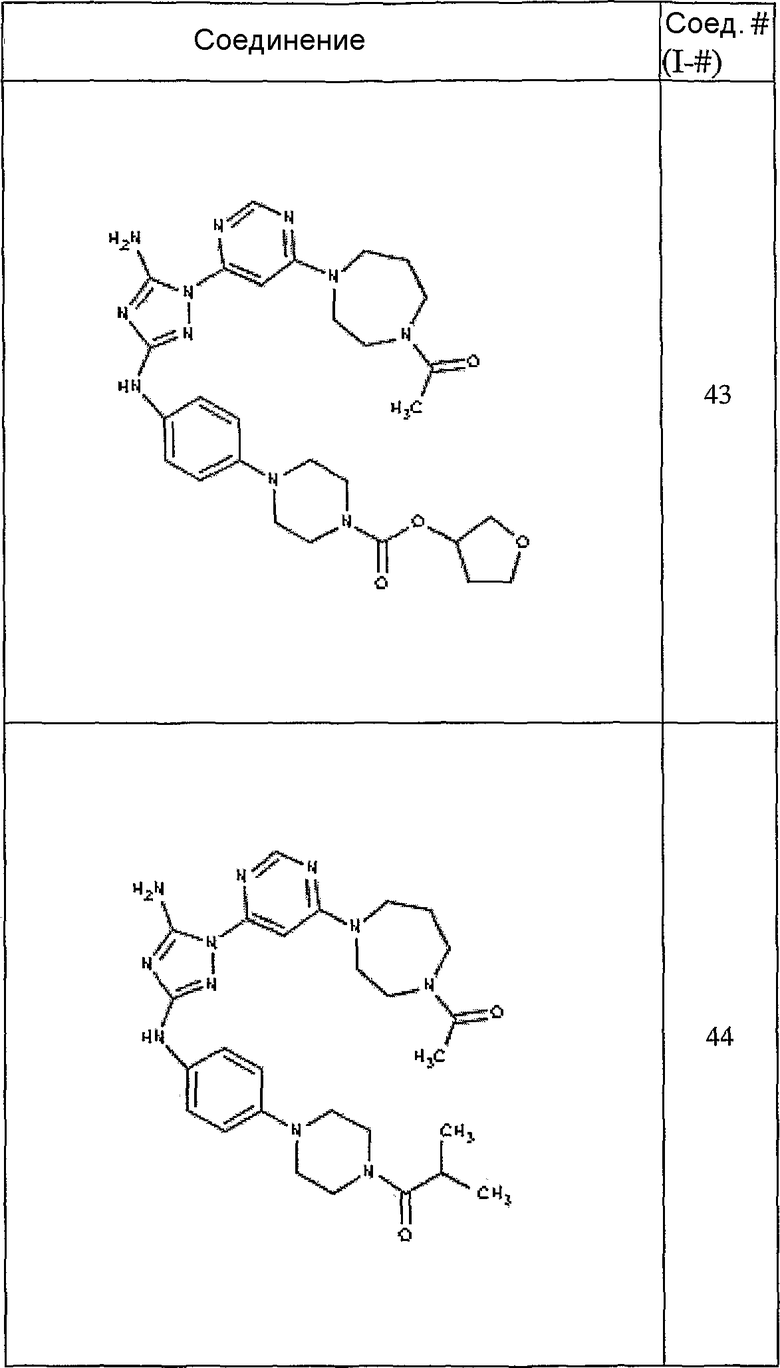
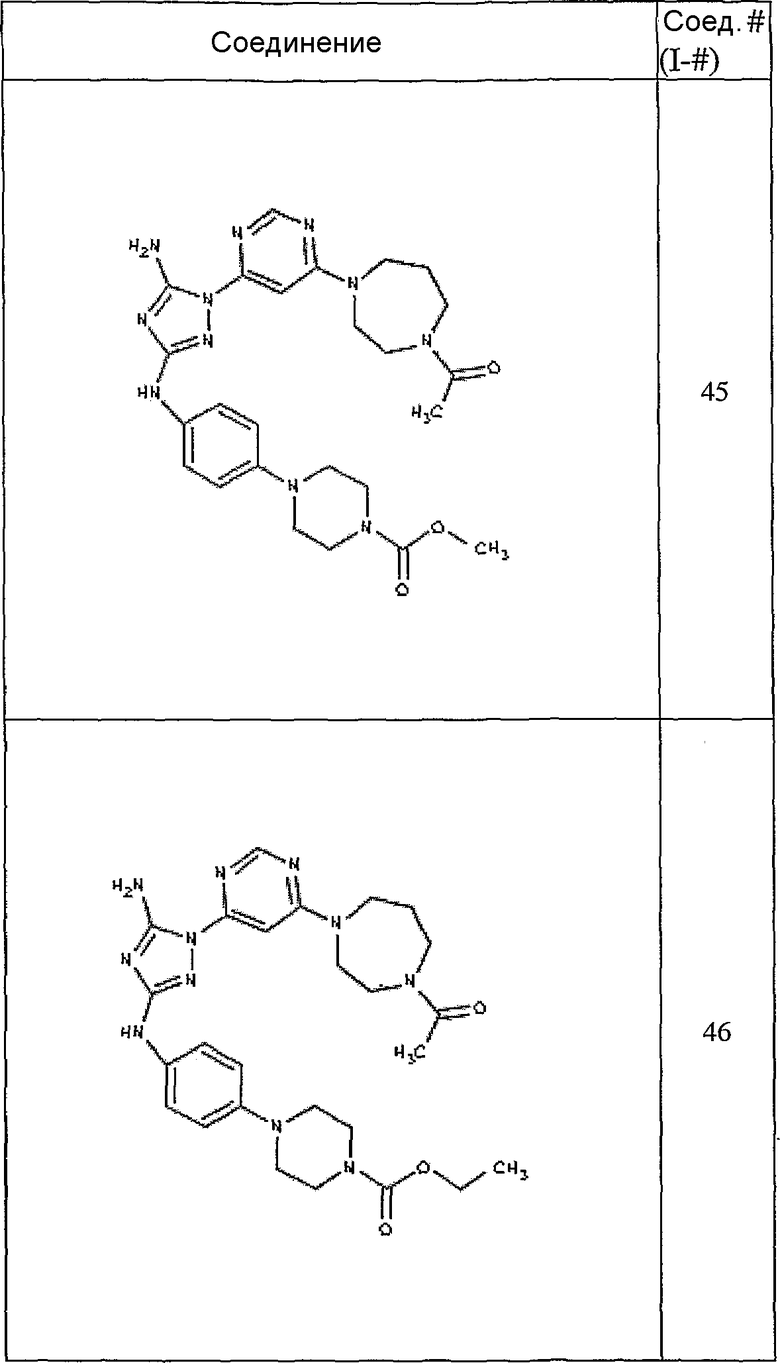
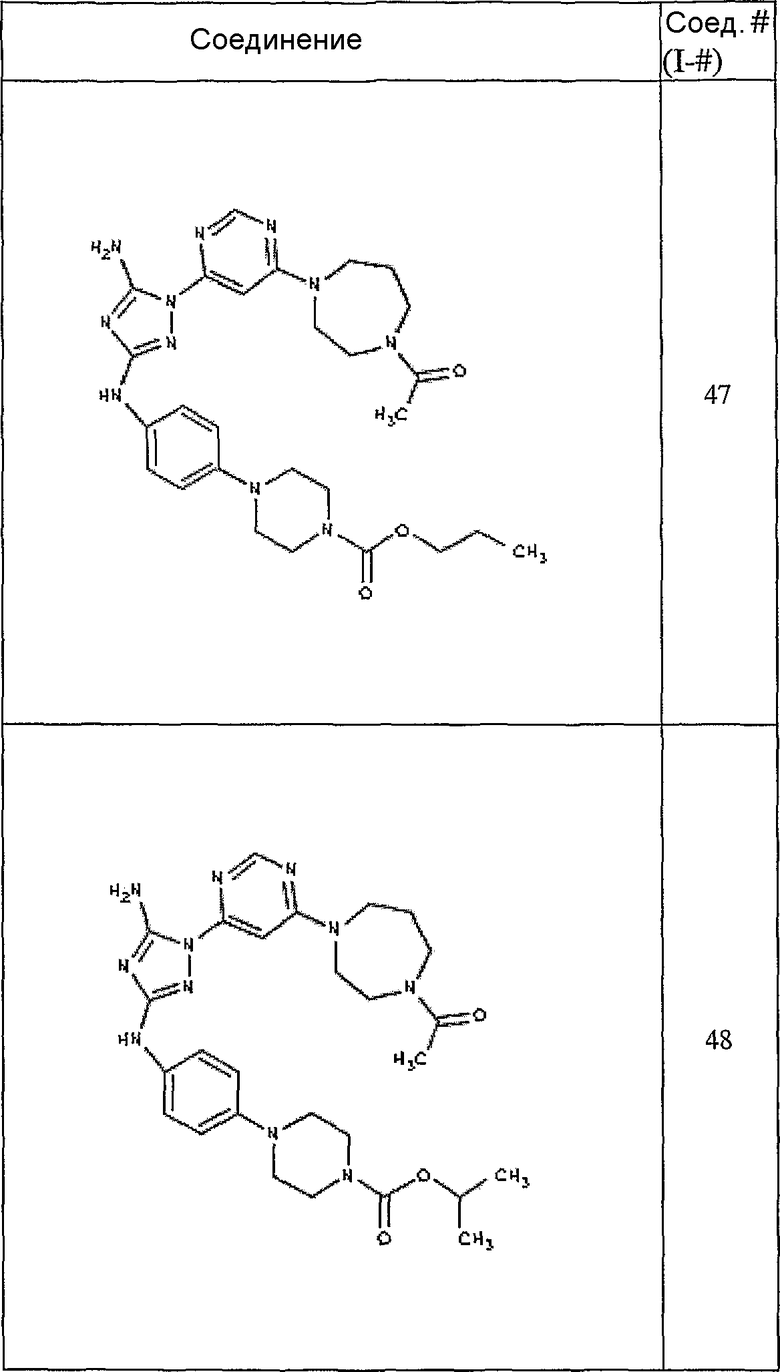
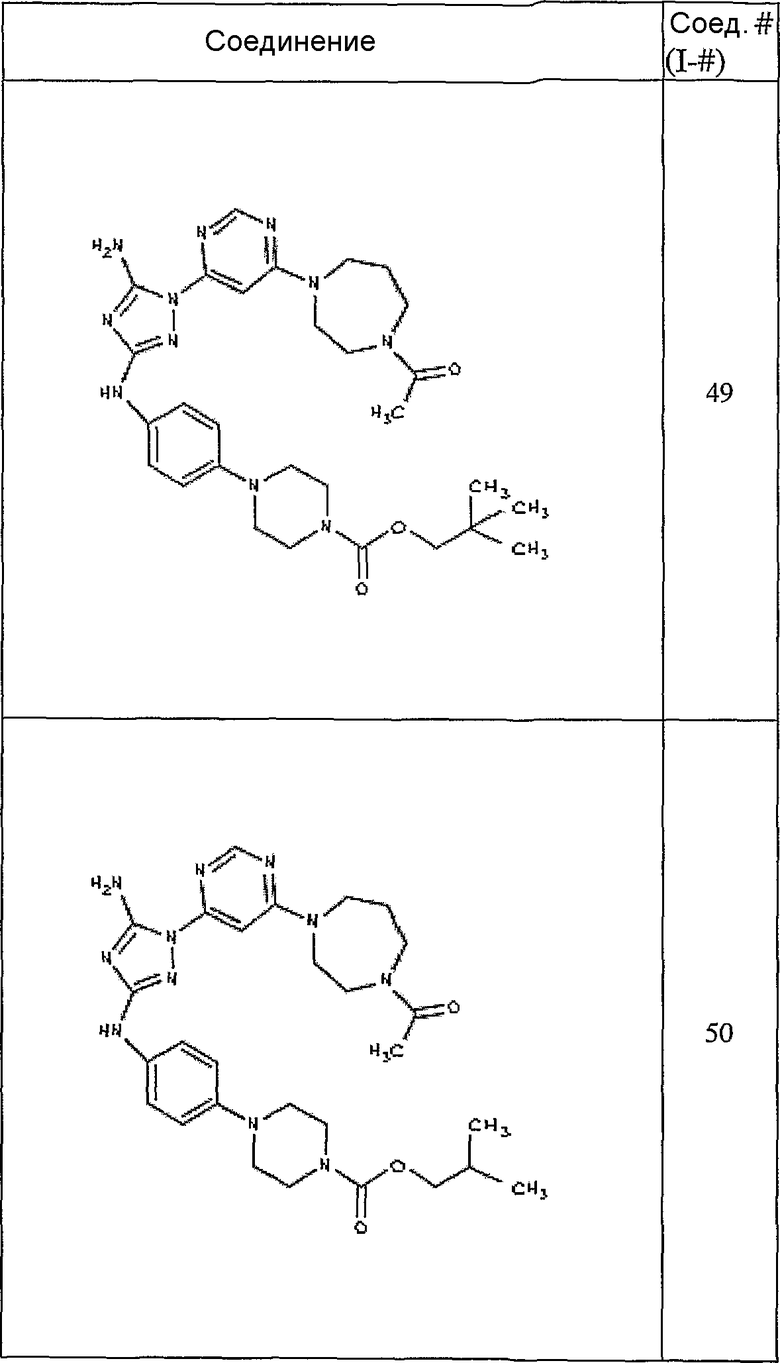
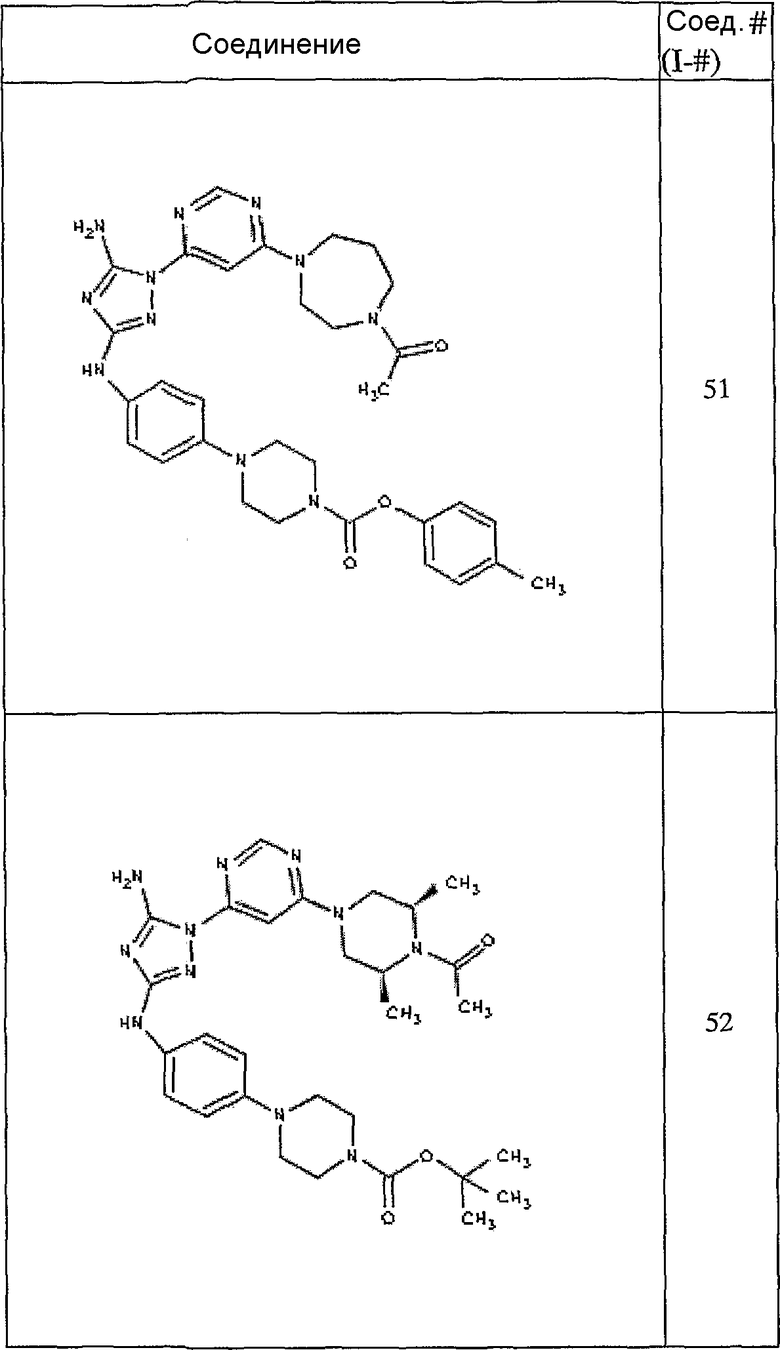

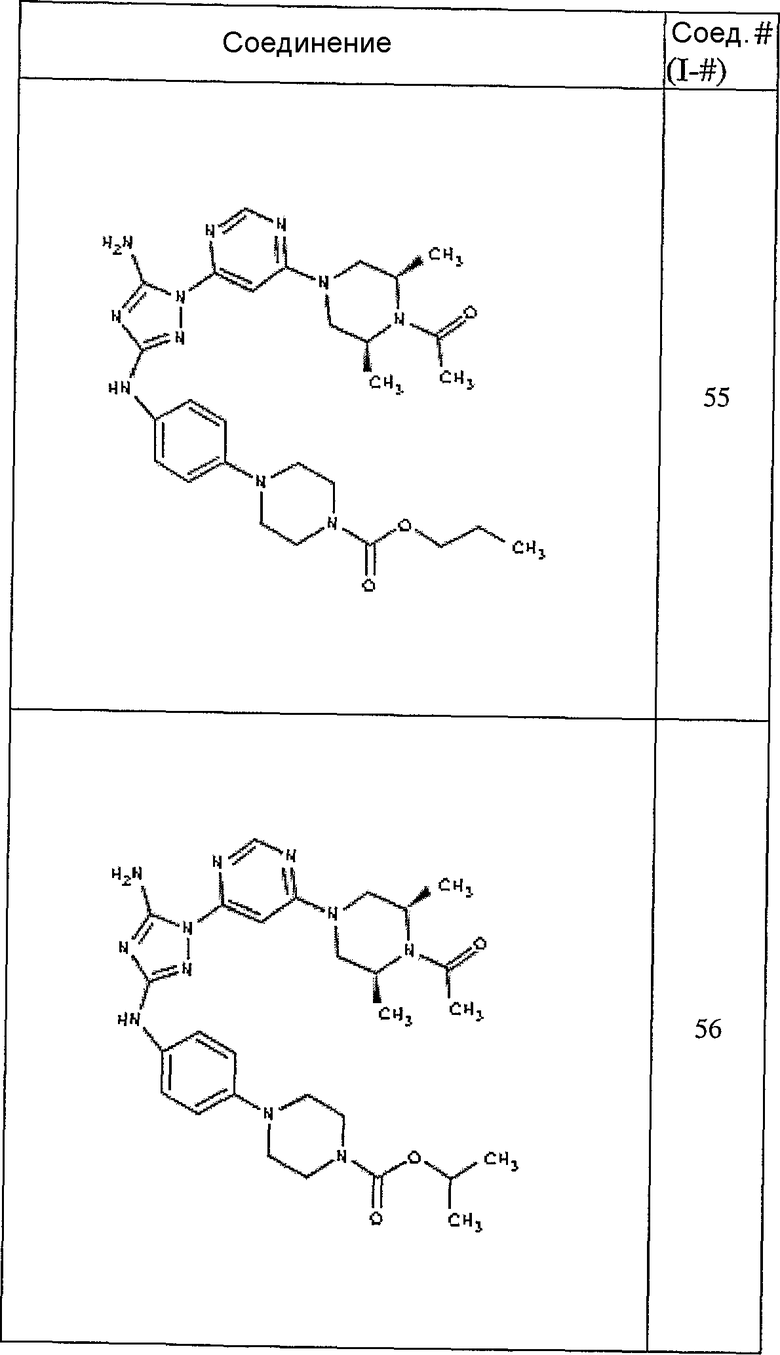

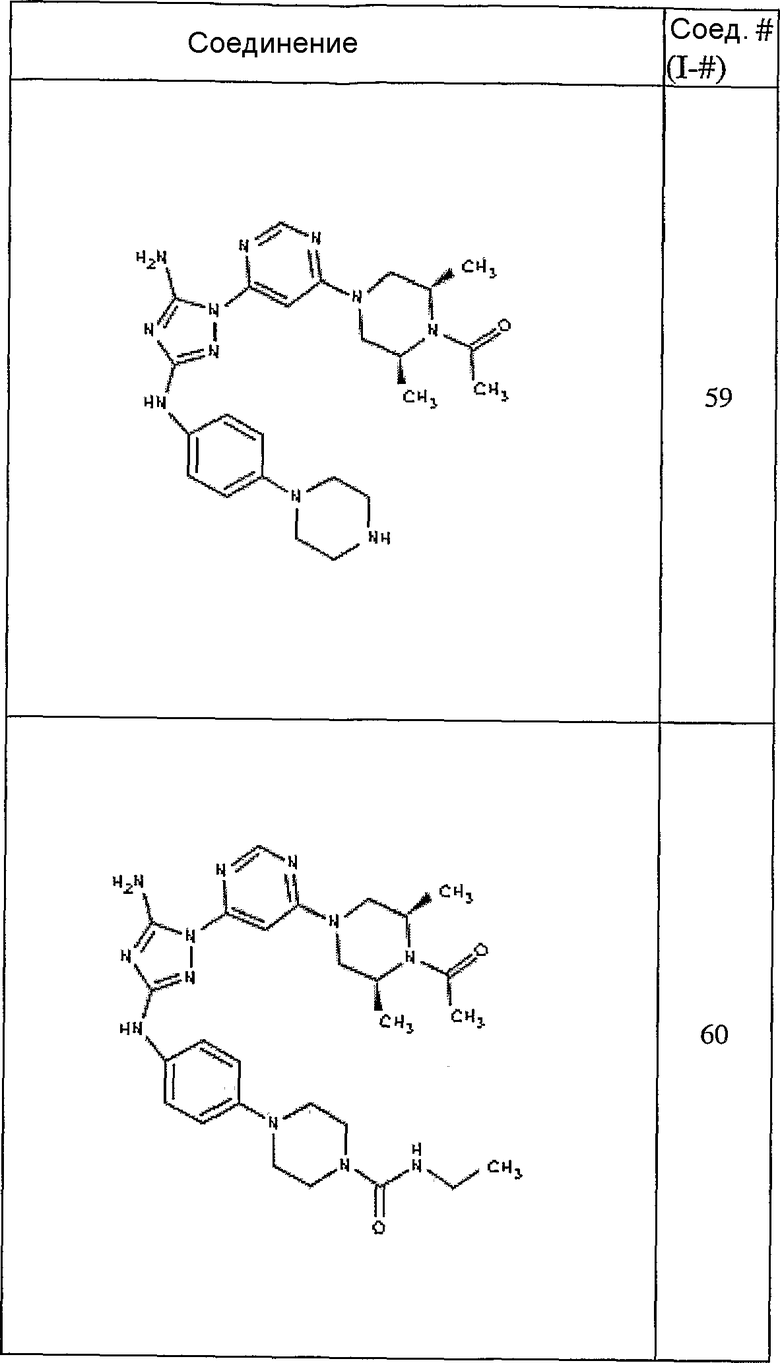

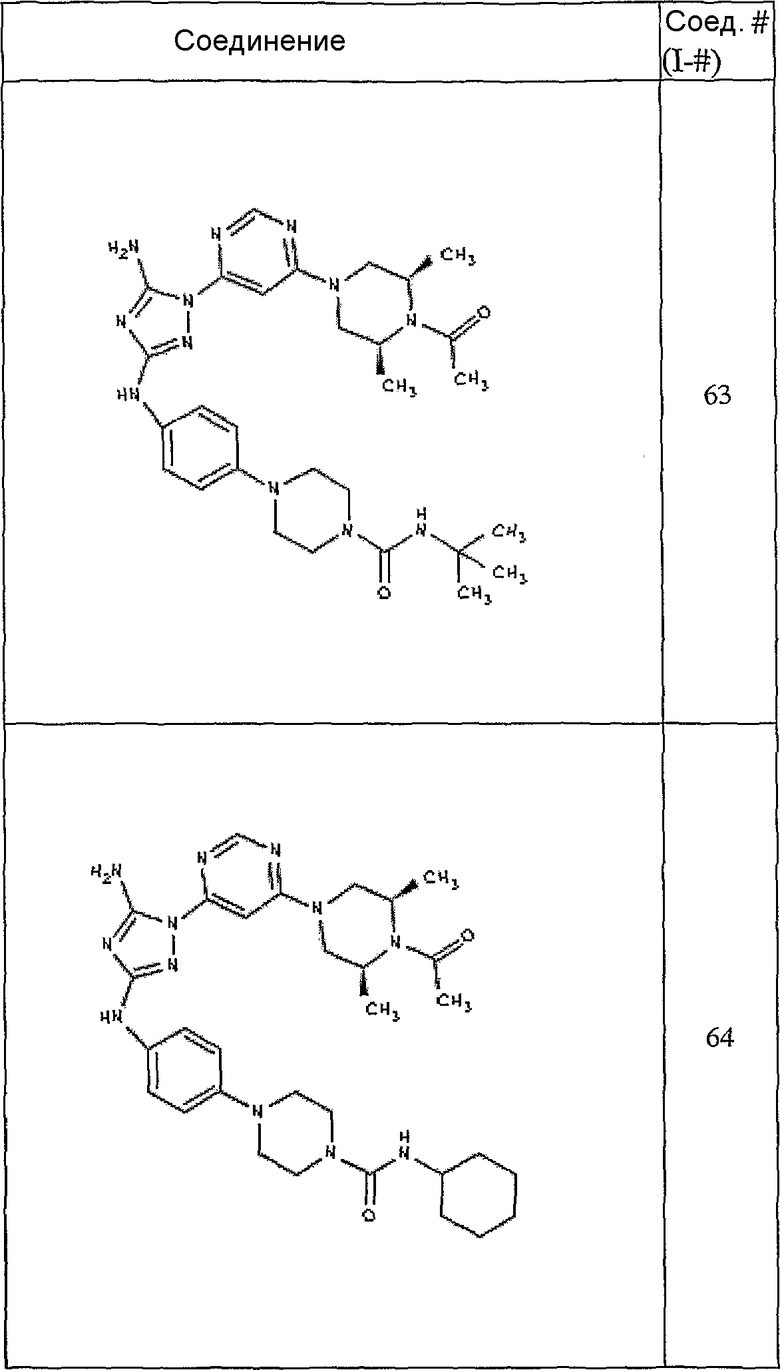
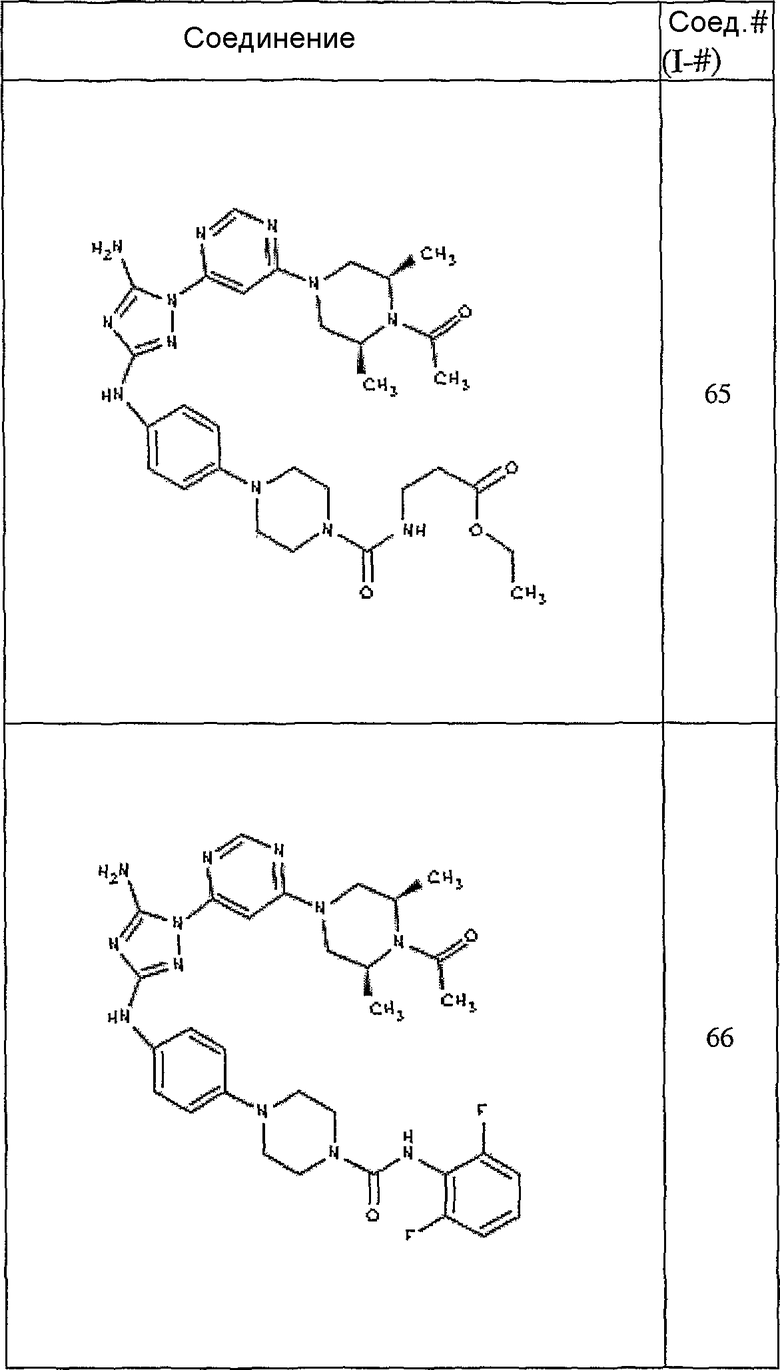
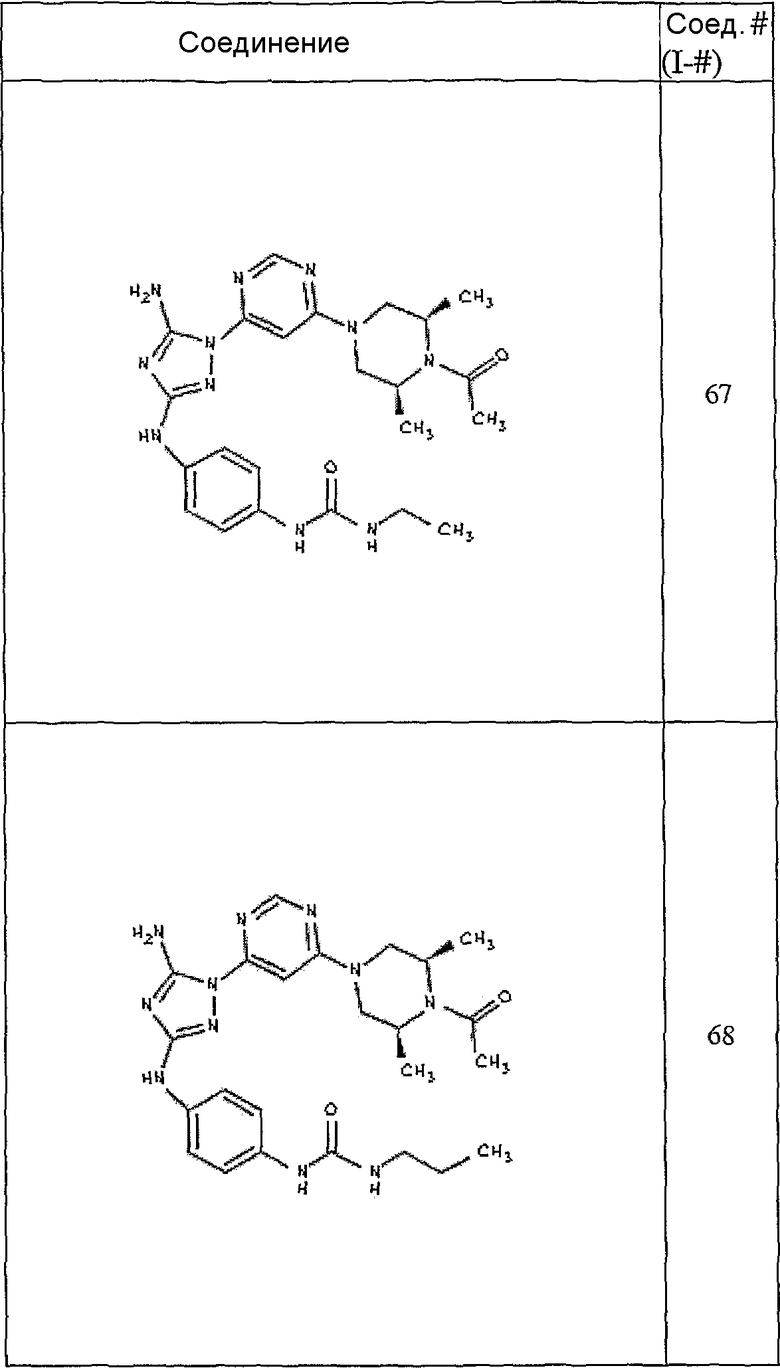
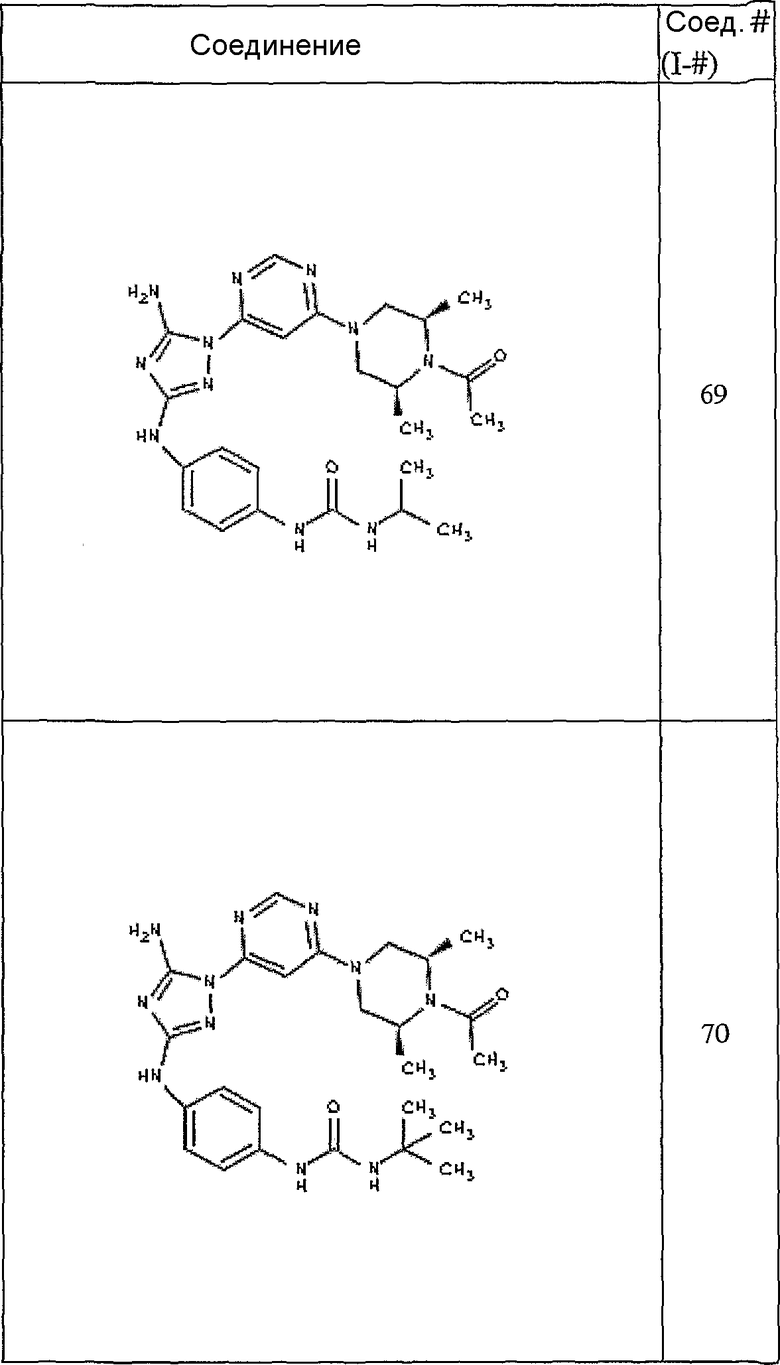
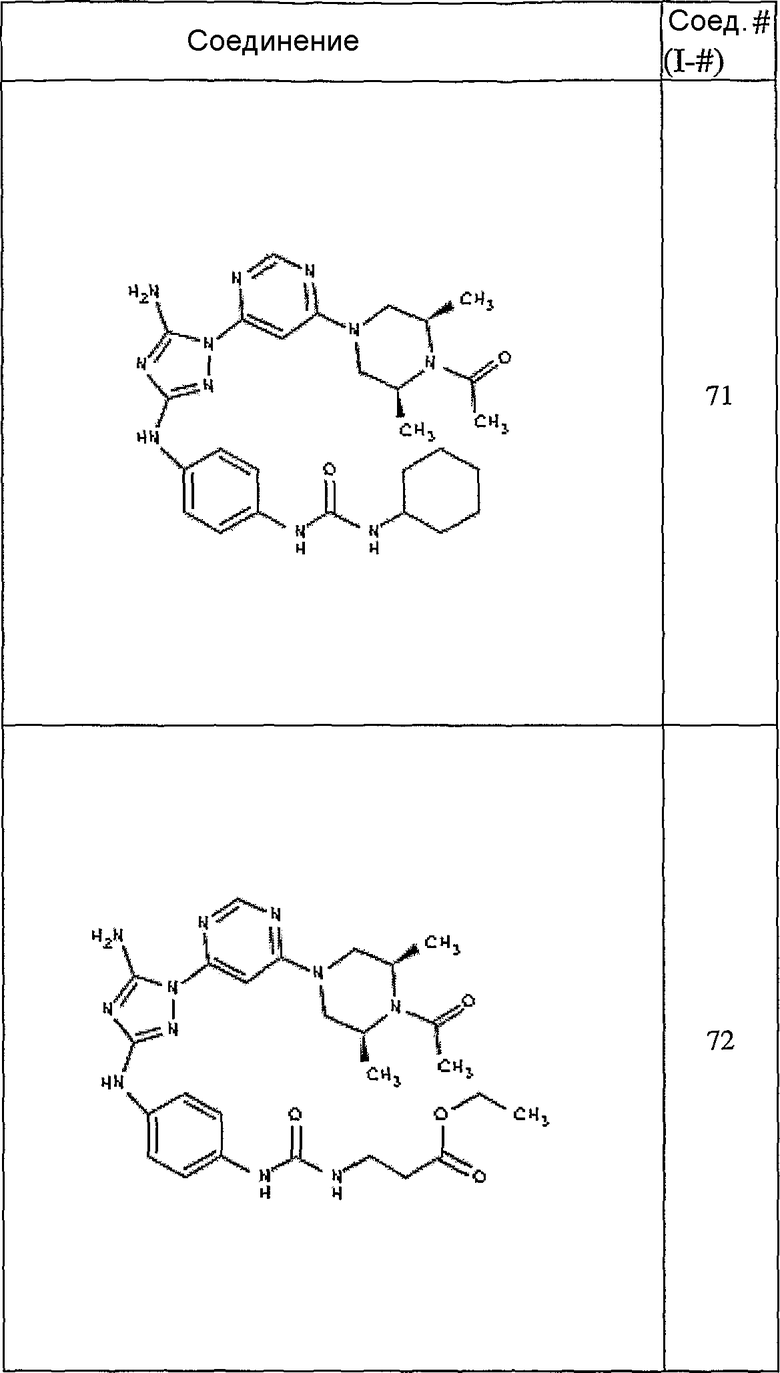
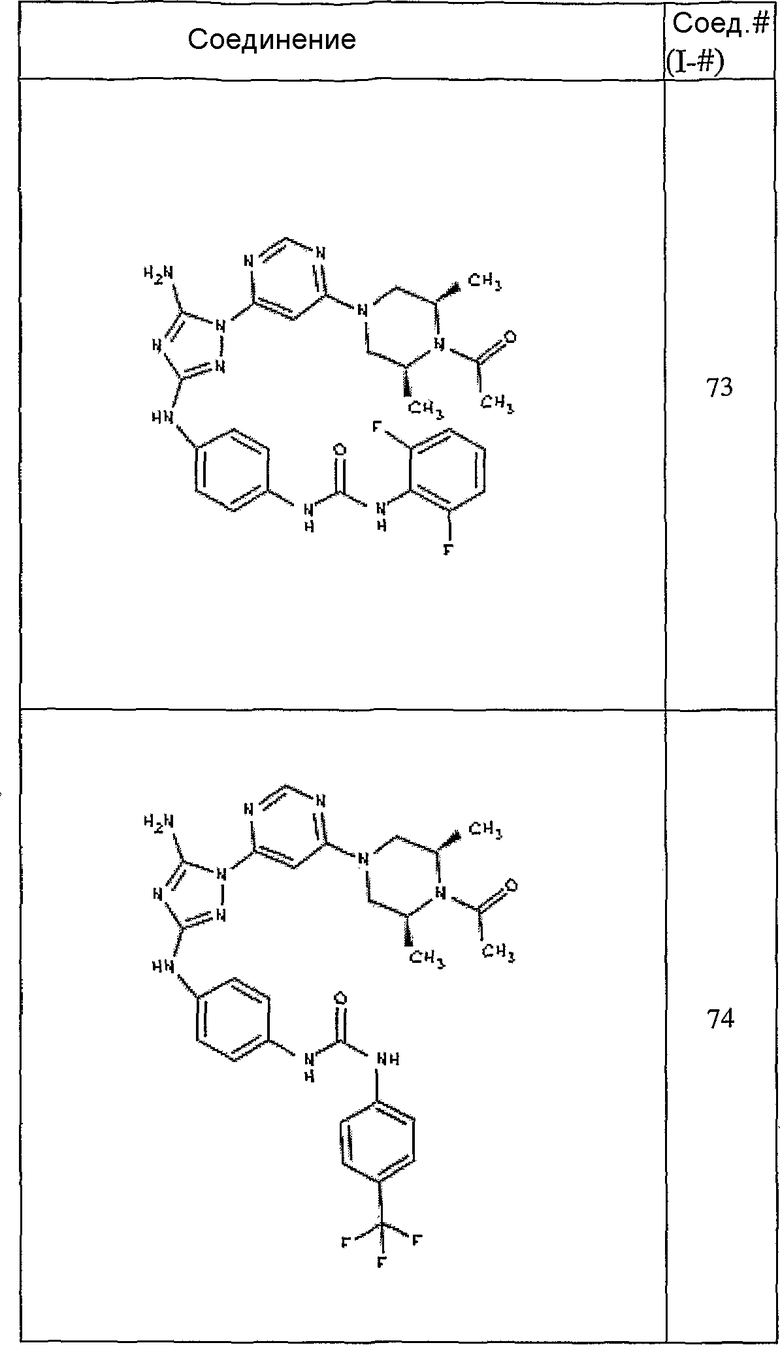
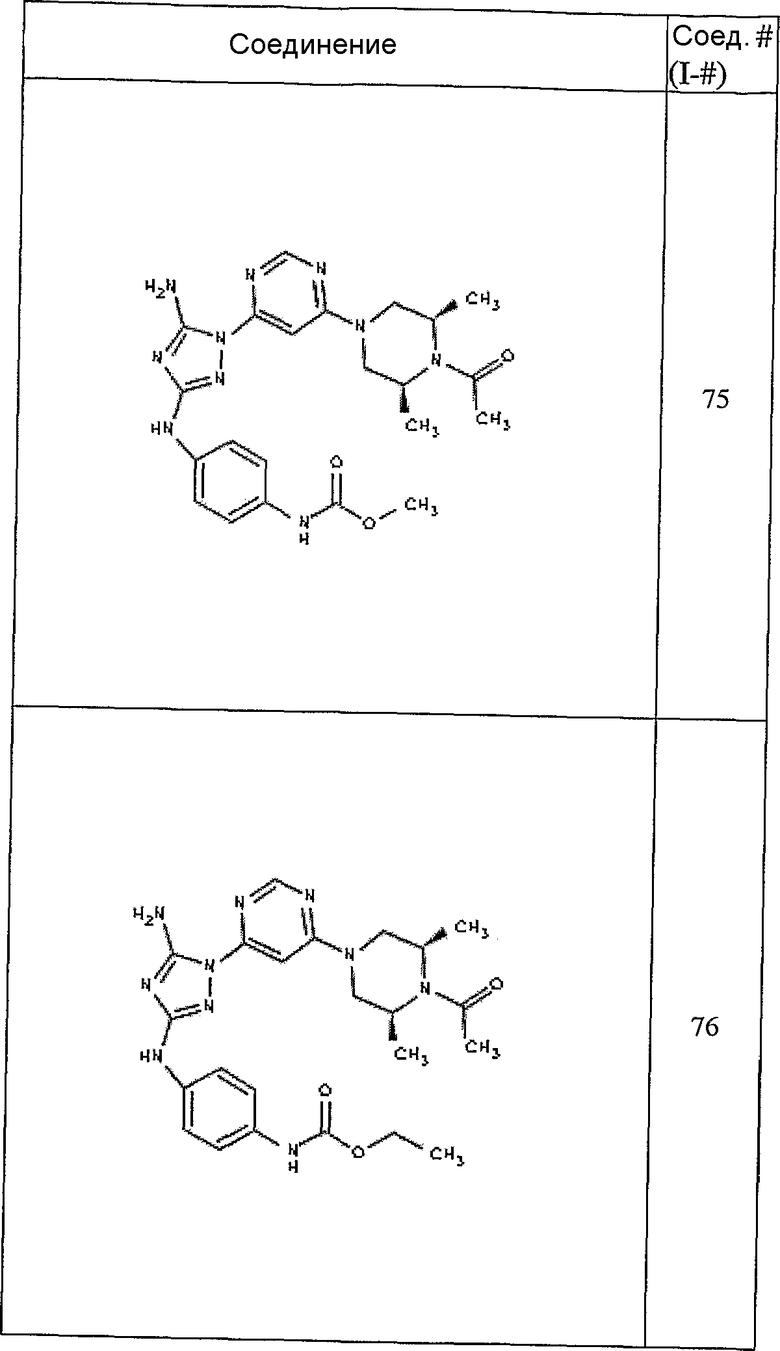
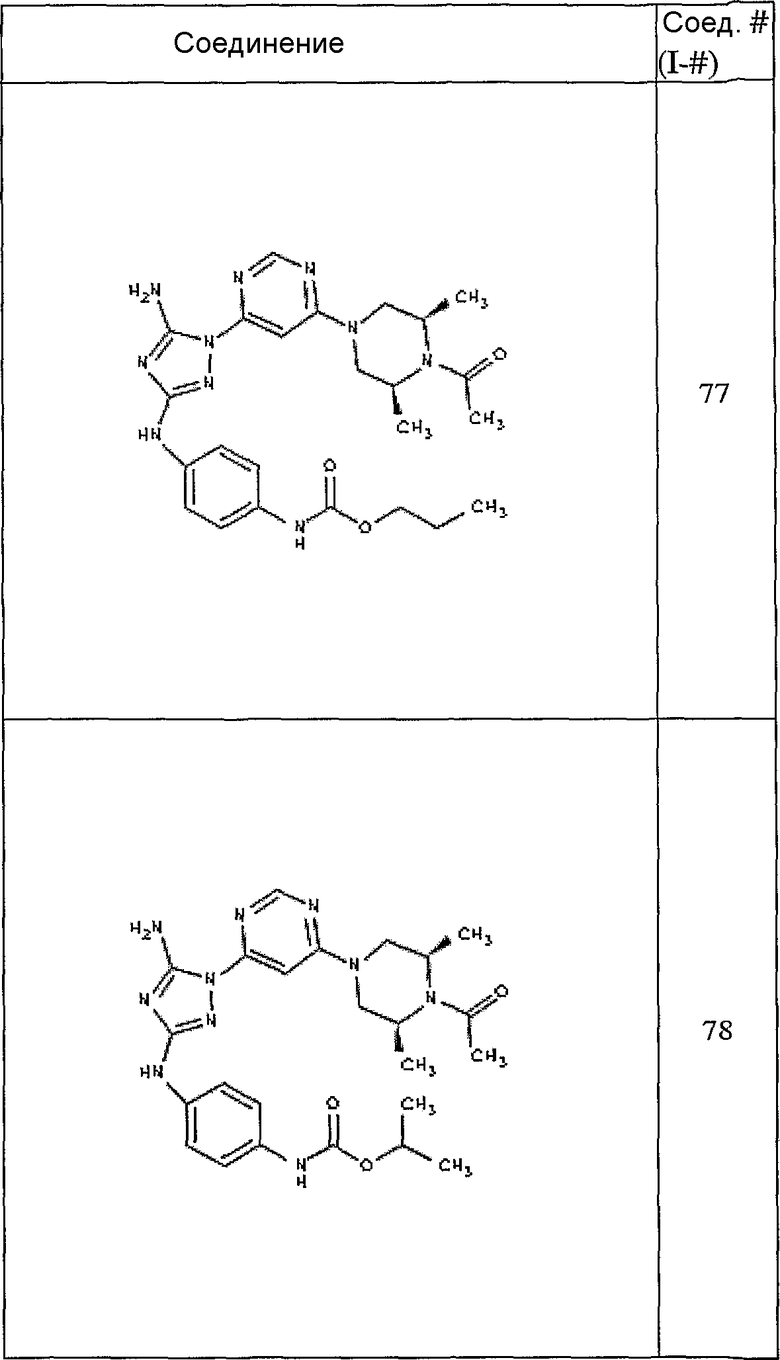
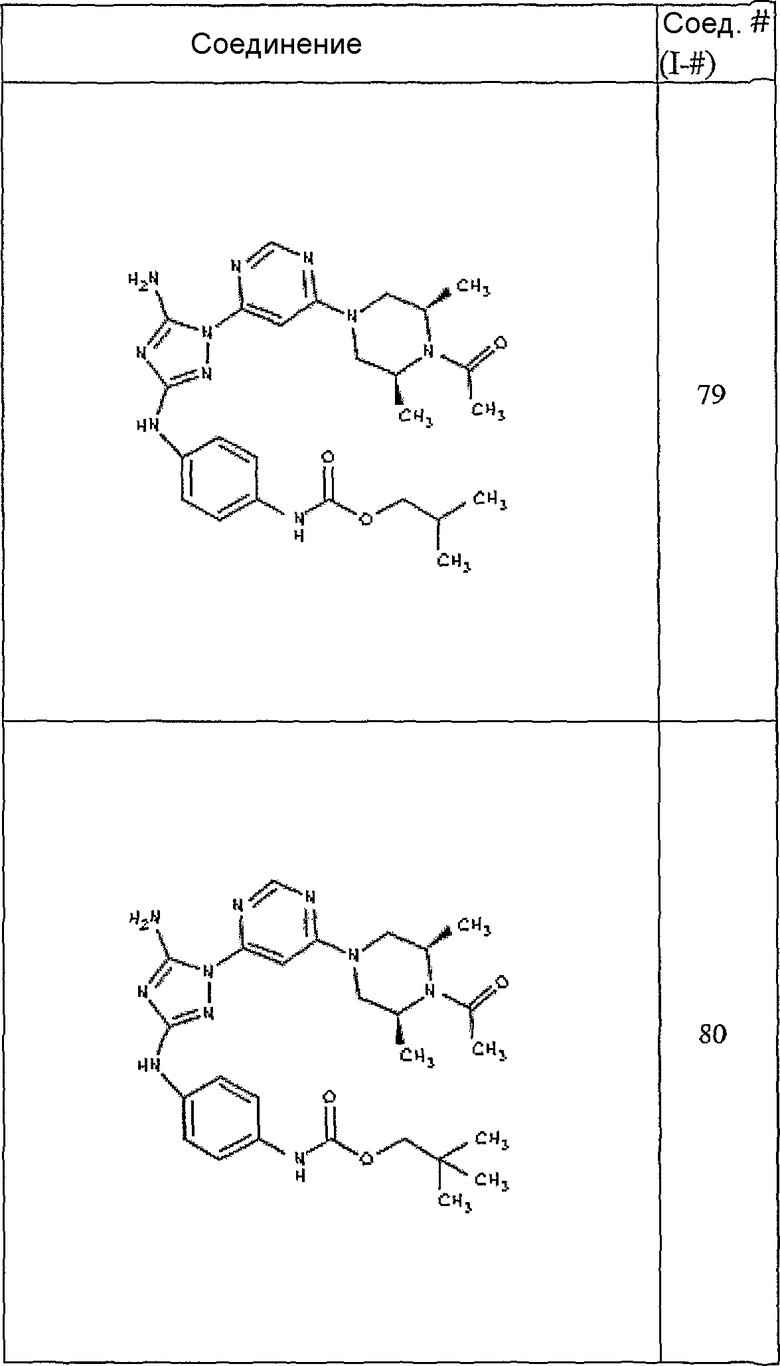
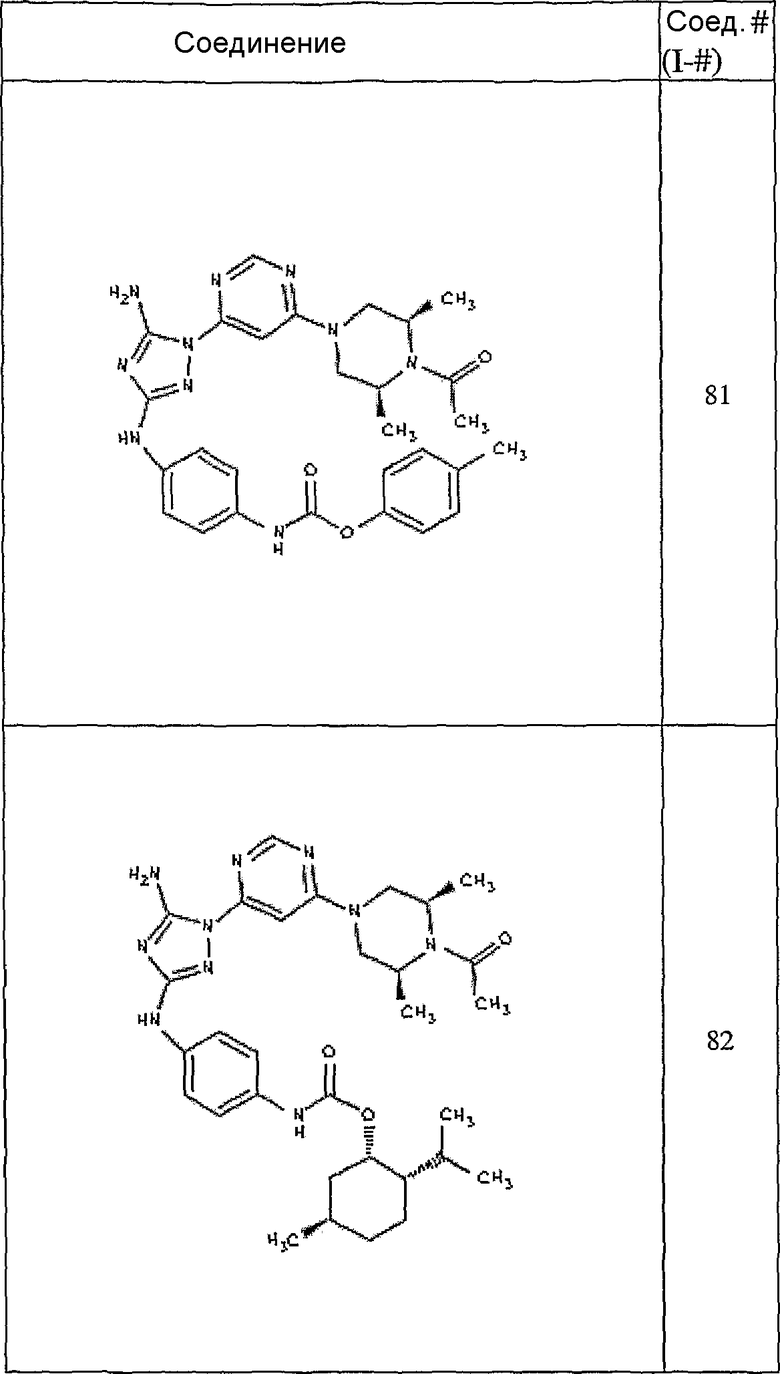
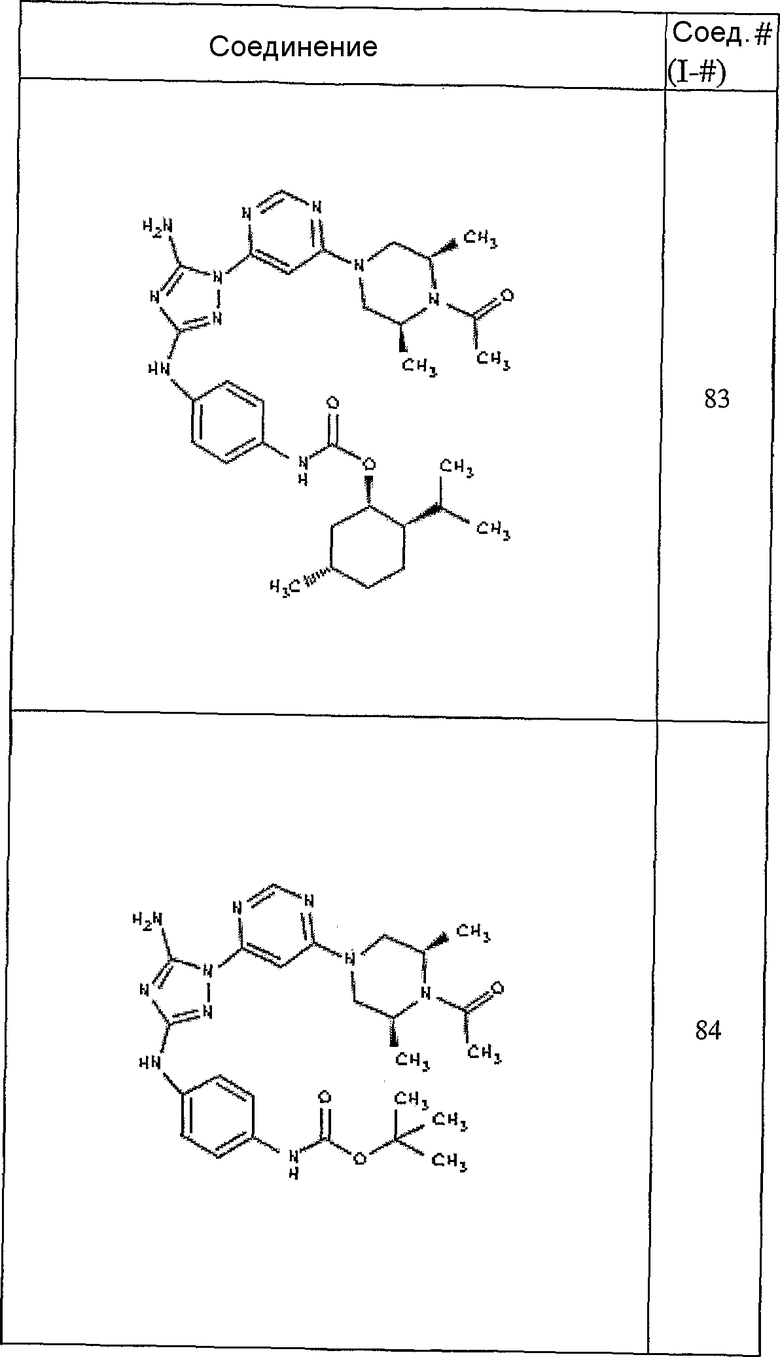
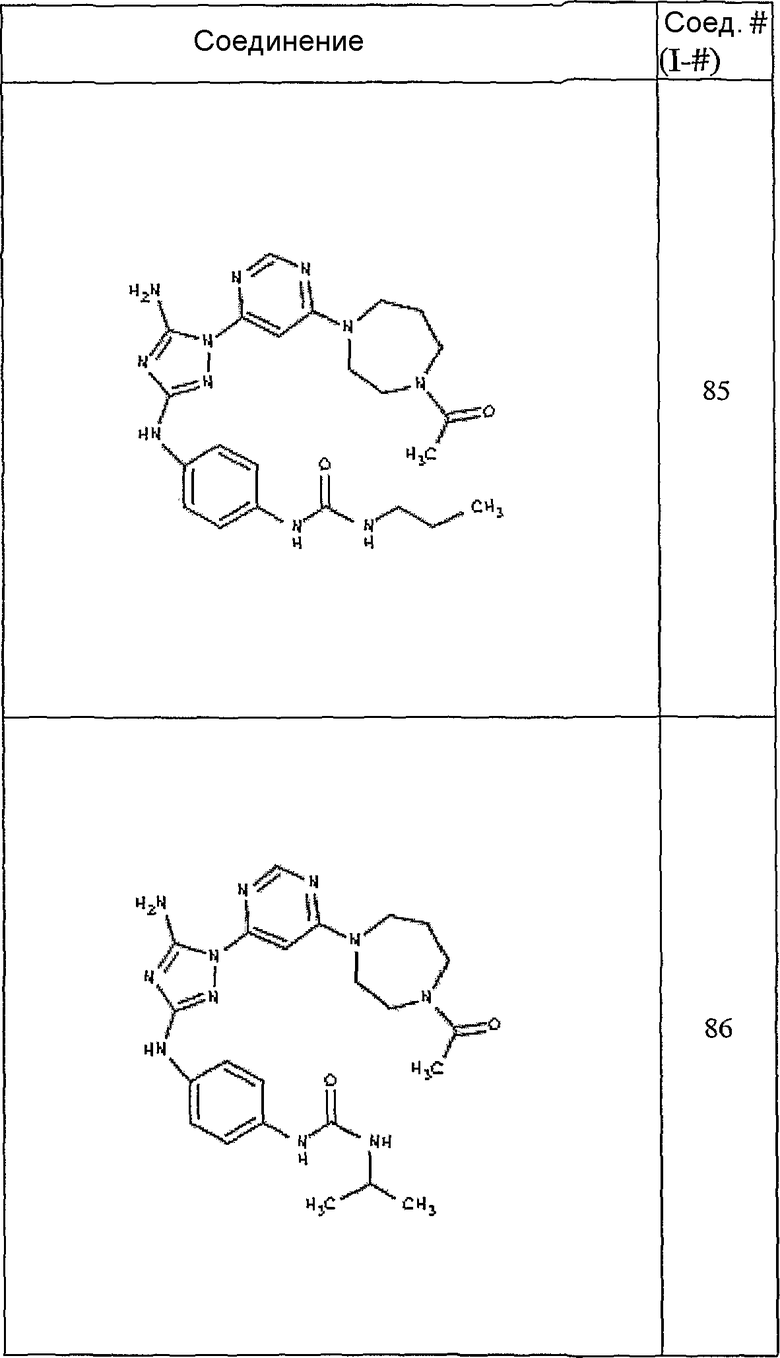
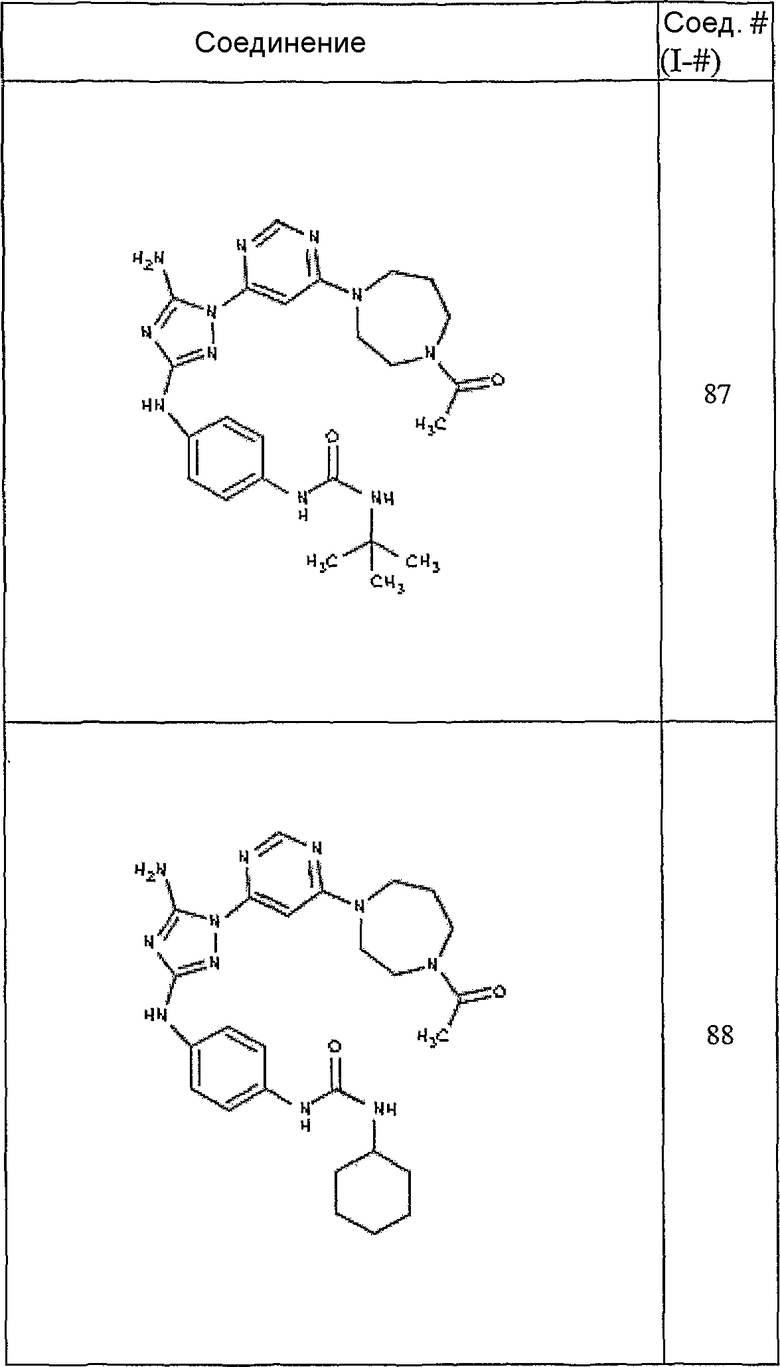
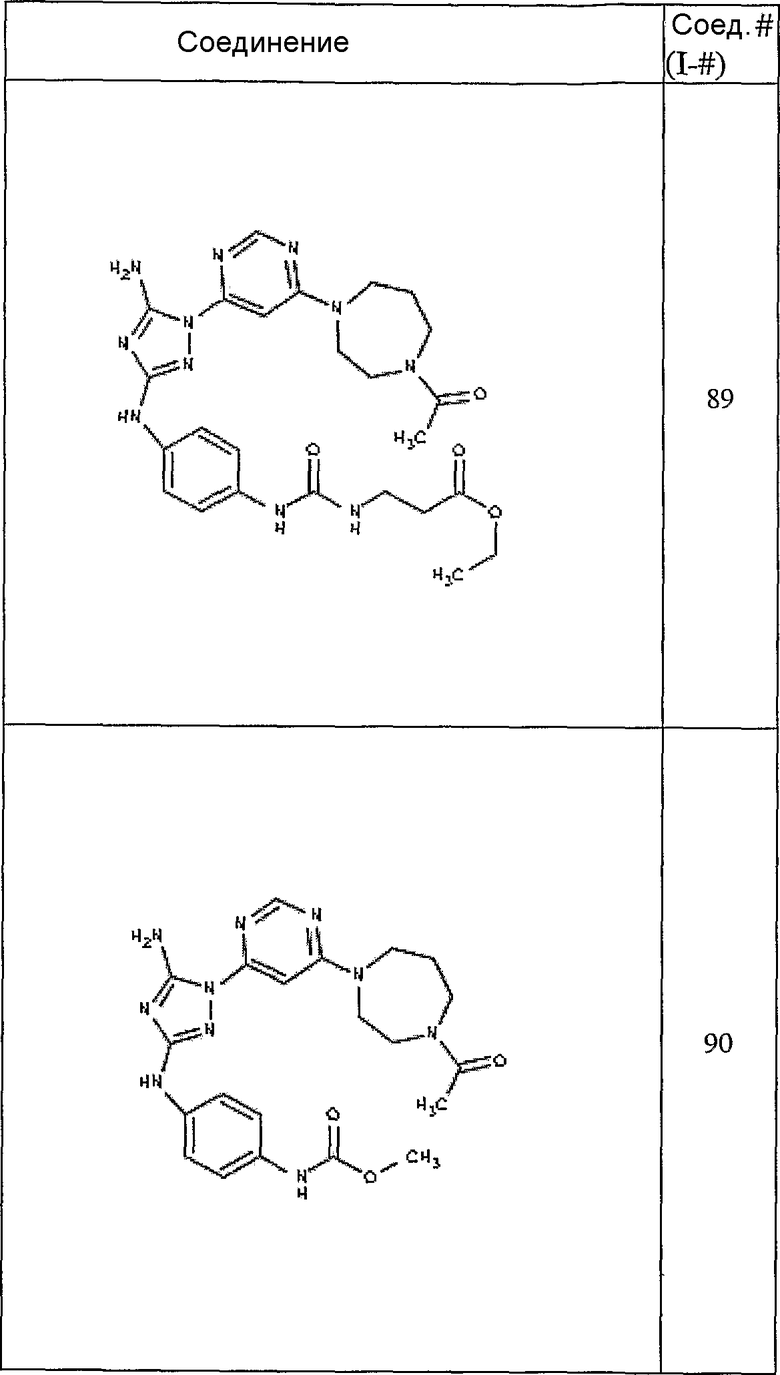
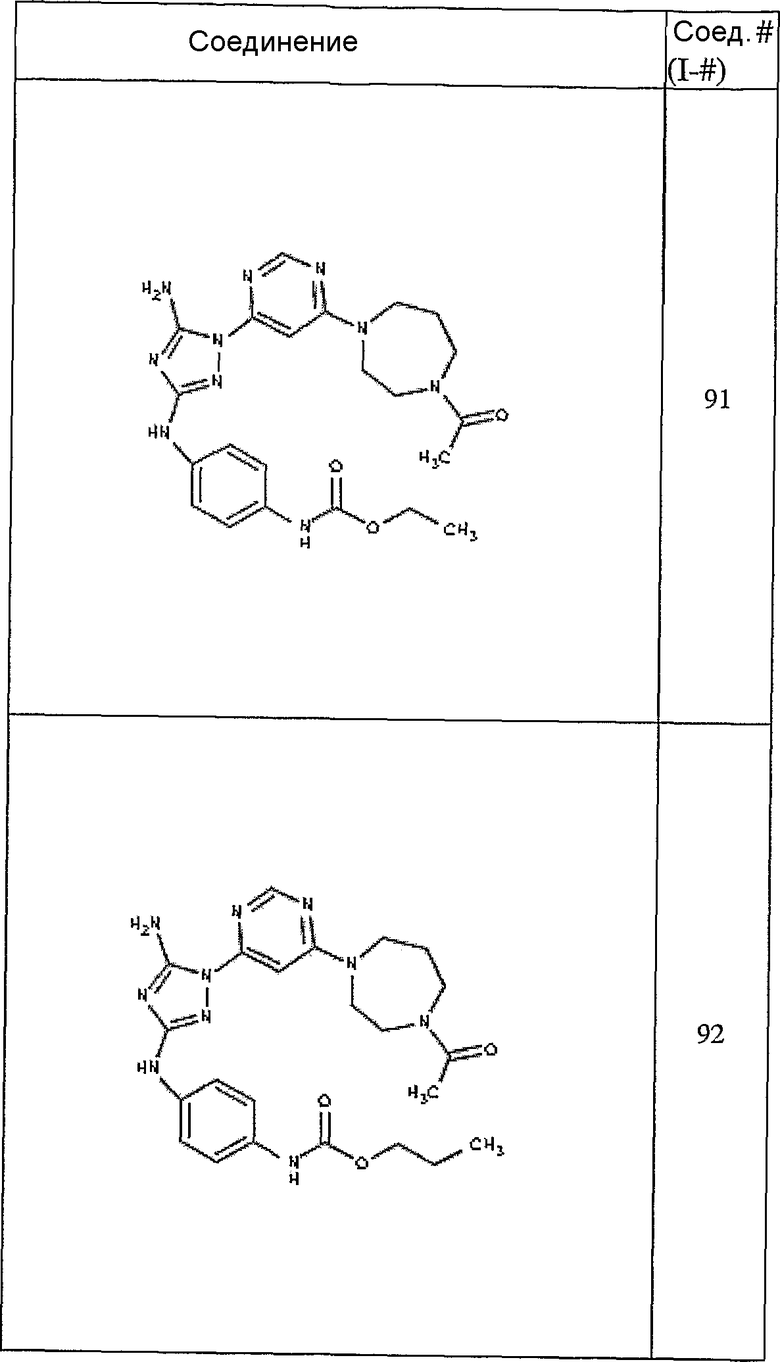
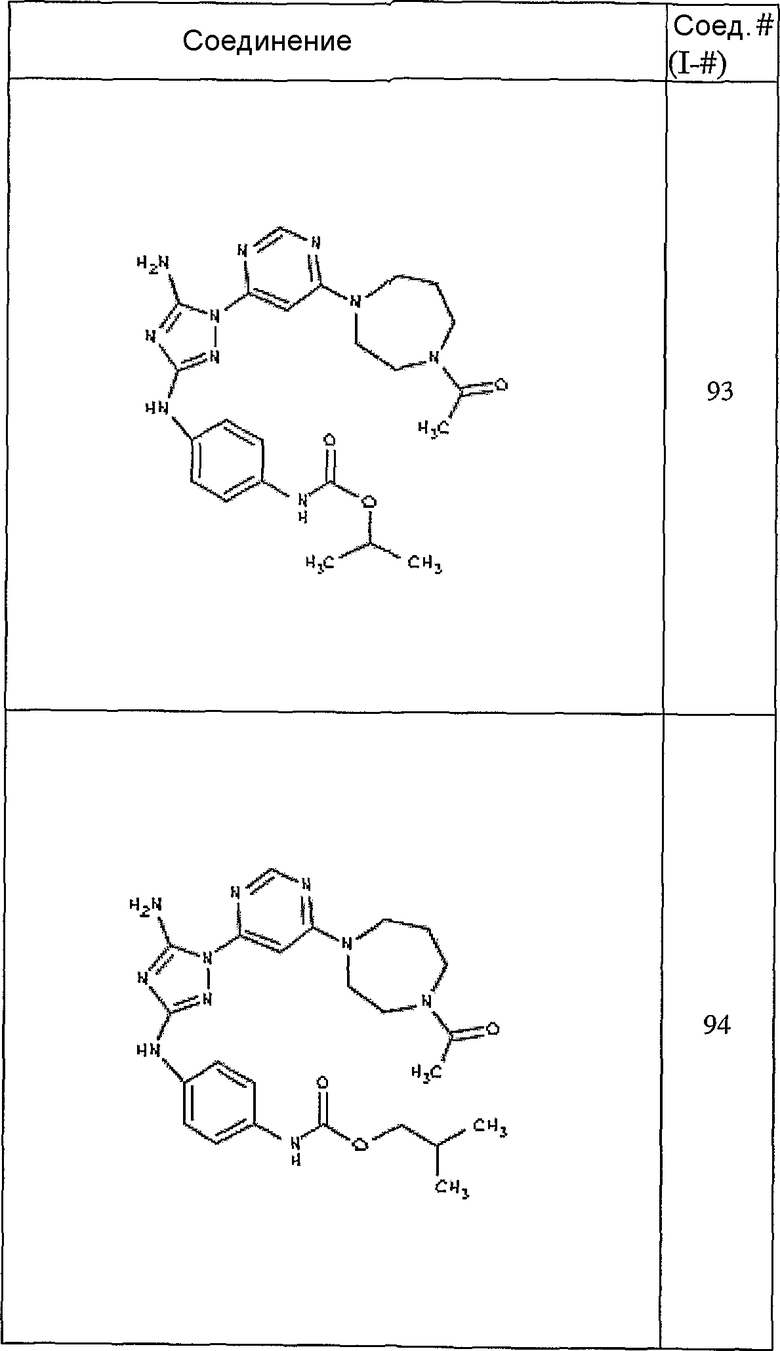
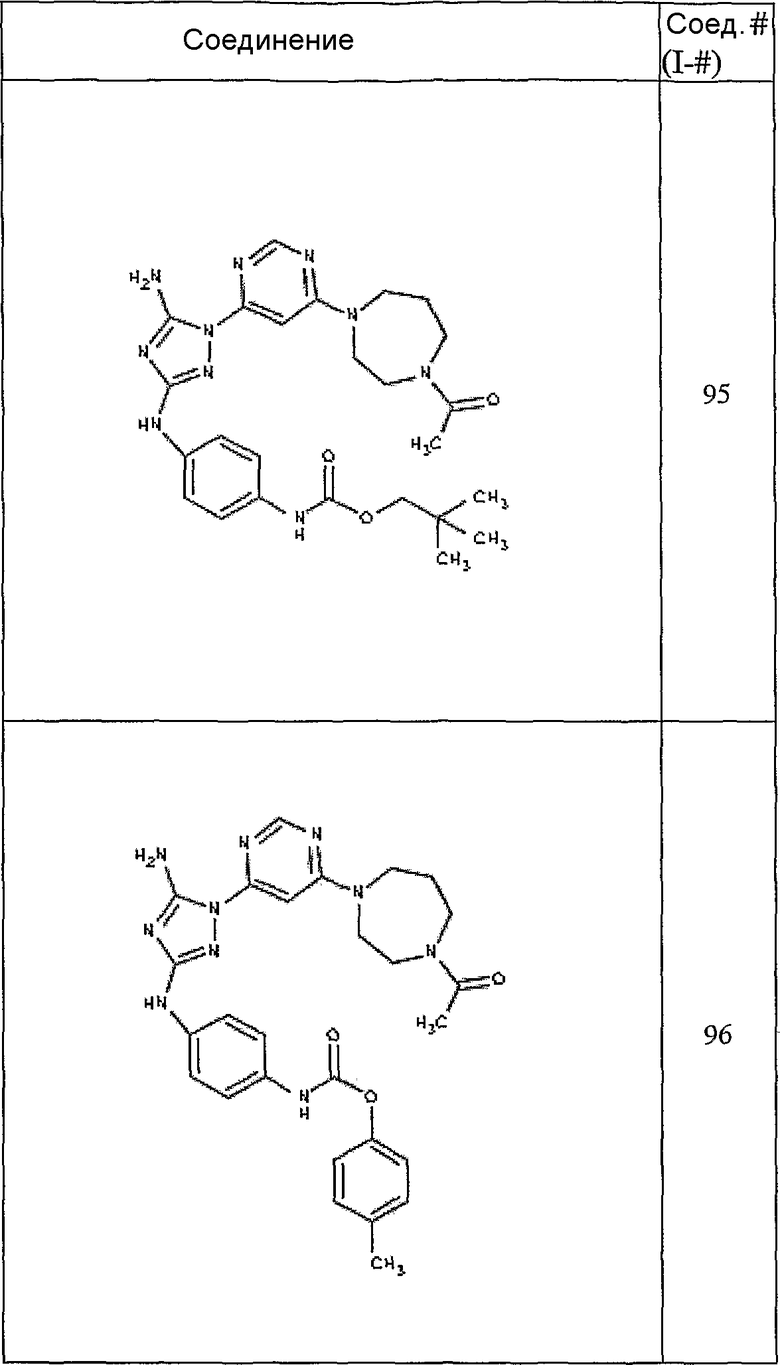
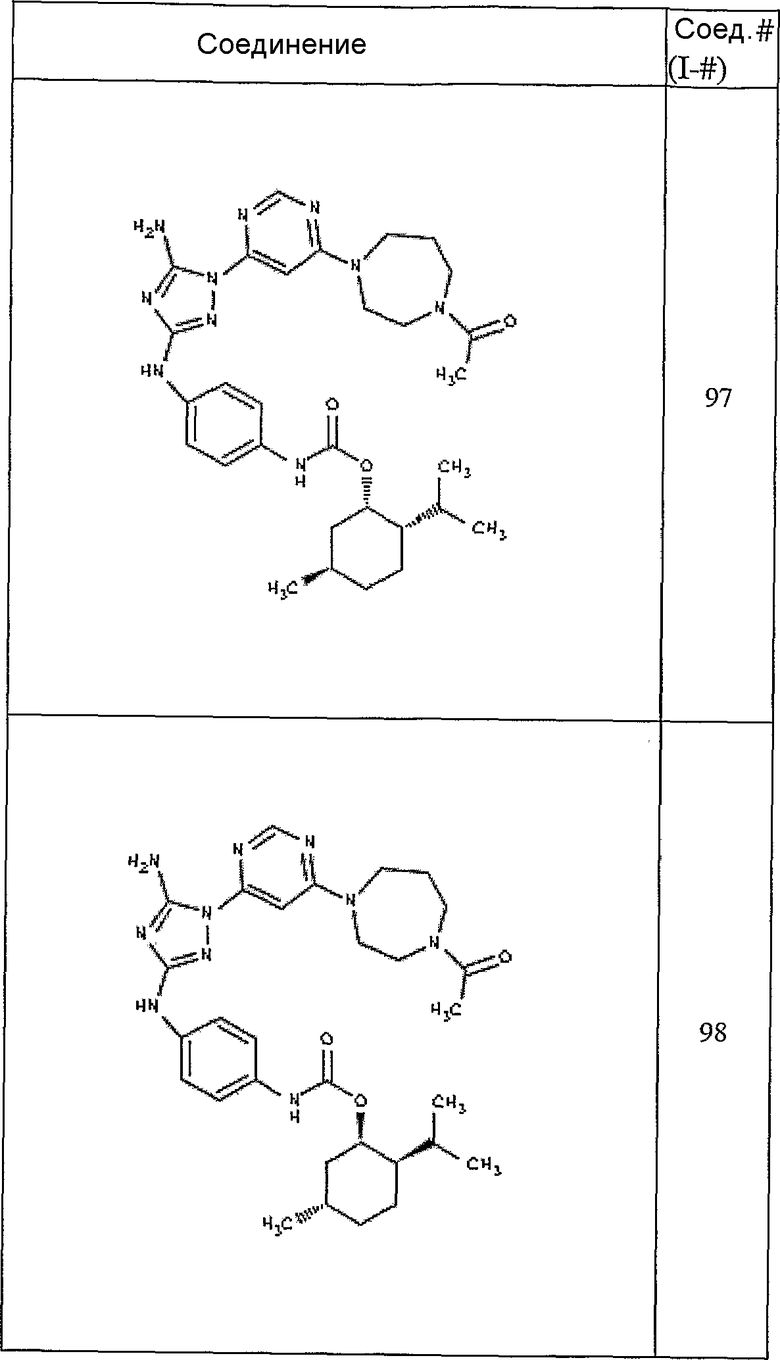
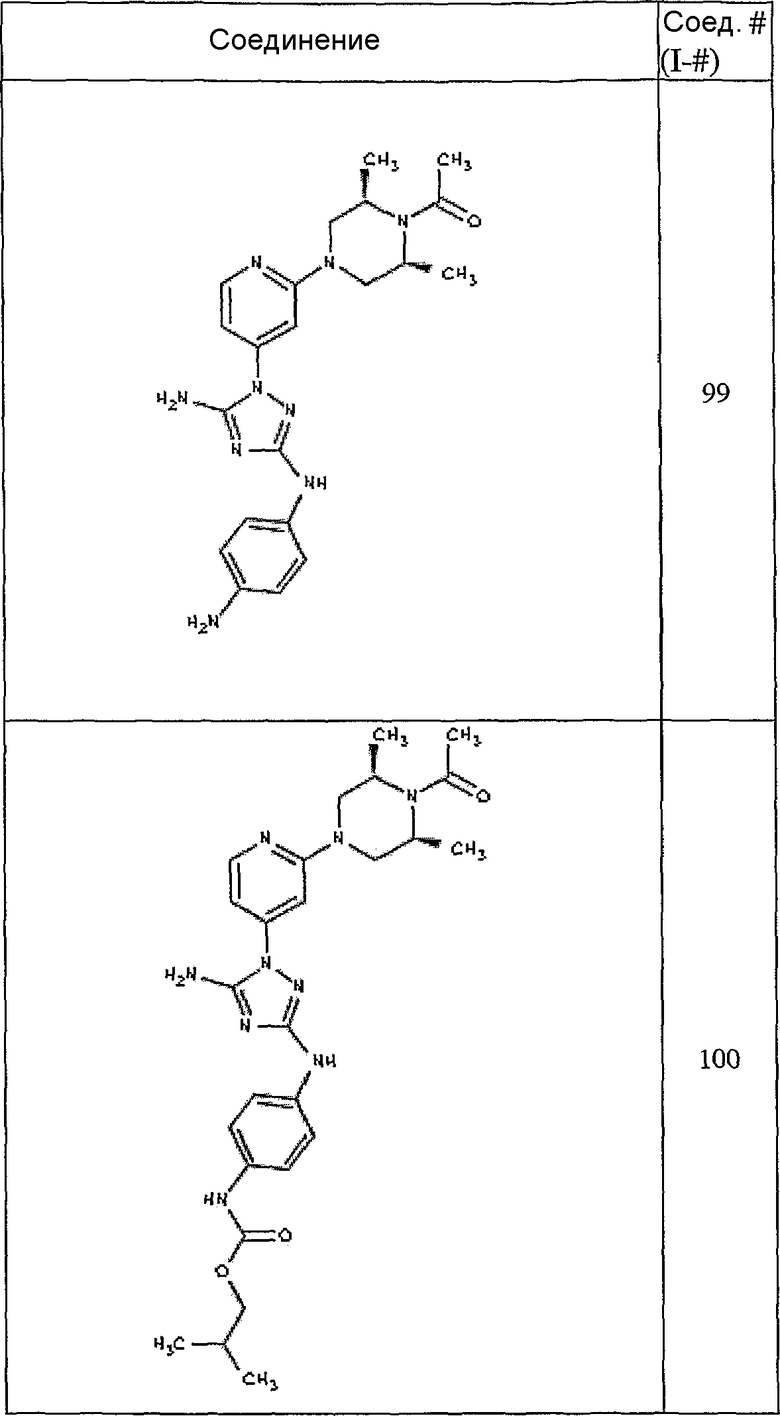
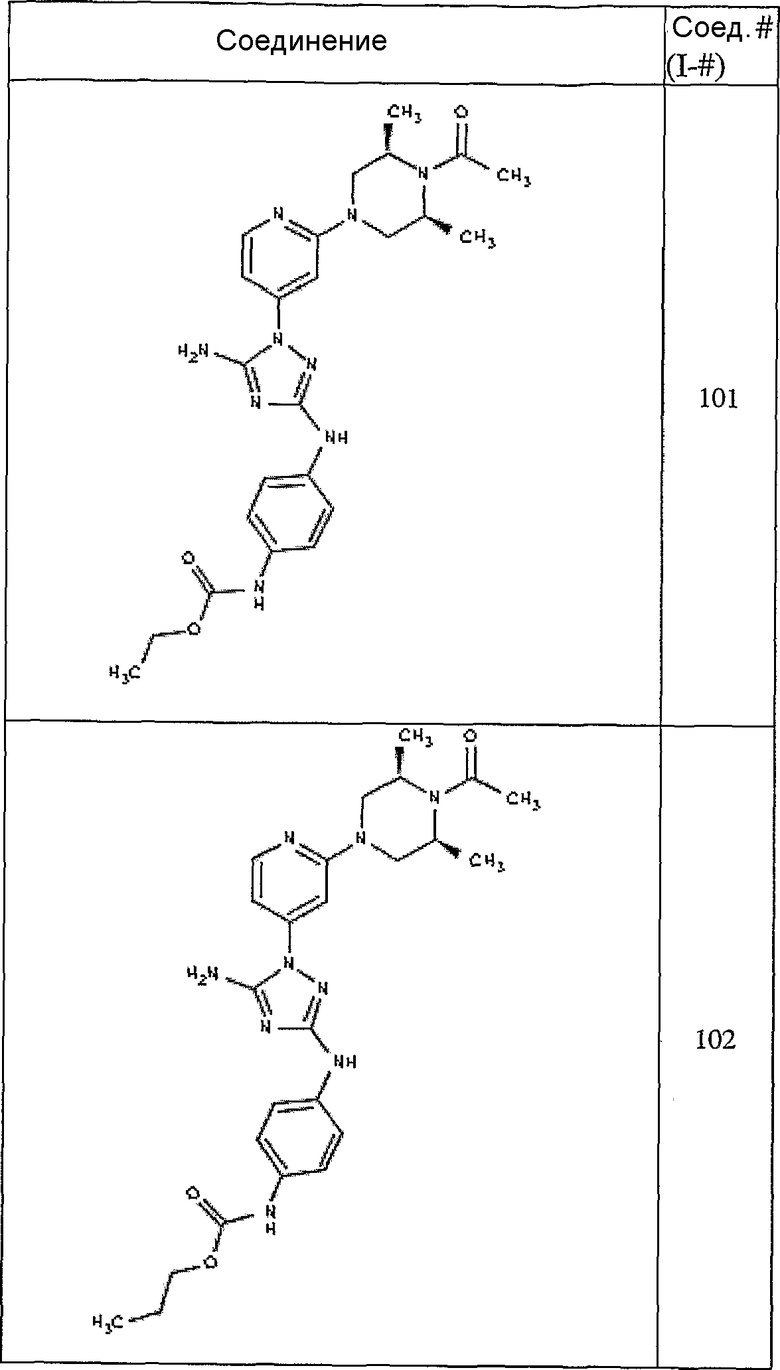
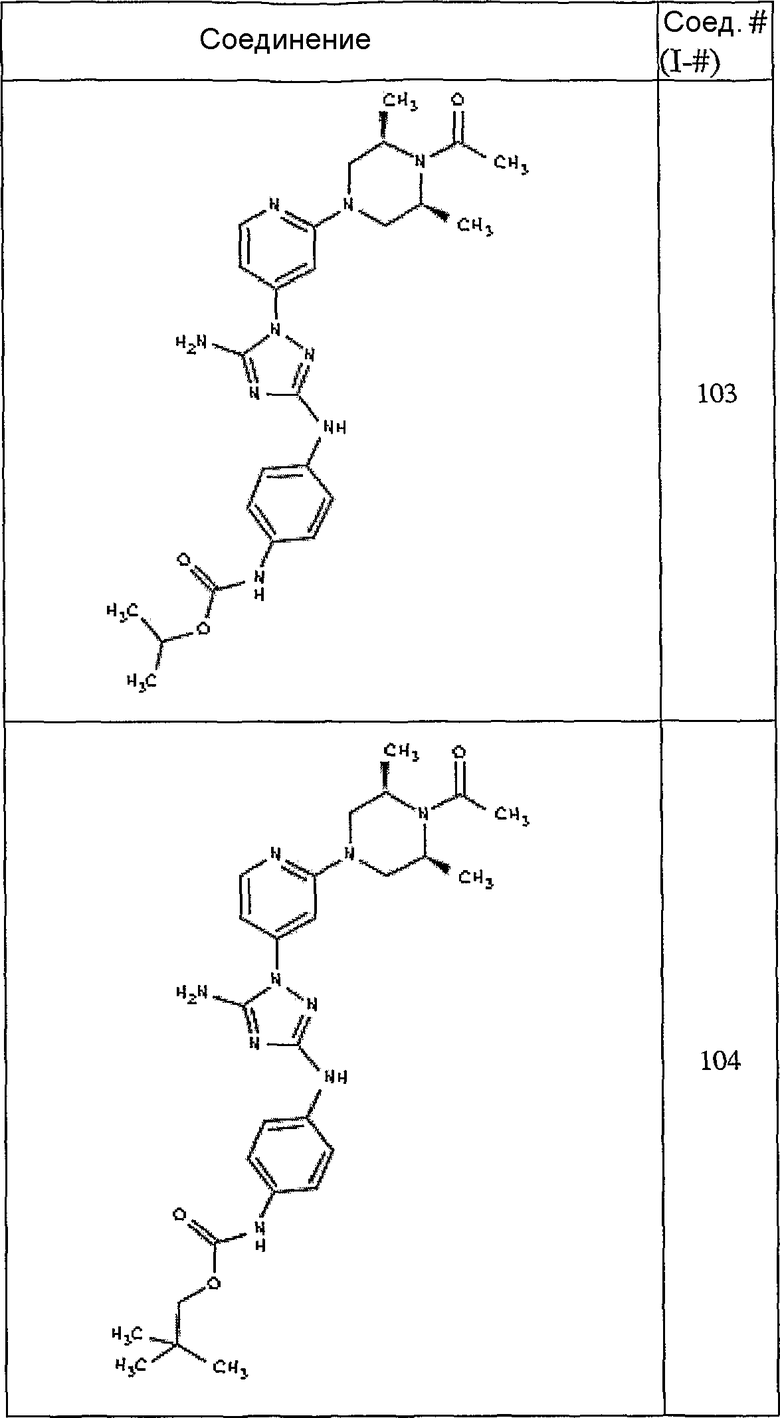
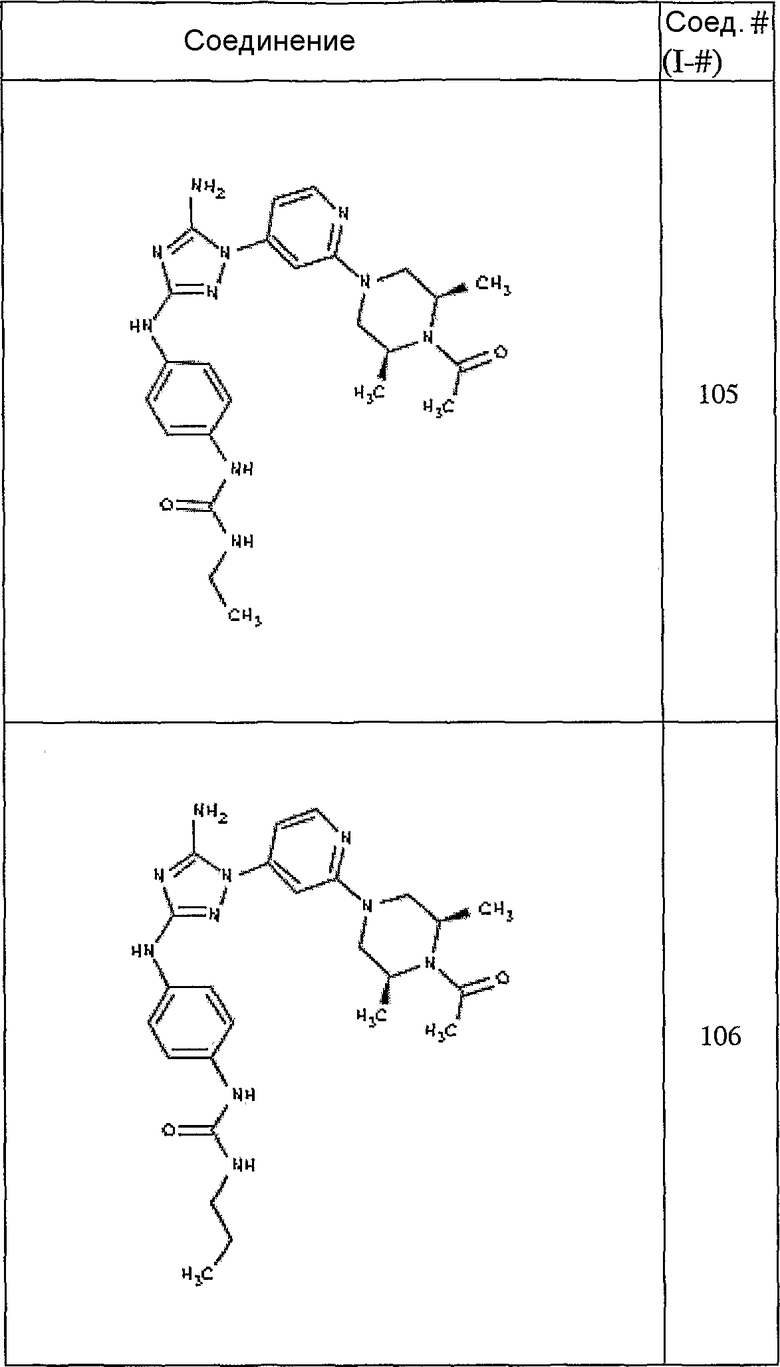
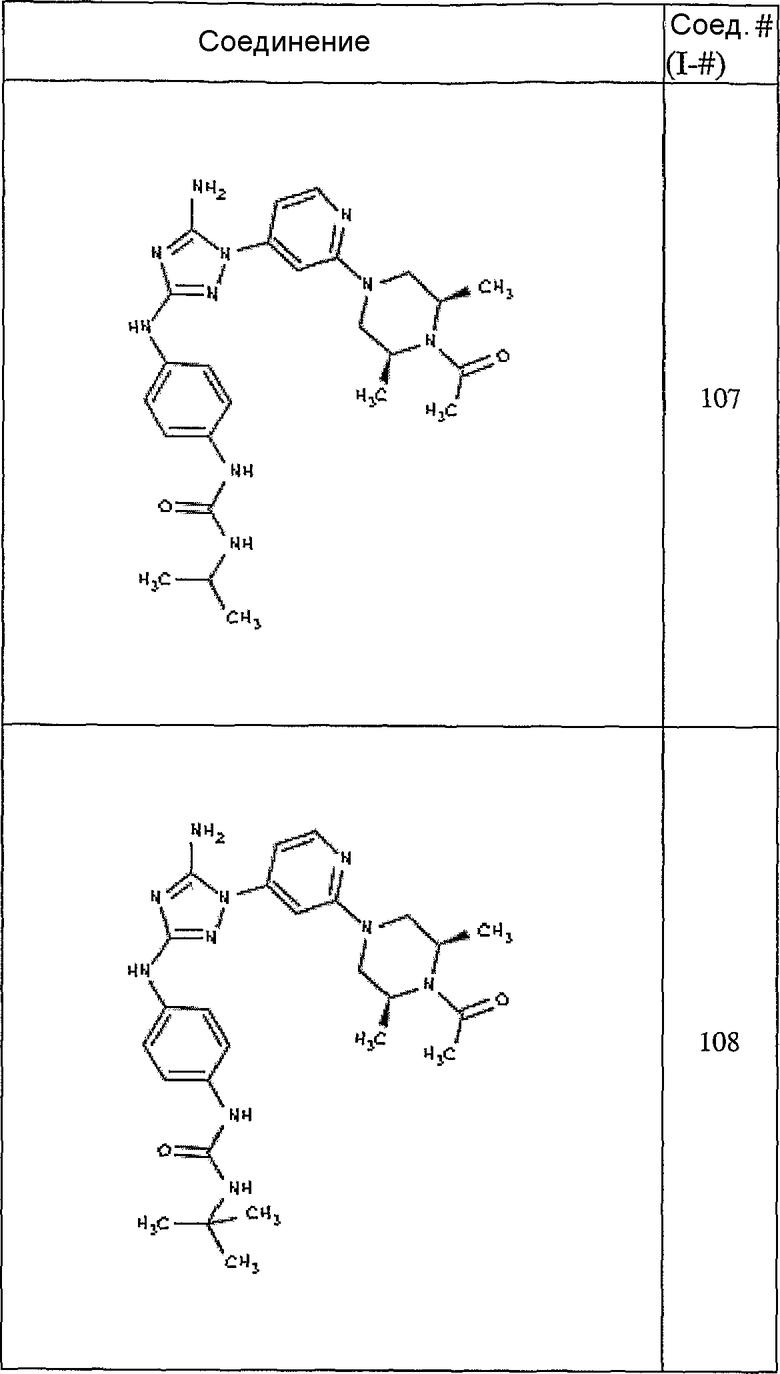
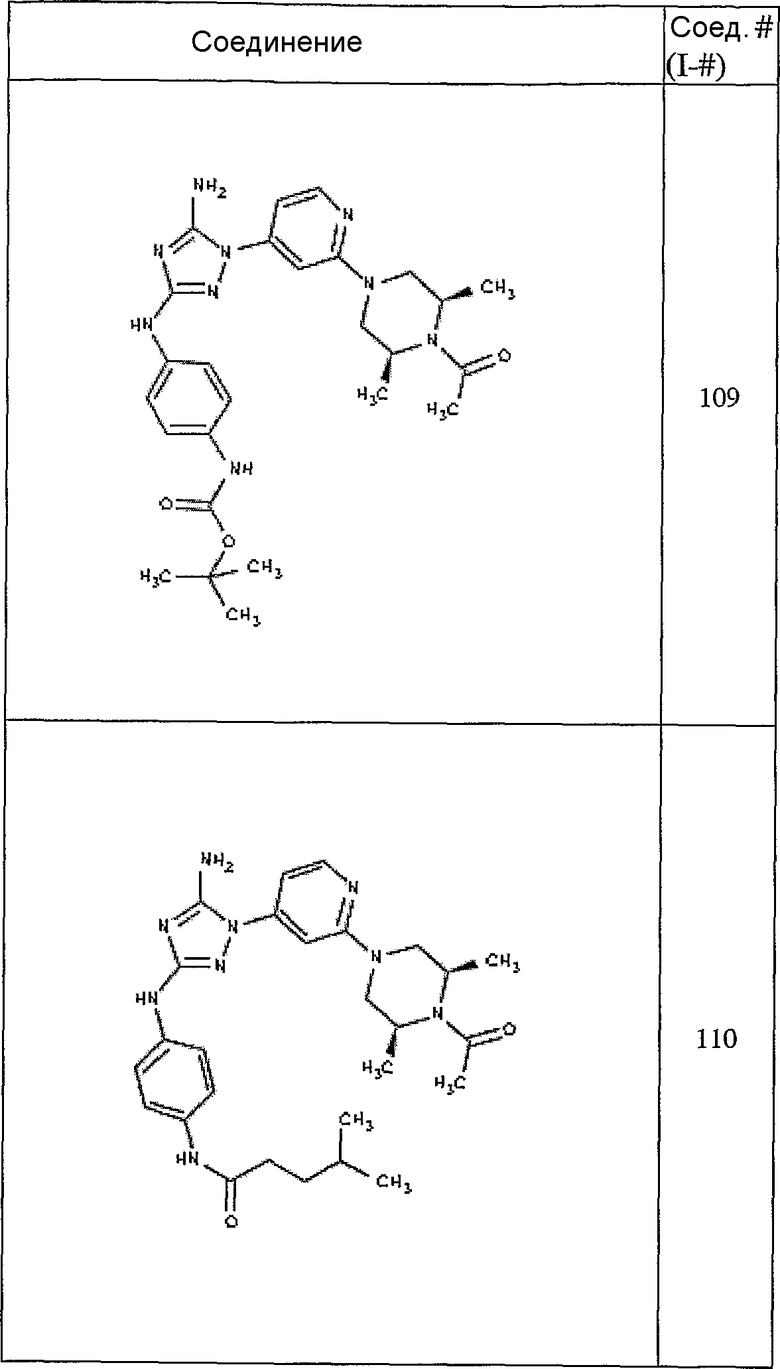
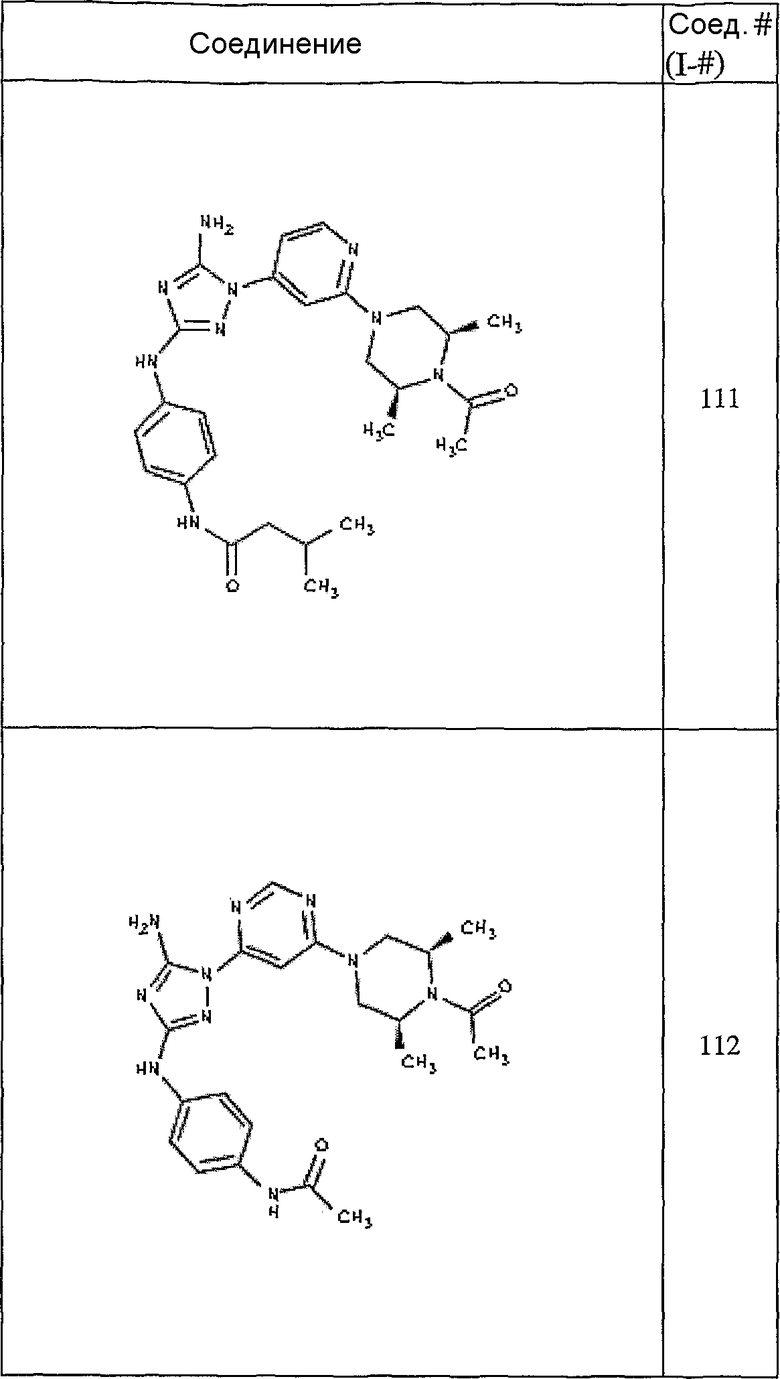
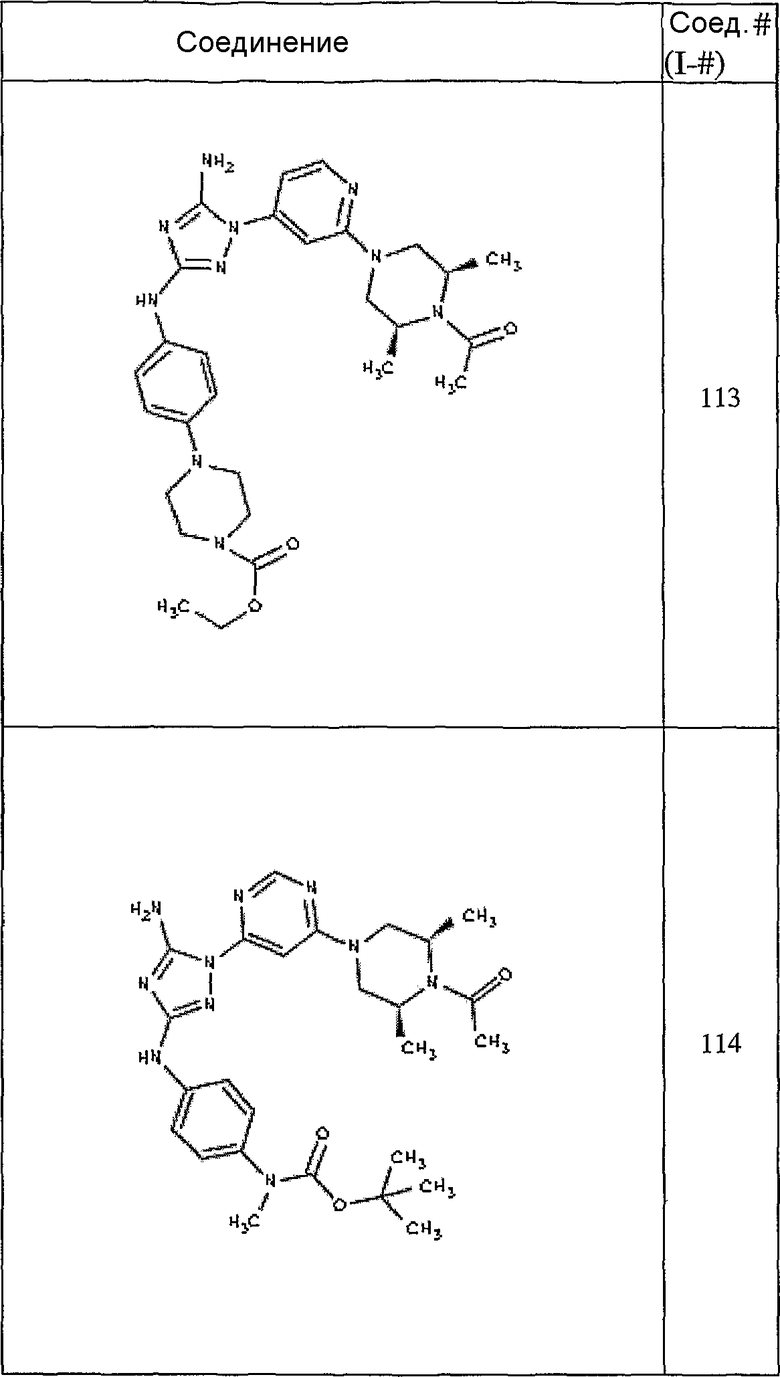
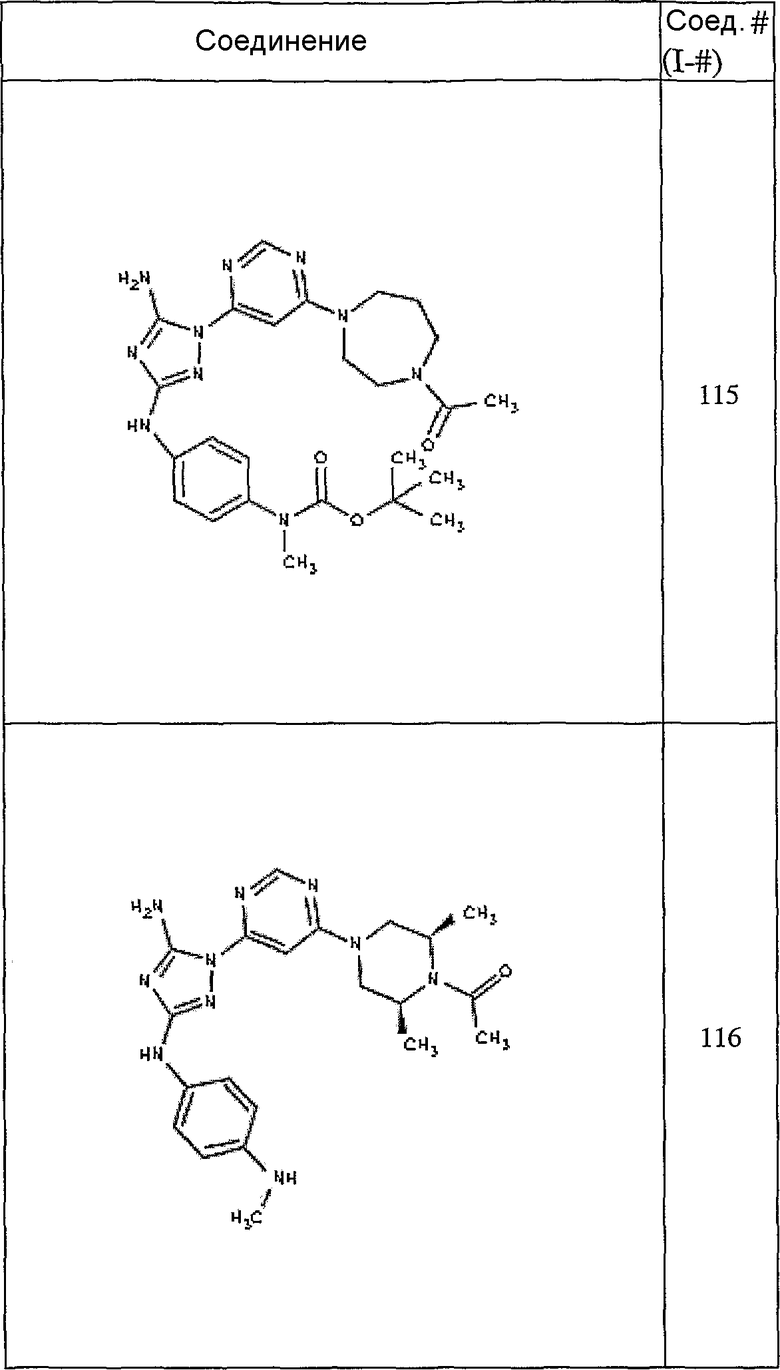
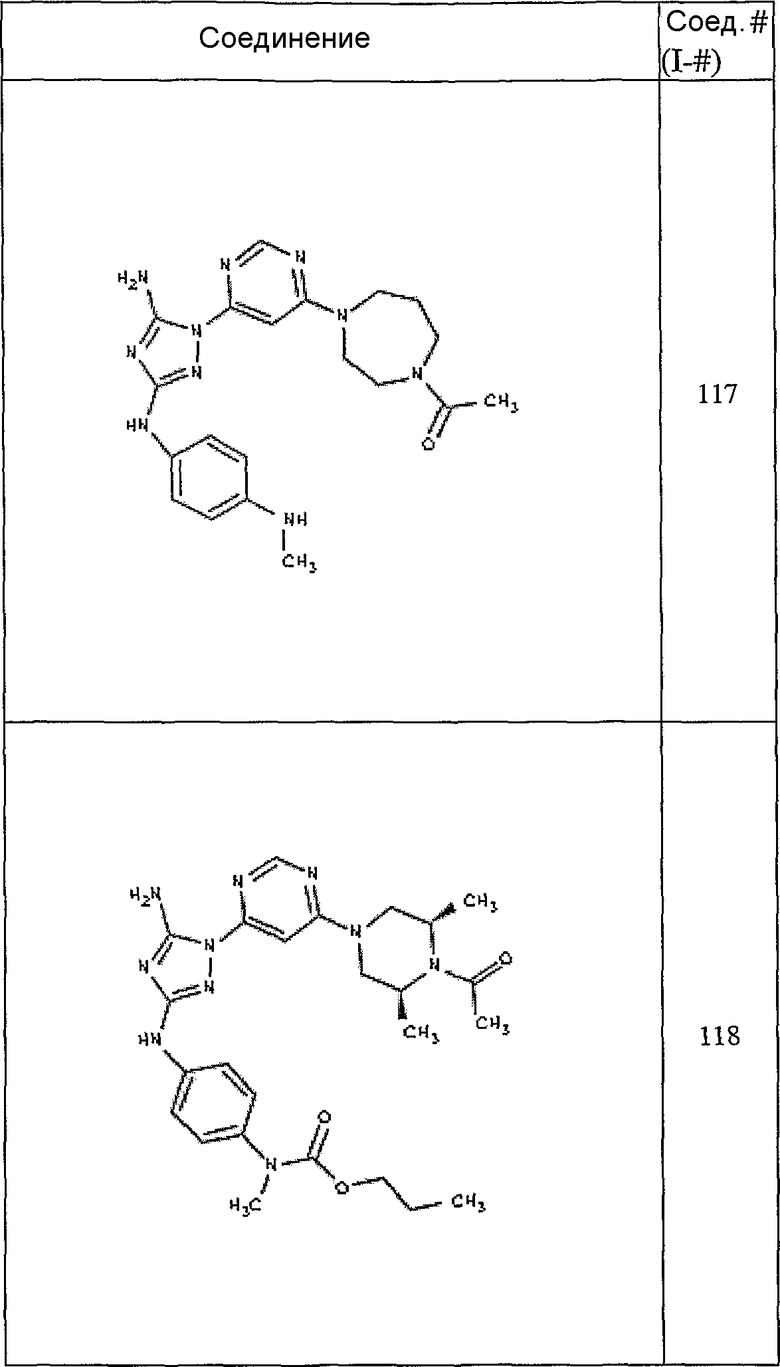

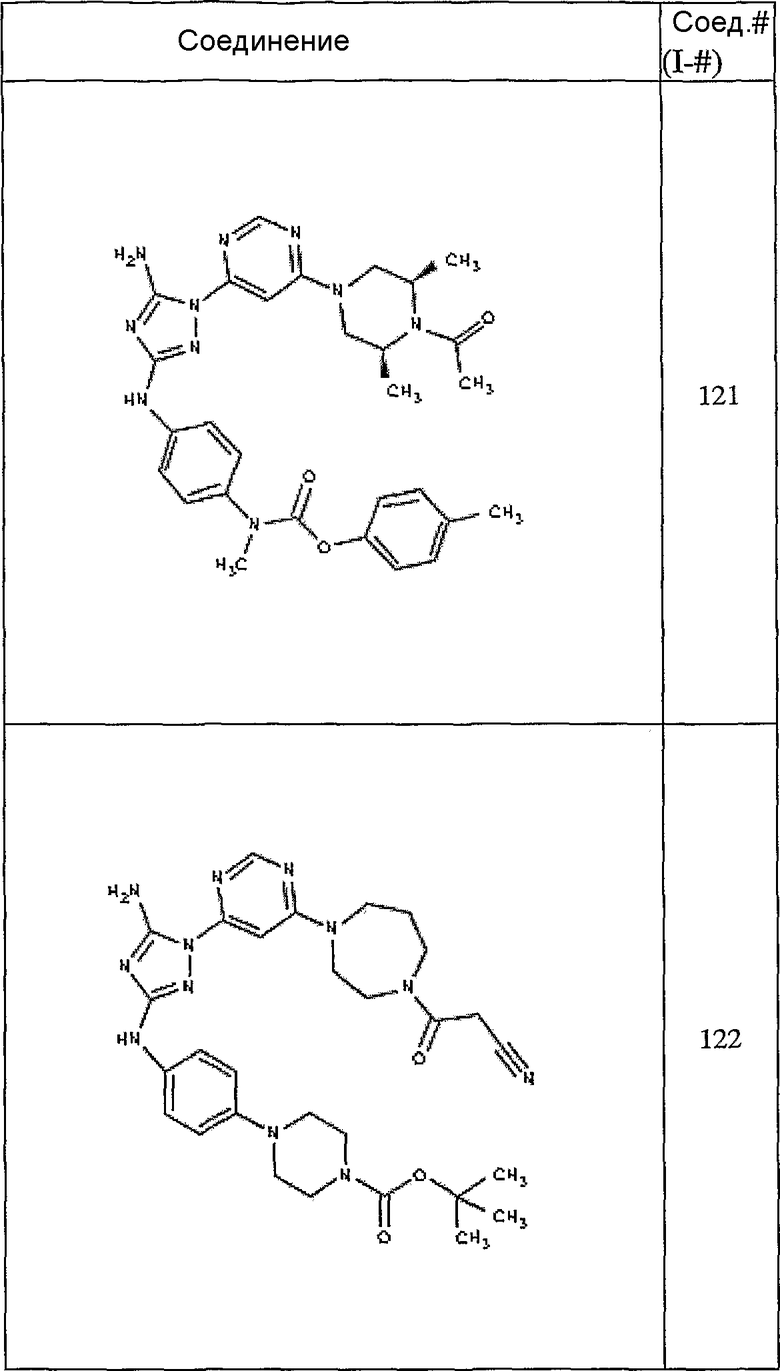
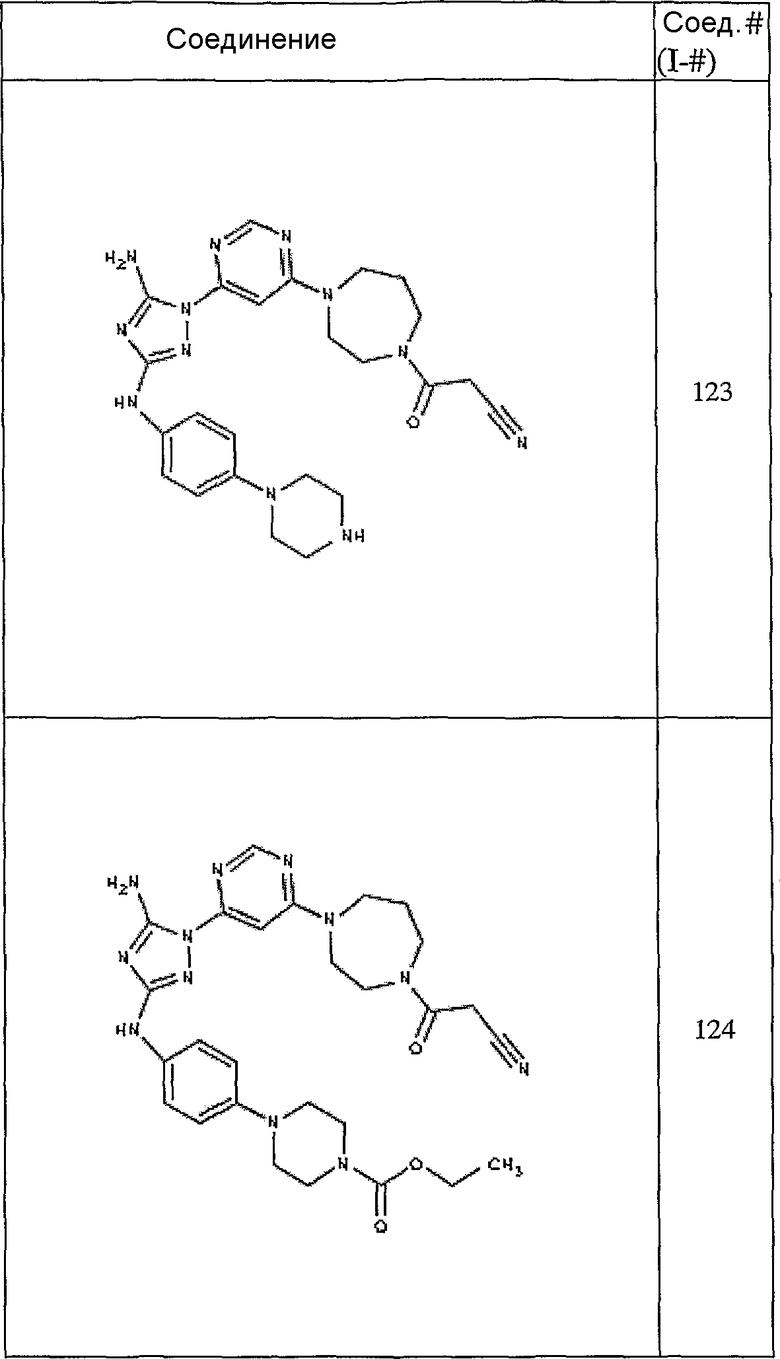
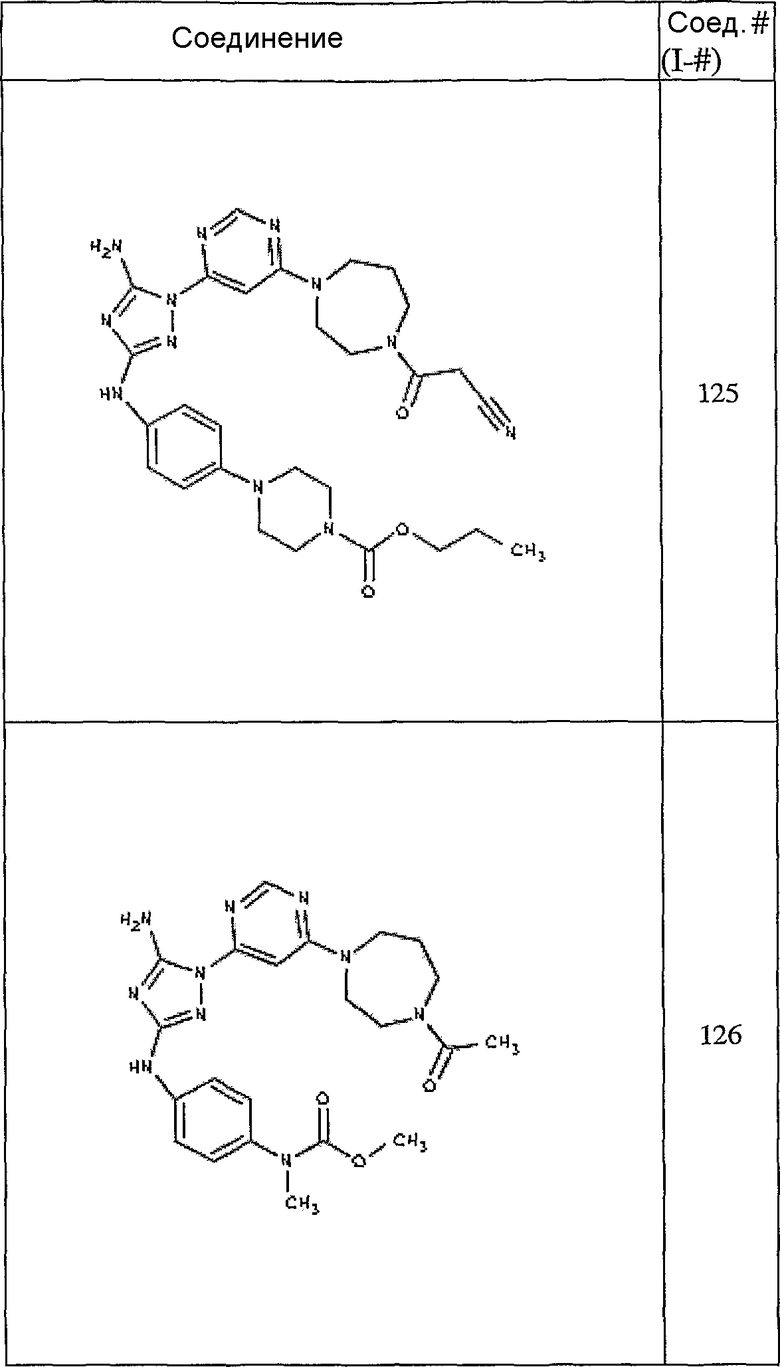
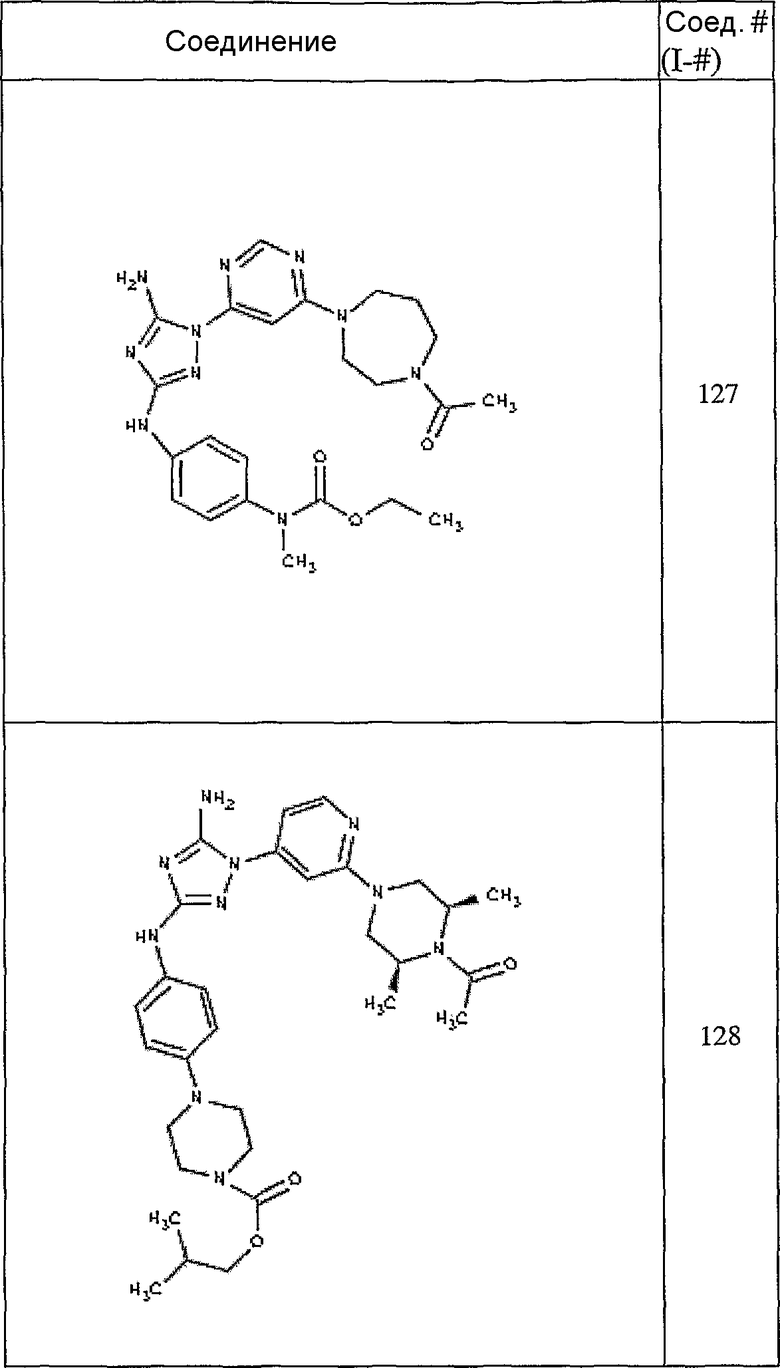
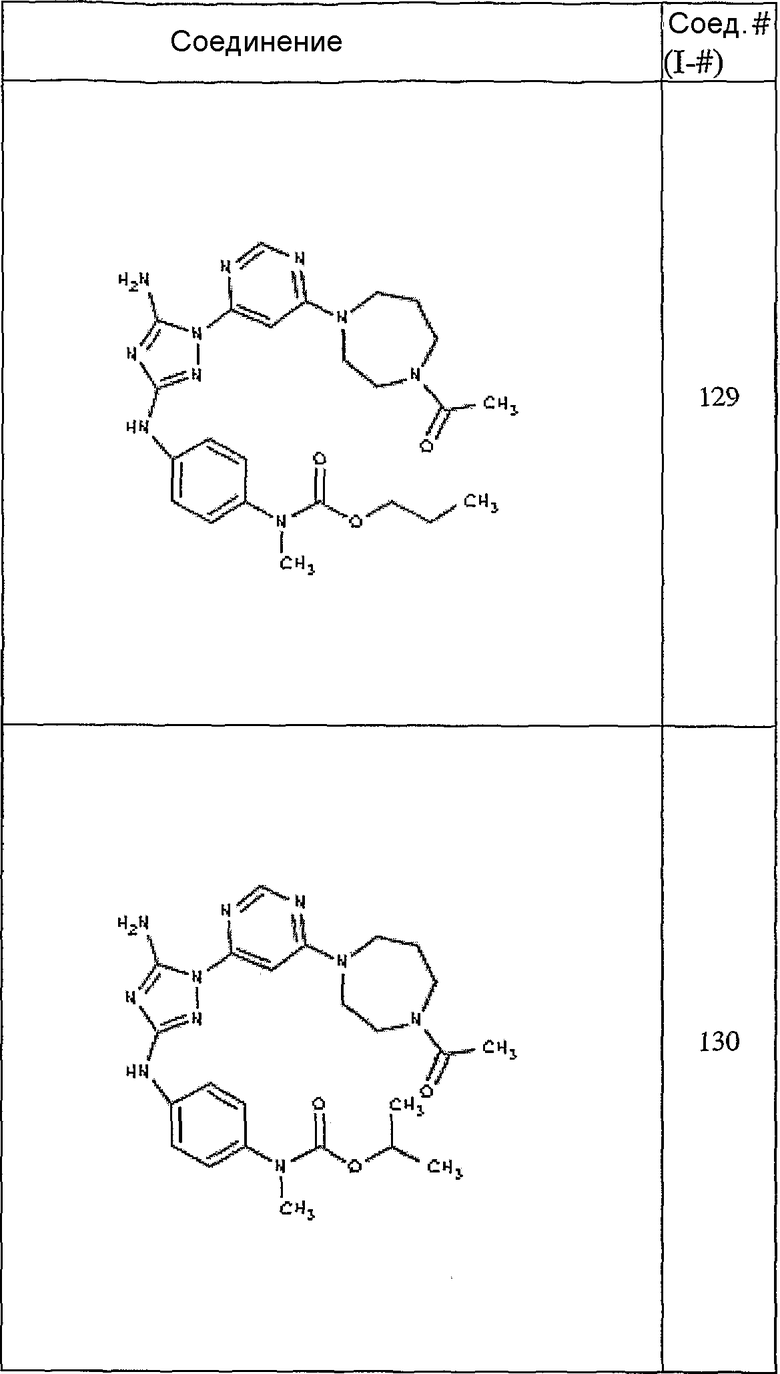
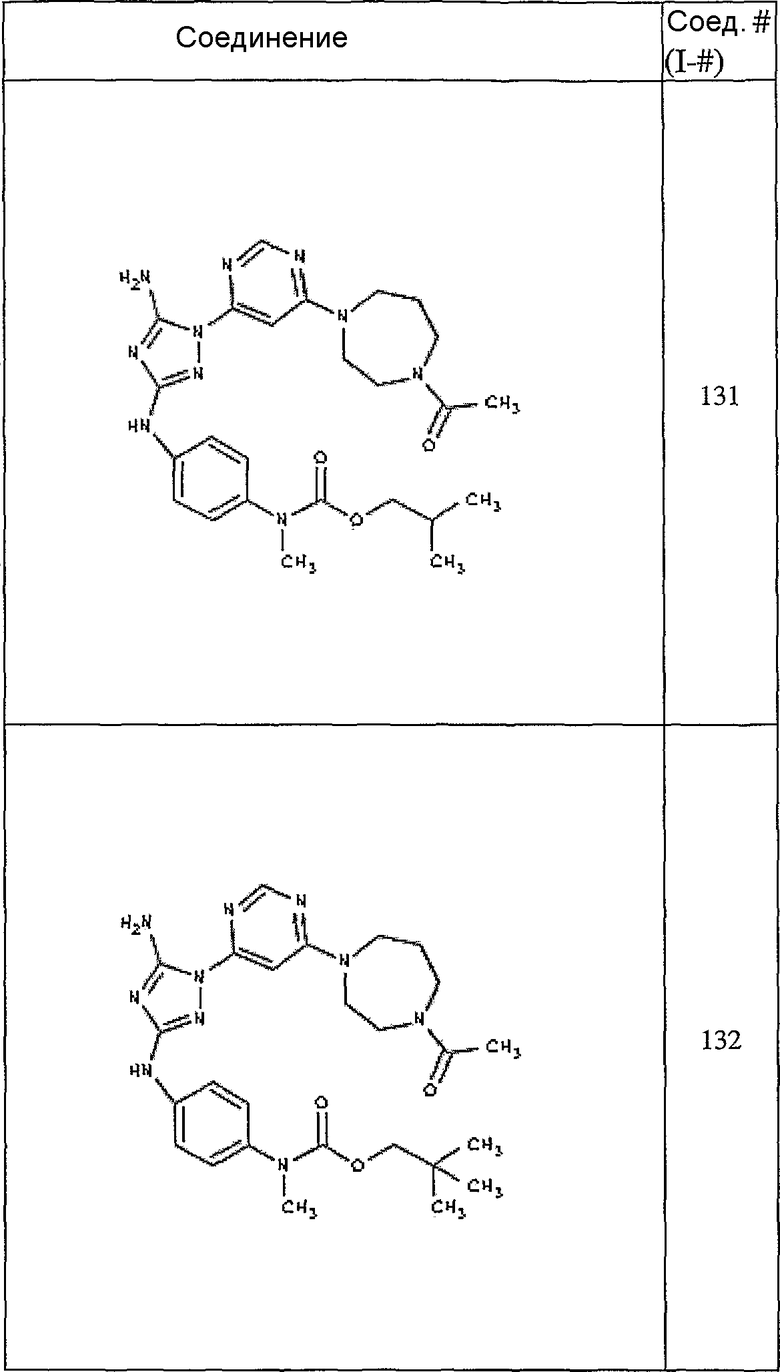
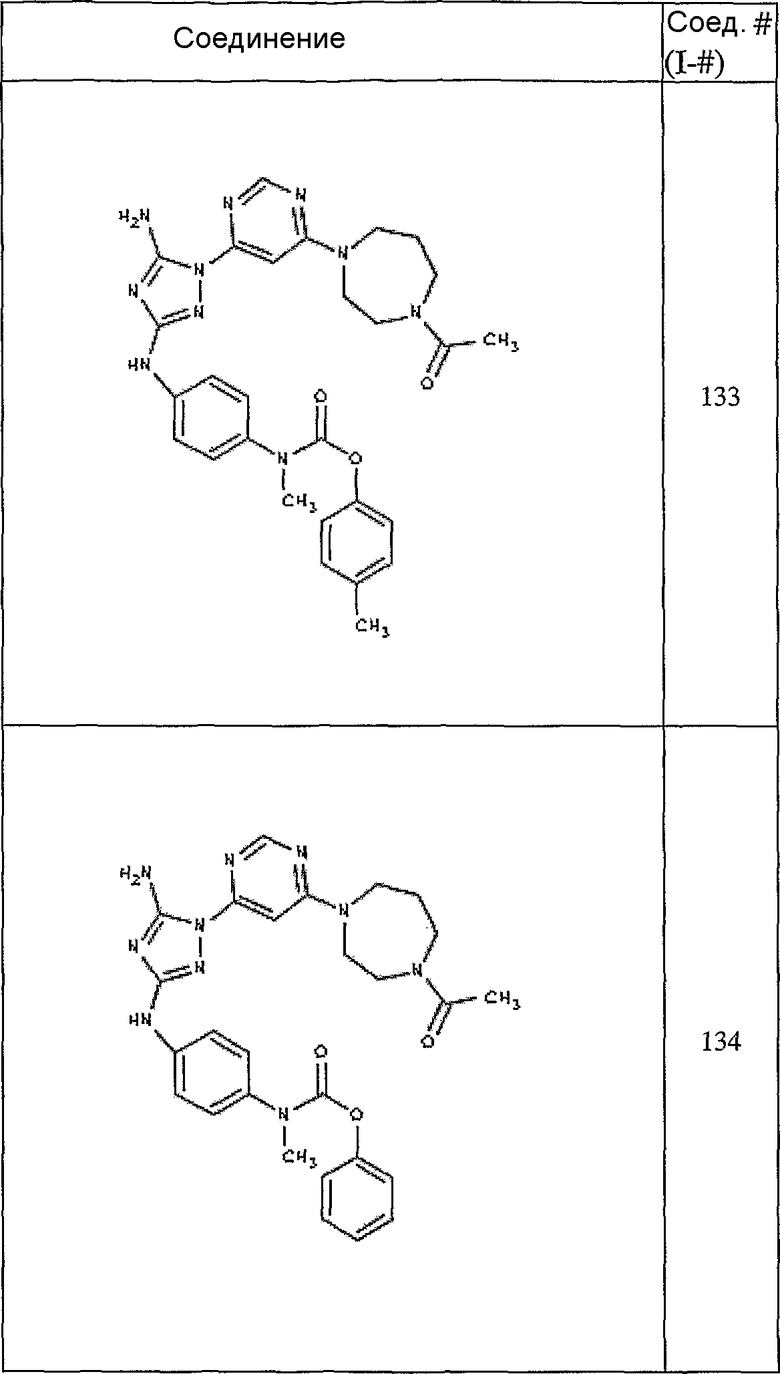
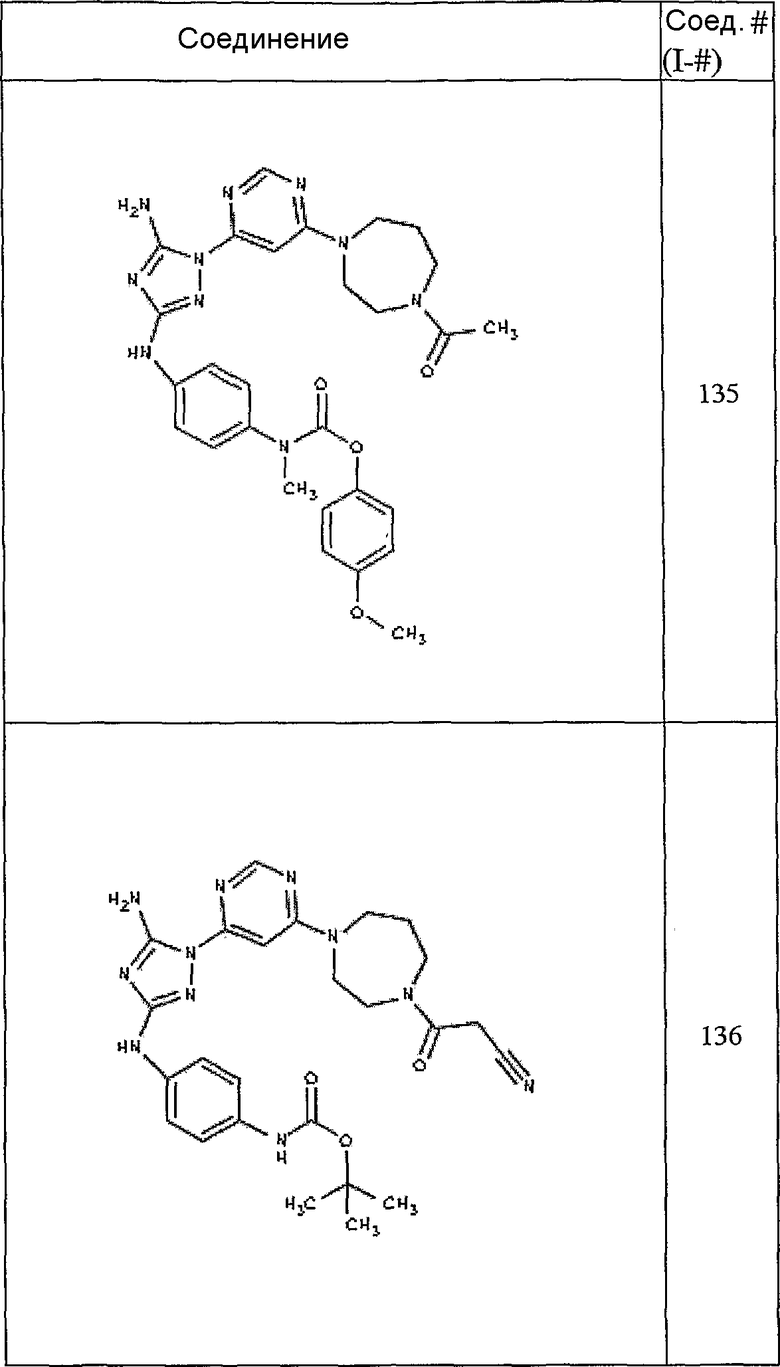
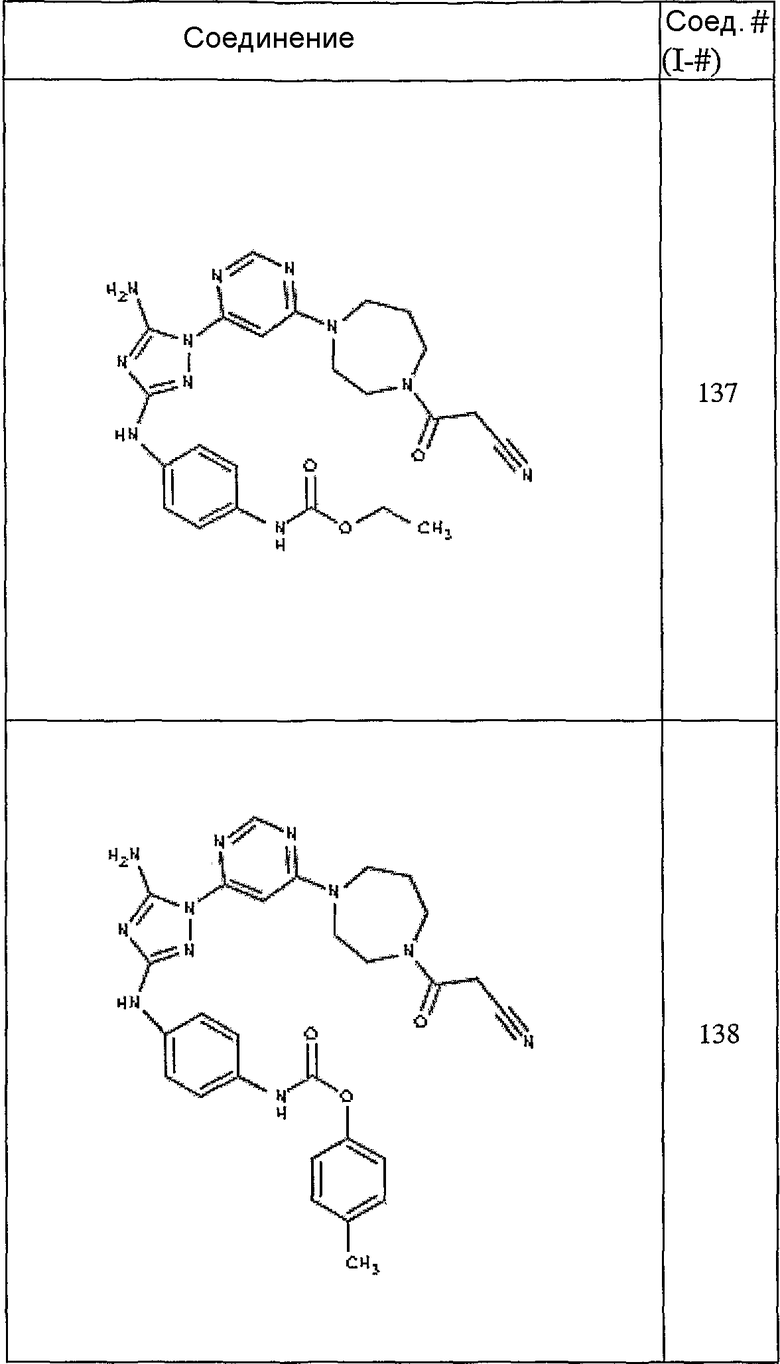
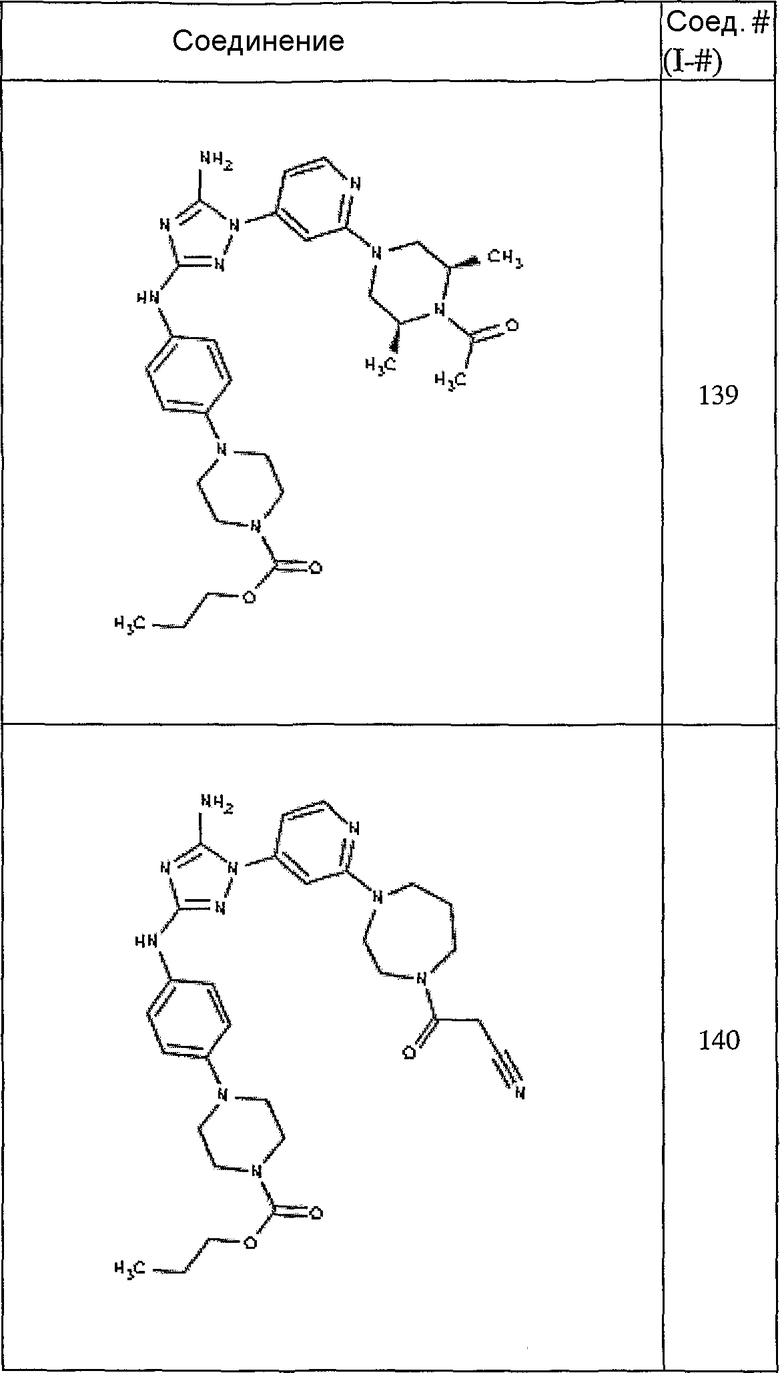
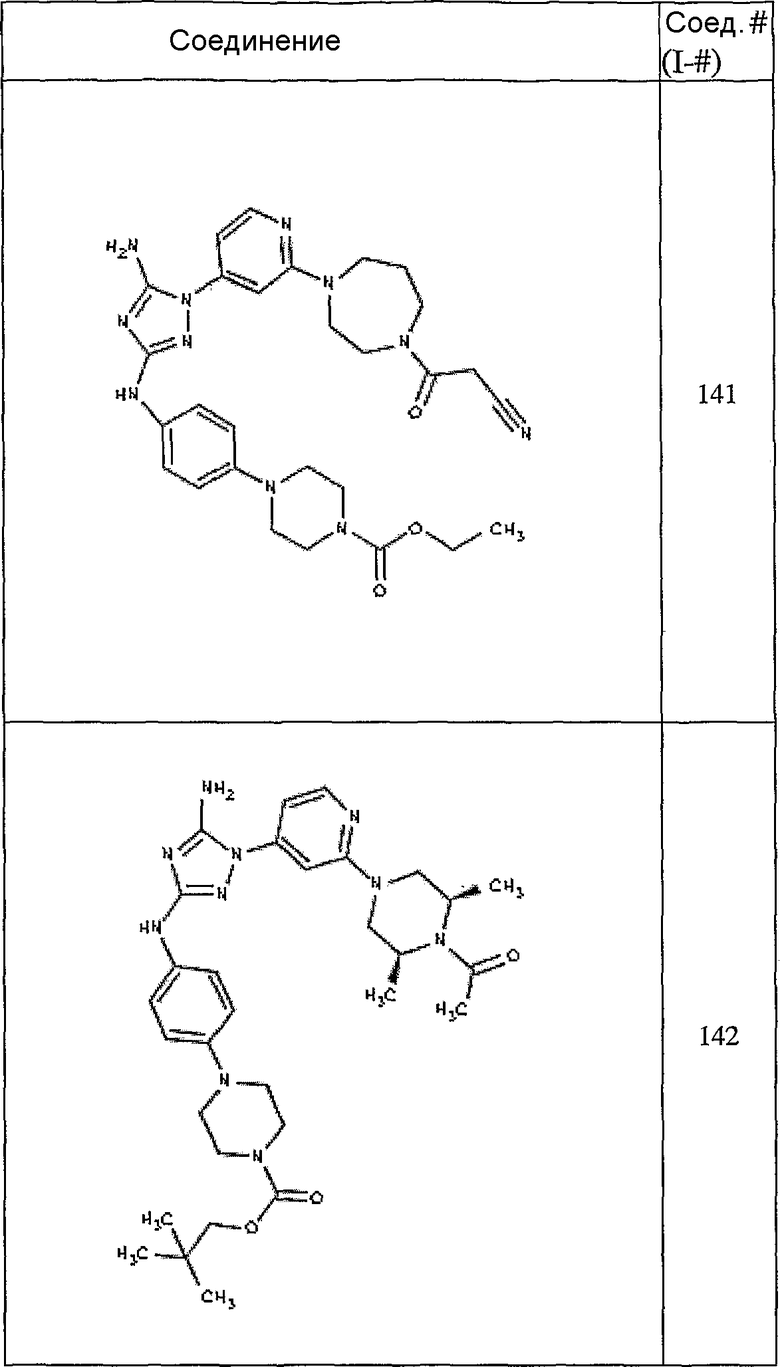
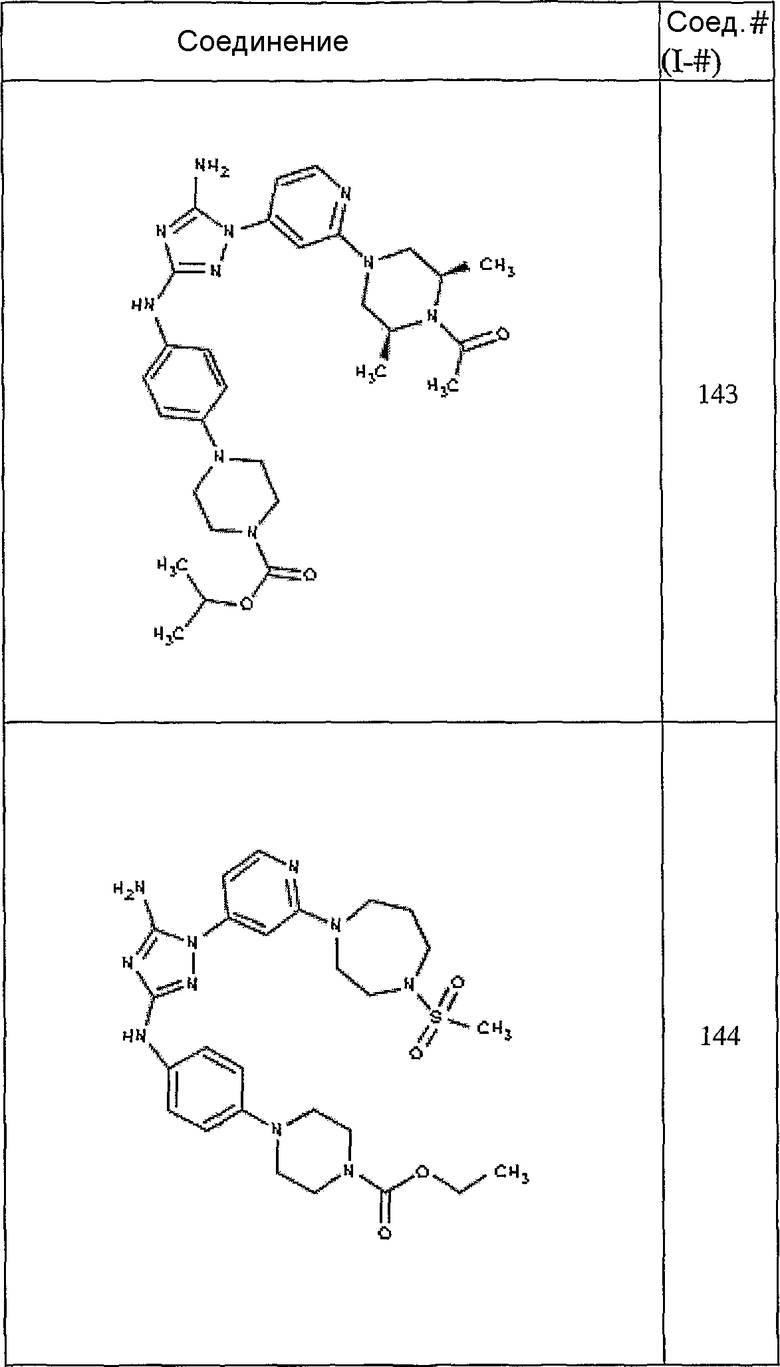
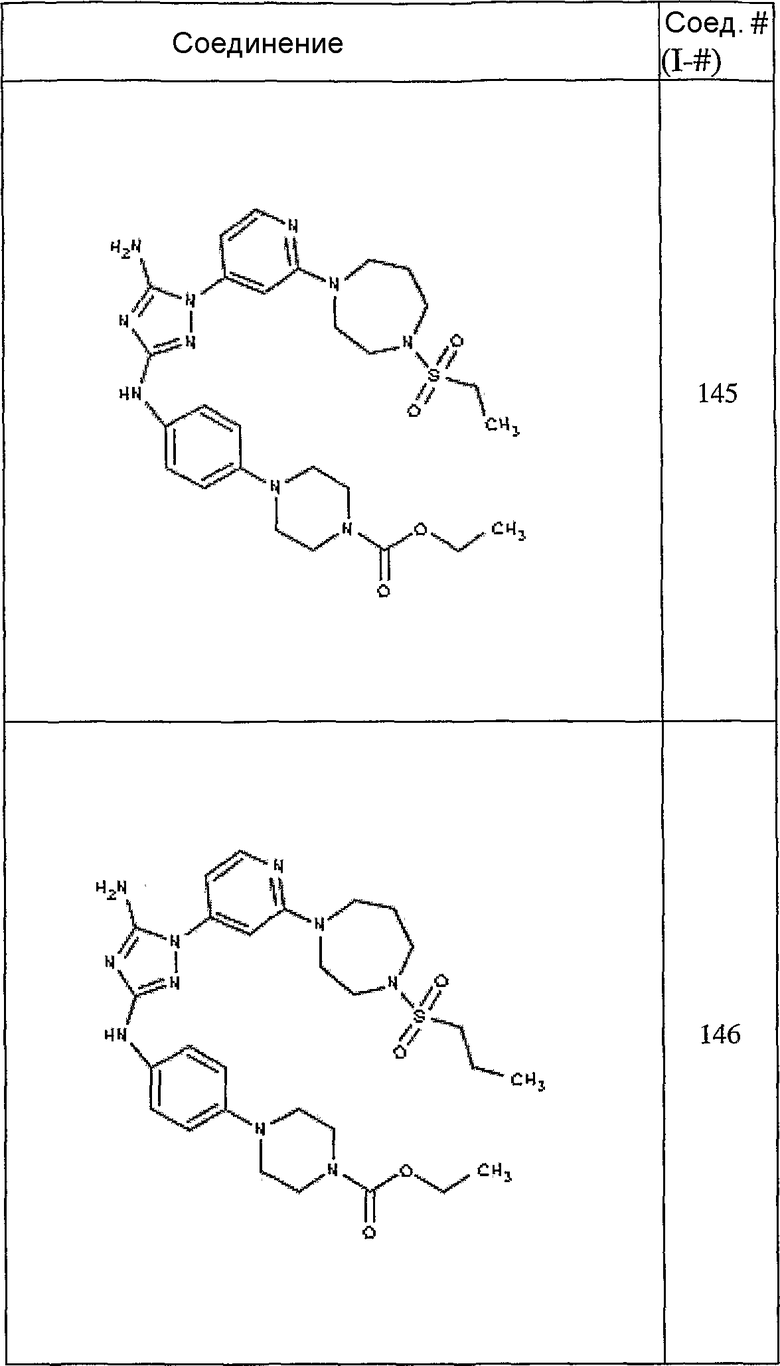
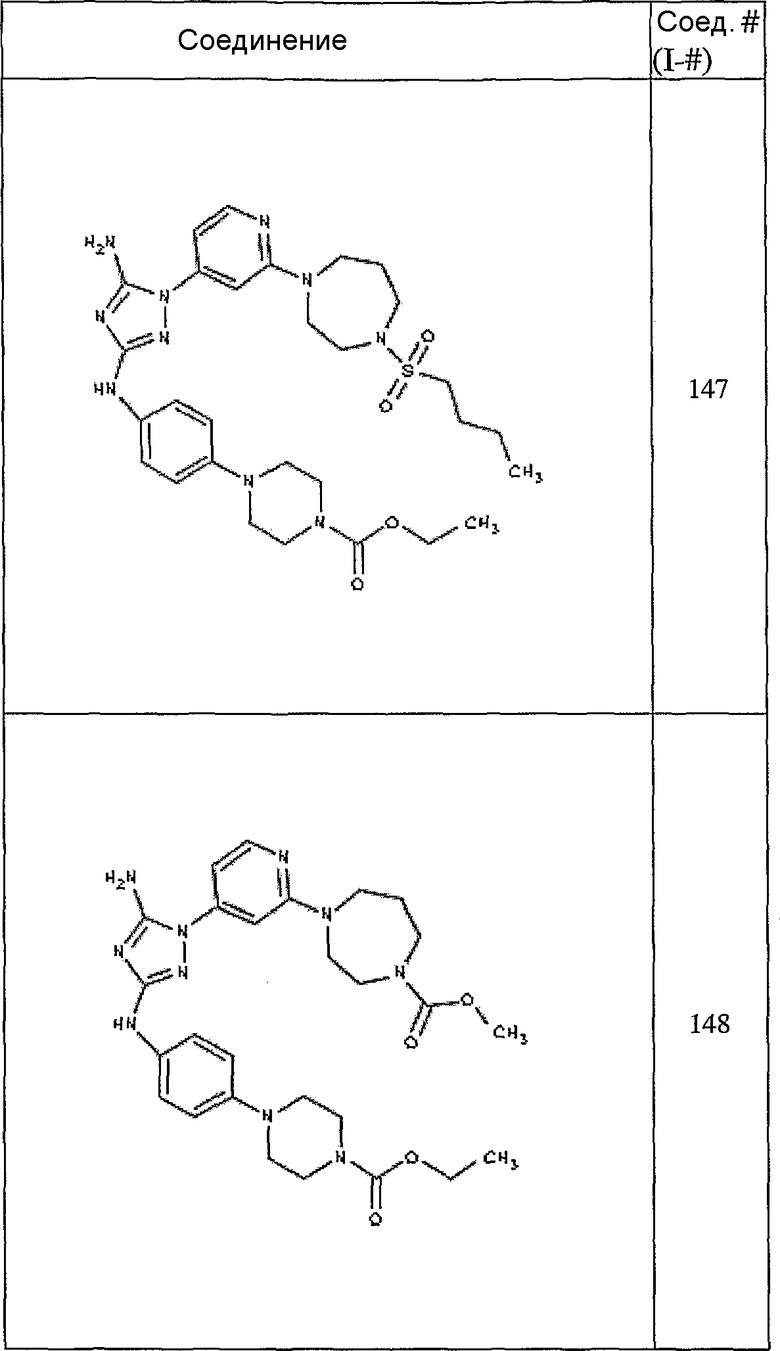
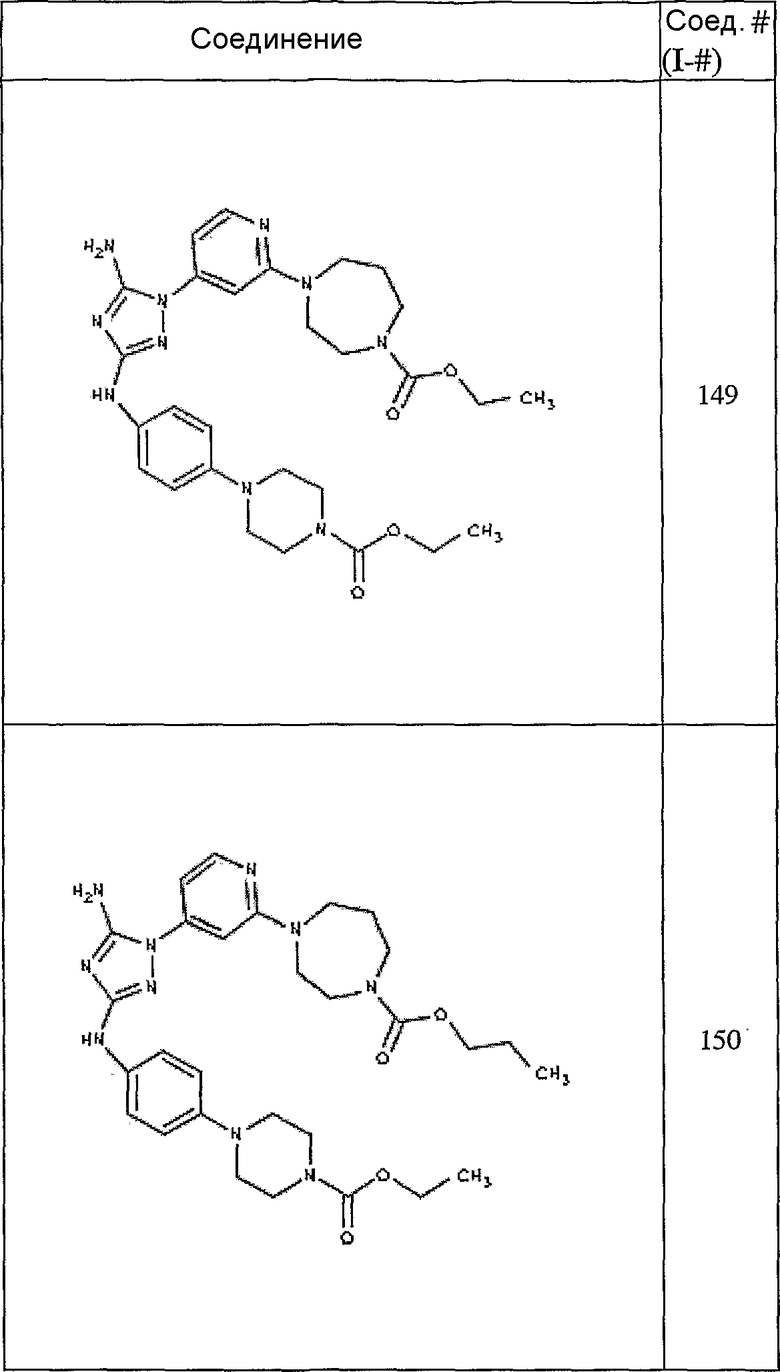
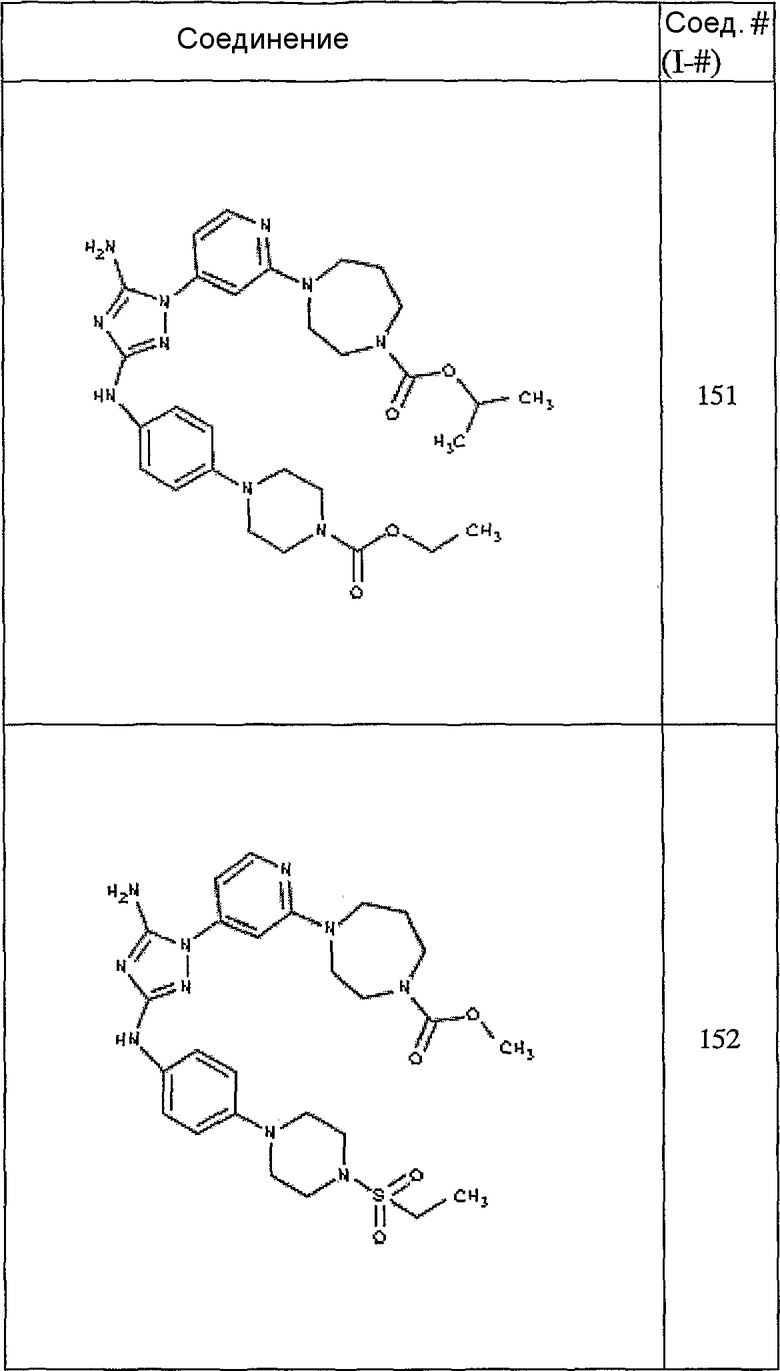
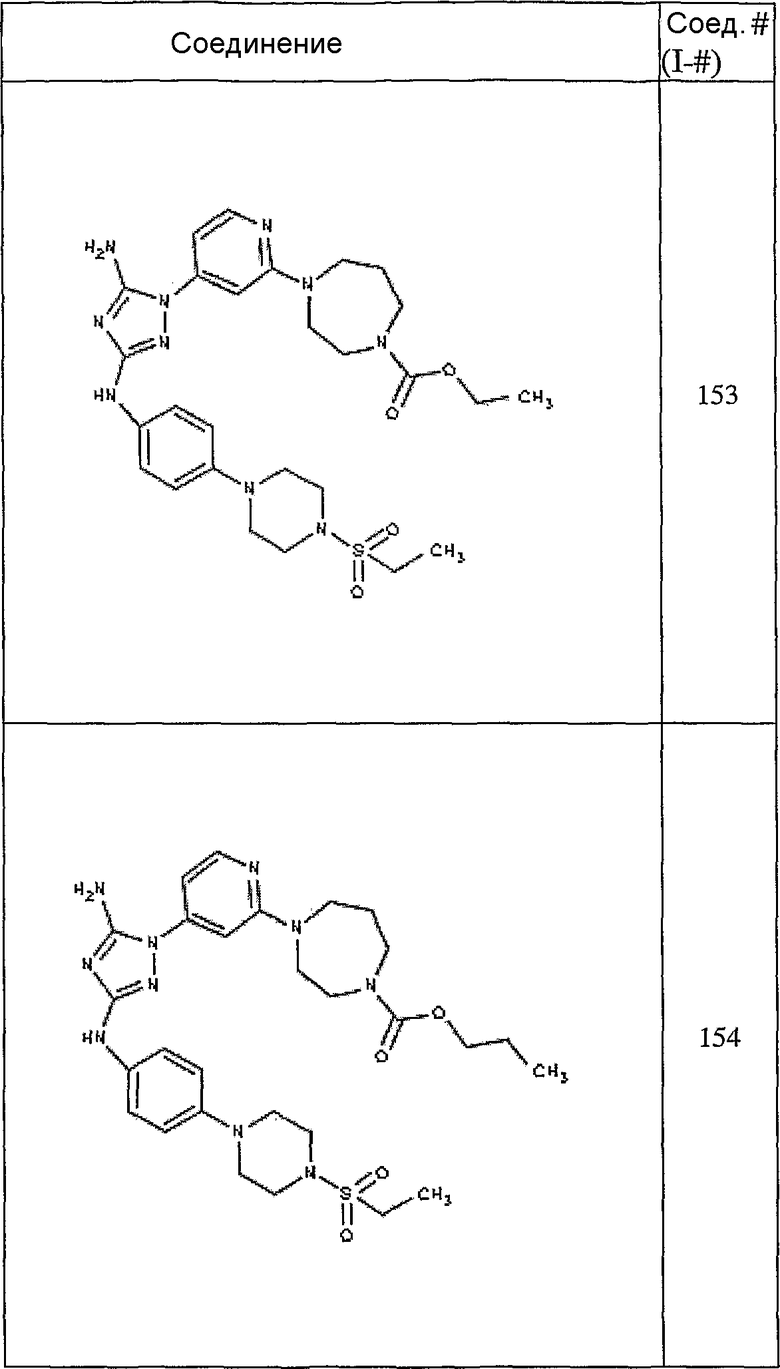
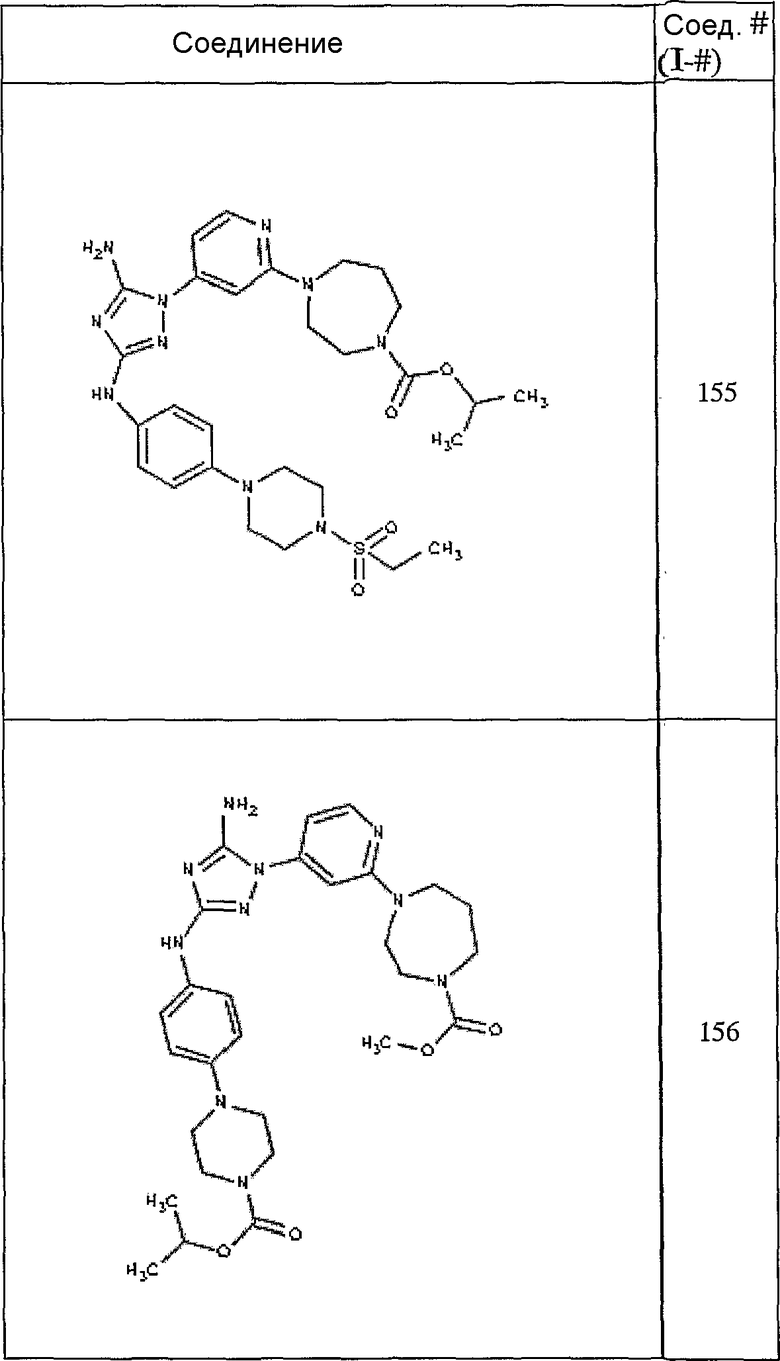
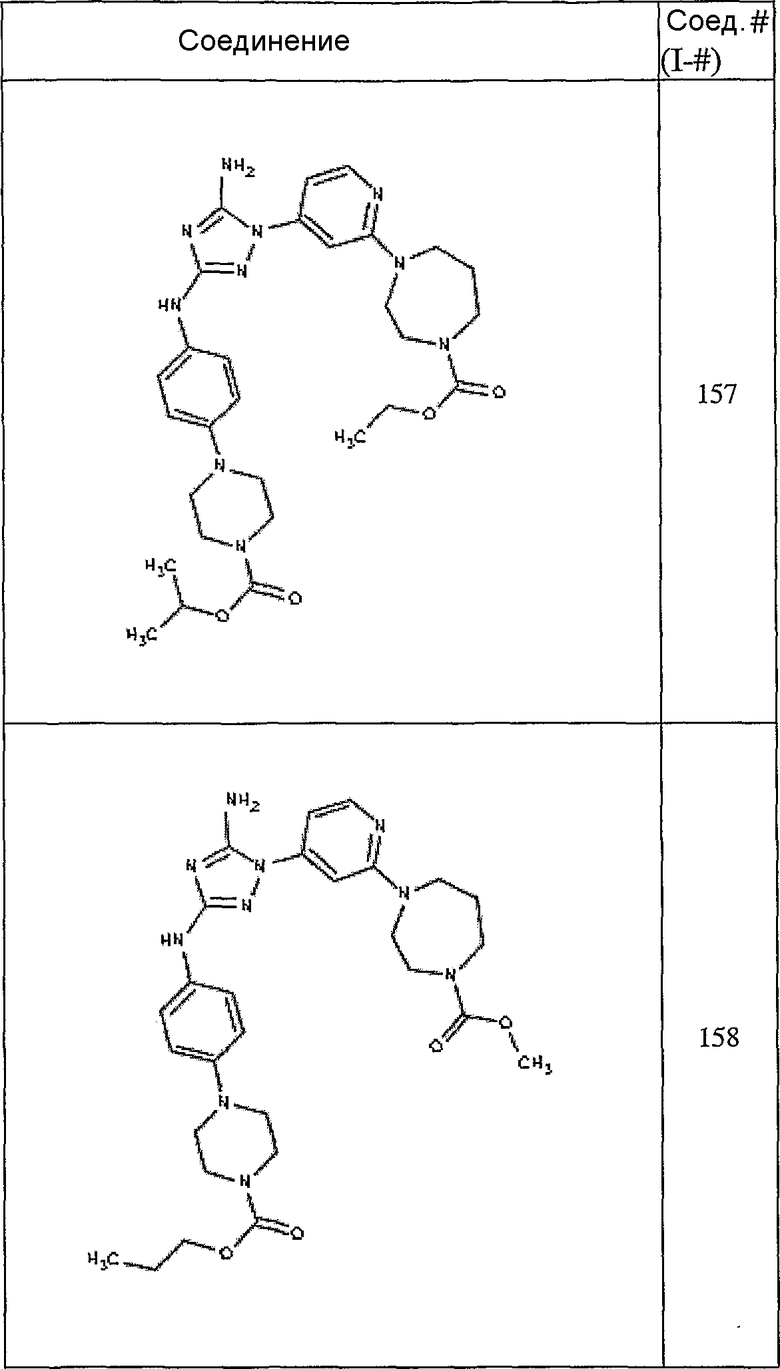
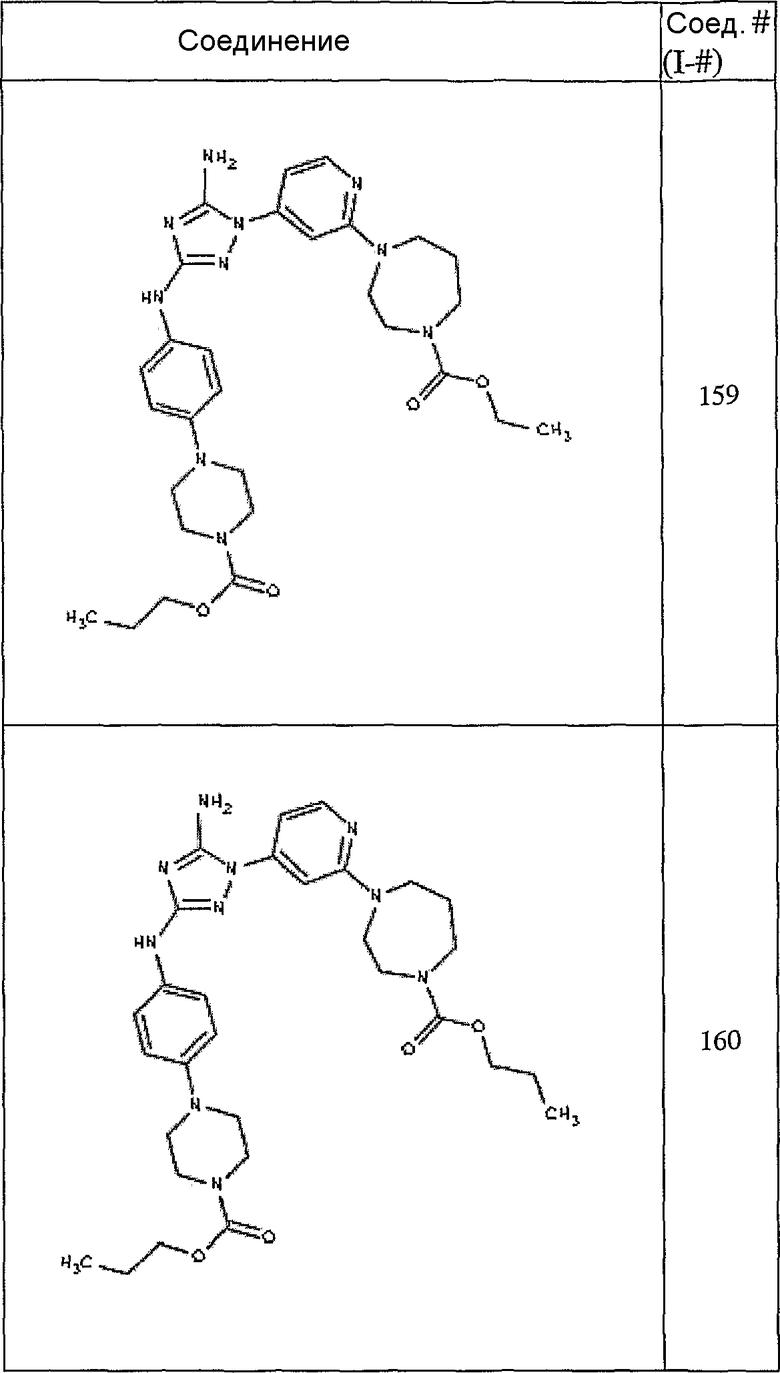
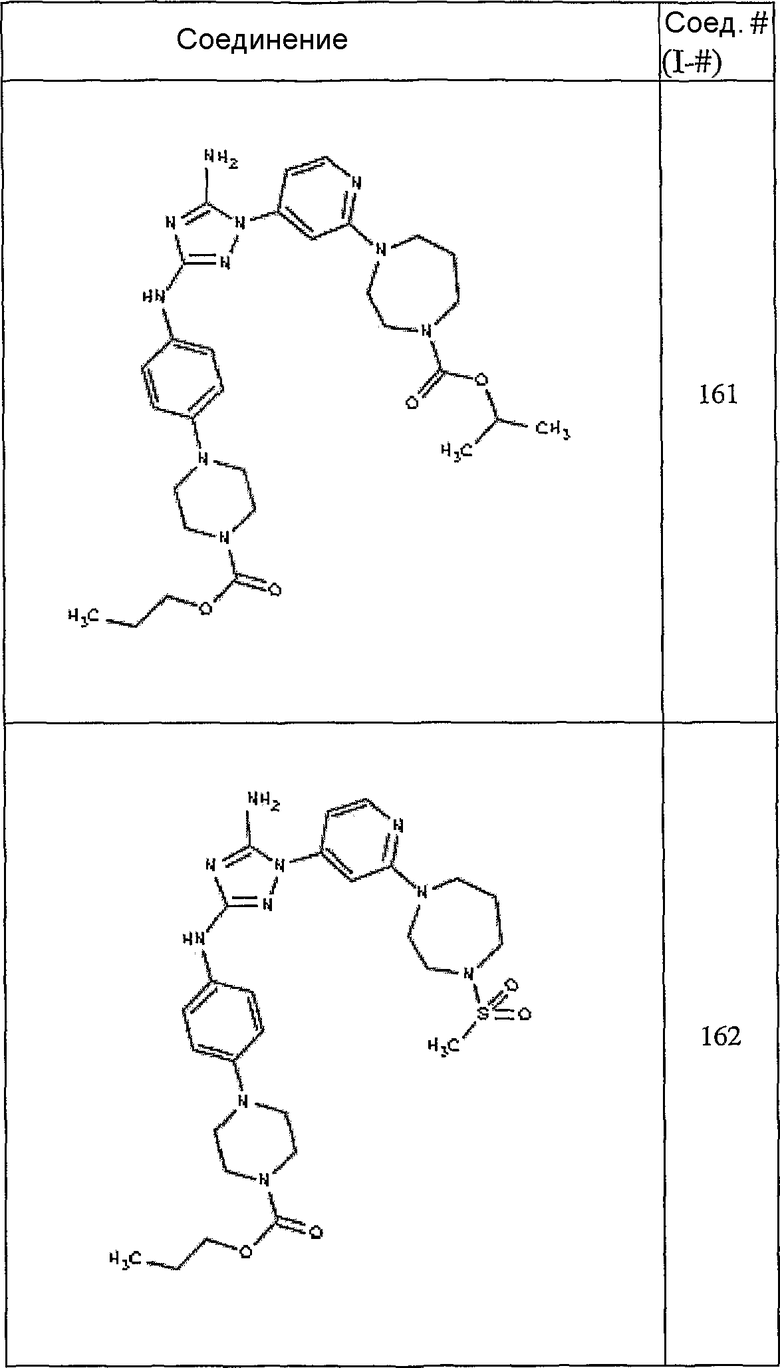
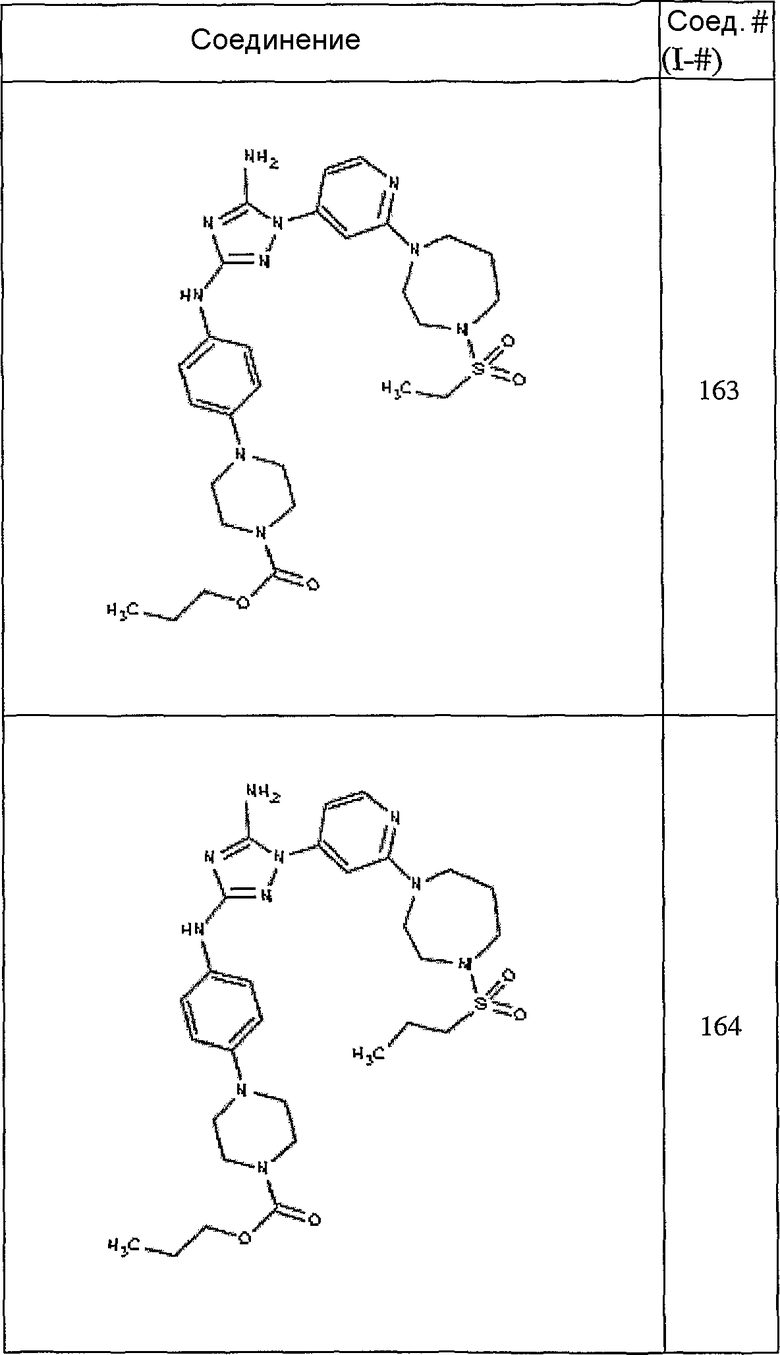
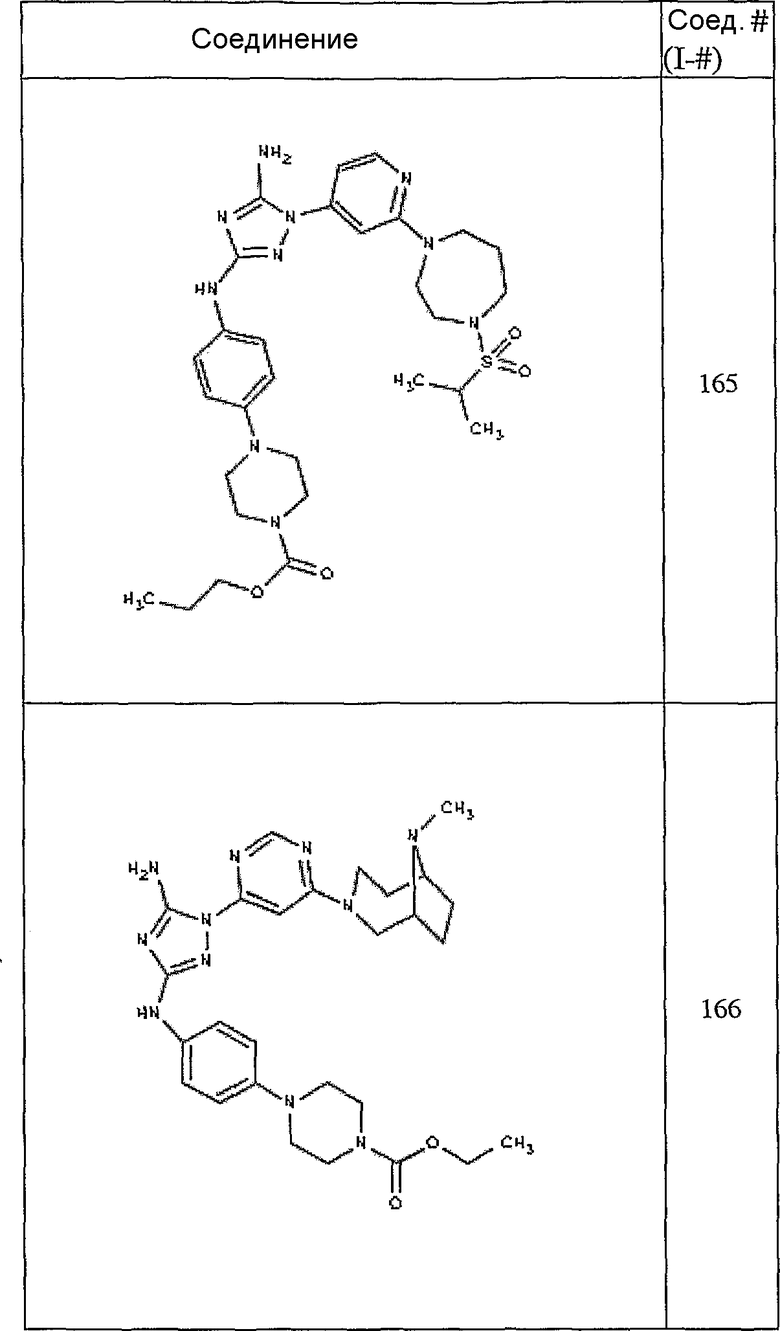
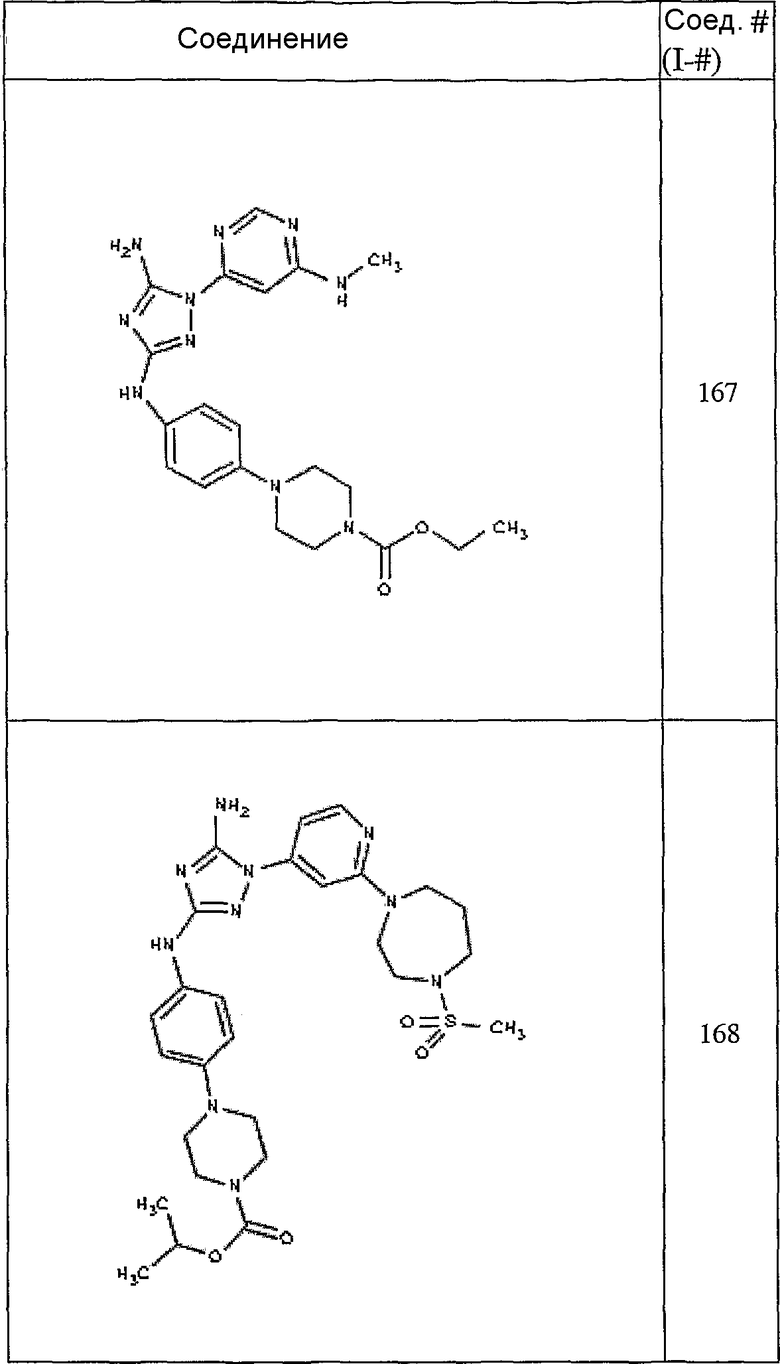
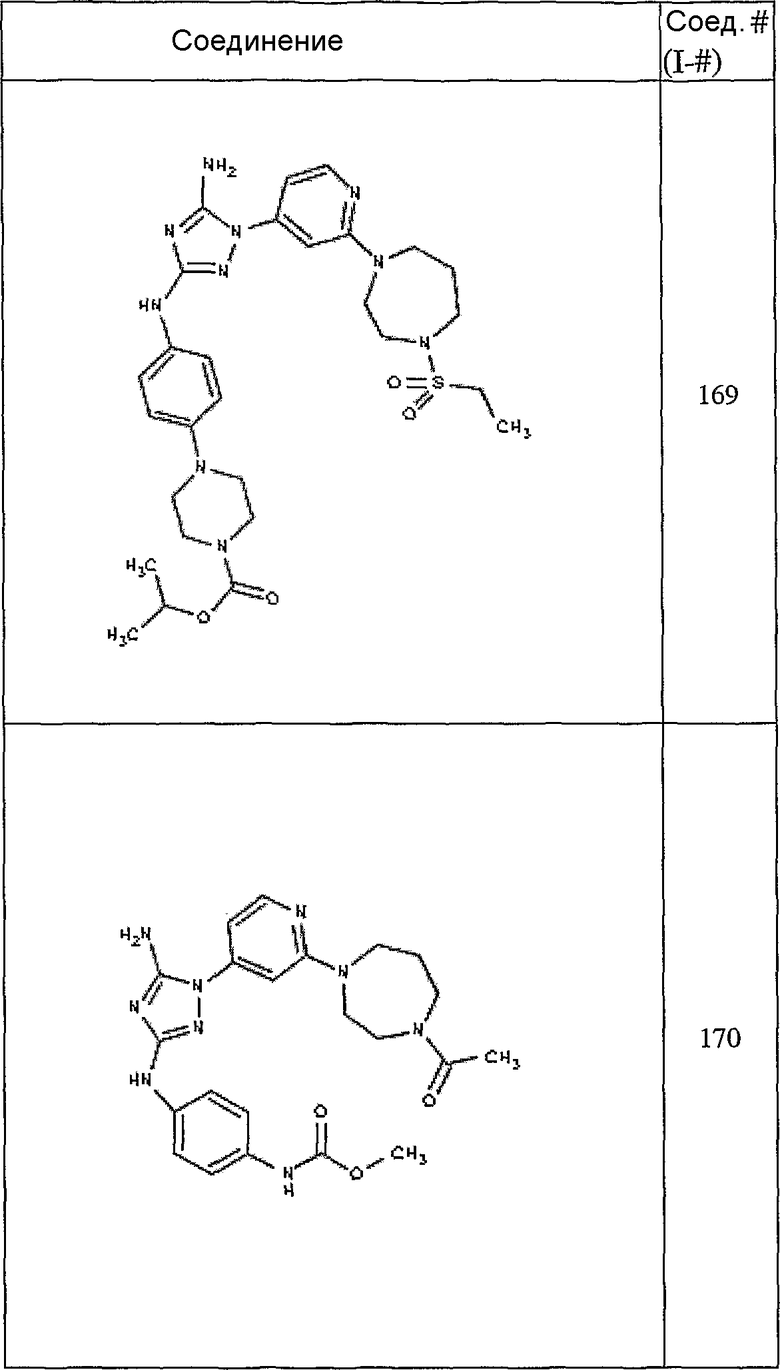
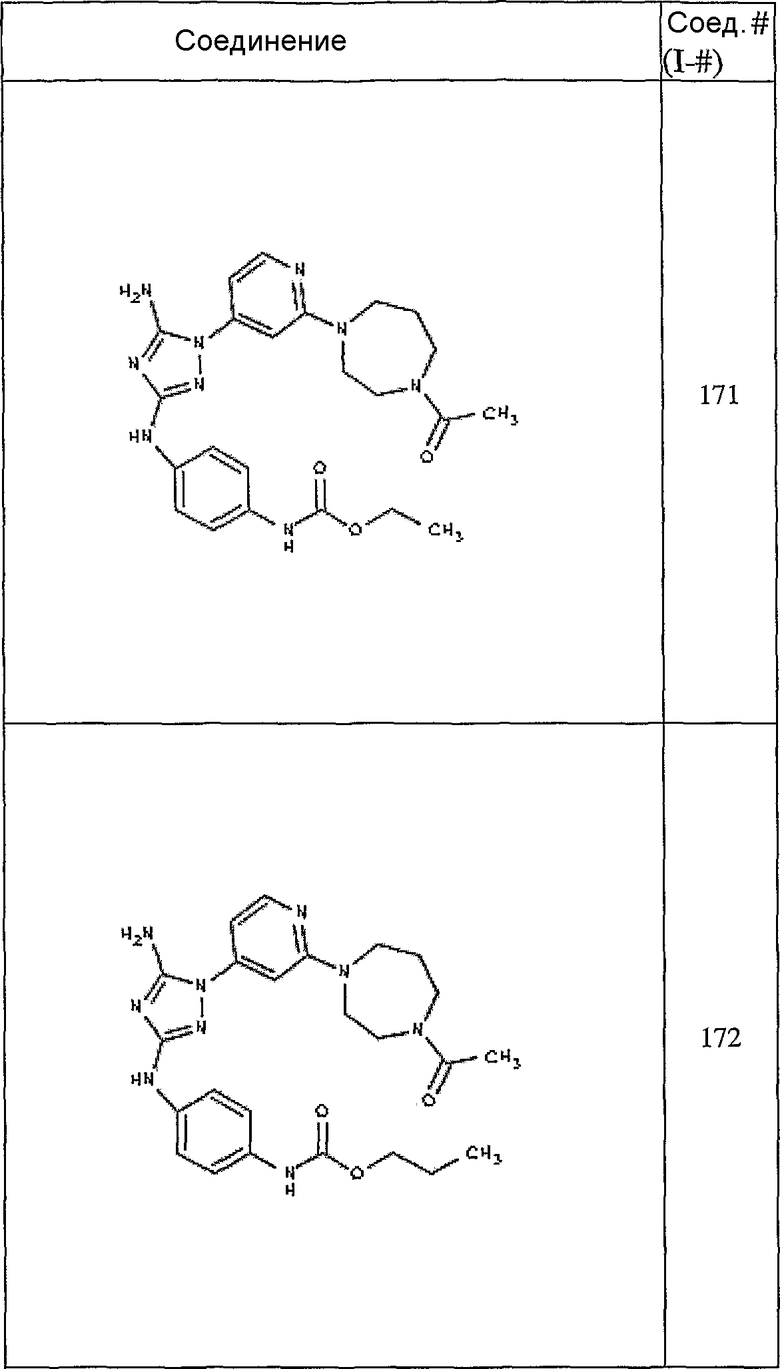
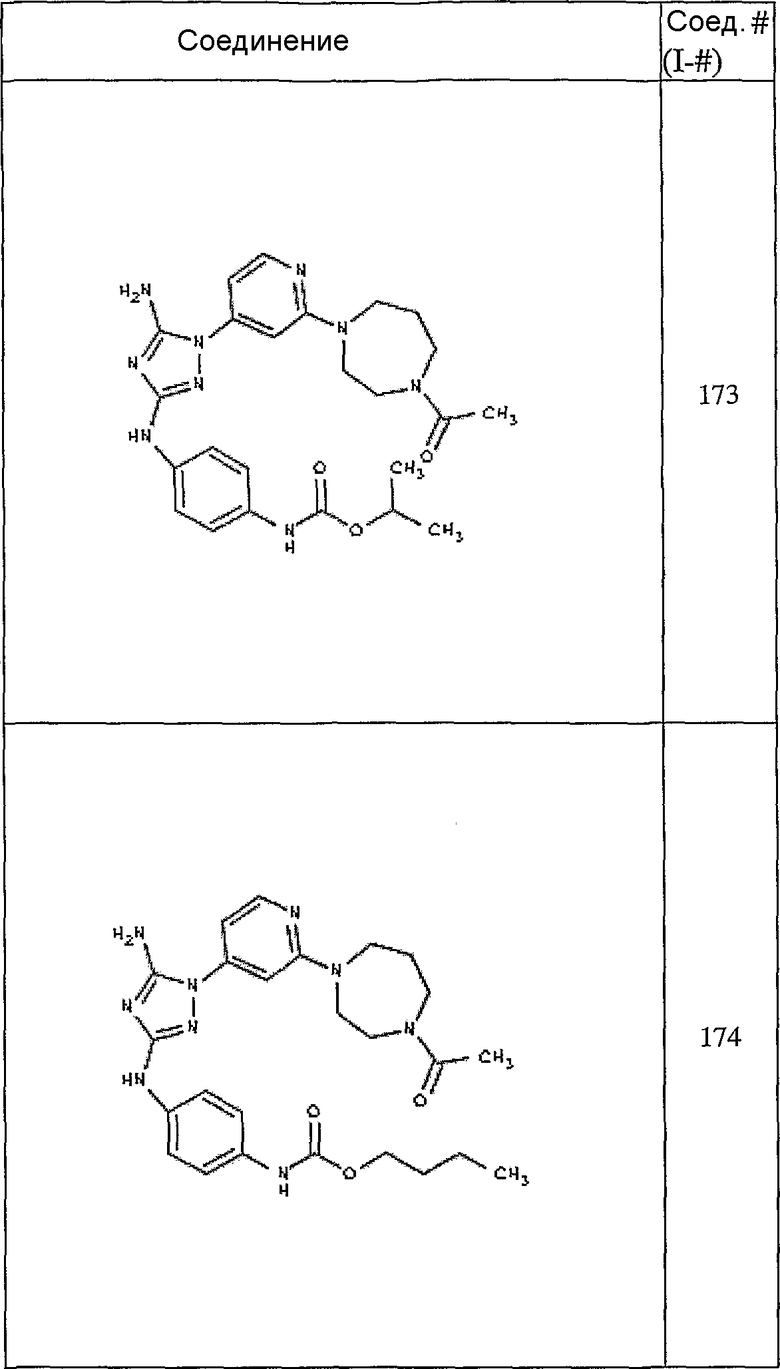
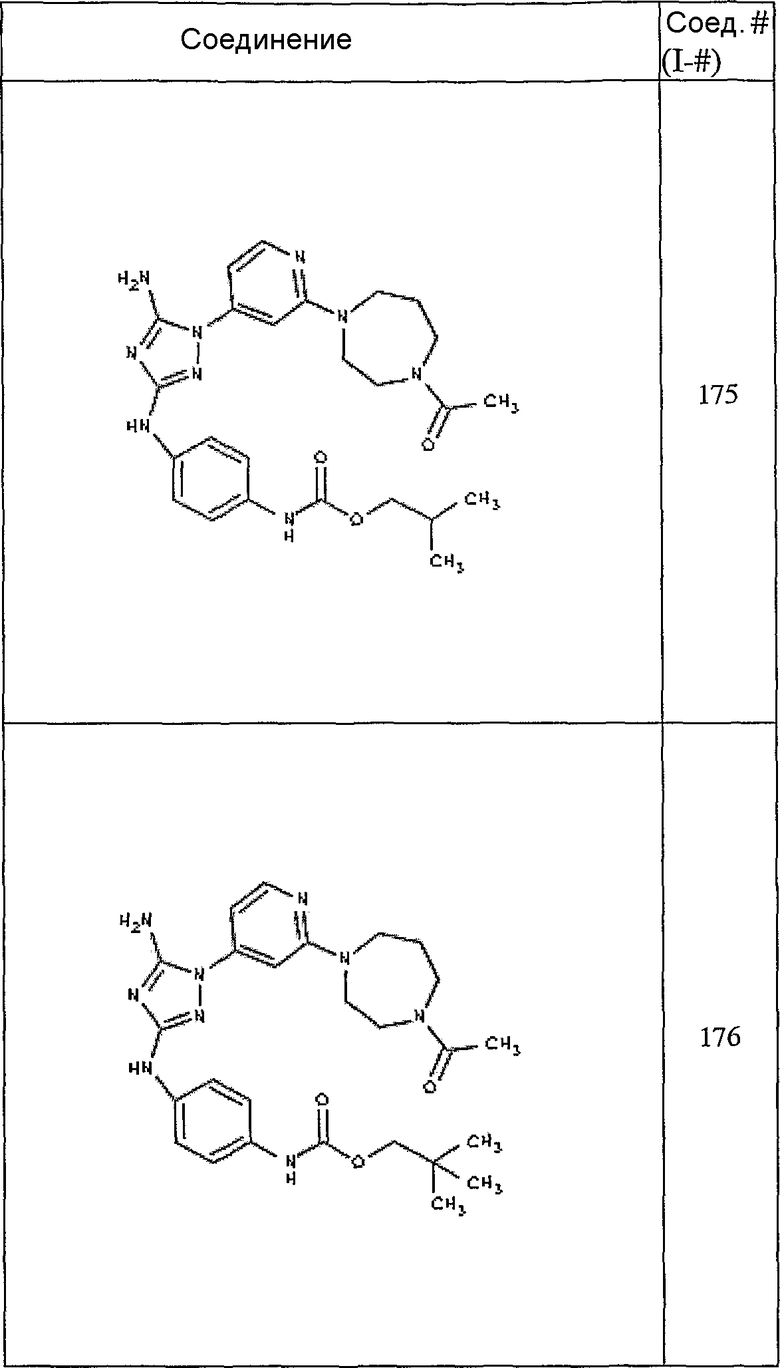
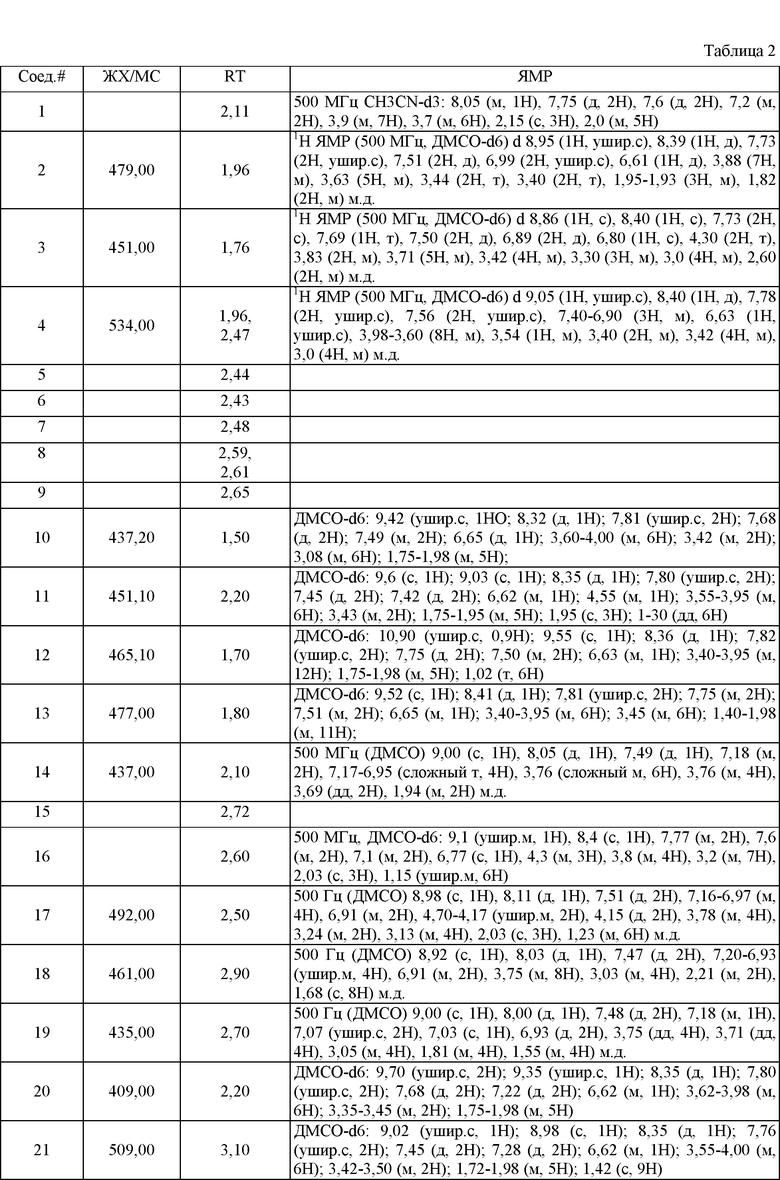
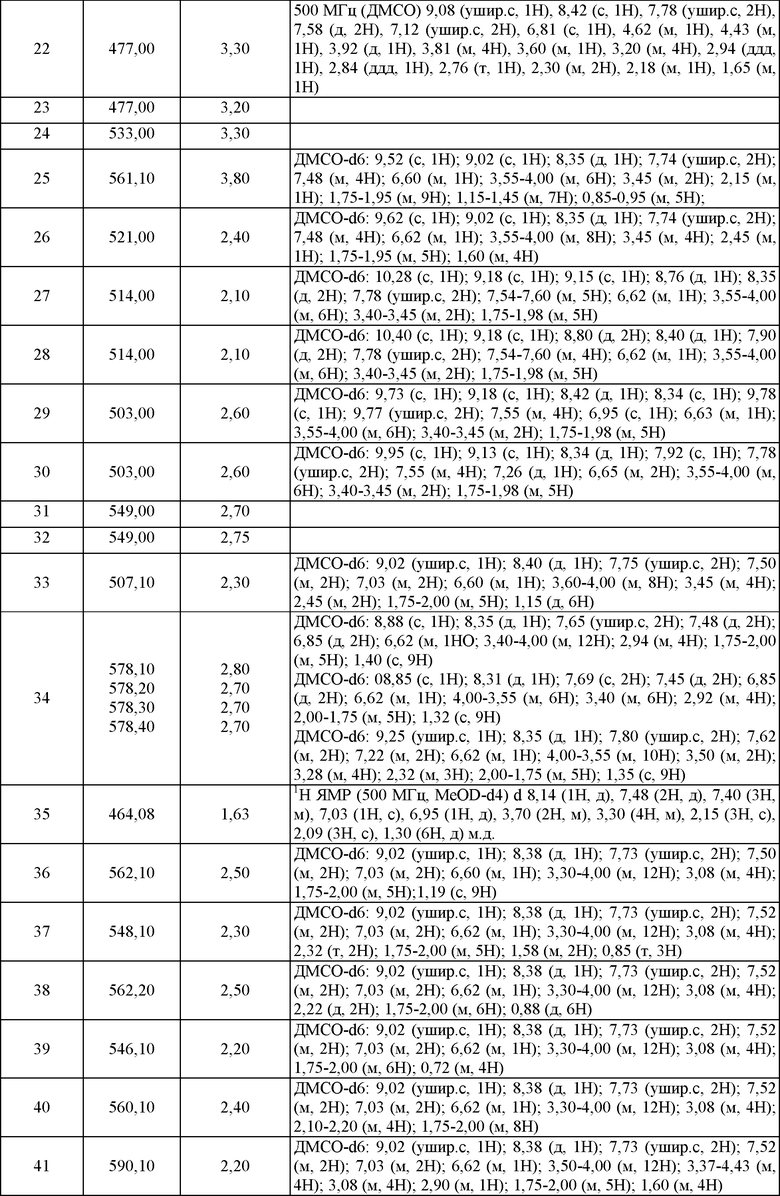
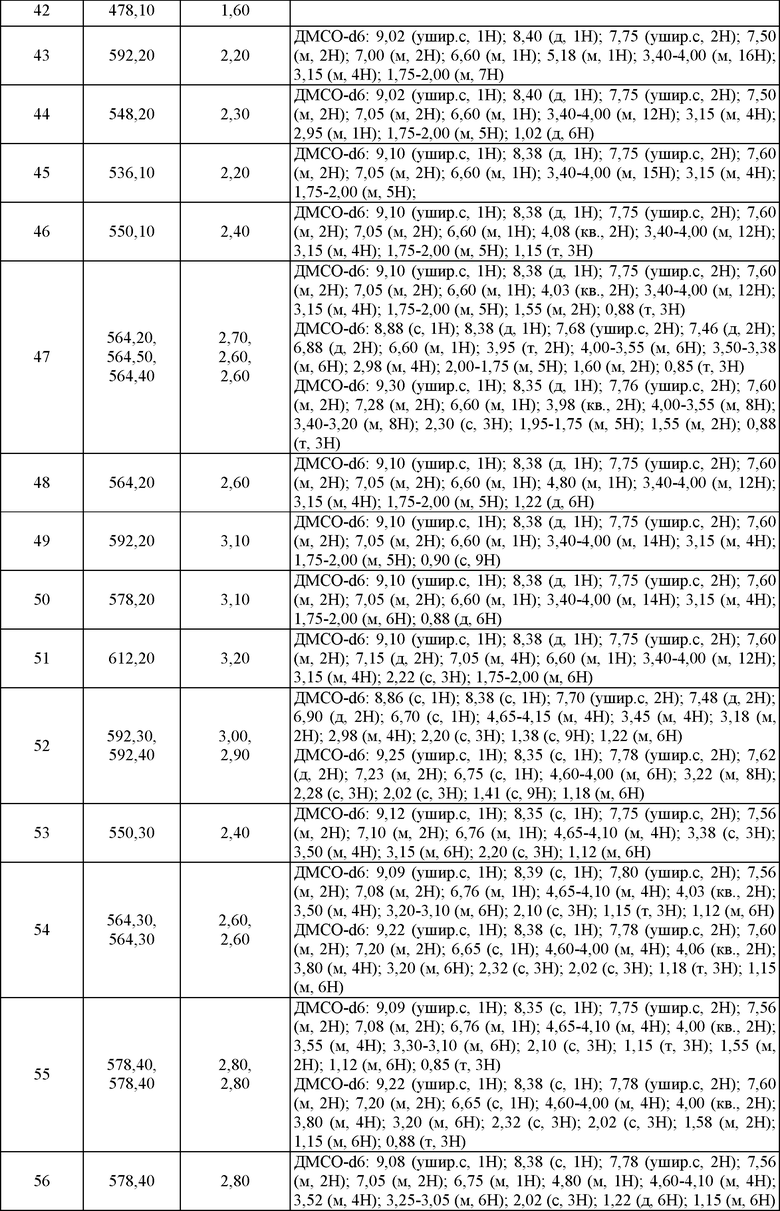
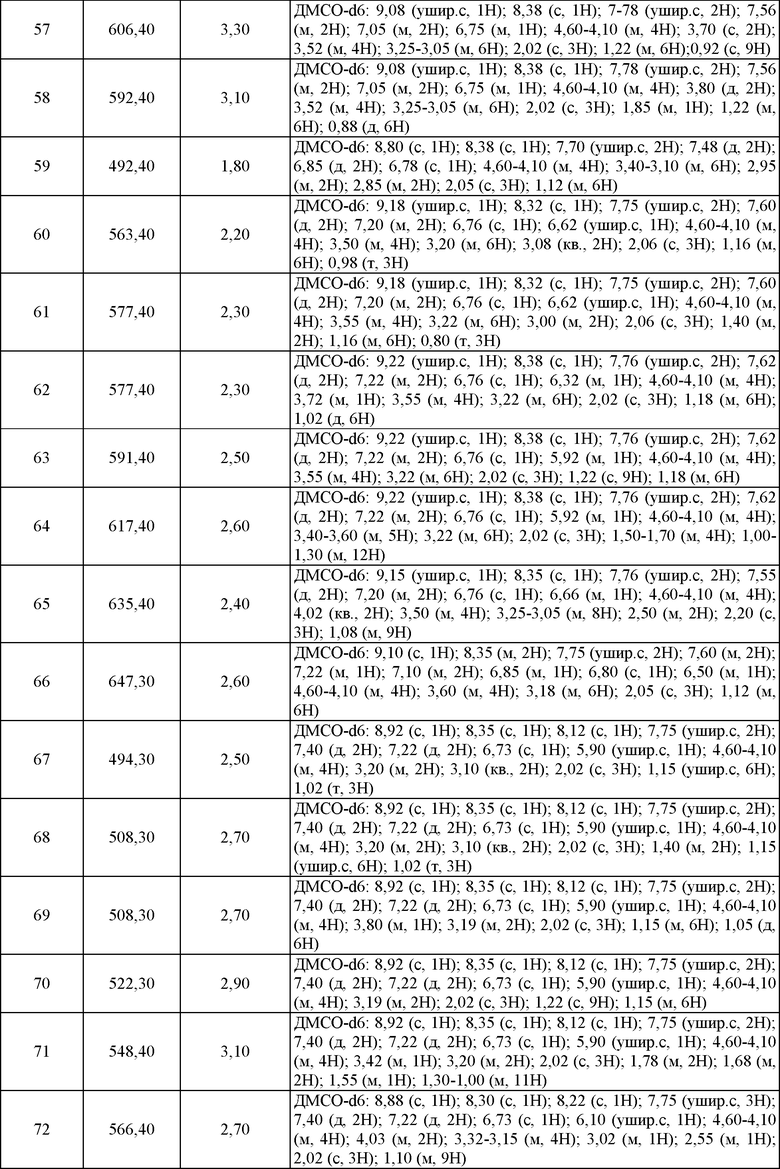
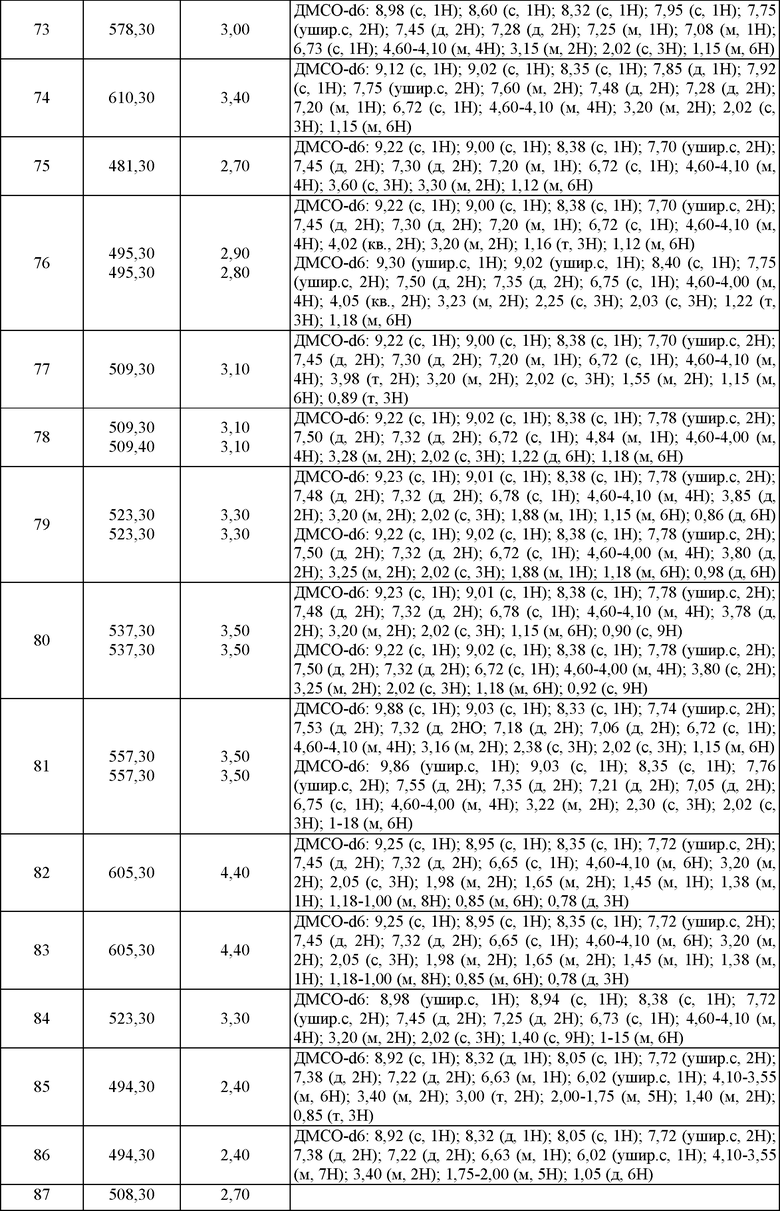
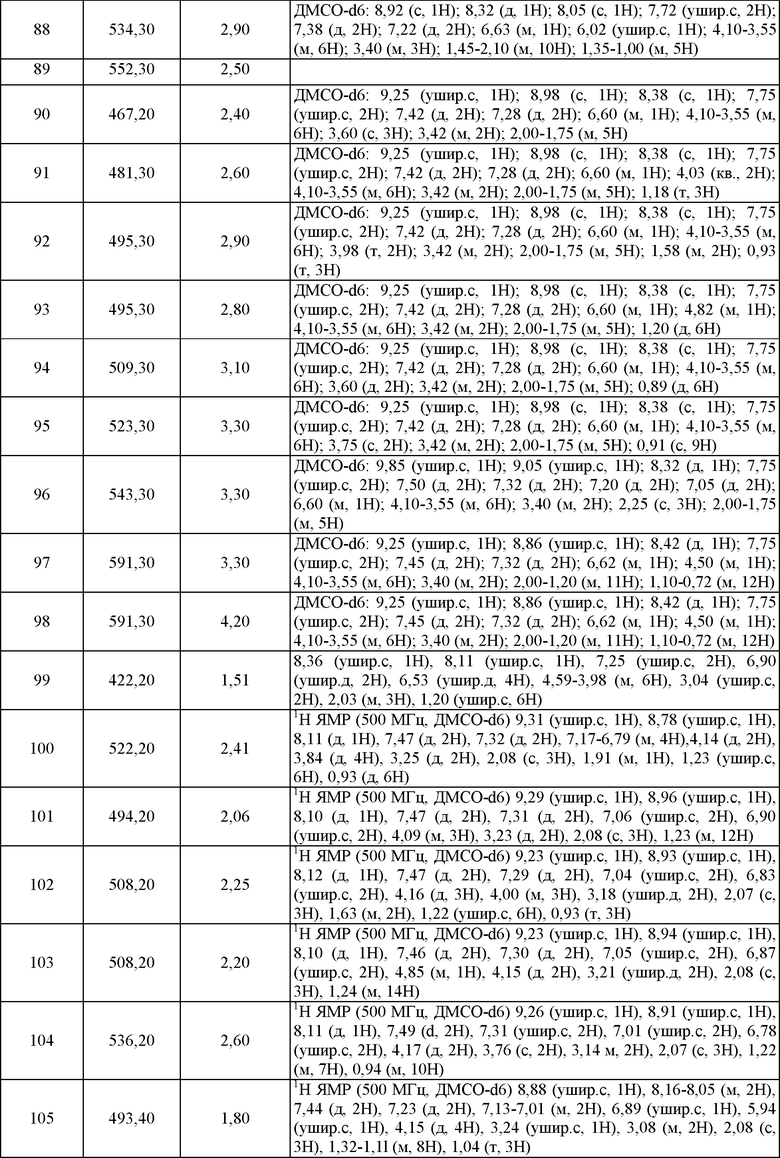
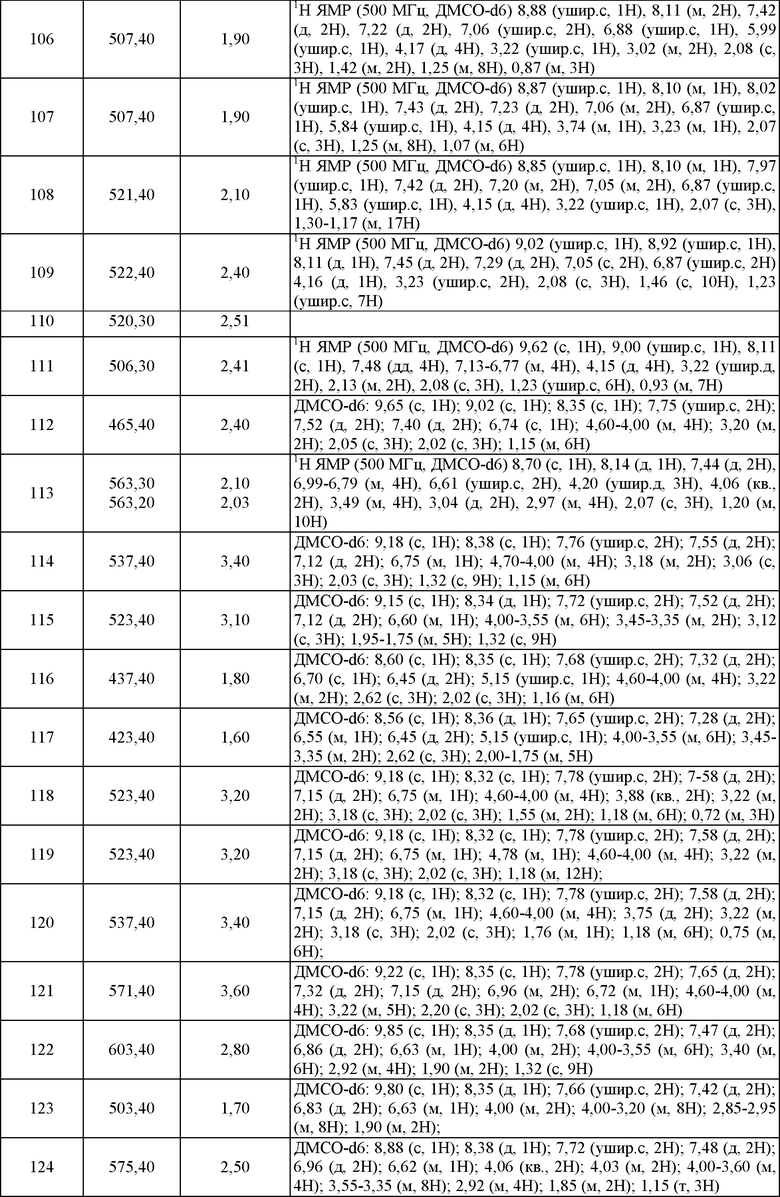
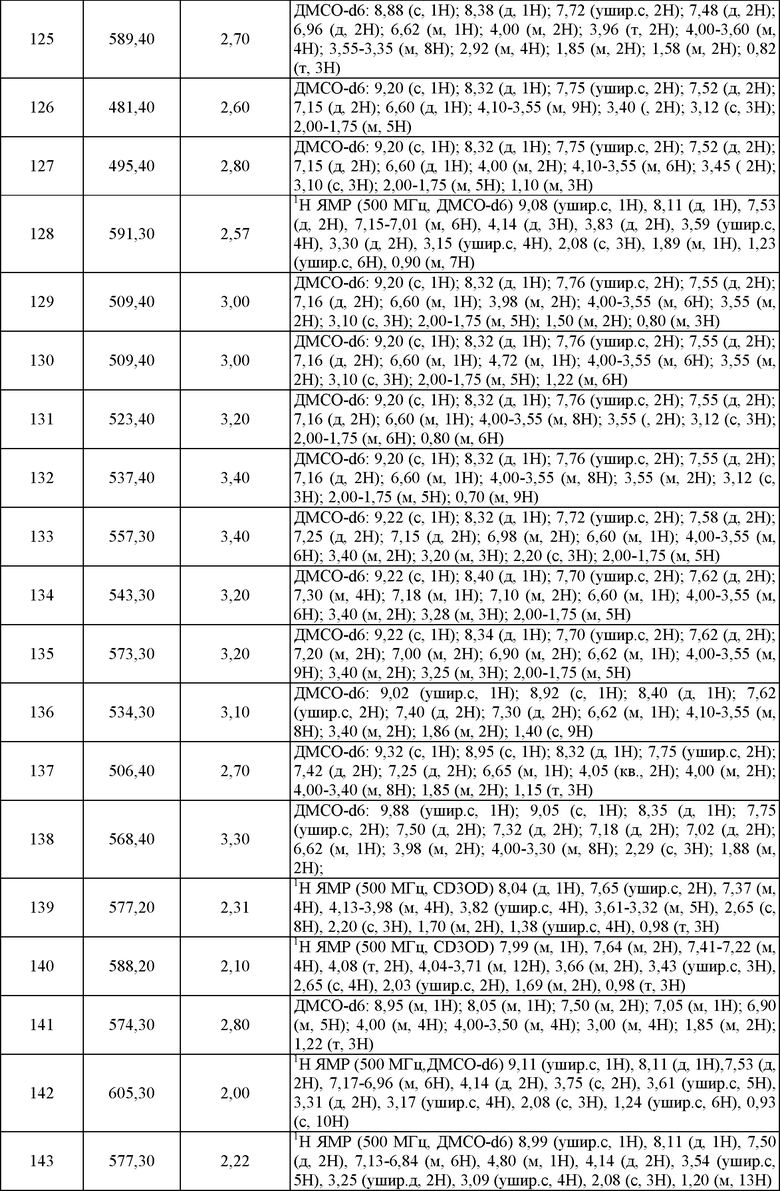
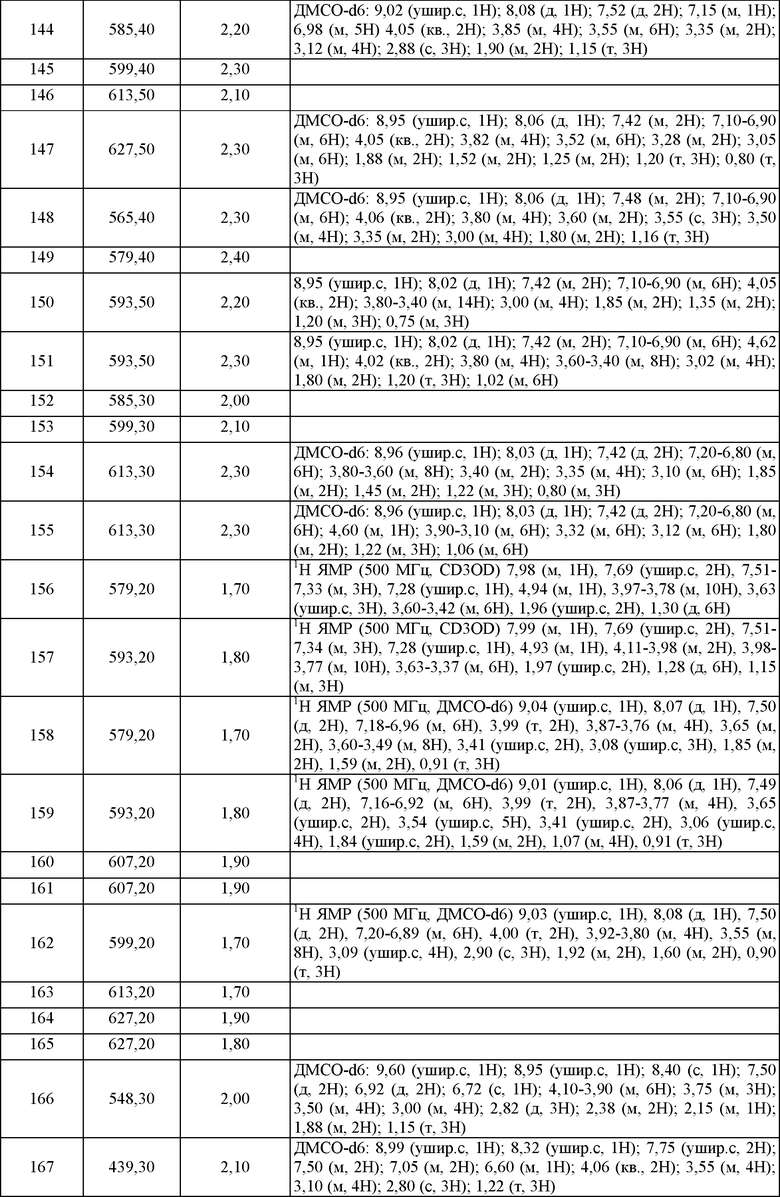
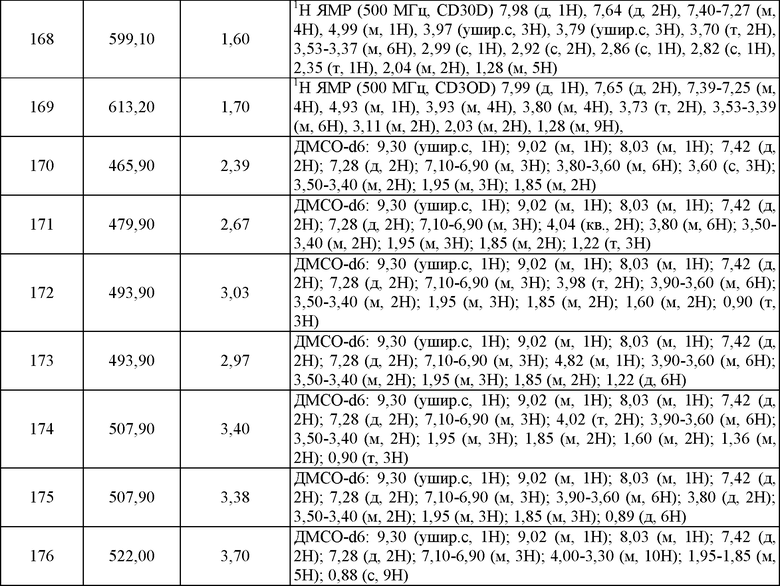
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРРОЛОПИРИМИДИНЫ, ПРИМЕНИМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2006 |
|
RU2434871C2 |
| ТРИАЗОЛЫ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2005 |
|
RU2393155C2 |
| АЗАИНДОЛЫ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ JAK И ДРУГИХ ПРОТЕИНКИНАЗ | 2005 |
|
RU2403252C2 |
| АЗАИНДОЛЫ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС-КИНАЗ | 2007 |
|
RU2453548C2 |
| ТРИАЗОЛОПИРИДИНОВЫЕ СОЕДИНЕНИЯ-ИНГИБИТОРЫ JAK И СПОСОБЫ | 2009 |
|
RU2561104C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2536584C2 |
| ТРИАЗОЛПИРИДИНОВЫЕ СОЕДИНЕНИЯ, ИНГИБИРУЮЩИЕ JAK, И СПОСОБЫ | 2009 |
|
RU2560153C2 |
| ПИРАЗОЛО[1,5-a]ПИРИМИДИНЫ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2005 |
|
RU2417996C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2769696C2 |
| МОДУЛИРУЮЩИЕ JAK КИНАЗУ ХИНАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2529019C2 |
Описываются новые диаминотриазольные соединения общей формулы (I) (значения радикалов приведены в формуле изобретения), их фармацевтически приемлемые соли, фармацевтическая композиция, их содержащая, способ ингибирования активности киназ JAK2 и JAK3 и применение новых соединений для производства лекарственного средства для лечения ряда заболеваний. 5 н. и 14 з.п. ф-лы, 3 табл.
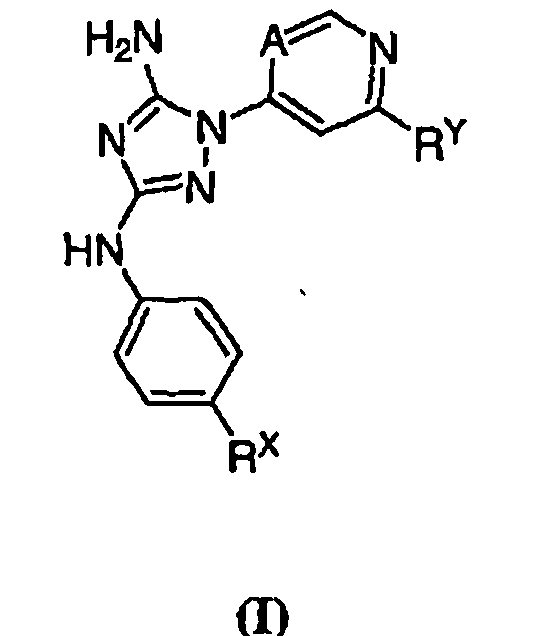
1. Соединение формулы I
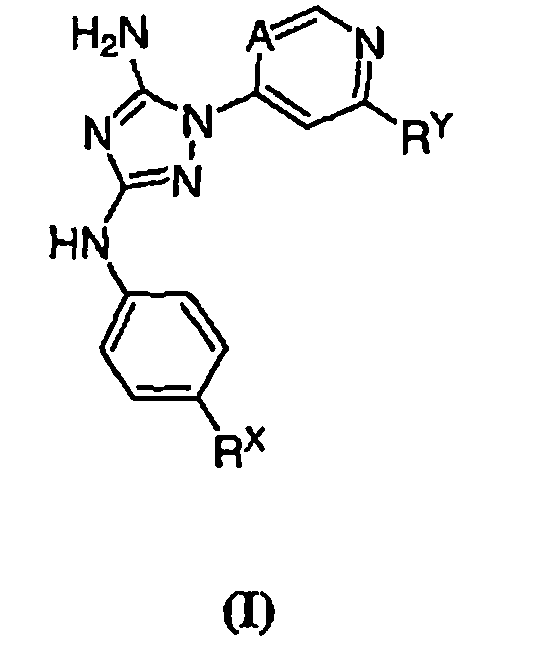
или его фармацевтически приемлемая соль, где
А представляет собой N или CR1;
R1 представляет собой H;
RX выбран из
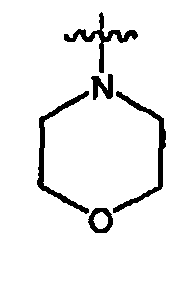
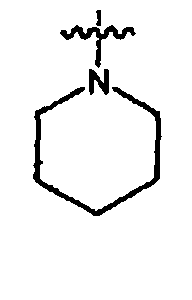
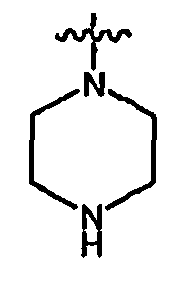
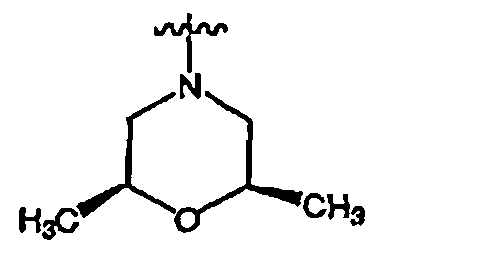
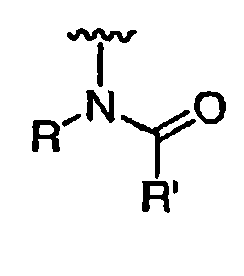
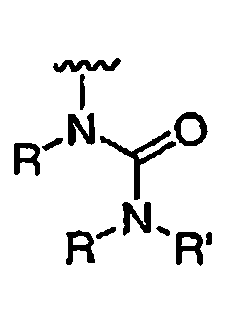
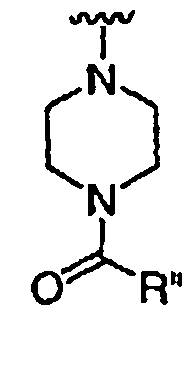
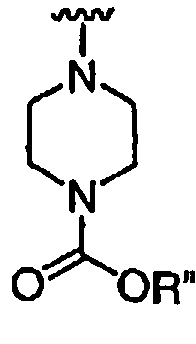
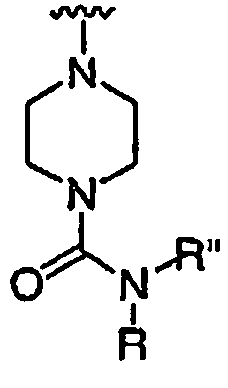 ;
;
в каждом случае R независимо выбран из водорода или C1-6алкила;
RY выбран из
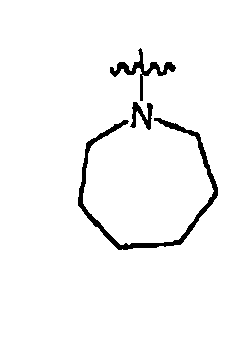
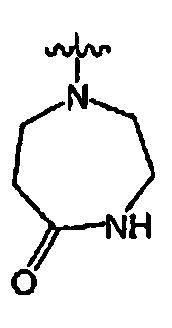
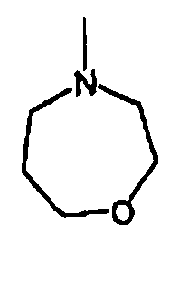
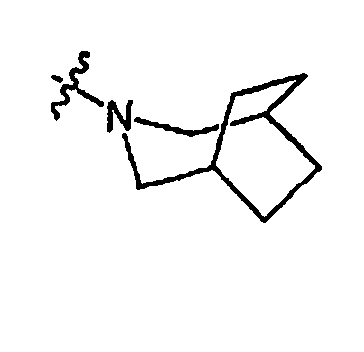
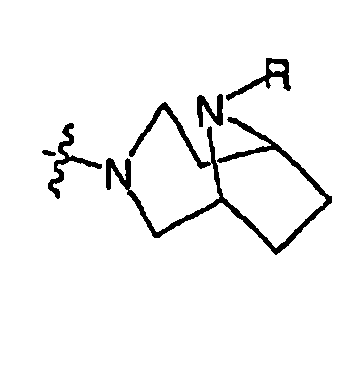
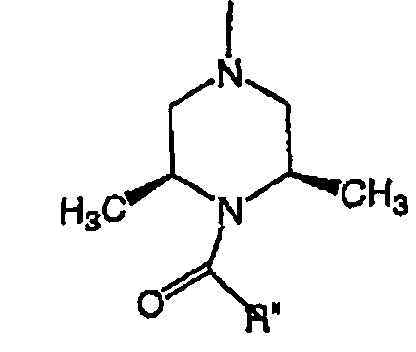
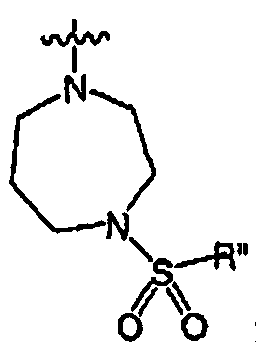
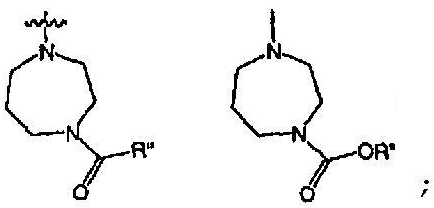
R представляет собой C1-6алкил; и
R' независимо выбирают из водорода или группы, выбранной из С1-8алкила, необязательно замещенного С1-6алкоксикарбонилом, С3-7циклоалкила, необязательно замещенного С1-6алкилом или С1-6алкокси, фенила, необязательно замещенного C1-6алкилом, CF3, С1-6алкокси, или фенила, необязательно дизамещенного галогеном, гетероциклического кольца, имеющего 6 атомов в кольце с атомом О в качестве гетероатома, пиридинила или фуранила;
R'' независимо выбирают из С1-8алкила, необязательно замещенного C1-6алкоксикарбонилом, С3-7циклоалкила, фенила, необязательно замещенного C1-6алкилом, или фенила, необязательно дизамещенного галогеном, или гетероциклического кольца, имеющего 5-6 атомов в кольце с атомом О в качестве гетероатома.
2. Соединение по п.1, где RY выбран из
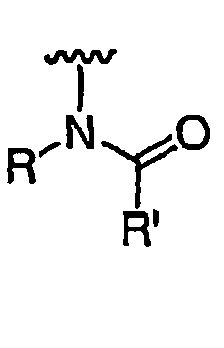
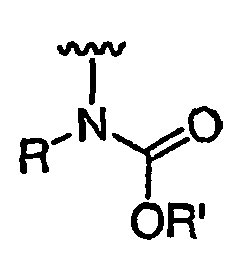
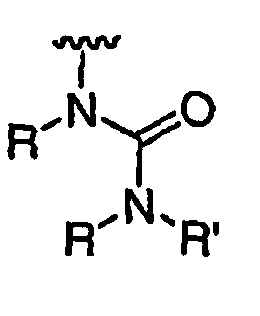
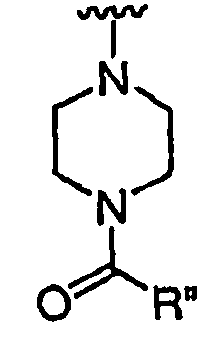
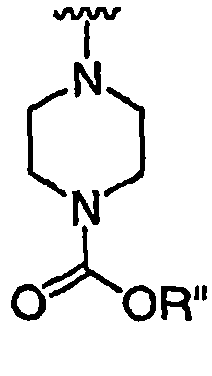
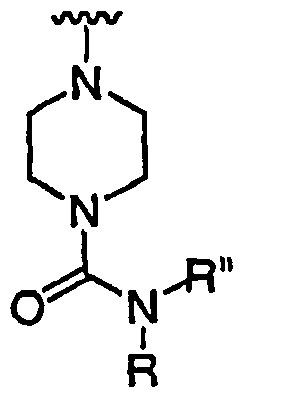
3. Соединение по п.1, где RY представляет собой

 ;
; 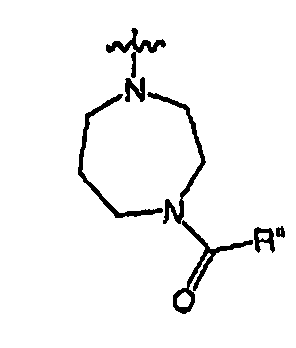
4. Соединение по любому одному из пп.1-3, где А представляет собой N.
5. Соединение по любому одному из пп.1-3, где А представляет собой CH.
6. Соединение по любому одному из пп.1-3, где R' представляет собой C1-6алкил, фенил, пиридинил или фуранил.
7. Соединение по п.6, где R' представляет собой C1-6 алкил, необязательно замещенный С1-6алкоксикарбонилом, или фенил, необязательно замещенный C1-6алкилом, CF3, C1-6алкокси.
8. Соединение по п.7, где R' представляет собой метил, этил, пропил, изопропил,
-CH2-изопропил, бутил, трет-бутил, -CH2-трет-бутил или циклогексил, необязательно замещенные С1-6алкоксикарбонилом, или циклогексил с атомом О в качестве гетероатома.
9. Соединение по любому из пп.1-3, где R в значении Rx представляет собой водород или метил.
10. Соединение по любому из пп.1-3, где каждый R'' независимо выбран из C1-8алкила, необязательно замещенного С1-6алкоксикарбонилом, фенила, необязательно замещенного С1-6алкилом, или фенила, необязательно дизамещенного галогеном, или 6-членной гетероциклической группы, имеющей О в качестве гетероатома.
11. Соединение по п.10, где каждый R'' независимо выбран из С1-6алкила, необязательно замещенного С1-6алкоксикарбонилом, или фенила, необязательно дизамещенного галогеном.
12. Соединение по п.11, где каждый R'' представляет собой метил, этил, пропил, изопропил, -CH2-изопропил, бутил, трет-бутил или -CH2-трет-бутил, необязательно замещенные С1-6алкоксикарбонилом.
13. Соединение, выбранное из одного из соединений, представленных в Таблице 1:
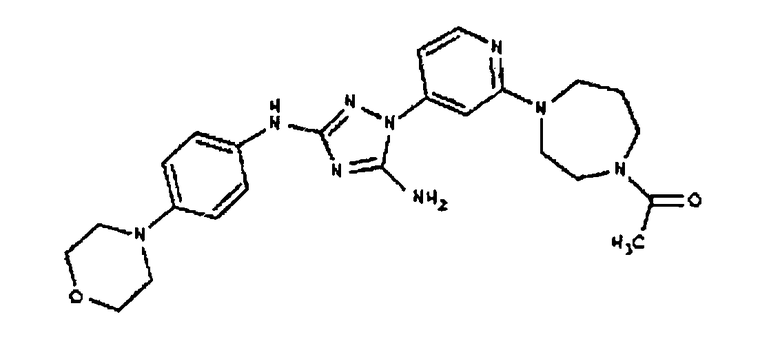
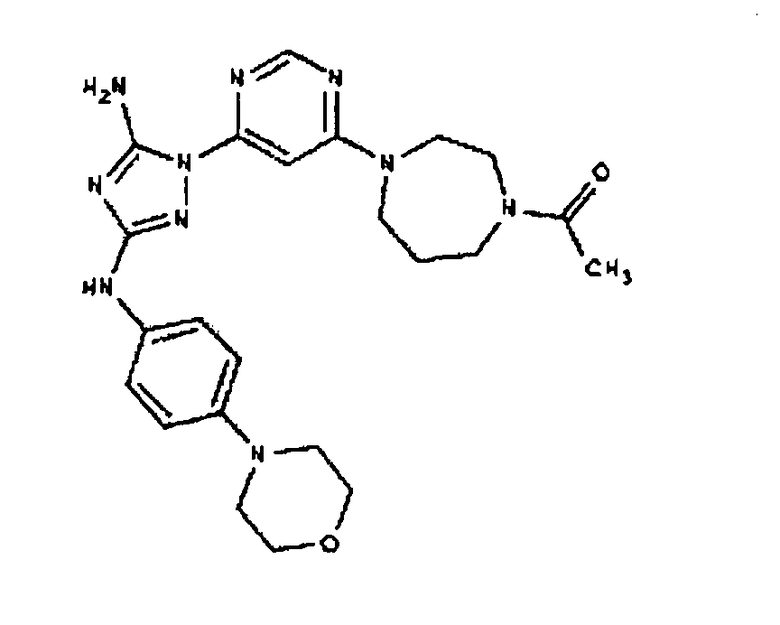
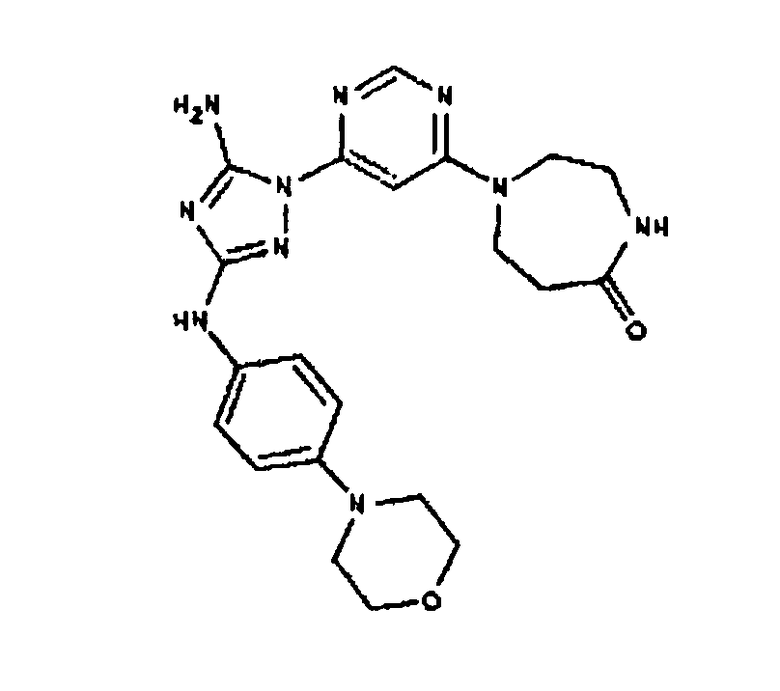
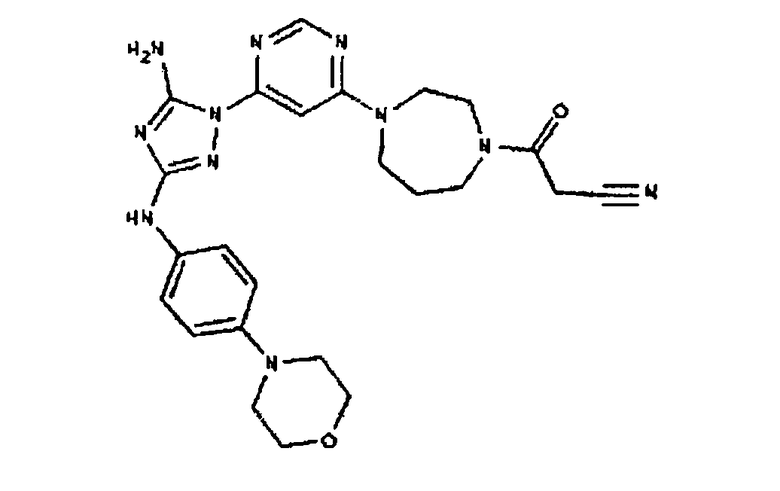
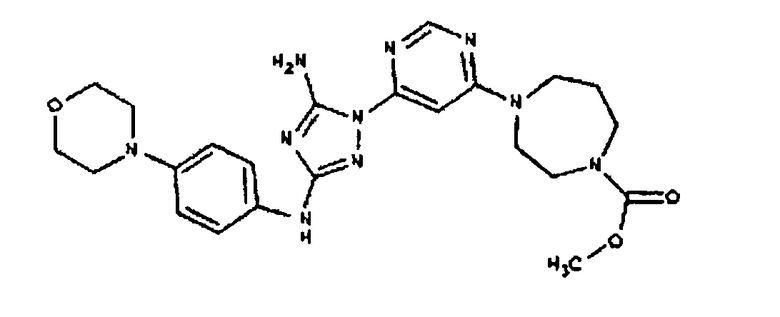
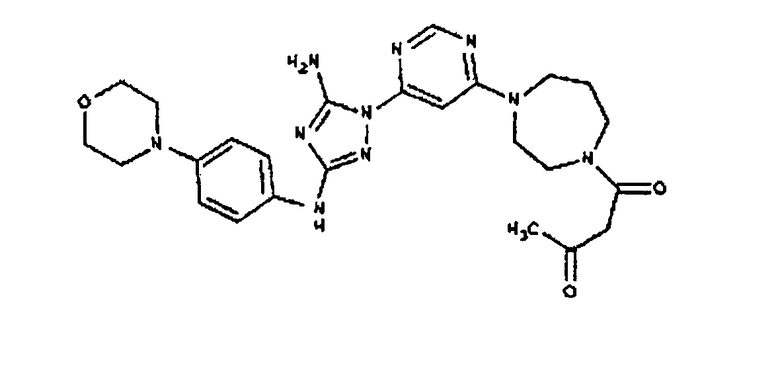
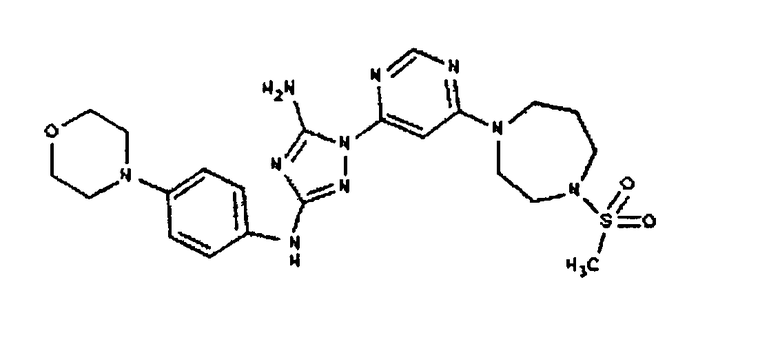


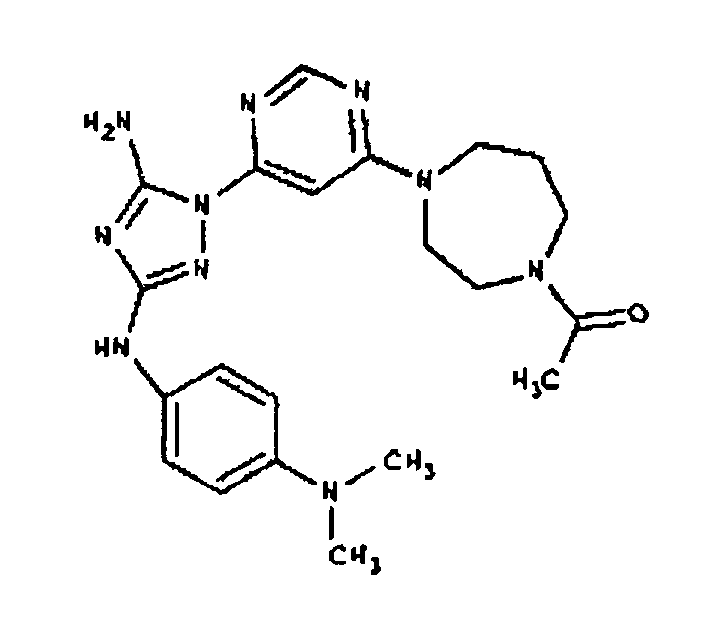
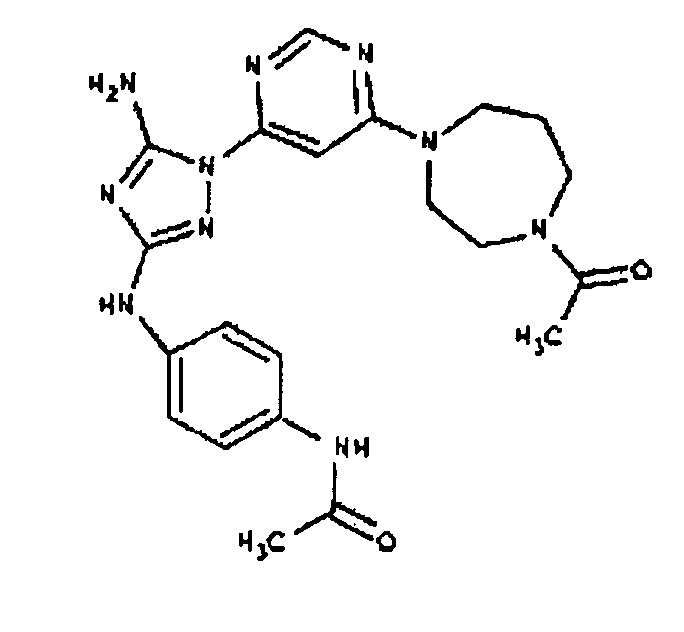
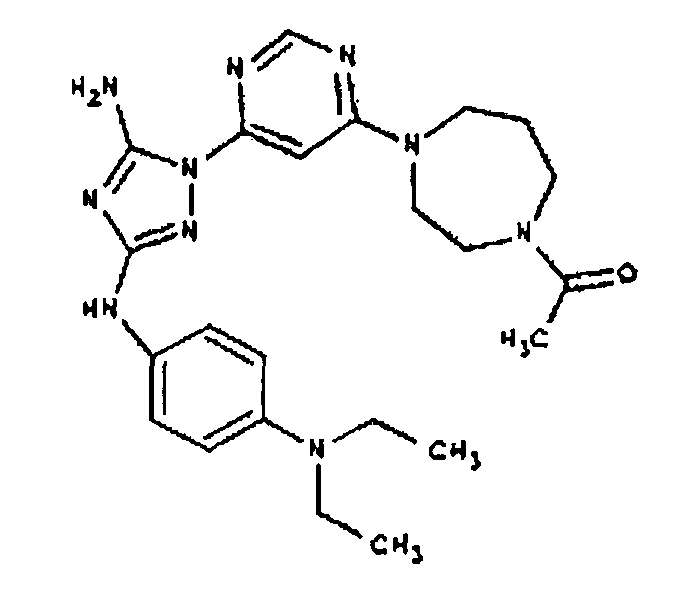
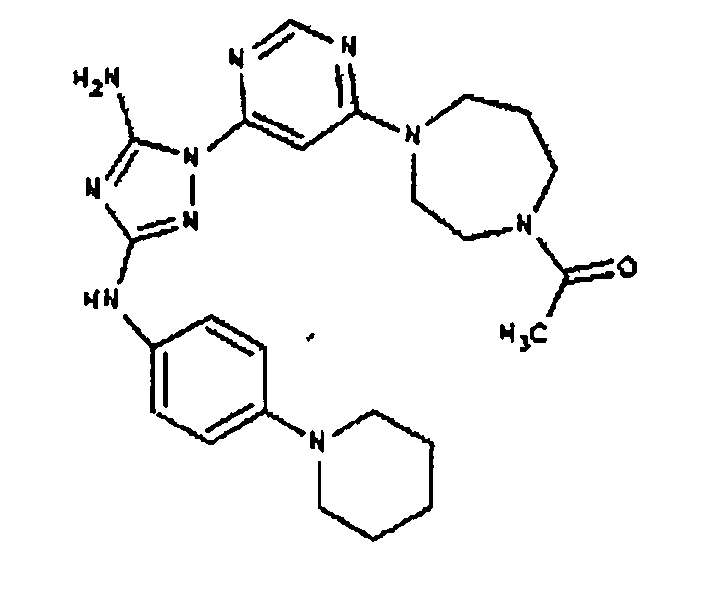
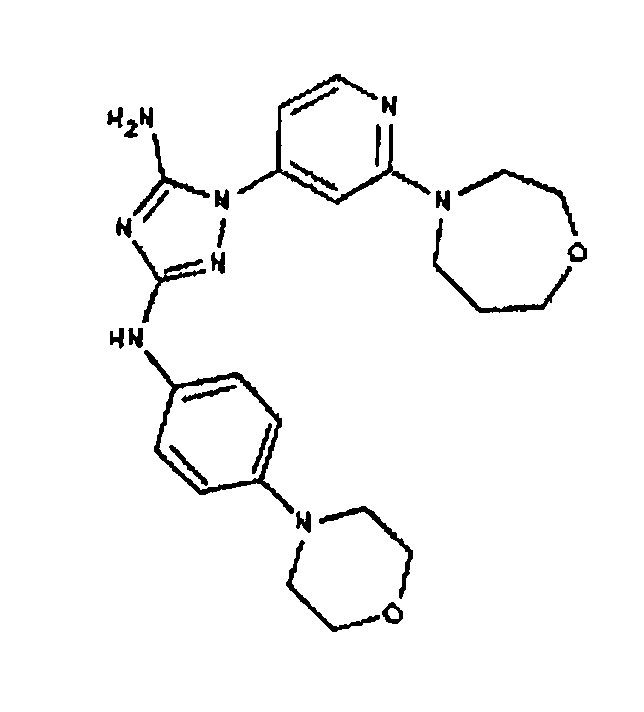
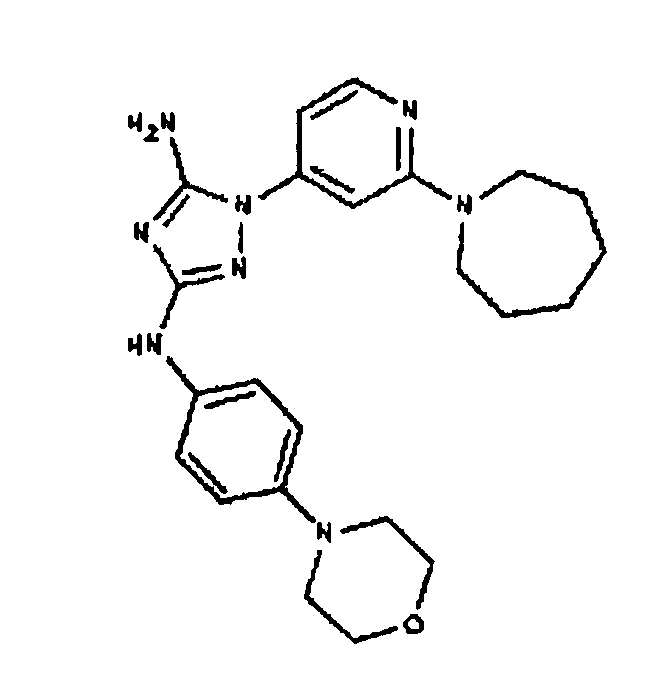
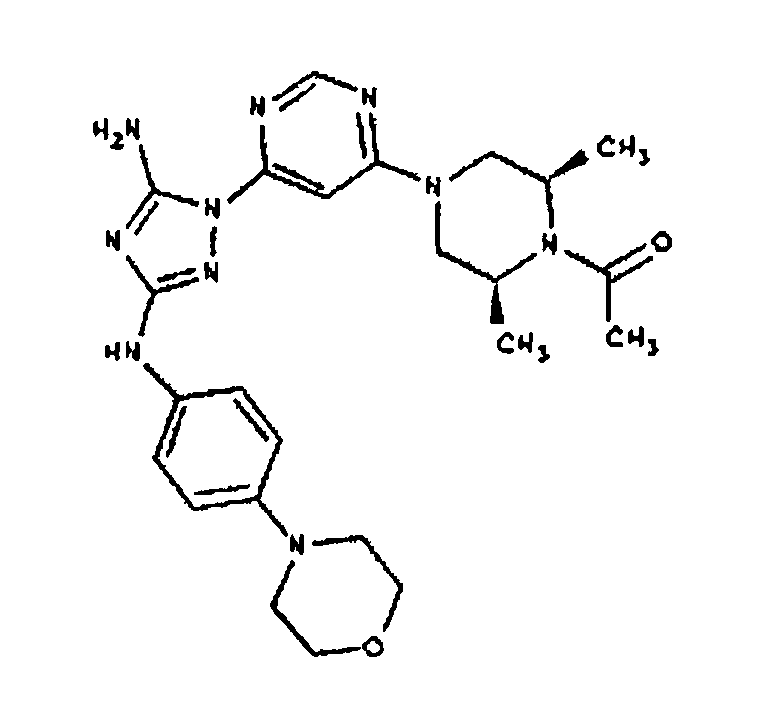
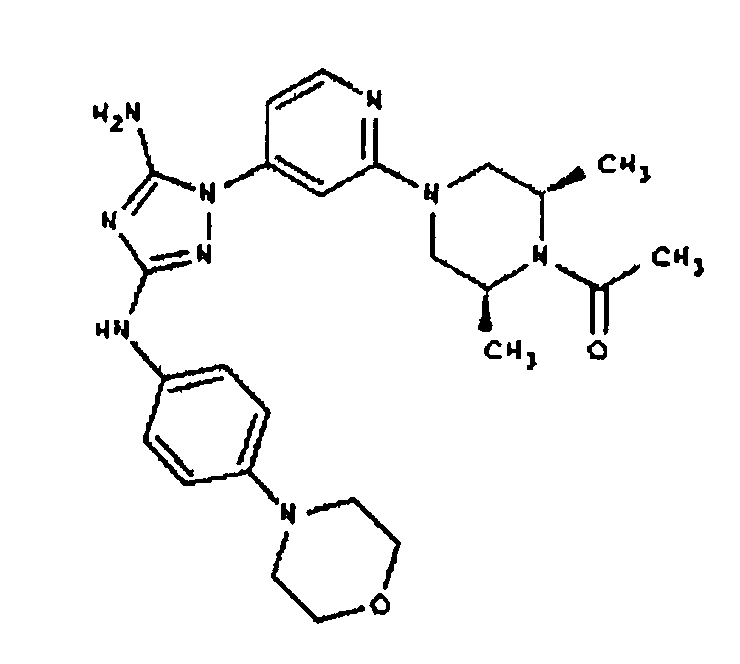
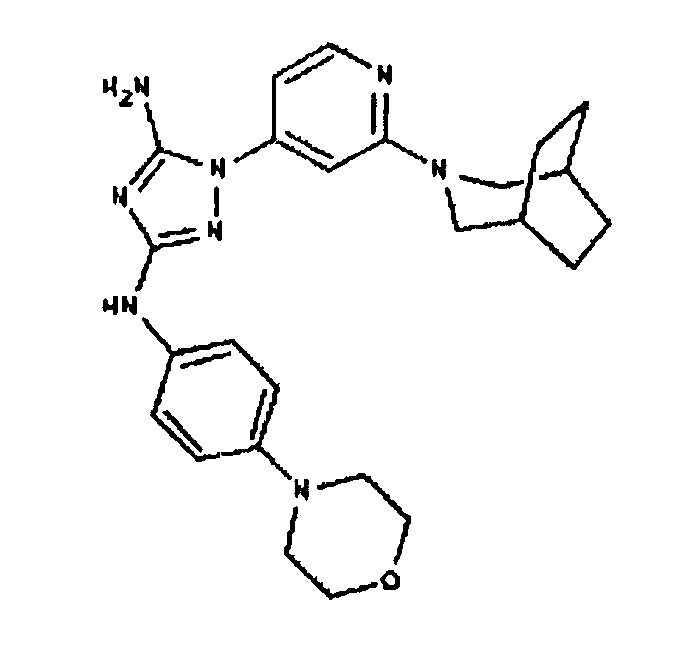

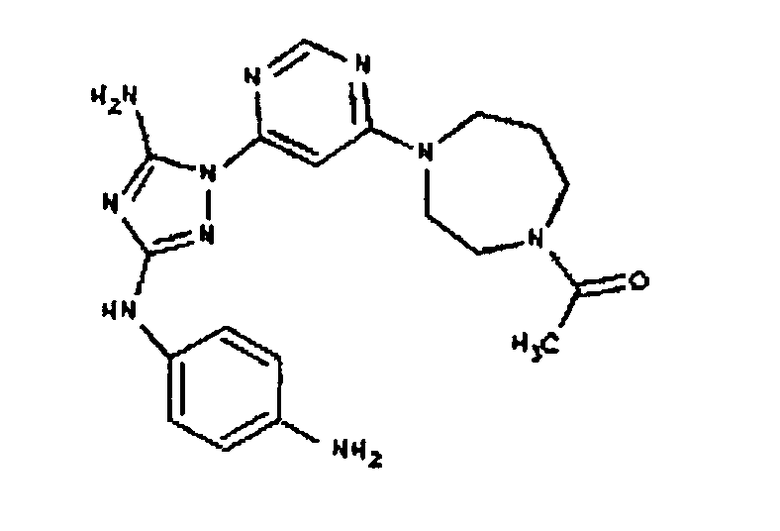
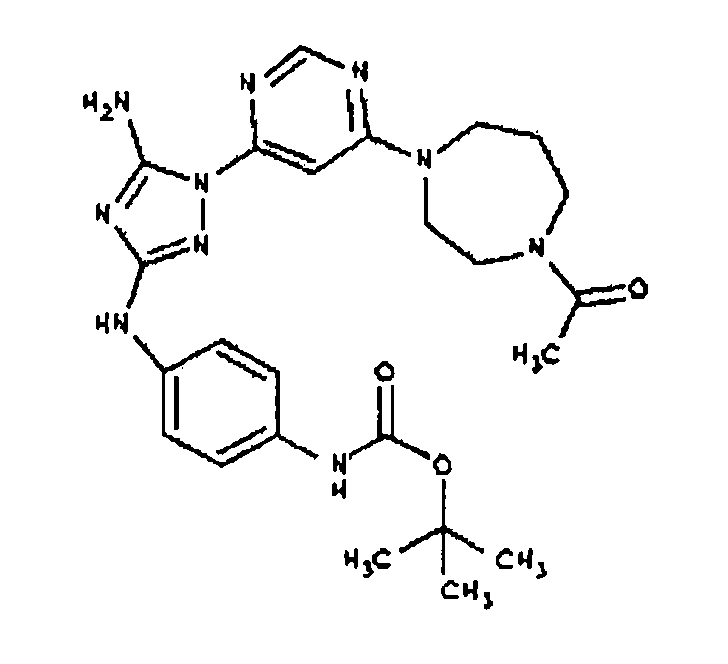
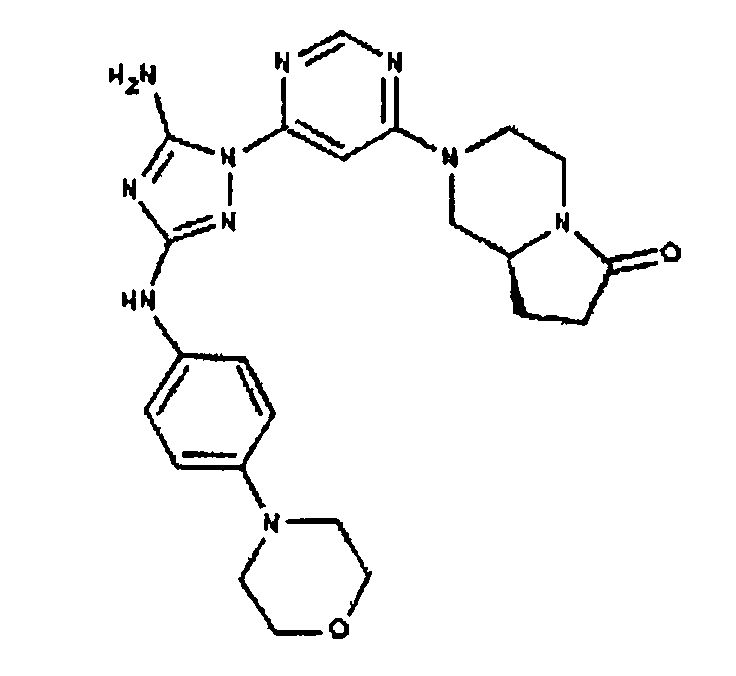
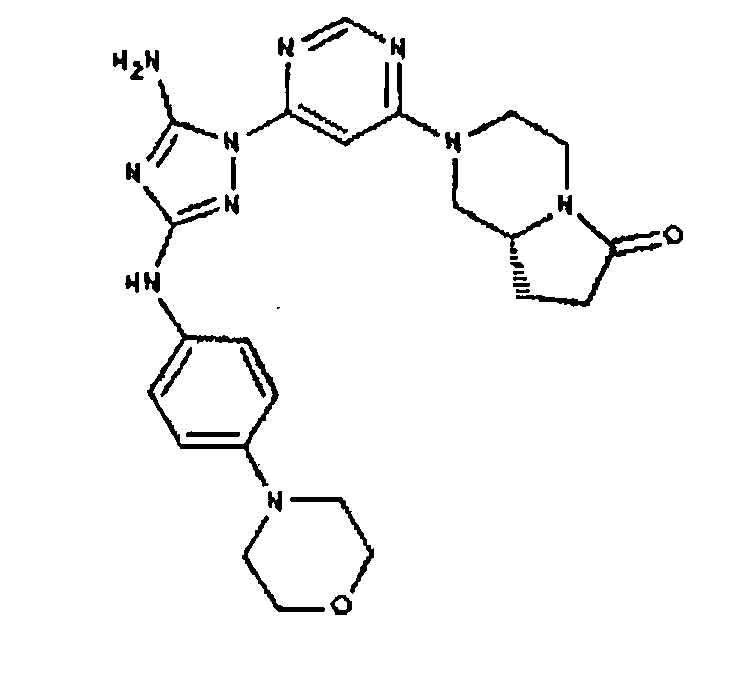
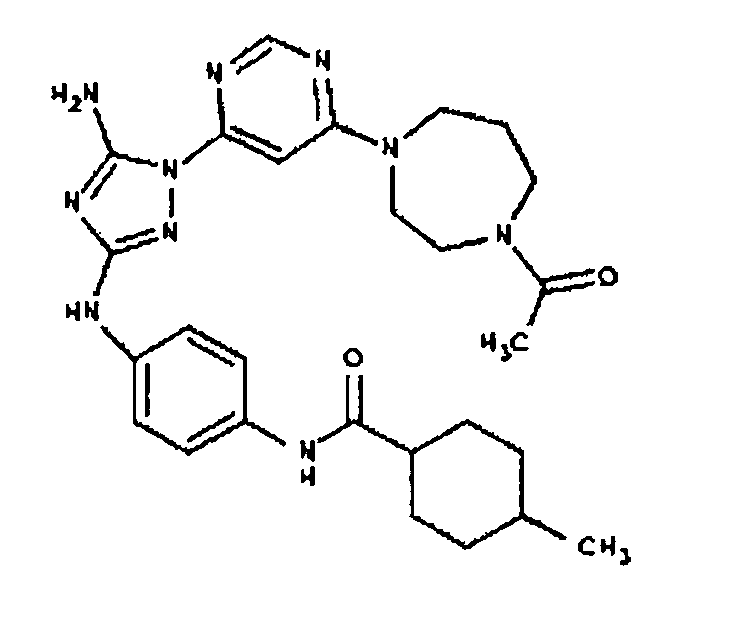
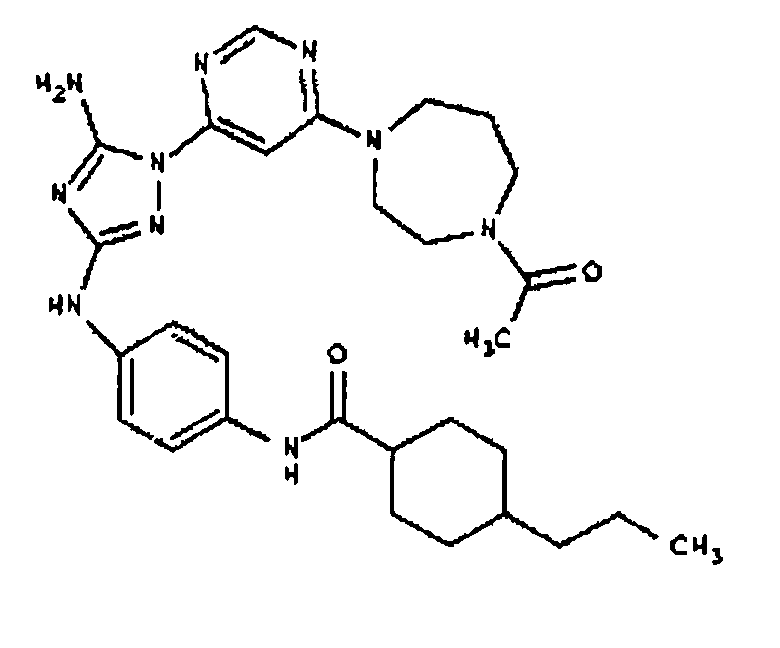
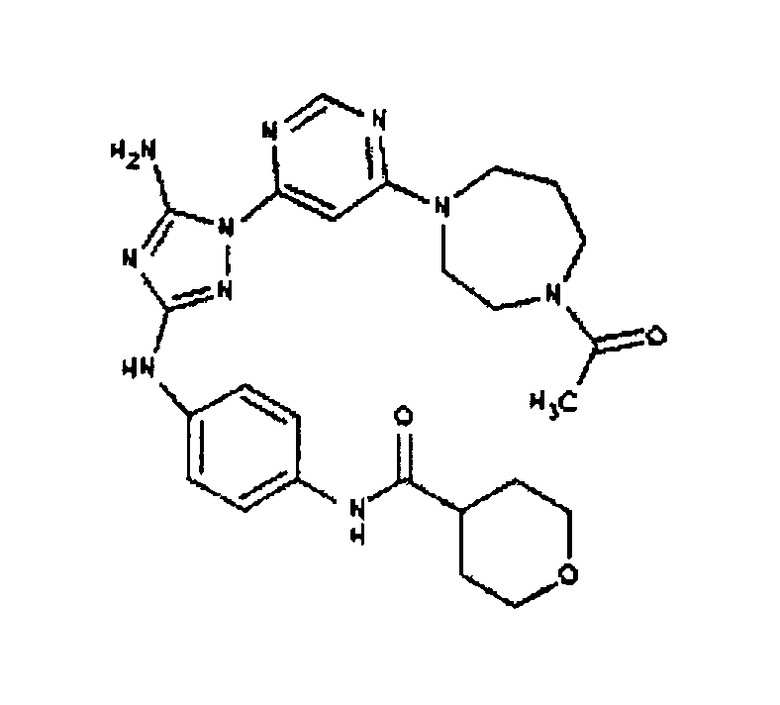
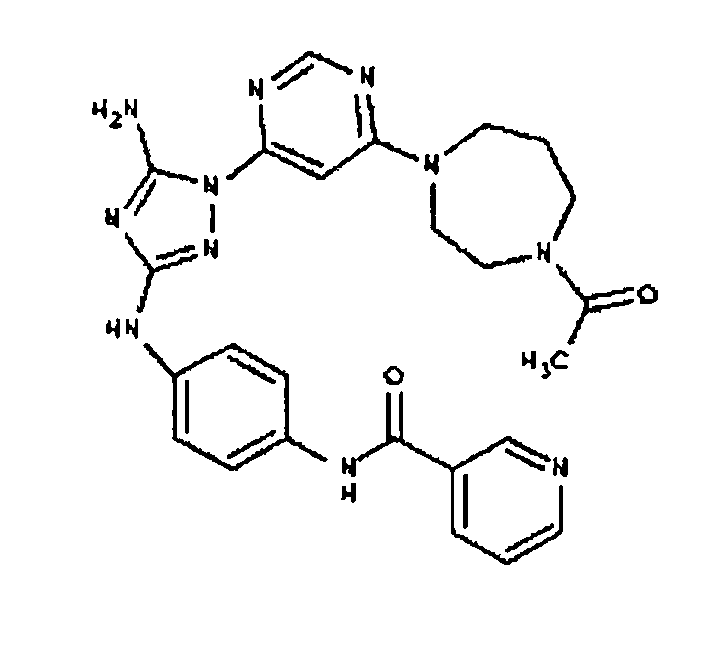
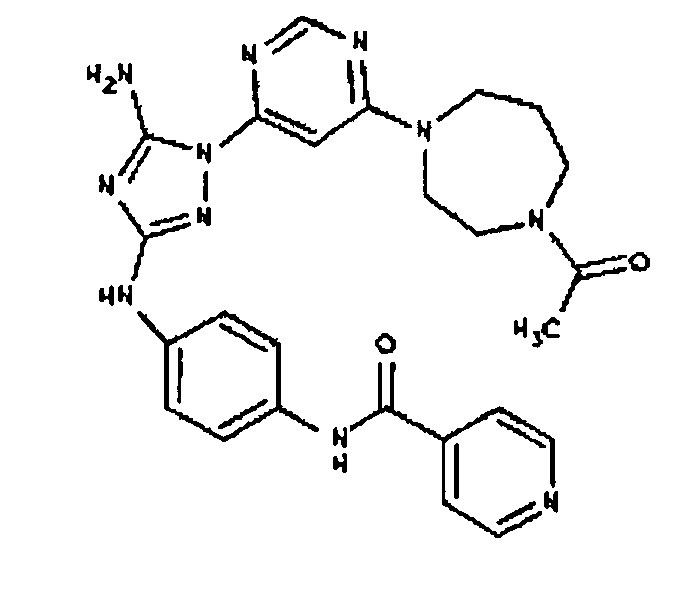
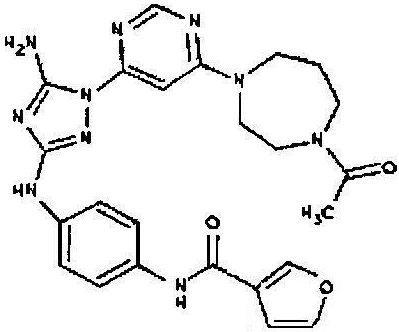
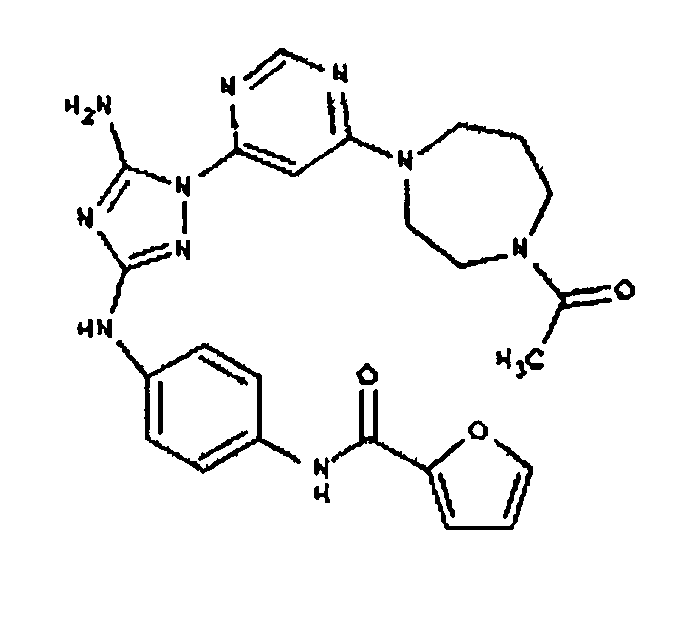
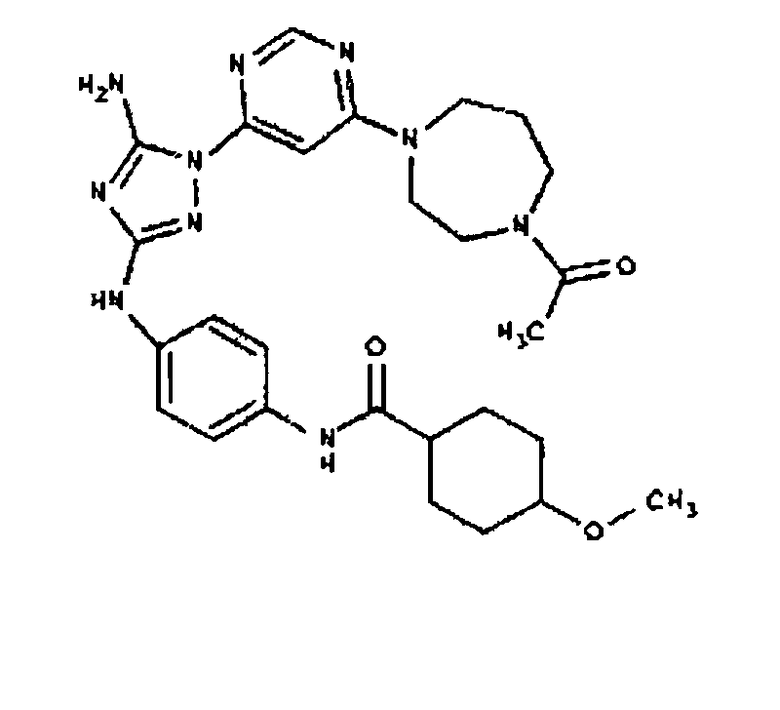
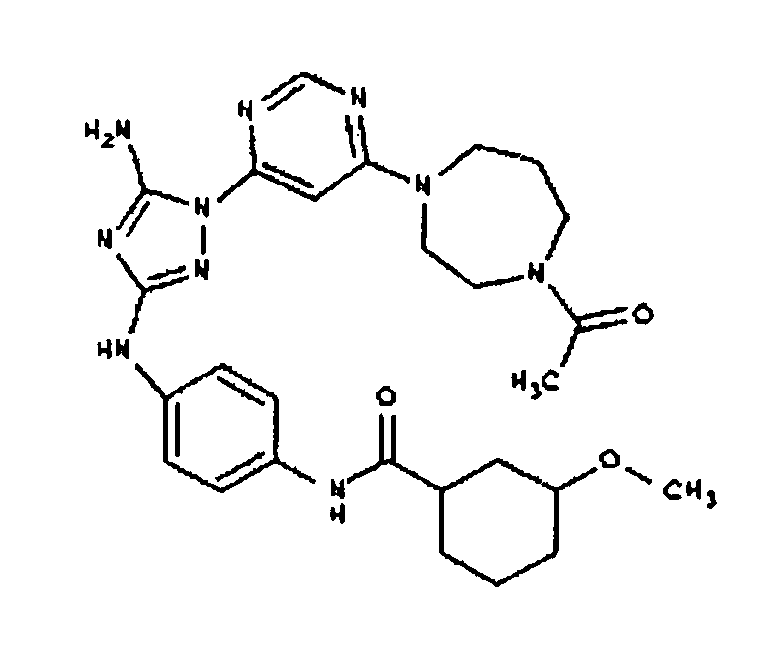
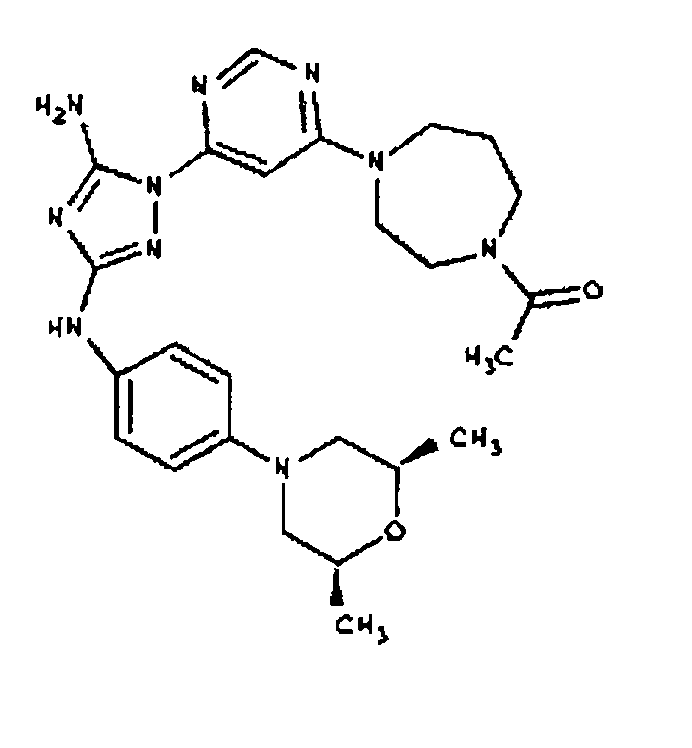
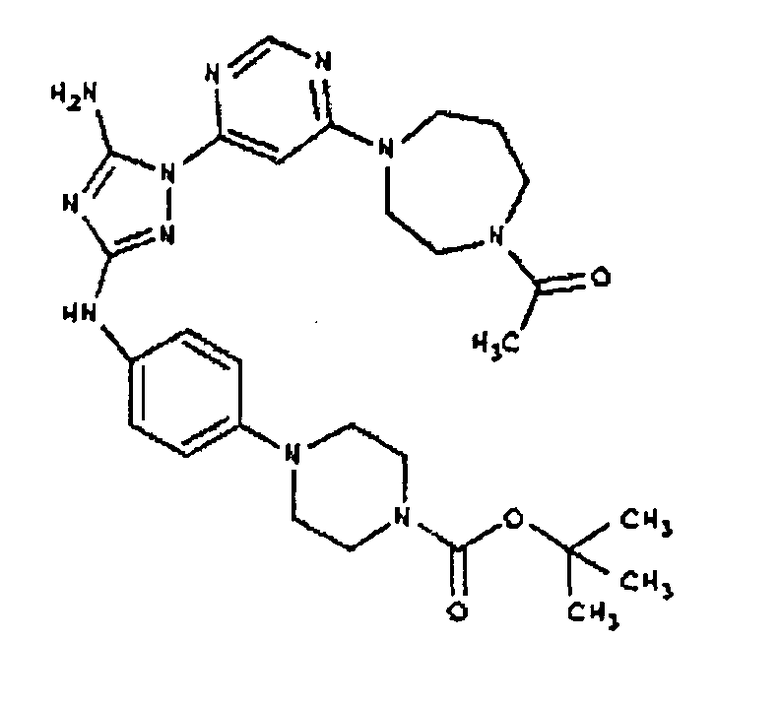
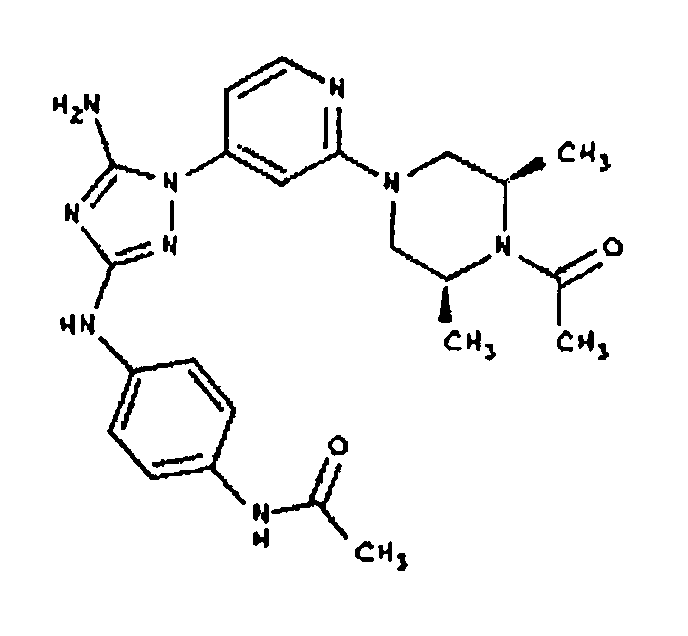
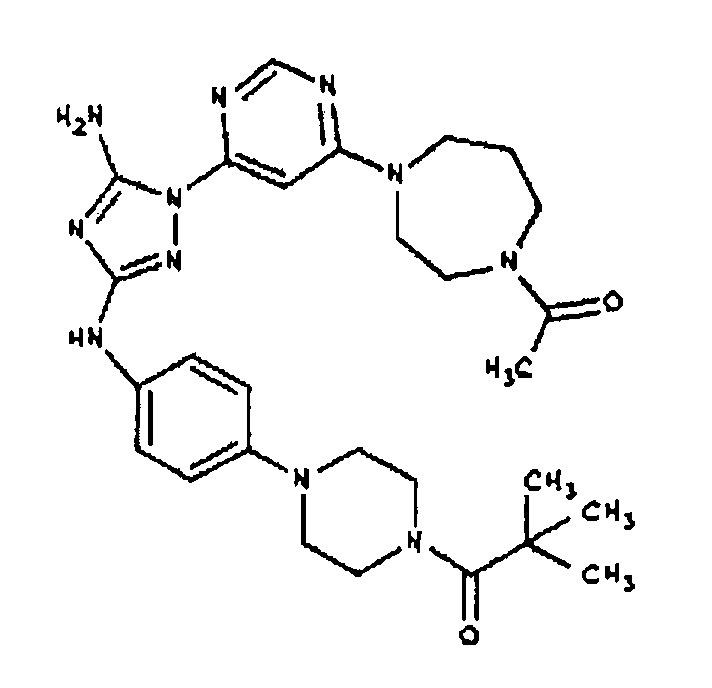
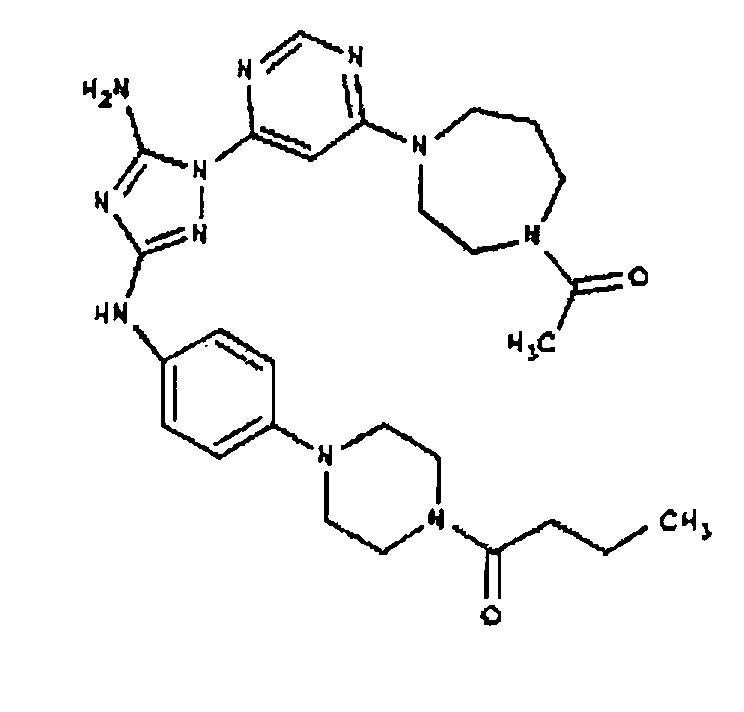
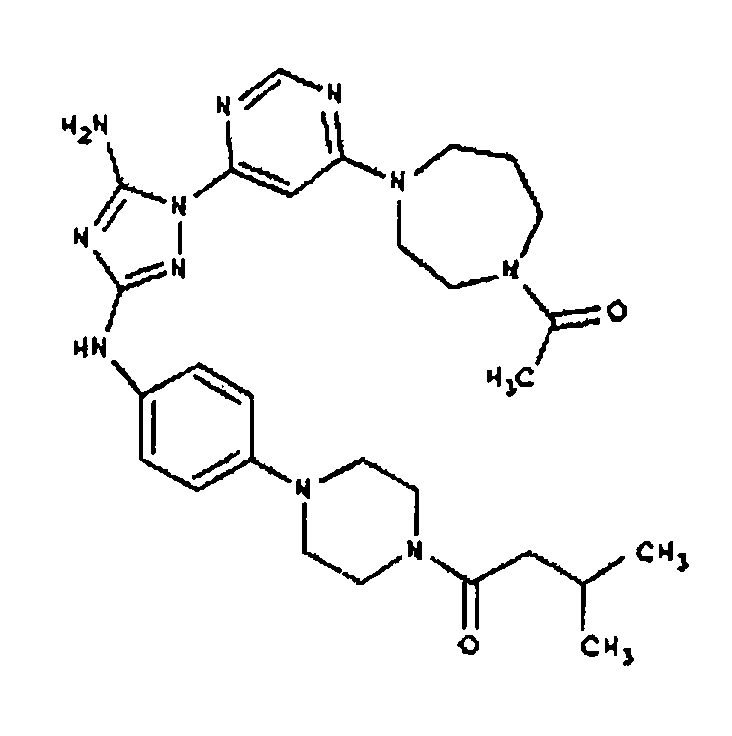
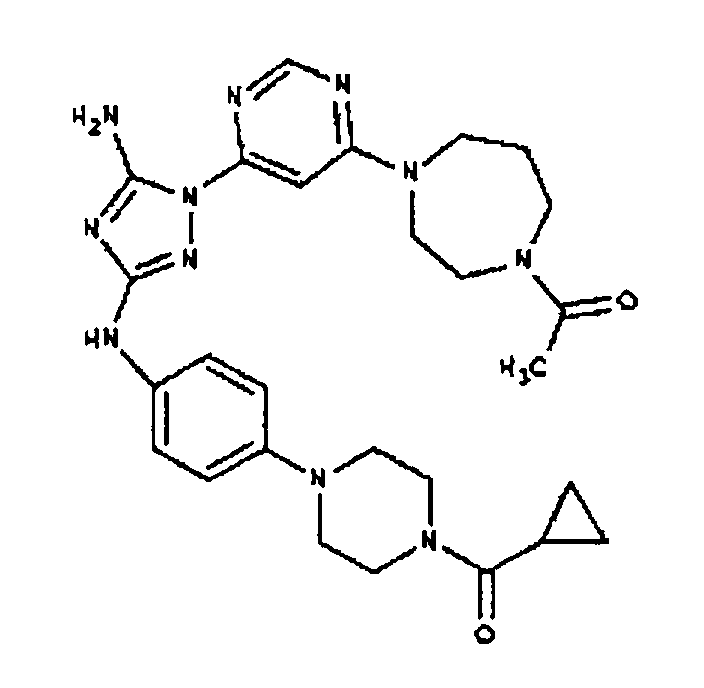
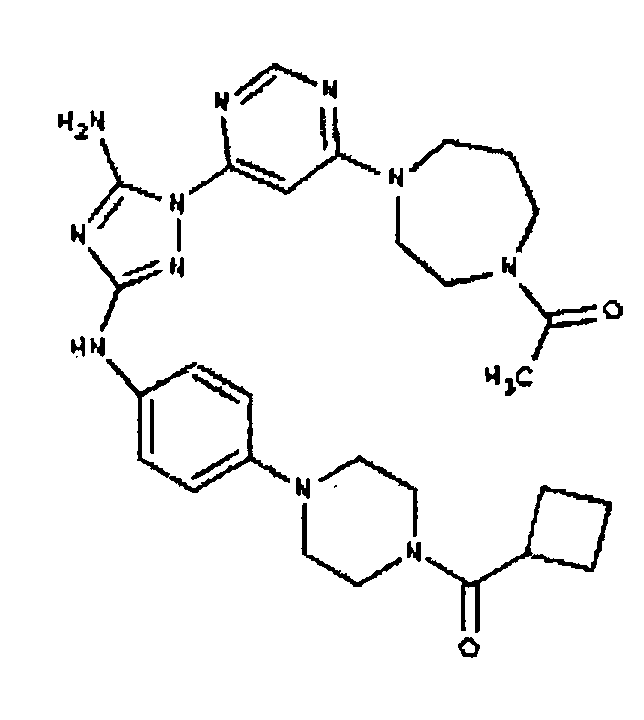
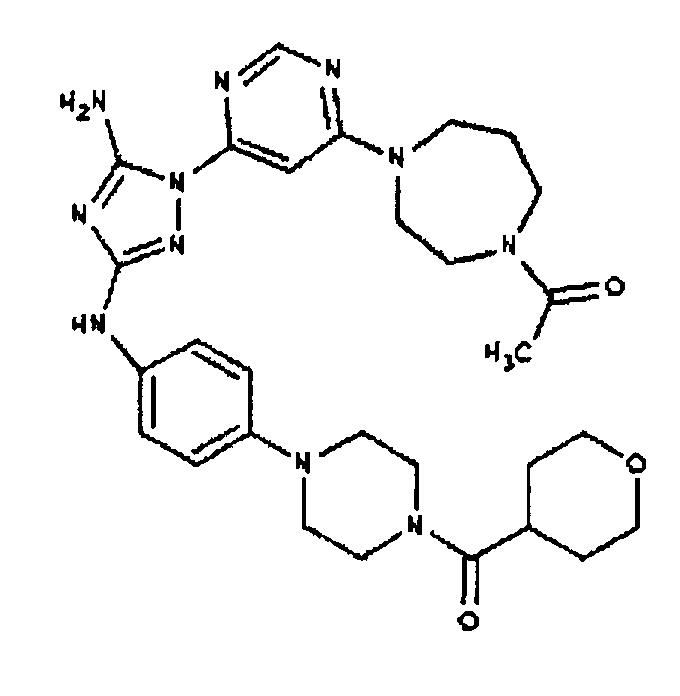
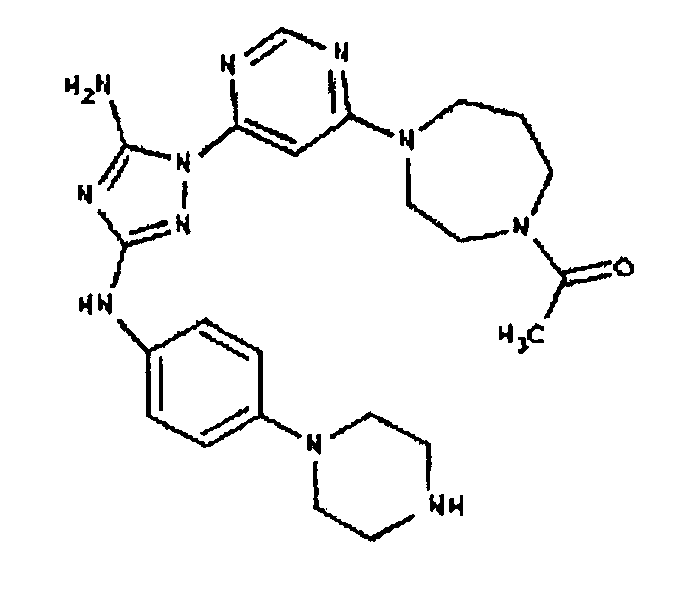
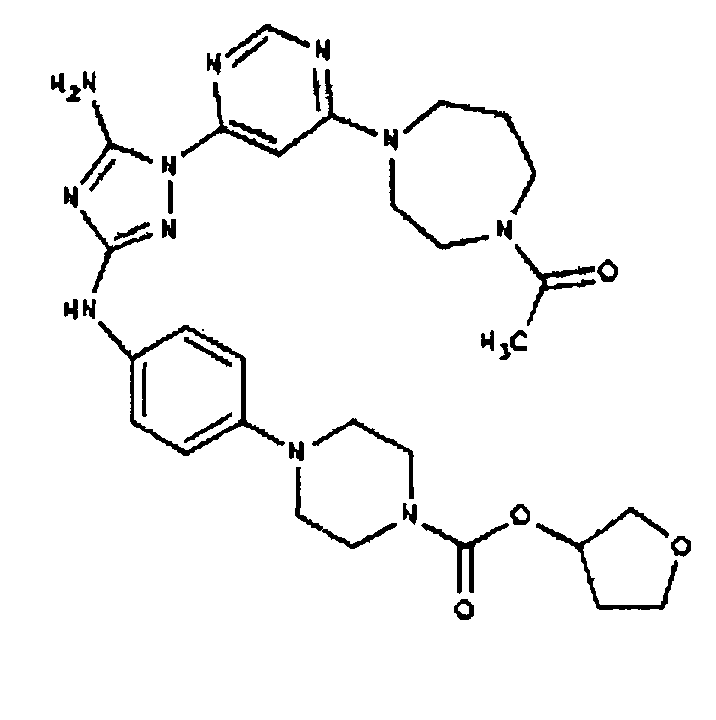
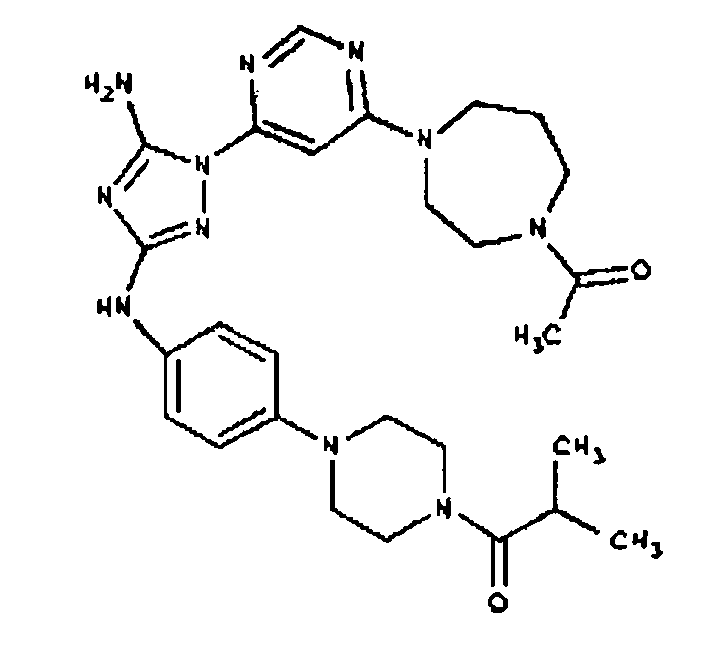
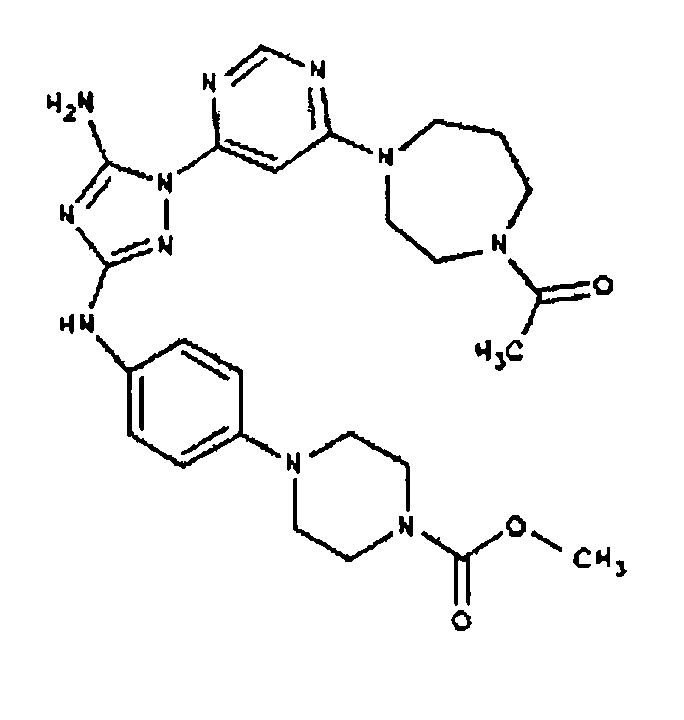

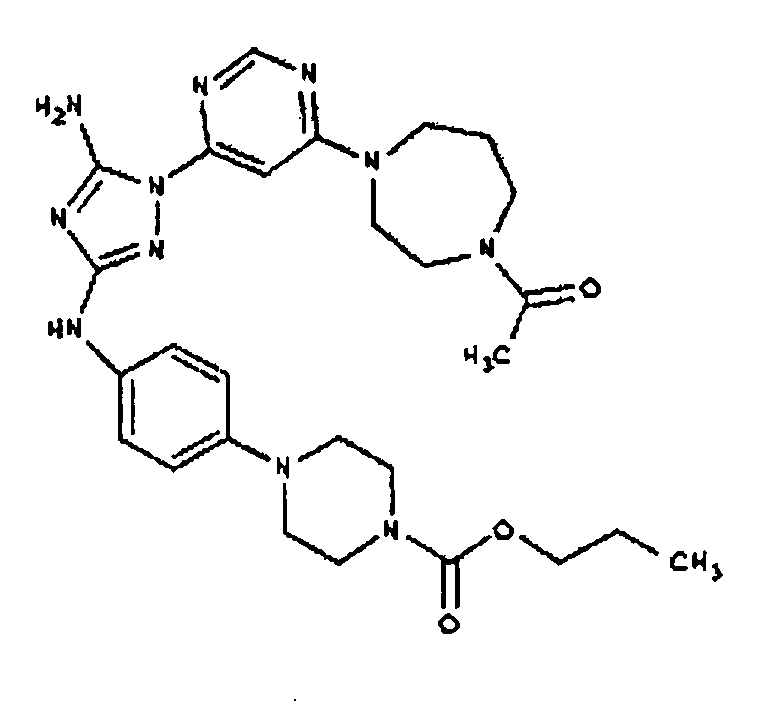
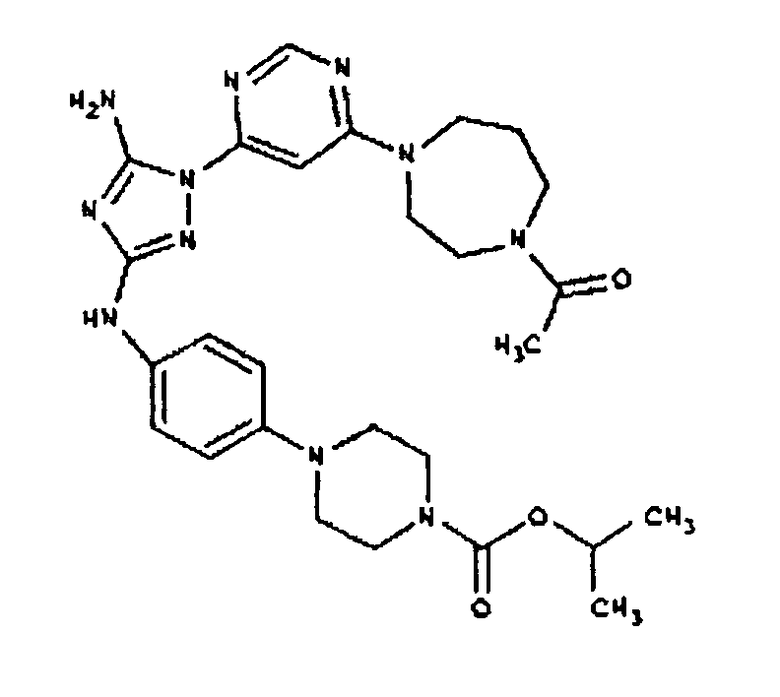
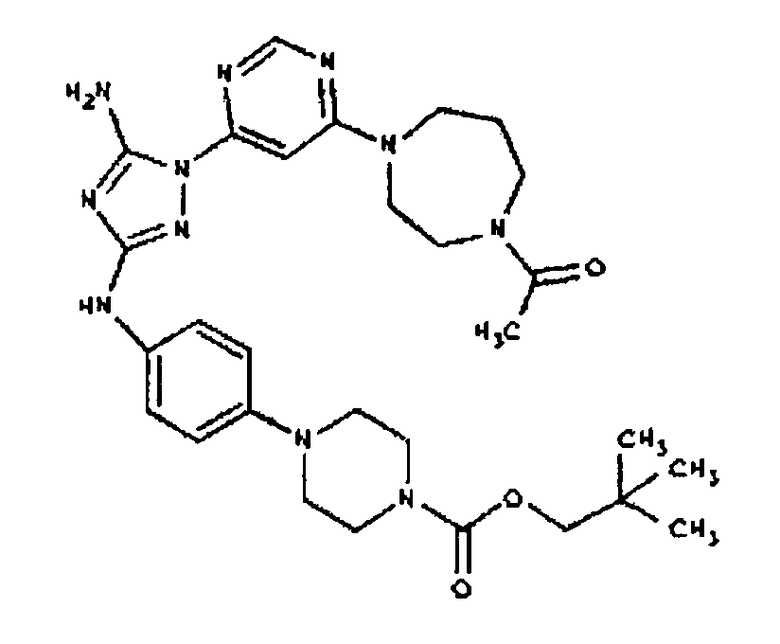
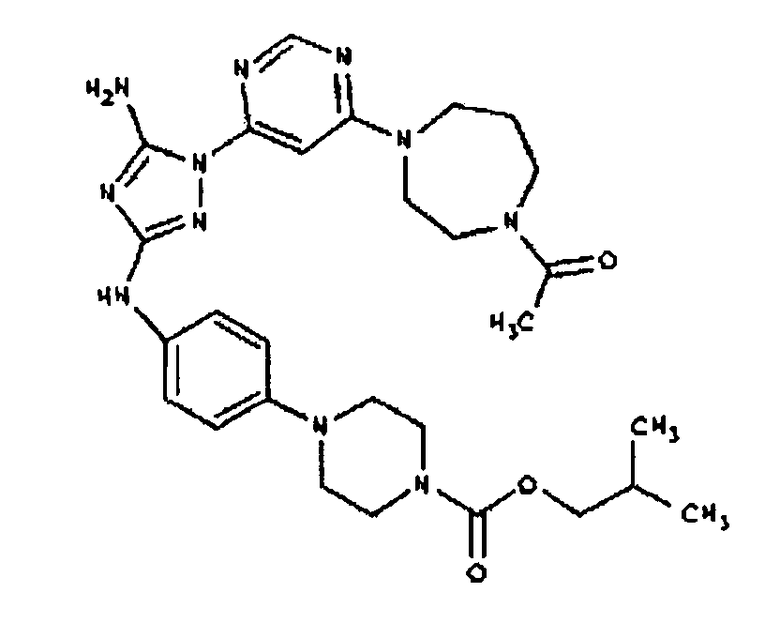
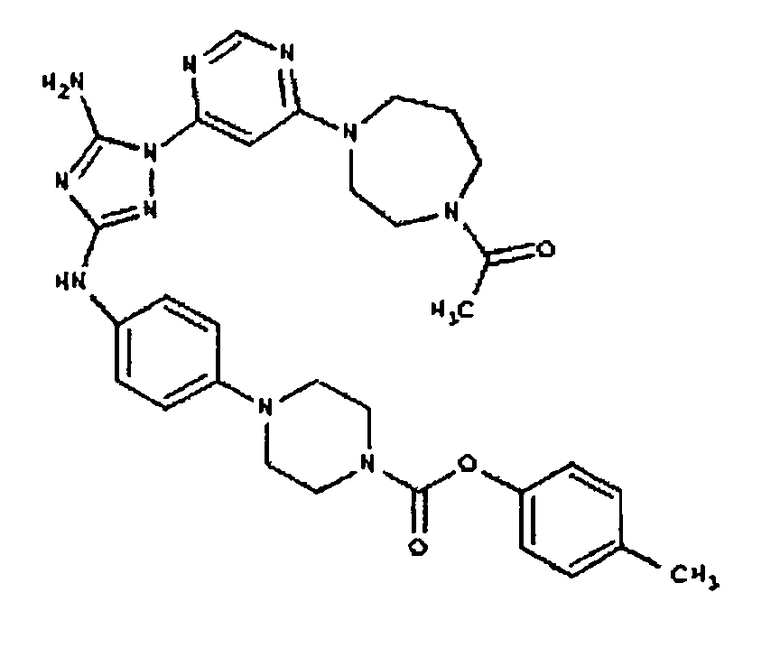
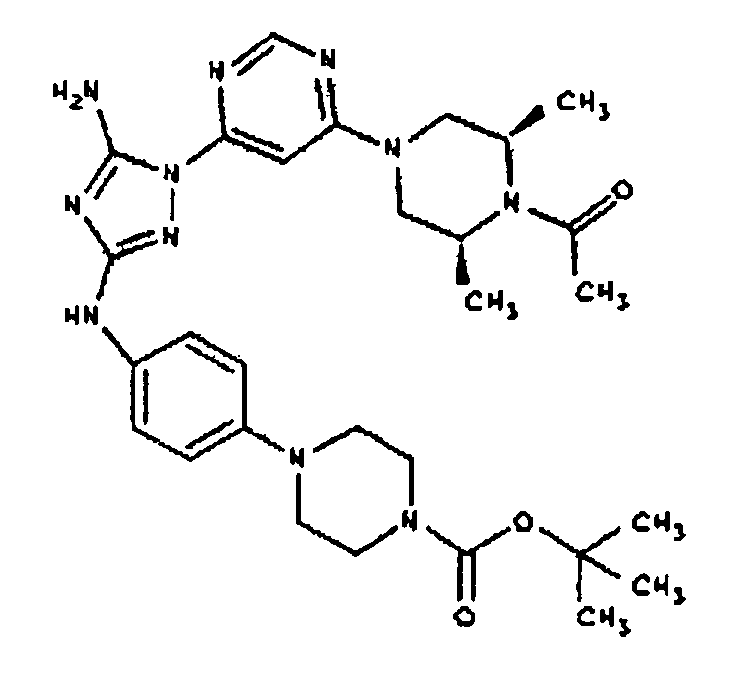
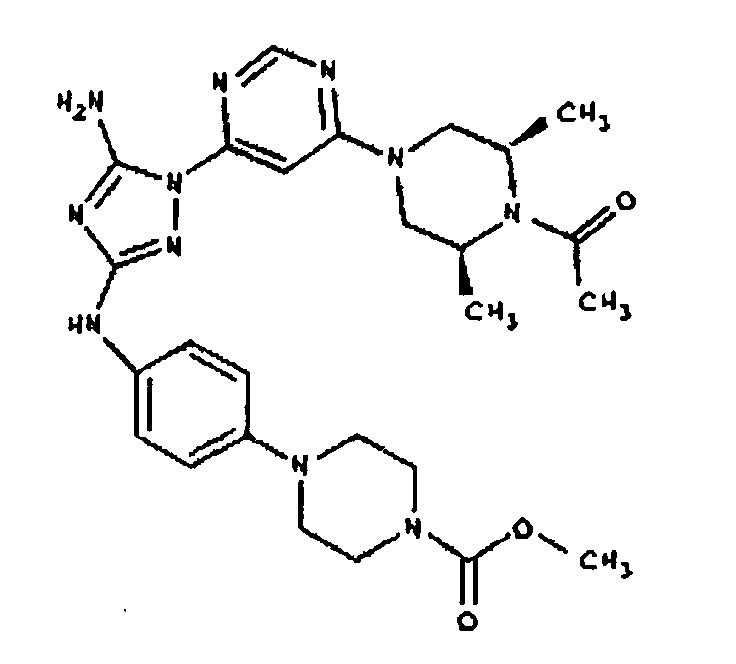
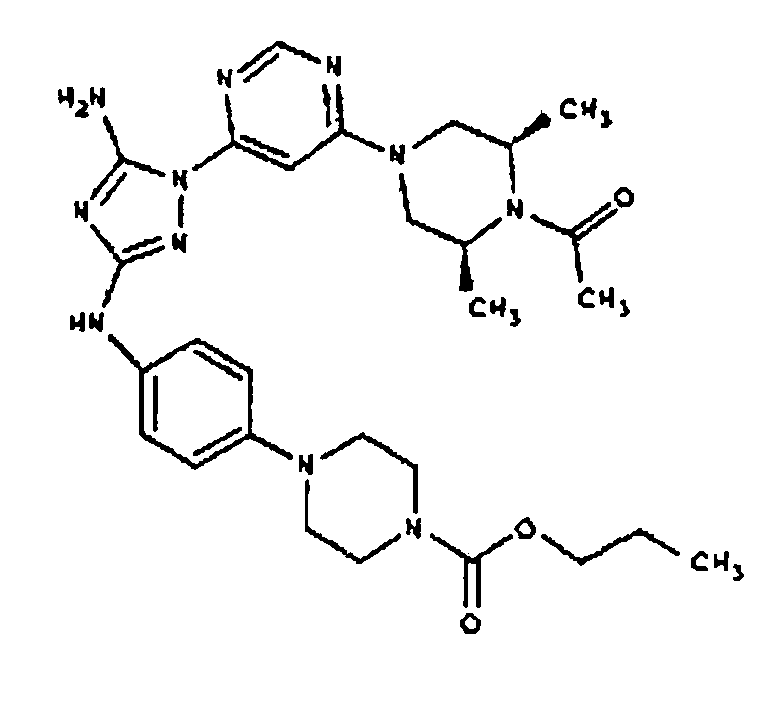

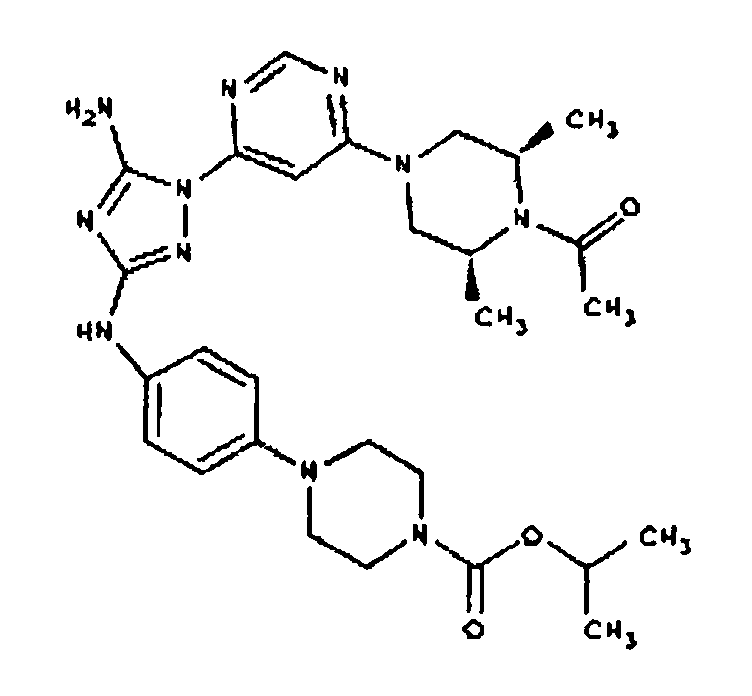
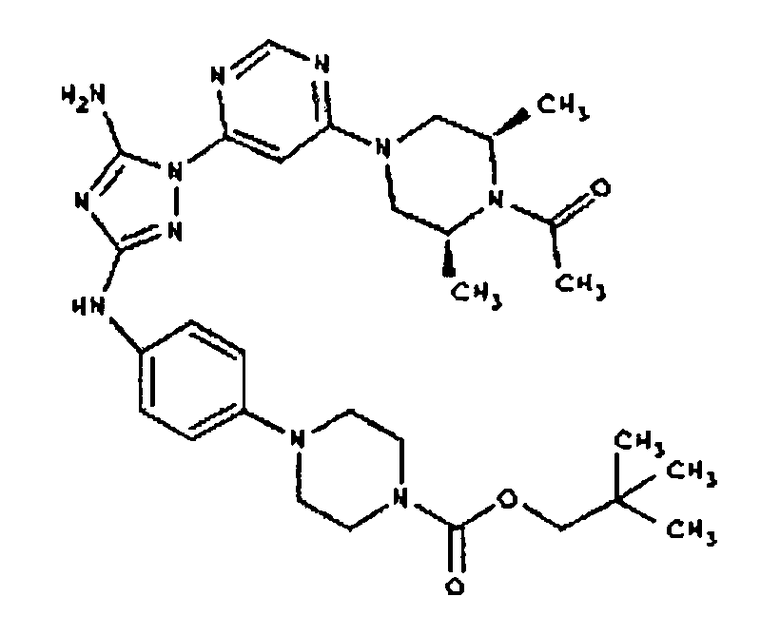
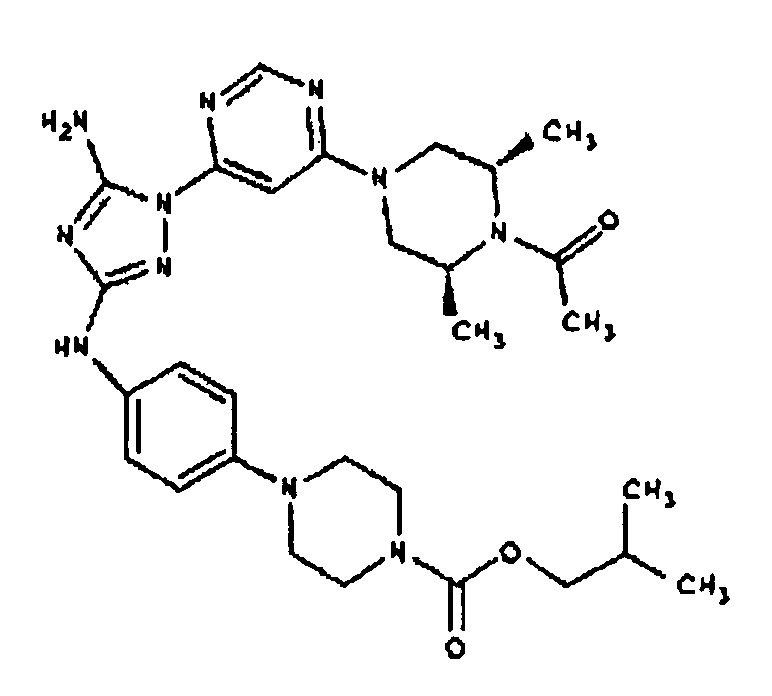
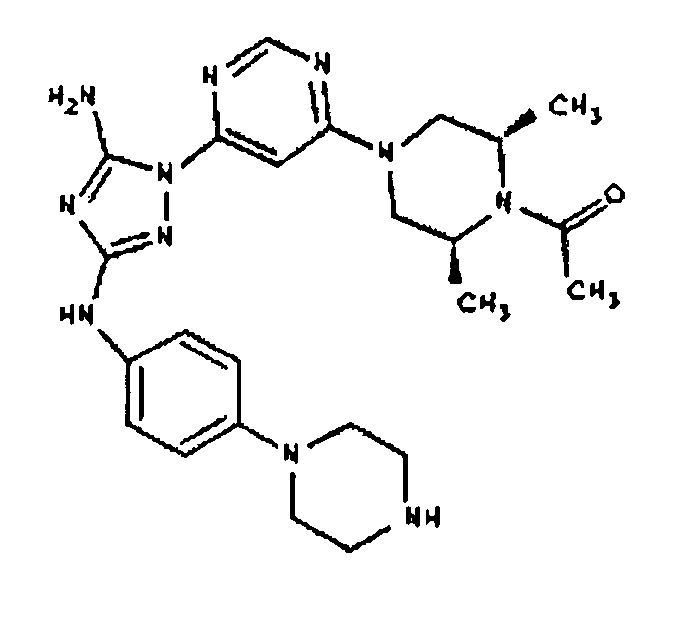

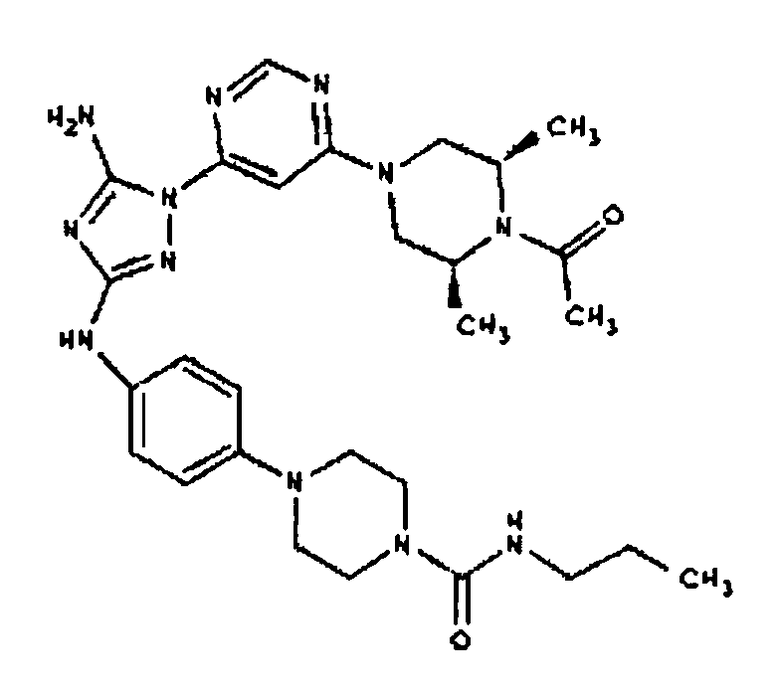
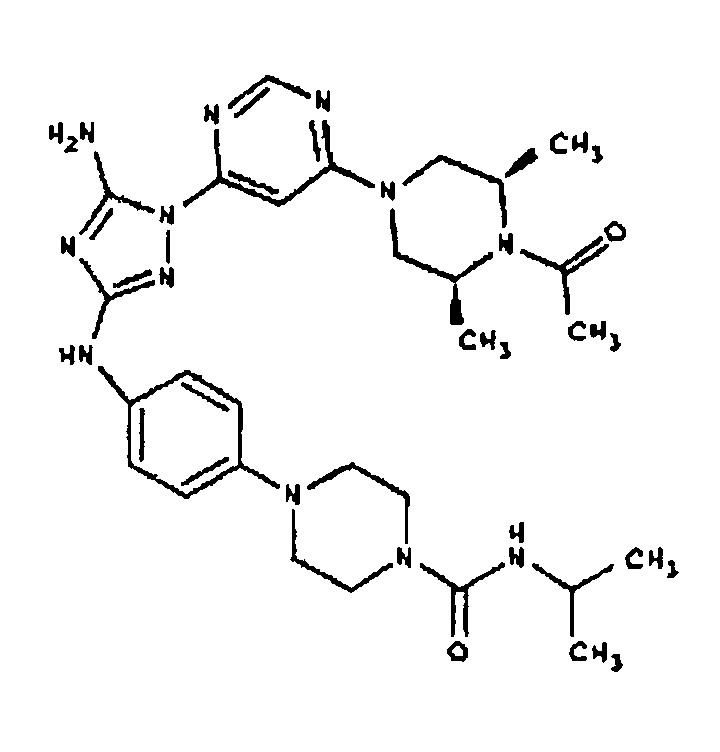
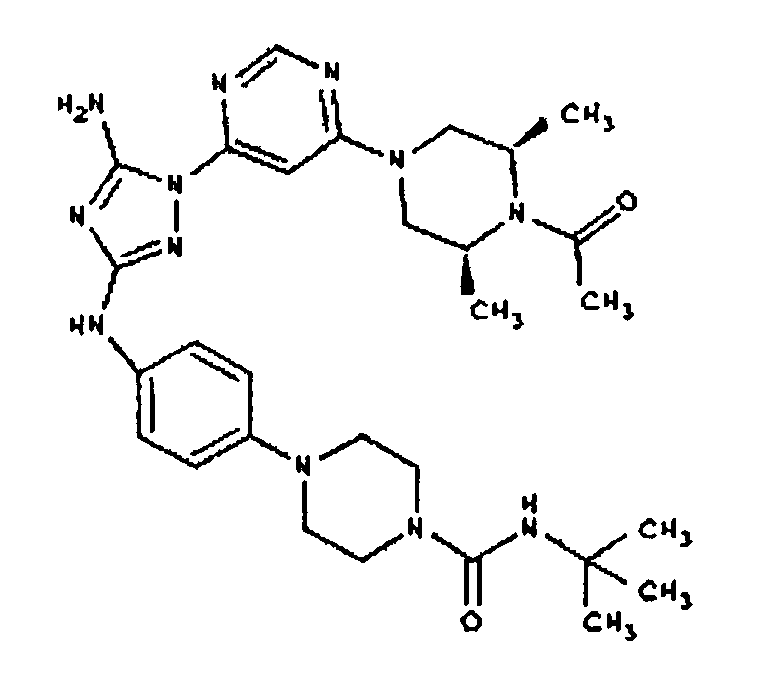
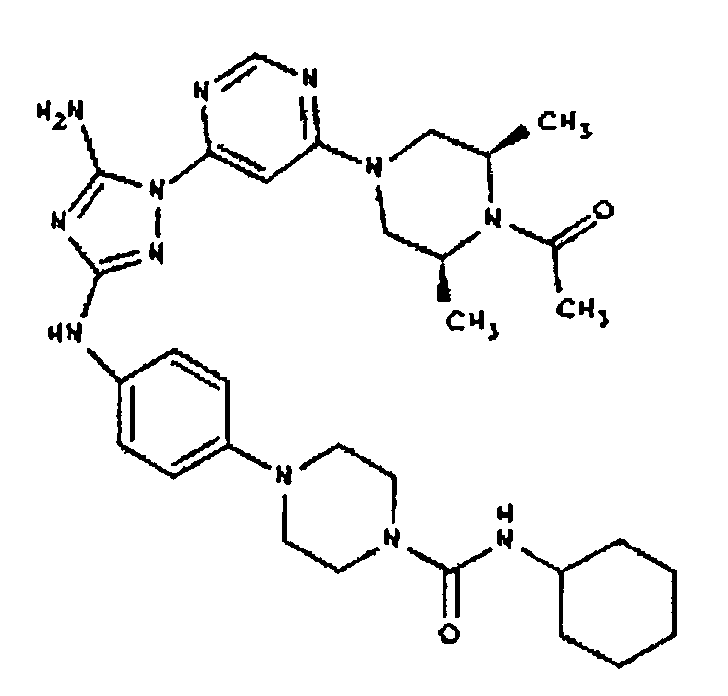
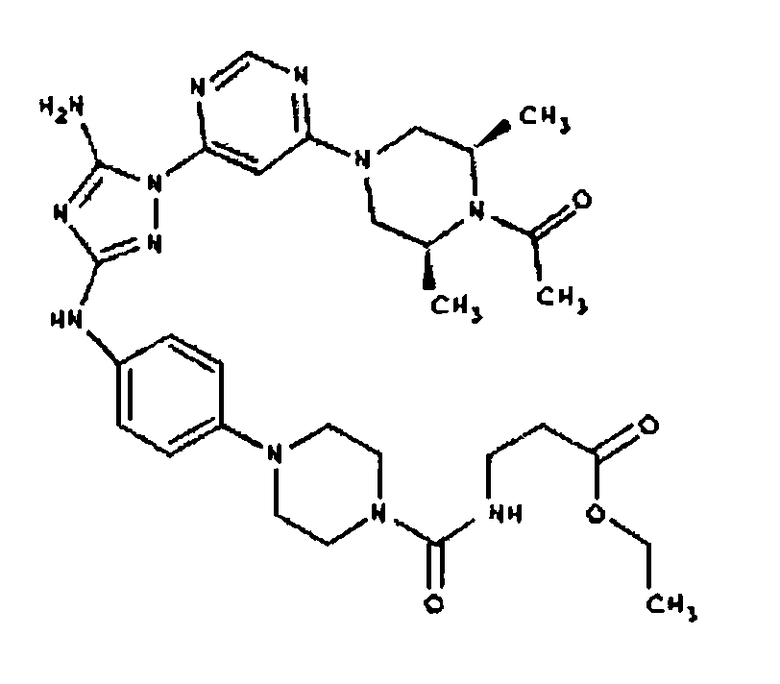


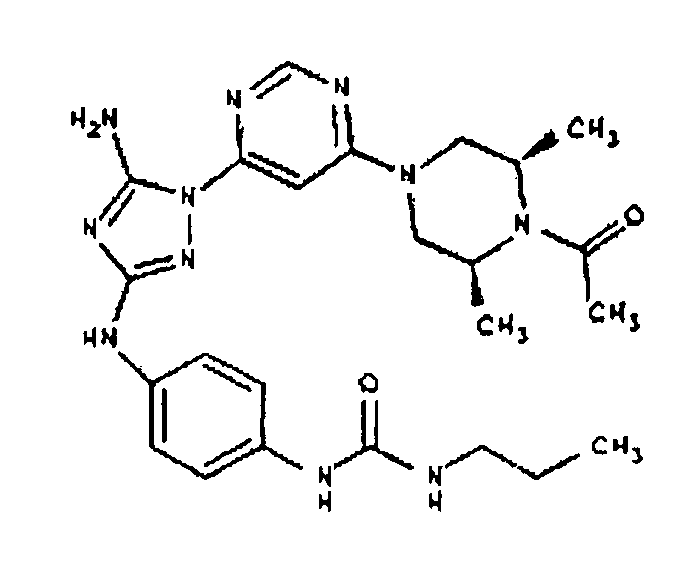
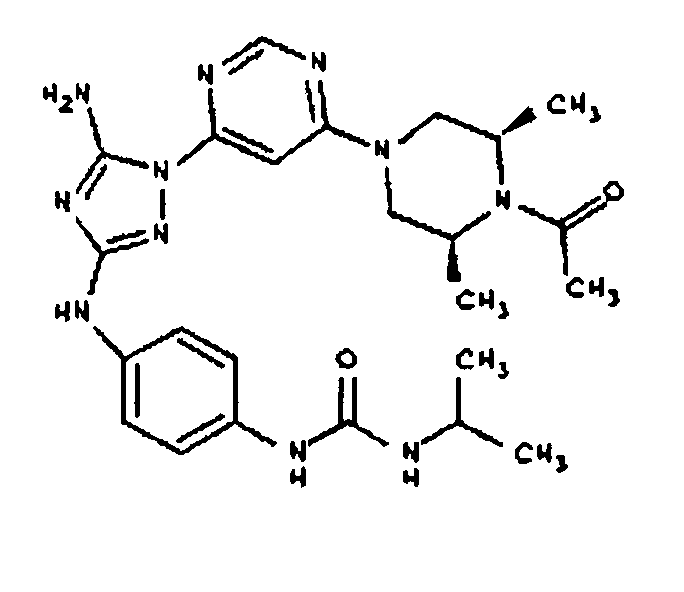
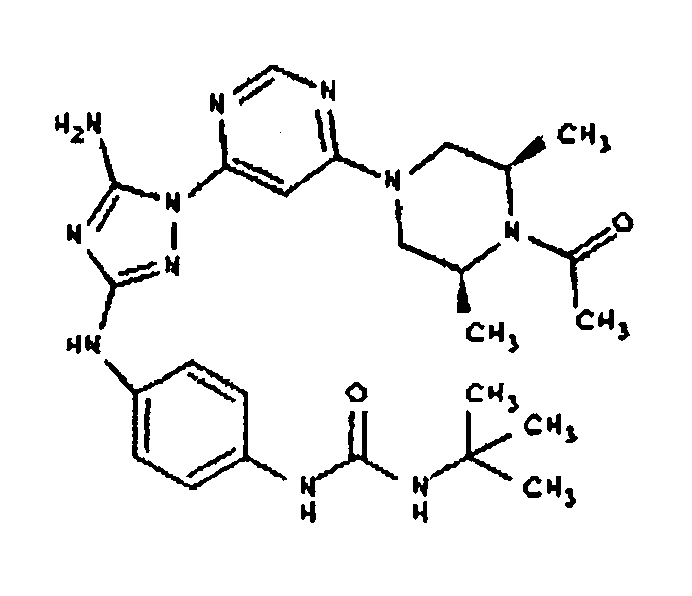
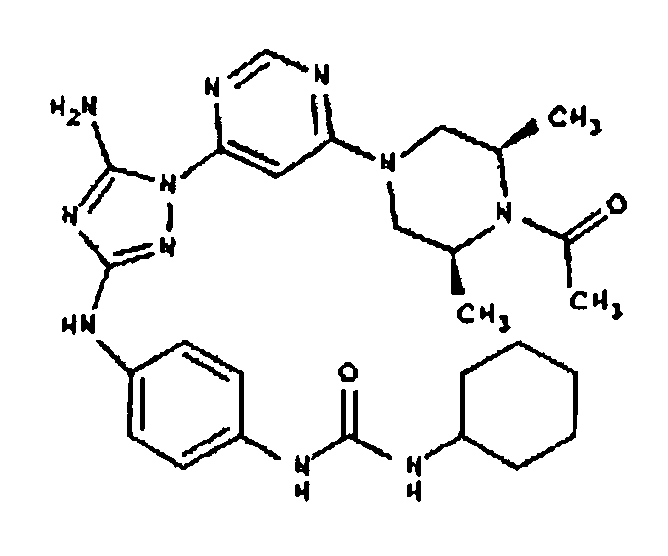
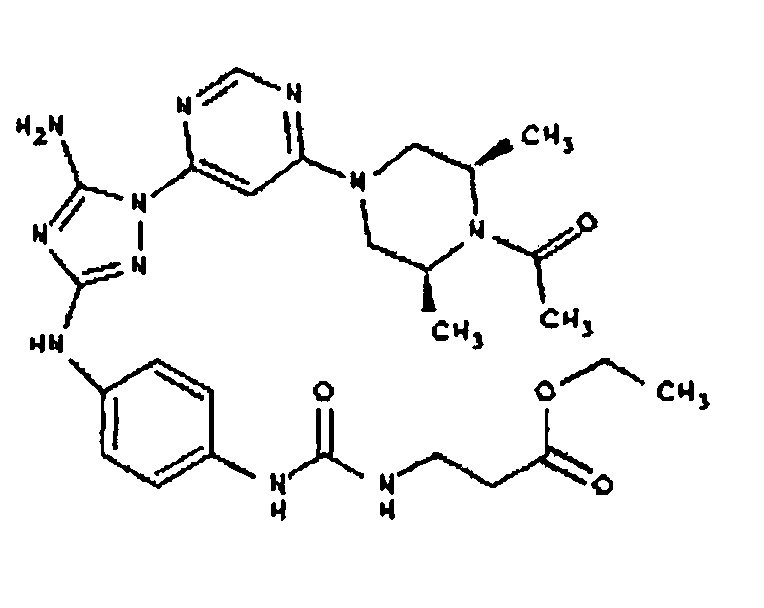
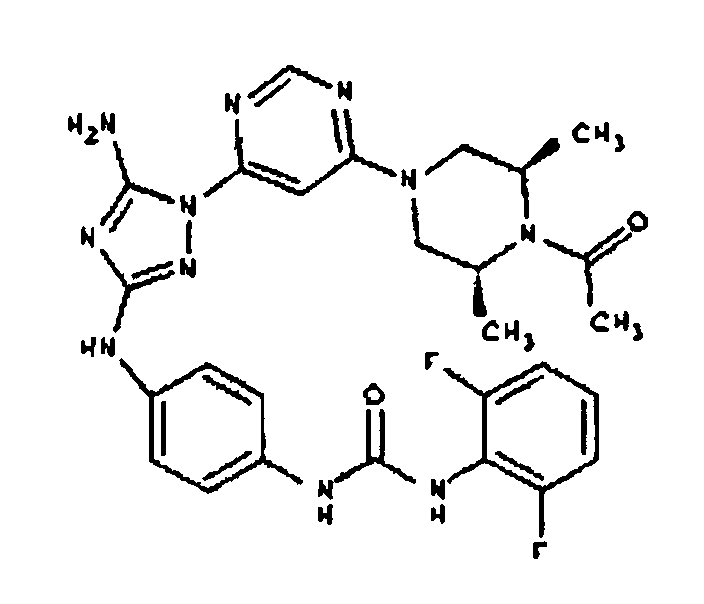
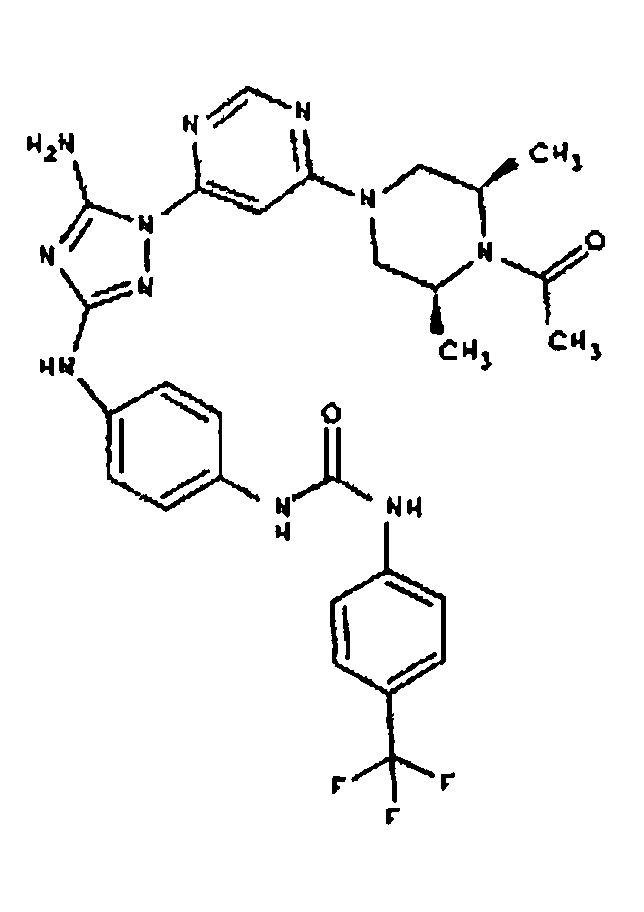
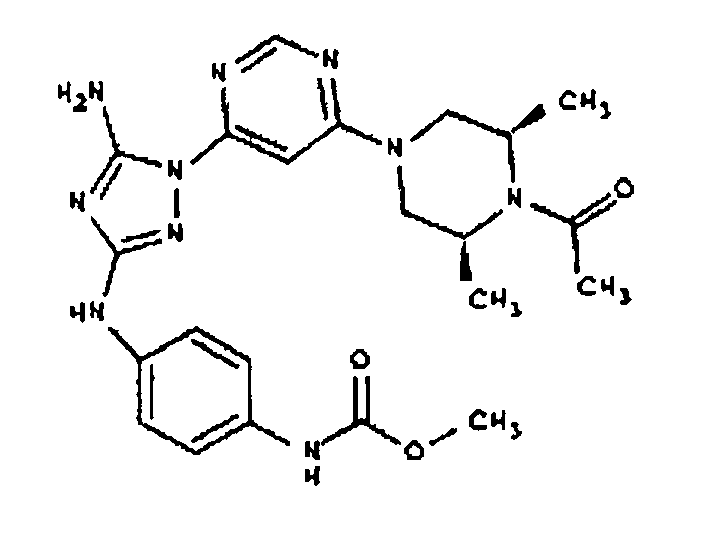
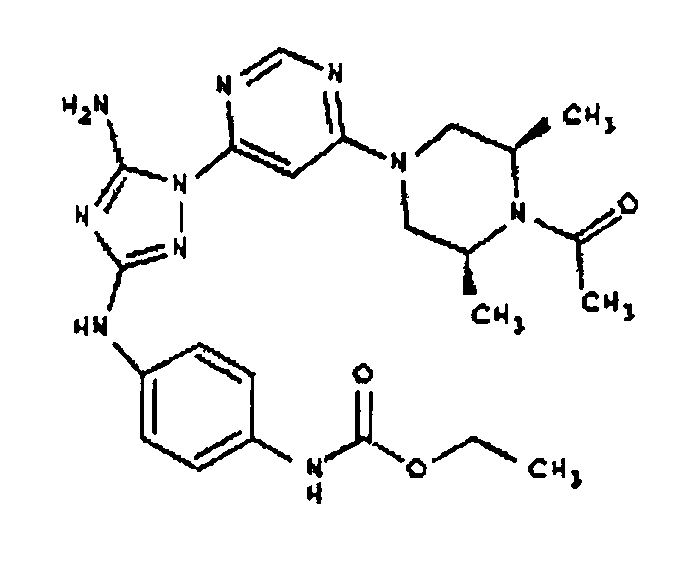
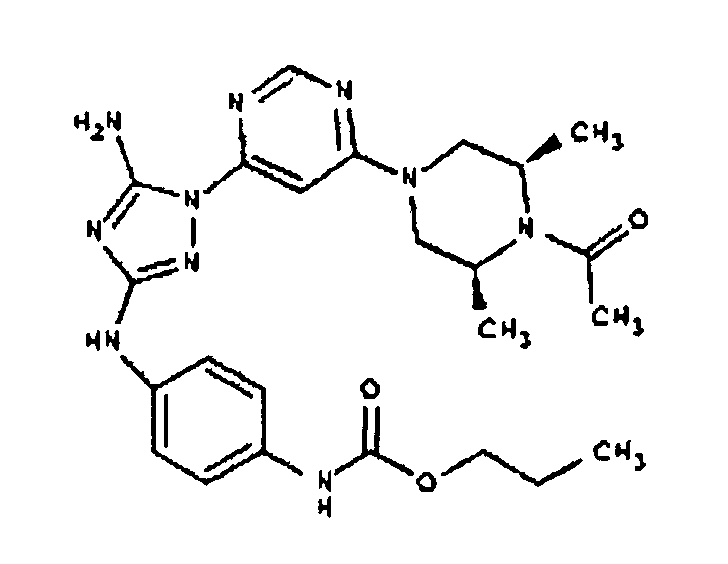
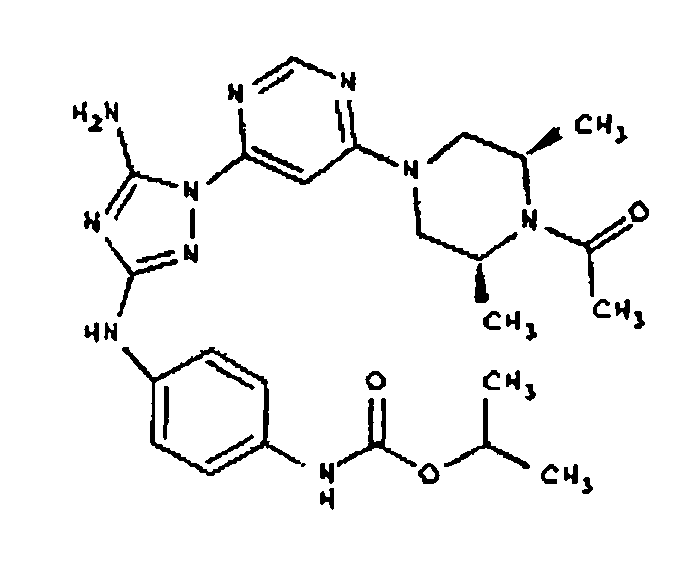
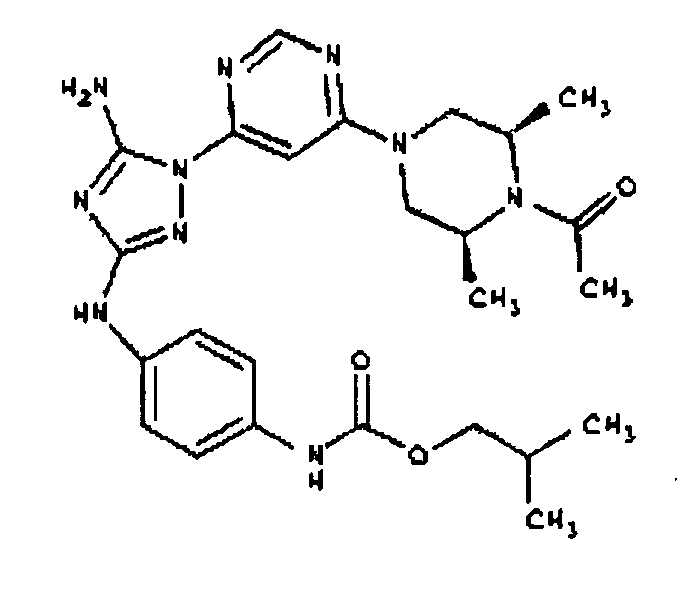
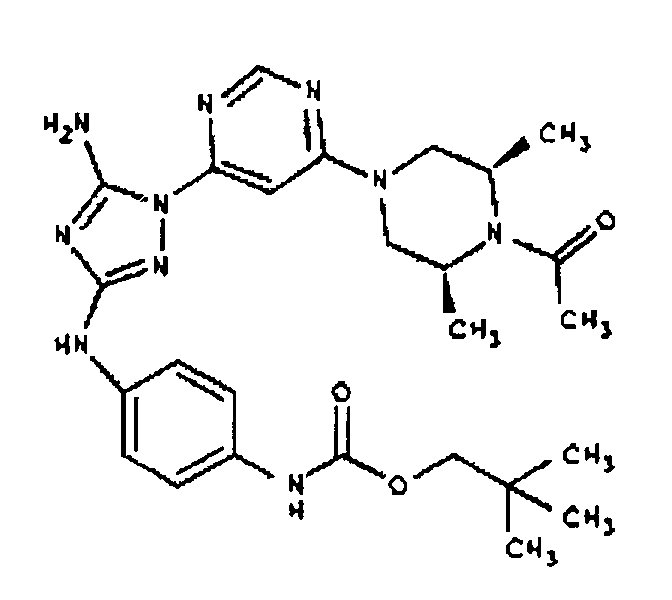
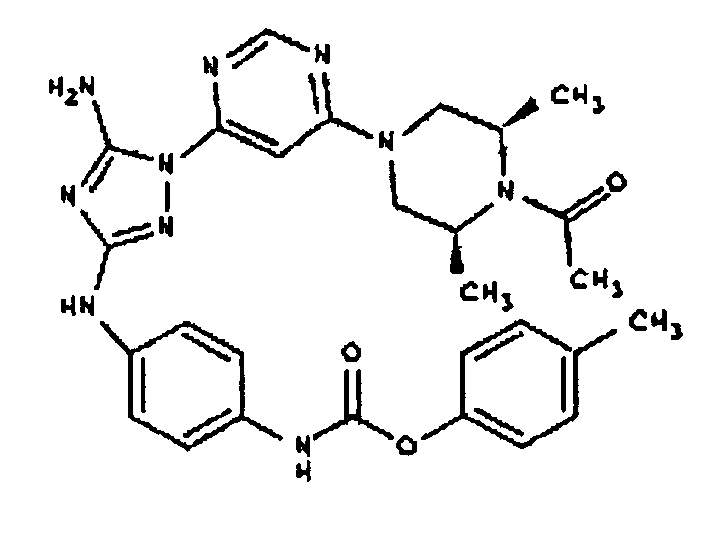
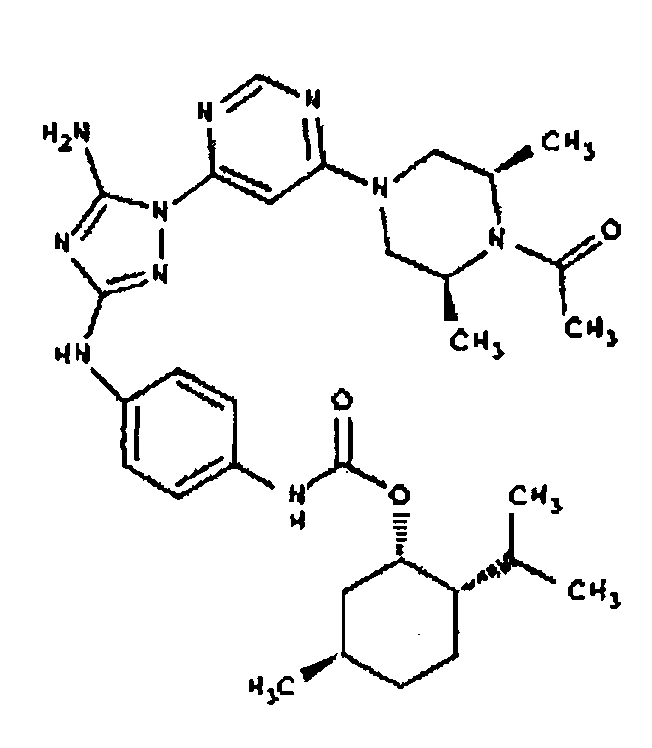
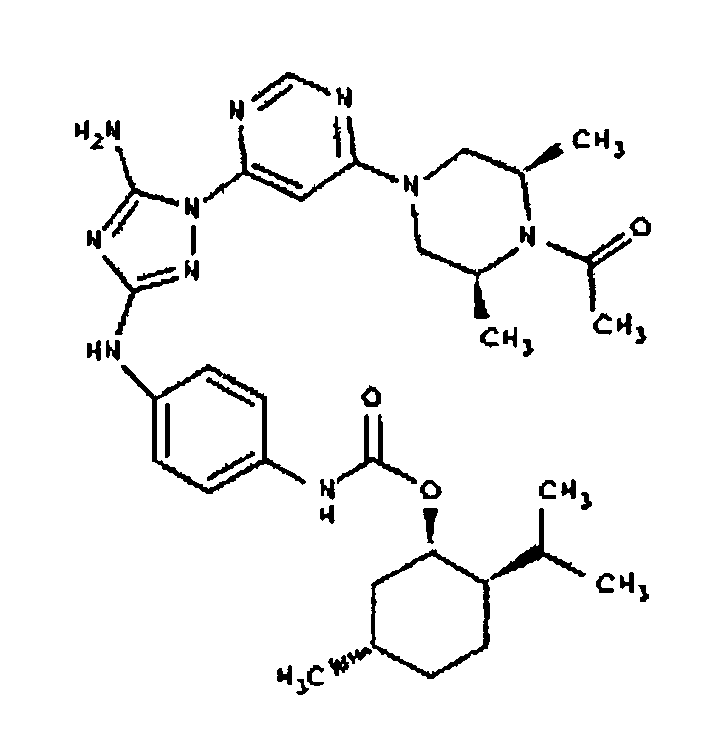
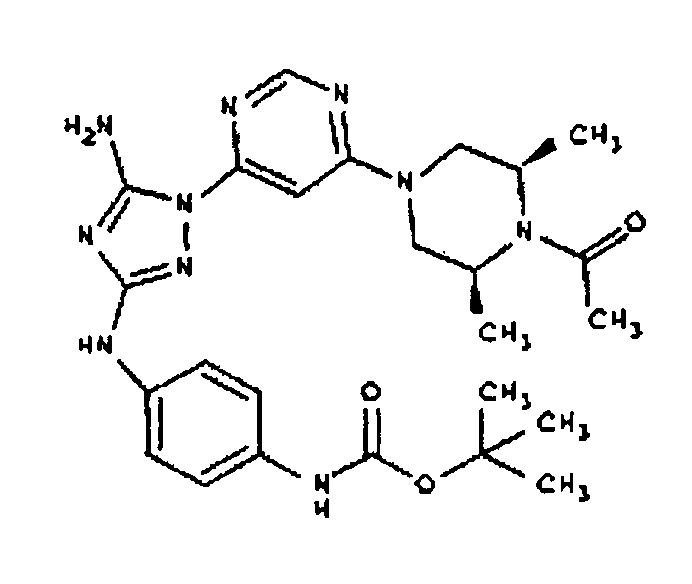
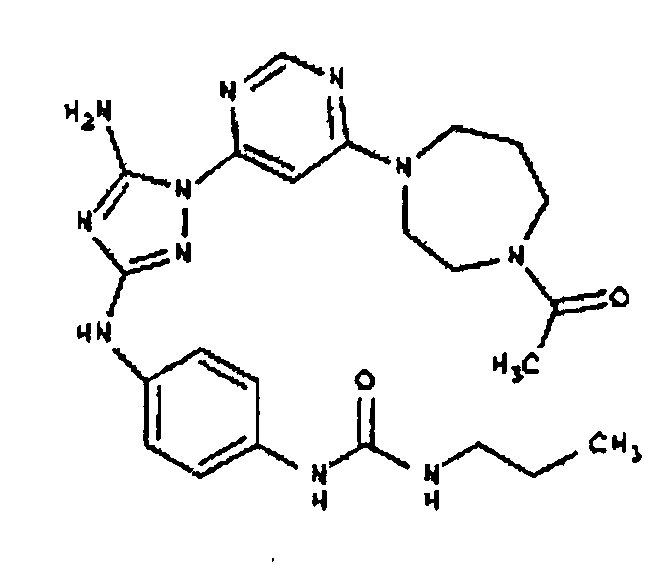
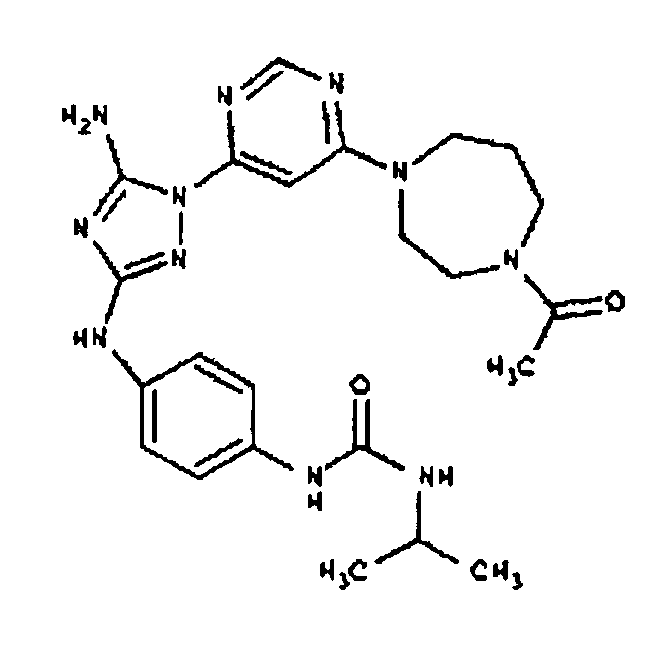

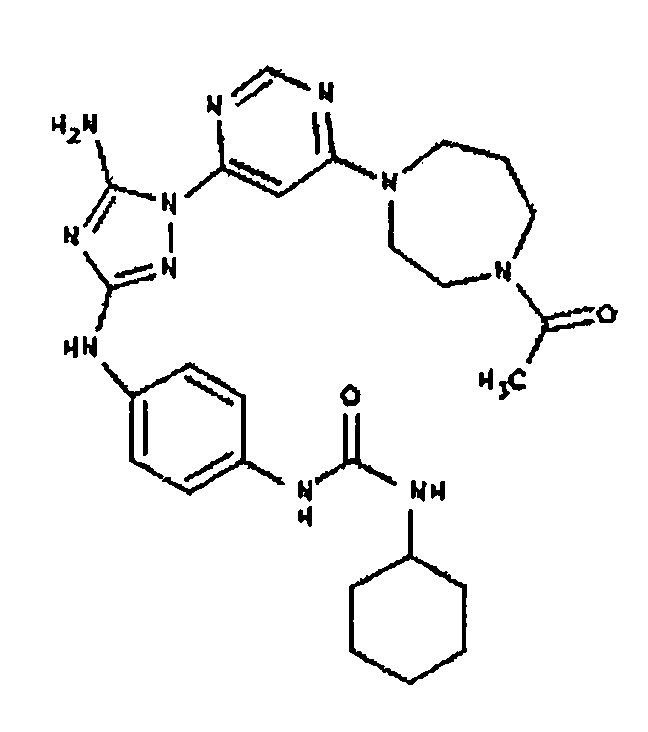
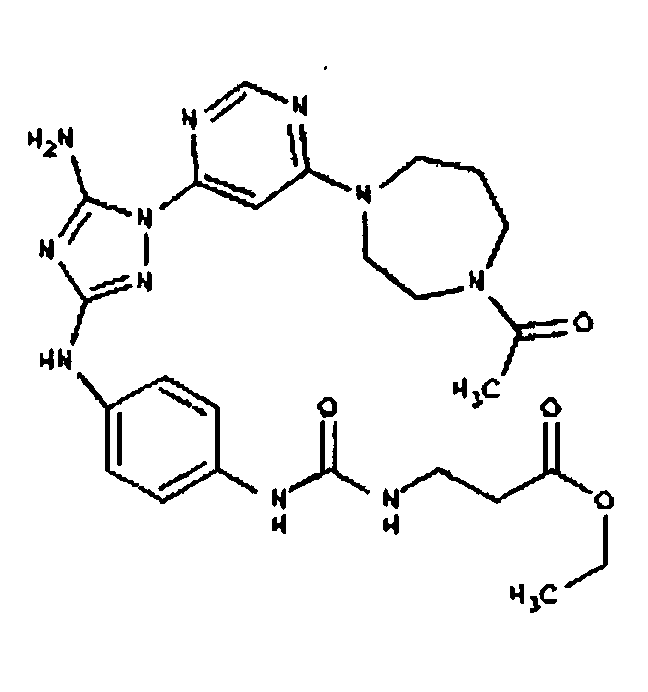
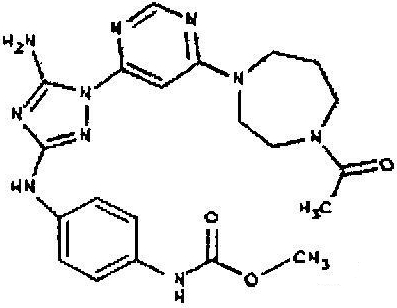
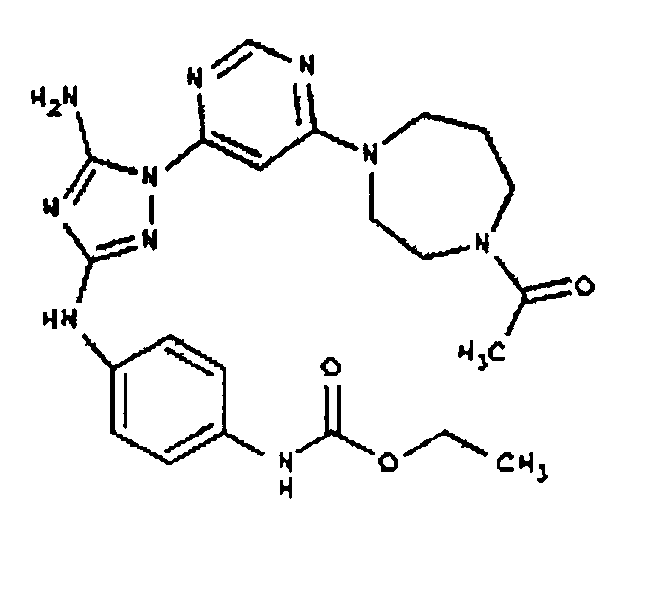
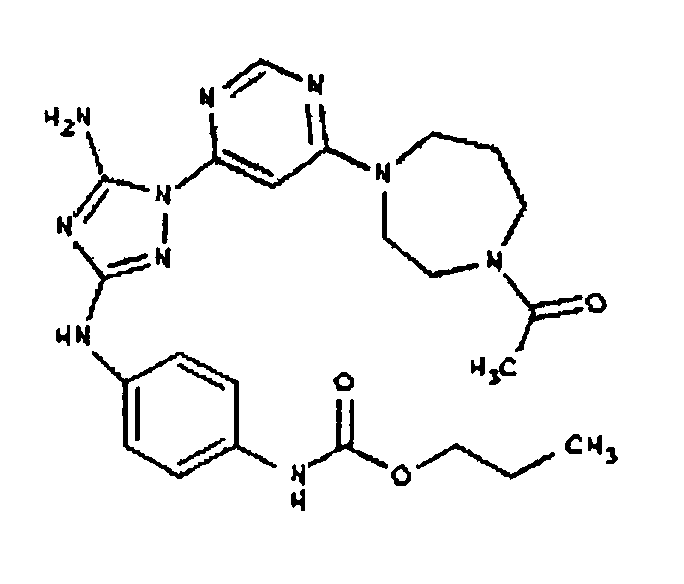
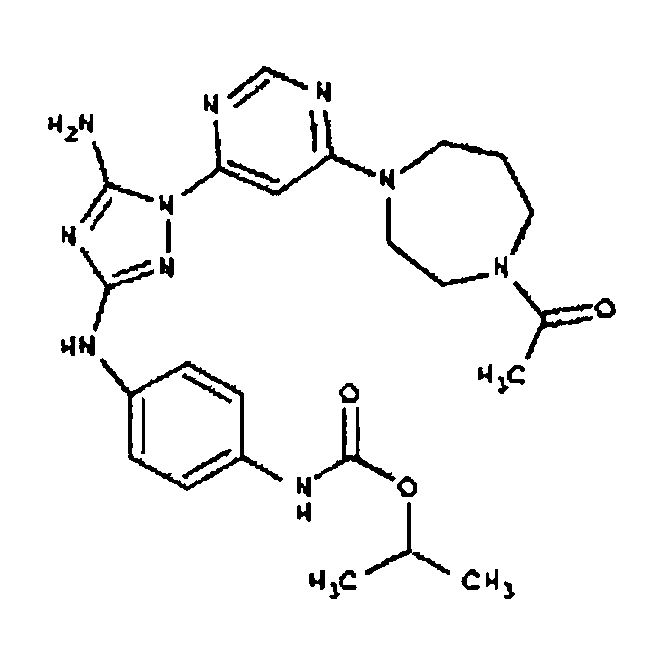
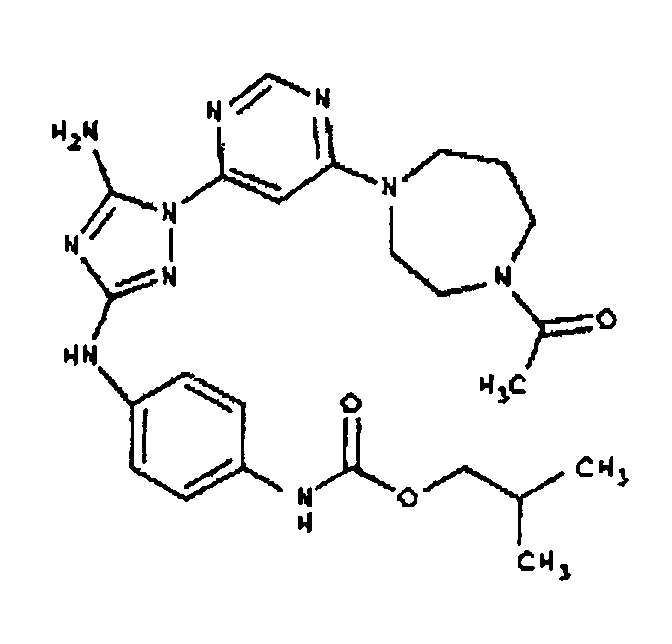
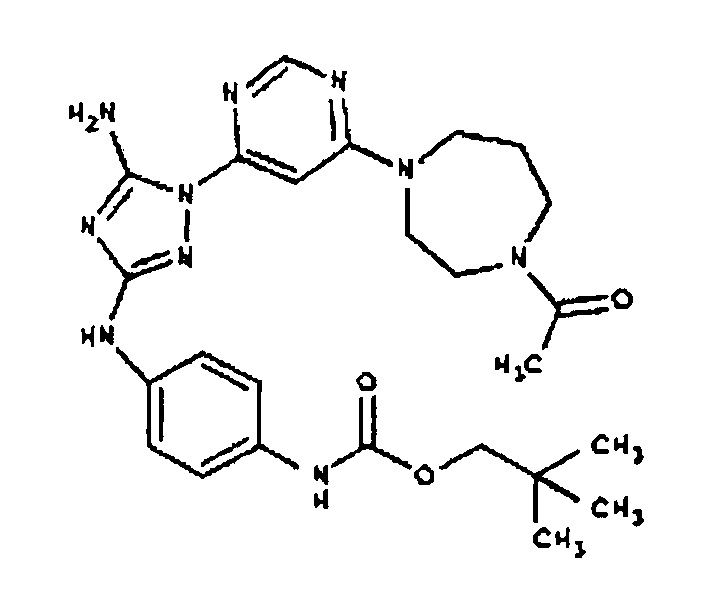
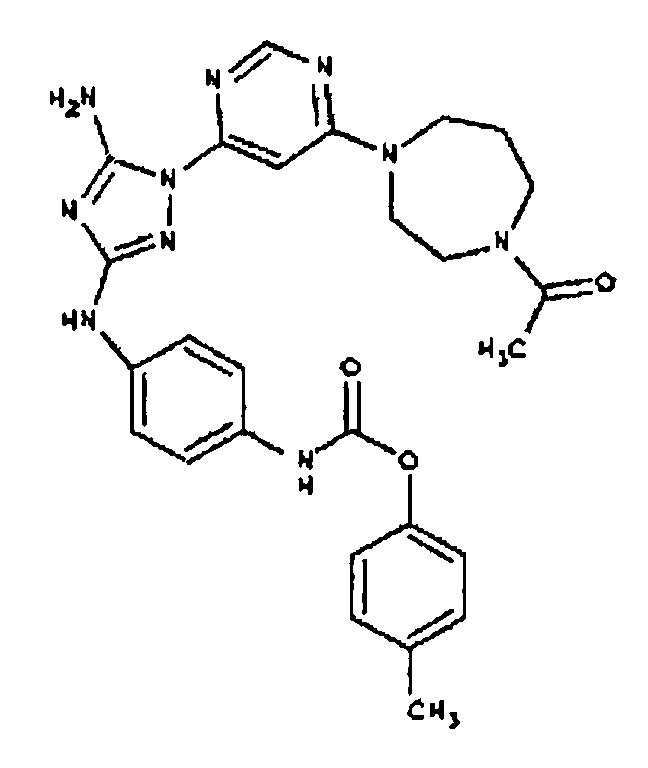
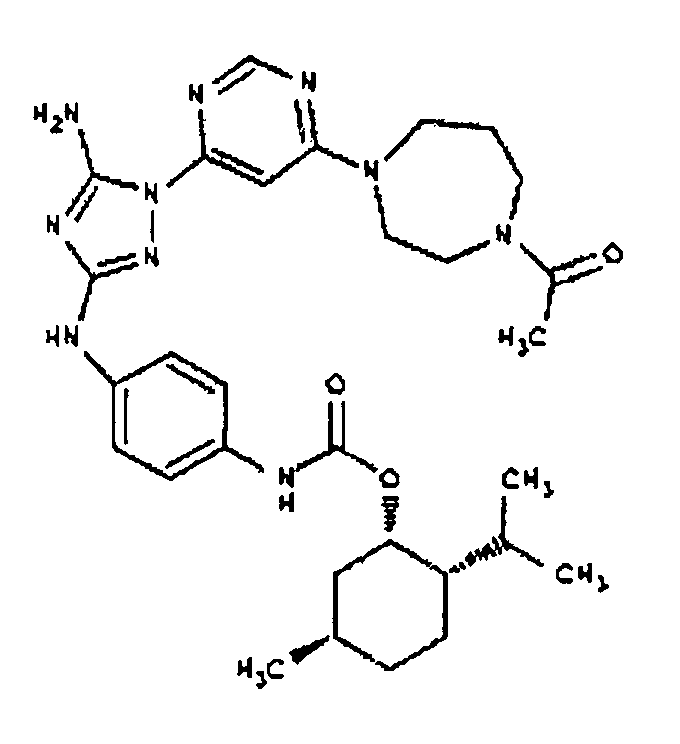
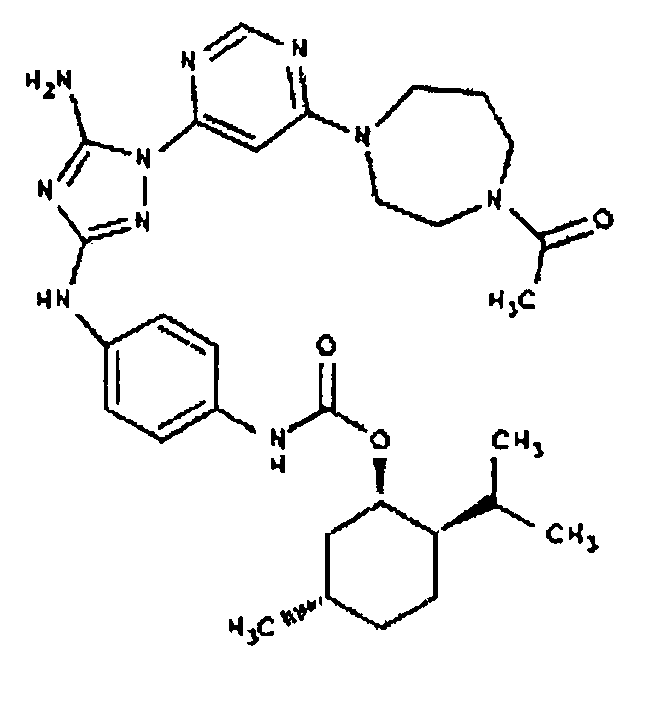
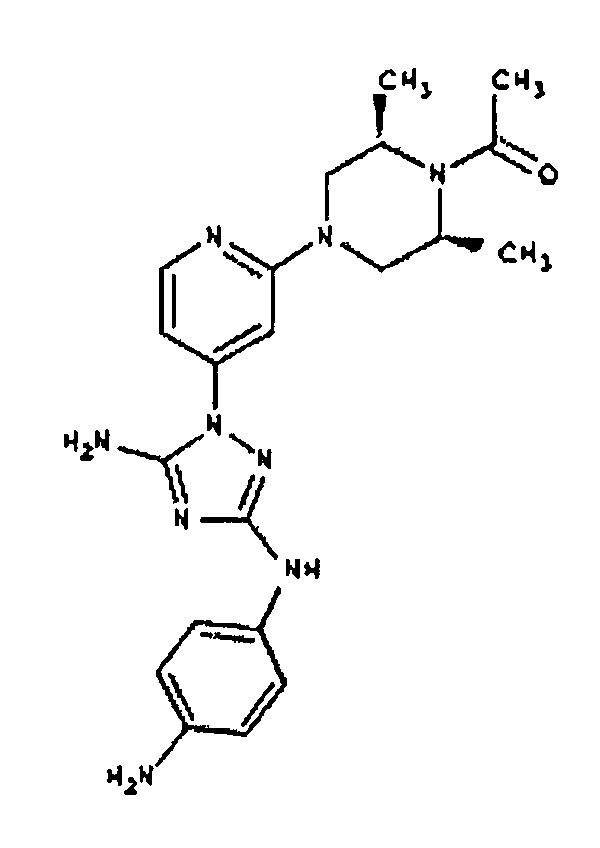
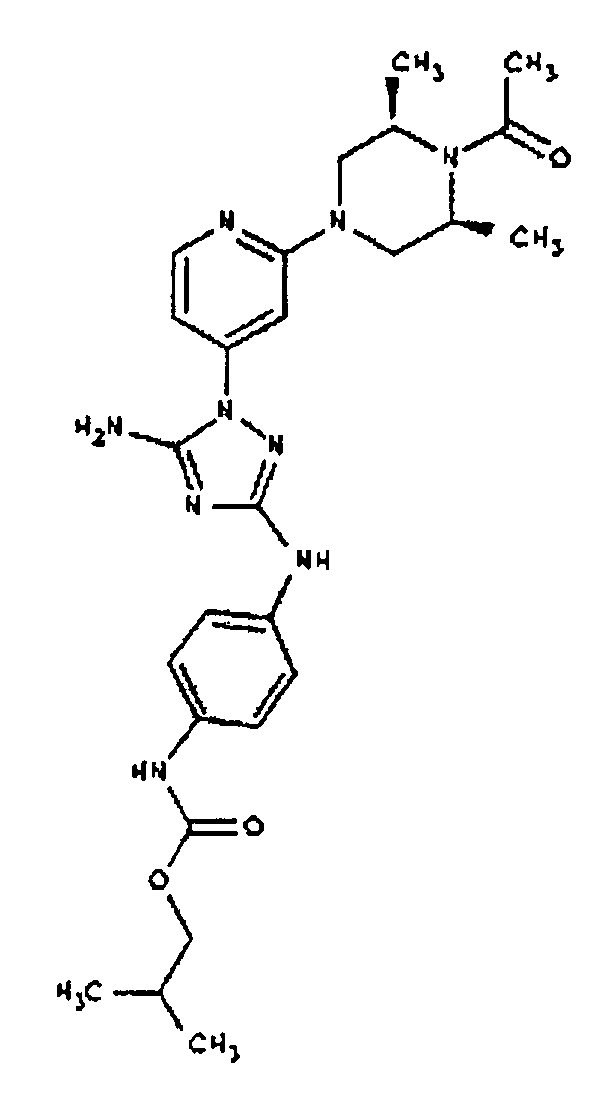
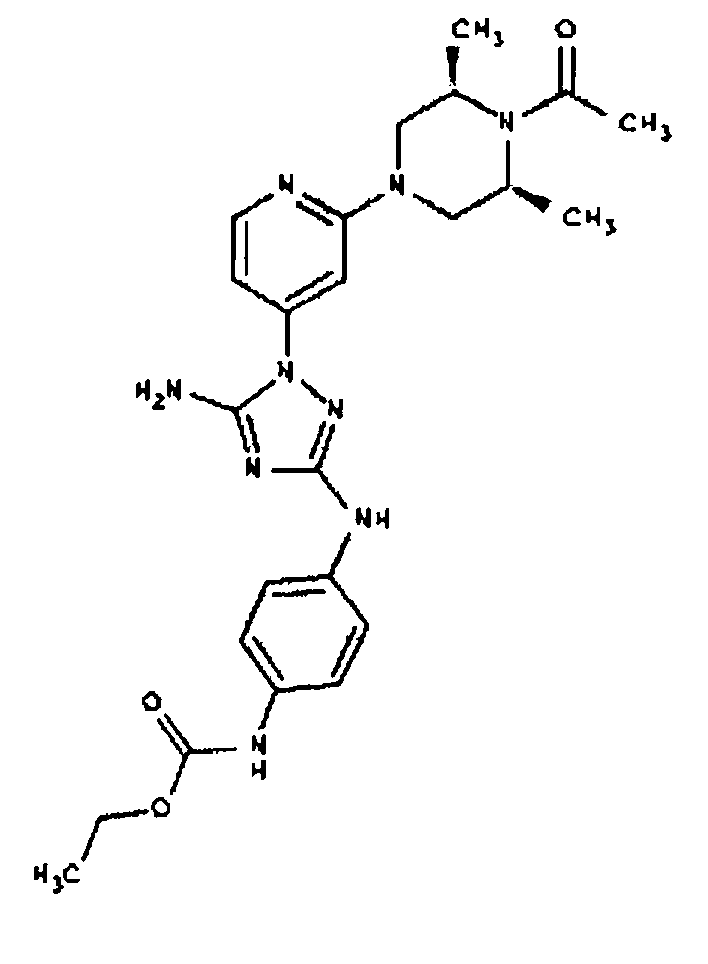
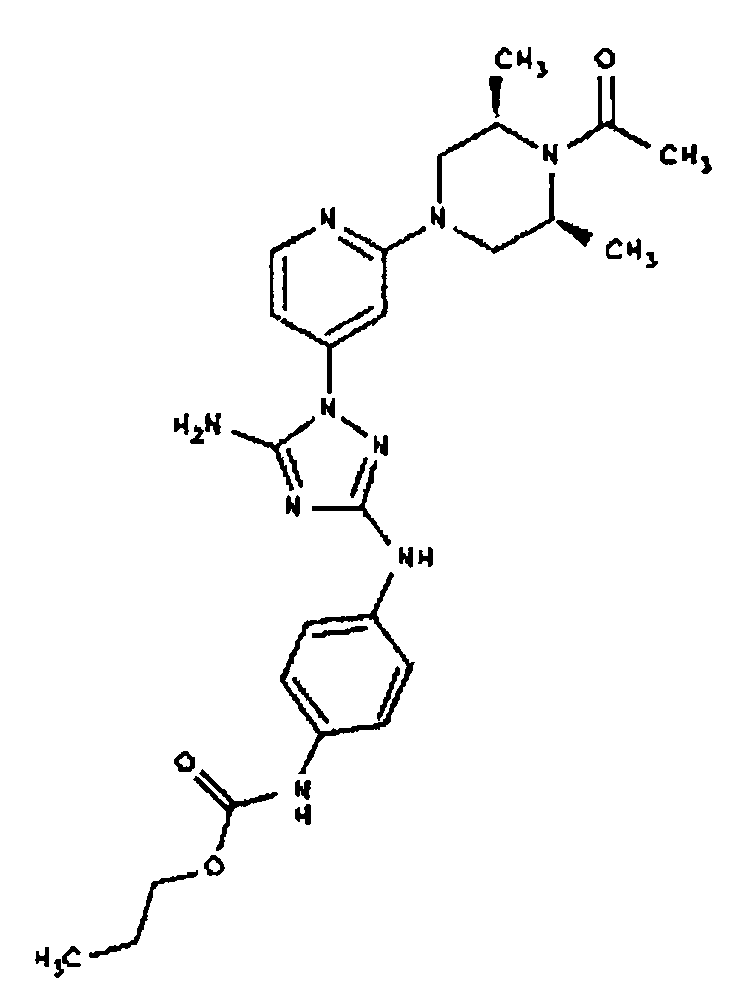
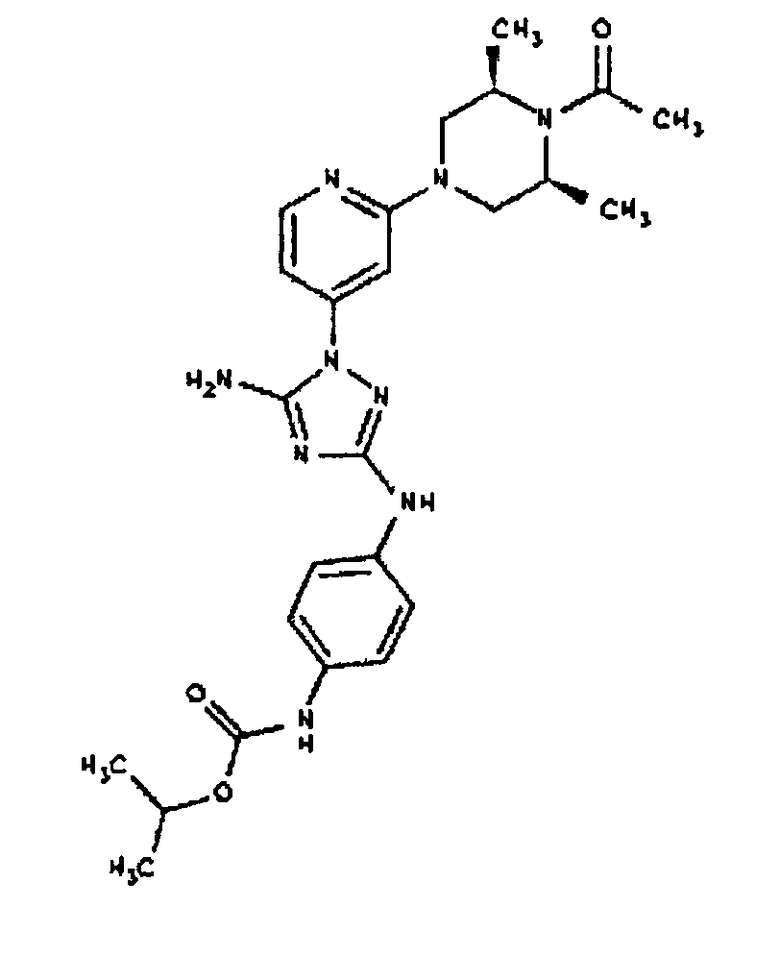
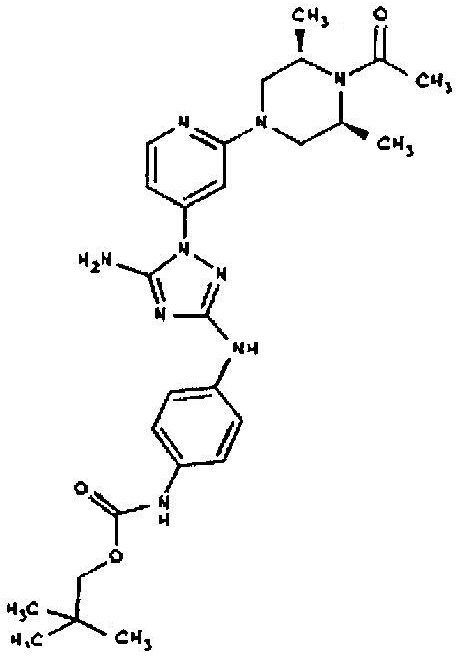
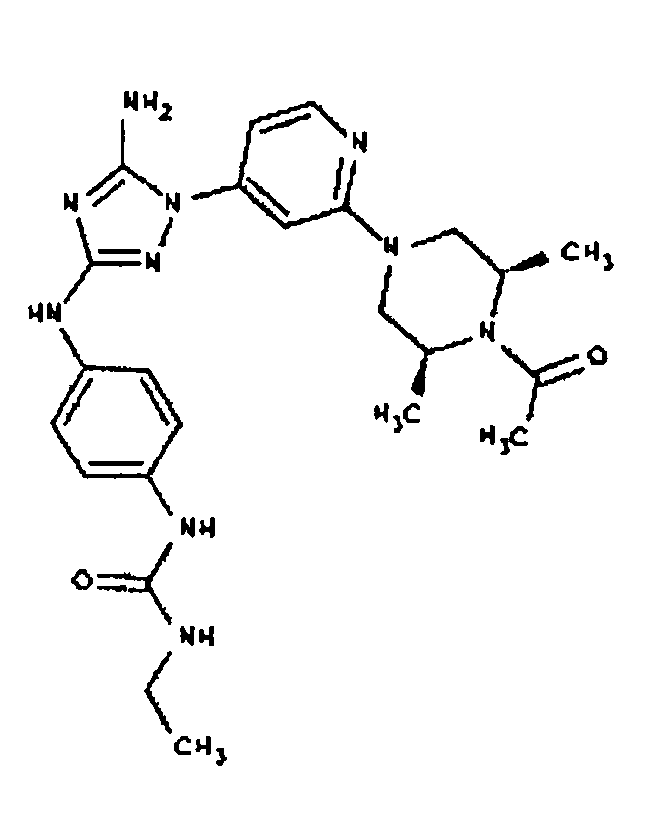
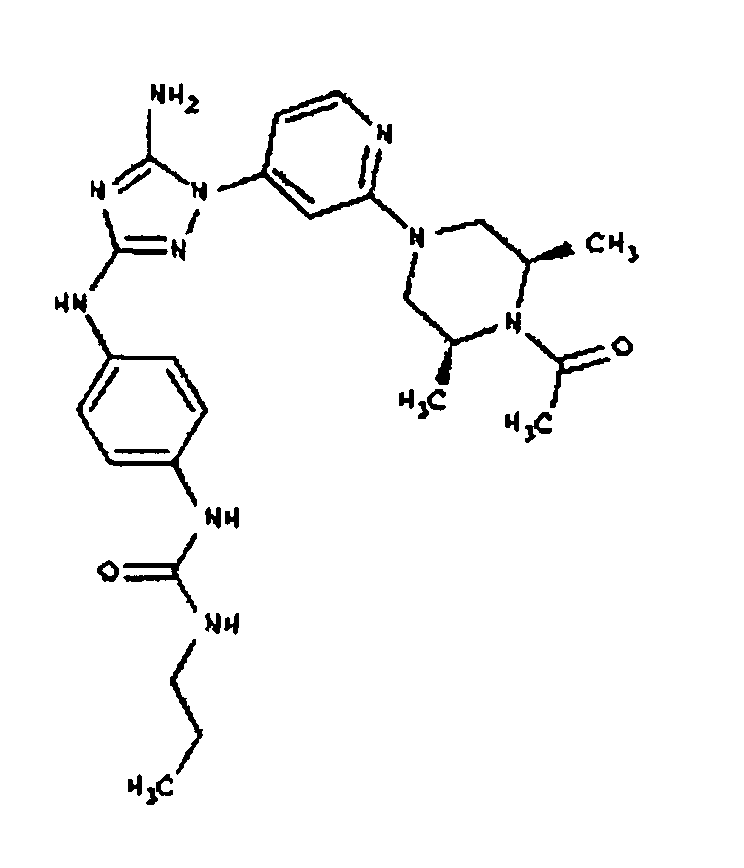
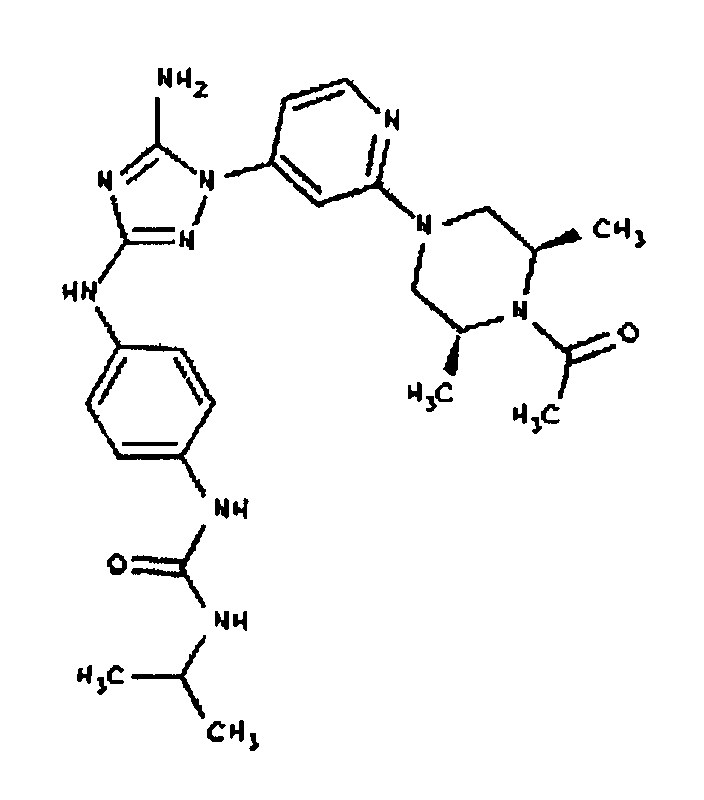
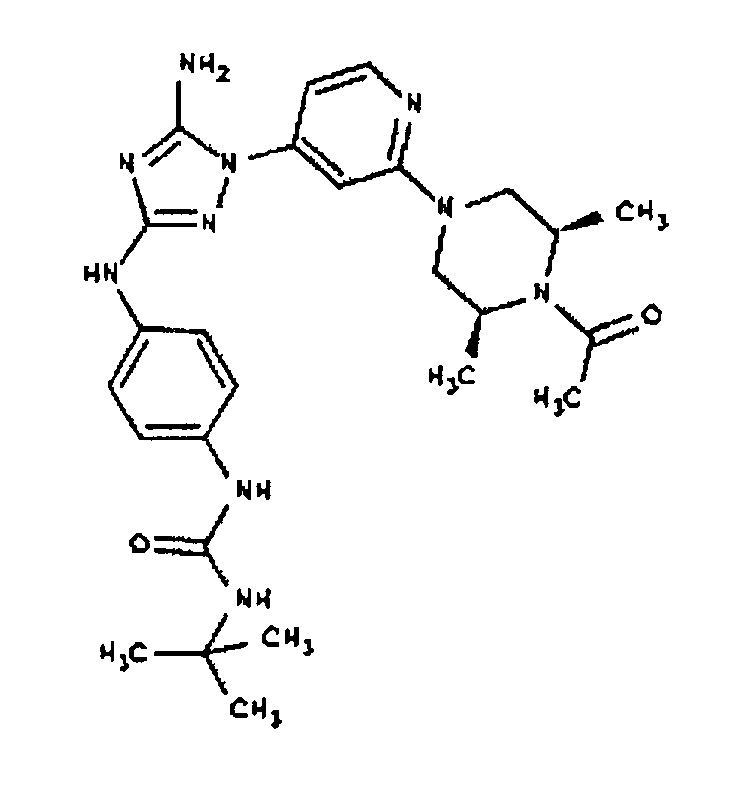
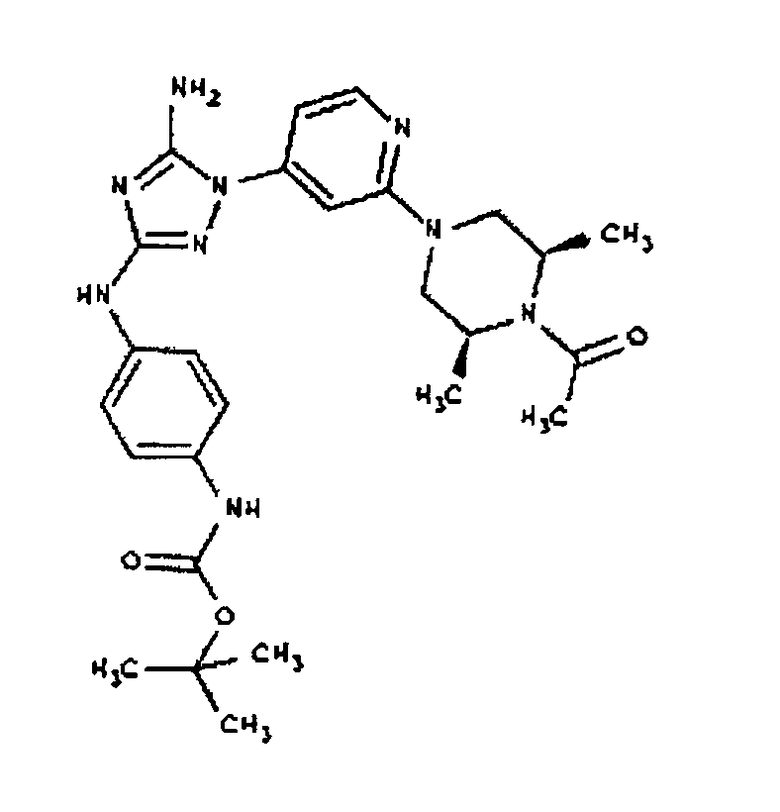
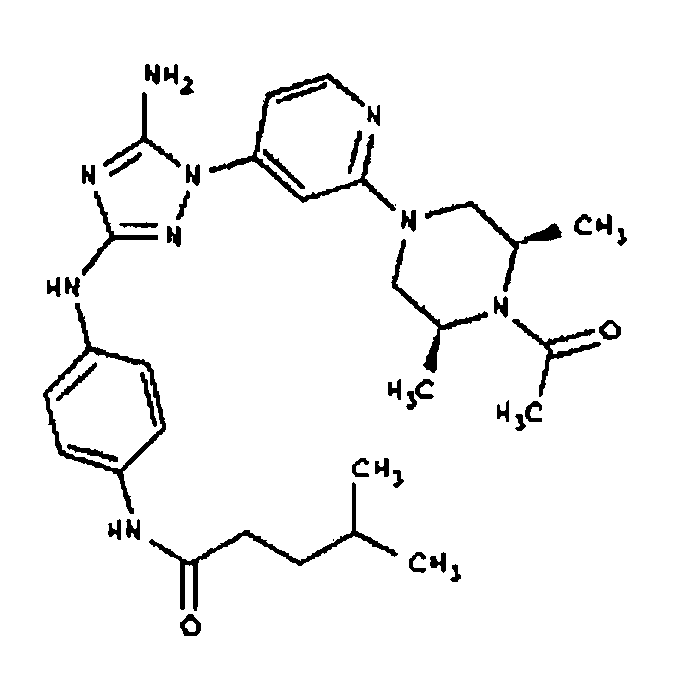
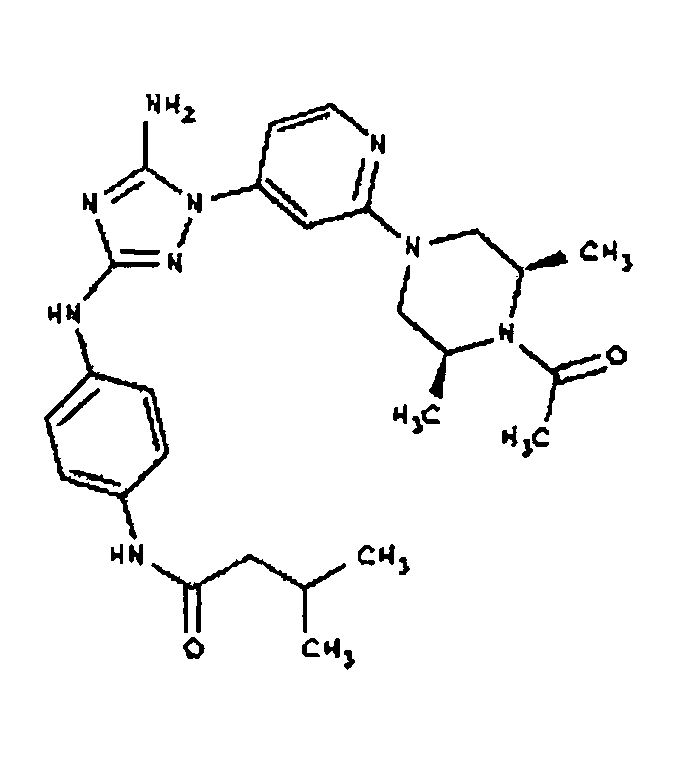
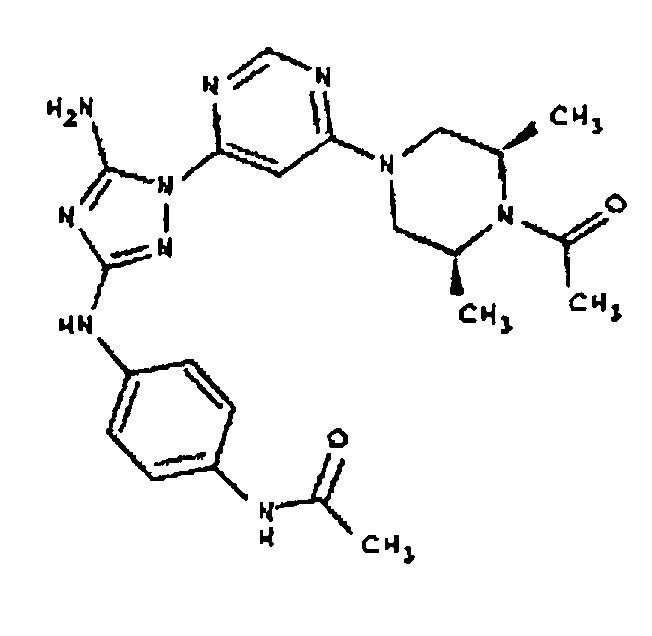
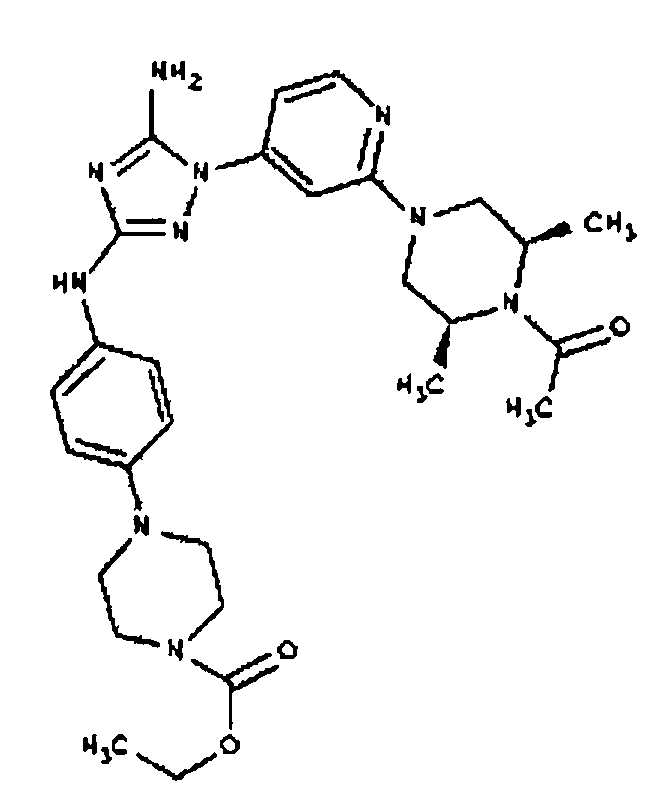
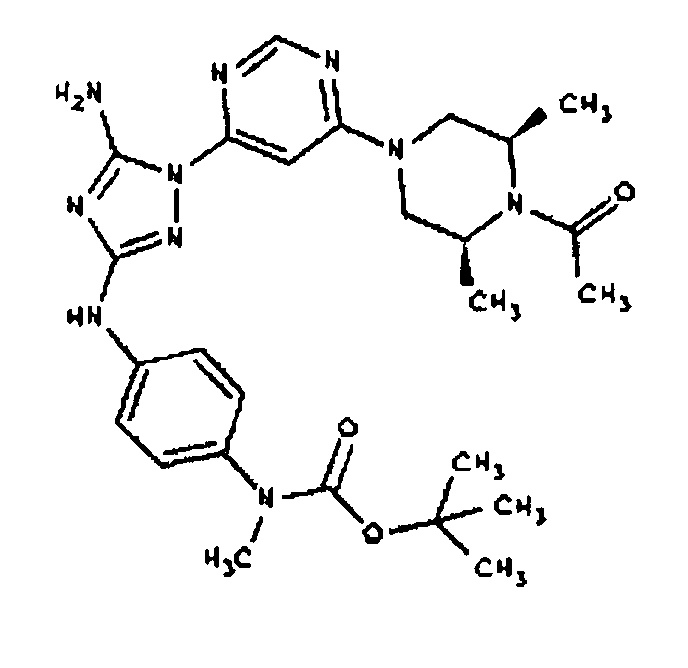
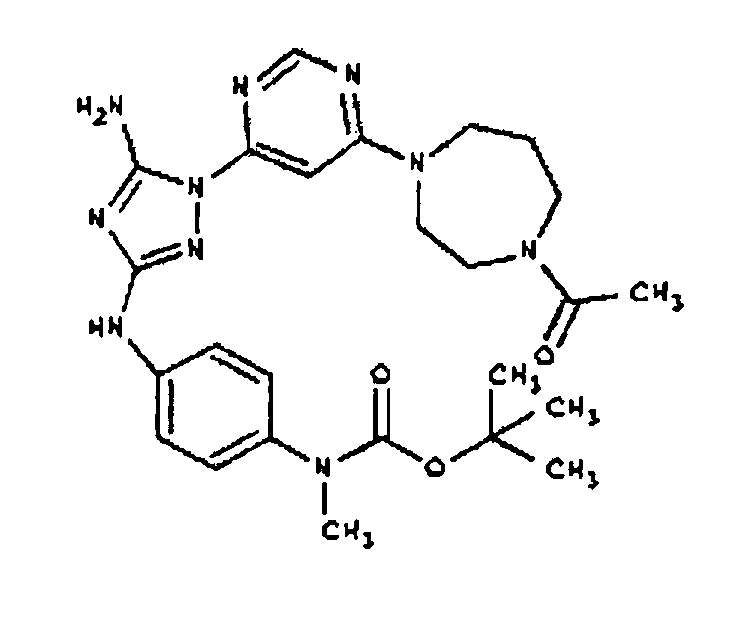
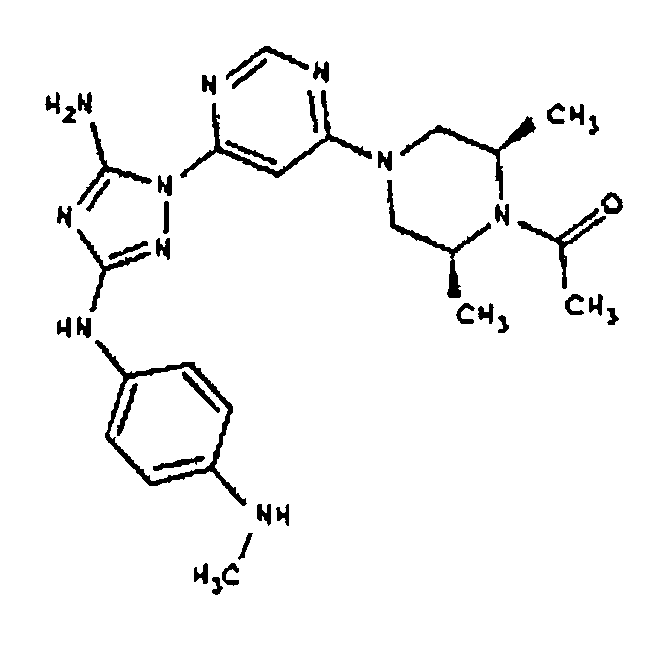
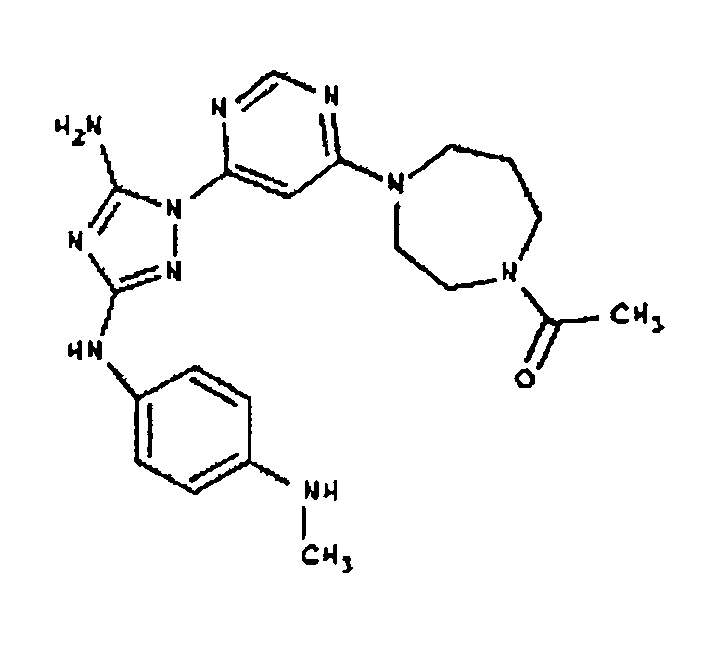
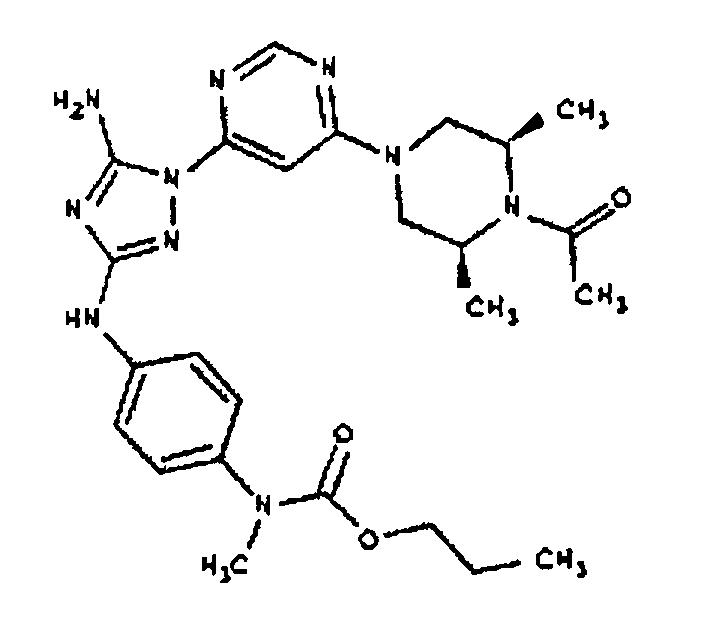
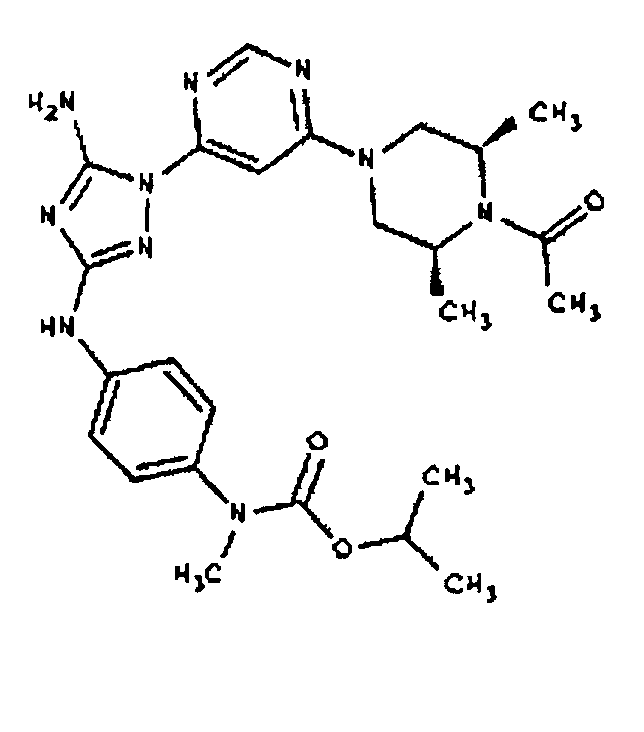
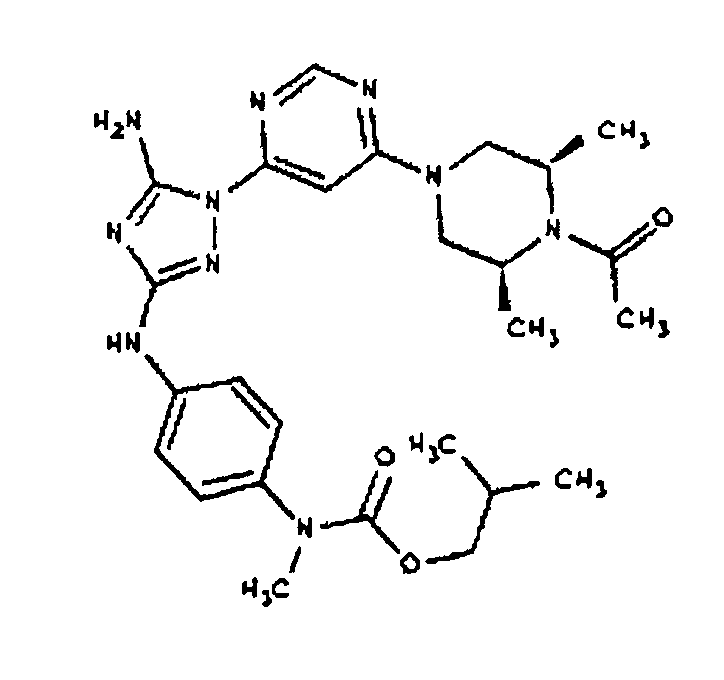
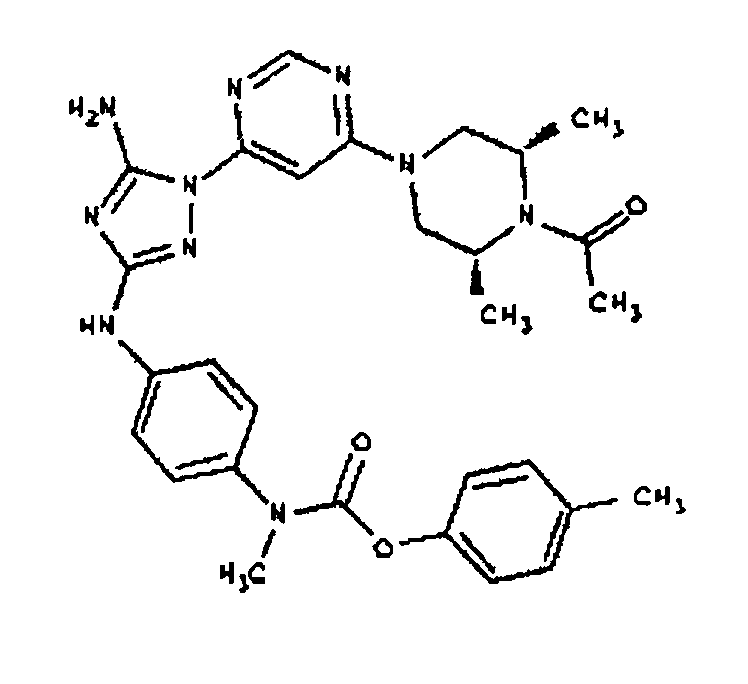
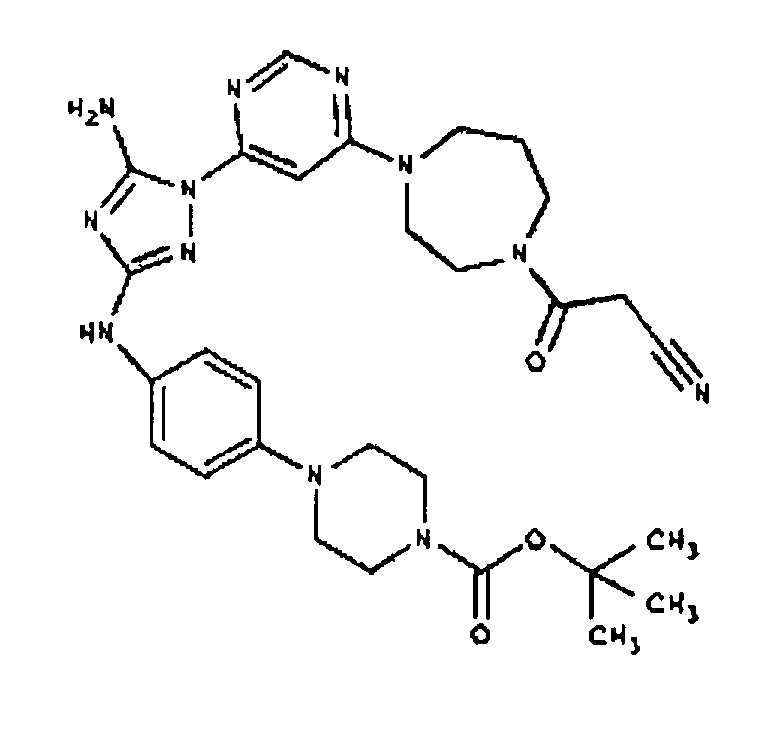
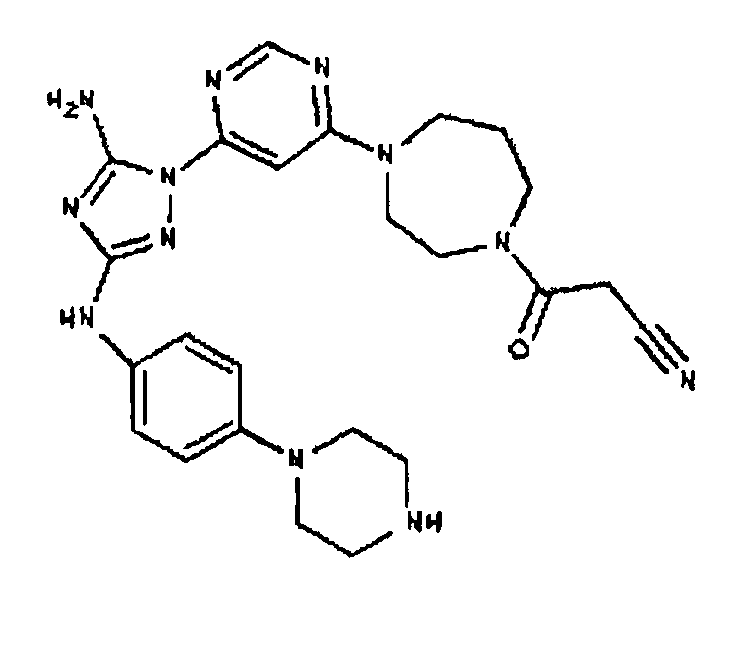
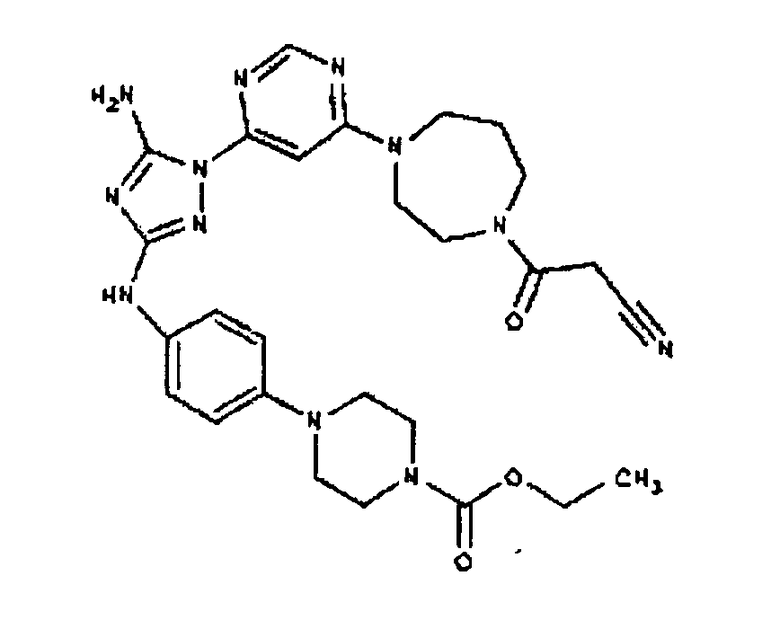
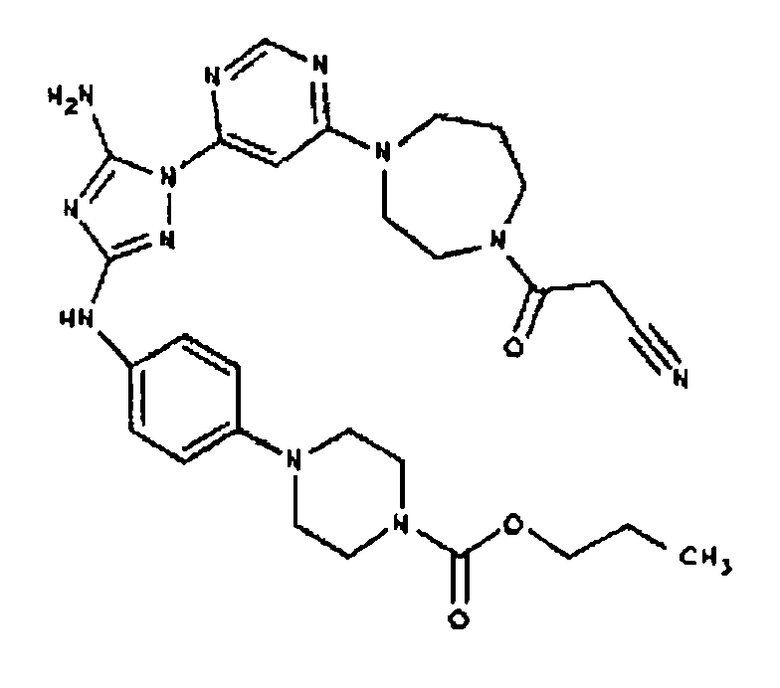
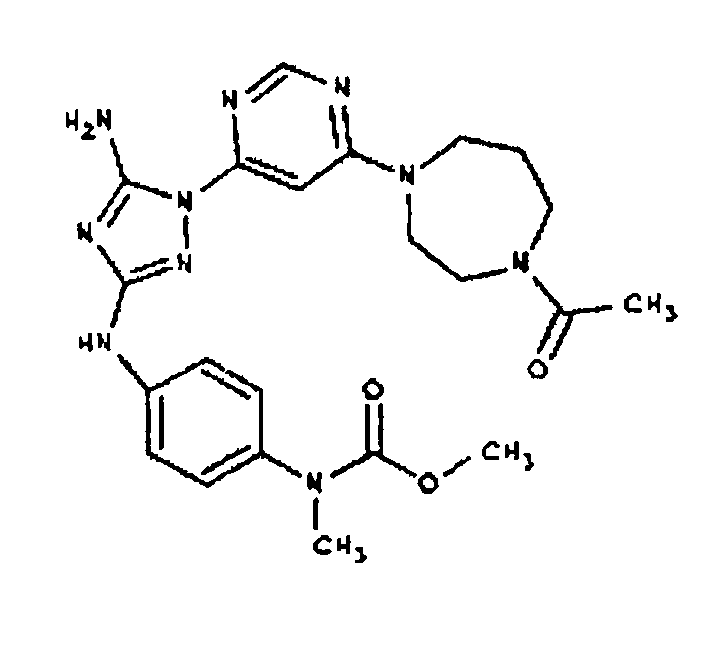
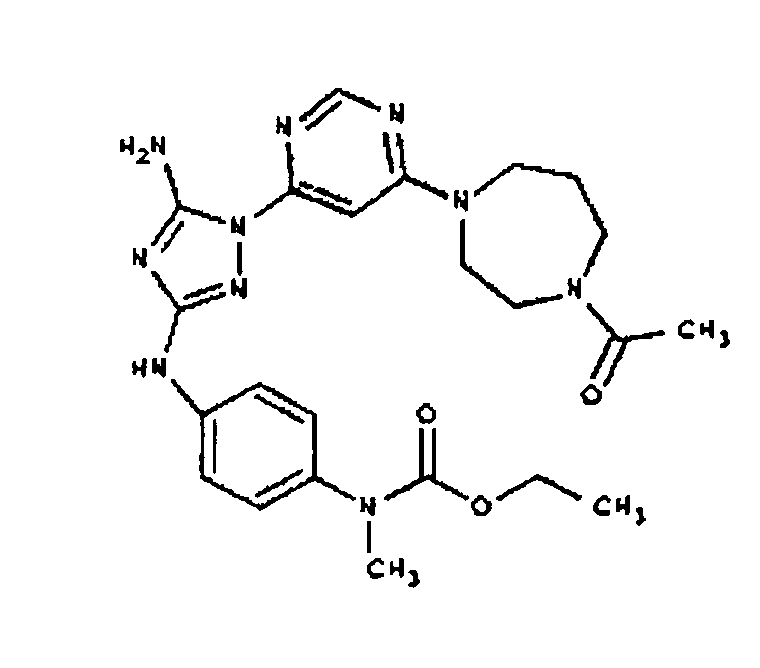
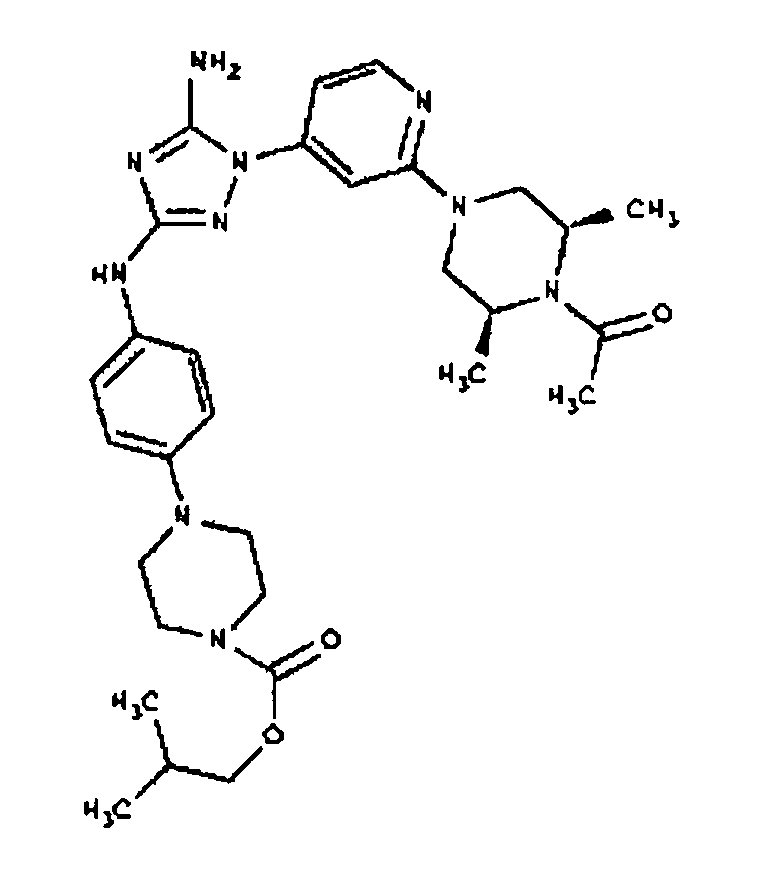
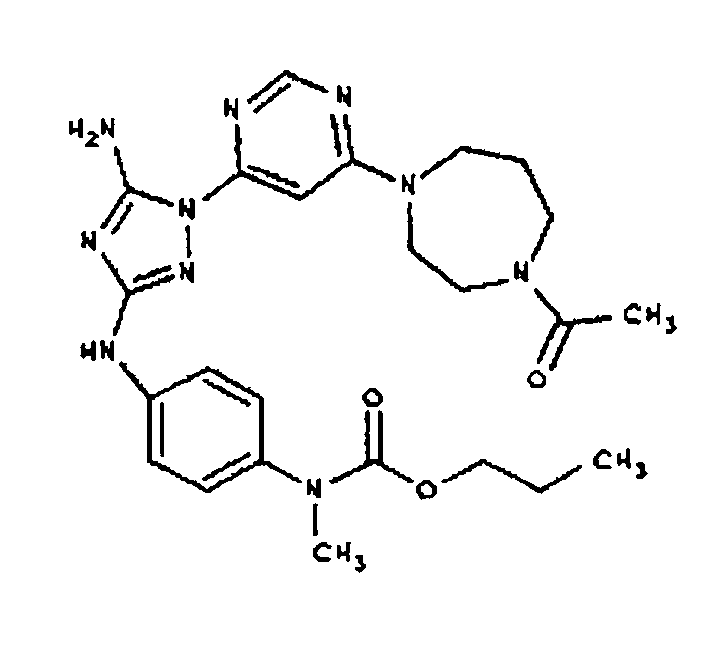
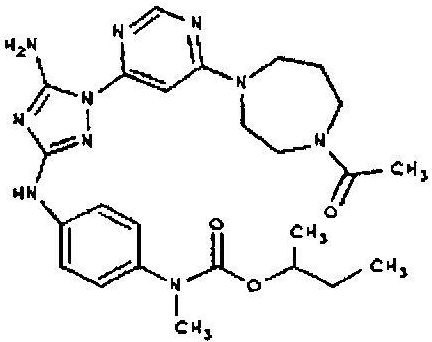
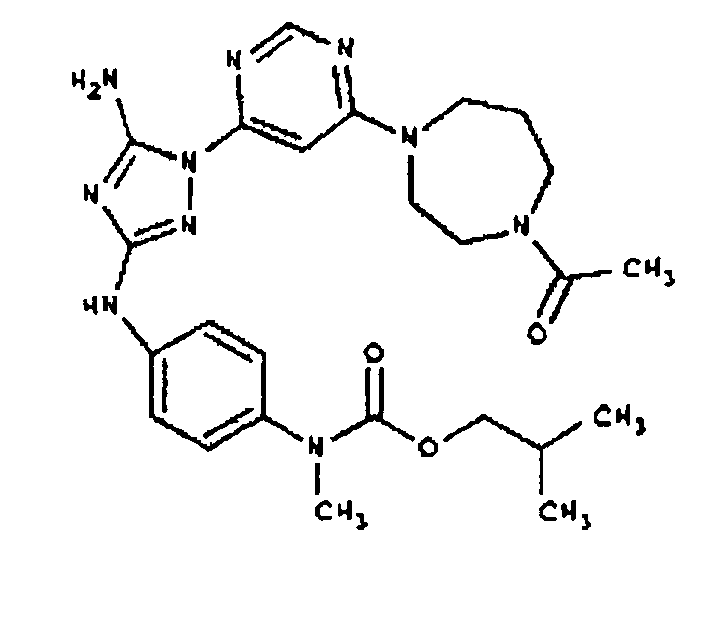
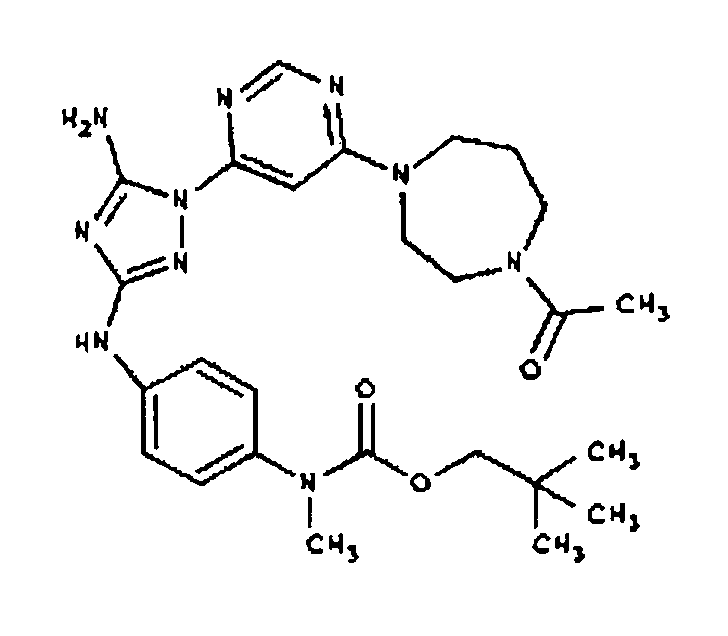

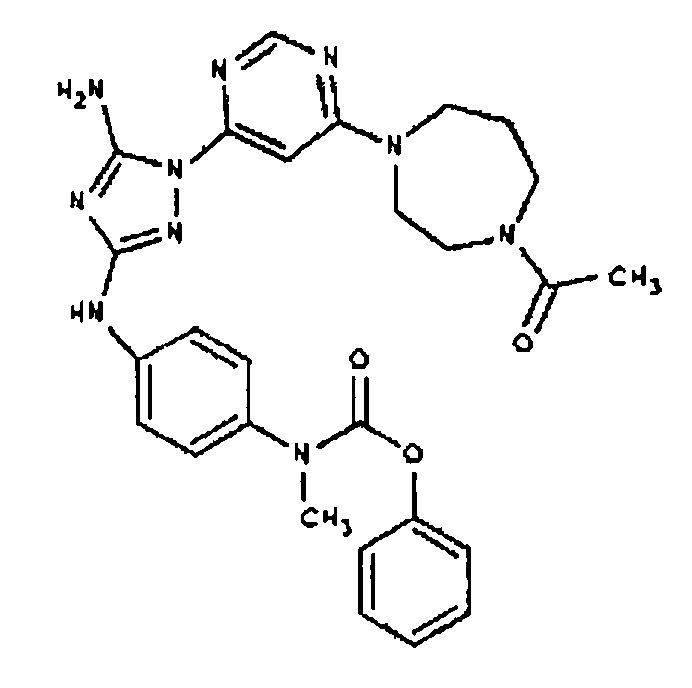
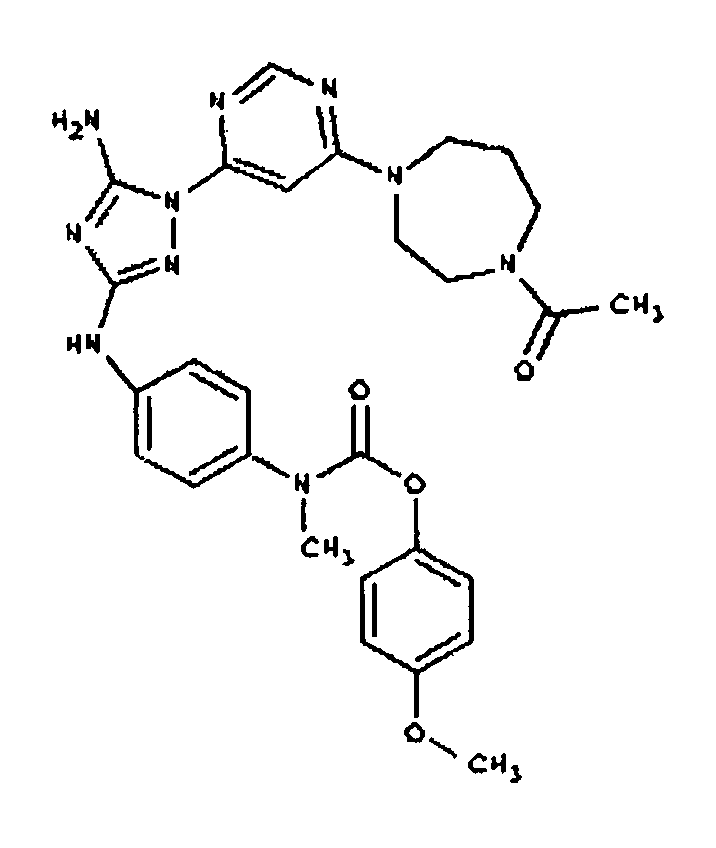
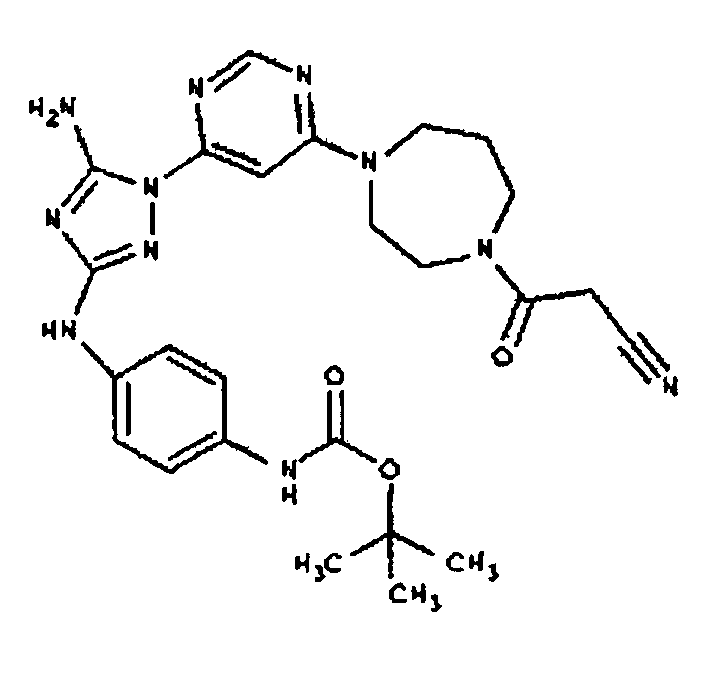
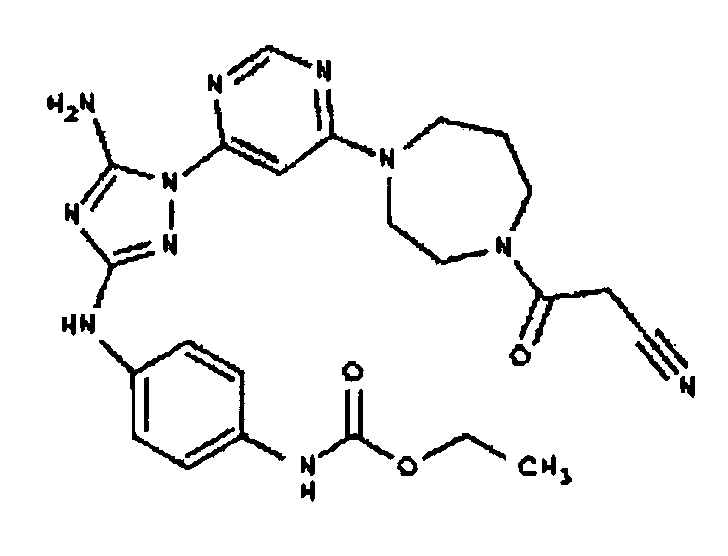
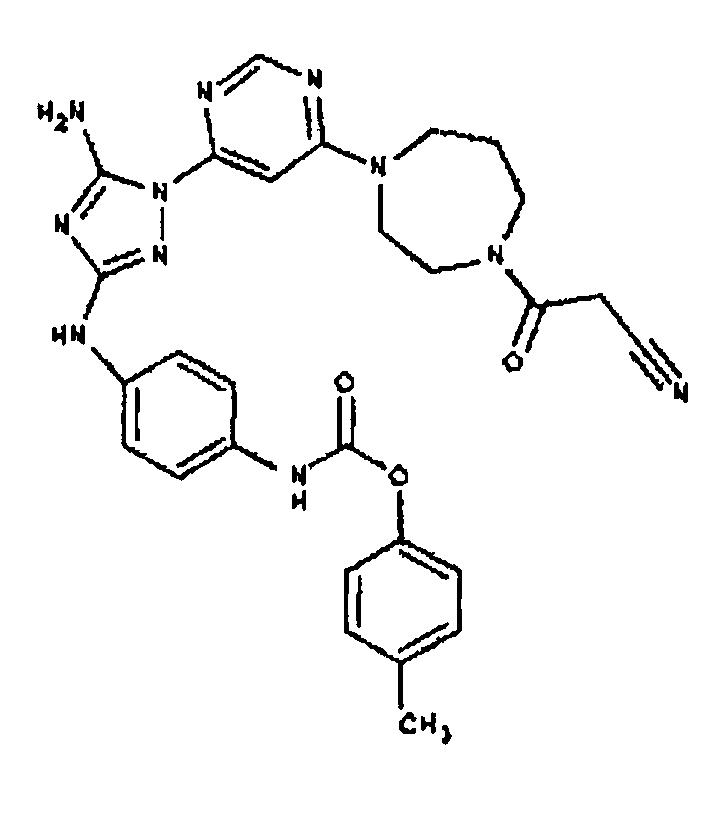
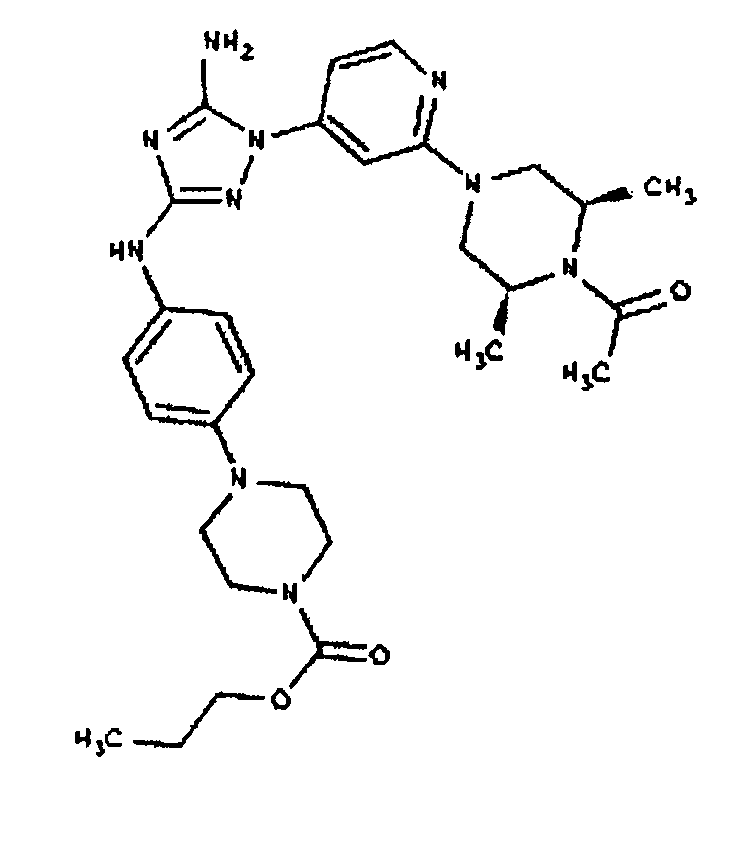
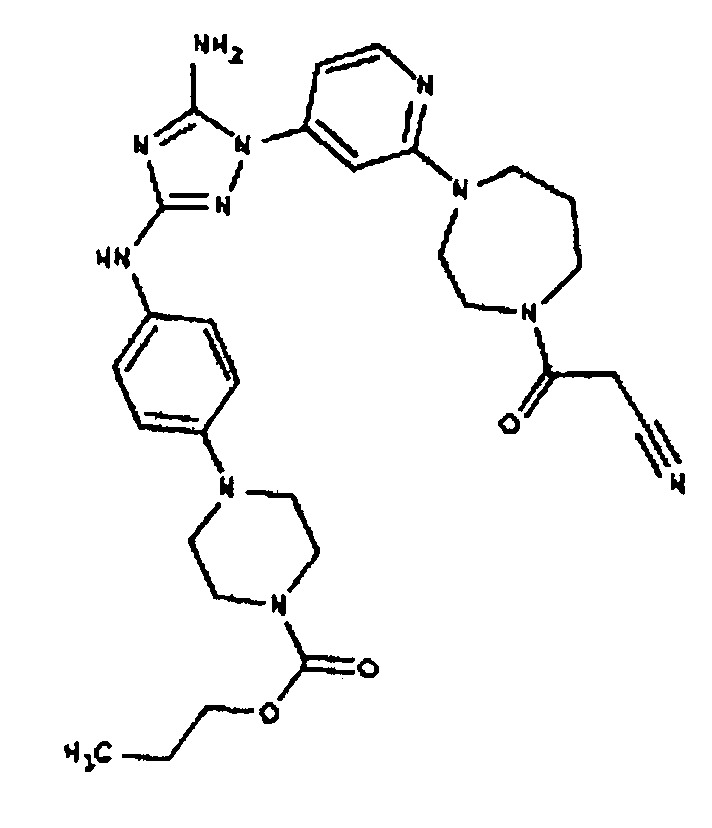
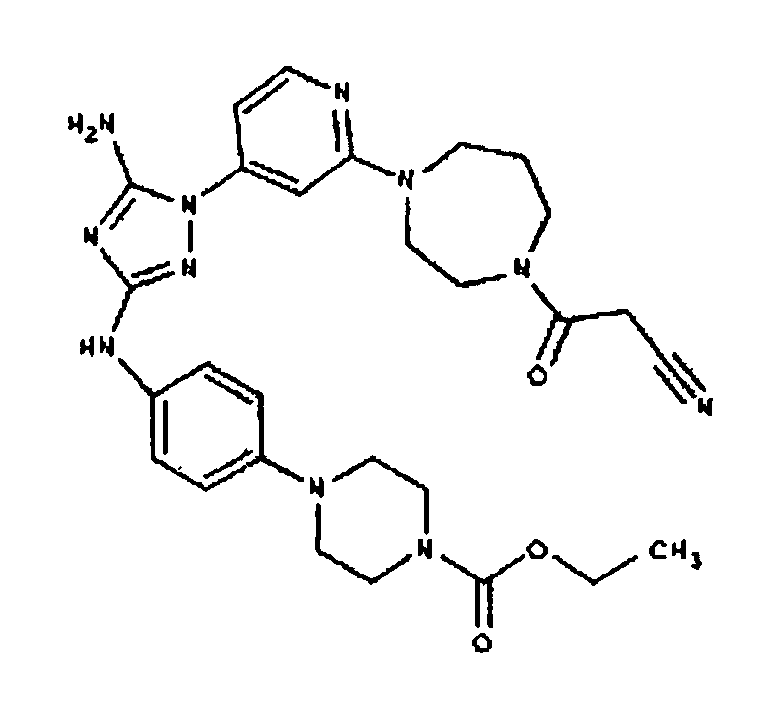
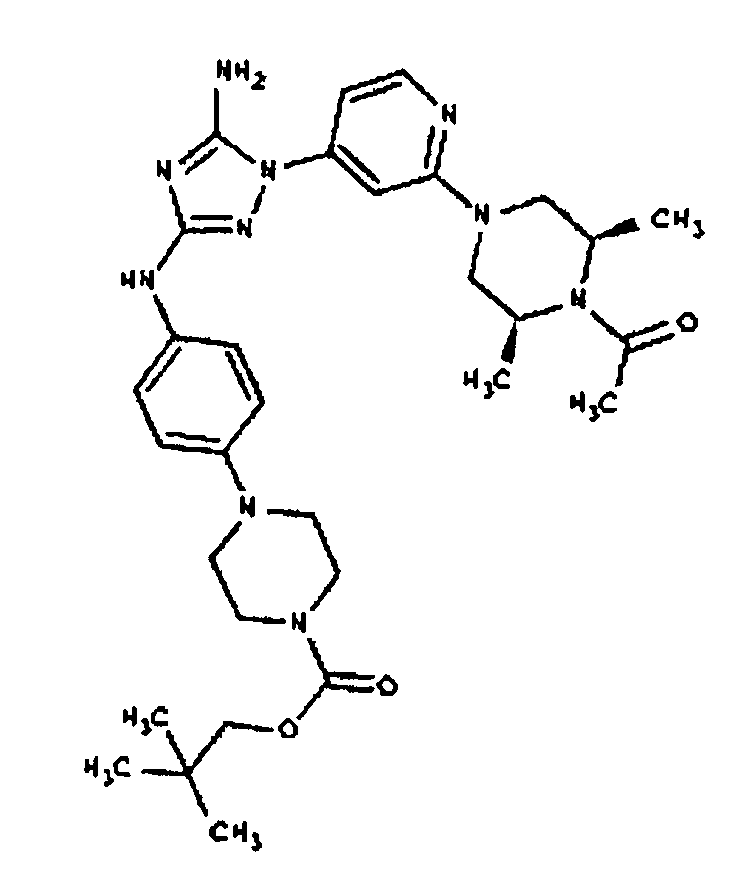
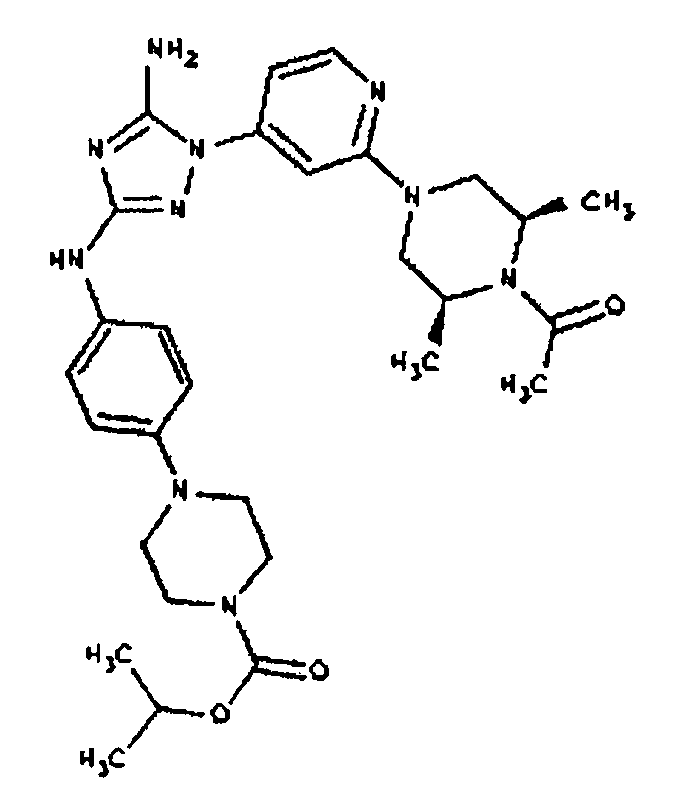

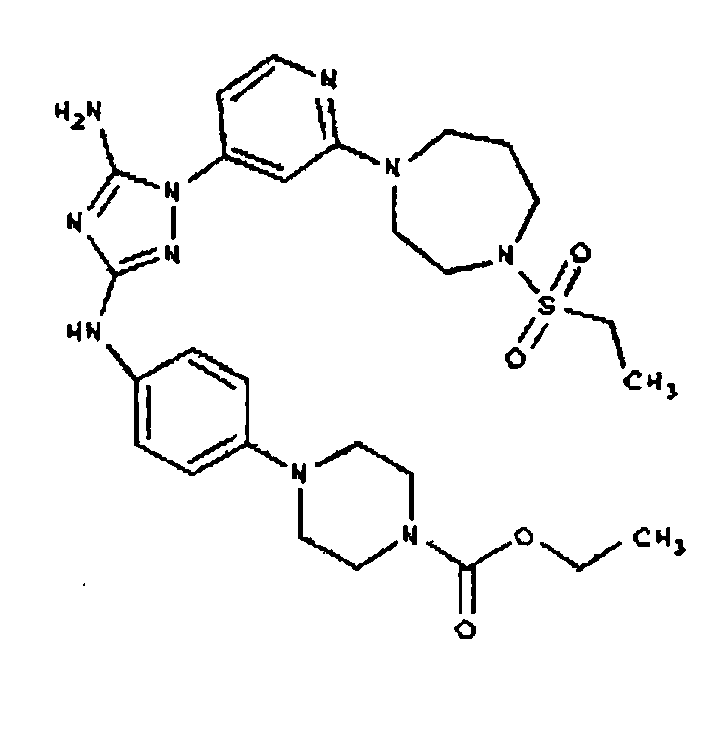
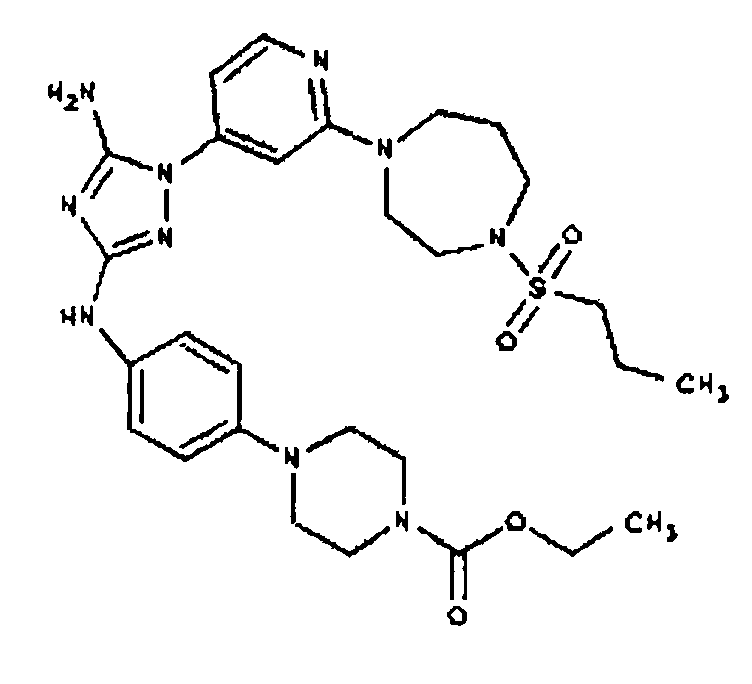
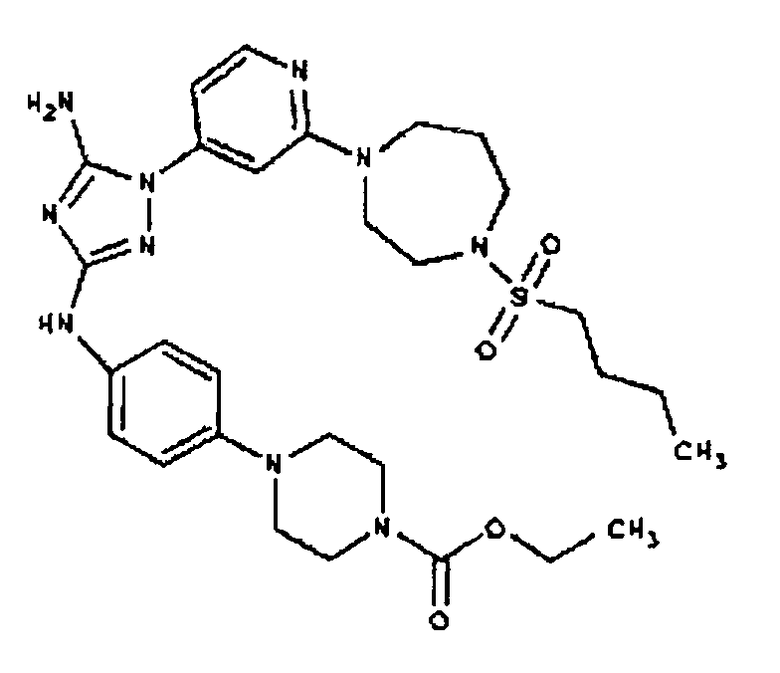
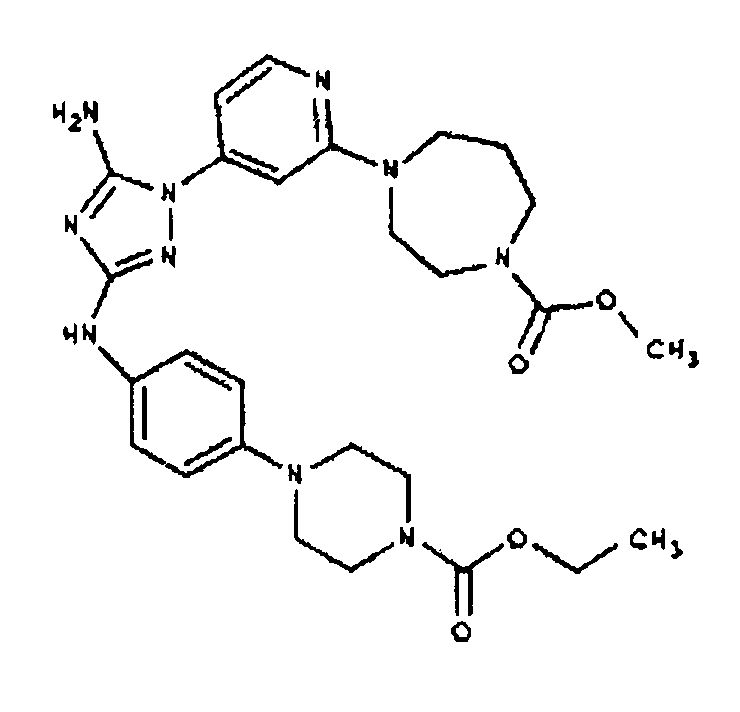
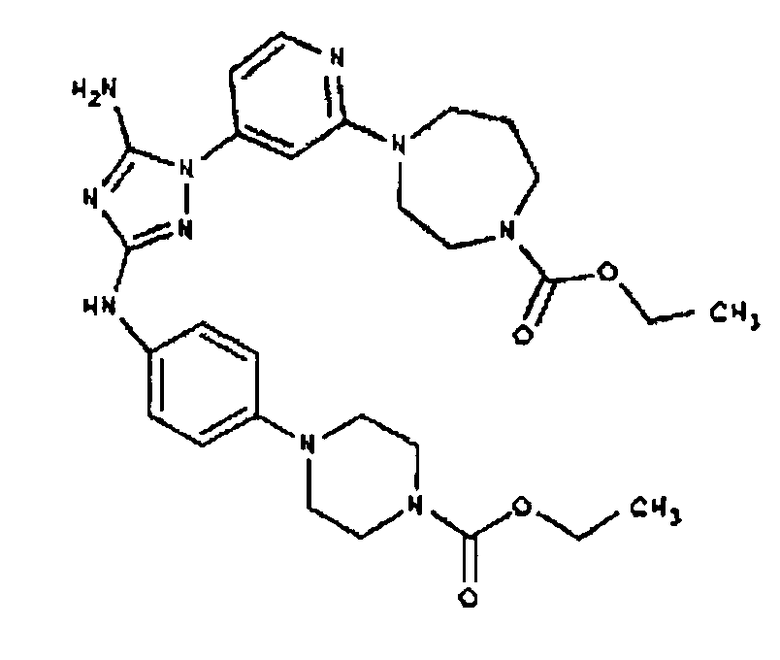
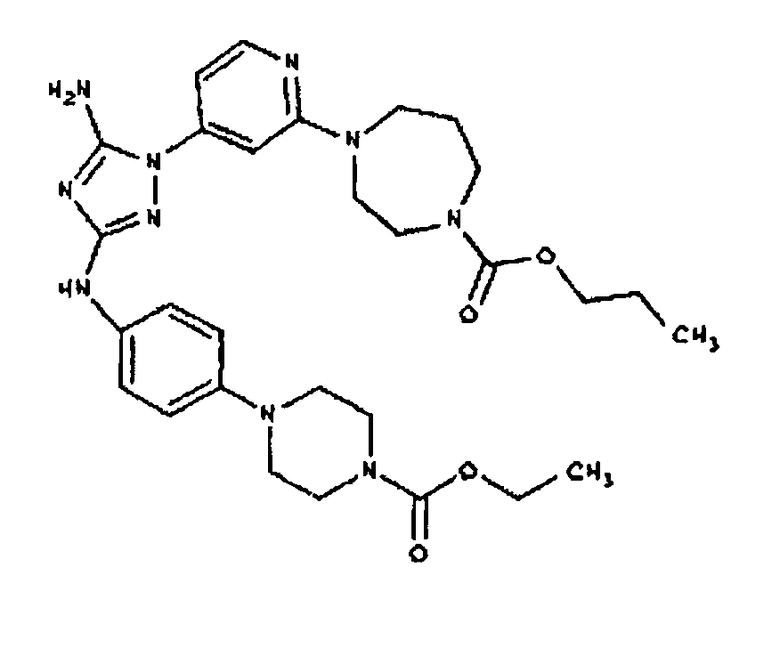
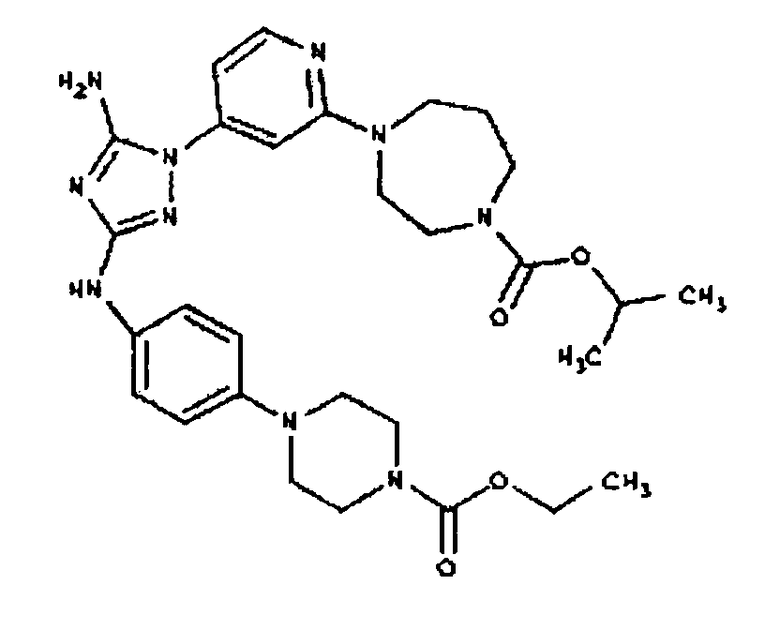
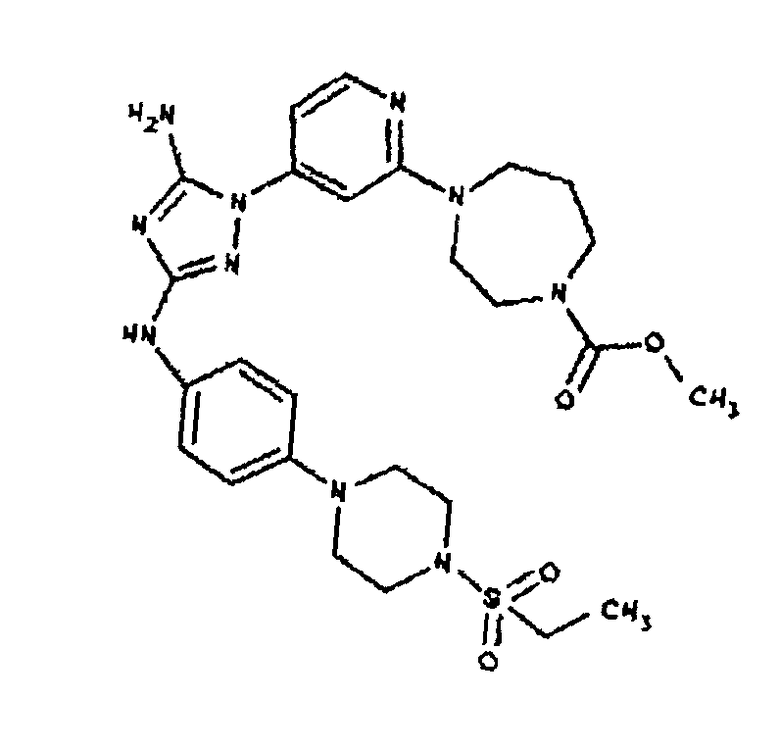
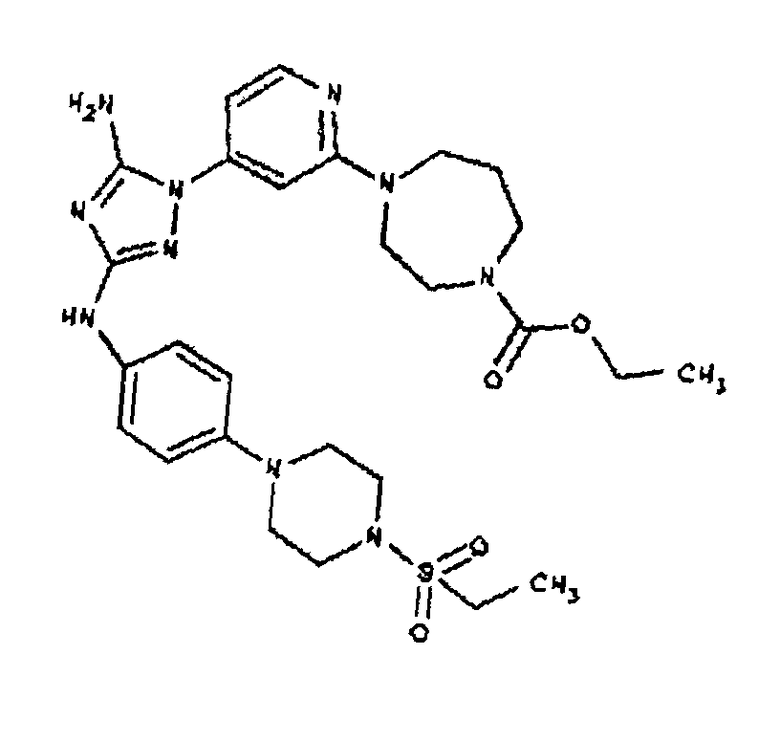
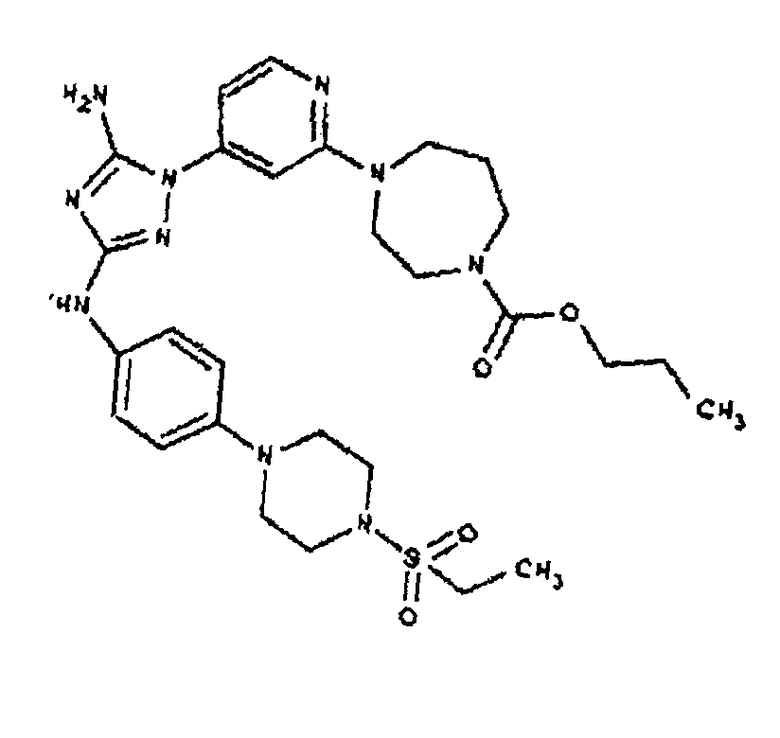

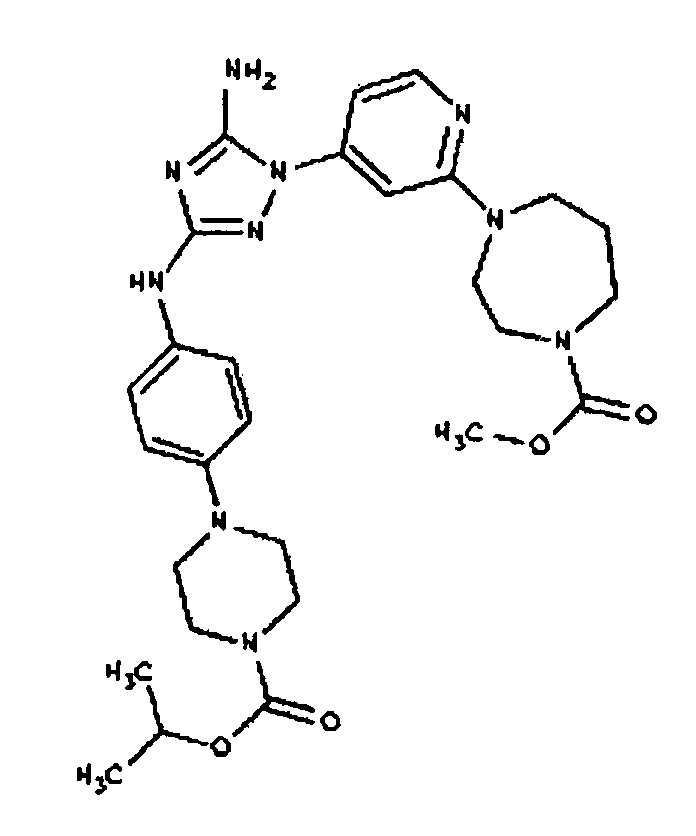
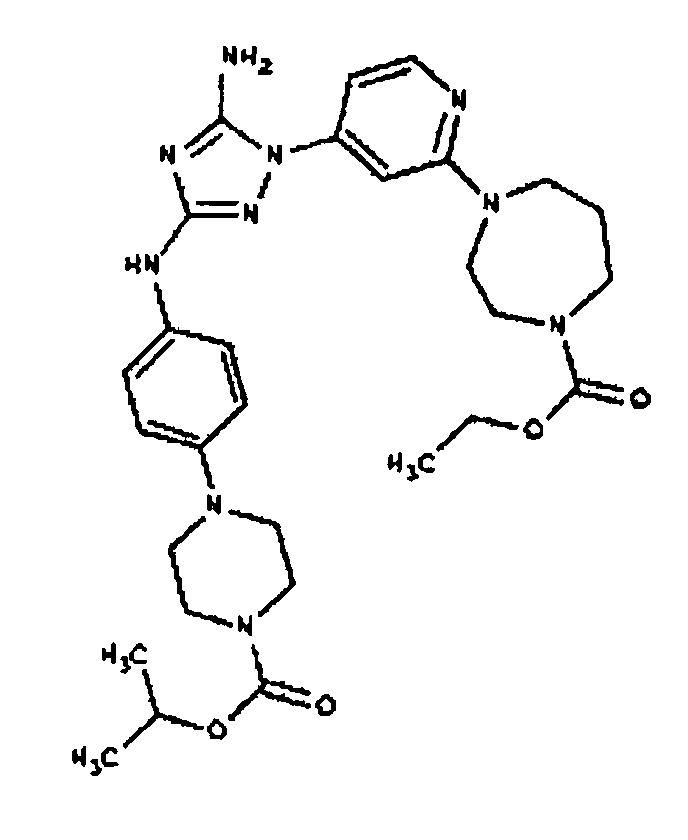
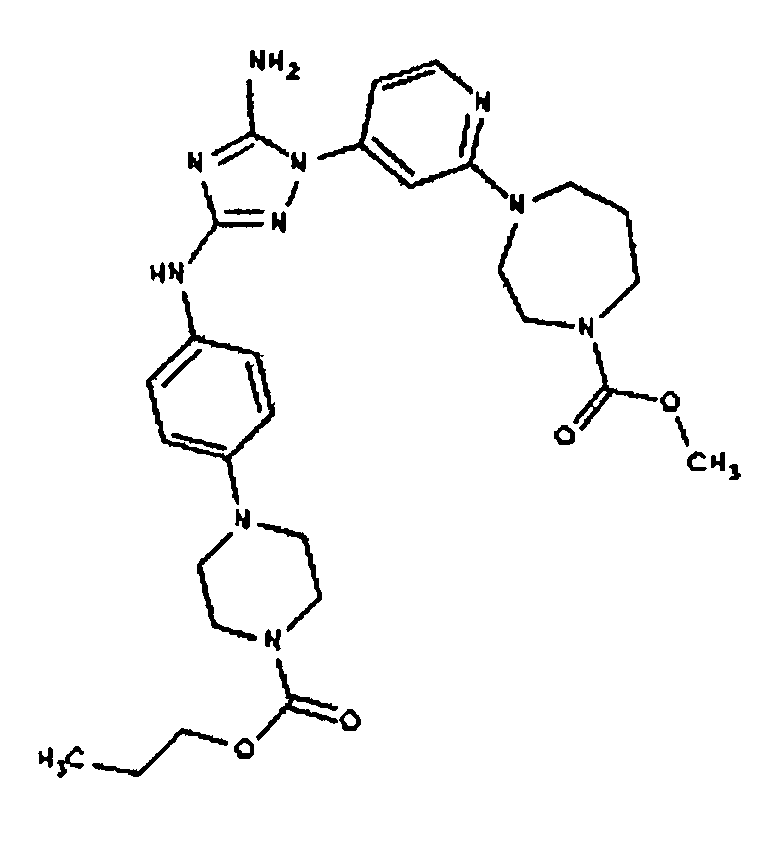
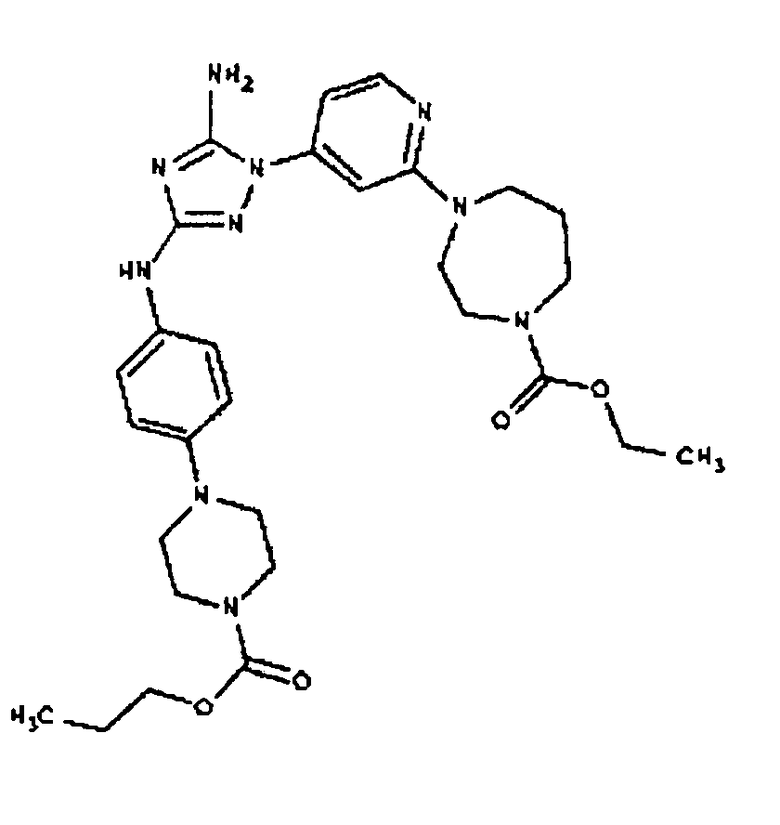
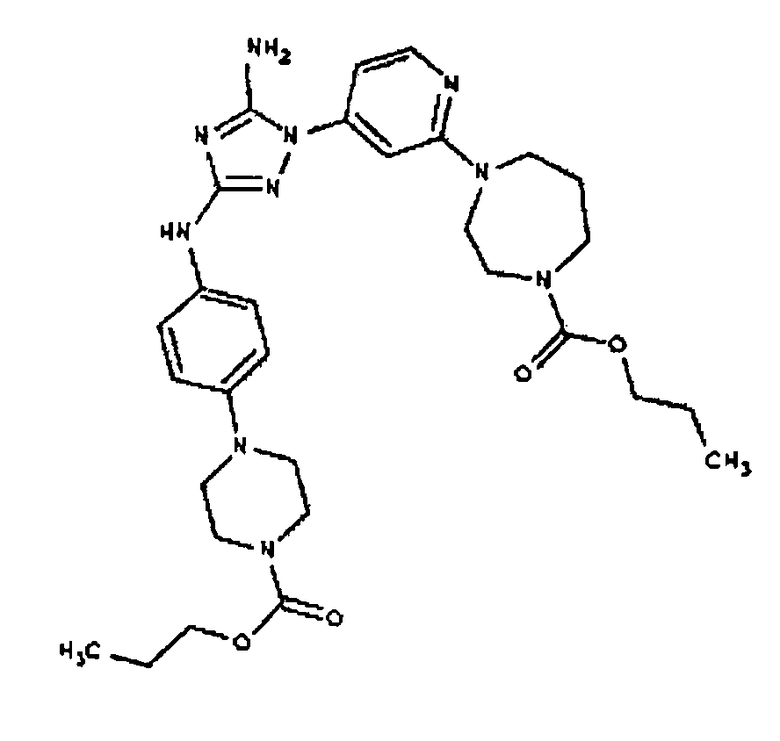
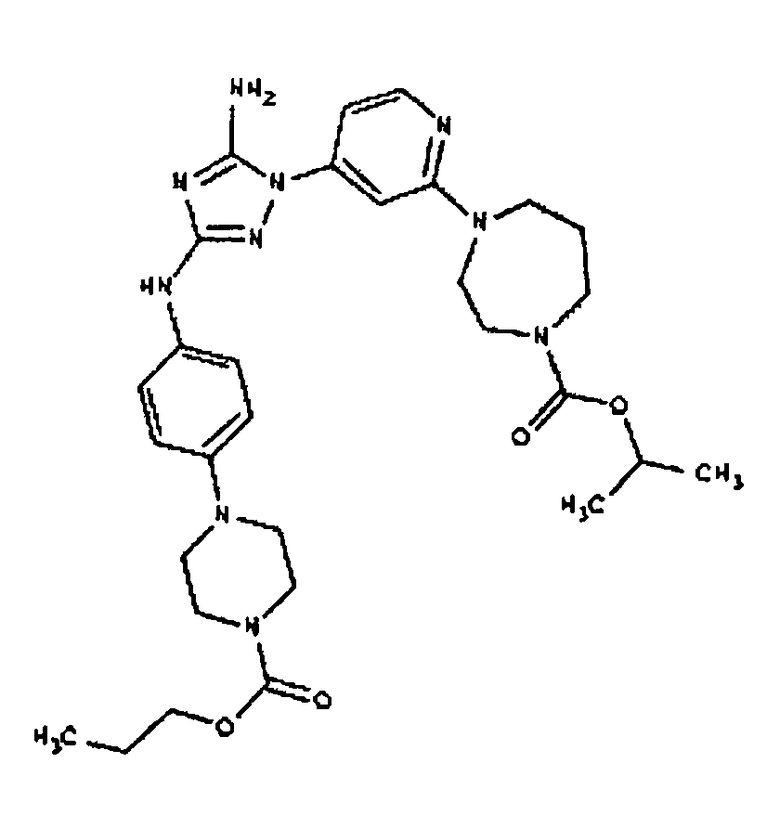
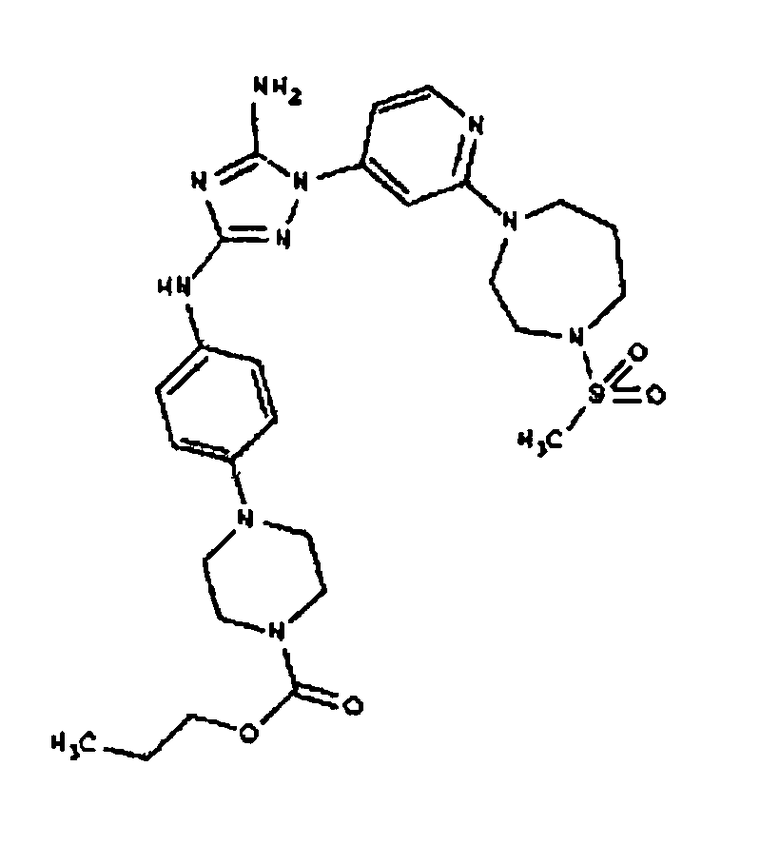
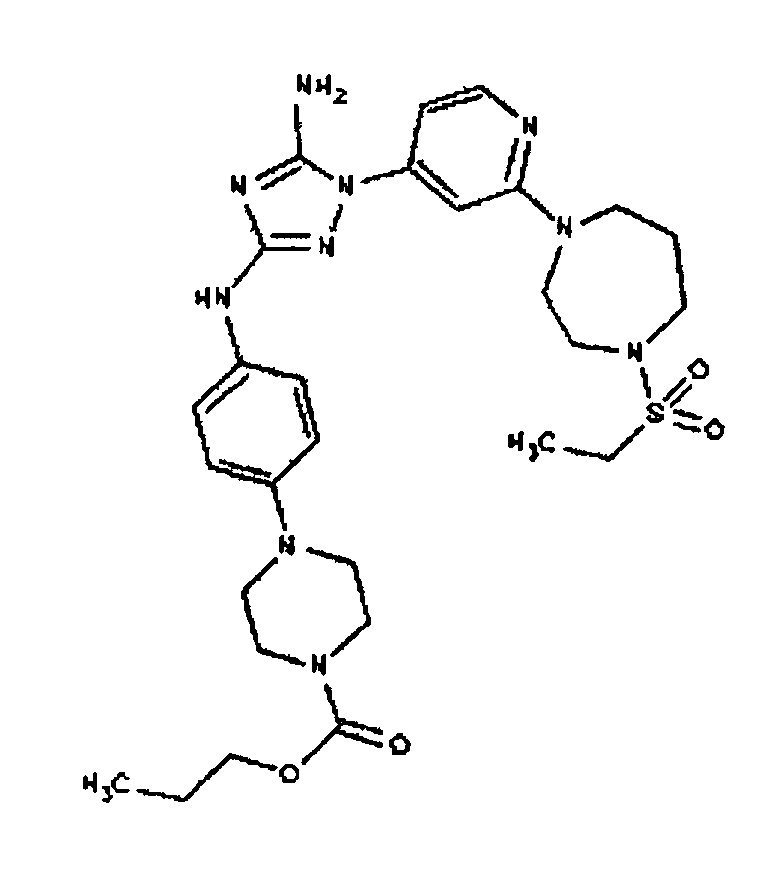
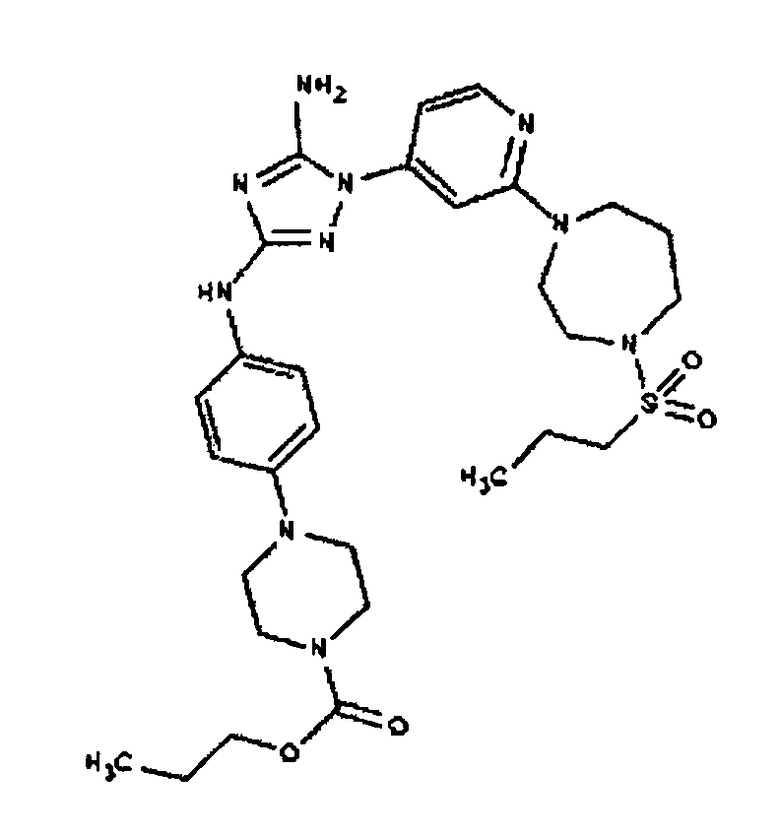
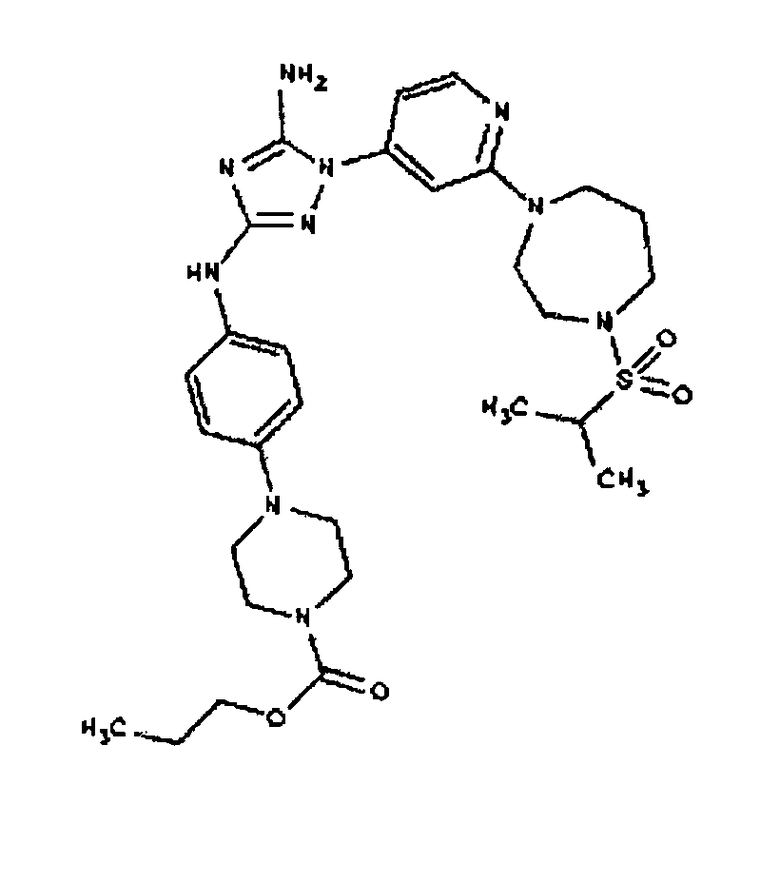
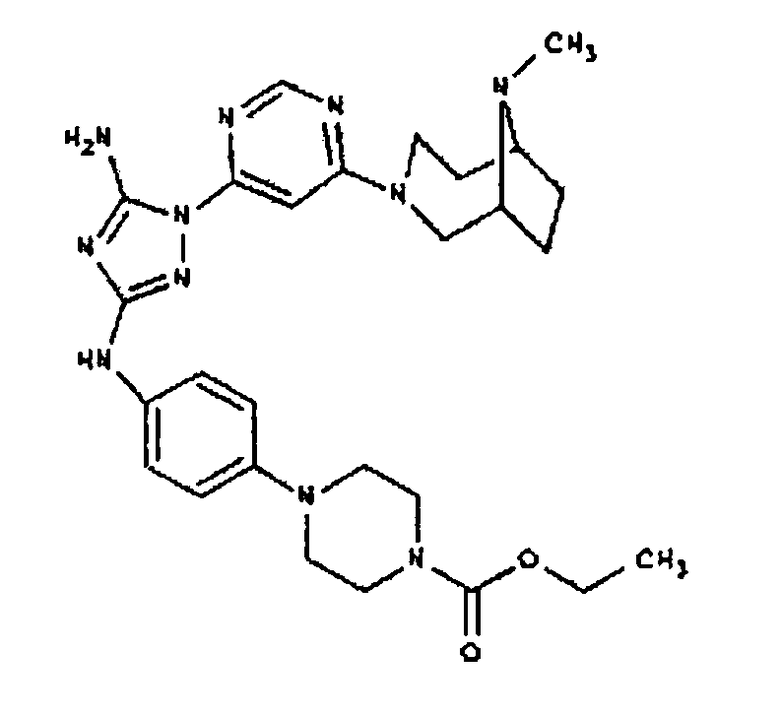
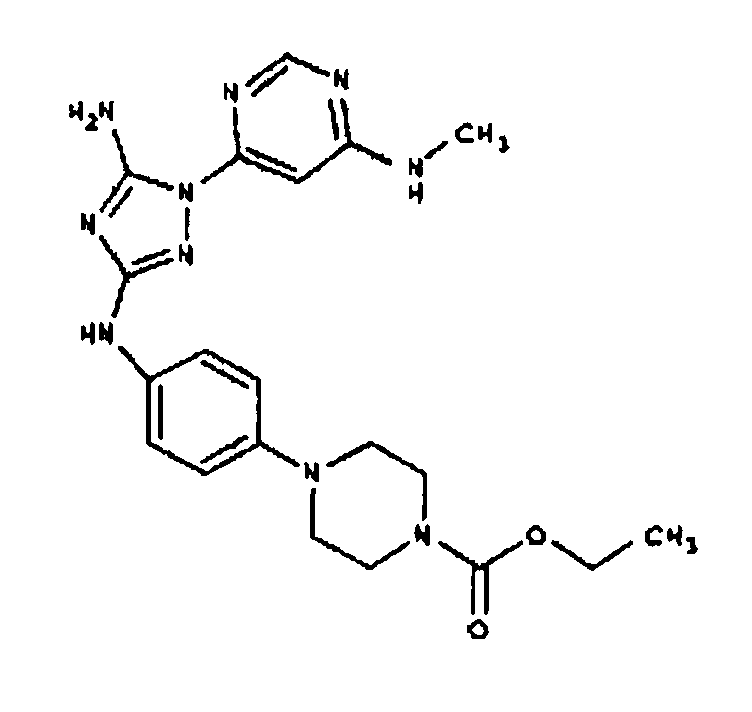
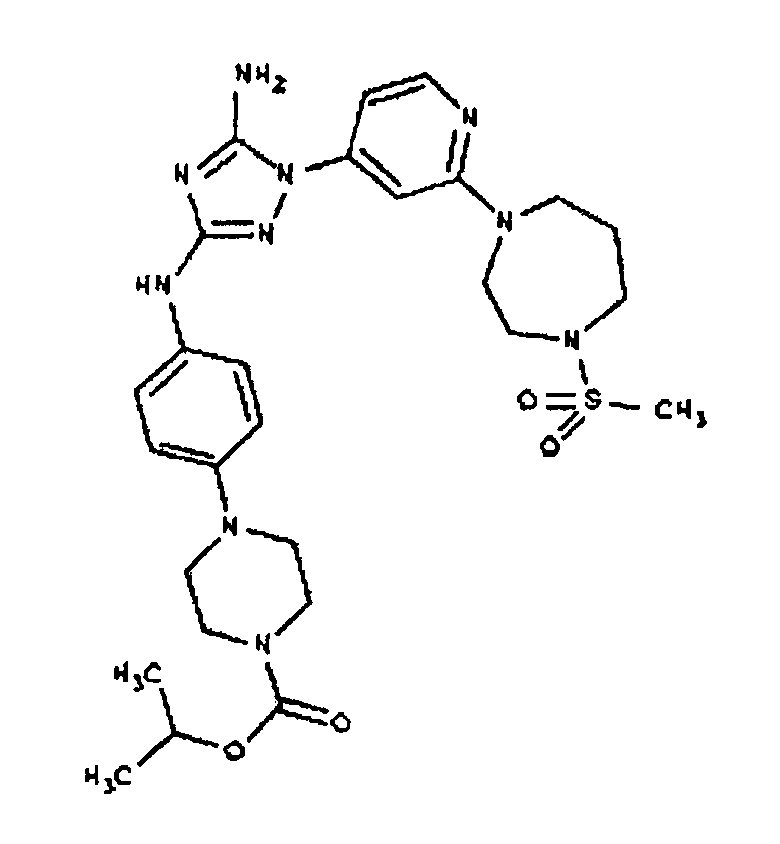
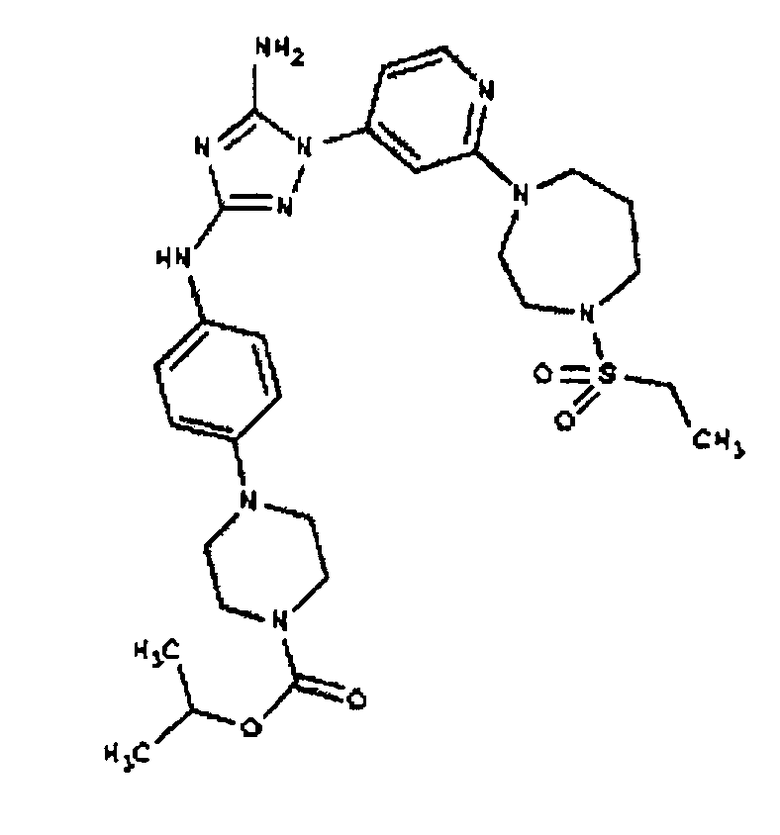
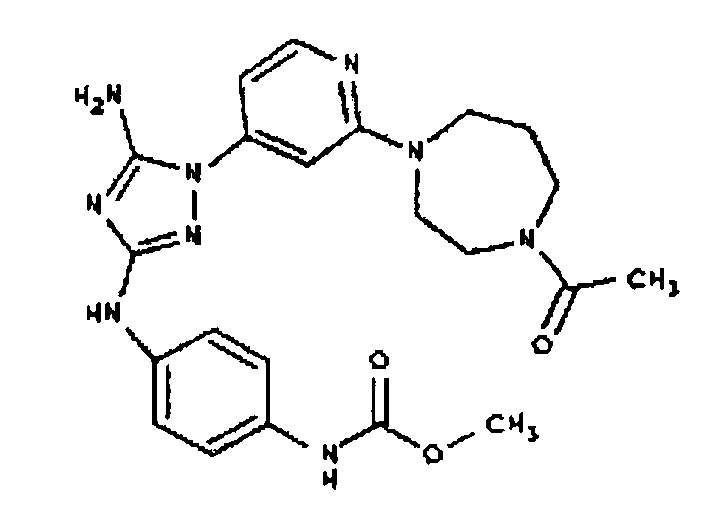
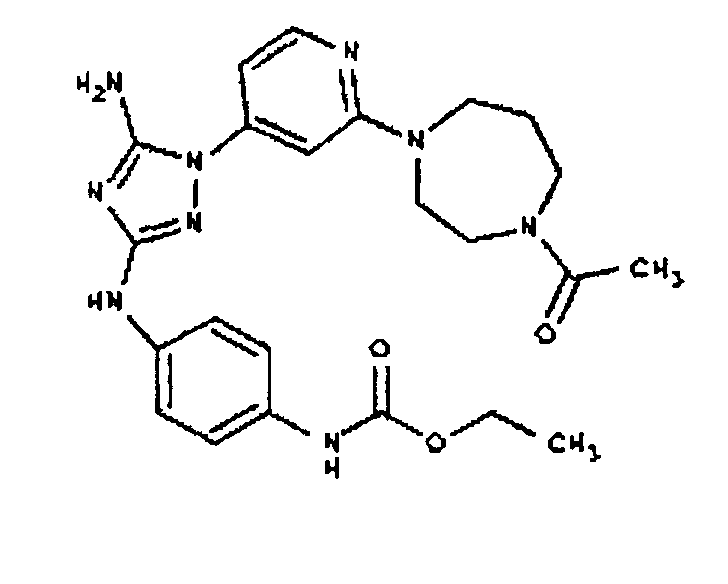
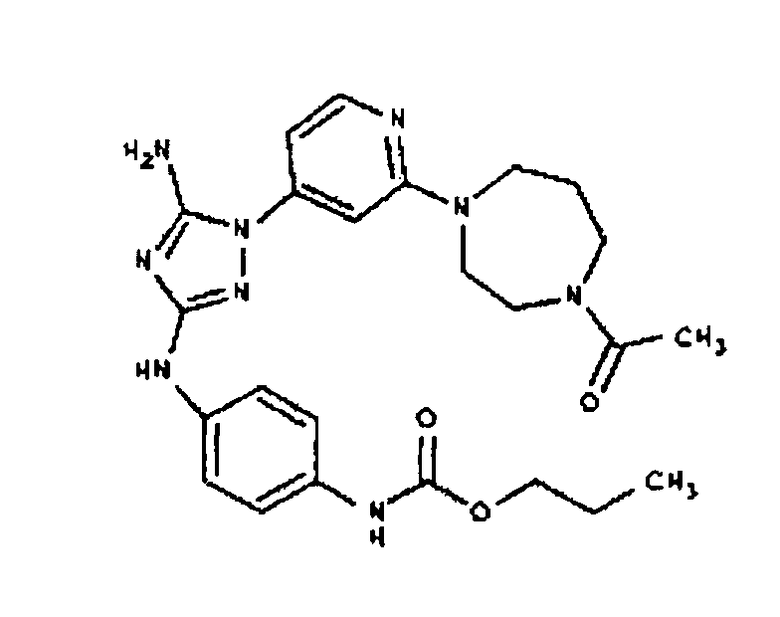
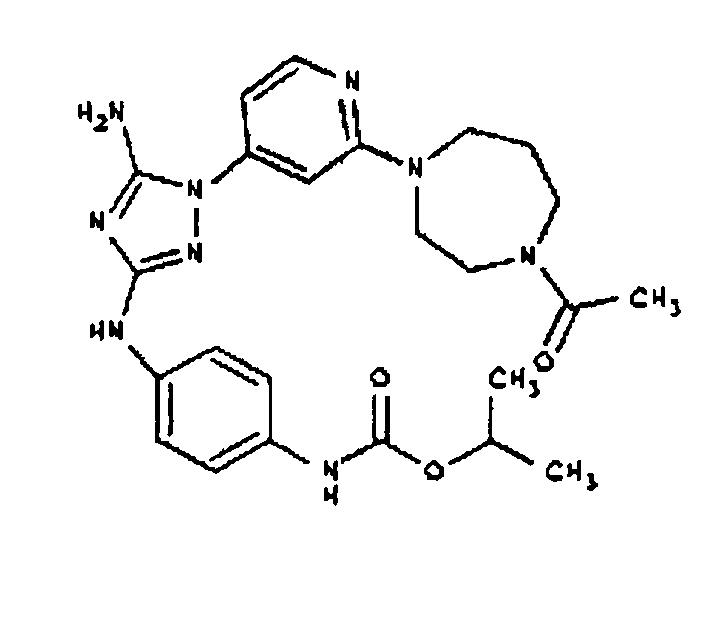
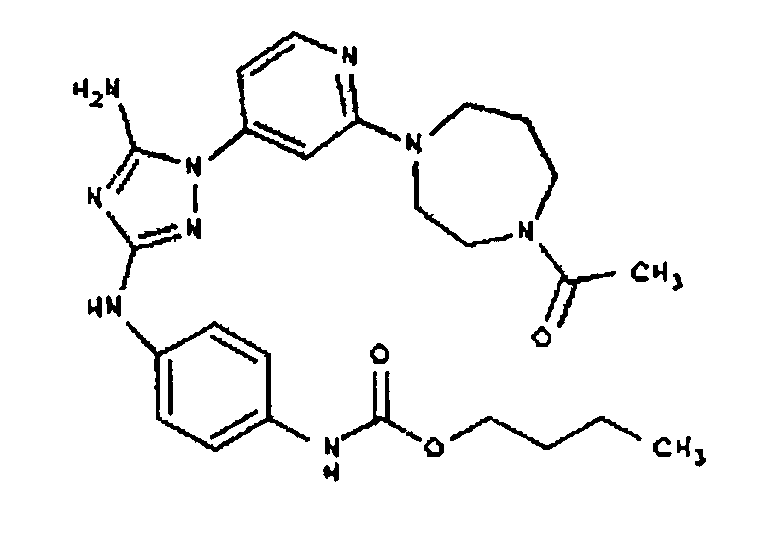
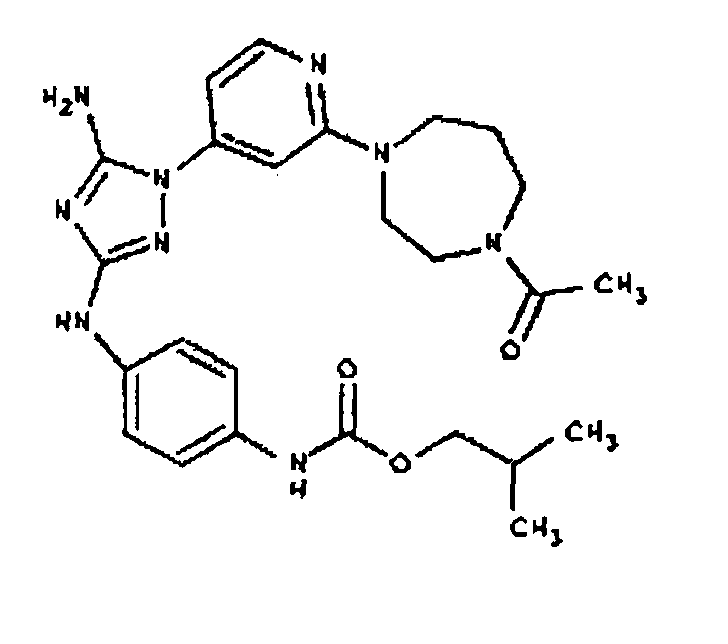
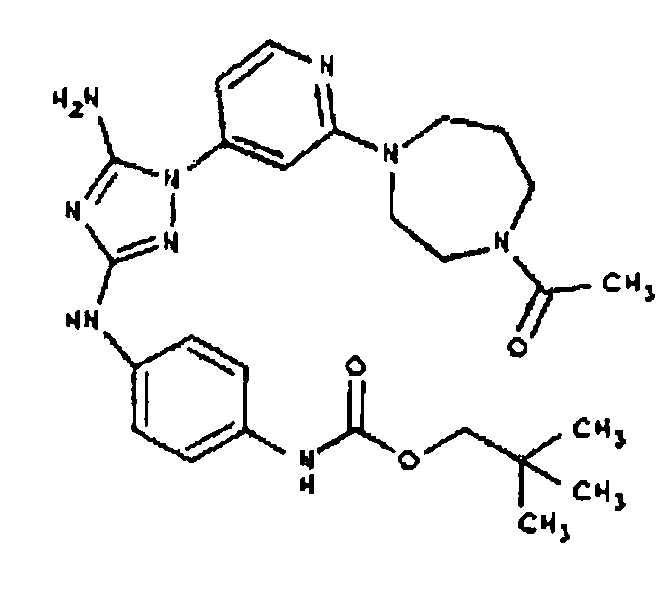
14. Фармацевтическая композиция, ингибирующая протеинкиназы GSK-3, JAK-2, JAK-3, FLT-3, KDR или AURORA-2 и содержащая соединение по любому из пп.1-13 и фармацевтически приемлемый носитель, адъювант или связующее средство.
15. Фармацевтическая композиция по п.14, отличающаяся тем, что, кроме того, содержит дополнительный терапевтический агент, выбранный из химиотерапевтического или антипролиферативного агента, противовоспалительного агента, иммуномодуляторного или иммуносупрессорного агента, нейротрофического фактора, агента для лечения сердечно-сосудистых заболеваний, агента для лечения диабета, агента для лечения иммунодефицитных заболеваний.
16. Фармацевтическая композиция по п.15, отличающаяся тем, что указанный терапевтический агент является иммуномодуляторным или иммуносупрессорным агентом.
17. Способ ингибирования активности киназ JAK2 или JAK3 в биологическом образце, включающий контактирование вышеуказанного биологического образца с соединением по любому из пп.1-13 или с композицией на его основе.
18. Применение соединения в соответствии с любым пп.1-13 или композиции на его основе для производства лекарственного средства для лечения или облегчения тяжести заболевания или патологического состояния, такого как аллергия, астма, аутоиммунное заболевание, отторжение трансплантата, (AML, болезнь Лу Герига), рассеянный склероз (МС), солидное злокачественное новообразование, гематологическое злокачественное новообразование или миелопролиферативное заболевание.
19. Применение по п.18, где заболевание или расстройство является аллергическим или гиперчувствительностью I типа, астмой, амиотрофическим боковым склерозом (AML, болезнь Лу Герига), рассеянным склерозом (МС), отторжением трансплантата, реакцией «трансплантат против хозяина», ревматоидным артритом, лейкозом, лимфомой, истинной полицитемией, эссенциальной тромбоцитемией, хроническим идиопатическим миелофиброзом, миелоидной метаплазией с миелофиброзом, хроническим миелолейкозом, хроническим миеломоноцитарным лейкозом, хроническим эозинофильным лейкозом, гиперэозинофильным синдромом или системным мастоцитозом.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| АЦИЛЬНЫЕ ПРОИЗВОДНЫЕ АЗОЛОНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1995 |
|
RU2152392C1 |
| N-ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ СИНТАЗЫ ОКСИДА АЗОТА | 1998 |
|
RU2241708C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
Авторы
Даты
2012-02-27—Публикация
2005-09-19—Подача