ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Данная заявка утверждает приоритет предварительной заявки США No. 60/778516, поданной 1 марта 2006.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам лечения рака у пациентов, включающим введение активированных цитотоксических Т-лимфоцитов, цитокинов, таких как IL-2 и IFN-α-2b, и кладрибина или денилейкин дифтитокса в качестве лимфоистощающего вещества.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Для облегчения понимания изобретения данный раздел можно рассматривать в качестве исторических и технических предпосылок, приведших к разработке изобретения, включающих наблюдения, заключения и точки зрения, которые могут быть присущими авторам. Соответственно положения предпосылок здесь не следует истолковывать в качестве допущения в отношении содержания прототипа.
Для лечения многообразия злокачественных новообразований был разработан ряд терапевтических схем. Многие из этих попыток были сконцентрированы вокруг химиотерапевтических режимов. В одном конкретном комбинированном химиотерапевтическом режиме, предназначенном для лечения метастатической меланомы, уровни ответа в 35-50% отмечались при «дартмутском режиме» (с комбинированием DTIC, цисплатина, BCNU и тамоксифена), однако продолжительность жизни выживших осталась в пределах от 6 до 10 месяцев. Также сообщалось о высоких уровнях достижения ремиссии при сильнодействующей высокодозовой интенсивной химиотерапии1 и насыщении гемопоэза при помощи аутогенного трансплантата костного мозга. Тем не менее усредненная продолжительность жизни была короткой, приблизительно четыре месяца2.
Значительные сдвиги в продолжительности жизни порядка нескольких лет были отмечены у небольшой части пациентов с меланомой, подвергшихся определенным видам иммунотерапии. Эти виды включают интенсивную специфическую иммунотерапию при помощи антиканцероматозной вакцины, а также использование неспецифических помощников иммунной системы, таких как интерлейкин-2 (IL-2) и интерферон-α (IFN-α).3-5
Идентифицирование распознаваемых Т-клетками опухолевых антигенов в меланоме привело к клинической проверке, которая выявляла раковые клетки путем попытки усиления антиген-специфического клеточного иммунного ответа. Такому подходу следовали в многочисленных стратегиях вакцинации, при которых антигены представляют в иммуногенном контексте в попытке индуцировать потенциальные Т-клеточные ответы in vivo. Несмотря на то, что в исследованиях с вакцинами были отмечены некоторые клинические ответы, величина вызванных Т-клеточных ответов была в большинстве случаев низкой или не определялась, и слабо коррелировала с клиническими ответами. Иммунизация меланомных пациентов раковыми антигенами может увеличивать число циркулирующих предшественников ЦТЛ; однако это не коррелировало с клинической регрессией опухоли, что дает возможность предположить нарушение функции или активации in vivo.
Исследования в модельных системах на мышах продемонстрировали, что адоптивная иммунотерапия, которая включает в себя in vitro-иммунизацию Т-клеток, специфических для одного или нескольких опухолевых антигенов, может быть эффективна при минимальной токсичности. Препятствием для применения этой стратегии для лечения опухолей человека стало выявление иммуногенных антигенов, которые представляют опухолевые клетки, чувствительные к ЦТЛ-обусловленному разрушению. Выделение реагирующих на опухоль Т-клеток из меланомы пациентов привело к идентифицированию некоторых опухолевых антигенов (эпитопов), на которые направлены ЦТЛ. Эти антигены включают тирозиназу, MART-1/Melan A, gp100 и MAGE. Из них тирозиназа и MART-1 экспрессируются в меланоме почти повсеместно и, таким образом, представляют требуемый выбор мишени для адоптивной иммунотерапии.
Адоптивная Т-клеточная терапия включает в себя извлечение Т-клеток из организма хозяина, где у онкологических больных активирован механизм индукции толерантности in vivo, и содействует неэффективным ответам, обнаруживаемым в этой популяции пациентов. CD8+ Т-клетки могут быть стимулированы ех vivo для образования антиген-специфических ЦТЛ (см., например, патент США No. 6225042). Ранее подходы адоптивной иммунотерапии использовали активированные лимфоциты в качестве терапии для всевозможных злокачественных новообразований.14 Первоначально использовали лимфокин-активированные клетки-убийцы (LAK), а впоследствии - противоопухолевые эффекторные лимфоциты (TIL), активированные ex vivo IL-2, однако доказательство эффективности было нечетким. Эти предварительные контролируемые клинические испытания оказались не в состоянии продемонстрировать преимущество в использовании ех vivo-активированных клеток перед непосредственным введением IL-2 больным меланомой. Более поздние исследования Yee et al. (Fred Hutchinson Cancer Research Center)15 и Dudley et al. (NCI)16 продемонстрировали возможность определенных подходов адоптивной Т-клеточной терапии. Эти исследования включали в себя использование либо клонов Т-клеток, специфических для MART-1 или gp100 и небольших доз IL-2, либо противоопухолевых эффекторных лимфоцитов, растущих ex vivo с аллогенными питающими клетками и высокими дозами IL-2. Данные исследования подтвердили, что адоптивная иммунотерапия оправдывает надежды на лечение рака, хотя ее полноценному развитию препятствовал недостаток воспроизводимых способов для образования ex vivo терапевтических количеств антиген-специфических CD8+ ЦТЛ.17
Цитолитические клетки CD8+T представляют собой главную линию защиты от вирусной инфекции. СD8+-лимфоциты специфически распознают и лизируют клетки организма-хозяина, которые инфицированы вирусом. Несмотря на то, что было желательно обуздывать цитотоксическую активность ЦТЛ, в распоряжении имелось незначительное число методик in vitro/ex vivo для специфического активирования ЦТЛ. Идентифицирование ключевых ассоциированных с меланомой антигенов и способа специфической in vitro-активации ЦТЛ позволяет эффективно оценивать адоптивную иммунотерапию метастатической меланомы.15-18
Несмотря на то, что существует возможность использования естественных антиген-представляющих клеток (АРС) для активации CD8+ in vitro (например, дендритные клетки, макрофаги, аутологичные опухолевые клетки), эффективность активации является невысокой, поскольку молекулы МНС Класса I природных АРС содержат много других пептидных эпитопов, что предполагает поэтому минимальную представленность ассоциированных с опухолью пептидных эпитопов. Большинство из этих представленных пептидов являются нормальными, безвредными эндогенными белками. Более прямым подходом к этой проблеме могла бы быть специфическая активация CD8+ Т-клеток к тем эпитопам, которые имеют отношение к противодействию заболеванию, в данном конкретном случае ассоциированным с меланомой антигенам.
Недавно, с использованием эмбриональной линии клеток Drosophila melanogaster (плодовая мушка) была разработана искусственная АРС, которая экспрессирует молекулы Класса I главного комплекса гистосовместимости (МНС).18,19 См. также патенты США No. 6225042 и 6355479. Из-за отсутствия развитой иммунной системы у насекомого Drosophila нет пептидного транспортера ТАР-1,2, который у человека вовлечен в нагружение пептидных эпитопов на молекулы Класса I. В результате трансфицированные молекулы Класса I появляются на поверхности клеток Drosophila в качестве незаполненных резервуаров. При инкубации этих трансфицированных клеток Drosophila с экзогенными синтетическими пептидами, которые связываются со специфическими молекулами Класса I (т.е. Т-клеточные пептидные эпитопы опухолевых антигенов), все доступные молекулы Класса I могут быть заняты МНС-рестриктированным, специфическим пептидным эпитопом(ами). Высокая плотность экспрессии молекул Класса I, представляющих одиночные или множественные эпитопы, и добавление ключевых ко-стимулирующих молекул В7-1 (CD80), CD70, LFA-3 (CD58) и ICAM-1 (CD54) на этих АРС Drosophila может обеспечивать образование in vitro эффективных, аутологичных цитотоксических CD8+ Т-клеток, которые являются специфическими для антигенных пептидов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Различные общие аспекты и предпочтительные варианты осуществления по изобретению отражены в пунктах формулы изобретения, прилагаемой к данному описанию, которые приводятся здесь в качестве ссылки. Другие предпочтительные варианты осуществления, особенности и преимущества различных аспектов по изобретению станут наглядными из приведенного ниже подробного описания, представленного вместе с чертежами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 иллюстрирует цитолитическую активность образованных ex vivo ЦТЛ, направленных против нагруженных пептидами клеток-мишеней. Выделеннные из меланомы пациента CD8+ Т-клетки были иммунизированы in vitro АРС Drosophila, нагруженными пятью различными ассоциированными с меланомой пептидными эпитопами. Активированные CD8+ Т-клетки культивировали in vitro с использованием IL-2 и IL-7 для селективного размножения меланома-специфических ЦТЛ. Активность оценивали по специфическому лизису 51Cr-меченных Т2-клеток-мишеней, индивидуально нагруженных каждым пептидом (Tyr-1689, Tyr-2792, gp100-1817, gp100-2853 или MART-1819 в сравнении с Т2-клетками, нагруженными контрольным пептидом HLA-A2).
Фигура 2 предоставляет схематическую иллюстрацию двух предпочтительных вариантов осуществления режимов лечения по изобретению наряду с контрольным режимом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ И ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ЕГО ОСУЩЕСТВЛЕНИЯ
Различные аспекты изобретения проиллюстрированы ниже путем подробного описания специфических и предпочтительных вариантов осуществления. Для краткости раскрытие всех патентов и других цитируемых публикаций приведены здесь в качестве ссылки. Если не определено особо здесь или не очевидно из контекста, все применяемые здесь технические и научные термины имеют то же значение, что и при повсеместном использовании в данной области.
Термины «включающий», «охватывающий» и «содержащий» используются здесь в их прямом, неограниченном значении. Терапевтические режимы по изобретению, которые включают введение ЦТЛ, активированных в результате контактирования хАРС, нагруженных выбранным пептидом, с цитокинами и, по меньшей мере, одним лимфоистощающим веществом, выбранным из кладрибина и DAB-IL2, могут быть использованы для лечения рака у субъекта, нуждающегося в таком лечении. Предпочтительно рак выбран из злокачественной меланомы, множественной миеломы, рака предстательной железы, лимфомы, неходжкинской лимфомы, лейкемии, острого лимфобластного лейкоза, острого миелолейкоза, хронического лимфоцитарного лейкоза, хронического миелолейкоза, лимфосаркомы Беркитта, рака щитовидной железы, рака тела матки, рака почки, рака яичника, рака легкого, рака молочной железы, рака печени, рака поджелудочной железы, рака предстательной железы, колоректального рака, рака кожи, рака желудка и рака шейки матки.
Таким образом, в одном предпочтительном варианте осуществления изобретение предоставляет режим адоптивной ЦТЛ-терапии для лечения или облегчения течения метастатической меланомы, включающий: получение первичных CD8+ Т-клеток от субъекта; контактирование первичных CD8+ Т-клеток с ксеногенными антиген-представляющими клетками (хАРС), нагруженными выбранным пептидным антигеном, в связи с чем образуются активированные ЦТЛ, которые выявляют клетки, экспрессирующие выбранный пептидный антиген; введение активированных ЦТЛ обратно субъекту; введение, по меньшей мере, одного лимфоистощающего вещества, выбранного из кладрибина и DAB-IL2; и введение, по меньшей мере, двух цитокинов, которые влияют на персистенцию ЦТЛ. Режим адоптивной ЦТЛ-терапии предпочтительно использует аутологичные CD8+ Т-клетки, активированные ex vivo, которые при активировании и введении субъекту в соответствии с изобретением способны к разрушению in vivo опухолевых клеток, содержащих ассоциированные с раком антигенные эпитопы.
Термин «субъект» в данном контексте относится к пациенту-млекопитающему, нуждающемуся в лечении рака. Например, субъект может быть человеком с выявленной меланомой, такой как развившаяся злокачественная метастатическая меланома, например пациент, который диагносцирован как HLА-А2-положительный и имеет нерезектабельное заболевание III/IV стадии.
Агент, включающий ЦТЛ, изготовляют из хАРС. Типичные ксеногенные антиген-представляющие клетки (хАРС), которые пригодны для использования, могут включать следующие компоненты: экзогенная молекула МНС I; одна или более экзогенных вспомогательных молекул для содействия активации исходных Т-клеток; и клетки хозяина, способные экспрессировать на своей поверхности экзогенные молекулы. Предпочтительно экзогенные молекулы кодируются экзогенной нуклеиновой кислотой, введенной в клетки хозяина. хАРС также предпочтительно экспрессируют экзогенные ко-стимуляторы и молекулы адгезии, которые усиливают способность Т-клеточной активации хАРС. Предпочтительно клетки хозяина представляют собой клетки насекомого, более предпочтительно клетки Drosophila, такие как клетки Schneider 2 (S2). Типичные хАРС и способы их получения описаны, например, в патентах США No. 6225042 и 6355479.
хАРС могут быть нагружены пептидным антигеном множеством способов, известных и доступных для использования в данной области. Выбирают пептиды, которые способны связываться с ненагруженными молекулами МНС Класса I. Выбранные пептиды предпочтительно соответствуют эпитопам, включающим антигенные или иммуногенные аминокислотные последовательности, полученные из белка, экспрессированного на поверхности клеток, которые могли бы служить в качестве мишеней для Т-клеток, используемых в адоптивной ЦТЛ-терапии. Для загрузки незаполненных молекул МНС Класса I выбранным пептидом один или более видов антигенных или иммуногенных пептидов, которые связываются с такими незаполненными молекулами МНС Класса I, могут контактировать с хАРС при соответствующих условиях для осуществления связывания.
Можно выбрать один или более видов антигенных или иммуногенных пептидов. В случае выбора более одного вида они могут контактировать с хАРС одновременно или по-отдельности, что приводит к образованию на хАРС мультиантигенных или мультииммуногенных МНС-пептидных комплексов.
Загрузка выбранным пептидом незаполненных молекул МНС предпочтительно происходит при условиях, которые почти соответствуют биологическим условиям связывания, которые могут быть аппроксимированы in vitro, ex vivo или in vivo. У выбранных пептидов любой специалист может рассматривать один или несколько факторов, таких как термодинамические, электростатические, энергетические и энтропийные соображения, а также специфические аминокислоты внутри выбранных пептидов, которые необходимы для эффективного присоединения к молекулам МНС.
Предпочтительные пептиды включают, например, пептиды, представляющие собой аминокислотные последовательности, выбранные из белка тирозиназы, белка gp100 и белка MART-1. Другие предпочтительные пептиды включают YMNGTMSQV (SEQ ID NO:1), YMDGTMSQV (SEQ ID NO:2), AAGIGILTV (SEQ ID NO:3), ITDQVPFSV (SEQ ID NO:4), YLEPGPVTA (SEQ ID NO:5) и KTWGQYWQV (SEQ ID NO:6). Дополнительные типичные пептиды, которые можно выбрать, включают, например, следующие аминокислотные последовательности, где белок, из которого получен каждый пептид, указан в скобках: SILSLKEAST (С-лектин; SEQ ID NO:70), KMASRSMRL (С-лектин; SEQ ID NO:71), ALALAALLVV (Рес60; SEQ ID NO:72), ALLVVDREV (Рес60; SEQ ID NO:73), YMNGTMSQV (Тирозиназа; SEQ ID NO:74), YMDGTMSQV (Тирозиназа; SEQ ID NO:75), ITDQVPFSV (gp100; SEQ ID NO:7), YLEPGPVTA (gp100; SEQ ID NO:8), AAGIGILTV (MART-1; SEQ ID NO:9), ELAGIGILTV (MART-1; SEQ ID NO:10), CLTSTVQLV (Her-2/neu; SEQ ID NO:11), HLYQGCQVV (Her-2/neu; SEQ ID NO:12), KIFGSLAFL (Her-2/neu; SEQ ID NO:13), IISAVVGIL (Her-2/neu; SEQ ID NO:14), PLTSIISAV (Her-2/neu; SEQ ID NO:15), VMAGVGSPYV (Her-2/neu; SEQ ID NO:16), VLVKSPNHV (Her-2/neu; SEQ ID NO:17), ELVSEFSRM (Her-2/neu; SEQ ID NO:18), YLSGANLNL (CEA; SEQ ID NO:19), GPLTPLPV (AES; SEQ ID NO:20), SLLMWITQC (NY-ESO-1; SEQ ID NO:21), KALFAGPPV (CA-125; SEQ ID NO:22), YLETFREQV (CA-125; SEQ ID NO:23), GLQSPKSPL (CA-125; SEQ ID NO:24), VLLKLRRPV (CA-125; SEQ ID NO:25), ELYIPSVDL (CA-125; SEQ ID NO:26), SLLMWITQV (NY-ESO-1; SEQ ID NO:27), ILAKFLHWL (Теломераза; SEQ ID NO:28), STAPPVHNV (MUC-1; SEQ ID NO:29), FLWGPRALV (MAGE-3; SEQ ID NO:30), FMWGNLTLA (CA-125; SEQ ID NO:31), RLVDDFLLV (Теломераза; SEQ ID NO:32), HLSTAFARV (G250; SEQ ID NO:33), QLSLLMWIT (NY-ESO-1; SEQ ID NO:34), ELWTHSYKV (FBP; SEQ ID NO:35), KVAELVHFL (MAGE-3; SEQ ID NO:36), YIFATCLGL (MAGE-3; SEQ ID NO:37), HLYIFATCL (MAGE-3; SEQ ID NO:38), MLMAQEALAFL (CAMEL; SEQ ID NO:39), STLEKINKT (SSX-4; SEQ ID NO:40), KASEKIFYV (SSX-2; SEQ ID NO:41), SLLMWITQCFL (NY-ESO-1; SEQ ID NO:42), ELTLGEFLKL (Сурвивин; SEQ ID NO:43), LTLGEFLKL (Сурвивин; SEQ ID NO:44), SLLEKREKT (SP17; SEQ ED NO:45), TLGEDDPWL (SART-1; SEQ ID NO:46), KLGLKPLEV (SART-1; SEQ ID NO:47), YLWTSAKNT (SCP-1; SEQ ID NO:48), STAPPAHGV (MUC-1; SEQ ID NO:49), GMGSEELRL (LIVIN; SEQ ID NO:50), SLGSPVLGL (LIVIN; SEQ ID NO:51), YLFFYRKSV (hTRT; SEQ ID NO:52), CQQEETFLL (CA-125; SEQ ID NO:53), TLAKFSPYL (PRAME; SEQ ID NO:54), NLTHVLYPV (PRAME; SEQ ID NO:55), STFKNWPFL (Сурвивин; SEQ ID NO:56), SLLQHLIGL (PRAME; SEQ ID NO:57), FLDQRVFFV (gp100; SEQ ID NO:58), FLDQRVFVV (gp100; SEQ ID NO:59), FLDQVAFVV (gp100; SEQ ID NO:60), GLDREQLYL (MUC-16; SEQ ID NO:61), VMQHLLSPL (MUC-16; SEQ ID NO:62), QQTHGITRL (MUC-16; SEQ ID NO:63), LQPLSGPGL (MUC-16; SEQ ID NO:64), TLDRDSLYV (MUC-16; SEQ ID NO:65), QLYLELSQL (MUC-16; SEQ ID NO:66), KVLEYVIKV (MAGE-1; SEQ ID NO:67), KVADLVGFL (MAGE-1; SEQ ID NO:68) и KTWGQYWQV (SEQ ID NO:69).
Выбранные пептиды могут быть представлены клеткам с помощью множества средств и способов, известных в данной области. Выбранные пептиды могут быть представлены способом, который позволяет им входить в состав внутриклеточного пула пептидов. Например, пептиды могут быть представлены с помощью осмотической загрузки. Предпочтительно пептиды добавляют к системной культуральной среде для хАРС. Пептиды можно добавлять к культуральной среде в виде интактного полипептида или белка, который последовательно деградирует в результате клеточных процессов, таких как, например, ферментативная деградация. Альтернативно интактный полипептид или белок может деградировать с помощью некоторых других средств, таких как химическое расщепление (например, цианогенбромид) или протеазы (например, трипсин и химотрипсин), перед добавлением к системной культуральной среде для хАРС. Альтернативно полная белковая или полипептидная последовательность может быть клонирована в соответствующий вектор и помещена в прокариотическую клетку, в результате чего клетка образует значительные количества антигенных полипептидов, которые затем собирают, очищают и расщепляют на пептиды, которые затем добавляют к системной культуральной среде для хАРС.
Достаточное количество каждого из выбранных пептидов можно добавить к клеточной культуре для предоставления возможности молекулам МНС Класса I связываться и в дальнейшем представлять высокую плотность пептида на поверхности экспрессирующих МНС Класса I клеток человека.
хАРС можно проверить на усиление функции АРС по сравнению с функцией АРС неэкзогенных или эндогенных антиген-представляющих клеток. Усиленную функцию АРС можно определить путем измерения любого из множества параметров CD8+ Т-клеточной активации, такого как, например, уровень экспрессии одного или нескольких белков клеточной поверхности, который свидетельствует об активации CD8+ Т-клеток, такие как экспрессия CD69 клеточной поверхности, уровень дифференцировки, уровень цитотоксической киллерной способности, уровень специфического клеточного лизиса и уровень продуцирования цитокинов.
Очистку белков и пептидов можно осуществлять при помощи различных методик, которые известны в данной области, таких как иммуноаффинная хроматография, аффинная хроматография, преципитация белка, смены буферов, ионообменная хроматография, хроматография гидрофобного взаимодействия, гель-фильтрация. Антиген-стимулированные ЦТЛ можно детектировать и выделять при помощи пептид-МНС рМНС тетрамерного окрашивания, где выявленные ЦТЛ являются специфическими для выбранного пептида, представленного хАРС.
Лейкоциты периферической крови (PBL) получают от субъекта, и предпочтительно в значительной степени очищают. Для этих целей можно применять способы очистки PBL, включая способы с использованием градиентов фиколла. Очищенные PBL затем смешивают с клетками хАРС, предварительно инкубированными с соответствующими антигенными пептидами. Предпочтительно PBL очищают при помощи систем очистки с магнитными бусами, которые известны в рассматриваемой области, такие как Miltenyi beads (Myltenyi Biotec) и Dynabead systems (Dynal Biotech). PBL также можно очищать при помощи методик сортировки клеток, таких как способы на основе использования клеточного сортера с возбуждением флуоресценции, или других подходящих приемов и методик клеточного сортинга. В таких способах сортировки клеток или сортинга эритроцитов в качестве маркера для различных клеточно-специфических белков используется зеленый флуоресцентный белок (GFP).
Первичные Т-клетки инкубируют в культуре с соответствующими хАРС и нагружают выбранным пептидом в течение периода времени, достаточного для активации и дополнительного обогащения популяцией СD8+-клеток. Например, патент США No. 4690915 описывает способ получения большого числа лимфоцитов при помощи лимфоцитофереза. Предпочтительно СD8+-клетки активируют антиген-специфическим образом. Соотношение покоящихся клеток или клеток-предшественников CD8+ (эффекторов) и антиген-представляющих клеток может варьировать от индивидуума к индивидууму и, кроме того, может зависеть от переменных характеристик, таких как подверженность лимфоцитов индивидуума условиям культивирования и природе и степени тяжести рака. Тем не менее предпочтительно, чтобы соотношение лимфоцит:антиген-представляющая клетка (например, клетка Drosophila) предпочтительно находилось в диапазоне примерно от 30:1 до 300:1. Например, в одном варианте осуществления смешивают 3×107 PBL человека и 1×106 живых клеток Drosophila и поддерживают в 20 мл культуральной среды RPMI 1640.
Культура эффекторов/антиген-представляющих клеток можно поддерживать сколь угодно долго для активации и обогащения популяции используемых для терапии или эффективного числа CD8+-клеток. При максимальном уровне активации специфических CD8+, наблюдаемом, как правило, после культивирования в течение от одного до десяти дней, например после пяти дней культивирования, предпочтительное время составляет от примерно трех до семи дней. В одном варианте осуществления по настоящему изобретению активацию in vitro CD8+ Т-клеток можно детектировать в течение короткого промежутка времени после трансфекции клеточной линии. В одном варианте осуществления временная экспрессия в трансфицированной линии клеток, способной активировать CD8+ Т-клетки, детектируется в течение 48 часов после трансфекции. Таким образом, для активации CD8+ Т-клеток эффективны либо стабильные, либо неустойчивые культуры трансформированных клеток, экспрессирующих молекулы МНС Класса I человека.
Активированные цитотоксические Т-лимфоциты можно эффективно отделить от хАРС (например, клеток Drosophila) с использованием подходящего способа, известного или доступного в рассматриваемой области. Например, моноклональные антитела, специфические для искусственных АРС, для пептидов, нагруженных на искусственные АРС, или для ЦТЛ (или их сегмента) могут быть использованы для связывания с их соответствующим комплементарным лигандом. Тагированные антителами клетки можно затем экстрагировать из смеси стимуляторных и эффекторных клеток любым из множества способов из рассматриваемой области, такими как, например, способы иммунопреципитации и иммунологического анализа. Альтернативно стадию разделения можно полностью опустить, и инактивированные хАРС можно оставить в культуре с активированными ЦТЛ.
Терапевтически эффективные, цитотоксические количества активированных ЦТЛ можно выбрать как подходящие для описанного применения in vitro и in vivo, например, в свете количества и типа клеток, которые представляют конечную мишень этих ЦТЛ-клеток. Количество следует также выбирать с учетом состояния пациента и может быть определено практикующим врачом путем рассмотрения всех соответствующих факторов. Предпочтительно примерно от 1×106 до приблизительно 1×1012, более предпочтительно примерно от 1×108 до приблизительно 1×1011 и даже более предпочтительно примерно от 1×109 до приблизительно 1×1010 активированных СD8+-клеток для применения у взрослых людей, по сравнению с примерно 5×106-5×107 клеток, используемых для мышей.
Предпочтительно активированные СD8+-клетки, которые являются ЦТЛ, собирают, как описано выше, из хАРС культуры перед введением ЦТЛ клеток подвергаемому лечению индивидууму. Система клеточной культуры предпочтительно не является опухолегенной. Таким образом, если полное разделение клеток Drosophila и активированных CD8+ клеток не достигается, это не должно быть неустранимым риском, связанным с введением малого числа клеток Drosophila.
Исходные CD4+ Т-клетки или CD8+ Т-клетки, или как CD4+ Т-клетки, так и CD8+ Т-клетки можно предпочтительно экстрагировать из субъекта перед инкубацией с культурами хАРС. Для сбора лейкоцитов субъекты могут подвергаться любой из множества известных или доступных методик разделения клеток крови (например, лейкаферезу).
Исходные Т-клетки можно отобрать у субъекта перед началом другого лечения или терапии, которое может препятствовать, ослаблять или, во всяком случае, ограничивать способы и применения специфической активации исходных Т-клеток, как предоставляется настоящим изобретением. Например, при лечении индивидуума с неоплазией или опухолью образцы исходных Т-клеток могут быть получены перед началом химиотерапевтического или радиационного лечения и поддерживаться в культуре. После активации исходных Т-клеток пептид-нагруженными хАРС исходные Т-клетки можно размножить и активировать, и активированные ЦТЛ можно вводить обратно субъекту. Альтернативно исходные Т-клетки могут быть активированы, и активированные ЦТЛ можно вводить обратно субъекту, от которого исходные Т-клетки были получены, перед, после или вместе с другими необязательными формами лечения, такими как химиотерапевтическая или радиационная.
Активированные ЦТЛ также можно суспендировать в соответствующем носителе для доставки и инфузии субъекту. Технические приемы повторного введения клеточных компонентов известны в данной области и включают методики, такие как представленные в качестве примера в патентах США Nos. 4844893 и 4690915. Например, можно использовать введение активированных ЦТЛ клеток с помощью внутривенной инфузии. Могут потребоваться множественные инфузии, и эти инфузии можно осуществлять в течение периода в несколько недель или более.
В режимах лечения по изобретению цитокины также вводят для достижения персистенции ЦТЛ и увеличения посредством этого времени полужизни, активности, эффективности и/или свойств селективности ЦТЛ, которые вводят субъекту. Такая персистенция может получаться в результате непосредственного действия на ЦТЛ или косвенного воздействия, которое включает в себя стимулирующую регуляцию экспрессии антигена на клетках-мишенях ЦТЛ. Предпочтительными цитокинами являются IFN-α-2b и IL-2.
Лимфоистощающие вещества кладрибин (2-CdA, Лейстатин®) и/или DAB IL-2 (ONTAK®) также вводят в режимы лечения по изобретению. Эти вещества не являются миелоаблативными и вызывают временную иммуносупрессию у субъектов, получающих ЦТЛ-терапию.
Расписание и продолжительность введения каждого из ЦТЛ, цитокина и лимфоистощающих веществ могут быть выбраны любым специалистом в рассматриваемой области на основе стандартной программы проведения опытов и этого руководства, включая приведенные ниже примеры.
Для иллюстрации различных аспектов и свойств по изобретению предоставлены следующие примеры.
ПРИМЕРЫ
Получение ЦТЛ ex-vivo
Линии ксеногенных АРС (хАРС) получают из клеток Schneider S2 (S2 клетки), которые были основаны в 1969 г. из нескольких сотен зародышей Oregon-R (дикого типа) Drosophila melanogaster (Oregon-R) в возрасте от 20 до 24 часов (АТСС CRL-1963), согласно опубликованным методикам (Schneider, J. Embryol. Morph. 27:353-365, 1972). Линия клеток S2 была определена на хранение в Американской коллекции типовых культур (CRL10974). Оригинальная поставка клеток S2, использованных для выведения линий клеток, из которых были выведены производные хАРС, получена из этого источника. Для образования хАРС клетки S2 трансфицируют векторами, производными от плазмидного вектора pRMHa-3 (см., например, патент США No. 6225042). Одну линию хАРС, обозначенную как клон А, трансфицируют векторами, кодирующими HLA-A2.1 Класса I, В7.1 и ICAM-1. Вторую линию хАРС, обозначенную как клон В, трансфицируют векторами, кодирующими HLA-A2.1 Класса I, В7.1, В7.2, ICAM-1 и LFA-3. Третью линию хАРС, обозначенную как клон С, трансфицируют векторами, кодирующими HLA-A2.1 Класса I, В7.1, ICAM-1, LFA-3, и CD70. Таким образом, клон А экспрессирует HLA-А2, В7.1 и ICAM-1, клон В экспрессирует HLA-A2.1 Класса I, В7.1, В7.2, ICAM-1 и LFA-3, и клон С экспрессирует HLA-A2.1 Класса I, В7.1, ICAM-1, LFA-3, и CD70.B7.2 и LFA-3.
Независимые непрерывные культуры клеток, происходящих от клона А и клона В, поддерживают в среде Schneider с добавлением 10% фетальной телячьей сыворотки и 500 мкг/мл генетицина (G418) и разводят два раза в неделю свежей средой, добавляемой во время каждого разделения, с доведением клеточной плотности до приблизительно 1×106 клеток/мл. Приблизительно за один день перед индукцией (день от -2 до -4; день 0 определен как день тестирования у клеток экспрессии экзогенных молекул и нагружения пептидом), 3×Т75-флаконов инокулируют объемом клеточной суспензии, подерживаемой в стоковой культуре, эквивалентным 1,5×107 клеток/флакон. Полную среду Drosophila-SFM без G418 добавляют для доведения объема до 15 мл/флакон. Флаконы затем инкубируют в камере при приблизительно 27°С. Приблизительно на -1 ÷ -3 день клетки затем индуцируют добавлением сульфата меди (CuSO4) до конечной концентрации 1,0 мМ (разведение 1:200 200 мМ стока CuSO4; 75 мкл CuSO4 в каждый Т75 флакон, содержащий 15 мл клеточной суспензии) и возвращают в камеру с 27°С. Время индукции составляет приблизительно от 24 до 72 часов.
В день 0 флаконы, содержащие индуцированные клеточные культуры, проверяют визуально и при помощи микроскопа для контроля контаминации. Содержимое незагрязненных флаконов объединяют в пул и подсчитывают жизнеспособные клетки. Образцы объединенных клеточных культур в приблизительно 6×106 клеток оценивают при помощи проточной цитометрии с использованием анализа в клеточном сортере с возбуждением флуоресценции (FACS) для определения уровня экспрессии экзогенных молекул. Клеточные культуры (приблизительно 1×107 клеток/мл) затем тестируют для проверки экспрессии экзогенных HLA-A2.1, В7.1 и ICAM-1 (для клеток клона А) или HLA-A2.1, В7.1, В7.2, ICAM-1 и LFA-3 для клеток клона В) перед нагружением пептида. После проверки экспрессии экзогенных молекул каждую клеточную культуру промывают при помощи раздела каждой культуры на части в две стерильные конические пробирки емкостью 50 мл. Каждую пробирку затем заполняют средой HYQ SFX-Insect (Hyclone) и центрифугируют при 1700 об./мин (600×g) в течение приблизительно семи минут для осаждения клеток. Супернатанты отбирают, и пробирки, содержащие клеточный осадок, снова центрифугируют при 1700 об./мин (600×g) в течение приблизительно одной минуты. Супернатанты удаляют при помощи пипетки с тонким наконечником. Осадки из каждой разделенной клеточной культуры затем воссоединяют и ресуспендируют в 8 мл среды SFX Insect до клеточной плотности приблизительно 1×107 клеток/мл. Приблизительно 40 мкл стокового раствора β2-микроглобулина с 1,0 мг/мл и 24 мкл разведения 1:50 стокового раствора пептидов combo с 1,67 мг/мл для каждого пептида добавляют к каждой ресуспендированной культуре. Таким образом, каждая суспензия клеточной культуры содержит β2-микроглобулин в конечной концентрации приблизительно 5 мкг/мл и каждый выбранный пептид, предназначенный для нагружения на хАРС, с конечной концентрацией приблизительно 0,1 мкг/мл на пептид. Клеточные культуры инкубируют в суспензии, содержащей β2-микроглобулин и пептиды, в течение, по меньшей мере, четырех часов и не более восьми часов, с мягким круговым взбалтыванием каждые 30 минут при комнатной температуре. После периода пептидной инкубации аликвоты по приблизительно 1 мл из каждой клеточной культуры распределяют по отдельности в восемь полипропиленовых пробирок (Falcon 2006). Любую оставшуюся суспензию клеточной культуры выбрасывают.
СD8+-клетки, выделенные из лейкаферезных образцов путем позитивной селекции с антителами против CD8, стимулировали в отношении ассоциированных с меланомой пептидов человека (тирозиназа-689369-377, тирозиназа-792369-377, MART-1-81927-35, gp100-817209-217, gp100-818280-288 и gp100-853154-162), представленных клетками Drosophila, экспрессирующими молекулы Класса I и молекулы кo-стимуляции/адгезии человека HLA-A2.1, B7.1, CD70, LFA-3 и ICAM-1. CD8+-клетки повторно стимулируют двумя раундами аутологичными моноцитами (импульсами с описанными эпитопами) в присутствии IL-2 и IL-7. Число эффекторных клеток затем увеличивают неспецифической стимуляцией моноклональными антителами к CD3 в присутствии гамма-облученных аутологичных питающих клеток и IL-2. Активность цитотоксических T-лимфоцитов измеряют в отношении пептид-нагруженных T2-клеток и панели клеток меланомы, тогда как чистоту in vitro-стимулированных CD8+ Т-клеток оценивают при помощи проточной цитометрии.
Материалы.
Реагенты
rhIL-7. Рекомбинантный интерлейкин-7 (IL-7) человека представляет собой лимфокин, производимый в Е.coli и очищенный при помощи подающего устройства (PeproTech) с использованием высокоэффективной жидкостной хроматографии (HPLC), а не антител. IL-7, полученный в качестве порошка, растворяют в стерильном DPBS, содержащем 1% сывороточного альбумина человека. Основной объем раствора затем фильтруют через фильтр 0,2 мкм, аликвоты (30000 Ед./мл, 1000Х концентрация) разливают в стерильные флаконы и хранят при -80°С перед использованием.
rhIL-2. Рекомбинантный интерлейкин-2 (IL-2) человека производится по технологии рекомбинантной ДНК и поставляется Chiron Corporation (Proleukin®). IL-2, полученный в качестве порошка, растворяют в IL-2-разбавителе (0,5% сывороточного альбумина человека в 50 мМ уксусной кислоте), фильтруют через фильтр 0,2 мкм, аликвоты (20000 Ед./мл, 1000Х концентрация) разливают в стерильные флаконы и хранят при -80°С перед использованием.
Пептид тирозиназы YMNGTMSQV (SEQ ID NO:1). Пептид тирозиназы (tyr 369-377), соответствующий аминокислотам 369-377 тирозиназы человека, производят и очищают с использованием стандартов соответствия GLP (Synpep Corporation). Порошок пептида, полученный от производителя (Synpep Corporation), растворяют в диметилсульфоксиде (DMSO) для получения стокового пептидного раствора с концентрацией 10 мг/мл и хранят при температуре от -72°С до -88°С перед использованием. Этот стоковый пептидный раствор смешивают в равных частях с другими пептидными стоковыми растворами (также с концентрацией 10 мг/мл) для образования комбинированных пептидных растворов для использования при нагружении хАРС. Комбинированные пептидные растворы разливают аликвотами в стерильные флаконы в камере с очищаемым воздухом Класса 10000 в стерильных условиях в застекленном шкафу биологической безопасности Класса II.
Пептид тирозиназы YMDGTMSQ (SEQ ID NO:2). Деамидированную форму описанного выше пептида tyr 369-377, которая содержит остаток аспарагиновой кислоты вместо остатка аспарагина в третьем положении пептида, производят и очищают с использованием стандартов соответствия GLP (Synpep Corporation). Эту диамидированную форму называют tyr 369-377d. Порошок пептида, полученный от производителя, растворяют в диметилсульфоксиде (DMSO) для получения стокового раствора пептида с концентрацией 10 мг/мл и хранят при температуре от -72°С до -88°С перед использованием.
Пептид gp100 ITDQVPFSV (SEQ ID NO:4). Пептид gp100 (gp100209-217), соответствующий аминокислотам 209-217 gp100 человека, производят и очищают с использованием стандартов соответствия GLP (Synpep Corporation). Порошок пептида растворяют в диметилсульфоксиде (DMSO) для получения стокового раствора пептида с концентрацией 10 мг/мл и хранят при температуре от -72°С до
-88°С перед использованием.
Пептид gp100 KTWGQYWQV (SEQ ID NO:6). Пептид gp100 (gp100154-162), соответствующий аминокислотам 154-162 gp100 человека, производят и очищают с использованием стандартов соответствия GLP. Порошок пептида, полученный от Synpep Corporation, растворяют в диметилсульфоксиде (DMSO) для получения стокового раствора пептида с концентрацией 10 мг/мл и хранят при температуре от -72°С до -88°С перед использованием.
Пептид gp100 YLEPGPVTA (SEQ ID NO:5). Пептид gp100 (gp100280-288), соответствующий аминокислотам 280-288 gp100 человека, производят и очищают с использованием стандартов соответствия GLP в Synpep Corporation. Порошок пептида растворяют в диметилсульфоксиде (DMSO) для получения стокового раствора пептида с концентрацией 10 мг/мл и хранят при температуре от -72°С до -88°С перед использованием.
Пептид MART-1 AAGIGILTV (SEQ ID NO:3). Пептид MART-1 (MART-127-35), соответствующий аминокислотам 27-35 MART-1 человека, производят и очищают с использованием стандартов соответствия GLP (Synpep Corporation). Порошок пептида растворяют в диметилсульфоксиде (DMSO) для получения стокового раствора пептида с концентрацией 10 мг/мл и хранят при температуре от -72°С до -88°С перед использованием.
DYNABEADS® М-450. DYNABEADS® М-450 (SAM) IgG представляют собой стерильные парамагнитные бусы, покрытые поликлональными антимышиными IgG овцы, которые связаны с первичными IgG мыши. DYNABEADS, доступные от Baxter Oncology Inc., хранят при 4°С перед использованием для выделения Т-клеток при помощи магнитного селектора клеток Isolex 300i.
Сывороточный альбумин человека. 25% HSA, USP (Baxter Fenwal Laboratories; источник плазмы для каждой партии проверен на отсутствие ВИЧ-1, ВИЧ-2 и вирусов гепатита С и В) хранят при комнатной температуре перед использованием в качестве источника белкового буфера во время последующих стадий подготовки Т-клеток и активации: очистки CD8+ Т-клеток и CD8- Т-клеток; пептидным нагружением присоединенных клеток; и окончательного составления активированных Т-клеток.
Антитела Anti-CD8. Моноклональные антитела Anti-CD8 (37 В1А) представляют собой моноклональные антитела мыши, направленные против антигена CD8 Т-клеток, которые используют для отбора CD8+ Т-клеток в системе магнитной селекции клеток Isolex 300i. Концентрированный раствор разводят стерильным DPBS для использования в процессах выделения или активации CD8+ Т-клеток. Основной объем раствора фильтруют через фильтр 0,2 мкм и затем разливают аликвотами во флаконы для одноразового использования в камере с очищаемым воздухом Класса 10000 в стерильных условиях в застекленном шкафу биологической безопасности Класса II. Аликвоты (10,0 мг/мл) хранят при -80°С перед использованием.
Пептид α-цепи CD8 - AAEGLDTQRFSG (SEQ ID NO:76). Пептид α легкой цепи CD8 ((AAEGLDTQRFSG) (SEQ ID NO:76)) очищают и производят с использованием стандартов соответствия GLP. Пептид α-цепи CD8 используют в процессах выделения CD8+ Т-клеток для высвобождения захваченных CD8+ Т-клеток с использованием антител к CD8 (37В1А) и магнитного селектора клеток Isolex 300i. Каждая партия пептида производится Synpep Corporation в соответствии со стандартами фармацевтического качества и проверяется по пептидной последовательности, чистоте, молекулярной массе и внешним признакам. Пептид α-цепи CD8, полученный в качестве порошка, далее обрабатывают для получения стокового раствора 10 мг/мл. Этот стоковый раствор разводят в DPBS, фильтруют через фильтр 0,2 мкм, разливают аликвотами в стерильные флаконы и хранят при температуре от -72°С до -88°С перед использованием. Розлив пептидного реагента во флаконы осуществляют в камере с очищаемым воздухом Класса 10000 в стерильных условиях в застекленном шкафу биологической безопасности Класса II.
β2М-микроглобулин человека. Концентрат β2-микроглобулина человека, произведенного при помощи технологии рекомбинантной ДНК, разводят в стерильном DPBS до получения концентрации 1,0 мг/мл. Основной объем раствора фильтруют через фильтр 0,2 мкм и затем разливают аликвотами в стерильные флаконы, и хранят при -80°С перед использованием во время подготовки и пептидного нагружения хАРС и пептидного нагружения присоединенных клеток.
Раствор цитрата натрия. Стерильный, непирогенный антикоагулянтный раствор цитрата натрия, USP (Baxter Fenwal), хранят при комнатной температуре (RT) перед использованием в качестве буферной добавки для эксплуатации магнитного селектора клеток Isolex 3001 при отборе CD8+ Т-клеток и CD8- Т-клеток.
Среда Schneider. Среда Schneider Drosophila представляет собой культуральную среду, используемую при выращивании клеток Drosophila. Каждую партию среды проверяют при помощи подающего устройства (Invitrogen Corporation) на осмотическую концентрацию раствора, рН, стерильность и способность поддерживать рост клеток Drosophila. Среду Schneider Drosophila (IX концентрация) хранят при температуре от 2°С до 6°С перед использованием.
Эмбриональная бычья сыворотка. Эмбриональную бычью сыворотку (FBS), которую используют в качестве источника белка для роста клеток хозяина или клеток хАРС, хранят при -80°С перед использованием. FBS, доступную от Gemini Bioproducts, перерабатывают из эмбриональной крови быка, полученной от животных, происходящих из Соединенных Штатов. Материнские животные, из которых получают кровь, не имеют инфекционных и контагиозных заболеваний и вредных паразитов.
Среда HYQ SFX Insect. Среда SFX Insect от Hyclone (Hyclone Corporation) представляет собой свободную от сыворотки культуральную среду (1 × концентрация), используемую при пептидном нагружении хАРС, и хранят при температуре от 2°С до 6°С перед использованием. Эта среда не содержит продуктов бычьего происхождения.
Сульфат меди. Сульфат меди (II) пятиводный (Aldrich) используют при индукции модифицированных клеток-хозяев для экспрессии молекул HLA, ко-стимулирующих молекул и молекул адгезии человека. Стоковый раствор составляют растворением кристаллического CuSO4 в свободной от эндотоксинов стерильной воде до получения концентрации 200 мМ и фильтрованием раствора в стерильных условиях через фильтр 0,2 мкм в стерильный контейнер в застекленном шкафу биологической безопасности Класса II. Профильтрованный стоковый раствор хранят при температуре от 2°С до 6°С перед использованием.
RPMI. Культуральную среду RPMI (доступную от Invitrogen Corporation или Gibco), не содержащую сыворотку и антибиотиков (IX концентрация), используют для роста Т-клеток. Культуральную среду RPMI хранят при температуре от 2°С до 6°С перед использованием.
Забуференный фосфатом солевой раствор Dulbecco (DPBS). Стерильный, непирогенный забуференный фосфатом солевой раствор Dulbecco (DPBS) (доступный от Invitrogen Corporation или Gibco, IX концентрация) хранят при RT перед использованием. DPBS используют для следующих процедур: эксплуатации прибора для магнитной селекции клеток Isolex 300i во время селекции CD8+ Т-клеток и CD8- Т-клеток; промывки неприсоединенных клеток во время стадий повторных стимуляций и отмывки несвязанных моноклональных антител ОKТ3 при неспецифическом размножении; и разбавления β2-микроглобулина человека, IL-7, пептида CD8 и ОKТ3.
Среда Leibovitz. Среду Leibovitz L-15 (без L-глутамина; IX концентрация), доступную от Sigma-Aldrich, хранят при температуре от 2°С до 6°С перед использованием при пептидном нагружении в процессе Т-клеточной активации.
Антитела OKT®3. Orthoclone OKT®3 (1,0 мг/мл), моноклональные антитела мыши, специфические для антигена CD3 Т-клеток, поставляемые в ампулах в качестве стерильного раствора, допущенного для клинического использования (доступны от Ortho), разливают аликвотами в одноразовые флаконы в стерильных условиях и хранят замороженными при -80°С перед использованием при активации Т-клеток.
Генетицин (G418). Генетицин (Invitrogen Corporation) представляет собой селективный антибиотик, применяемый при культивировании клеток Drosophila для поддержания экспрессии экзогенных молекул, кодируемых экзогенной нуклеиновой кислотой. Генетицин поставляют в виде стерильного стокового раствора (50 мг/мл) и хранят при температуре от 2°С до 6°С перед использованием.
Хлорид кальция. Гидрат хлорида кальция используют для коагуляции аутологичной плазмы, полученной из продукта лимфафереза для образования аутологичной сыворотки, используемой при процессах выделения и активации CD8+ Т-клеток. Гидрат хлорида кальция получают в виде кристаллического порошка, составляют стоковый раствор (1М) и хранят при температуре от 2°С до 6°С перед использованием. Стоковый раствор составляют путем растворения хлорида кальция в не содержащей эндотоксинов стерильной воде и в стерильных условиях фильтруют через фильтр 0,2 мкм в стерильный контейнер в застекленном шкафу биологической безопасности Класса II.
Уксусная кислота. Уксусную кислоту (17,4 М), используемую для получения стоковых растворов IL-2, получают от Sigma Corporation и хранят при RT перед использованием.
FICOLL-PAQUE® плюс. После выделения CD8+ Т-клеток и CD8- Т-клеток при помощи системы селекции клеток Isolex 300i, мононуклеарные клетки из не содержащей CD8+ фракции затем фракционируют с использованием FICOLL-PAQUE® плюс (1X концентрация), реагент для градиента фиколла без каких-либо компонентов животного происхождения, доступный от Amersham Pharmacia Biotech, применяемый для удаления погибших клеток, нейтрофилов и эритроцитов. Реагент хранят при RT перед использованием.
PENTASPAN®. PENTASPAN (В. Braun Medical Inc.) представляет собой стерильный раствор 10% пентакрахмала в 0,9% хлориде натрия для клинического применения (NDC 0264-1972-10) и хранится при RT перед использованием. Его применяют (IX концентрация) в качестве криопротектора при криоконсервации выделенных CD8- Т-клеток и CD8+ Т-клеток.
Диметилсульфоксид (DMSO). DMSO применяют в качестве криопротектора при криоконсервации выделенных CD8- Т-клеток и CD8+ Т-клеток. Раствор DMSO (1X концентрация), доступный от Sigma-Aldrich, хранят при RT перед использованием.
L-глутамин. L-глутамин (USP), 200 мМ (100Х концентрация), доступный от Invitrogen Corporation, применяют в качестве добавки к культуральной среде RPMI и хранят при RT перед использованием.
Раствор MEM пирувата натрия. Раствор MEM пирувата натрия (100 мМ, 100Х концентрация), доступный от Invitrogen Corporation, применяют в качестве добавки к среде RPMI и хранят при температуре от 2°С до 6°С перед использованием.
Несущественные аминокислоты. Несущественные аминокислоты (100 мМ; 100Х концентрация) от Invitrogen Corporation применяют в качестве добавки к среде RPMI и хранят при температуре от 2°С до 6°С перед использованием.
Раствор HEPES. 1М (200X концентрация) буферный раствор HEPES (Invitrogen Corporation) применяют в качестве добавки к среде RPMI и хранят при температуре от 2°С до 6°С перед использованием.
Среда X-Vivo 10-Cell. Культуральную среду X-vivo 10-cell, поставляемую BioWhittaker, хранят при температуре от 2°С до 6°С перед использованием. Эту среду (1X концентрация), которая не содержит сыворотки, фенолового красного и антибиотиков, используют во время фазы неспецифического размножения Т-клеток, активированных воздействием пептид-нагруженных хАРС.
Хлорид натрия для инъекций. 0,9% раствор хлорида натрия, USP, доступный от Baxter Fenwal Laboratories, используют для процедуры промывки клеток при собирании Т-клеток. Раствор, который является стерильным, непирогенным и не содержащим компонентов животного происхождения, хранят при RT перед использованием.
Раствор хлорида натрия + декстроза. Впрыскиваемый раствор 5% декстрозы и 0,9% хлорида натрия, USP (Baxter Fenwal Laboratories), получают в качестве стерильного, непирогенного и не содержащего компоненты животного происхождения. Раствор, который применяют в качестве буфера для хранения активированных Т-клеток, хранят при RT перед использованием.
Раствор Ringer с лактозой. 0,9% Раствор Ringer с лактозой, USP (Baxter Healthcare Laboratories), который является стерильным, с низким содержанием эндотоксинов раствором хлорида кальция, хлорида калия, хлорида натрия и лактата натрия в воде для инъекций (не содержащим компонентов животного происхождения), хранят при RT перед использованием для сбора и суспендирования Т-клеток.
Дистиллированная вода. Дистиллированная вода для клеточных культур, которую получают путем фильтрования через мембрану и проверки на эндотоксины (Invitrogen Corporation), используют в качестве растворителя для приготовления стоковых растворов сульфата меди, хлорида кальция и интерлейкина-2 (IL-2) и хранят при RT перед использованием.
Другие Материалы.
Продукты лимфафереза получают от обследуемых людей с диагнозом меланома и хранят при RT перед использованием для образования аутологичного, пациент-специфического клеточного продукта.
Аутологичную сыворотку человека используют в качестве источника белка для культивирования выделенных Т-клеток. Аутологичную плазму человека готовят из продуктов лимфафереза путем добавления хлорида кальция для получения коагуляции фибрина и последующего сбора жидкой фазы сыворотки. Собранную жидкую фазу сыворотки хранят при 4°С для кратковременного хранения и при -80°С для долговременного хранения.
Линия Drosophila хАРС, полученная из ксеногенного клона В Drosophila, которую используют в качестве источника посевного материала для непрерывной культуры хАРС Drosophila, получают, как описано ниже.
Методики.
Выделение CD8+-клеток человека.
СD8+-клетки выделяют из лейкаферезных образцов с использованием устройства Isolex 300i (Baxter) путем положительной селекции с моноклональными антителами anti-CD8 (антитела 1) с последующей процедурой выделения Dynabeads™ (Dynal) с использованием антимышиных IgG (антитела 2) овцы, покрывающих магнитные бусы (бусы SAM). Моноклональные антитела мыши против CD8 человека добавляют к отмытым клеткам, повторно суспендированным в PBS Dulbecco, с добавлением 1% HSA (Baxter-Hyland) и 0,2% цитрата натрия. Магнитные бусы Dynal (Dynabeads™) добавляют в соотношении бусы к клеткам от 1:1 до 1:2, в зависимости от числа РВМС. Выделенные СD8+-клетки удаляют при помощи магнитного сепарирования. Остающуюся, не содержащую CD8 фракцию собирают и замораживают для будущего использования во время стадий повторной стимуляции и неспецифического размножения. Диссоциация комплекса СD8-клетка-антитело1-антитело2-бусы происходит при инкубации при 37°С в течение 45 минут в присутствии пептида59-70 CD8 ((AAEGLDTQRFSG) (SEQ ID NO:76)), пептида, к которому получали антитело1. Высвобожденные бусы удаляют магнитным способом, и СD8+-клетки подсчитывают и анализируют при помощи проточной цитометрии для оценки чистоты. Выход СD8+-клеток, как правило, превышает 80%. Инактивированную теплом сыворотку готовят путем сбора аутологичной плазмы во время стадии первоначальной промывки клеток. Фибрин свертывается при помощи СаСl2, и фибриновые сгустки удаляют. Сыворотку инактивируют теплом, фильтруют, разделяют на аликвоты и замораживают при -80°С. Отличные от CD8+ клетки не подвергают процедуре положительной селекции и очищают с использованием градиента фиколла. Эти клетки замораживают в DMSO, Pentaspan и инактивированной теплом аутологичной сыворотке и хранят в жидком азоте (LN2). Эти клетки используют в качестве источника присоединенных клеток во время повторных стимуляций и обрабатывают пептидом перед использованием в качестве антиген-представляющих клеток.
In vitro-иммунизация очищенных CD8+ Т-клеток человека
Первичная стимуляция. Трансфицированные клетки S2 Drosophila инкубируют в среде Schneider (106 клеток/мл) с добавлением 10% эмбриональной сыворотки теленка и сульфата меди при 27°С от 24 до 72 часов. Клетки S2 (клон 1120-3-9) собирают, промывают и ресуспендируют в среде HYQ SFX-Insect (Hyclone), содержащей по 0,1 мкг/мл каждого из пептидов gp100154-162, gp100209-217, gp100280-288, MART-I27-35, тирозиназа-Н369-377 и тирозиназа-D369-377 человека и 5 мкг/мл рекомбинантного белка β2-микроглобулина человека, очищенного из Е.coli. После инкубации при комнатной температуре (23-25°С) в течение четырех часов S2 клетки смешивают с CD8+-клетками в соотношении 1:10 (клетки Drosophila:Т-клетки) в среде Roswell Park Memorial Institute (RPMI) (Gibco) с добавлением 5-10% аутологичной сыворотки. Смесь клеток инкубируют при 37°С, за это время клетки Drosophila погибают (за 48 часов). На четвертый день к селективно размноженной меланома-специфической популяции ЦТЛ добавляют IL-2 (20 Ед./мл) и IL-7 (30 Ед./мл).
Повторные стимуляции. Аутологичные РВМС с истощением CD8, полученные во время лимфафереза и замороженные для дальнейшего использования, оттаивают, промывают и ресуспендируют с концентрацией 107 клеток/мл в среде RPMI, содержащей 10% аутологичной сыворотки, 5 мкг/мл рекомбинантного β2-микроглобулина человека и 5 мкг/мл пептидов gp100154-162, gp100209-217, gp100280-288, MART-127-35, тирозиназа-N369-377 и тирозиназа-D369-377 человека. После γ-облучения (5000 рад) клетки инкубируют при 37°С в течение двух часов во флаконах, используемых для повторной стимуляции. Неприсоединенные клетки удаляют путем промывания PBS Dulbecco. Присоединенные моноциты нагружают пептидными эпитопами и инкубируют в течение 90 минут в среде Leibovitz, содержащей 5 мкг/мл β2-микроглобулина человека в 1% HSA и 5 мкг/мл каждого пептида. Супернатант удаляют, и добавляют суспензию активированных СD8+-клеток Drosophila (2,5×106 клеток/мл среды RPMI с 10% аутологичной сыворотки) в соотношении примерно 10 СD8+-клеток на один присоединенный моноцит. После трех или четырех дней культивирования при 37°С со сменой среды добавляют IL-2 (20 Ед./мл) и IL-7 (30 Ед./мл) для селективного размножения меланома-специфической популяции ЦТЛ.
Неспецифическое размножение. CD8+ эффекторные клетки, которые подверглись двум раундам повторной стимуляции, после стимулирования антителами ОКТ3 размножают в контейнерах для клеточной культуры вместе с питающими клетками (облученные, аутологичные, отличные от CD8+ отобранные клетки). Замороженные, отличные от CD8+ отобранные клетки оттаивают, промывают и затем подвергают γ-облучению (3500 рад). Клетки в соотношении 4:1 (питающие:эффекторные) помещают во флаконы Т-225, покрытые антителами ОКТ3. ОКТ3-стимуляцию проводят в полной среде RPMI, содержащей 10% аутологичной сыворотки с добавлением 20 Ед./мл IL-2. Спустя два дня стимулированные Т-клетки разводят свежей средой (среда X-vivo 10) и переносят в контейнеры для клеточной культуры для размножения. Для питания быстро размножающихся Т-клеток свежую среду и IL-2 добавляют приблизительно каждые два или три дня.
Получение и высвобождение ЦТЛ.
Сбор клеток и состав конечного продукта. Сбор конечного клеточного продукта проводят при помощи центрифугирования для удаления культуральной среды и концентрирования клеток. После центрифугирования клетки промывают в солевом растворе, содержащем 1% сывороточного альбумина человека (HSA), фильтруют через фильтр 70 мкм и затем разводят в среде для инфузии. Клеточный продукт для инфузии содержит аутологичные ЦТЛ в 300-мл растворе Ringer с лактозой для инъекции, USP (76% об./об.), 5% декстрозы в 0,9% хлориде натрия (4% об./об.) и 25% HSA (20% об./об.). Клетки конечного продукта расфасовывают в емкость 1000 мл для перевозки в охлажденном защищенном транспортировочном контейнере с устройством, регистрирующим температуру.
Тестирование продукта. Ниже перечислены тесты, проводимые перед выпуском продукта ЦТЛ. Специфическую активность в отношении индивидуальных пептидов оценивают путем измерения цитотоксической активности эффекторных клеток против хром-меченных Т2-клеток, нагруженных каждым индивидуальным пептидом, использованным для стимуляции. Цитотоксическую активность также измеряют против хром-меченных меланомных мишеней (Malme 3М, М14) с использованием обычных фибробластов (Malme 3) или линии клеток меланомы (01-KN), отрицательных для тирозиназы, gp100 и MART-1 в качестве контролей.
Фенотип: Часть собранных клеток используют для проверки фенотипа продукта CD8 перед транспортировкой. Характеристикой конечного продукта является экспрессия CD3, CD8 и TCR. Дополнительную фенотипическую характеристику для маркеров, соответствующих регистрации, активации и т.д., определяют и регистрируют.
Идентичность: HLA-A2, HLA-C и HLA-DR статус образцов определяют при помощи анализа препаратов ДНК, выделенных из образца РВМС, приготовленных во время получения первоначального лейкафереза и от CD8+ Т-клеток, собранных по окончании культивирования, взятых из собранного клеточного продукта. ПЦР-анализ образцов ДНК проводят с HLA-специфическими праймерными олигонуклеотидами, предоставленными Genovision. Характеристика конечного продукта идентична образцу дня 0.
Подсчеты клеток: Необходимая для инфузии доза клеток составляет 1010 CD8+ Т-клеток. Предельный размер конечного продукта для инфузии составляет 1010 Т-клеток. Общее число образованных клеток зависит от пациента. Дозы клеток составляли в среднем 9×109 в предыдущем исследовании, в котором клетки получали по тому же протоколу ex vivo. Конечный подсчет клеток проводили путем определения числа жизнеспособных клеток.
Жизнеспособность: Жизнеспособность конечной клеточной дозы составляет >70%. Число жизнеспособных клеток определяли путем микроскопического подсчета клеток, из которого исключали клетки, окрашенные трипановым синим.
Проверка на миколлазму: Проверка клеток на микоплазму проводили до введения клеток пациенту для подтверждения отрицательного теста на микоплазму. Используют ПЦР-набор Roche, который также включает анализ ELISA. Кроме того, образцы культур Т-клеток собирают при первом питании цитокинами (день 6) и отправляют в BioReliance для выполнения процедуры с 28-дневной культурой. В результате культивирования получают зарегистрированную Т-клеточную инфузию.
Проверка на эндотоксины: Проверку конечного клеточного продукта на эндотоксины проводят при помощи Limulus Amebocyte Lysate assay (BioWhittaker, Walkersville, MD). При инфузии пациентам уровень эндотоксинов составляет менее 5 единиц эндоксина/кг. Характеристика конечного клеточного продукта составляет менее 1 единиц эндоксина/мл.
Проверка продукта на стерильность в процессе: Проверку на стерильность в процессе проводят с использованием системы ВасТ/Alert. Образцы отбирают во время смен среды. Образец из конечной дозы также тестируют при помощи системы BacT/Alert, и характеристикой конечного продукта является отсутствие роста.
Детектирование ДНК Drosophila и вирусной РНК насекомых: ДНК выделяют из конечного продукта CD8+ Т-клеток и используют в качестве матрицы для ПЦР-анализа на ДНК Drosophila, в котором применяют праймеры, специфические для вектора насекомых, используемого при получении рекомбинантных АРС. Этот образец сравнивают с образцом исходных CD8+, который выступает в качестве отрицательного контроля, а клеточную ДНК Drosophila используют в качестве положительного контроля. Из тех же образцов CD8+ Т-клеток выделяют также тотальную РНК и проводят количественный RT-PCR в реальном времени, которым можно выявить 20 копий/мкг кДНК трех различных вирусных РНК известных вирусов насекомых. Характеристикой продукта для обоих тестов является отсутствие детектирования геномных и вирусных нуклеиновых кислот насекомых.
Литическая активность: Литическую активность конечного продукта CD8+ Т-клеток оценивают при помощи анализа по высвобождению хрома как у пептид-нагруженных Т2-клеток-мишеней для определения противопептидной активности, так и у установленных или аутологичных меланомноклеточных HLA-A2 мишеней и соответствующих донору опухолевых и неопухолевых линий (Malme 3 и Malme 3М) для оценки меланома-специфического уничтожения. Характеристикой продукта является специфическое уничтожение клеток-мишеней.
Кроме того, для облегчения контроля можно проводить следующие тесты в дополнение к описанным выше тестам по высвобождению:
Тетрамерное окрашивание: CD8+ Т-клетки для исходных, полученных лейкаферезом образцов оценивают на присутствие антиген-специфических Т-клеток с тетрамерными молекулами, которые предназначены для подсчитывания Т-клеток со специфичностью к пептидным эпитопам, используемым для образования ЦТЛ ex vivo. Это позволяет контролировать антиген-специфические Т-клетки после обработки.
Опухолевые клетки меланомы в образцах периферической крови: Чувствительный, количественный ПЦР-анализ в реальном времени позволяет контролировать циркулирование клеток меланомы по образцам крови пациента до, во время и после лекарственного лечения. Несмотря на то, что не все пациенты с меланомой в III/IV стадии демонстрируют циркулирование опухолевых клеток, детектирование этих клеток можно использовать в качестве заменяющего маркера для ответов на терапию. Продукты ЦТЛ, полученные, как описано выше, можно использовать в режимах обработки при комбинированном лечении по изобретению, что иллюстрируют описанные в последующих примерах предпочтительные варианты осуществления.
Лечение пациентов с метастатической меланомой при помощи аутологичных CD8+-лимфоцитов, стимулированных ex vivo клетками Drosophila, нагруженными ассоциированными с меланомой пептидами (MART-1, gp100 и тирозиназой), и подкожного введения IFNa-2b и 11-2, с введением и без введения 2-CdA или DAB IL-2
Эти примеры иллюстрируют лечение, включающее введение аутологичных цитотоксических Т-лимфоцитов (ЦТЛ), которые специфичны к пептидным элитопам, полученным из ассоциированных с меланомой антигенов, в сочетании с лимфоистощающими веществами, выбранными из кладрибина и DAB IL2, а также цитокинами IL-2 и IFN-α-2b, а также контрольное лечение. Средства клеточной терапии, которые включают аутологичные ЦТЛ, активированные так, что они специфически нацелены на клетки меланомы, экспрессируя MART-1, gp100 и тирозиназу путем контактирования с хАРС Drosophila, нагруженных производными от MART-1, gp100 и тирозиназы антигенными пептидами, предназначены для усиления и поддержания у пациента иммунного нацеливания на клетки меланомы, экспрессирующие MART-1, gp100 и тирозиназу. Добавление иммуномодуляторов IFN-α-2b и IL-2 включают для увеличения ответа ЦТЛ. Немиелоаблативный, но лимфоцит-истощающий, подготовительный режим (кладрибин) или специфически истощающий Т-клеточную подгруппу денилейкин дифлитокс (DAB IL-2) вводят перед инфузией ЦТЛ для усиления приживления ЦТЛ. Лечение предназначено для вызывания регрессии опухоли и клинической пользы путем персистенции меланома-специфических ЦТЛ.
Более конкретно, клиническим пациентам с развившейся злокачественной меланомой, которая HLA-A2 положительна, вводят немиелоаблативный, но при этом лимфоцит-истощающий, подготовительный режим, состоящий либо из кладрибина (0,12 мг/кг/день × 5 дней), либо DAB IL-2 (однократная инъекция в 18 мкг/кг). Кроме того, сопутствующий режим интерферона-α-2b (IFN-α-2b; 10 ММЕ/м2) вводят ежедневно, в течение 5 дней подряд, путем подкожной инъекции перед инфузией ЦТЛ. В дальнейшем пациенты получают однократную дозу образованных ex vivo, стимулированных хАРС Drosophila, аутологичных CD8+ Т-клеток, которые проявляют фенотип ЦТЛ. Инфузия клеток следует сразу за подкожным ежедневным введением низкой дозы (например, 3 ММЕ) IL-2 в течение двадцати восьми (28) дней, с последующей оценкой опухоли. Подкожное ежедневное введение низкой дозы (например, 3 ММЕ) IL-2 продолжают у пациентов с отсутствием признаков прогрессирования заболевания.
ЦТЛ образуют способом, при котором очищенные исходные CD8+ Т-клетки стимулируют хАРС Drosophila, представляющими шесть различных сопутствующих меланоме Т-клеточных пептидных эпитопов в контексте рестрикции МНС Класса I человека, что приводит к ЦТЛ, которые демонстрируют множественную специфичность к MART-1, gp100 и тирозиназе после приблизительно 34 дней культивирования.
Кровь собирают при скрининге для классификации пациентов для изучения, и подготовительную процедуру для лейкафереза совершают в день 0 или день 1. Пациентов подвергают стандартному лейкаферезу (2,0-3,0 × объем крови) для получения достаточного количества лейкоцитов, необходимых для получения средства клеточной терапии. При указанных временах проводят дополнительные процедуры лейкафереза (≤ трети количества, использованного для получения первоначального образца CD8) для получения клеток периферической крови для анализа. Эти образцы используют для контроля присутствия антиген-специфических Т-клеток и возможных циркулирующих меланомных опухолевых клеток. Плазму и клетки крови также собирают для соответствия требованию ксенотрансплантации для архивирования образцов, взятых до и после лечения. Продукты лейкафереза перемещают в устройство, где CD8+ Т-клетки выделяют, стимулируют и культивируют в течение приблизительно 34 дней.
Оценку поддающихся измерению повреждений проводят на 4 и на 8 неделях, следующих за инфузией ЦТЛ. Целью исследования является определение того, приводит ли введение полного немиелоаблативного, лимфоцит-истощающего (кладрибин) или селективного истощения Т-клеточной подгруппы (DAB IL-2), перед инфузией ЦТЛ и вместе с установленным усиливающим иммунитет цитокиновым режимом, к антиген-специфической Т-клеточной персистенции при сопровождающей объективной регрессии опухоли.
Получение цитотоксических лимфоцитов
CD8+-клетки, выделенные из лейкаферезных образцов путем положительной селекции с антителами против CD8, стимулируют ассоциированными с меланомой антигенными пептидами человека (тирозиназа369-377(native), тирозиназа369-377(modified D371), MART-127-35, gp100154-163, gp100209-217 и gp100280-288), представленными хАРС Drosophila, экспрессирующими молекулы Класса I и ко-стимулирующие молекулы человека (HLA-A2.1, β2-микроглобулин, В7.1, CD7O, ICAM-1 и LFA-3). Эти же самые СD8+-клетки повторно стимулируют при помощи двух раундов аутологичных, обработанных пептидом мононуклеарных клеток в присутствии IL-2 и IL-7. Для увеличения общего числа клеток также включают стадию неспецифического размножения с mAb против CD3 (ОKT3): как правило, в 25 раз выше, чем достигается в конце второй стадии повторной стимуляции. Активность цитолитических Т-клеток определяют в отношении пептид-нагруженных Т2-клеток и панели А2+ клеток меланомы, тогда как степень чистоты in vitro-стимулированных CD8+ Т-клетки оценивают при помощи проточной цитометрии. Кроме того, продукция интерферона-γ, в ответ на антиген-специфическую стимуляцию и пептид-специфический тетрамерный анализ, подтверждает, соответственно, эффекторную функцию и специфичность образованных ЦТЛ.
Эффективность ЦТЛ, образованных из исходных CD8+ Т-клеток, полученных от пациентов с меланомным раком
На пациентах с меланомой было показано, что антиген-специфические ЦТЛ, выделенные из образцов периферической крови, являются частью гетерогенной популяции клеток, которые варьируют от низкой до высокой авидности со специфическим комплексом пептид/МНС, к которому направлен TCR. Несмотря на это, подавляющее большинство этих ЦТЛ представляют собой ЦТЛ с низкой авидностью, и только ЦТЛ с высокой авидностью демонстрируют значительный лизис опухолевых клеток.21 Кроме того, противоопухолевые эффекторные лимфоциты (TIL) были выделены из масс опухоли пациентов с меланомой. Размножение ex vivo этих TIL в присутствии высокой дозы IL-2 приводит к объектным ответам у пациентов с меланомой; впрочем, эти ответы были с короткой продолжительностью, и в существенной степени реактивные клонированные Т-клетки, происходящие из TIL, оказались не в состоянии вызвать какой-либо полный ответ.16
В отличие от этого ЦТЛ, образованные ex vivo с xAVC Drosophila, являются эффективными, антиген-специфическими Т-клетками с высокой авидностью, способными к пептид-специфическому лизису (см., например, Фигуру 1) и значительному уничтожению меланомных опухолевых клеток. Воспроизводимое образование ЦТЛ со значительной цитолитической активностью по отношению к опухолевым клеткам, как предполагают, свойственно некоторым содействующим факторам. Во-первых, очистка CD8+ при помощи пептид-специфических моноклональных антител против CD8, отобранных для клеток с высокой плотностью CD8, при высвобождении антител в присутствии специфического пептида предотвращала неспецифическую стимуляцию Т-клеток. Во-вторых, высокоочищенные CD8+ Т-клетки (Таблица I) стимулируют xAPCs, представляющими специфические Т-клеточные эпитопы в окружении молекул МНС, где высокая плотность представления антигена приводит к первичному Т-клеточному иммунному ответу. Включение многочисленных молекул ко-стимуляции на АРС оптимизирует Т-клеточную стимуляцию. В-третьих, стадии повторной стимуляции включают аутологичные, мононуклеарные клетки, нагруженные теми же ассоциированными с меланомой Т-клеточными эпитопами, которые используются при первичной стимуляции и обеспечивают стимулирование пролиферирующих Т-клеток. Наконец, стадия однократного неспецифического размножения при помощи ОKТ3, аутологических питающих клеток и низкой дозы IL-2 сохраняет то же процентное отношение антиген-специфических Т-клеток, которое зарегистрировано в конце второй стадии повторной стимуляции, тогда как общее число Т-клеток увеличивается ~ в 25 раз.
Этот протокол хАРС-стимуляции CD8+ Т-клеток ex vivo приводит к образованию ЦТЛ с эффективным лизированием опухолевых клеток, высокой авидностью к пептид/МНС-комплексу и антиген-специфичностью, что оценивают путем подсчета пептид-специфических тетрамерных молекул, высвобождения интерферона-γ в ответ на специфические антигенные стимулы и специфического лизиса опухоли.
Оценивание ЦТЛ-терапии злокачественной метастазирующей меланомы из предварительных исследований
Были проведены двухстадийное испытание I и одностадийное испытание II, которые включали в итоге 55 субъектов с меланомой III стадии или IV стадии. Исследование 1, «Аутологические цитотоксические Т-лимфоциты (CD8+), серийно культивируемые ех vivo с антиген-представляющими клетками Drosophila, интерлейкином-2, интерлейкином-7, затем - присоединенными моноцитами, и пептидом тирозиназы», представляло собой открытое исследование у 10 пациентов с меланомой IV стадии. Клиническими критическими точками являлись: 1) безопасность и переносимость реинфузированных аутологичных ЦТЛ после иммунизации in vitro; 2) определение кинетики инфузных ЦТЛ в системной циркуляции путем анализа серийных разведений; 3) распределение по всему телу 111индий-меченных ЦТЛ при помощи радиосцинтиграфии; 4) клеточная композиция биопсийных узелков при помощи иммуногистохимического анализа (ЦТЛ, ТH, NK, В-клетки) и 5) регрессия поддающихся измерению участков повреждения и продолжительность ответа в течение двух месяцев.22
В Исследовании 2, «Предварительное исследование подкожного интерферона-α с инфузией стимулированных клетками Drosophila аутологичных СD8+-лимфоцитов для лечения развившейся меланомы», всего 15 пациентов с меланомой III/IV стадии было подвергнуто инфузии аутологичных CD8+ Т-клеток на фоне поддерживающей терапии с IFNα-2b. Лечение ЦТЛ оценивали путем: 1) контроля безопасности и переносимости реинфузных ЦТЛ; 2) клеточной композиции биопсийных узелков; 3) регрессии поддающихся измерению участков повреждения и 4) продолжительности ответа в течение трех месяцев. Субъектам со стабильным заболеванием или продемонстрировавшим клинический ответ при оценке во время последующего врачебного наблюдения (четыре недели после первой инфузии) предлагали второй цикл лечения. Восемь (8) из пятнадцати (15) субъектов были подвергнуты второму циклу ЦТЛ-терапии, четыре (4) субъекта приняли участие в третьем цикле, и один (1) субъект подвергался действию четырех циклов Т-клеточной терапии.23
В Исследовании 3, «Рандомизированное II-фазное испытание интерферона-α-2b (IFN) и интерлейкина-2 (IL-2), вводимых подкожно, с инфузией или без инфузии стимулированных клетками Drosophila аутологичных СD8-лимфоцитов для лечения развившейся меланомы», всего 30 пациентов с меланомой III/IV стадии было подвергнуто лечению одними лишь цитокинами (IFNα и IL-2) или цитокинами плюс Т-клетками. Это было рандомизированное исследование, при котором пациенты входили в группу «только цитокины» (Группа А) или группу «цитокины плюс Т-клетки» (Группа В). Пациентам, которые входили и продвинулись вперед в Группе А, была предоставлена возможность перейти в группу «цитокины плюс Т-клетки» (Группа С). Первичной отправной точкой этого исследования было сравнение времени прогрессирования (ТТР) заболевания между двумя группами (Группа А в сравнении с Группой В). Статистическая значимость была достигнута в ТТР у пациентов, входящих в Группу В по сравнению с пациентами, входящими в Группу А (Фигура 11). У пациентов, которые перешли из Группы А в Группу С, статистическая значимость в ТТР также была определена у пациентов, получивших Т-клетки. Безопасность и переносимость IFNα и IL-2 в дозах и в предписанном режиме также контролировали.24
Обоснование применения интерферона-α-2b (IFN-α-2b)
Интерферон-α (IFN-α) обладает широким спектром иммуномодуляторных и антипролиферативных воздействий на множество злокачественных новообразований. Предполагают, что одним из механизмов действия IFN-α является стимулирующая регуляция экспрессии опухолевых антигенов в клетках меланомы. Он обладает способностью усиливать экспрессию иммунологически важных молекул на поверхности опухоли. Эти молекулы включают антигены МНС, вспомогательные молекулы, а также ассоциированные с опухолью антигены.25-27 Такие иммуномодуляторные воздействия могут улучшать активность иммунной системы, включая как антитела, так и лимфоциты, для распознавания и поражения опухолевых клеток in vivo. Интенсивная, специфическая иммунотерапия продемонстрировала значительные клинические ответы при лечении диссеминированной меланомы. Обсуждаемые выше результаты изучений иммунной функции продемонстрировали, что вакцинное лечение меланомы увеличивает частоту противомеланомных ЦТЛ. Предполагают, что эти два средства иммунотерапии могут действовать синергически. Пятидневный (5) курс IFN-α (10 МЕ/м2; подкожно) был включен в Исследование 2, и результаты IHC-окрашиваний ткани продемонстрировали, что расчет времени и доза были достаточны для повышенной регуляции экспрессии и Класса I, и ассоциированного с меланомой антигена в серийный биопсийных образцах, полученных от отдельного пациента в точно определенных временных рамках. Тот же 5-дневный курс в клиническом исследовании был включен в Исследование 3.
Обоснование применения интерлейкина-2
Рекомбинантный интерлейкин-2 (IL-2) человека представляет собой лимфокин, производимый при помощи технологии рекомбинантной ДНК, для которого было показано проявление множества видов биологической активности. IL-2 стимулирует иммунную систему и оказывает влияние на ее биологические проявления, сопровождающие связывание со специфическими рецепторами на поверхности клетки-мишени. In vitro было показано, что он усиливает Т-клеточную пролиферацию и цитотоксичность лимфоцитов, индуцирует киллерную активность как лимфокин-активированных, так и натуральных киллерных клеток и вызывает продуцирование интерферона-γ. Введение высокой дозы IL-2 283 пациентам приводило к уровню ремиссии в 7% с 9 полными ответами, и пациенты оставались освобожденными от заболевания в течение от 9 до более чем 91 месяцев.28 Хотя высокая доза IL-2, по-видимому, более эффективна, чем продолжительные инфузии низких доз, высокие дозы IL-2 являются и более токсичными. Наиболее распространенными побочными эффектами являлись симптомы, напоминающие грипп. Наиболее тяжелые побочные эффекты представляли собой пониженное давление, синдром капиллярного кровотечения и ослабленную органную перфузию. Подкожное введение низкой дозы IL-2 (в 3 ММЕ/день × 28 дней) применяли в части Исследования 3 для усиления и поддержания уровня адоптивно передаваемых аутологичных Т-клеток. Его добавляли после короткого курса IFN-α и непосредственно следующей инфузии ЦТЛ для усиления митогенеза лимфоцитов, цитотоксичности лимфоцитов и продуцирования интерферона-γ с целью поддержания антиген-специфических Т-клеток in vivo.
Адоптивная передача лимфоцитов после немиелоаблативного иммуносупрессорного химиотерапевтического режима
Исследования на мышах продемонстрировали, что индукция иммуносупрессии с химиотерапией перед введением Т-клеток была существенной для облегчения содействия адоптивной передачи лимфоцитов в максимальной регрессии опухоли29,30. На основе этих исследований были введены клинические протоколы лечения пациентов с адоптивной передачей лимфоцитов после применения немиелоаблативного химиотерапевтического режима16,31.
Немиелоаблативные подготовительные режимы были использованы для лечения пациентов, получающих аллогенные трансплантаты костного мозга, и эти режимы, как оказалось, идеально подходили для вызывания кратковременной иммуносупрессии, которая может усиливать действие адоптивной передачи лимфоцитов. Режим циклофосфамида и флударабина, первоначально применявшийся для пациентов с раком клеток почечного эпителия, получающих HLA-соответствующие аллотрансплантаты32, недавно был использован для пациентов с метастатической меланомой16,31. Обоснованием для включения лимфоистощающего режима перед адоптивной передачей Т-клеток являлось возможное разрушение регуляторных клеток, нарушение гомеостатического Т-клеточного регулирования («способствующее пространство») или аннулирование других нормальных толерогенных механизмов, которые потенциально могли усиливать приживление переданных Т-клеток. Связанной с лечением смертности не наблюдали, и таким образом, немиелоаблативная химиотерапия в сочетании с противоопухолевыми лимфоцитами плюс высокая доза IL-2 должна быть безопасной. Немиелоаблацию индуцировали флударабином (25 мг/м2) и циклофосфамидом (60 мг/кг), после чего следовали инфузия лимфоцитов и высокая доза IL-2 (720000 МЕ/кг).
Комбинированные химиотерапевтические средства циклофосфамид и флударабин, хотя и не являются полностью миелоаблативными, продемонстрировали подавление функции костного мозга, воздействуя на нейтрофилы, лимфоциты, тромбоциты и эритроциты. Уровни нейтрофилов, которые падают до самой низкой отметки на 10 день, следующий за началом химиотерапии, были зарегистрированы на отметке 6/мм3 и возвратились на отметку выше 500/мм3 на 14 день при поддержке филграстима (G-CSF). Уровни лимфоцитов находились на самой низкой отметке 6/мм3 и возвратились на отметку выше 200/мм3 за тот же период времени. Пациенты обычно демонстрировали число нейтрофилов выше 500/мм3 и число тромбоцитов выше 20000/мм3 через 2-3 недели после начала химиотерапии. Пациенты, нуждающиеся в трансфузии стволовых клеток для восстановления функции мозга, не были выявлены, и таким образом, лечение в целом оказывается безопасным. Впрочем, число CD4 не оставалось постоянно низким (среднее число CD4 на приблизительно 200 день составляло 156/мм3, с диапазоном от 46/мм3 до 320/мм3), что, как известно, является побочным эффектом иммуносупрессии, индуцированной флударабином. Имело место развитие условно-патогенных инфекций (т.е. временный опоясывающий герпес), которые устранялись после окончания лечения.
Кладрибин (2-CdA, Лейстатин®), аналог пурина, сходный с флударабином, допущен для использования при лечении волосатоклеточного лейкоза и оценивался также на пациентах с рассеянным склерозом (MS) с целью ослабления аутореактивных Т-лимфоцитов. У MS-пациентов специфическое уменьшение Т-клеточных подгрупп коррелировало с различными дозами кладрибина.33-35 Оно обладает наиболее благоприятным профилем токсичности по сравнению с другими лимфоцитолитическими лекарственными средствами, несмотря на индуцирование продолжительной лимфопении. Уровни лимфоцитов незамедлительно опускаются после первой инфузии кладрибина, достигают наименьшего значения через 5 месяцев и начинают восстанавливаться через 6 месяцев, когда вводят 4-месячные курсы33,34. Лимфопению наблюдали у всех пациентов, и инфекционные осложнения не представляли серьезной проблемы. Лекарственное средство может назначаться путем подходящего подкожного курса без причинения местной болезненной чувствительности и с фармакокинетическими и терапевтическими результатами, которые оказываются полностью эквивалентными курсу IV36,37.
Недавнее исследование на людях, идентифицирующее регуляторные Т-клетки (Treg) как иммуносупрессорные в вакцинном окружении, продемонстрировало усиленный противоопухолевый иммунный ответ после истощения подгруппы Treg, которая обнаруживает фенотип CD4+/CD25+h1 наряду с CD28, CTLA-4 и GITR.38 Эта Т-клеточная подгруппа может быть селективно истощена (приблизительно 3 недели) после однократной дозы денилейкина дифтитикса (DAB389IL-2, ONTAK®). Через четыре дня после однократной дозы у восьми (8) пациентов с почечноклеточным раком было отмечено 37-77%-истощение клеток Treg. После Т-клеточного истощения была введена вакцина RNA-DC, и было отмечено 10-кратное увеличение иммунного ответа на антигены вакцины у пациентов, получивших и IL-2, и вакцину, по сравнению с пациентами, получившими одну лишь вакцину. Таким образом, та же доза (18 мкг/кг) за шесть дней перед адоптивной передачей антиген-специфических ЦТЛ является предпочтительной дозой для режимов по изобретению.
Выбор пациента
Субъекты для исследования представляют собой пациентов-людей с диагнозом метастатическая меланома, которые являются HLA-A2-положительными. Моноклональные антитела (ВВ7.2) используют для исследования образцов РВМС при помощи анализа FACS, и дальнейший анализ проводят с использованием ПЦР-теста Olerup SSP™ (Geno Vision) для определения субтипа HLA-A*0201.
Схема лечения
Фигура 2 иллюстрирует режимы лечения, более подробно описанные ниже. Пациентов разделяют на три группы субъектов, по десять в каждой группе. В режим Группы А, контрольный для лимфоистощающего режима, вводят ЦТЛ плюс цитокины. В режиме Группы В, который представляет собой предпочтительный вариант осуществления по изобретению, пациенты получают кладрибин (дни 0-4) плюс ЦТЛ (день 36), плюс цитокины. В режиме Группы С, который представляет собой другой предпочтительный вариант осуществления по изобретению, пациенты получают DAB IL-2 (день 30) плюс ЦТЛ (день 36), плюс цитокины. Экспериментальные режимы более подробно описаны ниже.
ЦТЛ, специфические для ассоциированных с меланомой антигенов
Терапия цитотоксическими Т-лимфоцитами злокачественной меланомы использует аутологичные in vitro-активированные CD8+ Т-клетки для разрушения клеток меланомы, несущих ассоциированные с меланомой антигенные эпитопы. ЦТЛ готовят из лейкаферезных образцов, полученных в клиническом участке и переданных в устройство, где ЦТЛ образуют по методическим рекомендациям GMP и возвращают для инфузии.
В день 0 пациентов с метастатической меланомой подвергают лейкаферезу (приблизительно 10-15-литровый прогон, в зависимости от массы и состояния пациента). Полученные клетки собирают в течение ночи при комнатной температуре для обработки по технологическим рекомендациям GMP. В соответствующее время проводят лейкаферез для получения лимфоцитов периферической крови для анализа. Эти образцы используют для контроля присутствия антиген-специфических Т-клеток и наличия циркулирующих клеток меланомной опухоли. При контрольной процедуре лейкафереза перерабатывают приблизительно 5 литров периферической крови (или одна треть объема, собранного при первичном лейкаферезе для получения CD8-клеток для последующей инфузии) в клиническом участке и собирают по технологическим рекомендациям GMP. ПЦР-анализ используют для определения уменьшения уровня циркулирующих клеток меланомы после терапии. Детектирование циркулирующих клеток меланомы можно определять при помощи чувствительного, количественного ПЦР-анализа в реальном времени39,41. Присутствие антиген-специфических Т-клеток оценивают с помощью пептид-специфических/НLА-А2 тетрамеров.
Конечный препарат ЦТЛ для инфузии содержит 1×1010 аутологичных ЦТЛ в 300 мл, включающих в себя 76% (об./об.) раствора Ringer с лактозой, 4% (об./об.) D5NS и 20% (об./об.) 25% сывороточного альбумина человека (HSA). Продукт ЦТЛ получают в стерильном контейнере, пригодном для инфузии, держат на льду и вводят через 30 минут, в течение сорока двух (42) часов подготовки.
Перед инфузией ЦТЛ проверяют на литическую активность (на лизис как пептид-нагруженных клеток-мишеней, так и клеток меланомной опухоли), жизнеспособность и степень чистоты при помощи FACS-анализа. Отсутствие как клеточной ДНК Drosophila, так и вирусной РНК насекомого проверяют при помощи чувствительного, количественного ПЦР-анализа в реальном времени. Стерильность определяют путем ВасТ/Alert®-анализа, тестирования на микоплазму и анализа окрашивания по Граму.
Пациенты получают ЦТЛ-инфузию приблизительно 1010 аутологичных Т-клеток, которые были стимулированы и размножены ex vivo с образованием цитотоксических Т-лимфоцитов, способных к нацеливанию на клетки, in vivo экспрессирующие антигены, на которые направлены ЦТЛ. Клетки вводят после окончания обработки IFN-α и непосредственно перед началом IL-2-режима.
Цитокины
Интерлейкин-2 (IL-2) получен от Chiron Corporation (Emeryville, СА). Он поставляется в виде одноразовых флаконов, содержащих 22 миллиона ME (-1,3 мг) IL-2 в качестве стерильного, от белого до не совсем белого лиофилизированного осадка в виде лепешки плюс 50 мг маннита и 0,18 мг додецилсульфата натрия, буферизированного приблизительно 0,17 мг одноосновного и 0,89 мг двухосновного фосфата натрия до рН 7,5 (диапазон от 7,2 до 7,8). Порошок разводят в 1,2 мл стерильной водой для инъекции, USP, и результирующая концентрация составляет 18 миллионов МЕ/мл или 1,1 мг/мл. Нетронутые флаконы хранят в холодильнике (2-8°С) и с защитой от света. Разведенный IL-2 дополнительно разводят 2,4 мл D5% воды. Раствор с конечной концентрацией (6 ММЕ/мл), после наполнения пластикового шприца, пригоден в течение 14 дней после разведения, при хранении в холодильнике при 2-8°С. Конечное разведение IL-2 вводят без контроля врача в амбулаторных условиях подкожно с дозой 3 миллиона единиц (3 ММЕ), начиная немедленно последующую инфузию ЦТЛ и ежедневно до прогрессирования заболевания.
ИНТРОН-А® получают от Schering-Plough Corporation (Kenilworth, NJ). Этот продукт IFN-α-2b поставляется либо в виде лиофилизированного порошка, или раствора для инъекций в стерильных 5-мл флаконах. Флакон содержит приблизительно 3×106 Ед. или 18×106 Ед. IFN. Лиофилизированный порошок растворяют предпочтительно непосредственно перед использованием, поскольку он не содержит бактериостатических веществ; неиспользованный лиофилизированный порошок хранят в холодильнике или морозильной камере (от -4°С до -20°С). В случае если вещество поставляется в виде раствора для инъекций, его хранят в холодильнике (2-8°С или 36°-46°F). Конечное разведение IFN-α вводят без контроля врача в амбулаторных условиях подкожно с дозой 10 МЕ/м2 31-35 дней в качестве подкожной инъекции.
DAB389IL-2
DAB399IL-2 (денилейкин дифтитокс, ONTAK®) представляет собой полученный при помощи рекомбинантной ДНК цитотоксический белок, составленный из аминокислотной последовательности фрагментов А и В дифтерийного токсина, за которой следуют последовательности интерлейкина 2, который экспрессируется в Е.coli. Он является адресным лекарственным средством, которое связывается с клетками, экспрессирующими CD25 (IL-2R) на своей поверхности. Он с высокой аффинностью взаимодействует с рецептором IL-2 на поверхности злокачественных или нормальных регуляторных Т-клеток (Treg) для ингибирования внутриклеточного белкового синтеза, что быстро приводит к клеточной гибели. DAB389IL-2 поставляют в одноразовых флаконах в виде стерильного, замороженного раствора, предназначенного для внутривенного (IV) введения. Каждый 2-мл флакон ONTAK содержит 300 мкг рекомбинантного DAB-IL2 в стерильном растворе лимонной кислоты (20 нМ), EDTA (0,05 мМ) и полисорбата 20 (<1%) в воде для инъекций, USP. Раствор имеет рН 6,9-7,2. Нетронутые флаконы хранят замороженными при -10°С, но не перезамораживают. Перед приготовлением дозы материал доводят до комнатной температуры (25°С или 77°F) путем оттаивания в холодильнике в течение не более 24 часов или при комнатной температуре в течение 1-2 часов, и разводят в NS до концентрации ≥15 мкг/мл. DAB389IL-2 вводят путем внутривенной инъекции, предпочтительно путем инфузии в течение, по меньшей мере, 15 минут. Пациенты, относящиеся к Группе С, получают однократную подкожную инъекцию DAB IL-2 на 30 день, что происходит за один день до начала IFN-α и за шесть дней перед инъекцией ЦТЛ. Доза составляет 18 мкг/кг.
Кладрибин
Лейстатин® (2-хлор-2'дезокси-β-D-аденозин) представляет собой синтетическое противоопухолевое средство. Оно является аналогом нуклеозида пурина, устойчивым к действию аденозиндезаминазы, которая приводит к преимущественной лимфоцитотоксичности. В клетках с высоким соотношением дезоксицитидинкиназы к дезоксинуклеотидазе (например, лимфоциты и моноциты) кладрибин фосфорилируется в активный дезоксинуклеотидтрифосфат, 2-CdATP, который накапливается, вызывая нарушение клеточного метаболизма, повреждение ДНК и последующую гибель клетки. Лекарственное средство представляет собой прозрачный, бесцветный, стерильный, бесконсервантный изотонический раствор, поставляемый в одноразовых флаконах, содержащих 10 мг (1 мг/мл) кладрибина. Каждый мл кладрибина содержит 1 мг активного ингредиента и 9 мг (0,15 мг-экв.) хлорида натрия в качестве неактивного ингредиента. Раствор имеет диапазон рН от 5,5 до 8,0. Фосфорная кислота и/или двухосновный фосфат натрия можно добавлять для доведения рН до 6,3±0,3. Нетронутые флаконы хранят охлажденными (2-8°С). Доза кладрибина для Группы В составляет 0,12 мг/кг/день в течение 5 дней, с разделением на 3-4 приема, где за один прием вводят максимально 3,0 сс. Итоговая доза кладрибина составляет 0,6 мг/кг. Сообщили, что кладрибин, введенный подкожно по этой же схеме (5 дней подряд) и с дозой 0,14 мг/кг/день (итоговая доза = 0,7 мг/кг), является безопасным для пациентов с волосатоклеточным лейкозом37. Кроме того, кладрибин, введенный по этому же графику и с теми же дозами шестидесяти пациентам, вызывал приблизительно 70%-лимфоистощение после одного цикла клинически безопасного подавления функции костного мозга. В результате изменения в стандартизации было обнаружено, что Лейстатин на 12% эффективнее, чем описано в предыдущих клинических исследованиях, при сравнении с синтезированным в лаборатории стоком кладрибина. Дозу, которая, как сообщалось, составляла 0,1 мг/кг, сейчас расценивают как составляющую в действительности лишь 0,087 мг/кг33. При рассмотрении безопасности подкожного введения состава Лейстатина®, разделенного на 2-3 приема, в исследовании пациентов с рецидивирующе-ремиттирующим рассеянным склерозом применяли 0,07 мг/кг/день × 5 дней, ежемесячно в течение 6 месяцев до итоговой накопленной дозы 2,1 мг/кг36. Всего 27 пациентов отобрали случайным образом в группу лечения лекарственным средством. Инфекции были ограничены случаем умеренного сегментного опоясывающего герпеса, который имел место у двух пациентов, подвергающихся лечению кладрибином, и у одного пациента, получающего плацебо. Не было отмечено отдельных случаев значительной тромбоцитопении, анемийной гранулоцитопении или распространенного подавления функции костного мозга.
Необязательное поддерживающее лечение
Пациенты могут получать любое из следующих лекарств для аннулирования токсичности IFN-α и IL-2 во время лечения и в дальнейшем: ацетаминофен (650 мг перорально каждые 4 дня по мере необходимости), дифенилгидрамин (50 мг внутримышечно или перорально каждые 4 дня по мере необходимости), индометацин (25 мг перорально три раза в день или 75 мг с медленным высвобождением ежедневно), прохлорперазин (10 мг внутривенно или перорально каждые 4 дня по мере необходимости при тошноте), Zantac® (150 мг дважды в день при гастрите). Любые из вышеперечисленных поддерживающих лекарственных средств можно заменять другими, специально не назначенными противовоспалительными и противорвотными средствами.
Несмотря на то, что изобретение подробно описано выше со ссылками на иллюстративные примеры и предпочтительные варианты осуществления, любому специалисту в данной области понятно, что объем изобретения определяется не вышеприведенным описанием, а прилагаемой формулой изобретения, как следует подразумевать в соответствии с принципами патентного права.





| название | год | авторы | номер документа |
|---|---|---|---|
| Способ активации цитотоксических Т-лимфоцитов в популяции мононуклеарных клеток крови при помощи мембранных везикул, полученных из генетически модифицированных опухолевых клеток меланомы М14 со сверхэкспрессией интерлейкина 2 | 2022 |
|
RU2790867C1 |
| СПОСОБЫ ПОЛУЧЕНИЯ Т-КЛЕТОК ПРОТИВ АНТИГЕНА ПАПИЛЛОМАВИРУСА ЧЕЛОВЕКА | 2014 |
|
RU2713333C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ Т-КЛЕТОК ПРОТИВ АНТИГЕНА ПАПИЛЛОМАВИРУСА ЧЕЛОВЕКА | 2019 |
|
RU2809610C2 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ЭПИТОПНЫЕ ПЕПТИДЫ HIG2 И URLC10, ДЛЯ ЛЕЧЕНИЯ РАКА, СПОСОБЫ И СРЕДСТВА ДЛЯ ИНДУКЦИИ АНТИГЕНПРЕЗЕНТИРУЮЩЕЙ КЛЕТКИ И ЦИТОТОКСИЧЕСКОГО Т-ЛИМФОЦИТА (ЦТЛ), АНТИГЕНПРЕЗЕНТИРУЮЩАЯ КЛЕТКА И ЦТЛ, ПОЛУЧЕННЫЕ ТАКИМ СПОСОБОМ, СПОСОБ И СРЕДСТВО ИНДУКЦИИ ИММУННОГО ПРОТИВООПУХОЛЕВОГО ОТВЕТА | 2009 |
|
RU2529373C2 |
| ПЕПТИД, ПОЛУЧЕННЫЙ ИЗ KOC1, И СОДЕРЖАЩАЯ ЕГО ВАКЦИНА | 2015 |
|
RU2699542C2 |
| Полиэпитопная противоопухолевая вакцинная конструкция, содержащая эпитопы опухоль-ассоциированных антигенов, фармацевтическая композиция и ее применение для стимуляции специфического противоопухолевого иммунного ответа | 2016 |
|
RU2684235C2 |
| ПЕПТИДЫ CDC45L И ВАКЦИНЫ, ВКЛЮЧАЮЩИЕ ТАКОВЫЕ | 2010 |
|
RU2562160C2 |
| КЛЕТОЧНЫЕ ЛИНИИ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ МЕЛАНОМ, СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ И СПОСОБЫ ЛЕЧЕНИЯ | 2008 |
|
RU2484134C2 |
| КЛЕТОЧНЫЙ ПРОДУКТ ДЛЯ НАГРУЗКИ И АКТИВАЦИИ ДЕНДРИТНЫХ КЛЕТОК ЧЕЛОВЕКА | 2019 |
|
RU2714208C1 |
| ПЕПТИД, ПОЛУЧЕННЫЙ ИЗ URLC10, И СОДЕРЖАЩАЯ ЕГО ВАКЦИНА | 2015 |
|
RU2700881C2 |
















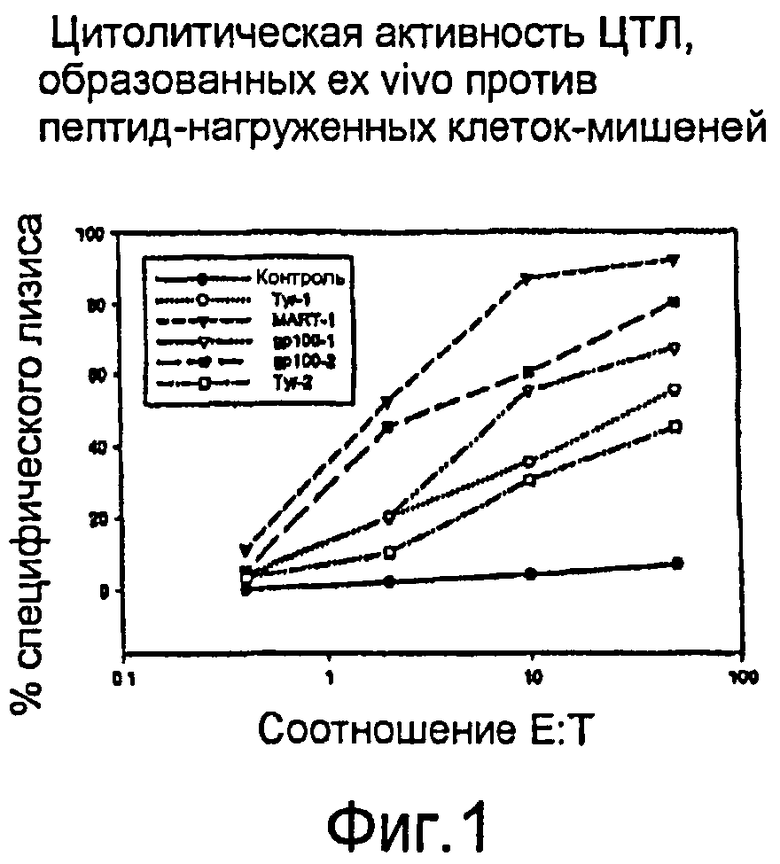
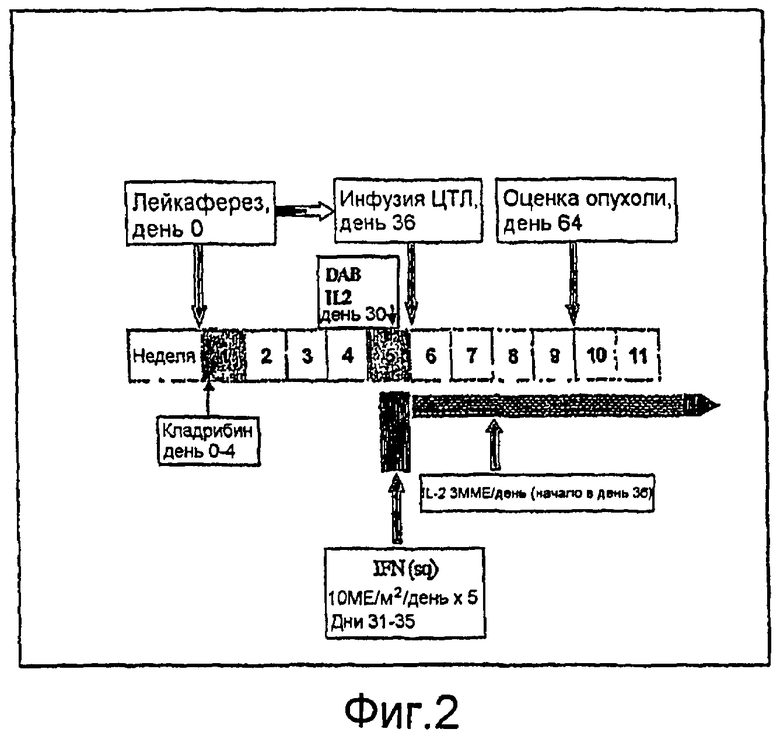
Изобретение относится к медицине, а именно к онкологии, и может быть использовано при лечении рака. Способ включает получение исходных CD8+ T-клеток от субъекта, введение субъекту кладрибина; контактирование исходных CD8+ Т-клеток с ксеногенными антигенпредставляющими клетками, нагруженными одним или несколькими пептидными антигенами, генерируя посредством этого активированные цитотоксические Т-лимфоциты (ЦТЛ), которые нацелены на клетки, экспрессирующие указанные один или несколько пептидных антигенов. Затем субъекту вводят активированные ЦТЛ и, по меньшей мере, два цитокина, которые влияют на персистирование ЦТЛ. Использование изобретения позволяет повысить эффективность лечения за счет продления времени персистенции активированных ЦТЛ и снижения количества осложнений, а именно - оппортунистических инфекций. 9 з.п. ф-лы, 1 табл., 2 ил., 1 пр.
1. Способ лечения субъекта, нуждающегося в лечении рака, включающий: (а) получение исходных СD8+Т-клеток от субъекта; (b) введение субъекту кладрибина; (с) контактирование исходных CD8+Т-клеток с ксеногенными антигенпредставляющими клетками, нагруженными одним или несколькими пептидными антигенами, генерируя посредством этого активированные цитотоксические Т-лимфоциты (ЦТЛ), которые нацелены на клетки, экспрессирующие указанные один или несколько пептидных антигенов; (d) введение субъекту активированных ЦТЛ; и (е) введение субъекту, по меньшей мере, двух цитокинов, которые влияют на персистирование ЦТЛ.
2. Способ по п.1, где указанные, по меньшей мере, два цитокина включают интерферон-а-2b и интерлейкин-2.
3. Способ по п.2, где указанные один или несколько пептидных антигенов содержат аминокислотную последовательность, полученную из белка, выбранного из gp 100, тирозиназы и MART-1.
4. Способ по п.1, где указанный один или несколько пептидных антигенов состоит из пептидных антигенов, полученных из белков человека gp 100, тирозиназы и MART-1.
5. Способ по п.1, где каждый из указанных одного или нескольких пептидных антигенов выбран из группы, состоящей из YMNGTMSQV (SEQ ID NO:1), YMDGTMSQV (SEQ ID NO:2), AAGIGILTV (SEQ ID NO:3), ITDQVPFSV (SEQ ID NO:4), YLEPGPVTA (SEQ ID NO:5) и KTWGQYWQV (SEQ ID NO:6).
6. Способ по п.5, где указанный рак представляет собой меланому.
7. Способ по п.1, где общая продолжительность введения кладрибина составляет 5 дней.
8. Способ по п.7, где 5 дней являются последовательными днями.
9. Способ по п.8, где кладрибин вводят в дозе 0,12 мг/кг/день, при этом общая доза кладрибина составляет 0,6 мг/кг.
10. Способ по п.9, где дозу 0,12 мг/кг/день разделяют на 3-4 приема, где за один прием вводят максимально 3,0 сс.
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1997 |
|
RU2242974C2 |
| КОНСТРУКЦИИ АНТИТЕЛ И ХЕМОКИНОВ И ИХ ПРИМЕНЕНИЕ ПРИ ИММУНОЛОГИЧЕСКИХ НАРУШЕНИЯХ | 2001 |
|
RU2252786C2 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| DE KEYSER F, et al | |||
| Structure-modifying capacity of anti-tumour necrosis factor-alpha therapy in ankylosing spondylitis // Drugs | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| KIM TH, et al | |||
| Cartilage biomarkers in ankylosing spondylitis: relationship to clinical variables and | |||
Авторы
Даты
2012-04-20—Публикация
2007-02-23—Подача