Техническая область
Настоящее изобретение относится к новым соединениям, их изомеру или их фармацевтически приемлемым солям в качестве антагониста TRPV1; и к содержащей их фармацевтической композиции.
Уровень техники
Ванилоидный рецептор 1 (VR1, или transient receptor potential vanilloid-1, TRPV1) представляет собой рецептор капсаицина (8-метил-N-ванилил-6-ноненамида), жгучего ингредиента в острых перцах. В 1997 году сообщалось о молекулярном клонировании TRPV1 (Caterina et al., 1997, Nature, 389, pp816-824), который принадлежит к семейству каналов TRP неизбирательных катионных каналов. TRPV1 активируется или сенсибилизируется стимулами, такими как капсаицин, резинифератоксин, высокая температура, кислота, анандамид, метаболиты липидов и т.п.; таким образом, он играет критическую роль как молекулярный интегратор токсических стимулов в организме млекопитающих (Tominaga et al., 1998, Neuron, 21 pp531-543; Hwang et al., 2000, PNAS, 97, pp6155-6160). TRPV1 в значительной степени экспрессируется в первичных афферентных сенсорных нейронах, и также по сообщениям экспрессируется в различных органах и тканях, таких как мочевой пузырь, почка, легкое, кишечник, кожа, центральная нервная система (ЦНС) и не нейронные ткани (Mezey et al., 2000, PNAS, 97, pp3655-3660; Stander et al., 2004, Exp. Dermatol. 13, pp129-139; Cortright et al., 2001, BBRC, 281, pp1183-1189), и, кроме того, белок TRPV1 активируется при болезненных паталогических состояниях. Активация TRPV1 эндогенными/экзогенными стимулами приводит не только к передаче токсических стимулов, но также и к высвобождению нейропептидов, таких как вещество P, CGRP (Пептид, Связанный с Геном Кальцитонина) в нейронах, таким образом вызывая нейрогенное воспаление. Мыши с нокаутом по TRPV1 показывают нормальные реакции в разнообразных поведенческих тестах, включая токсические, механические и острые термические стимулы, но показывают небольшую тепловую гиперчувствительность в состояниях воспаления (Caterina et al., 2000, Science, 288, pp306-313; Davis et al., 2000, Nature, 405, pp183-187; Karai et al., 2004, J. Clin. Invest., 113, pp1344-1352).
Как указано выше, мыши с нокаутом по TRPV1 показывают уменьшенные реакции на тепловые или токсические стимулы, что подтверждается эффектами антагонистов TRPV1 в различных моделях боли на животных (Immke et al., 2006, Semin. Cell. Dev. Biol., 17(5), pp582-91; Ma et al., 2007, Expert Opin. Ther. Targets, 11(3), pp307-20). Известный антагонист TRPV1, капсазепин, уменьшает гипералгезию, вызванную физическими стимулами в нескольких моделях воспалительной и нейропатической боли (Walker et al., 2003, JPET, 304, pp56-62; Garcia-Martinez et al., 2002, PNAS, 99, 2374-2379). Кроме того, обработка первичной культуры афферентных сенсорных нейронов агонистом TRPV1, капсаицином и т.д., приводит к нарушению функций нерва и, кроме того, к гибели нервных клеток. Антагонист TRPV1 проявляет защитный эффект против такого нарушения функций нерва и гибели нервной клетки (Holzer P., 1991, Pharmacological Reviews, 43, pp143-201; Mezey et al., 2000, PNAS, 97, 3655-3660). TRPV1 экспрессируется на сенсорных нейронах, распределенных во всех областях желудочно-кишечного тракта и высоко экспрессируется при воспалительных нарушениях, таких как синдром раздраженного кишечника и воспалительное заболевание кишечника (Chan et al., 2003, Lancet, 361, pp385-391; Yiangou et al., 2001, Lancet, 357, pp1338-1339). Кроме того, активация TRPV1 стимулирует сенсорные нервы, что в свою очередь вызывает высвобождение нейропептидов, которые, как известно, играют критическую роль в патогенезе желудочно-кишечных нарушений, таких как гастроэзофагеальная рефлюксная болезнь (GERD) и язва желудка и двенадцатиперстной кишки (Holzer P., 2004, Eur. J. Pharmacol. 500, pp231-241; Geppetti et al., 2004, Br. J. Pharmacol., 141, pp1313-1320).
TRPV1-экспрессия афферентных нервов в изобилии наблюдается в слизистой оболочке дыхательных путей, и бронхиальная гиперчувствительность представляет собой механизм, очень подобный гипералгезии. Протоны и продукты липооксигеназы, известные как эндогенные лиганды для TRPV1, известны как критические факторы, ответственные за развитие астмы и хронических обструктивных легочных заболеваний (Hwang et al., 2002, Curr. Opin. Pharmacol. pp235-242; Spina et al., 2002, Curr. Opin. Pharmacol. pp264-272). Кроме того, сообщалось, что загрязняющие воздух вещества, которые являются разновидностью вызывающих астму веществ, то есть частицы специфически действуют на TRPV1 и такое действие ингибируется капсазепином (Veronesi et al., 2001, NeuroToxicology, 22, pp795-810). Гиперчувствительность мочевого пузыря и недержание мочи вызываются различными нарушениями или повреждениями центральных/периферических нервов, и TRPV1, экспрессирующийся в афферентных нервах, и уротелиальные клетки играют важную роль в воспалении мочевого пузыря (Birder et al., 2001, PNAS, 98, pp13396-13401). Далее, мыши с нокаутом по TRPV1 анатомически являются нормальными, но имеют более высокую частоту низкоамплитудных, неопорожняющих сокращений мочевого пузыря и сниженный рефлекс опорожнения в ходе наполнения мочевого пузыря по сравнению с мышами дикого типа, что таким образом указывает, что TRPV1 воздействует на функции мочевого пузыря (Birder et al., 2002, Nat. Neuroscience, 5, pp856-860). TRPV1 распространен в кератиноцитах эпидермиса человека, а также в первичных афферентных сенсорных нервах (Denda et al., 2001, Biochem. Biophys. Res. Commun., 285, pp1250-1252; Inoue et al., 2002, Biochem. Biophys. Res. Commun., 291, pp124-129), и он участвует в передаче различных токсических стимулов и в болевых эффектах, таких как раздражение кожи и зуд, таким образом обнаруживая близкую корреляцию с этиологией дерматологических заболеваний и нарушений, таких как воспаления кожи, вследствие нейрогенных/не-нейрогенных факторов. Это подтверждается тем установленным фактом, что антагонист TRPV1, капсазепин, ингибирует воспалительные медиаторы в клетках кожи человека (Southall et al., 2003, J. Pharmacol. Exp. Ther., 304, pp217-222). За последние годы были накоплены доказательства других ролей TRPV1. TRPV1 может участвовать в кровотоке/регулировании давления через высвобождение сенсорного вазоактивного нейропептида и в регулировании плазменных уровней глюкозы или в патогенезе диабета типа 1 (Inoue et al., Cir. Res., 2006, 99, pp119-31; Razavi et al., 2006, Cell, 127, pp1123-35; Gram et al., 2007, Eur. J. Neurosci., 25, pp213-23). Далее, сообщается, что мыши с нокаутом по TRPV1 в меньшей степени показывают меньше связанное с тревожностью поведение чем их сородичи дикого типа, без различий в локомоции (Marsch et al., 2007, J. Neurosci.,27(4), pp832-9).
На основании вышеуказанной информации разработка различных антагонистов TRPV1 идет полным ходом, и были опубликованы некоторые патенты и заявки на патент, касающиеся разрабатываемых антагонистов TRPV1 (Szallasi et al., 2007, Nat. Rev. Drug Discov., 6, pp.357-72; Appendino et al., 2006, Progress in Medicinal Chemistry, 44, pp.145-180; Rami et al., 2004, Drug Discovery Today: Therapeutic Strategies, 1, pp.97-104; Correll et al., 2006, Expert Opin. Ther. Patents, 16, pp.783-795; Kyle et al., 2006, Expert Opin. Ther. Patents, 16, pp.977-996).
Соединения согласно настоящему изобретению могут быть использованы для профилактики и лечения заболеваний, связанных с активностью TRPV1 (Nagy et al., 2004, Eur. J. Pharmacol. 500, 351-369), включая, но не ограничиваясь ими, боли, такие как острая боль, хроническая боль, нейропатическая боль, послеоперационная боль, ревматическая артритическая боль, остеоартритическая боль, постгерпетическая невралгия, невралгия, головная боль, зубная боль, тазовая боль, мигрень, боль при раке кости, масталгия и висцеральная боль (Petersen et al., 2000, Pain 88, pp.125-133; Walker et al., 2003, J. Pharmacol. Exp. Ther., 304, pp.56-62; Morgan et al., 2005, J. Orofac. Pain, 19, pp.248-60; Dinis et al., 2005, Eur. Urol., 48, pp.162-7; Akerman et al., 2004, Br. J. Pharmcol., 142, pp.1354-1360; Ghilardi et al., 2005, J. Neurosci., 25, 3126-31; Gopinath et al., 2005, BMC Womens Health, 5, 2-9); связанные с нервами заболевания, такие как невропатии, ВИЧ-связанная невропатия, повреждение нерва, нейродегенерация и инсульт (Park et al., 1999, Arch. Pharm. Res. 22, pp.432-434; Kim et al., 2005, J. Neurosci. 25(3), pp.662-671); диабетическая невропатия (Kamei et al., 2001, Eur. J. Pharmacol. 422, pp.83-86); позывы к дефекации; синдром раздраженного кишечника (Chan et al., 2003, Lancet, 361, pp.385-391); воспалительное заболевание кишечника (Yiangou et al., 2001, Lancet 357, pp1338-1339); желудочно-кишечные расстройства, такие как гастроэзофагеальная рефлюксная болезнь (GERD), язва желудка и двенадцатиперстной кишки и Болезнь Крона (Holzer P, 2004, Eur. J. Pharm., 500, pp.231-241; Geppetti et al., 2004, Br. J. Pharmacol., 141, pp.1313-1320); респираторные заболевания, такие как астма, хроническое обструктивное легочное заболевание, кашель (Hwang et al., 2002, Curr. Opin. Pharmacol. pp.235-242; Spina et al., 2002, Curr. Opin. Pharmacol. pp.264-272; Geppetti et al., 2006, Eur. J. Pharmacol., 533, pp207-214; McLeod et al., 2006, Cough, 2, 10); недержание мочи (Birder et al., 2002, Nat. Neuroscience 5, pp.856-860); гиперчувствительность мочевого пузыря (Birder et al., 2001, PNAS, 98, pp.13396-13401); невропатические/аллергические/воспалительные кожные заболевания, такие как псориаз, зуд, пруриго и дерматит (Southall et al., 2003, J. Pharmacol. Exp. Ther., 304, pp.217-222); раздражение кожи, глаз или слизистой оболочки (Tominaga et al., 1998, Neuron 21 pp.531-543); гипернормальный слух; шум в ушах; вестибулярная гиперчувствительность (Balaban et al., 2003, Hear Res. 175, pp.165-70); сердечные заболевания, такие как миокардиальная ишемия (Scotland et al., 2004, Circ. Res. 95, pp1027-1034; Pan et al., 2004, Circulation 110, pp.1826-1831); геморрагический шок (Akabori et al., 2007, Ann. Surg., 245(6), pp.964-70); нарушения, связанные с ростом волос, такие как гирсутизм, эффлювиум, облысение (Bodó et al., 2005, Am. J. Patho. 166, pp.985-998; Bíró et al., 2006, J. Invest. Dermatol. pp.1-4); ринит (Seki et al., 2006, Rhinology, 44, pp128-34); панкреатит (Hutter et al., 2005, Pancreas, 30, pp260-5); цистит (Dinis et al., 2004, J. Neurosci., 24, pp11253-63; Sculptoreanu et al., 2005, Neurosci. Lett. 381, pp42-6); вульводиния (Tympanidis et al., 2004, Eur. J. Pain, 8, pp.12-33); психиатрические нарушения, такие как тревожность или страхи (Marsch et al., 2007, J. Neurosci., 27 (4), pp.832-9).
Соединения, которые связаны с активностями VR1, обсуждаются, например, в WO 02/61317, WO 02/090326, WO 02/16318, WO 02/16319, WO 03/053945, WO 03/099284, WO 03/049702, WO 03/049702, WO 03/029199, WO 03/70247, WO 04/07495, WO 04/72068, WO 04/035549, WO 04/014871, WO 04/024154, WO 04/024710, WO 04/029031, WO 04/089877, WO 04/089881, WO 04/072069, WO 04/111009, WO 05/03084, WO 05/073193, WO 05/051390, WO 05/049613, WO 05/049601, WO 05/047280, WO 05/047279, WO 05/044802, WO 05/044786, WO 06/097817, WO 06/098554, WO 06/100520, WO 06/101321, WO 06/102645, WO 06/103503, WO 06/111346, WO 06/101321, WO 06/101318, WO 06/1113769, WO 06/116563, WO 06/120481, WO 06/122250, WO 06/122799, WO 06/129164, WO 06/51378, WO 06/95263, WO 07/42906, WO 07/45462, WO 07/50732, WO 07/54474, WO 07/54480, WO 07/63925, WO 07/65663, WO 07/65888, WO 07/67619, WO 07/67710, WO 07/67711, WO 07/67756, WO 07/67757, WO 07/63925, WO 07/65662, WO 07/65663, WO 07/65888, WO 07/69773, US 20070149517 или US 20070149513.
Более конкретно, WO 06/101321 и WO 06/101318 касаются модуляторов VR1 с частичной структурой бифенила. В результате обширных и интенсивных исследований авторы настоящего изобретения синтезировали новые соединения, имеющие VR1-антагонистическую активность, путем замены одного фенильного кольца замещенным гетероциклическим кольцом. Кроме того, авторы настоящего изобретения также неожиданно идентифицировали, что замена одного фенильного кольца, как указано выше, обеспечивает улучшение их физико-химических характеристик, таких как метаболическая стабильность или фармакокинетические профили.
Поэтому объектом настоящего изобретения являются новые соединения, которые могут быть использованы как мощный антагонист TRPV1, их изомер и их фармацевтически приемлемые соли; и содержащая их фармацевтическая композиция.
Раскрытие изобретения
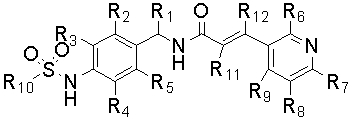
Настоящее изобретение относится к новому соединению следующей формулы (I), к его изомеру или фармацевтически приемлемой соли:
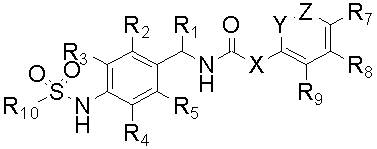 (I),
(I),
в которой
X обозначает CR11=CR12, CHR11CHR12, ,
, или C≡C, причем R11 и R12, если они присутствуют, являются независимо водородом, галогеном или C1-C10 алкилом;
или C≡C, причем R11 и R12, если они присутствуют, являются независимо водородом, галогеном или C1-C10 алкилом;
Y и Z независимо обозначают CH, CR6 или N, так, что по меньшей мере один из Y и Z обозначает N;
R1 обозначает водород, галоген или алкил (предпочтительно C1-C10 алкил);
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, алкил (предпочтительно C1-C10 алкил), алкокси (предпочтительно C1-C10 алкокси), галогеналкил (предпочтительно галоген (C1-C10) алкил), алкенил (предпочтительно C2-C10 алкенил), алкинил (предпочтительно C2-C10 алкинил), карбокси, алкоксикарбонил (предпочтительно C1-C10 алкоксикарбонил) или алкилтио (предпочтительно C1-C10 алкилтио);
R6, R7, R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, алкил (предпочтительно C1-C10 алкил), алкокси (предпочтительно C1-C10 алкокси), алкенил (предпочтительно C2-C10 алкенил), алкинил (предпочтительно C2-C10 алкинил), алкилтио (предпочтительно C1-C10 алкилтио), алкилсульфонил (предпочтительно C1-C10 алкилсульфонил), алкилкарбонил (предпочтительно C1-C10 алкилкарбонил), алкоксикарбонил (предпочтительно C1-C10 алкоксикарбонил), алкенилокси (предпочтительно C2-C10 алкенилокси), алкоксиалкокси (предпочтительно C1-C10 алкокси (C1-C10) алкокси), алкоксиалкоксиалкил (предпочтительно C1-C10 алкокси (C1-C10) алкокси (C1-C10) алкил), пиперидил, пиперазинил, алкоксиалкиламино (предпочтительно C1-C10 алкокси (C1-C10) алкиламино), алкиламино (предпочтительно C1-C10 алкиламино), диалкиламино (предпочтительно ди(C1-C10 алкил)амино), циклоалкил (предпочтительно C3-C8 циклоалкил), циклоалкиламино (предпочтительно C3-C8 циклоалкиламино), циклоалкокси (предпочтительно C3-C8 циклоалкокси), оксациклоалкилокси (предпочтительно C3-C8 оксациклоалкилокси), N-алкоксиалкил-N-алкиламино (предпочтительно N-(C1-C10)алкокси(C1-C10)алкил-N-(C1-C10)алкиламино), N-циклоалкил-N-алкиламино (предпочтительно N-(C3-C8)циклоалкил-N-(C1-C10)алкиламино), N-арил-N-алкиламино (предпочтительно N-арил-N-(C1-C10)алкиламино, более предпочтительно N-фенил-N-(C1-C10)алкиламино), арил, предпочтительно фенил, ариламино, предпочтительно фениламино, арилтио, предпочтительно фенилтио, гетероарил, предпочтительно пиридинил или тиенил, гетероариламино, арилокси, предпочтительно фенокси, гетероарилокси, предпочтительно пиридинилокси, пирролидинил или морфолинил,
причем
- каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилсульфониле, алкилкарбониле, алкиламино или алкенилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (C1-C5) алкокси, (C3-C8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенного галогеном (C1-C5) алкиламино, фенила, который может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C3 алкила или галоген (C1-C3) алкила, или незамещенного или замещенного галогеном ди(C1-C5)алкиламино,
- каждый арил или гетероарил, также как часть группы, например, в ариламино, арилокси, гетероариламино или гетероарилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C5 алкила, незамещенного C1-C5 алкокси или галоген (C1-C5) алкила,
- каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенным или замещенным галогеном C1-C3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
- каждый пиперазинил, пиперидил, морфолинил и пирролидинил может быть незамещенным или замещенным одним или более незамещенным или замещенным галогеном C1-C3 алкилом, гидрокси (C1-C3) алкилом, C1-C3 алкокси, (C1-C3) алкоксикарбонилом или гидроксилом;
и
R10 обозначает алкил (предпочтительно C1-C10 алкил), галогеналкил (предпочтительно галоген (C1-C10) алкил) или алкенил (предпочтительно C2-C10 алкенил).
Настоящее изобретение относится к новому соединению следующей формулы (I), к его изомеру или фармацевтически приемлемой соли:
 (I),
(I),
в которой
X обозначает CR11=CR12, CHR11CHR12 или C≡C, причем R11 и R12, если они присутствуют, являются независимо водородом, галогеном или C1-C5 алкилом;
Y и Z независимо обозначают CH, CR6 или N, так, что по меньшей мере один из Y и Z обозначает N, R1 обозначает водород, галоген или C1-C5 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, C1-C5 алкил, C1-C5 алкокси, галоген (C1-C5) алкил, C2-C5 алкенил, C2-C5 алкинил, карбокси, C1-C5 алкоксикарбонил или C1-C5 алкилтио;
R6, R7, R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, C1-C10 алкил, C1-C10 алкокси, C2-C10 алкенил, C2-C10 алкинил, C1-C10 алкилтио, C1-C10 алкилсульфонил, C1-C10 алкилкарбонил, C1-C10 алкоксикарбонил, C2-C10 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, пиперидил, пиперазинил, C1-C5 алкокси (C1-C5) алкиламино, C1-C10 алкиламино, ди(C1-C10 алкил)амино, C3-C8 циклоалкил, C3-C8 циклоалкиламино, C3-C8 циклоалкокси, C3-C8 оксациклоалкилокси, N-(C1-C5)алкокси(C1-C5)алкил-N-(C1-C5)алкиламино, N-(C3-C8)циклоалкил-N-(C1-C5)алкиламино, N-арил-N-(C1-C5)алкиламино, предпочтительно N-фенил-N-(C1-C5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, арилтио, предпочтительно фенилтио, гетероарил, предпочтительно пиридинил или тиенил, гетероариламино, арилокси, предпочтительно фенокси, гетероарилокси, предпочтительно пиридинилокси, пирролидинил или морфолинил,
причем
- каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилсульфониле, алкилкарбониле, алкиламино или алкенилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (C1-C5) алкокси, (C3-C8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенного галогеном (C1-C5) алкиламино, фенила, который может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C3 алкила или галоген (C1-C3) алкила, или незамещенного или замещенного галогеном ди(C1-C5)алкиламино,
- каждый арил или гетероарил, также как часть группы, например, в ариламино, арилокси, гетероариламино или гетероарилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C5 алкила, незамещенного C1-C5 алкокси или галоген (C1-C5) алкила,
- каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
- каждый пиперазинил, пиперидил, морфолинил и пирролидинил может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидрокси (C1-C3) алкилом, C1-C3 алкокси, (C1-C3) алкоксикарбонилом или гидроксилом;
и
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил,
и причем в одном варианте осуществления, предпочтительно Z обозначает N, Y обозначает CR6, и R7 обозначает C3-C6 алкил или галоген (C1-C5 алкил), например, трифторметил, и причем в другом варианте осуществления, в указанных соединениях формулы I предпочтительно X обозначает CR11=CR12 или C≡C, Z обозначает N, Y обозначает CR6, R6 отличается от водорода, и R7 обозначает галоген (C1-C5 алкил), особенно предпочтительно трифторметил.
Настоящее изобретение относится к новому соединению следующей формулы (I), к его изомеру или фармацевтически приемлемой соли:
 (I),
(I),
в которой
X обозначает CR11=CR12, CHR11CHR12, ,
, или C≡C, причем R11 и R12, если они присутствуют, являются независимо водородом, галогеном или C1-C5 алкилом;
или C≡C, причем R11 и R12, если они присутствуют, являются независимо водородом, галогеном или C1-C5 алкилом;
Y и Z независимо обозначают CH, CR6 или N, так, что по меньшей мере один из Y и Z обозначает N;
R1 обозначает водород или C1-C5 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, C1-C5 алкил, C1-C5 алкокси, галоген (C1-C5) алкил, C2-C5 алкенил, C2-C5 алкинил, карбокси, C1-C5 алкоксикарбонил или C1-C5 алкилтио;
R6, R7, R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, C1-C10 алкил, C1-C10 алкокси, C2-C10 алкенил, C2-C10 алкинил, C1-C10 алкилтио, C1-C10 алкилсульфонил, C1-C10 алкилкарбонил, C1-C10 алкоксикарбонил, C2-C10 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, пиперидил, пиперазинил, C1-C5 алкокси (C1-C5) алкиламино, C1-C10 алкиламино, ди(C1-C10 алкил)амино, C3-C8 циклоалкил, C3-C8 циклоалкиламино, C3-C8 циклоалкокси, C3-C8 оксациклоалкилокси, N-(C1-C5)алкокси(C1-C5)алкил-N-(C1-C5)алкиламино, N-(C3-C8)циклоалкил-N-(C1-C5)алкиламино, N-арил-N-(C1-C5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, гетероариламино, арилокси, предпочтительно фенокси, гетероарилокси, предпочтительно пиридинилокси, пирролидинил или морфолинил,
причем
- каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилсульфониле, алкилкарбониле, алкиламино или алкенилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (C1-C5) алкокси, (C3-C8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенного галогеном (C1-C5) алкиламино, или незамещенного или замещенного галогеном ди(C1-C5)алкиламино,
- каждый арил или гетероарил, также как часть группы, например, в ариламино, арилокси, гетероариламино или гетероарилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C5 алкила или галоген (C1-C5) алкила,
- каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
- каждый пиперазинил, пиперидил, морфолинил и пирролидинил может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидроксиметилом или гидроксилом;
и
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил.
Настоящее изобретение также относится к новому соединению следующей формулы (I), к его изомеру или фармацевтически приемлемой соли; и к содержащей его фармацевтической композиции:
 (I),
(I),
в которой
X обозначает CR11=CR12, CHR11CHR12, ,
, или C≡C, причем R11 и R12, если они присутствуют, являются независимо водородом, галогеном или C1-C5 алкилом;
или C≡C, причем R11 и R12, если они присутствуют, являются независимо водородом, галогеном или C1-C5 алкилом;
Y и Z независимо обозначают CH, CR6 или N, так, что по меньшей мере один из Y и Z обозначает N;
R1 обозначает водород или C1-C5 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, C1-C5 алкил, C1-C5 алкокси, галоген (C1-C5) алкил, C2-C5 алкенил, C2-C5 алкинил, карбокси, C1-C5 алкоксикарбонил или C1-C5 алкилтио;
R6, R7, R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, C1-C5 алкил, C1-C5 алкокси, гидрокси (C1-C5) алкил, C2-C5 алкенил, C2-C5 алкинил, галоген (C1-C5) алкил, галоген (C1-C5) алкокси, C1-C5 алкилтио, C1-C5 алкилсульфонил, C1-C5 алкилкарбонил, C1-C5 алкоксикарбонил, C2-C5 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, C1-C3 алкилпиперазинил, пиперидил, C1-C5 алкокси (C1-C5) алкиламино, C1-C7 алкиламино, ди(C1-C5 алкил)амино, C3-C6 циклоалкил, который может быть незамещенным или замещенным одним или более C1-C3 алкилом, пирролидинилом, фенилом или морфолинилом, причем фенил может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, C1-C5 алкила и галоген (C1-C5) алкила; и
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил.
Другой аспект настоящего изобретения относится к соединению согласно указанной формуле (I), к его изомеру или фармацевтически приемлемой соли,
в которой
X обозначает CR11=CR12, причем R11 и R12 являются независимо водородом, галогеном или C1-C3 алкилом;
R1 обозначает водород или C1-C3 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, метил, этил, этенил, этинил, трифторметил, метокси, этокси или метоксикарбонил;
R6, R7, R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, C1-C5 алкил, C1-C5 алкокси, гидрокси (C1-C5) алкил, C2-C5 алкенил, C2-C5 алкинил, галоген (C1-C5) алкил, галоген (C1-C5) алкокси, C1-C5 алкилтио, C1-C5 алкилсульфонил, C1-C5 алкилкарбонил, C1-C5 алкоксикарбонил, C2-C5 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, C1-C3 алкилпиперазинил, пиперидил, C1-C5 алкокси (C1-C5) алкиламино, C1-C7 алкиламино, ди(C1-C3 алкил)амино, C3-C6 циклоалкил, который может быть незамещенным или замещенным одной или более метильными группами, пирролидинилом, фенилом или морфолинилом, причем фенил может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, C1-C5 алкила и галоген (C1-C5) алкила; и
R10 обозначает C1-C3 алкил или C2-C3 алкенил.
Согласно одному варианту осуществления настоящего изобретения в соединениях формулы I, как описано далее, R6 отличается от водорода, и R7 обозначает галоген (C1-C5) алкил, предпочтительно галоген (C1-C4) алкил, более предпочтительно галоген (C1-C2) алкил, такой как CF2Cl или CF2CF3, особенно предпочтительно R7 обозначает CF3.
Согласно другому варианту осуществления настоящего изобретения в соединениях формулы (I), как описано далее,
- Z обозначает N;
- Y обозначает CR6;
- X обозначает CR11=CR12, CHR11CHR12 или C≡C;
- R7 обозначает C3-C6 алкил или галоген (C1-C5) алкил; и R7 еще более предпочтительно обозначает трет-бутил, изопропил, изобутил или трифторметил;
и
R6 не обозначает пиридинил, пиридинилокси, пиперазинил, замещенный гидроксилом алкиламино или замещенный пирролидин. В некоторых вариантах осуществления R6 также не обозначает водород. В другом варианте осуществления R6 не обозначает водород и также не обозначает фенилтио.
Соответственно, один вариант осуществления настоящего изобретения относится к соединению формулы (I), к его изомеру или фармацевтически приемлемой соли:
 (I),
(I),
в которой
- X обозначает CR11=CR12 или C≡C; причем R11 и R12, если они присутствуют, являются независимо водородом, галогеном или C1-C5 алкилом;
- Z обозначает N;
- Y обозначает CR6;
R1 обозначает водород, галоген или C1-C5 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, C1-C5 алкил, C1-C5 алкокси, галоген (C1-C5) алкил, C2-C5 алкенил, C2-C5 алкинил, карбокси, C1-C5 алкоксикарбонил или C1-C5 алкилтио;
R6 обозначает гидрокси, галоген, нитро, карбокси, C1-C10 алкил, C1-C10 алкокси, C2-C10 алкенил, C2-C10 алкинил, C1-C10 алкилтио, C1-C10 алкилсульфонил, C1-C10 алкилкарбонил, C1-C10 алкоксикарбонил, C2-C10 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, пиперидил, C1-C5 алкокси (C1-C5) алкиламино, C1-C10 алкиламино, ди(C1-C10 алкил)амино, C3-C8 циклоалкил, C3-C8 циклоалкиламино, C3-C8 циклоалкокси, C3-C8 оксациклоалкилокси, N-(C1-C5)алкокси(C1-C5)алкил-N-(C1-C5)алкиламино, N-(C3-C8)циклоалкил-N-(C1-C5)алкиламино, N-арил-N-(C1-C5)алкиламино, предпочтительно N-фенил-N-(C1-C5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, тиенил, гетероариламино, арилокси, предпочтительно фенокси, пирролидинил или морфолинил, при условии, что R6 не обозначает замещенный гидроксилом алкиламино;
R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, C1-C10 алкил, C1-C10 алкокси, C2-C10 алкенил, C2-C10 алкинил, C1-C10 алкилтио, C1-C10 алкилсульфонил, C1-C10 алкилкарбонил, C1-C10 алкоксикарбонил, C2-C10 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, пиперидил, пиперазинил, C1-C5 алкокси (C1-C5) алкиламино, C1-C10 алкиламино, ди(C1-C10 алкил)амино, C3-C8 циклоалкил, C3-C8 циклоалкиламино, C3-C8 циклоалкокси, C3-C8 оксациклоалкилокси, N-(C1-C5)алкокси(C1-C5)алкил-N-(C1-C5)алкиламино, N-(C3-C8)циклоалкил-N-(C1-C5)алкиламино, N-арил-N-(C1-C5)алкиламино, предпочтительно N-фенил-N-(C1-C5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, арилтио, предпочтительно фенилтио, гетероарил, предпочтительно пиридинил или тиенил, гетероариламино, арилокси, предпочтительно фенокси, гетероарилокси, предпочтительно пиридинилокси, пирролидинил или морфолинил,
причем
- каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилсульфониле, алкилкарбониле, алкиламино или алкенилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (C1-C5) алкокси, (C3-C8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенного галогеном (C1-C5) алкиламино, фенила, который может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C3 алкила, или галоген (C1-C3) алкила, или незамещенного или замещенного галогеном ди(C1-C5)алкиламино,
- каждый арил или гетероарил, также как часть группы, например, в ариламино, арилокси, гетероариламино или гетероарилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C5 алкила, незамещенного C1-C5 алкокси или галоген (C1-C5) алкила,
- каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
- каждый пиперидил и морфолинил может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидрокси (C1-C3) алкилом, C1-C3 алкокси, (C1-C3) алкоксикарбонилом или гидроксилом;
R7 обозначает галоген (C1-C5) алкил;
и
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил.
В другом варианте осуществления в соединениях формулы I, как описано здесь,
X обозначает -CH=CH-, -C(CH3)=CH-, -CH=C(CH3)-, -C(CH3)=C(CH3)-, -C(C2H5)=CH-, -CH=C(C2H5)-, -CF=CH-, -CH=CF- или C≡C;
R1 обозначает водород, фтор, метил или этил;
R2, R3, R4 и R5 независимо обозначают водород, фтор, хлор, бром, нитро, циано, метил, этил, этенил, этинил, трифторметил, метокси, этокси или метоксикарбонил;
R6 обозначает гидрокси, фтор, бром, хлор, гидроксиметил, C1-C6 алкил, C1-C6 алкокси, C2-C6 алкенил, C2-C6 алкинил, галоген (C1-C6) алкил, галоген (C1-C6) алкокси, C2-C6 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, ди(C1-C6 алкил)амино, C1-C6 алкиламино, C1-C3 алкокси (C1-C5) алкиламино, C3-C6 циклоалкил, который может быть незамещенным или замещенным одной или более метильными группами, C3-C6 циклоалкиламино, который может быть незамещенным или замещенным одной или более метильными группами, C3-C6 циклоалкокси, C3-C6 оксациклоалкокси, N-(C1-C2)алкокси(C1-C3)алкил-N-(C1-C3)алкиламино, N-(C3-C6)циклоалкил-N-(C1-C3)алкиламино, C1-C3 алкилпиперазинил, пиперидил, пирролидинил, галогенфенил, фенил, фенокси, фениламино, галогенфенокси, морфолинил; C1-C2 алкокси (C1-C3) алкил, фенил (C1-C3) алкил, фенил (C2-C3) алкенил, C1-C3 алкоксиалкинил, ди(C1-C3)алкиламиноалкинил, (C1-C3) алкоксифенил, тиенил, (C3-C6) циклоалкил (C1-C3) алкокси, фенил (C1-C3) алкокси, C1-C5 алкилтио, фенил (C1-C3) алкиламино, ариламино, N-фенил-N-(C1-C3)алкиламино, (C1-C3) алкоксикарбонил или пиперидил;
R7 обозначает галоген (C1-C5) алкил, такой как CF2Cl, CF2CF3 или, особенно предпочтительно, CF3;
R8 и R9 независимо обозначают водород, галоген или трифторметил; и
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил.
Настоящее изобретение также относится к новому соединению следующей формулы (II), к его изомеру или фармацевтически приемлемой соли:
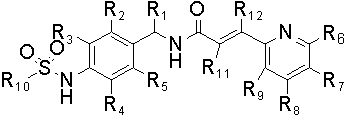 ,
,
(II)
в которой
R1 обозначает водород или C1-C5 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, C1-C5 алкил, C1-C5 алкокси, галоген (C1-C5) алкил, C2-C5 алкенил, C2-C5 алкинил, карбокси, C1-C5 алкоксикарбонил или C1-C5 алкилтио;
R6, R7, R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, C1-C5 алкил, C1-C5 алкокси, C2-C5 алкенил, C2-C5 алкинил, галоген (C1-C5) алкил, галоген (C1-C5) алкокси, гидрокси (C1-C5) алкил, C1-C5 алкилтио, C1-C5 алкилсульфонил, C1-C5 алкилкарбонил, C1-C5 алкоксикарбонил, C2-C5 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, C1-C3 алкилпиперазинил, пиперидил, C1-C5 алкокси (C1-C5) алкиламино, C1-C7 алкиламино, ди(C1-C5 алкил)амино, C3-C6 циклоалкил, который может быть незамещенным или замещенным одним или более C1-C3 алкилом, пирролидинил, фенил или морфолинил, причем фенил может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, C1-C5 алкила и галоген (C1-C5) алкила;
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил; и
R11 и R12 независимо обозначают водород, C1-C5 алкил или галоген.
Один предпочтительный аспект настоящего изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли:
 ,
,
(III)
в которой
R1 обозначает водород, галоген или C1-C10 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, алкил (предпочтительно C1-C10 алкил), алкокси (предпочтительно C1-C10 алкокси), галогеналкил (предпочтительно галоген (C1-C10) алкил), алкенил (предпочтительно C2-C10 алкенил), алкинил (C2-C10 алкинил), карбокси, алкоксикарбонил (предпочтительно C1-C10 алкоксикарбонил) или алкилтио (предпочтительно C1-C10 алкилтио);
R6, R7, R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, алкил (предпочтительно C1-C10 алкил), алкокси (предпочтительно C1-C10 алкокси), алкенил (предпочтительно C2-C10 алкенил), алкинил (предпочтительно C2-C10 алкинил), алкилтио (предпочтительно C1-C10 алкилтио), алкилсульфонил (предпочтительно C1-C10 алкилсульфонил), алкилкарбонил (предпочтительно C1-C10 алкилкарбонил), алкоксикарбонил (предпочтительно C1-C10 алкоксикарбонил), алкенилокси (предпочтительно C2-C10 алкенилокси), алкоксиалкокси (предпочтительно C1-C5 алкокси (C1-C10) алкокси), алкоксиалкоксиалкил (предпочтительно C1-C5 алкокси (C1-C10) алкокси (C1-C10) алкил), пиперидил, пиперазинил, алкоксиалкиламино (предпочтительно C1-C10 алкокси (C1-C10) алкиламино), алкиламино (предпочтительно C1-C10 алкиламино), диалкиламино (предпочтительно ди(C1-C10 алкил)амино), циклоалкил (предпочтительно C3-C8 циклоалкил), циклоалкиламино (предпочтительно C3-C8 циклоалкиламино), циклоалкокси (предпочтительно C3-C8 циклоалкокси), оксациклоалкилокси (предпочтительно C3-C8 оксациклоалкил-окси), N-алкоксиалкил-N-алкиламино (предпочтительно N-(C1-C10)алкокси(C1-C10)алкил-N-(C1-C10)алкиламино), N-циклоалкил-N-алкиламино (предпочтительно N-(C3-C8)циклоалкил-N-(C1-C10)алкиламино), N-арил-N-алкиламино (предпочтительно N-арил-N-(C1-C5)алкиламино, более предпочтительно N-фенил-N-(C1-C5)алкиламино), арил, предпочтительно фенил, ариламино, предпочтительно фениламино, арилтио, предпочтительно фенилтио, гетероарил, предпочтительно пиридинил или тиенил, гетероариламино, арилокси, предпочтительно фенокси, гетероарилокси, предпочтительно пиридинилокси, пирролидинил или морфолинил,
причем
- каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилсульфониле, алкилкарбониле, алкиламино или алкенилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (C1-C5) алкокси, (C3-C8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенным галогеном (C1-C5) алкиламино, фенила, который может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C3 алкила, или галоген (C1-C3) алкила, или незамещенного или замещенного галогеном ди(C1-C5)алкиламино,
- каждый арил или гетероарил, также часть группы, например, в ариламино, арилокси, гетероарилокси или гетероариламино, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C5 алкила, незамещенного C1-C5 алкокси или галоген (C1-C5) алкила,
- каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
- каждый пиперазинил, пиперидил, морфолинил и пирролидинил может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидрокси (C1-C3) алкилом, C1-C3 алкокси, (C1-C3) алкоксикарбонилом или гидроксилом;
R10 обозначает алкил (предпочтительно C1-C10 алкил), галогеналкил (предпочтительно галоген (C1-C10) алкил) или алкенил (предпочтительно C2-C10 алкенил); и
R11 и R12 независимо обозначают водород, C1-C5 алкил или галоген.
Соединение формулы (III), его изомер или фармацевтически приемлемая соль:
 ,
,
(III)
в которой
R1 обозначает водород, галоген или C1-C5 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, C1-C5 алкил, C1-C5 алкокси, галоген (C1-C5) алкил, C2-C5 алкенил, C2-C5 алкинил, карбокси, C1-C5 алкоксикарбонил или C1-C5 алкилтио;
R6, R7, R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, C1-C10 алкил, C1-C10 алкокси, C2-C10 алкенил, C2-C10 алкинил, C1-C10 алкилтио, C1-C10 алкилсульфонил, C1-C10 алкилкарбонил, C1-C10 алкоксикарбонил, C2-C10 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, пиперидил, пиперазинил, C1-C5 алкокси (C1-C5) алкиламино, C1-C10 алкиламино, ди(C1-C10 алкил)амино, C3-C8 циклоалкил, C3-C8 циклоалкиламино, C3-C8 циклоалкокси, C3-C8 оксациклоалкил-окси, N-(C1-C5)алкокси(C1-C5)алкил-N-(C1-C5)алкиламино, N-(C3-C8)циклоалкил-N-(C1-C5)алкиламино, N-арил-N-(C1-C5)алкиламино, предпочтительно N-фенил-N-(C1-C5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, арилтио, предпочтительно фенилтио, гетероарил, предпочтительно пиридинил или тиенил, гетероариламино, арилокси, предпочтительно фенокси, гетероарилокси, предпочтительно пиридинилокси, пирролидинил или морфолинил,
причем
- каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилсульфониле, алкилкарбониле, алкиламино или алкенилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (C1-C5) алкокси, (C3-C8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенного галогеном (C1-C5) алкиламино, фенила, который может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C3 алкила, или галоген (C1-C3) алкила, или незамещенного или замещенного галогеном ди(C1-C5)алкиламино,
- каждый арил или гетероарил, также как часть группы, например, в ариламино, арилокси, гетероарилокси или гетероариламино, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C5 алкила, незамещенного C1-C5 алкокси или галоген (C1-C5) алкила,
- каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
- каждый пиперазинил, пиперидил, морфолинил и пирролидинил может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидрокси (C1-C3) алкилом, C1-C3 алкокси, (C1-C3) алкоксикарбонилом или гидроксилом;
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил; и
R11 и R12 независимо обозначают водород, C1-C5 алкил или галоген, причем в одном варианте осуществления R6 предпочтительно отличается от водорода, и R7 обозначает галоген (C1-C5) алкил.
Один предпочтительный аспект настоящего изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли:
 ,
,
(III)
в которой
R1 обозначает водород или C1-C5 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, C1-C5 алкил, C1-C5 алкокси, галоген (C1-C5) алкил, C2-C5 алкенил, C2-C5 алкинил, карбокси, C1-C5 алкоксикарбонил или C1-C5 алкилтио;
R6, R7, R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, C1-C10 алкил, C1-C10 алкокси, C2-C10 алкенил, C2-C10 алкинил, C1-C10 алкилтио, C1-C10 алкилсульфонил, C1-C10 алкилкарбонил, C1-C10 алкоксикарбонил, C2-C10 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, пиперидил, пиперазинил, C1-C5 алкокси (C1-C5) алкиламино, C1-C10 алкиламино, ди(C1-C10 алкил)амино, C3-C8 циклоалкил, C3-C8 циклоалкиламино, C3-C8 циклоалкокси, C3-C8 оксациклоалкил-окси, N-(C1-C5)алкокси(C1-C5)алкил-N-(C1-C5)алкиламино, N-(C3-C8)циклоалкил-N-(C1-C5)алкиламино, N-арил-N-(C1-C5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, гетероариламино, арилокси, предпочтительно фенокси, гетероарилокси, предпочтительно пиридинилокси, пирролидинил или морфолинил,
причем
- каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилсульфониле, алкилкарбониле, алкиламино или алкенилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (C1-C5) алкокси, (C3-C8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенного галогеном (C1-C5) алкиламино, или незамещенного или замещенного галогеном ди(C1-C5)алкиламино,
- каждый арил или гетероарил, также как часть группы, например, в ариламино, арилокси или гетероарилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C5 алкила или галоген (C1-C5) алкила,
- каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
- каждый пиперазинил, пиперидил, морфолинил и пирролидинил может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидроксиметилом или гидроксилом;
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил; и
R11 и R12 независимо обозначают водород, C1-C5 алкил или галоген.
Один предпочтительный аспект настоящего изобретения относится к соединению формулы (I) или (III), к его изомеру или фармацевтически приемлемой соли:
 ,
,
(III)
в которой
R1 обозначает водород или C1-C5 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, нитро, циано, C1-C5 алкил, C1-C5 алкокси, галоген (C1-C5) алкил, C2-C5 алкенил, C2-C5 алкинил, карбокси, C1-C5 алкоксикарбонил или C1-C5 алкилтио;
R6, R7, R8 и R9 независимо обозначают водород, гидрокси, галоген, нитро, карбокси, C1-C5 алкил, C1-C5 алкокси, C2-C5 алкенил, C2-C5 алкинил, галоген (C1-C5) алкил, галоген (C1-C5) алкокси, гидрокси (C1-C5) алкил, C1-C5 алкилтио, C1-C5 алкилсульфонил, C1-C5 алкилкарбонил, C1-C5 алкоксикарбонил, C2-C5 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, C1-C3 алкилпиперазинил, пиперидил, C1-C5 алкокси (C1-C5) алкиламино, C1-C7 алкиламино, ди(C1-C5 алкил)амино, C3-C6 циклоалкил, который может быть незамещенным или замещенным одним или более C1-C3 алкилом, пирролидинил, фенил или морфолинил, причем фенил может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, C1-C5 алкила и галоген (C1-C5) алкила;
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил; и
R11 и R12 независимо обозначают водород, C1-C5 алкил или галоген.
Один предпочтительный аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено далее, в котором X обозначает CR11=CR12 или C≡C, особенно предпочтительно CR11=CR12, причем R11 и R12 предпочтительно обозначают водород, галоген или C1-C3 алкил, и еще более предпочтительно водород или метил.
Соответственно, один предпочтительный аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено далее, в котором X выбран из -CH=CH-, -C(CH3)=CH-, -CH=C(CH3)-, -C(CH3)=C(CH3)-, -C(C2H5)=CH-, -CH=C(C2H5)-, -CF=CH-, -CH=CF- или C≡C, еще более предпочтительно -CH=CH-, -C(CH3)=CH- или -CH=C(CH3)- и особенно предпочтительно -CH=CH-.
Один аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше,
в котором R7 обозначает C3-C6 циклоалкил, который может быть незамещенным или замещенным одной или более метильными группами, или C1-C5 алкил, который может быть галогенирован одним или более радикалами, выбранными из хлора, брома или, предпочтительно, фтора. Примерами являются метилциклопропил, CF3, изопропил, трет-бутил и изобутил.
В одном предпочтительном варианте осуществления настоящего изобретения в соединениях формулы (III), как описано, R7 обозначает C3-C6 алкил или галоген (C1-C5 алкил), и R7 еще более предпочтительно обозначает трет-бутил, изопропил, изобутил или трифторметил. В одном предпочтительном варианте осуществления настоящего изобретения в соединениях формулы (III), как описано далее, R7 обозначает галоген (C1-C5) алкил или галоген (C1-C4) алкил, такой как CF2Cl, CF2CF3 или, особенно предпочтительно, CF3.
В другом варианте осуществления настоящего изобретения в соединениях формулы (III) R6 не обозначает пиридинилокси, фенилтио или замещенный пирролидин. В другом предпочтительном аспекте настоящего раскрытия R6 отличается от водорода.
В другом варианте осуществления в соединениях формулы (III), как описано далее,
- R7 обозначает C3-C6 алкил или галоген (C1-C5 алкил), и R7 еще более предпочтительно обозначает трет-бутил, изопропил, изобутил или трифторметил;
и
- R6 не обозначает пиридинил, пиридинилокси, пиперазинил, замещенный гидроксилом алкиламино или замещенный пирролидин. В некоторых вариантах осуществления R6 также не обозначает водород и/или фенилтио.
Другой аспект настоящего изобретения относится к соединению формулы (I) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R6 выбран из водорода, брома, хлора, н-бутила, метокси, изобутилокси, втор-бутилокси, метоксиэтокси, диэтиламино, N-пирролидинила, N-пиперидила, N-морфолинила, циклопентиламино, н-бутиламино, фенокси, н-бутилокси и метоксиэтиламино.
Другой аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R3 выбран из водорода, фтора, брома, хлора, метила, этила, трифторметила, этенила, этинила и циано.
Другой аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R10 обозначает метил.
Другой аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R11 и R12, если они присутствуют, оба являются водородом. В другом варианте осуществления один из R11 и R12 обозначает водород, и другой выбран из метила, этила и пропила. В одном варианте осуществления R11 может быть водородом, и R12 может быть водородом, метилом, этилом или пропилом, предпочтительно водородом.
Другой аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R4 обозначает водород, фтор, хлор, бром, метил, этил, циано или трифторметил.
Другой аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R1 и R2 оба обозначают водород.
Другой аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R1, R2 и R11 и R12, если они присутствуют, все являются водородом.
Другой аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R1, R2 и R11 и R12, если они присутствуют, все являются водородом, R10 обозначает метил, и R3 выбран из водорода, фтора, брома, хлора, метила, этила, трифторметила, этенила, этинила и циано.
Другой аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R11 и R12, если они присутствуют, оба являются водородом, R10 обозначает метил или этил, R3 выбран из водорода, фтора, брома, хлора, метила, этила, трифторметила, этенила, этинила и циано, и R4 выбран из водорода, фтора, хлора, брома, метила, циано или трифторметила.
Другой аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R11 и R12, если они присутствуют, оба являются водородом, R10 обозначает метил или этил, R3 выбран из водорода, фтора, брома, хлора, метила, этила, трифторметила, этенила, этинила и циано, и R7 обозначает циклопропилметил или C1-C5 алкил, который может быть необязательно галогенирован одним или более радикалами, выбранными из хлора, брома или предпочтительно фтора.
Другой аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли, как определено выше, в котором R11 и R12, если они присутствуют, оба являются водородом, R10 обозначает метил или этил, R2, R5 и R8 обозначают водород, R3 выбран из водорода, фтора, брома, хлора, метила, этила, трифторметила, этенила, этинила и циано, и R7 обозначает C1-C5 алкил, который может быть необязательно галогенирован одним или более радикалами, выбранными из хлора, брома или предпочтительно фтора.
Один предпочтительный аспект настоящего изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1 обозначает водород, метил или этил;
R2, R3, R4 и R5 независимо обозначают водород, фтор, хлор, бром, нитро, циано, метил, этил, этенил, этинил, трифторметил, метокси, этокси или метоксикарбонил;
R6, если он присутствует, является водородом, гидрокси, фтором, бромом, хлором, гидроксиметилом, C1-C5 алкилом, C1-C5 алкокси, C2-C5 алкенилом, C2-C5 алкинилом, галоген (C1-C5) алкилом, галоген (C1-C5) алкокси, C2-C5 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкилом, ди(C1-C3 алкил)амино, C1-C3 алкилпиперазинилом, пиперидилом, пирролидинилом, галогенфенилом, фенилом или морфолинилом, причем R6 предпочтительно отличается от водорода;
R7 обозначает C1-C5 алкил, галоген (C1-C4) алкил, галоген, пиперидил, морфолинил, пирролидинил, C3-C6 циклоалкил, который может быть незамещенным или замещенным одной или более метильными группами, C2-C5 алкенил, причем R7 предпочтительно обозначает галоген (C1-C4) алкил;
R8 и R9 независимо обозначают водород, галоген или трифторметил;
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил; и
R11 и R12, если они присутствуют, являются независимо водородом или метилом.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1, R2 и R5 обозначает водород;
R3 обозначает водород, фтор, хлор, циано, метил, этенил, этинил или трифторметил;
R4 обозначает водород, фтор, хлор, циано, метил, этил или трифторметил;
R6, если он присутствует, обозначает водород, гидрокси, фтор, бром, хлор, метил, гидроксиметил, метокси, трифторметил, диэтиламино, пиперидил, пирролидинил, трифторфенил, фенил или морфолинил, причем R6 предпочтительно отличается от водорода;
R7 обозначает метил, изопропил, трет-бутил, трифторметил, хлор, бром, циклопропил, метилциклопропил, пиперидил, пирролидинил или морфолинил, и R7 предпочтительно обозначает трифторметил;
R8 обозначает водород;
R11 и R12, если они присутствуют, являются водородом;
R9 обозначает водород или трифторметил; и
R10 обозначает метил.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (I), (II) или (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, хлор, бром, циано, метил, этил, этенил, этинил или трифторметил;
R4 и R5 независимо обозначают водород, фтор, хлор, циано, метил, этил или трифторметил;
R6, если он присутствует, является водородом, фтором, хлором, бромом, метилом, метокси, пиперидилом или морфолинилом;
R7 обозначает изопропил, трет-бутил или, предпочтительно, трифторметил;
R8 обозначает водород;
R11 и R12, если они присутствуют, являются водородом;
R9 обозначает водород или трифторметил; и
R10 обозначает метил.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (I) или (III), к его изомеру или фармацевтически приемлемой соли,
в котором
X обозначает -CH=CH-, -C(CH3)=CH-, -CH=C(CH3)-, -C(CH3)=C(CH3)-, -C(C2H5)=CH-, -CH=C(C2H5)-, -CF=CH-, -CH=CF- или C≡C;
R1 обозначает водород, фтор, метил или этил;
R2, R3, R4 и R5 независимо обозначают водород, фтор, хлор, бром, нитро, циано, метил, этил, этенил, этинил, трифторметил, метокси, этокси или метоксикарбонил;
R6 обозначает водород, гидрокси, фтор, бром, хлор, гидроксиметил, C1-C6 алкил, C1-C6 алкокси, C2-C6 алкенил, C2-C6 алкинил, галоген (C1-C6) алкил, галоген (C1-C6) алкокси, C2-C6 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, ди(C1-C6 алкил)амино, C1-C6 алкиламино, C1-C3 алкокси (C1-C5) алкиламино, C3-C6 циклоалкил, который может быть незамещенным или замещенным одной или более метильными группами, C3-C6 циклоалкиламино, который может быть незамещенным или замещенным одной или более метильными группами, C3-C6 циклоалкокси, C3-C6 оксациклоалкокси, N-(C1-C2)алкокси(C1-C3)алкил-N-(C1-C3)алкиламино, N-(C3-C6)циклоалкил-N-(C1-C3)алкиламино, C1-C3 алкилпиперазинил, пиперидил, пирролидинил, галогенфенил, фенил, фенокси, пиридинилокси, фениламино, галогенфенокси или морфолинил;
R7 обозначает C1-C5 алкил, галоген (C1-C4) алкил, галоген, пиперидил, морфолинил, пирролидинил, C3-C6 циклоалкил, который может быть незамещенным или замещенным одной или более метильными группами, C2-C5 алкенил;
R8 и R9 независимо обозначают водород, галоген или трифторметил; и
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1, R2 и R5 обозначают водород;
R3 обозначает водород, фтор, хлор, циано, метил, этенил, этинил или трифторметил;
R4 обозначает водород, фтор, хлор, циано, метил, этил или трифторметил;
R6 обозначает водород, гидрокси, фтор, бром, хлор, метил, пропил, бутил, пентил, гидроксиметил, метокси, этокси, пропокси, бутокси, пентокси, метоксиметокси, метоксиэтокси, метоксипропокси, трифторметил, диэтиламино, метоксиметиламино, метоксиэтиламино, метоксипропиламино, циклобутиламино, циклопентиламино, циклогексиламино, этиламино, пропиламино, бутиламино, пентиламино, N,N-диметиламино, N-метил-N-этиламино N,N-диэтиламино, N-метил-N-пропиламино, N-этил-N-пропиламино, N,N-дипропиламино, N-метил-N-бутиламино, N-этил-N-бутиламино, N-метил-N-метоксиметиламино, N-метил-N-метоксиэтиламино, N-метил-N-метоксипропиламино, N-метил-N-циклобутиламино, N-метил-N-циклопентиламино, N-метил-N-циклогексиламино, фенокси, галогенфенокси, пиперидил, пирролидинил, трифторфенил, фенил или морфолинил, причем R6 предпочтительно отличается от водорода;
R7 обозначает метил, изопропил, трет-бутил, трифторметил, хлор, бром, циклопропил, метилциклопропил, пиперидил, пирролидинил или морфолинил, и предпочтительно обозначает трифторметил;
R8 обозначает водород;
R11 и R12 обозначают водород;
R9 обозначает водород или трифторметил; и
R10 обозначает метил.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, хлор, бром, циано, метил, этил, этенил, этинил или трифторметил;
R4 и R5 независимо обозначают водород, фтор, хлор, циано, метил, этил или трифторметил;
R6 обозначает водород, фтор, хлор, бром, метил, н-бутил, метокси, н-бутилокси, изобутилокси, втор-бутилокси, метоксиэтокси, метоксиэтиламино, диэтиламино, н-бутиламино, циклопентиламино, фенокси, N-пирролидинил, N-пиперидил или N-морфолинил, причем в одном аспекте R6 отличается от водорода;
R7 обозначает изопропил, трет-бутил или предпочтительно трифторметил;
R8 обозначает водород;
R11 и R12 обозначают водород;
R9 обозначает водород или трифторметил; и
R10 обозначает метил.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, этенил или этинил;
R4 обозначает водород или фтор;
R5 обозначает водород;
R6 обозначает водород, гидрокси, фтор, бром, хлор, метил, пропил, бутил, пентил, гидроксиметил, метокси, этокси, пропокси, бутокси, пентокси, метоксиметокси, метоксиэтокси, метоксипропокси, этоксиэтокси, трифторметил, N,N-диметиламино, N-метил-N-этиламино N,N-диэтиламино, N-метил-N-пропиламино, N-этил-N-пропиламино, N,N-дипропиламино, N-метил-N-бутиламино, N-этил-N-бутиламино, метоксиметиламино, метоксиэтиламино, метоксипропиламино, N-метил-N-метоксиметиламино, N-метил-N-метоксиэтиламино, N-метил-N-метоксипропиламино, циклобутиламино, циклопентиламино, циклогексиламино, N-метил-N-циклобутиламино, N-метил-N-циклопентиламино, N-метил-N-циклогексиламино, этиламино, пропиламино, бутиламино, пентиламино, фенокси, галогенфенокси, N-пиперидил, N-пирролидинил, трифторфенил, фенил или N-морфолинил,
причем R6 в одном аспекте отличается от водорода;
R7 обозначает изопропил, трет-бутил или предпочтительно трифторметил;
R8 обозначает водород;
R9 обозначает водород или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначает водород.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1 обозначает водород;
R2 обозначает водород;
R3 обозначает водород, этенил или этинил;
R4 обозначает водород или фтор;
R5 обозначает водород;
R6 обозначает водород, бром, хлор, н-бутил, метокси, изобутилокси, втор-бутилокси, метоксиэтокси, диэтиламино, N-пирролидинил, N-пиперидил, N-морфолинил, циклопентиламино, н-бутиламино, фенокси, н-бутилокси, метоксиэтиламино, причем R6 в одном аспекте отличается от водорода;
R7 обозначает изопропил, трет-бутил или предпочтительно трифторметил;
R8 обозначает водород;
R9 обозначает водород или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначают водород.
Другой аспект настоящего изобретения относится к соединению формулы (III), как описано далее, к его изомеру или фармацевтически приемлемой соли, в котором
R1 обозначает водород или метил, причем, если R1 обозначает метил, то соединение может быть чистым энантиомером или может быть смесью (R)- и (S)-энантиомеров; и C-атом, к которому присоединен R1, находится предпочтительно в (R)-конфигурации;
один из R2 и R5 обозначает водород, а другой обозначает водород, метил или галоген, предпочтительно фтор;
R3 выбран из водорода, фтора, брома, хлора, метила, этила, трифторметила, этенила, этинила и циано, предпочтительно водорода, фтора, хлора, метила, этила, этенила, этинила и циано;
R4 обозначает водород, фтор, хлор, циано, метил или этил;
R6 имеет значения, описанные в различных вариантах осуществления в рамках этой заявки;
R7 обозначает C1-C5 алкил или более предпочтительно C1-C4 алкил или C1-C3 алкил, который галогенирован одним или более радикалами, выбранными из хлора, брома или предпочтительно фтора, причем R7 особенно предпочтительно обозначает CF3;
один из R8 и R9 обозначает водород, а другой обозначает галоген, CF3 или предпочтительно водород;
R10 обозначает метил, этил или этенил, и предпочтительно метил;
R11 обозначает водород;
R12 обозначает водород, метил, этил или пропил, и предпочтительно водород.
Другой аспект настоящего раскрытия относится к соединению формулы (III), как описано здесь, к его изомеру или фармацевтически приемлемой соли, в котором
R6 обозначает галоген, нитро, карбокси, C1-C10 алкил, C1-C10 алкокси, C2-C10 алкенил, C2-C10 алкинил, C1-C10 алкилтио, C1-C10 алкилсульфонил, C1-C10 алкилкарбонил, C1-C10 алкоксикарбонил, C2-C10 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, пиперидил, C1-C5 алкокси (C1-C5) алкиламино, C1-C10 алкиламино, ди(C1-C10 алкил)амино, C3-C8 циклоалкил, C3-C8 циклоалкиламино, C3-C8 циклоалкокси, C3-C8 оксациклоалкил-окси, N-(C1-C5)алкокси(C1-C5)алкил-N-(C1-C5)алкиламино, N-(C3-C8)циклоалкил-N-(C1-C5)алкиламино, N-арил-N-(C1-C5)алкиламино, предпочтительно N-фенил-N-(C1-C5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, арилтио, предпочтительно фенилтио, тиенил, гетероариламино, арилокси, предпочтительно фенокси, пирролидинил или морфолинил, при условии, что R6 не обозначает замещенный гидроксилом алкиламино, причем предпочтительно
R6 обозначает хлор, бром, метил, этил, пропил, бутил, пентил, трифторметил, этоксиметил, метоксипропил, фенилэтил, фенилэтенил, этинил, метоксипропинил, диэтиламинопропинил, фенил, галогенфенил, метоксифенил, тиенил, метокси, этокси, пропокси, бутокси, пентокси, трифторэтокси, циклопентокси, циклопропилметокси, метоксиэтокси, тетрагидропиранилокси, фенокси, галогенфенокси, бензилокси, этилтио, пропилтио, бутилтио, пентилтио, метиламино, этиламино, пропиламино, бутиламино, пентиламино, метоксиэтиламино, этоксиэтиламино, метоксипропиламино, циклобутиламино, циклопентиламино, циклогексиламино, бензиламино, фениламино, N,N-диметиламино, N-метил-N-пропиламино, N-этил-N-пропиламино, N,N-дипропиламино, N-метил-N-бутиламино, N-этил-N-бутиламино, N-этил-N-фениламино, N-метил-N-фениламино, N-пирролидинил, N-пиперидил, этоксикарбонил-N-пиперидил или N-морфолинил, причем предпочтительно
R6 обозначает этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 1-метилбутил, 2-метилбутил, 3-метилбутил, н-пентил, этоксиметил, 2-фенилэтил, фенилэтенил, фенил, фторфенил, тиенил, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, 3-метилбутокси, 2,2,2-трифторэтокси, циклопентокси, циклопропилметокси, фенокси, этилтио, пропилтио, изопропилтио, метиламино, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиметиламино, метоксиэтиламино, этоксиэтиламино, циклопентиламино, бензиламино, фениламино, N-метил-N-фениламино, N-метил-N-пропиламино, N-пирролидинил, N-пиперидил или этоксикарбонил-N-пиперидил, причем более предпочтительно
R6 обозначает этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, 2-фенилэтил, н-бутокси, изобутокси, втор-бутокси, метиламино, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиэтиламино, этоксиэтиламино, бензиламино или N-метил-N-фениламино, причем более предпочтительно
R6 обозначает н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, 2-фенилэтил, н-бутокси, изобутокси, втор-бутокси, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиэтиламино, бензиламино или N-метил-N-фениламино, причем еще более предпочтительно
R6 обозначает C2-C5 алкил, C1-C4 алкиламино или метоксиэтиламино, причем особенно предпочтительно
R6 обозначает C3-C5 алкил или C2-C4 алкиламино, причем особенно предпочтительно
R6 обозначает C2-C4 алкил или C1-C3 алкиламино, причем особенно предпочтительно
R6 обозначает линейный или разветвленный C3 алкил, линейный C4 алкил или линейный (C2-C3) алкиламино.
Предпочтительные примеры соединений согласно изобретению выбраны из группы, состоящей из следующих соединений:
3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(6-метокси-4-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-метокси-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-2-хлор-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-хлор-4-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(6-трет-бутил-2-морфолин-4-ил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-метокси-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-гидрокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-метил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-метил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-циклопентиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутил-5-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропилокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутокси-6-трифторметил-пиридин-3-ил)-акриламид,
3-[2-(тетрагидро-фуран-3-илокси)-6-трифторметил-пиридин-3-ил]-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(пиридин-3-илокси)-6-трифторметил-пиридин-3-ил]-акриламид и
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-фтор-фенокси)-6-трифторметил-пиридин-3-ил]-акриламид.
Предпочтительные примеры соединений согласно изобретению выбраны из группы, состоящей из следующих соединений:
3-(6-трет-бутил-пиридин-3-ил)-N-(3-хлор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-пиридин-3-ил)-N-(4-метансульфониламино-3-винил-бензил)-акриламид,
N-(3-Фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-винил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-хлор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(6-трет-бутил-2-метокси-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-винил-бензил)-акриламид,
3-(6-трет-бутил-2-метокси-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(6-трет-бутил-4-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-4-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(6'-трифторметил-3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-3'-ил)-акриламид,
3-(2-бром-6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-бром-6-трет-бутил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид и
N-(3-фтор-4-метансульфониламино-бензил)-3-(6'-трифторметил-3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-3'-ил)-акриламид.
Особенно предпочтительными соединениями согласно настоящему изобретению являются
3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-метокси-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-2-хлор-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-2-морфолин-4-ил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-циклопентиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутил-5-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропилокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутокси-6-трифторметил-пиридин-3-ил)-акриламид,
3-[2-(тетрагидро-фуран-3-илокси)-6-трифторметил-пиридин-3-ил]-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид и
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-фтор-фенокси)-6-трифторметил-пиридин-3-ил]-акриламид.
Особенно предпочтительными соединениями согласно настоящему изобретению являются
3-(6-трет-бутил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-пиридин-3-ил)-N-(4-метансульфониламино-3-винил-бензил)-акриламид,
N-(4-метансульфониламино-3-винил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(6-трет-бутил-2-метокси-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-винил-бензил)-акриламид,
3-(6-трет-бутил-2-метокси-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(6-трет-бутил-4-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(6-трет-бутил-4-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(6'-трифторметил-3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-3'-ил)-акриламид,
3-(2-бром-6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид и
3-(2-бром-6-трет-бутил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (I) или (III), к его изомеру или фармацевтически приемлемой соли,
в котором
X обозначает -CH=CH-, -C(CH3)=CH-, -CH=C(CH3)-, -C(CH3)=C(CH3)-, -C(C2H5)=CH-, -CH=C(C2H5)-, -CF=CH-, -CH=CF- или C≡C;
R1 обозначает водород, фтор, метил или этил;
R2, R3, R4 и R5 независимо обозначают водород, фтор, хлор, бром, нитро, циано, метил, этил, этенил, этинил, трифторметил, метокси, этокси или метоксикарбонил;
R6 обозначает C1-C2 алкокси (C1-C3) алкил, фенил (C1-C3) алкил, фенил (C2-C3) алкенил, C1-C3 алкоксиалкинил, ди(C1-C3)алкиламиноалкинил, (C1-C3) алкоксифенил, тиенил, пиридинил, галогенпиридинил, (C3-C6) циклоалкил (C1-C3) алкокси, фенил (C1-C3) алкокси, C1-C5 алкилтио, фенилтио, фенил (C1-C3) алкиламино, ариламино, N-фенил-N-(C1-C3)алкиламино, гидрокси(C1-C3)алкил-N-пирролидинил, C1-C2 алкокси-N-пирролидинил, (C1-C3) алкоксикарбонил пиперидил, пиперазинил или C1-C3 алкилпиперазинил, причем R6 в одном варианте осуществления отличается от водорода;
R7 обозначает C1-C5 алкил, галоген (C1-C4) алкил, галоген, пиперидил, морфолинил, пирролидинил, C3-C6 циклоалкил, который может быть незамещенным или замещенным одной или более метильными группами, C2-C5 алкенил, причем R7 предпочтительно обозначает галоген (C1-C4) алкил;
R8 и R9 независимо обозначают водород, галоген или трифторметил; и
R10 обозначает C1-C5 алкил, галоген (C1-C5) алкил или C2-C5 алкенил.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, метил, этил, циано, этенил, этинил или трифторметил;
R4 обозначает водород, фтор, хлор или метил;
R5 обозначает водород;
R6 обозначает фтор, хлор, бром, метил, этил, пропил, бутил, пентил, трифторметил, этоксиметил, метоксипропил, фенилэтил, фенилэтенил, этинил, метоксипропинил, диэтиламинопропинил, фенил, галогенфенил, метоксифенил, тиенил, пиридинил, галогенпиридинил, метокси, этокси, пропокси, бутокси, пентокси, трифторэтокси, циклопентокси, циклопропилметокси, метоксиэтокси, тетрагидропиранилокси, фенокси, галогенфенокси, бензилокси, пиридинилокси, этилтио, пропилтио, бутилтио, пентилтио, фенилтио, этиламино, пропиламино, бутиламино, пентиламино, метоксиэтиламино, этоксиэтиламино, метоксипропиламино, циклобутиламино, циклопентиламино, циклогексиламино, бензиламино, фениламино, N,N-диметиламино, N-метил-N-пропиламино, N-этил-N-пропиламино, N,N-дипропиламино, N-метил-N-бутиламино, N-этил-N-бутиламино, N-этил-N-фениламино, N-метил-N-фениламино, N-пирролидинил, метокси N-пирролидинил, гидроксиметил N-пирролидинил, N-пиперидил, этоксикарбонил N-пиперидил, пиперазинил или N-морфолинил;
R7 обозначает изопропил, трет-бутил или трифторметил;
R8 обозначает водород;
R9 обозначает водород или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначают водород.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, хлор, бром, циано, метил, этил, этенил, этинил или трифторметил;
R4 и R5 независимо обозначают водород, фтор, хлор, циано, метил или этил;
R6 обозначает н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, 2-фенилэтил, н-бутокси, изобутокси, втор-бутокси, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиэтиламино, этоксиэтиламино, бензиламино, фениламино, N-этил-N-фениламино или N-метил-N-фениламино;
R7 обозначает изопропил, трет-бутил или трифторметил;
R8 обозначает водород или хлор;
R9 обозначает водород или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначают водород.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R4 обозначает водород, фтор, хлор или метил;
R3 обозначает водород, фтор, метил, циано, этенил, этинил или трифторметил;
R5 обозначает водород;
R6 обозначает этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, этоксиметил, 2-фенилэтил, фенилэтенил, фенил, фторфенил, тиенил, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, 3-метилбутокси, 2,2,2-трифторэтокси, циклопентокси, циклопропилметокси, фенокси, этилтио, пропилтио, изопропилтио, фенилтио, этиламино, н-пропиламино изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиметиламино, метоксиэтиламино, этоксиэтиламино, циклопентиламино, бензиламино, фениламино, N-этил-N-фениламино, N-метил-N-фениламино, N-метил-N-пропиламино, N-пирролидинил, метокси N-пирролидинил, N-пиперидил или этоксикарбонил-N-пиперидил;
R7 обозначает изопропил, трет-бутил или трифторметил;
R8 обозначает водород или хлор;
R9 обозначает водород или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначают водород.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, метил, циано, этенил или этинил;
R4 обозначает водород, фтор или метил;
R5 обозначает водород;
R6 обозначает н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, 2-фенилэтил, н-бутокси, изобутокси, втор-бутокси, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиэтиламино, этоксиэтиламино, бензиламино, N-этил-N-фениламино или N-метил-N-фениламино;
R7 обозначает изопропил, трет-бутил или трифторметил;
R8 и R9 обозначает водород;
R10 обозначает метил; и
R11 и R12 обозначают водород.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы (III), к его изомеру или фармацевтически приемлемой соли,
в котором
R1 обозначает водород или метил;
R2 обозначает водород;
когда R4 обозначает фтор, R3 обозначает водород, фтор, метил или этинил, или когда R4 обозначает водород,
R3 обозначает метил;
R5 обозначает водород;
R6 обозначает н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, 2-фенилэтил, н-бутокси, изобутокси, втор-бутокси, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиэтиламино, этоксиэтиламино, бензиламино, N-этил-N-фениламино или N-метил-N-фениламино;
R7 обозначает изопропил, трет-бутил или трифторметил;
R8 и R9 обозначают водород;
R10 обозначает метил; и
R11 и R12 обозначают водород.
В предпочтительном аспекте настоящего изобретения в соединениях формулы III, как описано здесь, R7 обозначает группу CF3. Другой вариант осуществления настоящего раскрытия относится к соединениям, имеющим формулу III, как описано здесь, в которой R7 обозначает CF2Cl или CF2CF3.
Предпочтительные примеры соединений согласно изобретению выбраны из группы, состоящей из следующих соединений:
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2,2,2-трифтор-этокси)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-циклопентиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-циклопропилметокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метил-бутокси)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-тиен-3-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-винил-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенилтио-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-этил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-стирил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(метил-пропил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(метил-пропил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(метил-фенил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(метил-фенил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-[2-(метил-фенил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
(R)-3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
3-(2-этилтио-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изобутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропилтио-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид,
3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-пиперид-1-ил-6-трифторметил-пиридин-3-ил]-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-[2-пиперид-1-ил-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-трифторметил-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
(R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
(R)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид,
N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид и
(S)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид,
включая их изомеры, рацемические смеси и фармацевтически приемлемые соли.
Предпочтительные примеры соединений согласно изобретению выбраны из группы, состоящей из следующих соединений:
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(метил-фенил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изобутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
(R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид,
(R)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид и
(R)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид,
включая их изомеры, рацемические смеси и фармацевтически приемлемые соли.
Предпочтительные примеры соединений согласно изобретению выбраны из группы, состоящей из следующих соединений:
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-1-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(2,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-(3-этенил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-хлор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-хлор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(2,5-дифтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3,5-дифтор-4-метансульфониламино-бензиламид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты,
[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты,
N-(4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-этенсульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-этинил-5-фтор-4-метансульфониламино-бензиламид (Z)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты,
3-этинил-5-фтор-4-метансульфониламино-бензиламид (E)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты,
[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид (Z)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты,
[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид (E)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты и
N-(3-этенил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
включая их изомеры, рацемические смеси и фармацевтически приемлемые соли.
Другой аспект настоящего изобретения относится к соединениям формулы III, их изомерам или фармацевтически приемлемой соли, в которых
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, хлор, метил, циано, этенил или этинил;
R4 обозначает водород;
R5 обозначает фтор, хлор или метил, предпочтительно фтор;
R6 обозначает этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, этоксиметил, 2-фенилэтил, фенилэтенил, фенил, фторфенил, тиенил, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, 3-метилбутокси, 2,2,2-трифторэтокси, циклопентокси, циклопропилметокси, фенокси, этилтио, пропилтио, изопропилтио, этиламино, н-пропиламино изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиметиламино, метоксиэтиламино, этоксиэтиламино, циклопентиламино, бензиламино, фениламино, N-этил-N-фениламино, N-метил-N-фениламино, N-метил-N-пропиламино, N-пирролидинил, N-пиперидил или этоксикарбонил N-пиперидил, и причем R6 предпочтительно обозначает н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, 2-фенилэтил, н-бутокси, изобутокси, втор-бутокси, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиэтиламино, этоксиэтиламино, бензиламино, N-этил-N-фениламино или N-метил-N-фениламино;
R7 обозначает галоген (C1-C3) алкил, предпочтительно CF3;
R8 и R9 независимо обозначают водород, галоген или трифторметил, причем R8 предпочтительно представляет собой водород или хлор, и R9 обозначает водород;
R10 обозначает метил; и
R11 и R12 обозначают водород.
Другой аспект настоящего изобретения относится к соединению, имеющему формулу IV, к его изомеру или фармацевтически приемлемой соли:
 формула IV,
формула IV,
в которой
R1 обозначает водород, метил или этил;
R12 обозначает водород или C1-C3 алкил, предпочтительно водород или пропил;
R6 обозначает C2-C6 алкил, ди(C1-C6 алкил)амино, C1-C6 алкокси, 2,2,2-трифтор(C1-C3)алкокси, C1-C3 алкокси (C1-C5) алкиламино, C1-C6 алкиламино, C3-C6 циклоалкиламино, фенокси, фениламино, фенил (C1-C3) алкиламино, фенил (C1-C3) алкил, N-фенил-N-(C1-C5)алкиламино, метокси-N-пирролидинил или C1-C6 алкилтио;
R7 обозначает CF3, CF2Cl или CF2CF3;
и
R8 и R9 независимо обозначают водород, CF3 или галоген.
В особом аспекте настоящего раскрытия соединение формулы IV является таким, как описано выше, в котором
R1 обозначает водород или метил;
R6 обозначает C2-C5 алкил, C1-C4 алкиламино, метокси или метоксиэтиламино;
R7 обозначает CF3;
R8 и R9 обозначают водород; и
R12 обозначает водород.
Другой аспект настоящего изобретения относится к соединению, имеющему формулу V, к его изомеру или фармацевтически приемлемой соли:
 формула V,
формула V,
в которой
R1 обозначает водород, метил или этил;
R3 обозначает водород, фтор или хлор;
R6 обозначает C2-C6 алкил, ди(C1-C6 алкил)амино, C1-C6 алкокси, 2,2,2-трифтор(C1-C3)алкокси, C1-C3 алкокси (C1-C5) алкиламино, C1-C6 алкиламино, C3-C6 циклоалкиламино, фенокси, фениламино, фенил (C1-C3) алкиламино, фенил (C1-C3) алкил или N-фенил-N-(C1-C5)алкиламино;
R7 обозначает CF3, CF2Cl или CF2CF3;
R8 и R9 независимо обозначают водород, CF3 или галоген; и
R12 обозначает водород или C1-C3 алкил, предпочтительно водород или пропил.
В одном особом аспекте изобретения соединение формулы V является таким, как описано выше, в котором
R1 обозначает водород или метил;
R3 обозначает водород или фтор;
R6 обозначает C2-C5 алкил, C1-C4 алкиламино, метокси или метоксиэтиламино;
R7 обозначает CF3;
R8 и R9 оба обозначают водород; и
R12 обозначает водород.
Другой аспект настоящего изобретения относится к соединению, имеющему формулу VI, к его изомеру или фармацевтически приемлемой соли:
 ,
,
в которой
W обозначает водород или фтор;
X обозначает -CR11=CR12- или -C≡C-;
R1 выбран из водорода и C1-C3 алкила;
R6 обозначает гидрокси, галоген, нитро, карбокси, C1-C10 алкил, C1-C10 алкокси, C2-C10 алкенил, C2-C10 алкинил, C1-C10 алкилтио, C1-C10 алкилсульфонил, C1-C10 алкилкарбонил, C1-C10 алкоксикарбонил, C2-C10 алкенилокси, C1-C5 алкокси (C1-C5) алкокси, C1-C5 алкокси (C1-C5) алкокси (C1-C5) алкил, пиперидил, C1-C5 алкокси (C1-C5) алкиламино, C1-C10 алкиламино, ди(C1-C10 алкил)амино, C3-C8 циклоалкил, C3-C8 циклоалкиламино, C3-C8 циклоалкокси, C3-C8 оксациклоалкил-окси, N-(C1-C5)алкокси(C1-C5)алкил-N-(C1-C5)алкиламино, N-(C3-C8)циклоалкил-N-(C1-C5)алкиламино, N-арил-N-(C1-C5)алкиламино, предпочтительно N-фенил-N-(C1-C5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, гетероарил, предпочтительно тиенил, гетероариламино, арилокси, предпочтительно фенокси, пирролидинил или морфолинил;
R11 и R12, если они присутствуют, независимо выбраны из водорода и C1-C3 алкила, предпочтительно водорода или пропила;
R7 обозначает CF2CF3, CF2Cl или предпочтительно CF3;
R8 и R9 независимо выбраны из водорода, галогена или CF3,
причем
- каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилсульфониле, алкилкарбониле, алкиламино или алкенилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (C1-C5) алкокси, (C3-C8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенного галогеном (C1-C5) алкиламино, фенила, который может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C3 алкила, или галоген (C1-C3) алкила, или незамещенного или замещенного галогеном ди(C1-C5)алкиламино,
- каждый арил или гетероарил, также как часть группы, например, в ариламино, арилокси, гетероарилокси или гетероариламино, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного C1-C5 алкила, незамещенного C1-C5 алкокси или галоген (C1-C5) алкила,
- каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
- каждый пиперидил или морфолинил может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном C1-C3 алкилом, гидрокси (C1-C3) алкилом, C1-C3 алкокси, (C1-C3) алкоксикарбонилом или гидроксилом.
Один аспект настоящего изобретения относится к соединениям общей формулы VI, как описано выше, в которой
• R8 и R9 оба являются водородом, и/или
• X обозначает -CH=CH-, и/или
• X обозначает -CH=CH-, и W, R8 и R9 являются водородом, и/или
• R1 обозначает водород или метил; и/или
• R6 выбран из C2-C6 алкила, ди(C1-C6 алкил)амино, 2,2,2-трифтор(C1-C3)алкокси, C1-C3 алкокси (C1-C5) алкиламино, C1-C6 алкиламино, C3-C6 циклоалкиламино, фенила, фениламино, фенил (C1-C3) алкиламино, фенил (C1-C3) алкила или N-фенил-N-(C1-C5)алкиламино, причем каждый фенил может быть замещен одним или более галогенами; и/или
• R7 обозначает CF3.
Другой аспект настоящего изобретения относится к соединениям общей формулы VI, как описано здесь, в которой
• R1 обозначает водород или метил; и/или
• R6 выбран из C2-C5 алкила, C1-C4 алкиламино или метоксиэтиламино, предпочтительно R6 обозначает -NH-(C1-C4) алкил или линейный или разветвленный C2-C5 алкил; и/или
• R7 обозначает CF3; и/или
• R12 обозначает водород.
Другой предпочтительный вариант осуществления изобретения относится к соединению формулы VI, как описано выше, в которой
• W, R8 и R9 обозначают водород;
• X обозначает -CH=CH-;
• R6 выбран из C2-C5 алкила, C1-C4 алкиламино или метоксиэтиламино, предпочтительно R6 обозначает -NH-(C1-C4) алкил или линейный или разветвленный C2-C5 алкил;
• R1 обозначает водород или метил; и
• R7 обозначает CF3.
Другой аспект настоящего изобретения относится к соединениям формулы I, III, IV, V или VI, как описано здесь, в которых R1 обозначает водород, метил или этил, предпочтительно водород или метил. В более частных вариантах осуществления, если R1 обозначает метил или этил, то атом, к которому присоединен R1, находится предпочтительно в (R)-конфигурации.
Соединения формулы (I), (II), (III), (IV), (V) и (VI) согласно настоящему изобретению могут химически синтезироваться в соответствии со следующими схемами реакции. Однако они приведены только для иллюстрации изобретения и не предназначены для ограничения его объема.
[Схема 1]
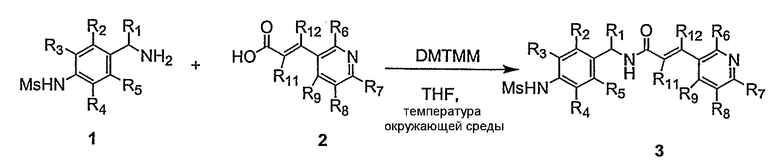
Схема 1 показывает способ синтеза акриламидного соединения с различными заместителями. Замещенный бензиламин (1) вводят в реакцию с пиридинилакриловой кислотой (2), получая бензилпиридинилакриламид (3) с использованием DMTMM {4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолинийхлорид} (Tetrahedron Lett., 1999, 40, 5327).
[Схема 2]
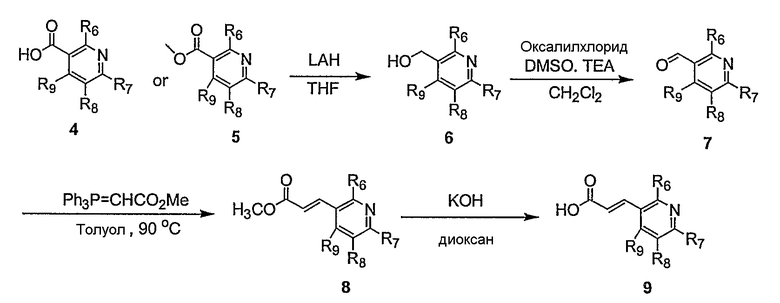
Схема 2 показывает способ синтеза пиридинилакриловой кислоты (9) с различными заместителями. Замещенный пиридинкарбоксальдегид (7) получают известными способами. Замещенную никотиновую кислоту (4) или эфир никотиновой кислоты (5) превращают в соответствующий пиридинкарбоксальдегид (7) через пиридинилметиловый спирт (6). Пиридинилметиловый спирт превращают в пиридинкарбоксальдегид (7) через окисление согласно Swern. Пиридинкарбоксальдегид (7) превращают в эфир метилпиридинилакриловой кислоты (8) реакцией Wittig. Эфир метилпиридинилакриловой кислоты (8) гидролизуют гидроксидом калия, получая пиридинилакриловую кислоту (9).
[Схема 3]
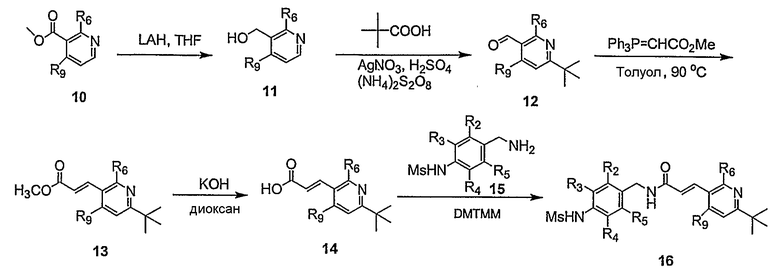
Схема 3 показывает способ синтеза амида пиридинилакриловой кислоты (16) с трет-бутильной группой. Замещенный пиридинкарбоксальдегид с трет-бутильной группой (12) получают восстановлением, сопровождаемым радикальным способом замещения (J. Heterocyclic Chem., 1989, 25, 45-48). Замещенный эфир никотиновой кислоты (10) превращают в соответствующий пиридин-3-метанол (11). Пиридинил-3-метанол вводят в реакцию с триметилуксусной кислотой и нитратом серебра, получая пиридинкарбоксальдегид (12) через радикальное замещение по Tada. Соединение (14) синтезируют из соединения (12) способом, подобным указанному для схемы 2. 4-трет-Бутилпиридинилакриловую кислоту (14) вводят в реакцию с соединением (15), получая соединение (16).
[Схема 4]
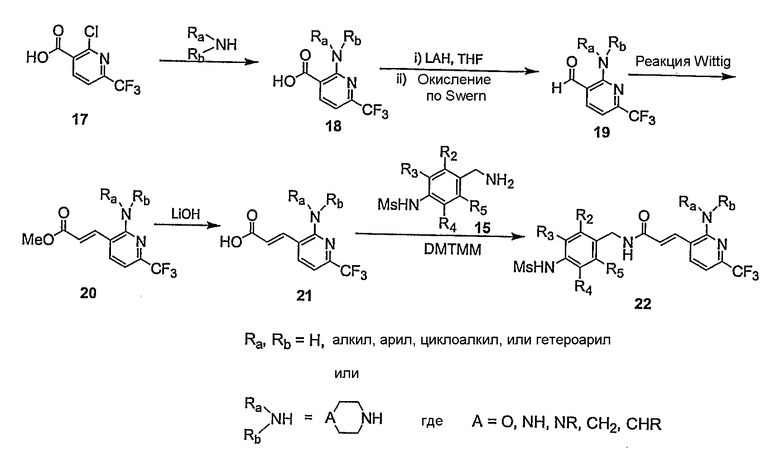
Схема 4 показывает способ синтеза амида пиридинилакриловой кислоты (22) с трифторметильной группой на пиридине. Эфир 2-хлор-6-трифторметил-никотиновой кислоты (17) вводят в реакцию с циклическим вторичным амином, получая соединение (18). Соединение (18) превращают в соединение (21) реакцией, подобной реакции схемы 2. Соединение (21) вводят в реакцию с соединением (15), получая соединение (22).
[Схема 5]
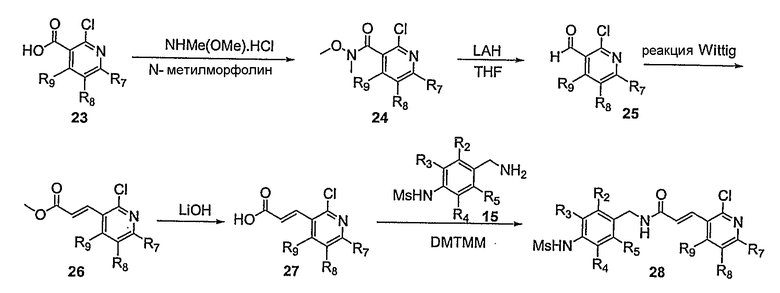
Схема 5 показывает способ синтеза пиридинилакриламида (28). 2-Хлор-никотиновую кислоту (23) вводят в реакцию с N,O-диметилгидроксиламингидрохлоридом, получая соединение (24). Соединение (24) восстанавливают LAH, получая соединение (25), которое превращают в эфир метилпиридинилакриловой кислоты (26) реакцией по Wittig. Соединение (26) гидролизуют, используя LiOH, получая пиридинилакриловую кислоту (27), которую затем вводят в реакцию с соединением (15), получая соединение (28).
[Схема 6]
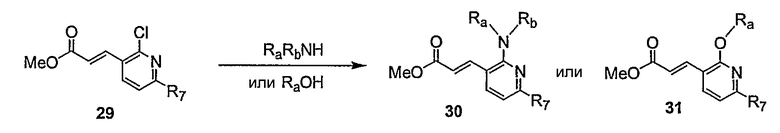
Схема 6 показывает способ синтеза эфира пиридинилакриловой кислоты или пиридинилакриловой кислоты (30) или (31) с 2-алкиламино-группой или 2-алкокси-группой на пиридине соответственно. Соединение (29) вводят в реакцию с различными аминами или спиртами, получая соединение (30) или соединение (31) с использованием или без использования основания, такого как K2CO3 или NaH.
[Схема 7]
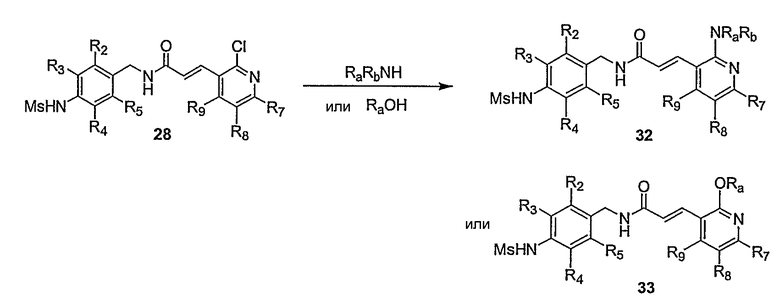
Схема 7 показывает способ синтеза пиридинилакриламида (32) или (33) с алкиламино- (или ариламино-) группой или алкокси-группой на пиридине соответственно. Соединение (28) вводят в реакцию с различными аминами или спиртами, получая соединение (32) или соединение (33) с использованием или без использования основания, такого как K2CO3 или NaH.
[Схема 8]
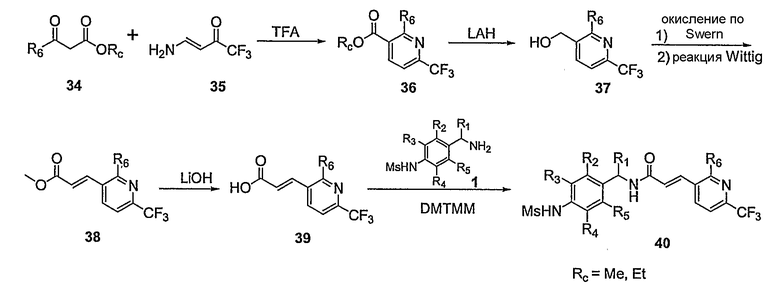
Схема 8 показывает способ синтеза пиридинилакриламида (40) с 2-алкильной группой на пиридине. Сложный кетоэфир (34) вводят в реакцию с соединением (35), получая алкиловый эфир 2-алкил-6-трифторметил-никотиновой кислоты (36), который восстанавливают до спиртового соединения (37) литий-алюминийгидридом. Окислением по Swern соединения (37) с последующей реакцией Wittig получают метиловый эфир 3-(2-алкил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (38). 3-(2-Алкил-6-трифторметил-пиридин-3-ил)-акриловую кислоту (39), полученную гидролизом соединения (38) с использованием LiOH, вводят в реакцию с соединением амина (1), получая пиридинилакриламид (40) с 2-алкильной группой на пиридине.
[Схема 9]
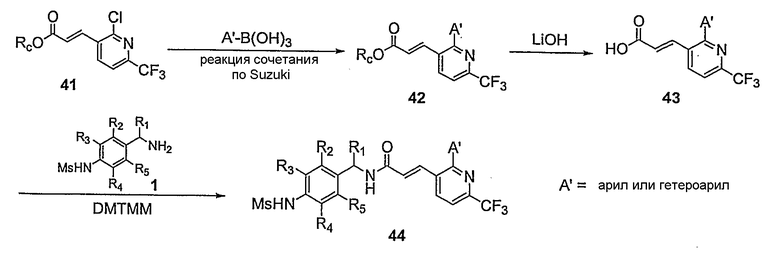
Схема 9 показывает способ синтеза пиридинилакриламида (44) с 2-арилом или 2-гетероарилом на пиридине. Соединение (42), полученное реакцией сочетания по Suzuki из соединения (41) с различными бороновыми кислотами с использованием микроволнового облучения, гидролизуют LiOH, получая акриловую кислоту (43). Акриловую кислоту (43) затем вводят в реакцию с соединением (1), получая пиридинилакриламид (44) с 2-арильной или 2-гетероарильной группой на пиридине.
[Схема 10]
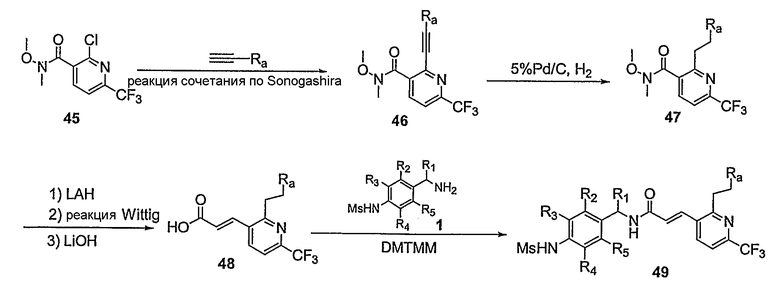
Схема 10 показывает другой способ синтеза пиридинилакриламида (49) с 2-алкильной группой на пиридине. Соединение (46), полученное реакцией сочетания Sonogashira из соединения (45) с различными алкинами с использованием микроволнового облучения, восстанавливают гидрированием, получая амид Weireb (47). Этот амид (47) восстанавливают до альдегида, и полученный альдегид подвергают реакции Wittig, сопровождаемой гидролизом с использованием LiOH, получая акриловую кислоту (48). Акриловую кислоту (48) затем вводят в реакцию с соединением (1), получая пиридинилакриламид (49) с 2-алкильной группой на пиридине.
[Схема 11]
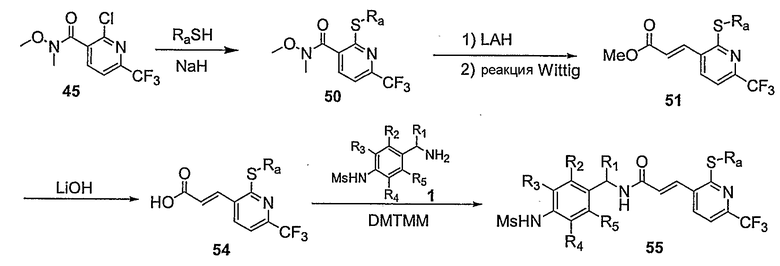
Схема 11 показывает способ синтеза пиридинилакриламида (53) с 2-алкилсульфинильной или 2-арилсульфинильной группой на пиридине. Соединение (50), полученное реакцией соединения (45) с различными алкилтиолами или арилтиолами с использованием NaH, восстанавливают литий-алюминийгидридом, получая альдегид, и полученный альдегид подвергают реакции Wittig, получая соединение (51). Соединение (51) гидролизуют LiOH, получая акриловую кислоту (54). Акриловую кислоту (54) затем вводят в реакцию с соединением (1), получая пиридинилакриламид (55) с 2-алкилтио или 2-арилтио группой на пиридине.
[Схема 12]
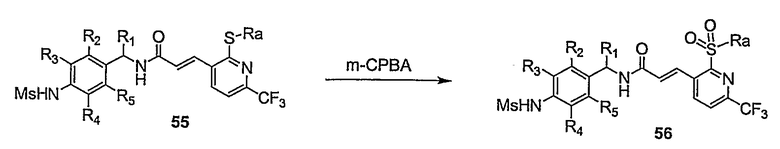
Схема 12 показывает способ синтеза пиридинилакриламида (56) с 2-алкилсульфонильной или 2-арилсульфонильной группой на пиридине. Соединение (55) окисляют mCPBA, получая пиридинилакриламид (56) с 2-алкилсульфонильной или 2-арилсульфонильной группой на пиридине.
[Схема 13]
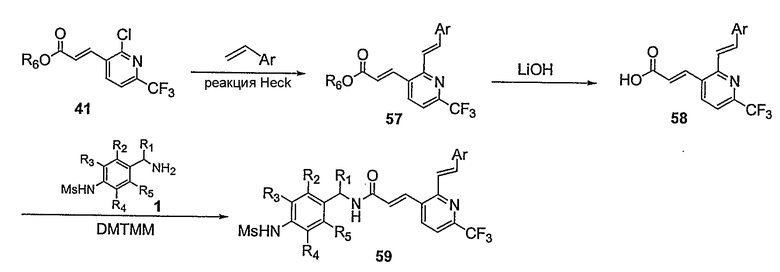
Схема 13 показывает способ синтеза пиридинилакриламида (59) с 2-стирильной группой на пиридине. Соединение (57), полученное реакцией Heck соединения (41) с использованием микроволнового облучения, гидролизуют с использованием LiOH, получая акриловую кислоту (58). Акриловую кислоту (58) затем вводят в реакцию с соединением (1), получая пиридинилакриламид (59) с 2-стирильной группой на пиридине.
[Схема 14]
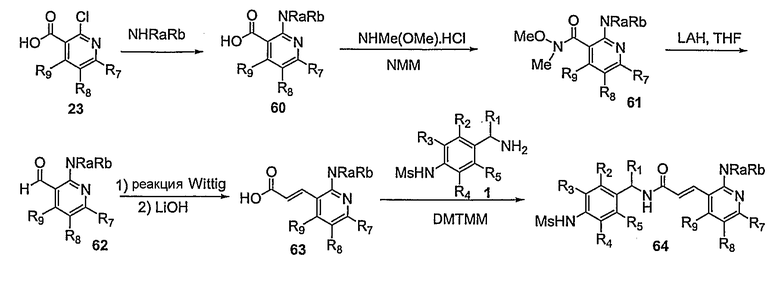
Схема 14 показывает способ синтеза пиридинилакриламида (64). Соединение 2-хлор-никотиновой кислоты (23) вводят в реакцию с различными аминами, получая никотиновую кислоту (60) с 2-алкиламино-, 2-диалкиламино-, 2-ариламино- или 2-N-алкил-N-арил-амино-группой, которую подвергают реакциям, подобным таковым из схемы 5, получая пиридинилакриловую кислоту (63). Пиридинилакриламид (64) затем получают реакцией пиридинилакриловой кислоты (63) с соединением амина (1).
[Схема 15]
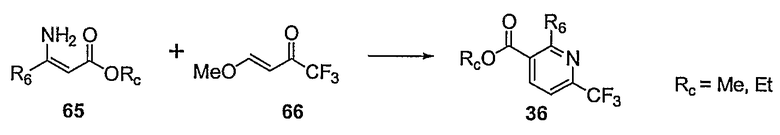
Схема 15 показывает другой способ синтеза алкилового эфира 2-алкил-6-трифторметил-никотиновой кислоты (36). Алкиловый эфир 3-Амино-алк-2-еновой кислоты (65) вводят в реакцию с соединением (66), получая алкиловый эфир 2-алкил-6-трифторметил-никотиновой кислоты (36).
[Схема 16]
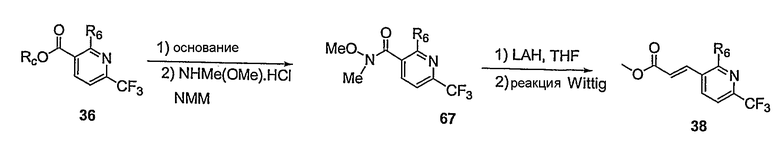
Схема 16 показывает другой способ синтеза метилового эфира 3-(2-алкил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (38). Алкиловый эфир 2-алкил-6-трифторметил-никотиновой кислоты (36) обрабатывают основанием, таким как LiOH, получая соответствующую кислоту, которую вводят в реакцию с N,O-диметилгидроксиламин гидрохлоридом, получая соединение амида (67). Соединение (67) восстанавливают с использованием LAH, получая соответствующий альдегид, который превращают в метиловый эфир 3-(2-алкил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (38) реакцией Wittig.
[Схема 17]
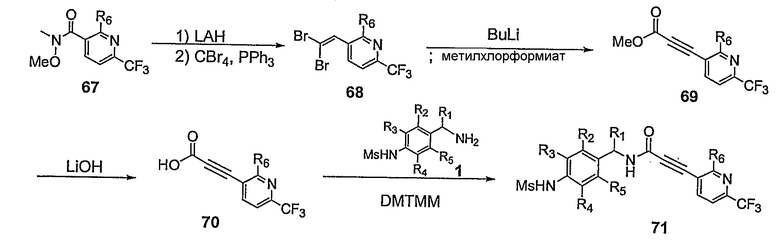
Схема 17 показывает способ синтеза бензиламида 3-пиридин-3-ил-пропиновой кислоты (71). Амид Weinreb (67) восстанавливают с использованием LAH, получая соответствующий альдегид, который превращают в дибромид (68). Соединение (68) обрабатывают BuLi, затем метилхлорформиатом, получая метиловый эфир 3-пиридин-3-ил-пропиновой кислоты (69), который затем превращают в 3-пиридин-3-ил-пропиновую кислоту (70) с использованием LiOH. Бензиламид 3-пиридин-3-ил-пропиновой кислоты (71) получают реакцией пропиновой кислоты (70) с соединением амина (1).
[Схема 18]
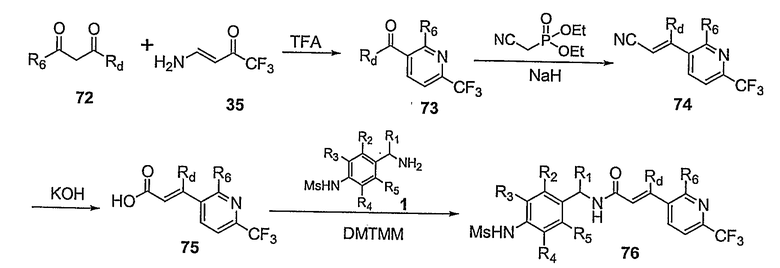
Схема 18 показывает способ синтеза пиридинилакриламида (76). Дикетон (72) вводят в реакцию с соединением (35), получая пиридинилкетон (73), который превращают в пиридинилакрилонитрил (74) реакцией с диэтиловым эфиром цианометилфосфоновой кислоты и NaH. 3-(2-Алкил-6-трифторметил-пиридин-3-ил)-акриловую кислоту (75), полученную гидролизом пиридинилакрилонитрила (74) с KOH, вводят в реакцию с соединением амина (1), получая пиридинилакриламид (76).
[Схема 19]
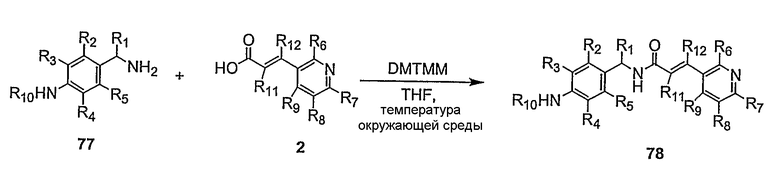
Схема 19 показывает способ синтеза акриламида с различными заместителями. Замещенный бензиламин (77) вводят в реакцию с пиридинилакриловой кислотой (2), получая бензилпиридинилакриламид (78) с использованием DMTMM.
Настоящее изобретение также относится к соединению формулы (I), (II), (III), (IV), (V) или (VI), к его изомеру или к его фармацевтически приемлемой соли для профилактики или лечения заболевания, связанного с патологическим возбуждением и/или аберрантной экспрессией ванилоидного рецептора, причем указанная композиция содержит соединение формулы (I), (II), (III), (IV), (V) или (VI), его изомер или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
В одном предпочтительном аспекте настоящее изобретение относится к соединению формулы (I), (II), (III), (IV), (V) или (VI), к его изомеру или к его фармацевтически приемлемой соли для лечения состояния, выбранного из группы, состоящей из боли, воспалительного заболевания сустава, невропатий, ВИЧ-связанной невропатии, повреждения нерва, нейродегенерации, инсульта, гиперчувствительности мочевого пузыря, включая недержание мочи, цистита, язвы желудка и двенадцатиперстной кишки, синдрома раздраженного кишечника (IBS) и воспалительного заболевания кишечника (IBD), позывов к дефекации, гастроэзофагеальной рефлюксной болезни (GERD), болезни Крона, астмы, хронического обструктивного легочного заболевания, кашля, невропатического/аллергического/воспалительного кожного заболевания, псориаза, зуда, пруриго, раздражения кожи, глаза или слизистой оболочки, гипернормального слуха, шума в ушах, вестибулярной гиперчувствительности, эпизодического головокружения, заболеваний сердца, таких как миокардиальная ишемия, нарушений, связанных с ростом волос, таких как эффлювиум, алопеция, ринита, панкреатита, вульводиния, геморрагический шок, и психиатрических нарушений, таких как тревожность или страхи.
В особенно предпочтительном аспекте настоящее изобретение относится к соединению формулы (I), (II), (III), (IV), (V) или (VI), к его изомеру или к его фармацевтически приемлемой соли, где боль является или связана с состоянием, выбранным из группы, состоящей из остеоартрита, ревматоидного артрита, анкилозирующего спондилита, диабетической нейропатической боли, послеоперационной боли, зубной боли, невоспалительной скелетно-мышечной боли (включая фибромиалгию, миофасциальный болевой синдром и боль в пояснице), мигрени, других типов головной боли, болей при раке кости, масталгии и висцеральной боли.
Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение формулы (I), (II), (III), (IV), (V) или (VI), его изомер или его фармацевтически приемлемую соль в качестве активного ингредиента вместе с фармацевтически приемлемым носителем.
Настоящее изобретение также относится к фармацевтической композиции для профилактики или лечения заболевания, связанного с патологическим возбуждением и/или аберрантной экспрессией ванилоидного рецептора, причем указанная композиция содержит соединение формулы (I), (II), (III), (IV), (V) или (VI), его изомер или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
В одном предпочтительном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I), (II), (III), (IV), (V) или (VI), его изомер или его фармацевтически приемлемую соль, для лечения состояния, выбранного из группы, состоящей из боли, воспалительного заболевания сустава, невропатий, ВИЧ-связанной невропатии, повреждения нерва, нейродегенерации, инсульта, гиперчувствительности мочевого пузыря, включая недержание мочи, цистита, язвы желудка и двенадцатиперстной кишки, синдрома раздраженного кишечника (IBS) и воспалительного заболевания кишечника (IBD), позывов к дефекации, гастроэзофагеальной рефлюксной болезни (GERD), болезни Крона, астмы, хронического обструктивного легочного заболевания, кашля, невропатического/аллергического/воспалительного кожного заболевания, псориаза, зуда, пруриго, раздражения кожи, глаза или слизистой оболочки, гипернормального слуха, шума в ушах, вестибулярной гиперчувствительности, эпизодического головокружения, заболеваний сердца, таких как миокардиальная ишемия, нарушений, связанных с ростом волос, таких как эффлювиум, алопеция, ринита, панкреатита, вульводиния, геморрагический шок, и психиатрических нарушений, таких как тревожность или страхи.
В особенно предпочтительном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I), (II), (III), (IV), (V) или (VI), его изомер или его фармацевтически приемлемую соль, для лечения боли, как описано выше, причем боль является или связана с состоянием, выбранным из группы, состоящей из остеоартрита, ревматоидного артрита, анкилозирующего спондилита, диабетической нейропатической боли, послеоперационной боли, зубной боли, невоспалительной скелетно-мышечной боли (включая фибромиалгию, миофасциальный болевой синдром и боль в пояснице), мигрени, других типов головной боли, болей при раке кости, масталгии и висцеральной боли.
Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение формулы (I), (II), (III), (IV), (V) или (VI), его изомер или его фармацевтически приемлемую соль, которая отличается тем, что она адаптирована для перорального введения.
В другом аспекте настоящее изобретение относится к способу ингибирования связывания ванилоидного лиганда с ванилоидным рецептором у пациента, включающему введение клеток, экспрессирующих ванилоидный рецептор в организме пациента, в контакт с соединением формулы (I), (II), (III), (IV), (V) или (VI), его изомером или его фармацевтически приемлемой солью.
В другом аспекте настоящее изобретение также относится к способу профилактики или лечения состояния, выбранного из группы, состоящей из боли, воспалительного заболевания сустава, невропатий, ВИЧ-связанной невропатии, повреждения нерва, нейродегенерации, инсульта, гиперчувствительности мочевого пузыря, включая недержание мочи, цистита, язвы желудка и двенадцатиперстной кишки, синдрома раздраженного кишечника (IBS) и воспалительного заболевания кишечника (IBD), позывов к дефекации, гастроэзофагеальной рефлюксной болезни (GERD), болезни Крона, астмы, хронического обструктивного легочного заболевания, кашля, невропатического/аллергического/воспалительного кожного заболевания, псориаза, зуда, пруриго, раздражения кожи, глаза или слизистой оболочки, гипернормального слуха, шума в ушах, вестибулярной гиперчувствительности, эпизодического головокружения, заболеваний сердца, таких как миокардиальная ишемия, нарушений, связанных с ростом волос, таких как эффлювиум, алопеция, ринита, панкреатита, вульводиния, геморрагический шок, и психиатрических нарушений, таких как тревожность или страхи, который включает введение млекопитающему, включая человека, терапевтически эффективного количества соединения формулы (I), (II), (III), (IV), (V) или (VI), его изомера или его фармацевтически приемлемой соли.
В особенно предпочтительном аспекте настоящее изобретение относится к способу лечения боли путем введения соединения формулы (I), (II), (III), (IV), (V) или (VI), его изомера или его фармацевтически приемлемой соли, как описано выше, причем боль является или связана с состоянием, выбранным из группы, состоящей из остеоартрита, ревматоидного артрита, анкилозирующего спондилита, диабетической нейропатической боли, послеоперационной боли, зубной боли, невоспалительной скелетно-мышечной боли (включая фибромиалгию, миофасциальный болевой синдром и боль в пояснице), мигрени, других типов головной боли, болей при раке кости, масталгии и висцеральной боли.
В другом аспекте настоящее изобретение относится к применению соединения формулы (I), (II), (III), (IV), (V) или (VI), его изомера или его фармацевтически приемлемой соли для получения лекарственного средства для профилактики или лечения состояния, которое связано с аберрантной экспрессией и/или аберрантной активацией ванилоидного рецептора.
В другом аспекте настоящее изобретение относится к применению соединения формулы (I), (II), (III), (IV), (V) или (VI), его изомера или его фармацевтически приемлемой соли в получении лекарственного средства для профилактики или лечения состояния, которое выбрано из группы, состоящей из боли, воспалительного заболевания сустава, невропатий, ВИЧ-связанной невропатии, повреждения нерва, нейродегенерации, инсульта, гиперчувствительности мочевого пузыря, включая недержание мочи, цистита, язвы желудка и двенадцатиперстной кишки, синдрома раздраженного кишечника (IBS) и воспалительного заболевания кишечника (IBD), позывов к дефекации, гастроэзофагеальной рефлюксной болезни (GERD), болезни Крона, астмы, хронического обструктивного легочного заболевания, кашля, невропатического/аллергического/воспалительного кожного заболевания, псориаза, зуда, пруриго, раздражения кожи, глаза или слизистой оболочки, гипернормального слуха, шума в ушах, вестибулярной гиперчувствительности, эпизодического головокружения, заболеваний сердца, таких как миокардиальная ишемия, нарушений, связанных с ростом волос, таких как эффлювиум, алопеция, ринита, панкреатита, вульводиния, геморрагический шок, и психиатрических нарушений, таких как тревожность или страхи.
В особенно предпочтительном аспекте настоящее изобретение относится к применению соединения формулы (I), (II), (III), (IV), (V) или (VI), его изомера для получения лекарственного средства для профилактики или лечения боли, как описано выше, причем состояние представляет собой боль, которая является или которая связана с состоянием, выбранным из группы, состоящей из остеоартрита, ревматоидного артрита, анкилозирующего спондилита, диабетической нейропатической боли, послеоперационной боли, зубной боли, невоспалительной скелетно-мышечной боли (включая фибромиалгию, миофасциальный болевой синдром и боль в пояснице), мигрени, других типов головной боли, болей при раке кости, масталгии и висцеральной боли.
Настоящее изобретение также относится к способу получения соединения, представленного формулой (III):
 ,
,
(III)
который включает введение в реакцию соединения, представленного формулой (IIIa):
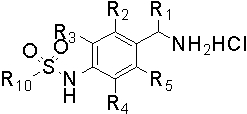 (IIIa),
(IIIa),
с соединением, представленным формулой (IIIb):
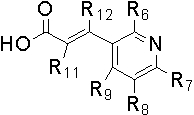 (IIIb),
(IIIb),
в которых
R1, R2, R3, R4, R5 R6, R7, R8, R9, R10, R11 и R12 являются такими, как описаны в любом из предыдущих вариантов осуществления.
Один предпочтительный аспект настоящего изобретения относится к способу получения соединения формулы (III), в котором реакцию проводят в присутствии агента сочетания.
Другой предпочтительный аспект настоящего изобретения относится к способу получения соединения формулы (III), в котором агент сочетания выбран из группы, состоящей из DCC (N,N-дициклогексилкарбодиимида), EDCI {1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида (EDCI)} и DMTMM {4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиний хлорида}.
Настоящее изобретение также относится к способу получения соединения формулы (IIIc):
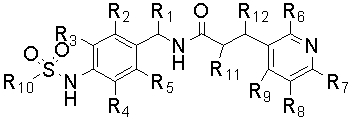 (IIIc),
(IIIc),
который включает стадию восстановления соединения формулы (III).
Один предпочтительный аспект настоящего изобретения относится к способу получения соединения формулы (IIIc), в котором стадию восстановления проводят в присутствии газообразного водорода и палладия на углероде.
Другой предпочтительный аспект настоящего изобретения относится к способу получения соединения формулы (III) или (IIIc), в которой R1, R11 и R12 обозначают водород.
Другой предпочтительный аспект настоящего изобретения относится к способу получения соединения формулы (III) или (IIIc), в которой R1, R2, R8, R11 и R12 обозначают водород; R3 обозначает водород, фтор, хлор, бром, циано, метил, этил, этенил, этинил или трифторметил; R4 и R5 независимо обозначают водород, фтор, хлор, циано, метил, этил или трифторметил; R6 обозначает водород, фтор, хлор, бром, метил, метокси, диэтиламино, пирролидинил, пиперидил или морфолинил; R7 обозначает изопропил, трет-бутил или трифторметил; R9 обозначает водород или трифторметил; и R10 обозначает метил.
Настоящее изобретение также относится к новому соединению формулы (IIId):
 Формула (IIId),
Формула (IIId),
в которой
W обозначает водород или фтор;
R1 обозначает водород или C1-C3 алкил, предпочтительно метил; и
R10 обозначает C1-C3 алкил, C2-C3 алкенил или галоген C1-C3 алкил, предпочтительно метил;
при условии, что если R1 обозначает водород и R10 обозначает метил, то W обозначает фтор.
Частными примерами соединений формулы (IIId) являются:
(R)-N-[4-(1-амино-этил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl,
(R)-N-[4-(1-амино-пропил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl,
N-(4-аминометил-2,3,6-трифтор-фенил)-метансульфонамид, соль HCl,
(R)-N-[4-(1-амино-этил)-2,3,6-трифтор-фенил]-метансульфонамид, соль HCl,
(R)-N-[4-(1-амино-пропил)-2,3,6-трифтор-фенил]-метансульфонамид, соль HCl,
N-(4-аминометил-2,6-дифтор-фенил)-этенсульфонамид, соль HCl,
(R)-N-[4-(1-амино-этил)-2,6-дифтор-фенил]-этенсульфонамид, соль HCl,
(R)-N-[4-(1-амино-пропил)-2,6-дифтор-фенил]-этенсульфонамид, соль HCl,
N-(4-аминометил-2,3,6-трифтор-фенил)-этенсульфонамид, соль HCl,
(R)-N-[4-(1-амино-этил)-2,3,6-трифтор-фенил]-этенсульфонамид, соль HCl или
(R)-N-[4-(1-амино-пропил)-2,3,6-трифтор-фенил]-этенсульфонамид, соль HCl.
Другой аспект настоящего изобретения относится к применению соединения формулы (IIId), как описано выше, в качестве промежуточного соединения в получении соединения лиганда VR1, предпочтительно общей формулы I, III или наиболее предпочтительно VI, как описано в этой заявке, в котором W обозначает водород или фтор.
Другой вариант осуществления настоящего изобретения относится к способу получения соединения формулы (IIId), в которой R1 обозначает C1-C3 алкил, предпочтительно метил,
включающему:
(a) введение соединения формулы (IIIe)
 Формула (IIIe),
Формула (IIIe),
в которой W имеет значение, определенное выше,
в реакцию с соединением формулы (IIIf)
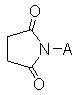 Формула (IIIf),
Формула (IIIf),
в которой A обозначает I или Br, в присутствии кислоты в растворителе, с получением соединения формулы (IIIg)
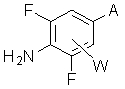 Формула (IIIg),
Формула (IIIg),
в которой W и A являются такими, как определены выше;
(b) введение соединения Формулы (IIIg) в реакцию с соединением формулы (IIIh)
 Формула (IIIh),
Формула (IIIh),
в которой R13 обозначает водород или C1-C2 алкил, предпочтительно водород, в присутствии катализатора и лиганда в растворителе, с получением соединения формулы (IIIi)
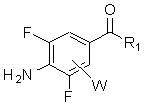 Формула (IIIi),
Формула (IIIi),
в которой W и R1 являются такими, как определены выше;
(c) введение соединения формулы (IIIi) в реакцию с соединением Формулы (IIIj)
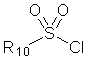 Формула (IIIj),
Формула (IIIj),
в которой R10 является таким, как определен выше, в присутствии основания в растворителе, затем NaOH в растворителе, с получением соединения формулы (IIIk)
 Формула (IIIk),
Формула (IIIk),
в которой W, R1 и R10 являются такими, как определены выше;
(d) введение соединения Формулы (IIIk) в реакцию с (R)-(+)-2-метил-2-пропансульфинамидом в присутствии кислоты в растворителе, затем NaBH4 в растворителе и затем HCl в растворителе, с получением соединения Формулы (IIId), в которой W и R10 являются такими, как определены выше, и R1 обозначает C1-C3 алкил, предпочтительно метил.
Другой вариант осуществления настоящего изобретения относится к способу получения соединения формулы (IIId), в которой R1 обозначает водород,
включающему:
(a) введение соединения формулы (IIIg)
 Формула (IIIg),
Формула (IIIg),
в которой W и A являются такими, как определены выше, в реакцию с CuCN в растворителе с получением соединения формулы (IIIm)
 Формула (IIIm),
Формула (IIIm),
в которой W является таким, как определен выше;
(b) введение соединения формулы (IIIm) в реакцию с соединением формулы (IIIj)
 Формула (IIIj),
Формула (IIIj),
в которой R10 является таким, как определен выше, в присутствии основания в растворителе, затем NaOH в растворителе, с получением соединения формулы (IIIn)
 Формула (IIIn),
Формула (IIIn),
в которой W и R10 являются такими, как определены выше;
c) введение соединения формулы (IIIn) в реакцию с водородом в присутствии катализатора и кислоты в растворителе с получением соединения Формулы (IIId)
 Формула (IIId),
Формула (IIId),
в которой W и R10 являются такими, как определены выше, и R1 обозначает водород.
Далее будут описаны способы составления и виды эксципиентов, но настоящее изобретение ими не ограничено.
Соединение формулы (I), (II), (III), (IV), (V) или (VI), его изомер или его фармацевтически приемлемая соль согласно настоящему изобретению может быть получено в форме фармацевтической композиции, содержащей фармацевтически приемлемые носители, адъюванты, разбавители и т.п. Например, соединения согласно настоящему изобретению могут быть растворены в маслах, пропиленгликоле или других растворителях, которые обычно используются для получения составов для инъекции. Подходящие примеры носителей включают, но не ограничены ими, физиологический солевой раствор, полиэтиленгликоль, этанол, растительные масла, изопропилмиристат и т.д. Для топического введения соединения согласно настоящему изобретению могут быть составлены в форме мази или крема.
Соединение согласно настоящему изобретению может также использоваться в формах фармацевтически приемлемых солей и может использоваться индивидуально или в комбинации, или в смеси с другими фармацевтически активными соединениями.
Соединения согласно настоящему изобретению могут быть составлены в инъекционные составы путем растворения, суспендирования или эмульгирования в водорастворимом растворителе, таком как солевой раствор и 5%-ая декстроза, или в нерастворимых в воде растворителях, таких как растительные масла, синтетический глицерид жирной кислоты, сложные эфиры высшей жирной кислоты и пропиленгликоль. Составы по изобретению могут включать любую из обычных добавок, таких как растворители, изотонические средства, суспендирующие агенты, эмульгаторы, стабилизаторы и консерванты.
Предпочтительный уровень дозы соединений согласно настоящему изобретению зависит от различных факторов, включая состояние и массу тела пациента, серьезность конкретного заболевания, лекарственные формы, и пути и периода введения, но может соответственно быть выбран специалистом. Соединения согласно настоящему изобретению предпочтительно вводят в количестве от 0,001 до 100 мг/кг массы тела в сутки и более предпочтительно от 0,01 до 30 мг/кг массы тела в сутки. Дозы могут вводиться один раз в день или несколько раз день с разделением дозы на части. Соединения согласно настоящему изобретению используются в фармацевтической композиции в количестве 0,0001~10% по весу и предпочтительно 0,001~1% по весу в рассчете на общее количество композиции.
Фармацевтическая композиция согласно настоящему изобретению может вводиться млекопитающему, такому как крыса, мышь, домашние животные, человек и т.п., различными путями. Способы введения включают пероральное и ректальное введение; внутривенные, внутримышечные, подкожные, внутриматочные, дуральные и интрацеребровентрикулярные инъекции.
Детализированное описание определений изобретения
При описании соединений, фармацевтических композиций, содержащих такие соединения, способов применения таких соединений и композиций и применения таких соединений и композиций все термины, используемые в настоящей заявке, имеют значения, обычно используемые специалистами, например, фармхимиками, фармакологами или врачами. В качестве примера некоторые определения конкретных групп даются ниже:
"Алкил" включает моновалентные насыщенные алифатические углеводородные группы. Углеводородная цепь может быть прямой или разветвленной. "Алкил" имеет предпочтительно 1-15 атомов углерода (“C1-C15 алкил”), более предпочтительно 1-10 атомов углерода (“C1-C10 алкил”), еще более предпочтительно 1-8 атомов углерода (“C1-C8 алкил”) или 1-6 атомов углерода (“C1-C6 алкил”), и в некоторых случаях еще более предпочтительно 1-5 атомов углерода (“C1-C5 алкил”), 1-4 атома углерода (“C1-C4 алкил”) или только 1-3 атома углерода (“C1-C3 алкил”). Этот термин иллюстрируется такими группами, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, трет-амил и т.п.
"Алкокси" включает группу -OR, в которой R обозначает "алкил", как он определен выше. Частные примеры алкокси-групп включают, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, 1,2-диметилбутокси и т.п.
“Алкоксиалкокси” относится к группе -OROR', в которой R и R' являются одинаковыми или разными "алкильными" группами, как определено выше.
“Алкоксиалкоксиалкил” относится к группе -ROR'OR'', в которой R, R' и R'' являются одинаковыми или разными "алкильными" группами, как определено выше.
“Алкоксиалкиламино” относится к группе -NH(ROR'), в которой R и R' являются одинаковыми или разными "алкильными" группами, как определено выше.
"N-Алкоксиалкил-N-алкиламино" относится к группе -NR(R'OR''), в которой R, R' и R'' являются одинаковыми или разными "алкильными" группами, как определено выше.
“Алкоксиалкинил” относится к группе 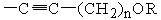 , в которой n означает целое число от 0 до 8, и R обозначает "алкильную" группу, как определено выше.
, в которой n означает целое число от 0 до 8, и R обозначает "алкильную" группу, как определено выше.
“Диалкиламиноалкинил” относится к группе 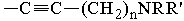 , в которой n означает целое число от 0 до 8, и R и R' являются одинаковыми или разными "алкильными" группами, как определено выше.
, в которой n означает целое число от 0 до 8, и R и R' являются одинаковыми или разными "алкильными" группами, как определено выше.
“Алкоксикарбонил” относится к радикалу -C(=O)-O-R, в котором R обозначает "алкильную" группу, как определено выше.
"Алкенил" включает моновалентные олефиново ненасыщенные углеводородные группы, являющиеся прямыми или разветвленными и имеющие по меньшей мере 1 двойную связь. "Алкенил" имеет предпочтительно 2-15 атомов углерода (“C2-C15 алкенил”), более предпочтительно 2-10 атомов углерода (“C2-C10 алкенил”), еще более предпочтительно 2-8 атомов углерода (“C2-C8 алкенил”) или 2-6 атомов углерода (“C2-C6 алкенил”), и в некоторых случаях еще более предпочтительно 2-5 атомов углерода (“C1-C5 алкенил”), 2-4 атома углерода (“C2-C4 алкенил”) или только 2-3 атома углерода (“C2-C3 алкенил”). Примеры алкенильных групп включают этенил (-CH=CH2), н-пропенил (-CH2CH=CH2), изопропенил (C(CH3)=CH2) и т.п. Предпочтительной "алкенильной" группой является этенил (винил).
"Алкинил" включает ацетиленово ненасыщенные углеводородные группы, являющиеся прямыми или разветвленными и имеющие по меньшей мере 1 тройную связь. “Алкинил” имеет предпочтительно 2-15 атомов углерода (“C2-C15 алкинил”), более предпочтительно 2-10 атомов углерода (“C2-C10 алкинил”), еще более предпочтительно 2-8 атомов углерода (“C2-C8 алкинил”) или 2-6 атомов углерода (“C2-C6 алкинил”), и в некоторых случаях еще более предпочтительно 2-5 атомов углерода (“C1-C5 алкинил”), 2-4 атома углерода (“C2-C4 алкинил”) или только 2-3 атома углерода (“C2-C3 алкинил”). Предпочтительной алкинильной группой является этинил (ацетиленил).
"Алкиламино" включает группу -NHR', в которой R' является алкильными группами, определенными здесь.
"Диалкиламино" включает группу -NR'R", в которой R' и R" являются алкильными группами, определенными здесь.
"Алкилсульфонил" включает радикал -S(O)2R, в котором R обозначает алкильные группы, определенные здесь. Репрезентативные примеры включают, но не ограничены ими, метансульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил и т.п.
"Алкилтио" включает радикал -S-R, в котором R обозначает алкильные группы, определенные здесь, который может быть замещен, как определено здесь. Репрезентативные примеры включают, но не ограничены ими, метилтио, этилтио, пропилтио, бутилтио и т.п.
"Амино" относится к радикалу -NH2.
"Арил" относится к ароматическому углеводородному радикалу. Примерами "арильных" радикалов являются фенил, нафтил, инденил, азуленил, фтор или антрацен, причем фенил является предпочтительным.
“Ариламино” относится к группе -NHAr, в которой Ar обозначает «арильные» группы, определенные выше.
“Арилокси” относится к группе -OAr, в которой Ar обозначает «арильные» группы, определенные выше.
"Карбокси" относится к радикалу -C(=O)ОН.
"Циклоалкил" относится к циклическим насыщенным алифатическим углеводородным группам. Число C-атомов, указанное в связи с данной циклоалкильной группой, соответствует числу образующих кольцо атомов углерода, например, “C3-C6 циклоалкил” относится к циклоалкилу с числом образующих кольцо C-атомов от трех до шести. Примерами "циклоалкила" являются циклопропил, циклобутил, циклопентил, циклогексил и т.д. Если обозначено, "циклоалкильная" группа может быть незамещенной или замещенной одной или более алкильными группами, например, C1-C6 алкильными группами, предпочтительно C1-C3 алкильными группами, особенно предпочтительно метильными группами. Если "циклоалкил" несет более одного алкильного заместителя, эти заместители могут быть присоединены к тому же самому или к разным образующим кольцо атомам углерода.
"Циклоалкокси" относится к группе -OR, в которой R обозначает "циклоалкильные" группы, определенные выше.
“Циклоалкиламино” относится к группе -NHR, в которой R обозначает "циклоалкильные" группы, определенные выше.
"N-Циклоалкиламино-N-алкиламино" относится к группе -NRR', в которой R являются одинаковыми или разными "алкильными" группами, определенными выше, и R' являются "циклоалкильными" группами, определенными выше.
"N-арил-N-алкиламино" относится к группе -NRAr, в которой Ar обозначает "арильные" группы, определенные выше, и R обозначает "алкильные" группы, определенные выше.
“Оксациклоалкил” относится к циклическим насыщенным алифатическим углеводородным группам с одним атомом кислорода в любом положении в кольце. Число C-атомов, указанное в связи с данной оксациклоалкильной группой, соответствует числу образующих кольцо атомов углерода, например, “C3-C6 оксациклоалкил” относится к оксациклоалкилу с числом образующих кольцо C-атомов от трех до шести и одним атомом O. Примерами “оксациклоалкила” являются оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил и т.д. Если обозначено, “оксациклоалкильная” группа может быть незамещенной или замещенной одной или более алкильными группами, например, C1-C6 алкильными группами, предпочтительно C1-C3 алкильными группами, особенно предпочтительно метильными группами. Если “оксациклоалкил” несет более одного алкильного заместителя, эти заместители могут быть присоединены к тому же самому или к разным образующим кольцо атомам углерода.
"Оксациклоалкил-окси" относится к группе -OR, в которой R обозначает “оксациклоалкильные” группы, определенные выше.
"Циано" относится к радикалу -C≡N.
"Этенил" относится к -CH=CH2, который также определяется в настоящей заявке как "винил".
"Этинил" относится к -C≡CH.
"Галоген" относится к фтору, хлору, брому и йоду. Предпочтительные группы галогена являются фтором или хлором.
“Галогеналкил” включает "алкильную" группу, определенную выше, замещенную одним или более галогенами, которые могут быть одинаковыми, например, в трифторметиле или пентафторэтиле, или которые могут быть разными.
"Гетероарил" относится к ароматической кольцевой системе, содержащей по меньшей мере один гетероатом, такой как O, S или N. Примерами гетероарильных радикалов являются фуранил, тиенил, пирролил, тиазолил, оксазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, пиранил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил, тетразинил, индолинил, индолил, изоиндолил, бензофуранил, бензотиофенил, бензоимидазолил, бензотиазолил, пуринил, хиназолинил, хинолинил, изохинолинил, хинолизинил, птеридинил, карбазолил, причем однокольцевые системы, и в особенности пиридинил и имидазолил, являются предпочтительными.
“Гетероариламино” относится к группе -NHAr', в которой Ar' является "гетероарильной" группой, определенной выше.
“Гетероарилокси” относится к группе -OAr', в которой Ar' является "гетероарильной" группой, определенной выше.
"Гидрокси" относится к -ОН.
"Гидроксиалкил" включает "алкильную" группу, определенную выше, замещенную одной или более гидроксильными группами.
"Нитро" относится к радикалу -NO2.
“Алкилпиперазинил” относится к кольцу пиперазина, которое несет "алкил" как заместитель, причем пиперазинильное кольцо предпочтительно связано и с "алкилом", и со вторым положением присоединения через атомы азота.
“Пиперазинил” включает пиперазинильное кольцо, которое может быть связано через любой C-атом, а также через атом азота, причем предпочтительным является связывание через один из атомов азота.
“Пирролидинил” включает кольцо пирролидина, которое может быть связано через любой C-атом, а также через атом азота, причем предпочтительным является связывание через его атом азота.
“Морфолинил” включает морфолиновое кольцо, которое может быть связано через любой C-атом, а также через атом азота, причем предпочтительным является связывание через его атом азота.
“Пиридинил” включает кольцо {ядро} пиридина, которое может быть связано любым C-атомом так же, как его азотным атомом.
Любой "алкил", "алкенил", “алкинил”, "арил", "гетероарил", "циклоалкил", “пиперазинил”, “пиперидил”, “морфолинил” или “пирролидинил”, также как части более крупных групп, таких как "алкокси", “алкилсульфонил”, “алкенилокси”, “арилокси”, “гетероарилокси”, “циклоалкиламино” и т.д., могут быть незамещенными или замещенными одной или более группами. Подходящими заместителями являются, например, галоген, гидроксил, незамещенный или замещенный галогеном C1-C5 алкокси, незамещенный или замещенный один или более раз метилом и/или галогеном C3-C8 циклоалкил, C1-C5 алкил, галоген (C1-C5) алкил, амино, циано или нитро. Если явно не указано иное, любой "алкил", "алкенил", “алкинил”, "арил", "гетероарил", "циклоалкил", “пиперазинил”, “пиперидил”, “морфолинил” или “пирролидинил” (также как части более крупной группы) предпочтительно является незамещенным.
"Изомер" включает особенно оптические изомеры (например, по существу чистые энантиомеры, по существу чистые диастереомеры и их смеси), а также конформационные изомеры (то есть изомеры, которые отличаются только по их углам по меньшей мере одной химической связи), изомеры положения (особенно таутомеры) и геометрические изомеры (например, изомеры цис-транс).
“По существу чистый”, например, в отношении энантиомеров или диастереомеров, означает по меньшей мере приблизительно 90%, предпочтительно по меньшей мере приблизительно 95%, более предпочтительно по меньшей мере приблизительно 97 или по меньшей мере приблизительно 98%, еще более предпочтительно по меньшей мере приблизительно 99%, и особенно предпочтительно по меньшей мере приблизительно 99,5% (вес/вес) указанного соединения, например, конкретного энантиомера или диастереомера.
"Фармацевтически приемлемый" означает не проявляющий существенных токсических эффектов при использовании в дозах, обычно используемых в медицинских целях, и таким образом, который может быть апробирован или предпочтительно может быть апробирован регулирующим органом Федерального правительства или правительства штата, или который включен в Фармакопею США или другую общепризнанную фармакопею для использования на животных, и более конкретно на человеке.
"Фармацевтически приемлемая соль" относится к соли соединения по изобретению, которая является фармацевтически приемлемой и обладает желаемой фармакологической активностью родительского соединения. Такие соли включают: (1) соли присоединения с кислотой, образованные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этан-дисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтоевая кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п.; или (2) соли, образованные заменой протона кислоты, присутствующего в родительском соединении.
"Фармацевтически приемлемый носитель" относится к разбавителю, адъюванту, эксципиенту или носителю, с которым вводят соединение по изобретению.
"Предотвращение" или "профилактика" относятся к уменьшению риска приобретения заболевания или нарушения (то есть предотвращение развития у лица, которое может быть подвержено или предрасположено к заболеванию, но еще не испытывает или не демонстрирует симптомы заболевания, меньшей мере одного из клинических симптомов заболевания к заболеванию, но еще не испытывает или показывает симптомы заболевания).
"Пациент" включает человека. Термины "человек", "пациент" и "лицо" используются взаимозаменяемо.
"Терапевтически эффективное количество" означает количество соединения, которое, при введении пациенту для лечения заболевания, является достаточным для осуществления лечения заболевания. "Терапевтически эффективное количество" может варьировать в зависимости от соединения, заболевания и его серьезности, и возраста, массы тела и т.д. пациента.
"Лечение" заболевания или нарушения относится, в одном варианте осуществления, к улучшению состояния при заболевании или нарушении (то есть остановке или ослаблению развития заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "лечение" относится к улучшению в отношении по меньшей мере одного физического параметра, который, возможно, не различим пациентом. В еще одном варианте осуществления "лечение" относится к коррекции заболевания или нарушения физически (например, стабилизацией видимого симптома), физиологически (например, стабилизацией физического параметра) или обоими способами. В еще одном варианте осуществления "лечение" относится к отсрочке начала заболевания или нарушения.
Способ осуществления изобретения
Настоящее изобретение более специфично объясняется следующими примерами и экспериментальными примерами. Однако следует понимать, что объем настоящего изобретения не ограничен следующими примерами и экспериментальными примерами.
Пример 1: 3-(6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
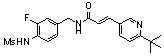
Стадия 1: Синтез 3-(6-трет-бутил-пиридин-3-ил)-акриловой кислоты
К раствору 6-трет-бутил-пиридин-3-карбоксальдегида (1,34 г, 8,75 ммоль), полученного в соответствии с известной процедурой, в толуоле добавляли метил(трифенилфосфоранилиден)ацетат (2,93 г), и полученную смесь нагревали при 90°C в течение 3 часов. Реакционную смесь разбавляли EtOAc и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=4/1), получая эфирный продукт (1,56 г, 81%). Полученный сложный эфир растворяли в 1,4-диоксане, обрабатывали водой и KOH, перемешивали и нагревали с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и затем промывали простым эфиром. Водную фазу подкисляли 1н. HCl и затем экстрагировали CHCl3, и объединенную органическую фазу промывали солевым раствором, высушивали над безводным MgSO4 и концентрировали при пониженном давлении, получая 3-(6-трет-бутил-пиридин-3-ил)-акриловую кислоту (1.00 г, 68%).
1H ЯМР (300 МГц, CDCl3): δ 8,78 (д, 1H, J=2,1 Гц), 7,84 (дд, 1H, J=2,1 и 8,4 Гц), 7,78 (д, 1H, J=16,2 Гц), 7,42 (д, 1H, J=8,4 Гц), 6,53 (д, 1H, J=16,2 Гц), 1,40 (c, 9H).
Стадия 2: Синтез 3-(6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламида
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (50 мг, 0,20 ммоль) вводили в реакцию с 3-(6-трет-бутил-пиридин-3-ил)-акриловой кислотой (40 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) 3-(6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид (75 мг, 92%).
1H ЯМР (300 МГц, CDCl3): δ 8,70 (д, 1H, J=2,1 Гц), 7,77 (дд, 1H, J=2,1 и 8,1 Гц), 7,64 (д, 1H, J=15,6 Гц), 7,48 (м, 1H), 7,38 (д, 1H, J=8,4 Гц), 7,13 (м, 2H), 6,77 (c, 1H), 6,51 (д, 1H, J=15,6 Гц), 6,43 (т, 1H), 4,54 (д, 2H, J=6,0 Гц), 3,02 (c, 3H), 1,38 (c, 9H).
ESI [M+H]+: 406,2.
Пример 2: 3-(6-трет-бутил-пиридин-3-ил)-N-(3-хлор-4-метансульфониламино-бензил)-акриламид
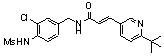
N-(4-Аминометил-2-хлор-фенил)-метансульфонамид, соль HCl (100 мг, 0,35 ммоль) вводили в реакцию с 3-(6-трет-бутил-пиридин-3-ил)-акриловой кислотой (70 мг), получая 3-(6-трет-бутил-пиридин-3-ил)-N-(3-хлор-4-метансульфониламино-бензил)-акриламид (110 мг, 74%) после очистки хроматографией на колонках (Hex/EtOAc=1/2).
1H ЯМР (300 МГц, CDCl3): δ 8,66 (д, 1H, J=2,1 Гц), 7,74 (дд, 1H, J=2,1 и 8,1 Гц), 7,64 (д, 1H, J=15,6 Гц), 7,57 (д, 1H, J=8,7 Гц), 7,41 (д, 1H, J=2,1 Гц), 7,36 (д, 1H, J=8,1 Гц), 7,24 (дд, 1H, J=2,1 и 8,7 Гц), 6,82 (c, 1H), 6,48 (д, 1H, J=15,6 Гц), 6,42 (т, 1H), 4,53 (д, 2H, J=6,0 Гц), 3,00 (c, 3H), 1,37 (c, 9H).
ESI [M+H]+: 422,2.
Пример 3: 3-(6-трет-бутил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
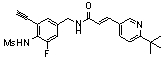
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (70 мг, 0,25 ммоль) вводили в реакцию с 3-(6-трет-бутил-пиридин-3-ил)-акриловой кислотой (52 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) 3-(6-трет-бутил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (63 мг, 64%).
1H ЯМР (300 МГц, CDCl3): δ 8,71 (д, 1H, J=2,4 Гц), 7,76 (дд, 1H, J=2,4 и 8,4 Гц), 7,63 (д, 1H, J=16,0 Гц), 7,39 (д, 1H, J=8,4 Гц), 7,28 (c, 1H), 7,16 (дд, 1H, J=2,1 и 11,0 Гц), 6,64 (c, 1H), 6,52 (д, 1H, J=16,0 Гц), 6,47 (т, 1H), 4,51 (д, 2H, J=6,0 Гц), 3,45 (c, 1H), 3,24 (c, 3H), 1,38 (c, 9H).
ESI [M+H]+: 430,1.
Пример 4: 3-(6-трет-бутил-пиридин-3-ил)-N-(4-метансульфониламино-3-винил-бензил)-акриламид
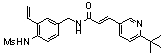
N-(4-Аминометил-2-винил-фенил)-метансульфонамид, соль HCl (70 мг, 0,28 ммоль) вводили в реакцию с 3-(6-трет-бутил-пиридин-3-ил)-акриловой кислотой (52 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) 3-(6-трет-бутил-пиридин-3-ил)-N-(4-метансульфониламино-3-винил-бензил)-акриламид (62 мг, 54%).
1H ЯМР (300 МГц, CDCl3): δ 8,66 (д, 1H, J=1,8 Гц), 7,74 (дд, 1H, J=2,1 и 8,4 Гц), 7,63 (д, 1H, J=16,0 Гц), 7,44 (д, 1H, J=2,1 Гц), 7,36 (м, 2H), 7,23 (м, 2H), 6,90 (дд, 1H, J=11,0 и 17,0 Гц), 6,70 (c, 1H), 6,48 (д, 1H, J=16,0 Гц), 6,40 (т, 1H), 5,70 (д, 1H, J=17,0 Гц), 5,43 (д, 1H, J=11,0 Гц), 4,54 (д, 2H, J=5,7 Гц), 2,98 (c, 3H), 1,37 (c, 9H).
ESI [M+H]+: 414,2.
Пример 5: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид
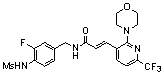
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (100 мг, 0,40 ммоль) вводили в реакцию с 3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (121 мг), полученной в соответствии с известной процедурой, получая после очистки хроматографией на колонках (CH2Cl2/MeOH=20/1) N-(3-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид (118 мг, 66%).
1H ЯМР (300 МГц, CDCl3 + ДМСО-d6): δ 9,13 (c, 1H), 8,32 (т, 1H), 7,96 (д, 1H, J=7,8 Гц), 7,79 (д, 1H, J=15,9 Гц), 7,56 (т, 1H, J=8,4 Гц), 7,38 (д, 1H, J=7,8 Гц), 7,26 (м, 2H), 6,80 (д, 1H, J=15,9 Гц), 4,63 (д, 2H, J=5,7 Гц), 3,98 (м, 4H), 3,46 (м, 4H), 3,13 (c, 3H).
ESI [M+H]+: 503,1.
Пример 6: N-(4-метансульфониламино-3-винил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид
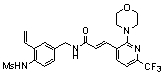
N-(4-Аминометил-2-винил-фенил)-метансульфонамид, соль HCl (70 мг, 0,27 ммоль) вводили в реакцию с 3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (81 мг), получая после очистки хроматографией на колонках (CH2Cl2/MeOH=20/1) N-(4-метансульфониламино-3-винил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид (55 мг, 45%).
1H ЯМР (300 МГц, CDCl3 + ДМСО-d6): δ 8,92 (c, 1H), 8,18 (c, 1H), 7,97 (д, 1H, J=7,8 Гц), 7,83 (д, 1H, J=16,0 Гц), 7,73 (c, 1H), 7,44 (м, 3H), 7,33 (дд, 1H, J=11,0 и 17,0 Гц), 6,83 (д, 1H, J=16,0 Гц), 5,93 (д, 1H, J=17,0 Гц), 6,55 (д, 1H, J=11,0 Гц), 4,69 (д, 2H, J=5,1 Гц), 4,01 (м, 4H), 3,50 (м, 4H), 3,09 (c, 3H).
ESI [M+H]+: 511,1.
Пример 7: N-(3-хлор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид
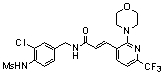
N-(4-Аминометил-2-хлор-фенил)-метансульфонамид, соль HCl (62 мг, 0,22 ммоль) вводили в реакцию с 3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (67 мг), получая после очистки хроматографией на колонках (CH2Cl2/MeOH=20/1) N-(3-хлор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид (93 мг, 91%).
1H ЯМР (300 МГц, CDCl3 + ДМСО-d6): δ 8,37 (c, 1H), 8,27 (т, 1H), 7,99 (д, 1H, J=7,8 Гц), 7,86 (д, 1H, J=15,9 Гц), 7,72 (д, 1H, J=8,4 Гц), 7,62 (м, 1H), 7,44 (м, 2H), 6,84 (д, 1H, J=15,9 Гц), 4,68 (д, 2H, J=5,7 Гц), 4,04 (м, 4H), 3,52 (м, 4H), 3,19 (c, 3H).
ESI [M+H]+: 519,1.
Пример 8: N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид
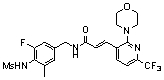
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (100 мг, 0,35 ммоль) вводили в реакцию с 3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (116 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид (120 мг, 74%).
1H ЯМР (300 МГц, CDCl3): δ 7,76 (д, 1H, J=7,8 Гц), 7,71 (д, 1H, J=15,6 Гц), 7,24 (м, 3H), 6,42 (д, 1H, J=15,6 Гц), 6,32 (c, 1H), 6,06 (т, 1H), 4,59 (д, 2H, J=6,3 Гц), 3,85 (м, 4H), 3,34 (м, 4H), 3,05 (c, 3H), 2,25 (д, 3H, J=2,1 Гц).
ESI [M+H]+: 517,1.
Пример 9: 3-(6-трет-бутил-2-метокси-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
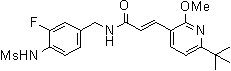
Гидрохлорид 3-фтор-4-метансульфониламинобензиламина (17,8 мг, 0,052 ммоль) вводили в реакцию с 3-(6-трет-бутил-2-метокси-пиридин-3-ил)-акриловой кислотой (12 мг), DMTMM (1,1 экв., 16 мг) и NMP (1,2 экв., 90 мкл) в ТГФ (THF), получая после очистки хроматографией на колонках (Hex/EtOAc=3/2) целевое соединение (14 мг, 61,8%).
1H ЯМР (300 МГц, CDCl3): δ 7,70 (д, 1H, J=15,6 Гц), 7,61 (д, 1H, J=9,3 Гц), 7,51 (м, 1H), 7,13 (м, 2H), 6,90 (д, 1H, J=7,8 Гц), 6,84 (д, 1H, J=15,6 Гц), 6,61 (c ушир., 1H), 6,10 (c ушир., 1H), 4,54 (д, 2H, J=6 Гц), 4,01 (c, 3H), 3,02 (c, 3H), 1,33 (c, 9H).
ESI [M+H]+: 436,1.
Пример 10: 3-(6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-винил-бензил)-акриламид
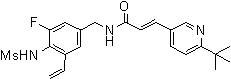
N-(4-Аминометил-2-фтор-6-винил-фенил)-метансульфонамид, соль HCl (84 мг, 0,30 ммоль) вводили в реакцию с 3-(6-трет-бутил-пиридин-3-ил)-акриловой кислотой (62 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) 3-(6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-винил-бензил)-акриламид (34 мг, 26%).
1H ЯМР (300 МГц, CDCl3 + ДМСО-d6): δ 8,68 (д, 1H, J=2,4 Гц), 8,09 (c, 1H), 7,78 (дд, 1H, J=2,1 и 8,4 Гц), 7,61 (c, 1H), 7,56 (д, 1H, J=15,9 Гц), 7,35 (д, 1H, J=8,4 Гц), 7,33 (c, 1H), 7,12 (дд, 1H, J=14,8 и 18,0 Гц), 7,01 (дд, 1H, J=1,8 и 10,2 Гц), 6,60 (д, 1H, J=15,9 Гц), 5,73 (д, 1H, J=18,0 Гц), 5,33 (д, 1H, J=11,4 Гц), 4,46 (д, 2H, J=6,0 Гц), 2,97 (д, 3H, J=0,9 Гц), 1,34 (c, 9H).
ESI [M+H]+: 432,2.
Пример 11: 3-(6-трет-бутил-2-метокси-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
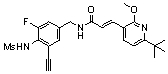
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (82,4 мг, 0,30 ммоль) вводили в реакцию с 3-(6-трет-бутил-2-метокси-пиридин-3-ил)-акриловой кислотой (66 мг), DMTMM (1,1 экв., 90 мг) и NMP (1,2 экв., 40 мкл) в ТГФ, получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (51,2 мг, 37,6%).
1H ЯМР (300 МГц, CDCl3): δ 7,70 (д, 1H, J=15,9 Гц), 7,62 (д, 1H, J=8,4 Гц), 7,30 (c, 1H), 7,17 (м, 1H), 6,91 (д, 1H, J=7,8 Гц), 6,69 (д, 1H, J=15,6 Гц), 6,41 (c, 1H). 6,02 (c ушир., 1H), 4,53 (д, 2H, J=6 Гц), 4,02 (c, 3H), 3,47 (c, 1H), 3,26 (c, 3H), 1,34 (c, 9H).
ESI [M+H]+: 460,1.
Пример 12: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид
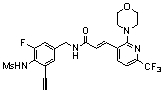
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (100 мг, 0,22 ммоль) вводили в реакцию с 3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (108 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид (190 мг, 100%).
1H ЯМР (300 МГц, CDCl3 + ДМСО-d6): δ 9,31 (c, 1H), 8,73 (т, 1H), 7,92 (д, 1H, J=7,8 Гц), 7,49 (д, 1H, J=15,6 Гц), 7,31 (д, 1H, J=7,8 Гц), 7,25 (c, 1H), 7,18 (д, 1H, J=10,8 Гц), 6,71 (д, 1H, J=15,6 Гц), 4,38 (д, 2H, J=5,7 Гц), 4,14 (c, 1H), 3,76 (м, 4H), 3,22 (м, 4H), 3,04 (c, 3H).
ESI [M+H]+: 527,2.
Пример 13: 2-(2-пиперид-1-ил-6-хлор-пиридинил-3-илокси)-N-(3-фтор-4-метансульфониламино-бензил)-ацетамид
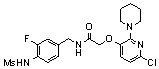
N-(4-Аминометил-3-фтор-фенил)-метансульфонамид, соль HCl (32 мг, 0,12 ммоль) и NMP (0,05 мл) добавляли в 20 мл ТГФ. Смесь перемешивали в течение 10 минут. В смесь добавляли DMTMM (51 мг, 0,18 ммоль) и 2-(2-пиперид-1-ил-6-хлор-пиридин-3-илокси)-уксусную кислоту (20 мг, 0,092 ммоль). Реакционную смесь перемешивали в течение ночи. Реакционный растворитель удаляли в вакууме. Остаток экстрагировали этилацетатом (30 мл × 3) и H2O (30 мл). Объединенный органический слой промывали насыщ. NaHCO3 (30 мл) и солевым раствором (30 мл), высушивали с использованием MgSO4 и концентрировали в вакууме. Остаток очищали хроматографией на колонках, получая твердое вещество белого цвета (11 мг).
1H ЯМР (CDCl3, 300 МГц) δ 7,87 (д, J=15,9 гц, 1H), 7,62 (д, J=9,0 гц, 1H), 7,51 (т, J=7,8 гц, 1H), 7,12 (м, 2H), 6,39 (ушир., 1H), 6,51 (д, J=9,0 гц, 1H), 6,20 (д, J=15,6 Гц), 6,00 (ушир., 1H), 5,53 (д, J=6,3 гц, 2H), 3,60 (м, 4H), 3,01 (c, 3H), 1,65 (м, 6H).
ESI [M+H]+: 467,1.
Пример 14: 3-(6-хлор-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
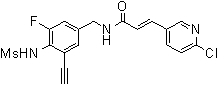
Стадия 1: метиловый эфир 3-(6-хлор-пиридин-3-ил)-акриловой кислоты
К 6-хлор-пиридин-3-карбоксальдегиду (300 мг, 2,12 ммоль) в толуоле добавляли метил(трифенилфосфоранилиден)ацетат (708 мг, 2,12 ммоль) и раствор нагревали с обратным холодильником в течение 6 часов. Реакционную смесь разбавляли EtOAc и затем промывали три раза H2O, солевым раствором, высушивали Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученный остаток хроматографировали на колонке, получая метиловый эфир 3-(6-хлор-пиридин-3-ил)-акриловой кислоты (380 мг, 90%).
1H ЯМР (300 МГц, CDCl3): δ 8,51 (д, 1H, J=2,7 Гц), 7,80 (дд, 1H, J=8,1, 2,4 Гц), 7,65 (д, 1H, J=15,9 Гц), 7,36 (д, 1H, J=8,4 Гц), 6,48 (д, 1H, J=15,9 Гц), 3,83 (c, 3H).
Стадия 2: 3-(6-хлор-пиридин-3-ил)-акриловая кислота
Метиловый эфир 3-(6-хлор-пиридин-3-ил)-акриловой кислоты (107 мг, 0,541 ммоль) в ТГФ добавляли к раствору 0,5н. LiOH (2 экв.), и смесь перемешивали в течение 3 часов при комнатной температуре. Полученный остаток растворяли в H2O и затем промывали три раза Et2O, нейтрализовывали 1н. HCl до рН 5~7. Полученное твердое вещество отфильтровывали и промывали H2O, и затем высушивали в вакууме, получая 3-(6-хлор-пиридин-3-ил)-акриловую кислоту (80 мг, 80%).
1H ЯМР (300 МГц, ДМСО-d6): δ 8,64 (c, 1H), 8,16 (д, 1H, J=8,1 Гц), 7,54 (д, 1H, J=16,8 Гц), 7,50 (д, 1H, J=9,9 Гц), 6,63 (д, 1H, J=15,9 Гц).
Стадия 3: 3-(6-хлор-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (78,3 мг, 0,272 ммоль) суспендировали в ТГФ и обрабатывали триэтиламином (30 мг, 0,299 ммоль), и затем полученную смесь перемешивали в течение 10 мин. К реакционной смеси добавляли 3-(6-хлор-пиридин-3-ил)-акриловую кислоту (50 мг, 0,272 ммоль), затем через 10 минут DMTMM (82 мг, 0,299 ммоль). Полученную смесь перемешивали в течение ночи при температуре окружающей среды и затем разбавляли EtOAc. Полученный раствор промывали последовательно водой, насыщ. NaHCO3 (x2), солевым раствором и затем высушивали над безвод. Na2SO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток перекристаллизовывали (CH2Cl2), получая целевое соединение (26 мг, 23%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,54 (c, 1H), 8,74 (т, 1H, J=6,0 Гц), 8,61 (д, 1H, J=2,4 Гц), 8,07 (дд, 1H, J=8,4, 2,4 Гц), 7,56 (д, 1H, J=8,4 Гц), 7,51 (д, 1H, J=15,9 Гц), 7,34 (т, 1H, J=8,1 Гц), 7,19 (д, 1H, J=12,0 Гц), 7,12 (д, 1H, J=8,4 Гц), 6,79 (д, 1H, J=15,9 Гц), 4,39 (д, 2H, J=5,7 Гц), 3,00 (c, 3H).
ESI [M+H]+: 408,0.
Пример 15: 3-(6-бром-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
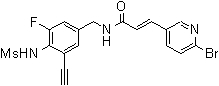
Стадия 1: метиловый эфир 3-(6-бром-пиридин-3-ил)-акриловой кислоты
К 6-бром-пиридин-3-карбоксальдегиду (300 мг, 1,61 ммоль) в толуоле добавляли метил(трифенилфосфоранилиден)ацетат (647 мг, 1,94 ммоль) и раствор нагревали с обратным холодильником в течение 6 часов. Реакционную смесь разбавляли EtOAc и затем промывали три раза H2O, солевым раствором, высушивали Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученный остаток хроматографировали на колонке, получая метиловый эфир 3-(6-бром-пиридин-3-ил)-акриловой кислоты (380 мг, 97%).
1H ЯМР (300 МГц, CDCl3): δ 8,47 (д, 1H, J=2,4 Гц), 7,68 (дд, 1H, J=8,4, 2,4 Гц), 7,60 (д, 1H, J=15,9 Гц), 7,51 (д, 1H, J=8,4 Гц), 6,49 (д, 1H, J=15,9 Гц), 3,81 (c, 3H).
Стадия 2: 3-(6-бром-пиридин-3-ил)-акриловая кислота
К метиловому эфиру 3-(6-бром-пиридин-3-ил)-акриловой кислоты (120 мг, 0,495 ммоль) в ТГФ добавляли 0,5н. раствор LiOH (2 экв.) и смесь перемешивали в течение 3 часов при комнатной температуре. Полученный остаток растворяли в H2O, затем промывали три раза Et2O и нейтрализовывали 1н. HCl до рН 5~7. Полученное твердое вещество отфильтровывали и промывали H2O, и затем высушивали в вакууме, получая 3-(6-бром-пиридин-3-ил)-акриловую кислоту (100 мг, 88%).
1H ЯМР (300 МГц, ДМСО-d6): δ 8,67 (д, 1H, J=2,1 Гц), 8,11 (дд, 1H, J=8,4, 2,1 Гц), 7,69 (д, 1H, J=8,4 Гц), 7,59 (д, 1H, J=15,9 Гц), 6,71 (д, 1H, J=15,9 Гц).
Стадия 3: 3-(6-бром-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (63 мг, 0,219 ммоль) суспендировали в ТГФ и обрабатывали триэтиламином (25 мг, 0,241 ммоль), и затем полученную смесь перемешивали в течение 10 мин. К реакционной смеси добавляли 3-(6-бром-пиридин-3-ил)-акриловую кислоту (50 мг, 0,219 ммоль), затем через 10 минут DMTMM (66 мг, 0,241 ммоль). Полученную смесь перемешивали в течение ночи при температуре окружающей среды и затем разбавляли EtOAc. Полученный раствор промывали последовательно водой, насыщ. NaHCO3 (×2) и солевым раствором и затем высушивали над безвод. Na2SO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток перекристаллизовывали (EtOAc/н-гексан), получая целевое соединение (71 мг, 72%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,42 (c, 1H), 8,77 (т, 1H, J=6,0 Гц), 8,60 (д, 1H, J=2,4 Гц), 7,96 (дд, 1H, J=8,1, 1,8 Гц), 7,70 (д, 1H, J=8,1 Гц), 7,48 (д, 1H, J=15,9 Гц), 7,28 (c, 1H), 7,27 (д, 1H, J=8,7 Гц), 6,81 (д, 1H, J=15,9 Гц), 4,50 (c, 1H), 4,39 (д, 2H, J=5,7 Гц), 3,06 (c, 3H).
ESI [M+H]+: 452,0.
Пример 16: 3-(6-хлор-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
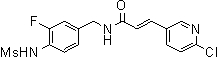
Гидрохлорид 3-фтор-4-метансульфониламинобензиламина (51 мг, 0,201 ммоль) суспендировали в ТГФ и обрабатывали триэтиламином (23 мг, 0,22 ммоль), и затем полученную смесь перемешивали в течение 10 мин. К реакционной смеси добавляли 3-(6-хлор-пиридин-3-ил)-акриловую кислоту (37 мг, 0,201 ммоль), затем через 10 минут DMTMM (61 мг, 0,22 ммоль). Полученную смесь перемешивали в течение ночи при температуре окружающей среды и затем разбавляли EtOAc. Полученный раствор промывали последовательно водой, насыщ. NaHCO3 (x2), солевым раствором и затем высушивали над безвод. Na2SO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток хроматографировали на колонке, получая целевое соединение (74 мг, 96%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,54 (c, 1H), 8,74 (т, 1H, J=6,0 Гц), 8,62 (д, 1H, J=2,4 Гц), 8,07 (дд, 1H, J=6,0, 2,4 Гц), 7,57 (д, 1H, J=8,4 Гц), 7,51 (д, 1H, J=15,9 Гц), 7,34 (т, 1H, J=8,1 Гц), 7,19 (д, 1H, J=12,0 Гц), 7,12 (д, 1H, J=8,4 Гц), 6,79 (д, 1H, J=15,9 Гц), 4,39 (д, 2H, J=5,7 Гц), 3,00 (c, 3H).
ESI [M+H]+: 384,0.
Пример 17: 3-(6-трет-бутил-4-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
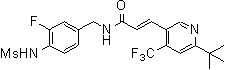
Гидрохлорид 3-фтор-4-метансульфониламинобензиламина (41,2 мг, 0,162 ммоль) вводили в реакцию с 3-(6-трет-бутил-4-трифторметил-пиридин-3-ил)-акриловой кислотой (1,0 экв., 44,2 мг), DMTMM (1,0 экв., 44,8 мг) и NMP (1,2 экв., 22 мл) в ТГФ, получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (48 мг, 62,6%).
1H ЯМР (300 МГц, CDCl3): δ 8,84 (c, 1H), 7,93 (д, 1H, J=15,3 Гц), 7,57 (c, 1H), 7,52 (т, 1H), 7,14 (м, 1H), 6,60 (c ушир., 1H), 6,45 (д, 1H, J=15,6 Гц), 6,24 (c ушир., 1H), 6,50 (c ушир., 1H), 4,54 (д, 2H, J=6,0 Гц), 3,03 (c, 3H), 1,39 (c, 9H).
ESI [M+H]+: 474,2.
Пример 18: 3-(6-трет-бутил-4-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
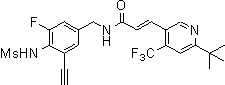
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (11,2 мг, 0,04 ммоль) вводили в реакцию с 3-(6-трет-бутил-4-трифторметил-пиридин-3-ил)-акриловой кислотой (1,0 экв., 11,0 мг), DMTMM (1,0 экв., 11,1 мг) и NMP (1,2 экв., 6 мкл) в ТГФ, получая после очистки хроматографией на колонках (Hex/EtOAc=3/2) целевое соединение (6 мг, 30,2%).
1H ЯМР (300 МГц, CDCl3): δ 8,85 (c, 1H), 7,95 (д, 1H, J=13,5 Гц), 7,58 (c, 1H), 7,32 (c ушир., 1H). 7,20 (д, 1H, J=12,6 Гц), 6,05 (c ушир., 1H), 4,54 (д, 1H, J=6,0 Гц), 3,49 (c, 1H), 3,27 (c, 3H), 1,40 (c, 9H).
ESI [M+H]+: 498,2.
Пример 19: N-(3-фтор-4-метансульфониламино-бензил)-3-(6-пиперид-1-ил-пиридинил-3-ил)-акриламид
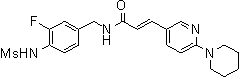
Стадия 1: метиловый эфир 3-(6-пиперид-1-ил-пиридинил-3-ил)-акриловой кислоты
Метиловый эфир 3-(6-бром-пиридин-3-ил)-акриловой кислоты (180 мг, 0,74 ммоль) добавляли к пиперидину (1 мл), и смесь перемешивали в течение 1,5 часов при комнатной температуре. Реакционную смесь разбавляли EtOAc и затем промывали три раза H2O, солевым раствором, высушивали Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученный остаток хроматографировали на колонке, получая метиловый эфир 3-(6-пиперид-1-ил-пиридинил-3-ил)-акриловой кислоты (60 мг, 33%).
1H ЯМР (300 МГц, CDCl3): δ 8,25 (д, 1H, J=2,1 Гц), 7,63 (дд, 1H, J=6,0, 2,4 Гц), 7,58 (д, 1H, J=15,9 Гц), 6,62 (д, 1H, J=9,3 Гц), 6,21 (д, 1H, J=15,9 Гц), 3,78 (c, 3H), 3,64-3,61 (м, 4H), 1,66-1,60 (м, 6H).
Стадия 2: N-(3-фтор-4-метансульфониламино-бензил)-3-(6-пиперид-1-ил-пиридинил-3-ил)-акриламид
Гидрохлорид 3-фтор-4-метансульфониламинобензиламина (25,2 мг, 0,099 ммоль) суспендировали в ТГФ и обрабатывали триэтиламином (11 мг, 0,108 ммоль), и затем полученную смесь перемешивали в течение 10 мин. К реакционной смеси добавляли 3-(6-пиперид-1-ил-пиридинил-3-ил)-акриловую кислоту (23 мг, 0,099 ммоль), затем через 10 минут DMTMM (30 мг, 0,108 ммоль). Полученную смесь перемешивали в течение ночи при температуре окружающей среды и затем разбавляли EtOAc. Полученный раствор промывали последовательно водой, насыщ. NaHCO3 (×2), солевым раствором и затем высушивали над безвод. Na2SO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток перекристаллизовывали (CH2Cl2), получая целевое соединение (15 мг, 35%).
1H ЯМР (300 МГц, CDCl3): δ 8,25 (д, 1H, J=2,7 Гц), 7,59 (дд, 1H, J=6,0, 2,7 Гц), 7,52 (д, 1H, J=15,9 Гц), 7,15 (т, 1H, J=6,0 Гц), 6,62 (д, 1H, J=9,0 Гц), 6,21 (д, 1H, J=15,3 Гц), 6,01 (c, 1H, ушир.), 4,53 (д, 2H, J=6,0 Гц), 3,62-3,59 (м, 4H), 3,01 (c, 3H), 1,65-1,64 (м, 6H).
ESI [M+H]+: 433,2.
Пример 20: 3-(6-бром-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
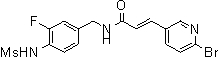
Гидрохлорид 3-фтор-4-метансульфониламинобензиламина (183 мг, 0,719 ммоль) суспендировали в ТГФ и обрабатывали триэтиламином (80 мг, 0,791 ммоль), и затем полученную смесь перемешивали в течение 10 мин. К реакционной смеси добавляли (6-хлор-пиридин-3-илокси)-уксусную кислоту (164 мг, 0,719 ммоль), затем через 10 минут DMTMM (218 мг, 0,791 ммоль). Полученную смесь перемешивали в течение ночи при температуре окружающей среды и затем разбавляли EtOAc. Полученный раствор промывали последовательно водой, насыщ. NaHCO3 (×2), солевым раствором и затем высушивали над безвод. Na2SO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток перекристаллизовывали (CH2Cl2), получая целевое соединение (225 мг, 65%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,54 (c, 1H), 8,75 (т, 1H, J=6,0 Гц), 8,59 (д, 1H, J=2,1 Гц), 7,95 (дд, 1H, J=8,4, 2,4 Гц), 7,71 (д, 1H, J=8,4 Гц), 7,49 (д, 1H, J=15,9 Гц), 7,34 (т, 1H, J=8,1 Гц), 7,19 (д, 1H, J=12,0 Гц), 7,12 (д, 1H, J=8,4 Гц), 6,79 (д, 1H, J=15,9 Гц), 4,39 (д, 2H, J=5,7 Гц), 3,00 (c, 3H).
ESI [M+H]+: 428,0.
Пример 21: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид
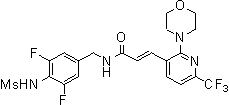
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (50 мг, 0,22 ммоль) вводили в реакцию с 3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (55 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид (37 мг, 39%).
1H ЯМР (300 МГц, CDCl3): δ 7,78 (д, 1H, J=8,1 Гц), 7,75 (д, 1H, J=15,3 Гц), 7,25 (д, 1H, J=8,1 Гц), 6,98 (д, 2H, J=8,4 Гц), 6,46 (д, 1H, J=15,3 Гц), 6,15 (c, 1H), 6,10 (т, 1H), 4,38 (д, 2H, J=6,6 Гц), 3,85 (м, 4H), 3,35 (м, 4H), 3,21 (c, 3H).
ESI [M+H]+: 521,1.
Пример 22: N-(3-фтор-4-метансульфониламино-5-трифторметил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид
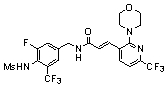
N-(4-Аминометил-2-фтор-6-трифторметил-фенил)-метансульфонамид, соль HCl (80 мг, 0,25 ммоль) вводили в реакцию с 3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (76 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) N-(3-фтор-4-метансульфониламино-5-трифторметил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид (56 мг, 39%).
1H ЯМР (300 МГц, CDCl3): δ 8,71 (c, 1H), 8,21 (т, 1H), 7,65 (д, 1H, J=7,8 Гц), 7,49 (д, 1H, J=15,6 Гц), 7,29 (c, 1H), 7,22 (д, 1H, J=9,9 Гц), 7,07 (д, 1H, J=7,8 Гц), 6,48 (д, 1H, J=15,6 Гц), 4,36 (д, 2H, J=6,0 Гц), 3,67 (м, 4H), 3,18 (м, 4H), 3,02 (c, 3H).
ESI [M+H]+: 571.
Пример 23: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(6-морфолин-4-ил-пиридин-3-ил)-акриламид
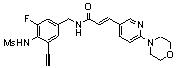
Стадия 1: метиловый эфир 3-(6-морфолин-4-ил-пиридин-3-ил)-акриловой кислоты
Метиловый эфир 3-(6-бром-пиридин-3-ил)-акриловой кислоты (100 мг, 0,413 ммоль) добавляли к пиперидину (1 мл), и смесь перемешивали в течение 1,5 часов при комнатной температуре. Реакционную смесь разбавляли EtOAc и затем промывали три раза H2O, солевым раствором, высушивали Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученный остаток хроматографировали на колонке, получая метиловый эфир 3-(6-морфолин-4-ил-пиридин-3-ил)-акриловой кислоты (40 мг, 21%).
1H ЯМР (300 МГц, CDCl3): δ 8,27 (д, 1H, J=2,4 Гц), 7,68 (дд, 1H, J=6,0, 2,4 Гц), 7,59 (д, 1H, J=15,9 Гц), 6,62 (д, 1H, J=9,3 Гц), 6,25 (д, 1H, J=15,3 Гц), 3,82-3,78 (м, 7H), 3,61-3,57 (м, 4H).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(6-морфолин-4-ил-пиридин-3-ил)-акриламид
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (20 мг, 0,072 ммоль) суспендировали в ТГФ и обрабатывали триэтиламином (11 мг, 0,108 ммоль), и затем полученную смесь перемешивали в течение 10 мин. К реакционной смеси добавляли 3-(6-морфолин-4-ил-пиридин-3-ил)-акриловую кислоту (17 мг, 0,072 ммоль), затем через 10 минут DMTMM (22 мг, 0,08 ммоль). Полученную смесь перемешивали в течение ночи при температуре окружающей среды и затем разбавляли EtOAc. Полученный раствор промывали последовательно водой, насыщ. NaHCO3 (×2), солевым раствором и затем высушивали над безвод. Na2SO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток перекристаллизовывали (CH2Cl2), получая целевое соединение (8 мг, 24%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,39 (c, 1H), 8,52 (т, 1H, J=5,4 Гц), 8,24 (c, 1H), 7,74 (д, 1H, J=8,7 Гц), 7,34 (д, 1H, J=15,9 Гц), 7,22-7,19 (м, 2H), 6,84 (д, 1H, J=9,3 Гц), 6,45 (д, 1H, J=15,9 Гц), 4,46 (c, 1H), 4,31 (д, 2H, J=5,7 Гц), 3,63-3,62 (м, 4H), 3,48-3,47 (м, 4H), 3,01 (c, 3 H).
ESI [M+H]+: 459.
Пример 24: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриламид
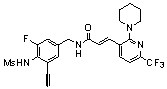
Стадия 1: Синтез 3-(2-пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриловой кислоты
3-(2-Пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриловую кислоту (720 мг) получали в соответствии с процедурой, подобной описанной в предыдущих примерах, из 2-хлор-6-трифторметилникотиновой кислоты при общем выходе 54%.
1H ЯМР (300 МГц, CDCl3): δ 7,81 (м, 2H), 7,18 (д, 1H, J=7,5 Гц), 6,45 (д, 1H, J=16,2 Гц), 3,31 (м, 4H), 1,72 (м, 6H).
Стадия 2: Синтез N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриламида
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (139 мг, 0,50 ммоль) вводили в реакцию с 3-(2-пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриловой кислотой (150 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриламид (132 мг, 50%).
1H ЯМР (300 МГц, CDCl3): δ 7,72 (м, 2H), 7,30 (c, 1H), 7,16 (м, 2H), 6,44 (c, 1H), 6,43 (д, 1H, J=15,6 Гц), 6,10 (c, 1H), 4,53 (д, 2H, J=6,0 Гц), 3,48 (c, 1H), 3,30 (м, 4H), 3,26 (c, 3H), 1,65 (м, 6H).
ESI [M+H]+: 525.
Пример 25: N-(3-фтор-4-метансульфониламино-бензил)-3-(6-пирролидин-1-ил-пиридин-3-ил)-акриламид
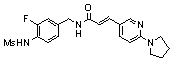
3-(6-Хлор-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид (15 мг, 0,413 ммоль) добавляли к пирролидину (0,5 мл), и смесь перемешивали в течение 12 часов при 90°C. Полученный остаток растворяли в EtOAc, затем промывали три раза H2O и нейтрализовывали 1 н. HCl до рН 5~7. Полученный раствор промывали солевым раствором и затем высушивали над безвод. Na2SO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток перекристаллизовывали (CH2Cl2), получая целевое соединение (4 мг, 24%).
1H ЯМР (300 МГц, ДМСО-d6): δ, 8,41 (т, 1H, J=6,0 Гц), 8,15 (c, 1H), 7,65 (д, 1H, J=8,7 Гц), 7,29 (д, 1H, J=16,8 Гц), 7,26 (д, 1H, J=16,5 Гц), 7,10 (д, 1H, J=11,7 Гц), 7,02 (д, 1H, J=7,5 Гц), 6,43 (д, 1H, J=9,3 Гц), 6,36 (д, 1H, J=15,6 Гц), 4,29 (д, 2H, J=5,7 Гц), 3,85-3,75 (м, 4H), 2,92 (c, 3H), 3,48-3,47 (м, 4H).
ESI [M+H]+: 419.
Пример 26: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриламид
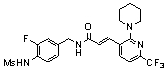
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (127 мг, 0,50 ммоль) вводили в реакцию с 3-(2-пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриловой кислотой (150 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) N-(3-фтор-4-метансульфониламино-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриламид (175 мг, 70%).
1H ЯМР (300 МГц, CDCl3): δ 7,70 (м, 2H), 7,50 (т, 1H, J=8,1 Гц), 7,12 (м, 3H), 6,65 (c, 1H), 6,45 (д, 1H, J=15,6 Гц), 6,14 (т, 1H), 4,54 (д, 2H, J=6,0 Гц), 3,29 (м, 4H), 3,02 (c, 3H), 1,70 (м, 6H).
ESI [M+H]+: 501.
Пример 27: N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-пропионамид
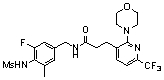
Суспензию N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламида (32 мг, 0,069 ммоль) и 10% Pd/C (3 мг) в MeOH вводили в реакцию под давлением водорода 40 psi. Реакционную смесь фильтровали через целит и затем концентрировали при пониженном давлении, получая N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-пропионамид (22 мг, 69%).
1H ЯМР (300 МГц, CDCl3): δ 7,61 (д, 1H, J=6,9 Гц), 7,27 (д, 1H, J=8,4 Гц), 7,10 (м, 2H), 6,51 (c, 1H), 6,21 (c, 1H), 4,42 (д, 2H, J=5,1 Гц), 3,86 (м, 4H), 3,20 (м, 4H), 3,07 (м, 2H), 3,03 (c, 3H), 2,63 (м, 2H), 2,22 (д, 3H, J=2,4 Гц).
ESI [M+H]+: 519.
Пример 28: 2-(2-бром-6-трет-бутил-пиридин-3-илокси)-N-(3-фтор-4-метансульфониламино-бензил)-ацетамид
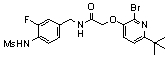
Гидрохлорид 3-фтор-4-метансульфониламинобензиламина (72 мг, 0,25 ммоль) вводили в реакцию с (2-бром-6-трет-бутил-пиридин-3-илокси)-уксусной кислотой (64 мг), DMTMM (1,2 экв., 83 мг) и NEt3 (2,5 экв., 90 мкл) в ТГФ, получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (71 мг, 58,2%).
1H ЯМР (300 МГц, CDCl3): δ 7,56 (м, 1H), 7,24 (м, 2H), 7,11 (м, 3H), 6,48 (c ушир., 1H), 4,58 (c, 2H), 4,55 (д, 2H, J=6 Гц), 3,03 (c, 3H), 1,33 (c, 9H).
ESI [M+H]+: 488.
Пример 29: 2-(6-трет-бутил-пиридин-3-илокси)-N-(3-фтор-4-метансульфониламино-бензил)-ацетамид
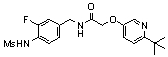
Гидрохлорид 3-фтор-4-метансульфониламинобензиламина (158 мг, 0,62 ммоль) вводили в реакцию с (6-трет-бутил-пиридин-3-илокси)-уксусной кислотой (130 мг), DMTMM (1,2 экв., 206 мг) и NEt3 (2,5 экв., 220 мкл) в ТГФ, получая после очистки хроматографией на колонках (Hex/EtOAc=1/3) целевое соединение (165 мг, 65%).
1H ЯМР (300 МГц, CDCl3): δ 8,33 (д, 1H, J=0,6 Гц), 7,38 (м, 1H), 7,21 (c ушир., 1H), 6,96 (м, 2H), 6,88 (м, 2H), 4,71 (c, 2H), 4,52 (д, 2H, J=6 Гц), 2,99 (c, 3H), 1,47 (c, 9H).
ESI [M+H]+: 409.
Пример 30: 2-(6-трет-бутил-2-хлор-пиридин-3-илокси)-N-(3-фтор-4-метансульфониламино-бензил)-ацетамид
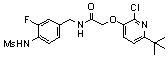
Гидрохлорид 3-фтор-4-метансульфониламинобензиламина (21 мг, 0,08 ммоль) вводили в реакцию с (6-трет-бутил-2-хлор-пиридин-3-илокси)-уксусной кислотой (1,0 экв., 20 мг), DMTMM (1,2 экв., 27 мг) и NMM (1,5 экв., 14 мкл) в ТГФ, получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (10 мг, 28,2%).
1H ЯМР (300 МГц, CDCl3): δ 7,55 (м, 1H), 7,23 (c, 1H), 7,16 (c, 1H), 7,13 (м, 2H), 7,10 (c ушир., 1H), 6,50 (c ушир., 1H), 4,59 (c, 2H), 4,54 (д, 2H, J=6,3 Гц), 3,03 (c, 3H), 1,33 (c, 9H).
ESI [M+H]+: 444.
Пример 31: N-(3-фтор-4-метансульфониламино-бензил)-2-(2-гидроксиметил-6-метил-пиридин-3-илокси)-ацетамид
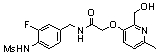
Стадия 1: Синтез (2-гидроксиметил-6-метил-пиридин-3-илокси)-уксусной кислоты
(2-Гидроксиметил-6-метил-пиридин-3-илокси)-уксусную кислоту (200 мг) получали в соответствии с процедурой, подобной описанной выше, из 2,6-лютидин-α2,3-диола при общем выходе 51%.
1H ЯМР (300 МГц, ДМСО-d6): δ 7,24 (д, 1H, J=8,1 Гц), 7,10 (д, 1H, J=8,1 Гц), 4,73 (c, 2H), 4,54 (c, 2H), 2,40 (c, 3H).
Стадия 2: Синтез N-(3-фтор-4-метансульфониламино-бензил)-2-(2-гидроксиметил-6-метил-пиридин-3-илокси)-ацетамида
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (270 мг, 1,00 ммоль) вводили в реакцию с (2-гидроксиметил-6-метил-пиридин-3-илокси)-уксусной кислотой (200 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=10/1) N-(3-фтор-4-метансульфониламино-бензил)-2-(2-гидроксиметил-6-метил-пиридин-3-илокси)-ацетамид (350 мг, 88%).
1H ЯМР (300 МГц, ДМСО-d6): δ 8,69 (т, 1H), 7,29 (м, 2H), 7,09 (м, 3H), 5,10 (т, 1H), 4,66 (c, 2H), 4,60 (д, 2H, J=5,4 Гц), 4,31 (д, 2H, J=6,3 Гц), 2,99 (c, 3H), 2,40 (c, 3H).
ESI [M+H]+: 398.
Пример 32: N-(3-фтор-4-метансульфониламино-бензил)-2-(6-трифторметил-пиридин-3-илокси)-ацетамид
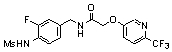
Стадия 1: Синтез (6-трифторметил-пиридин-3-илокси)-уксусной кислоты
(6-Трифторметил-пиридин-3-илокси)-уксусную кислоту (410 мг) получали в соответствии с процедурой, подобной описанной выше, из 2-трифторметил-5-гидроксипиридина при общем выходе 93%.
1H ЯМР (300 МГц, ДМСО-d6): δ 8,29 (д, 1H, J=2,7 Гц), 7,75 (д, 1H, J=8,7 Гц), 7,34 (дд, 1H, J=2,7 и 8,7 Гц), 4,33 (c, 2H).
Стадия 2: Синтез N-(3-фтор-4-метансульфониламино-бензил)-2-(6-трифторметил-пиридин-3-илокси)-ацетамида
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (270 мг, 1,00 ммоль) вводили в реакцию с (6-трифторметил-пиридин-3-илокси)-уксусной кислотой (221 мг), получая после перекристаллизации из Hex/EtOAc N-(3-фтор-4-метансульфониламино-бензил)-2-(6-трифторметил-пиридин-3-илокси)-ацетамид (54 мг, 88%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,52 (c, 1H), 8,80 (т, 1H), 8,49 (д, 1H, J=2,7 Гц), 7,87 (д, 1H, J=9,0 Гц), 7,60 (дд, 1H, J=2,7 и 9,0 Гц), 7,32 (м, 1H), 7,11 (м, 2H), 4,80 (c, 2H), 4,33 (д, 2H, J=6,3 Гц), 2,99 (c, 3H).
ESI [M+H]+: 422.
Пример 33: 2-(6-трет-бутил-5-хлор-пиридин-3-илокси)-N-(3-фтор-4-метансульфониламино-бензил)-ацетамид
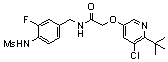
Гидрохлорид 3-фтор-4-метансульфониламинобензиламина (192 мг, 0,751 ммоль) вводили в реакцию с (6-трет-бутил-5-хлор-пиридин-3-илокси)-уксусной кислотой (183 мг), DMTMM (1,1 экв., 229 мг) и NMM (1,2 экв., 100 мкл) в ТГФ, получая целевое соединение (102 мг, 30,6%) после очистки хроматографией на колонках (Hex/EtOAc=1/1).
1H ЯМР (300 МГц, CDCl3): δ 8,18 (д, 1H, J=1,8 Гц), 7,56 (т, 1H), 7,10 (м, 2H), 7,07 (м, 1H), 6,71 (c ушир., H), 6,50 (c ушир., 1H), 4,60 (c, 2H), 4,54 (д, 2H, J=6 Гц), 3,03 (c, 3H), 1,38 (c, 9H).
ESI [M+H]+: 444.
Пример 34: 2-(6-трет-бутил-пиридин-3-илокси)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-ацетамид
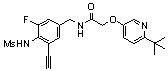
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (120 мг, 0,43 ммоль) вводили в реакцию с (6-трет-бутил-пиридин-3-илокси)-уксусной кислотой (90 мг), DMTMM (1,1 экв., 131 мг) и NMP (1,2 экв., 60 мкл) в ТГФ, получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (62 мг, 33,3%).
1H ЯМР (300 МГц, CDCl3): δ 8,36 (д, 1H, J=1,8 Гц), 7,22 (c ушир., 1H), 7,18 (м, 1H), 7,06 (м, 1H), 6,89 (тс, 1H), 6,64 (c, 1H), 4,68 (c, 2H), 4,51 (д, 2H, J=6 Гц), 3,46 (c, 1H), 3,23 (c, 3H), 1,47 (c, 9H).
ESI [M+H]+: 434.
Пример 35: 2-(6-хлор-пиридин-3-илокси)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-ацетамид
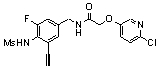
Стадия 1: этиловый эфир (6-хлор-пиридин-3-илокси)-уксусной кислоты
К суспензии 6-хлор-пиридин-3-ола (1000 мг, 7,72 ммоль) и бромэтил ацетата (1933 мг, 11,57 ммоль) в CH3CN добавляли Cs2CO3 (3772 мг, 11,57 ммоль). Смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли EtOAc, затем промывали три раза H2O и солевым раствором и затем высушивали MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный остаток хроматографировали на колонке, получая этиловый эфир (6-хлор-пиридин-3-илокси)-уксусной кислоты (1,5 г, 90%).
1H ЯМР (300 МГц, CDCl3): δ 8,07 (дд, 1H, J=2,7, 0,9 Гц), 7,27-7,23 (м, 2H), 4,65 (c, 2H), 4,28 (кв, 2H, J=7,2 Гц), 1,30 (т, 3H, J=7,2 Гц).
Стадия 2: (6-хлор-пиридин-3-илокси)-уксусная кислота
Этиловый эфир (6-хлор-пиридин-3-илокси)-уксусной кислоты (800 мг, 3,71 ммоль) в ТГФ добавляли к раствору 0,5 н. LiOH (2 экв.), и смесь перемешивали в течение 1,5 часов при комнатной температуре. Полученный остаток растворяли в H2O, затем промывали три раза Et2O и нейтрализовывали 1 н. HCl до рН 5~7. Раствор экстрагировали три раза метиленхлоридом и затем высушивали над безвод. Na2SO4, и концентрировали в вакууме, получая (6-хлор-пиридин-3-илокси)-уксусную кислоту (300 мг, 36%).
1H ЯМР (300 МГц, CDCl3): δ 8,05 (д, 1H, J=3,3 Гц), 7,43-7,35 (м, 2H), 4,74 (c, 2H).
Стадия 3: 2-(6-хлор-пиридин-3-илокси)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-ацетамид
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид (74,3 мг, 0,266 ммоль) суспендировали в ТГФ и обрабатывали триэтиламином (27 мг, 0,266 ммоль), и затем полученную смесь перемешивали в течение 10 мин. К реакционной смеси добавляли (6-хлор-пиридин-3-илокси)-уксусную кислоту (50 мг, 0,266 ммоль), затем через 10 минут DMTMM (62,5 мг, 0,266 ммоль). Полученную смесь перемешивали в течение ночи при температуре окружающей среды и затем разбавляли EtOAc. Полученный раствор промывали последовательно водой, насыщ. NaHCO3 (×3) и солевым раствором и затем высушивали над безвод. MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток перекристаллизовывали (CH2Cl2), получая целевое соединение (25 мг, 25%).
1H ЯМР (300 МГц, CDCl3): δ 8,13 (дд, 1H, J=3,0, 0,9 Гц), 7,34-7,24 (м, 3H), 7,14 (дд, 1H, J=10,5, 2,1 Гц), 6,90 (c, 1H, ушир.), 6,44 (c, 1H), 4,58 (c, 2H), 4,53 (c, 1H), 4,50 (д, 2H, J=6,3 Гц), 3,26 (c, 3H).
ESI [M+H]+: 412.
Пример 36: 3-(2-бром-6-трет-бутил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
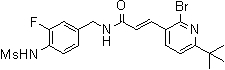
Гидрохлорид 3-фтор-4-метансульфониламинобензиламина (116 мг, 0,454 ммоль) вводили в реакцию с 3-(2-бром-6-трет-бутил-пиридин-3-ил)-акриловой кислотой (1,0 экв., 129 мг), DMTMM (1,0 экв., 126 мг) и NMP (1,2 экв., 60 мкл) в ТГФ, получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (72 мг, 32,8%).
1H ЯМР (300 МГц, CDCl3): δ 7,89 (д, 1H, J=12,9 Гц), 7,72 (д, 1H, J=7,8 Гц), 7,56 (м, 1H), 7,29 (д, 1H, J=8,4 Гц), 7,15 (м, 2H), 6,46 (c ушир., 1H), 6,36 (д, 1H, J=15,3 Гц), 6,01 (c ушир., 1H), 4,56 (д, 2H, J=6,3 Гц), 3,03 (c, 3H), 1,35 (c, 9H).
Пример 37: 3-(2-бром-6-трет-бутил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
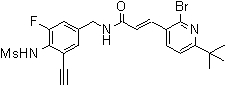
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (41,2 мг, 0,148 ммоль) вводили в реакцию с 3-(2-бром-6-трет-бутил-пиридин-3-ил)-акриловой кислотой (1,0 экв., 42 мг), DMTMM (1,0 экв., 41 мг) и NMP (1,2 экв., 20 мкл) в ТГФ, получая после очистки хроматографией на колонках (Hex/EtOAc=3/2) целевое соединение (42 мг, 55,8%).
1H ЯМР (300 МГц, CDCl3): δ 7,90 (д, 1H, J=15,9 Гц), 7,73 (д, 1H, J=7,5 Гц), 7,31 (м, 1H), 7,28 (c, 1H), 7,17 (дд, 1H, J=2,1 Гц и 1,5 Гц), 6,41 (c, 1H), 6,37 (д, 1H, J=15,7 Гц), 6,09 (c ушир., 1H), 4,53 (д, 2H, J=6,0 Гц), 3,48 (c, 1H), 3,27 (c, 3H), 1,35 (c, 9H).
Пример 38: 3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
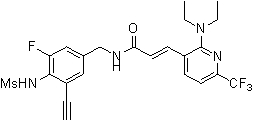
Стадия 1: 2-Хлор-N-метокси-N-метил-6-трифторметил-никотинамид
К суспензии 2-хлор-6-трифторметил-никотиновой кислоты (200 мг, 0,88 ммоль) и N,O-диметилгидроксиламингидрохлорида (95 мг, 0,97 ммоль) в CH2Cl2 (3 мл) добавляли N-метилморфолин (0,106 мл, 0,97 ммоль). Смесь перемешивали в течение 5 минут, затем добавляли N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид (185 мг, 0,97 ммоль). Смесь перемешивали в течение 3 часов при комнатной температуре и затем разбавляли EtOAc и водой. Органический слой промывали 1 н. HCl, насыщенным раствором бикарбоната натрия и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Продукт высушивали в вакууме, получая 2-хлор-N-метокси-N-метил-6-трифторметил-никотинамид (220 мг, 92%).
1H ЯМР (300 МГц, CDCl3): δ 7,86 (д, 1H, J=7,8 Гц), 7,69 (д, 1H, J=7,8 Гц), 3,52 (c, 3H), 3,42 (c, 3H).
Стадия 2: 2-диэтиламино-N-метокси-N-метил-6-трифторметил-никотинамид
К суспензии 2-хлор-N-метокси-N-метил-6-трифторметил-никотинамида (400 мг, 1,489 ммоль) и диэтиламина (0,773 мл, 7,44 ммоль) в DMF (4 мл) добавляли K2CO3 (1,02 г, 7,44 ммоль). Смесь перемешивали в течение 4 часов при 110°C. Реакционную смесь разбавляли EtOAc (30 мл) и затем промывали два раза 1 н. HCl (30 мл) и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток хроматографировали, получая 2-диэтиламино-N-метокси-N-метил-6-трифторметил-никотинамид (400 мг, 88%).
1H ЯМР (300 МГц, CDCl3): δ 7,50 (д, 1H, J=7,5 Гц), 6,90 (д, 1H, J=7,5 Гц), 3,54-3,41 (м, 7H), 3,29 (c, 3H), 1,71 (т, 6H, J=7,2 Гц).
Стадия 3: 2-диэтиламино-6-трифторметил-пиридин-3-карбальдегид
К суспензии 2-диэтиламино-N-метокси-N-метил-6-трифторметил-никотинамида (66 мг, 0,216 ммоль) в ТГФ (2 мл) добавляли по каплям 1,0 M LiAlH4 (0,108 мл, 0,108 ммоль) при -78°C. Смесь нагревали до -20°C в течение 30 мин. Реакционную смесь разбавляли Et2O и промывали два раза 1 н. KHSO4 и солевым раствором, высушивали над безвод. MgSO4, фильтровали и концентрировали при пониженном давлении. Продукт высушивали в вакууме, получая 2-диэтиламино-6-трифторметил-пиридин-3-ил-карбальдегид (43 мг, 75%).
1H ЯМР (300 МГц, CDCl3): δ 9,98 (c, 1H), 8,07 (д, 1H, J=7,5 Гц), 7,05 (д, 1H, J=7,5 Гц), 3,54 (кв, 4H, J=7,2 Гц), 1,27 (т, 6H, J=7,2 Гц).
Стадия 4: метиловый эфир 3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-акриловой кислоты
К раствору 2-диэтиламино-6-трифторметил-пиридин-3-ил-карбальдегида (39 мг, 0,147 ммоль) в толуоле добавляли метил(трифенилфосфоранилиден)ацетат (73,8 мг, 0,221 ммоль), и полученную смесь нагревали при 90°C в течение 3 часов. Реакционную смесь разбавляли EtOAc и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=10/1), получая метиловый эфир 3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-акриловой кислоты (40 мг, 90%).
1H ЯМР (300 МГц, CDCl3): δ 7,73 (д, 1H, J=16,2 Гц), 7,72 (д, 1H, J=8,1 Гц), 6,36 (д, 1H, J=16,2 Гц), 3,82 (c, 3H), 3,38 (кв, 4H, J=7,2 Гц), 1,78 (т, 6H, J=7,2 Гц).
Стадия 5: 3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-акриловая кислота
К суспензии метилового эфира 3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-акриловой кислоты (40 мг, 0,132 ммоль) в ТГФ (1 мл) добавляли раствор 0,5 н. LiOH (0,3 мл), и смесь перемешивали в течение 3 часов при комнатной температуре. Полученный остаток растворяли в H2O и затем промывали три раза EtOAc, подкисляли 1 н. HCl до рН 1~2. Раствор экстрагировали три раза метиленхлоридом и затем высушивали над безвод. Na2SO4, и концентрировали в вакууме, получая 3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-акриловую кислоту (33 мг, 87%).
1H ЯМР (300 МГц, CDCl3): δ 7,79 (д, 1H, J=18,0 Гц), 7,74 (д, 1H, J=8,1 Гц), 7,09 (д, 1H, J=7,5 Гц), 6,37 (д, 1H, J=15,6 Гц), 3,38 (кв, 4H, J=7,2 Гц), 1,22 (т, 6H, J=7,2 Гц).
Стадия 6: 3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
К суспензии N-(4-аминометил-2-этинил-6-фтор-фенил)-метансульфонамида, соль HCl (476 мг, 1,66 ммоль) в ТГФ (5 мл) добавляли N-метилморфолин (0,365 мл, 3,32 ммоль). Смесь перемешивали в течение 5 минут, затем добавляли 3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-акриловую кислоту (434 мг, 1,51 ммоль) и 4-(4,6-диметокси[1,3,5]триазин-2-ил)-4-метилморфолинийхлорид гидрат (DMTMM, 459 мг, 1,66 ммоль). Смесь перемешивали в течение ночи при комнатной температуре и концентрировали при пониженном давлении. Остаток разбавляли EtOAc и водой. Органический слой промывали насыщенным бикарбонатом натрия, 1 н. HCl и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали перекристаллизацией из CH2Cl2, получая целевое соединение (645 мг, 83%).
1H ЯМР (300 МГц, CDCl3): δ 7,73 (д, 1H, J=16,5 Гц), 7,69 (д, 1H, J=8,4 Гц), 7,28 (д, 1H, J=7,8 Гц), 7,16 (д, 1H, J=11,1 Гц), 7,07 (д, 1H, J=7,8 Гц), 6,44 (c, 1H), 6,35 (д, 1H, J=15,3 Гц), 6,10 (c, 1H), 4,51 (д, 2Н, J=5,7 Гц), 3,47 (c, 1H), 3,38 (кв, 4H, J=7,2 Гц), 3,26 (c, 1H), 1,19 (т, 6H, J=7,2 Гц).
ESI [M+H]+: 513.
Пример 39: 3-(6-трет-бутил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид
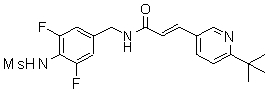
Стадия 1: 3-(6-трет-бутил-пиридин-3-ил)-акриловая кислота
К раствору 6-трет-бутил-пиридин-3-ил-карбальдегида (1,34 г, 8,75 ммоль), полученного в соответствии с известной процедурой, в толуоле добавляли метил(трифенилфосфоранилиден)ацетат (2,93 г), и полученную смесь нагревали при 90°C в течение 3 часов. Реакционную смесь разбавляли EtOAc и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=4/1), получая эфирный продукт (1,56 г, 81%). Полученный сложный эфир растворяли в 1,4-диоксане, обрабатывали водой и KOH, перемешивали и нагревали с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и затем промывали простым эфиром. Водную фазу подкисляли 1 н. HCl и затем экстрагировали CHCl3, и объединенную органическую фазу промывали солевым раствором, высушивали над безводным MgSO4 и концентрировали при пониженном давлении, получая 3-(6-трет-бутил-пиридин-3-ил)-акриловую кислоту (1,00 г, 68%).
1H ЯМР (300 МГц, CDCl3): δ 8,78 (д, 1H, J=2,1 Гц), 7,84 (дд, 1H, J=2,1 и 8,4 Гц), 7,78 (д, 1H, J=16,2 Гц), 7,42 (д, 1H, J=8,4 Гц), 6,53 (д, 1H, J=16,2 Гц), 1,40 (c, 9H).
Стадия 2: 3-(6-трет-бутил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (50 мг, 0,18 ммоль) вводили в реакцию с 3-(6-трет-бутил-пиридин-3-ил)-акриловой кислотой (37 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (60 мг, 79%).
1H ЯМР (300 МГц, CDCl3 + ДМСО-d6): δ 8,69 (д, 1H, J=2,4 Гц), 7,98 (7, 1H, J=6,0 Гц), 7,76 (дд, 1H, J=2,4 и 8,4 Гц), 7,63 (д, 1H, J=15,6 Гц), 7,37 (д, 1H, J=8,4 Гц), 6,99 (д, 2H, J=8,1 Гц), 6,63 (д, 1H, J=15,6 Гц), 4,50 (д, 2H, J=6,0 Гц), 3,11 (c, 3H), 1,37 (c, 9H).
ESI [M+H]+: 424.
Пример 40: 3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
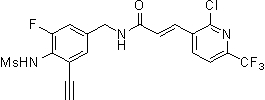
Стадия 1: 2-хлор-6-трифторметил-пиридин-3-ил-карбальдегид
Целевое соединение получали согласно общей процедуре, описанной в примере 38 (стадия 3).
2-Хлор-N-метокси-N-метил-6-трифторметил-никотинамид (1,109 мг, 4,128 ммоль) вводили в реакцию с 1,0 M LiAlH4 (0,5 экв.), получая 2-хлор-6-трифторметил-пиридин-3-ил-карбальдегид (844 мг, 97%).
1H ЯМР (300 МГц, CDCl3): δ 10,49 (c, 1H), 8,41 (д, 1H, J=7,8 Гц), 7,79 (д, 1H, J=7,8 Гц).
Стадия 2: метиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты
Целевое соединение получали согласно общей процедуре, описанной в примере 38 (стадия 4).
2-Хлор-6-трифторметил-пиридин-3-ил-карбальдегид (844 мг, 4,027 ммоль) вводили в реакцию с метил(трифенилфосфоранилиден)ацетатом (1,62 г, 4,83 ммоль), получая метиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (900 мг, 84%).
1H ЯМР (300 МГц, CDCl3): δ 8,08 (д, 1H, J=8,1 Гц), 7,99 (д, 1H, J=15,9 Гц), 7,67 (д, 1H, J=8,1 Гц), 6,53 (д, 1H, J=15,9 Гц), 3,86 (c, 3H).
Стадия 3: 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловая кислота
Целевое соединение получали согласно общей процедуре, описанной в примере 38 (стадия 5).
Метиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (200 мг, 0,753 ммоль) вводили в реакцию с 0,5 н. LiOH (2 экв.), получая 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (189 мг, 99%).
1H ЯМР (300 МГц, ДМСО-d6): δ 8,56 (д, 1H, J=8,1 Гц), 7,93 (д, 1H, J=8,1 Гц), 7,68 (д, 1H, J=15,9 Гц), 6,77 (д, 1H, J=15,9 Гц).
Стадия 4: 3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
Целевое соединение получали согласно общей процедуре, описанной в примере 38 (стадия 6).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (228 мг, 0,795 ммоль) вводили в реакцию с 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислотой (200 мг, 0,795 ммоль), получая целевое соединение (340 мг, 90%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,47 (c, 1H), 8,96 (т, 1H, J=6,0 Гц), 8,43 (д, 1H, J=7,8 Гц), 8,02 (д, 1H, J=8,1 Гц), 7,67 (д, 1H, J=15,6 Гц), 7,31-7,27 (м, 2H), 6,90 (д, 1H, J=15,6 Гц), 4,52 (c, 1H), 4,41 (д, 2H, J=5,7 Гц), 3,07 (c, 3H).
ESI [M+H]+: 476.
Пример 41: N-(3-этинил-5-фтор-4-метансульфониламинобензил)-3-(6-метокси-4-трифторметилпиридин-3-ил)акриламид
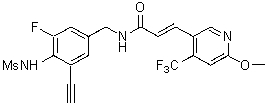
Стадия 1: синтез метил-6-метокси-4-трифторметилникотината
К раствору 6-гидрокси-4-трифторметилникотиновой кислоты (400 мг, 1,93 ммоль) в хлороформе (25 мл) добавляли карбонат серебра (1,06 г, 3,84 ммоль) и метилйодид (2,4 мл, 3,84 ммоль). Смесь перемешивали в темноте при комнатной температуре в течение ночи, фильтровали через целит и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонках (EtOAc/гексаны=от 1/10 до 1/1), получая метил-6-метокси-4-трифторметилникотинат (300 мг, 69,9%) в форме твердого вещества.
1H ЯМР (300 МГц, CDCl3): δ 8,79 (c, 1 H), 7,08 (м, 1 H), 4,04 (c, 3 H), 3,93 (c, 3 H).
Стадия 2: синтез 6-метокси-4-трифторметил-3-пиридинметанола
К охлажденному (-78°C) раствору метил-6-метокси-4-трифторметилникотината (300 мг, 1,35 ммоль) в толуоле (10 мл) добавляли диизобутилалюминийгидрид (DIBAL, 1М/толуол, 1,35 мл). Смесь медленно нагревали до комнатной температуры и перемешивали в течение 2 дней. Добавляли дополнительный DIBAL (1М/толуол, 2 мл), чтобы завершить реакцию. После перемешивания в течение 4 часов смесь гасили насыщенным водным раствором хлорида аммония (1 мл), высушивали над безводным сульфатом магния, фильтровали через целит и концентрировали при пониженном давлении, получая 6-метокси-4-трифторметил-3-пиридинметанол (220 мг, 78,6%). Сырой продукт использовали непосредственно в следующем окислении по Swern.
1H ЯМР (300 МГц, CDCl3): δ 8,41 (c, 1H), 7,00 (c, 1H), 4,80 (c, 2 H), 3,98 (c, 3H).
Стадия 3: синтез 6-метокси-4-трифторметил-3-пиридинкарбоксальдегида
К охлажденному (-78°C) раствору диметилсульфоксида (DMSO) (0,15 мл, 2,13 ммоль) в дихлорметане (2 мл) добавляли оксалилхлорид (0,14 мл, 1,60 ммоль), и смесь перемешивали в течение 10 минут. К реакционной смеси добавляли 6-метокси-4-трифторметил-3-пиридинметанол (220 мг, 1,06 ммоль) в дихлорметане (4 мл). После перемешивания при -40°C в течение 50 минут смесь обрабатывали триэтиламином (0,44 мл, 3,16 ммоль), перемешивали в течение 90 минут, нагревали до комнатной температуры и гасили водой. Органический слой промывали солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая 6-метокси-4-трифторметил-3-пиридинкарбоксальдегид (162 мг, 74,4%) в форме твердого вещества. Сырой продукт использовали непосредственно в следующем окислении по Swern.
1H ЯМР (300 МГц, CDCl3): δ 10,25~10,23 (м, 1H), 8,91 (c, 1H), 7,07 (c, 1H), 4,08 (c, 3H).
Стадия 4: синтез метилового эфира 3-(6-метокси-4-трифторметилпиридин-3-ил)-акриловой кислоты
К раствору 6-метокси-4-трифторметил-3-пиридинкарбоксальдегида (150 мг, 0,73 ммоль) в толуоле (8 мл) добавляли метил(трифенилфосфоранилиден)ацетат (270 мг, 0,81 ммоль). Смесь нагревали при 110°C в течение ночи, охлаждали до комнатной температуры и разбавляли EtOAc и водой. Органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонках (EtOAc/гексаны=1/4), получая метиловый эфир 3-(6-метокси-4-трифторметилпиридин-3-ил)-акриловой кислоты (140 мг, 73,3%) как смесь цис- и транс-изомеров (цис-/транс-=1/10). Транс-изомер затем выделяли перекристаллизацией из гексанов, получая 60 мг в форме твердого вещества.
1H ЯМР (300 МГц, CDCl3): δ 8,52 (c, 1H), 7,90~7,84 (м, 1H), 7,03 (c, 1H), 6,38 (д, 1Н, J=15,9 Гц), 4,01 (c, 3H), 3,83 (c, 3H).
Стадия 5: синтез 3-(6-метокси-4-трифторметилпиридин-3-ил)-акриловой кислоты
К раствору метилового эфира 3-(6-метокси-4-трифторметилпиридин-3-ил)-акриловой кислоты (транс-изомер, 59 мг, 0,23 ммоль) в ТГФ (2 мл) добавляли 1 н. LiOH (2 мл). Смесь перемешивали при комнатной температуре в течение 2 часов, подкисляли до рН 5 с использованием 3 н. HCl и экстрагировали EtOAc. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении, получая 3-(6-метокси-4-трифторметилпиридин-3-ил)-акриловую кислоту (50 мг, 89,6%) в форме твердого вещества.
1H ЯМР (300 МГц, CDCl3): δ 8,57 (c, 1H), 7,80~7,94 (м, 1H), 7,05 (c, 1H), 6,41 (д, 1Н, J=15,9 Гц), 4,02 (c, 3H).
Стадия 6: синтез N-(3-этинил-5-фтор-4-метансульфониламинобензил)-3-(6-метокси-4-трифторметилпиридин-3-ил)акриламида
К суспензии 3-этинил-5-фтор-4-метансульфониламинобензиламингидрохлорида (67 мг, 0,24 ммоль) в ТГФ (2 мл) добавляли N-метилморфолин (40 мкл, 0,36 ммоль). После перемешивания в течение 5 минут добавляли 3-(6-метокси-4-трифторметилпиридин-3-ил)акриловую кислоту (50 мг, 0,20 ммоль), растворенную в ТГФ (3 мл), и 4-(4,6-диметокси[1,3,5]триазин-2-ил)-4-метилморфолинийхлорид гидрат (DMTMM 67 мг, 0,24 ммоль). Смесь перемешивали при комнатной температуре в течение ночи и концентрировали при пониженном давлении. Остаток разбавляли EtOAc и водой. Органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали перекристаллизацией из смеси EtOAc/гексан, получая N-(3-этинил-5-фтор-4-метансульфониламинобензил)-3-(6-метокси-4-трифторметилпиридин-3-ил)акриламид (75 мг, 66,2%) в форме твердого вещества.
1H ЯМР (300 МГц, ДМСО-d6): δ 8,83 (т, 1Н, J=6 Гц), 8,70 (д, 1Н, J=0,6 Гц), 7,59~7,54 (м, 1H), 7,28~7,24 (м, 3H), 6,71 (д, 1Н, J=15,6 Гц), 4,49 (c, 1H), 4,38 (д, 2Н, J=5,7 Гц), 3,96 (c, 3H), 3,05 (c, 3H).
ESI [M+H]+: 472
Пример 42: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-метокси-6-трифторметил-пиридин-3-ил)-акриламид
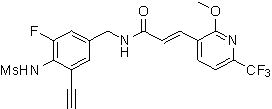
К суспензии 3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламида (50 мг, 0,105 ммоль) в CH3OH (1 мл) добавляли по каплям при 0°C 30% NaOCH3 в CH3OH (3 экв.). Смесь перемешивали в течение 12 часов при комнатной температуре. Реакционную смесь разбавляли EtOAc и промывали два раза 1 н. HCl и солевым раствором, высушивали над безвод. MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках, получая целевое соединение (10 мг, 20%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,45 (c, 1H), 8,86 (c, 1H, ушир.), 8,19 (д, 1H, J=7,5 Гц), 7,60-7,54 (м, 2H), 7,29-7,26 (м, 2H), 6,96 (д, 1H, J=15,9 Гц), 4,51 (c, 1H), 4,40 (д, 2H, J=5,7 Гц), 4,01 (c, 3H), 3,07 (c, 3H).
ESI [M+H]+: 472.
Пример 43: N-(3-фтор-4-метансульфониламинобензил)-3-(6-метокси-4-трифторметилпиридин-3-ил)акриламид
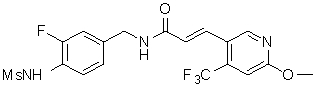
К суспензии 3-фтор-4-метансульфониламинобензиламингидрохлорида (40 мг, 0,16 ммоль) в ТГФ (4 мл) добавляли N-метилморфолин (26 мкл, 0,24 ммоль). После перемешивания в течение 5 минут добавляли 3-[6-метокси-4-(трифторметил)пиридин-3-ил]акриловую кислоту (32 мг, 0,13 ммоль), растворенную в ТГФ (3 мл), и 4-(4,6-диметокси[1,3,5]триазин-2-ил)-4-метилморфолинийхлорид гидрат (DMTMM 43 мг, 0,16 ммоль). Смесь перемешивали при комнатной температуре в течение ночи и концентрировали при пониженном давлении. Остаток разбавляли EtOAc и водой. Органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали перекристаллизацией из смеси EtOAc/гексан, получая N-(3-фтор-4-метансульфониламинобензил)-3-(6-метокси-4-трифторметилпиридин-3-ил)акриламид (30 мг, 42,7%) в форме твердого вещества.
1H ЯМР (300 МГц, ДМСО-d6): δ 8,80 (т, 1Н, J=5,7 Гц), 8,68 (c, 1H), 7,59~7,53 (м, 1H), 7,35 (т, 1Н, J=8,4 Гц), 7,24 (c, 1H), 7,22~7,18 (м, 1H), 7,14~7,11 (м, 1H), 6,70 (д, 1Н, J=15,6 Гц), 4,38 (д, 2Н, J=5,7 Гц), 3,96 (c, 3H), 3,00 (c, 3H).
ESI [M+H]+: 448.
Пример 44: 3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
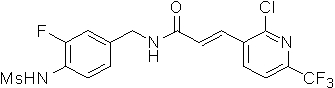
Целевое соединение получали согласно общей процедуре, описанной в примере 38 (стадия 6).
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (467 мг, 1,84 ммоль) вводили в реакцию с 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислотой (420 мг, 1,67 ммоль), получая целевое соединение (737 мг, 98%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,55 (c, 1H), 8,92 (т, 1H, J=5,7 Гц), 8,41 (д, 1H, J=8,1 Гц), 8,02 (д, 1H, J=8,1 Гц), 7,67 (д, 1H, J=15,9 Гц), 7,34 (т, 1H, J=8,1 Гц), 7,20 (д, 1H, J=11,4 Гц), 7,13 (д, 1H, J=8,1 Гц), 6,89 (д, 1H, J=15,9 Гц), 4,40 (д, 2H, J=5,4 Гц), 3,00 (c, 3H).
ESI [M+H]+: 452.
Пример 45: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид
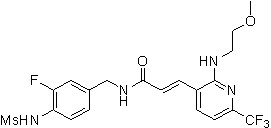
К суспензии 3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламида (35 мг, 0,077 ммоль) и метоксиэтиламина (5 экв.) в DMF (0,5 мл) добавляли K2CO3 (5 экв.). Смесь перемешивали в течение 12 часов при 110°C. Реакционную смесь разбавляли EtOAc и затем промывали два раза 1 н. HCl и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток хроматографировали на колонке, получая целевое соединение (10 мг, 26%).
1H ЯМР (300 МГц, CDCl3): δ 7,67 (м, 3H), 7,13 (т, 2H, J=9,3 Гц), 6,92 (д, 1H, J=7,8 Гц), 6,57 (c, 1H), 6,37 (д, 1H, J=15,3 Гц), 6,11 (c, 1Н, ушир.), 5,25 (c, 1H, ушир.), 4,55 (д, 2H, J=6,0 Гц), 3,74-3,69 (м, 2H), 3,65-3,58 (м, 2H), 3,38 (c, 3H), 3,01 (c, 3H).
ESI [M+H]+: 491.
Пример 46: отсутствует
Пример 47: 3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
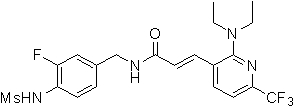
Целевое соединение получали согласно общей процедуре, описанной в примере 45 (стадия 1).
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид (27 мг, 0,06 ммоль) вводили в реакцию с диэтиламином (5 экв.), получая целевое соединение (14 мг, 48%).
1H ЯМР (300 МГц, CDCl3): δ 7,75 (д, 1H, J=15,9 Гц), 7,68 (д, 1H, J=7,8 Гц), 7,52 (т, 1H, J=7,8 Гц), 7,17-7,11 (м, 2H), 7,06 (д, 1H, J=7,8 Гц), 6,57 (c, 1H), 6,35 (д, 1H, J=15,3 Гц), 6,04 (т, 1H, J=5,7 Гц), 4,55 (д, 2H, J=6,0 Гц), 3,38 (кв, 4H, J=7,2 Гц), 3,02 (c, 3H), 1,19 (т, 6H, J=7,2 Гц).
ESI [M+H]+: 489.
Пример 48: отсутствует
Пример 49: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-пиридин-3-ил)-акриламид
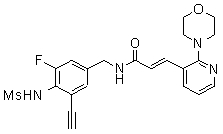
Стадия 1: синтез 2-морфолин-4-ил-пиридин-3-карбальдегид
К раствору 2-хлор-пиридин-3-ил-карбальдегида (0,5 г, 3,53 ммоль) в DMF добавляли морфолин (0,37 мл, 1,2 экв.), и реакционную смесь перемешивали при 90°C в течение 6 часов. Реакционную смесь разбавляли EtOAc и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=4/1), получая продукт (0,38 г, 56,1%).
1H ЯМР (300 МГц, CDCl3): δ 10,04 (c, 1H), 8,40 (м, 1H), 8,01 (м, 1H), 6,96 (м, 1H), 3,88 (м, 4H), 3,47 (м, 4H).
Стадия 2: синтез 3-(2-морфолин-4-ил-пиридин-3-ил)-акриловой кислоты
К раствору 2-морфолин-4-ил-пиридин-3-ил-карбальдегида (0,38 г, 1,98 ммоль) в толуоле добавляли метил(трифенилфосфоранилиден)ацетат (0,793 г, 1,2 экв.), и полученную смесь нагревали при 90°C в течение 4 часов. Реакционную смесь разбавляли EtOAc и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=4/1), получая эфирный продукт (0,35 г, 71,2%). Полученный сложный эфир растворяли в 1,4-диоксане, обрабатывали водой и KOH, перемешивали и нагревали с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали до комнатной температуре, разбавляли водой и затем промывали простым эфиром. Водную фазу подкисляли 1 н. HCl и затем экстрагировали EtOAc, и объединенную органическую фазу промывали солевым раствором, высушивали над безводным MgSO4 и концентрировали при пониженном давлении, получая 3-(6-трет-бутил-пиридин-3-ил)-акриловую кислоту (0,25 г, 75,7%).
1H ЯМР (300 МГц, CDCl3): δ 8,33 (м, 1H), 7,90 (д, 1H, J=15,9 Гц), 7,77 (м, 1H), 6,97 (м, 1H), 6,42 (д, 1H, J=15,9 Гц), 3,86 (м, 4H), 3,27 (м, 4H).
Стадия 3: синтез N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-пиридин-3-ил)-акриламида
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (96 мг, 0,35 ммоль) вводили в реакцию с 3-(2-морфолин-4-ил-пиридин-3-ил)-акриловой кислотой (81 мг, 1,0 экв.), получая после очистки хроматографией на колонках (Hex/EtOAc=1/10) N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-пиридин-3-ил)-акриламид (105 мг, 63,6%).
1H ЯМР (300 МГц, CDCl3): δ 8,29 (м, 1H), 7,80 (д, 1H, J=15,3 Гц), 7,30 (c ушир., 1H), 7,18 (м, 1H), 6,94 (м, 1H), 6,43 (c ушир., 1H), 6,40 (д, 1H, J=15,3 Гц), 5,99 (c ушир., 1H), 4,54 (д, 1H, J=6,0 Гц), 3,88 (м, 4H), 3,49 (c, 1H), 3,27 (c, 3H), 3,26 (м, 4H).
ESI [M+H]+: 459.
Пример 50: N-(5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-пиридин-3-ил)-акриламид
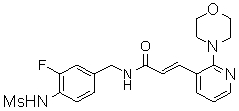
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (57 мг, 0,22 ммоль) вводили в реакцию с 3-(2-морфолин-4-ил-пиридин-3-ил)-акриловой кислотой (52 мг, 1,0 экв.), получая после очистки хроматографией на колонках (Hex/EtOAc=1/7) N-(5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-пиридин-3-ил)-акриламид (67 мг, 69,5%).
1H ЯМР (300 МГц, CDCl3): δ 8,29 (м, 1H), 7,81 (д, 1H, J=15,6 Гц), 7,69 (м, 1H), 7,55 (м, 1H), 7,17 (м, 1H), 6,93 (м, 1H), 6,46 (c ушир., 1H), 6,40 (д, 1H, J=15,6 Гц), 5,92 (c ушир., 1H), 4,56 (д, 1H, J=6,0 Гц), 3,88 (м, 4H), 3,26 (м, 4H), 3,03 (c, 3H).
ESI [M+H]+: 435.
Пример 51: 3-(6-трет-бутил-2-хлор-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
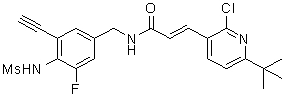
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (30 мг, 0,11 ммоль), вводили в реакцию с 3-(6-трет-бутил-2-хлор-пиридин-3-ил)-акриловой кислотой (30 мг, 1,0 экв.), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) 3-(6-трет-бутил-2-хлор-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (19 мг, 37,9%).
1H ЯМР (300 МГц, CDCl3): δ 7,93 (д, 1H, J=15,6 Гц), 7,23 (м, 3H), 7,00 (м, 1H), 6,42 (c ушир., 1H), 6,41 (д, 1H, J=15,6 Гц), 6,08 (c ушир., 1H), 4,53 (д, 2H, J=6,0 Гц), 3,48 (c, 1H), 3,26 (c, 3H), 1,36 (c, 9H).
ESI [M+H]+: 464.
Пример 52: 3-(6-хлор-4-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
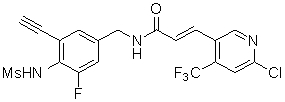
Стадия 1: синтез N-(6-хлор-4-трифторметил-пиридин-3-ил)-O,N-диметил-гидроксиламина
К раствору 6-хлор-4-трифторметил-никотиновой кислоты (0,9 г, 3,99 ммоль) в метиленхлориде при 0°C добавляли N,O-диметилгидроксиламин HCl (0,39 г, 1,0 экв.), NMM (0,44 мл) и EDC (0,768 г), и реакционную смесь перемешивали при 0°C в течение 2 часов. Реакционную смесь экстрагировали метиленхлоридом и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=4/1), получая продукт (0,824 г, 76,9%).
1H ЯМР (300 МГц, CDCl3): δ 8,53 (c, 1H), 7,63 (c, 1H), 3,47 (c, 3H), 3,38 (c, H).
Стадия 2: синтез 3-(6-хлор-4-трифторметил-пиридин-3-ил)-акриловой кислоты
N-(6-Хлор-4-трифторметил-пиридин-3-ил)-O,N-диметил-гидроксиламин (0,824 г, 3,07 ммоль) растворяли в безводном ТГФ и охлаждали до -78°C, и добавляли в шприце 1,0 M LAH (1,54 мл), и затем полученную смесь перемешивали в течение 30 минут. К реакционной смеси осторожно добавляли 1 M NaOH (2 мл) и H2O (2 мл), и затем полученный раствор перемешивали в течение 30 минут. Смесь высушивали безводным MgSO4, фильтровали и концентрировали в вакууме, получая 6-хлор-4-трифторметил-пиридин-3-ил-карбальдегид в форме светло-желтого масла (0,643 г, 100%). К раствору 6-хлор-4-трифторметил-пиридин-3-ил-карбальдегида (0,643 г, 3,07 ммоль) в толуоле добавляли метил(трифенилфосфоранилиден)ацетат (1,13 г, 1,1 экв.), и полученную смесь нагревали при 90°C в течение 4 часов. Реакционную смесь разбавляли EtOAc и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=8/1), получая эфирный продукт (0,56 г, 68,4%). Полученный сложный эфир растворяли в 1,4-диоксане, обрабатывали водой и KOH, перемешивали и нагревали с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и затем промывали простым эфиром. Водную фазу подкисляли 1 н. HCl и затем экстрагировали EtOAc, и объединенную органическую фазу промывали солевым раствором, высушивали над безводным MgSO4 и концентрировали при пониженном давлении, получая 3-(6-хлор-4-трифторметил-пиридин-3-ил)-акриловую кислоту (0,43 г, 81,4%).
1H ЯМР (300 МГц, CDCl3): δ 8,77 (c, 1H), 7,97 (м, 1H), 7,65 (c, 1H), 6,52 (д, 1H, J=15,9 Гц).
Стадия 3: синтез 3-(6-хлор-4-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламида
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (123 мг, 0,40 ммоль) вводили в реакцию с 3-(6-хлор-4-трифторметил-пиридин-3-ил)-акриловой кислотой (105 мг, 1,0 экв.), получая после очистки хроматографией на колонках (Hex/EtOAc=3/2) 3-(6-хлор-4-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (136 мг, 73,3%).
1H ЯМР (300 МГц, CDCl3): δ 8,70 (c, 1H), 7,90 (м, 1H), 7,62 (c, 1H), 7,30 (c, 1H), 7,18 (м, 1H), 6,46 (д, 1H, J=15,3 Гц), 6,14 (c ушир., 1H), 4,54 (д, 2H, J=6,0 Гц), 3,49 (c, 1H), 3,27 (c, 3H).
ESI [M+H]+: 476.
Пример 53: 3-(6-хлор-4-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
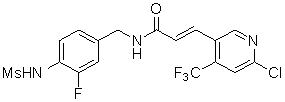
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (56 мг, 0,22 ммоль) вводили в реакцию с 3-(6-хлор-4-трифторметил-пиридин-3-ил)-акриловой кислотой (54 мг, 1,0 экв.), получая после очистки хроматографией на колонках (Hex/EtOAc=3/2) 3-(6-хлор-4-трифторметил-пиридин-3-ил)-N-(5-фтор-4-метансульфониламино-бензил)-акриламид (66 мг, 65,7%).
1H ЯМР (300 МГц, CDCl3): δ 8,69 (c, 1H), 7,89 (м, 1H), 7,57 (д, 1H, J=15,3 Гц), 7,54 (м, 1H), 7,15 (м, 2H), 6,53 (c ушир., 1H), 6,46 (д, 1H, J=15,3 Гц), 6,13 (c ушир., 1H), 4,56 (д, 2H, J=5,7 Гц), 3,03 (c, 3H).
ESI [M+H]+: 452.
Пример 54: отсутствует
Пример 55: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид
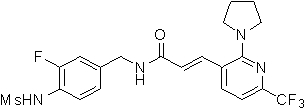
К суспензии 3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламида (40 мг, 0,088 ммоль) в пирролидине (0,4 мл) добавляли DMF (0,5 мл). Смесь перемешивали в течение 12 часов при 110°C. Реакционную смесь разбавляли EtOAc и затем промывали два раза 1 н. HCl и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток хроматографировали на колонке, получая целевое соединение (40 мг, 93%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,95 (c, 1H), 8,72 (т, 1H, J=6,0 Гц), 7,80 (д, 1H, J=7,5 Гц), 7,69 (д, 1H, J=15,3 Гц), 7,34 (т, 1H, J=8,1 Гц), 7,19 (д, 1H, J=11,4 Гц), 7,13-7,08 (м, 2H), 6,43 (д, 1H, J=15,3 Гц), 4,37 (д, 1H, J=6,0 Гц), 3,48-3,41 (м, 4H), 3,00 (c, 3H), 1,88-1,86 (м, 4H).
ESI [M+H]+: 487.
Пример 56: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-гидрокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид
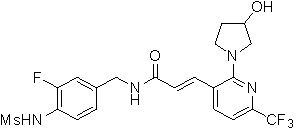
К суспензии 3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламида (40 мг, 0,088 ммоль) в пирролидин-3-оле (0,4 мл) добавляли DMF (0,5 мл). Смесь перемешивали в течение 12 часов при 110°C. Реакционную смесь разбавляли EtOAc и затем промывали два раза 1 н. HCl и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток хроматографировали на колонке, получая целевое соединение (40 мг, 91%).
1H ЯМР (300 МГц, ДМСО-d6): δ 8,72 (т, 1H, J=5,7 Гц), 7,80 (д, 1H, J=7,5 Гц), 7,68 (д, 1H, J=15,3 Гц), 7,34 (т, 1H, J=8,1 Гц), 7,19 (д, 1H, J=11,1 Гц), 7,12-7,08 (м, 2H), 4,98 (д, 1H, J=2,7 Гц), 4,37 (д, 2H, J=6,0 Гц), 4,31 (c, 1H, ушир.), 3,74-3,64 (м, 4H), 3,00 (c, 3H), 1,98-1,84 (м, 2H).
ESI [M+H]+: 503.
Пример 57: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(6-трифторметил-пиридин-3-ил)-акриламид
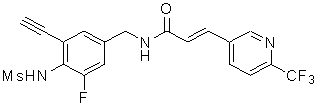
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (137 мг, 0,49 ммоль) вводили в реакцию с 3-(6-трифторметил-пиридин-3-ил)-акриловой кислотой (107 мг, 1,0 экв.), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(6-трифторметил-пиридин-3-ил)-акриламид (105 мг, 48,5%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,44 (c ушир., 1H), 8,97 (c, 1H), 8,84 (м, 1H), 8,28 (м, 1H), 7,96 (м, 1H), 7,60 (д, 1H, J=16,2 Гц), 7,25 (м, 2H), 6,92 (д, 1H, J=15,9 Гц), 4,39 (д, 2H, J=6,0 Гц), 3,33 (c, 1H), 3,02 (c, 3H).
ESI [M+H]+: 442.
Пример 58: N-(3-фтор-4-метансульфониламино-бензил)-3-(6-трифторметил-пиридин-3-ил)-акриламид
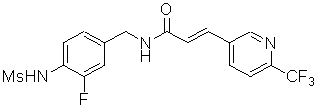
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (59 мг, 0,23 ммоль) вводили в реакцию с 3-(6-хлор-4-трифторметил-пиридин-3-ил)-акриловой кислотой (50 мг, 1,0 экв.), получая после очистки хроматографией на колонках (Hex/EtOAc=4/5) 3-(6-хлор-4-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид (47 мг, 49,0%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,55 (c ушир., 1H), 8,97 (c, 1H), 8,83 (м, 1H), 8,28 (м, 1H), 7,96 (м, 1H), 7,60 (д, 1H, J=15,9 Гц), 7,35 (м, 1H), 7,17 (м, 2H), 6,92 (д, 1H, J=16,2 Гц), 4,41 (д, 2H, J=6,0 Гц), 3,00 (c, 3H).
ESI [M+H]+: 418.
Пример 59: 3-(6-трет-бутил-2-морфолин-4-ил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
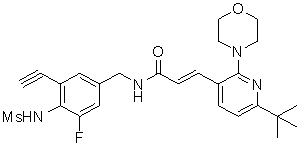
Стадия 1: синтез 3-(6-трет-бутил-2-морфолин-4-ил-пиридин-3-ил)-акриловой кислоты
Метиловый эфир 3-(6-трет-бутил-2-хлор-пиридин-3-ил)-акриловой кислоты (0,281 г, 1,11 ммоль) растворяли в DMF и постадийно добавляли морфолин (0,15 мл), NEt3 (0,31 мл) и реактив палладия (48 мг), и затем реакционную смесь перемешивали при 80°C в течение 18 часов. Полученную смесь экстрагировали EtOAc, и органическую фазу высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=8/1), получая метиловый эфир 3-(6-трет-бутил-2-морфолин-4-ил-пиридин-3-ил)-акриловой кислоты (76 мг, 0,25 ммоль, 22,5%). Метиловый эфир растворяли в 1,4-диоксане, обрабатывали водой и KOH, перемешивали и нагревали с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и затем промывали простым эфиром. Водную фазу подкисляли 1 н. HCl и затем экстрагировали EtOAc, и объединенную органическую фазу промывали солевым раствором, высушивали над безводным MgSO4 и концентрировали при пониженном давлении, получая 3-(6-трет-бутил-2-морфолин-4-ил-пиридин-3-ил)-акриловую кислоту (67 мг, 92%).
1H ЯМР (300 МГц, CDCl3): δ 7,88 (д, 1H, J=15,9 Гц), 7,68 (д, 1H, J=8,1 Гц), 6,97 (д, 1H, J=8,1 Гц), 6,38 (д, 1H, J=15,9 Гц), 3,87 (м, 4H), 3,30 (м, 4H), 1,33 (c, 9H).
Стадия 2: синтез 3-(6-трет-бутил-2-морфолин-4-ил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламида
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (59 мг, 0,23 ммоль) вводили в реакцию с 3-(6-трет-бутил-2-морфолин-4-ил-пиридин-3-ил)-акриловой кислотой (67 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=3/2) 3-(6-трет-бутил-2-морфолин-4-ил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (60 мг, 92%).
1H ЯМР (300 МГц, CDCl3): δ 7,78 (д, 1H, J=15,9 Гц), 7,61 (м, 1H), 7,25 (м, 2H), 6,93 (м, 1H), 6,41 (c ушир., 1H), 6,35 (д, 1H, J=15,9 Гц), 5,91 (c ушир., 1H), 4,53 (д, 2H, J=6,3 Гц), 3,86 (м, 4H), 3,48 (c, 1H), 3,29 (м, 4H), 3,26 (c, 3H), 1,32 (c, 9H).
ESI [M+H]+: 515.
Пример 60: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-метокси-6-трифторметил-пиридин-3-ил)-акриламид
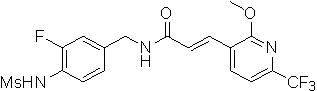
Целевое соединение получали согласно общей процедуре, описанной в примере 42 (стадия 1).
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид (40 мг, 0,088 ммоль) вводили в реакцию с 30%-ым NaOCH3 в CH3OH, получая целевое соединение (39 мг, 98%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,55 (c, 1H), 8,82 (c, 1H, ушир.), 8,17 (д, 1H, J=7,5 Гц), 7,59-7,54 (м, 2H), 7,34 (т, 1H, J=7,8 Гц), 7,19 (д, 1H, J=11,4 Гц), 7,12 (д, 1H, J=7,8 Гц), 6,95 (д, 1H, J=15,9 Гц), 4,39 (д, 2H, J=5,4 Гц), 4,00 (c, 3H), 3,00 (c, 3H).
ESI [M+H]+: 448.
Пример 61: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-гидрокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид
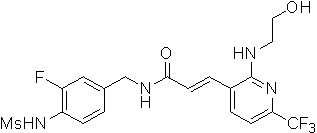
Целевое соединение получали согласно общей процедуре, описанной в примере 56 (стадия 1).
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид (40 мг, 0,088 ммоль) вводили в реакцию с 2-аминоэтанолом (избыток), получая целевое соединение (10 мг, 24%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,55 (c, 1H), 8,72 (c, 1H), 7,78 (д, 1H, J=7,5 Гц), 7,60 (д, 1H, J=15,0 Гц), 7,34 (т, 1H, J=7,5 Гц), 7,19 (д, 1H, J=10,8 Гц), 7,13 (д, 1H, J=8,1 Гц), 7,04 (c, 1H), 6,98 (д, 1H, J=7,2 Гц), 6,63 (д, 1H, J=15,3 Гц), 4,68 (c, 1H), 4,40 (д, 2H, J=4,5 Гц), 3,55-3,54 (м, 2H), 3,42-3,40 (м, 2H), 3,00 (c, 3H).
ESI [M+H]+: 477.
Пример 62: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид
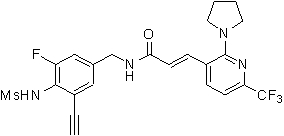
Стадия 1: 3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриловая кислота
К суспензии 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (100 мг, 0,397 ммоль) в пирролидине (1,0 мл) добавляли DMF (1,0 мл). Смесь перемешивали в течение 12 часов при комнатной температуре. Реакционную смесь разбавляли EtOAc и затем промывали два раза 1 н. HCl и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток хроматографировали на колонке, получая 3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриловую кислоту (100 мг, 91%).
1H ЯМР (300 МГц, CDCl3): δ 8,05 (д, 1H, J=15,9 Гц), 7,69 (д, 1H, J=10,8 Гц), 6,97 (д, 1H, J=10,8 Гц), 6,21 (д, 1H, J=15,9 Гц), 3,64-3,60 (м, 4H), 1,96-1,92 (м, 4H).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид
Целевое соединение получали согласно общей процедуре, описанной в примере 38 (стадия 6).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (94 мг, 0,327 ммоль) вводили в реакцию с 3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (78 мг, 0,272 ммоль), получая целевое соединение (110 мг, 80%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,44 (c, 1H), 8,73 (т, 1H, J=9,0 Гц), 7,82 (д, 1H, J=7,5 Гц), 7,69 (д, 1H, J=15,3 Гц), 7,29-7,26 (м, 2H), 7,10 (д, 1H, J=7,8 Гц), 6,43 (д, 1H, J=15,9 Гц), 4,52 (c, 1H), 4,38 (д, 2H, J=5,7 Гц), 3,51-3,47 (м, 4H), 3,07 (c, 3H), 1,88-1,86 (м, 4H).
ESI [M+H]+: 511.
Пример 63: 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
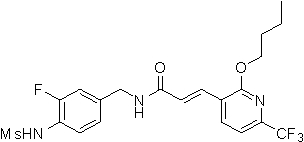
К суспензии 3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламида (40 мг, 0,088 ммоль) в 1-бутаноле (0,5 мл) добавляли K2CO3 (5 экв.). Смесь перемешивали в течение 12 часов при 110°C. Реакционную смесь разбавляли EtOAc и затем промывали два раза 1 н. HCl и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток перекристаллизовывали из смеси CH2Cl2/н-гексан, получая целевое соединение (40 мг, 93%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,54 (c, 1H), 8,83 (т, 1H, J=5,7 Гц), 8,16 (д, 1H, J=7,8 Гц), 7,58 (д, 1H, J=15,9 Гц), 7,52 (д, 1H, J=7,5 Гц), 7,35 (т, 1H, J=8,1 Гц), 7,19 (д, 1H, J=11,4 Гц), 7,12 (д, 1H, J=8,1 Гц), 6,92 (д, 1H, J=15,9 Гц), 4,42-4,38 (м, 4H), 3,00 (c, 3H), 1,83-1,73 (м, 2H), 1,47-1,40 (м, 2H), 0,94 (д, 3H, J=7,5 Гц).
ESI [M+H]+: 490.
Пример 64: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-метил-пиперазин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид
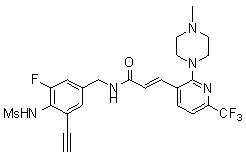
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (70 мг, 0,057 ммоль) вводили в реакцию с N-метилпиперазином (30 мкл), как в примере 46, получая после перекристаллизации из смеси Hex/EtOAc целевое соединение (13 мг, 15%).
1H ЯМР (300 МГц, CDCl3): δ 7,75 (д, 1H, J=7,2 Гц), 7,72 (д, 1H, J=15,3 Гц), 7,29 (c, 1H), 7,18 (м, 2H), 6,44 (д, 1H, J=15,3 Гц), 6,12 (т, 1H), 4,53 (д, 2H, J=6,0 Гц), 3,48 (c, 1H), 3,39 (м, 4H), 3,26 (c, 3H), 2,59 (м, 4H), 2,35 (c, 3H).
ESI [M+H]+: 540.
Пример 65: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид
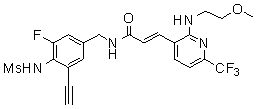
Смесь 3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламида (30 мг, 0,28 ммоль) и 2-метоксиэтиламина (100 мкл) перемешивали при температуре окружающей среды в течение 48 часов. Реакционную смесь разбавляли водой и затем подкисляли 2 н. раствором HCl. Водную фазу экстрагировали EtOAc, и объединенную органическую фазу промывали солевым раствором, высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=2/3), получая целевое соединение (4,0 мг, 12%).
1H ЯМР (300 МГц, CDCl3): δ 7,65 (д, 1H, J=15,6 Гц), 7,59 (д, 1H, J=7,2 Гц), 7,21 (c, 1H), 7,11 (д, 1H, J=10,5 Гц), 6,92 (д, 1H, J=7,2 Гц), 6,33 (д, 1H, J=15,6 Гц), 6,33 (т, 1H), 5,40 (c, 1H), 4,47 (д, 2H, J=5,7 Гц), 3,71 (м, 2H), 3,61 (м, 2H), 3,44 (c, 1H), 3,37 (c, 3H), 3,28 (c, 3H).
ESI [M+H]+: 515.
Пример 66: 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
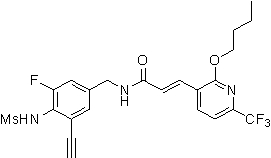
Стадия 1: 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-акриловая кислота
К суспензии 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (40 мг, 0,158 ммоль) и 1-бутанола (0,029 мл, 0,316 ммоль) в DMF (2 мл) при 0°C добавляли NaH (19 мг, 0,47 ммоль). Смесь перемешивали в течение 12 часов при комнатной температуре. Остаток разбавляли EtOAc и водой. Органический слой промывали 1 н. HCl, насыщенным раствором бикарбоната натрия и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток хроматографировали на колонке, получая 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-акриловую кислоту (21 мг, 92%).
1H ЯМР (300 МГц, CDCl3): δ 7,88 (д, 1H, J=16,2 Гц), 7,88 (д, 1H, J=7,8 Гц), 7,28 (д, 1H, J=7,8 Гц), 6,73 (д, 1H, J=16,2 Гц), 4,49 (т, 2H, J=6,6 Гц), 1,86-1,79 (м, 2H), 1,53-1,47 (м, 2H), 1,00 (т, 3H, J=7,5 Гц).
Стадия 2: 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
Целевое соединение получали согласно общей процедуре, описанной в примере 38 (стадия 6).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (25 мг, 0,087 ммоль) вводили в реакцию с 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (21 мг, 0,73 ммоль), получая целевое соединение (24 мг, 54%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,44 (c, 1H), 8,85 (т, 1H, J=6,0 Гц), 8,18 (д, 1H, J=7,5 Гц), 7,58 (д, 1H, J=15,9 Гц), 7,52 (д, 1H, J=7,5 Гц), 7,29-7,25 (м, 2H), 6,93 (д, 1H, J=15,9 Гц), 4,50 (c, 1H), 4,42-4,37 (м, 2H), 3,06 (c, 3H), 1,83-1,73 (м, 2H), 1,50-1,42 (м, 2H), 0,94 (д, 3H, J=7,5 Гц).
ESI [M+H]+: 514.
Пример 67: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриламид
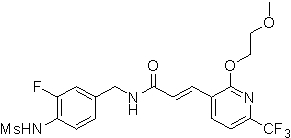
Целевое соединение получали согласно общей процедуре, описанной в примере 63 (стадия 1).
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид (70 мг, 0,155 ммоль) вводили в реакцию с метоксиэтанолом, получая целевое соединение (50 мг, 66%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,54 (c, 1H), 8,82 (т, 1H, J=5,7 Гц), 8,19 (д, 1H, J=7,5 Гц), 7,61-7,53 (м, 2H), 7,34 (т, 1H, J=8,4 Гц), 7,21 (д, 1H, J=11,4 Гц), 7,12 (д, 1H, J=8,4 Гц), 6,92 (д, 1H, J=15,9 Гц), 4,52 (т, 2H, J=4,5 Гц), 4,40 (д, 2H, J=5,7 Гц), 3,74 (т, 2H, J=4,5 Гц), 3,31 (c, 3H), 3,00 (c, 3H).
ESI [M+H]+: 492.
Пример 68: N-(3-этинил-5-фтор-4-метансульфониламинобензил)-3-(2-метил-6-трифторметилпиридин-3-ил)акриламид
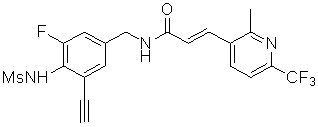
Стадия 1: синтез N-метокси-N-метил-2-метил-6-трифторметил-3-пиридинкарбоксамида
К раствору 2-метил-6-трифторметилникотиновой кислоты (500 мг, 2,44 ммоль) и N,O-диметилгидроксиламингидрохлорида (285 мг, 2,92 ммоль) в дихлорметане (10 мл) добавляли N-метилморфолин (0,32 мл, 2,92 ммоль) и N-(3-диметиламинопропил-N'-этилкарбодиимид гидрохлорид (EDC, 560 мг, 2,92 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов и промывали 1 н. HCl и водой. Органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая N-метокси-N-метил-2-метил-6-трифторметил-3-пиридинкарбоксамид количественно в форме масла. Сырой продукт использовали непосредственно в следующей реакции.
1H ЯМР (300 МГц, CDCl3): δ 7,77 (д, 1Н, J=7,5 Гц), 7,56 (д, 1Н, J=7,8 Гц), 3,44 (c ушир., 3H), 3,39 (c ушир., 1H), 2,63 (c, 3H).
Стадия 2: синтез 2-метил-6-трифторметил-3-пиридинкарбоксальдегида
К охлажденному (-78°C) раствору N-метокси-N-метил-2-метил-6-трифторметил-3-пиридинкарбоксамида (615 мг, 2,48 ммоль) в ТГФ (10 мл) добавляли литий-алюминийгидрид (LAH, 1М/ТГФ, 1,23 мл). Смесь перемешивали в течение 15 минут и затем нагревали до -10°C. После дополнительного перемешивания в течение 30 минут смесь гасили насыщенным раствором гидросульфата калия (1 мл) и экстрагировали простым диэтиловым эфиром. Органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая 2-метил-6-трифторметил-3-пиридинкарбоксальдегид количественно в форме масла. Сырой продукт использовали непосредственно в следующей реакции.
1H ЯМР (300 МГц, CDCl3): δ 10,40 (c, 1H), 8,29 (д, 1Н, J=8,1 Гц), 7,71 (д, 1Н, J=8,1 Гц), 2,61 (c, 3H).
Стадия 3: синтез 3-(2-метил-6-трифторметилпиридин-3-ил)акриловой кислоты
К раствору 2-метил-6-трифторметил-3-пиридинкарбоксальдегида (440 мг, 2,32 ммоль) в толуоле (10 мл) добавляли метил(трифенилфосфоранилиден)ацетат (855 мг, 2,56 ммоль). Смесь нагревали при 110°C в течение ночи, охлаждали до комнатной температуры и разбавляли EtOAc и водой. Органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали хроматографией на колонках (EtOAc/гексаны=1/4), получая метиловый эфир 3-(2-метил-6-трифторметилпиридин-3-ил)акриловой кислоты (376 мг, 65,9%) в форме смеси цис- и транс-изомеров (цис-/транс-=1/10). К раствору сложного эфира (376 мг, 1,53 ммоль) в ТГФ (5 мл) добавляли 1 н. LiOH (2,5 мл). Смесь перемешивали при комнатной температуре в течение 1 часа и концентрировали при пониженном давлении. Остаток разбавляли EtOAc и водой. Водный слой затем отделяли, подкисляли до рН 4 с помощью 3 н. HCl и экстрагировали EtOAc. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Сырой продукт очищали перекристаллизацией из смеси EtOAc/гексаны, получая 3-(2-метил-6-трифторметилпиридин-3-ил)акриловую кислоту (транс-изомер, 200 мг, 56,4%) в форме твердого вещества.
1H ЯМР (300 МГц, CDCl3): δ 8,05~7,97 (м, 2H), 7,58 (д, 1Н, J=8,1 Гц), 6,47 (д, 1Н, J=15,9 Гц), 2,75 (c, 3H).
Стадия 5: синтез N-(3-этинил-5-фтор-4-метансульфониламинобензил)-3-(2-метил-6-трифторметилпиридин-3-ил)акриламида
К суспензии 3-этинил-5-фтор-4-метансульфониламинобензиламингидрохлорида (73 мг, 0,26 ммоль) в ТГФ (5 мл) добавляли N-метилморфолин (43 мкл, 0,39 ммоль). После перемешивания в течение 5 минут добавляли 3-(2-метил-6-трифторметилпиридин-3-ил)акриловую кислоту (60 мг, 0,26 ммоль) и 4-(4,6-диметокси[1,3,5]триазин-2-ил)-4-метилморфолинийхлорид гидрат (DMTMM 73 мг, 0,26 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, концентрировали при пониженном давлении и разбавляли EtOAc и водой. Органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали перекристаллизацией из смеси EtOAc/гексан, получая N-(3-этинил-5-фтор-4-метансульфониламинобензил)-3-(2-метил-6-трифторметилпиридин-3-ил)акриламид (89 мг, 75,5%) в форме твердого вещества.
1H ЯМР (300 МГц, CDCl3 + ДМСО-d6): δ 8,22 (c, 1H), 8,16 (т, 1Н, J=5,7 Гц), 7,94 (д, 1Н, J=8,1 Гц), 7,84 (д, 1Н, J=15,6 Гц), 7,54 (д, 1Н, J=8,1 Гц), 7,33 (c, 1H), 7,19 (дд, 1Н, J=10,5, 1,8 Гц), 6,61 (д, 1Н, J=15,3 Гц), 4,50 (д, 2Н, J=5,7 Гц), 3,18 (c, 3H), 2,72 (c, 3H).
ESI [M+H]+: 456.
Пример 69: N-(3-фтор-4-метансульфониламинобензил)-3-(2-метил-6-трифторметилпиридин-3-ил)акриламид
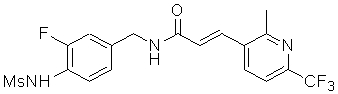
Стадия 1: синтез N-(3-фтор-4-метансульфониламинобензил)-3-(2-метил-6-трифторметилпиридин-3-ил)акриламида
К суспензии 3-фтор-4-метансульфониламинобензиламингидрохлорида (67 мг, 0,26 ммоль) в ТГФ (5 мл) добавляли N-метилморфолин (43 мкл, 0,39 ммоль). После перемешивания в течение 5 минут добавляли 3-(2-метил-6-трифторметилпиридин-3-ил)акриловую кислоту (60 мг, 0,26 ммоль) и 4-(4,6-диметокси[1,3,5]триазин-2-ил)-4-метилморфолинийхлорид гидрат (DMTMM 73 мг, 0,26 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, концентрировали при пониженном давлении и разбавляли EtOAc и водой. Органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали перекристаллизацией из смеси EtOAc/гексан, получая N-(3-фтор-4-метансульфониламинобензил)-3-(2-метил-6-трифторметилпиридин-3-ил)акриламид (66 мг, 58,8%) в форме твердого вещества.
1H ЯМР (300 МГц, CDCl3): δ 7,95~7,88 (м, 2H), 7,56~7,51 (м, 2H), 7,18~7,11 (м, 2H), 6,51 (c ушир., 1H), 6,41 (д, 1Н, J=15,6 Гц), 6,07 (т ушир., 1H), 4,57 (д, 2Н, J=6 Гц), 3,03 (c, 3H), 2,72 (c, 3H.)
ESI [M+H]+: 432.
Пример 70: 3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
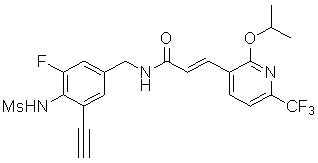
Стадия 1: синтез 3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-акриловой кислоты
60%-ый NaH (24 мг, 3,0 экв.) помещали в колбу и добавляли в шприце 2-пропанол (30 мкл) в DMF (1 мл), перемешивали некоторое время, и наконец добавляли при комнатной температуре 3-(2-хлор-6-трифторметил-4-ил-пиридин-3-ил)-акриловую кислоту (50 мг). Реакционную смесь перемешивали в течение 18 часов. После завершения реакции по результатам проверки TLC смесь разбавляли EtOAc, промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении, получая сырую 3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-акриловую кислоту (23 мг, 42%).
1H ЯМР (300 МГц, CDCl3): δ 7,86 (м, 2H), 7,24 (м, 1H), 6,71 (д, 1H, J=15,9 Гц), 5,49 (м, 1H), 1,43 (м, 6H).
Стадия 2: синтез 3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламида
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (23 мг, 0,084 ммоль) вводили в реакцию с 3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (23 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=3/2) 3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (19 мг, 45%).
1H ЯМР (300 МГц, CDCl3): δ 7,81 (м, 1H), 7,75 (д, 1H, J=15,9 Гц), 7,29 (c, 1H), 7,20 (м, 2H), 6,73 (д, 1H, J=15,9 Гц), 6,44 (c, 1H), 6,12 (c ушир., 1H), 5,48 (м, 1H), 4,53 (д, 2H, J=6,0 Гц), 3,47 (c, 1H), 3,26 (c, 3H), 1,43 (м, 6H).
ESI [M+H]+: 500.
Пример 71: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-бензилоксикарбонил-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид
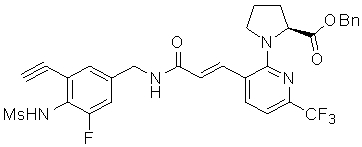
Гидрохлорид бензилового эфира L-пролина (96 мг, 2,0 экв.) в DMF помещали в колбу и добавляли K2CO3 (132 мг, 2,0 экв.), перемешивали некоторое время и добавляли при комнатной температуре 3-(2-хлор-6-трифторметил-4-ил-пиридин-3-ил)-акриловую кислоту (50 мг). Реакционную смесь перемешивали в течение 18 часов. После завершения реакции по результатам проверки TLC смесь разбавляли EtOAc, промывали 1 н. раствором HCl. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении, получая сырой бензиловый эфир 6-трифторметил-пиридин-2-ил}-пирролидин-2-ил-карбоновой кислоты (45 мг). N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (30 мг, 0,11 ммоль) вводили в реакцию с бензиловым эфиром 6-трифторметил-пиридин-2-ил}-пирролидин-2-ил-карбоновой кислоты (45 мг), получая бензиловый эфир 1-{3-[2-(3-этинил-5-фтор-4-метансульфониламино-бензилкарбамоил)-винил]-6-трифторметил-пиридин-2-ил}-пирролидин-2-ил-карбоновой кислоты (3,2 мг, 4,5%) после очистки хроматографией на колонках (EtOAc/MeOH=10/1).
1H ЯМР (300 МГц, CDCl3): δ 7,81 (д, 1H, J=15,6 Гц), 7,67 (м, 1H), 7,29 (c, 1H), 7,19 (м, 5H), 6,92 (м, 1H), 6,86 (c ушир., 1H), 6,40 (м, 2H), 6,09 (д, 1H, J=15,0 Гц), 4,49 (д, 2H, J=5,7 Гц), 4,32 (д, 2H, J=5,7 Гц), 3,48 (c, 1H), 3,26 (c, 3H), 2,38 (м, 2H), 2,25 (м, 2H), 2,02 (м, 3H).
Пример 72: 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
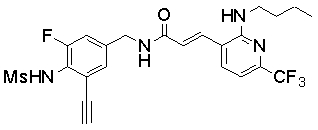
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (30 мг, 0,057 ммоль) вводили в реакцию с н-бутиламином (500 мкл), как в примере 65, получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (3,6 мг, 12%).
1H ЯМР (300 МГц, CDCl3): δ 7,66 (д, 1H, J=15,3 Гц), 7,57 (д, 1H, J=7,8 Гц), 7,23 (c, 1H), 7,12 (дд, 1H, J=1,8 и 10,8 Гц), 6,89 (д, 1H, J=7,8 Гц), 6,64 (c, 1H), 6,35 (д, 1H, J=15,3 Гц), 6,24 (т, 1H), 5,04 (c, 1H), 4,48 (д, 2H, J=6,0 Гц), 3,50 (м, 2H), 3,46 (c, 1H), 3,27 (c, 3H), 1,61 (м, 2H), 1,36 (м, 2H), 0,95 (т, 3H, J=7,2 Гц).
ESI [M+H]+: 513.
Пример 73: 3-(2-циклопентиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
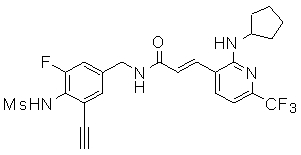
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (30 мг, 0,057 ммоль) вводили в реакцию с циклопентиламином (500 мкл), как в примере 65, получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (2,5 мг, 8%).
1H ЯМР (300 МГц, CDCl3): δ 7,65 (д, 1H, J=15,0 Гц), 7,58 (д, 1H, J=7,5 Гц), 7,29 (c, 1H), 7,17 (дд, 1H, J=2,1 и 10,8 Гц), 6,90 (д, 1H, J=7,5 Гц), 6,46 (c, 1H), 6,35 (д, 1H, J=15,0 Гц), 6,07 (т, 1H), 4,82 (c, 1H), 4,53 (д, 2H, J=6,3 Гц), 4,41 (м, 1H), 3,49 (c, 1H), 3,27 (c, 3H), 2,17 (м, 2H), 1,70-1,30 (м, 6H).
ESI [M+H]+: 525.
Пример 74: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутокси-6-трифторметил-пиридин-3-ил)-акриламид
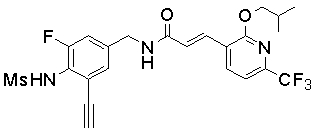
Смесь 3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламида (50 мг, 0,11 ммоль), 2-метил-1-пропанола (20 мкл, 0,22 ммоль) и 60% NaH (13 мг, 0,33 ммоль) в DMF перемешивали при температуре окружающей среды в течение 4 часов. Реакционную смесь разбавляли водой и затем подкисляли 2 н. раствором HCl. Водную фазу экстрагировали EtOAc, и объединенную органическую фазу промывали солевым раствором, высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=1/2), получая целевое соединение (12 мг, 40%).
1H ЯМР (300 МГц, CDCl3): δ 7,97 (д, 1H, J=7,8 Гц), 7,83 (м, 2H), 7,71 (c, 1H), 7,31 (м, 2H), 7,22 (дд, 1H, J=1,8 и 10,5 Гц), 6,94 (д, 1H, J=15,9 Гц), 4,54 (д, 2H, J=6,0 Гц), 4,22 (д, 2H, J=6,6 Гц), 3,64 (c, 1H), 3,18 (c, 3H), 2,18 (м, 1H), 1,04 (д, 6H, J=6,6 Гц).
ESI [M+H]+: 514.
Пример 75: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриламид
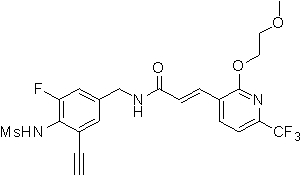
Стадия 1: 3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриловая кислота
Целевое соединение получали согласно общей процедуре, описанной в примере 66 (стадия 1).
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (86,6 мг, 0,344 ммоль) вводили в реакцию с метоксиэтанолом, получая 3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриловую кислоту (100 мг, 99%).
1H ЯМР (300 МГц, CDCl3): δ 7,90 (д, 1H, J=7,5 Гц), 7,88 (д, 1H, J=16,2 Гц), 7,30 (д, 1H, J=7,5 Гц), 4,66-4,63 (м, 2H), 3,86-3,82 (м, 2H), 3,47 (c, 3H).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриламид
Целевое соединение получали согласно общей процедуре, описанной в примере 38 (стадия 6).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (45 мг, 0,156 ммоль) вводили в реакцию с 3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (38 мг, 0,13 ммоль), получая целевое соединение (47 мг, 70%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,44 (c, 1H), 8,85 (т, 1H, J=6,0 Гц), 8,20 (д, 1H, J=7,5 Гц), 7,58 (д, 1H, J=16,8 Гц), 7,54 (д, 1H, J=8,1 Гц), 7,29-7,26 (м, 2H), 6,93 (д, 1H, J=15,9 Гц), 4,54-4,51 (м, 2H), 4,40 (д, 2H, J=6,0 Гц), 3,97 (c, 1H), 3,76-3,73 (м, 2H), 3,31 (c, 3H), 3,07 (c, 3H).
ESI [M+H]+: 516.
Пример 76: 3-(2-бутил-5-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
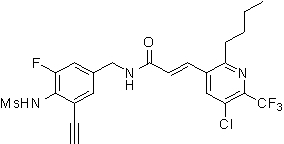
Стадия 1: 3-(2-бутил-5-хлор-6-трифторметил-пиридин-3-ил)-акриловая кислота
К суспензии 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (78 мг, 0,31 ммоль) в ТГФ (2 мл) добавляли по каплям при -78°C 2,5 M н-бутиллития (2 экв.). Смесь перемешивали в течение 12 часов при комнатной температуре. Остаток разбавляли EtOAc и водой. Органический слой промывали 1 н. HCl, насыщенным бикарбонатом натрия и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток хроматографировали на колонке, получая 3-(2-бутил-5-хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (14 мг, 17%).
1H ЯМР (300 МГц, CDCl3): δ 7,83 (д, 1H, J=16,5 Гц), 7,51 (c, 1H), 6,35 (д, 1H, J=16,5 Гц), 2,79-2,66 (м, 2H), 1,66-1,50 (м, 2H), 1,50-1,44 (м, 2H), 0,98 (т, 3H, J=7,5 Гц).
Стадия 2: 3-(2-бутил-5-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
Целевое соединение получали согласно общей процедуре, описанной в примере 38 (стадия 6).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (13 мг, 0,044 ммоль) вводили в реакцию с 3-(2-бутил-5-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислотой (14 мг, 0,036 ммоль), получая целевое соединение (18 мг, 86%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,45 (c, 1H), 8,92 (т, 1H, J=6,0 Гц), 7,92 (c, 1H), 7,50 (д, 1H, J=15,6 Гц), 7,30-7,29 (м, 2H), 6,55 (д, 1H, J=15,9 Гц), 4,52 (c, 1H), 4,41 (д, 2H, J=5,7 Гц), 3,02 (c, 3H), 2,80-2,75 (м, 2H), 1,59-1,49 (м, 2H), 0,88 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 532.
Пример 77: 3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
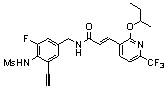
Стадия 1: 3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-акриловая кислота
2-Бутанол (70,1 мг, 0,945 ммоль) и гидрид натрия (70 мг, 1,8 ммоль) добавляли к DMF. Реакционную смесь перемешивали в течение 10 минут и затем в реакционную смесь добавляли 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (67 мг, 0,266 ммоль). Реакционную смесь разбавляли EtOAc и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=1/1), получая целевой продукт (52 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,89 (д, 1H, J=7,2), 7,86 (д, 1H, J=3,6 Гц), 7,25 (д, 1H, J=7,8 Гц), 6,72 (д, 1H, J=16,2 Гц), 5,35 (час, 1H, J=6,0 Гц), 1,79 (м, 2H), 1,26 (м, 3H), 1,02 (м, 3H).
Стадия 2: 3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
N-(4-Аминометил-2-этенил-6-фтор-фенил)-метансульфонамид, соль HCl (35 мг, 0,13 ммоль) вводили в реакцию с 3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (22 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (10 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,82 (д, 1H, J=7,8 Гц), 7,75 (д, 1H, J=15,6 Гц), 7,27 (д, 1H, J=15,9 Гц), 7,21 (м, 3H), 6,73 (д, 1H, J=15,6 Гц), 6,44 (c, 1H), 6,11 (т, 1H), 5,33 (час, 1H, J=6,3 Гц), 4,53 (д, 2H, J=6,3 Гц), 3,48 (c, 1H), 3,26 (c, 3H), 1,37 (д, 3H, J=6,0 Гц), 0,98 (т, 3H, J=7,2 Гц).
ESI [M+H]+: 514.
Пример 78: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид
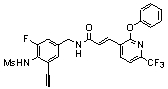
Стадия 1: 3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриловая кислота
Фенол (57 мг, 0,60 ммоль) и гидрид натрия (32 мг, 0,8 ммоль) добавляли к DMF (15 мл). Реакционную смесь перемешивали в течение 10 минут и затем в реакционную смесь добавляли 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (70 мг, 0,27 ммоль). Реакционную смесь разбавляли EtOAc и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=1/1), получая целевой продукт (15 мг).
1H ЯМР (300 МГц, CDCl3): δ 8,07 (д, 1H, J=15,9 Гц), 8,04 (д, 1H, J=7,5 Гц), 7,43 (м, 3H), 7,21 (м, 2H), 6,79 (д, 1H, J=15,9 Гц).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид
N-(4-Аминометил-2-этенил-6-фтор-фенил)-метансульфонамид, соль HCl (35 мг, 0,13 ммоль) вводили в реакцию с 3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (17 мг), получая целевое соединение (22 мг, 75%) после очистки хроматографией на колонках (Hex/EtOAc=1/1).
1H ЯМР (300 МГц, CDCl3): δ 7,90 (д, 1H, J=7,5 Гц), 7,80 (д, 1H, J=15,6 Гц), 7,33 (м, 3H), 7,21 (м, 2H), 7,03 (м, 2H), 6,80 (д, 1H, J=15,6 Гц), 6,45 (c, 1H), 6,37 (т, 1H), 4,43 (д, 2H, J=6,0 Гц), 3,32 (c, 1H), 3,22 (c, 3H).
ESI [M+H]+: 534.
Пример 79: 3-[2-(тетрагидро-фуран-3-илокси)-6-трифторметил-пиридин-3-ил]-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
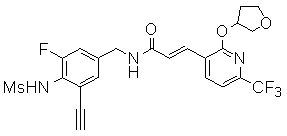
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (50 мг, 0,11 ммоль) и 3-гидрокситетрагидрофуран (18 мкл, 0,22 ммоль) вводили в реакцию, как в примере 72, получая целевое соединение (23 мг, 21%).
1H ЯМР (300 МГц, CDCl3): δ 7,85 (д, 1H, J=7,8 Гц), 7,71 (д, 1H, J=15,9 Гц), 7,30 (д, 1H, J=7,8 Гц), 7,29 (c, 1H), 7,18 (дд, 1H, J=2,1 и 10,8 Гц), 6,77 (д, 1H, J=15,9 Гц), 6,51 (c, 1H), 6,41 (т, 1H), 5,74 (м, 1H), 4,52 (д, 2H, J=6,0 Гц), 4,05 (м, 3H), 3,91 (м, 1H), 3,46 (c, 1H), 3,25 (c, 3H), 2,35 (м, 1H), 2,30 (м, 1H).
ESI [M+H]+: 528.
Пример 80: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-пиразол-1-ил-6-трифторметил-пиридин-3-ил]-акриламид
Стадия 1: 3-(5-хлор-2-пиразол-1-ил-6-трифторметил-пиридин-3-ил)-акриловая кислота
Целевое соединение получали согласно общей процедуре, описанной в примере 66 (стадия 1).
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (100 мг, 0,397 ммоль) вводили в реакцию с пиразолом, получая 3-(5-хлор-2-пиразол-1-ил-6-трифторметил-пиридин-3-ил)-акриловую кислоту (100 мг, 99%).
1H ЯМР (300 МГц, CDCl3): δ 8,59 (д, 1H, J=15,9 Гц), 8,53 (д, 1H, J=2,7 Гц), 8,16 (д, 1H, J=8,1 Гц), 7,84 (д, 1H, J=0,6 Гц), 7,64 (д, 1H, J=8,1 Гц), 5,52 (д, 1H, J=2,7 Гц), 6,42 (д, 1H, J=15,9 Гц).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриламид
Целевое соединение получали согласно общей процедуре, описанной в примере 38 (стадия 6).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (8,5 мг, 0,029 ммоль) вводили в реакцию с 3-(5-хлор-2-пиразол-1-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (7 мг, 0,025 ммоль), получая целевое соединение (9 мг, 70%).
1H ЯМР (300 МГц, CDCl3): δ 8,47 (д, 1H, J=2,7 Гц), 8,32 (д, 1H, J=15,9 Гц), 8,11 (д, 1H, J=7,8 Гц), 7,80 (д, 1H, J=0,6 Гц), 7,60 (д, 1H, J=7,8 Гц), 7,23 (c, 1H), 7,15-7,11 (м, 1H), 6,59-6,49 (м, 3H), 6,38 (д, 1H, J=15,9 Гц), 4,46 (д, 2H, J=6,0 Гц), 3,44 (c, 1H), 3,24 (c, 3H).
ESI [M+H]+: 534.
Пример 81: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(пиридин-3-илокси)-6-трифторметил-пиридин-3-ил]-акриламид
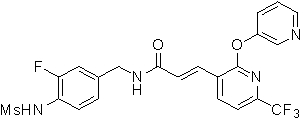
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид (48 мг, 0,11 ммоль), 3-гидроксипиридин (97 мг) и карбонат калия (421 мг) добавляли в 40 мл DMF. Реакционную смесь перемешивали в течение ночи. Реакционную смесь экстрагировали этилацетатом (30 мл × 2) и водой (30 мл). Объединенный органический слой промывали H2O (30 мл × 4) и солевым раствором (40 мл), высушивали MgSO4 и затем концентрировали в вакууме. Остаток очищали хроматографией на колонках (гексан/этилацетат=1/4), получая целевое соединение (46 мг, 82%).
1H ЯМР (300 МГц, ацетон d6): δ 8,53 (д, 1H, J=2,4 Гц), 8,45 (дд, 1H, J=4,5, 1,2 Гц), 8,31 (д, 1H, J=7,8 Гц), 8,00 (т ушир., 1H), 7,83 (д, 1H, J=15,9 Гц), 7,71 (м, 1H), 7,60 (д, 1H, J=7,8 Гц), 7,44 (м, 1H), 7,20 (м, 1H), 7,12 (д, 1H, J=15,9 Гц), 4,50 (д, 2H, J=6,0 Гц), 2,98 (c, 3H).
Пример 82: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-фторфенокси)-6-трифторметил-пиридин-3-ил]-акриламид
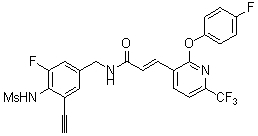
Стадия 1: 3-[2-(4-фторфенокси)-6-трифторметил-пиридин-3-ил]-акриловая кислота
4-Фторфенол (116 мг, 1,03 ммоль) и гидрид натрия (53 мг, 1,3 ммоль) добавляли в DMF (7 мл). Реакционную смесь перемешивали в течение 10 минут, и затем в реакционную смесь добавляли 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (132 мг, 0,52 ммоль). Реакционную смесь разбавляли EtOAc и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=1/1), получая целевой продукт (57 мг).
1H ЯМР (300 МГц, CDCl3): δ 8,00 (д, 1H, J=15,9 Гц), 7,99 (д, 1H, J=7,8 Гц), 7,36 (д, 1H, J=7,8 Гц), 7,08 (м, 3H), 6,73 (д, 1H, J=15,9 Гц).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-фторфенокси)-6-трифторметил-пиридин-3-ил]-акриламид
N-(4-Аминометил-2-этенил-6-фтор-фенил)-метансульфонамид, соль HCl (32 мг, 0,13 ммоль) вводили в реакцию с 3-[2-(4-фторфенокси)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (25 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (42 мг, 67%).
1H ЯМР (300 МГц, CDCl3): δ 7,90 (д, 1H, J=7,8 Гц), 7,79 (д, 1H, J=15,6 Гц), 7,30 (д, 1H, J=7,5 Гц), 7,19 (c, 1H), 7,03 (м, 4H), 6,79 (д, 1H, J=15,6 Гц), 6,64 (т ушир, 1H), 6,57 (c, 1H), 4,41 (д, 2H, J=6,0 Гц), 3,37 (c, 1H), 3,16 (c, 3H).
Пример 83: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-гидроксиметил-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид
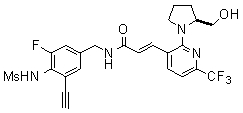
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (17 мг, 0,06 ммоль) вводили в реакцию с 2-(2-гидроксиметил-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил)-акриловой кислотой (19 мг, 0,06 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (15 мг, 46%).
1H ЯМР (300 МГц, CDCl3): δ 7,88 (д, 1H, J=15,6 Гц), 7,68 (м, 1H), 7,30 (c, 1H), 7,18 (м, 1H), 7,03 (м, 1H), 6,44 (c, 1H), 6,20 (д, 1H, J=15,0 Гц), 6,05 (c ушир., 1H), 4,52 (д, 1H, J=6,3 Гц), 3,79 (м, 6H), 3,41 (м, 3H), 3,27 (c, 3H).
Пример 84: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2,2,2-трифтор-этокси)-6-трифторметил-пиридин-3-ил]-акриламид
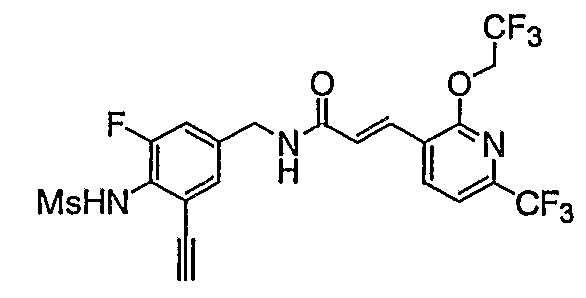
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (69 мг, 0,25 ммоль) вводили в реакцию с 2-(2,2,2-трифтор-этокси)-6-трифторметил-пиридин-3-ил-акриловой кислотой (78 мг, 0,26 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) целевое соединение (73 мг, 54%).
1H ЯМР (300 МГц, CDCl3): δ 7,92 (д, 1H, J=7,5 Гц), 7,73 (д, 1H, J=16,8 Гц), 7,42 (д, 1H, J=7,8 Гц), 7,20 (м, 2H), 6,77 (д, 1H, J=15,6 Гц), 6,41 (c, 1H), 6,03 (c ушир., 1H), 4,90 (д, 2H, J=8,1 Гц), 4,55 (д, 2H, J=5,7 Гц), 3,89 (c, 1H), 3,26 (c, 3H).
Пример 85: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-пирролидин-1-ил)-4-трифторметил-фенил]-акриламид
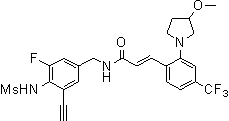
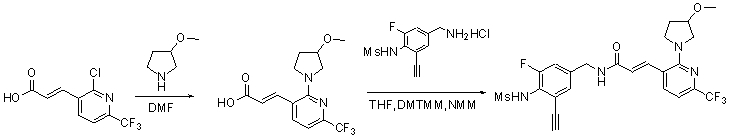
Стадия 1: синтез 3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты.
К суспензии 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (50 мг, 0,198 ммоль) в 3-метоксипирролидине (40 мг, 0,396 ммоль) добавляли DMF (1,0 мл). Смесь перемешивали в течение 12 часов при комнатной температуре. Реакционную смесь разбавляли EtOAc и затем промывали два раза 1 н. HCl и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток хроматографировали, получая 3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриловую кислоту (59 мг, 98%).
1H ЯМР (300 МГц, CDCl3): δ 8,06 (д, 1H, J=15,9 Гц), 7,71 (д, 1H, J=7,5 Гц), 7,01 (д, 1H, J=7,50 Гц), 6,23 (д, 1H, J=15,9 Гц), 4,05 (т, 1H, J=2,1 Гц), 3,89-3,58 (м, 2H), 3,69-3,58 (м, 2H), 3,37 (c, 3H), 2,18-2,11 (м, 1H), 2,05-1,94 (м, 1H).
Стадия 2: синтез N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-пирролидин-1-ил)-4-трифторметил-фенил]-акриламида
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (16,6 мг, 0,057 ммоль) вводили в реакцию с 3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (15,2 мг, 0,048 ммоль), получая после очистки перекристаллизацией из смеси н-гексан/EtOAc N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид (18 мг, 58%).
1H ЯМР (300 МГц, ДМСО): δ 9,45 (c, 1H, ушир.), 8,75 (т, 1H, J=6,0 Гц), 7,83 (д, 1H, J=7,8 Гц), 7,67 (д, 1H, J=15,6 Гц), 7,28 (c, 1H), 7,27 (д, 1H, J=7,8 Гц), 7,13 (д, 1H, J=7,8 Гц), 6,45 (д, 1H, J=15,6 Гц), 4,50 (c, 1H), 4,38 (д, 2H, J=5,7 Гц), 4,00 (д, 1H, J=1,8 Гц), 3,71-3,12 (м, 7H), 3,06 (c, 3H), 2,00-1,92 (м, 2H).
Пример 86: 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-пропионамид.
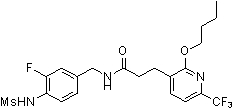
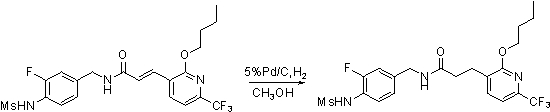
К суспензии 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламида (19,3 мг, 0,039 ммоль) в 5%-ом Pd/C (6 мг) добавляли CH3OH (1,0 мл). Смесь продували три раза газообразным водородом (50 psi) и взбалтывали в течение 40 минут при комнатной температуре. Реакционную смесь фильтровали через слой целита и концентрировали при пониженном давлении. Сырой остаток хроматографировали, получая 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-пропионамид (19 мг, 98%).
1H ЯМР (300 МГц, ДМСО): δ 9,49 (c, 1H, ушир), 8,43 (c, 1H), 7,71 (д, 1H, J=7,5 Гц), 7,35 (д, 1H, J=7,2 Гц), 7,28 (т, 1H, J=8,1 Гц), 6,70 (д, 1H, J=8,4 Гц), 6,96 (д, 1H, J=9,0 Гц), 4,31 (т, 2H, J=3,3 Гц), 4,21 (д, 2H, J=5,7 Гц), 2,87 (c, 3H), 2,85 (т, 2H, J=8,2 Гц), 2,51-2,47 (м, 2H), 1,77-1,68 (м, 2H), 1,50-1,37 (м, 2H), 0,93 (т, 3H, J=7,5 Гц).
Пример 87: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2,2,2-трифтор-этокси)-6-трифторметил-пиридин-3-ил]-акриламид
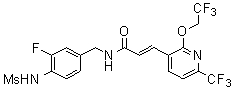
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (41 мг, 0,16 ммоль) вводили в реакцию с 2-(2,2,2-трифтор-этокси)-6-трифторметил-пиридин-3-ил-акриловой кислотой (50 мг, 0,16 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) целевое соединение (53 мг, 64%).
1H ЯМР (300 МГц, CDCl3): δ 7,92 (д, 1H, J=8,1 Гц), 7,73 (д, 1H, J=15,3 Гц), 7,55 (т, 1H, J=8,7 Гц), 7,42 (д, 1H, J=7,42 Гц), 7,15 (м, 2H), 6,78 (д, 1H, J=16,2 Гц), 6,50 (c ушир., 1H), 6,03 (c ушир., 1H), 4,90 (кв, 2H, J=7,8 Гц), 4,57 (д, 2H, J=5,7 Гц), 3,03 (c, 3H).
Пример 88: 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
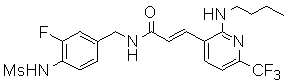
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (53 мг, 0,19 ммоль) вводили в реакцию с 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (10 мг, 0,036 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (12 мг, 69%).
1H ЯМР (300 МГц, CDCl3): δ 7,68 (д, 1H, J=15,0 Гц), 7,57 (д, 1H, J=7,5 Гц), 7,48 (т, 1H, J=8,4 Гц), 7,10 (м, 2H), 6,89 (д, 1H, J=7,5 Гц), 6,80 (c, 1H), 6,37 (д, 1H, J=15,0 Гц), 6,12 (т, 1H, J=6,0 Гц), 6,95 (т, 1H, J=5,4 Гц), 4,54 (д, 2H, J=6,0 Гц), 3,50 (м, 2H), 3,03 (c, 3H), 1,61 (м, 2H), 1,40 (м, 2H), 0,95 (т, 3H, J=7,5 Гц).
Пример 89: 3-(2-циклопентиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
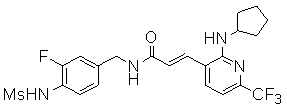
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (53 мг, 0,19 ммоль) вводили в реакцию с 3-(2-циклопентиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (10 мг, 0,034 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (6,3 мг, 38%).
1H ЯМР (300 МГц, CDCl3): δ 7,65 (д, 1H, J=15,3 Гц), 7,56 (м, 2H), 7,13 (м, 2H), 6,89 (д, 1H, J=7,8 Гц), 6,60 (c, 1H), 6,35 (д, 1H, J=15,3 Гц), 6,03 (т, 1H), 4,82 (д, 1H, J=6,3 Гц), 4,56 (д, 2H, J=6,0 Гц), 4,40 (м, 1H), 3,03 (c, 3H), 2,14 (м, 2H), 1,67 (м, 4H), 1,44 (м, 2H).
Пример 90: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид
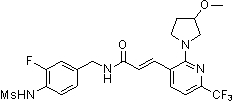
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (14,5 мг, 0,057 ммоль) вводили в реакцию с 3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (15 мг, 0,047 ммоль), получая после очистки перекристаллизацией из смеси н-гексан/CH2Cl2 N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид (22 мг, 76%).
1H ЯМР (300 МГц, ДМСО): δ 9,55 (c, 1H, ушир.), 8,71 (т, 1H, J=5,7 Гц), 7,81 (д, 1H, J=7,5 Гц), 7,67 (д, 1H, J=15,3 Гц), 7,34 (т, 1H, J=8,4 Гц), 7,21-7,10 (м, 2H), 6,44 (д, 1H, J=15,6 Гц), 4,38 (д, 1H, J=6,0 Гц), 4,01 (c, 1H), 3,71-3,16 (м, 7H), 2,99 (c, 3H), 2,00-1,93 (м, 2H).
Пример 91: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-пропионамид
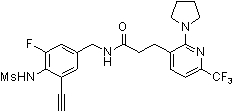
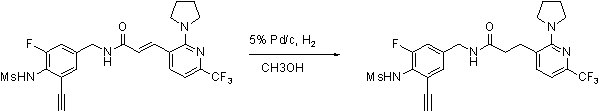
К суспензии N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламида (15 мг, 0,029 ммоль) в 5%-ом Pd/C (5 мг) добавляли CH3OH (1,0 мл). Смесь продували три раза газообразным водородом (50 psi) и затем взбалтывали в течение 40 минут при комнатной температуре. Реакционную смесь фильтровали через слой целита и концентрировали при пониженном давлении. Сырой остаток хроматографировали, получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-пропионамид (15 мг, 98%).
1H ЯМР (300 МГц, CDCl3): δ 7,33 (д, 1H, J=7,2 Гц), 7,12 (c, 1H), 6,96 (дд, 1H, J=10,5, 1,8 Гц), 6,89 (д, 1H, J=7,8 Гц), 6,39 (c, 1H), 5,78 (c, 1H, ушир.), 4,27 (д, 2H, J=6,0 Гц), 3,89 (c, 1H), 3,50-3,42 (м, 4H), 3,20 (c, 3H), 3,05 (т, 2H, J=7,5 Гц), 2,41 (т, 2H, J=7,5 Гц), 1,91-1,86 (м, 4H).
Пример 92: 3-(2-циклопентокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (41 мг, 0,15 ммоль) вводили в реакцию с 3-(2-циклопентокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (40 мг, 0,13 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (50 мг, 73%).
1H ЯМР (300 МГц, CDCl3): δ 7,80 (д, 1H, J=7,5 Гц), 7,74 (д, 1H, J=15,9 Гц), 7,22 (м, 3H), 6,72 (д, 1H, J=15,9 Гц), 6,41 (c, 1H), 6,02 (т, 1H), 5,58 (м, 1H), 4,54 (д, 2H, J=6,0 Гц), 3,48 (c, 1H), 3,26 (c, 3H), 1,82 (м, 8H).
Пример 93: 3-(2-циклопропилметокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (41 мг, 0,15 ммоль) вводили в реакцию с 3-(2-циклопропилметокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (10 мг, 0,036 ммоль), получая после кристаллизации из смеси EtOAc/Hex целевое соединение (48 мг, 72%).
1H ЯМР (300 МГц, CDCl3): δ 7,81 (м, 2H), 7,26 (м, 3H), 6,80 (д, 1H, J=15,6 Гц), 6,40 (c, 1H), 6,00 (т, 1H), 4,55 (д, 2H, J=6,3 Гц), 4,31 (д, 2H, J=7,5 Гц), 3,48 (c, 1H), 3,27 (c, 3H), 1,39 (м, 1H), 0,63 (м, 2H), 0,40 (м, 2H).
Пример 94: 3-(2-диметиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (33 мг, 0,12 ммоль) вводили в реакцию с 3-(2-диметиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (26 мг, 0,10 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (42 мг, 87%).
1H ЯМР (300 МГц, CDCl3): δ 7,77 (д, 1H, J=15,6 Гц), 7,70 (д, 1H, J=7,8 Гц), 7,30 (c, 1H), 7,18 (д, 1H, J=10,8 Гц), 7,10 (д, 1H, J=7,8 Гц), 6,41 (c, 1H), 6,35 (д, 1H, J=15,6 Гц), 5,96 (т, 1H), 4,54 (д, 2H, J=6,0 Гц), 3,46 (c, 1H), 3,27 (c, 3H), 3,01 (c, 6H).
Пример 95: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(4-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид
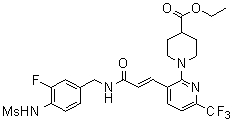
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (60 мг, 0,24 ммоль) вводили в реакцию с 3-[2-(4-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (50 мг, 0,16 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (34 мг, 25%).
1H ЯМР (300 МГц, CDCl3): δ 7,74 (д, 1H, J=7,8 Гц), 7,69 (д, 1H, J=15,6 Гц), 7,54 (м, 1H), 7,18 (м, 2H), 6,51 (c, 1H), 6,47 (д, 1H, J=15,9 Гц), 6,04 (c ушир., 1H), 4,57 (д, 2H, J=6,0 Гц), 4,16 (д, 2H, J=7,2 Гц), 3,72 (м, 2H), 3,03 (c, 3H), 2,99 (м, 2H), 2,50 (м, 1H), 1,96 (м, 4H), 1,28 (т, 3H, J=7,2 Гц).
Пример 96: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-бензилокси 6-трифторметил-пиридин-3-ил)-акриламид
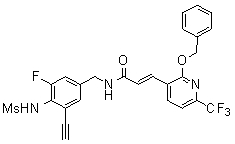
N-(5-Этинил-4-аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (58 мг, 0,21 ммоль) вводили в реакцию с 3-(2-бензилокси 6-трифторметил-пиридин-3-ил)-акриловой кислотой (87 мг, 0,21 ммоль), получая целевое соединение (75 мг, 66%) после очистки хроматографией на колонках (Hex/EtOAc=2/3).
1H ЯМР (300 МГц, CDCl3): δ 7,83 (м, 1H), 7,75 (д, 1H, J=15,9 Гц), 7,49 (м, 2H), 7,35 (м, 5H), 7,15 (м, 1H), 6,74 (д, 1H, J=15,6 Гц), 6,39 (c, 1H), 5,93 (c ушир., 1H), 5,54 (c, 2H), 4,51 (д, 2H, J=6,3 Гц), 3,48 (c, 1H), 3,26 (c, 3H).
Пример 97: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид
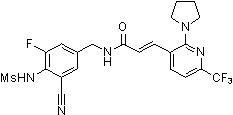
N-(4-Аминометил-2-циано-6-фтор-фенил)-метансульфонамид, соль HCl (33 мг, 0,118 ммоль) вводили в реакцию с 3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (33 мг, 0,118 ммоль), получая после очистки перекристаллизацией из Et2O N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид (33 мг, 55%).
1H ЯМР (300 МГц, ДМСО): δ 10,07 (c, 1H, ушир.), 8,77 (т, 1H, J=6,0 Гц), 7,82 (д, 1H, J=7,8 Гц), 7,70 (д, 1H, J=15,6 Гц), 7,76-7,60 (м, 2H), 7,10 (д, 1H, J=7,8 Гц), 6,43 (д, 1H, J=15,6 Гц), 4,44 (д, 1H, J=6,0 Гц), 3,51-3,34 (м, 4H), 3,11 (c, 3H), 1,88-1,84 (м, 4H).
Пример 98: 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид
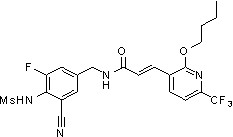
N-(4-Аминометил-2-циано-6-фтор-фенил)-метансульфонамид, соль HCl (33 мг, 0,118 ммоль) вводили в реакцию с 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (34 мг, 0,118 ммоль), получая после очистки перекристаллизацией из Et2O 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид (32 мг, 53%).
1H ЯМР (300 МГц, ДМСО): δ 10,07 (c, 1H, ушир.), 8,90 (т, 1H, J=6,0 Гц), 8,18 (д, 1H, J=7,5 Гц), 7,76-7,51 (м, 4H), 6,93 (д, 1H, J=15,9 Гц), 4,45 (д, 2H, J=5,4 Гц), 4,40 (т, 2H, J=6,3 Гц), 3,10 (c, 3H), 1,83-1,73 (м, 2H), 1,47-1,40 (м, 2H), 0,94 (т, 3H, J=7,5 Гц).
Пример 99: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриламид
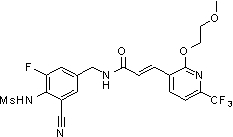
N-(4-Аминометил-2-циано-6-фтор-фенил)-метансульфонамид, соль HCl (33 мг, 0,118 ммоль) вводили в реакцию с 3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (34 мг, 0,118 ммоль), получая после очистки перекристаллизацией из Et2O N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриламид (38 мг, 62%).
1H ЯМР (300 МГц, ДМСО): δ 10,08 (c, 1H, ушир.), 8,89 (т, 1H, J=5,4 Гц), 8,20 (д, 1H, J=7,5 Гц), 7,64-7,53 (м, 3H), 6,93 (д, 1H, J=15,9 Гц), 4,54-4,44 (м, 4H), 3,74 (т, 2H, J=4,5 Гц), 3,31 (c, 3H), 3,09 (м, 4H).
Пример 100: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид
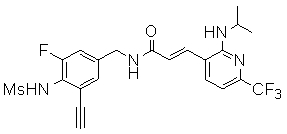
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (58 мг, 0,21 ммоль) вводили в реакцию с 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (48 мг, 0,18 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=3/5) целевое соединение (40 мг, 45%).
1H ЯМР (300 МГц, ДМСО-d6 + CDCl3): δ 8,40 (c ушир., 1H), 8,20 (т, 1H, J=5,7 Гц), 7,59 (м, 2H), 7,32 (c, 1H), 7,19 (дд, 1H, J=2,1 и 10,5 Гц), 6,88 (д, 1H, J=7,8 Гц), 6,53 (д, 1H, J=15,3 Гц), 5,01 (д, 1H, J=7,2 Гц), 4,48 (д, 2H, J=6,0 Гц), 4,33 (м, 1H), 3,48 (c, 1H), 3,17 (c, 3H), 1,25 (д, 6H, J=6,3 Гц).
ESI [M+H]+: 499.
Пример 101: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид
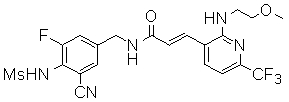
N-(4-Аминометил-5-циано-2-фтор-фенил)-метансульфонамид, соль HCl (168 мг, 0,60 ммоль) вводили в реакцию с 3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (145 мг, 0,50 ммоль), получая после кристаллизации из смеси MeOH/EtOAc/Hex целевое соединение (189 мг, 73%).
1H ЯМР (300 МГц, ДМСО-d6 + CDCl3): δ 9,90 (c ушир., 1H), 8,63 (т, 1H, J=6,0 Гц), 7,64 (д, 1H, J=7,8 Гц), 7,58 (д, 1H, J=15,3 Гц), 7,45 (c, 1H), 7,43 (дд, 1H, J=1,8 и 10,2 Гц), 6,83 (д, 1H, J=7,8 Гц), 6,24 (т, 1H, J=5,1 Гц), 6,52 (д, 1H, J=15,3 Гц), 4,42 (д, 2H, J=6,0 Гц), 3,52 (м, 4H), 3,27 (c, 3H), 3,04 (c, 3H).
Пример 102: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-диметиламино-6-трифторметил-пиридин-3-ил)-акриламид
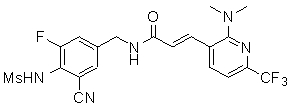
N-(4-Аминометил-6-циано-2-фтор-фенил)-метансульфонамид, соль HCl (130 мг, 0,46 ммоль) вводили в реакцию со смесью (120 мг) 3-(2-диметиламино-6-трифторметил-пиридин-3-ил)-акриловой кислоты и 3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриловой кислоты, получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) с последующей перекристаллизацией из смеси EtOAc/гексан N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-диметиламино-6-трифторметил-пиридин-3-ил)-акриламид (59 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,78 (д, 1Н, J=15 Гц), 7,71 (д, 1Н, J=7,2 Гц), 7,49~7,42 (м, 2H), 7,11 (д, 1H, J=7,8 Гц), 6,39~6,34 (м, 2H), 6,05 (м, 1H), 4,59 (д, 2Н, J=6,3 Гц), 3,33 (c, 3H), 3,02 (c, 6H).
Пример 103: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид
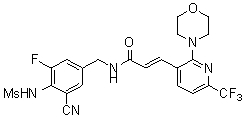
N-(4-Аминометил-6-циано-2-фтор-фенил)-метансульфонамид, соль HCl (130 мг, 0,46 ммоль) вводили в реакцию со смесью (120 мг) 3-(2-диметиламино-6-трифторметил-пиридин-3-ил)-акриловой кислоты и 3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриловой кислоты, получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) с последующей перекристаллизацией из смеси EtOAc/гексан N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид (7 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,81 (д, 1Н, J=7,5 Гц), 7,72 (д, 1Н, J=15,6 Гц), 7,42~7,38 (м, 2H), 7,23 (д, 1Н, J=7,8 Гц), 6,75 (т, 1Н, J=6 Гц), 6,55 (д, 1Н, J=15,3 Гц), 4,56 (д, 2Н, J=6 Гц), 3,85~3,82 (м, 4H), 3,35~3,32 (м, 4H), 3,23 (c, 3H).
Пример 104: 3-[2-(тетрагидро-фуран-3-илокси)-6-трифторметил-пиридин-3-ил]-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
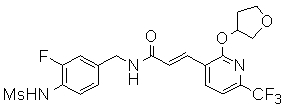
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (76 мг, 0,30 ммоль) вводили в реакцию с 3-[2-(тетрагидро-фуран-3-илокси)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (60 мг, 0,20 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (70 мг, 70%).
1H ЯМР (300 МГц, CDCl3): δ 7,84 (д, 1H, J=7,8 Гц), 7,71 (д, 1H, J=15,9 Гц), 7,51 (т, 1H, J=8,4 Гц), 7,30 (д, 1H, J=7,8 Гц), 7,13 (м, 2H), 6,79 (д, 1H, J=15,9 Гц), 6,73 (c, 1H), 6,46 (т, 1H, J=6,0 Гц), 5,76 (м, 1H), 4,54 (д, 2H, J=6,0 Гц), 4,05 (м, 2H), 3,91 (м, 2H), 3,02 (c, 3H), 2,35 (м, 1H), 2,20 (м, 1H).
Пример 105: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид
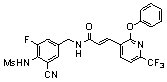
N-(4-Аминометил-2-фтор-6-циано-фенил)-метансульфонамид, соль HCl (48,5 мг, 0,173 ммоль) вводили в реакцию с NMM (0,07 мл), DMTMM (55 мг) и 3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (50 мг, 0,16 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (66 мг, 76%).
1H ЯМР (300 МГц, CD3OD): δ 8,20 (д, 1H, J=7,5 Гц), 7,83 (д, 1H, J=16,2 Гц), 7,45 (м, 4H), 7,15 (м, 2H), 6,99 (д, 1H, J=15,9 Гц), 4,47 (c, 2H), 3,05 (c, 3H).
Пример 106: 3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид
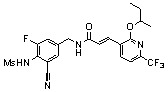
N-(4-Аминометил-2-фтор-6-циано-фенил)-метансульфонамид, соль HCl (46,1 мг, 0,165 ммоль) вводили в реакцию с NMM (0,2 мл), DMTMM (60,1 мг) и 3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (43 мг, 0,15 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (57 мг, 75%).
1H ЯМР (300 МГц, CD3OD): δ 8,02 (д, 1H, J=7,8 Гц), 7,69 (д, 1H, J=15,9 Гц), 7,52 (м, 1H), 7,47 (дд, 1H, J=0,75 и 9,9 Гц), 7,30 (д, 1H, J=7,8 Гц), 6,87 (д, 1H, J=15,9 Гц), м, 2H), 5,27 (м, 1H), 4,89 (c, 1H), 3,07 (c, 3H), 1,33 (д, 3H, J=6,0 Гц), 0,95 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 515.
Пример 107: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриламид
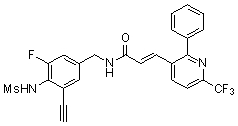
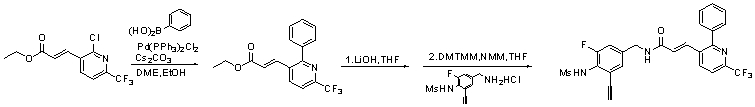
Стадия 1: синтез этилового эфира 3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриловой кислоты
В микроволновую ампулу загружали этиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (100 мг, 0,376 ммоль), фенилбороновую кислоту (2 экв.), Cs2CO3 (3 экв.), Pd(PPh3)2Cl2 (0,08 экв.), DME (1 мл) и этанол (0,25 мл). Ампулу облучали в микроволновом синтезаторе при 140°C в течение 20 мин. Содержимое ампулы фильтровали через целит, который затем тщательно промывали метанолом. Фильтрат упаривали, и остаток очищали хроматографией на колонках, получая этиловый эфир 3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (96 мг, 80%).
1H ЯМР (300 МГц, CDCl3): δ 8,07 (д, 1H, J=7,5 Гц), 7,73 (д, 1H, J=16,2 Гц), 7,64 (д, 1H, J=8,1 Гц), 7,57-7,53 (м, 2H), 7,47-7,43 (м, 3H), 6,45 (д, 1H, J=16,3 Гц), 4,21 (кв, 2H, J=7,2 Гц), 1,26 (т, 3H, J=7,2 Гц).
Стадия 2: синтез N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриламида
К суспензии этилового эфира 3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (20 мг, 0,062 ммоль) в ТГФ (1 мл) добавляли водный раствор 0,5 н. LiOH (0,3 мл), и смесь перемешивали в течение 3 часов при комнатной температуре. Полученный остаток растворяли в H2O и затем промывали три раза EtOAc, подкисляли 1 н. HCl до рН 1~2. Раствор экстрагировали три раза метиленхлоридом и затем высушивали над безвод. Na2SO4 и концентрировали в вакууме, получая 3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриловую кислоту (19 мг, 96%). К суспензии N-(4-аминометил-2-этинил-6-фтор-фенил)-метансульфонамида, соли HCl (21 мг, 0,074 ммоль) в ТГФ (3 мл) добавляли N-метилморфолин (0,015 мл, 0,148 ммоль). Смесь перемешивали в течение 5 минут, затем добавляли 3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриловую кислоту (19 мг, 0,065 ммоль) и 4-(4,6-диметокси[1,3,5]триазин-2-ил)-4-метилморфолинийхлорид гидрат (DMTMM 19 мг, 0,068 ммоль). Смесь перемешивали в течение ночи при комнатной температуре и концентрировали при пониженном давлении. Остаток разбавляли EtOAc и водой. Органический слой промывали насыщенным бикарбонатом натрия, 1 н. HCl и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали перекристаллизацией из Et2O, получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриламид (18 мг, 56%).
1H ЯМР (300 МГц, ДМСО): δ 9,46 (c, 1H, ушир.), 8,85 (т, 1H, J=5,7 Гц), 8,39 (д, 1H, J=8,1 Гц), 7,98 (д, 1H, J=8,1 Гц), 7,61-7,54 (м, 5H), 7,45 (д, 1H, J=15,9 Гц), 7,26 (м, 2H), 6,84 (д, 1H, J=15,9 Гц), 4,52 (c, 1H), 4,36 (д, 2H, J=5,7 Гц), 3,06 (c, 3H).
Пример 108: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-акриламид
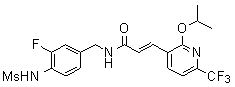
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (46 мг, 0,18 ммоль) вводили в реакцию с 3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (50 мг, 0,18 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/1) целевое соединение (34 мг, 25%).
1H ЯМР (300 МГц, CDCl3): δ 7,81 (д, 1H, J=7,8 Гц), 7,76 (д, 1H, J=15,6 Гц), 7,54 (м, 1H), 7,19 (м, 3H), 6,72 (д, 1H, J=15,6 Гц), 6,51 (c, 1H), 6,03 (c ушир., 1H), 5,48 (септет, 1H, J=6,0 Гц), 4,57 (д, 2H, J=6,3 Гц), 3,03 (c, 3H), 1,41 (д, 6H, J=7,2 Гц).
Пример 109: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-акриламид
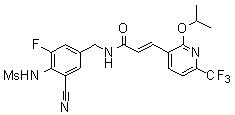
N-(4-Аминометил-6-циано-2-фтор-фенил)-метансульфонамид, соль HCl (51 мг, 0,18 ммоль) вводили в реакцию с 3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (50 мг, 0,18 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (44 мг, 51%).
1H ЯМР (300 МГц, ДМСО-d6): δ 10,08 (c ушир., 1H), 8,90 (м, 1H), 8,177 (д, 1H, J=7,8 Гц), 7,56 (м, 4H), 7,35 (септет, 1H, J=6,0 Гц), 4,44 (д, 2H, J=5,7 Гц), 3,08 (c, 3H), 1,38 (д, 6H, J=6,0 Гц).
Пример 110: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид
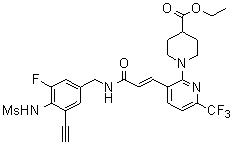
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (75 мг, 0,27 ммоль) вводили в реакцию с 3-[2-(4-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (100 мг, 0,27 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (111 мг, 69%).
1H ЯМР (300 МГц, CDCl3): δ 7,72 (м, 2H), 7,31 (c ушир., 1H), 7,19 (м, 2H), 6,45 (д, 2H, J=15,6 Гц), 6,41 (c ушир., 1H), 6,00 (c ушир., 1H), 4,54 (д, 2H, J=6,3 Гц), 4,15 (кв, 2H, J=7,2 Гц), 3,71 (м, 2H), 3,49 (c, 1H), 3,27 (c, 3H), 3,01 (м, 2H), 2,51 (м, 1H), 1,96 (м, 4H), 1,27 (т, 3H, J=7,2 Гц).
Пример 111: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид
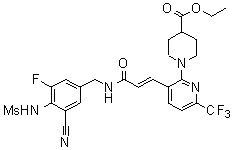
N-(4-Аминометил-5-циано-2-фтор-фенил)-метансульфонамид, соль HCl (39 мг, 0,14 ммоль) вводили в реакцию с 3-[2-(4-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (52 мг, 0,14 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (63 мг, 75%).
1H ЯМР (300 МГц, CDCl3): δ 7,77 (м, 1H), 7,70 (д, 1H, J=15,0 Гц), 7,46 (м, 2H), 7,21 (м, 1H), 6,50 (д, 1H, J=15,6 Гц), 6,44 (c ушир., 1H), 4,59 (д, 2H, J=6,6 Гц), 4,16 (кв, 2H, J=7,2 Гц), 3,72 (м, 2H), 3,32 (c, 3H), 3,02 (м, 2H), 2,52 (м, 1H), 1,96 (м, 4H), 1,28 (т, 3H, J=7,2 Гц).
Пример 112: 3-(2-бензилокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
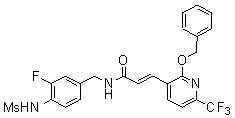
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (21 мг, 0,083 ммоль) вводили в реакцию с 3-(2-бензилокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (35 мг, 0,083 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (18 мг, 41%).
1H ЯМР (300 МГц, CDCl3): δ 7,84 (м, 1H), 7,76 (д, 1H, J=15,9 Гц), 7,49 (м, 3H), 7,35 (м, 4H), 7,12 (м, 2H), 6,74 (д, 1H, J=15,6 Гц), 6,46 (c, 1H), 5,92 (c ушир., 1H), 5,54 (c, 2H), 4,54 (д, 2H, J=6,3 Гц), 3,02 (c, 3H).
Пример 113: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриламид
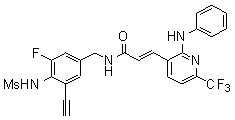
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (31 мг, 0,11 ммоль) вводили в реакцию с 3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (19 мг, 0,06 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (10 мг, 17%).
1H ЯМР (300 МГц, CDCl3): δ 7,57 (д, 1H, J=16,2 Гц), 7,43 (м, 5H), 7,23 (м, 3H), 7,06 (м, 1H), 6,49 (д, 1H, J=15,9 Гц), 6,45 (c ушир., 1H), 6,29 (c ушир., 1H), 4,34 (д, 2H, J=6,6 Гц), 3,46 (c, 1H), 3,31 (c, 3H).
Пример 114: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид
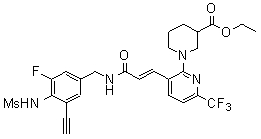
N-(5-Этинил-4-аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (75 мг, 0,27 ммоль) вводили в реакцию с 3-[2-(3-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (100 мг, 0,27 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=4/5) целевое соединение (75 мг, 46%).
1H ЯМР (300 МГц, CDCl3): δ 7,79 (д, 1H, J=7,2 Гц), 7,67 (д, 1H, J=16,2 Гц), 7,32 (c ушир., 1H), 7,21 (м, 2H), 6,82 (c ушир., 1H), 6,54 (д, 1H, J=16,2 Гц), 6,39 (c, 1H), 4,54 (т, 2H, J=6,6 Гц), 4,10 (м, 2H), 3,48 (c, 1H), 3,43 (м, 4H), 3,26 (c, 3H), 3,19 (м, 2H), 2,75 (м, 1H), 1,92 (м, 2H), 1,24 (т, 3H, J=7,2 Гц).
Пример 115: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид
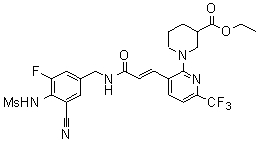
N-(4-Аминометил-3-циано-5-фтор-фенил)-метансульфонамид, соль HCl (23 мг, 0,081 ммоль) вводили в реакцию с 3-[2-(3-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (30 мг, 0,081 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (35 мг, 72%).
1H ЯМР (300 МГц, ДМСО-d6): δ 10,10 (c ушир., 1H), 8,85 (м, 1H), 8,03 (д, 1H, J=7,5 Гц), 7,63 (м, 2H), 7,43 (м, 2H), 6,76 (д, 1H, J=16,2 Гц), 4,45 (д, 2H, J=5,7 Гц), 4,03 (кв, 2H, J=6,9 Гц), 3,72 (м, 1H), 3,09 (c, 3H), 2,94 (м, 4H), 1,81 (м, 4H), 1,12 (т, 3H, J=7,2 Гц).
Пример 116: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пипераз-1-ил-6-трифторметил-пиридин-3-ил)-акриламид, соль HCl
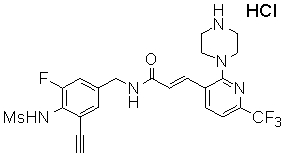
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (192 мг, 0,70 ммоль) вводили в реакцию с 3-(2-пипераз-1-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (230 мг, 0,57 ммоль), получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-Boc-пипераз-1-ил-6-трифторметил-пиридин-3-ил)-акриламид. Этот акриламид обрабатывали 4 M HCl в диоксане, получая после очистки с использованием MeOH целевое соединение (90 мг, 28%).
1H ЯМР (300 МГц, ДМСО-d6 + CDCl3): δ 9,57 (c ушир., 2H), 9,08 (c, 1H), 8,75 (т, 1H, J=5,7 Гц), 7,86 (д, 1H, J=7,8 Гц), 7,49 (д, 1H, J=15,9 Гц), 7,30 (д, 1H, J=7,8 Гц), 7,23 (c, 1H), 7,12 (дд, 1H, J=2,1 и 10,2 Гц), 6,75 (д, 1H, J=15,9 Гц), 4,37 (д, 2H, J=5,7 Гц), 3,68 (c, 1H), 3,51 (м, 4H), 3,25 (м, 4H), 3,03 (c, 3H).
Пример 117: 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
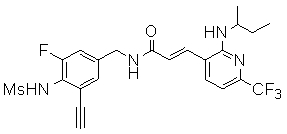
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (84 мг, 0,30 ммоль) вводили в реакцию с 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,24 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (75 мг, 63%).
1H ЯМР (300 МГц, ДМСО-d6 + CDCl3): δ 9,40 (c ушир., 1H), 8,71 (т, 1H), 7,74 (д, 1H, J=7,8 Гц), 7,64 (д, 1H, J=15,3 Гц), 7,26 (м, 2H), 6,87 (д, 1H, J=7,8 Гц), 6,68 (д, 1H, J=8,1 Гц), 6,59 (д, 1H, J=15,3 Гц), 4,39 (д, 2H, J=6,0 Гц), 4,38 (c, 1H), 4,09 (м, 1H), 3,05 (c, 3H), 1,55 (м, 2H), 1,14 (д, 3H, J=6,6 Гц), 0,86 (т, 3H, J=7,2 Гц).
ESI [M+H]+: 514.
Пример 118: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метил-бутокси)-6-трифторметил-пиридин-3-ил]-акриламид
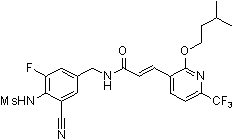
N-(4-Аминометил-2-циано-6-фтор-фенил)-метансульфонамид, соль HCl (17,3 мг, 0,062 ммоль) вводили в реакцию с 3-[2-(3-метил-бутокси)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (15,7 мг, 0,052 ммоль), получая после очистки хроматографией (Hex/EtOAc=1/2) N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриламид (22 мг, 80%).
1H ЯМР (300 МГц, ДМСО): δ 10,08 (c, 1H, ушир.), 8,83 (т, 1H, J=5,7 Гц), 8,12 (д, 1H, J=7,5 Гц), 7,59-7,45 (м, 4H), 6,86 (д, 1H, J=16,2 Гц), 4,49-4,35 (м, 4H), 3,02 (c, 3H), 1,73-1,60 (м, 3H), 0,87 (д, 6H, J=6,0 Гц).
Пример 119: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-тиен-3-ил-6-трифторметил-пиридин-3-ил)-акриламид
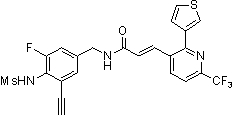
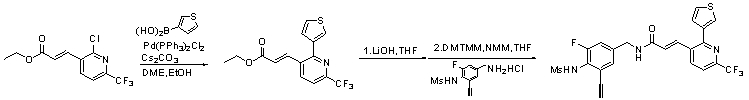
Стадия 1: синтез этилового эфира 3-(2-тиен-3-ил-6-трифторметил-пиридин-3-ил)-акриловой кислоты
Этиловый эфир 3-(2-тиен-3-ил-6-трифторметил-пиридин-3-ил)-акриловой кислоты получали согласно общей процедуре, описанной в примере 107 (стадия 1).
Этиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (100 мг, 0,357 ммоль) вводили в реакцию с 3-тиенилбороновой кислотой (2 экв.), получая этиловый эфир 3-(2-тиен-3-ил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (80 мг, 68%).
1H ЯМР (300 МГц, CDCl3): δ 7,99 (д, 1H, J=6,0 Гц), 7,91 (д, 1H, J=16,5 Гц), 7,61 (дд, 1H, J=2,7, 1,2 Гц), 7,57 (д, 1H, J=8,1 Гц), 7,49 (дд, 1H, J=4,8, 1,2 Гц), 7,39 (дд, 1H, J=5,4, 3,0 Гц), 6,43 (д, 1H, J=15,9 Гц), 4,24 (кв, 2H, J=7,2 Гц), 1,30 (т, 3H, J=7,2 Гц).
Стадия 2: синтез N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-тиен-3-ил-6-трифторметил-пиридин-3-ил)-акриламида
N-(3-Этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-тиофен-3-ил-6-трифторметил-пиридин-3-ил)-акриламид получали согласно общей процедуре, описанной в примере 107 (стадия 2).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (19 мг, 0,068 ммоль) вводили в реакцию с 3-(2-тиен-3-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (17 мг, 0,057 ммоль), получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-тиен-3-ил-6-трифторметил-пиридин-3-ил)-акриламид (12 мг, 34%).
1H ЯМР (300 МГц, ДМСО): δ 9,39 (c, 1H, ушир.), 8,80 (т, 1H, J=6,0 Гц), 8,26 (д, 1H, J=8,1 Гц), 7,86 (д, 1H, J=8,4 Гц), 7,76 (д, 1H, J=2,4 Гц), 7,66 (дд, 1H, J=4,8, 2,7 Гц), 7,56 (д, 1H, J=15,6 Гц), 7,35 (д, 1H, J=5,4 Гц), 7,23 (c, 1H), 7,22 (д, 1H, J=7,5 Гц), 6,75 (д, 1H, J=15,6 Гц), 4,45 (c, 1H), 4,33 (д, 2H, J=5,4 Гц), 3,00 (c, 3H).
Пример 120: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид
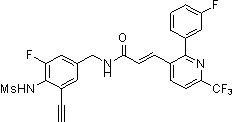
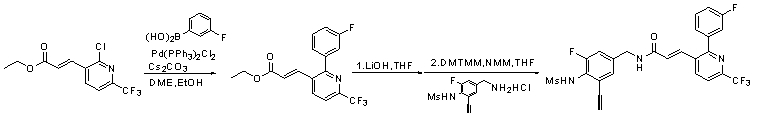
Стадия 1: синтез этилового эфира 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты
Этиловый эфир 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты получали согласно общей процедуре, описанной в примере 107 (стадия 1).
Этиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (110 мг, 0,393 ммоль) вводили в реакцию с 3-фторфенилбороновой кислотой (2 экв.), получая этиловый эфир 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты (70 мг, 53%).
1H ЯМР (300 МГц, CDCl3): δ 8,13 (д, 1H, J=8,1 Гц), 7,76 (д, 1H, J=15,6 Гц), 7,72 (д, 1H, J=8,4 Гц), 7,51-7,43 (м, 1H), 7,38-7,33 (м, 2H), 7,27-7,16 (м, 1H), 6,50 (д, 1H, J=15,6 Гц), 4,26 (кв, 2H, J=7,2 Гц), 1,30 (т, 3H, J=7,2 Гц).
Стадия 2: синтез N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид
N-(3-Этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид получали согласно общей процедуре, описанной в примере 107 (стадия 2).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (71,45 мг, 0,255 ммоль) вводили в реакцию с 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (53 мг, 0,170 ммоль), получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид (52 мг, 57%).
1H ЯМР (300 МГц, ДМСО): δ 9,45 (c, 1H, ушир.), 8,86 (т, 1H, J=6,0 Гц), 8,40 (д, 1H, J=8,1 Гц), 8,01 (д, 1H, J=8,1 Гц), 7,63-7,56 (м, 1H), 7,45-7,35 (м, 4H), 7,27 (c, 1H), 7,26 (д, 1H, J=8,7 Гц), 6,83 (д, 1H, J=15,9 Гц), 4,51 (c, 1H), 4,36 (д, 2H, J=6,0 Гц), 3,06 (c, 3H).
Пример 121: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид
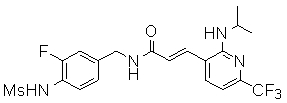
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (95 мг, 0,37 ммоль) вводили в реакцию с 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (84 мг, 0,31 ммоль), получая после очистки кристаллизацией из метиленхлорида целевое соединение (125 мг, 84%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,55 (c ушир., 1H), 8,72 (т, 1H, J=5,7 Гц), 7,78 (д, 1H, J=7,5 Гц), 7,63 (д, 1H, J=15,6 Гц), 7,34 (т, 1H, J=8,4 Гц), 7,20 (дд, 1H, J=2,1 и 11,4 Гц), 7,13 (д, 1H, J=8,4 Гц), 6,96 (д, 1H, J=7,5 Гц), 6,82 (д, 1H, J=7,5 Гц), 6,61 (д, 1H, J=15,6 Гц), 4,39 (д, 2H, J=5,7 Гц), 4,21 (м, 1H), 3,00 (c, 3H), 1,18 (д, 6H, J=6,6 Гц).
Пример 122: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид
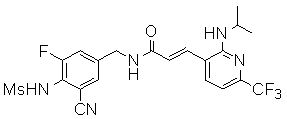
N-(4-Аминометил-5-циано-2-фтор-фенил)-метансульфонамид, соль HCl (104 мг, 0,37 ммоль) вводили в реакцию с 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (84 мг, 0,31 ммоль), получая после очистки кристаллизацией из метиленхлорида целевое соединение (115 мг, 74%).
1H ЯМР (300 МГц, ДМСО-d6): δ 10,1 (c ушир., 1H), 8,79 (т, 1H, J=5,7 Гц), 7,80 (д, 1H, J=7,5 Гц), 7,63 (м, 2H), 6,96 (д, 1H, J=7,5 Гц), 6,82 (д, 1H, J=7,5 Гц), 6,61 (д, 1H, J=15,6 Гц), 4,39 (д, 2H, J=5,7 Гц), 4,21 (м, 1H), 3,10 (c, 3H), 1,18 (д, 6H, J=6,6 Гц).
ESI [M+H]+: 500.
Пример 123: 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
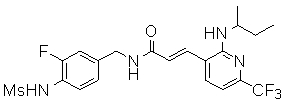
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (325 мг, 1,27 ммоль) вводили в реакцию с 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (306 мг, 1,06 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (490 мг, 95%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,55 (c ушир., 1H), 8,70 (т, 1H, J=6,0 Гц), 7,77 (д, 1H, J=7,8 Гц), 7,64 (д, 1H, J=15,3 Гц), 7,35 (т, 1H, J=8,4 Гц), 7,21 (дд, 1H, J=1,5 и 11,4 Гц), 7,13 (д, 1H, J=8,4 Гц), 6,94 (д, 1H, J=7,5 Гц), 6,74 (д, 1H, J=7,8 Гц), 6,63 (д, 1H, J=15,3 Гц), 4,40 (д, 2H, J=6,0 Гц), 4,07 (м, 1H), 3,00 (c, 3H), 1,55 (м, 2H), 1,14 (д, 3H, J=6,6 Гц), 0,86 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 489.
Пример 124: 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид
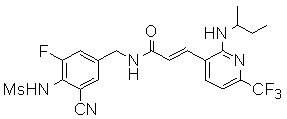
N-(4-Аминометил-5-циано-2-фтор-фенил)-метансульфонамид, соль HCl (104 мг, 0,37 ммоль) вводили в реакцию с 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (100 мг, 0,34 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (130 мг, 74%).
1H ЯМР (300 МГц, ДМСО-d6): δ 10,1 (c ушир., 1H), 8,77 (т, 1H, J=6,0 Гц), 7,80 (д, 1H, J=7,2 Гц), 7,63 (м, 3H), 6,94 (д, 1H, J=7,8 Гц), 6,76 (д, 1H, J=7,8 Гц), 6,62 (д, 1H, J=15,6 Гц), 4,55 (д, 2H, J=6,0 Гц), 4,07 (м, 1H), 3,09 (c, 3H), 1,55 (м, 2H), 1,14 (д, 3H, J=6,6 Гц), 0,85 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 514.
Пример 125: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксифенил)-6-трифторметил-пиридин-3-ил]-акриламид
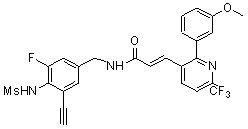
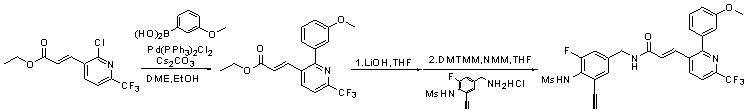
Стадия 1: синтез этилового эфира 3-[2-(3-метоксифенил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты
Этиловый эфир 3-[2-(3-метоксифенил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты получали согласно общей процедуре, описанной в примере 107 (стадия 1).
Этиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (103 мг, 0,368 ммоль) вводили в реакцию с 3-метоксифенилбороновой кислотой (2 экв.), получая этиловый эфир 3-[2-(3-метоксифенил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты (70 мг, 54%).
1H ЯМР (300 МГц, CDCl3): δ 8,09 (д, 1H, J=8,4 Гц), 7,79 (д, 1H, J=15,9 Гц), 7,68 (д, 1H, J=7,8 Гц), 7,39 (дд, 1H, J=7,2, 1,5 Гц), 7,51-7,12 (м, 2H), 7,04-7,00 (м, 1H), 6,47 (д, 1H, J=15,9 Гц), 4,25 (кв, 2H, J=7,2 Гц), 3,85 (c, 3H), 1,31 (т, 3H, J=7,2 Гц).
Стадия 2: синтез N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксифенил)-6-трифторметил-пиридин-3-ил]-акриламида
N-(3-Этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксифенил)-6-трифторметил-пиридин-3-ил]-акриламид получали согласно общей процедуре, описанной в примере 107 (стадия 2).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (15,6 мг, 0,056 ммоль) вводили в реакцию с 3-[2-(3-метоксифенил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (15 мг, 0,046 ммоль), получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксифенил)-6-трифторметил-пиридин-3-ил]-акриламид (15 мг, 60%).
1H ЯМР (300 МГц, ДМСО): δ 9,44 (c, 1H, ушир.), 8,84 (т, 1H, J=6,0 Гц), 8,37 (д, 1H, J=8,1 Гц), 7,97 (д, 1H, J=8,1 Гц), 7,47 (д, 1H, J=15,9 Гц), 7,46 (т, 1H, J=7,8 Гц), 7,27 (c, 1H), 7,25 (д, 1H, J=8,1 Гц), 7,11 (дд, 2H, J=3,0, 2,4 Гц), 7,07 (дд, 1H, J=5,1, 1,8 Гц), 6,82 (д, 1H, J=15,9 Гц), 4,51 (c, 1H), 4,37 (д, 2H, J=5,7 Гц), 3,79 (c, 3H), 3,06 (c, 3H).
Пример 126: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пиридин-3-ил-6-трифторметил-пиридин-3-ил)-акриламид
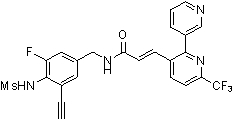
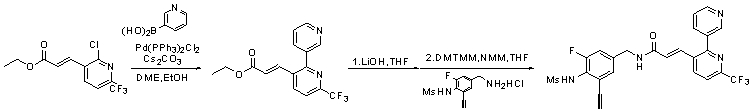
Стадия 1: синтез этилового эфира 3-(2-пиридин-3-ил-6-трифторметил-пиридин-3-ил)-акриловой кислоты
Этиловый эфир 3-(2-пиридин-3-ил-6-трифторметил-пиридин-3-ил)-акриловой кислоты получали согласно общей процедуре, описанной в примере 107 (стадия 1).
Этиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (103 мг, 0,368 ммоль) вводили в реакцию с 3-пиридинбороновой кислотой (2 экв.), получая этиловый эфир 3-(2-пиридин-3-ил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (60 мг, 50%).
1H ЯМР (300 МГц, CDCl3): δ 8,84 (д, 1H, J=1,8 Гц), 8,74 (д, 1H, J=4,8 Гц), 8,14 (д, 1H, J=8,1 Гц), 7,79 (дд, 1H, J=6,3, 1,8 Гц), 7,75 (д, 1H, J=7,8 Гц), 7,72 (д, 1H, J=15,9 Гц), 7,46 (дд, 1H, J=4,8, 3,0 Гц), 6,54 (д, 1H, J=15,9 Гц), 4,26 (кв, 2H, J=7,2 Гц), 1,32 (т, 3H, J=7,2 Гц).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пиридин-3-ил-6-трифторметил-пиридин-3-ил)-акриламид.
N-(3-Этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пиридин-3-ил-6-трифторметил-пиридин-3-ил)-акриламид получали согласно общей процедуре, описанной в примере 107 (стадия 2).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (68 мг, 0,24 ммоль) вводили в реакцию с 3-(2-пиридин-3-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (60 мг, 0,20 ммоль), получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пиридин-3-ил-6-трифторметил-пиридин-3-ил)-акриламид (60 мг, 58%).
1H ЯМР (300 МГц, CDCl3): δ 8,81 (д, 1H, J=2,4 Гц), 8,69 (дд, 1H, J=3,6, 1,5 Гц), 8,11 (д, 1H, J=8,1 Гц), 7,97 (дд, 1H, J=4,2, 1,2 Гц), 7,72 (д, 1H, J=8,4 Гц), 7,69 (д, 1H, J=15,6 Гц), 7,44 (дд, 1H, J=7,8, 5,1 Гц), 7,72 (дд, 1H, J=9,0, 1,8 Гц), 6,53 (д, 1H, J=15,6 Гц), 6,45 (т, 1H, J=5,7 Гц), 4,46 (д, 2H, J=6,3 Гц), 3,50 (c, 1H), 3,24 (c, 3H).
Пример 127: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриламид
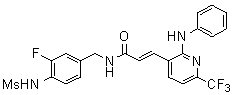
N-(4-Аминометил-3-фтор-фенил)-метансульфонамид, соль HCl (74 мг, 0,29 ммоль) вводили в реакцию с 3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (90 мг, 0,29 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (100 мг, 67%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,57 (c, 1H), 8,80 (м, 1H), 8,02 (д, 1H, J=7,8 Гц), 7,80 (д, 1H, J=15,9 Гц), 7,63 (м, 2H), 7,29 (м, 6H), 6,98 (м, 1H), 6,73 (д, 1H, J=15,6 Гц), 4,41 (д, 2H, J=5,1 Гц), 2,99 (c, 3H).
Пример 128: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриламид
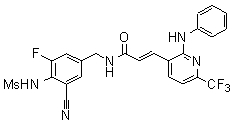
N-(4-Аминометил-2-циано-6-фтор-фенил)-метансульфонамид, соль HCl (81 мг, 0,29 ммоль) вводили в реакцию с 3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (90 мг, 0,29 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/3) целевое соединение (95 мг, 61%).
1H ЯМР (300 МГц, ДМСО-d6): δ 10,09 (c, 1H), 9,01 (c, 1H), 8,88 (м, 1H), 8,04 (д, 1H, J=7,5 Гц), 7,82 (м, 1H), 7,64 (м, 4H), 7,29 (м, 3H), 6,98 (м, 1H), 6,74 (д, 1H, J=15,6 Гц), 4,48 (д, 2H, J=6,0 Гц), 3,10 (c, 3H).
Пример 129: 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид
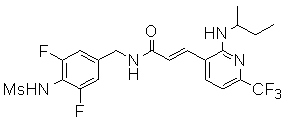
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (86 мг, 0,32 ммоль) вводили в реакцию с 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (90 мг, 0,31 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (106 мг, 68%).
1H ЯМР (300 МГц, ДМСО-d6): δ 8,76 (т, 1H, J=6,0 Гц), 7,79 (д, 1H, J=7,5 Гц), 7,65 (д, 1H, J=15,3 Гц), 7,11 (д, 2H, J=8,4 Гц), 6,95 (д, 1H, J=7,8 Гц), 6,78 (д, 1H, J=7,8 Гц), 6,62 (д, 1H, J=15,3 Гц), 4,41 (д, 2H, J=6,0 Гц), 4,07 (м, 1H), 3,03 (c, 3H), 1,55 (м, 2H), 1,14 (д, 3H, J=6,6 Гц), 0,86 (т, 3H, J=7,5 Гц).
Пример 130: 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид
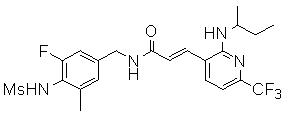
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (99 мг, 0,37 ммоль) вводили в реакцию с 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (100 мг, 0,34 ммоль), получая целевое соединение (140 мг, 82%) после очистки кристаллизацией из простого эфира.
1H ЯМР (300 МГц, ДМСО-d6): δ 10,1 (c ушир., 1H), 8,64 (т, 1H, J=5,7 Гц), 7,75 (д, 1H, J=7,5 Гц), 7,63 (д, 1H, J=15,3 Гц), 7,16 (м, 2H), 6,94 (д, 1H, J=7,2 Гц), 6,76 (д, 1H, J=7,8 Гц), 6,62 (д, 1H, J=15,3 Гц), 4,40 (д, 2H, J=5,7 Гц), 4,06 (м, 1H), 2,97 (c, 3H), 2,20 (д, 3H, J=2,4 Гц), 1,55 (м, 2H), 1,14 (д, 3H, J=6,6 Гц), 0,85 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 503.
Пример 131: N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриламид
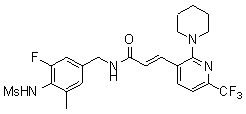
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (50 мг, 0,19 ммоль) вводили в реакцию с 3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (56 мг, 0,19 ммоль), получая после очистки перекристаллизацией из смеси EtOAc/гексан N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридинил-3-ил)-акриламид (66 мг, 69%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,26 (c, 1H), 8,72 (т, 1Н, J=5,7 Гц), 7,97 (д, 1Н, J=7,8 Гц), 7,46~7,37 (м, 2H), 7,22~7,10 (м, 2H), 6,74 (д, 1Н, J=15,6 Гц), 4,41 (д, 2Н, J=5,7 Гц), 3,20~3,17 (м, 4H), 2,98 (c, 3H), 2,21 (д, 3Н, J=2,1 Гц), 1,62 (ушир., 6H).
Пример 132: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид
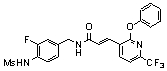
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (41,7 мг, 0,162 ммоль) вводили в реакцию с NMM (0,07 мл), DMTMM (44,7 мг) и 3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (45 мг, 0,15 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (63 мг, 85%).
1H ЯМР (300 МГц, CDCl3): δ 7,96 (д, 1H, J=7,8 Гц), 7,86 (д, 1H, J=15,6 Гц), 7,53 (т, 1H, J=7,8 Гц), 7,39 (м, 3H), 7,15 (м, 4H), 6,87 (д, 1H, J=15,6 Гц), 6,53 (c, 1H), 6,13 (т, 1H), 4,56 (д, 2H, J=6,0 Гц), 3,01 (c, 3H).
Пример 133: N-(3-фтор-4-метансульфониламино-5-винил-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид
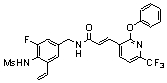
N-(4-Аминометил-2-фтор-6-винил-фенил)-метансульфонамид, соль HCl (85 мг, 0,302 ммоль) вводили в реакцию с NMM (0,1 мл), DMTMM (83,7 мг) и 3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (69 мг, 0,245 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (69 мг, 53%).
1H ЯМР (300 МГц, CDCl3): δ 7,96 (д, 1H, J=8,1 Гц), 7,87 (д, 1H, J=15,6 Гц), 7,40 (м, 3H), 7,17 (м, 2H), 7,10 (м, 2H), 6,88 (д, 1H, J=15,6 Гц), 6,20 (т, 1H), 6,09 (м, 1H), 5,80 (дд, 1H, J=3,6 и 17,4 Гц), 5,46 (д, 1H, J=11,1 Гц), 4,57 (д, 2H, J=6,0 Гц), 3,37 (c, 1H), 3,07 (c, 3H).
Пример 134: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(пиридин-3-илокси)-6-трифторметил-пиридин-3-ил]-акриламид
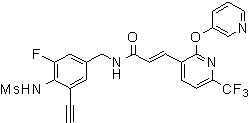
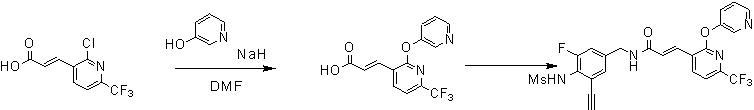
Стадия 1: 3-[2-(пиридин-3-илокси)-4-трифторметил-фенил]-акриловая кислота
3-Гидроксипиридин (69,1 мг) и гидрид натрия (65 мг, 1,6 ммоль) добавляли в ТГФ. К реакционной смеси добавляли 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (156 мг, 0,620 ммоль). Реакционную смесь очищали, получая целевое соединение (15 мг) после очистки хроматографией на колонках (Hex/EtOAc=1/4).
1H ЯМР (300 МГц, CD3OD): δ 8,48 (м, 1H), 8,32 (д, 1H, J=7,8 Гц), 8,03 (c, 1H), 7,93 (д, 1H, J=16,2 Гц), 7,73 (м, 1H), 7,51 (м, 1H), 7,21 (м, 1H), 6,79 (д, 1H, J=16,2 Гц).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(пиридин-3-илокси)-6-трифторметил-пиридин-3-ил]-акриламид
N-(4-Аминометил-2-фтор-6-этинил-фенил)-метансульфонамид, соль HCl (50,5 мг, 0,198 ммоль) вводили в реакцию с NMM (0,08 мл), DMTMM (57,8 мг) и 3-[2-(пиридин-3-илокси)-4-трифторметил-фенил]-акриловой кислотой (40,5 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/4) целевое соединение (29 мг).
1H ЯМР (300 МГц, CD3OD): δ 8,52 (д, 1H, J=2,7 Гц), 8,45 (мд, 1H), 8,30 (д, 1H, J=7,2 Гц), 7,88 (д, 1H, J=15,9 Гц), 7,77 (м, 1H), 7,55 (м, 2H), 7,33 (c, 1H), 7,21 (дд, 1H, J=1,2 и 10,2 Гц), 7,02 (д, 1H, J=15,9 Гц), 4,49 (c, 2H), 3,31 (c, 1H), 3,11 (c, 3H).
Пример 135: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-фтор-пиридин-3-ил)-6-трифторметил-пиридин-3-ил]-акриламид
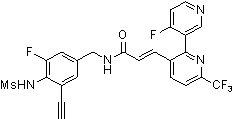
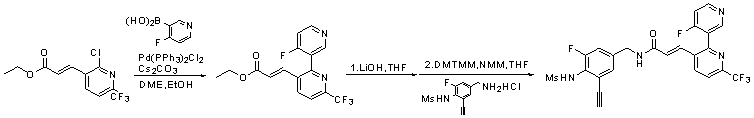
Стадия 1: синтез этилового эфира 3-[2-(4-фтор-пиридин-3-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты
Этиловый эфир 3-[2-(4-фтор-пиридин-3-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты получали согласно общей процедуре, описанной в примере 107 (стадия 1).
Этиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (110 мг, 0,393 ммоль) вводили в реакцию с 2-фтор-5-пиридин бороновой кислотой (2 экв.), получая этиловый эфир 3-[2-(4-фтор-пиридин-3-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты (40 мг, 30%).
1H ЯМР (300 МГц, CDCl3): δ 8,45 (д, 1H, J=2,4 Гц), 8,16-8,08 (м, 2H), 7,76 (д, 1H, J=8,4 Гц), 7,70 (д, 1H, J=15,9 Гц), 7,11 (дд, 1H, J=5,4, 3,0 Гц), 6,55 (д, 1H, J=15,9 Гц), 4,27 (кв, 2H, J=7,2 Гц), 1,33 (т, 3H, J=7,2 Гц).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-фтор-пиридин-3-ил)-6-трифторметил-пиридин-3-ил]-акриламид
N-(3-Этинил-5-фтор-4-метансульфониламино-бензил)-3-(4'-фтор-6-трифторметил-[2,3']бипиридинил-3-ил)-акриламид получали согласно общей процедуре, описанной в примере 107 (стадия 2).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (29,5 мг, 0,107 ммоль) вводили в реакцию с 3-[2-(4-фтор-пиридин-3-ил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (22 мг, 0,070 ммоль), получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-фтор-пиридин-3-ил)-6-трифторметил-пиридин-3-ил]-акриламид (14 мг, 39%).
1H ЯМР (300 МГц, ДМСО): δ 9,46 (c, 1H, ушир.), 8,88 (т, 1H, J=6,0 Гц), 8,43 (д, 1H, J=8,1 Гц), 8,41 (c, 1H), 8,23-8,16 (м, 1H), 8,04 (д, 1H, J=8,1 Гц), 7,42 (д, 1H, J=15,6 Гц), 7,41 (д, 1H, J=2,7 Гц), 7,28 (c, 1H), 7,26 (д, 1H, J=4,8 Гц), 6,83 (д, 1H, J=15,6 Гц), 4,52 (c, 1H), 4,37 (д, 2H, J=5,7 Гц), 3,06 (c, 3H).
Пример 136: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид
N-(4-Аминометил-2-циано-6-фтор-фенил)-метансульфонамид, соль HCl (18 мг, 0,065 ммоль) вводили в реакцию с 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (17 мг, 0,054 ммоль), получая после очистки перекристаллизацией из смеси н-гексан/EtOAc N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид (21 мг, 62%).
1H ЯМР (300 МГц, ДМСО): δ 8,90 (т, 1H, J=6,0 Гц), 8,41 (д, 1H, J=8,1 Гц), 8,02 (д, 1H, J=8,1 Гц), 7,62-7,57 (м, 3H), 7,45-7,35 (м, 4H), 6,83 (д, 1H, J=15,6 Гц), 4,42 (д, 2H, J=6,0 Гц), 3,06 (c, 3H).
Примеры 137 и 138 отсутствуют
Пример 139: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенилтио-6-трифторметил-пиридин-3-ил)-акриламид
Стадия 1: 3-(2-фенилтио-6-трифторметил-пиридин-3-ил)-акриловая кислота
Метиловый эфир 3-(2-фенилтио-6-трифторметил-пиридин-3-ил)-акриловой кислоты (80 мг) гидролизовали 1 М раствором (3 ммоль) LiOH при комнатной температуре, получая целевое соединение (63 мг).
1H ЯМР (300 МГц, CDCl3): δ 8,13 (д, 1H, J=15,6 Гц), 7,81 (м, 1H), 7,53 (м, 2H), 7,38 (м, 3H), 6,48 (д, 1H, J=15,9 Гц).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенилтио-6-трифторметил-пиридин-3-ил)-акриламид
N-(4-Аминометил-2-фтор-6-этинил-фенил)-метансульфонамид, соль HCl (43 мг, 0,154 ммоль) вводили в реакцию с NMM (0,1 мл), DMTMM (46 мг) и 3-(2-фенилтио-6-трифторметил-пиридин-3-ил)-акриловой кислотой (41 мг, 0,126 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (25,6 мг, 37%).
1H ЯМР (300 МГц, CDCl3): δ 7,88 (д, 1H, J=15,6 Гц), 7,76 (д, 1H, J=8,1 Гц), 7,48 (м, 2H), 7,32 (м, 4H), 7,21 (c, 1H), 7,08 (д, 1H, J=10,5 Гц), 6,45 (д, 1H, J=15,3 Гц), 6,43 (c, 1H), 4,44 (д, 2H, J=6,3 Гц), 3,40 (c, 1H), 3,20 (c, 3H).
Пример 140: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-фенилтио-6-трифторметил-пиридин-3-ил)-акриламид
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (21 мг, 0,082 ммоль) вводили в реакцию с NMM (0,1 мл), DMTMM (26 мг) и 3-(2-фенилтио-6-трифторметил-пиридин-3-ил)-акриловой кислотой (21 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (18 мг, 53%).
1H ЯМР (300 МГц, CDCl3): 7,88 (д, 1H, J=15,6 Гц), 7,76 (д, 1H, J=7,8 Гц), 7,48 (м, 2H), 7,32 (м, 4H), 7,11 (c, 1H), 6,91 (м, 2H), 6,43 (д, 1H, J=15,3 Гц), 6,42 (c, 1H), 4,52 (д, 2H, J=6,3 Гц), 3,00 (c, 3H).
Пример 141: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид
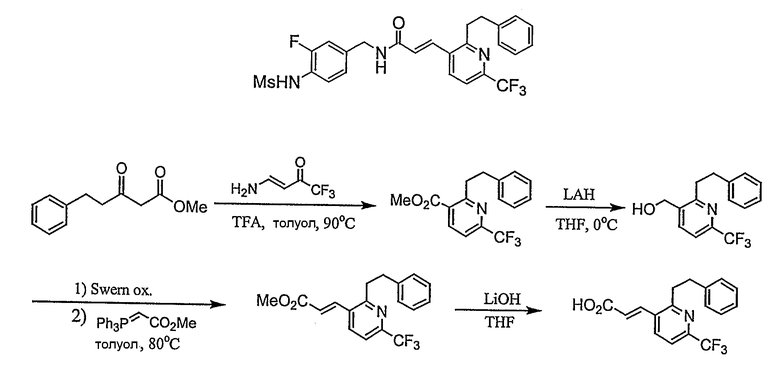
Стадия 1: метиловый эфир 2-фенэтил-4-трифторметил-никотиновой кислоты
К раствору β-кетоэфира (2,43 г, 17,5 ммоль) в толуоле (30 мл) добавляли 4-амино-1,1,1-трифторбутен-2-он (3,60 г, 17,5 ммоль) и трифторуксусную кислоту (1,30 мл, 17,5 ммоль), и полученную смесь перемешивали при 90°C в течение 60 часов. Эту смесь промывали водным 20%-ым раствором Na2CO3 и высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали хроматографией на колонках (Hex/EtOAc=10:1), получая метиловый эфир 2-фенэтил-4-трифторметил-никотиновой кислоты (1,84 г, 41%).
1H ЯМР (300 МГц, CDCl3): δ 8,30 (д, 1H, J=8,1 Гц), 7,59 (д, 1H, J=8,1 Гц), 7,24 (м, 5H), 3,92 (c, 3H), 3,53 (м, 1H), 3,07 (м, 1H).
Стадия 2: 2-фенэтил-4-трифторметил-пиридин-3-илметиловый спирт
К суспензии метилового эфира 2-фенэтил-4-трифторметил-никотиновой кислоты (1,84 г, 5,95 ммоль) в ТГФ (50 мл) добавляли по каплям при 0°C 1,0 M LiAlH4 (6,0 мл, 6,0 ммоль). После перемешивания при 0°C в течение 1 часа реакцию останавливали, добавляя 10%-ый натрийкалийтартрат (50 мл), и полученную смесь энергично перемешивали в течение 1 часа. Две фазы разделяли, и водную фазу экстрагировали простым эфиром. Объединенный органический слой промывали солевым раствором, высушивали над безвод. MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали хроматографией на колонках (Hex/EtOAc=10:1), получая спиртовой продукт (1,55 г, 93%).
1H ЯМР (300 МГц, CDCl3): δ 7,87 (д, 1H, J=8,1 Гц), 7,54 (д, 1H, J=8,1 Гц), 7,20 (м, 5H), 5,59 (д, 2H, J=5,4 Гц), 3,11 (c, 4H).
Стадия 3: 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловая кислота, метиловый эфир
К раствору оксалилхлорида (540 мл, 6,06 ммоль) в CH2Cl2 (30 мл) при -78°C добавляли по каплям ДМСО (860 мл, 12,2 ммоль), и полученный раствор перемешивали в течение 5 минут при -78°C. К реакционной смеси добавляли по каплям раствор спирта, полученного на указанной стадии 2, (1,55 г, 5,51 ммоль) в CH2Cl2 (10 мл). После перемешивания при -78°C в течение 30 минут реакцию останавливали, добавляя триэтиламин (3,84 мл, 27,6 ммоль), и полученную смесь нагревали до комнатной температуры. К реакционной смеси добавляли воду (40 мл), и две фазы разделяли. Водную фазу экстрагировали CH2Cl2. Объединенный органический слой промывали солевым раствором, высушивали над безвод. MgSO4, фильтровали и концентрировали при пониженном давлении с получением альдегидного продукта, который использовали без дальнейшей очистки.
К раствору альдегидного продукта, полученного выше, в толуоле (20 мл) добавляли метил(трифенилфосфоранилиден)ацетат (1,77 г, 5,51 ммоль), и полученную смесь нагревали при 90°C в течение 3 часов. Реакционную смесь разбавляли EtOAc и промывали водой и солевым раствором. Органический слой высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонках (Hex/EtOAc=10/1), получая метиловый эфир 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (1,46 г, 79% 2 стадии).
1H ЯМР (300 МГц, CDCl3): δ 7,88 (д, 1H, J=7,8 Гц), 7,79 (д, 1H, J=15,9 Гц), 7,54 (д, 1H, J=7,8 Гц), 7,20 (м, 5H), 6,30 (д, 1H, J=15,9 Гц), 3,82 (c, 3H), 3,29 (м, 2H), 3,07 (м, 2H).
Стадия 4: 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловая кислота
К суспензии метилового эфира 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (1,46 г, 4,35 ммоль) в ТГФ (3 мл) добавляли 1 н. раствор LiOH (6,0 мл), и смесь перемешивали в течение 3 часов при комнатной температуре. Полученный остаток растворяли в H2O и затем промывали EtOAc, подкисляли 1 н. HCl до рН 1~2. Раствор экстрагировали три раза метиленхлоридом и затем высушивали над безвод. MgSO4, и концентрировали в вакууме, получая 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловую кислоту (1,37 г, 98%).
1H ЯМР (300 МГц, CDCl3): δ 7,91 (м, 2H), 7,58 (д, 1H, J=7,8 Гц), 7,20 (м, 5H), 6,31 (д, 1H, J=15,9 Гц), 3,31 (м, 2H), 3,09 (м, 2H).
Стадия 5: синтез N-(3-фтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламида
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (153 мг, 0,60 ммоль) вводили в реакцию с 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (160 мг, 0,50 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc N-(3-фтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид (174 мг, 67%).
1H ЯМР (300 МГц, ДМСО-d6 + CDCl3): δ 8,70 (c ушир., 1H), 7,91 (м, 2H), 7,82 (д, 1H, J=15,3 Гц), 7,54 (д, 1H, J=8,1 Гц), 7,46 (т, 1H, J=8,1 Гц), 7,20 (м, 7H), 6,51 (д, 1H, J=15,3 Гц), 4,50 (д, 2H, J=5,7 Гц), 3,29 (м, 2H), 3,08 (м, 2H), 3,00 (c, 3H).
ESI [M+H]+: 528.
Пример 142: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (167 мг, 0,60 ммоль) вводили в реакцию с 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (160 мг, 0,50 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (175 мг, 64%).
1H ЯМР (300 МГц, ДМСО-d6 + CDCl3): δ 8,20 (c ушир., 1H), 8,11 (т, 1H), 7,92 (д, 1H, J=8,1 Гц), 7,72 (д, 1H, J=15,3 Гц), 7,55 (д, 1H, J=8,1 Гц), 7,33 (c, 1H), 7,20 (м, 6H), 6,52 (д, 1H, J=15,3 Гц), 4,49 (д, 2H, J=6,0 Гц), 3,47 (c, 1H), 3,29 (м, 2H), 3,18 (c, 3H), 3,08 (м, 2H).
ESI [M+H]+: 546.
Пример 143: 3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (153 мг, 0,60 ммоль) вводили в реакцию с 3-(2-бутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (137 мг, 0,50 ммоль), полученной способом, аналогичным описанному выше, получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (160 мг, 68%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,50 (c ушир, 1H), 8,84 (т, 1H, J=5,7 Гц), 8,16 (д, 1H, J=7,8 Гц), 7,79 (д, 1H, J=8,1 Гц), 7,72 (д, 1H, J=15,3 Гц), 7,35 (т, 1H, J=8,1 Гц), 7,16 (м, 2H), 6,74 (д, 1H, J=15,3 Гц), 4,40 (д, 2H, J=6,3 Гц), 2,99 (c, 3H), 2,94 (м, 2H), 1,60 (м, 2H), 1,35 (м, 2H), 0,90 (т, 3H, J=7,2 Гц).
Пример 144: 3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (167 мг, 0,60 ммоль) вводили в реакцию с 3-(2-бутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (137 мг, 0,50 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (158 мг, 64%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,46 (c ушир., 1H), 8,88 (т, 1H, J=5,7 Гц), 8,18 (д, 1H, J=7,8 Гц), 7,79 (д, 1H, J=8,4 Гц), 7,71 (д, 1H, J=15,6 Гц), 7,29 (м, 2H), 6,74 (д, 1H, J=15,6 Гц), 4,52 (c, 1H), 4,40 (д, 2H, J=5,7 Гц), 3,06 (c, 3H), 2,94 (м, 2H), 1,60 (м, 2H), 1,35 (м, 2H), 0,90 (т, 3H, J=6,9 Гц).
ESI [M+H]+: 498.
Пример 145: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-этинил-6-трифторметил-пиридин-3-ил)-акриламид
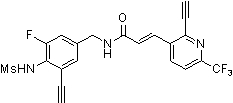
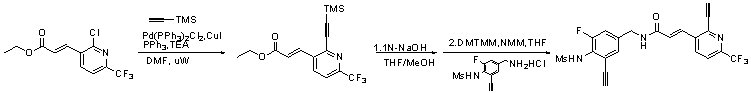
Стадия 1: синтез этилового эфира 3-(6-трифторметил-2-триметилсиланилэтинил-пиридин-3-ил)-акриловой кислоты
В микроволновую ампулу загружали этиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (103 мг, 0,368 ммоль), Pd(PPh3)2Cl2 (0,06 экв.), CuI (0,06 экв.), PPh3 (0,2 экв.), Et3N (15 экв.), (триметилсилил)ацетилен и DMF (0,25 мл). Ампулу облучали в микроволновом синтезаторе при 120°C в течение 25 мин. Содержимое ампулы фильтровали через слой целита, который тщательно промывали EtOAc. Фильтрат упаривали, и остаток очищали хроматографией на колонках, получая этиловый эфир 3-(6-трифторметил-2-триметилсиланилэтинил-пиридин-3-ил)-акриловой кислоты (58 мг, 46%).
1H ЯМР (300 МГц, CDCl3): δ 8,08 (д, 1H, J=16,4 Гц), 8,0 (д, 1H, J=8,1 Гц), 6,55 (д, 1H, J=8,1 Гц), 6,54 (д, 1H, J=16,4 Гц), 4,25 (кв, 2H, J=7,2 Гц), 1,30 (т, 3H, J=7,2 Гц), 0,27 (c, 9H).
Стадия 2: синтез N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-этинил-6-трифторметил-пиридин-3-ил)-акриламида
К суспензии этилового эфира 3-(6-трифторметил-2-триметилсиланилэтинил-пиридин-3-ил)-акриловой кислоты (68 мг, 0,169 ммоль) в ТГФ (1 мл) и CH3OH (0,5 мл) добавляли 1 н. раствор NaOH (0,5 мл), и смесь перемешивали в течение 50 минут при комнатной температуре. Полученный остаток растворяли в H2O и затем промывали три раза EtOAc, подкисляли 1 н. HCl до рН 1~2. Раствор экстрагировали три раза метиленхлоридом и затем высушивали над безвод. Na2SO4, и концентрировали в вакууме, получая 3-(2-этинил-6-трифторметил-пиридин-3-ил)-акриловую кислоту (48 мг, 99%).
К суспензии N-(4-аминометил-2-этинил-6-фтор-фенил)-метансульфонамида, соль HCl, (83 мг, 0,298 ммоль) в ТГФ (3 мл) добавляли N-метилморфолин (0,066 мл, 0,597 ммоль). Смесь перемешивали в течение 5 минут, затем добавляли 3-(2-этинил-6-трифторметил-пиридин-3-ил)-акриловую кислоту (48 мг, 0,065 ммоль) и 4-(4,6-диметокси[1,3,5]триазин-2-ил)-4-метилморфолинийхлорид гидрат (DMTMM 71,4 мг, 0,258 ммоль). Смесь перемешивали в течение ночи при комнатной температуре и концентрировали при пониженном давлении. Остаток разбавляли EtOAc и водой. Органический слой промывали насыщенным бикарбонатом натрия, 1 н. HCl и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали перекристаллизацией из CH2Cl2, получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-этинил-6-трифторметил-пиридин-3-ил)-акриламид (30 мг, 32%).
1H ЯМР (300 МГц, ДМСО): δ 9,46 (c, 1H, ушир.), 8,94 (т, 1H, J=5,4 Гц), 8,39 (д, 1H, J=8,4 Гц), 8,00 (д, 1H, J=8,4 Гц), 7,83 (д, 1H, J=15,9 Гц), 7,30 (c, 1H), 7,28 (д, 1H, J=7,8 Гц), 6,97 (д, 1H, J=15,9 Гц), 4,94 (c, 1H), 4,51 (c, 1H), 4,41 (д, 2H, J=5,7 Гц), 3,06 (c, 3H).
Пример 146: отсутствует
Пример 147: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид
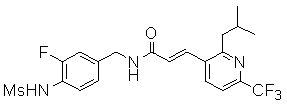
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (153 мг, 0,60 ммоль) вводили в реакцию с 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (137 мг, 0,50 ммоль), полученной способом, аналогичным описанному выше, получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (151 мг, 64%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,55 (c ушир., 1H), 8,83 (т, 1H), 8,17 (д, 1H, J=8,1 Гц), 7,79 (д, 1H, J=7,8 Гц), 7,72 (д, 1H, J=15,3 Гц), 7,35 (т, 1H, J=8,4 Гц), 7,16 (м, 2H), 6,74 (д, 1H, J=15,3 Гц), 4,40 (д, 2H, J=5,7 Гц), 3,00 (c, 3H), 2,83 (д, 2H, J=6,9 Гц), 2,01 (м, 1H), 0,89 (т, 6H, J=6,6 Гц).
Пример 148: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид
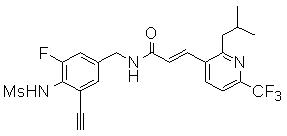
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (167 мг, 0,60 ммоль) вводили в реакцию с 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (137 мг, 0,50 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (153 мг, 62%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,46 (c ушир., 1H), 8,86 (т, 1H, J=5,7 Гц), 8,19 (д, 1H, J=8,1 Гц), 7,79 (д, 1H, J=8,1 Гц), 7,72 (д, 1H, J=15,3 Гц), 7,29 (м, 2H), 6,74 (д, 1H, J=15,3 Гц), 4,50 (c, 1H), 4,41 (д, 2H, J=5,7 Гц), 3,07 (c, 3H), 2,83 (д, 2H, J=7,2 Гц), 2,01 (м, 1H), 0,89 (т, 6H, J=6,6 Гц).
ESI [M+H]+: 498.
Пример 149: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриламид
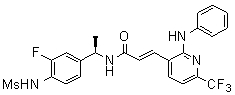
(R)-N-[4-(1-Амино-этил)-2-фторфенил]-метансульфонамид, соль HCl (78 мг, 0,29 ммоль) вводили в реакцию с 3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (90 мг, 0,29 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (120 мг, 80%).
1H ЯМР (300 МГц, ДМСО-d6): δ 8,34 (д, 1H, J=8,1 Гц), 8,12 (c, 1H), 7,72 (м, 5H), 7,40 (м, 1H), 7,29 (м, 2H), 7,15 (м, 3H), 7,01 (м, 1H), 6,66 (д, 1H, J=15,6 Гц), 5,16 (кв, 1H, J=6,6 Гц), 2,93 (c, 3H), 1,51 (д, 3H, J=6,9 Гц).
Пример 150: 3-(2-этил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
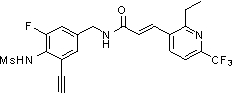
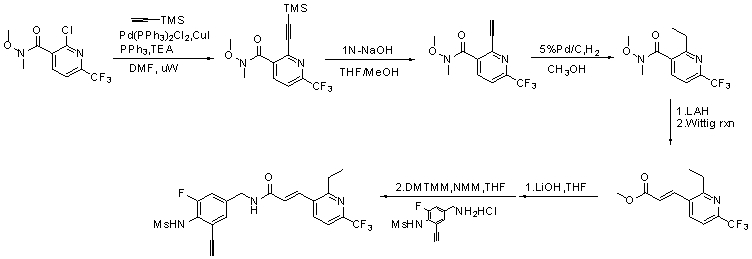
Стадия 1: синтез N-метокси-N-метил-6-трифторметил-2-триметилсиланилэтинил-никотинамида
N-Метокси-N-метил-6-трифторметил-2-триметилсиланилэтинил-никотинамид получали согласно общей процедуре, описанной в примере 145 (стадия 1).
2-Хлор-N-метокси-N-метил-6-трифторметил-никотинамид (1,2 г, 4,52 ммоль) вводили в реакцию с (триметилсилил)ацетиленом (0,689 мл, 4,97 ммоль), получая N-метокси-N-метил-6-трифторметил-2-триметилсиланилэтинил-никотинамид (896 мг, 60%).
1H ЯМР (300 МГц, CDCl3): δ 7,83 (д, 1H, J=7,8 Гц), 7,66 (д, 1H, J=7,8 Гц), 3,51 (c, 3H), 3,39 (c, 3H), 0,26 (c, 9H).
Стадия 2: синтез 2-этинил-N-метокси-N-метил-6-трифторметил-никотинамида
К суспензии N-метокси-N-метил-6-трифторметил-2-триметилсиланилэтинил-никотинамида (148 г, 0,449 ммоль) в ТГФ (1 мл) и CH3OH (0,5 мл) добавляли 1 н. раствор NaOH (0,5 мл), и смесь перемешивали в течение 50 минут при комнатной температуре. Полученный остаток растворяли в H2O и затем промывали три раза EtOAc, подкисляли 1 н. HCl до рН 1~2. Раствор экстрагировали три раза метиленхлоридом и затем высушивали над безвод. Na2SO4, и концентрировали в вакууме, получая 2-этинил-N-метокси-N-метил-6-трифторметил-никотинамид (116 мг, 99%).
1H ЯМР (300 МГц, CDCl3): δ 7,82 (д, 1H, J=7,8 Гц), 7,65 (д, 1H, J=7,8 Гц), 3,69 (c, 3H), 3,45 (c, 3H).
Стадия 3: синтез 2-этил-N-метокси-N-метил-6-трифторметил-никотинамид
К суспензии 2-этинил-N-метокси-N-метил-6-трифторметил-никотинамида (145 мг, 0,561 ммоль) в 5%-ом Pd/C (30 мг) добавляли CH3OH (4 мл). Смесь продували три раза газообразным водородом (50 psi) и взбалтывали в течение 2 часов при комнатной температуре. Реакционную смесь фильтровали через слой целита и концентрировали при пониженном давлении. Сырой остаток хроматографировали, получая 2-этил-N-метокси-N-метил-6-трифторметил-никотинамид (112 мг, 76%).
1H ЯМР (300 МГц, CDCl3): δ 7,75 (д, 1H, J=7,8 Гц), 7,54 (д, 1H, J=7,8 Гц), 3,43 (c, 3H), 3,39 (c, 3H), 2,89 (кв, 2H, J=7,5 Гц), 1,33 (т, 3H, J=7,5 Гц).
Стадия 4: метиловый эфир 3-(2-этил-6-трифторметил-пиридин-3-ил)-акриловой кислоты
К охлажденному (-78°C) раствору 2-этил-N-метокси-N-метил-6-трифторметил-никотинамида (113 мг, 0,43 ммоль) в ТГФ (4 мл) добавляли литий-алюминийгидрид (1M LAH в ТГФ, 0,22 мл). Смесь перемешивали в течение 15 минут и затем нагревали до -10°C. После дополнительного перемешивания в течение 30 минут смесь гасили насыщенным раствором гидросульфата калия (1 мл) и экстрагировали простым диэтиловым эфиром. Органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая 2-этил-6-трифторметил-пиридин-3-карбальдегид количественно в форме масла. Сырой продукт использовали непосредственно в следующей реакции.
К раствору 2-этил-6-трифторметил-пиридин-3-карбальдегида в толуоле (10 мл) добавляли метил(трифенилфосфоранилиден)ацетат (172 мг, 0,516 ммоль). Смесь нагревали при 110°C в течение ночи, охлаждали до комнатной температуры и разбавляли EtOAc и водой. Органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали хроматографией на колонках (EtOAc/гексаны=1/4), получая метиловый эфир 3-(2-этил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (89 мг, 80%).
1H ЯМР (300 МГц, CDCl3): δ 7,95 (д, 1H, J=15,9 Гц), 7,94 (д, 1H, J=7,8 Гц), 7,54 (д, 1H, J=8,1 Гц), 6,44 (д, 1H, J=15,9 Гц), 3,85 (c, 3H), 3,02 (кв, 2H, J=7,5 Гц), 1,31 (т, 3H, J=7,5 Гц).
Стадия 5: 3-(2-этил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
3-(2-Этил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид получали согласно общей процедуре, описанной в примере 107 (стадия 2).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (74 мг, 0,263 ммоль) вводили в реакцию с 3-(2-этил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (43 мг, 0,175 ммоль), получая 3-(2-этил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (45 мг, 37%).
1H ЯМР (300 МГц, ДМСО): δ 9,45 (c, 1H, ушир.), 8,87 (т, 1H, J=6,0 Гц), 8,18 (д, 1H, J=8,1 Гц), 7,79 (д, 1H, J=8,1 Гц), 7,71 (д, 1H, J=15,6 Гц), 7,30 (c, 1H), 7,28 (д, 1H, J=8,4 Гц), 6,74 (д, 1H, J=15,6 Гц), 4,51 (c, 1H), 4,40 (д, 2H, J=5,7 Гц), 3,00 (c, 3H), 2,96 (кв, 2H, J=7,5 Гц), 1,21 (т, 3H, J=7,5 Гц).
Пример 151: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид
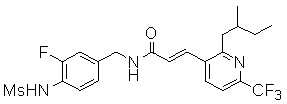
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (153 мг, 0,60 ммоль) вводили в реакцию с 3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (144 мг, 0,50 ммоль), полученной способом, аналогичным описанному выше, получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (176 мг, 72%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,55 (c ушир., 1H), 8,83 (т, 1H), 8,17 (д, 1H, J=8,1 Гц), 7,79 (д, 1H, J=7,8 Гц), 7,72 (д, 1H, J=15,3 Гц), 7,35 (т, 1H, J=8,4 Гц), 7,16 (м, 2H), 6,74 (д, 1H, J=15,3 Гц), 4,40 (д, 2H, J=5,7 Гц), 3,00 (c, 3H), 2,97 (м, 1H), 2,70 (м, 1H), 1,80 (м, 1H), 1,30 (м, 2H), 0,87 (т, 3H, J=7,2 Гц), 0,81 (д, 3H, J=6,6 Гц).
Пример 152: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (167 мг, 0,60 ммоль) вводили в реакцию с 3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (144 мг, 0,50 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (175 мг, 68%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,45 (c ушир., 1H), 8,85 (т, 1H, J=5,7 Гц), 8,19 (д, 1H, J=8,4 Гц), 7,79 (д, 1H, J=8,1 Гц), 7,72 (д, 1H, J=15,6 Гц), 7,28 (м, 2H), 6,74 (д, 1H, J=15,6 Гц), 4,52 (c, 1H), 4,41 (д, 2H, J=6,0 Гц), 3,07 (c, 3H), 2,97 (м, 1H), 2,70 (м, 1H), 1,80 (м, 1H), 1,30 (м, 2H), 0,87 (т, 3H, J=7,2 Гц), 0,81 (д, 3H, J=6,6 Гц).
ESI [M+H]+: 512.
Пример 153: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-проп-1-инил)-6-трифторметил-пиридин-3-ил]-акриламид
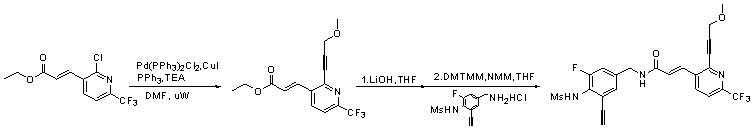
Стадия 1: синтез N-метокси-N-метил-6-трифторметил-2-триметилсиланилэтинил-никотинамида
N-Метокси-N-метил-6-трифторметил-2-триметилсиланилэтинил-никотинамид получали согласно общей процедуре, описанной в примере 145 (стадия 1).
2-Хлор-N-метокси-N-метил-6-трифторметил-никотинамид (128 мг, 0,457 ммоль) вводили в реакцию с 3-метоксипропином (0,042 мг, 0,504 ммоль), получая этиловый эфир 3-[2-(3-метокси-проп-1-инил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты (89 мг, 62%).
1H ЯМР (300 МГц, CDCl3): δ 8,11 (д, 1H, J=16,2 Гц), 8,08 (д, 1H, J=9,0 Гц), 7,66 (д, 1H, J=9,0 Гц), 6,60 (д, 1H, J=16,2 Гц), 4,44 (c, 2H), 4,30 (д, 2H, J=7,2 Гц), 3,53 (c, 3H), 1,36 (т, 3H, J=7,2 Гц).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-проп-1-инил)-6-трифторметил-пиридин-3-ил]-акриламид
N-(3-Этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-проп-1-инил)-6-трифторметил-пиридин-3-ил]-акриламид получали согласно общей процедуре, описанной в примере 107 (стадия 2).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (59 мг, 0,21 ммоль) вводили в реакцию с 3-[2-(3-метокси-проп-1-инил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (40 мг, 0,14 ммоль), получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-проп-1-инил)-6-трифторметил-пиридин-3-ил]-акриламид (35 мг, 33%).
1H ЯМР (300 МГц, CDCl3): δ 8,04 (д, 1H, J=7,2 Гц), 8,00 (д, 1H, J=16,5 Гц), 7,62 (д, 1H, J=8,1 Гц), 7,22 (c, 1H), 7,09 (дд, 1H, J=10,8, 1,8 Гц), 6,73 (д, 1H, J=15,9 Гц), 6,68 (д, 1H, J=5,7 Гц), 6,61 (c, 1H), 4,47 (д, 2H, J=5,7 Гц), 4,40 (c, 2H), 3,47 (c, 3H), 3,24 (c, 3H).
Пример 154: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-проп-1-инил)-6-трифторметил-пиридин-3-ил]-акриламид
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (19,1 мг, 0,075 ммоль) вводили в реакцию с 3-[2-(3-метокси-проп-1-инил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (18 мг, 0,063 ммоль), получая N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-проп-1-инил)-6-трифторметил-пиридин-3-ил]-акриламид (35 мг, 33%).
1H ЯМР (300 МГц, CDCl3): δ 8,04 (д, 1H, J=16,2 Гц), 8,01 (д, 1H, J=7,2 Гц), 7,63 (д, 1H, J=8,1 Гц), 7,52 (т, 1H, J=8,1 Гц), 7,17-7,11 (м, 2H), 6,73 (д, 1H, J=15,6 Гц), 6,56 (c, 1H), 6,22 (т, 1H, J=6,0 Гц), 4,56 (д, 2H, J=6,0 Гц), 4,42 (c, 2H), 3,48 (c, 3H), 3,03 (c, 3H).
Пример 155: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриламид
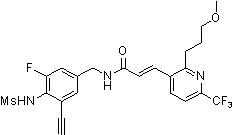
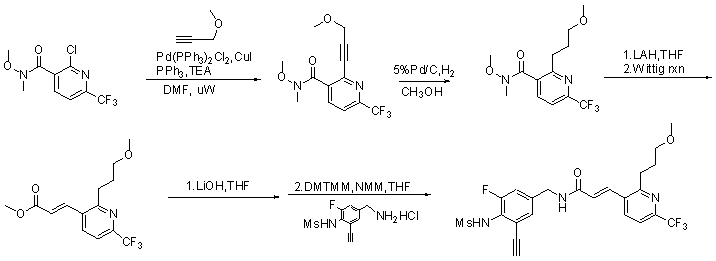
Стадия 1: синтез N-метокси-2-(3-метокси-проп-1-инил)-N-метил-6-трифторметил-никотинамида
N-Метокси-2-(3-метокси-проп-1-инил)-N-метил-6-трифторметил-никотинамид получали согласно общей процедуре, описанной в примере 145 (стадия 1).
2-Хлор-N-метокси-N-метил-6-трифторметил-никотинамид (1000 мг, 3,72 ммоль) вводили в реакцию с 3-метоксипропином (0,345 мл, 4,09 ммоль), получая N-метокси-2-(3-метокси-проп-1-инил)-N-метил-6-трифторметил-никотинамид (247 мг, 22%).
1H ЯМР (300 МГц, CDCl3): δ 7,87 (д, 1H, J=7,8 Гц), 7,68 (д, 1H, J=7,8 Гц), 4,35 (c, 3H), 3,51 (c, 3H), 3,44 (c, 3H), 3,41 (c, 3H).
Стадия 2: синтез N-метокси-2-(3-метоксипропил)-N-метил-6-трифторметил-никотинамида
К суспензии N-метокси-2-(3-метокси-проп-1-инил)-N-метил-6-трифторметил-никотинамида (247 мг, 0,817 ммоль) в 5%-ом Pd/C (50 мг) добавляли CH3OH (6 мл). Смесь продували три раза газообразным водородом (50 psi) и взбалтывали в течение 2 часов при комнатной температуре. Реакционную смесь фильтровали через слой целита и концентрировали при пониженном давлении. Сырой остаток хроматографировали, получая N-метокси-2-(3-метоксипропил)-N-метил-6-трифторметил-никотинамид (160 мг, 64%).
1H ЯМР (300 МГц, CDCl3): δ 7,74 (д, 1H, J=7,8 Гц), 7,68 (д, 1H, J=7,8 Гц), 3,46-3,34 (м, 8H), 3,32 (c, 3H), 2,93 (т, 2H, J=7,8 Гц), 2,12-2,03 (м, 2H).
Стадия 3: синтез метилового эфира 3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты
Метиловый эфир 3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты получали согласно общей процедуре, описанной в примере 150 (стадия 4).
N-Метокси-2-(3-метоксипропил)-N-метил-6-трифторметил-никотинамид (156 мг, 0,509 ммоль) вводили в реакцию с 1M LAH в растворе ТГФ, получая 2-(3-метоксипропил)-6-трифторметил-пиридин-3-карбальдегид количественно в форме масла. Сырой продукт использовали непосредственно в следующей реакции. 2-(3-Метоксипропил)-6-трифторметил-пиридин-3-карбальдегид вводили в реакцию с метил(трифенилфосфоранилиден)ацетатом (204 мг, 0,61 ммоль), получая метиловый эфир 3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриловой кислоты (124 мг, 80%).
1H ЯМР (300 МГц, CDCl3): δ 7,98 (д, 1H, J=15,9 Гц), 7,93 (д, 1H, J=7,8 Гц), 7,53 (д, 1H, J=7,8 Гц), 6,43 (д, 1H, J=15,9 Гц), 3,84 (c, 3H), 3,43 (т, 2H, J=6,0 Гц), 3,33 (c, 3H), 3,09-3,04 (м, 2H), 2,09-1,99 (м, 2H).
Стадия 4: синтез N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриламида
N-(3-Этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриламид получали согласно общей процедуре, описанной в примере 107 (стадия 2).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (57,9 мг, 0,207 ммоль) вводили в реакцию с 3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (40 мг, 0,138 ммоль), получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриламид (18 мг, 17%).
1H ЯМР (300 МГц, CDCl3): δ 7,92 (д, 1H, J=15,9 Гц), 7,90 (д, 1H, J=8,1 Гц), 7,52 (д, 1H, J=8,1 Гц), 7,27 (д, 1H, J=5,4 Гц), 7,16 (дд, 1H, J=9,0, 1,8 Гц), 6,48 (д, 1H, J=11,7 Гц), 6,41-6,36 (м, 2H), 4,51 (д, 2H, J=5,7 Гц), 3,47-3,42 (м, 3H), 3,31 (c, 3H), 3,26 (c, 3H), 3,09-3,04 (м, 2H), 2,07-1,98 (м, 2H).
Пример 156: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриламид
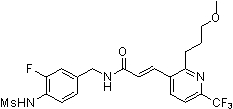
N-(3-Фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриламид получали согласно общей процедуре, описанной в примере 107 (стадия 2).
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (21 мг, 0,083 ммоль) вводили в реакцию с 3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (20 мг, 0,096 ммоль), получая N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-метоксипропил)-6-трифторметил-пиридин-3-ил]-акриламид (18 мг, 17%).
1H ЯМР (300 МГц, CDCl3): δ 7,93 (д, 1H, J=15,0 Гц), 7,89 (д, 1H, J=7,4 Гц), 7,55-7,49 (м, 2H), 7,17-7,10 (м, 2H), 6,59 (c, 1H), 6,43 (д, 1H, J=15,6 Гц), 6,27 (т, 1H, J=6,0 Гц), 4,55 (д, 2H, J=6,0 Гц), 3,44 (т, 2H, J=2,0 Гц), 3,31 (c, 3H), 3,09-3,04 (м, 2H), 3,02 (c, 3H), 2,07-1,98 (м, 2H).
Пример 157: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-стирил-6-трифторметил-пиридин-3-ил)-акриламид
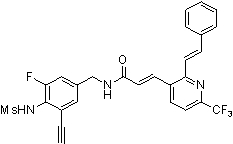
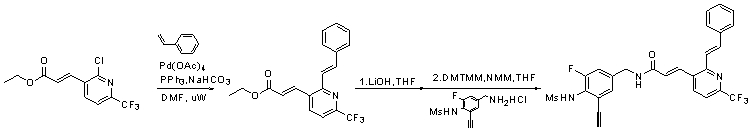
Стадия 1: синтез этилового эфира 3-(2-стирил-6-трифторметил-пиридин-3-ил)-акриловой кислоты
В микроволновую ампулу загружали этиловый эфир 3-(2-хлор-6-трифторметил-пиридин-3-ил)-акриловой кислоты (100 мг, 0,357 ммоль), Pd(OAc)4 (0,05 экв.), NaHCO3 (2 экв.), PPh3 (0,5 экв.), стирол (5 экв.) и DMF (1 мл). Ампулу облучали в микроволновом синтезаторе при 135°C в течение 3 часов. Содержимое ампулы фильтровали через слой целита, который тщательно промывали EtOAc. Фильтрат упаривали, и остаток очищали хроматографией на колонках, получая этиловый эфир 3-(2-стирил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (37 мг, 20%).
1H ЯМР (300 МГц, CDCl3): δ 8,10 (д, 1H, J=15,6 Гц), 7,95 (д, 1H, J=15,6 Гц), 7,93 (д, 1H, J=7,8 Гц), 7,63 (д, 1H, J=7,2 Гц), 7,52 (д, 1H, J=7,8 Гц), 7,43-7,34 (м, 5H), 6,45 (д, 1H, J=15,9 Гц), 4,32 (кв, 2H, J=7,2 Гц), 1,36 (т, 3H, J=7,2 Гц).
Стадия 2: синтез N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-стирил-6-трифторметил-пиридин-3-ил)-акриламида
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (36 мг, 0,127 ммоль) вводили в реакцию с 3-(2-стирил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (37 мг, 0,115 ммоль), получая N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-стирил-6-трифторметил-пиридин-3-ил)-акриламид (38 мг, 55%).
1H ЯМР (300 МГц, ДМСО): δ 9,45 (c, 1H, ушир.), 8,91 (т, 1H, J=6,0 Гц), 8,23 (д, 1H, J=8,1 Гц), 7,97 (д, 1H, J=15,9 Гц), 7,82-7,74 (м, 4H), 7,61 (д, 1H, J=15,9 Гц), 7,46-7,29 (м, 5H), 6,75 (д, 1H, J=15,6 Гц), 4,51 (c, 1H), 4,42 (д, 2H, J=5,7 Гц), 3,07 (c, 3H).
Пример 158: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(N-метил-N-пропил-амино)-6-трифторметил-пиридин-3-ил]-акриламид
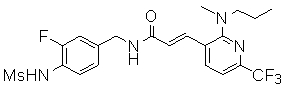
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (53 мг, 0,21 ммоль) вводили в реакцию с 3-[2-(метил-пропил-амино)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (50 мг, 0,18 ммоль), получая целевое соединение (62 мг, 71%) после очистки хроматографией на колонках (Hex/EtOAc=2/3).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,56 (c ушир., 1H), 8,75 (т, 1H), 8,17 (д, 1H), 7,92 (д, 1H, J=7,2 Гц), 7,49 (д, 1H, J=15,6 Гц), 7,20 (м, 4H), 6,63 (д, 1H, J=15,6 Гц), 4,39 (д, 2H, J=5,1 Гц), 3,21 (м, 2H), 3,00 (c, 3H), 2,91 (c, 3H), 1,63 (м, 2H), 0,81 (т, 3H, J=4,8 Гц).
Пример 159: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(N-метил-N-пропил-амино)-6-трифторметил-пиридин-3-ил]-акриламид
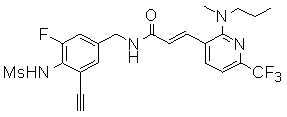
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (93 мг, 0,33 ммоль) вводили в реакцию с 3-[2-(метил-пропил-амино)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (80 мг, 0,28 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (96 мг, 57%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,46 (c ушир., 1H), 8,78 (т, 1H, J=5,3 Гц), 7,93 (д, 1H, J=7,5 Гц), 7,49 (д, 1H, J=15,6 Гц), 7,28 (м, 3H), 6,63 (д, 1H, J=15,6 Гц), 4,51 (c, 1H), 4,40 (д, 2H, J=5,7 Гц), 3,21 (м, 2H), 3,07 (c, 3H), 2,91 (c, 3H), 1,63 (м, 2H), 0,81 (т, 3H, J=7,5 Гц).
Пример 160: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-этоксиметил-6-трифторметил-пиридин-3-ил)-акриламид
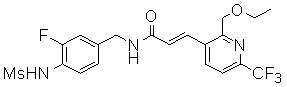
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (53 мг, 0,21 ммоль) вводили в реакцию с 3-(2-этоксиметил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (52 мг, 0,19 ммоль), полученной способом, аналогичным описанному выше, получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (53 мг, 59%).
1H ЯМР (300 МГц, ДМСО-d6 + CDCl3): δ 8,03 (м, 2H), 7,86 (т, 1H), 7,65 (д, 1H, J=7,8 Гц), 7,46 (т, 1H, J=7,8 Гц), 7,13 (м, 2H), 6,64 (д, 1H, J=15,3 Гц), 4,77 (c, 2H), 4,52 (д, 2H, J=5,7 Гц), 3,66 (кв, 2H, J=6,9 Гц), 3,01 (c, 3H), 1,25 (т, 3H, J=6,9 Гц).
Пример 161: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-этоксиметил-6-трифторметил-пиридин-3-ил)-акриламид
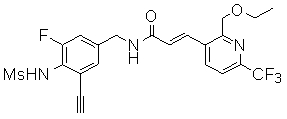
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (140 мг, 0,50 ммоль) вводили в реакцию с 3-(2-этоксиметил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (125 мг, 0,45 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (141 мг, 63%).
1H ЯМР (300 МГц, ДМСО-d6 + CDCl3): δ 8,41 (c, 1H), 8,20 (т, 1H), 8,01 (д, 1H, J=7,8 Гц), 7,94 (д, 1H, J=15,6 Гц), 7,61 (д, 1H, J=8,1 Гц), 7,27 (c, 1H), 7,14 (д, 1H, J=10,2 Гц), 6,51 (д, 1H, J=15,6 Гц), 4,71 (c, 2H), 4,4 (д, 2H, J=5,7 Гц), 3,60 (кв, 2H, J=6,9 Гц), 3,11 (c, 3H), 1,19 (т, 3H, J=6,9 Гц).
Пример 162: 3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид
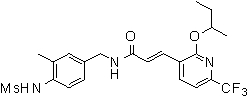
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (43 мг, 0,156 ммоль) вводили в реакцию с NMM (0,1 мл), DMTMM (44 мг) и 3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (42 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (52,7 мг, 75%).
1H ЯМР (300 МГц, CDCl3): δ 7,80 (д, 1H, J=7,8 Гц), 7,75 (д, 1H, J=16,2 Гц), 7,41 (д, 2H, J=8,1 Гц), 7,21 (м, 3H), 6,70 (д, 2H, J=15,6 Гц), 6,19 (c, 1H), 5,95 (т, 1H), 4,53 (д, 2H, J=6,0 Гц), 3,02 (c, 3H), 2,32 (c, 3H), 1,75 (м, 2H), 1,36 (д, 3H, J=6,0 Гц), 0,97 (т, 3H, J=7,2 Гц).
Пример 163: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид
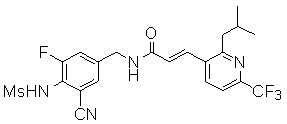
N-(4-Аминометил-6-циано-2-фтор-фенил)-метансульфонамид, соль HCl (101 мг, 0,36 ммоль) вводили в реакцию с 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (82 мг, 0,30 ммоль), получая после очистки кристаллизацией из метиленхлорида целевое соединение (102 мг, 68%).
1H ЯМР (300 МГц, ДМСО-d6): δ 8,78 (т, 1H), 8,04 (д, 1H, J=8,4 Гц), 7,81 (м, 2H), 7,60 (д, 1H, J=7,8 Гц), 7,53 (c, 1H), 7,47 (д, 1H, J=10,2 Гц), 6,67 (д, 1H, J=15,6 Гц), 4,51 (д, 2H, J=5,4 Гц), 3,12 (c, 3H), 2,86 (д, 2H, J=7,5 Гц), 2,15 (м, 1H), 0,93 (д, 6H, J=6,6 Гц).
Пример 164: N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид
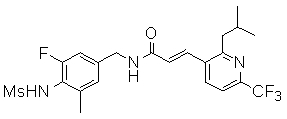
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (89 мг, 0,33 ммоль) вводили в реакцию с 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (82 мг, 0,30 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (116 мг, 79%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,30 (c ушир., 1H), 8,78 (т, 1H), 8,15 (д, 1H, J=8,4 Гц), 7,79 (д, 1H, J=8,1 Гц), 7,70 (д, 1H, J=15,6 Гц), 7,13 (м, 2H), 6,74 (д, 1H, J=15,6 Гц), 4,42 (д, 2H, J=5,7 Гц), 2,97 (c, 3H), 2,82 (д, 2H, J=7,2 Гц), 2,20 (д, 3H, J=2,1 Гц), 2,10 (м, 1H), 0,88 (д, 6H, J=6,6 Гц).
ESI [M+H]+: 488.
Пример 165: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(метил-фениламино)-6-трифторметил-пиридин-3-ил]-акриламид
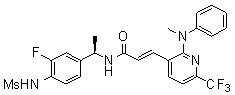
(R)-N-[4-(1-аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (46 мг, 0,17 ммоль) вводили в реакцию с 2-метил-фениламино-6-трифторметил-пиридин-3-ил-акриловой кислотой (55 мг, 0,17 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=3/2) целевое соединение (45 мг, 49%).
1H ЯМР (300 МГц, CDCl3): δ 7,66 (м, 1H), 7,53 (м, 1H), 7,23 (м, 4H), 7,03 (м, 4H), 6,89 (д, 1H, J=15,9 Гц), 6,47 (c ушир., 1H), 6,03 (д, 1H, J=16,2 Гц), 5,16 (д, 1H, J=7,5 Гц), 5,00 (кв, 1H, J=7,2 Гц), 3,53 (c, 3H), 3,04 (c, 3H), 1,40 (д, 3H, J=6,9 Гц).
Пример 166: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(метил-фениламино)-6-трифторметил-пиридин-3-ил]-акриламид
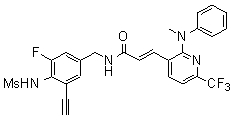
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (47 мг, 0,17 ммоль) вводили в реакцию с 3-(2-метил-фениламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (55 мг, 0,17 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) целевое соединение (30 мг, 32%).
1H ЯМР (300 МГц, CDCl3): δ 7,65 (м, 1H), 7,20 (м, 4H), 7,00 (м, 5H), 6,43 (c ушир., 1H), 6,02 (д, 1H, J=16,2 Гц), 5,31 (c ушир., 1H), 4,32 (д, 2H, J=6,0 Гц), 3,52 (c, 3H), 3,48 (c, 1H), 3,29 (c, 3H).
ESI [M+H]+: 547.
Пример 167: N-(4-метансульфониламино-3-метил-бензил)-3-[2-(метил-фениламино)-6-трифторметил-пиридин-3-ил]-акриламид
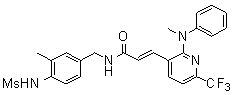
N-(4-Аминометил-3-метил-фенил)-метансульфонамид, соль HCl (46 мг, 0,17 ммоль) вводили в реакцию с 3-(2-метил-фениламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (55 мг, 0,17 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (32 мг, 36%).
1H ЯМР (300 МГц, CDCl3): δ 7,66 (м, 1H), 7,42 (м, 1H), 7,08 (м, 9H), 6,18 (c ушир., 1H), 6,05 (д, 1H, J=16,2 Гц), 5,25 (c ушир., 1H), 4,31 (д, 2H, J=5,7 Гц), 3,51 (c, 3H), 3,04 (c, 3H), 2,33 (c, 3H).
Пример 168: 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-трифторметил-бензил)-акриламид
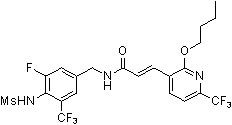
N-(4-Аминометил-2-фтор-6-трифторметил-фенил)-метансульфонамид, соль HCl (68 мг, 0,21 ммоль) вводили в реакцию с 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (51 мг, 0,17 ммоль), получая 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-трифторметил-бензил)-акриламид (80 мг, 68%).
1H ЯМР (300 МГц, CDCl3): δ 7,82 (д, 1H, J=7,5 Гц), 7,76 (д, 1H, J=15,9 Гц), 7,40-7,23 (м, 3H), 6,76 (д, 1H, J=15,6 Гц), 6,37-6,34 (м, 2H), 4,57 (д, 2H, J=6,0 Гц), 4,48-4,44 (м, 2H), 3,27 (c, 3H), 1,83-1,76 (м, 2H), 1,51-1,44 (м, 2H), 0,97 (т, 3H, J=7,5 Гц).
Пример 169: (R)-3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид
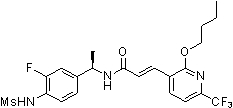
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (57 мг, 0,21 ммоль) вводили в реакцию с 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (51 мг, 0,17 ммоль), получая (R)-3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид (57 мг, 54%).
1H ЯМР (300 МГц, CDCl3): δ 7,80 (д, 1H, J=7,5 Гц), 7,73 (д, 1H, J=15,6 Гц), 7,24 (д, 1H, J=8,4 Гц), 7,16 (д, 2H, J=9,6 Гц), 6,69 (д, 1H, J=15,9 Гц), 6,53 (c, 1H), 5,87 (д, 1H, J=7,5 Гц), 5,24-5,19 (м, 1H), 4,46 (т, 2H, J=6,9 Гц), 3,02 (c, 3H), 1,86-1,76 (м, 2H), 1,56-1,45 (м, 5H), 0,9 (т, 3H, J=7,5 Гц).
Пример 170: 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид
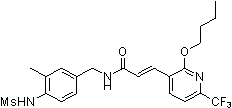
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (58 мг, 0,21 ммоль) вводили в реакцию с 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-акриловой кислотой (51 мг, 0,17 ммоль), получая 3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид (58 мг, 57%).
1H ЯМР (300 МГц, CDCl3): δ 7,76 (д, 1H, J=9,9 Гц), 7,71 (д, 1H, J=16,5 Гц), 7,35 (дд, 1H, J=5,7, 2,4 Гц), 7,21-7,11 (м, 3H), 6,68 (дд, 1H, J=13,4, 2,7 Гц), 6,28 (c, 1H), 6,00 (c, 1H), 4,49-4,38 (м, 4H), 2,96 (c, 3H), 2,26 (c, 3H), 1,79-1,74 (м, 2H), 1,47-1,40 (м, 2H), 0,92 (т, 3H, J=7,2 Гц).
Пример 171: 3-(2-этилтио-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
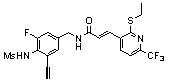
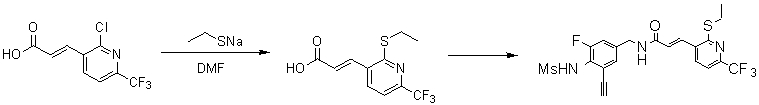
Стадия 1: 3-(2-этилтио-6-трифторметил-пиридин-3-ил)-акриловая кислота
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (214 мг, 0,850 ммоль) и метоксид натрия (95 мг, 1,13 ммоль) добавляли в микроволновую ампулу. Ампулу облучали в синтезаторе Biotage при 200°C в течение 10 мин. Реакционную смесь очищали, получая целевое соединение (15 мг) (Hex/EtOAc=5/1).
1H ЯМР (300 МГц, CDCl3): δ 7,92 (д, 1H), 7,75 (д, 1H), 7,25 (д, 1H), 6,38 (д, 1H), 3,23 (кв, 2H), 1,37 (т, 3H).
Стадия 2: 3-(2-этилтио-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
N-(4-Аминометил-2-фтор-6-этинил-фенил)-метансульфонамид, соль HCl (67 мг, 0,240 ммоль) вводили в реакцию с NMM (0,2 мл), DMTMM (65 мг) и 3-(2-этилтио-6-трифторметил-пиридин-3-ил)-акриловой кислотой (56 мг, 0,200 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (22 мг, 21%).
1H ЯМР (300 МГц, CDCl3): δ 7,92 (д, 1H, J=7,5 Гц), 7,75 (д, 1H, J=15,3 Гц), 7,50 (д, 1H, J=7,5 Гц), 7,28 (д, 1H, J=7,8 Гц), 7,08 (м, 1H), 6,44 (д, 1H, J=15,6 Гц), 6,37 (т, 1H), 4,44 (д, 2H, J=5,7 Гц), 3,40 (c, 1H), 3,21 (т, 2H, J=7,2 Гц), 3,02 (c, 3H), 1,32 (т, 3H, J=7,2 Гц).
Пример 172: N-(4-метансульфониламино-3-метил-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид
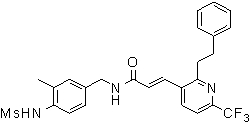
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (57,8 мг, 0,210 ммоль) вводили в реакцию с NMM (0,15 мл), DMTMM (64,8 мг) и 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (76 мг, 0,236 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (61,5 мг, 57%).
1H ЯМР (300 МГц, CDCl3): δ 7,83 (д, 1H, J=8,7 Гц), 7,79 (д, 1H, J=15,6 Гц), 7,51 (д, 1H, J=8,4 Гц), 7,41 (д, 1H, J=8,4 Гц), 7,20 (м, 5H), 6,30 (c, 1H), 6,25 (д, 1H, J=15,3 Гц), 5,99 (т, 1H), 4,51 (д, 2H, J=6,0 Гц), 3,28 (т, 2H, J=8,4 Гц), 3,06 (т, 2H, J=8,4 Гц), 3,01 (c, 3H).
ESI [M+H]+: 518.
Пример 173: N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид
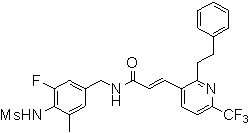
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (56 мг, 0,208 ммоль) вводили в реакцию с NMM (0,15 мл), DMTMM (62,4 мг) и 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (74 мг, 0,230 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (62 мг, 56%).
1H ЯМР (300 МГц, CDCl3): δ 7,82 (д, 1H, J=8,1 Гц), 7,76 (д, 1H, J=15,6 Гц), 7,50 (д, 1H, J=7,8 Гц), 7,20 (м, 6H), 6,62 (c, 1H), 6,25 (д, 1H, J=15,6 Гц), 6,18 (т, 1H), 4,55 (д, 2H, J=5,4 Гц), 3,26 (т, 2H, J=8,4 Гц), 3,05 (т, 2H, J=8,4 Гц), 3,01 (c, 3H), 2,23 (д, 3H, J=2,1 Гц).
Пример 174: 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид
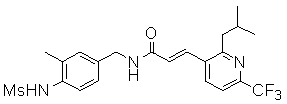
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (47 мг, 0,17 ммоль) вводили в реакцию с 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (41 мг, 0,15 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (68 мг, 96%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,05 (c ушир., 1H), 8,78 (т, 1H, J=6,0 Гц), 8,16 (д, 1H, J=7,8 Гц), 7,78 (д, 1H, J=8,1 Гц), 7,71 (д, 1H, J=15,6 Гц), 7,17 (м, 3H), 6,74 (д, 1H, J=15,6 Гц), 4,36 (д, 2H, J=5,7 Гц), 2,95 (c, 3H), 2,83 (д, 2H, J=6,9 Гц), 2,29 (c, 3H), 2,10 (м, 1H), 0,89 (д, 6H, J=6,6 Гц).
ESI [M+H]+: 470.
Пример 175: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид
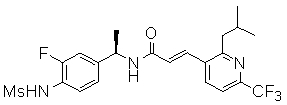
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (44 мг, 0,17 ммоль) вводили в реакцию с 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (41 мг, 0,15 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (47 мг, 64%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,56 (c ушир., 1H), 8,78 (д, 1H, J=8,1 Гц), 8,16 (д, 1H, J=8,1 Гц), 7,80 (д, 1H, J=8,1 Гц), 7,67 (д, 1H, J=15,6 Гц), 7,17 (м, 3H), 6,74 (д, 1H, J=15,6 Гц), 5,03 (т, 1H, J=7,2 Гц), 3,00 (c, 3H), 2,81 (д, 2H, J=7,2 Гц), 2,01 (м, 1H), 1,41 (д, 3H, J=7,2 Гц), 0,88 (дд, 6H, J=2,1 и 6,6 Гц).
ESI [M+H]+: 488.
Пример 176: 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид
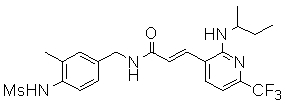
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (60 мг, 0,22 ммоль) вводили в реакцию с 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (58 мг, 0,20 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (85 мг, 88%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,04 (c ушир., 1H), 8,65 (т, 1H, J=6,0 Гц), 7,76 (д, 1H, J=7,8 Гц), 7,63 (д, 1H, J=15,3 Гц), 7,17 (м, 3H), 6,94 (д, 1H, J=7,5 Гц), 6,79 (д, 1H, J=7,5 Гц), 6,61 (д, 1H, J=15,3 Гц), 4,35 (д, 2H, J=5,7 Гц), 4,07 (м, 1H), 2,94 (c, 3H), 2,28 (c, 3H), 1,55 (м, 2H), 1,14 (д, 3H, J=6,6 Гц), 0,85 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 485.
Пример 177: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропилтио-6-трифторметил-пиридин-3-ил)-акриламид
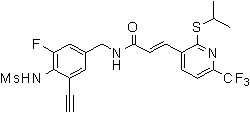
N-(4-Аминометил-2-фтор-6-этинил-фенил)-метансульфонамид, соль HCl (53 мг, 0,190 ммоль) вводили в реакцию с NMM (0,15 мл), DMTMM (62 мг) и 3-(2-изопропилтио-6-трифторметил-пиридин-3-ил)-акриловой кислотой (51 мг, 0,175 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (65 мг, 72%).
1H ЯМР (300 МГц, CDCl3): δ 7,80 (д, 1H, J=15,9 Гц), 7,74 (д, 1H, J=7,5 Гц), 7,34 (д, 1H, J=8,1 Гц), 7,29 (м, 1H), 7,15 (дд, 1H, J=2,1 и 10,8 Гц), 6,45 (д, 1H, J=15,9 Гц), 6,42 (c, 1H), 6,16 (т, 1H), 4,52 (д, 2H, J=6,3 Гц), 4,14 (м, 1H), 3,48 (c, 1H), 3,27 (c, 3H), 1,43 (д, 6H, J=6,6 Гц).
Пример 178: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-изопропилтио-6-трифторметил-пиридин-3-ил)-акриламид
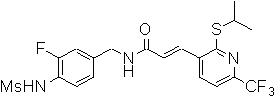
Стадия 1: 3-(2-изопропилтио-6-трифторметил-пиридин-3-ил)-акриловая кислота
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (245 мг, 0,974 ммоль) вводили в реакцию с 2-пропантиолом (240 мг, 3,15 ммоль) и гидридом натрия (143 мг, 3,56 ммоль) с получением после очистки хроматографией на колонках (Hex/EtOAc=2,5/1) целевого соединения (103 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,98 (д, 1H, J=15,9 Гц), 7,82 (д, 1H, J=7,8 Гц), 7,37 (д, 1H, J=8,1 Гц), 6,46 (д, 1H, J=15,6 Гц), 4,13 (м, 1H), 1,44 (д, 6H, J=6,9 Гц).
Стадия 2: N-(3-фтор-4-метансульфониламино-бензил)-3-(2-изопропилтио-6-трифторметил-пиридин-3-ил)-акриламид
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (37 мг, 0,145 ммоль) вводили в реакцию с NMM (0,15 мл), DMTMM (39 мг) и 3-(2-изопропилтио-6-трифторметил-пиридин-3-ил)-акриловой кислотой (31 мг, 0,106 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (49 мг, 94%).
1H ЯМР (300 МГц, CDCl3): δ 7,80 (д, 1H, J=15,6 Гц), 7,72 (д, 1H, J=7,5 Гц), 7,53 (т, 1H, J=8,1 Гц), 7,34 (д, 1H, J=7,5 Гц), 7,16 (д, 1H, J=10,2 Гц), 7,12 (д, 1H, J=8,4 Гц), 6,52 (c, 1H), 6,45 (д, 1H, J=15,6 Гц), 6,10 (т, 1H), 4,55 (д, 2H, J=6,0 Гц), 4,11 (м, 1H), 3,03 (c, 3H), 1,43 (д, 6H, J=6,9 Гц).
Пример 179: N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид
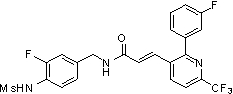
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (49 мг, 0,19 ммоль) вводили в реакцию с 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (50 мг, 0,16 ммоль), получая N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид (58 мг, 71%).
1H ЯМР (300 МГц, ДМСО): δ 9,57 (c, 1H, ушир.), 8,84 (т, 1H, J=5,7 Гц), 8,38 (д, 1H, J=7,8 Гц), 8,02 (д, 1H, J=7,8 Гц), 7,61-7,56 (м, 1H), 7,45-7,31 (м, 5H), 7,18 (д, 1H, J=11,1 Гц), 7,10 (д, 1H, J=8,1 Гц), 6,83 (д, 1H, J=15,6 Гц), 4,36 (д, 2H, J=5,7 Гц), 3,00 (c, 3H).
Пример 180: N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид
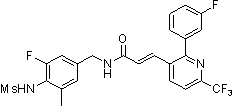
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (51 мг, 0,19 ммоль) вводили в реакцию с 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриловая кислота (50 мг, 0,16 ммоль), получая N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид (47 мг, 56%).
1H ЯМР (300 МГц, ДМСО): δ 9,28 (c, 1H, ушир.), 8,80 (т, 1H, J=6,0 Гц), 8,36 (д, 1H, J=8,4 Гц), 8,01 (д, 1H, J=8,4 Гц), 7,59 (дд, 1H, J=7,8, 5,7 Гц), 7,43-7,34 (м, 4H), 7,19-7,09 (м, 2H), 6,83 (д, 1H, J=15,6 Гц), 4,37 (д, 2H, J=5,4 Гц), 2,98 (c, 3H), 2,20 (c, 3H).
Пример 181: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид
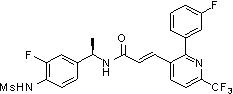
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (51 мг, 0,19 ммоль) вводили в реакцию с 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (50 мг, 0,16 ммоль), получая (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид (54 мг, 64%).
1H ЯМР (300 МГц, CDCl3): δ 8,07 (д, 1H, J=8,1 Гц), 7,72 (д, 1H, J=15,3 Гц), 7,70 (д, 1H, J=8,1 Гц), 7,56-7,41 (м, 2H), 7,35-7,30 (м, 2 H), 7,19-7,15 (м, 3H), 6,48 (c, 1H), 6,45 (д, 1H, J=15,3 Гц), 5,87 (д, 1H, J=7,5 Гц), 5,20-5,15 (м, 1H), 3,02 (c, 3H), 1,54 (д, 3H, J=7,2 Гц).
Пример 182: 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-N-(4-метансульфониламино-3-метил-бензил)-акриламид
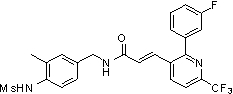
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (53 мг, 0,19 ммоль) вводили в реакцию 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (50 мг, 0,16 ммоль), получая 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-N-(4-метансульфониламино-3-метил-бензил)-акриламид (48 мг, 59%).
1H ЯМР (300 МГц, CDCl3): δ 8,06 (д, 1H, J=8,1 Гц), 7,75 (д, 1H, J=15,3 Гц), 7,79 (д, 1H, J=8,1 Гц), 7,50-7,33 (м, 3H), 7,26-7,20 (м, 3H), 6,44 (д, 1H, J=15,0 Гц), 6,15 (c, 1H), 5,93 (c, 1H), 4,51 (д, 2H, J=5,7 Гц), 3,03 (c, 3H), 2,31 (c, 3H).
Пример 183: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид
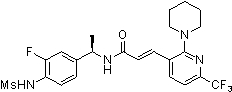
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (54 мг, 0,19 ммоль) вводили в реакцию с 3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (50 мг, 0,16 ммоль), получая (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид (54 мг, 64%).
1H ЯМР (300 МГц, CDCl3): δ 7,71 (д, 1H, J=8,1 Гц), 7,66 (д, 1H, J=15,6 Гц), 7,52 (д, 1H, J=8,1 Гц), 7,17-7,12 (м, 3H), 6,56 (c, 1H), 6,42 (д, 1H, J=15,6 Гц), 5,92 (д, 1H, J=7,5 Гц), 5,24-5,19 (м, 1H), 3,29-3,26 (м, 4H), 3,03 (c, 3H), 1,70-1,64 (м, 6H), 1,54 (д, 3H, J=7,2 Гц).
Пример 184: N-(4-метансульфониламино-3-метил-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид
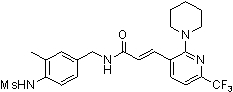
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (55 мг, 0,19 ммоль) вводили в реакцию с 3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (50 мг, 0,16 ммоль), получая 3-N-(4-метансульфониламино-3-метил-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид (33 мг, 40%).
1H ЯМР (300 МГц, CDCl3): δ 7,72-7,67 (м, 2H), 7,41 (д, 1H, J=8,4 Гц), 7,21-7,12 (м, 3H), 6,43 (д, 1H, J=15,6 Гц), 6,24 (c, 1H), 5,96 (т, 1H, J=5,7 Гц), 4,53 (д, 2H, J=5,7 Гц), 3,30-3,25 (м, 4H), 3,03 (c, 3H), 2,32 (c, 3H), 1,71-1,63 (м, 6H).
Пример 185: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриламид
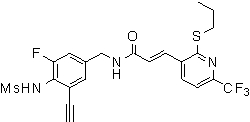
Стадия 1: 3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриловая кислота
3-(2-Хлор-6-трифторметил-пиридин-3-ил)-акриловую кислоту (243 мг, 0,966 ммоль) вводили в реакцию с пропантиолом (229 мг, 3,01 ммоль) и гидридом натрия (145 мг, 3,62 ммоль) с получением после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевого соединения (115 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,97 (д, 1H, J=15,9 Гц), 7,77 (д, 1H, J=7,8 Гц), 7,32 (д, 1H, J=7,8 Гц), 6,42 (д, 1H, J=15,9 Гц). 3,21 (т, 2H, J=7,2 Гц), 1,73 (м, 2H), 1,00 (т, 3H, J=7,2 Гц).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриламид
N-(4-Аминометил-2-фтор-6-этинил-фенил)-метансульфонамид, соль HCl (60,2 мг, 0,215 ммоль) вводили в реакцию с NMM (0,15 мл), DMTMM (70,2 мг) и 3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриловой кислотой (58,7 мг, 0,201 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (60 мг, 58%).
1H ЯМР (300 МГц, CDCl3): δ 7,85 (д, 1H, J=15,6 Гц), 7,74 (д, 1H, J=7,8 Гц), 7,34 (д, 1H, J=8,1 Гц), 7,30 (м, 1H), 7,16 (дд, 1H, J=1,8 и 10,8 Гц), 6,47 (д, 1H, J=15,3 Гц), 6,42 (м, 1H), 6,17 (м, 1H), 4,52 (д, 2H, J=6,0 Гц), 3,48 (c, 1H), 3,26 (c, 3H), 3,23 (кв, 2H, J=7,5 Гц), 1,73 (м, 2H), 1,03 (т, 3H, J=7,5 Гц).
Пример 186: N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриламид
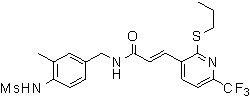
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (115,3 мг, 0,420 ммоль) вводили в реакцию с NMM (0,15 мл), DMTMM (123 мг) и 3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриловой кислотой (114,4 мг, 0,393 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (57 мг, 30%).
1H ЯМР (300 МГц, CDCl3): δ 7,84 (д, 1H, J=15,6 Гц), 7,72 (д, 1H, J=7,8 Гц), 7,41 (д, 1H, J=7,8 Гц), 7,320 (д, 1H, J=7,8 Гц), 7,19 (м, 2H), 6,45 (д, 1H, J=15,6 Гц), 6,22 (м, 1H), 6,03 (м, 1H), 4,52 (д, 2H, J=5,7 Гц), 3,23 (кв, 2H, J=6,9 Гц), 3,02 (c, 3H), 1,73 (м, 2H), 1,03 (т, 3H, J=6,9 Гц).
Пример 187: N-(4-метансульфониламино-3-метил-бензил)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-акриламид
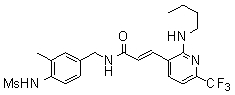
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (47 мг, 0,17 ммоль) вводили в реакцию с 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (50 мг, 0,17 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (39 мг, 47%).
1H ЯМР (300 МГц, CDCl3): δ 7,61 (м, 2H), 7,42 (м, 1H), 7,20 (м, 2H), 6,89 (д, 1H, J=7,5 Гц), 6,33 (д, 1H, J=15,0 Гц), 6,17 (c ушир., 1H), 5,90 (c ушир., 1H), 4,80 (c ушир., 1H), 4,53 (д, 2H, J=5,7 Гц), 3,50 (м, 2H), 3,03 (c, 3H), 2,32 (c, 3H), 1,49 (м, 4H), 1,40 (м, 2H), 0,96 (т, 3H, J=7,2 Гц).
ESI [M+H]+: 485.
Пример 188: N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-акриламид
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (56 мг, 0,21 ммоль) вводили в реакцию с 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (60 мг, 0,21 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (60 мг, 57%).
1H ЯМР (300 МГц, CDCl3): δ 7,60 (м, 2H), 7,23 (м, 2H), 6,89 (д, 1H, J=7,8 Гц), 6,33 (д, 1H, J=15,3 Гц), 6,30 (c ушир., 1H), 6,01 (c ушир., 1H), 4,84 (c ушир., 1H), 4,59 (д, 2H, J=6,0 Гц), 3,49 (м, 2H), 3,05 (c, 3H), 2,25 (д, 3H, J=2,1 Гц), 1,60 (м, 2H), 1,39 (м, 2H), 0,95 (т, 3H, J=7,2 Гц).
ESI [M+H]+: 503.
Пример 189: N-(3-фтор-4-метансульфониламино-5-трифторметил-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид
N-(4-Аминометил-2-фтор-6-трифторметил-фенил)-метансульфонамид, соль HCl (51,7 мг, 0,160 ммоль) вводили в реакцию с NMM (0,17 мл), DMTMM (57,2 мг) и 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (49,7 мг, 0,154 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (82 мг, 90%).
1H ЯМР (300 МГц, CDCl3): δ 7,85 (д, 1H, J=8,1 Гц), 7,77 (д, 1H, J=15,3 Гц), 7,53 (д, 1H, J=8,1 Гц), 7,43 (м, 1H), 7,39 (д, 1H, J=9,9 Гц), 7,22 (м, 2H), 7,17 (c, 1H), 7,14 (м, 1H), 6,25 (д, 1H, J=15,3 Гц), 6,18 (c, 1H), 6,08 (т, 1H), 4,58 (д, 2H, J=6,0 Гц), 3,29 (т, 2H, J=8,7 Гц), 3,28 (c, 3H), 3,08 (т, 2H, J=8,7 Гц).
Пример 190: 3-[2-(3-диэтиламино-проп-1-инил)-4-трифторметил-фенил]-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
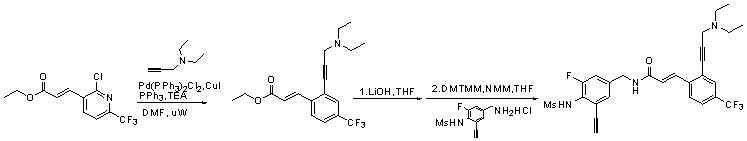
Стадия 1: синтез этилового эфира 3-[2-(3-диэтиламино-проп-1-инил)-4-трифторметил-фенил]-акриловой кислоты
Этиловый эфир 3-[2-(3-диэтиламино-проп-1-инил)-4-трифторметил-фенил]-акриловой кислоты получали согласно общей процедуре, описанной в примере 145 (стадия 1).
2-Хлор-N-метокси-N-метил-6-трифторметил-никотинамид (50 мг, 0,178 ммоль) вводили в реакцию, как описано выше, с диэтил-проп-2-инил-амином (2 экв.), получая этиловый эфир 3-[2-(3-диэтиламино-проп-1-инил)-4-трифторметил-фенил]-акриловой кислоты (30 мг, 47%).
1H ЯМР (300 МГц, CDCl3): δ 8,14 (д, 1H, J=16,2 Гц), 8,05 (д, 1H, J=8,4 Гц), 7,63 (д, 1H, J=8,4 Гц), 6,57 (д, 1H, J=16,2 Гц), 4,30 (кв, 2H, J=7,2 Гц), 3,81 (c, 2H), 2,69 (кв, 4H, J=7,2 Гц), 1,35 (т, 3H, J=7,2 Гц), 1,15 (т, 6H, J=7,2 Гц).
Стадия 2: синтез 3-[2-(3-диэтиламино-проп-1-инил)-4-трифторметил-фенил]-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламида
3-[2-(3-Диэтиламино-проп-1-инил)-4-трифторметил-фенил]-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид получали согласно общей процедуре, описанной в примере 107 (стадия 2).
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (31 мг, 0,11 ммоль) вводили в реакцию с 3-[2-(3-диэтиламино-проп-1-инил)-4-трифторметил-фенил]-акриловой кислотой (30 мг, 0,092 ммоль), как описано выше, получая 3-[2-(3-диэтиламино-проп-1-инил)-4-трифторметил-фенил]-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид (7 мг, 12%).
1H ЯМР (300 МГц, CDCl3): δ 8,05 (д, 1H, J=15,9 Гц), 8,81 (д, 1H, J=8,1 Гц), 7,61 (д, 1H, J=8,4 Гц), 7,28-7,26 (м, 2H), 7,16 (д, 1H, J=10,2 Гц), 6,70 (д, 1H, J=15,6 Гц), 6,60 (c, 1H), 4,52 (д, 2H, J=6,0 Гц), 3,77 (c, 2H), 3,47 (c, 1H), 3,25 (c, 3H), 2,71 (кв, 4H, J=7,2 Гц), 1,13 (т, 6H, J=7,2 Гц).
Пример 191: 3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид
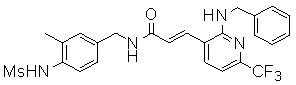
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (40 мг, 0,15 ммоль) вводили в реакцию с 3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (40 мг, 0,12 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (32 мг, 51%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,04 (c ушир., 1H), 8,63 (т, 1H), 7,78 (м, 2H), 7,63 (д, 1H, J=15,9 Гц), 7,25 (м, 8H), 6,99 (д, 1H, J=8,1 Гц), 6,65 (д, 1H, J=15,9 Гц), 4,53 (д, 2H, J=5,1 Гц), 4,35 (д, 2H, J=6,3 Гц), 2,99 (c, 3H), 2,28 (c, 3H).
Пример 192: 3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид
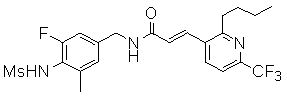
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (65 мг, 0,24 ммоль) вводили в реакцию с 3-(2-бутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (55 мг, 0,20 ммоль), получая после очистки кристаллизацией из метиленхлорида целевое соединение (43 мг, 44%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,18 (c ушир., 1H), 8,77 (т, 1H, J=5,7 Гц), 8,14 (д, 1H, J=8,1 Гц), 7,79 (д, 1H, J=8,4 Гц), 7,70 (д, 1H, J=15,6 Гц), 7,16 (м, 2H), 6,74 (д, 1H, J=15,6 Гц), 4,42 (д, 2H, J=5,4 Гц), 2,99 (c, 3H), 2,94 (м, 2H), 2,22 (д, 3H, J=2,7 Гц), 1,62 (м, 2H), 1,35 (м, 2H), 0,91 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 488.
Пример 193: (R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид
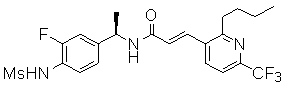
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (65 мг, 0,24 ммоль) вводили в реакцию с 3-(2-бутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (55 мг, 0,20 ммоль), получая после очистки кристаллизацией из метиленхлорида целевое соединение (49 мг, 50%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,54 (c ушир., 1H), 8,76 (д, 1H, J=7,8 Гц), 8,15 (д, 1H, J=7,8 Гц), 7,80 (д, 1H, J=8,1 Гц), 7,67 (д, 1H, J=15,6 Гц), 7,24 (м, 3H), 6,74 (д, 1H, J=15,6 Гц), 5,04 (т, 1H, J=7,5 Гц), 3,01 (c, 3H), 2,93 (м, 2H), 1,60 (м, 2H), 1,42 (д, 3H, J=7,5 Гц), 1,33 (м, 2H), 0,90 (т, 3H, J=7,2 Гц).
ESI [M+H]+: 488.
Пример 194: 3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид
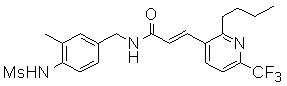
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (66 мг, 0,24 ммоль) вводили в реакцию с 3-(2-бутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (55 мг, 0,20 ммоль), получая целевое соединение (69 мг, 73%) после очистки хроматографией на колонках (Hex/EtOAc=1/2).
1H ЯМР (300 МГц, CDCl3): δ 7,97 (д, 1H, J=15,6 Гц), 7,88 (д, 1H, J=8,4 Гц), 7,51 (д, 1H, J=8,4 Гц), 7,44 (д, 1H, J=8,1 Гц), 7,20 (м, 2H), 6,37 (д, 1H, J=15,6 Гц), 6,11 (c ушир., 1H), 5,92 (т, 1H), 4,55 (д, 2H, J=5,4 Гц), 3,03 (c, 3H), 2,99 (м, 2H), 2,33 (c, 3H), 1,70 (м, 2H), 1,41 (м, 2H), 0,95 (т, 3H, J=7,2 Гц).
ESI [M+H]+: 470.
Пример 195: (R)-3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид
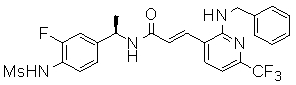
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (27 мг, 0,10 ммоль) вводили в реакцию с 3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (30 мг, 0,093 ммоль), получая целевое соединение (39 мг, 78%) после очистки хроматографией на колонках (Hex/EtOAc=2/3).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,30 (c ушир., 1H), 8,35 (д, 1H, J=7,8 Гц), 7,64 (м, 2H), 7,27 (м, 8H), 7,01 (т, 1H), 6,89 (д, 1H, J=7,8 Гц), 6,59 (д, 1H, J=15,3 Гц), 5,11 (т, 1H, J=7,5 Гц), 4,63 (д, 2H, J=5,7 Гц), 2,98 (c, 3H), 1,48 (д, 3H, J=6,9 Гц).
ESI [M+H]+: 537.
Пример 196: 3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
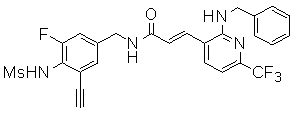
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (28 мг, 0,10 ммоль) вводили в реакцию с 3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (30 мг, 0,093 ммоль), получая целевое соединение (44 мг, 87%) после очистки хроматографией на колонках (Hex/EtOAc=2/3).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,45 (c ушир., 1H), 8,75 (т, 1H), 7,81 (м, 2H), 7,65 (д, 1H, J=15,3 Гц), 7,27 (м, 7H), 6,99 (д, 1H, J=7,2 Гц), 6,66 (д, 1H, J=15,3 Гц), 4,53 (д, 2H, J=6,0 Гц), 4,48 (c, 1H), 4,39 (д, 2H, J=5,7 Гц), 3,04 (c, 3H).
ESI [M+H]+: 547.
Пример 197: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил)-пиридин-3-ил-акриламид
Стадия 1: 3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриловая кислота
К суспензии метилового эфира 3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриловой кислоты (366 мг, 1,22 ммоль) в ТГФ (3 мл) добавляли 1 н. раствор LiOH (3,0 мл), и смесь перемешивали в течение 3 часов при комнатной температуре. Полученный остаток растворяли в H2O и затем промывали EtOAc, подкисляли 1 н. HCl до рН 1~2. Раствор экстрагировали три раза метиленхлоридом и затем высушивали над безвод. MgSO4, и концентрировали в вакууме, получая 3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриловую кислоту (340 мг, 97%).
1H ЯМР (300 МГц, CDCl3): δ 8,05 (д, 1H, J=15,9 Гц), 7,98 (д, 1H, J=8,4 Гц), 7,56 (д, 1H, J=8,1 Гц), 6,46 (д, 1H, J=15,6 Гц), 3,00 (т, 2H, J=7,8 Гц), 1,73 (м, 2H), 1,39 (м, 4H), 0,91 (т, 3H, J=7,2 Гц).
Стадия 2: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил)-пиридин-3-ил-акриламид
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (74 мг, 0,27 ммоль) вводили в реакцию с 3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (77 мг, 0,27 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил)-пиридин-3-ил-акриламид (57 мг, 42%).
1H ЯМР (300 МГц, CDCl3): δ 7,93 (м, 2H), 7,52 (д, 1H, J=8,1 Гц), 7,30 (c ушир., 1H), 7,17 (м, 1H), 6,39 (д, 1H, J=15,3 Гц), 6,42 (c ушир., 1H), 6,09 (c ушир., 1H), 4,54 (д, 2H, J=6,0 Гц), 3,49 (c, 1H), 3,27 (c, 3H), 2,98 (м, 2H), 1,72 (м, 2H), 1,37 (м, 4H), 0,89 (м, 3H).
ESI [M+H]+: 512.
Пример 198: N-(4-метансульфониламино-3-метил-бензил)-3-(2-пентил-6-трифторметил)-пиридин-3-ил-акриламид
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (70 мг, 0,26 ммоль) вводили в реакцию с 3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (74 мг, 0,26 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=3/2) N-(4-метансульфониламино-3-метил-бензил)-3-(2-пентил-6-трифторметил)-пиридин-3-ил-акриламид (57 мг, 46%).
1H ЯМР (300 МГц, CDCl3): δ 7,96 (д, 1H, J=15,9 Гц), 7,88 (д, 1H, J=7,8 Гц), 7,47 (м, 2H), 7,22 (м, 2H), 6,37 (д, 1H, J=15,3 Гц), 6,14 (c ушир., 1H), 5,94 (c ушир., 1H), 4,55 (д, 2H, J=5,7 Гц), 3,03 (c, 3H), 2,98 (c, 3H), 2,32 (c, 3H), 1,72 (м, 2H), 1,37 (м, 4H), 0,89 (м, 3H).
ESI [M+H]+: 484.
Пример 199: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил)-пиридин-3-ил-акриламид

N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (49 мг, 0,18 ммоль) вводили в реакцию с 3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (52 мг, 0,18 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) целевое соединение (58 мг, 63%).
1H ЯМР (300 МГц, CDCl3): δ 7,94 (м, 2H), 7,41 (м, 1H), 6,99 (м, 2H), 6,40 (д, 1H, J=15,0 Гц), 6,09 (c ушир., 1H), 6,06 (c ушир., 1H), 4,56 (д, 2H, J=6,0 Гц), 3,22 (c, 3H), 2,96 (м, 2H), 1,72 (м, 2H), 1,37 (м, 4H), 0,89 (м, 3H).
ESI [M+H]+: 506.
Пример 200: синтез N-(4-метансульфониламино-3,5-дифтор-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламида
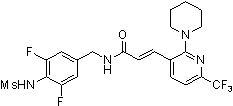
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (55 мг, 0,19 ммоль) вводили в реакцию с 3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (50 мг, 0,16 ммоль), получая 3-N-(4-метансульфониламино-3,5-дифтор-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид (35 мг, 41%).
1H ЯМР (300 МГц, ДМСО): δ 9,50 (c, 1H, ушир.), 8,82 (т, 1H, J=6,0 Гц), 7,01 (д, 1H, J=7,8 Гц), 7,45 (д, 1H, J=15,9 Гц), 7,40 (д, 1H, J=7,8 Гц), 7,13 (c, 1H), 7,12 (д, 1H, J=8,7 Гц), 6,75 (д, 1H, J=15,9 Гц), 4,42 (д, 2H, J=6,0 Гц), 3,19 (c, 4H), 3,04 (c, 3H), 1,63 (c, 6H).
Пример 201: N-(4-метансульфониламино-3,5-дифтор-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид
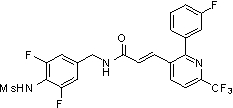
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (53 мг, 0,19 ммоль) вводили в реакцию с 3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (50 мг, 0,16 ммоль), получая N-(4-метансульфониламино-3,5-дифтор-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид (31 мг, 37%).
1H ЯМР (300 МГц, ДМСО): δ 9,50 (c, 1H, ушир.), 8,87 (т, 1H, J=6,0 Гц), 8,40 (д, 1H, J=8,1 Гц), 8,02 (д, 1H, J=8,4 Гц), 7,63-7,56 (м, 2H), 7,46-7,35 (м, 3H), 7,11-7,09 (м, 2H), 6,84 (д, 1H, J=15,6 Гц), 4,39 (д, 2H, J=5,7 Гц), 3,04 (c, 3H).
Пример 202: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-бутиламино-6-трифторметил)-пиридин-3-ил-акриламид
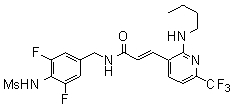
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (47 мг, 0,17 ммоль) вводили в реакцию с 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (50 мг, 0,17 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) целевое соединение (52 мг, 59%).
1H ЯМР (300 МГц, CDCl3): δ 7,84 (м, 1H), 7,51 (д, 1H, J=7,8 Гц), 6,79 (м, 1H), 6,47 (c ушир., 3H), 6,30 (д, 1H, J=15,6 Гц), 4,05 (д, 2H, J=2,1 Гц), 3,50 (м, 2H), 3,32 (c, 3H), 1,65 (м, 2H), 1,26 (м, 2H), 0,95 (м, 3H).
ESI [M+H]+: 507.
Пример 203: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид
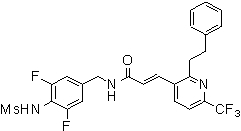
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (107,2 мг, 0,393 ммоль) вводили в реакцию с NMM (0,20 мл), DMTMM (123 мг) и 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (101,3 мг, 0,315 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (99 мг, 58%).
1H ЯМР (300 МГц, CDCl3): δ 7,86 (д, 1H, J=7,8 Гц), 7,79 (д, 1H, J=15,6 Гц), 7,52 (д, 1H, J=7,8 Гц), 7,17 (м, 4H), 6,91 (д, 2H, J=8,4 Гц), 6,40 (д, 1H, J=15,6 Гц), 6,32 (т, 1H), 6,28 (c, 1H), 4,48 (д, 2H, J=6,0 Гц), 3,27 (т, 2H, J=7,2 Гц), 3,17 (c, 3H), 3,06 (т, 2H, J=7,2 Гц).
ESI [M+H]+: 540.
Пример 204: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид
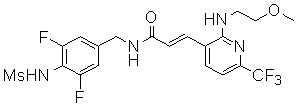
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (100 мг, 0,37 ммоль) вводили в реакцию с 3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (102 мг, 0,35 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (107 мг, 60%).
1H ЯМР (300 МГц, ДМСО-d6): 9,52 (c ушир., 1H), δ 8,76 (т, 1H), 7,81 (д, 1H, J=7,8 Гц), 7,59 (д, 1H, J=15,3 Гц), 7,11 (м, 3H), 6,99 (д, 1H, J=7,8 Гц), 6,64 (д, 1H, J=15,3 Гц), 4,41 (д, 2H, J=6,0 Гц), 3,50 (м, 4H), 3,25 (c, 3H), 3,03 (c, 3H).
ESI [M+H]+: 509.
Пример 205: 3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид
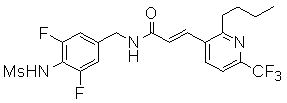
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (100 мг, 0,37 ммоль) вводили в реакцию с 3-(2-бутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (96 мг, 0,35 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (125 мг, 73%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,50 (c ушир., 1H), 8,88 (т, 1H), 8,18 (д, 1H, J=7,8 Гц), 7,79 (д, 1H, J=7,8 Гц), 7,72 (д, 1H, J=15,6 Гц), 7,13 (д, 2H, J=8,7 Гц), 6,75 (д, 1H, J=15,6 Гц), 4,43 (д, 2H, J=5,7 Гц), 3,05 (c, 3H), 2,94 (м, 2H), 1,62 (м, 2H), 1,35 (м, 2H), 0,90 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 492.
Пример 206: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид
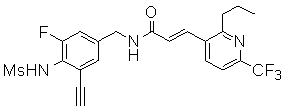
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (167 мг, 0,60 ммоль) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (30 мг, 0,50 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (211 мг, 87%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,46 (c ушир., 1H), 8,87 (т, 1H), 8,18 (д, 1H, J=8,4 Гц), 7,79 (д, 1H, J=8,1 Гц), 7,72 (д, 1H, J=15,6 Гц), 7,13 (м, 2H), 6,75 (д, 1H, J=15,6 Гц), 4,53 (c, 1H), 4,41 (д, 2H, J=6,0 Гц), 3,07 (c, 3H), 2,93 (м, 2H), 1,66 (м, 2H), 0,94 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 484.
Пример 207: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид
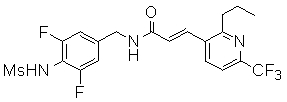
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (100 мг, 0,37 ммоль) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (90 мг, 0,35 ммоль), получая целевое соединение (134 мг, 80%) после очистки хроматографией на колонках (Hex/EtOAc=1/2).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,50 (c ушир., 1H), 8,88 (т, 1H), 8,18 (д, 1H, J=8,1 Гц), 7,79 (д, 1H, J=8,1 Гц), 7,72 (д, 1H, J=15,6 Гц), 7,13 (д, 2H, J=8,4 Гц), 6,75 (д, 1H, J=15,6 Гц), 4,43 (д, 2H, J=5,7 Гц), 3,05 (c, 3H), 2,92 (м, 2H), 1,67 (м, 2H), 0,93 (т, 3H, J=6,9 Гц).
ESI [M+H]+: 478.
Пример 208: N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид
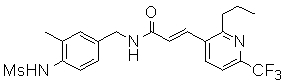
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (102 мг, 0,37 ммоль) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (90 мг, 0,35 ммоль), получая целевое соединение (120 мг, 75%) после очистки хроматографией на колонках (Hex/EtOAc=1/2).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,03 (c ушир., 1H), 8,77 (т, 1H), 8,15 (д, 1H, J=7,8 Гц), 7,78 (д, 1H, J=8,4 Гц), 7,70 (д, 1H, J=15,6 Гц), 7,18 (м, 3H), 6,74 (д, 1H, J=15,6 Гц), 4,37 (д, 2H, J=6,0 Гц), 2,96 (c, 3H), 2,92 (м, 2H), 2,30 (c, 3H), 1,67 (м, 2H), 0,94 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 456.
Пример 209: (R)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид
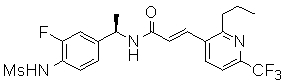
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (105 мг, 0,39 ммоль) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (90 мг, 0,35 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (151 мг, 91%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,56 (c ушир., 1H), 8,77 (д, 1H, J=7,8 Гц), 8,14 (д, 1H, J=8,1 Гц), 7,80 (д, 1H, J=8,4 Гц), 7,66 (д, 1H, J=15,6 Гц), 7,27 (м, 3H), 6,74 (д, 1H, J=15,6 Гц), 5,04 (т, 1H, J=7,5 Гц), 3,00 (c, 3H), 2,91 (м, 2H), 1,67 (м, 2H), 1,41 (д, 3H, J=6,9 Гц), 0,92 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 474.
Пример 210: (R)-3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид
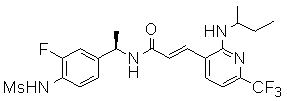
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (92 мг, 0,34 ммоль) вводили в реакцию с 3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (82 мг, 0,28 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (133 мг, 95%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,56 (c ушир., 1H), 8,64 (д, 1H, J=8,4 Гц), 7,76 (д, 1H, J=7,8 Гц), 7,58 (д, 1H, J=15,6 Гц), 7,25 (м, 3H), 6,94 (д, 1H, J=7,8 Гц), 6,77 (д, 1H, J=7,8 Гц), 6,53 (д, 1H, J=15,6 Гц), 5,03 (т, 1H), 4,06 (м, 1H), 3,00 (c, 3H), 1,55 (м, 2H), 1,40 (д, 3H, J=7,2 Гц), 1,12 (м, 3H), 0,84 (м, 3H).
ESI [M+H]+: 503.
Пример 211: (R)-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид
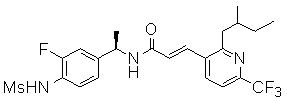
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (105 мг, 0,39 ммоль) вводили в реакцию с 3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (101 мг, 0,35 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (73 мг, 42%).
1H ЯМР (300 МГц, ДМСО-d6): δ 8,76 (д, 1H, J=8,1 Гц), 8,16 (д, 1H, J=8,4 Гц), 7,78 (д, 1H, J=15,6 Гц), 7,25 (м, 3H), 6,74 (д, 1H, J=15,6 Гц), 5,04 (т, 1H, J=7,5 Гц), 3,01 (c, 3H), 3,00 (м, 1H), 2,70 (м, 1H), 1,92 (м, 1H), 1,41 (д, 3H, J=6,9 Гц), 1,30 (м, 2H), 0,84 (м, 6H).
ESI [M+H]+: 502.
Пример 212: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид
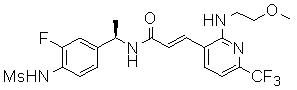
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (105 мг, 0,39 ммоль) вводили в реакцию с 3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриловой кислотой (102 мг, 0,35 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (114 мг, 65%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,54 (c ушир., 1H), 8,65 (д, 1H, J=7,8 Гц), 7,78 (д, 1H, J=7,8 Гц), 7,54 (д, 1H, J=15,3 Гц), 7,25 (м, 4H), 6,99 (д, 1H, J=7,8 Гц), 6,64 (д, 1H, J=15,3 Гц), 5,04 (т, 1H, J=6,9 Гц), 3048 (c, 4H), 3,25 (c, 3H), 3,01 (c, 3H), 1,41 (д, 3H, J=6,9 Гц).
Пример 213: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-бутиламино)-6-трифторметил-пиридин-3-ил-акриламид
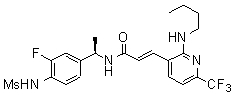
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (103 мг, 0,38 ммоль) вводили в реакцию с 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (110 мг, 0,38 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (120 мг, 63%).
1H ЯМР (300 МГц, ДМСО-d6 + CDCl3): δ 9,23 (c ушир., 1H), 8,24 (c ушир., 1H), 7,56 (м, 3H), 7,41 (м, 1H), 7,17 (м, 2H), 6,86 (д, 1H, J=7,5 Гц), 6,56 (д, 1H, J=15,6 Гц), 5,15 (м, 1H), 3,46 (м, 2H), 2,99 (c, 3H), 1,60 (м, 2H), 1,50 (д, 3H, J=7,2 Гц), 0,94 (м, 3H).
ESI [M+H]+: 503.
Пример 214: N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пентил-6-трифторметил)-пиридин-3-ил-акриламид
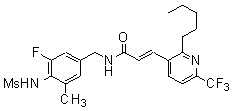
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (52 мг, 0,19 ммоль) вводили в реакцию с 3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (55 мг, 0,19 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (65 мг, 68%).
1H ЯМР (300 МГц, CDCl3): δ 7,91 (м, 2H), 7,50 (д, 1H, J=5,8 Гц), 7,25 (м, 2H), 6,36 (д, 1H, J=15,3 Гц), 6,15 (c, ушир., 1H), 6,01 (c, ушир., 1H), 4,61 (д, 2H, J=6,0 Гц), 3,05 (c, 3H), 2,97 (м, 2H), 2,25 (c, 3H), 1,71 (м, 2H), 1,34 (м, 2H), 0,89 (м, 3H).
ESI [M+H]+: 502.
Пример 215: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пентил-6-трифторметил)-пиридин-3-ил-акриламид
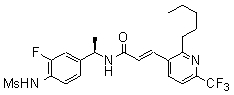
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (54 мг, 0,20 ммоль) вводили в реакцию с 3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (57 мг, 0,20 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (35 мг, 35%).
1H ЯМР (300 МГц, CDCl3): δ 7,90 (м, 2H), 7,53 (м, 2H), 6,45 (c ушир., 1H), 6,37 (д, 1H, J=15,6 Гц), 5,85 (д, 1H, J=7,8 Гц), 5,22 (м, 1H), 3,04 (c, 3H), 2,96 (м, 2H), 1,70 (м, 2H), 1,58 (c, 3H), 1,36 (м, 4H), 0,88 (м, 3H).
ESI [M+H]+: 502.
Пример 216: N-(4-метансульфониламино-3-метил-бензил)-3-[2-(пропан-1-сульфонил)-6-трифторметил-пиридин-3-ил]-акриламид
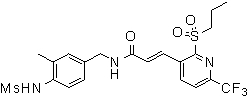
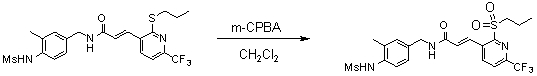
N-(4-Метансульфониламино-3-метил-бензил)-3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриламид (34,9 мг, 0,0715 ммоль) в течение 3 часов при комнатной температуре вводили в реакцию с м-CPBA (60%, 43,7 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/4) целевое соединение (31 мг, 83%).
1H ЯМР (300 МГц, CDCl3): δ 8,24 (д, 1H, J=14,1 Гц), 8,20 (д, 1H, J=8,1 Гц), 7,86 (д, 1H, J=8,1 Гц), 7,33 (д, 1H, J=8,4 Гц), 7,15 (м, 2H), 6,55 (д, 1H, J=15,9 Гц), 6,50 (т, 1H), 6,38 (c, 1H), 4,45 (д, 2H, J=6,0 Гц), 3,62 (м, 2H), 3,00 (c, 3H), 2,68 (c, 3H), 1,94 (м, 2H), 1,11 (т, 3H, J=7,5 Гц).
Пример 217: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид
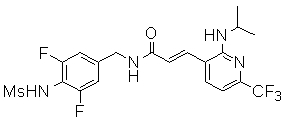
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (109 мг, 0,40 ммоль) вводили в реакцию с 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (82 мг, 0,30 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (109 мг, 74%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,50 (c ушир., 1H), 8,76 (т, 1H, J=6,0 Гц), 7,80 (д, 1H, J=7,5 Гц), 7,64 (д, 1H, J=15,6 Гц), 7,13 (д, 2H, J=8,7 Гц), 6,96 (д, 1H, J=7,8 Гц), 6,82 (д, 1H, J=7,5 Гц), 6,62 (д, 1H, J=15,6 Гц), 4,41 (д, 2H, J=6,0 Гц), 4,22 (м, 1H), 3,05 (c, 3H), 1,18 (д, 6H, J=6,3 Гц).
ESI [M+H]+: 493.
Пример 218: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид
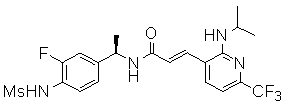
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (107 мг, 0,40 ммоль) вводили в реакцию с 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (82 мг, 0,30 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (137 мг, 93%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,54 (c ушир., 1H), 8,65 (д, 1H, J=7,8 Гц), 7,76 (д, 1H, J=7,8 Гц), 7,57 (д, 1H, J=15,3 Гц), 7,25 (м, 3H), 6,96 (д, 1H, J=7,5 Гц), 6,80 (д, 1H, J=7,5 Гц), 6,60 (д, 1H, J=15,3 Гц), 5,03 (т, 1H, J=7,5 Гц), 4,20 (м, 1H), 3,01 (c, 3H), 1,40 (д, 3H, J=6,9 Гц), 1,16 (дд, 6H, J=2,1 и 6,3 Гц).
ESI [M+H]+: 489.
Пример 219: 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид
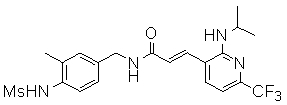
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (110 мг, 0,40 ммоль) вводили в реакцию с 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (82 мг, 0,30 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (92 мг, 65%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,00 (c ушир., 1H), 8,64 (т, 1H), 7,76 (д, 1H, J=7,2 Гц), 7,62 (д, 1H, J=15,3 Гц), 7,18 (м, 3H), 6,95 (д, 1H, J=7,5 Гц), 6,80 (д, 1H, J=7,2 Гц), 6,61 (д, 1H, J=15,3 Гц), 4,45 (д, 2H, J=5,4 Гц), 4,20 (м, 1H), 2,95 (c, 3H), 2,29 (c, 3H), 1,18 (д, 6H, J=5,7 Гц).
ESI [M+H]+: 471.
Пример 220: N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид
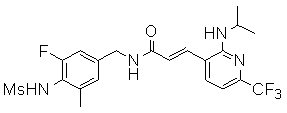
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (71 мг, 0,26 ммоль) вводили в реакцию с 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (55 мг, 0,20 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (88 мг, 90%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,25 (c ушир., 1H), 8,64 (т, 1H), 7,75 (д, 1H, J=7,5 Гц), 7,62 (д, 1H, J=15,3 Гц), 7,14 (м, 2H), 6,95 (д, 1H, J=6,6 Гц), 6,80 (д, 1H, J=7,5 Гц), 6,62 (д, 1H, J=15,3 Гц), 4,41 (д, 2H, J=5,4 Гц), 4,21 (м, 1H), 2,99 (c, 3H), 2,21 (c, 3H), 1,18 (д, 6H, J=6,3 Гц).
ESI [M+H]+: 489.
Пример 221: N-(3-Этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид
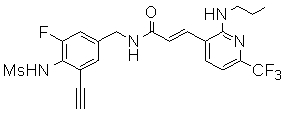
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (106 мг, 0,39 ммоль) вводили в реакцию с 3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,26 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (86 мг, 66%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,45 (c ушир., 1H), 8,74 (т, 1H, J=5,7 Гц), 7,79 (д, 1H, J=7,5 Гц), 7,60 (д, 1H, J=15,3 Гц), 7,29 (м, 2H), 7,15 (м, 1H), 6,95 (д, 1H, J=7,5 Гц), 6,63 (д, 1H, J=15,3 Гц), 4,52 (c, 1H), 4,39 (д, 2H, J=5,7 Гц), 3,30 (м, 2H), 3,07 (c, 3H), 1,58 (м, 2H), 0,87 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 499.
Пример 222: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид
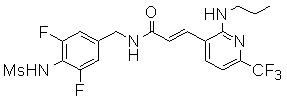
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (92 мг, 0,34 ммоль) вводили в реакцию с 3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,26 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (74 мг, 58%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,49 (c ушир., 1H), 8,75 (т, 1H, J=6,0 Гц), 7,79 (д, 1H, J=7,5 Гц), 7,60 (д, 1H, J=15,3 Гц), 7,13 (м, 3H), 6,95 (д, 1H, J=7,5 Гц), 6,64 (д, 1H, J=15,3 Гц), 4,41 (д, 2H, J=6,0 Гц), 3,30 (м, 2H), 3,04 (c, 3H), 1,58 (м, 2H), 0,88 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 493.
Пример 223: N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид
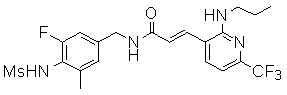
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (91 мг, 0,34 ммоль) вводили в реакцию с 3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,26 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (98 мг, 77%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,27 (c ушир., 1H), 8,64 (т, 1H), 7,75 (д, 1H, J=7,2 Гц), 7,58 (д, 1H, J=15,6 Гц), 7,15 (м, 3H), 6,95 (д, 1H, J=7,8 Гц), 6,63 (д, 1H, J=15,6 Гц), 4,40 (д, 2H, J=5,4 Гц), 3,27 (м, 2H), 2,97 (c, 3H), 2,21 (c, 3H), 1,57 (м, 2H), 0,87 (т, 3H, J=7,2 Гц).
Пример 224: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид
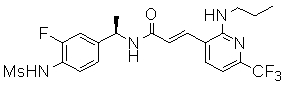
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (91 мг, 0,34 ммоль) вводили в реакцию с 3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,26 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (106 мг, 83%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,50 (c ушир., 1H), 8,64 (д, 1H, J=7,5 Гц), 7,76 (д, 1H, J=7,5 Гц), 7,55 (д, 1H, J=15,6 Гц), 7,25 (м, 4H), 6,95 (д, 1H, J=8,1 Гц), 6,63 (д, 1H, J=15,6 Гц), 5,03 (т, 1H, J=7,2 Гц), 3,27 (м, 2H), 3,00 (c, 3H), 1,56 (м, 2H), 1,40 (д, 3H, J=6,6 Гц), 0,86 (т, 3H, J=7,5 Гц).
Пример 225: N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид
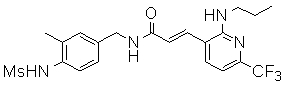
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (93 мг, 0,34 ммоль) вводили в реакцию с 3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,26 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (85 мг, 69%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,12 (c ушир., 1H), 8,64 (т, 1H), 7,76 (д, 1H, J=7,8 Гц), 7,58 (д, 1H, J=15,6 Гц), 7,25 (м, 4H), 6,95 (д, 1H, J=7,8 Гц), 6,63 (д, 1H, J=15,6 Гц), 4,36 (д, 2H, J=4,2 Гц), 3,30 (м, 2H), 2,92 (c, 3H), 2,29 (c, 3H), 1,57 (м, 2H), 0,87 (т, 3H, J=7,2 Гц).
Пример 226: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид
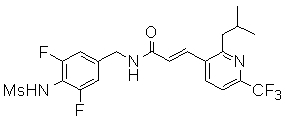
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (30 мг, 0,11 ммоль) вводили в реакцию с 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (20 мг, 0,73 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (30 мг, 84%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,50 (c ушир., 1H), 8,88 (т, 1H), 8,19 (д, 1H, J=8,1 Гц), 7,80 (д, 1H, J=7,8 Гц), 7,73 (д, 1H, J=15,6 Гц), 7,13 (д, 2H, J=8,7 Гц), 6,75 (д, 1H, J=15,6 Гц), 4,43 (д, 2H, J=5,4 Гц), 3,05 (c, 3H), 2,83 (д, 2H, J=6,9 Гц), 2,01 (м, 1H), 0,88 (т, 3H, J=6,6 Гц).
Пример 227: (R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид
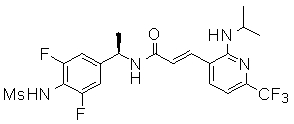
Стадия 1: синтез 2,6-дифтор-4-йодоанилина
К раствору 2,6-дифторанилина (5,0 г, 38,7 ммоль) и п-толуолсульфоновой кислоты (1,45 г, 7,62 ммоль) в DMF (70 мл) при 5°C добавляли по каплям N-йодсукцинимид (9,6 г, 42,7 ммоль), растворенный в DMF (50 мл). Смесь перемешивали в течение 2,5 часов при комнатной температуре. Смесь концентрировали при пониженном давлении и затем разбавляли EtOAc и водой. Органический слой промывали насыщенным водным раствором тиосульфата натрия и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали кристаллизацией из EtOAc и гексана, получая 2,6-дифтор-4-йодоанилин (9,12 г, 92,4%).
1H ЯМР (300 МГц, CDCl3): δ 7,16 (д, 1Н, J=1,8 Гц), 7,14 (д, 1Н, J=1,8 Гц), 3,76 (c ушир., 2H).
Стадия 2: синтез 1-(4-амино-3,5-дифтор-фенил)-этанона
Суспензию 2,6-дифтор-4-йодоанилина (1 г, 3,92 ммоль) и Pd(OAc)2 (0,025 экв.), DPPP (0,05 экв.) в [bmim][BF3] (6 мл) перемешивали в течение 10 мин. После трехкратной дегазации смеси последовательно вводили простой бутилвиниловый эфир (5 экв.) и Et3N (1,2 экв.). Смесь перемешивали в течение 15 часов при 115°C. Смесь охлаждали до комнатной температуры и затем добавляли 1 н. HCl. После перемешивания смеси в течение 0,5 часов добавляли CH2Cl2. Органический слой промывали солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали хроматографией, получая 1-(4-амино-3,5-дифтор-фенил)-этанон (300 мг, 45%).
1H ЯМР (300 МГц, CDCl3): δ 7,15 (д, 1Н, J=1,2 Гц), 7,13 (д, 1Н, J=1,2 Гц), 3,76 (c, 2Н, ушир.).
Стадия 3: синтез N-(4-ацетил-2,6-дифтор-фенил)-метансульфонамида
К раствору 1-(4-амино-3,5-дифтор-фенил)-этанона (2,35 г, 13,73 ммоль) и Et3N (2 мл) в CH2Cl2 (10 мл) при 0°C добавляли по каплям MsCl (2,34 мл, 2,34 ммоль). Смесь перемешивали в течение 3 часов при комнатной температуре. Смесь затем разбавляли EtOAc и 1 н. HCl. Органический слой промывали водой и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой продукт использовали непосредственно в следующей реакции. Сырой остаток растворяли в ТГФ (8 мл), затем к раствору добавляли 1 н. NaOH (4 мл) и CH3OH (4 мл). После перемешивания в течение 5 часов при комнатной температуре смесь разбавляли EtOAc и 1 н. HCl. Органический слой промывали водой и солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали хроматографией с получением N-(4-ацетил-2,6-дифтор-фенил)-метансульфонамида (1,85 г, 54%).
1H ЯМР (300 МГц, CDCl3): δ 7,60 (д, 1Н, J=3,3 Гц), 7,56 (д, 1Н, J=3,3 Гц), 6,43 (c, 1H), 3,89 (c, 3H), 3,58 (c, 3H).
Стадия 4: синтез N-{2,6-дифтор-4-[1-(2-метил-пропан-2-сульфиниламино)-этил]-фенил}-метансульфонамида
К раствору N-(4-ацетил-2,6-дифтор-фенил)-метансульфонамида (1,84 г, 7,38 ммоль) и (R)-(+)-2-метил-2-пропансульфинамида (1,07 г, 8,86 мл) в ТГФ (15 мл) добавляли по каплям при комнатной температуре Ti(OEt)4 (2,61 мл, 12,6 ммоль). Смесь перемешивали в течение ночи при 90°C. Смесь охлаждали до комнатной температуры и затем добавляли солевой раствор. После экстракции смеси три раза с использованием EtOAc смесь высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали хроматографией, получая N-{2,6-дифтор-4-[1-(2-метил-пропан-2-сульфинилимино)-этил]-фенил}-метансульфонамид (2,2 г, 85%). К раствору N-{2,6-дифтор-4-[1-(2-метил-пропан-2-сульфинилимино)-этил]-фенил}-метансульфонамида (2,2 г, 6,24 ммоль) в ТГФ (20 мл) при -48°C добавляли порциями NaBH4 (944 мг, 24,9 ммоль), растворенный в ТГФ (2 мл). Смесь перемешивали в течение 10 часов при температуре от -48°C до приблизительно комнатной температуры, и затем добавляли по каплям CH3OH до прекращения газообразования. Смесь концентрировали при пониженном давлении и затем очищали хроматографией с получением N-{2,6-дифтор-4-[1-(2-метил-пропан-2-сульфиниламино)-этил]-фенил}-метансульфонамида (1,89 г, 50%).
1H ЯМР (300 МГц, CDCl3): δ 7,04 (д, 1Н, J=2,4 Гц), 6,99 (д, 1Н, J=2,4 Гц), 6,59 (c, 1H), 4,54-4,49 (м, 1H), 3,53 (д, 1H, J=3,6 Гц), 3,20 (c, 3H), 1,50 (д, 3H, 6,6 Гц), 1,23 (c, 9H).
Стадия 5: синтез (R)-N-[4-(1-аминоэтил)-2,6-дифтор-фенил]-метансульфонамида, соль HCl
К раствору N-{2,6-дифтор-4-[1-(2-метил-пропан-2-сульфиниламино)-этил]-фенил}-метансульфонамида (789 мг, 2,22 ммоль) в CH3OH (8 мл) при комнатной температуре добавляли по каплям 4 М HCl в диоксане (2 мл). Смесь перемешивали в течение 30 минут при комнатной температуре и затем концентрировали при пониженном давлении. Сырой остаток очищали кристаллизацией из CH2Cl2 и Et2O, получая (R)-N-[4-(1-аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (611 г, 96%).
1H ЯМР (300 МГц, ДМСО): δ 8,73 (c, 3H, ушир.), 7,48 (д, 1Н, J=2,7 Гц), 7,43 (д, 1Н, J=2,7 Гц), 4,43 (кв, 1H, J=3,6 Гц), 3,53 (д, 1H, J=3,6 Гц), 3,07 (c, 3H), 1,51 (д, 3H, 6,9 Гц).
Стадия 6: синтез (R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламида
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (70 мг, 0,24 ммоль) вводили в реакцию с 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (67 мг, 0,24 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (108 мг, 89%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,49 (c ушир., 1H), 8,68 (д, 1H, J=7,8 Гц), 7,78 (д, 1H, J=7,5 Гц), 7,57 (д, 1H, J=15,3 Гц), 7,17 (д, 2H, J=9,0 Гц), 6,96 (д, 1H, J=7,8 Гц), 6,82 (д, 1H, J=7,5 Гц), 6,62 (д, 1H, J=15,3 Гц), 5,03 (м, 1H), 4,22 (м, 1H), 3,04 (c, 3H), 1,40 (д, 3H, J=6,9 Гц), 1,17 (дд, 6H, J=2,4 и 6,3 Гц).
ESI [M+H]+: 507.
Пример 228: (R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (70 мг, 0,24 ммоль) вводили в реакцию с 3-(2-бутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (67 мг, 0,24 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (115 мг, 95%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,50 (c ушир., 1H), 8,80 (д, 1H, J=7,5 Гц), 8,16 (д, 1H, J=8,1 Гц), 7,80 (д, 1H, J=8,4 Гц), 7,67 (д, 1H, J=15,6 Гц), 7,17 (д, 2H, J=8,4 Гц), 6,75 (д, 1H, J=15,6 Гц), 5,04 (м, 1H), 3,03 (c, 3H), 2,93 (м, 2H), 1,61 (м, 2H), 1,41 (д, 3H, J=6,9 Гц), 1,36 (м, 2H), 0,90 (т, 3H, J=7,2 Гц).
ESI [M+H]+: 506.
Пример 229: (R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (60 мг, 0,21 ммоль) вводили в реакцию с 3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (56 мг, 0,20 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (95 мг, 95%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,50 (c ушир., 1H), 8,68 (д, 1H, J=7,8 Гц), 7,78 (д, 1H, J=7,8 Гц), 7,55 (д, 1H, J=15,3 Гц), 7,16 (м, 3H), 6,96 (д, 1H, J=7,5 Гц), 6,63 (д, 1H, J=15,3 Гц), 5,03 (м, 1H), 3,28 (м, 2H), 3,04 (c, 3H), 1,56 (м, 2H), 1,40 (д, 3H, J=6,5 Гц), 0,87 (т, 3H, J=7,2 Гц).
ESI [M+H]+: 507.
Пример 230: (R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид
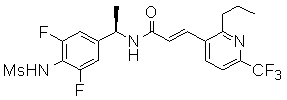
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (62 мг, 0,22 ммоль) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (56 мг, 0,22 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (81 мг, 73%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,50 (c ушир., 1H), 8,81 (д, 1H, J=7,8 Гц), 8,16 (д, 1H, J=8,4 Гц), 7,80 (д, 1H, J=7,8 Гц), 7,67 (д, 1H, J=15,6 Гц), 7,18 (д, 2H, J=7,2 Гц), 6,76 (д, 1H, J=15,6 Гц), 5,04 (м, 1H), 3,05 (c, 3H), 2,91 (м, 2H), 1,65 (м, 2H), 1,41 (д, 3H, J=6,9 Гц), 0,92 (т, 3H, J=7,2 Гц).
ESI [M+H]+: 492.
Пример 231: N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид
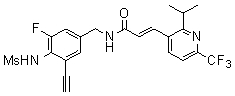
N-(4-Аминометил-6-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (75 мг, 0,27 ммоль) вводили в реакцию с 3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,27 ммоль), получая после очистки перекристаллизацией (Hex/EtOAc) N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид (54 мг, 42%).
1H ЯМР (300 МГц, CDCl3): δ 8,04 (д, 1H, J=15,6 Гц), 7,85 (д, 1H, J=7,8 Гц), 7,49 (д, 1H, J=8,4 Гц), 7,31 (c, 1H), 7,19 (м, 1H), 6,41 (c, 1H), 6,35 (д, 1H, J=15,6 Гц), 6,02 (c ушир., 1H), 4,55 (д, 2H, J=5,7 Гц), 3,49 (c, 1H), 3,48 (м, 1H), 3,27 (c, 3H), 1,32 (c, 3H), 1,29 (c, 3H).
ESI [M+H]+: 484.
Пример 232: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид
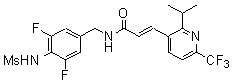
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (74 мг, 0,27 ммоль) вводили в реакцию с 3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,27 ммоль), получая после очистки перекристаллизацией (Hex/EtOAc) целевое соединение (46 мг, 36%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,60 (c, 1H), 8,89 (т, 1H, J=6,0 Гц), 8,15 (д, 1H, J=8,4 Гц), 7,78 (м, 2H), 7,13 (д, 1H, J=8,4 Гц), 6,72 (д, 1H, J=15,9 Гц), 4,43 (д, 2H, J=5,7 Гц), 3,47 (м, 1H), 3,04 (c, 3H), 1,24 (c, 3H), 1,21 (c, 3H).
Пример 233: N-(4-метансульфониламино-3-метил-бензил)-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид
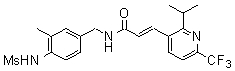
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (74 мг, 0,27 ммоль) вводили в реакцию с 3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (74 мг, 0,27 ммоль), получая после очистки перекристаллизацией (Hex/EtOAc) целевое соединение (61 мг, 50%).
1H ЯМР (300 МГц, CDCl3): δ 8,03 (д, 1H, J=15,6 Гц), 7,83 (д, 1H, J=8,1 Гц), 7,45 (м, 2H), 7,22 (c, 1H), 7,19 (c, 1H), 6,34 (д, 1H, J=15,3 Гц), 6,19 (c, 1H), 5,98 (c, 1H), 4,54 (д, 2H, J=6,0 Гц), 3,47 (м, 1H), 3,03 (c, 3H), 2,32 (c, 3H), 1,31 (c, 3H), 1,29 (c, 3H).
Пример 234: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид
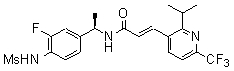
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (73 мг, 0,27 ммоль) вводили в реакцию с 3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,27 ммоль), получая после очистки перекристаллизацией (Hex/EtOAc) целевое соединение (69 мг, 54%).
1H ЯМР (300 МГц, CDCl3): δ 8,49 (д, 1H, J=15,6 Гц), 7,83 (д, 1H, J=8,1 Гц), 7,51 (м, 2H), 7,17 (м, 2H), 6,50 (c, 1H), 6,34 (д, 1H, J=15,9 Гц), 5,87 (c ушир., 1H), 5,21 (c ушир., 1H), 3,90 (д, 1H, J=5,1 Гц), 3,44 (м, 1H), 3,04 (c, 3H), 1,54 (c, 3H), 1,29 (c, 3H), 1,27 (c, 3H).
ESI [M+H]+: 474.
Пример 235: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-акриламид
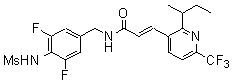
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (89 мг, 0,33 ммоль) вводили в реакцию с 3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (89 мг, 0,33 ммоль), получая после очистки перекристаллизацией (Hex/EtOAc=2:3) целевое соединение (33 мг, 20%).
1H ЯМР (300 МГц, CDCl3): δ 8,05 (д, 1H, J=15,6 Гц), 7,86 (д, 1H, J=7,8 Гц), 7,49 (д, 1H, J=7,8 Гц), 7,00 (д, 2H, J=7,8 Гц), 6,35 (д, 1H, J=15,3 Гц), 6,03 (c ушир., 2H), 4,57 (д, 2H, J=6,0 Гц), 3,22 (c, 3H), 1,88 (м, 2H), 1,66 (м, 1H), 1,27 (д, 2H, J=6,6 Гц), 0,82 (т, 3H, J=7,5 Гц).
Пример 236: (R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид
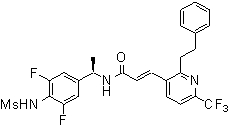
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (61,8 мг, 0,215 ммоль) вводили в реакцию с NMM (0,10 мл), DMTMM (93 мг) и 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (67 мг, 0,208 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (98,3 мг, 85%).
1H ЯМР (300 МГц, CDCl3): δ 7,84 (д, 1H, J=7,8 Гц), 7,76 (д, 1H, J=15,6 Гц), 7,51 (д, 1H, J=7,8 Гц), 7,19 (м, 4H), 6,95 (д, 1H, J=8,1 Гц), 6,48 (c, 1H), 6,27 (д, 1H, J=15,6 Гц), 6,12 (д, 1H), 5,14 (м, 1H), 3,24 (т, 2H, J=6,3 Гц), 3,18 (c, 3H), 3,07 (т, 2H, J=8,4 Гц).
Пример 237: (R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид
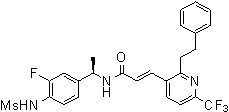
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (61,4 мг, 0,228 ммоль) вводили в реакцию с NMM (0,10 мл), DMTMM (97 мг) и 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (72 мг, 0,224 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (80,8 мг, 67%).
1H ЯМР (300 МГц, CDCl3): δ 7,83 (д, 1H, J=8,1 Гц), 7,76 (д, 1H, J=15,3 Гц), 7,55 (м, 2H), 7,19 (м, 5H), 6,528 (c, 1H), 6,22 (д, 1H, J=15,3 Гц), 5,83 (д, 1H, J=7,5 Гц), 5,20 (м, 1H J=6,9 Гц), 3,25 (т, 2H, J=7,8 Гц), 3,07 (т, 2H, J=7,8 Гц), 3,02 (c, 3H).
ESI [M+H]+: 554.
Пример 238: (R)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[(1R)-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид
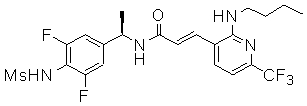
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (80 мг, 0,28 ммоль) вводили в реакцию с 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (96 мг, 0,33 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (140 мг, 96%).
1H ЯМР (300 МГц, ДМСО): δ 9,49 (c, 1H), 8,68 (д, 1H, J=7,2 Гц), 7,77 (д, 1H, J=7,2 Гц), 7,54 (д, 1H, J=15,3 Гц), 7,19-7,12 (м, 3H), 6,95 (д, 1H, J=7,8 Гц), 6,63 (д, 1H, J=15,6 Гц), 5,05-5,01 (м, 1H), 3,34-3,26 (м, 2H), 3,05 (c, 3H), 1,55-1,45 (м, 2H), 1,40 (д, 3H, J=5,7 Гц), 0,88 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 521.
Пример 239: (R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид
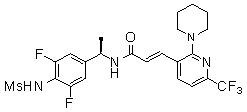
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (80 мг, 0,28 ммоль) вводили в реакцию с 3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (100 мг, 0,33 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (140 мг, 95%).
1H ЯМР (300 МГц, ДМСО): δ 9,95 (c, 1H), 8,68 (д, 1H, J=7,5 Гц), 7,99 (д, 1H, J=7,5 Гц), 7,42 (д, 1H, J=7,2 Гц), 7,41 (д, 1H, J=15,0 Гц), 7,25-7,15 (м, 3H), 6,74 (д, 1H, J=15,6 Гц), 5,06-5,02 (м, 1H), 3,32 (c, 4H, ушир.), 3,05 (c, 3H), 1,61 (c, 5H, ушир.), 1,40 (т, 3H, J=5,1 Гц).
ESI [M+H]+: 533.
Пример 240: (S)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[(1S)-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид
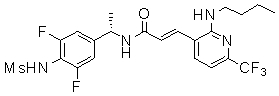
(S)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (40 мг, 0,14 ммоль) вводили в реакцию с 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (48 мг, 0,16 ммоль), получая после очистки кристаллизацией из простого эфира целевое соединение (57 мг, 80%).
1H ЯМР (300 МГц, ДМСО): δ 9,49 (c, 1H), 8,68 (д, 1H, J=7,5 Гц), 7,77 (д, 1H, J=7,5 Гц), 7,54 (д, 1H, J=15,3 Гц), 7,19-7,14 (м, 3H), 6,95 (д, 1H, J=7,8 Гц), 6,63 (д, 1H, J=15,3 Гц), 5,05-5,00 (м, 1H), 3,34-3,29 (м, 2H), 3,05 (c, 3H), 1,58-1,48 (м, 2H), 1,40 (д, 3H, J=6,9 Гц), 0,88 (т, 3H, J=7,5 Гц).
ESI [M+H]+: 521.
Пример 241: (R)-3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-N-1-(4-метансульфониламино-3-метил-бензил)-акриламид
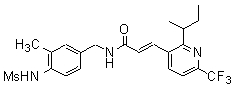
N-(4-Аминометил-2-метил-фенил)-метансульфонамид, соль HCl (98 мг, 0,359 ммоль) вводили в реакцию с NMM (0,10 мл), DMTMM (99 мг) и 3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (98 мг, 0,359 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (25 мг, 15%).
1H ЯМР (300 МГц, CDCl3): δ 8,03 (д, 1H, J=15 Гц), 7,84 (д, 1H, J=7,8 Гц), 7,45 (м, 2H), 7,22 (c, 1H), 6,99 (c ушир., 1H), 6,33 (д, 1H, J=15,3 Гц), 6,20 (c, 1H), 4,54 (д, 2H, J=5,7 Гц), 3,21 (м, 1H), 3,03 (c, 3H), 2,32 (c, 3H), 1,85 (м, 1H), 1,66 (м, 1H), 1,26 (д, 3H, J=6,6 Гц), 0,81 (т, 3H, J=7,2 Гц).
Пример 242: (R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид
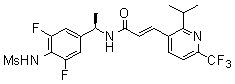
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (77 мг, 0,27 ммоль) вводили в реакцию с NMM (0,10 мл), DMTMM (90 мг) и 3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,27 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (75 мг, 57%).
1H ЯМР (300 МГц, CDCl3): δ 7,99 (д, 1H, J=15,6 Гц), 7,85 (д, 1H, J=7,8 Гц), 7,49 (д, 1H, J=8,1 Гц), 7,02 (c, 1H), 6,99 (c, 1H), 6,35 (д, 1H, J=15,3 Гц), 6,12 (c, 1H), 5,95 (д, 1H, J=7,2 Гц), 5,19 (м, 1H), 3,44 (м, 1H), 3,22 (c, 3H), 1,53 (д, 3H, J=6,6 Гц), 1,30 (c, 3H), 1,28 (c, 3H).
Пример 243: (R)-3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид
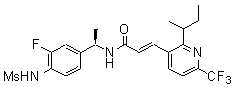
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (69 мг, 0,256 ммоль) вводили в реакцию с NMM (0,10 мл), DMTMM (85 мг) и 3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70 мг, 0,256 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (40 мг, 32%).
1H ЯМР (300 МГц, CDCl3): δ 8,00 (д, 1H, J=15,3 Гц), 7,84 (д, 1H, J=8,1 Гц), 7,56 (т, 1H, J=7,8 Гц), 7,48 (д, 1H, J=8,1 Гц), 7,19 (c, 1H), 7,16 (c, 1H), 6,46 (c, 1H), 6,32 (д, 1H, J=15,3 Гц), 5,85 (д, 1H, NH), 5,22 (м, 1H), 3,19 (м, 1H), 3,03 (c, 3H), 1,84 (м, 1H), 1,64 (м, 1H), 1,25 (дд, 3H, J=6,6Hz, 1,2 Гц), 0,80 (м, 3H).
Пример 244: (R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид
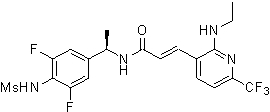
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (22 мг, 0,215 ммоль) вводили в реакцию с NMM (0,10 мл), DMTMM (43 мг) и 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (21 мг, 0,081 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (22 мг, 55%).
1H ЯМР (300 МГц, CDCl3): δ 8,02 (д, 1H), 7,92 (д, 1H, J=15,3 Гц), 7,62 (м, 3H), 7,08 (д, 1H, J=7,8 Гц), 6,53 (д, 1H, J=15,3 Гц), 5,20 (м, 1H), 3,20 (м, 2H), 2,99 (c, 3H), 1,56 (м, 2H), 1,49 (д, 3H, J=6,5 Гц), 0,87 (т, 3H, J=7,2 Гц).
Пример 245: (R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид
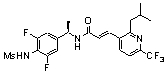
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (138 мг, 0,48 ммоль) вводили в реакцию с NMM (0,11 мл), DMTMM (138 мг, 0,499 ммоль) и 3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (127 мг, 0,467 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (178 мг, 74%).
1H ЯМР (300 МГц, CDCl3): δ 7,94 (д, 1H, J=4,2 Гц), 7,90 (д, 1H, J=2,7 Гц), 7,49 (д, 1H, J=8,1 Гц), 6,93 (д, 1H, J=8,4 Гц), 6,64 (c, 1H), 6,45 (д, 1H, J=15,3 Гц), 6,35 (д, 1H, J=7,5 Гц), 5,13 (м, 1H), 3,19 (c, 3H), 2,83 (д, 2H, J=7,2 Гц), 2,12 (м, 1H), 1,46 (д, 3H, J=6,9 Гц), 0,90 (д, 6H).
ESI [М-Н]-: 504.
Пример 246: N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-этиламино)-6-трифторметил-пиридин-3-ил-акриламид
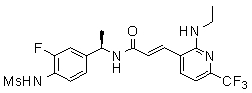
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (145 мг, 0,54 ммоль) вводили в реакцию с 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (140 мг, 0,54 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) целевое соединение (113 мг, 41%).
1H ЯМР (300 МГц, CDCl3): δ 7,58 (м, 3H), 7,18 (c, 1H), 7,14 (м, 1H), 6,90 (д, 1H, J=7,2 Гц), 6,48 (c, 1H), 6,33 (д, 1H, J=15,0 Гц), 5,82 (c ушир., 1H), 5,21 (м, 1H), 4,78 (c ушир., 1H), 3,53 (м, 2H), 3,03 (c, 3H), 1,56 (д, 3H, J=5,5 Гц), 1,25 (т, 3H, J=7,5 Гц).
ESI [М-Н]-: 473.
Пример 247: N-(4-метансульфониламино-3-метил-бензил)-3-(2-этиламино-6-трифторметил)-пиридин-3-ил-акриламид
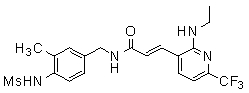
N-(4-Аминометил-3-метил-фенил)-метансульфонамид, соль HCl (78 мг, 0,284 ммоль) вводили в реакцию с 2-этиламино-6-трифторметил-пиридин-3-ил-акриловой кислотой (74 мг, 0,284 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2:3) целевое соединение (83 мг, 64%).
1H ЯМР (300 МГц, CDCl3): δ 7,66 (д, 1H, J=14,7 Гц), 7,57 (м, 1H), 7,19 (м, 2H), 6,90 (м, 1H), 6,35 (д, 1H, J=15,3 Гц), 6,30 (c, 1H), 5,96 (c, 1H), 4,86 (c, 1H), 4,53 (д, 2H, J=5,4 Гц), 3,54 (м, 2H), 3,02 (c, 3H), 2,31 (c, 3H), 1,26 (т, 3H, J=6,6 Гц).
ESI [М-Н]-: 455.
Пример 248: N-(2,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид
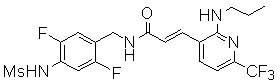
N-(4-Аминометил-2,5-дифтор-фенил)-метансульфонамид, соль HCl (33 мг, 0,12 ммоль) вводили в реакцию с 3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (38 мг, 0,14 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (35 мг, 59%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,84 (c ушир., 1H), 8,69 (т, 1H, J=5,7 Гц), 7,77 (д, 1H, J=7,5 Гц), 7,59 (д, 1H, J=15,6 Гц), 7,25 (м, 2H), 7,14 (м, 1H), 6,96 (д, 1H, J=7,5 Гц), 6,62 (д, 1H, J=15,6 Гц), 4,39 (д, 2H, J=5,4 Гц), 3,28 (м, 2H), 3,07 (c, 3H), 1,57 (м, 2H), 0,87 (т, 3H, J=7,2 Гц).
ESI [М-Н]-: 491.
Пример 249: 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид
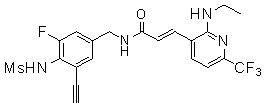
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (301 мг, 1,07 ммоль) вводили в реакцию с 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (200 мг, 0,76 ммоль), получая после очистки перекристаллизацией из простого диэтилового эфира целевое соединение (110 мг, 74%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,45 (c, 1H), 8,75 (т, 1H, J=6,0 Гц), 7,80 (д, 1H, J=7,5 Гц), 7,59 (д, 1H, J=15,6 Гц), 7,30 (c, 1H), 7,29 (д, 1H, J=9,0 Гц), 7,13 (т, 1H, J=5,1 Гц), 6,96 (д, 1H, J=7,8 Гц), 6,63 (д, 1H, J=15,3 Гц), 4,51 (c, 1H), 4,39 (д, 2H, J=6,0 Гц), 3,41-3,37 (м, 2H), 3,06 (c, 3H), 1,14 (т, 3H, J=6,9 Гц).
ESI [М-Н]-: 483.
Пример 250: 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-винил-бензил)-акриламид
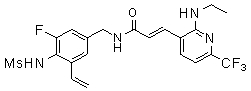
N-(4-Аминометил-2-фтор-6-винил-фенил)-метансульфонамид, соль HCl (258 мг, 0,92 ммоль) вводили в реакцию с 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (200 мг, 0,76 ммоль), получая после очистки перекристаллизацией из простого диэтилового эфира целевое соединение (270 мг, 60%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,32 (c, 1H), 8,74 (т, 1H, J=6,0 Гц), 7,79 (д, 1H, J=7,5 Гц), 7,58 (д, 1H, J=15,3 Гц), 7,50 (c, 1H), 7,18-7,04 (м, 2H), 6,96 (д, 1H, J=7,8 Гц), 6,64 (д, 1H, J=15,6 Гц), 5,86 (д, 1H, J=18,0 Гц), 5,42 (д, 1H, J=11,4 Гц), 4,42 (д, 2H, J=5,7 Гц), 3,50-3,40 (м, 2H), 3,00 (c, 3H), 1,13 (т, 3H, J=6,9 Гц).
ESI [М-Н]-: 485.
Пример 251: N-(2-хлор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид
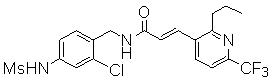
Смесь N-(4-аминометил-3-хлор-фенил)-метансульфонамид, соль HCl и N-(4-аминометил-фенил)-метансульфонамид, соль HCl (80 мг) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (76 мг, 0,28 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (77 мг, 57%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,98 (c ушир., 1H), 8,76 (т, 1H, J=5,7 Гц), 8,15 (д, 1H, J=7,8 Гц), 7,79 (д, 1H, J=7,8 Гц), 7,70 (д, 1H, J=15,9 Гц), 7,36 (д, 1H, J=8,4 Гц), 7,27 (д, 1H, J=2,4 Гц), 7,17 (дд, 1H, J=8,4 и 2,4 Гц), 6,78 (д, 1H, J=15,9 Гц), 4,43 (д, 2H, J=5,4 Гц), 3,02 (c, 3H), 2,91 (м, 2H), 1,66 (м, 2H), 0,93 (т, 3H, J=7,5 Гц).
ESI [М-Н]-: 474.
Пример 252: N-(4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид
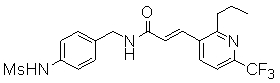
Смесь N-(4-аминометил-3-хлор-фенил)-метансульфонамид, соль HCl и N-(4-аминометил-фенил)-метансульфонамид, соль HCl (80 мг) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (76 мг, 0,28 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (50 мг, 39%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,69 (c ушир., 1H), 8,77 (т, 1H, J=5,7 Гц), 8,14 (д, 1H, J=7,8 Гц), 7,78 (д, 1H, J=7,8 Гц), 7,71 (д, 1H, J=15,9 Гц), 7,28 (д, 2H, J=8,4 Гц), 7,18 (д, 2H, J=8,4 Гц), 6,73 (д, 1H, J=15,9 Гц), 4,37 (д, 2H, J=5,7 Гц), 3,00 (м, 5H), 1,66 (м, 2H), 0,93 (т, 3H, J=7,5 Гц).
ESI [М-Н]-: 440.
Пример 253: N-(3-хлор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил)-пиридин-3-ил-акриламид
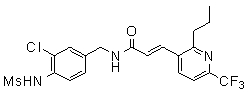
N-(4-Аминометил-2-хлор-фенил)-метансульфонамид, соль HCl (58 мг, 0,22 ммоль) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (60 мг, 0,22 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) целевое соединение (65 мг, 62%).
1H ЯМР (300 МГц, CDCl3): δ 7,98 (м, 1H), 7,89 (м, 1H), 7,46 (м, 4H), 6,38 (д, 1H, J=15,3 Гц), 6,02 (c ушир., 1H), 4,59 (дд, 2H, J=7,8 Hz, 6,0 Гц), 3,49 (c, 3H), 1,76 (м, 2H), 1,26 (м, 2H), 1,01 (м, 3H).
Пример 254: N-(3-хлор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил)-пиридин-3-ил-акриламид
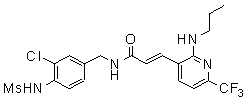
N-(3-Хлор-4-аминометил-фенил)-метансульфонамид, соль HCl (61 мг, 0,22 ммоль) вводили в реакцию с 3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (60 мг, 0,22 ммоль), получая целевое соединение (73 мг, 68%) после очистки хроматографией на колонках (Hex/EtOAc=1:1).
1H ЯМР (300 МГц, CDCl3): δ 7,59 (м, 3H), 7,31 (м, 2H), 6,90 (м, 1H), 6,84 (c ушир., 1H), 6,36 (д, 1H, J=15,0 Гц), 6,13 (c ушир., 1H), 4,55 (дд, 2H, J=14,1Hz, 6,3 Гц), 3,48 (c, 3H), 1,65 (м, 4H), 0,97 (т, 3H, J=7,2 Гц).
Пример 255: N-(2,5-дифтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил)-пиридин-3-ил-акриламид
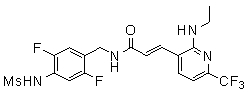
N-(4-Аминометил-2,5-дифтор-фенил)-метансульфонамид, соль HCl (61 мг, 0,22 ммоль) вводили в реакцию с 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (58 мг, 0,22 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) целевое соединение (20 мг, 18%).
1H ЯМР (300 МГц, CDCl3): δ 8,91 (м, 1H), 8,22 (м, 1H), 7,67 (д, 1H, J=15,3 Гц), 7,57 (д, 1H, J=7,5 Гц), 6,87 (м, 2H), 6,36 (д, 1H, J=15,0 Гц), 6,25 (c ушир., 1H), 5,01 (c ушир., 1H), 4,53 (д, 2H, J=6,0 Гц), 3,06 (c, 3H), 3,04 (м, 2H), 1,25 (м, 3H).
ESI [М-Н]-: 477.
Пример 256: 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид
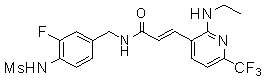
N-(4-Аминометил-2-фтор-фенил)-метансульфонамид, соль HCl (117 мг, 0,46 ммоль) вводили в реакцию с 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (100 мг, 0,38 ммоль), получая после очистки перекристаллизацией из простого диэтилового эфира целевое соединение (118 мг, 56%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,55 (c, 1H), 8,71 (т, 1H, J=6,0 Гц), 7,78 (д, 1H, J=7,2 Гц), 7,58 (д, 1H, J=15,3 Гц), 7,34 (т, 1H, J=8,1 Гц), 7,21 (дд, 1H, J=11,4, 1,8 Гц), 7,14-7,11 (м, 2H), 6,96 (д, 1H, J=7,5 Гц), 6,63 (д, 1H, J=15,6 Гц), 4,39 (д, 2H, J=5,7 Гц), 3,42-3,37 (м, 2H), 3,00 (c, 3H), 1,14 (т, 3H, J=6,9 Гц).
ESI [М-Н]-: 459.
Пример 257: N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид
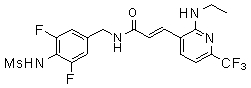
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (125 мг, 0,46 ммоль) вводили в реакцию с 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (100 мг, 0,38 ммоль), получая после очистки перекристаллизацией из простого диэтилового эфира целевое соединение (110 мг, 60%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,50 (c, 1H), 8,76 (т, 1H, J=6,0 Гц), 7,80 (д, 1H, J=7,8 Гц), 7,59 (д, 1H, J=15,3 Гц), 7,13 (c, 1H), 7,13 (д, 1H, J=8,4 Гц), 6,96 (д, 1H, J=7,5 Гц), 6,64 (д, 1H, J=15,6 Гц), 4,41 (д, 2H, J=6,0 Гц), 3,42-3,35 (м, 2H), 3,04 (c, 3H), 1,14 (т, 3H, J=6,9 Гц).
ESI [М-Н]-: 477.
Пример 258: 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид
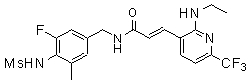
N-(4-Аминометил-2-фтор-6-метил-фенил)-метансульфонамид, соль HCl (124 мг, 0,46 ммоль) вводили в реакцию с 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (100 мг, 0,38 ммоль), получая после очистки перекристаллизацией из простого диэтилового эфира целевое соединение (230 мг, 62%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,26 (c, 1H), 8,64 (т, 1H, J=6,0 Гц), 7,75 (д, 1H, J=7,5 Гц), 7,57 (д, 1H, J=15,6 Гц), 7,22-7,17 (м, 1H), 6,96 (д, 1H, J=7,8 Гц), 6,63 (д, 1H, J=15,6 Гц), 4,41 (д, 2H, J=5,4 Гц), 3,42-3,37 (м, 2H), 2,98 (c, 3H), 2,21 (c, 3H), 1,14 (т, 3H, J=6,9 Гц).
ESI [М-Н]-: 473.
Пример 259: N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид
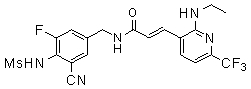
N-(4-Аминометил-2-циано-6-фтор-фенил)-метансульфонамид, соль HCl (129 мг, 0,46 ммоль) вводили в реакцию с 3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (100 мг, 0,38 ммоль), получая после очистки перекристаллизацией из простого диэтилового эфира целевое соединение (113 мг, 54%).
1H ЯМР (300 МГц, ДМСО-d6): δ 10,07 (c, 1H), 8,79 (т, 1H, J=6,0 Гц), 7,80 (д, 1H, J=7,2 Гц), 7,66-7,56 (м, 3H), 7,13 (т, 1H, J=8,1 Гц), 6,97 (д, 1H, J=7,5 Гц), 6,64 (д, 1H, J=15,6 Гц), 4,45 (д, 2H, J=5,7 Гц), 3,42-3,38 (м, 2H), 3,11 (c, 3H), 1,14 (т, 3H, J=6,9 Гц).
Пример 260: 3-этинил-5-фтор-4-метансульфониламино-бензиламид 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-пропиновой кислоты
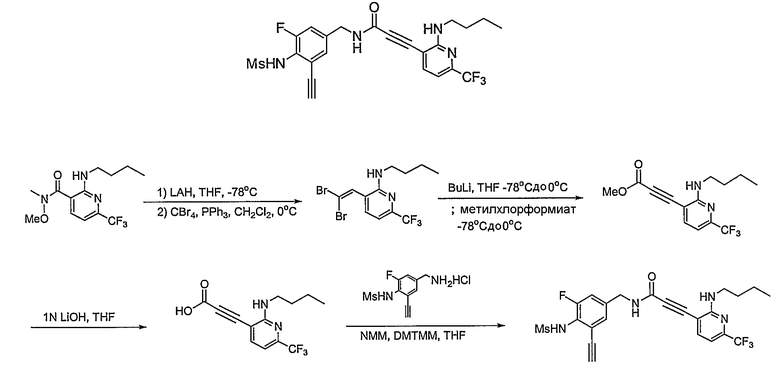
Стадия 1: бутил-[3-(2,2-дибромвинил)-6-трифторметил-пиридин-2-ил]-амин
Раствор 2-бутиламино-N-метокси-N-метил-6-трифторметил-никотинамида (2,00 г, 6,55 ммоль) в ТГФ (50 мл) охлаждали до -78°C и добавляли по каплям 1 M LiAlH4 в ТГФ (3,3 мл, 3,3 ммоль). Полученную смесь перемешивали в течение 1 часа при -78°C и затем медленно нагревали до -20°C в течение 2 часов, после чего гасили, добавляя 10%-ный натрий-калийтартрат, затем EtOAc. После энергичного перемешивания в течение 30 минут при комнатной температуре разделяли две фазы, и водную фазу экстрагировали дважды EtOAc. Объединенный органический слой промывали солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая альдегид.
Раствор тетрабромида углерода (4,35 г, 13,1 ммоль) в метиленхлориде в атмосфере азота при 0°C обрабатывали трифенилфосфином (6,87 г, 26,2 ммоль) и перемешивали в течение 1 ч при 0°C. Смесь обрабатывали альдегидом, полученным выше, перемешивали в течение 1 ч при 0°C и затем гасили водой. Отделенную органическую фазу промывали солевым раствором, высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток обрабатывали гексаном и собирали супернатант. Остаток растворяли в метиленхлориде и вливали в гексан. Супернатант собирали. Процедуру повторяли еще два раза. Объединенный супернатант пропускали через силикагель и затем концентрировали, получая целевое соединение (1,60 г, 61%).
1H ЯМР (300 МГц, CDCl3): δ 7,51 (д, 1Н, J=7,8 Гц), 7,09 (c., 1H), 6,89 (д, 1Н, J=7,8 Гц), 4,40 (c. ушир., 1H), 3,45 (м, 2H), 1,58 (м, 2H), 1,36 (м, 2H), 0,92 (т, 3H, J=7,2 Гц).
Стадия 2: метиловый эфир (2-бутиламино-6-трифторметил-пиридин-3-ил)-пропиновой кислоты
Раствор бутил-[3-(2,2-дибромвинил)-6-трифторметил-пиридин-2-ил]-амина (1,02 г, 2,54 ммоль) в ТГФ в атмосфере азота при -78°C медленно обрабатывали 2,5 М BuLi в гексане (2,0 мл, 5,00 ммоль) и затем перемешивали в течение 30 мин при -78°C и 30 мин при -0°C. Смесь обрабатывали метилхлорформиатом (0,235 мл, 3,05 ммоль) при -78°C и нагревали до 0°C в течение 1 ч. Смесь разбавляли 1:1 смесью насыщенного NaHCO3 и раствора NH4Cl, и водный слой экстрагировали простым эфиром (×3). Объединенный органический слой высушивали над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Сырой остаток очищали хроматографией (Hex/EtOAc=10/1), получая целевое соединение (78 мг, 10%).
1H ЯМР (300 МГц, CDCl3): δ 7,85 (д, 1Н, J=7,8 Гц), 7,52 (д, 1Н, J=7,8 Гц), 3,78 (м, 2H), 3,64 (c, 3H), 1,48 (м, 2H), 1,26 (м, 2H), 0,82 (т, 3H, J=7,5 Гц).
Стадия 3: (2-бутиламино-6-трифторметил-пиридин-3-ил)-пропиновая кислота
К суспензии метилового эфира (2-бутиламино-6-трифторметил-пиридин-3-ил)-пропиновой кислоты (78 мг, 0,26 ммоль) в ТГФ (0,50 мл) добавляли 1 н. раствор LiOH (1,0 мл), и смесь перемешивали в течение 3 часов при комнатной температуре. Реакционную смесь подкисляли 1 н. HCl до рН 1~2. Раствор экстрагировали три раза метиленхлоридом и затем высушивали над безвод. Na2SO4, и концентрировали в вакууме, получая целевое соединение (50 мг, 65%).
1H ЯМР (300 МГц, ДМСО-d6): δ 8,17 (д, 1Н, J=7,8 Гц), 7,80 (д, 1Н, J=7,8 Гц), 3,71 (м, 5H), 1,47 (м, 2H), 1,26 (м, 2H), 0,81 (т, 3H, J=7,2 Гц).
Стадия 4: 3-этинил-5-фтор-4-метансульфониламино-бензиламид 3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-пропиновой кислоты
N-(4-Аминометил-2-этинил-6-фтор-фенил)-метансульфонамид, соль HCl (80 мг, 0,29 ммоль) вводили в реакцию с (2-бутиламино-6-трифторметил-пиридин-3-ил)-пропиновой кислотой (70 мг, 0,24 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (84 мг, 57%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,46 (м, 2H), 8,38 (д, 1H, J=7,8 Гц), 7,92 (д, 1H, J=7,8 Гц), 7,27 (м, 2H), 4,53 (c, 1H), 4,36 (д, 2H, J=5,7 Гц), 3,77 (м, 2H), 3,07 (c, 3H), 1,51 (м, 2H), 1,28 (м, 2H), 0,82 (т, 3H, J=7,2 Гц).
Пример 261: 3,5-дифтор-4-метансульфониламино-бензиламид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты
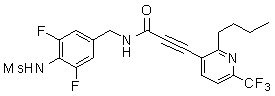
N-(4-Аминометил-2,6-дифтор-фенил)-метансульфонамид, соль HCl (82 мг, 0,30 моль) вводили в реакцию с (2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислотой (68 мг, 0,25 ммоль), полученной, как описано на стадиях 1-3 из примера 260, получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (74 мг, 50%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,55 (т, 1H, J=5,7 Гц), 9,50 (c ушир., 1H), 8,25 (д, 1H, J=8,1 Гц), 7,83 (д, 1H, J=8,1 Гц), 7,13 (д, 2H, J=8,4 Гц), 4,40 (д, 2H, J=6,0 Гц), 3,03 (м, 5H), 1,70 (м, 2H), 1,36 (м, 2H), 0,91 (т, 3H, J=7,2 Гц).
Пример 262: [1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты
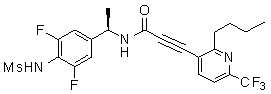
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (86 мг, 0,30 моль) вводили в реакцию с (2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислотой (68 мг, 0,25 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (76 мг, 50%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,24 (д, 1H), 8,25 (д, 1H, J=8,1 Гц), 7,83 (д, 1H, J=8,1 Гц), 7,19 (д, 2H, J=8,7 Гц), 5,02 (т, 1H), 3,06 (м, 5H), 1,70 (м, 2H), 1,38 (м, 5H), 0,92 (т, 3H, J=7,2 Гц).
ESI [М-Н]-: 502.
Пример 263: 2-хлор-4-метансульфониламино-бензиламид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты
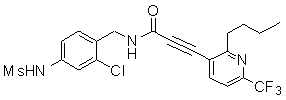
Смесь N-(4-аминометил-3-хлор-фенил)-метансульфонамид, соль HCl и N-(4-аминометил-фенил)-метансульфонамид, соль HCl (80 мг) вводили в реакцию с (2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислотой (76 мг, 0,28 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (80 мг, 55%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,99 (c. ушир., 1H), 9,44 (c. ушир., 1H), 8,23 (д, 1H, J=7,8 Гц), 7,82 (д, 1H, J=8,1 Гц), 7,27 (м, 3H), 4,41 (д, 2H, J=6,0 Гц), 3,03 (м, 5H), 1,69 (м, 2H), 1,36 (м, 2H), 0,91 (т, 3H, J=7,2 Гц).
Пример 264: N-(4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид
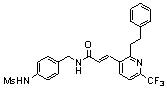
N-[4-(1-Аминометил)-фенил]-метансульфонамид, соль HCl (111 мг, 0,47 ммоль) вводили в реакцию с NMM (0,11 мл), DMTMM (138 мг, 0,499 ммоль) и 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (132 мг, 0,472 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (144 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,83 (д, 1H, J=8,7 Гц), 7,80 (д, 1H, J=15,6 Гц), 7,49 (д, 1H, J=8,1 Гц), 7,53 (д, 1H, J=7,8 Гц), 7,33 (м, 2H), 7,18 (м, 6H), 6,71 (c, 1H), 6,22 (д, 1H, J=15,3 Гц), 5,99 (м, 1H), 4,54 (д, 2H, J=5,7 Гц), 3,28 (м, 2H), 3,10 (м, 2H), 3,08 (м, 3H).
Пример 265: 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-бензил)-акриламид
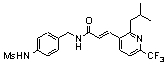
N-[4-(1-Аминометил)-фенил]-метансульфонамид, соль HCl (117 мг, 0,496 ммоль) вводили в реакцию с NMM (350 мкл), DMTMM (165 мг) и 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (116 мг, 0,498 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/2) целевое соединение (92 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,93 (д, 1H, J=15,6 Гц), 7,90 (д, 1H, J=9,3 Гц), 7,46 (д, 1H, J=8,1 Гц), 7,31 (c, 1H), 7,23 (м, 4H), 6,48 (м, 1H), 6,44 (д, 1H, J=15,3 Гц), 4,51 (д, 2H, J=6,0 Гц), 2,97 (c, 3H), 2,83 (д, J=6,9 Гц), 2,15 (м, 1H), 0,90 (д, 6H).
Пример 266: 4-метансульфониламино-бензиламид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты
Смесь N-(4-аминометил-3-хлор-фенил)-метансульфонамид, соль HCl и N-(4-аминометил-фенил)-метансульфонамид, соль HCl (80 мг) вводили в реакцию с (2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты (76 мг, 0,28 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (45 мг, 33%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,72 (c. ушир., 1H), 9,45 (c. ушир., 1H), 8,24 (д, 1H, J=7,8 Гц), 7,83 (д, 1H, J=8,1 Гц), 7,27 (д, 2H, J=8,4 Гц), 7,18 (д, 2H, J=8,4 Гц), 4,34 (д, 2H, J=6,0 Гц), 2,97 (м, 5H), 1,70 (м, 2H), 1,36 (м, 2H), 0,91 (т, 3H, J=7,2 Гц).
ESI [М-Н]-: 452.
Пример 267: N-(4-этенсульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид
N-[4-(1-Аминометил)-фенил]-этенсульфонамид, соль HCl (97,8 мг, 0,392 ммоль) вводили в реакцию с NMM (0,2 мл), DMTMM (121 мг) и 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (97,9 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (62 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,86 (c, 1H), 7,65 (д, 1H, J=15,3 Гц), 7,51 (д, 1H, J=7,8 Гц), 7,11 (д, 2H, J=8,4 Гц), 7,01 (д, 2H, J=6,6 Гц), 6,77 (д, 1H, J=7,8 Гц), 6,46 (м, 1H), 6,40 (д, 1H, J=19,2 Гц), 6,15 (д, 1H, J=16,5 Гц), 5,85 (д, 1H, J=9,6 Гц), 5,00 (д, 1H), 4,43 (д, 2H, J=6,0 Гц), 4,30 (м, 1H), 1,20 (д, 6H).
ESI [М-Н]-: 467.
Пример 268: N-(4-этенсульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид
N-[4-(1-Аминометил)-фенил]-этенсульфонамид, соль HCl (95,5 мг, 0,384 ммоль) вводили в реакцию с NMM (0,2 мл), DMTMM (116 мг) и 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (99,9 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (17 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,83 (c, 1H), 7,80 (д, 1H, J=15,3 Гц), 7,48 (д, 1H, J=8,1 Гц), 7,22 (м, 6H), 6,47 (д, 1H, J=9,9 Гц), 6,30 (д, 1H, J=15,3 Гц), 6,20 (д, 1H, J=16,5 Гц), 5,89 (д, 1H, J=9,6 Гц), 4,47 (д, 2H, J=5,7 Гц), 3,32 (м, 2H), 3,04 (м, 2H).
Пример 269: N-(4-этенсульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид
N-[4-(1-аминометил)-фенил]-этенсульфонамид, соль HCl (96,6 мг, 0,388 ммоль) вводили в реакцию с NMM (0,2 мл), DMTMM (124,8 мг) и 3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (107,2 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (19 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,95 (д, 1H, J=15,6 Гц), 7,88 (д, 1H, J=7,5 Гц), 7,50 (д, 1H, J=8,1 Гц), 7,26 (м, 2H), 7,12 (м, 2H), 6,96 (c, 1H), 6,40 (д, 1H, J=15,6 Гц), 6,27 (д, 1H, J=16,5 Гц), 6,20 (м, 1H), 5,96 (д, 1H, J=9,6 Гц), 4,53 (д, 2H, J=5,7 Гц), 2,86 (д, 1H, J=7,2 Гц), 2,15 (м, 1H), 0,92 (д, 6H, J=6,6 Гц).
Пример 270: 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-N-(4-трифторметансульфониламино-бензил)-акриламид
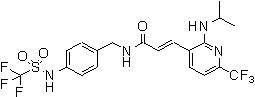
N-[4-(1-Аминометил)-фенил]-трифторметансульфонамид, соль HCl (78,4 мг) вводили в реакцию с NMM (0,2 мл), DMTMM (119,8 мг) и 3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриловой кислотой (70,8 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (20 мг).
1H ЯМР (300 МГц, CDCl3): δ 8,08 (c, 1H), 7,61 (м, 3H), 7,28 (м, 1H), 7,10 (д, 1H, J=8,1 Гц), 6,87 (м, 1H), 6,65 (д, 1H, J=8,4 Гц), 6,32 (д, 1H, J=16,5 Гц), 4,72 (м, 1H), 4,44 (д, 2H, J=8,4 Гц), 4,35 (м, 1H), 1,25 (д, 6H).
ESI [М-Н]-: 509.
Пример 271: 1-(3-хлор-4-метансульфониламино-бензиламид (Z)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты
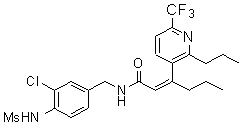
1H ЯМР (300 МГц, CDCl3): δ 7,58 (д, 1H, J=8,1 Гц), 7,52 (д, 1H, J=8,1 Гц), 7,41 (д, 1H, J=8,1 Гц), 7,25 (м, 1H), 7,10 (м, 1H), 6,73 (c, 1H), 5,76 (c, 1H), 5,63 (т, 1H, J=7,5 Гц), 4,34 (д, 2H, J=6,0 Гц), 3,33 (c, 2H), 3,01 (c, 3H), 2,74 (м, 2H), 2,29 (м, H), 1,74 (м, 2H), 1,10 (т, 1H, J=7,5 Гц), 0,94 (т, 3H, J=7,5 Гц).
Пример 272: 1-(3-хлор-4-метансульфониламино-бензиламид (E)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты
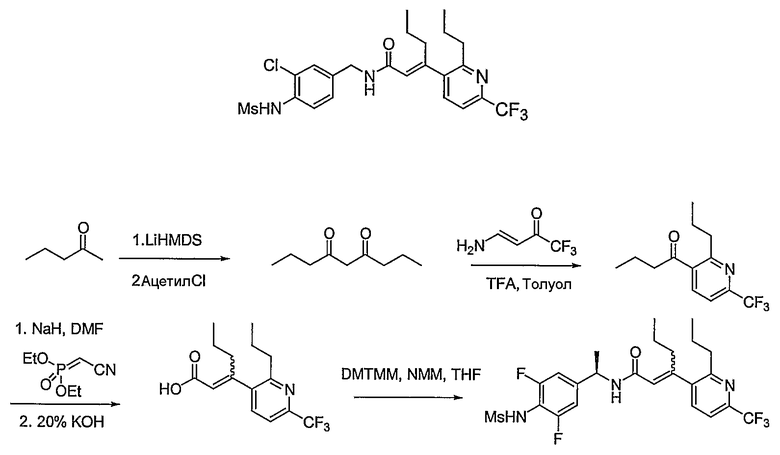
Стадия 1: 3-пропионил-2-пропил-6-трифторметил-пиридин
2-Пентанон (1 мл, 9,4 ммоль) растворяли в 15 мл сухого толуола в двугорлой колбе, и раствор охлаждали до 0°C в токе аргона. LiHMDS (9,4 мл, 1,0 М в ТГФ, 2,1 ммоль) добавляли через шприц при перемешивании, и полученный анион выдерживали в течение 1 минуты, после чего добавляли бутирилхлорид (0,49 мл, 4,7 ммоль) в виде одной части при перемешивании. Колбу затем удаляли из ванны со льдом и оставляли на 1 минуту, и добавляли при перемешивании 1 M раствор HCl. Смесь раствора экстрагировали EtOAc. Органическую смесь затем промывали солевым раствором, высушивали над Na2SO4 и упаривали при пониженном давлении. К раствору полученного сырого остатка в толуоле (20 мл) добавляли 4-амино-1,1,1-трифтор-3-бутен-2-он (0,72 г, 4,7 ммоль) и трифторуксусную кислоту (0,42 мл, 5,64 ммоль) и смесь перемешивали с обратным холодильником в течение 24 часов. Реакционную смесь промывали 20% водным раствором Na2CO3 и высушивали с использованием Na2SO4. После удаления растворителя остаток подвергали хроматографии на колонках с силикагелем, получая целевое соединение (0,62 г, 51%).
1H ЯМР (300 МГц, CDCl3): δ 7,91 (д, 1H, J=8,1 Гц), 7,57 (д, 1H, J=7,8 Гц), 2,90 (м, 4H), 1,76 (м, 4H), 1,00 (м, 4H).
Стадия 2: 3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновая кислота
Раствор 3-пропионил-2-пропил-6-трифторметил-пиридина (0,62 г, 2,39 ммоль) и диэтилового эфира цианометилфосфоновой кислоты (1,1 экв., 2,7 г) в DMF помещали в одногорлую круглодонную колбу на 50 мл, затем порциями добавляли NaH (144 мг, 3,59 ммоль) и смесь перемешивали в течение 18 часов при комнатной температуре. Реакционную смесь гасили 10 мл воды со льдом. Реакционную смесь экстрагировали этилацетатом и затем промывали 1 н. раствором HCl, и объединенный органический слой высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученную жидкость гидролизовали 20%-ным раствором KOH при нагревании с обратным холодильникомом в течение ночи. После этого смесь промывали EtOAc, водную фазу подкисляли HCl и экстрагировали 50 мл EtOAc три раза. Объединенный органический слой концентрировали при пониженном давлении, получая сырой остаток (0,349 г, 49%). Сырой остаток использовали на следующей стадии без дальнейшей очистки.
Стадия 3: 1-(3-хлор-4-метансульфониламино-бензиламид (E)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты
N-(3-Хлор-4-аминометил-фенил)-метансульфонамид, соль HCl (69 мг, 0,23 ммоль) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислотой (59 мг, 0,23 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) целевое соединение (69 мг, 58%).
1H ЯМР (300 МГц, CDCl3): δ 7,58 (д, 1H, J=8,4 Гц), 7,45 (м, 2H), 7,10 (м, 1H), 6,73 (c. ушир., 1H), 5,82 (тс, 1H), 5,75 (c. ушир., 1H), 4,33 (д, 2H, J=6,3 Гц), 3,20 (м, 2H), 3,01 (c, 3H), 2,71 (м, 2H), 1,74 (м, 4H), 0,94 (м, 3H).
ESI [М-Н]-: 516.
Пример 273: 3-фтор-4-метансульфониламино-5-метил-бензиламид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты
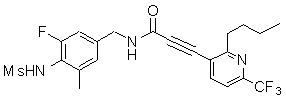
N-(4-Аминометил-2-хлор-6-метил-фенил)-метансульфонамид, соль HCl (60 мг, 0,30 моль) вводили в реакцию с (2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислотой (50 мг, 0,18 ммоль), получая после очистки кристаллизацией из смеси Hex/EtOAc целевое соединение (48 мг, 55%).
1H ЯМР (300 МГц, ДМСО-d6): δ 9,46 (т, 1H), 9,18 (c. ушир., 1H), 8,23 (д, 1H, J=7,8 Гц), 7,82 (д, 1H, J=7,8 Гц), 7,17 (м, 2H), 4,39 (д, 2H, J=5,4 Гц), 3,00 (м, 5H), 2,22 (д, 3H), 1,69 (м, 2H), 1,35 (м, 2H), 0,90 (т, 3H, J=7,5 Гц).
Пример 274: [1-(3-фтор-4-метансульфониламино-фенил)-этил]-амид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты
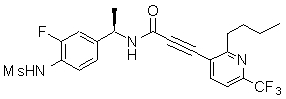
(R)-N-[4-(1-Аминоэтил)-2-фторфенил]-метансульфонамид, соль HCl (91 мг, 0,34 моль) вводили в реакцию с (2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислотой (92 мг, 0,34 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (68 мг, 43%).
1H ЯМР (300 МГц, CDCl3): δ 7,90 (д, 1H, J=7,8 Гц), 7,50 (д, 1H, J=7,8 Гц), 6,97 (м, 2H), 6,77 (т, 3H, J=8,4 Гц), 6,04 (д, 1H, J=7,5 Гц), 5,12 (м, 1H), 3,03 (м, 5H), 1,77 (м, 2H), 1,55 (м, 3H), 1,40 (м, 2H), 0,95 (т, 3H, J=7,2 Гц).
Пример 275: 1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид (Z)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты
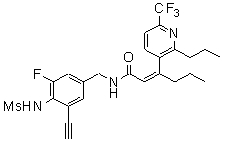
1H ЯМР (300 МГц, CDCl3): δ 7,46 (м, 3H), 7,14 (c, 1H), 6,97 (м, 1H), 6,42 (c, 1H), 5,83 (c, 1H), 5,62 (т, 1H, J=7,5 Гц), 4,32 (д, 2H, J=6,0 Гц), 3,48 (c, 1H), 3,26 (c, 3H), 2,75 (м, 2H), 2,29 (м, 2H), 1,75 (м, 4H), 1,10 (м, 3H), 0,94 (м, 3H).
Пример 276: 1-(3-этинил-5-фтор-4-метансульфониламино-бензиламид (E)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты
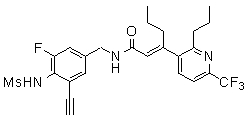
N-(4-Аминометил-5-этинил-2-фтор-фенил)-метансульфонамид, соль HCl (113 мг, 0,41 ммоль) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислотой (122 мг, 0,41 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) 1-(3-этинил-5-фтор-4-метансульфониламино-бензиламид (E)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты (139 мг, 65,3%).
1H ЯМР (300 МГц, CDCl3): δ 7,44 (c, 2H), 7,15 (c, 1H), 6,98 (м, 1H), 6,41 (c, 1H), 5,83 (м, 2H), 4,32 (д, 2H, J=6,0 Гц), 3,49 (c, 1H), 3,27 (c, 3H), 2,71 (м, 2H), 1,74 (м, 4H), 1,26 (м, 2H), 0,95 (м, 6H).
ESI [М-Н]-: 524.
Пример 277: [1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид (Z)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты
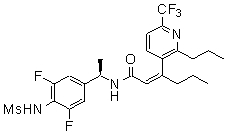
1H ЯМР (300 МГц, CDCl3): δ 7,44 (м, 2H), 6,82 (c, 1H), 6,79 (c, 1H), 6,14 (c, 1H), 5,62 (т, 1H, J=7,2 Гц), 4,97 (м, 1H), 4,12 (м, 1H), 3,25 (м, 2H), 3,21 (c, 3H), 2,74 (м, 2H), 2,27 (м, 2H), 1,74 (м, 2H), 1,37 (д, 3H, J=7,2 Гц), 1,10 (т, 3H, J=7,8 Гц), 0,95 (т, 3H, J=7,5 Гц).
ESI [М-Н]-: 532.
Пример 278: [1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид (E)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты
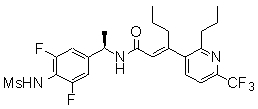
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (150 мг, 0,52 ммоль) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислотой (158 мг, 0,52 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1:1) 1-(3-этинил-5-фтор-4-метансульфониламино-бензиламид (E)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты (162 мг, 58%).
1H ЯМР (300 МГц, CDCl3): δ 7,44 (c, 1H), 7,40 (c, 1H), 6,87 (д, 2H, J=8,4 Гц), 6,76 (д, 1H, J=8,4 Гц), 6,06 (c, 1H), 5,80 (т, 1H, J=7,2 Гц), 5,59 (c, 1H), 4,97 (м, 1H), 3,21 (c, 3H), 3,15 (м, 2H), 2,71 (м, 2H), 1,75 (м, 4H), 1,37 (м, 3H), 0,94 (м, 6H).
ESI [М-Н]-: 532.
Пример 279: 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-N-(4-трифторметансульфониламино-бензил)-акриламид
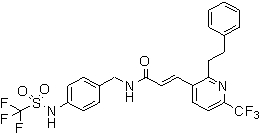
N-[4-(1-аминометил)-фенил]-трифторметансульфонамид, соль HCl (75 мг) вводили в реакцию с NMM (0,2 мл), DMTMM (119 мг) и 3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (78 мг), получая после очистки хроматографией на колонках (Hex/EtOAc=2/3) целевое соединение (8,5 мг).
1H ЯМР (300 МГц, CDCl3): δ 7,82 (м, 2H), 7,51 (м, 1H), 7,19 (м, 3H), 6,66 (д, 1H, J=6,6 Гц), 6,18 (д, 1H, J=17,4 Гц), 5,80 (м, 1H), 4,42 (д, 2H, J=5,4 Гц), 3,29 (м, 2H), 3,05 (м, 2H).
Пример 280: [1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид (E)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-бут-2-еновой кислоты
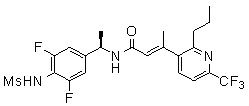
(R)-N-[4-(1-Аминоэтил)-2,6-дифтор-фенил]-метансульфонамид, соль HCl (70 мг, 0,25 ммоль) вводили в реакцию с 3-(2-пропил-6-трифторметил-пиридин-3-ил)-бут-2-еновой кислотой (67 мг, 0,25 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=3:2) целевое соединение (32 мг, 24%).
1H ЯМР (300 МГц, CDCl3): δ 7,45 (c ушир., 2H), 6,82 (м, 2H), 6,06 (c, 1H), 5,80 (т, 1H, J=7,2 Гц), 5,57 (c, 1H), 4,97 (м, 1H), 3,22 (c, 3H), 2,50 (c, 3H), 1,76 (м, 2H), 1,55 (м, 2H), 1,37 (д, 3H, J=6,9 Гц), 0,93 (т, 3H, J=7,8 Гц).
Пример 281: N-(3-этенил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид
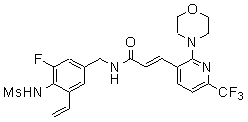
N-[4-(1-Аминометил)-2-этенил-6-фтор-фенил]-метансульфонамид, соль HCl (70 мг, 0,25 ммоль) вводили в реакцию с NMM (0,055 мл), DMTMM (83 мг, 0,30 ммоль) и 3-(2-морфолин-1-ил-6-трифторметил-пиридин-3-ил)-акриловой кислотой (76 мг, 0,25 ммоль), получая после очистки хроматографией на колонках (Hex/EtOAc=1/1) целевое соединение (95 мг, 74%).
1H ЯМР (300 МГц, ДМСО-d6 + CDCl3): δ 8,84 (c. ушир., 1H), 8,37 (т, 1H, J=5,7 Гц), 7,76 (д, 1H, J=7,5 Гц), 7,55 (д, 1H, J=15,6 Гц), 7,33 (c, 1H), 7,18 (д, 1H, J=7,5 Гц), 7,10 (дд, 1H, J=17,1 и 10,8 Гц), 7,01 (д, 1H, J=9,3 Гц), 6,61 (д, 1H, J=15,6 Гц), 5,73 (д, 1H, J=17,1 Гц), 5,32 (д, 1H, J=10,8 Гц), 4,42 (д, 2H, J=5,7 Гц), 3,75 (м, 4H), 3,24 (м, 4H), 2,90 (c, 3H).
Экспериментальный пример: Тест на биологическую активность
1. Тест на приток 45 Са
1) Отделение заднекорешковых спинномозговых ганглиев (DRG) новорожденных крыс и их первичная культура
Новорожденных (2-3 дня или моложе) крыс SD помещали на лед на 5 минут для анестезии и дезинфицировали 70%-ным этанолом. DRG всех отделов спинного мозга иссекали (Wood et al., 1988, J. Neurosci. 8, pp3208-3220) и помещали в среду DME/F12, к которой добавляли 1,2 г/л бикарбоната натрия и 50 мг/л гентамицина. DRG инкубировали последовательно при 37°C в течение 30 минут в 200 Ед./мл коллагеназы и 2,5 мг/мл трипсина, отдельно. Ганглии промывали дважды средой DME/F12, дополненной 10%-ной конской сывороткой, растирали с помощью оплавленной пипетки Пастера, фильтровали через мембрану Nitex 80, получая единую суспензию клеток, и эту суспензию промывали еще раз. Ее подвергали центрифугированию, затем повторно суспендировали в среде для культуры клеток с определенным уровнем плотности клеток. В качестве среды для культуры клеток среду DME/F12, дополненную 10%-ной конской сывороткой, разбавляли идентичной средой, кондиционированной клетками глиомы C6 в течение 2 дней на слитом мономолекулярном слое (1:1), и NGF добавляли (Фактор роста нервов) до конечной концентрации 200 нг/мл. После выращивания клеток в течение 2 дней в среде, куда добавляли цитозинарабинозид (Ara-C, 100 мкМ), чтобы уничтожить делящиеся не-нейронные клетки, среду заменяли средой без Ara-C. Повторно суспендированные клетки высеивали в плотности 1500-2000 нейронов/лунка на планшеты Terasaki, предварительно покрытые поли-D-орнитином в количестве 10 мкг/мл.
2) Эксперименты на приток 45 Са
Нервные клетки DRG после первичного культивирования в течение 2 дней уравновешивали, промывая 4 раза буферизованной HEPES (10 мМ, рН 7,4), не содержащей Ca2+, Mg2+ HBSS (Н-HBSS). Раствор в каждой лунке удаляли из каждой лунки. В каждую лунку добавляли среду, содержащую тестируемое соединение плюс капсаицин (конечная концентрация 0,5 мкМ) и 45Ca (конечная концентрация 10 мкCi/мл) в Н-HBSS и инкубировали при комнатной температуре в течение 10 минут. Планшеты Terasaki промывали пять раз Н-HBSS и высушивали при комнатной температуре. К каждой лунке добавляли 0,3% SDS (10 мкл), чтобы элюировать 45Ca. После добавления в каждую лунку сцинтилляционного коктейля количество 45Ca, входящего в нейрон, измеряли путем подсчета радиоактивности. Антагонистические активности тестируемых соединений в отношении ванилоидного рецептора вычисляли как процент ингибирования максимального ответа капсаицина в концентрации 0,5 мкМ.
Таблица 1
Результаты теста на приток кальция
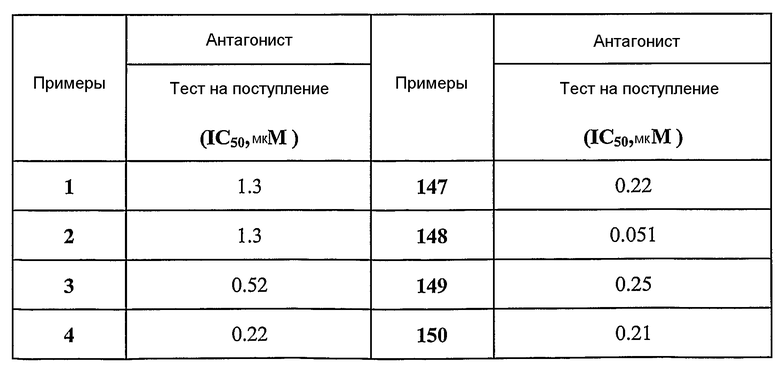
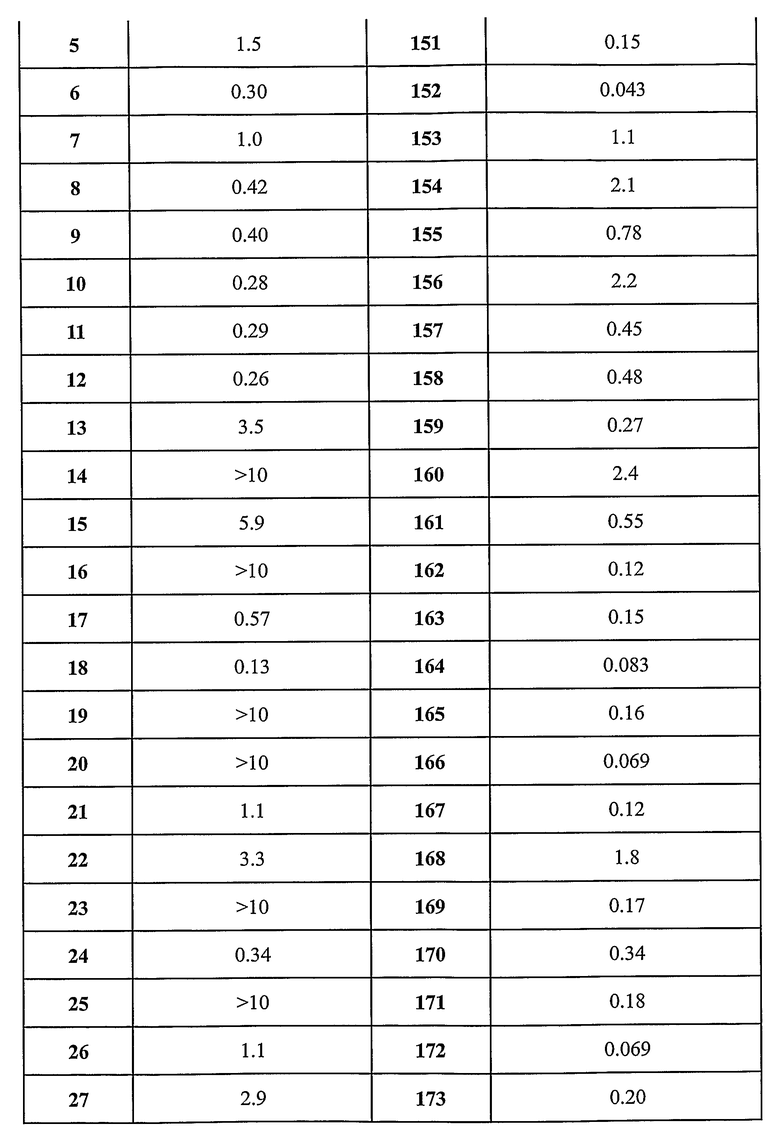
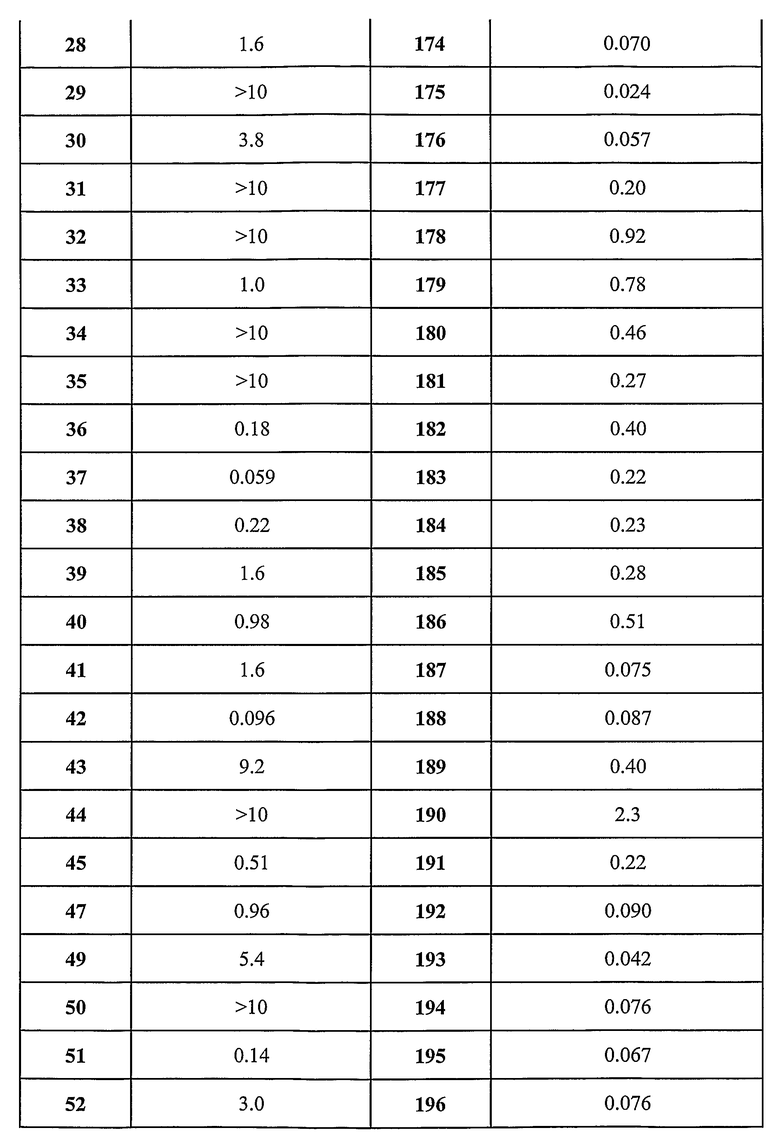
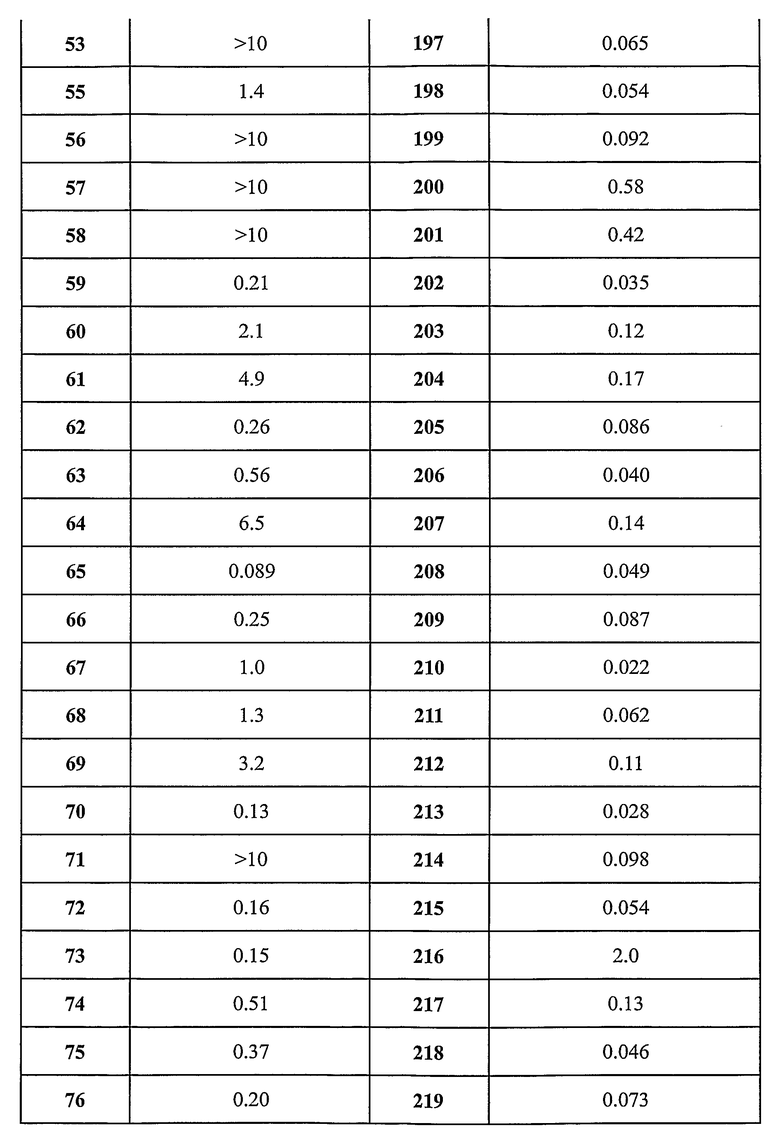
2. Тест анальгетической активности: тест конвульсий на модели мыши с индукцией фенил-п-хиноном
Самцов мышей ICR (средняя масса тела 25 г) для эксперимента выдерживали в контролируемых условиях освещения (12 часов свет/12 часов темнота). Животные получали интраперитонеальную инъекцию 0,3 мл химического раздражителя фенил-п-хинона (растворенного в солевом растворе, содержащем 5%-ный этанол, в дозе 4,5 мг/кг), и 6 минут спустя подсчитывали число сокращений брюшных мышц в последующий период 6 минут. Животные (10 животных/группа) получали 0,2 мл раствора тестируемых соединений в носителе, состоящем из смеси этанол/Tween 80/солевой раствор (10/10/80), интраперитонеально за 30 минут до инъекции фенил-п-хинона. В случае перорального введения 0,2 мл раствора тестируемых соединений в носителе, состоящем из смеси этанол/Tween 80/солевой раствор (5/5/90), вводили за 54 минуты до инъекции 0,2 мл 0,02% фенил-п-хинона. Уменьшение числа конвульсий в ответ на лекарственное средство, содержащее тестируемое соединение, относительно их числа в контрольной группе, получавшей солевой раствор принимали как показатель анальгетического эффекта. Анальгетический эффект вычисляли уравнением % ингибирования (%ингибирования=(C-T)/C × 100), где C и T означают число конвульсий в контрольной и получавшей соединение группах, соответственно. Большинство примеров настоящего изобретения, имеющих хорошую активность in vitro, было проверено в различных дозах (в пределах от 0,1 до 3 мг/кг), и все соединения, проверенные in vivo, показали анальгетические эффекты от 12 до 70% ингибирования в каждой дозе, соответственно.
3. Метаболическая стабильность и исследование PK
1) Тест на метаболическую стабильность
Разбавленный образец (конечная концентрация 5 мкг/мл в буфере из 0,1 М фосфата калия, рН 7,4) предварительно инкубировали с ко-факторами (глюкозо-6-фосфат 3,3 мМ, NADPH 1,3 мМ, MgCl2 0,16 мМ, глюкозо-6-фосфатдегидрогеназа в конечной концентрации 0,4 Ед./мл), и ферментативную реакцию инициировали добавлением микросом кишечника человека (1 мг/мл белка) или печени крысы (0,5 мг/мл белка). Реакцию завершали с использованием 2X объема холодного ацетонитрила после 1 минуты (исходная точка) или 30 минут (реакция образца) инкубации. В случае микросом кишечника человека использовали время реакции 2 часа. Реакционную смесь экстрагировали во взбалтываемой ванне в течение 20 минут, после чего полученный супернатант отделяли центрифугированием. Область пика родительского соединения анализировали в супернатанте, используя способ ВЭЖХ-УФ, и степень метаболизма показана как уменьшение области пика соединения (%) от исходной точки.
Метаболическая стабильность соединений с частичной структурой CF3-пиридинила согласно настоящему изобретению в целом лучше, чем у соответствующих трет-бутилфенил-содержащих соединений, которые были по меньшей мере частично раскрыты в уровне техники, например в WO06/101318. Детали полученных данных по метаболической стабильности представлены в Таблице 2.
2) Исследование PK
Фармакокинетические свойства соединений анализировали на крысах, используя следующий эксперимент. Крыс держали без пищи в течение ночи до введения и до спустя приблизительно 4 часа после введения. Крысам давали единственный пероральный прием соединения в той же самой дозе. Объем введения составлял 10 мл/кг. Пробы крови забирали из ретро-орбитального синуса в различные моменты времени в течение следующих 7 часов. Непосредственно после каждого забора плазму отделяли от клеток крови центрифугированием и сохраняли при -20°C до проведения анализа. Образцы плазмы анализировали, используя способ высокоэффективной хроматографии (ВЭЖХ) с обратной фазой.
Как показано в Таблице 3, профиль PK соединений с частичной структурой CF3-пиридинила согласно настоящему изобретению был в целом лучше, чем у соответствующих трет-бутилфенил-содержащих соединений, которые были по меньшей мере частично раскрыты в уровне техники, например в WO 06/101318. При замене трет-бутилфенила CF3 пиридинилом наблюдали существенное увеличение абсорбции и видимого периода полужизни.
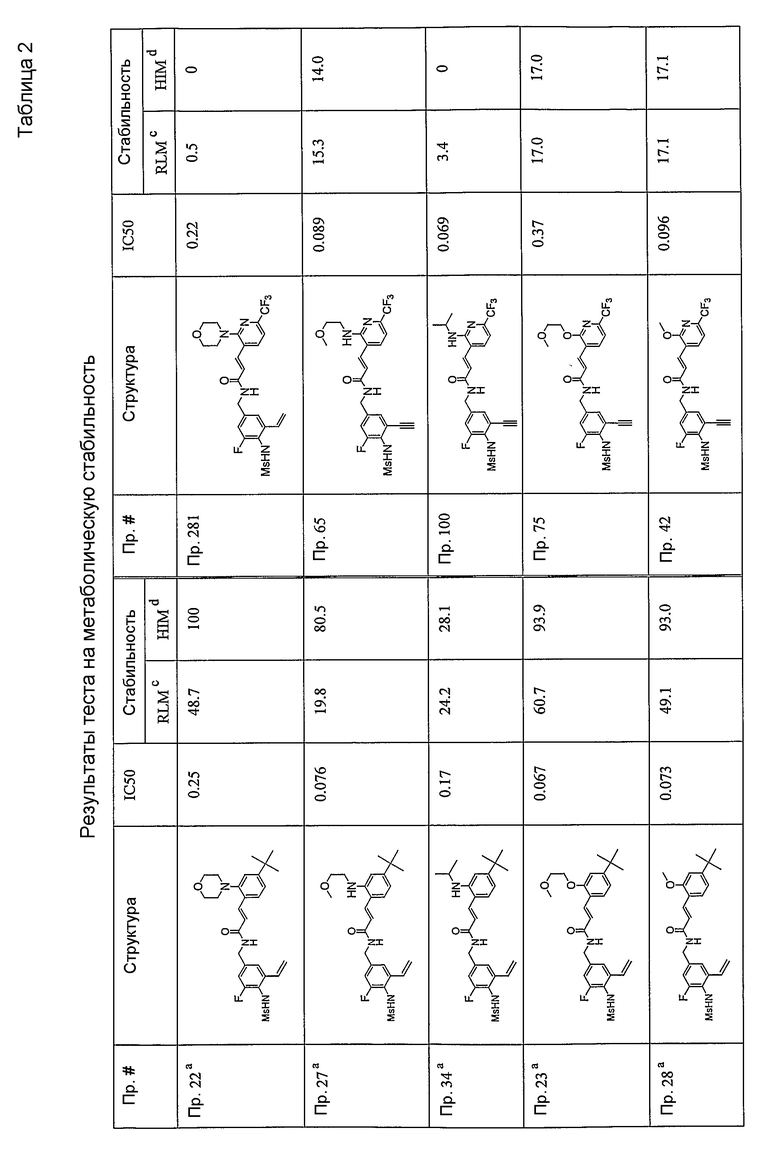
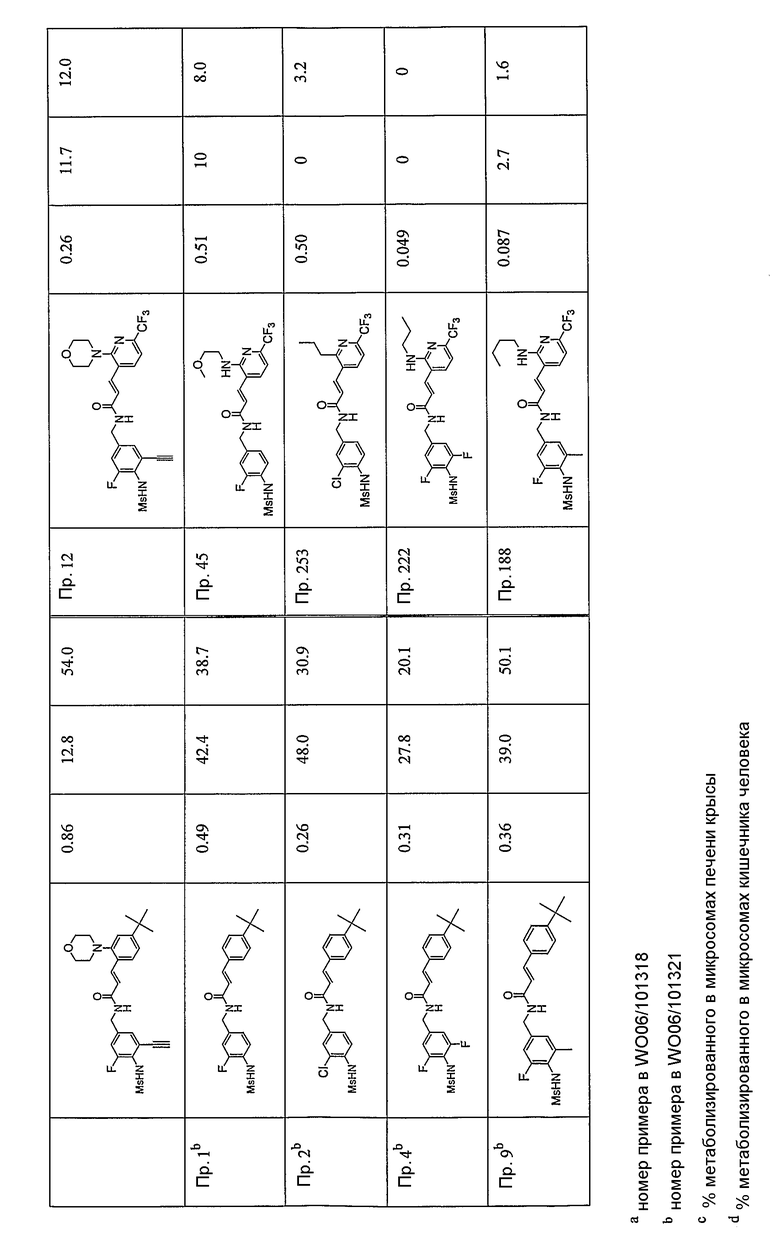
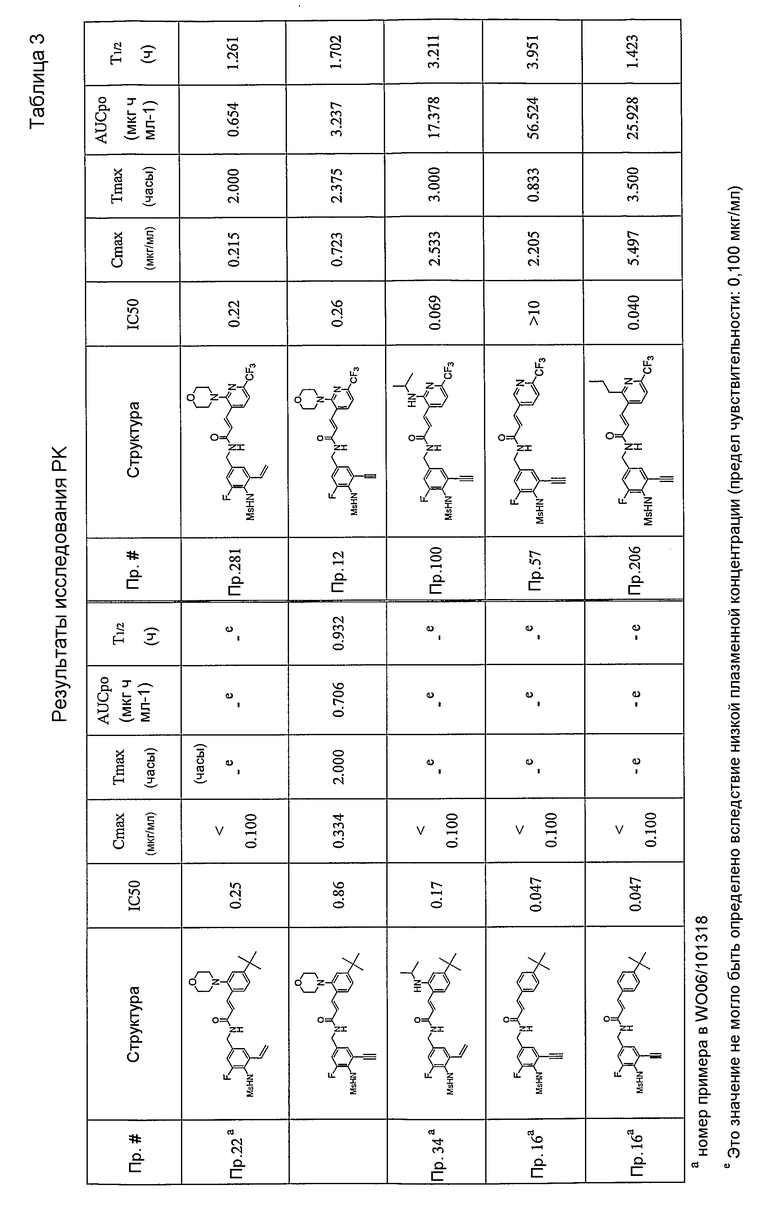
Промышленная применимость
Как объясняется выше, соединение согласно настоящему изобретению может быть использовано для предотвращения или лечения боли, воспалительного заболевания сустава, невропатий, ВИЧ-связанной невропатии, повреждения нерва, нейродегенерации, инсульта, гиперчувствительности мочевого пузыря, включая недержание мочи, цистита, язвы желудка и двенадцатиперстной кишки, синдрома раздраженного кишечника (IBS) и воспалительного заболевания кишечника (IBD), позывов к дефекации, гастроэзофагеальной рефлюксной болезни (GERD), болезни Крона, астмы, хронического обструктивного легочного заболевания, кашля, невропатического/аллергического/воспалительного кожного заболевания, псориаза, зуда, пруриго, раздражения кожи, глаза или слизистой оболочки, гипернормального слуха, шума в ушах, вестибулярной гиперчувствительности, эпизодического головокружения, заболеваний сердца, таких как миокардиальная ишемия, нарушений, связанных с ростом волос, таких как эффлювиум, алопеция, ринита, панкреатита.
Более конкретно, соединение согласно настоящему изобретению может быть использовано для предотвращения или лечения боли, которая является или связана с состоянием, выбранным из группы, состоящей из остеоартрита, ревматоидного артрита, анкилозирующего спондилита, диабетической нейропатической боли, послеоперационной боли, зубной боли, невоспалительной скелетно-мышечной боли (включая фибромиалгию, миофасциальный болевой синдром и боль в пояснице), мигрени и других типов головной боли.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2681849C2 |
| СОЕДИНЕНИЯ ИНДОЛА И ИНДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРА НЕКРОЗА КЛЕТКИ | 2008 |
|
RU2437883C1 |
| ПРОИЗВОДНЫЕ 1,3,4-ОКСАДИАЗОЛСУЛЬФОНАМИДА В КАЧЕСТВЕ ИНГИБИТОРОВ ДЕАЦЕТИЛАЗЫ ГИСТОНОВ 6 И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ | 2016 |
|
RU2697665C1 |
| СОЕДИНЕНИЯ ИНДОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ КЛЕТОЧНОГО НЕКРОЗА | 2008 |
|
RU2477282C2 |
| ПРОИЗВОДНЫЕ ИНДОЛА И ИНДАЗОЛА, ОБЛАДАЮЩИЕ КОНСЕРВИРУЮЩИМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К КЛЕТКАМ, ТКАНЯМ И ОРГАНАМ | 2009 |
|
RU2460525C2 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛПИРИДИНА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2018 |
|
RU2748945C1 |
| НОВОЕ ТРИЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2470934C1 |
| АКТИВАТОРЫ ГЛЮКОКИНАЗЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2008 |
|
RU2450001C2 |
| ПРОИЗВОДНЫЕ ТИЕНО[3,2-d]ПИРИМИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ПРОТЕИНКИНАЗЫ | 2011 |
|
RU2524210C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2734390C2 |
Изобретение описывает соединения формул (I) и (III), а также их изомеры или фармацевтически приемлемые соли:
 (I),
(I),  ,
,
(III)
где значения радикалов такие, как представлены в пунктах 1 и 5 формулы изобретения. Кроме того, изобретение относится к фармацевтической композиции на основе этих соединений, которая обладает антагонистической активностью в отношении ванилоидного рецептора, к применению представленных выше соединений, для получения лекарственного средства для профилактики или лечения состояния, которое связано с аберрантной экспрессией и/или абер-рантной активацией ванилоидного рецептора, а также описывается способ получения соединения формулы III. Технический результат: получены и описаны новые соединения, которые могут быть применимы в качестве антагонистов ванилоидного рецептора (Vanilloid Receptor 1; VR1; TRPV1), для профилактики или лечения таких заболеваний как боль, мигрень, артралгия, невралгия, невропатии, повреждение нерва, кожные нарушения, гиперчувствительность мочевого пузыря, синдром раздраженного кишечника, позывы к дефекации, респираторные заболевания, раздражение кожи, глаза или слизистой оболочки, язва желудка и двенадцатиперстной кишки, воспалительные заболевания, заболевание уха, заболевание сердца и т.д. 9 н. и 31 з.п. ф-лы, 281 прим., 3 табл.
1. Соединение формулы (I), его изомер или фармацевтически приемлемая соль:
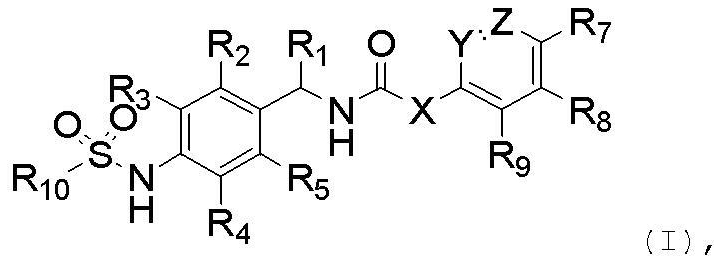
в которой
- Х обозначает CR11=CR12 или С≡С; причем R11 и R12, если они присутствуют, являются независимо водородом, галогеном или С1-С5 алкилом;
- Z обозначает N;
- Y обозначает CR6;
R1 обозначает водород или С1-С5 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, циано, С1-С5 алкил, С2-С5 алкенил, С2-С5 алкинил;
R6 обозначает водород, галоген, карбокси, С1-С10 алкил, С1-С10 алкокси, С2-С10 алкенил, С2-С10 алкинил, С1-С10 алкилтио, С1-С10 алкилсульфонил, С1-С10 алкилкарбонил, С1-С5 алкокси (С1-С5) алкокси, С1-С5 алкокси (С1-С5) алкокси (С1-С5) алкил, пиперидил, пиперазинил, С1-С5 алкокси (С1-С5) алкиламино, С1-С10 алкиламино, ди(С1-С10 алкил)амино, С3-С8 циклоалкил, С3-С8 циклоалкиламино, С3-С8 циклоалкокси, С3-С8 оксациклоалкилокси, N-арил-N-(С1-С5)алкиламино, предпочтительно N-фенил-N-(C1-C5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, арилтио, предпочтительно фенилтио, гетероарил, предпочтительно пиридинил или тиенил, гетероариламино, арилокси, предпочтительно фенокси, гетероарилокси, предпочтительно пиридинилокси, пирролидинил или морфолинил,
R8 и R9 независимо обозначают водород, галоген, С1-С10 алкил, причем
каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилкарбониле, алкиламино, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (С1-С5) алкокси, (С3-С8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенного галогеном (С1-С5) алкиламино, фенила, который может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного С1-С3 алкила или галоген (С1-С3) алкила, или незамещенного или замещенного галогеном ди(С1-С5) алкиламино,
каждый арил или гетероарил, также как часть группы, например, в ариламино, арилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного С1-С5 алкила, незамещенного С1-С5 алкокси или галоген (С1-С5) алкила,
каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном С1-С3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
каждый пиперазинил, пиперидил, морфолинил и пирролидинил может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном С1-С3 алкилом, гидрокси (С1-С3) алкилом, С1-С3 алкокси, (С1-С3) алкоксикарбонилом или гидроксилом;
R7 обозначает галоген (С1-С5) алкил;
и
R10 обозначает С1-С5 алкил, галоген (С1-С5) алкил или С2-С5 алкенил.
2. Соединение по п.1, его изомер или фармацевтически приемлемая соль, в котором
Х обозначает -CH=CH-, -C(CH3)=CH-, -CH=C(CH3)-, -C(CH3)=C(CH3)-, -C(C2H5)=CH-, -CH=C(C2H5)-, -CF=CH-, -CH=CF- или C≡C;
R1 обозначает водород, метил или этил;
R2, R3, R4 и R5 независимо обозначают водород, фтор, хлор, бром, циано, метил, этил, этенил, этинил, трифторметил;
R6 обозначает фтор, бром, хлор, гидроксиметил, С1-С6 алкил, С1-С6 алкокси, С2-С6 алкенил, С2-С6 алкинил, галоген (С1-С6) алкил, галоген (С1-С6) алкокси, С1-С5 алкокси (С1-С5) алкокси, С1-С5 алкокси (С1-С5) алкокси (С1-С5) алкил, ди(С1-С6 алкил)амино, С1-С6 алкиламино, С1-С3 алкокси (С1-С5) алкиламино, С3-С6 циклоалкил, который может быть незамещенным или замещенным одной или более метильными группами, С3-С6 циклоалкиламино, который может быть незамещенным или замещенным одной или более метильными группами, С3-С6 циклоалкокси, С3-С6 оксациклоалкокси, пиперидил, пирролидинил, галогенфенил, фенил, фенокси, фениламино, галогенфенокси, морфолинил; С1-С2 алкокси (С1-С3) алкил, фенил (С1-С3) алкил, фенил (С2-С3) алкенил, С1-С3 алкоксиалкинил, ди(С1-С3) алкиламиноалкинил, (С1-С3) алкоксифенил, тиенил, (С3-С6) циклоалкил (С1-С3) алкокси, фенил (С1-С3) алкокси, С1-С5 алкилтио, фенил (С1-С3) алкиламино, ариламино, N-фенил-N-(С1-С3)алкиламино, или пиперидил;
R7 обозначает галоген (С1-С5) алкил;
R8 и R9 независимо обозначают водород, галоген или трифторметил; и R10 обозначает С1-С5 алкил, галоген (С1-С5) алкил или С2-С5 алкенил.
3. Соединение по п.1, его изомер или фармацевтически приемлемая соль, в котором
Х обозначает CR11=CR12, причем R11 и R12 являются независимо водородом, галогеном или С1-С3 алкилом;
R1 обозначает водород или С1-С3 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, циано, метил, этил, этенил, этинил трифторметил;
R6 обозначает галоген, карбокси, С1-С5 алкил, С1-С5 алкокси, гидрокси (С1-С5) алкил, С2-С5 алкенил, С2-С5 алкинил, галоген (С1-С5) алкил, галоген (С1-С5) алкокси, С1-С5 алкилтио, С1-С5 алкилсульфонил, С1-С5 алкилкарбонил, С1-С5 алкокси (С1-С5) алкокси, С1-С5 алкокси (С1-С5) алкокси (С1-С5) алкил, пиперидил, С1-С5 алкокси (С1-С5) алкиламино, С1-С7 алкиламино, ди(С1-С3 алкил)амино, С3-С6 циклоалкил, который может быть незамещенным или замещенным одной или более метильными группами, пирролидинил, фенил или морфолинил, причем фенил может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, С1-С5 алкила и галоген (С1-С5) алкила;
R8 и R9 независимо обозначают водород, галоген, С1-С5 алкил;
R7 обозначает галоген (С1-С4) алкил;
и
R10 обозначает С1-С3 алкил или С2-С3 алкенил.
4. Соединение по пп.1-3, его изомер или фармацевтически приемлемая соль, в котором R7 обозначает трифторметил.
5. Соединение формулы (III), его изомер или фармацевтически приемлемая соль:
 ,
,
(III)
в которой
R1 обозначает водород или С1-С5 алкил;
R2, R3, R4 и R5 независимо обозначают водород, галоген, циано, С1-С5 алкил, С2-С5 алкенил, С2-С5 алкинил;
R6 обозначает водород, галоген, карбокси, С1-С10 алкил, С1-С10 алкокси, С2-С10 алкенил, С2-С10 алкинил, С1-С10 алкилтио, С1-С10 алкилсульфонил, С1-С10 алкилкарбонил, С1-С5 алкокси (С1-С5) алкокси, С1-С5 алкокси (С1-С5) алкокси (С1-С5) алкил, пиперидил, пиперазинил, С1-С5 алкокси (С1-С5) алкиламино, С1-С10 алкиламино, ди(С1-С10 алкил)амино, С3-С8 циклоалкил, С3-С8 циклоалкиламино, С3-С8 циклоалкокси, С3-С8 оксациклоалкилокси, N-арил-N-(С1-С5) алкиламино, предпочтительно N-фенил-N-(С1-С5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, арилтио, предпочтительно фенилтио, гетероарил, предпочтительно, тиенил, гетероариламино, арилокси, предпочтительно фенокси, гетероарилокси, предпочтительно пиридинилокси, пирролидинил или морфолинил;
R8 и R9 независимо обозначают водород, галоген, С1-С10 алкил,
причем
каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилкарбониле, алкиламино, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (С1-С5) алкокси, (С3-С8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенного галогеном (С1-С5) алкиламино, фенила, который может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного С1-С3 алкила или галоген (С1-С3) алкила, или незамещенного или замещенного галогеном ди(С1-С5)алкиламино,
каждый арил или гетероарил, также как часть группы, например, в ариламино, арилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного С1-С5 алкила, незамещенного С1-С5 алкокси или галоген (С1-С5) алкила,
каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном С1-С3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
каждый пиперазинил, пиперидил, морфолинил и пирролидинил может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном С1-С3 алкилом, гидрокси (С1-С3) алкилом, С1-С3 алкокси, (С1-С3) алкоксикарбонилом или гидроксилом;
R7 обозначает галоген (С1-С5) алкил;
R10 обозначает С1-С5 алкил, галоген (С1-С5) алкил или С2-С5 алкенил; и
R11 и R12 независимо обозначают водород, С1-С5 алкил или галоген.
6. Соединение по п.1 или 5, его изомер или фармацевтически приемлемая соль,
в котором
R1 обозначает водород, метил или этил;
R2, R3, R4 и R5 независимо обозначают водород, фтор, хлор, бром, циано, метил, этил, этенил, этинил, трифторметил;
R6 обозначает фтор, бром, хлор, гидроксиметил, С1-С5 алкил, С1-С5 алкокси, С2-С5 алкенил, С2-С5 алкинил, галоген (С1-С5) алкил, галоген (С1-С5) алкокси, С1-С5 алкокси (С1-С5) алкокси, С1-С5 алкокси (С1-С5) алкокси (С1-С5) алкил, ди(С1-С3 алкил)амино, С1-С3 алкилпиперазинил, пиперидил, пирролидинил, галогенфенил, фенил или морфолинил;
R7 обозначает галоген (С1-С4) алкил;
R8 и R9 независимо обозначают водород, галоген или трифторметил;
R10 обозначает С1-С5 алкил, галоген (С1-С5) алкил или С2-С5 алкенил; и
R11 и R12, если они присутствуют, являются независимо водородом или метилом.
7. Соединение по п.1 или 5, его изомер или фармацевтически приемлемая соль,
в котором
R1, R2 и R5 обозначают водород;
R3 обозначает водород, фтор, хлор, циано, метил, этенил, этинил или трифторметил;
R4 обозначает водород, фтор, хлор, циано, метил, этил или трифторметил;
R6 обозначает фтор, бром, хлор, метил, гидроксиметил, метокси, трифторметил, диэтиламино, пиперидил, пирролидинил, трифторфенил, фенил или морфолинил;
R7 обозначает трифторметил;
R8 обозначает водород;
R11 и R12 если они присутствуют, являются водородом;
R9 обозначает водород или трифторметил; и
R10 обозначает метил.
8. Соединение по п.5, его изомер или фармацевтически приемлемая соль, в котором
R1, R2 и R5 обозначают водород;
R3 обозначает водород, фтор, хлор, циано, метил, этенил, этинил или трифторметил;
R4 обозначает водород, фтор, хлор, циано, метил, этил или трифторметил;
R6 обозначает фтор, бром, хлор, метил, пропил, бутил, пентил, гидроксиметил, метокси, этокси, пропокси, бутокси, пентокси, метоксиметокси, метоксиэтокси, метоксипропокси, трифторметил, диэтиламино, метоксиметиламино, метоксиэтиламино, метоксипропиламино, циклобутиламино, циклопентиламино, циклогексиламино, этиламино, пропиламино, бутиламино, пентиламино, N,N-диметиламино, N-метил-N-этиламино N,N-диэтиламино, N-метил-N-пропиламино, N-этил-N-пропиламино, N,N-дипропиламино, N-метил-N-бутиламино, N-этил-N-бутиламино, фенокси, галогенфенокси, пиперидил, пирролидинил, трифторфенил, фенил или морфолинил;
R7 обозначает трифторметил;
R8 обозначает водород;
R11 и R12, обозначают водород;
R9 обозначает водород или трифторметил; и
R10 обозначает метил.
9. Соединение по п.5, его изомер или фармацевтически приемлемая соль, в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, хлор, бром, циано, метил, этил, этенил, этинил или трифторметил;
R4 и R5 независимо обозначают водород, фтор, хлор, циано, метил, этил или трифторметил;
R6 обозначает фтор, хлор, бром, метил, н-бутил, метокси, н-бутилокси, изобутилокси, втор-бутилокси, метоксиэтокси, метоксиэтиламино, диэтиламино, н-бутиламино, циклопентиламино, фенокси, N-пирролидинил, N-пиперидил или N-морфолинил;
R7 обозначает трифторметил;
R8 обозначает водород;
R11 и R12 обозначают водород;
R9 обозначает водород или трифторметил; и
R10 обозначает метил.
10. Соединение по п.5, его изомер или фармацевтически приемлемая соль, в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, этенил или этинил;
R4 обозначает водород или фтор;
R5 обозначает водород;
R6 обозначает фтор, бром, хлор, метил, пропил, бутил, пентил, гидроксиметил, метокси, этокси, пропокси, бутокси, пентокси, метоксиметокси, метоксиэтокси, метоксипропокси, этоксиэтокси, трифторметил, N,N-диметиламино, N-метил-N-этиламино N,N-диэтиламино, N-метил-N-пропиламино, N-этил-N-пропиламино, N,N-дипропиламино, N-метил-N-бутиламино, N-этил-N-бутиламино, метоксиметиламино, метоксиэтиламино, метоксипропиламино, циклобутиламино, циклопентиламино, циклогексиламино, этиламино, пропиламино, бутиламино, пентиламино, фенокси, галогенфенокси, N-пиперидил, N-пирролидинил, трифторфенил, фенил или N-морфолинил;
R7 обозначает трифторметил;
R8 обозначает водород;
R9 обозначает водород или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначают водород.
11. Соединение по п.5, его изомер или фармацевтически приемлемая соль, в котором
R1 обозначает водород;
R2 обозначает водород;
R3 обозначает водород, этенил или этинил;
R4 обозначает водород или фтор;
R5 обозначает водород;
R6 обозначает бром, хлор, н-бутил, метокси, изобутилокси, втор-бутилокси, метоксиэтокси, диэтиламино, N-пирролидинил, N-пиперидил, N-морфолинил, циклопентиламино, н-бутиламино, фенокси, н-бутилокси, метоксиэтиламино;
R7 обозначает трифторметил;
R8 обозначает водород;
R9 обозначает водород или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначают водород.
12. Соединение по п.5, его изомер или фармацевтически приемлемая соль, в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, метил, этил, циано, этенил, этинил или трифторметил;
R4 обозначает водород, фтор, хлор или метил;
R5 обозначает водород;
R6 обозначает фтор, хлор, бром, метил, этил, пропил, бутил, пентил, трифторметил, этоксиметил, метоксипропил, фенилэтил, фенилэтенил, этинил, метоксипропинил, диэтиламинопропинил, фенил, галогенфенил, метоксифенил, тиенил, пиридинил, галогенпиридинил, метокси, этокси, пропокси, бутокси, пентокси, трифторэтокси, циклопентокси, циклопропилметокси, метоксиэтокси, тетрагидропиранилокси, фенокси, галогенфенокси, бензилокси, пиридинилокси, этилтио, пропилтио, бутилтио, пентилтио, этиламино, пропиламино, бутиламино, пентиламино, метоксиэтиламино, этоксиэтиламино, метоксипропиламино, циклобутиламино, циклопентиламино, циклогексиламино, бензиламино, фениламино, N,N-диметиламино, N-метил-N-пропиламино, N-метил-N-пропиламино, N,N-дипропиламино, N-метил-N-бутиламино, N-этил-N-бутиламино, N-этил-N-фениламино, N-метил-N-фениламино, N-пирролидинил, метокси N-пирролидинил, гидроксиметил N-пирролидинил, N-пиперидил, этоксикарбонил N-пиперидил, пиперазинил или N-морфолинил;
R7 обозначает трифторметил;
R8 обозначает водород;
R9 обозначает водород или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначают водород.
13. Соединение по п.5, его изомер или фармацевтически приемлемая соль, в котором
R1 обозначает водород или метил; R2 обозначает водород;
R3 обозначает водород, фтор, хлор, бром, циано, метил, этил, этенил, этинил или трифторметил;
R4 и R5 независимо обозначают водород, фтор, хлор, циано, метил или этил;
R6 обозначает н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, 2-фенилэтил, н-бутокси, изобутокси, втор-бутокси, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиэтиламино, этоксиэтиламино, бензиламино, фениламино, N-этил-N-фениламино или N-метил-N-фениламино;
R7 обозначает трифторметил;
R8 обозначает водород или хлор;
R9 обозначает водород или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначают водород.
14. Соединение по п.5, его изомер или фармацевтически приемлемая соль, в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R4 обозначает водород, фтор, хлор или метил;
R3 обозначает водород, фтор, метил, циано, этенил, этинил или трифторметил;
R5 обозначает водород;
R6 обозначает этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, этоксиметил, 2-фенилэтил, фенилэтенил, фенил, фторфенил, тиенил, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, 3-метилбутокси, 2,2,2-трифторэтокси, циклопентокси, циклопропилметокси, фенокси, этилтио, пропилтио, изопропилтио, фенилтио, этиламино, н-пропиламино изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиметиламино, метоксиэтиламино, этоксиэтиламино, циклопентиламино, бензиламино, фениламино, N-этил-N-фениламино, N-метил-N-фениламино, N-метил-N-пропиламино, N-пирролидинил, метокси N-пирролидинил, N-пиперидил или этоксикарбонил N-пиперидил;
R7 обозначает трифторметил;
R8 обозначает водород или хлор;
R9 обозначает водород или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначают водород.
15. Соединение по п.5, его изомер или фармацевтически приемлемая соль, в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, метил, циано, этенил или этинил;
R4 обозначает водород, фтор или метил;
R5 обозначает водород;
R6 обозначает н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, 2-фенилэтил, н-бутокси, изобутокси, втор-бутокси, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиэтиламино, этоксиэтиламино, бензиламино, N-этил-N-фениламино или N-метил-N-фениламино;
R7 обозначает трифторметил;
R8 и R9 обозначают водород;
R10 обозначает метил; и
R11 и R12 обозначают водород.
16. Соединение по п.5, его изомер или фармацевтически приемлемая соль, в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, хлор, метил, циано, этенил или этинил;
R4 обозначает водород;
R5 обозначает фтор, хлор или метил;
R6 обозначает этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, этоксиметил, 2-фенилэтил, фенилэтенил, фенил, фторфенил, тиенил, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, 3-метилбутокси, 2,2,2-трифторэтокси, циклопентокси, циклопропилметокси, фенокси, этилтио, пропилтио, изопропилтио, этиламино, н-пропиламино изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиметиламино, метоксиэтиламино, этоксиэтиламино, циклопентиламино, бензиламино, фениламино, N-этил-N-фениламино, N-метил-N-фениламино, N-метил-N-пропиламино, N-пирролидинил, N-пиперидил или этоксикарбонил N-пиперидил;
R7 обозначает галоген (С1-С3) алкил;
R8 и R9 независимо обозначают водород, галоген или трифторметил;
R10 обозначает метил; и
R11 и R12 обозначают водород.
17. Соединение по п.5, его изомер или фармацевтически приемлемая соль, в котором
R1 обозначает водород или метил;
R2 обозначает водород;
R3 обозначает водород, фтор, хлор, метил, циано, этенил или этинил;
R4 обозначает водород;
R5 обозначает фтор;
R6 обозначает н-пропил, изопропил, н-бутил, изобутил, втор-бутил, 2-метилбутил, 3-метилбутил, н-пентил, 2-фенилэтил, н-бутокси, изобутокси, втор-бутокси, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино, метоксиэтиламино, этоксиэтиламино, бензиламино, N-этил-N-фениламино или N-метил-N-фениламино;
R7 обозначает трифторметил;
R8 обозначает водород или хлор;
R9 обозначает водород;
R10 обозначает метил; и
R11 и R12 обозначают водород.
18. Соединение по п.1, его изомер или фармацевтически приемлемая соль, причем соединение представлено формулой VI:
 ,
,
в которой
W обозначает водород или фтор;
X обозначает -CR11=CR12- или -C≡C-;
R1 выбран из водорода и C1-C3 алкила;
R6 обозначает галоген, карбокси, С1-С10 алкил, С1-С10 алкокси, С2-С10 алкенил, С2-С10 алкинил, С1-С10 алкилтио, С1-С10 алкилсульфонил, С1-С10 алкилкарбонил, С1-С5 алкокси (С1-С5) алкокси, С1-С5 алкокси (С1-С5) алкокси (С1-С5) алкил, пиперидил, С1-С5 алкокси (С1-С5) алкиламино, С1-С 10 алкиламино, ди(С1-С10 алкил)амино, С3-С8 циклоалкил, С3-С8 циклоалкиламино, С3-С8 циклоалкокси, С3-С8 оксациклоалкилокси, N-арил-N-(С1-С5)алкиламино, предпочтительно N-фенил-N-(С1-С5)алкиламино, арил, предпочтительно фенил, ариламино, предпочтительно фениламино, гетероарил, предпочтительно тиенил, гетероариламино, арилокси, предпочтительно фенокси, пирролидинил или морфолинил;
R11 и R12, если они присутствуют, независимо выбраны из водорода и пропила;
R7 обозначает CF3, CF2Cl или CF2CF3;
R8 и R9 независимо выбраны из водорода, галогена или CF3;
причем
каждый алкил, алкенил и алкинил, также как часть группы, например, в алкокси, алкилкарбониле, алкиламино, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, гидроксила, незамещенного или замещенного галогеном (С1-С5) алкокси, (С3-С8) циклоалкила, который может быть незамещенным или замещенным одним или двумя радикалами галогена и/или метильными группами, незамещенного или замещенного галогеном (С1-С5) алкиламино, фенила, который может быть незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного С1-С3 алкила или галоген (С1-С3) алкила, или незамещенного или замещенного галогеном ди(С1-С5) алкиламино,
каждый арил или гетероарил, также как часть группы, например, в ариламино, арилокси, может быть независимо незамещенным или замещенным одним или более заместителями, выбранными из галогена, незамещенного С1-С5 алкила, незамещенного С1-С5 алкокси или галоген (С1-С5) алкила,
каждый циклоалкил, также как часть группы, например, в циклоалкокси или циклоалкиламино, может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном С1-С3 алкилом, гидроксиметилом, гидрокси, метокси или амино, и
каждый пиперидил или морфолинил может быть незамещенным или замещенным одним или более незамещенными или замещенными галогеном С1-С3 алкилом, гидрокси (С1-С3) алкилом, С1-С3 алкокси, (С1-С3) алкоксикарбонилом или гидроксилом.
19. Соединение по п.18, его изомер или фармацевтически приемлемая соль, в котором R8 и R9 оба обозначают водород.
20. Соединение по п.18, его изомер или фармацевтически приемлемая соль, в котором X обозначает -СН=СН-.
21. Соединение по п.18, его изомер или фармацевтически приемлемая соль, в котором X обозначает -СН=СН-, и W, R8 и R9 обозначают водород.
22. Соединение по п.18, его изомер или фармацевтически приемлемая соль, в котором
R6 выбран из С2-С6 алкила, ди(С1-С6 алкил)амино, 2,2,2-трифтор(С1-С3)алкокси, С1-С3 алкокси (С1-С5) алкиламино, С1-С6 алкиламино, С3-С6 циклоалкиламино, фенила, фениламино, фенил (С1-С3) алкиламино, фенил (С1-С3) алкила или N-фенил-N-(С1-С5)алкиламино, причем каждый фенил может быть замещен одним или более галогенами; и
R7 обозначает CF3.
23. Соединение по п.18, его изомер или фармацевтически приемлемая соль, в котором
R6 выбран из С2-С5 алкила, С1-С4 алкиламино или метоксиэтиламино;
R7 обозначает CF3; и
R12 обозначает водород.
24. Соединение по п.22, его изомер или фармацевтически приемлемая соль, в котором
R6 обозначает -NH-(С1-С4)алкил или линейный или разветвленный С2-С5 алкил; и
R7 обозначает CF3.
25. Соединение по п.18, его изомер или фармацевтически приемлемая соль, в котором R1 обозначает водород или метил.
26. Соединение по п.1 или 5, его изомер или фармацевтически приемлемая соль, в котором, если R1 обозначает метил или этил, то атом, к которому присоединен R1, находится в (R)-конфигурации.
27. Соединение по п.1 или 5, его изомер или фармацевтически приемлемая соль, причем соединение выбрано из группы, состоящей из следующих соединений:
3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-метокси-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-метокси-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-гидрокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-метил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-метил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-циклопентиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутил-5-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропилокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутокси-6-трифторметил-пиридин-3-ил)-акриламид,
3-[2-(тетрагидро-фуран-3-илокси)-6-трифторметил-пиридин-3-ил]-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-фторфенокси)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-винил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-хлор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2,2,2-трифтор-этокси)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-циклопентиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(3-метокси-пирролидин-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-циклопропилметокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропокси-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-этоксикарбонил-пиперид-1-ил)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-метил-бутокси)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-тиен-3-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-винил-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенилтио-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-фениламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-этил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-стирил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(метил-пропил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(метил-пропил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(метил-фенил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(метил-фенил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-[2-(метил-фенил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
(R)-3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
3-(2-этилтио-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изобутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропилтио-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид,
3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-пиперид-1-ил-6-трифторметил-пиридин-3-ил]-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-[2-пиперид-1-ил-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропилтио-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-трифторметил-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
(R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-[2-(3-фторфенил)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
(R)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
(R)-N-[l-(3,5-дифтop-4-мeтaнcyльфoнилaминo-фeнил)-этил]-3-(2-фeнэтил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-фенэтил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
(S)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-N-1-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-втop-бyтил-6-тpифтopмeтил-пиpидин-3-ил)-N-[1-(3-фтop-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-1-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(2,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-(3-этенил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-хлор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-хлор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(2,5-дифтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3,5-дифтор-4-метансульфониламино-бензиламид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты,
[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты,
N-(4-метансульфониламино-бензил)-3-(2-фенетил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-этенсульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-этинил-5-фтор-4-метансульфониламино-бензиламид Z-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты,
3-этинил-5-фтор-4-метансульфониламино-бензиламид (Е)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты,
[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид (Z)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты,
[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид (Е)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты, и
N-(3-этенил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид.
28. Соединение по п.27, его изомер или фармацевтически приемлемая соль, причем соединение выбрано из группы, состоящей из следующих соединений:
3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-метокси-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-диэтиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пирролидин-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-циклопентиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этокси)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутил-5-хлор-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенокси-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропилокси-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутокси-6-трифторметил-пиридин-3-ил)-акриламид,
3-[2-(тетрагидро-фуран-3-илокси)-6-трифторметил-пиридин-3-ил]-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(4-фторфенокси)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(4-метансульфониламино-3-винил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-морфолин-4-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пиперид-1-ил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутокси-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-циано-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-циано-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-фенетил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-[2-(метил-фенил-амино)-6-трифторметил-пиридин-3-ил]-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-фенетил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изобутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3-фтор-4-метансульфониламино-5-метил-бензил)-акриламид,
(R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-бензиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-фенетил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-[2-(2-метокси-этиламино)-6-трифторметил-пиридин-3-ил]-акриламид,
3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-(3,5-дифтор-4-метансульфониламино-бензил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-втор-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-[2-(2-метил-бутил)-6-трифторметил-пиридин-3-ил]-акриламид,
(R)-3-(2-бутиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пентил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(4-метансульфониламино-3-метил-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-пропил-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-изопропил-6-трифторметил-пиридин-3-ил)-N-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-фенетил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-бyтилaминo-6-тpифтopмeтил-пиpидин-3-ил)-N-[1-(3,5-дифтop-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-N-1-(4-метансульфониламино-3-метил-бензил)-акриламид,
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изопропил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-втор-бутил-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
(R)-N-[1-(3,5-дифтop-4-мeтaнcyльфoнилaминo-фeнил)-этил]-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид
(R)-N-[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-3-(2-изобутил-6-трифторметил-пиридин-3-ил)-акриламид,
(R)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-[1-(3-фтор-4-метансульфониламино-фенил)-этил]-акриламид,
3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-1-(4-метансульфониламино-3-метил-бензил)-акриламид,
N-(2,5-дифтор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-(3-этинил-5-фтор-4-метансульфониламино-бензил)-акриламид,
3-(2-этиламино-6-трифторметил-пиридин-3-ил)-N-(3-этенил-5-фтор-4-метансульфониламино-бензил)-акриламид,
N-(3-хлор-4-метансульфониламино-бензил)-3-(2-пропиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(2,5-дифтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3,5-дифтор-4-метансульфониламино-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
N-(3-фтор-4-метансульфониламино-5-метил-бензил)-3-(2-этиламино-6-трифторметил-пиридин-3-ил)-акриламид,
[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид 3-(2-бутил-6-трифторметил-пиридин-3-ил)-пропиновой кислоты, и
[1-(3,5-дифтор-4-метансульфониламино-фенил)-этил]-амид (Е)-3-(2-пропил-6-трифторметил-пиридин-3-ил)-гекс-2-еновой кислоты.
29. Фармацевтическая композиция, обладающая антагонистической активностью в отношении ванилоидного рецептора, содержащая соединение по п.1 или 5, его изомер или фармацевтически приемлемую соль в качестве активного ингредиента и фармацевтически приемлемый носитель.
30. Фармацевтическая композиция для профилактики или лечения состояния, связанного с патологическим возбуждением и/или аберрантной экспрессией ванилоидных рецепторов, причем указанная композиция содержит соединение по п.1 или 7, его изомер или фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
31. Фармацевтическая композиция по п.29 для лечения состояния, выбранного из группы, состоящей из боли, воспалительного заболевания сустава, невропатий, ВИЧ-связанной невропатии, повреждения нерва, нейродегенерации, инсульта, гиперчувствительности мочевого пузыря, включая недержание мочи, цистита, язвы желудка и двенадцатиперстной кишки, синдрома раздраженного кишечника (IBS) и воспалительного заболевания кишечника (IBD), позывов к дефекации, гастроэзофагеальной рефлюксной болезни (GERD), болезни Крона, астмы, хронического обструктивного легочного заболевания, кашля, невропатического/аллергического/воспалительного кожного заболевания, псориаза, зуда, пруриго, раздражения кожи, глаза или слизистой оболочки, гипернормального слуха, шума в ушах, вестибулярной гиперчувствительности, эпизодического головокружения, заболеваний сердца, таких как миокардиальная ишемия, нарушений, связанных с ростом волос, таких как эффлювиум, алопеция, ринита и панкреатита.
32. Фармацевтическая композиция по п.31, причем боль является или связана с состоянием, выбранным из группы, состоящей из остеоартрита, ревматоидного артрита, анкилозирующего спондилита, диабетической нейропатической боли, послеоперационной боли, зубной боли, невоспалительной скелетно-мышечной боли (включая фибромиалгию, миофасциальный болевой синдром и боль в пояснице), мигрени и других типов головной боли.
33. Фармацевтическая композиция по п.29, отличающаяся тем, что она адаптирована для перорального введения.
34. Применение соединения по п.1 или 7, его изомера или фармацевтически приемлемой соли для получения лекарственного средства для профилактики или лечения состояния, которое связано с аберрантной экспрессией и/или аберрантной активацией ванилоидного рецептора.
35. Применение соединения по п.1 или 7, его изомера или фармацевтически приемлемой соли для получения лекарственного средства для профилактики или лечения состояния, которое выбрано из группы, состоящей из боли, воспалительного заболевания сустава, невропатий, ВИЧ-связанной невропатии, повреждения нерва, нейродегенерации, инсульта, гиперчувствительности мочевого пузыря, включая недержание мочи, цистита, язвы желудка и двенадцатиперстной кишки, синдрома раздраженного кишечника (IBS) и воспалительного заболевания кишечника (IBD), позывов к дефекации, гастроэзофагеальной рефлюксной болезни (GERD), болезни Крона, астмы, хронического обструктивного легочного заболевания, кашля,
невропатического/аллергического/воспалительного кожного заболевания, псориаза, зуда, пруриго, раздражения кожи, глаза или слизистой оболочки, гипернормального слуха, шума в ушах, вестибулярной гиперчувствительности, эпизодического головокружения, заболеваний сердца, таких как миокардиальная ишемия, нарушений, связанных с ростом волос, таких как эффлювиум, алопеция, ринита и панкреатита.
36. Применение соединения по п.35, причем состоянием является боль, которая является или которая связана с состоянием, выбранным из группы, состоящей из остеоартрита, ревматоидного артрита, анкилозирующего спондилита, диабетической нейропатической боли, послеоперационной боли, зубной боли, невоспалительной скелетно-мышечной боли (включая фибромиалгию, миофасциальный болевой синдром и боль в пояснице), мигрени и других типов головной боли.
37. Способ получения соединения, представленного формулой (III):
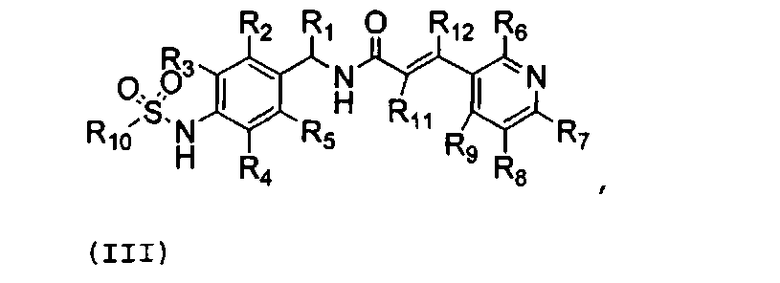
который включает введение соединения, представленного формулой (IIIа):
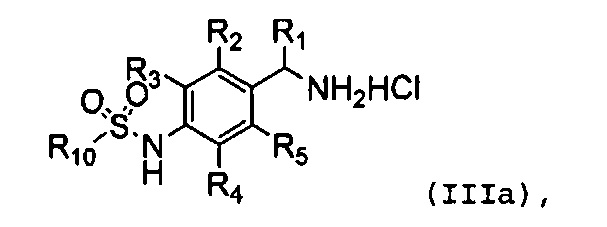
в реакцию с соединением, представленным формулой (IIIb):
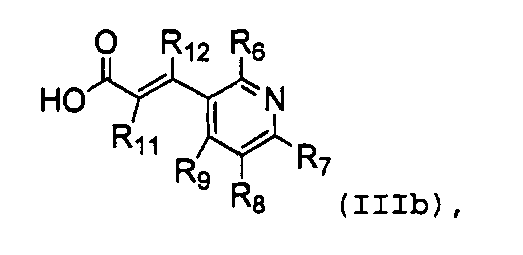
в которых
R1 R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 имеют значения, как определено в п.5.
38. Способ по п.37, в котором реакцию проводят в присутствии агента сочетания, выбранного из группы, состоящей из DCC (N,N-дициклогексилкарбодиимид), EDCI {1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDCI)} и DMTMM {4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиний хлорид}.
39. Соединение формулы (IIId)

в которой
W обозначает водород или фтор;
R1 обозначает водород или С1-С3 алкил, предпочтительно метил; и
R10 обозначает С1-С3 алкил, С2-С3 алкенил или галоген С1-С3 алкил, предпочтительно метил;
при условии, что если R1 обозначает водород и R10 обозначает метил, то W обозначает фтор.
40. Применение соединения формулы (IIId) по п.39 в качестве промежуточного соединения в получении лиганда рецептора VR1.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| PARK Н | |||
| ЕТ AL | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Устройство для многократного телефонирования | 1919 |
|
SU787A1 |
| RU 2004122481, 20.01.2006. | |||
Авторы
Даты
2012-04-20—Публикация
2007-07-26—Подача