ИЗМЕНЕННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОИЗВОДНЫЕ 1,3,4-ОКСАДИАЗОЛСУЛЬФОНАМИДА В КАЧЕСТВЕ ИНГИБИТОРОВ ДЕАЦЕТИЛАЗЫ ГИСТОНОВ 6 И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ
ОБЛАСТЬ ТЕХНИКИ
[1] Настоящее изобретение относится к производным 1,3,4-оксадиазолсульфонамида, обладающими активностью ингибирования деацетилазы гистонов 6 (HDAC6), их стереоизомерам или их фармацевтически приемлемым солям; их применениям для получения терапевтических средств; способам лечения заболеваний с их использованием; фармацевтическим композициям, содержащим их; и к способам их получения.
УРОВЕНЬ ТЕХНИКИ
[2] Посттрансляционные модификации, такие как ацетилирование, являются очень важными регуляторным модулями в центре биологических процессов в клетках, и они тщательно регулируются множеством ферментов. Гистоны являются основными белковыми компонентами хроматина и выступают в качестве катушек, на которые намотана нить ДНК. Также баланс ацетилирования и деацетилирования гистонов играет ключевую роль в регуляции экспрессии генов.
[3] Деацетилазы гистонов (HDAC) представляют собой ферменты, которые удаляют ацетильные группы из остатков лизина на гистоновых белках хроматина и которые, как известно, ассоциированы с сайленсингом генов и индуцируют остановку клеточного цикла, ингибирование ангиогенеза, иммунную регуляцию, клеточную смерть и т.д. (Hassig et al., Curr. Opin. Chem. Biol. 1997, 1, 300-308). Кроме того, было описано, что ингибирование ферментативной функции HDAC индуцирует апоптоз злокачественных клеток in vivo путем уменьшения активности факторов, ассоциированных с выживаемостью злокачественных клеток, и активации факторов, ассоциированных с апоптозом злокачественных клеток (Warrell et al, J. Natl. Cancer Inst. 1998, 90, 1621-1625).
[4] У человека было идентифицировано 18 HDAC, и их подразделяют на четыре класса, исходя из их гомологии с HDAC дрожжей. Среди них, 11 HDAC используют цинк в качестве кофактора и могут быть подразделены на три группы: класс I (HDAC1, 2, 3 и 8), класс II (IIa: HDAC4, 5, 7 и 9; IIb: HDAC6 и 10), класс IV (HDAC 11). Кроме того, 7 HDAC класса III (SIRT 1-7) требуют NAD+ вместо цинка в качестве кофактора (Bolden et al., Nat. Rev. Drug Discov. 2006, 5(9), 769-784).
[5] Различные ингибиторы HDAC находится на стадии доклинической или клинической разработки, однако в настоящий момент только неселективные ингибиторы HDAC были идентифицированы в качестве средств против злокачественной опухоли и только вориностат (SAHA) и ромидепсин (FK228) были одобрены для лечения Т-клеточной лимфомы кожи. Однако известно, что неселективные ингибиторы HDAC вызывают побочные эффекты, такие как усталость и тошнота, с основном в высоких дозах (Piekarz et al., Pharmaceuticals 2010, 3, 2751-2767). Сообщалось, что такие побочные эффекты являются следствием ингибирования HDAC класса I. Вследствие таких побочных эффектов использование неселективных ингибиторов HDAC для разработки лекарственных средств, отличных от лекарственных средств против злокачественной опухоли, является ограниченным (Witt et al., Cancer Letters, 2009, 277, 8-21).
[6] Между тем, сообщалось, что селективное ингибирование HDAC класса II не демонстрирует токсичности, которую демонстрирует ингибирование HDAC класса I. Также, при разработке селективных ингибиторов HDAC побочные эффекты, такие как токсичность, которые вызываются неселективным ингибированием HDAC, могут быть преодолены. Таким образом, селективные ингибиторы HDAC являются перспективными в отношении разработки в качестве лекарственных средств, эффективных для лечения различных заболеваний (Matthias et al., Mol. Cell. Biol. 2008, 28, 1688-1701).
[7] Известно, что HDAC6, представитель HDAC класса IIb, присутствует в основном в цитоплазме и вовлечена в деацетилирование ряда негистонных субстратов (HSP90, кортактин, и т.д.), включая тубулин, (Yao et al., Mol. Cell 2005, 18, 601-607). HDAC6 имеет два каталитических домена, и домен цинкового пальца на C-конце может связываться с убиквитинилированными белками. Известно, что субстратами HDAC6 является ряд негистонных белков, и, таким образом, она играет важную роль в различных заболеваниях, включая злокачественную опухоль, воспалительные заболевания, аутоиммунные заболевания, неврологические заболевания и нейродегенеративные нарушения (Santo et al., Blood 2012 119: 2579-258; Vishwakarma et al., International Immunopharmacology 2013, 16, 72-78; Hu et al., J. Neurol. Sci. 2011, 304, 1-8).
[8] Общей структурной характеристикой различных ингибиторов HDAC является структура, состоящая из кэппирующей группы, линкера и цинк-связывающей группы (ZBG), как показано в представленной ниже структуре вориностата. Многие исследователи проводили исследования в отношении активности и селективности ингибирования фермента посредством модификации кэппирующей группы и линкера. Известно, что среди этих групп цинк-связывающая группа играет более важную роль в активности и селективности ингибирования фермента (Wiest et al., J. Org. Chem. 2013 78: 5051-5065; Methot et al., Bioorg. Med. Chem. Lett. 2008, 18, 973-978).
[9] 
[10] Цинк-связывающая группа обычно представляет собой производное гидроксамовой кислоты или бензамида. При этом, производное гидроксамовой кислоты демонстрирует мощный эффект ингибирования HDAC, но имеет проблемы низкой биодоступности и высокой неспецифической активности. Кроме того, производное бензамида имеет проблему, состоящую в том, что оно может образовывать токсические метаболиты in vivo, поскольку оно содержит анилин (Woster et al., Med. Chem. Commun. 2015, публикация через Интернет).
[11] Таким образом, существует потребность в разработке селективных ингибиторов HDAC6 для лечения заболеваний, таких как злокачественная опухоль, воспалительные заболевания, аутоиммунные заболевания, неврологические заболевания и нейродегенеративные нарушения, которые имеют цинк-связывающую группу с улучшенной биодоступностью и в то же время не вызывают побочных эффектов, в отличие от неселективных ингибиторов, которые вызывают побочные эффекты.
Описание
Техническая проблема
[12] Задачей настоящего изобретения является предоставление производных 1,3,4-оксадиазолсульфонамида, обладающей активностью селективного ингибирования HDAC6, их стереоизомеров или их фармацевтически приемлемых солей.
[13] Другой задачей настоящего изобретения является предоставление фармацевтических композиций, содержащих производные 1,3,4-оксадиазолсульфонамида, обладающие активностью селективного ингибирования HDAC6, их стереоизомеры или их фармацевтически приемлемые соли.
[14] Другой задачей настоящего изобретение является предоставление способов получения этих новых соединений.
[15] Другой задачей настоящего изобретения является предоставление фармацевтических композиций для предупреждения или лечения заболеваний, ассоциированных с активностью HDAC6, включая инфекционные заболевания; новообразования; эндокринные, алиментарные и метаболические заболевания; психические и поведенческие расстройства; неврологические заболевания; заболевания глаза и прилежащих органов; сердечно-сосудистые заболевания; респираторные заболевания; заболевания пищеварительного тракта; заболевания кожи и подкожной ткани; заболевания скелетно-мышечной системы и соединительной ткани; или врожденные пороки, деформации и хромосомные аномалии, которые содержат описанное выше соединение.
[16] Другой задачей настоящего изобретения является обеспечение применения соединений для изготовления терапевтических средств против заболеваний, ассоциированных с активностью HDAC6.
[17] Другой задачей настоящего изобретения является предоставление способов лечения заболеваний, ассоциированных с активностью HDAC6, которые включают введение терапевтически эффективного количества фармацевтических композиций, содержащих эти соединения.
Техническое решение
[18] Авторы настоящего изобретения открыли производные 1,3,4-оксадиазолсульфонамида, которые обладают активностью ингибирования деацетилазы гистонов 6 (HDAC6), и обнаружили, что эти соединения можно использовать для ингибирования или лечения заболеваний, ассоциированных с активностью деацетилазы гистонов 6 (HDAC6), тем самым осуществив настоящее изобретение.
[19] Производные 1,3,4-оксадиазолсульфонамида
[20] Для достижения описанных выше задач, настоящее изобретение относится к производному 1,3,4-оксадиазолсульфонамида формулы I, его стереоизомеру или его фармацевтически приемлемой соли:
[21] [Формула I]
[22]
[23] где R1 представляет собой -CX2H или -CX3;
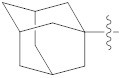
[24] R2 представляет собой -(C1-C4 алкил), -(C1-C4 алкил)-O(C1-C4 алкил), -(C1-C4)-C(=O)-O(C1-C4 алкил), -(C1-C4 алкил)-O-C(=O)-(C1-C4 алкил), -(C1-C4 алкил)-NRARB, -(C1-C4 алкил)арил, -(C1-C4 алкил)-гетероарил, -арил, -гетероарил,  ,
,  ,
,  или
или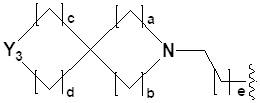 ,
,
[25] где по меньшей мере один H в -(C1-C4 алкиле), -(C1-C4 алкил)-O(C1-C4 алкиле), -(C1-C4 алкил)-C(=O)-O(C1-C4 алкиле), -(C1-C4 алкил)-O-C(=O)-(C1-C4 алкиле) или -(C1-C4 алкил)-NRARB может быть замещен -X или -OH,
[26] по меньшей мере один H в -(C1-C4 алкил)ариле, -(C1-C4 алкил)гетероариле, -ариле или -гетероариле может быть замещен -X, -OH, -O(C1-C4 алкилом), -(C1-C4 алкилом), -CF3, -CF2H, -(C1-C4 алкил)-OH, -C(=O)-(C1-C4 алкилом), -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкил)-C(=O)-(C1-C4 алкилом), -C(=O)-CF3 или -C(=O)-CF2H, и
[27] по меньшей мере один H в  ,
,  ,
,  или
или  может быть замещен -X, -OH, -O(C1-C4 алкилом), -NRARB, -CN, -(C1-C4 алкилом), -CF3, -CF2H, -(C1-C4 алкил)-OH, -(C1-C4 алкил)-NRARB, -C(=O)-(C1-C4 алкилом), -C(=O)-CF3, -C(=O)-CF2H, -C(=O)-NRARB, -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкил)-C(=O)-(C1-C4 алкилом), -(C1-C4 алкил)-OC(=O)-CF2H, -(C3-C6 гетероциклоалкилом), -(C1-C4 алкил)арилом, арилом или гетероарилом, где по меньшей мере один H в -(C1-C4 алкил)ариле, ариле или гетероариле может быть замещен -X, -OH, -O(C1-C4 алкилом) или -(C1-C4 алкилом);
может быть замещен -X, -OH, -O(C1-C4 алкилом), -NRARB, -CN, -(C1-C4 алкилом), -CF3, -CF2H, -(C1-C4 алкил)-OH, -(C1-C4 алкил)-NRARB, -C(=O)-(C1-C4 алкилом), -C(=O)-CF3, -C(=O)-CF2H, -C(=O)-NRARB, -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкил)-C(=O)-(C1-C4 алкилом), -(C1-C4 алкил)-OC(=O)-CF2H, -(C3-C6 гетероциклоалкилом), -(C1-C4 алкил)арилом, арилом или гетероарилом, где по меньшей мере один H в -(C1-C4 алкил)ариле, ариле или гетероариле может быть замещен -X, -OH, -O(C1-C4 алкилом) или -(C1-C4 алкилом);
[28] R3 представляет собой -H, -(C1-C4 алкил), -(C1-C4 алкил)-O(C1-C4 алкил), -(C1-C4 алкил)-C(=O)-O(C1-C4 алкил), -арил, -гетероарил,  ,
,  ,
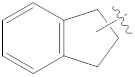
,  ,
,  ,
,  ,
,  или
или , где по меньшей мере один H в -(C1-C4 алкиле), -(C1-C4 алкил)-O(C1-C4 алкиле) или -(C1-C4 алкил)-C(=O)-O(C1-C4 алкиле) может быть замещен -X или -OH,
, где по меньшей мере один H в -(C1-C4 алкиле), -(C1-C4 алкил)-O(C1-C4 алкиле) или -(C1-C4 алкил)-C(=O)-O(C1-C4 алкиле) может быть замещен -X или -OH,
[29] по меньшей мере один H в -ариле или -гетероариле может быть замещен -X, -OH, -O(C1-C4 алкилом), -(C1-C4 алкилом), -CF3, -CF2H, -(C1-C4 алкил)-OH, -C(=O)-(C1-C4 алкилом), -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкил)-C(=O)-(C1-C4 алкилом), -C(=O)-CF3, -C(=O)-CF2H, 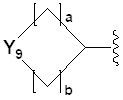 или
или ,
,
[30] по меньшей мере один H в ,
,  ,
,  или
или  может быть замещен -X, -OH, -O(C1-C4 алкилом), -(C1-C4 алкилом), -C(=O)-(C1-C4 алкилом), -C(=O)-O(C1-C4 алкилом) или -(C3-C6 гетероциклоалкилом);
может быть замещен -X, -OH, -O(C1-C4 алкилом), -(C1-C4 алкилом), -C(=O)-(C1-C4 алкилом), -C(=O)-O(C1-C4 алкилом) или -(C3-C6 гетероциклоалкилом);
[31] R4 представляет собой -CX2H или -CX3;
[32] каждый из L1-L4 независимо представляет собой -(C0-C2 алкил)-;
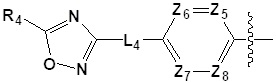
[33] каждый из Z1-Z8 независимо представляет собой N или CRZ, где по меньшей мере три из Z1-Z4 или Z5-Z8 не могут одновременно представлять собой N, и RZ представляет собой -H, -X или -O(C1-C4 алкил);
[34] каждый из Z9 и Z10 независимо представляет собой N или S;
[35] каждый из Y1-Y3 независимо представляет собой -CH2-, -NRC-, -O- или -S(=O)2-;
[36] каждый из Y4-Y7 независимо представляет собой -CH2-, -NRD- или -O-;
[37] Y8 представляет собой -C(=O), -CH2- или -NRE-;
[38] каждый из Y9 и Y10 независимо представляет собой -NRF- или -S(=O)2-;
[39] каждый из RA и RB независимо представляет собой -H, -(C1-C4 алкил), -(C1-C4 алкил)арил, -C(=O)-CF2H или -C(=O)-O(C1-C4 алкил);
[40] каждый из RC-RE независимо представляет собой -H, -(C1-C4 алкил), -(C1-C4 алкил)-OH, -(C1-C4 алкил)-O-(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-O(C1-C4 алкил), -C(=O)-(C3-C7 циклоалкил), -(C1-C4 алкил)-C(=O)-(C2-C6 гетероциклоалкил), -S(=O)2-(C1-C4 алкил), -(C1-C4 алкил)арил, -(C2-C4 алкенил)арил, -(C1-C4 алкил)гетероарил, -арил, -гетероарил, 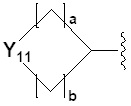 или
или ,
,
[41] где по меньшей мере один H в -(C1-C4 алкил)ариле, -(C2-C4 алкенил)ариле, -(C1-C4 алкил)гетероариле, -ариле, -гетероариле,  или
или  может быть замещен -X, -OH, -O(C1-C4 алкилом), -(C1-C4 алкилом) или -CF3;
может быть замещен -X, -OH, -O(C1-C4 алкилом), -(C1-C4 алкилом) или -CF3;
[42] Y11 представляет собой -CH2-, -NRF- или -O-;
[43] RF представляет собой -(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-(C1-C4 алкил)-OH, -C(=O)-(C3-C7 циклоалкил) или -S(=O)2-(C1-C4 алкил);
[44]  представляет собой одинарную связь или двойную связь при условии, что когда
представляет собой одинарную связь или двойную связь при условии, что когда  представляет собой двойную связь, Y1 или Y2 представляет собой -CH-;
представляет собой двойную связь, Y1 или Y2 представляет собой -CH-;
[45] каждый из a-e независимо представляет собой целое число, равное 0, 1, 2 или 3, при условии, что a и b не могут одновременно быть равны 0, и c и d не могут одновременно быть равны 0; и
[46] X представляет собой F, Cl, Br или I.
[47] Согласно предпочтительному варианту осуществления настоящего изобретения,
[48] R1 представляет собой -CX2H или -CX3;
[49] R2 представляет собой -(C1-C4 алкил), -(C1-C4 алкил)-O(C1-C4 алкил), -(C1-C4 алкил)-C(=O)-O(C1-C4 алкил), -(C1-C4 алкил)-O-C(=O)-(C1-C4 алкил), -(C1-C4 алкил)-NRARB, -(C1-C4 алкил)гетероарил, -арил, -гетероарил,  ,
,  или
или ,
,
[50] где по меньшей мере один H в -(C1-C4 алкиле), -(C1-C4 алкил)-O(C1-C4 алкиле), -(C1-C4 алкил)-C(=O)-O(C1-C4 алкиле), -(C1-C4 алкил)-O-C(=O)-(C1-C4 алкиле) или -(C1-C4 алкил)-NRARB может быть замещен -X или -OH,
[51] по меньшей мере один H в -(C1-C4 алкил)гетероариле, -ариле или -гетероариле может быть замещен -O(C1-C4 алкилом), -(C1-C4 алкилом) или -(C1-C4 алкил)-OH, и
[52] по меньшей мере один H в ,
,  или
или  может быть замещен -X, -OH, -NRARB, -CN, -(C1-C4 алкилом), -(C1-C4 алкил)-OH, -(C1-C4 алкил)-NRARB, -C(=O)-NRARB, -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкил)-C(=O)-(C1-C4 алкилом), -(C1-C4 алкил)-OC(=O)-CF2H, -(C3-C6 гетероциклоалкилом), -(C1-C4 алкил)арилом, -арилом или -гетероарилом, где по меньшей мере один H в -(C1-C4 алкил)ариле, -ариле или -гетероариле может быть замещен -X, -OH, -O(C1-C4 алкилом) или -(C1-C4 алкилом);
может быть замещен -X, -OH, -NRARB, -CN, -(C1-C4 алкилом), -(C1-C4 алкил)-OH, -(C1-C4 алкил)-NRARB, -C(=O)-NRARB, -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкил)-C(=O)-(C1-C4 алкилом), -(C1-C4 алкил)-OC(=O)-CF2H, -(C3-C6 гетероциклоалкилом), -(C1-C4 алкил)арилом, -арилом или -гетероарилом, где по меньшей мере один H в -(C1-C4 алкил)ариле, -ариле или -гетероариле может быть замещен -X, -OH, -O(C1-C4 алкилом) или -(C1-C4 алкилом);
[53] R3 представляет собой -H, -(C1-C4 алкил), -арил, -гетероарил,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или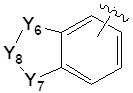 , где по меньшей мере один H в -(C1-C4 алкиле) может быть замещен -X или -OH,
, где по меньшей мере один H в -(C1-C4 алкиле) может быть замещен -X или -OH,
[54] по меньшей мере один H в -ариле или -гетероариле может быть замещен -X, -O(C1-C4 алкилом), -(C1-C4 алкилом), -CF3, -C(=O)-(C1-C4 алкилом),  или
или , и
, и
[55] по меньшей мере один H в  ,
,  ,
,  или
или  может быть замещен -(C1-C4 алкилом), -C(=O)-(C1-C4 алкилом), -C(=O)-O(C1-C4 алкилом) или -(C3-C6 гетероциклоалкилом);
может быть замещен -(C1-C4 алкилом), -C(=O)-(C1-C4 алкилом), -C(=O)-O(C1-C4 алкилом) или -(C3-C6 гетероциклоалкилом);
[56] R4 представляет собой -CX2H или -CX3;
[57] каждый из L1-L4 независимо представляет собой -(C0-C2 алкил)-;
[58] каждый из Z1-Z8 независимо представляет собой N или CRZ, где по меньшей мере три из Z1-Z4 или Z5-Z8 не могут одновременно представлять собой N, и RZ представляет собой -H, -X или -O(C1-C4 алкил);
[59] каждый из Z9 и Z10 независимо представляет собой N или S;
[60] каждый из Y1-Y3 независимо представляет собой -CH2-, -NRC-, -O- или -S(=O)2-;
[61] каждый из Y4-Y7 независимо представляет собой -CH2-, -NRD- или -O-;
[62] Y8 представляет собой -C(=O), -CH2- или -NRE-;
[63] каждый из Y9 и Y10 независимо представляет собой -NRF- или -S(=O)2-;
[64] каждый из RA и RB независимо представляет собой -H, -(C1-C4 алкил), -(C1-C4 алкил)арил, -C(=O)-CF2H или -C(=O)-O(C1-C4 алкил);
[65] каждый из RC-RE независимо представляет собой -H, -(C1-C4 алкил), -(C1-C4 алкил)-OH, -(C1-C4 алкил)-O-(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-O(C1-C4 алкил), -C(=O)-(C3-C7 циклоалкил), -(C1-C4 алкил)-C(=O)-(C2-C6 гетероциклоалкил), -S(=O)2-(C1-C4 алкил), -(C1-C4 алкил)арил, -(C2-C4 алкенил)арил, -(C1-C4 алкил)гетероарил, -арил, -гетероарил,  или
или ,
,
[66] где по меньшей мере один H в -(C1-C4 алкил)ариле, -(C2-C4 алкенил)ариле, -(C1-C4 алкил)гетероариле, -ариле, -гетероариле,  или
или  может быть замещен -X, -OH, -O(C1-C4 алкилом), -(C1-C4 алкилом) или -CF3;
может быть замещен -X, -OH, -O(C1-C4 алкилом), -(C1-C4 алкилом) или -CF3;
[67] Y11 представляет собой -CH2-, -NRF- или -O-;
[68] RF представляет собой -(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-(C1-C4 алкил)-OH, -C(=O)-(C3-C7 циклоалкил) или -S(=O)2-(C1-C4 алкил);
[69]  представляет собой одинарную связь или двойную связь при условии, что, когда
представляет собой одинарную связь или двойную связь при условии, что, когда  представляет собой двойную связь, Y1 или Y2 представляет собой -CH-;
представляет собой двойную связь, Y1 или Y2 представляет собой -CH-;
[70] каждый из a-e независимо представляет собой целое число, равное 0, 1, 2 или 3, при условии, что a и b не могут одновременно быть равны 0, и c и d не могут одновременно быть равны 0; и
[71] X представляет собой F, Cl, Br или I.
[72] Согласно более предпочтительному варианту осуществления настоящего изобретения,
[73] R1 представляет собой -CX2H;
[74] R2 представляет собой -(C1-C4 алкил), -(C1-C4 алкил)-C(=O)-O(C1-C4 алкил), -(C1-C4 алкил)-NRARB, -гетероарил,  или
или ,
,
[75] где по меньшей мере один H в -(C1-C4 алкиле), -(C1-C4 алкил)-C(=O)-O(C1-C4 алкиле) или -(C1-C4 алкил)-NRARB может быть замещен -X или -OH,
[76] по меньшей мере один H в -гетероариле может быть замещен -O(C1-C4 алкилом), -(C1-C4 алкилом) или -(C1-C4 алкил)-OH, и
[77] по меньшей мере один H в  или
или  может быть замещен -(C1-C4 алкилом) или -(C1-C4 алкил)-OH;
может быть замещен -(C1-C4 алкилом) или -(C1-C4 алкил)-OH;
[78] R3 представляет собой -арил, -гетероарил или ,
,
[79] где по меньшей мере один H в -ариле или -гетероариле может быть замещен -X, -O(C1-C4 алкилом), -(C1-C4 алкилом), -CF3 или -C(=O)-(C1-C4 алкилом), и
[80] по меньшей мере один H в  может быть замещен -(C1-C4 алкилом);
может быть замещен -(C1-C4 алкилом);
[81] каждый из L1 и L3 независимо представляет собой -(C0 алкил)-;
[82] L2 представляет собой -(C1 алкил)-;
[83] каждый из Z1-Z4 независимо представляет собой N или CRZ, где по меньшей мере два из Z1-Z4 не могут одновременно представлять собой N, и RZ представляет собой -H или -X;
[84] Y1 представляет собой -NRC-, -O- или -S(=O)2-;
[85] Y2 представляет собой -CH2- или -NRC-;
[86] каждый из Y6 и Y7 независимо представляет собой -O-;
[87] Y8 представляет собой -CH2-;
[88] каждый из RA и RB независимо представляет собой -(C1-C4 алкил);
[89] RC представляет собой -(C1-C4 алкил), -(C1-C4 алкил)-OH, -C(=O)-(C1-C4 алкил), -S(=O)2-(C1-C4 алкил) или ,
,
[90] где по меньшей мере один H в  может быть замещен -(C1-C4 алкилом);
может быть замещен -(C1-C4 алкилом);
[91] Y11 представляет собой -NRF- или -O-;
[92] RF представляет собой -(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-(C1-C4 алкил)-OH или -S(=O)2-(C1-C4 алкил);
[93]  представляет собой одинарную связь;
представляет собой одинарную связь;
[94] каждый из a, b и e независимо представляет собой целое число, равное 0, 1 или 2, при условии, что a и b не могут одновременно быть равны 0; и
[95] X представляет собой F, Cl, Br или I.
[96] Согласно особенно предпочтительному варианту осуществления настоящего изобретения,
[97] R1 представляет собой -CF2H;
[98] R2 представляет собой -(C1-C4 алкил), -(C1-C4 алкил)-NRARB,  или
или ,
,
[99] где по меньшей мере один H в -(C1-C4 алкиле) или -(C1-C4 алкил)-NRARB может быть замещен -X или -OH, и
[100] по меньшей мере один H в или
или  может быть замещен -(C1-C4 алкилом);
может быть замещен -(C1-C4 алкилом);
[101] R3 представляет собой -арил или -гетероарил,
[102] где по меньшей мере один H в -ариле или -гетероариле может быть замещен -X или -(C1-C4 алкилом);
[103] каждый из L1 и L3 независимо представляет собой -(C0 алкил)-;
[104] L2 представляет собой -(C1 алкил)-;
[105] каждый из Z1-Z4 независимо представляет собой N или CRZ, где по меньшей мере два из Z1-Z4 не могут одновременно представлять собой N, и RZ представляет собой H или -X;
[106] Y1 представляет собой -NRC-, -O- или -S(=O)2-;
[107] Y2 представляет собой -NRC-;
[108] каждый из RA и RB независимо представляет собой -(C1-C4 алкил);
[109] RC представляет собой -(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -S(=O)2-(C1-C4 алкил) или ,
,
[110] где по меньшей мере один H в  может быть замещен -(C1-C4 алкилом);
может быть замещен -(C1-C4 алкилом);
[111] Y11 представляет собой -NRF- или -O-;
[112] RF представляет собой -(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-(C1-C4 алкил)-OH или -S(=O)2-(C1-C4 алкил);
[113]  представляет собой одинарную связь;
представляет собой одинарную связь;
[114] каждый из a, b и e независимо представляет собой целое число, равное 0, 1 или 2, при условии, что a и b не могут одновременно быть равны 0; и
[115] X представляет собой F, Cl или Br.
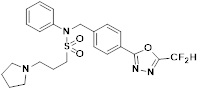
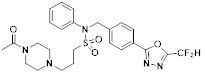
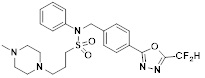
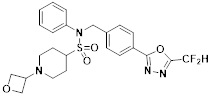
[116] Конкретные соединения формулы I представлены в таблице 1 ниже:
[117] [Таблица 1]
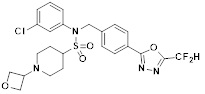
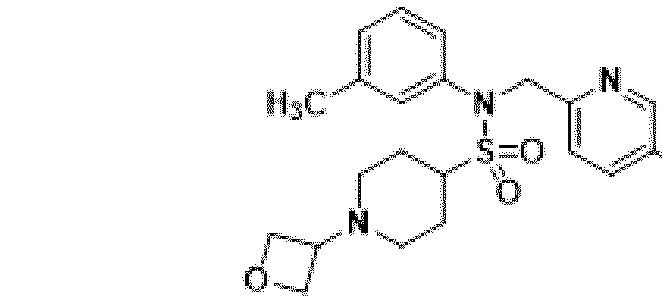
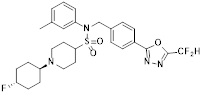
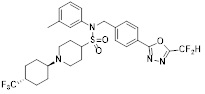
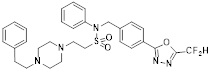
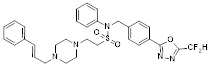
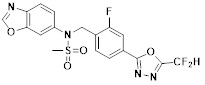
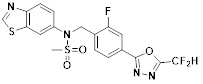
[118]




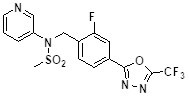

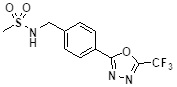
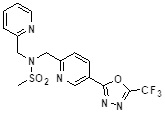



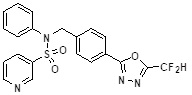














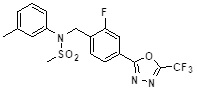






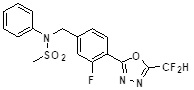






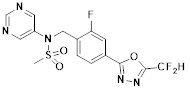






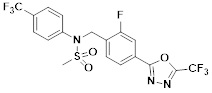

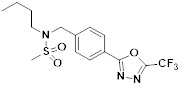


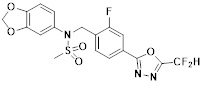


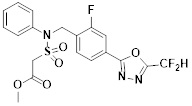
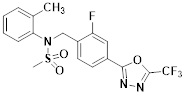





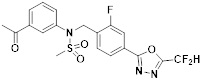

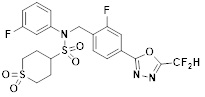
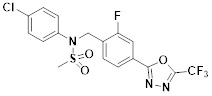







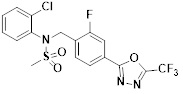


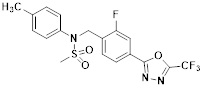




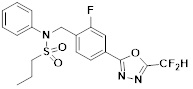



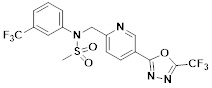








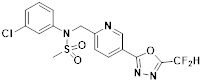


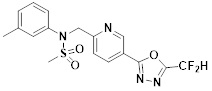





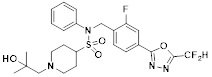



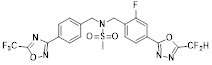

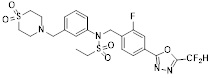
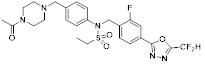








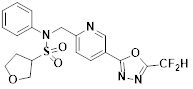




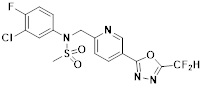


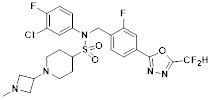



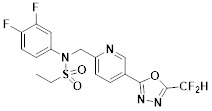



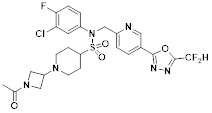





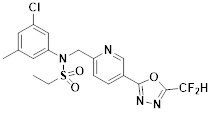




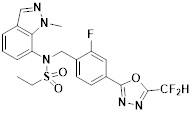




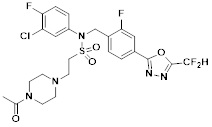
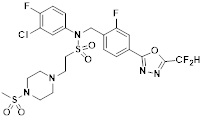
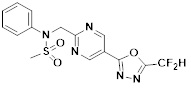

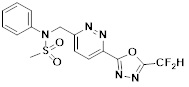
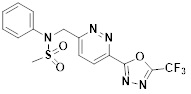
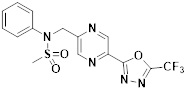
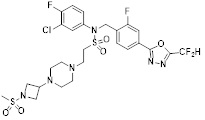










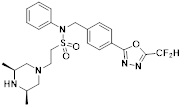




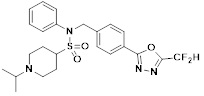




























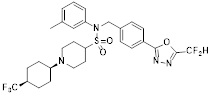




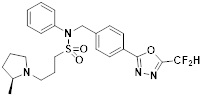



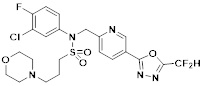
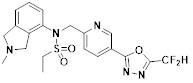
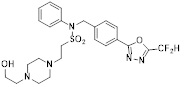
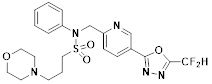





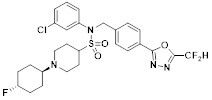


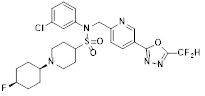
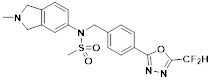


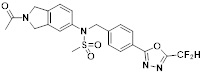





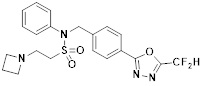



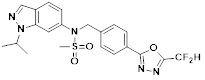





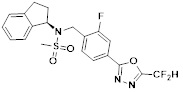
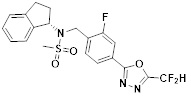
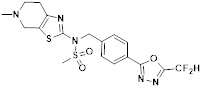

















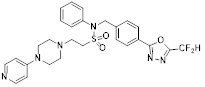



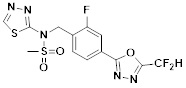
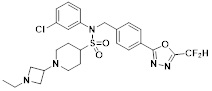






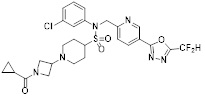


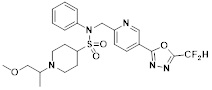




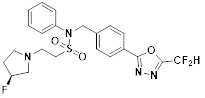









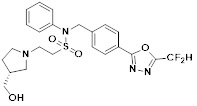


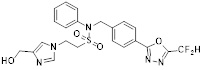







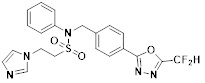



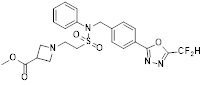

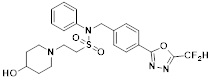
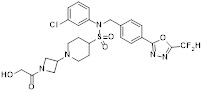




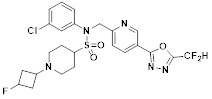
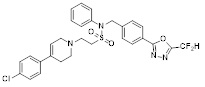




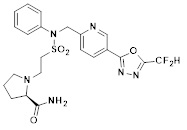

[142] Предпочтительно, соединения формулы I, их стереоизомеры или фармацевтически приемлемые соли могут быть выбраны из группы, состоящей из соединений 11154, 11156, 11168, 11170, 11171, 11172, 11176, 11178, 11182, 11191, 11193, 11197, 11217, 11225, 11227, 11231, 11254, 11256, 11276, 11284, 11287, 11289, 11324, 11345, 11346, 11350, 11352, 11353, 11354, 11355, 11366, 11367, 11368, 11372, 11373, 11377, 11390, 11411, 11412, 11426, 11428, 11433, 11447, 11448, 11451, 11452, 11460, 11461, 11462, 11463, 11497, 11501, 11502, 11503, 11504, 11505, 11506, 11507, 11508, 11521, 11522, 11539, 11540, 11541, 11552, 11553, 11554, 11564, 11582, 11583, 11637, 11638, 11646, 11647, 11665, 11679, 11680, 11681, 11682, 11683, 11684, 11685, 11721, 11777, 11781, 11782, 11803, 11806, 11809 и 11837. Более предпочтительно, соединения, соответствующие формуле I, их стереоизомеры или их фармацевтически приемлемые соли могут быть выбраны из группы, состоящей из соединений 11154, 11170, 11172, 11178, 11182, 11191, 11197, 11217, 11256, 11350, 11352, 11354, 11355, 11366, 11367, 11368, 11372, 11373, 11390, 11411, 11412, 11426, 11428, 11433, 11447, 11451, 11452, 11460, 11461, 11462, 11463, 11497, 11501, 11502, 11503, 11504, 11505, 11506, 11507, 11521, 11540, 11541, 11552, 11553, 11637, 11646, 11665, 11681, 11683, 11684, 11685 и 11781.
[143] Как используют в рамках изобретения, термин "фармацевтически приемлемая соль" означают соль, которую обычно используют в области фармацевтики. Примеры фармацевтически приемлемой соли включают, но не ограничиваются ими, соли с неорганическими ионами, такими как ионы кальция, калия, натрия или магния, соли с неорганическими кислотами, такими как хлористоводородная кислота, азотная кислота, фосфорная кислота, бромноватая кислота, йодноватая кислота, перхлорная кислота или серная кислота, соли с органическими кислотами, такими как уксусная кислота, трифторуксусная кислота, лимонная кислота, малеиновая кислота, янтарная кислота, щавелевая кислота, бензойная кислота, виннокаменная кислота, фумаровая кислота, миндальная кислота, пропионовая кислота, молочная кислота, гликолевая кислота, глюконовая кислота, галактуроновая кислота, глутаминовая кислота, глутаровая кислота, глюкуроновая кислота, аспарагиновая кислота, аскорбиновая кислота, угольная кислота, ванилиновая кислота, йодистоводородная кислота и т.п., соли с сульфоновыми кислотами, такими как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота или нафталинсульфоновая кислота, соли с аминокислотами, такими как глицин, аргинин или лизин, и соли с аминами, такими как триметиламин, триэтиламин, аммиак, пиридин или пиколин.
[144] В рамках настоящего изобретения предпочтительные соли включают соли с хлористоводородной кислотой, фосфорной кислотой, серной кислотой, трифторуксусной кислотой, лимонной кислотой, бромноватой кислотой, малеиновой кислотой, виннокаменной кислотой и т.п., и предпочтительные примеры таких соединений включают соединение 11172, как описано в настоящем описании.
[145] Соединения формулы I могут содержать один или несколько асимметричных атомов углерода и, таким образом, могут существовать в форме рацематов, рацемических смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Соединения формулы I могут быть разделены на такие изомеры способами, известными в данной области, например, колоночной хроматографией или ВЭЖХ. Альтернативно стереоизомеры соединений формулы I можно синтезировать стереоспецифическим синтезом с использованием оптически чистых исходных материалов и/или реагентов известной конфигурации.
[146]
[147] Способы получения соединений-производных 1,3,4-оксадиазолсульфонамида
[148] Настоящее изобретение относится к способам получения соединений-производных 1,3,4-оксадиазолсульфонамида, соответствующих формуле I, их стереоизомеров или их фармацевтически приемлемых солей.
[149] Предпочтительные способы получения соединений-производных 1,3,4-оксадиазолсульфонамида, соответствующих формуле I, их стереоизомеров или их фармацевтически приемлемых солей, показаны на схемах реакции 1-25 ниже и также включают модификации, понятные специалистам в данной области.
[150] [Схема реакции 1]
[151] 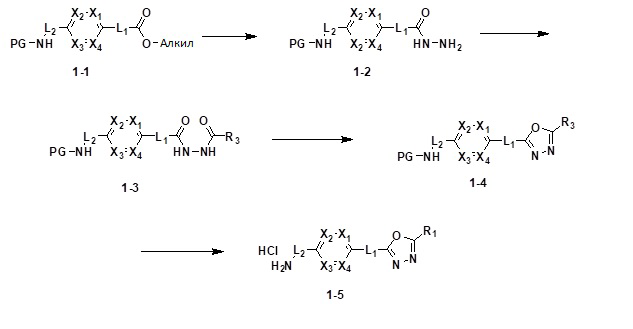
[152] Как показано на схеме реакции 1 выше, сложноэфирную часть соединения формулы 1-1 замещают гидразином с получением соединения формулы 1-2, которое затем подвергают реакции с трифторуксусным ангидридом или дифторуксусным ангидридом с получением соединения формулы 1-3. Затем полученное соединение формулы 1-3 подвергают реакции с 1-метокси-N-триэтиламмониосульфонилметилимидатом (реагент Бургесса) с получением соединения формулы 1-4, которое имеет структуру оксадиазола. Затем из соединения формулы 1-4 удаляют защитную группу, тем самым получая промежуточное соединение формулы 1-5.
[153] [Схема реакции 2]
[154] 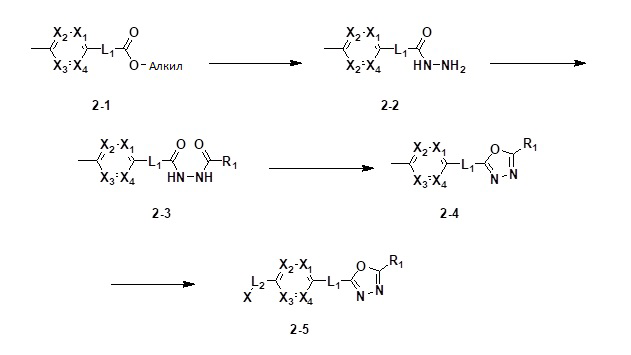
[155] Как показано на схеме реакции 2 выше, сложноэфирную часть соединения формулы 2-1 замещают гидразином с получением соединения формулы 2-2, которое затем подвергают реакции с трифторуксусным ангидридом или дифторуксусным ангидридом с получением соединения формулы 2-3. Далее соединение формулы 2-3 подвергают реакции с 1-метокси-N-триэтиламмониосульфонилметилимидатом (реагент Бургесса) с получением соединения формулы 2-4, которое имеет структуру оксадиазола. Затем метильную группу соединения формулы 2-4 галогенируют, тем самым получая промежуточное соединение формулы 2-5.
[156] [Схема реакции 3]
[157] 
[158] На схеме реакции 3 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 3-1 подвергают реакции с амином с получением соединения формулы 3-2, которое затем подвергают реакции с соединением формулы 2-5 в основных условиях, тем самым получая соединение формулы 3-3.
[159] Соединения, которые получают по схеме реакции 3, представляют собой соединения 11229, 11230, 11231, 11252, 11253, 11254, 11287, 11288, 11289, 11290, 11291, 11292, 11747, 11748, 11749, 11774, 11775 и 11776.
[160] [Схема реакции 4]
[161] 
[162] На схеме реакции 4 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 1-5 подвергают реакции с любыми из различных сульфонилхлоридных соединений (формула 3-1) с получением соединения формулы 4-1, которое затем подвергают реакции замещения с R3-L2-X, тем самым получая соединение формулы 3-3.
[163] Соединения, которые получают по схеме реакции 4, представляют собой соединения 11078, 11121 и 11222.
[164] [Схема реакции 5]
[165] 
[166] На схеме реакции 5 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 5-1 подвергают реакции восстановительного аминирования с соединения амина с получением соединения формулы 5-2, которое затем подвергают реакции с любым из различных сульфонилхлоридных соединений (формула 3-1) с получением соединения формулы 5-4. Альтернативно соединение формулы 3-2 подвергают реакции замещения с соединением формулы 5-3 в основных условиях с получением соединения формулы 5-4. Затем соединение формулы 5-4 подвергают реакции с гидразином с получением соединения формулы 5-5. Далее, соединение формулы 5-5 подвергают реакции с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 3-3, которое имеет структуру оксадиазола. Соединения, которые получают по схеме реакции 5 выше, представляют собой соединения 11120, 11151, 11152, 11153, 11154, 11155, 11167, 11168, 11173, 11174, 11196, 11197, 11216, 11217, 11218, 11225, 11226, 11227, 11255, 11256, 11271, 11272, 11323, 11324, 11338, 11345, 11346, 11347, 11348, 11350, 11351, 11354, 11355, 11366, 11390, 11411, 11412, 11428, 11429, 11430, 11431, 11432, 11433, 11504, 11505, 11506, 11520, 11521, 11522, 11539, 11540, 11541, 11628, 11636, 11668, 11669, 11739, 11740, 11741, 11742, 11743, 11744, 11745, 11746 и 11750.
[167] Кроме того, соединение формулы 5-6, которое не имеет структуры оксадиазола, подвергают реакции с 1-метокси-N-триэтиламмониосульфонилметилимидатом (реагент Бургесса) с получением соединения формулы 3-3, которое имеет структуру оксадиазола. Соединения, которые получают по этой схеме реакции, представляют собой соединения 11044, 11045, 11088, 11089, 11128, 11129, 11133, 11156, 11169, 11170, 11171, 11172, 11175, 11176, 11177, 11178, 11179, 11180, 11181, 11182, 11183, 11184, 11190, 11191, 11192, 11193, 11194, 11195, 11219, 11220, 11221, 11248, 11249, 11250, 11251, 11273, 11274, 11275, 11276, 11277, 11278, 11279, 11280, 11281, 11282, 11283, 11284, 11352, 11353, 11460, 11461, 11462, 11463, 11497, 11507 и 11508.
[168] [Схема реакции 6]
[169]
[170]
[171]
[172] На схеме реакции 6 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 6-1 подвергают реакции восстановительного аминирования с соединением формулы 5-1 с получением соединения формулы 6-2, которое затем подвергают реакции с любым из различных сульфонилхлоридных соединений (формула 3-1), тем самым получая соединение формулы 6-3. Соединение формулы 6-3 подвергают реакции с гидразином с получением соединения формулы 6-4, которое затем подвергают реакции с трифторуксусным ангидридом или дифторуксусным ангидридом с получением соединения формулы 6-5, которое имеет структуру оксадиазола.
[173] Соединение, которое получают по схеме реакции 6 выше, представляет собой соединение 11186.
[174] [Схема реакции 7]
[175] 
[176] 
[177] На схеме реакции 7 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 7-1 подвергают реакции с любым из различных соединений амина с получением соединения формулы 7-2, которое затем подвергают реакции замещения с соединением формулы 5-1, тем самым получая соединение формулы 7-3. Защитную группу соединения формулы 7-3 удаляют, тем самым получая соединение формулы 7-4. Соединение формулы 7-4 подвергают реакции восстановительного аминирования или реакции замещения, тем самым получая соединение формулы 7-5. Соединение формулы 7-5 подвергают реакции с гидразином с получением соединения формулы 7-6, которое затем подвергают реакции с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 7-7, которое имеет структуру оксадиазола.
[178] Соединения, которые получают по схеме реакции 7 выше, представляют собой соединения 11367, 11368, 11372, 11373, 11377, 11426, 11501, 11625, 11637, 11638, 11639 и 11794.
[179] [Схема реакции 8]
[180]
[181]
[182]
[183] На схеме реакции 8 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 7-4 подвергают реакции восстановительного аминирования, реакции замещения и реакции амидного сочетания с получением соединения формулы 8-1, которое затем подвергают реакции с гидразином, тем самым получая соединение формулы 8-2. Затем соединение формулы 8-2 подвергают реакции с трифторуксусным ангидридом или дифторуксусным ангидридом с получением соединения формулы 8-3 или формулы 8-4. Далее, соединение формулы 8-3 подвергают реакции циклизации с использованием основания и хорошей уходящей группы, тем самым получая соединение формулы 8-4. Из полученного соединения формулы 8-4 удаляют защитную группу с получением соединения формулы 8-5, которое затем подвергают реакции восстановительного аминирования или реакции замещения, тем самым получая соединение формулы 8-6.
[184] Соединения, которые получают по схеме реакции 8 выше, представляют собой соединения 11447, 11448, 11451, 11452, 11837, 11838 и 11839.
[185] [Схема реакции 9]
[186]
[187] На схеме реакции 9 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, из соединения формулы 8-1 удаляют защитную группу с получением соединения формулы 9-1, которое затем подвергают реакции замещения, тем самым получая соединение формулы 9-2. Далее, соединение формулы 9-2 подвергают реакции с гидразином с получением соединения формулы 9-3, которое затем подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 8-6.
[188] Соединения, которые получают по схеме реакции 9 выше, представляют собой соединения 11502 и 11503.
[189] [Схема реакции 10]
[190]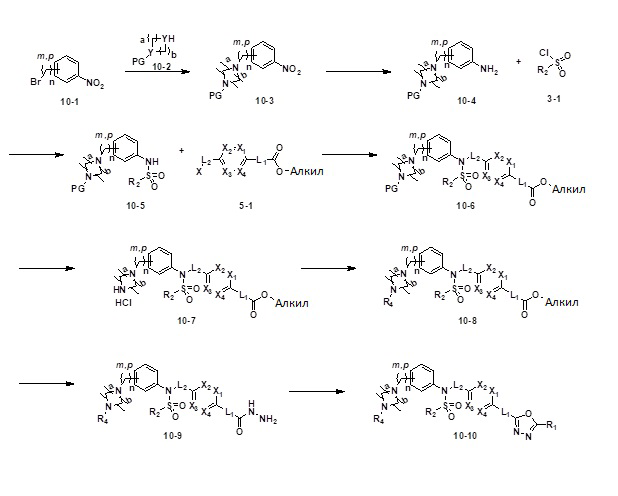
[191] 
[192] На схеме реакции 10 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 10-1 подвергают реакции замещения с соединением формулы 10-2 с получением соединения формулы 10-3, и нитрогруппу соединения формулы 10-3 восстанавливают цинком, тем самым получая соединение формулы 10-4. Далее, соединение формулы 10-4 подвергают реакции с любыми из различных сульфонилхлоридных соединений (формула 3-1) с получением соединения формулы 10-5, которое затем подвергают реакции замещения с соединением формулы 5-1, тем самым получая соединение формулы 10-7. Далее, из соединения формулы 10-7 удаляют защитную группу и подвергают реакции восстановительного аминирования, реакции замещения или реакции амидного сочетания с получением соединения формулы 10-8, которое затем подвергают реакции с гидразином с получением соединения формулы 10-9. Далее, соединение формулы 10-9 подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 10-10.
[193] Соединения, которые получают по схеме реакции 10 выше, представляют собой соединения 11386, 11387, 11388, 11402, 11403, 11404, 11405 и 11406.
[194] [Схема реакции 11]


[201] На схеме реакции 11 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 9-1 подвергают реакции замещения с соединением формулы 11-2 с получением соединения формулы 11-3, и нитрогруппу соединения формулы 11-3 восстанавливают цинком с получением соединения формулы 11-4. Далее, соединение формулы 11-4 подвергают реакции с любым из различных сульфонилхлоридных соединений (формула 3-1) с получением соединения формулы 11-5, которое затем подвергают реакции замещения с соединением формулы 5-1, тем самым получая соединение формулы 11-6. Соединение формулы 11-6 подвергают реакции с гидразином с получением соединения формулы 11-7, которое затем подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусной кислотой, тем самым получая соединение формулы 11-8.
[202] Соединение, которое получают по схеме реакции 11 выше, представляет собой соединение 11392.
[203] [Схема реакции 12]
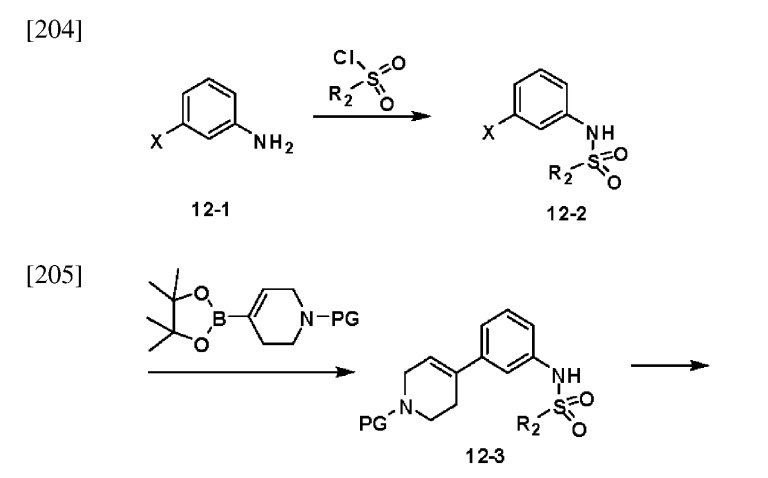
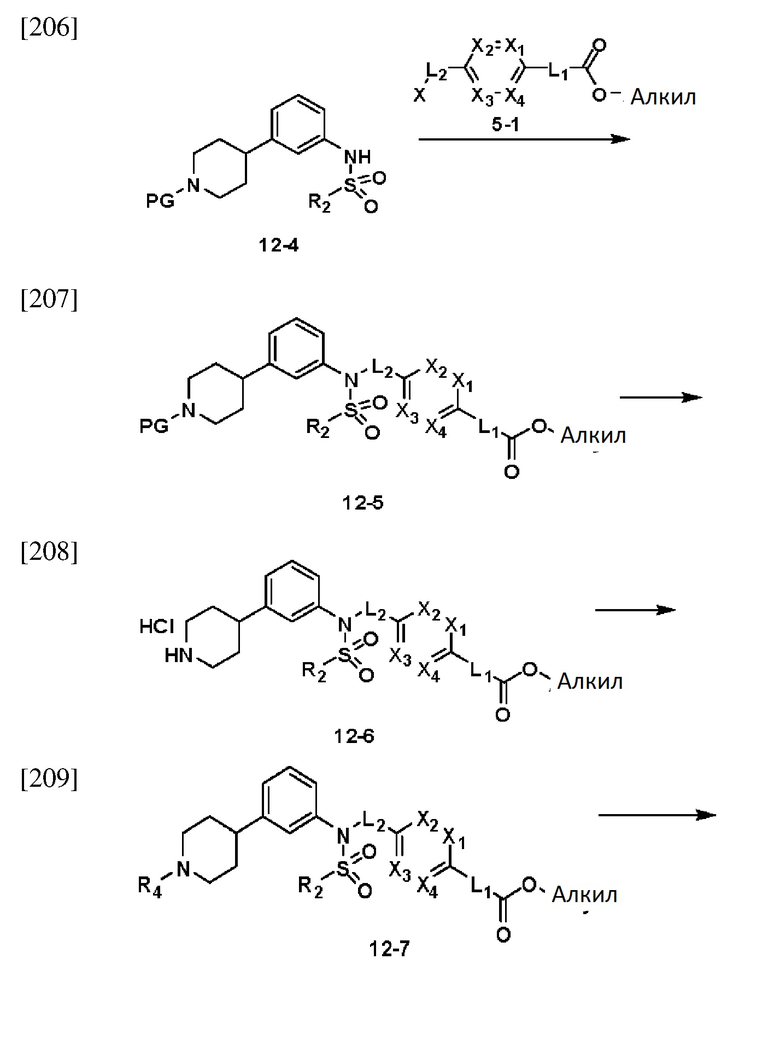

[212] На схеме реакции 12 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 12-1 подвергают реакции замещения с любым из различных сульфонилхлоридных соединений (формула 3-1) с получением соединения формулы 12-2, которое затем подвергают реакции сочетания Сузуки со сложным эфиром борной кислоты, тем самым получая соединение формулы 12-3. Соединение формулы 12-3 подвергают реакции восстановления в присутствии палладия и водорода с получением соединения формулы 12-4, которое затем подвергают реакции замещения с соединением формулы 5-1, тем самым получая соединение формулы 12-5. Из соединения формулы 12-5 удаляют защитную группу, а затем подвергают реакции восстановительного аминирования с амином, тем самым получая соединение формулы 12-7. Далее соединение формулы 12-7 подвергают реакции с гидразином с получением соединения формулы 12-8, которое затем подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 12-9.
[213] Соединение, которое получают по схеме реакции 12 выше, представляет собой соединение 11427.
[214] [Схема реакции 13]


[219] На схеме реакции 13 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, защитную группу вносят в соединение формулы 13-1 с получением соединения формулы 13-2, и бензонитрильную группу соединения формулы 13-2 замещают гидроксибензимидом в присутствии гидроксиламина и основания с получением соединения формулы 13-3. Затем полученное соединение формулы 13-3 подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом с получением соединения формулы 13-4. Далее, из соединения формулы 13-4 удаляют защитную группу с получением соединения формулы 13-5, которое затем подвергают реакции замещения с любым из различных сульфонилхлоридных соединений (формула 3-1), тем самым получая соединение формулы 13-6. Соединение формулы 13-6 подвергают реакции замещения с соединением формулы 2-5 в основных условиях с получением соединения формулы 13-7. Когда оксадиазольное кольцо открыто, соединение формулы 13-7 подвергают реакции циклизации с использованием хорошей уходящей группы в основных условиях, тем самым получая соединение формулы 13-8.
[220] Соединение, которое получают по схеме реакции 13 выше, представляет собой соединение 11389.
[221] [Схема реакции 14]
[222] 
[223] На схеме реакции 14 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, метильную группу соединения формулы 2-1 галогенируют с получением соединения формулы 5-1, которое затем подвергают реакции замещения с любым из различных сульфонамидных соединений (формула 3-2), тем самым получая соединение формулы 5-4. Далее, соединение формулы 5-4 подвергают реакции с гидразином с получением соединения формулы 5-5, которое затем подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусной кислотой, тем самым получая соединение формулы 3-3.
[224] Соединения, которые получают по схеме реакции 14 выше, представляют собой соединения 11518, 11564, 11565, 11566, 11567, 11573, 11605 и 11606.
[225] [Схема реакции 15]
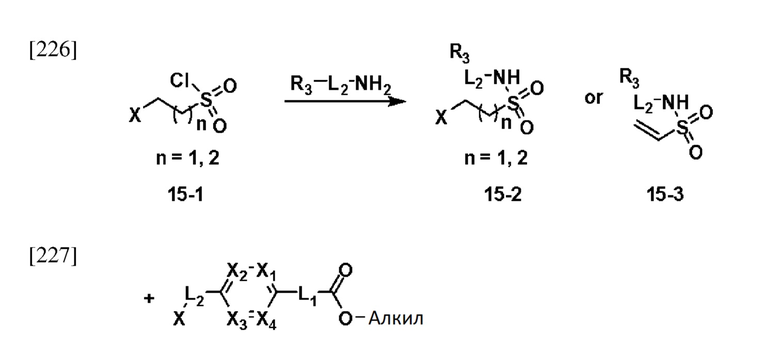

[232] На схеме реакции 15 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 15-1 подвергают реакции замещения с любым из различных соединений первичных аминов с получением соединения формулы 15-2 или формулы 15-3, которое затем подвергают реакции замещения с соединением формулы 5-1, тем самым получая соединение формулы 15-4 или 15-5. Полученное соединение подвергают реакции с соединением амина (формула 10-2) с получением соединения формулы 15-6, которое затем подвергают реакции с гидразином, тем самым получая соединение формулы 15-7. Далее, полученное соединение подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 15-8.
[233] Соединения, которые получают по схеме реакции 15 выше, представляют собой соединения 11514, 11588, 11589, 11629, 11630, 11631. 11632, 11645, 11647, 11655, 11657, 11658, 11663, 11675, 11676, 11677, 11678, 11679, 11685, 11700, 11705, 11706, 11707, 11708, 11709, 11710, 11711, 11717, 11718, 11719, 11721, 11722, 11723, 11724 и 11786.
[234] [Схема реакции 16]
[235] 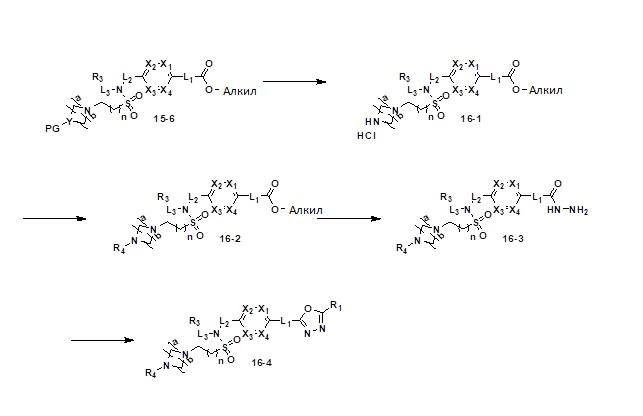
[236] На схеме реакции 16 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, из соединения формулы 15-6 удаляют защитную группу с получением соединения формулы 16-1, которое затем подвергают реакции восстановительного аминирования или реакции замещения, тем самым получая соединение формулы 16-2. Далее, полученное соединение подвергают реакции с гидразином с получением соединения формулы 16-3, которое затем подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 16-4.
[237] Соединения, которые получают по схеме реакции 16 выше, представляют собой соединения 11552, 11553, 11554, 11583, 11648 и 11656.
[238] [Схема реакции 17]


[241] На схеме реакции 17 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 16-1 подвергают реакции восстановительного аминирования с соединением кетона с получением соединения формулы 17-1, из которого затем удаляют защитную группу с получением соединения формулы 17-2. Затем полученное соединение подвергают реакции замещения с получением соединения формулы 17-3. Соединение формулы 17-3 подвергают реакции с гидразином с получением соединения формулы 17-4, которое затем подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 17-5.
[242] Соединение, которое получают согласно схеме реакции 17 выше, представляет собой соединение 11582.
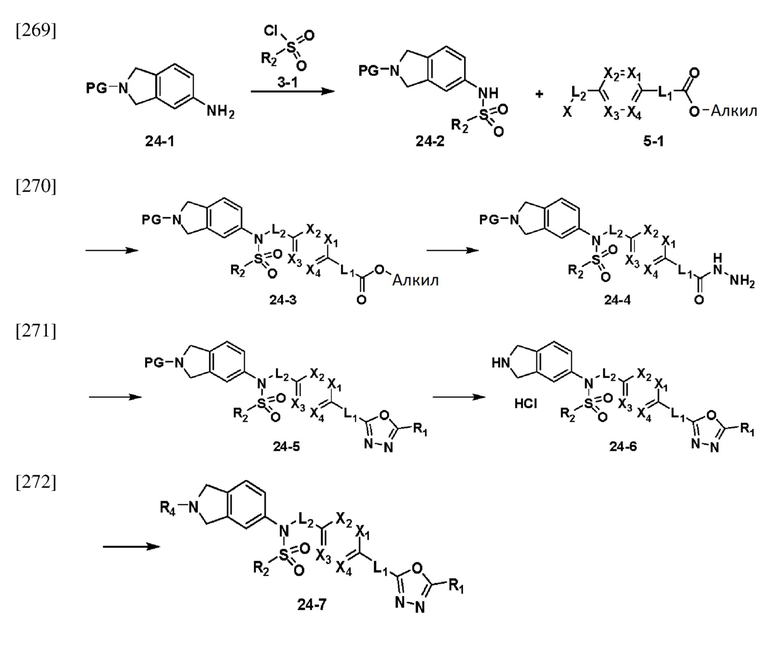
[243] [Схема реакции 18]
[244]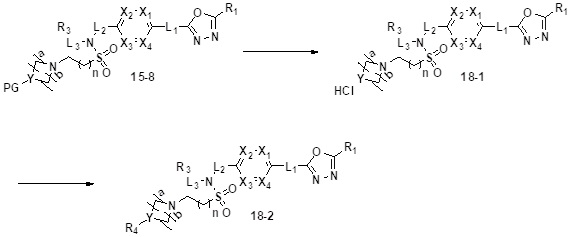
[245] На схеме реакции 18 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, из соединения формулы 15-8 удаляют защитную группу с получением соединения формулы 18-1, которое затем подвергают реакции замещения, тем самым синтезируя соединение формулы 18-2.
[246] Соединения, которые получают по схеме реакции 18 выше, представляют собой соединения 11633 и 11634.
[247] [Схема реакции 19]
[248]
[249] На схеме реакции 19 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 15-6 подвергают реакции восстановительного аминирования с альдегидом с получением соединения формулы 19-1. Полученное соединение формулы 19-1 подвергают реакции с гидразином с получением соединения формулы 19-2, которое затем подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 19-3.
[250] Соединения, которые получают по схеме реакции 19 выше, представляют собой соединения 11646 и 11665.
[251] [Схема реакции 20]


[254] На схеме реакции 20 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 20-1 подвергают реакции с гидразином с получением соединения формулы 20-5, которое затем подвергают реакции циклизации с получением соединения формулы 20-3. Полученное соединение формулы 20-3 бромируют с получением соединения формулы 20-6. Альтернативно используют ацилхлорид формулы 20-4 с получением соединения формулы 20-6. Между тем, соединение формулы 14-1 подвергают реакции замещения с любым из различных соединений первичных аминов с получением соединения формулы 14-3, которое затем подвергают реакции замещения с соединением формулы 20-6 с получением соединения формулы 20-7. Затем полученное соединение подвергают реакции с соединением амина (формула 14-6), тем самым получая соединение формулы 20-8.
[255] Соединения, которые получают по схеме реакции 20 выше, представляют собой соединения 11737, 11738, 11751, 11752, 11753, 11754, 11755, 11756, 11757, 11758, 11759, 11760, 11761, 11762, 11763, 11764, 11765, 11766, 11767, 11768, 11769, 11770, 11771, 11772, 11773, 11795, 11796, 11797, 11798, 11799, 11800, 11801, 11802, 11803, 11804, 11805, 11806, 11807, 11808, 11809, 11810, 11811, 11812, 11813, 11814, 11815, 11816, 11817, 11818, 11819, 11820, 11821, 11822, 11842, 11843, 11844, 11845, 11847, 11848 и 11849.
[256] [Схема реакции 21]
[257] 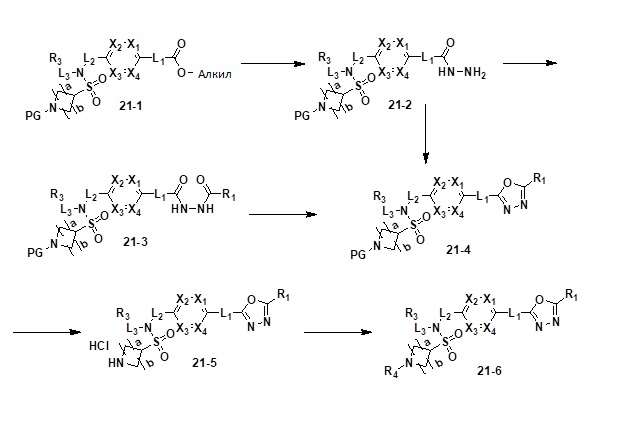
[258] На схеме реакции 21 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 21-1 подвергают реакции с гидразином с получением соединения формулы 21-2, которое затем подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 21-4. Из полученного соединения формулы 21-4 удаляют защитную группу с получением соединения формулы 21-5, которое затем подвергают реакции восстановительного аминирования или реакции замещения, тем самым получая соединение формулы 21-6.
[259] Соединения, которые получают по схеме реакции 21 выше, представляют собой соединения 11680, 11681, 11682, 11683, 11684, 11686, 11687, 11688, 11689, 11690, 11691, 11692, 11693, 11694, 11695, 11696, 11697, 11698, 11699, 11725, 11726, 11727, 11728, 11790, 11791, 11792 и 11793.
[260] [Схема реакции 22]
[261] 
[262] На схеме реакции 22 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 22-1 подвергают реакции восстановительного аминирования с получением соединения формулы 22-2, из которого затем удаляют защитную группу, тем самым получая соединение формулы 22-3. Полученное соединение формулы 22-3 подвергают реакции восстановительного аминирования или реакции замещения, тем самым получая соединение формулы 22-4.
[263] Соединения, которые получают по схеме реакции 22 выше, представляют собой соединения 11777, 11778, 11779, 11780, 11781, 11782, 11783, 11784, 11785 и 11836.
[264] [Схема реакции 23]
[265] 
[266] На схеме реакции 23 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 23-1 подвергают реакции восстановительного аминирования с получением соединения формулы 23-2, и гидроксильную группу соединения формулы 23-1 замещают фторидом с получением соединения формулы 23-3. Полученное соединение формулы 23-3 подвергают реакции с гидразином с получением соединения формулы 23-4, которое затем подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 23-5.
[267] Соединения, которые получают по схеме реакции 23 выше, представляют собой соединения 11840 и 11841.
[268] [Схема реакции 24]
[273] На схеме реакции 24 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 24-1 последовательно подвергают реакции замещения с соединением формулы 3-1 и реакции замещения с соединением формулы 5-1 с получением соединения формулы 24-3, которое затем подвергают реакции с гидразином с получением соединения формулы 24-4. Затем полученное соединение формулы 24-4 подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом с получением соединения формулы 24-5, из которого затем удаляют защитную группу, тем самым получая соединение формулы 24-6. Затем полученное соединение формулы 24-6 подвергают реакции восстановительного аминирования или реакции замещения, тем самым получая соединение формулы 24-7.
[274] Соединения, которые получают по схеме реакции 24 выше, представляют собой соединения 11729, 11730, 11731, 11732, 11733, 11734, 11735 и 11736.
[275] [Схема реакции 25]
[276]
[277]На схеме реакции 25 выше представлен общий способ синтеза соединений, имеющих сульфонамидную структуру. Как показано на схеме, соединение формулы 25-1 последовательно подвергают реакции замещения с соединением формулы 3-1 и реакции замещения с соединением формулы 5-1 с получением соединения формулы 25-3. Соединение формулы 25-4 подвергают реакции восстановительного аминирования или реакции замещения с получением соединения формулы 25-5. Затем соединение формулы 25-5 подвергают реакции с гидразином с получением соединения формулы 25-6, которое затем подвергают реакции циклизации с трифторуксусным ангидридом или дифторуксусным ангидридом, тем самым получая соединение формулы 25-7.
[278] Соединение, которое получено по схеме реакции 25 выше, представляет собой соединение 11712.
[279]
[280] Композиции, содержащие соединения-производные 1,3,4-оксадиазолсульфонамида, их применение и способ лечения заболеваний
[281] Настоящее изобретение относится к фармацевтической композиции для предупреждения или лечения заболеваний, ассоциированных с активностью деацетилазы гистонов 6 (HDAC6), которая содержит в качестве активного ингредиента соединение, соответствующее следующей формуле I, его стереоизомер или его фармацевтически приемлемую соль:
[282] [Формула I]
[283] 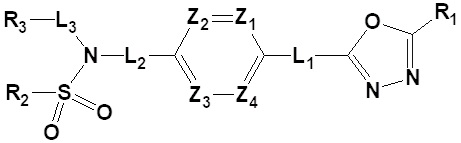
[284] где формула I является такой, как определено выше.
[285] Фармацевтическая композиция в соответствии с настоящим изобретением демонстрирует примечательный эффект предупреждения или лечения заболеваний, ассоциированных с активностью деацетилазы гистонов 6 (HDAC6), посредством селективного ингибирования деацетилазы гистонов 6 (HDAC6).
[286] Заболевания, ассоциированные с активностью деацетилазы гистонов 6 (HDAC6), включают инфекционные заболевания, такие как прионное заболевание; новообразования, такие как доброкачественная опухоль (например, миелодиспластический синдром) или злокачественная опухоль (например, множественная миелома, лимфома, лейкоз, рак легкого, рак прямой кишки, рак толстого кишечника, рак предстательной железы, уротелиальная карцинома, рак молочной железы, меланома, рак кожи, рак печени, злокачественная опухоль головного мозга, рак желудка, рак яичника, рак поджелудочной железы, рак головы и шеи, рак полости рта или глиома); эндокринные, алиментарные и метаболические заболевания, такие как болезнь Вилсона, амилоидоз или диабет; психические и поведенческие расстройства, такие как депрессия или синдром Ретта и т.д.; неврологические заболевания, такие как атрофия центральной нервной системы (например, болезнь Гентингтона, спинальная мышечная атрофия (SMA), спинально-церебеллярная атаксия (SCA)), нейродегенеративное заболевание (например, болезнь Альцгеймера), двигательное нарушение (например, болезнь Паркинсона), невропатия (например, наследственная невропатия (болезнь Шарко-Мари-Тута), спорадическая невропатия, воспалительная невропатия, индуцируемая лекарственными средствами невропатия), заболевания двигательных нейронов (боковой амиотрофический склероз (ALS)) или демиелинизирующие заболевания центральной нервной системы (например, рассеянный склероз (MS)) и т.п.; заболевания глаза и прилежащих органов, такие как увеит; сердечно-сосудистые заболевания, такие как фибрилляция предсердий или инсульт и т.п.; респираторные заболевания, такие как астма; заболевания пищеварительного тракта, такие как алкогольное заболевание печени, воспалительное заболевание кишечника, болезнь Крона или язвенное заболевание кишечника и т.п.; заболевания кожи и подкожной ткани, такие как псориаз; заболевания скелетно-мышечной системы и соединительной ткани, такие как ревматоидный артрит, остеоартрит или системная красная волчанка (SLE) и т.п.; или врожденные пороки, деформации и хромосомные аномалии, такие как аутосомно-доминантный поликистоз почек, а также нарушения или заболевания, ассоциированные с аномальной функцией деацетилазы гистонов.
[287] Фармацевтически приемлемая соль является такой, как описано выше в отношении фармацевтически приемлемой соли соединения формулы I в соответствии с настоящим изобретением.
[288] Для введения фармацевтическая композиция в соответствии с настоящим изобретением, кроме того, может содержать по меньшей мере один фармацевтически приемлемый носитель в дополнение к соединению формулы I, его изомеру или его фармацевтически приемлемой соли. Фармацевтически приемлемый носитель, который используют в рамках настоящего изобретения, может представлять собой по меньшей мере один из физиологического солевого раствора, стерильной воды, раствора Рингера, забуференного солевого раствора, раствора декстрозы, раствора мальтодекстрина, глицерина, этанола и смеси двух или более из их. Если необходимо, композиция может содержать другие общепринятые добавки, такие как антиоксидант, буфер или бактериостатическое средство. Кроме того, композицию можно составлять в виде инъекционных составов, таких как растворы, суспензии, мутные жидкости и т.д., пилюли, капсулы, гранулы или таблетки, с использованием разбавителя, диспергирующего вещества, поверхностно-активного вещества, связующего вещества и смазывающего вещества. Таким образом, композиция по настоящему изобретению может иметь форму пластырей, жидкостей, пилюль, капсул, гранул, таблеток, суппозиториев и т.д. Эти составы можно получать либо общепринятыми способами, которые используют для составления в данной области, либо способом, описанным в Remington's Pharmaceutical Science (последнее издание), Mack Publishing Company, Easton PA.
[289] Фармацевтическую композицию по настоящему изобретению можно вводить перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местным путем), в зависимости от предполагаемого применения. Доза фармацевтической композиции варьируется в зависимости от массы тела, возраста, пола, состояния здоровья и рациона пациента, времени введения, пути введения, скорости экскреции, тяжести заболевания и т.п. Суточная доза соединения формулы I в соответствии с настоящим изобретением может составлять от 1 до 1000 мг/кг, предпочтительно от 5 до 100 мг/кг, и ее можно вводить от одного до нескольких раз в сутки.
[290] Кроме того, фармацевтическая композиция по настоящему изобретению может содержать, в дополнение к соединению, соответствующему формуле I, его стереоизомеру или его фармацевтически приемлемой соли, один или несколько активных ингредиентов, которые демонстрируют медицинскую эффективность, идентичную или сходную с ним.
[291] Настоящее изобретение также относится к способу предупреждения или лечения заболевания, опосредуемого деацетилазой гистонов, который включает введение терапевтически эффективного количества соединения, соответствующего формуле I, его стереоизомера или его фармацевтически приемлемой соли.
[292] Как используют в рамках изобретения, термин "терапевтически эффективное количество" относится к количеству соединения, соответствующего формуле I, которое является эффективным для предупреждения или лечения заболеваний, ассоциированных с активностью деацетилазы гистонов 6.
[293] Настоящее изобретение также относится к способу селективного ингибирования HDAC6, который включает введение соединения формулы I, его стереоизомера или его фармацевтически приемлемой соли млекопитающим, в том числе людям.
[294] Способ предупреждения или лечения заболевания, ассоциированного с активностью деацетилазы гистонов 6, в соответствии с настоящим изобретением включает ингибирование или предотвращение заболевания, а также воздействие на само заболевание перед возникновением симптомов путем введения соединения, соответствующего формуле I. При управлении течением заболеваний, величина профилактической или терапевтической дозы конкретного активного ингредиента варьируется в зависимости от природы и тяжести заболевания или состояния, и также может варьироваться в зависимости от пути введения активного ингредиента. Доза и частота дозирования также варьируются в зависимости от возраста, массы тела и ответа индивидуального пациента. Подходящие режимы дозирования могут быть без труда выбраны специалистами в данной области с учетом таких факторов. Кроме того, способ предупреждения или лечения заболевания, ассоциированного с активностью деацетилазы гистонов 6, в соответствии с настоящим изобретением, кроме того, может включать введение терапевтически эффективного количества дополнительного активного вещества, способствующего лечению заболевания вместе с соединением формулы I, где дополнительное активное вещество может проявлять синергичный эффект с соединением формулы I или эффект способствования.
[295] Настоящее изобретение также относится к применению соединения формулы I, его стереоизомера или его фармацевтически приемлемой соли для получения лекарственного средства для лечения заболевания, ассоциированного с активностью деацетилазы гистонов 6. Для получения лекарственного средства соединение формулы I можно смешивать с фармацевтически приемлемым адъювантом, разбавителем, носителем и т.п. и комбинировать с другими активными веществами, так чтобы активные ингредиенты могли иметь синергичные эффекты.
[296] Признаки, упомянутые в отношении применения, композиции и способа лечения по настоящему изобретению можно соответствующим образом комбинировать, если они не противоречат друг другу.
Преимущественные эффекты
[297] Соединения формулы I, их стереоизомеры или их фармацевтически приемлемые соли могут селективно ингибировать HDAC6, и, таким образом, демонстрируют превосходные эффекты в отношении предупреждения или лечения заболеваний, ассоциированных с активностью деацетилазы гистонов 6.
Способ осуществления изобретения
[298] Далее, настоящее изобретение описано более подробно с помощью примеров, примеров получения и примеров испытания. Однако будет понятно, что эти примеры предназначены только для иллюстративных целей и не предназначены для ограничения объема настоящего изобретения.
[299]
[300] Получение соединений-производных 1,3,4-оксадиазолсульфонамида
[301] Конкретные примеры получения соединений формулы I являются следующими.
[302]
[303] Пример 1. Соединение 11044: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиридин-2-илметил)метансульфонамид
[304] [Стадия 1] N-(пиридин-2-илметил)метансульфонамид
[305] 
[306] Раствор пиридин-2-илметанамина (1,000 г, 9,247 ммоль), пиридина (0,821 мл, 10,172 ммоль) и метансульфонилхлорида (0,865 мл, 11,097 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Преципитат собирали фильтрацией, промывали дихлорметаном и сушили с получением N-(пиридин-2-илметил)метансульфонамида в виде коричневого твердого вещества (1,050 г, 61,0%).
[307] [Стадия 2] Метил 3-фтор-4-((N-(пиридин-2-илметил)метилсульфонамидо)метил)бензоат
[308] 
[309] Раствор N-(пиридин-2-илметил)метансульфонамида (0,300 г, 1,611 ммоль), NaH (60,00%, 0,077 г, 1,933 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,438 г, 1,772 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(пиридин-2-илметил)метилсульфонамидо)метил)бензоата в виде белого твердого вещества (0,290 г, 51,1%).
[310] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-2-илметил)метансульфонамид
[311] 
[312] Смесь метил 3-фтор-4-((N-(пиридин-2-илметил)метилсульфонамидо)метил)бензоата (0,400 г, 1,135 ммоль) и гидрата гидразина (0,568 г, 11,351 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-2-илметил)метансульфонамид, 0,370 г, 92,5%, желтое твердое вещество).
[313] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-2-илметил)метансульфонамид
[314] 
[315] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-2-илметил)метансульфонамида (0,370 г, 1,050 ммоль), трифторуксусного ангидрида (TFAA, 0,131 мл, 0,945 ммоль) и триэтиламина (TEA, 0,220 мл, 1,575 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-2-илметил)метансульфонамида в виде желтого твердого вещества (0,350 г, 74,3%).
[316] [Стадия 5] Соединение 11044
[317] 
[318]
[319] Раствор N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-2-илметил)метансульфонамида (0,350 г, 0,781 ммоль) и реагента Бургесса (1-метокси-N-триэтиламмониосульфонилметилимидат, 0,279 г, 1,171 ммоль) в тетрагидрофуране (10 мл) перемешивали при 150°C в течение 30 мин и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиридин-2-илметил)метансульфонамида в виде желтого твердого вещества (0,095 г, 28,3%).
[320] 1H-ЯМР (400 МГц, CDCl3) δ 8,62-8,55 (м, 1H), 7,90 (дд, 1H, J=8,1, 1,7 Гц), 7,81-7,72 (м, 2H), 7,72-7,66 (м, 1H), 7,34-7,21 (м, 3H), 4,65 (с, 2H), 4,57 (с, 2H), 3,07 (с, 3H); LRMS (ES) m/z 431,1 (M++1).
[321] Пример 2. Соединение 11045: N-(пиридин-2-илметил)-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[322] [Стадия 1] метил 4-((N-(пиридин-2-илметил)метилсульфонамидо)метил)бензоат
[323] 
[324] Раствор N-(пиридин-2-илметил)метансульфонамида (0,300 г, 1,611 ммоль), NaH (60,00%, 0,077 г, 1,933 ммоль) и метил 4-(бромметил)бензоата (0,406 г, 1,772 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 4-((N-(пиридин-2-илметил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,270 г, 50,1%).
[325] [Стадия 2] N-(4-(гидразинкарбонил)бензил)-N-(пиридин-2-илметил)метансульфонамид
[326] 
[327] Смесь метил 4-((N-(пиридин-2-илметил)метилсульфонамидо)метил)бензоата (0,420 г, 1,256 ммоль) и гидрата гидразина (0,629 г, 12,560 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(гидразинкарбонил)бензил)-N-(пиридин-2-илметил)метансульфонамид, 0,330 г, 78,6%, желтое твердое вещество).
[328] [Стадия 3] N-(пиридин-2-илметил)-N-(4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамид
[329] 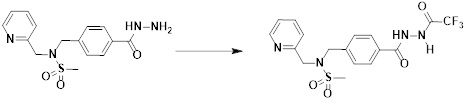
[330] Раствор N-(4-(гидразинкарбонил)бензил)-N-(пиридин-2-илметил)метансульфонамида (0,332 г, 0,993 ммоль), TFAA (0,124 мл, 0,894 ммоль) и TEA (0,208 мл, 1,489 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением N-(пиридин-2-илметил)-N-(4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамида в виде желтого твердого вещества (0,330 г, 77,2%).
[331] [Стадия 4] Соединение 11045
[332] 
[333] Смесь N-(пиридин-2-илметил)-N-(4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамида (0,330 г, 0,767 ммоль) и реагента Бургесса (0,274 г, 1,150 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-(пиридин-2-илметил)-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,100 г, 31,6%).
[334] 1H-ЯМР (400 МГц, CDCl3) δ 8,62-8,56 (м, 1H), 8,10-8,03 (м, 2H), 7,76-7,67 (м, 1H), 7,60-7,53 (м, 2H), 7,34-7,25 (м, 2H), 4,58 (с, 4H), 3,04 (с, 3H); LRMS (ES) m/z 413,1 (M++1).
[335] Пример 3: Соединение 11078, 4-метокси-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)бензолсульфонамид
[336] [Стадия 1] трет-бутил (4-(гидразинкарбонил)бензил)карбамат:
[337] 
[338] Смесь метил 4-(((трет-бутоксикарбонил)амино)метил)бензоата (10,000 г, 37,692 ммоль) и моногидрата гидразина (9,661 г, 301,534 ммоль) в этаноле (20 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 20 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Преципитат собирали фильтрацией, промывали водой и сушили с получением трет-бутил (4-(гидразинкарбонил)бензил)карбамата в виде белого твердого вещества (9,800 г, 98,0%).
[339] [Стадия 2] трет-бутил (4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)карбамат
[340] 
[341] TEA (3,396 мл, 24,500 ммоль) добавляли к раствору трет-бутил (4-(гидразинкарбонил)бензил)карбамата (5,000 г, 18,846 ммоль) в дихлорметане (20 мл) при 0°C, и смесь перемешивали при той же температуре. Реакционную смесь обрабатывали TFAA (2,760 мл, 20,730 ммоль) и перемешивали в течение дополнительных 3 ч при комнатной температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (трет-бутил (4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)карбамат, 6,000 г, 88,1%, белое твердое вещество).
[342] [Стадия 3] трет-бутил (4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)карбамат
[343] 
[344] Смесь трет-бутил 4-(2-(2,2,2-трифторацетил)гидразинкарбонил)бензилкарбамата (6,990 г, 19,346 ммоль) и реагента Бургесса (7,438 г, 29,019 ммоль) в тетрагидрофуране (25 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 80g; этилацетат/гексан=от 0% до 20%) с получением трет-бутил 4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензилкарбамата в виде белого твердого вещества (4,500 г, 67,8%).
[345] [Стадия 4] гидрохлорид (4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)фенил)метанамина
[346] 
[347] Раствор трет-бутил (4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)карбамата (3,760 г, 10,953 ммоль) в дихлорметане (20 мл) смешивали с HCl (4,00 M раствор, 3,012 мл, 12,048 ммоль) при комнатной температуре. Реакционную смесь перемешивали при той же температуре в течение 8 ч. Преципитат собирали фильтрацией, промывали дихлорметаном и сушили с получением гидрохлорида (4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)фенил)метанамина в виде белого твердого вещества (2,800 г, 91,4%).
[348] [Стадия 5] Соединение 11078:
[349] 
[350] Раствор гидрохлорида (4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)фенил)метанамина (0,050 г, 0,179 ммоль), 4-метоксибензол-1-сульфонилхлорида (0,041 г, 0,197 ммоль) и пиридина (0,017 г, 0,215 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 20 мин. Затем к реакционной смеси добавляли 1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 10%) с получением 4-метокси-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)бензолсульфонамида в виде белого твердого вещества (0,065 г, 87,9%).
[351] 1H-ЯМР (400 МГц, DMSO-d6) δ 8,20 (с, 1H), 8,06-8,01 (м, 2H), 7,81-7,72 (м, 2H), 7,58-7,53 (м, 2H), 7,17-7,09 (м, 2H), 4,11 (с, 2H), 3,86 (д, 3H, J=0,9 Гц); LRMS (ES) m/z 414,0 (M++1).
[352] Пример 4. Соединение 11088: N-(пиридин-3-ил)-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[353] [Стадия 1] N-(пиридин-3-ил)метансульфонамид
[354] 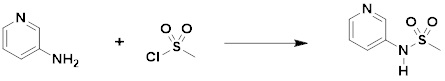
[355] Раствор пиридин-3-амина (3,000 г, 31,874 ммоль), пиридина (2,830 мл, 35,062 ммоль) и метансульфонилхлорида (4,381 г, 38,249 ммоль) в дихлорметане (80 мл) перемешивали при комнатной температуре в течение 12 ч. Преципитат собирали фильтрацией, промывали дихлорметаном и сушили с получением N-(пиридин-3-ил)метансульфонамида в виде желтого твердого вещества (3,200 г, 58,3%).
[356] [Стадия 2] метил 4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоат
[357] 
[358] Раствор N-(пиридин-3-ил)метансульфонамида (0,400 г, 2,323 ммоль), NaH (60,00%, 0,111 г, 2,787 ммоль) и метил 4-(бромметил)бензоата (0,585 г, 2,555 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,210 г, 28,2%).
[359] [Стадия 3] N-(4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамид
[360] 
[361] Раствор метил 4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата (0,210 г, 0,656 ммоль) и гидрата гидразина (0,328 г, 6,555 ммоль) в этаноле (10 мл) перемешивали при 120°C в течение 1 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамид, 0,150 г, 71,4%, желтое твердое вещество).
[362] [Стадия 4] N-(пиридин-3-ил)-N-(4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамид
[363] 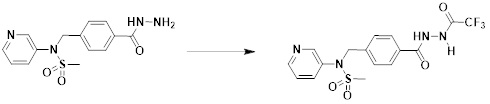
[364] Раствор N-(4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамида (0,150 г, 0,468 ммоль), трифторуксусного ангидрида (0,059 мл, 0,421 ммоль) и триэтиламина (0,098 мл, 0,702 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-(пиридин-3-ил)-N-(4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамида в виде желтого масла (0,110 г, 56,4%).
[365] [Стадия 5] Соединение 11088
[366] 
[367] Смесь N-(пиридин-3-ил)-N-(4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамида (0,110 г, 0,264 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,094 г, 0,396 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-(пиридин-3-ил)-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,073 г, 69,4%).
[368] 1H-ЯМР (400 МГц, CDCl3) δ 9,07 (с, 1H), 8,59 (с, 1H), 8,08 (д, 2H, J=8,3 Гц), 7,97 (д, 1H, J=8,5 Гц), 7,55 (д, 3H, J=8,1 Гц), 5,15 (с, 2H), 3,15 (с, 3H); LRMS (ES) m/z 399,19 (M++1).
[369] Пример 5. Соединение 11089: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиридин-3-ил)метансульфонамид
[370] [Стадия 1] метил 3-фтор-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоат
[371] 
[372] Раствор N-(пиридин-3-ил)метансульфонамида (0,400 г, 2,323 ммоль), NaH (60,00%, 0,111 г, 2,787 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,631 г, 2,555 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-фтор-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата в виде белого твердого вещества (0,250 г, 31,8%).
[373] [Стадия 2] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамид
[374] 
[375] Смесь метил 3-фтор-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата (0,250 г, 0,739 ммоль) и гидрата гидразина (0,370 г, 7,389 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамид, 0,200 г, 80,0%, желтое твердое вещество).
[376] [Стадия 3] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-3-ил)метансульфонамид
[377] 
[378] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамида (0,200 г, 0,591 ммоль), трифторуксусного ангидрида (0,074 мл, 0,532 ммоль) и триэтиламина (0,124 мл, 0,887 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-3-ил)метансульфонамида в виде желтого масла (0,130 г, 50,6%).
[379] [Стадия 4] Соединение 11089
[380] 
[381] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-3-ил)метансульфонамида (0,130 г, 0,299 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,107 г, 0,449 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиридин-3-ил)метансульфонамида в виде желтого твердого вещества (0,091 г, 73,0%).
[382] 1H-ЯМР (400 МГц, CDCl3) δ 8,70 (с, 1H), 8,58 (д, 1H, J=4,7 Гц), 7,91 (дд, 1H, J=8,0, 1,5 Гц), 7,81-7,73 (м, 2H), 7,69 (т, 1H, J=7,6 Гц), 7,40 (дд, 1H, J=8,3, 4,8 Гц), 5,09 (с, 2H), 3,09 (с, 3H); LRMS (ES) m/z 416,9 (M++1).
[383] Пример 6. Соединение 11120: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(пиридин-3-ил)метансульфонамид
[384] [Стадия 1] метил 3-фтор-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоат
[385] 
[386] Раствор N-(пиридин-3-ил)метансульфонамида (0,800 г, 4,646 ммоль), гидрида натрия (60,00%, 0,223 г, 5,575 ммоль) и метил 4-(бромметил)-3-фторбензоата (1,263 г, 5,110 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,740 г, 47,1%).
[387] [Стадия 2] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамид
[388] 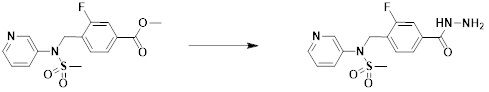
[389] Смесь метил 3-фтор-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата (0,740 г, 2,187 ммоль) и гидрата гидразина (1,095 г, 21,871 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамид, 0,610 г, 82,4%, желтое твердое вещество).
[390] [Стадия 3] Соединение 11120
[391] 
[392] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамида (0,080 г, 0,236 ммоль), дифторуксусного ангидрида (0,031 мл, 0,284 ммоль) и триэтиламина (0,066 мл, 0,473 ммоль) в дихлорметане (1 мл) перемешивали при комнатной температуре в течение 1 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(пиридин-3-ил)метансульфонамида в виде белого твердого вещества (0,041 г, 43,5%).
[393] 1H-ЯМР (400 МГц, CDCl3) δ 8,92 (с, 1H), 8,65-8,59 (м, 1H), 8,02-7,95 (м, 1H), 7,92 (дд, 1H, J=8,0, 1,7 Гц), 7,78 (дд, 1H, J=10,0, 1,7 Гц), 7,67 (т, 1H, J=7,6 Гц), 7,59 (дд, 1H, J=8,4, 5,1 Гц), 7,06 (с, 0,2 H), 6,93 (с, 0,4H), 6,80 (с, 0,2H), 5,13 (с, 2H), 3,13 (с, 3H); LRMS (ES) m/z 399,1 (M++1).
[394] Пример 7. Соединение 11121: N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[395] 
[396] К раствору гидрохлорида (4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)фенил)метанамина (0,050 г, 0,179 ммоль) в дихлорметане (2 мл) добавляли триэтиламин (0,032 мл, 0,232 ммоль) при комнатной температуре и смесь перемешивали при той же температуре в течение 10 мин. Реакционную смесь обрабатывали метансульфонилхлоридом (0,015 мл, 0,197 ммоль) и перемешивали в течение дополнительных 5 ч при той же температуре. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,055 г, 95,7%).
[397] 1H-ЯМР (400 МГц, DMSO-d6) δ 8,17-8,07 (м, 2H), 7,77 (с, 1H), 7,66 (д, 2H, J=8,2 Гц), 4,32 (д, 2H, J=3,6 Гц), 2,96 (с, 3H); LRMS (ES) m/z 320,19 (M+-1).
[398] Пример 8. Соединение 11128: N-(пиридин-2-илметил)-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамид
[399] [Стадия 1] метил 6-((N-(пиридин-2-илметил)метилсульфонамидо)метил)никотинат
[400] 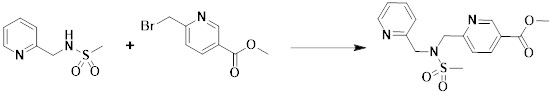
[401] Раствор N-(пиридин-2-илметил)метансульфонамида (0,300 г, 1,611 ммоль), гидрида натрия (60,00%, 0,077 г, 1,933 ммоль) и метил 6-(бромметил)никотината (0,408 г, 1,772 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением метил 6-((N-(пиридин-2-илметил)метилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,290 г, 53,7%).
[402] [Стадия 2] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(пиридин-2-илметил)метансульфонамид
[403] 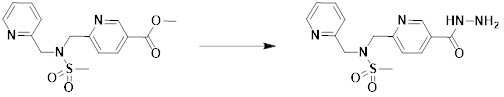
[404] Смесь метил 6-((N-(пиридин-2-илметил)метилсульфонамидо)метил)никотината (0,290 г, 0,865 ммоль) и гидрата гидразина (0,433 г, 8,647 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(пиридин-2-илметил)метансульфонамид, 0,110 г, 37,9%, белое твердое вещество).
[405] [Стадия 3] N-(пиридин-2-илметил)-N-((5-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)метансульфонамид
[406] 
[407] Раствор N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(пиридин-2-илметил)метансульфонамида (0,110 г, 0,328 ммоль), трифторуксусного ангидрида (0,041 мл, 0,295 ммоль) и триэтиламина (0,069 мл, 0,492 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-(пиридин-2-илметил)-N-((5-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)метансульфонамида в виде желтого масла (0,091 г, 64,3%).
[408] [Стадия 4] Соединение 11128
[409] 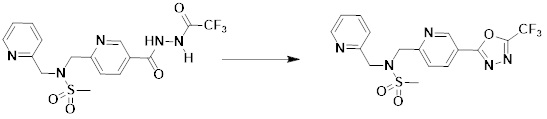
[410] Смесь N-(пиридин-2-илметил)-N-((5-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)метансульфонамида (0,091 г, 0,211 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,075 г, 0,316 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(пиридин-2-илметил)-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамида в виде белого твердого вещества (0,021 г, 24,1%).
[411] 1H-ЯМР (400 МГц, CDCl3) δ 9,27 (дд, 1H, J=2,2, 0,9 Гц), 8,61-8,54 (м, 1H), 8,43-8,35 (м, 1H), 7,76 (т, 1H, J=7,8 Гц), 7,67 (дд, 1H, J=8,2, 0,8 Гц), 7,46 (д, 1H, J=7,9 Гц), 7,29 (с, 1H), 4,73 (с, 2H), 4,67 (с, 2H), 3,16 (с, 3H); LRMS (ES) m/z 414,3 (M++1).
[412] Пример 9. Соединение 11129: N-(2-метокси-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиридин-3-ил)метансульфонамид
[413] [Стадия 1] метил 3-метокси-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоат
[414] 
[415] Раствор N-(пиридин-3-ил)метансульфонамида (0,500 г, 2,904 ммоль), гидрида натрия (60,00%, 0,139 г, 3,484 ммоль) и метил 4-(бромметил)-3-метоксибензоата (0,828 г, 3,194 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-метокси-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,117 г, 11,5%).
[416] [Стадия 2] N-(4-(гидразинкарбонил)-2-метоксибензил)-N-(пиридин-3-ил)метансульфонамид
[417] 
[418] Смесь метил 3-метокси-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата (0,117 г, 0,334 ммоль) и гидрата гидразина (0,167 г, 3,339 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(гидразинкарбонил)-2-метоксибензил)-N-(пиридин-3-ил)метансульфонамид, 0,100 г, 85,5%, желтое масло).
[419] [Стадия 3] N-(2-метокси-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-3-ил)метансульфонамид
[420] 
[421] Раствор N-(4-(гидразинкарбонил)-2-метоксибензил)-N-(пиридин-3-ил)метансульфонамида (0,100 г, 0,285 ммоль), трифторуксусного ангидрида (0,036 мл, 0,257 ммоль) и триэтиламина (0,059 мл, 0,428 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-(2-метокси-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-3-ил)метансульфонамида в виде желтого масла (0,090 г, 70,6%).
[422] [Стадия 4] Соединение 11129
[423] 
[424] Смесь N-(2-метокси-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-3-ил)метансульфонамида (0,090 г, 0,202 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,072 г, 0,302 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения, охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-(2-метокси-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиридин-3-ил)метансульфонамида в виде белого твердого вещества (0,036 г, 41,7%).
[425] 1H-ЯМР (400 МГц, CDCl3) δ 8,76 (с, 1H), 8,56 (д, 1H, J=5,1 Гц), 8,01 (д, 1H, J=8,5 Гц), 7,67 (дд, 1H, J=7,9, 1,6 Гц), 7,61-7,52 (м, 3H), 5,08 (с, 2H), 3,90 (с, 3H), 3,09 (с, 3H); LRMS (ES) m/z 429,3 (M++1).
[426] Пример 10. Соединение 11133: N-(3-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиридин-3-ил)метансульфонамид
[427] [Стадия 1] метил 2-фтор-4-((пиридин-3-иламино)метил)бензоат
[428] 
[429] К раствору пиридин-3-амина (0,700 г, 7,437 ммоль) в дихлорметане (20 мл) добавляли метил 2-фтор-4-формилбензоат (1,490 г, 8,181 ммоль) и AcOH (0,501 мл, 8,181 ммоль) при комнатной температуре и смесь перемешивали при той же температуре в течение 1 ч. Реакционную смесь обрабатывали Na(OAc)3BH (3,153 г, 14,875 ммоль), и перемешивали в течение дополнительных 12 ч при той же температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 2-фтор-4-((пиридин-3-иламино)метил)бензоата в виде желтого масла (0,500 г, 25,8%).
[430] [Стадия 2] метил 2-фтор-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоат
[431] 
[432] Раствор метил 2-фтор-4-((пиридин-3-иламино)метил)бензоата (0,500 г, 1,921 ммоль), пиридина (0,171 мл, 2,113 ммоль) и метансульфонилхлорида (0,180 мл, 2,305 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 2-фтор-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,160 г, 24,6%).
[433] [Стадия 3] N-(3-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамид
[434] 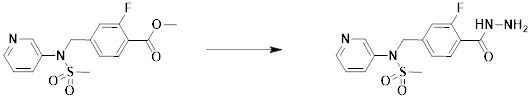
[435] Смесь метил 2-фтор-4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата (0,160 г, 0,473 ммоль) и гидрата гидразина (0,237 г, 4,729 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамид, 0,109 г, 68,1%, желтое масло).
[436] [Стадия 4] N-(3-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-3-ил)метансульфонамид
[437] 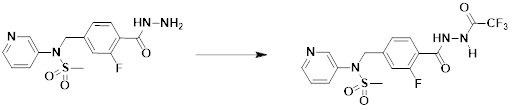
[438] Раствор N-(3-фтор-4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамида (0,109 г, 0,322 ммоль), трифторуксусного ангидрида (0,040 мл, 0,290 ммоль) и триэтиламина (0,067 мл, 0,483 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 60%) с получением N-(3-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-3-ил)метансульфонамида в виде желтого масла (0,071 г, 50,7%).
[439] [Стадия 5] Соединение 11133
[440] 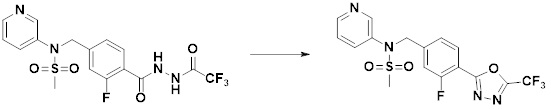
[441] Смесь N-(3-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиридин-3-ил)метансульфонамида (0,071 г, 0,163 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,058 г, 0,245 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(3-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиридин-3-ил)метансульфонамида в виде желтого масла (0,031 г, 45,6%).
[442] 1H-ЯМР (400 МГц, CDCl3) δ 9,24 (с, 1H), 8,60 (д, 1H, J=5,1 Гц), 8,13-8,02 (м, 2H), 7,67-7,54 (м, 1H), 7,37 (д, 2H, J=9,3 Гц), 5,19 (с, 2H), 3,16 (с, 3H); LRMS (ES) m/z 417,1 (M++1).
[443] Пример 11. Соединение 11151: N-фенил-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)пиридин-3-сульфонамид
[444] [Стадия 1] N-фенилпиридин-4-сульфонамид
[445] 
[446] Раствор анилина (0,200 г, 2,147 ммоль) и пиридина (0,260 мл, 3,221 ммоль) в дихлорметане (6 мл) смешивали с гидрохлоридом пиридин-4-сульфонилхлорида (0,483 г, 2,255 ммоль) при комнатной температуре, и реакционную смесь перемешивали при той же температуре в течение 10 ч. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-фенилпиридин-4-сульфонамида в виде желтого твердого вещества (0,250 г, 49,7%).
[447] [Стадия 2] метил 4-((N-фенилпиридин-3-сульфонамидо)метил)бензоат
[448] 
[449] К раствору N-фенилпиридин-3-сульфонамида (0,400 г, 1,707 ммоль) в N,N-диметилформамиде (8 мл) добавляли гидрид натрия (60,00%, 0,082 г, 2,049 ммоль) при 0°C, и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали метил 4-(бромметил)бензоатом (0,430 г, 1,878 ммоль) и перемешивали в течение дополнительных 8 ч при комнатной температуре. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 4-((N-фенилпиридин-3-сульфонамидо)метил)бензоата в виде белого твердого вещества (0,380 г, 58,2%).
[450] [Стадия 3] N-(4-(гидразинкарбонил)бензил)-N-фенилпиридин-3-сульфонамид
[451] 
[452] Смесь метил 4-((N-фенилпиридин-3-сульфонамидо)метил)бензоата (0,330 г, 0,863 ммоль) и гидрата гидразина (0,138 г, 4,315 ммоль) в этаноле (6 мл) нагревали при температуре кипения с обратным холодильником в течение 16 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении. Преципитат собирали фильтрацией, промывали водой, и сушили с получением N-(4-(гидразинкарбонил)бензил)-N-фенилпиридин-3-сульфонамида в виде белого твердого вещества (0,320 г, 97,0%).
[453] [Стадия 4] Соединение 11151
[454] 
[455] К раствору N-(4-(гидразинкарбонил)бензил)-N-фенилпиридин-3-сульфонамида (0,160 г, 0,418 ммоль) в тетрагидрофуране (8 мл) добавляли триэтиламин (0,075 мл, 0,544 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали трифторуксусного ангидрида (0,061 мл, 0,460 ммоль), нагревали при температуре кипения с обратным холодильником в течение 14 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением N-фенил-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)пиридин-3-сульфонамида в виде белого твердого вещества (0,150 г, 77,9%).
[456] 1H-ЯМР (400 МГц, DMSO-d6) δ 8,95 (дд, 1H, J=4,9, 1,6 Гц), 8,84 (дд, 1H, J=2,4, 0,8 Гц), 8,10 (ддд, 1H, J=8,1, 2,4, 1,6 Гц), 8,06-7,99 (м, 2H), 7,73 (ддд, 1H, J=8,1, 4,9, 0,8 Гц), 7,66-7,54 (м, 2H), 7,38-7,24 (м, 3H), 7,21-7,12 (м, 2H), 5,04 (с, 2H); LRMS (ES) m/z 462,0 (M++1).
[457] Пример 12. Соединение 11152: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенилпиридин-3-сульфонамид
[458] 
[459] К раствору N-(4-(гидразинкарбонил)бензил)-N-фенилпиридин-3-сульфонамида (0,160 г, 0,418 ммоль) в тетрагидрофуране (8 мл) добавляли триэтиламин (0,075 мл, 0,544 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,050 мл, 0,460 ммоль), нагревали при температуре кипения с обратным холодильником в течение 14 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенилпиридин-3-сульфонамида в виде белого твердого вещества (0,140 г, 75,6%).
[460] 1H-ЯМР (400 МГц, DMSO-d6) δ 8,95 (дд, 1H, J=4,9, 1,6 Гц), 8,84 (дд, 1H, J=2,3, 0,8 Гц), 8,09 (ддд, 1H, J=8,1, 2,4, 1,6 Гц), 8,06-7,96 (м, 2H), 7,78-7,66 (м, 1H), 7,64-7,53 (м, 3H), 7,43 (с, 0H), 7,38-7,26 (м, 3H), 7,21-7,12 (м, 2H), 5,03 (с, 2H); LRMS (ES) m/z 444,0 (M++1).
[461] Пример 13. Соединение 11153: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенилэтансульфонамид
[462] [Стадия 1] метил 3-фтор-4-((N-фенилэтилсульфонамидо)метил)бензоат
[463] 
[464] Раствор этансульфонилхлорида (0,219 мл, 2,314 ммоль), N,N-диметилпиридин-4-амина (DMAP, 0,071 г, 0,579 ммоль) и пиридина (0,233 мл, 2,893 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 30 мин, а затем смешивали с метил 3-фтор-4-((фениламино)метил)бензоатом (0,500 г, 1,928 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 5 ч, охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 25%) с получением метил 3-фтор-4-((N-фенилэтилсульфонамидо)метил)бензоата в виде белого твердого вещества (0,450 г, 66,4%).
[465] [Стадия 2] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилэтансульфонамид
[466] 
[467] Смесь метил 3-фтор-4-((N-фенилэтилсульфонамидо)метил)бензоата (0,450 г, 1,281 ммоль) и гидрата гидразина (0,205 г, 6,403 ммоль) в этаноле (8 мл) нагревали при температуре кипения с обратным холодильником в течение 16 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Преципитат собирали фильтрацией, промывали водой, и сушили с получением N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилэтансульфонамида в виде белого твердого вещества (0,420 г, 93,3%).
[468] [Стадия 3] Соединение 11153
[469] 
[470] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилэтансульфонамида (0,080 г, 0,228 ммоль) и триэтиламина (0,041 мл, 0,296 ммоль) в тетрагидрофуране (2 мл) перемешивали при комнатной температуре в течение 10 мин, а затем смешивали с трифторуксусным ангидридом (0,033 мл, 0,250 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 6 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенилэтансульфонамида в виде белого твердого вещества (0,075 г, 76,7%).
[471] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,91 (дд, 1H, J=8,0, 1,7 Гц), 7,84 (дд, 1H, J=10,1, 1,7 Гц), 7,71 (т, 1H, J=7,7 Гц), 7,51-7,43 (м, 2H), 7,44-7,30 (м, 3H), 5,11 (с, 2H), 3,31 (кв, 2H, J=7,3 Гц), 1,33 (т, 3H, J=7,3 Гц); LRMS (ES) m/z 430,0 (M++1).
[472] Пример 14. Соединение 11154: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилэтансульфонамид
[473] 
[474] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилэтансульфонамида (0,080 г, 0,228 ммоль) и триэтиламина (0,041 мл, 0,296 ммоль) в тетрагидрофуране (2 мл) перемешивали при комнатной температуре в течение 10 мин, а затем смешивали с 2,2-дифторуксусным ангидридом (0,030 мл, 0,273 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 3 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилэтансульфонамида в виде белого твердого вещества (0,065 г, 69,4%).
[475] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,88 (дд, 1H, J=8,0, 1,7 Гц), 7,80 (дд, 1H, J=10,2, 1,7 Гц), 7,75-7,67 (м, 1H), 7,58-7,40 (м, 3H), 7,39 (дд, 2H, J=8,5, 6,9 Гц), 7,34-7,27 (м, 1H), 5,10 (с, 2H), 3,30 (кв, 2H, J=7,4 Гц), 1,33 (т, 3H, J=7,3 Гц); LRMS (ES) m/z 412,3 (M++1).
[476] Пример 15. Соединение 11155: N-(3-фторфенил)-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)пиридин-3-сульфонамид
[477] [Стадия 1] N-(3-фторфенил)-N-(4-(гидразинкарбонил)бензил)пиридин-3-сульфонамид
[478] 
[479] Смесь метил 4-((N-(3-фторфенил)пиридин-3-сульфонамидо)метил)бензоата (0,300 г, 0,749 ммоль) и гидрата гидразина (0,120 г, 3,746 ммоль) в этаноле (6 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 16 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали при температуре окружающей среды. Полученный преципитат собирали фильтрацией, промывали водой, и сушили с получением N-(3-фторфенил)-N-(4-(гидразинкарбонил)бензил)пиридин-3-сульфонамида в виде белого твердого вещества (0,290 г, 96,7%).
[480] [Стадия 2] Соединение 11155
[481] 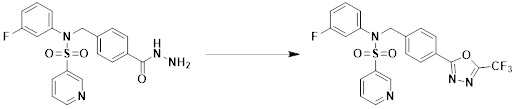
[482] Раствор N-(3-фторфенил)-N-(4-(гидразинкарбонил)бензил)пиридин-3-сульфонамида (0,100 г, 0,250 ммоль) и триэтиламина (0,045 мл, 0,325 ммоль) в тетрагидрофуране (2 мл) перемешивали при комнатной температуре в течение 10 мин, а затем смешивали с трифторуксусным ангидридом (0,037 мл, 0,275 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 3 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(3-фторфенил)-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)пиридин-3-сульфонамида в виде белого твердого вещества (0,060 г, 50,2%).
[483] 1H-ЯМР (400 МГц, DMSO-d6) δ 8,97 (дд, 1H, J=4,9, 1,6 Гц), 8,87 (дд, 1H, J=2,4, 0,8 Гц), 8,11 (ддд, 1H, J=8,1, 2,4, 1,6 Гц), 8,05-7,95 (м, 2H), 7,74 (ддд, 1H, J=8,1, 4,9, 0,8 Гц), 7,69 (с, 0,2H), 7,62-7,57 (м, 2H), 7,56 (с, 0,5H), 7,43 (с, 0,2H), 7,37 (дд, 1H, J=8,2, 6,6 Гц), 7,21-7,11 (м, 2H), 7,07 (ддд, 1H, J=8,1, 2,0, 1,0 Гц), 5,04 (с, 2H); LRMS (ES) m/z 477,2 (M+-1).
[484] Пример 16. Соединение 11156: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(3-фторфенил)пиридин-3-сульфонамид
[485] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)бензил)-N-(3-фторфенил)пиридин-3-сульфонамид
[486] 
[487] Раствор N-(3-фторфенил)-N-(4-(гидразинкарбонил)бензил)пиридин-3-сульфонамида (0,100 г, 0,250 ммоль) и триэтиламина (0,045 мл, 0,325 ммоль) в тетрагидрофуране (2 мл) перемешивали при комнатной температуре в течение 10 мин, а затем смешивали с 2,2-дифторуксусным ангидридом (0,033 мл, 0,300 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 3 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)бензил)-N-(3-фторфенил)пиридин-3-сульфонамида в виде белого твердого вещества (0,080 г, 67,0%).
[488] [Стадия 2] Соединение 11156
[489] 
[490] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)бензил)-N-(3-фторфенил)пиридин-3-сульфонамида (0,080 г, 0,167 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,035 г, 0,201 ммоль) в тетрагидрофуране (2 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(3-фторфенил)пиридин-3-сульфонамида в виде белого твердого вещества (0,055 г, 71,4%).
[491] 1H-ЯМР (400 МГц, DMSO-d6) δ 8,97 (дд, 1H, J=4,9, 1,5 Гц), 8,87 (д, 1H, J=2,3 Гц), 8,11 (ддд, 1H, J=8,1, 2,4, 1,6 Гц), 8,08-7,97 (м, 2H), 7,74 (ддд, 1H, J=8,0, 4,9, 0,8 Гц), 7,60 (д, 2H, J=8,2 Гц), 7,37 (тд, 1H, J=8,1, 6,6 Гц), 7,22-7,10 (м, 2H), 7,10-7,02 (м, 1H), 5,05 (с, 2H); LRMS (ES) m/z 462,0 (M++1).
[492] Пример 17. Соединение 11167: N-фенил-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[493] [Стадия 1] N-фенилметансульфонамид
[494] 
[495] Раствор анилина (3,000 г, 32,213 ммоль), пиридина (2,860 мл, 35,434 ммоль) и метансульфонилхлорида (3,012 мл, 38,656 ммоль) в дихлорметане (80 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-фенилметансульфонамид, 4,100 г, 74,3%, белое твердое вещество).
[496] [Стадия 2] метил 4-((N-фенилметилсульфонамидо)метил)бензоат
[497] 
[498] Раствор N-фенилметансульфонамида (0,800 г, 4,673 ммоль), гидрида натрия (60,00%, 0,224 г, 5,607 ммоль) и метил 4-(бромметил)бензоата (1,177 г, 5,140 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 4-((N-фенилметилсульфонамидо)метил)бензоата в виде белого твердого вещества (0,700 г, 46,9%).
[499] [Стадия 3] N-(4-(гидразинкарбонил)бензил)-N-фенилметансульфонамид
[500] 
[501] Смесь метил 4-((N-фенилметилсульфонамидо)метил)бензоата (0,700 г, 2,192 ммоль) и гидрата гидразина (1,097 г, 21,917 ммоль) в дихлорметане (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(гидразинкарбонил)бензил)-N-фенилметансульфонамид, 0,430 г, 61,4%, желтое масло).
[502] [Стадия 4] Соединение 11167
[503] 
[504] Раствор N-(4-(гидразинкарбонил)бензил)-N-фенилметансульфонамида (0,200 г, 0,626 ммоль), трифторуксусного ангидрида (0,096 мл, 0,689 ммоль) и триэтиламина (0,175 мл, 1,252 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-фенил-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,140 г, 56,3%).
[505] 1H-ЯМР (400 МГц, CDCl3) δ 8,09-8,01 (м, 2H), 7,54-7,47 (м, 2H), 7,42-7,26 (м, 5H), 4,97 (с, 2H), 3,01 (с, 3H); LRMS (ES) m/z 398,1 (M++1).
[506] Пример 18. Соединение 11168: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенилметансульфонамид
[507] 
[508] Раствор N-(4-(гидразинкарбонил)бензил)-N-фенилметансульфонамида (0,200 г, 0,626 ммоль), дифторуксусного ангидрида (0,075 мл, 0,689 ммоль) и триэтиламина (0,131 мл, 0,939 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенилметансульфонамида в виде белого твердого вещества (0,110 г, 46,3%).
[509] 1H-ЯМР (400 МГц, CDCl3) δ 8,08-7,97 (м, 2H), 7,53-7,45 (м, 2H), 7,44-7,26 (м, 5H), 7,05 (с, 0,2H), 6,92 (с, 0,5H), 6,79 (с, 0,2H), 4,96 (с, 2H), 3,01 (с, 3H); LRMS (ES) m/z 380,0 (M++1).
[510] Пример 19. Соединение 11169: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенилметансульфонамид
[511] [Стадия 1] метил 3-фтор-4-((N-фенилметилсульфонамидо)метил)бензоат
[512] 
[513] Раствор N-фенилметансульфонамида (0,800 г, 4,673 ммоль), гидрида натрия (60,00%, 0,224 г, 5,607 ммоль) и метил 4-(бромметил)-3-фторбензоата (1,270 г, 5,140 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением метил 3-фтор-4-((N-фенилметилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,752 г, 47,7%).
[514] [Стадия 2] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилметансульфонамид
[515] 
[516] Смесь метил 3-фтор-4-((N-фенилметилсульфонамидо)метил)бензоата (0,752 г, 2,229 ммоль) и гидрата гидразина (1,116 г, 22,290 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилметансульфонамид, 0,700 г, 93,1%, желтое масло).
[517] [Стадия 3] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-фенилметансульфонамид
[518] 
[519] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилметансульфонамида (0,200 г, 0,593 ммоль), трифторуксусного ангидрида (0,091 мл, 0,652 ммоль) и триэтиламина (0,124 мл, 0,889 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-фенилметансульфонамид, 0,150 г, 58,4%, желтое масло).
[520] [Стадия 4] Соединение 11169
[521] 
[522] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-фенилметансульфонамида (0,150 г, 0,346 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,124 г, 0,519 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенилметансульфонамида в виде белого твердого вещества (0,091 г, 63,3%).
[523] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (дд, 1H, J=8,1, 1,7 Гц), 7,75 (дд, 1H, J=9,8, 1,6 Гц), 7,71 (т, 1H, J=7,6 Гц), 7,42-7,29 (м, 5H), 5,05 (с, 2H), 3,03 (с, 3H); LRMS (ES) m/z 416,3 (M++1).
[524] Пример 20. Соединение 11170: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилметансульфонамид
[525] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-фенилметансульфонамид
[526] 
[527] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилметансульфонамида (0,200 г, 0,593 ммоль), дифторуксусного ангидрида (0,071 мл, 0,652 ммоль) и триэтиламина (0,124 мл, 0,889 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-фенилметансульфонамид, 0,110 г, 44,7%, желтое масло).
[528] [Стадия 2] Соединение 11170
[529] 
[530] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-фенилметансульфонамида (0,110 г, 0,254 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,091 г, 0,381 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилметансульфонамида в виде белого твердого вещества (0,071 г, 70,4%).
[531] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (д, 1H, J=8,3 Гц), 7,75 (д, 1H, J=10,0 Гц), 7,68 (т, 1H, J=7,7 Гц), 7,42-7,29 (м, 5H), 7,05 (с, 0,2H), 6,92 (с, 0,5H), 6,79 (с, 0,2H), 5,04 (с, 2H), 3,03 (с, 3H); LRMS (ES) m/z 398,5 (M++1).
[532] Пример 21. Соединение 11171: N-фенил-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамид
[533] [Стадия 1] метил 6-((N-фенилметилсульфонамидо)метил)никотинат
[534] 
[535] Раствор N-фенилметансульфонамида (0,800 г, 4,673 ммоль), гидрида натрия (60,00%, 0,224 г, 5,607 ммоль) и метил 6-(бромметил)никотината (1,182 г, 5,140 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением метил 6-((N-фенилметилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,323 г, 21,6%).
[536] [Стадия 2] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилметансульфонамид
[537] 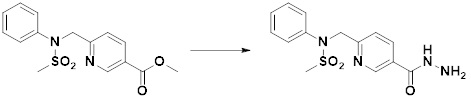
[538] Смесь метил 6-((N-фенилметилсульфонамидо)метил)никотината (0,323 г, 1,008 ммоль) и гидрата гидразина (0,505 г, 10,082 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилметансульфонамид, 0,300 г, 92,9%, желтое масло).
[539] [Стадия 3] N-фенил-N-((5-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)метансульфонамид
[540] 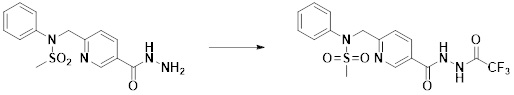
[541] Раствор N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилметансульфонамида (0,100 г, 0,312 ммоль), трифторуксусного ангидрида (0,048 мл, 0,343 ммоль) и триэтиламина (0,065 мл, 0,468 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили (безводный MgSO4), фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-фенил-N-((5-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)метансульфонамид, 0,083 г, 63,9%, желтое масло).
[542] [Стадия 4] Соединение 11171
[543] 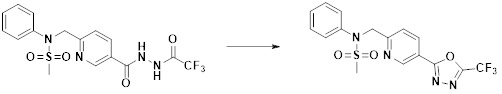
[544] Смесь N-фенил-N-((5-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)метансульфонамида (0,083 г, 0,199 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,071 г, 0,299 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 60%) с получением N-фенил-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамида в виде желтого твердого вещества (0,053 г, 66,7%).
[545] 1H-ЯМР (400 МГц, CDCl3) δ 9,25 (дд, 1H, J=2,3, 0,8 Гц), 8,40 (дд, 1H, J=8,3, 2,3 Гц), 7,76 (дд, 1H, J=8,2, 0,8 Гц), 7,46-7,34 (м, 4H), 7,35-7,29 (м, 1H), 5,18 (с, 2H), 3,08 (с, 3H); LRMS (ES) m/z 399,3 (M++1).
[546] Пример 22. Соединение 11172: N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилметансульфонамид
[547] [Стадия 1] N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-фенилметансульфонамид
[548] 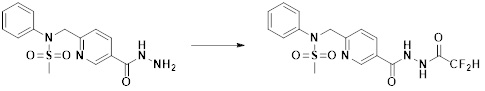
[549] Раствор N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилметансульфонамида (0,100 г, 0,312 ммоль), дифторуксусного ангидрида (0,037 мл, 0,343 ммоль) и триэтиламина (0,065 мл, 0,468 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-фенилметансульфонамид, 0,083 г, 66,7%, желтое масло).
[550] [Стадия 2] Соединение 11172
[551] 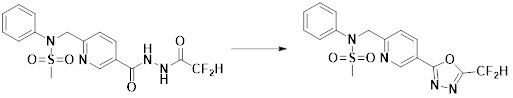
[552] Смесь N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-фенилметансульфонамида (0,083 г, 0,208 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,074 г, 0,313 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилметансульфонамида в виде желтого твердого вещества (0,043 г, 54,3%).
[553] 1H-ЯМР (400 МГц, CDCl3) δ 9,25 (дд, 1H, J=2,2, 0,9 Гц), 8,40 (дд, 1H, J=8,3, 2,2 Гц), 7,74 (дд, 1H, J=8,1, 0,8 Гц), 7,49-7,29 (м, 5H), 7,08 (с, 0,2H), 6,95 (с, 0,5H), 6,82 (с, 0,2H), 5,17 (с, 2H), 3,09 (с, 3H); LRMS (ES) m/z 381,2 (M++1).
[554] [Стадия 3] Соединение 11172, соль HCl
[555] 
[556] Раствор N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилметансульфонамида (0,026 г, 0,068 ммоль) и хлористоводородной кислоты (1,00 M раствор в EtOAc, 0,075 мл, 0,075 ммоль) в этилацетате (2 мл) перемешивали при комнатной температуре в течение 1 ч. Преципитат собирали фильтрацией, промывали этилацетатом и сушили с получением гидрохлорида N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилметансульфонамида в виде белого твердого вещества (0,028 г, 98,3%).
[557] Пример 23. Соединение 11173: N-фенил-N-((6-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-3-ил)метил)метансульфонамид
[558] [Стадия 1] метил 5-((фениламино)метил)пиколинат
[559] 
[560] У раствору анилина (0,500 г, 5,369 ммоль) в дихлорметане (20 мл) добавляли метил 5-формилпиколинат (0,975 г, 5,906 ммоль) и уксусную кислоту (0,338 мл, 5,906 ммоль) при комнатной температуре и смесь перемешивали при той же температуре в течение 30 мин. Реакционную смесь обрабатывали триацетоксиборгидридом натрия (2,276 г, 10,738 ммоль), перемешивали в течение дополнительных 12 ч при той же температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 5-((фениламино)метил)пиколината в виде желтого твердого вещества (0,672 г, 51,7%).
[561] [Стадия 2] метил 5-((N-фенилметилсульфонамидо)метил)пиколинат
[562] 
[563] Раствор метил 5-((фениламино)метил)пиколината (0,672 г, 2,774 ммоль), триэтиламина (0,773 мл, 5,547 ммоль) и метансульфонилхлорида (0,259 мл, 3,328 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 5-((N-фенилметилсульфонамидо)метил)пиколината в виде желтого масла (0,620 г, 69,8%).
[564] [Стадия 3] N-((6-(гидразинкарбонил)пиридин-3-ил)метил)-N-фенилметансульфонамид
[565] 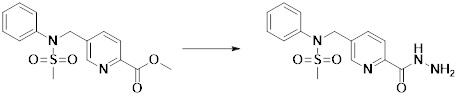
[566] Смесь метил 5-((N-фенилметилсульфонамидо)метил)пиколината (0,620 г, 1,935 ммоль) и гидрата гидразина (0,969 г, 19,353 ммоль) в дихлорметане (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((6-(гидразинкарбонил)пиридин-3-ил)метил)-N-фенилметансульфонамид, 0,590 г, 95,2%, желтое масло).
[567] [Стадия 4] Соединение 11173
[568] 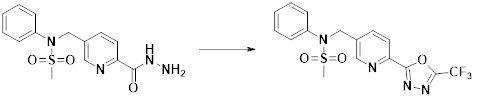
[569] Раствор N-((6-(гидразинкарбонил)пиридин-3-ил)метил)-N-фенилметансульфонамида (0,200 г, 0,624 ммоль), трифторуксусного ангидрида (0,096 мл, 0,687 ммоль) и триэтиламина (0,131 мл, 0,936 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-фенил-N-((6-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-3-ил)метил)метансульфонамида в виде желтого твердого вещества (0,100 г, 40,2%).
[570] 1H-ЯМР (400 МГц, CDCl3) δ 8,67-8,60 (м, 1H), 8,31-8,24 (м, 1H), 8,04-7,96 (м, 1H), 7,45-7,24 (м, 5H), 5,01 (с, 2H), 3,03 (с, 3H); LRMS (ES) m/z 399,0 (M++1).
[571] Пример 24. Соединение 11174: N-((6-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-3-ил)метил)-N-фенилметансульфонамид
[572] 
[573] Раствор N-((6-(гидразинкарбонил)пиридин-3-ил)метил)-N-фенилметансульфонамида (0,200 г, 0,624 ммоль), дифторуксусного ангидрида (0,075 мл, 0,687 ммоль) и триэтиламина (0,131 мл, 0,936 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-((6-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-3-ил)метил)-N-фенилметансульфонамида в виде желтого твердого вещества (0,110 г, 46,3%).
[574] 1H-ЯМР (400 МГц, CDCl3) δ 8,63 (дд, 1H, J=2,2, 0,8 Гц), 8,25 (д, 1H, J=8,1, 0,8 Гц), 8,02-7,95 (м, 1H), 7,41-7,29 (м, 5H), 7,07 (с, 0,2H), 6,94 (с, 0,5H), 6,81 (с, 0,2H), 5,01 (с, 2H), 3,03 (с, 3H); LRMS (ES) m/z 381,3 (M++1).
[575] Пример 25. Соединение 11175: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(3-(трифторметил)фенил)метансульфонамид
[576] [Стадия 1] N-(3-(трифторметил)фенил)метансульфонамид
[577] 
[578] Раствор 3-(трифторметил)анилина (1,000 г, 6,206 ммоль), пиридина (0,551 мл, 6,827 ммоль) и метансульфонилхлорида (0,580 мл, 7,447 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-(трифторметил)фенил)метансульфонамид, 1,050 г, 70,7%, желтое масло).
[579] [Стадия 2] метил 3-фтор-4-((N-(3-(трифторметил)фенил)метилсульфонамидо)метил)бензоат
[
[580] 
[581] Раствор N-(3-(трифторметил)фенил)метансульфонамида (0,500 г, 2,090 ммоль), гидрида натрия (60,00%, 0,100 г, 2,508 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,568 г, 2,299 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-фтор-4-((N-(3-(трифторметил)фенил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,600 г, 70,8%).
[582] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-(трифторметил)фенил)метансульфонамид
[583] 
[584] Смесь метил 3-фтор-4-((N-(3-(трифторметил)фенил)метилсульфонамидо)метил)бензоата (0,665 г, 1,641 ммоль) и гидрата гидразина (0,821 г, 16,405 ммоль) в дихлорметане (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-(трифторметил)фенил)метансульфонамид, 0,520 г, 78,2%, желтое масло).
[585] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(3-(трифторметил)фенил)метансульфонамид
[586] 
[587] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-(трифторметил)фенил)метансульфонамида (0,200 г, 0,493 ммоль), трифторуксусного ангидрида (0,075 мл, 0,543 ммоль) и триэтиламина (0,103 мл, 0,740 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(3-(трифторметил)фенил)метансульфонамид, 0,140 г, 56,6%, белое твердое вещество).
[588] [Стадия 5] Соединение 11175
[589] 
[590] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(3-(трифторметил)фенил)метансульфонамида (0,140 г, 0,279 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,100 г, 0,419 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(3-(трифторметил)фенил)метансульфонамида в виде желтого твердого вещества (0,094 г, 69,6%).
[591] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дт, 1H, J=8,1, 4,0 Гц), 7,81-7,72 (м, 1H), 7,68 (т, 1H, J=7,6 Гц), 7,63-7,56 (м, 2H), 7,56-7,45 (м, 2H), 5,07 (с, 2H), 3,06 (с, 3H); LRMS (ES) m/z 484,3 (M++1).
[592] Пример 26. Соединение 11176: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-(трифторметил)фенил)метансульфонамид
[593] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(3-(трифторметил)фенил)метансульфонамид
[594] 
[595] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-(трифторметил)фенил)метансульфонамида (0,200 г, 0,493 ммоль), дифторуксусного ангидрида (0,059 мл, 0,543 ммоль) и триэтиламина (0,103 мл, 0,740 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(3-(трифторметил)фенил)метансульфонамид, 0,130 г, 54,5%, белое твердое вещество).
[596] [Стадия 2] Соединение 11176
[597] 
[598] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(3-(трифторметил)фенил)метансульфонамида (0,130 г, 0,269 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,096 г, 0,403 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-(трифторметил)фенил)метансульфонамида в виде желтого твердого вещества (0,094 г, 75,1%).
[599] 1H-ЯМР (400 МГц, CDCl3) δ 7,90 (дд, 1H, J=8,0, 1,7 Гц), 7,76 (дд, 1H, J=9,9, 1,7 Гц), 7,66 (т, 1H, J=7,6 Гц), 7,61-7,55 (м, 2H), 7,55-7,45 (м, 2H), 7,05 (с, 0,2H), 6,92 (с, 0,4H), 6,79 (с, 0,2H), 5,06 (с, 2H), 3,05 (с, 3H); LRMS (ES) m/z 466,2 (M++1).
[600] Пример 27. Соединение 11177: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(m-толил)метансульфонамид
[601] [Стадия 1] N-(м-толил)метансульфонамид
[602] 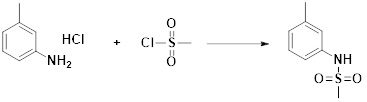
[603] Раствор гидрохлорида м-толуидина (1,000 г, 6,963 ммоль), пиридина (0,618 мл, 7,660 ммоль) и метансульфонилхлорида (0,651 мл, 8,356 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(м-толил)метансульфонамид, 1,100 г, 85,3%, белое твердое вещество).
[604] [Стадия 2] метил 3-фтор-4-((N-(м-толил)метилсульфонамидо)метил)бензоат
[605] 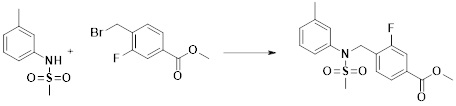
[606] Раствор N-(м-толил)метансульфонамида (0,500 г, 2,699 ммоль), гидрида натрия (60,00%, 0,130 г, 3,239 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,734 г, 2,969 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-фтор-4-((N-(м-толил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,630 г, 66,4%).
[607] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(м-толил)метансульфонамид
[608] 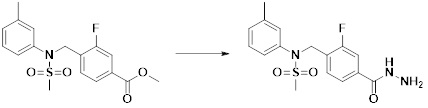
[609] Смесь метил 3-фтор-4-((N-(м-толил)метилсульфонамидо)метил)бензоата (0,630 г, 1,793 ммоль) и гидрата гидразина (0,898 г, 17,929 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(м-толил)метансульфонамид, 0,590 г, 93,7%, желтое масло).
[610] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(м-толил)метансульфонамид
[611] 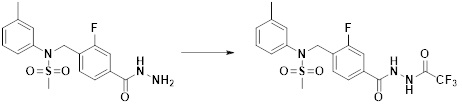
[612] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(м-толил)метансульфонамида (0,200 г, 0,569 ммоль), трифторуксусного ангидрида (0,087 мл, 0,626 ммоль) и триэтиламина (0,119 мл, 0,854 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(м-толил)метансульфонамид, 0,153 г, 60,1%, белое твердое вещество).
[613] [Стадия 5] Соединение 11177
[614] 
[615] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(м-толил)метансульфонамида (0,153 г, 0,342 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,122 г, 0,513 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(м-толил)метансульфонамида в виде желтого твердого вещества (0,100 г, 68,1%).
[616] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (дд, 1H, J=8,1, 1,7 Гц), 7,79-7,67 (м, 2H), 7,30-7,09 (м, 4H), 5,03 (с, 2H), 3,02 (с, 3H), 2,34 (с, 3H); LRMS (ES) m/z 430,0 (M++1).
[617] Пример 28. Соединение 11178: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(м-толил)метансульфонамид
[618] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(м-толил)метансульфонамид
[619] 
[620] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(м-толил)метансульфонамида (0,200 г, 0,569 ммоль), дифторуксусного ангидрида (0,068 мл, 0,626 ммоль) и триэтиламина (0,119 мл, 0,854 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(м-толил)метансульфонамид, 0,130 г, 53,2%, белое твердое вещество).
[621] [Стадия 2] Соединение 11178
[622] 
[623] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(м-толил)метансульфонамида (0,130 г, 0,303 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,108 г, 0,454 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(м-толил)метансульфонамида в виде желтого твердого вещества (0,091 г, 73,1%).
[624] 1H-ЯМР (400 МГц, CDCl3) δ 7,92-7,83 (м, 1H), 7,79-7,64 (м, 2H), 7,25 (дд, 1H, J=15,9, 8,2 Гц), 7,19-7,08 (м, 3H), 7,05 (с, 0,2H), 6,92 (с, 0,5H), 6,79 (с, 0,2H), 5,02 (с, 2H), 3,02 (с, 3H), 2,34 (с, 3H); LRMS (ES) m/z 412,0 (M++1).
[625] Пример 29. Соединение 11179: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(3-метоксифенил)метансульфонамид
[626] [Стадия 1] N-(3-метоксифенил)метансульфонамид
[627] 
[628] Раствор 3-метоксианилина (1,000 г, 8,120 ммоль), пиридина (0,721 мл, 8,931 ммоль) и метансульфонилхлорида (0,759 мл, 9,743 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-метоксифенил)метансульфонамид, 0,920 г, 52,6%, желтое масло).
[629] [Стадия 2] метил 3-фтор-4-((N-(3-метоксифенил)метилсульфонамидо)метил)бензоат
[630] 
[631] Раствор N-(3-метоксифенил)метансульфонамида (0,700 г, 3,252 ммоль), гидрида натрия (60,00%, 0,156 г, 3,902 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,884 г, 3,577 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-фтор-4-((N-(3-метоксифенил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,900 г, 75,3%).
[632] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-метоксифенил)метансульфонамид
[633] 
[634] Смесь метил 3-фтор-4-((N-(3-метоксифенил)метилсульфонамидо)метил)бензоата (0,973 г, 2,648 ммоль) и гидрата гидразина (1,326 г, 26,484 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-метоксифенил)метансульфонамид, 0,830 г, 85,3%, желтое масло).
[635] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)- N-(3-метоксифенил)метансульфонамид
[636] 
[637] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-метоксифенил)метансульфонамида (0,200 г, 0,544 ммоль), трифторуксусного ангидрида (0,083 мл, 0,599 ммоль) и триэтиламина (0,114 мл, 0,817 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)- N-(3-метоксифенил)метансульфонамид, 0,140 г, 55,5%, желтое твердое вещество).
[638] [Стадия 5] Соединение 11179
[639] 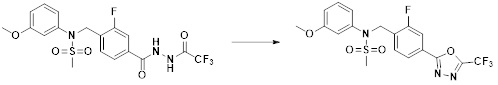
[640] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(3-метоксифенил)метансульфонамида (0,140 г, 0,302 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,108 г, 0,453 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения, охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(3-метоксифенил)метансульфонамида в виде белого твердого вещества (0,100 г, 74,3%).
[641] 1H-ЯМР (400 МГц, CDCl3) δ 7,90-7,82 (м, 1H), 7,79-7,65 (м, 2H), 7,31-7,20 (м, 1H), 6,96-6,80 (м, 3H), 5,03 (с, 2H), 3,77 (с, 3H), 3,02 (с, 3H); LRMS (ES) m/z 446,3 (M++1).
[642] Пример 30. Соединение 11180: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-метоксифенил)метансульфонамид
[643] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(3-метоксифенил)метансульфонамид
[644] 
[645] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-метоксифенил)метансульфонамида (0,200 г, 0,544 ммоль), дифторуксусного ангидрида (0,065 мл, 0,599 ммоль) и триэтиламина (0,114 мл, 0,817 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(3-метоксифенил)метансульфонамид, 0,160 г, 66,0%, белое твердое вещество).
[646] [Стадия 2] Соединение 11180
[647] 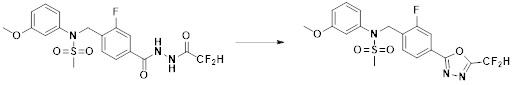
[648] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(3-метоксифенил)метансульфонамида (0,160 г, 0,359 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,128 г, 0,539 ммоль) в дихлорметане (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения, охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-метоксифенил)метансульфонамида в виде белого твердого вещества (0,120 г, 78,2%).
[649] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (дд, 1H, J=7,9, 1,7 Гц), 7,75 (дд, 1H, J=10,0, 1,7 Гц), 7,68 (т, 1H, J=7,6 Гц), 7,31-7,22 (м, 1H), 7,05 (с, 0,2H), 6,95-6,81 (м, 3H), 6,79 (с, 0,2H), 5,03 (с, 2H), 3,78 (д, 3H, J=0,6 Гц), 3,03 (д, 3H, J=0,5 Гц); LRMS (ES) m/z 428,1 (M++1).
[650] Пример 31. Соединение 11181: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(3-фторфенил)метансульфонамид
[651] [Стадия 1] N-(3-фторфенил)метансульфонамид
[652] 
[653] Раствор 3-фторанилина (0,800 г, 7,199 ммоль), пиридина (0,639 мл, 7,919 ммоль) и метансульфонилхлорида (0,673 мл, 8,639 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-фторфенил)метансульфонамид, 0,610 г, 44,8%, желтое масло).
[654] [Стадия 2] метил 3-фтор-4-((N-(3-фторфенил)метилсульфонамидо)метил)бензоат
[655] 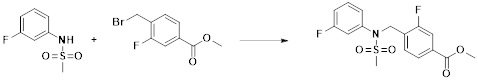
[656] Раствор N-(3-фторфенил)метансульфонамида (0,610 г, 3,224 ммоль), гидрида натрия (0,093 г, 3,869 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,876 г, 3,547 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (метил 3-фтор-4-((N-(3-фторфенил)метилсульфонамидо)метил)бензоат, 0,590 г, 51,5%, желтое масло).
[657] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)метансульфонамид
[658] 
[659] Смесь метил 3-фтор-4-((N-(3-фторфенил)метилсульфонамидо)метил)бензоата (0,590 г, 1,660 ммоль) и гидрата гидразина (0,831 г, 16,603 ммоль) в дихлорметане (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)метансульфонамид, 0,500 г, 84,7%, желтое масло).
[660] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(3-фторфенил)метансульфонамид
[661] 
[662] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)метансульфонамида (0,200 г, 0,563 ммоль), трифторуксусного ангидрида (0,086 мл, 0,619 ммоль) и триэтиламина (0,118 мл, 0,844 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(3-фторфенил)метансульфонамид, 0,150 г, 59,0%, желтое твердое вещество).
[663] [Стадия 5] Соединение 11181
[664] 
[665] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(3-фторфенил)метансульфонамида (0,150 г, 0,332 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,119 г, 0,498 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(3-фторфенил)метансульфонамида в виде белого твердого вещества (0,091 г, 63,2%).
[666] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,1, 1,7 Гц), 7,77 (дд, 1H, J=9,8, 1,6 Гц), 7,68 (т, 1H, J=7,6 Гц), 7,39-7,30 (м, 1H), 7,18-6,99 (м, 3H), 5,04 (с, 2H), 3,05 (с, 3H); LRMS (ES) m/z 434,1 (M++1).
[667] Пример 32. Соединение 11182: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-фторфенил)метансульфонамид
[668] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(3-фторфенил)метансульфонамид
[669] 
[670] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)метансульфонамида (0,200 г, 0,563 ммоль), дифторуксусного ангидрида (0,067 мл, 0,619 ммоль) и триэтиламина (0,118 мл, 0,844 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(3-фторфенил)метансульфонамид, 0,150 г, 61,5%, белое твердое вещество).
[671] [Стадия 2] Соединение 11182
[672] 
[673] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(3-фторфенил)метансульфонамида (0,150 г, 0,346 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,124 г, 0,519 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-фторфенил)метансульфонамида в виде белого твердого вещества (0,089 г, 61,9%).
[674] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,0, 1,7 Гц), 7,77 (дд, 1H, J=9,9, 1,7 Гц), 7,66 (т, 1H, J=7,6 Гц), 7,34 (тд, 1H, J=8,2, 6,3 Гц), 7,18-6,98 (м, 3H), 6,92 (с, 0,5H), 6,79 (с, 0,2H), 5,03 (с, 2H), 3,04 (с, 3H); LRMS (ES) m/z 416,3 (M++1).
[675] Пример 33. Соединение 11183: N-(3-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенилметансульфонамид
[676] [Стадия 1] метил 2-фтор-4-((фениламино)метил)бензоат
[677] 
[678] К раствору анилина (0,500 г, 5,369 ммоль) в дихлорметане (30 мл) добавляли метил 2-фтор-4-формилбензоат (1,076 г, 5,906 ммоль) и уксусную кислоту (0,338 мл, 5,906 ммоль) при комнатной температуре, и смесь перемешивали при той же температуре в течение 30 мин. Реакционную смесь обрабатывали триацетоксиборгидридом натрия (2,276 г, 10,738 ммоль), и перемешивали в течение дополнительных 12 ч при той же температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 2-фтор-4-((фениламино)метил)бензоата в виде бесцветного масла (1,000 г, 71,8%).
[679] [Стадия 2] метил 2-фтор-4-((N-фенилметилсульфонамидо)метил)бензоат
[680] 
[681] Раствор метил 2-фтор-4-((фениламино)метил)бензоата (0,540 г, 2,083 ммоль), триэтиламина (0,581 мл, 4,165 ммоль) и метансульфонилхлорида (0,195 мл, 2,499 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 35%) с получением метил 2-фтор-4-((N-фенилметилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,600 г, 85,4%).
[682] [Стадия 3] N-(3-фтор-4-(гидразинкарбонил)бензил)-N-фенилметансульфонамид
[683] 
[684] Смесь метил 2-фтор-4-((N-фенилметилсульфонамидо)метил)бензоата (0,600 г, 1,778 ммоль) и гидрата гидразина (0,890 г, 17,785 ммоль) в дихлорметане (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-фтор-4-(гидразинкарбонил)бензил)-N-фенилметансульфонамид, 0,520 г, 86,7%, желтое масло).
[685] [Стадия 4] N-(3-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-фенилметансульфонамид
[686] 
[687] Раствор N-(3-фтор-4-(гидразинкарбонил)бензил)-N-фенилметансульфонамида (0,200 г, 0,593 ммоль), трифторуксусного ангидрида (0,091 мл, 0,652 ммоль) и триэтиламина (0,124 мл, 0,889 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-фенилметансульфонамид, 0,120 г, 46,7%, белое твердое вещество).
[688] [Стадия 5] Соединение 11183
[689] 
[690] Смесь N-(3-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-фенилметансульфонамида (0,120 г, 0,277 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,099 г, 0,415 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(3-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенилметансульфонамида в виде белого твердого вещества (0,079 г, 68,7%).
[691] 1H-ЯМР (400 МГц, CDCl3) δ 8,05 (дд, 1H, J=8,2, 7,0 Гц), 7,46-7,25 (м, 7H), 4,96 (с, 2H), 3,02 (с, 3H); LRMS (ES) m/z 416,3 (M++1).
[692] Пример 34. Соединение 11184: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-3-фторбензил)-N-фенилметансульфонамид
[693] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-3-фторбензил)-N-фенилметансульфонамид
[694] 
[695] Раствор N-(3-фтор-4-(гидразинкарбонил)бензил)-N-фенилметансульфонамида (0,200 г, 0,593 ммоль), дифторуксусного ангидрида (0,071 мл, 0,652 ммоль) и триэтиламина (0,124 мл, 0,889 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-3-фторбензил)-N-фенилметансульфонамид, 0,130 г, 52,8%, белое твердое вещество).
[696] [Стадия 2] Соединение 11184
[697] 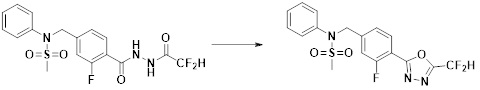
[698] Раствор N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-3-фторбензил)-N-фенилметансульфонамида (0,130 г, 0,313 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,112 г, 0,469 ммоль) в тетрагидрофуране (10 мл) перемешивали при 150°C в течение 30 мин и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-3-фторбензил)-N-фенилметансульфонамида в виде белого твердого вещества (0,096 г, 77,2%).
[699] 1H-ЯМР (400 МГц, CDCl3) δ 8,04 (дд, 1H, J=8,2, 7,0 Гц), 7,45-7,28 (м, 6H), 7,06 (с, 0H), 6,94 (с, 0H), 6,81 (с, 0H), 4,96 (с, 2H), 3,02 (с, 3H); LRMS (ES) m/z 398,3 (M++1).
[700] Пример 35. Соединение 11186: N,N-бис(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[701] [Стадия 1] диметил 4,4'-(азандиилбис(метилен))дибензоат
[702] 
[703] К раствору метил 4-(аминометил)бензоата (0,260 г, 1,574 ммоль) и метил 4-формилбензоата (0,284 г, 1,731 ммоль) в дихлорметане (10 мл) добавляли уксусную кислоту (0,099 мл, 1,731 ммоль) при комнатной температуре, и смесь перемешивали при той же температуре в течение 30 мин. Реакционную смесь обрабатывали триацетоксиборгидридом натрия (0,667 г, 3,148 ммоль), и перемешивали в течение дополнительных 12 ч при той же температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением диметил 4,4'-(азандиилбис(метилен))дибензоата в виде белого твердого вещества (0,248 г, 50,3%).
[704] [Стадия 2] диметил 4,4'-(((метилсульфонил)азандиил)бис(метилен))дибензоат
[705] 
[706] Раствор диметил 4,4'-(азандиилбис(метилен))дибензоата (0,248 г, 0,791 ммоль), триэтиламина (0,165 мл, 1,187 ммоль) и метансульфонилхлорида (0,074 мл, 0,950 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 20%) с получением диметил 4,4'-(((метилсульфонил)азандиил)бис(метилен))дибензоата в виде белого твердого вещества (0,250 г, 80,7%).
[707] [Стадия 3] N,N-бис(4-(гидразинкарбонил)бензил)метансульфонамид
[708] 
[709] Смесь диметил 4,4'-(((метилсульфонил)азандиил)бис(метилен))дибензоата (0,250 г, 0,639 ммоль) и гидрата гидразина (0,320 г, 6,387 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N,N-бис(4-(гидразинкарбонил)бензил)метансульфонамид, 0,210 г, 84,0%, белое твердое вещество).
[710] [Стадия 4] Соединение 11186
[711] 
[712] Раствор N,N-бис(4-(гидразинкарбонил)бензил)метансульфонамида (0,100 г, 0,255 ммоль), дифторуксусного ангидрида (0,033 мл, 0,307 ммоль) и триэтиламина (0,071 мл, 0,511 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N,N-бис(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,079 г, 60,5%).
[713] 1H-ЯМР (400 МГц, CDCl3) δ 8,10 (д, 4H, J=8,0 Гц), 7,48 (д, 4H, J=7,8 Гц), 7,07 (с, 0,3H), 6,94 (с, 0,8H), 6,81 (с, 0,4H), 4,49 (с, 4H), 2,96 (с, 3H); LRMS (ES) m/z 512,2 (M++1).
[714] Пример 36. Соединение 11190: N-(3-хлорфенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[715] [Стадия 1] N-(3-хлорфенил)метансульфонамид
[716] 
[717] Раствор 3-хлоранилина (0,500 г, 3,919 ммоль), пиридина (0,348 мл, 4,311 ммоль) и метансульфонилхлорида (0,366 мл, 4,703 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлорфенил)метансульфонамид, 0,700 г, 86,8%, желтое твердое вещество).
[718] [Стадия 2] метил 4-((N-(3-хлорфенил)метилсульфонамидо)метил)-3-фторбензоат
[719] 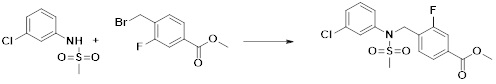
[720] Раствор N-(3-хлорфенил)метансульфонамида (0,700 г, 3,404 ммоль), гидрида натрия (60,00%, 0,163 г, 4,084 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,925 г, 3,744 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 4-((N-(3-хлорфенил)метилсульфонамидо)метил)-3-фторбензоата в виде желтого твердого вещества (0,640 г, 50,6%).
[721] [Стадия 3] N-(3-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид
[722] 
[723] Смесь метил 4-((N-(3-хлорфенил)метилсульфонамидо)метил)-3-фторбензоата (0,640 г, 1,721 ммоль) и гидрата гидразина (0,862 г, 17,213 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид, 0,570 г, 89,1%, белое твердое вещество).
[724] [Стадия 4] N-(3-хлорфенил)-N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамид
[725] 
[726] Раствор N-(3-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,250 г, 0,672 ммоль), трифторуксусного ангидрида (0,112 мл, 0,807 ммоль) и триэтиламина (0,187 мл, 1,345 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлорфенил)-N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамид, 0,170 г, 54,0%, желтое твердое вещество).
[727] [Стадия 5] Соединение 11190
[728] 
[729] Смесь N-(3-хлорфенил)-N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамида (0,170 г, 0,363 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,130 г, 0,545 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-(3-хлорфенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,110 г, 67,3%).
[730] 1H-ЯМР (400 МГц, CDCl3) δ 7,90 (дд, 1H, J=8,0, 1,7 Гц), 7,78 (дд, 1H, J=9,9, 1,7 Гц), 7,68 (т, 1H, J=7,6 Гц), 7,39-7,27 (м, 3H), 7,32-7,19 (м, 1H), 5,03 (с, 2H), 3,04 (с, 3H); LRMS (ES) m/z 450,2 (M++1).
[731] Пример 37. Соединение 11191: N-(3-хлорфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамид
[732] [Стадия 1] N-(3-хлорфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамид
[733] 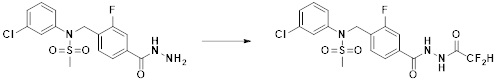
[734] Раствор N-(3-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,250 г, 0,672 ммоль), дифторуксусного ангидрида (0,088 мл, 0,807 ммоль) и триэтиламина (0,187 мл, 1,345 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлорфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамид, 0,180 г, 59,5%, желтое твердое вещество).
[735] [Стадия 2] Соединение 11191
[736] 
[737] Смесь N-(3-хлорфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамида (0,180 г, 0,400 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,143 г, 0,600 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(3-хлорфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамида в виде белого твердого вещества (0,120 г, 69,4%).
[738] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,0, 1,7 Гц), 7,76 (дд, 1H, J=10,0, 1,7 Гц), 7,65 (т, 1H, J=7,6 Гц), 7,39-7,18 (м, 4H), 7,05 (с, 0,2H), 6,93 (с, 0,5H), 6,80 (с, 0,2H), 5,02 (с, 2H), 3,04 (с, 3H); LRMS (ES) m/z 432,0 (M++1).
[739] Пример 38. Соединение 11192: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(4-метоксифенил)метансульфонамид
[740] [Стадия 1] N-(4-метоксифенил)метансульфонамид
[741] 
[742] Раствор 4-метоксианилина (0,600 г, 4,872 ммоль), пиридина (0,424 г, 5,359 ммоль) и метансульфонилхлорида (0,670 г, 5,846 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-метоксифенил)метансульфонамид, 0,840 г, 85,7%, желтое твердое вещество).
[743] [Стадия 2] метил 3-фтор-4-((N-(4-метоксифенил)метилсульфонамидо)метил)бензоат
[744] 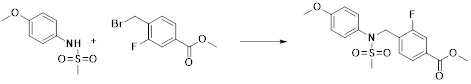
[745] Раствор N-(4-метоксифенил)метансульфонамида (1,000 г, 4,969 ммоль), гидрида натрия (60,00%, 0,239 г, 5,963 ммоль) и метил 4-(бромметил)-3-фторбензоата (1,350 г, 5,466 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(4-метоксифенил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,810 г, 44,4%).
[746] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-метоксифенил)метансульфонамид
[747] 
[748] Смесь метил 3-фтор-4-((N-(4-метоксифенил)метилсульфонамидо)метил)бензоата (0,810 г, 2,205 ммоль) и гидрата гидразина (1,104 г, 22,047 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-метоксифенил)метансульфонамид, 0,700 г, 86,4%, белое твердое вещество).
[749] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(4-метоксифенил)метансульфонамид
[750] 
[751] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-метоксифенил)метансульфонамида (0,350 г, 0,953 ммоль), трифторуксусного ангидрида (0,159 мл, 1,143 ммоль) и триэтиламина (0,264 мл, 1,905 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(4-метоксифенил)метансульфонамид, 0,250 г, 56,6%, желтое твердое вещество).
[752] [Стадия 5] Соединение 11192
[753] 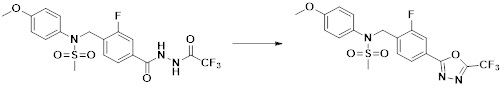
[754] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(4-метоксифенил)метансульфонамида (0,250 г, 0,539 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,193 г, 0,809 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(4-метоксифенил)метансульфонамида в виде желтого твердого вещества (0,190 г, 79,1%).
[755] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (дд, 1H, J=8,0, 1,8 Гц), 7,78-7,65 (м, 2H), 7,26-7,16 (м, 2H), 6,92-6,81 (м, 2H), 4,98 (с, 2H), 3,79 (с, 3H), 3,01 (с, 3H); LRMS (ES) m/z 446,2 (M++1).
[756] Пример 39. Соединение 11193: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(4-метоксифенил)метансульфонамид
[757] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-метоксифенил)метансульфонамид
[758] 
[759] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-метоксифенил)метансульфонамида (0,350 г, 0,953 ммоль), дифторуксусного ангидрида (0,124 мл, 1,143 ммоль) и триэтиламина (0,264 мл, 1,905 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-метоксифенил)метансульфонамид, 0,260 г, 61,3%, белое твердое вещество).
[760] [Стадия 2] Соединение 11193
[761] 
[762] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-метоксифенил)метансульфонамида (0,260 г, 0,584 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,209 г, 0,876 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(4-метоксифенил)метансульфонамида в виде желтого твердого вещества (0,180 г, 72,1%).
[763] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (дд, 1H, J=8,0, 1,7 Гц), 7,75 (дд, 1H, J=9,9, 1,7 Гц), 7,67 (дд, 1H, J=8,0, 7,3 Гц), 7,26-7,16 (м, 2H), 7,05 (с, 0,2H), 6,92 (с, 0,5H), 6,89-6,82 (м, 2H), 6,80 (с, 0,2H), 4,98 (с, 2H), 3,79 (с, 3H), 3,01 (с, 3H); LRMS (ES) m/z 428,3 (M++1).
[764]
[765] Пример 40. Соединение 11194: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиримидин-5-ил)метансульфонамид
[766] [Стадия 1] N-(пиримидин-5-ил)метансульфонамид
[767] 
[768] Раствор пиримидин-5-амина (0,500 г, 5,257 ммоль), пиридина (0,467 мл, 5,783 ммоль) и метансульфонилхлорида (0,492 мл, 6,308 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением N-(пиримидин-5-ил)метансульфонамида в виде желтого твердого вещества (0,610 г, 67,0%).
[769] [Стадия 2] метил 3-фтор-4-((N-(пиримидин-5-ил)метилсульфонамидо)метил)бензоат
[770] 
[771] Раствор N-(пиримидин-5-ил)метансульфонамида (0,610 г, 3,522 ммоль), гидрида натрия (60,00%, 0,169 г, 4,227 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,957 г, 3,874 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-фтор-4-((N-(пиримидин-5-ил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,590 г, 49,4%).
[772] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиримидин-5-ил)метансульфонамид
[773] 
[774] Смесь метил 3-фтор-4-((N-(пиримидин-5-ил)метилсульфонамидо)метил)бензоата (0,590 г, 1,739 ммоль) и гидрата гидразина (0,870 г, 17,387 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиримидин-5-ил)метансульфонамид, 0,520 г, 88,1%, белое твердое вещество).
[775] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиримидин-5-ил)метансульфонамид
[776] 
[777] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиримидин-5-ил)метансульфонамида (0,245 г, 0,722 ммоль), трифторуксусного ангидрида (0,121 мл, 0,866 ммоль) и триэтиламина (0,200 мл, 1,444 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиримидин-5-ил)метансульфонамид, 0,180 г, 57,3%, желтое твердое вещество).
[778] [Стадия 5] Соединение 11194
[779] 
[780] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(пиримидин-5-ил)метансульфонамида (0,180 г, 0,413 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,148 г, 0,620 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 60%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиримидин-5-ил)метансульфонамида в виде желтого твердого вещества (0,090 г, 52,2%).
[781] 1H-ЯМР (400 МГц, CDCl3) δ 9,14 (д, 1H, J=0,6 Гц), 8,73 (с, 2H), 7,94 (дд, 1H, J=8,1, 1,6 Гц), 7,81 (дд, 1H, J=9,8, 1,7 Гц), 7,68 (т, 1H, J=7,6 Гц), 5,07 (с, 2H), 3,10 (с, 3H); LRMS (ES) m/z 418,3 (M++1).
[782] Пример 41. Соединение 11195: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(пиримидин-5-ил)метансульфонамид
[783] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(пиримидин-5-ил)метансульфонамид
[784] 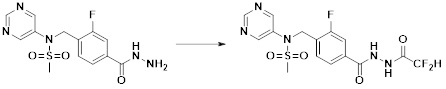
[785] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(пиримидин-5-ил)метансульфонамида (0,245 г, 0,722 ммоль), дифторуксусного ангидрида (0,094 мл, 0,866 ммоль) и триэтиламина (0,200 мл, 1,444 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(пиримидин-5-ил)метансульфонамид, 0,170 г, 52,3%, желтое твердое вещество).
[786] [Стадия 2] Соединение 11195
[787] 
[788] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(пиримидин-5-ил)метансульфонамида (0,170 г, 0,407 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,146 г, 0,611 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(пиримидин-5-ил)метансульфонамида в виде желтого твердого вещества (0,100 г, 61,5%).
[789] 1H-ЯМР (400 МГц, CDCl3) δ 9,12 (с, 1H), 8,70 (с, 2H), 7,91 (дд, 1H, J=8,1, 1,6 Гц), 7,78 (дд, 1H, J=10,0, 1,6 Гц), 7,64 (т, 1H, J=7,6 Гц), 7,04 (с, 0,04H), 6,91 (с, 0,06H), 6,78 (с, 0,2H), 5,04 (с, 2H), 3,08 (с, 3H); LRMS (ES) m/z 400,1 (M++1).
[790] Пример 42. Соединение 11196: N-(3-бромфенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[791] [Стадия 1] N-(3-бромфенил)метансульфонамид
[792] 
[793] Раствор 3-броманилина (1,000 г, 5,813 ммоль), пиридина (0,516 мл, 6,394 ммоль) и метансульфонилхлорида (0,799 г, 6,976 ммоль) в дихлорметане (50 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 30%) с получением N-(3-бромфенил)метансульфонамида в виде белого твердого вещества (1,100 г, 75,7%).
[794] [Стадия 2] метил 4-((N-(3-бромфенил)метилсульфонамидо)метил)-3-фторбензоат
[795] 
[796] Раствор N-(3-бромфенил)метансульфонамида (0,500 г, 1,999 ммоль), гидрида натрия (60,00%, 0,096 г, 2,399 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,543 г, 2,199 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 4-((N-(3-бромфенил)метилсульфонамидо)метил)-3-фторбензоата в виде желтого твердого вещества (0,490 г, 58,9%).
[797] [Стадия 3] N-(3-бромфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид
[798] 
[799] Смесь метил 4-((N-(3-бромфенил)метилсульфонамидо)метил)-3-фторбензоата (0,490 г, 1,177 ммоль) и гидрата гидразина (0,589 г, 11,771 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-бромфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид, 0,400 г, 81,6%, белое твердое вещество).
[800] [Стадия 4] Соединение 11196
[801] 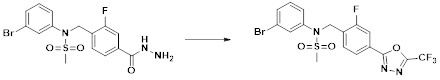
[802] Раствор N-(3-бромфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,200 г, 0,480 ммоль), трифторуксусного ангидрида (0,074 мл, 0,529 ммоль) и триэтиламина (0,100 мл, 0,721 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением N-(3-бромфенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,100 г, 42,1%).
[803] 1H-ЯМР (400 МГц, CDCl3) δ 7,90 (дд, 1H, J=8,1, 1,7 Гц), 7,77 (дд, 1H, J=9,8, 1,6 Гц), 7,68 (дд, 1H, J=8,1, 7,2 Гц), 7,52 (т, 1H, J=1,9 Гц), 7,48-7,44 (м, 1H), 7,29-7,22 (м, 2H), 5,03 (с, 2H), 3,04 (с, 3H); LRMS (ES) m/z 496,2 (M++1).
[804] Пример 43. Соединение 11197: N-(3-бромфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамид
[805] 
[806] Раствор N-(3-бромфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,200 г, 0,480 ммоль), дифторуксусного ангидрида (0,057 мл, 0,529 ммоль) и триэтиламина (0,100 мл, 0,721 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(3-бромфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамида в виде желтого твердого вещества (0,130 г, 56,8%).
[807] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,0, 1,6 Гц), 7,77 (дт, 1H, J=10,0, 1,3 Гц), 7,65 (т, 1H, J=7,6 Гц), 7,54-7,49 (м, 1H), 7,48-7,42 (м, 1H), 7,32-7,20 (м, 2H), 7,05 (с, 0,2H), 6,93 (с, 0,5H), 6,80 (с, 0,2H), 5,02 (с, 2H), 3,04 (с, 3H); LRMS (ES) m/z 478,2 (M++1).
[808] Пример 44. Соединение 11216: N-(3-фторфенил)-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамид
[809] [Стадия 1] метил 6-(((3-фторфенил)амино)метил)никотинат
[810] 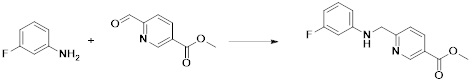
[811] К раствору 3-фторанилина (0,500 г, 4,500 ммоль) и метил 6-формилникотината (0,817 г, 4,950 ммоль) в дихлорметане (20 мл) добавляли уксусную кислоту (0,283 мл, 4,950 ммоль) при комнатной температуре, и смесь перемешивали при той же температуре в течение 30 мин. Реакционную смесь обрабатывали триацетоксиборгидридом натрия (1,907 г, 8,999 ммоль) и перемешивали в течение дополнительных 12 ч при той же температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-(((3-фторфенил)амино)метил)никотината в виде желтого масла (0,500 г, 42,7%).
[812] [Стадия 2] метил 6-((N-(3-фторфенил)метилсульфонамидо)метил)никотинат
[813] 
[814] Раствор метил 6-(((3-фторфенил)амино)метил)никотината (0,500 г, 1,921 ммоль), пиридина (0,186 мл, 2,305 ммоль), N,N-диметилпиридин-4-амина (DMAP, 0,012 г, 0,096 ммоль) и метансульфонилхлорида (0,180 мл, 2,305 ммоль) в дихлорметане (10 мл) перемешивали при 50°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((N-(3-фторфенил)метилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,380 г, 58,5%).
[815] [Стадия 3] N-(3-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид
[816] 
[817] Смесь метил 6-((N-(3-фторфенил)метилсульфонамидо)метил)никотината (0,380 г, 1,123 ммоль) и гидрата гидразина (0,562 г, 11,231 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид, 0,280 г, 73,7%, белое твердое вещество).
[818] [Стадия 4] Соединение 11216
[819] 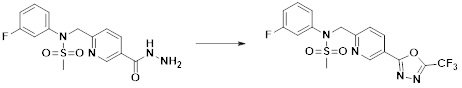
[820] Раствор N-(3-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида (0,090 г, 0,266 ммоль), трифторуксусного ангидрида (0,041 мл, 0,293 ммоль) и триэтиламина (0,055 мл, 0,399 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(3-фторфенил)-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамида в виде белого твердого вещества (0,043 г, 38,8%).
[821] 1H-ЯМР (400 МГц, CDCl3) δ 9,27 (дд, 1H, J=2,3, 0,8 Гц), 8,41 (дд, 1H, J=8,2, 2,2 Гц), 7,73-7,66 (м, 1H), 7,38-7,31 (м, 1H), 7,26-7,17 (м, 2H), 7,07-6,97 (м, 1H), 5,16 (с, 2H), 3,10 (с, 3H); LRMS (ES) m/z 417,3 (M++1).
[822] Пример 45. Соединение 11217: N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3-фторфенил)метансульфонамид
[823] 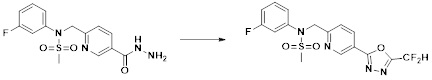
[824] Раствор N-(3-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида (0,090 г, 0,266 ммоль), дифторуксусного ангидрида (0,032 мл, 0,293 ммоль) и триэтиламина (0,055 мл, 0,399 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3-фторфенил)метансульфонамида в виде желтого твердого вещества (0,053 г, 50,0%).
[825] 1H-ЯМР (400 МГц, CDCl3) δ 9,27 (дд, 1H, J=2,3, 0,9 Гц), 8,40 (дд, 1H, J=8,2, 2,2 Гц), 7,68 (дд, 1H, J=8,3, 0,8 Гц), 7,38-7,30 (м, 1H), 7,27-7,16 (м, 2H), 7,08 (с, 0,2H), 7,05-6,98 (м, 1H), 6,95 (с, 0,5H), 6,82 (с, 0,2H), 5,15 (с, 2H), 3,10 (с, 3H); LRMS (ES) m/z 399,0 (M++1).
[826] Пример 46. Соединение 11218: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(2-(трифторметил)фенил)метансульфонамид
[827] [Стадия 1] N-(2-(трифторметил)фенил)метансульфонамид
[828] 
[829] Раствор 2-(трифторметил)анилина (1,000 г, 6,206 ммоль), пиридина (0,551 мл, 6,827 ммоль) и метансульфонилхлорида (0,580 мл, 7,447 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-(трифторметил)фенил)метансульфонамид, 1,100 г, 74,1%, желтое твердое вещество).
[830] [Стадия 2] метил 3-фтор-4-((N-(2-(трифторметил)фенил)метилсульфонамидо)метил)бензоат
[831] 
[832] Раствор N-(2-(трифторметил)фенил)метансульфонамида (0,500 г, 2,090 ммоль), гидрида натрия (60,00%, 0,100 г, 2,508 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,568 г, 2,299 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(2-(трифторметил)фенил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,610 г, 72,0%).
[833] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-(трифторметил)фенил)метансульфонамид
[834] 
[835] Смесь метил 3-фтор-4-((N-(2-(трифторметил)фенил)метилсульфонамидо)метил)бензоата (0,610 г, 1,505 ммоль) и гидрата гидразина (0,753 г, 15,048 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-(трифторметил)фенил)метансульфонамид, 0,530 г, 86,9%, желтое твердое вещество).
[836] [Стадия 4] Соединение 11218
[837] 
[838] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-(трифторметил)фенил)метансульфонамида (0,265 г, 0,654 ммоль), трифторуксусного ангидрида (0,100 мл, 0,719 ммоль) и триэтиламина (0,136 мл, 0,981 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(2-(трифторметил)фенил)метансульфонамида в виде белого твердого вещества (0,190 г, 60,1%).
[839] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,0, 1,7 Гц), 7,79-7,70 (м, 2H), 7,66-7,57 (м, 1H), 7,56-7,46 (м, 2H), 7,31-7,21 (м, 1H), 5,01 (дд, 1H, J=14,7, 1,5 Гц), 4,86 (д, 1H, J=14,7 Гц), 3,12 (с, 3H); LRMS (ES) m/z 484,2 (M++1).
[840] Пример 47. Соединение 11219: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(2-(трифторметил)фенил)метансульфонамид
[841] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(2-(трифторметил)фенил)метансульфонамид
[842] 
[843] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-(трифторметил)фенил)метансульфонамида (0,270 г, 0,666 ммоль), дифторуксусного ангидрида (0,087 мл, 0,799 ммоль) и TEA (0,185 мл, 1,332 ммоль) в (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(2-(трифторметил)фенил)метансульфонамид, 0,192 г, 59,6%, желтое твердое вещество).
[844] [Стадия 2] Соединение 11219
[845] 
[846] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(2-(трифторметил)фенил)метансульфонамида (0,192 г, 0,397 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,142 г, 0,596 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(2-(трифторметил)фенил)метансульфонамида в виде желтого твердого вещества (0,110 г, 59,5%).
[847] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,0, 1,7 Гц), 7,79-7,70 (м, 2H), 7,59 (т, 1H, J=7,6 Гц), 7,55-7,46 (м, 2H), 7,27-7,21 (м, 1H), 7,06 (с, 0,2H), 6,93 (с, 0,5H), 6,80 (с, 0,2H), 5,00 (дд, 1H, J=14,8, 1,4 Гц), 4,86 (д, 1H, J=14,6 Гц), 3,12 (с, 3H); LRMS (ES) m/z 466,2 (M++1).
[848] Пример 48. Соединение 11220: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(4-(трифторметил)фенил)метансульфонамид
[849] [Стадия 1] N-(4-(трифторметил)фенил)метансульфонамид
[850] 
[851] Раствор 4-(трифторметил)анилина (1,000 г, 6,206 ммоль), пиридина (0,551 мл, 6,827 ммоль) и метансульфонилхлорида (0,580 мл, 7,447 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(трифторметил)фенил)метансульфонамид, 1,200 г, 80,8%, желтое масло).
[852] [Стадия 2] метил 3-фтор-4-((N-(4-(трифторметил)фенил)метилсульфонамидо)метил)бензоат
[853] 
[854] Раствор N-(4-(трифторметил)фенил)метансульфонамида (0,500 г, 2,090 ммоль), гидрида натрия (60,00%, 0,100 г, 2,508 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,568 г, 2,299 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(4-(трифторметил)фенил)метилсульфонамидо)метил)бензоата в виде белого твердого вещества (0,630 г, 74,4%).
[855] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-(трифторметил)фенил)метансульфонамид
[856] 
[857] Раствор метил 3-фтор-4-((N-(4-(трифторметил)фенил)метилсульфонамидо)метил)бензоата (0,630 г, 1,554 ммоль) и гидрата гидразина (0,778 г, 15,542 ммоль) в этаноле (10 мл) перемешивали при 120°C в течение 1 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-(трифторметил)фенил)метансульфонамид, 0,600 г, 95,2%, желтое твердое вещество).
[858] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(4-(трифторметил)фенил)метансульфонамид
[859] 
[860] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-(трифторметил)фенил)метансульфонамида (0,240 г, 0,592 ммоль), трифторуксусного ангидрида (0,091 мл, 0,651 ммоль) и триэтиламина (0,123 мл, 0,888 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(4-(трифторметил)фенил)метансульфонамид, 0,180 г, 60,6%, желтое твердое вещество).
[861] [Стадия 5] Соединение 11220
[862] 
[863] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(4-(трифторметил)фенил)метансульфонамида (0,180 г, 0,359 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,128 г, 0,539 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(4-(трифторметил)фенил)метансульфонамида в виде желтого твердого вещества (0,130 г, 74,9%).
[864] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,1, 1,7 Гц), 7,78 (дд, 1H, J=9,8, 1,7 Гц), 7,72-7,60 (м, 3H), 7,52-7,45 (м, 2H), 5,09 (с, 2H), 3,05 (с, 3H); LRMS (ES) m/z 484,4 (M++1).
[865] Пример 49. Соединение 11221: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(4-(трифторметил)фенил)метансульфонамид
[866] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-(трифторметил)фенил)метансульфонамид
[867] 
[868] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-(трифторметил)фенил)метансульфонамида (0,240 г, 0,592 ммоль), дифторуксусного ангидрида (0,077 мл, 0,710 ммоль) и триэтиламина (0,123 мл, 0,888 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-(трифторметил)фенил)метансульфонамид, 0,140 г, 48,9%, желтое твердое вещество).
[869] [Стадия 2] Соединение 11221
[870] 
[871] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-(трифторметил)фенил)метансульфонамида (0,140 г, 0,365 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,131 г, 0,548 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(4-(трифторметил)фенил)метансульфонамида в виде желтого твердого вещества (0,092 г, 54,1%).
[872] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,1, 1,7 Гц), 7,77 (дд, 1H, J=10,0, 1,7 Гц), 7,70-7,60 (м, 3H), 7,52-7,44 (м, 2H), 7,05 (с, 0,2H), 6,92 (с, 0,5H), 6,79 (с, 0,2H), 5,08 (с, 2H), 3,05 (с, 3H); LRMS (ES) m/z 466,3 (M++1).
[873] Пример 50. Соединение 11222: N-бутил-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[874] 
[875] К раствору N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида (0,100 г, 0,311 ммоль) в N,N-диметилформамиде (2 мл) добавляли гидрид натрия (60,00%, 0,016 г, 0,405 ммоль) при 0°C, и смесь перемешивали в течение 30 мин. Реакционную смесь обрабатывали 1-йодбутаном (0,063 г, 0,342 ммоль) и перемешивали при той же температуре в течение 30 мин. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 25%) с получением неочищенного продукта, который повторно подвергали хроматографии (SiO2, кассета 4g; ацетонитрил/1% водный раствор муравьиной кислоты=от 5% до 50%) с получением N-бутил-N-(4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,035 г, 29,8%).
[876] 1H-ЯМР (400 МГц, CDCl3) δ 8,14-8,06 (м, 2H), 7,61-7,53 (м, 2H), 4,46 (с, 2H), 3,27-3,12 (м, 2H), 2,90 (с, 3H), 1,47 (ддт, 2H, J=9,3, 7,7, 3,4 Гц), 1,28-1,21 (м, 2H), 0,84 (т, 3H, J=7,3 Гц); LRMS (ES) m/z 378,3 (M++1).
[877] Пример 51: Соединение 11225: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-фторфенил)пиридин-3-сульфонамид
[878] [Стадия 1] N-(3-фторфенил)пиридин-3-сульфонамид
[879] 
[880] К раствору 3-фторанилина (1,000 г, 8,999 ммоль) в дихлорметане (14 мл) добавляли триэтиламин (1,622 мл, 11,699 ммоль) при комнатной температуре и смесь перемешивали при той же температуре в течение 10 мин. Реакционную смесь обрабатывали пиридин-3-сульфонилхлоридом (1,758 г, 9,899 ммоль) и перемешивали в течение дополнительных 24 ч при той же температуре. Преципитат собирали фильтрацией, промывали диэтиловым эфиром и сушили с получением N-(3-фторфенил)пиридин-3-сульфонамида в виде светло-желтого твердого вещества (1,900 г, 83,7%).
[881] [Стадия 2] метил 3-фтор-4-((N-(3-фторфенил)пиридин-3-сульфонамидо)метил)бензоат
[882] 
[883] К раствору N-(3-фторфенил)пиридин-3-сульфонамида (0,400 г, 1,586 ммоль) в N,N-диметилформамиде (6 мл) добавляли гидрид натрия (60,00%, 0,076 г, 1,903 ммоль) при 0°C и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали метил 4-(бромметил)-3-фторбензоатом (0,411 г, 1,665 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 1 Н водный раствор хлористоводородной кислоты, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(3-фторфенил)пиридин-3-сульфонамидо)метил)бензоата в виде белого твердого вещества (0,250 г, 37,7%).
[884] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)пиридин-3-сульфонамид
[885] 
[886] Смесь метил 3-фтор-4-((N-(3-фторфенил)пиридин-3-сульфонамидо)метил)бензоата (0,250 г, 0,598 ммоль) и гидрата гидразина (0,057 г, 1,793 ммоль) в этаноле (6 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 24 ч, и охлаждали до температуры окружающей среды. Реакционную смесь концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой, и сушили с получением N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)пиридин-3-сульфонамида в виде белого твердого вещества (0,220 г, 88,0%).
[887] [Стадия 4] Соединение 11225
[888] 
[889] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)пиридин-3-сульфонамида (0,040 г, 0,096 ммоль) и триэтиламина (0,017 мл, 0,124 ммоль) в тетрагидрофуране (2 мл) перемешивали при комнатной температуре в течение 10 мин, а затем смешивали с 2,2-дифторуксусным ангидридом (0,012 мл, 0,115 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 8 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-фторфенил)пиридин-3-сульфонамида в виде белого твердого вещества (0,035 г, 76,5%).
[890] 1H-ЯМР (400 МГц, DMSO-d6) δ 8,96 (дд, 1H, J=4,9, 1,6 Гц), 8,87 (дд, 1H, J=2,4, 0,8 Гц), 8,11 (ддд, 1H, J=8,1, 2,4, 1,6 Гц), 7,91-7,78 (м, 2H), 7,78-7,69 (м, 2H), 7,68 (с, 0,25H), 7,56 (с, 0,5H), 7,44 (с, 0,25H), 7,39 (тд, 1H, J=8,2, 6,6 Гц), 7,24-7,11 (м, 2H), 7,06 (ддд, 1H, J=8,0, 2,0, 0,9 Гц), 5,08 (с, 2H); LRMS (ES) m/z 480,1 (M++1).
[891] Пример 52. Соединение 11226: N-(бензо[d][1,3]диоксол-5-ил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[892] [Стадия 1] N-(бензо[d][1,3]диоксол-5-ил)метансульфонамид
[893] 
[894] К раствору бензо[d][1,3]диоксол-5-амина (1,000 г, 7,292 ммоль) в дихлорметане (14 мл) добавляли триэтиламин (1,314 мл, 9,479 ммоль) при комнатной температуре, и смесь перемешивали при той же температуре в течение 10 мин. Реакционную смесь обрабатывали метансульфонилхлоридом (0,621 мл, 8,021 ммоль), и перемешивали в течение дополнительных 24 ч при той же температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(бензо[d][1,3]диоксол-5-ил)метансульфонамид, 1,400 г, 89,2%, светло-желтое твердое вещество).
[895] [Стадия 2] метил 4-((N-(бензо[d][1,3]диоксол-5-ил)метилсульфонамидо)метил)-3-фторбензоат
[896] 
[897] К раствору N-(бензо[d][1,3]диоксол-5-ил)метансульфонамида (0,300 г, 1,394 ммоль) в N,N-диметилформамиде (4 мл) добавляли гидрид натрия (60,00%, 0,067 г, 1,673 ммоль) при 0°C, и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали метил 4-(бромметил)-3-фторбензоатом (0,362 г, 1,464 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением метил 4-((N-(бензо[d][1,3]диоксол-5-ил)метилсульфонамидо)метил)-3-фторбензоата в виде белого твердого вещества (0,210 г, 39,5%).
[898] [Стадия 3] N-(бензо[d][1,3]диоксол-5-ил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид
[899] 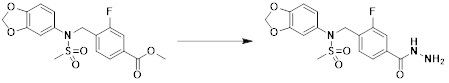
[900] Смесь метил 4-((N-(бензо[d][1,3]диоксол-5-ил)метилсульфонамидо)метил)-3-фторбензоата (0,210 г, 0,551 ммоль) и гидрата гидразина (0,053 г, 1,652 ммоль) в этаноле (6 мл), полученную при температуре окружающей среды нагревали при температуре кипения с обратным холодильником в течение 24 ч, охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой, и сушили с получением N-(бензо[d][1,3]диоксол-5-ил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида в виде белого твердого вещества (0,190 г, 90,5%).
[901] [Стадия 4] Соединение 11226
[902] 
[903] Раствор N-(бензо[d][1,3]диоксол-5-ил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,055 г, 0,144 ммоль) и триэтиламина (0,026 мл, 0,187 ммоль) в тетрагидрофуране (2 мл) перемешивали при комнатной температуре в течение 10 мин, а затем смешивали с трифторуксусным ангидридом (0,021 мл, 0,159 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 8 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(бензо[d][1,3]диоксол-5-ил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,040 г, 60,4%).
[904] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,98-7,80 (м, 2H), 7,72 (т, 1H, J=7,7 Гц), 6,99-6,86 (м, 2H), 6,06 (с, 2H), 4,99 (с, 2H), 3,15 (с, 3H); LRMS (ES) m/z 460,2 (M++1).
[905] Пример 53. Соединение 11227: N-(бензо[d][1,3]диоксол-5-ил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамид
[906] 
[907] Раствор N-(бензо[d][1,3]диоксол-5-ил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,055 г, 0,144 ммоль) и триэтиламина (0,026 мл, 0,187 ммоль) в тетрагидрофуране (2 мл) перемешивали при комнатной температуре в течение 10 мин, а затем смешивали с 2,2-дифторуксусным ангидридом (0,019 мл, 0,173 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 8 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(бензо[d][1,3]диоксол-5-ил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамида в виде белого твердого вещества (0,035 г, 55,0%).
[908] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,90 (дд, 1H, J=8,0, 1,7 Гц), 7,82 (дд, 1H, J=10,3, 1,6 Гц), 7,71 (т, 1H, J=6,8 Гц), 7,69 (с, 0,25H), 7,57 (д, 0,5H), 7,44 (с, 0,25H), 7,10 (с, 1H), 6,96-6,85 (м, 2H), 6,06 (с, 2H), 4,98 (с, 2H), 3,14 (д, 3H, J=0,7 Гц); LRMS (ES) m/z 442,2 (M++1).
[909] Пример 54: Соединение 11229: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилциклогексансульфонамид
[910] [Стадия 1] N-фенилциклогексансульфонамид
[911] 
[912] Смесь анилина (0,500 г, 5,369 ммоль) и пиридина (0,520 мл, 6,443 ммоль) в дихлорметане (10 мл) обрабатывали при комнатной температуре циклогексансульфонилхлоридом (1,079 г, 5,906 ммоль) и перемешивали при той же температуре в течение 5 мин. Реакционную смесь перемешивали при той же температуре в течение дополнительных 2 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 0,1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-фенилциклогексансульфонамид, 1,400 г, 109,0%, коричневое твердое вещество).
[913] [Стадия 2] Соединение 11229
[914] 
[915] Смесь 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазола (0,050 г, 0,154 ммоль) и N-фенилциклогексансульфонамида (0,040 г, 0,169 ммоль) в N,N-диметилформамиде (10 мл) обрабатывали при комнатной температуре NaH (60,00%, 0,007 г, 0,185 ммоль) и перемешивали при той же температуре в течение 5 мин. Реакционную смесь перемешивали при той же температуре в течение дополнительных 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 20%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилциклогексансульфонамида в виде белого твердого вещества (0,070 г, 97,8%).
[916] 1H-ЯМР (400 МГц, CDCl3) δ 7,88-7,86 (м, 1H), 7,74-7,69 (м, 2H), 7,35-7,27 (м, 5H), 6,91 (т, 1H, J=52,0 Гц), 5,08 (ушир. с, 2H), 3,05-3,00 (м, 1H), 2,23-2,14 (м, 2H), 1,92 (м, 2H), 1,72-1,66 (м, 4H), 1,28-1,24 (м, 2H); LRMS (ES) m/z 466,30 (M++1).
[917] Пример 55: Соединение 11230: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилбутан-2-сульфонамид
[918] [Стадия 1] N-фенилбутан-2-сульфонамид
[919] 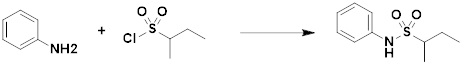
[920] Смесь анилина (0,078 мл, 0,859 ммоль) и пиридина (0,083 мл, 1,031 ммоль) в дихлорметане (10 мл) обрабатывали при комнатной температуре бутан-2-сульфонилхлоридом (0,148 г, 0,945 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 0,1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-фенилбутан-2-сульфонамида в виде желтого твердого вещества (0,160 г, 87,3%).
[921] [Стадия 2] Соединение 11230
[922] 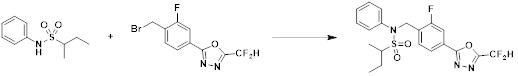
[923] Раствор 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазола (0,050 г, 0,154 ммоль) и N-фенилбутан-2-сульфонамида (0,036 г, 0,169 ммоль) в дихлорметане (10 мл) смешивали при комнатной температуре с гидридом натрия (60,00%, 0,007 г, 0,185 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 0,1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 20%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилбутан-2-сульфонамида в виде белого твердого вещества (0,045 г, 64,0%).
[924] 1H-ЯМР (400 МГц, CDCl3) δ 7,88-7,86 (м, 1H), 7,74-7,69 (м, 2H), 7,35-7,27 (м, 5H), 6,91 (т, 1H, J=52,0 Гц), 5,11- 5,08 (м, 2H), 3,09-3,04 (м, 1H), 2,13-2,07 (м, 1H), 1,74-1,64 (м, 1H), 1,44 (д, 3H, J=8,0 Гц), 1,03 (т, 3H, J=8,0 Гц); LRMS (ES) m/z m/z 440,23 (M++1).
[925] Пример 56: Соединение 11231: метил 2-(N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилсульфамоил)ацетат
[926] [Стадия 1] метил 2-(N-фенилсульфамоил)ацетат
[927] 
[928] Смесь анилина (0,147 мл, 1,611 ммоль) и пиридина (0,156 мл, 1,933 ммоль) в дихлорметане (10 мл) обрабатывали при комнатной температуре метил 2-(хлорсульфонил)ацетатом (0,306 г, 1,772 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 0,1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки. (метил 2-(N-фенилсульфамоил)ацетат, 0,300 г, 75,3%, коричневое твердое вещество).
[929] [Стадия 2] Соединение 11231
[930] 
[931] Раствор 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазола (0,050 г, 0,154 ммоль), метил 2-(N-фенилсульфамоил)ацетата (0,039 г, 0,169 ммоль) и гидрида натрия (60,00%, 0,007 г, 0,185 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 0,1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 20%) с получением метил 2-(N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилсульфамоил)ацетата в виде светло-желтого масла (0,035 г, 50,0%).
[932] 1H-ЯМР (400 МГц, CDCl3) δ 7,89-7,87 (м, 1H), 7,72-7,66 (м, 2H), 7,47-7,45 (м, 2H), 7,40-7,28 (м, 3H), 6,91 (т, 1H, J=52,0 Гц), 5,12 (с, 2H), 4,07 (с, 2H), 3,87 (с, 3H); LRMS (ES) m/z 454,27 (M+-1).
[933] Пример 57. Соединение 11248: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(o-толил)метансульфонамид
[934] [Стадия 1] N-(o-толил)метансульфонамид
[935] 
[936] Раствор o-толуидина (1,000 г, 9,332 ммоль), пиридина (0,829 мл, 10,265 ммоль) и метансульфонилхлорида (0,873 мл, 11,198 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(o-толил)метансульфонамид, 0,910 г, 52,6%, желтое твердое вещество).
[937] [Стадия 2] метил 3-фтор-4-((N-(o-толил)метилсульфонамидо)метил)бензоат
[938] 
[939] Раствор N-(o-толил)метансульфонамида (0,500 г, 2,699 ммоль), гидрида натрия (60,00%, 0,130 г, 3,239 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,734 г, 2,969 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(o-толил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,610 г, 64,3%).
[940] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(o-толил)метансульфонамид
[941] 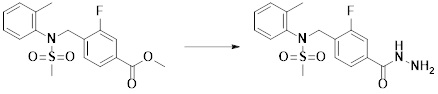
[942] Смесь метил 3-фтор-4-((N-(o-толил)метилсульфонамидо)метил)бензоата (0,610 г, 1,736 ммоль) и гидрата гидразина (0,869 г, 17,360 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(o-толил)метансульфонамид, 0,530 г, 86,9%, желтое твердое вещество).
[943] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(o-толил)метансульфонамид
[944] 
[945] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(o-толил)метансульфонамида (0,260 г, 0,740 ммоль), трифторуксусного ангидрида (0,113 мл, 0,814 ммоль) и триэтиламина (0,154 мл, 1,110 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(o-толил)метансульфонамид, 0,190 г, 57,4%, желтое твердое вещество).
[946] [Стадия 5] Соединение 11248
[947] 
[948] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(o-толил)метансульфонамида (0,190 г, 0,425 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,152 г, 0,637 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(o-толил)метансульфонамида в виде белого твердого вещества (0,100 г, 54,8%).
[949] 1H-ЯМР(400 МГц, CDCl3) δ 7,85 (дд, 1H, J=8,1, 2,0 Гц), 7,80-7,72 (м, 1H), 7,61-7,51 (м, 1H), 7,28-7,15 (м, 4H), 4,92 (с, 2H), 3,07 (с, 3H), 2,23 (с, 3H); LRMS (ES) m/z 430,3 (M++1).
[950] Пример 58. Соединение 11249: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(o-толил)метансульфонамид
[951] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(o-толил)метансульфонамид
[952] 
[953] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(o-толил)метансульфонамида (0,260 г, 0,740 ммоль), дифторуксусного ангидрида (0,097 мл, 0,888 ммоль) и триэтиламина (0,205 мл, 1,480 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(o-толил)метансульфонамид, 0,180 г, 56,7%, желтое твердое вещество).
[954] [Стадия 2] Соединение 11249
[955] 
[956] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(o-толил)метансульфонамида (0,180 г, 0,419 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,150 г, 0,629 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(o-толил)метансульфонамида в виде белого твердого вещества (0,110 г, 63,8%).
[957] 1H-ЯМР (400 МГц, CDCl3) δ 7,84 (дд, 1H, J=8,0, 1,7 Гц), 7,74 (дд, 1H, J=9,7, 1,7 Гц), 7,57-7,47 (м, 1H), 7,27-7,15 (м, 4H), 7,05 (с, 0,2H), 6,92 (с, 0,5H), 6,80 (с, 0,2H), 4,91 (с, 2H), 3,06 (с, 3H), 2,22 (с, 3H); LRMS (ES) m/z 412,3 (M++1).
[958] Пример 59. Соединение 11250: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(2-метоксифенил)метансульфонамид
[959] [Стадия 1] N-(2-метоксифенил)метансульфонамид
[960] 
[961] Раствор 2-метоксианилина (1,000 г, 8,120 ммоль), пиридина (0,721 мл, 8,931 ммоль) и метансульфонилхлорида (0,759 мл, 9,743 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-метоксифенил)метансульфонамид, 0,920 г, 56,3%, коричневое твердое вещество).
[962] [Стадия 2] метил 3-фтор-4-((N-(2-метоксифенил)метилсульфонамидо)метил)бензоат
[963] 
[964] Раствор N-(2-метоксифенил)метансульфонамида (0,500 г, 2,485 ммоль), гидрида натрия (60,00%, 0,119 г, 2,982 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,675 г, 2,733 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-фтор-4-((N-(2-метоксифенил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,630 г, 69,0%).
[965] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-метоксифенил)метансульфонамид
[966] 
[967] Раствор метил 3-фтор-4-((N-(2-метоксифенил)метилсульфонамидо)метил)бензоата (0,630 г, 1,715 ммоль) и гидрата гидразина (0,858 г, 17,148 ммоль) в этаноле (10 мл) перемешивали при 120°C в течение 1 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-метоксифенил)метансульфонамид, 0,520 г, 82,5%, желтое твердое вещество).
[968] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(2-метоксифенил)метансульфонамид
[969] 
[970] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-метоксифенил)метансульфонамида (0,260 г, 0,708 ммоль), трифторуксусного ангидрида (0,108 мл, 0,778 ммоль) и триэтиламина (0,147 мл, 1,062 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(2-метоксифенил)метансульфонамид, 0,210 г, 64,0%, желтое твердое вещество).
[971] [Стадия 5] Соединение 11250
[972] 
[973] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(2-метоксифенил)метансульфонамида (0,210 г, 0,453 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,162 г, 0,680 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(2-метоксифенил)метансульфонамида в виде белого твердого вещества (0,130 г, 64,4%).
[974] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,0, 1,8 Гц), 7,80-7,67 (м, 2H), 7,36-7,26 (м, 1H), 7,24-7,15 (м, 1H), 7,02-6,94 (м, 1H), 6,93-6,82 (м, 1H), 4,97 (с, 2H), 3,94 (д, 3H, J=0,9 Гц), 3,04 (д, 3H, J=1,0 Гц); LRMS (ES) m/z 446,0 (M++1).
[975] Пример 60. Соединение 11251: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(2-метоксифенил)метансульфонамид
[976] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(2-метоксифенил)метансульфонамид
[977] 
[978] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-метоксифенил)метансульфонамида (0,260 г, 0,708 ммоль), дифторуксусного ангидрида (0,092 мл, 0,849 ммоль) и триэтиламина (0,196 мл, 1,415 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(2-метоксифенил)метансульфонамид, 0,210 г, 66,6%, желтое твердое вещество).
[979] [Стадия 2] Соединение 11251
[980] 
[981] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(2-метоксифенил)метансульфонамида (0,210 г, 0,471 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,169 г, 0,707 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(2-метоксифенил)метансульфонамида в виде белого твердого вещества (0,126 г, 62,5%).
[982] 1H-ЯМР (400 МГц, CDCl3) δ 7,91-7,83 (м, 1H), 7,77-7,66 (м, 2H), 7,36-7,26 (м, 1H), 7,22-7,15 (м, 1H), 7,05 (с, 0,2H), 7,00-6,94 (м, 1H), 6,92 (с, 0,5H), 6,91-6,83 (м, 1H), 6,79 (с, 0,2H), 4,97 (с, 2H), 3,94 (с, 3H), 3,04 (с, 3H); LRMS (ES) m/z 428,1 (M++1).
[983] Пример 61. Соединение 11252: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилпиридин-3-сульфонамид
[984] [Стадия 1] N-фенилпиридин-3-сульфонамид
[985] 
[986] Раствор пиридин-3-сульфонилхлорид (2,002 г, 11,275 ммоль) и пиридина (1,274 г, 16,107 ммоль) в дихлорметане (14 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с анилином (1,000 г, 10,738 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-фенилпиридин-3-сульфонамид, 2,300 г, 91,4%, оранжевое твердое вещество).
[987] [Стадия 2] 3-фтор-4-метилбензогидразид
[988] 
[989] Смесь метил 3-фтор-4-метилбензоата (10,000 г, 59,464 ммоль) и гидрата гидразина (9,526 г, 297,318 ммоль) в этаноле (20 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 16 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Преципитат собирали фильтрацией, промывали водой, и сушили с получением 3-фтор-4-метилбензогидразида в виде белого твердого вещества (9,500 г, 95,0%).
[990] [Стадия 3] N'-(2,2-дифторацетил)-3-фтор-4-метилбензогидразид
[991] 
[992] Раствор 3-фтор-4-метилбензогидразида (4,000 г, 23,785 ммоль) и триэтиламина (4,286 мл, 30,921 ммоль) в тетрагидрофуране (12 мл) перемешивали при комнатной температуре в течение 10 мин, а затем смешивали с 2,2-дифторуксусным ангидридом (3,105 мл, 28,543 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 8 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 24g; этилацетат/гексан=от 0% до 30%) с получением N'-(2,2-дифторацетил)-3-фтор-4-метилбензогидразида в виде белого твердого вещества (4,900 г, 83,7%).
[993] [Стадия 4] 2-(дифторметил)-5-(3-фтор-4-метилфенил)-1,3,4-оксадиазол
[994] 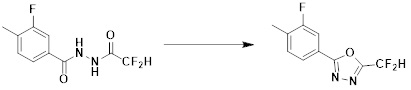
[995] Смесь N'-(2,2-дифторацетил)-3-фтор-4-метилбензогидразида (4,800 г, 19,497 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 3,563 г, 20,472 ммоль) в тетрагидрофуране (25 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 16 ч, и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 15%) с получением 2-(дифторметил)-5-(3-фтор-4-метилфенил)-1,3,4-оксадиазола в виде белого твердого вещества (2,830 г, 63,6%).
[996] [Стадия 5] 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазол
[997] 
[998] Смесь 2-(дифторметил)-5-(3-фтор-4-метилфенил)-1,3,4-оксадиазола (2,830 г, 12,403 ммоль), 1-бромпирролидин-2,5-диона (NBS, 2,317 г, 13,023 ммоль) и азобисизобутиронитрила (AIBN, 0,102 г, 0,620 ммоль) в дихлорметане (20 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 24 ч, и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 10%) с получением 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазола в виде белого твердого вещества (2,900 г, 76,1%).
[999] [Стадия 6] Соединение 11252
[1000] 
[1001] К раствору N-фенилпиридин-3-сульфонамида (0,035 г, 0,149 ммоль) в N,N-диметилформамиде (1 мл) добавляли гидрид натрия (60,00%, 0,007 г, 0,179 ммоль) при 0°C и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазолом (0,048 г, 0,157 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилпиридин-3-сульфонамида в виде белого твердого вещества (0,055 г, 80,0%).
[1002] 1H-ЯМР (400 МГц, CDCl3) δ 8,94-8,85 (м, 2H), 7,96-7,84 (м, 2H), 7,74-7,66 (м, 2H), 7,52-7,46 (м, 1H), 7,35-7,24 (м, 3H), 7,05 (ддд, 2H, J=6,7, 3,1, 1,1 Гц), 7,04-6,76 (м, 1H), 4,95 (с, 2H); LRMS (ES) m/z 461,0 (M++1).
[1003] Пример 62. Соединение 11253: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(6-(трифторметил)пиридин-2-ил)пиридин-3-сульфонамид
[1004] 
[1005] К раствору N-(6-(трифторметил)пиридин-2-ил)пиридин-3-сульфонамида (0,045 г, 0,148 ммоль) в N,N-диметилформамиде (1 мл) добавляли гидрид натрия (60,00%, 0,007 г, 0,178 ммоль) при 0°C, и смесь перемешивали при той же температуре в течение 30 мин. Реакционную смесь обрабатывали 2-(4-(бромметил)-3-фторфенил)-5-(трифторметил)-1,3,4-оксадиазолом (0,051 г, 0,156 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 60%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(6-(трифторметил)пиридин-2-ил)пиридин-3-сульфонамида в виде белого твердого вещества (0,045 г, 55,4%).
[1006] 1H-ЯМР (400 МГц, CDCl3) δ 8,95 (д, 1H, J=2,4 Гц), 8,87 (дд, 1H, J=4,9, 1,6 Гц), 8,02 (дт, 1H, J=8,0, 2,0 Гц), 7,90 (т, 1H, J=7,9 Гц), 7,82 (дд, 1H, J=8,0, 1,7 Гц), 7,79-7,71 (м, 2H), 7,63 (т, 1H, J=7,6 Гц), 7,54-7,47 (м, 2H), 5,22 (с, 2H); LRMS (ES) m/z 546,18 (M+-1).
[1007] Пример 63. Соединение 11254: N-(3-ацетилфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамид
[1008] [Стадия 1] N-(3-ацетилфенил)метансульфонамид
[1009] 
[1010] К раствору 1-(3-аминофенил)этан-1-она (1,000 г, 7,398 ммоль) в дихлорметане (14 мл) добавляли триэтиламин (1,333 мл, 9,618 ммоль) при комнатной температуре и смесь перемешивали при той же температуре в течение 10 мин. Реакционную смесь обрабатывали метансульфонилхлоридом (0,630 мл, 8,138 ммоль) и перемешивали в течение дополнительных 24 ч при той же температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 24g; этилацетат/гексан=от 0% до 30%) с получением N-(3-ацетилфенил)метансульфонамида в виде белого твердого вещества (0,750 г, 47,5%).
[1011] [Стадия 2] Соединение 11254
[1012] 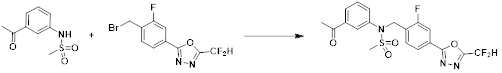
[1013] К раствору N-(3-ацетилфенил)метансульфонамида (0,030 г, 0,141 ммоль) в N,N-диметилформамиде (1 мл) добавляли гидрид натрия (60,00%, 0,007 г, 0,169 ммоль) при 0°C, и смесь перемешивали при той же температуре в течение 30 мин. Реакционную смесь обрабатывали 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазолом (0,045 г, 0,148 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(3-ацетилфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамида в виде белого твердого вещества (0,030 г, 48,5%).
[1014] 1H-ЯМР (400 МГц, CDCl3) δ 7,92 (т, 1H, J=1,9 Гц), 7,89-7,82 (м, 2H), 7,72 (дд, 1H, J=9,9, 1,7 Гц), 7,64 (т, 1H, J=7,6 Гц), 7,52 (ддд, 1H, J=8,0, 2,3, 1,2 Гц), 7,45 (т, 1H, J=7,8 Гц), 6,89 (т, 1H, J=51,7 Гц), 5,04 (с, 2H), 3,02 (с, 3H), 2,58 (с, 3H); LRMS (ES) m/z 438,16 (M+-1).
[1015] Пример 64. Соединение 11255: 1,1-диоксид N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида
[1016] [Стадия 1] N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамид 1,1-диоксид
[1017] 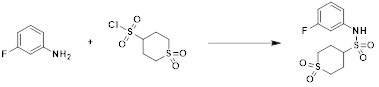
[1018] К раствору анилина (0,100 г, 0,900 ммоль) в дихлорметане (4 мл) добавляли триэтиламин (0,162 мл, 1,170 ммоль) при 0°C и смесь перемешивали при той же температуре в течение 10 мин. Реакционную смесь обрабатывали 1,1-диоксидом тетрагидро-2H-тиопиран-4-сульфонилхлорида (0,209 г, 0,900 ммоль) и перемешивали в течение дополнительных 25 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением 1,1-диоксида N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида в виде белого твердого вещества (0,250 г, 90,4%).
[1019] [Стадия 2] метил 3-фтор-4-(((N-(3-фторфенил)-1,1-диоксидотетрагидро-2H-тиопиран)-4-сульфонамидо)метил)бензоат
[1020] 
[1021] К раствору 1,1-диоксида N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида (0,244 г, 0,794 ммоль) в N,N-диметилформамиде (6 мл) добавляли гидрид натрия (60,00%, 0,041 г, 1,032 ммоль) при 0°C и перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали метил 4-(бромметил)-3-фторбензоатом (0,216 г, 0,873 ммоль) и перемешивали при той же температуре в течение 20 мин. Затем к реакционной смеси добавляли 1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-фтор-4-(((N-(3-фторфенил)-1,1-диоксидотетрагидро-2H-тиопиран)-4-сульфонамидо)метил)бензоата в виде бесцветного масла (0,220 г, 58,5%).
[1022] [Стадия 3] 1,1-диоксид N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида
[1023] 
[1024] Смесь метил 3-фтор-4-(((N-(3-фторфенил)-1,1-диоксидотетрагидро-2H-тиопиран)-4-сульфонамидо)метил)бензоата (0,220 г, 0,465 ммоль) и гидрата гидразина (0,074 г, 2,323 ммоль) в этаноле (8 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 18 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли водой и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой, и сушили с получением 1,1-диоксида N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида в виде белого твердого вещества (0,200 г, 90,9%).
[1025] [Стадия 4] Соединение 11255
[1026] 
[1027] Раствор 1,1-диоксида N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида (0,070 г, 0,148 ммоль) и триэтиламина (0,027 мл, 0,192 ммоль) в тетрагидрофуране (2 мл) перемешивали при комнатной температуре в течение 10 мин, а затем смешивали с трифторуксусным ангидридом (0,022 мл, 0,163 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 16 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением 1,1-диоксида N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида в виде белого твердого вещества (0,065 г, 79,7%).
[1028] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,93 (дд, 1H, J=8,0, 1,7 Гц), 7,85 (дд, 1H, J=10,1, 1,7 Гц), 7,68 (т, 1H, J=7,7 Гц), 7,51-7,39 (м, 2H), 7,35-7,30 (м, 1H), 7,22-7,15 (м, 1H), 5,18 (с, 2H), 3,76 (т, 1H, J=11,7 Гц), 3,51-3,43 (м, 2H), 3,37-3,29 (м, 2H), 3,23 (д, 2H, J=13,8 Гц), 2,18 (кв, 2H, J=12,6 Гц); LRMS (ES) m/z 552,3 (M++1).
[1029] Пример 65. Соединение 11256: 1,1-диоксид N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида
[1030] 
[1031] Раствор 1,1-диоксида N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида (0,070 г, 0,148 ммоль) и триэтиламина (0,027 мл, 0,192 ммоль) в тетрагидрофуране (2 мл) перемешивали при комнатной температуре в течение 10 мин, а затем смешивали с 2,2-дифторуксусным ангидридом (0,019 мл, 0,177 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 16 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением 1,1-диоксида N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида в виде белого твердого вещества (0,070 г, 88,8%).
[1032] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,90 (дд, 1H, J=8,0, 1,7 Гц), 7,82 (дд, 1H, J=10,1, 1,7 Гц), 7,68 (д, 1H, J=8,2 Гц), 7,65 (с, 0,25H), 7,56 (с, 0,5H), 7,49 (м, 0,25H), 7,49-7,37 (м, 2H), 7,33 (дд, 1H, J=8,2, 1,9 Гц), 7,19 (тд, 1H, J=8,2, 2,2 Гц), 5,17 (с, 2H), 3,75 (т, 1H, J=11,8 Гц), 3,53-3,41 (м, 2H), 3,36-3,28 (м, 2H), 3,23 (д, 2H, J=13,6 Гц), 2,18 (кв, 2H, J=12,6 Гц); LRMS (ES) m/z 534,3 (M++1).
[1033] Пример 66. Соединение 11271: N-(4-хлорфенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[1034] [Стадия 1] N-(4-хлорфенил)метансульфонамид
[1035] 
[1036] Раствор 4-хлоранилина (1,000 г, 7,839 ммоль), пиридина (0,696 мл, 8,623 ммоль) и метансульфонилхлорида (0,733 мл, 9,407 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-хлорфенил)метансульфонамид, 0,950 г, 58,9%, коричневое твердое вещество).
[1037] [Стадия 2] метил 4-((N-(4-хлорфенил)метилсульфонамидо)метил)-3-фторбензоат
[1038] 
[1039] Раствор N-(4-хлорфенил)метансульфонамида (0,500 г, 2,431 ммоль), гидрида натрия (60,00%, 0,117 г, 2,917 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,661 г, 2,674 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 4-((N-(4-хлорфенил)метилсульфонамидо)метил)-3-фторбензоата в виде желтого твердого вещества (0,690 г, 76,3%).
[1040] [Стадия 3] N-(4-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид
[1041] 
[1042] Смесь метил 4-((N-(4-хлорфенил)метилсульфонамидо)метил)-3-фторбензоата (0,690 г, 1,856 ммоль) и гидрата гидразина (0,929 г, 18,558 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид, 0,580 г, 84,1%, желтое твердое вещество).
[1043] [Стадия 4] Соединение 11271
[1044] 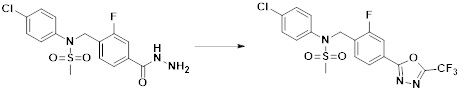
[1045] Раствор N-(4-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,300 г, 0,807 ммоль), трифторуксусного ангидрида (0,123 мл, 0,888 ммоль) и триэтиламина (0,169 мл, 1,210 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-хлорфенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид, 0,120 г, 33,1%, белое твердое вещество).
[1046] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (дд, 1H, J=8,0, 1,7 Гц), 7,76 (дд, 1H, J=9,8, 1,7 Гц), 7,67 (т, 1H, J=7,6 Гц), 7,38-7,29 (м, 2H), 7,31-7,22 (м, 2H), 5,01 (с, 2H), 3,02 (с, 3H); LRMS (ES) m/z 450,3 (M++1).
[1047] Пример 67. Соединение 11272: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(5-фторпиридин-3-ил)метансульфонамид
[1048] [Стадия 1] N-(5-фторпиридин-3-ил)метансульфонамид
[1049] 
[1050] Раствор 5-фторпиридин-3-амина (1,000 г, 8,920 ммоль), пиридина (0,792 мл, 9,812 ммоль) и метансульфонилхлорида (0,834 мл, 10,704 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 5 ч. Преципитат собирали фильтрацией, промывали насыщенным водным раствором дихлорметана и сушили с получением N-(5-фторпиридин-3-ил)метансульфонамида в виде желтого твердого вещества (0,890 г, 52,5%).
[1051] [Стадия 2] метил 3-фтор-4-((N-(5-фторпиридин-3-ил)метилсульфонамидо)метил)бензоат
[1052] 
[1053] Раствор N-(5-фторпиридин-3-ил)метансульфонамида (0,380 г, 1,998 ммоль), гидрида натрия (60,00%, 0,096 г, 2,398 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,543 г, 2,198 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(5-фторпиридин-3-ил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,510 г, 71,6%).
[1054] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(5-фторпиридин-3-ил)метансульфонамид
[1055] 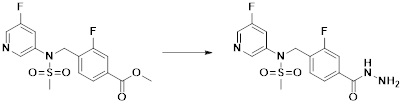
[1056] Смесь метил 3-фтор-4-((N-(5-фторпиридин-3-ил)метилсульфонамидо)метил)бензоата (0,510 г, 1,431 ммоль) и гидрата гидразина (0,716 г, 14,312 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(5-фторпиридин-3-ил)метансульфонамид, 0,440 г, 86,3%, желтое твердое вещество).
[1057] [Стадия 4] Соединение 11272
[1058] 
[1059] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(5-фторпиридин-3-ил)метансульфонамида (0,220 г, 0,617 ммоль), трифторуксусного ангидрида (0,094 мл, 0,679 ммоль) и триэтиламина (0,129 мл, 0,926 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение получали без дальнейшей очистки (N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(5-фторпиридин-3-ил)метансульфонамид, 0,110 г, 41,0%, желтое твердое вещество).
[1060] 1H-ЯМР (400 МГц, CDCl3) δ 8,48-8,42 (м, 2H), 7,92 (дд, 1H, J=8,1, 1,7 Гц), 7,80 (дд, 1H, J=9,8, 1,7 Гц), 7,67 (т, 1H, J=7,6 Гц), 7,52-7,43 (м, 1H), 5,07 (с, 2H), 3,09 (с, 3H); LRMS (ES) m/z 435,1 (M++1).
[1061] Пример 68. Соединение 11273: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(2-фторфенил)метансульфонамид
[1062] [Стадия 1] N-(2-фторфенил)метансульфонамид
[1063] 
[1064] Раствор 2-фторанилина (1,000 г, 8,999 ммоль), пиридина (0,799 мл, 9,899 ммоль) и метансульфонилхлорида (0,841 мл, 10,799 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фторфенил)метансульфонамид, 0,900 г, 52,9%, желтое твердое вещество).
[1065] [Стадия 2] метил 3-фтор-4-((N-(2-фторфенил)метилсульфонамидо)метил)бензоат
[1066] 
[1067] Раствор N-(2-фторфенил)метансульфонамида (0,500 г, 2,643 ммоль), гидрида натрия (60,00%, 0,127 г, 3,171 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,718 г, 2,907 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-фтор-4-((N-(2-фторфенил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,630 г, 67,1%).
[1068] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-фторфенил)метансульфонамид
[1069] 
[1070] Смесь метил 3-фтор-4-((N-(2-фторфенил)метилсульфонамидо)метил)бензоата (0,680 г, 1,914 ммоль) и гидрата гидразина (0,958 г, 19,136 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-фторфенил)метансульфонамид, 0,590 г, 86,8%, белое твердое вещество).
[1071] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(2-фторфенил)метансульфонамид
[1072] 
[1073] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-фторфенил)метансульфонамида (0,290 г, 0,816 ммоль), трифторуксусного ангидрида (0,125 мл, 0,898 ммоль) и триэтиламина (0,170 мл, 1,224 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(2-фторфенил)метансульфонамид, 0,210 г, 57,0%, желтое твердое вещество).
[1074] [Стадия 5] Соединение 11273
[1075] 
[1076] Раствор N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(2-фторфенил)метансульфонамида (0,210 г, 0,465 ммоль) в тетрагидрофуране (10 мл) обрабатывали 1-метокси-N-триэтиламмониосульфонилметилимидатом (реагент Бургесса, 0,166 г, 0,698 ммоль), нагревали при 150°C под действием микроволнового излучения в течение 30 мин и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(2-фторфенил)метансульфонамида в виде желтого твердого вещества (0,150 г, 74,4%).
[1077] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,0, 1,7 Гц), 7,79-7,67 (м, 2H), 7,41-7,30 (м, 1H), 7,32-7,23 (м, 1H), 7,22-7,07 (м, 2H), 5,00 (с, 2H), 3,09 (с, 3H); LRMS (ES) m/z 434,0 (M++1).
[1078] Пример 69. Соединение 11274: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(2-фторфенил)метансульфонамид
[1079] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(2-фторфенил)метансульфонамид
[1080] 
[1081] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(2-фторфенил)метансульфонамида (0,290 г, 0,816 ммоль), дифторуксусного ангидрида (0,098 мл, 0,898 ммоль) и триэтиламина (0,170 мл, 1,224 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(2-фторфенил)метансульфонамид, 0,200 г, 56,5%, желтое твердое вещество).
[1082] [Стадия 2] Соединение 11274
[1083] 
[1084] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(2-фторфенил)метансульфонамида (0,200 г, 0,461 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,165 г, 0,692 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(2-фторфенил)метансульфонамида в виде желтого твердого вещества (0,110 г, 57,4%).
[1085] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,0, 1,7 Гц), 7,74 (дд, 1H, J=9,9, 1,6 Гц), 7,68 (т, 1H, J=7,6 Гц), 7,38-7,31 (м, 1H), 7,30-7,24 (м, 1H), 7,20-7,08 (м, 2H), 7,05 (с, 0,2H), 6,92 (с, 0,5H), 6,80 (с, 0,2H), 4,99 (с, 2H), 3,09 (с, 3H); LRMS (ES) m/z 416,3 (M++1).
[1086] Пример 70. Соединение 11275: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(4-фторфенил)метансульфонамид
[1087] [Стадия 1] N-(4-фторфенил)метансульфонамид
[1088] 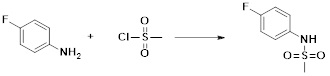
[1089] Раствор 4-фторанилина (1,000 г, 8,999 ммоль), пиридина (0,799 мл, 9,899 ммоль) и метансульфонилхлорида (0,841 мл, 10,799 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-фторфенил)метансульфонамид, 0,960 г, 56,4%, коричневое твердое вещество).
[1090] [Стадия 2] метил 3-фтор-4-((N-(4-фторфенил)метилсульфонамидо)метил)бензоат
[1091] 
[1092] Раствор N-(4-фторфенил)метансульфонамидаа (0,500 г, 2,643 ммоль), гидрида натрия (60,00%, 0,127 г, 3,171 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,718 г, 2,907 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-фтор-4-((N-(4-фторфенил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,690 г, 73,5%).
[1093] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-фторфенил)метансульфонамид
[1094] 
[1095] Смесь аметил 3-фтор-4-((N-(4-фторфенил)метилсульфонамидо)метил)бензота (0,690 г, 1,942 ммоль) и гидрата гидразина (0,972 г, 19,417 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-фторфенил)метансульфонамид, 0,610 г, 88,4%, желтое твердое вещество).
[1096] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(4-фторфенил)метансульфонамид
[1097] 
[1098] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-фторфенил)метансульфонамида (0,300 г, 0,844 ммоль), трифторуксусного ангидрида (0,129 мл, 0,929 ммоль) и триэтиламина (0,176 мл, 1,266 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(4-фторфенил)метансульфонамид, 0,210 г, 55,1%, желтое твердое вещество).
[1099] [Стадия 5] Соединение 11275
[1100] 
[1101] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(4-фторфенил)метансульфонамида (0,210 г, 0,465 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,166 г, 0,698 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(4-фторфенил)метансульфонамида в виде белого твердого вещества (0,140 г, 69,4%).
[1102] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,0, 1,7 Гц), 7,76 (дд, 1H, J=9,8, 1,6 Гц), 7,68 (т, 1H, J=7,6 Гц), 7,35-7,23 (м, 2H), 7,13-7,00 (м, 2H), 5,00 (с, 2H), 3,03 (с, 3H); LRMS (ES) m/z 434,2 (M++1).
[1103] Пример 71. Соединение 11276: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(4-фторфенил)метансульфонамид
[1104] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-фторфенил)метансульфонамид
[1105] 
[1106] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(4-фторфенил)метансульфонамида (0,300 г, 0,844 ммоль), дифторуксусного ангидрида (0,101 мл, 0,929 ммоль) и триэтиламина (0,176 мл, 1,266 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-фторфенил)метансульфонамид, 0,230 г, 62,9%, желтое твердое вещество).
[1107] [Стадия 2] Соединение 11276
[1108] 
[1109] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-фторфенил)метансульфонамида (0,230 г, 0,531 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,190 г, 0,796 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(4-фторфенил)метансульфонамида в виде желтого твердого вещества (0,140 г, 63,5%).
[1110] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,0, 1,7 Гц), 7,76 (дд, 1H, J=9,9, 1,7 Гц), 7,65 (т, 1H, J=7,6 Гц), 7,34-7,24 (м, 2H), 7,11-7,00 (м, 2H), 6,93 (с, 0,5H), 6,80 (с, 0,2H), 4,99 (с, 2H), 3,03 (с, 3H); LRMS (ES) m/z 416,3 (M++1).
[1111] Пример 72. Соединение 11277: N-(4-бромфенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[1112] [Стадия 1] N-(4-бромфенил)метансульфонамид
[1113] 
[1114] Раствор 4-броманилина (1,000 г, 5,813 ммоль), пиридина (0,516 мл, 6,395 ммоль) и метансульфонилхлорида (0,544 мл, 6,976 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-бромфенил)метансульфонамид, 0,960 г, 66,0%, желтое твердое вещество).
[1115] [Стадия 2] метил 4-((N-(4-бромфенил)метилсульфонамидо)метил)-3-фторбензоат
[1116] 
[1117] Раствор N-(4-бромфенил)метансульфонамида (0,500 г, 1,999 ммоль), гидрида натрия (60,00%, 0,096 г, 2,399 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,543 г, 2,199 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 4-((N-(4-бромфенил)метилсульфонамидо)метил)-3-фторбензоата в виде желтого твердого вещества (0,680 г, 81,7%).
[1118] [Стадия 3] N-(4-бромфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид
[1119] 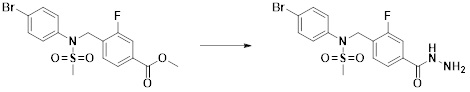
[1120] Смесь метил 4-((N-(4-бромфенил)метилсульфонамидо)метил)-3-фторбензоата (0,680 г, 1,634 ммоль) и гидрата гидразина (0,818 г, 16,336 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-бромфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид, 0,650 г, 95,6%, белое твердое вещество).
[1121] [Стадия 4] N-(4-бромфенил)-N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамид
[1122] 
[
[1123] Раствор N-(4-бромфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,290 г, 0,697 ммоль), трифторуксусного ангидрида (0,108 мл, 0,766 ммоль) и триэтиламина (0,117 мл, 0,836 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-бромфенил)-N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамид, 0,258 г, 72,3%, желтое твердое вещество).
[1124] [Стадия 5] Соединение 11277
[1125] 
[1126] Раствор N-(4-бромфенил)-N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамида (0,290 г, 0,566 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,202 г, 0,849 ммоль) в тетрагидрофуране (10 мл) перемешивали при 150°C в течение 30 мин, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-(4-бромфенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде желтого твердого вещества (0,190 г, 67,9%).
[1127] 1H-ЯМР (400 МГц, CDCl3) δ 7,92-7,85 (м, 1H), 7,76 (дд, 1H, J=9,9, 1,7 Гц), 7,71-7,62 (м, 1H), 7,54-7,45 (м, 2H), 7,24-7,17 (м, 2H), 5,01 (с, 2H), 3,02 (с, 3H); LRMS (ES) m/z 496,2 (M++1).
[1128] Пример 73. Соединение 11278: N-(4-бромфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамид
[1129] [Стадия 1] N-(4-бромфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамид
[1130] 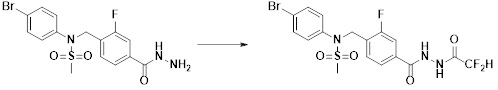
[1131] Раствор N-(4-бромфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,300 г, 0,721 ммоль), дифторуксусного ангидрида (0,138 г, 0,793 ммоль) и триэтиламина (0,121 мл, 0,865 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-бромфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамид, 0,240 г, 67,4%, желтое твердое вещество).
[1132] [Стадия 2] Соединение 11278
[1133] 
[1134] Смесь N-(4-бромфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамида (0,240 г, 0,486 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,174 г, 0,728 ммоль) в дихлорметане (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-бромфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамида в виде белого твердого вещества (0,150 г, 64,9%).
[1135] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,1, 1,7 Гц), 7,76 (дд, 1H, J=9,9, 1,7 Гц), 7,64 (т, 1H, J=7,6 Гц), 7,54-7,45 (м, 2H), 7,25-7,16 (м, 2H), 7,05 (с, 0,2H), 6,93 (с, 0,5H), 6,80 (с, 0,2H), 5,01 (с, 2H), 3,02 (с, 3H); LRMS (ES) m/z 476,2 (M++1).
[1136] Пример 74. Соединение 11279: N-(2-хлорфенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[1137] [Стадия 1] N-(2-хлорфенил)метансульфонамид
[1138] 
[1139] Раствор 2-хлоранилина (1,000 г, 7,839 ммоль), пиридина (0,696 мл, 8,623 ммоль) и метансульфонилхлорида (0,733 мл, 9,407 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-хлорфенил)метансульфонамид, 0,940 г, 58,3%, желтое твердое вещество).
[1140] [Стадия 2] метил 4-((N-(2-хлорфенил)метилсульфонамидо)метил)-3-фторбензоат
[1141] 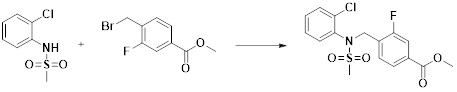
[1142] Раствор N-(2-хлорфенил)метансульфонамида (0,500 г, 2,431 ммоль), гидрида натрия (60,00%, 0,117 г, 2,917 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,661 г, 2,674 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 4-((N-(2-хлорфенил)метилсульфонамидо)метил)-3-фторбензоата в виде желтого твердого вещества (0,640 г, 70,8%).
[1143] [Стадия 3] N-(2-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид
[1144] 
[1145] Смесь метил 4-((N-(2-хлорфенил)метилсульфонамидо)метил)-3-фторбензоата (0,640 г, 1,721 ммоль) и гидрата гидразина (0,862 г, 17,213 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамид, 0,580 г, 90,6%, желтое твердое вещество).
[1146] [Стадия 4] N-(2-хлорфенил)-N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамид
[1147] 
[1148] Раствор N-(2-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,290 г, 0,780 ммоль), трифторуксусного ангидрида (0,121 мл, 0,858 ммоль) и триэтиламина (0,130 мл, 0,936 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-хлорфенил)-N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамид, 0,200 г, 54,8%, желтое твердое вещество).
[1149] [Стадия 5] Соединение 11279
[1150] 
[1151] Смесь N-(2-хлорфенил)-N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)метансульфонамида (0,200 г, 0,428 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,153 г, 0,641 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-хлорфенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде желтого твердого вещества (0,120 г, 65,0%).
[1152] 1H-ЯМР (400 МГц, CDCl3) δ 7,89 (дд, 1H, J=8,0, 1,7 Гц), 7,77-7,66 (м, 2H), 7,52-7,44 (м, 1H), 7,36-7,17 (м, 3H), 5,04 (с, 2H), 3,14 (с, 3H); LRMS (ES) m/z 450,0 (M++1).
[1153] Пример 75. Соединение 11280: N-(2-хлорфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамид
[1154] [Стадия 1] N-(2-хлорфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамид
[1155] 
[1156] Раствор N-(2-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,290 г, 0,780 ммоль), дифторуксусного ангидрида (0,093 мл, 0,858 ммоль) и триэтиламина (0,130 мл, 0,936 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-хлорфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамид, 0,220 г, 62,7%, желтое твердое вещество).
[1157] [Стадия 2] Соединение 11280
[1158] 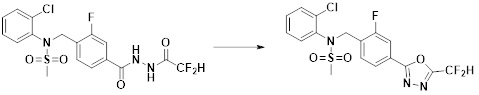
[1159] Смесь N-(2-хлорфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамида (0,220 г, 0,489 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,175 г, 0,734 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-хлорфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамида в виде желтого твердого вещества (0,130 г, 61,6%).
[1160] 1H-ЯМР (400 МГц, CDCl3) δ 7,91-7,82 (м, 1H), 7,78-7,62 (м, 2H), 7,53-7,43 (м, 1H), 7,36-7,26 (м, 1H), 7,26-7,17 (м, 2H), 7,06 (с, 0,2H), 6,93 (с, 0,5H), 6,80 (с, 0,2H), 5,02 (с, 2H), 3,13 (с, 3H); LRMS (ES) m/z 432,2 (M++1).
[1161] Пример 76. Соединение 11281: N-(4-хлорфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамид
[1162] [Стадия 1] N-(4-хлорфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамид
[1163] 
[1164] Раствор N-(4-хлорфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)метансульфонамида (0,300 г, 0,807 ммоль), дифторуксусного ангидрида (0,097 мл, 0,888 ммоль) и триэтиламина (0,135 мл, 0,968 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-хлорфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамид, 0,240 г, 66,1%, желтое твердое вещество).
[1165] [Стадия 2] Соединение 11281
[1166] 
[1167] Смесь N-(4-хлорфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)метансульфонамида (0,240 г, 0,534 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,191 г, 0,800 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением N-(4-хлорфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамида в виде желтого твердого вещества (0,140 г, 60,8%).
[1168] 1H-ЯМР (400 МГц, CDCl3) δ 7,93-7,85 (м, 1H), 7,80-7,72 (м, 1H), 7,65 (т, 1H, J=7,7 Гц), 7,37-7,30 (м, 2H), 7,30-7,22 (м, 2H), 7,05 (с, 0,2H), 6,93 (с, 0,5H), 6,80 (с, 0,2H), 5,01 (с, 2H), 3,02 (с, 3H); LRMS (ES) m/z 432,2 (M++1).
[1169] Пример 77. Соединение 11282: N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(п-толил)метансульфонамид
[1170] [Стадия 1] N-(п-толил)метансульфонамид
[1171] 
[1172] Раствор п-толуидина (1,000 г, 9,332 ммоль), пиридина (0,829 мл, 10,265 ммоль) и метансульфонилхлорида (0,873 мл, 11,198 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(п-толил)метансульфонамид, 1,100 г, 63,6%, желтое твердое вещество).
[1173] [Стадия 2] метил 3-фтор-4-((N-(п-толил)метилсульфонамидо)метил)бензоат
[1174] 
[1175] Раствор N-(п-толил)метансульфонамида (0,500 г, 2,699 ммоль), гидрида натрия (60,00%, 0,130 г, 3,239 ммоль) и метил 4-(бромметил)-3-фторбензоата (0,734 г, 2,969 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 3-фтор-4-((N-(п-толил)метилсульфонамидо)метил)бензоата в виде белого твердого вещества (0,660 г, 69,6%).
[1176] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(п-толил)метансульфонамид
[1177] 
[1178] Смесь метил 3-фтор-4-((N-(п-толил)метилсульфонамидо)метил)бензоата (0,660 г, 1,878 ммоль) и гидрата гидразина (0,940 г, 18,783 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(п-толил)метансульфонамид, 0,540 г, 81,8%, белое твердое вещество).
[1179] [Стадия 4] N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(п-толил)метансульфонамид
[1180] 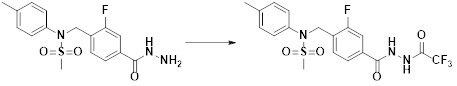
[1181] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(п-толил)метансульфонамида (0,270 г, 0,768 ммоль), трифторуксусного ангидрида (0,118 мл, 0,845 ммоль) и триэтиламина (0,161 мл, 1,153 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(п-толил)метансульфонамид, 0,190 г, 55,3%, белое твердое вещество).
[1182] [Стадия 5] Соединение 11282
[1183] 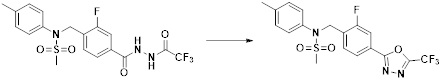
[1184] Смесь N-(2-фтор-4-(2-(2,2,2-трифторацетил)гидразин-1-карбонил)бензил)-N-(п-толил)метансульфонамида (0,190 г, 0,425 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,152 г, 0,637 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(п-толил)метансульфонамида в виде желтого твердого вещества (0,110 г, 60,3%).
[1185] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (дд, 1H, J=8,0, 1,7 Гц), 7,79-7,65 (м, 2H), 7,25-7,08 (м, 4H), 5,02 (с, 2H), 3,01 (с, 3H), 2,33 (с, 3H); LRMS (ES) m/z 430,3 (M++1).
[1186] Пример 78. Соединение 11283: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(п-толил)метансульфонамид
[1187] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(п-толил)метансульфонамид
[1188] 
[1189] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(п-толил)метансульфонамида (0,270 г, 0,768 ммоль), дифторуксусного ангидрида (0,092 мл, 0,845 ммоль) и триэтиламина (0,129 мл, 0,922 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(п-толил)метансульфонамид, 0,210 г, 63,6%, желтое твердое вещество).
[1190] [Стадия 2] Соединение 11283
[1191] 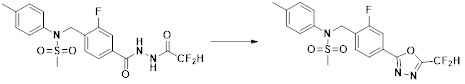
[1192] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(п-толил)метансульфонамида (0,210 г, 0,489 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,175 г, 0,734 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(п-толил)метансульфонамида в виде желтого твердого вещества (0,120 г, 59,6%).
[1193] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,1, 1,6 Гц), 7,74 (дд, 1H, J=9,9, 1,7 Гц), 7,68 (т, 1H, J=7,7 Гц), 7,25-7,12 (м, 4H), 7,05 (с, 0,2H), 6,92 (с, 0,5H), 6,79 (с, 0,2H), 5,01 (с, 2H), 3,01 (с, 3H), 2,33 (с, 3H); LRMS (ES) m/z 412,4 (M++1).
[1194] Пример 79. Соединение 11284: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(5-фторпиридин-3-ил)метансульфонамид
[1195] [Стадия 1] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(5-фторпиридин-3-ил)метансульфонамид
[1196] 
[1197] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(5-фторпиридин-3-ил)метансульфонамида (0,220 г, 0,617 ммоль), дифторуксусного ангидрида (0,074 мл, 0,679 ммоль) и триэтиламина (0,129 мл, 0,926 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(5-фторпиридин-3-ил)метансульфонамида в виде желтого твердого вещества (0,140 г, 52,2%).
[1198] [Стадия 2] Соединение 11284
[1199] 
[1200] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(5-фторпиридин-3-ил)метансульфонамида (0,140 г, 0,322 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,115 г, 0,483 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(5-фторпиридин-3-ил)метансульфонамида в виде желтого твердого вещества (0,086 г, 64,1%).
[1201] 1H-ЯМР (400 МГц, CDCl3) δ 8,46 (с, 2H), 7,92 (дд, 1H, J=8,1, 1,7 Гц), 7,80 (дд, 1H, J=9,8, 1,3 Гц), 7,65 (т, 1H, J=7,7 Гц), 7,54-7,43 (м, 1H), 7,06 (с, 0,2H), 6,93 (с, 0,5H), 6,80 (с, 0,2H), 5,07 (с, 2H), 3,09 (д, 3H, J=1,1 Гц); LRMS (ES) m/z 417,3 (M++1).
[1202] Пример 80. Соединение 11287: метил 3-(N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилсульфамоил)пропаноат
[1203] [Стадия 1] метил 3-(N-фенилсульфамоил)пропаноат
[1204] 
[1205] Раствор анилина (0,490 мл, 5,369 ммоль) и пиридина (0,520 мл, 6,443 ммоль) в дихлорметане (10 мл) смешивали при комнатной температуре с метил 3-(хлорсульфонил)пропаноатом (1,102 г, 5,906 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 0,1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (метил 3-(N-фенилсульфамоил)пропаноат, 1,000 г, 71,3%, коричневое твердое вещество).
[1206] [Стадия 2] Соединение 11287
[1207] 
[1208] К раствору метил 3-(N-фенилсульфамоил)пропаноата (0,070 г, 0,288 ммоль) в N,N-диметилформамиде (1 мл) добавляли гидрид натрия (60,00%, 0,014 г, 0,345 ммоль) при 0°C и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазолом (0,093 г, 0,302 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением метил 3-(N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилсульфамоил)пропаноата в виде белого твердого вещества (0,085 г, 62,9%).
[1209] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,88 (дд, 1H, J=8,1, 1,7 Гц), 7,80 (дд, 1H, J=10,2, 1,7 Гц), 7,73-7,67 (м, 1H), 7,66 (с, 0,25H), 7,56 (с, 0,5H), 7,50 (с, 0,25H), 7,50-7,45 (м, 2H), 7,44-7,36 (м, 2H), 7,36-7,29 (м, 1H), 5,11 (с, 2H), 3,67 (с, 3H), 3,59 (т, 2H, J=7,4 Гц), 2,84 (т, 2H, J=7,4 Гц); LRMS (ES) m/z 470,2 (M++1).
[1210] Пример 81. Соединение 11288: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-3-метокси-N-фенилбутан-1-сульфонамид
[1211] [Стадия 1] 3-метокси-2-метил-N-фенилпропан-1-сульфонамид
[1212] 
[1213] Раствор анилина (0,245 мл, 2,684 ммоль) и пиридина (0,259 мл, 3,221 ммоль) в дихлорметане (10 мл) смешивали при комнатной температуре с 3-метокси-2-метилпропан-1-сульфонилхлоридом (0,551 г, 2,953 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 0,1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (3-метокси-2-метил-N-фенилпропан-1-сульфонамид, 0,500 г, 76,5%, коричневое твердое вещество).
[1214] [Стадия 2] Соединение 11288
[1215] 
[1216] К раствору 3-метокси-2-метил-N-фенилпропан-1-сульфонамида (0,060 г, 0,247 ммоль) в N,N-диметилформамиде (1 мл) добавляли гидрид натрия (60,00%, 0,012 г, 0,296 ммоль) при 0°C и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазолом (0,080 г, 0,259 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-3-метокси-N-фенилбутан-1-сульфонамида в виде белого твердого вещества (0,045 г, 38,9%).
[1217] 1H-ЯМР (400 МГц, DMSO-d6) 400 МГц): δ 7,88 (дд, 1H, J=8,1, 1,7 Гц), 7,80 (дд, 1H, J=10,2, 1,7 Гц), 7,70 (д, 1H, J=8,0 Гц), 7,67 (с, 0,25H), 7,56 (с, 0,5H), 7,53-7,44 (м, 2H), 7,43 (с, 0,25H), 7,43-7,34 (м, 2H), 7,36-7,27 (м, 1H), 5,09 (с, 2H), 3,49-3,40 (м, 2H), 3,33-3,22 (м, 4H), 3,12 (дд, 1H, J=14,0, 8,2 Гц), 2,32 (тт, 1H, J=12,8, 6,1 Гц), 1,08 (д, 3H, J=6,8 Гц); LRMS (ES) m/z 468,17 (M+-1).
[1218] Пример 82. Соединение 11289: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилпропан-1-сульфонамид
[1219] [Стадия 1] N-фенилпропан-1-сульфонамид
[1220] 
[1221] Раствор анилина (0,490 мл, 5,369 ммоль) и пропан-1-сульфонилхлорида (0,628 г, 5,637 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 мин и смешивали с триэтиламином (1,497 мл, 10,738 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 20%) с получением N-фенилпропан-1-сульфонамида в виде светло-желтого масла (0,130 г, 12,2%).
[1222] [Стадия 2] Соединение 11289
[1223] 
[1224] К раствору N-фенилпропан-1-сульфонамида (0,045 г, 0,226 ммоль) в N,N-диметилформамиде (1 мл) в гидриде натрия (60,00%, 0,011 г, 0,271 ммоль) при 0°C, и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазолом (0,073 г, 0,237 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 15%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилпропан-1-сульфонамида в виде белого твердого вещества (0,060 г, 62,5%).
[1225] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,1, 1,6 Гц), 7,77-7,65 (м, 2H), 7,41-7,27 (м, 5H), 6,92 (т, 1H, J=51,7 Гц), 5,06 (с, 2H), 3,17-2,99 (м, 2H), 2,06-1,83 (м, 2H), 1,09 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 424,32 (M+-1).
[1226] Пример 83. Соединение 11290: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилбутан-1-сульфонамид
[1227] [Стадия 1] N-фенилбутан-1-сульфонамид
[1228] 
[1229] Раствор анилина (0,490 мл, 5,369 ммоль) и бутан-1-сульфонилхлорида (0,883 г, 5,637 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 мин и смешивали с триэтиламином (1,497 мл, 10,738 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 20%) с получением N-фенилбутан-1-сульфонамида в виде светло-желтого масла (0,460 г, 40,2%).
[1230] [Стадия 2] Соединение 11290
[1231] 
[1232] К раствору N-фенилбутан-1-сульфонамида (0,045 г, 0,211 ммоль) в N,N-диметилформамиде (1 мл) добавляли гидрид натрия (60,00%, 0,010 г, 0,253 ммоль) при 0°C и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазолом (0,068 г, 0,222 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 15%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилбутан-1-сульфонамида в виде белого твердого вещества (0,060 г, 64,7%).
[1233] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,0, 1,7 Гц), 7,78-7,63 (м, 2H), 7,42-7,25 (м, 5H), 6,92 (т, 1H, J=51,7 Гц), 5,06 (с, 2H), 3,15-3,03 (м, 2H), 1,98-1,79 (м, 2H), 1,48 (h, 2H, J=7,4 Гц), 0,97 (т, 3H, J=7,3 Гц); LRMS (ES) m/z 440,2 (M++1).
[1234] Пример 84. Соединение 11291: N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилциклопропансульфонамид
[1235] [Стадия 1] N-фенилциклопропансульфонамид
[1236] 
[1237] Раствор анилина (0,500 г, 5,369 ммоль) и Et3N (1,630 г, 16,107 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 10 мин и смешивали с циклопропансульфонилхлоридом (1,510 г, 10,738 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением N-фенилциклопропансульфонамида в виде белого твердого вещества (0,650 г, 61,4%).
[1238] [Стадия 2] Соединение 11291
[1239] 
[1240] К раствору N-фенилциклопропансульфонамида (0,045 г, 0,228 ммоль) в N,N-диметилформамиде (1 мл) добавляли гидрид натрия (60,00%, 0,011 г, 0,274 ммоль) при 0°C и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазолом (0,074 г, 0,240 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 20%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-фенилциклопропансульфонамида в виде белого твердого вещества (0,055 г, 56,9%).
[1241] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,1, 1,6 Гц), 7,76-7,65 (м, 2H), 7,41-7,26 (м, 5H), 6,92 (т, 1H, J=51,7 Гц), 5,07 (с, 2H), 2,51 (тт, 1H, J=8,0, 4,8 Гц), 1,18-1,11 (м, 2H), 1,06-0,98 (м, 2H); LRMS (ES) m/z 424,3 (M++1).
[1242] Пример 85: Соединение 11292: N-циклогексил-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамид
[1243] [Стадия 1] N-циклогексилметансульфонамид
[1244] 
[1245] Раствор метансульфонилхлорида (0,858 мл, 11,091 ммоль) и пиридина (1,221 мл, 15,124 ммоль) в дихлорметане (16 мл) перемешивали при комнатной температуре в течение 10 мин и смешивали с циклогексанамином (1,000 г, 10,083 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-циклогексилметансульфонамид, 1,700 г, 95,1%, желтое твердое вещество).
[1246] [Стадия 2] Соединение 11292
[1247] 
[1248] К раствору N-циклогексилметансульфонамида (0,050 г, 0,282 ммоль) в N,N-диметилформамиде (1 мл) добавляли гидрид натрия (60,00%, 0,014 г, 0,338 ммоль) при 0°C и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазолом (0,087 г, 0,282 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-циклогексил-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метансульфонамида в виде светло-желтого масла (0,080 г, 70,3%).
[1249] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (дд, 1H, J=8,2, 1,6 Гц), 7,84-7,72 (м, 2H), 6,91 (т, 1H, J=51,7 Гц), 4,49 (с, 2H), 3,74 (тт, 1H, J=11,3, 2,9 Гц), 2,94 (д, 3H, J=9,4 Гц), 1,87-1,66 (м, 4H), 1,66-1,52 (м, 1H), 1,31 (квт, 4H, J=12,6, 6,9 Гц), 1,01 (дт, 1H, J=9,5, 6,3 Гц); LRMS (ES) m/z 404,0 (M++1).
[1250] Пример 86. Соединение 11323: N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3-(трифторметил)фенил)метансульфонамид
[1251] [Стадия 1] метил 6-((N-(3-(трифторметил)фенил)метилсульфонамидо)метил)никотинат
[1252] 
[1253] Раствор N-(3-(трифторметил)фенил)метансульфонамида (0,500 г, 2,090 ммоль), гидрида натрия (60,00%, 0,100 г, 2,508 ммоль) и метил 6-(бромметил)никотината (0,529 г, 2,299 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением метил 6-((N-(3-(трифторметил)фенил)метилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,400 г, 49,3%).
[1254] [Стадия 2] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(3-(трифторметил)фенил)метансульфонамид
[1255] 
[1256] Смесь метил 6-((N-(3-(трифторметил)фенил)метилсульфонамидо)метил)никотината (0,400 г, 1,030 ммоль) и гидрата гидразина (0,516 г, 10,300 ммоль) в этаноле (10 мл) нагревали при 120°C в течение 1 ч под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(3-(трифторметил)фенил)метансульфонамид, 0,300 г, 75,0%, желтое твердое вещество).
[1257] [Стадия 3] Соединение 11323
[1258] 
[1259] Раствор N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(3-(трифторметил)фенил)метансульфонамида (0,150 г, 0,386 ммоль), трифторуксусного ангидрида (0,060 мл, 0,425 ммоль) и триэтиламина (0,081 мл, 0,579 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3-(трифторметил)фенил)метансульфонамида в виде желтого твердого вещества (0,067 г, 37,2%).
[1260] 1H-ЯМР (400 МГц, CDCl3) δ 9,28 (дд, 1H, J=2,3, 0,8 Гц), 8,41 (дд, 1H, J=8,2, 2,2 Гц), 7,76-7,62 (м, 3H), 7,62-7,47 (м, 2H), 5,18 (с, 2H), 3,10 (с, 3H); LRMS (ES) m/z 467,3 (M++1).
[1261] Пример 87. Соединение 11324: N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3-(трифторметил)фенил)метансульфонамид
[1262] 
[1263] Смесь N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(3-(трифторметил)фенил)метансульфонамида (0,150 г, 0,386 ммоль), дифторуксусного ангидрида (0,050 мл, 0,463 ммоль) и триэтиламина (0,081 мл, 0,579 ммоль) в дихлорметане (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3-(трифторметил)фенил)метансульфонамида в виде желтого твердого вещества (0,074 г, 42,7%).
[1264] 1H-ЯМР (400 МГц, CDCl3) δ 9,28 (дд, 1H, J=2,2, 0,9 Гц), 8,42 (дд, 1H, J=8,2, 2,2, 0,8 Гц), 7,73 (дкв, 1H, J=3,0, 0,8 Гц), 7,70-7,62 (м, 2H), 7,62-7,45 (м, 2H), 7,08 (с, 0,2H), 6,95 (с, 0,5H), 6,83 (с, 0,2H), 5,18 (с, 2H), 3,10 (д, 3H, J=0,7 Гц); LRMS (ES) m/z 449,3 (M++1).
[1265] Пример 88. Соединение 11338: трет-бутил 4-(N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метилсульфонамидо)пиперидин-1-карбоксилат
[1266] [Стадия 1] трет-бутил 4-(метилсульфонамидо)пиперидин-1-карбоксилат
[1267] 
[1268] Раствор метансульфонилхлорида (0,425 мл, 5,492 ммоль) и пиридина (0,605 мл, 7,490 ммоль) в дихлорметане (14 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с трет-бутил 4-аминопиперидин-1-карбоксилатом (1,000 г, 4,993 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (трет-бутил 4-(метилсульфонамидо)пиперидин-1-карбоксилат, 1,300 г, 93,5%, белое твердое вещество).
[1269] [Стадия 2] трет-бутил 4-(N-(2-фтор-4-(метоксикарбонил)бензил)метилсульфонамидо)пиперидин-1-карбоксилат
[1270] 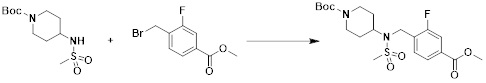
[1271] К раствору трет-бутил 4-(метилсульфонамидо)пиперидин-1-карбоксилата (1,000 г, 3,592 ммоль) в N,N-диметилформамиде (8 мл) добавляли гидрид натрия (60,00%, 0,172 г, 4,311 ммоль) при 0°C и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали метил 4-(бромметил)-3-фторбензоатом (0,932 г, 3,772 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 20%) с получением трет-бутил 4-(N-(2-фтор-4-(метоксикарбонил)бензил)метилсульфонамидо)пиперидин-1-карбоксилата в виде белого твердого вещества (1,200 г, 75,1%).
[1272] [Стадия 3] трет-бутил 4-(N-(2-фтор-4-(гидразинкарбонил)бензил)метилсульфонамидо)пиперидин-1-карбоксилат
[1273] 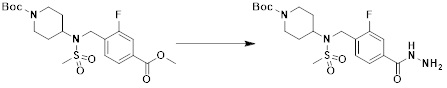
[1274] Смесь трет-бутил 4-(N-(2-фтор-4-(метоксикарбонил)бензил)метилсульфонамидо)пиперидин-1-карбоксилата (1,200 г, 2,700 ммоль) и гидрата гидразина (0,394 мл, 8,099 ммоль) в этаноле (10 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 24 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (трет-бутил 4-(N-(2-фтор-4-(гидразинкарбонил)бензил)метилсульфонамидо)пиперидин-1-карбоксилат, 1,100 г, 91,7%, белое твердое вещество).
[1275] [Стадия 4] Соединение 11338
[1276] 
[1277] К раствору трет-бутил 4-(N-(2-фтор-4-(гидразинкарбонил)бензил)метилсульфонамидо)пиперидин-1-карбоксилата (0,300 г, 0,675 ммоль) в дихлорметане (8 мл) добавляли триэтиламин (0,122 мл, 0,877 ммоль) при комнатной температуре и смесь перемешивали в течение 20 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,088 мл, 0,810 ммоль), нагревали при температуре кипения с обратным холодильником в течение 16 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением трет-бутил 4-(N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)метилсульфонамидо)пиперидин-1-карбоксилата в виде светло-желтого масла (0,280 г, 82,2%).
[1278] 1H-ЯМР (400 МГц, CDCl3) δ 7,91 (дд, 1H, J=8,2, 1,6 Гц), 7,83-7,77 (м, 2H), 6,92 (т, 1H, J=51,7 Гц), 4,50 (с, 2H), 4,11 (кв, 2H, J=7,2 Гц), 3,92 (тт, 1H, J=12,1, 3,8 Гц), 2,94 (с, 3H), 2,71 (т, 2H, J=12,8 Гц), 1,70 (т, 2H, J=13,6 Гц), 1,64-1,48 (м, 2H), 1,42 (с, 9H); LRMS (ES) m/z 405,33 (M++1).
[1279] Пример 89. Соединение 11345: N-(бензо[d][1,3]диоксол-5-ил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамид
[1280] [Стадия 1] метил 6-((бензо[d][1,3]диоксол-5-иламино)метил)никотинат
[1281] 
[1282] К раствору бензо[d][1,3]диоксол-5-амина (0,300 г, 2,188 ммоль) и метил 6-формилникотината (0,379 г, 2,297 ммоль) в дихлорметане (10 мл) добавляли уксусную кислоту (0,150 мл, 2,625 ммоль) при комнатной температуре и смесь перемешивали при той же температуре в течение 30 мин. Реакционную смесь обрабатывали триацетоксиборгидридом натрия (0,927 г, 4,375 ммоль) и перемешивали в течение дополнительных 12 ч при той же температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((бензо[d][1,3]диоксол-5-иламино)метил)никотината в виде желтого твердого вещества (0,492 г, 78,6%).
[1283] [Стадия 2] метил 6-((N-(бензо[d][1,3]диоксол-5-ил)метилсульфонамидо)метил)никотинат
[1284] 
[1285] Смесь метил 6-((бензо[d][1,3]диоксол-5-иламино)метил)никотината (0,490 г, 1,712 ммоль), триэтиламина (0,477 мл, 3,423 ммоль) и метансульфонилхлорида (0,160 мл, 2,054 ммоль) в дихлорметане (10 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 15 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 30%) с получением метил 6-((N-(бензо[d][1,3]диоксол-5-ил)метилсульфонамидо)метил)никотината в виде коричневого масла (0,216 г, 34,6%).
[1286] [Стадия 3] N-(бензо[d][1,3]диоксол-5-ил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид
[1287] 
[1288] Смесь метил 6-((N-(бензо[d][1,3]диоксол-5-ил)метилсульфонамидо)метил)никотината (0,216 г, 0,593 ммоль) и гидрата гидразина (50,00% раствор, 0,165 мл, 1,778 ммоль) в этаноле (10 мл) перемешивали при температуре окружающей среды в течение 1 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(бензо[d][1,3]диоксол-5-ил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид, 0,131 г, 60,6%, белое вспененное твердое вещество).
[1289] [Стадия 4] Соединение 11345
[1290] 
[1291] Смесь N-(бензо[d][1,3]диоксол-5-ил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида (0,135 г, 0,371 ммоль), дифторуксусного ангидрида (0,060 мл, 0,556 ммоль) и триэтиламина (0,155 мл, 1,112 ммоль) в дихлорметане (5 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 36 ч и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 10% до 50%) с получением N-(бензо[d][1,3]диоксол-5-ил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамида в виде коричневого твердого вещества (0,097 г, 61,7%).
[1292] 1H-ЯМР (400 МГц, CDCl3) δ 9,23 (д, 1H, J=2,2 Гц), 8,37 (дд, 1H, J=8,2, 2,2 Гц), 7,67 (д, 1H, J=8,2 Гц), 7,26 (с, 0,4H), 7,06 (с, 0,2H), 6,93 (с, 0,5H), 6,88-6,76 (м, 2H), 6,72 (д, 1H, J=8,2 Гц), 5,96 (с, 2H), 5,04 (с, 2H), 3,06 (с, 3H); LRMS (ES) m/z 425,24 (M++1).
[1293] Пример 90. Соединение 11346: N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(4-метоксифенил)метансульфонамид
[1294] [Стадия 1] метил 6-(((4-метоксифенил)амино)метил)никотинат
[1295] 
[1296] К раствору 4-метоксианилина (0,300 г, 2,436 ммоль) и метил 6-формилникотината (0,422 г, 2,558 ммоль) в дихлорметане (10 мл) добавляли уксусную кислоту (0,167 мл, 2,923 ммоль) при комнатной температуре и смесь перемешивали в течение 30 мин при той же температуре. Реакционную смесь обрабатывали триацетоксиборгидридом натрия (1,033 г, 4,872 ммоль) и перемешивали в течение дополнительных 12 ч при той же температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-(((4-метоксифенил)амино)метил)никотината в виде желтого твердого вещества (0,537 г, 81,0%).
[1297] [Стадия 2] метил 6-((N-(4-метоксифенил)метилсульфонамидо)метил)никотинат
[1298] 
[1299] Раствор метил 6-(((4-метоксифенил)амино)метил)никотината (0,530 г, 1,946 ммоль), триэтиламина (0,543 мл, 3,893 ммоль) и метансульфонилхлорида (0,182 мл, 2,336 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 6-((N-(4-метоксифенил)метилсульфонамидо)метил)никотината в виде светло-коричневого твердого вещества (0,305 г, 44,7%).
[1300] [Стадия 3] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(4-метоксифенил)метансульфонамид
[1301] 
[1302] Смесь метил 6-((N-(4-метоксифенил)метилсульфонамидо)метил)никотината (0,305 г, 0,870 ммоль) и гидрата гидразина (50,00% раствор, 0,242 мл, 2,611 ммоль) в этаноле (10 мл) перемешивали при температуре окружающей среды в течение 1 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(4-метоксифенил)метансульфонамида в виде белого твердого вещества (0,282 г, 92,5%)
[1303] [Стадия 4] Соединение 11346
[1304] 
[1305] Смесь N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(4-метоксифенил)метансульфонамида (0,282 г, 0,805 ммоль), дифторуксусного ангидрида (0,131 мл, 1,207 ммоль) и триэтиламина (0,337 мл, 2,414 ммоль) в дихлорметане (5 мл) нагревали при температуре кипения с обратным холодильником в течение 36 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 10% до 50%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(4-метоксифенил)метансульфонамида в виде коричневого твердого вещества (0,228 г, 69,0%).
[1306] 1H-ЯМР (400 МГц, CDCl3) δ 9,22 (дд, 1H, J=2,2, 0,9 Гц), 8,37 (дд, 1H, J=8,3, 2,2 Гц), 7,71 (д, 1H, J=8,2 Гц), 7,34-7,21 (м, 2H), 7,06 (с, 0,2H), 6,93 (с, 0,4H), 6,88-6,81 (м, 2H), 6,80 (с, 0,2H), 5,08 (с, 2H), 3,76 (с, 3H), 3,05 (с, 3H); LRMS (ES) m/z 411,28 (M++1).
[1307] Пример 91. Соединение 11347: N-(5-бромпиридин-2-ил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[1308] [Стадия 1] Метил 4-((N-(5-бромпиридин-2-ил)метилсульфонамидо)метил)бензоат
[1309] 
[1310] Раствор метансульфонилхлорида (0,106 мл, 1,370 ммоль), N,N-диметилпиридин-4-амина (DMAP, 0,046 г, 0,374 ммоль) и пиридина (0,151 мл, 1,868 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 20 мин, а затем смешивали с метил 4-(((5-бромпиридин-2-ил)амино)метил)бензоатом (0,400 г, 1,245 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 24 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 15%) с получением метил 4-((N-(5-бромпиридин-2-ил)метилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,350 г, 70,4%).
[1311] [Стадия 2] N-(5-бромпиридин-2-ил)-N-(4-(гидразинкарбонил)бензил)метансульфонамид
[1312] 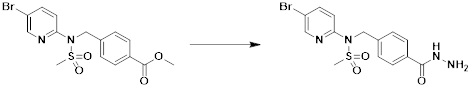
[1313] Смесь метил 4-((N-(5-бромпиридин-2-ил)метилсульфонамидо)метил)бензоата (0,350 г, 0,877 ммоль) и гидрата гидразина (0,084 г, 2,630 ммоль) в этаноле (8 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 24 ч, и охлаждали до температуры окружающей среды и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением N-(5-бромпиридин-2-ил)-N-(4-(гидразинкарбонил)бензил)метансульфонамида в виде белого твердого вещества (0,290 г, 82,9%).
[1314] [Стадия 3] Соединение 11347
[1315] 
[1316] К раствору N-(5-бромпиридин-2-ил)-N-(4-(гидразинкарбонил)бензил)метансульфонамида (0,072 г, 0,180 ммоль) в тетрагидрофуране (1 мл) добавляли триэтиламин (0,032 мл, 0,234 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,024 мл, 0,216 ммоль), нагревали при температуре кипения с обратным холодильником в течение 6 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением неочищенного продукта, который повторно подвергали хроматографии (пластина из SiO2, 20×20×1 мм; этилацетат/гексан=30%) с получением N-(5-бромпиридин-2-ил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,035 г, 42,3%).
[1317] 1H-ЯМР (400 МГц, CDCl3) δ 8,39-8,31 (м, 1H), 8,08-7,99 (м, 2H), 7,61 (дд, 1H, J=8,7, 2,6 Гц), 7,56-7,46 (м, 2H), 7,32-7,26 (м, 2H), 6,89 (т, 1H, J=51,7 Гц), 5,16 (с, 2H), 3,07 (с, 3H); LRMS (ES) m/z 461,1 (M++1).
[1318] Пример 92. Соединение 11348: N-(5-хлорпиридин-2-ил)-N-(4-(5-(дифторметил-1,3,4-оксадиазол-2-ил)бензил)метансульфонамид
[1319] [Стадия 1] метил 4-((N-(5-хлорпиридин-2-ил)метилсульфонамидо)метил)бензоат
[1320] 
[1321] Раствор метансульфонилхлорида (0,123 мл, 1,590 ммоль), N,N-диметилпиридин-4-амина (DMAP, 0,053 г, 0,434 ммоль) и пиридина (0,175 мл, 2,168 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 20 мин, а затем смешивали с метил 4-(((5-хлорпиридин-2-ил)амино)метил)бензоатом (0,400 г, 1,446 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 24 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 15%) с получением метил 4-((N-(5-хлорпиридин-2-ил)метилсульфонамидо)метил)бензоата в виде белого твердого вещества (0,320 г, 62,4%).
[1322] [Стадия 2] N-(5-хлорпиридин-2-ил)-N-(4-(гидразинкарбонил)бензил)метансульфонамид
[1323] 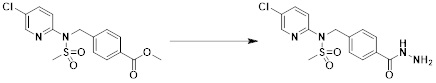
[1324] Смесь метил 4-((N-(5-хлорпиридин-2-ил)метилсульфонамидо)метил)бензоата (0,320 г, 0,902 ммоль) и гидрата гидразина (0,087 г, 2,706 ммоль) в этаноле (8 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 24 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой, и сушили с получением N-(5-хлорпиридин-2-ил)-N-(4-(гидразинкарбонил)бензил)метансульфонамида в виде белого твердого вещества (0,280 г, 87,5%).
[1325] [Стадия 3] Соединение 11348
[1326] 
[1327] N-(5-хлорпиридин-2-ил)-N-(4-(гидразинкарбонил)бензил)метансульфонамид (0,074 г, 0,207 ммоль) в тетрагидрофуране (1 мл) перемешивали в течение 10 мин при комнатной температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,027 мл, 0,249 ммоль) и нагревали при температуре кипения с обратным холодильником в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 30%) с получением N-(5-хлорпиридин-2-ил)-N-(4-(5-(дифторметил-1,3,4-оксадиазол-2-ил)бензил)метансульфонамида в виде белого твердого вещества (0,030 г, 34,9%).
[1328] 1H-ЯМР (400 МГц, CDCl3) δ 8,48 (дд, 1H, J=2,6, 0,7 Гц), 8,09-8,00 (м, 2H), 7,77 (ддд, 1H, J=8,6, 2,5, 0,6 Гц), 7,54 (д, 2H, J=8,2 Гц), 7,30-7,27 (м, 1H), 6,92 (т, 1H, J=51,7 Гц), 5,19 (с, 2H), 3,10 (с, 3H); LRMS (ES) m/z 415,2 (M++1).
[1329] Пример 93. Соединение 11350: 1,1-диоксид N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-тиопиран-4-сульфонамида
[1330] [Стадия 1] N-фенилтетрагидро-2H-тиопиран-4-сульфонамид 1,1-диоксид
[1331] 
[1332] К раствору анилина (0,100 г, 1,074 ммоль) в дихлорметане (6 мл) добавляли триэтиламин (0,193 мл, 1,396 ммоль) 0°C и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали 1,1-диоксидом тетрагидро-2H-тиопиран-4-сульфонилхлорида (0,250 г, 1,074 ммоль) и перемешивали в течение дополнительных 16 ч при комнатной температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (1,1-диоксид N-фенилтетрагидро-2H-тиопиран-4-сульфонамида, 0,310 г, 99,8%, белое твердое вещество).
[1333] [Стадия 2] метил 6-(((1,1-диоксидо-N-фенилтетрагидро-2H-тиопиран)-4-сульфонамидо)метил)никотинат
[1334] 
[1335] Раствор метил 6-(бромметил)никотината (0,125 г, 0,544 ммоль) и йодида калия (0,017 г, 0,104 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с 1,1-диоксидом N-фенилтетрагидро-2H-тиопиран-4-сульфонамидом (0,150 г, 0,518 ммоль) и карбонатом калия (0,086 г, 0,622 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию этилацетатом. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 60%) с получением метил 6-(((1,1-диоксидо-N-фенилтетрагидро-2H-тиопиран)-4-сульфонамидо)метил)никотината в виде белого твердого вещества (0,200 г, 87,9%).
[1336] [Стадия 3] 1,1-диоксид N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-тиопиран-4-сульфонамида
[1337] 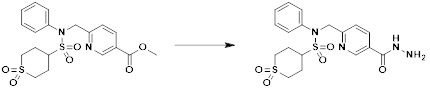
[1338] Смесь метил 6-(((1,1-диоксидо-N-фенилтетрагидро-2H-тиопиран)-4-сульфонамидо)метил)никотината (0,200 г, 0,456 ммоль) и гидрата гидразина (0,067 мл, 1,368 ммоль) в этаноле (4 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 16 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Преципитат собирали фильтрацией, промывали водой и сушили с получением 1,1-диоксида N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-тиопиран-4-сульфонамида в виде белого твердого вещества (0,180 г, 90,0%).
[1339] [Стадия 4] Соединение 11350
[1340] 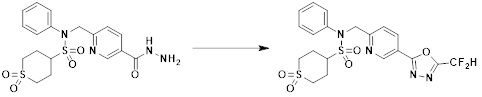
[1341] К раствору 1,1-диоксида N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-тиопиран-4-сульфонамида (0,090 г, 0,205 ммоль) в тетрагидрофуране (1 мл) добавляли триэтиламин (0,057 мл, 0,410 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,033 мл, 0,308 ммоль), нагревали при температуре кипения с обратным холодильником в течение 6 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением 1,1-диоксида N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-тиопиран-4-сульфонамида в виде белого твердого вещества (0,070 г, 68,4%)
[1342] 1H-ЯМР (400 МГц, CDCl3) δ 9,24 (д, 1H, J=2,1 Гц), 8,37 (дд, 1H, J=8,2, 2,2 Гц), 7,59 (д, 1H, J=8,2 Гц), 7,45-7,28 (м, 5H), 6,95 (т, 1H, J=51,6 Гц), 5,16 (с, 2H), 3,45 (п, 1H, J=6,3 Гц), 3,41-3,28 (м, 2H), 3,05-2,94 (м, 2H), 2,64 (кв, 4H, J=6,3 Гц); LRMS (ES) m/z 499,3 (M++1).
[1343] Пример 94. Соединение 11351: N-циклогексил-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамид
[1344] [Стадия 1] метил 6-((N-циклогексилметилсульфонамидо)метил)никотинат
[1345] 
[1346] Раствор метил 6-(бромметил)никотината (0,164 г, 0,711 ммоль) и йодида калия (0,022 г, 0,135 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с N-циклогексилметансульфонамидом (0,120 г, 0,677 ммоль) и карбонатом калия (0,112 г, 0,812 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((N-циклогексилметилсульфонамидо)метил)никотината в виде белого твердого вещества (0,210 г, 95,0%).
[1347] [Стадия 2] N-циклогексил-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид
[1348] 
[1349] Смесь метил 6-((N-циклогексилметилсульфонамидо)метил)никотината (0,210 г, 0,643 ммоль) и гидрата гидразина (0,094 мл, 1,930 ммоль) в этаноле (4 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 16 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Преципитат собирали фильтрацией, промывали водой и сушили с получением N-циклогексил-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида в виде белого твердого вещества (0,180 г, 85,7%).
[1350] [Стадия 3] Соединение 11351
[1351] 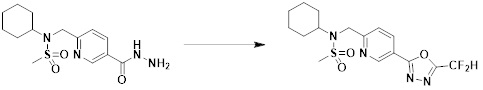
[1352] К раствору N-циклогексил-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида (0,090 г, 0,276 ммоль) в тетрагидрофуране (1 мл) добавляли триэтиламин (0,077 мл, 0,551 ммоль) при комнатной температуре, и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,045 мл, 0,414 ммоль), нагревали при температуре кипения с обратным холодильником в течение 6 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-циклогексил-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамида в виде белого твердого вещества (0,070 г, 65,7%).
[1353] 1H-ЯМР (400 МГц, CDCl3) δ 9,21 (дд, 1H, J=2,3, 0,8 Гц), 8,36 (дд, 1H, J=8,3, 2,2 Гц), 7,80 (дд, 1H, J=8,3, 0,8 Гц), 6,93 (т, 1H, J=51,6 Гц), 4,59 (с, 2H), 3,86-3,69 (м, 1H), 3,00 (с, 3H), 1,84-1,66 (м, 4H), 1,59 (д, 1H, J=13,6 Гц), 1,31 (тд, 4H, J=9,4, 2,8 Гц), 1,07-0,88 (м, 1H); LRMS (ES) m/z 387,0 (M++1).
[1354] Пример 95: Соединение 11352: N-(3-хлорфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамид
[1355] [Стадия 1] метил 6-((N-(3-хлорфенил)метилсульфонамидо)метил)никотинат
[1356] 
[1357] Раствор метил 6-(бромметил)никотината (0,294 г, 1,276 ммоль) и йодида калия (0,040 г, 0,243 ммоль) в N,N-диметилформамиде (4 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с N-(3-хлорфенил)метансульфонамидом (0,250 г, 1,216 ммоль) и карбонатом калия (0,202 г, 1,459 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((N-(3-хлорфенил)метилсульфонамидо)метил)никотината в виде светло-желтого твердого вещества (0,292 г, 67,7%).
[1358] [Стадия 2] (N-(3-хлорфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид
[1359] 
[1360] Смесь метил 6-((N-(3-хлорфенил)метилсульфонамидо)метил)никотината (0,292 г, 0,823 ммоль) и гидрата гидразина (0,087 мл, 2,469 ммоль) в этаноле (6 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 16 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлорфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид, 0,250 г, 85,6%, белое твердое вещество).
[1361] [Стадия 3] N-(3-хлорфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)метансульфонамид
[1362] 
[1363] К раствору N-(3-хлорфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида (0,190 г, 0,535 ммоль) в тетрагидрофуране (3 мл) добавляли триэтиламин (0,112 мл, 0,803 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,070 мл, 0,643 ммоль), нагревали при температуре кипения с обратным холодильником в течение 16 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением N-(3-хлорфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)метансульфонамида в виде белого твердого вещества (0,210 г, 90,6%).
[1364] [Стадия 4] Соединение 11352
[1365] 
[1366] Смесь N-(3-хлорфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)метансульфонамида (0,110 г, 0,254 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,073 г, 0,305 ммоль) в тетрагидрофуране (6 мл) нагревали при 130°C в течение 30 мин под действием микроволнового излучения. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(3-хлорфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамида в виде белого твердого вещества (0,080 г, 75,9%).
[1367] 1H-ЯМР (400 МГц, CDCl3) δ 9,27 (дд, 1H, J=2,3, 0,8 Гц), 8,41 (дд, 1H, J=8,2, 2,2 Гц), 7,67 (дд, 1H, J=8,2, 0,9 Гц), 7,47 (дт, 1H, J=2,6, 1,1 Гц), 7,36-7,26 (м, 4H), 6,95 (т, 1H, J=51,6 Гц), 5,14 (с, 2H), 3,10 (с, 3H); LRMS (ES) m/z 417,0 (M++1).
[1368] Пример 96. Соединение 11353: N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(пиридин-3-ил)метансульфонамид
[1369] [Стадия 1] метил 6-((N-(пиридин-3-ил)метилсульфонамидо)метил)никотинат
[1370] 
[1371] Раствор метил 6-(бромметил)никотината (0,168 г, 0,732 ммоль) и йодида калия (0,023 г, 0,139 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с N-(пиридин-3-ил)метансульфонамидом (0,120 г, 0,697 ммоль) и карбонатом калия (0,116 г, 0,836 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением метил 6-((N-(пиридин-3-ил)метилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,140 г, 62,5%).
[1372] [Стадия 2] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(пиридин-3-ил)метансульфонамид
[1373] 
[1374] Смесь метил 6-((N-(пиридин-3-ил)метилсульфонамидо)метил)никотината (0,140 г, 0,436 ммоль) и гидрата гидразина (0,064 мл, 1,307 ммоль) в этаноле (4 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 16 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(пиридин-3-ил)метансульфонамид, 0,135 г, 96,4%, светло-желтое масло).
[1375] [Стадия 3] N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(пиридин-3-ил)метансульфонамид
[1376] 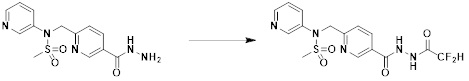
[1377] К раствору N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(пиридин-3-ил)метансульфонамида (0,135 г, 0,420 ммоль) в тетрагидрофуране (1 мл) добавляли триэтиламин (0,117 мл, 0,840 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,069 мл, 0,630 ммоль), нагревали при температуре кипения с обратным холодильником в течение 6 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(пиридин-3-ил)метансульфонамида в виде желтого масла (0,070 г, 43,7%).
[1378] [Стадия 4] Соединение 11353
[1379] 
[1380] Смесь N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(пиридин-3-ил)метансульфонамида (0,070 г, 0,184 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,052 г, 0,220 ммоль) в тетрагидрофуране (2 мл) нагревали при 130°C в течение 30 мин под действием микроволнового излучения. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(пиридин-3-ил)метансульфонамида в виде светло-желтого масла (0,025 г, 35,7%).
[1381] 1H-NMR (400 МГц, CDCl3) δ 9,28 (д, J=1,7 Гц, 1H), 8,89 (д, J=2,1 Гц, 1H), 8,57 (дд, J=5,0, 1,2 Гц, 1H), 8,42 (дд, J=8,2, 2,2 Гц, 1H), 8,15 (д, J=9,0 Гц, 1H), 7,54 (м, 1H), 6,94 (т, J=51,6 Гц, 1H), 5,19 (с, 2H), 3,10 (с, 3H); LRMS (ES) m/z 382,27 (M++1).
[1382] Пример 97. Соединение 11354: N-(3-бромфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамид
[1383] [Стадия 1] метил 6-((N-(3-бромфенил)метилсульфонамидо)метил)никотинат
[1384] 
[1385] Раствор метил 6-(бромметил)никотината (0,193 г, 0,840 ммоль) и йодида калия (0,027 г, 0,160 ммоль) в N,N-диметилформамиде (3 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с N-(3-бромфенил)метансульфонамидом (0,200 г, 0,800 ммоль) и карбонатом калия (0,144 г, 1,040 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((N-(3-бромфенил)метилсульфонамидо)метил)никотината в виде белого твердого вещества (0,270 г, 84,6%).
[1386] [Стадия 2] N-(3-бромфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид
[1387] 
[1388] Смесь метил 6-((N-(3-бромфенил)метилсульфонамидо)метил)никотината (0,270 г, 0,676 ммоль) и моногидрата гидразина (0,099 мл, 2,029 ммоль) в этаноле (6 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 8 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Преципитат собирали фильтрацией, промывали водой и сушили с получением N-(3-бромфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида в виде белого твердого вещества (0,250 г, 92,6%).
[1389] [Стадия 3] Соединение 11354
[1390] 
[1391] К раствору N-(3-бромфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида (0,061 г, 0,152 ммоль) в тетрагидрофуране (2 мл) добавляли триэтиламин (0,042 мл, 0,304 ммоль) при комнатной температуре и смесь перемешивали в течение 20 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,025 мл, 0,228 ммоль), нагревали при температуре кипения с обратным холодильником в течение 8 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(3-бромфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамида в виде белого твердого вещества (0,055 г, 78,8%).
[1392] 1H-NMR (400 МГц, CDCl3) δ 9,26 (д, J=1,7 Гц, 1H), 8,40 (дд, J=8,2, 2,1 Гц, 1H), 7,67 (д, J=8,2 Гц, 1H), 7,61 (м, 1H), 7,44 ~ 7,37 (м, 2H), 7,24 (т, J=8,0 Гц, 1H), 6,95 (т, J=51,6 Гц, 1H), 5,13 (с, 2H), 3,09 (с, 3H); LRMS (ES) m/z 491,06 (M++1).
[1393] Пример 98. Соединение 11355: N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(м-толил)метансульфонамид
[1394] [Стадия 1] 6-((N-(м-толил)метилсульфонамидо)метил)никотинат
[1395] 
[1396] Раствор метил 6-(бромметил)никотината (0,196 г, 0,850 ммоль) и йодида калия (0,027 г, 0,162 ммоль) в N,N-диметилформамиде (3 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с N-(м-толил)метансульфонамидом (0,150 г, 0,810 ммоль) и карбонатом калия (0,145 г, 1,053 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением метил 6-((N-(м-толил)метилсульфонамидо)метил)никотината в виде белого твердого вещества (0,200 г, 73,9%).
[1397] [Стадия 2] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(м-толил)метансульфонамид
[1398] 
[1399] Смесь метил 6-((N-(м-толил)метилсульфонамидо)метил)никотината (0,200 г, 0,598 ммоль) и моногидрата гидразина (0,087 мл, 1,794 ммоль) в этаноле (3 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 8 ч, охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Затем к концентратам добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(м-толил)метансульфонамид, 0,190 г, 95,0%, белое твердое вещество).
[1400] [Стадия 3] Соединение 11355
[1401] 
[1402] К раствору N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(м-толил)метансульфонамида (0,065 г, 0,196 ммоль) в тетрагидрофуране (2 мл) добавляли триэтиламин (0,055 мл, 0,391 ммоль) при комнатной температуре и смесь перемешивали в течение 20 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,032 мл, 0,293 ммоль), нагревали при температуре кипения с обратным холодильником в течение 8 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(м-толил)метансульфонамида в виде белого твердого вещества (0,048 г, 62,2%).
[1403] 1H-NMR (400 МГц, CDCl3) δ 9,23 (д, J=2,0 Гц, 1H), 8,39 (дд, J=8,3, 2,2 Гц, 1H), 7,75 (д, J=8,3 Гц, 1H), 7,28 ~ 7,18 (м, 3H), 6,95 (т, J=51,6 Гц, 1H), 5,14 (с, 2H), 3,07 (с, 3H); LRMS (ES) m/z 394,99 (M++1).
[1404] Пример 99. Соединение 11366: N-(3-бромфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[1405] [Стадия 1] N-(3-бромфенил)этансульфонамид
[1406] 
[1407] Раствор 3-броманилина (3,000 г, 17,439 ммоль), пиридина (1,545 мл, 19,183 ммоль) и этансульфонилхлорида (2,148 мл, 22,670 ммоль) в дихлорметане (100 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 40%) с получением N-(3-бромфенил)этансульфонамида в виде бесцветного масла (4,000 г, 86,8%).
[1408] [Стадия 2] метил 6-((N-(3-бромфенил)этилсульфонамидо)метил)никотинат
[1409] 
[1410] Раствор метил 6-(бромметил)никотината (0,479 г, 2,082 ммоль) и йодида калия (0,063 г, 0,379 ммоль) в N,N-диметилформамиде (30 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с N-(3-бромфенил)этансульфонамидом (0,500 г, 1,893 ммоль) и карбонатом калия (0,392 г, 2,839 ммоль). Реакционную смесь перемешивали при 50°C в течение дополнительных 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 6-((N-(3-бромфенил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,582 г, 74,4%).
[1411] [Стадия 3] N-(3-бромфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид
[1412] 
[1413] Смесь метил 6-((N-(3-бромфенил)метилсульфонамидо)метил)никотината (0,582 г, 1,458 ммоль) и гидрата гидразина (0,730 г, 14,577 ммоль) в этаноле (40 мл) нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-бромфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид, 0,500 г, 85,9%, бесцветное масло).
[1414] [Стадия 4] Соединение 11366
[1415] 
[1416] Смесь N-(3-бромфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида (0,500 г, 1,210 ммоль), триэтиламина (0,843 мл, 6,049 ммоль) и дифторуксусного ангидрида (0,329 мл, 3,025 ммоль) в тетрагидрофуране (10 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 12 ч, и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением N-(3-бромфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамида в виде бесцветного масла (0,430 г, 74,8%).
[1417] 1H-ЯМР (400 МГц, CDCl3) δ 9,25 (д, 1H, J=1,8 Гц), 8,40 (дд, 1H, J=8,2, 2,3 Гц), 7,70 (д, 1H, J=8,3 Гц), 7,63-7,62 (м, 1H), 7,43-7,37 (м, 2H), 7,24-7,20 (м, 1H), 7,07 (с, 0,2H), 6,95 (с, 0,5H), 6,82 (с, 0,8H), 5,16 (с, 2H), 3,21 (кв, 2H, J=7,4 Гц), 1,48-1,41 (м, 3H); LRMS (ES) m/z 473,0 (M++1).
[1418] Пример 100. Соединение 11367: N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-1-метил-N-фенилпиперидин-4-сульфонамид
[1419] [Стадия 1] трет-бутил 4-(N-фенилсульфамоил)пиперидин-1-карбоксилат
[1420] 
[1421] К раствору анилина (0,980 мл, 10,738 ммоль) в дихлорметане (10 мл) добавляли триэтиламин (1,946 мл, 13,959 ммоль) при комнатной температуре и смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь обрабатывали трет-бутил 4-(хлорсульфонил)пиперидин-1-карбоксилатом (3,199 г, 11,275 ммоль) и перемешивали в течение дополнительных 16 ч при той же температуре. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (трет-бутил 4-(N-фенилсульфамоил)пиперидин-1-карбоксилат, 3,600 г, 98,5%, белое твердое вещество).
[1422] [Стадия 2] метил 6-(((1-(трет-бутоксикарбонил)-N-фенилпиперидин)-4-сульфонамидо)метил)никотинат
[1423] 
[1424] Раствор метил 6-(бромметил)никотината (0,710 г, 3,084 ммоль) и йодида калия (0,098 г, 0,587 ммоль) в N,N-диметилформамиде (6 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с трет-бутил 4-(N-фенилсульфамоил)пиперидин-1-карбоксилатом (1,000 г, 2,937 ммоль) и карбонатом калия (0,487 г, 3,525 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Реакционную смесь разбавляли водой и перемешивали при температуре окружающей среды. Полученный преципитат собирали фильтрацией, промывали водным раствором и сушили с получением метил 6-(((1-(трет-бутоксикарбонил)-N-фенилпиперидин)-4-сульфонамидо)метил)никотината в виде коричневого твердого вещества (1,350 г, 93,9%).
[1425] [Стадия 3] гидрохлорид метил 6-((N-фенилпиперидин-4-сульфонамидо)метил)никотината
[1426] 
[1427] Раствор метил 6-(((1-(трет-бутоксикарбонил)-N-фенилпиперидин)-4-сульфонамидо)метил)никотината (0,436 г, 0,891 ммоль) и хлористоводородной кислоты (4,00 M раствор в 1,4-диоксане, 0,891 мл, 3,562 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 1 ч, и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (гидрохлорид метил 6-((N-фенилпиперидин-4-сульфонамидо)метил)никотината, 0,350 г, 92,3%, желтое твердое вещество).
[1428] [Стадия 4] метил 6-(((1-метил-N-фенилпиперидин)-4-сульфонамидо)метил)никотинат
[1429] 
[1430] К раствору гидрохлорида метил 6-((N-фенилпиперидин-4-сульфонамидо)метил)никотината (0,200 г, 0,470 ммоль) и формальдегида (0,141 г, 4,696 ммоль) в дихлорметане (10 мл) добавляли уксусную кислоту (0,032 мл, 0,563 ммоль) при комнатной температуре и смесь перемешивали при той же температуре в течение 30 мин. Реакционную смесь обрабатывали триацетоксиборгидридом натрия (0,199 г, 0,939 ммоль) и перемешивали в течение дополнительных 12 ч при той же температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением метил 6-(((1-метил-N-фенилпиперидин)-4-сульфонамидо)метил)никотината в виде желтого масла (0,142 г, 74,9%).
[1431] [Стадия 5] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-метил-N-фенилпиперидин-4-сульфонамид
[1432] 
[1433] Смесь метил 6-(((1-метил-N-фенилпиперидин)-4-сульфонамидо)метил)никотината (0,142 г, 0,352 ммоль) и моногидрата гидразина (0,171 мл, 3,519 ммоль) в этаноле (10 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 12 ч, и охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-метил-N-фенилпиперидин-4-сульфонамид, 0,130 г, 91,5%, желтое твердое вещество).
[1434] [Стадия 6] Соединение 11367
[1435] 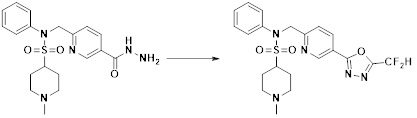
[1436] Смесь N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-метил-N-фенилпиперидин-4-сульфонамида (0,130 г, 0,322 ммоль), дифторуксусного ангидрида (0,062 г, 0,354 ммоль) и триэтиламина (0,054 мл, 0,387 ммоль) в тетрагидрофуране (10 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-1-метил-N-фенилпиперидин-4-сульфонамида в виде желтого твердого вещества (0,094 г, 62,9%).
[1437] 1H-ЯМР (400 МГц, CDCl3) δ 9,29-9,20 (м, 1H), 8,41-8,37 (м, 1H), 7,60-7,47 (м, 2H), 7,36-7,29 (м, 4H), 7,08 (с, 0,2H), 6,95 (с, 0,5H), 6,82 (с, 0,2H), 5,14 (с, 2H), 3,68-3,65 (м, 2H), 3,45-3,35 (м, 3H), 3,17-3,10 (м, 2H), 2,84 (с, 3H), 2,64-2,49 (м, 2H); LRMS (ES) m/z 464,4 (M++1).
[1438] Пример 101. Соединение 11368: N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-1-этил-N-фенилпиперидин-4-сульфонамид
[1439] [Стадия 1] метил 6-(((1-этил-N-фенилпиперидин)-4-сульфонамидо)метил)никотинат
[1440] 
[1441] К раствору гидрохлорида метил 6-((N-фенилпиперидин-4-сульфонамидо)метил)никотината (0,200 г, 0,470 ммоль) и ацетальдегида (0,207 г, 4,696 ммоль) в дихлорметане (10 мл) добавляли уксусную кислоту (0,032 мл, 0,563 ммоль) при комнатной температуре и смесь перемешивали при той же температуре в течение 30 мин. Реакционную смесь обрабатывали триацетоксиборгидридом натрия (0,199 г, 0,939 ммоль) и перемешивали в течение дополнительных 12 ч при той же температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением метил 6-(((1-этил-N-фенилпиперидин)-4-сульфонамидо)метил)никотината в виде желтого масла (0,139 г, 70,9%).
[1442] [Стадия 2] 1-этил-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилпиперидин-4-сульфонамид
[1443] 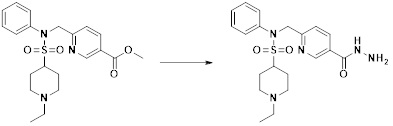
[1444] Смесь метил 6-(((1-этил-N-фенилпиперидин)-4-сульфонамидо)метил)никотината (0,139 г, 0,333 ммоль) и моногидрата гидразина (0,162 мл, 3,329 ммоль) в этаноле (10 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 12 ч, охлаждали до температуры окружающей среды и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (1-этил-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилпиперидин-4-сульфонамид, 0,120 г, 86,3%, белое твердое вещество).
[1445] [Стадия 3] Соединение 11368
[1446] 
[1447] Смесь 1-этил-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилпиперидин-4-сульфонамида (0,120 г, 0,287 ммоль), дифторуксусного ангидрида (0,055 г, 0,316 ммоль) и триэтиламина (0,048 мл, 0,345 ммоль) в тетрагидрофуране (10 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-1-этил-N-фенилпиперидин-4-сульфонамида в виде белого твердого вещества (0,082 г, 59,7%).
[1448] 1H-ЯМР (400 МГц, CDCl3) δ 9,30-9,20 (м, 1H), 8,40-8,34 (м, 1H), 7,55-7,54 (м, 1H), 7,47-7,45 (м, 1H), 7,41-7,29 (м, 4H), 7,08 (с, 0,2H), 6,95 (с, 0,5H), 6,82 (с, 0,2H), 5,14 (с, 2H), 3,80-3,65 (м, 2H), 3,45-3,31 (м, 2H), 3,29-3,07 (м, 3H), 2,70-2,61 (м, 2H), 2,55-2,50 (м, 2H), 1,41-1,26 (м, 3H); LRMS (ES) m/z 478,4 (M++1).
[1449] Пример 102: Соединение 11372, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-метил-N-фенилпиперидин-4-сульфонамид
[1450] [Стадия 1] трет-бутил 4-(N-(2-фтор-4-(метоксикарбонил)бензил)-N-фенилсульфамоил)пиперидин-1-карбоксилат
[1451] 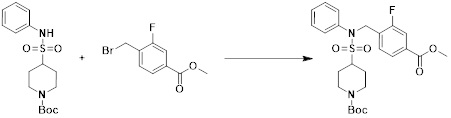
[1452] Раствор метил 4-(бромметил)-3-фторбензоата (0,610 г, 2,467 ммоль) и йодида калия (0,039 г, 0,235 ммоль) в N,N-диметилформамиде (8 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с трет-бутил 4-(N-фенилсульфамоил)пиперидин-1-карбоксилатом (0,800 г, 2,350 ммоль) и карбонатом калия (0,422 г, 3,055 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 70%) с получением трет-бутил 4-(N-(2-фтор-4-(метоксикарбонил)бензил)-N-фенилсульфамоил)пиперидин-1-карбоксилата в виде белого твердого вещества (1,100 г, 92,4%).
[1453] [Стадия 2] гидрохлорид метил 3-фтор-4-((N-фенилпиперидин-4-сульфонамидо)метил)бензоата
[1454] 
[1455] Раствор трет-бутил 4-(N-(2-фтор-4-(метоксикарбонил)бензил)-N-фенилсульфамоил)пиперидин-1-карбоксилата (1,100 г, 2,171 ммоль) в дихлорметане (10 мл) смешивали при комнатной температуре с хлористоводородной кислотой (0,158 г, 4,343 ммоль). Реакционную смесь перемешивали при той же температуре в течение 5 ч. Преципитат собирали фильтрацией, промывали дихлорметаном и сушили с получением гидрохлорида метил 3-фтор-4-((N-фенилпиперидин-4-сульфонамидо)метил)бензоата в виде белого твердого вещества (0,850 г, 88,4%).
[1456] [Стадия 3] метил 3-фтор-4-(((1-метил-N-фенилпиперидин)-4-сульфонамидо)метил)бензоат
[1457] 
[1458] Раствор метил гидрохлорида 3-фтор-4-((N-фенилпиперидин-4-сульфонамидо)метил)бензоата (0,100 г, 0,226 ммоль), формальдегида (0,034 г, 1,129 ммоль) и уксусной кислоты (0,006 мл, 0,113 ммоль) в метаноле (2 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с цианоборгидридом натрия (0,043 г, 0,677 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 5 ч и концентрировали при пониженном давлении для удаления растворителя. Затем к концентрату добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 10%) с получением метил 3-фтор-4-(((1-метил-N-фенилпиперидин)-4-сульфонамидо)метил)бензоата в виде белого твердого вещества (0,080 г, 84,3%).
[1459] [Стадия 4] N-(2-фтор-4-(гидразинкарбонил)бензил)-1-метил-N-фенилпиперидин-4-сульфонамид
[1460] 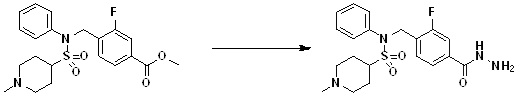
[1461] Смесь метил 3-фтор-4-(((1-метил-N-фенилпиперидин)-4-сульфонамидо)метил)бензоата (0,080 г, 0,190 ммоль) и моногидрата гидразина (0,028 мл, 0,571 ммоль) в этаноле (3 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 16 ч, охлаждали до температуры окружающей среды и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением N-(2-фтор-4-(гидразинкарбонил)бензил)-1-метил-N-фенилпиперидин-4-сульфонамида в виде белого твердого вещества (0,075 г, 93,8%).
[1462] [Стадия 5] Соединение 11372
[1463] 
[1464] К раствору N-(2-фтор-4-(гидразинкарбонил)бензил)-1-метил-N-фенилпиперидин-4-сульфонамида (0,069 г, 0,164 ммоль) в тетрагидрофуране (2 мл) добавляли триэтиламин (0,046 мл, 0,327 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,027 мл, 0,245 ммоль), нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-метил-N-фенилпиперидин-4-сульфонамида в виде белого твердого вещества (0,055 г, 70,0%).
[1465] 1H-ЯМР (400 МГц, CDCl3) δ 7,85 (дд, 1 H, J=8,0, 1,6 Гц), 7,69 (д, 1 H, J=16,4 Гц), 7,62 (т, 1 H, J=7,4 Гц), 7,37-7,26 (м, 5 H), 7,02 (с, 0,25 H), 6,89 (с, 0,5 H), 6,76 (с, 0,25 H), 5,06 (с, 2 H), 3,19 (м, 3 H), 2,51-2,42 (м, 4 H), 2,28-2,04 (м, 5 H); LRMS (ES) m/z 481,21 (M++1).
[1466] Пример 103: Соединение 11373, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-этил-N-фенилпиперидин-4-сульфонамид
[1467] [Стадия 1] метил 4-(((1-этил-N-фенилпиперидин)-4-сульфонамидо)метил)-3-фторбензоат
[1468] 
[1469] Раствор гидрохлорида метил 3-фтор-4-((N-фенилпиперидин-4-сульфонамидо)метил)бензоата (0,100 г, 0,226 ммоль) и ацетальдегида (0,038 мл, 0,677 ммоль) в метаноле (2 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с цианоборгидридом натрия (0,043 г, 0,677 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 5 ч. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 100%) с получением метил 4-(((1-этил-N-фенилпиперидин)-4-сульфонамидо)метил)-3-фторбензоата в виде белого твердого вещества (0,080 г, 81,5%).
[1470] [Стадия 2] 1-этил-N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилпиперидин-4-сульфонамид
[1471] 
[1472] Смесь метил 4-(((1-этил-N-фенилпиперидин)-4-сульфонамидо)метил)-3-фторбензоата (0,080 г, 0,184 ммоль) и моногидрата гидразина (0,045 мл, 0,921 ммоль) в этаноле (3 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 18 ч, охлаждали до температуры окружающей среды и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой, и сушили с получением 1-этил-N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилпиперидин-4-сульфонамида в виде белого твердого вещества (0,070 г, 87,5%).
[1473] [Стадия 3] Соединение 11373
[1474] 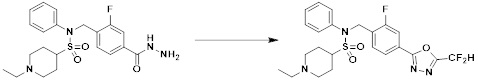
[1475] К раствору 1-этил-N-(2-фтор-4-(гидразинкарбонил)бензил)-N-фенилпиперидин-4-сульфонамида (0,063 г, 0,145 ммоль) в тетрагидрофуране (2 мл) добавляли триэтиламин (0,040 мл, 0,289 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,024 мл, 0,217 ммоль), нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-этил-N-фенилпиперидин-4-сульфонамида в виде белого твердого вещества (0,055 г, 77,0%).
[1476] 1H-ЯМР (400 МГц, CDCl3) δ 7,85 (дд, 1 H, J=8,1, 1,6 Гц), 7,69 (дд, 1 H, J=9,8, 1,4 Гц), 7,64 (т, 1 H, J=6,7 Гц), 7,33-7,02 (м, 5 H), 7,02 (с, 0,25 H), 6,89 (с, 0,5 H), 6,76 (с, 0,25 H), 5,06 (с, 2H), 3,21 (м, 3 H), 2,65 (м, 3 H), 2,24 (м, 5 H), 1,24 (м, 3 H); LRMS (ES) m/z 495,18 (M++1).
[1477] Пример 104: Соединение 11377, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-(2-гидрокси-2-метилпропил)-N-фенилпиперидин-4-сульфонамид
[1478] [Стадия 1] этил 3-фтор-4-(((1-(2-гидрокси-2-метилпропил)-N-фенилпиперидин)-4-сульфонамидо)метил)бензоат
[1479] 
[1480] Смесь гидрохлорида метил 3-фтор-4-((N-фенилпиперидин-4-сульфонамидо)метил)бензоата (0,090 г, 0,203 ммоль), 2,2-диметилоксирана (0,073 г, 1,016 ммоль) и карбоната калия (0,056 г, 0,406 ммоль) в этаноле (6 мл) нагревали при 120°C в течение 30 мин под действием микроволнового излучения. Затем реакционную смесь концентрировали при пониженном давлении для удаления растворителя. Преципитат собирали фильтрацией, промывали водой и сушили с получением этил 3-фтор-4-(((1-(2-гидрокси-2-метилпропил)-N-фенилпиперидин)-4-сульфонамидо)метил)бензоата в виде белого твердого вещества (0,080 г, 79,9%).
[1481] [Стадия 2] N-(2-фтор-4-(гидразинкарбонил)бензил)-1-(2-гидрокси-2-метилпропил)-N-фенилпиперидин-4-сульфонамид
[1482] 
[1483] Смесь этил 3-фтор-4-(((1-(2-гидрокси-2-метилпропил)-N-фенилпиперидин)-4-сульфонамидо)метил)бензоата (0,080 г, 0,162 ммоль) и моногидрата гидразина (0,039 мл, 0,812 ммоль) в этаноле (2 мл), полученную при температуре окружающей среды, нагревали при температуре кипения с обратным холодильником в течение 16 ч, охлаждали до температуры окружающей среды и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением N-(2-фтор-4-(гидразинкарбонил)бензил)-1-(2-гидрокси-2-метилпропил)-N-фенилпиперидин-4-сульфонамида в виде белого твердого вещества (0,065 г, 83,6%).
[1484] [Стадия3] Соединение 11377
[1485] 
[1486] К раствору N-(2-фтор-4-(гидразинкарбонил)бензил)-1-(2-гидрокси-2-метилпропил)-N-фенилпиперидин-4-сульфонамида (0,043 г, 0,090 ммоль) в тетрагидрофуране (3 мл) добавляли триэтиламин (0,025 мл, 0,180 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,015 мл, 0,135 ммоль), нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 70%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-(2-гидрокси-2-метилпропил)-N-фенилпиперидин-4-сульфонамида в виде белого твердого вещества (0,015 г, 31,0%).
[1487] 1H-ЯМР (400 МГц, CDCl3) δ 7,85 (дд, 1 H, J=8,0, 1,5 Гц), 7,70 (дд, 1 H, J=9,9, 1,5 Гц), 7,63 (т, 1 H, J=7,6 Гц), 7,35-7,27 (м, 5 H), 7,02 (с, 0,25 H), 6,89 (с, 0,5 H), 6,76 (с, 0,25 H), 5,05 (с, 2 H), 3,24 (м, 2 H), 3,14 (м, 1 H), 2,63-2,54 (м, 4 H), 2,23-2,16 (м, 4 H), 1,25 (с, 6 H); LRMS (ES) m/z 539,54 (M++1).
[1488] Пример 105: Соединение 11386, N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[1489] [Стадия 1] трет-бутил 4-(4-нитробензил)пиперазин-1-карбоксилат
[1490] 
[1491] Раствор 1-(бромметил)-4-нитробензола (1,000 г, 4,629 ммоль), N,N-диизопропилэтиламина (1,209 мл, 6,943 ммоль) и трет-бутилпиперазин-1-карбоксилата (0,948 г, 5,092 ммоль) в ацетонитриле (50 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 20%) с получением трет-бутил 4-(4-нитробензил)пиперазин-1-карбоксилата в виде желтого масла (1,100 г, 73,9%).
[1492] [Стадия 2] трет-бутил 4-(4-аминобензил)пиперазин-1-карбоксилат
[1493] 
[1494] Раствор трет-бутил 4-(4-нитробензил)пиперазин-1-карбоксилата (1,100 г, 3,423 ммоль), хлорида аммония (0,915 г, 17,114 ммоль) и Zn-пыли (1,119 г, 17,114 ммоль) в смеси тетрагидрофуран (20 мл)/вода (20 мл) перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь фильтровали для удаления твердых веществ. Затем к фильтрату добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (трет-бутил 4-(4-аминобензил)пиперазин-1-карбоксилат, 0,900 г, 90,2%, желтое твердое вещество).
[1495] [Стадия 3] трет-бутил 4-(4-(этилсульфонамидо)бензил)пиперазин-1-карбоксилат
[1496] 
[1497] Раствор трет-бутил 4-(4-аминобензил)пиперазин-1-карбоксилата (0,900 г, 3,089 ммоль), пиридина (0,299 мл, 3,706 ммоль) и этансульфонилхлорида (0,477 г, 3,706 ммоль) в дихлорметане (30 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением трет-бутил 4-(4-(этилсульфонамидо)бензил)пиперазин-1-карбоксилата в виде желтого твердого вещества (0,800 г, 67,5%).
[1498] [Стадия 4] трет-бутил 4-(4-(N-((5-(метоксикарбонил)пиридин-2-ил)метил)этилсульфонамидо)бензил)пиперазин-1-карбоксилат
[1499] 
[1500] Раствор метил 6-(бромметил)никотината (0,528 г, 2,295 ммоль) и йодида калия (0,069 г, 0,417 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с трет-бутил 4-(4-(этилсульфонамидо)бензил)пиперазин-1-карбоксилатом (0,800 г, 2,086 ммоль) и карбонатом калия (0,432 г, 3,129 ммоль). Реакционную смесь перемешивали при 50°C в течение дополнительных 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением трет-бутил 4-(4-(N-((5-(метоксикарбонил)пиридин-2-ил)метил)этилсульфонамидо)бензил)пиперазин-1-карбоксилата в виде желтого твердого вещества (0,623 г, 56,1%).
[1501] [Стадия 5] гидрохлорид метил 6-((N-(4-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)никотината
[1502] 
[1503] Раствор трет-бутил 4-(4-(N-((5-(метоксикарбонил)пиридин-2-ил)метил)этилсульфонамидо)бензил)пиперазин-1-карбоксилата (0,623 г, 1,170 ммоль) и хлористоводородной кислоты (4,00 M раствор в 1,4-диоксане, 1,170 мл, 4,678 ммоль) в дихлорметане (30 мл) перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь концентрировали при пониженном давлении для удаления растворителя, а затем указанное в заголовке соединение использовали без дальнейшей очистки (гидрохлорид метил 6-((N-(4-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)никотината, 0,500 г, 91,2%, желтое твердое вещество).
[1504] [Стадия 6] метил 6-((N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)никотинат
[1505] 
[1506] Раствор гидрохлорида метил 6-((N-(4-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)никотината (0,150 г, 0,320 ммоль), триэтиламина (0,067 мл, 0,480 ммоль) и уксусного ангидрида (0,042 г, 0,416 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением метил 6-((N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)никотината в виде желтого масла (0,090 г, 59,3%).
[1507] [Стадия 7] N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1508] 
[1509] Раствор метил 6-((N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)никотината (0,090 г, 0,190 ммоль) и гидрата гидразина (0,095 г, 1,896 ммоль) в этаноле (5 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,071 г, 78,9%, белое твердое вещество).
[1510] [Стадия 8] Соединение 11386
[1511] 
[1512] Смесь N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,072 г, 0,152 ммоль), триэтиламина (0,085 мл, 0,607 ммоль) и 2,2-дифторуксусного ангидрида (0,033 мл, 0,303 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамида в виде желтого твердого вещества (0,026 г, 32,1%).
[1513] 1H-ЯМР (400 МГц, CDCl3) δ 9,23 (дд, 1H, J=2,2, 0,9 Гц), 8,39 (дд, 1H, J=8,2, 2,2 Гц), 7,77 (д, 1H, J=8,3 Гц), 7,39 (с, 4H), 6,95 (м, 1H), 5,18 (с, 2H), 3,62 (с, 3H), 3,50 (с, 3H), 3,22 (кв, 2H, J=7,4 Гц), 2,43 (с, 4H), 2,09 (с, 3H), 1,47 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 535,34 (M++1).
[1514] Пример 106: Соединение 11387, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этансульфонамид
[1515] [Стадия 1] метил 6-((N-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)никотинат
[1516] 
[1517] Раствор гидрохлорида метил 6-((N-(4-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)никотината (0,150 г, 0,320 ммоль), триэтиламина (0,067 мл, 0,480 ммоль) и метансульфонилхлорида (0,032 мл, 0,416 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением метил 6-((N-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)никотината в виде желтого масла (0,094 г, 57,6%).
[1518] [Стадия 2] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этансульфонамид
[1519] 
[1520] Раствор метил 6-((N-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)никотината (0,094 г, 0,184 ммоль) и гидрата гидразина (0,092 г, 1,841 ммоль) в этаноле (5 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этансульфонамид, 0,069 г, 73,4%, белое твердое вещество).
[1521] [Стадия 3] Соединение 11387
[1522] 
[1523] Смесь N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этансульфонамида (0,090 г, 0,176 ммоль), триэтиламина (0,098 мл, 0,705 ммоль) и 2,2-дифторуксусного ангидрида (0,038 мл, 0,353 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 5 ч, и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(4-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этансульфонамида в виде желтого твердого вещества (0,031 г, 30,8%).
[1524] 1H-ЯМР (400 МГц, CDCl3) δ 9,22 (тд, 1H, J=2,2, 0,9 Гц), 8,39 (дд, 1H, J=8,2, 2,2 Гц), 7,70 (ддд, 1H, J=8,2, 4,7, 0,9 Гц), 7,53-7,44 (м, 2H), 7,46-7,37 (м, 2H), 7,11-6,80 (м, 1H), 5,17 (с, 2H), 3,72 (с, 1H), 3,55-3,50 (м, 3H), 3,22 (кв, 2H, J=7,4 Гц), 3,06 (с, 4H), 2,84 (с, 3H), 1,44 (с, 5H); LRMS (ES) m/z 571,37 (M++1).
[1525] Пример 107: Соединение 11388, N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[1526] [Стадия 1] трет-бутил 4-(3-нитробензил)пиперазин-1-карбоксилат
[1527] 
[1528] Раствор 1-(бромметил)-3-нитробензола (1,000 г, 4,629 ммоль), N,N-диизопропилэтиламина (1,209 мл, 6,943 ммоль) и трет-бутилпиперазин-1-карбоксилата (0,948 г, 5,092 ммоль) в ацетонитриле (20 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 20%) с получением трет-бутил 4-(3-нитробензил)пиперазин-1-карбоксилата в виде желтого масла (1,050 г, 70,6%).
[1529] [Стадия 2] трет-бутил 4-(3-аминобензил)пиперазин-1-карбоксилат
[1530] 
[1531] Раствор трет-бутил 4-(3-нитробензил)пиперазин-1-карбоксилата (1,050 г, 3,267 ммоль), хлорида аммония (0,874 г, 16,336 ммоль) и цинковой пыли (1,068 г, 16,336 ммоль) в смеси тетрагидрофуран (20 мл)/вода (20 мл) перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь фильтровали для удаления твердых веществ. Затем к фильтрату добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (трет-бутил 4-(3-аминобензил)пиперазин-1-карбоксилат, 0,940 г, 98,7%, желтое твердое вещество).
[1532] [Стадия 3] трет-бутил 4-(3-(этилсульфонамидо)бензил)пиперазин-1-карбоксилат
[1533] 
[1534] Раствор трет-бутил 4-(3-аминобензил)пиперазин-1-карбоксилата (0,940 г, 3,226 ммоль), пиридина (0,312 мл, 3,871 ммоль) и этансульфонилхлорида (0,456 г, 3,548 ммоль) в дихлорметане (30 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, separated, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением трет-бутил 4-(3-(этилсульфонамидо)бензил)пиперазин-1-карбоксилата в виде желтого твердого вещества (1,080 г, 87,3%).
[1535] [Стадия 4] трет-бутил 4-(3-(N-((5-(метоксикарбонил)пиридин-2-ил)метил)этилсульфонамидо)бензил)пиперазин-1-карбоксилат
[1536] 
[1537] Раствор метил 6-(бромметил)никотината (0,713 г, 3,098 ммоль) и йодида калия (0,093 г, 0,563 ммоль) в N,N-диметилформамиде (30 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с трет-бутил 4-(3-(этилсульфонамидо)бензил)пиперазин-1-карбоксилатом (1,080 г, 2,816 ммоль) и карбонатом калия (0,584 г, 4,224 ммоль). Реакционную смесь перемешивали при 50°C в течение дополнительных 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением трет-бутил 4-(3-(N-((5-(метоксикарбонил)пиридин-2-ил)метил)этилсульфонамидо)бензил)пиперазин-1-карбоксилата в виде желтого твердого вещества (0,616 г, 41,1%).
[1538] [Стадия 5] гидрохлорид метил 6-((N-(3-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)никотината
[1539] 
[1540] Раствор трет-бутил 4-(3-(N-((5-(метоксикарбонил)пиридин-2-ил)метил)этилсульфонамидо)бензил)пиперазин-1-карбоксилата (0,616 г, 1,156 ммоль) и хлористоводородной кислоты (4,00 M раствор в 1,4-диоксане, 1,156 мл, 4,626 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 5 ч, и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (гидрохлорид метил 6-((N-(3-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)никотината, 0,520 г, 95,9%, желтое твердое вещество).
[1541] [Стадия 6] метил 6-((N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)никотинат
[1542] 
[1543] Раствор гидрохлорида метил 6-((N-(3-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)никотината (0,150 г, 0,320 ммоль), триэтиламина (0,067 мл, 0,480 ммоль) и уксусного ангидрида (0,039 г, 0,384 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением метил 6-((N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,094 г, 61,9%).
[1544] [Стадия 7] N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1545] 
[1546] Раствор метил 6-((N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)никотината (0,094 г, 0,198 ммоль) и гидрата гидразина (0,099 г, 1,981 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,064 г, 68,1%, белое твердое вещество).
[1547] [Стадия 8] Соединение 11388
[1548] 
[1549] Смесь N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,061 г, 0,129 ммоль), триэтиламина (0,072 мл, 0,514 ммоль) и 2,2-дифторуксусного ангидрида (0,028 мл, 0,257 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамида в виде желтого твердого вещества (0,018 г, 26,2%).
[1550] 1H-ЯМР (400 МГц, CDCl3) δ 9,21 (д, 1H, J=2,2 Гц), 8,38 (дд, 1H, J=8,2, 2,2 Гц), 7,76 (д, 1H, J=8,2 Гц), 7,44 (с, 1H), 7,35-7,23 (м, 3H), 7,13-6,77 (м, 1H), 5,18 (с, 2H), 3,88-3,33 (м, 6H), 3,21 (кв, 2H, J=7,4 Гц), 2,40 (с, 4H), 2,08 (с, 3H), 1,46 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 535,47 (M++1).
[1551] Пример 108: Соединение 11389, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)метансульфонамид
[1552] [Стадия 1] (трет-бутил (4-цианобензил)карбамат
[1553] 
[1554] К раствору гидрохлорида 4-(аминометил)бензонитрила (5,000 г, 29,652 ммоль) в дихлорметане (20 мл) добавляли триэтиламин (4,932 мл, 35,583 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали при той же температуре ди-трет-бутилдикарбонатом (6,795 г, 31,135 ммоль) и перемешивали в течение дополнительных 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (трет-бутил (4-цианобензил)карбамат, 6,850 г, 99,5%, белое твердое вещество).
[1555] [Стадия 2] трет-бутил (Z)-4-(N'-гидроксикарбамимидоил)бензилкарбамат
[1556] 
[1557] Смесь трет-бутил 4-цианобензилкарбамата (6,800 г, 29,275 ммоль), NH2OH (6,103 г, 87,825 ммоль), Na2CO3 (9,309 г, 87,825 ммоль) и NH2OH (50,00% раствор в воде, 5,372 мл, 87,825 ммоль) в этаноле (20 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 14 ч, охлаждали до температуры окружающей среды и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением трет-бутил (Z) -4-(N'-гидроксикарбамимидоил)бензилкарбамата в виде белого твердого вещества (7,500 г, 96,6%).
[1558] [Стадия 3] трет-бутил (4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)карбамат
[1559] 
[1560] К раствору трет-бутил (Z)-(4-(N'-гидроксикарбамимидоил)бензил)карбамата (7,800 г, 29,400 ммоль) в N,N-диметилформамиде (25 мл) добавляли триэтиламин (5,298 мл, 38,219 ммоль) при 0°C и смесь перемешивали при той же температуре. Реакционную смесь обрабатывали TFAA (4,305 мл, 32,340 ммоль) при 80°C, перемешивали в течение дополнительных 2 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для завершения реакции. Затем к реакционной смеси добавляли водный раствор хлорида аммония, а затем проводили экстракцию этилацетатом. Органический слой промывали рассолом, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 80g; этилацетат/гексан=от 0% до 30%) с получением трет-бутил (4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)карбамата в виде бесцветного масла (5,240 г, 51,9%).
[1561] [Стадия 4] гидрохлорид (4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)метанамина
[1562] 
[1563] Раствор трет-бутил (4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)карбамата (5,240 г, 15,263 ммоль) в дихлорметане (20 мл), полученный при комнатной температуре, смешивали с HCl (4,00 M раствор, 4,197 мл, 16,789 ммоль). Реакционную смесь перемешивали при той же температуре в течение 1 ч. Преципитат собирали фильтрацией, промывали дихлорметаном и сушили с получением гидрохлорида (4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)метанамина в виде белого твердого вещества (3,900 г, 91,4%).
[1564] [Стадия 5] N-(4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)метансульфонамид
[1565] 
[1566] К раствору гидрохлорида (4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)метанамина (0,100 г, 0,358 ммоль) в дихлорметане (4 мл) добавляли триэтиламин (0,060 мл, 0,429 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали при той же температуре метансульфонилхлоридом (0,028 мл, 0,358 ммоль) и перемешивали в течение дополнительных 3 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)метансульфонамид, 0,110 г, 95,7%, белое твердое вещество).
[1567] [Стадия 6] N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)метансульфонамид
[1568] 
[1569] Раствор 2-(4-(бромметил)-3-фторфенил)-5-(дифторметил)-1,3,4-оксадиазола (0,043 г, 0,141 ммоль) и йодида калия (0,004 г, 0,027 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с N-(4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)метансульфонамидом (0,043 г, 0,134 ммоль) и карбонатом калия (0,028 г, 0,201 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 8 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 35%) с получением N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)метансульфонамида в виде желтого твердого вещества (0,050 г, 66,1%).
[1570] [Стадия 7] Соединение 11389
[1571] 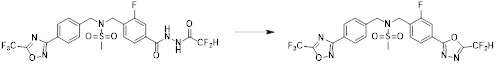
[1572] Смесь N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)-N-(4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)метансульфонамида (0,050 г, 0,088 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,063 г, 0,265 ммоль) в тетрагидрофуране (4 мл) нагревали при 130°C в течение 30 мин под действием микроволнового излучения. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 25%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(4-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)метансульфонамида в виде белого твердого вещества (0,025 г, 51,6%).
[1573] 1H-ЯМР (400 МГц, DMSO-D6) δ 7,94 (д, 2 H, J=8,3 Гц), 7,78 (дд, 1 H, J=25,9, 17,9 Гц), 7,70-7,67 (м, 1,25 H), 7,62 (т, 5 H, J=7,8 Гц), 7,56 (с, 0,5 H), 7,50 (д, 1 H, J=8,3 Гц), 7,43 (с, 0,25 H), 4,60 (с, 2 H), 4,55 (с, 2 H), 3,17 (с, 3 H); LRMS (ES) m/z 548,38 (M++1).
[1574] Пример 109: Соединение 11390, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-пиран-4-сульфонамид
[1575] [Стадия 1] N-фенилтетрагидро-2H-пиран-4-сульфонамид
[1576] 
[1577] Раствор анилина (0,294 мл, 3,221 ммоль) и триэтиламина (0,539 мл, 3,866 ммоль) в дихлорметане (8 мл) перемешивали при 0°C в течение 10 мин и смешивали с тетрагидро-2H-пиран-4-сульфонилхлоридом (0,624 г, 3,382 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 6 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением N-фенилтетрагидро-2H-пиран-4-сульфонамида в виде светло-желтого масла (0,650 г, 83,6%).
[1578] [Стадия 2] метил 6-(((N-фенилтетрагидро-2H-пиран)-4-сульфонамидо)метил)никотинат
[1579] 
[1580] Раствор метил 6-(бромметил)никотината (0,497 г, 2,158 ммоль) и йодида калия (0,068 г, 0,411 ммоль) в N,N-диметилформамиде (8 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с N-фенилтетрагидро-2H-пиран-4-сульфонамидом (0,496 г, 2,055 ммоль) и карбонатом калия (0,369 г, 2,672 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-(((N-фенилтетрагидро-2H-пиран)-4-сульфонамидо)метил)никотината в виде желтого твердого вещества (0,650 г, 81,0%).
[1581] [Стадия 3] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-пиран-4-сульфонамид
[1582] 
[1583] Смесь метил 6-(((N-фенилтетрагидро-2H-пиран)-4-сульфонамидо)метил)никотината (0,650 г, 1,665 ммоль) и моногидрата гидразина (0,405 мл, 8,324 ммоль) в этаноле (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 8 ч, охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-пиран-4-сульфонамида в виде белого твердого вещества (0,580 г, 89,2%).
[1584] [Стадия 4] Соединение 11390
[1585] 
[1586] К раствору N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-пиран-4-сульфонамида (0,054 г, 0,138 ммоль) в тетрагидрофуране (2 мл) добавляли триэтиламин (0,039 мл, 0,277 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,023 мл, 0,207 ммоль), нагревали при температуре кипения с обратным холодильником в течение 3 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-пиран-4-сульфонамида в виде белого твердого вещества (0,055 г, 88,3%).
[1587] 1H-ЯМР (400 МГц, CDCl3) δ 9,18 (д, 1 H, J=2,2 Гц), 8,38 (дд, 1 H, J=8,2, 2,2 Гц), 7,75 (д, 1 H, J=8,2 Гц), 7,40 (м, 2 Гц), 7,35 (м, 2 H), 7,25 (м, 1 Гц), 7,05 (с, 0,25 H), 6,92 (с, 0,5 H), 6,79 (с, 0,25 H), 5,20 (с, 2 H), 4,11-4,07 (м, 2 H), 3,39-3,30 (м, 3 H), 2,20-1,99 (м, 4 H); LRMS (ES) m/z 451,35 (M++1).
[1588] Пример 110: Соединение 11392, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-((1,1-диоксидотиоморфолино)метил)фенил)этансульфонамид
[1589] [Стадия 1] 4-(3-нитробензил)тиоморфолин 1,1-диоксид
[1590] 
[1591] Раствор 1-(бромметил)-3-нитробензола (2,400 г, 11,110 ммоль), 1,1-диоксида тиоморфолина (1,427 г, 10,554 ммоль) и N,N-диизопропилэтиламина (2,516 мл, 14,442 ммоль) в ацетонитриле (16 мл) перемешивали при комнатной температуре в течение 24 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением 1,1-диоксида 4-(3-нитробензил)тиоморфолина в виде желтого твердого вещества (2,800 г, 93,2%).
[1592] [Стадия 2] 4-(3-аминобензил)тиоморфолин 1,1-диоксид
[1593] 
[1594] Раствор 1,1-диоксида 4-(3-нитробензил)тиоморфолина (2,750 г, 10,174 ммоль), цинка (2,661 г, 40,696 ммоль) и хлорида аммония (2,177 г, 40,696 ммоль) в смеси тетрагидрофуран (10 мл)/вода (5 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь фильтровали через бумажный фильтр для удаления твердых веществ. Затем к фильтрату добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением 1,1-диоксида 4-(3-аминобензил)тиоморфолина в виде желтого твердого вещества (2,100 г, 85,9%).
[1595] [Стадия 3] N-(3-((1,1-диоксидотиоморфолино)метил)фенил)этансульфонамид
[1596] 
[1597] Раствор 1,1-диоксида 4-(3-аминобензил)тиоморфолина (1,000 г, 4,161 ммоль) и пиридина (0,402 мл, 4,993 ммоль) в дихлорметане (20 мл) смешивали при 0°C с этансульфонилхлоридом (0,387 мл, 4,369 ммоль) и перемешивали при той же температуре в течение 20 мин. Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 16 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением N-(3-((1,1-диоксидотиоморфолино)метил)фенил)этансульфонамида в виде светло-желтого твердого вещества (1,200 г, 86,8%).
[1598] [Стадия 4] метил 4-((N-(3-((1,1-диоксидотиоморфолино)метил)фенил)этилсульфонамидо)метил)-3-фторбензоат
[1599] 
[1600] Раствор метил 4-(бромметил)-3-фторбензоата (0,531 г, 2,148 ммоль) и йодида калия (0,068 г, 0,409 ммоль) в N,N-диметилформамиде (8 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с N-(3-((1,1-диоксидотиоморфолино)метил)фенил)этансульфонамидом (0,680 г, 2,046 ммоль) и карбонатом калия (0,368 г, 2,659 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 8 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 70%) с получением метил 4-((N-(3-((1,1-диоксидотиоморфолино)метил)фенил)этилсульфонамидо)метил)-3-фторбензоата в виде белого твердого вещества (0,880 г, 86,3%).
[1601] [Стадия 5] N-(3-((1,1-диоксидотиоморфолино)метил)фенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этансульфонамид
[1602] 
[1603] Смесь метил 4-((N-(3-((1,1-диоксидотиоморфолино)метил)фенил)этилсульфонамидо)метил)-3-фторбензоата (0,880 г, 1,765 ммоль) и моногидрата гидразина (0,257 мл, 5,295 ммоль) в этаноле (8 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 14 ч, охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли насыщенным водным раствором бикарбоната натрия и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой, и сушили с получением N-(3-((1,1-диоксидотиоморфолино)метил)фенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этансульфонамида в виде белого твердого вещества (0,850 г, 96,6%).
[1604] [Стадия 6] Соединение 11392
[1605] 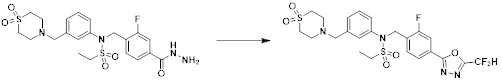
[1606] К раствору N-(3-((1,1-диоксидотиоморфолино)метил)фенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этансульфонамида (0,050 г, 0,100 ммоль) в тетрагидрофуране (2 мл) добавляли триэтиламин (0,028 мл, 0,201 ммоль) при комнатной температуре и смесь перемешивали в течение 10 мин при той же температуре. Реакционную смесь обрабатывали 2,2-дифторуксусным ангидридом (0,016 мл, 0,150 ммоль), нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 80%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-((1,1-диоксидотиоморфолино)метил)фенил)этансульфонамида в виде белого твердого вещества (0,045 г, 80,3%).
[1607] 1H-ЯМР (400 МГц, CDCl3) δ 7,86 (дд, 1 H, J=8,1, 1,5 Гц), 7,84-7,66 (м, 2 H), 7,32-7,28 (м, 2 Гц), 7,25 -ЕЕ7,21 (м, 2 Гц), 7,02 (с, 0,25 H), 6,89 (с, 0,5 H), 6,77 (с, 0,25 H), 5,03 (с, 2 H), 3,62 (м, 2 H), 3,13 (кв, 2 H, J=7,4 Гц), 3,02 (м, 4 H), 2,87 (м, 4 H), 1,45 (т, 3 H, J=7,4 Гц); LRMS (ES) m/z 560,47 (M++1).
[1608] Пример 111: Соединение 11402, N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)этансульфонамид
[1609] [Стадия 1] трет-бутил 4-(4-(N-(2-фтор-4-(метоксикарбонил)бензил)этилсульфонамидо)бензил)пиперазин-1-карбоксилат
[1610] 
[1611] Раствор метил 4-(бромметил)-3-фторбензоата (0,454 г, 1,836 ммоль) и йодида калия (0,055 г, 0,334 ммоль) в N,N-диметилформамиде (30 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с трет-бутил 4-(4-(этилсульфонамидо)бензил)пиперазин-1-карбоксилатом (0,640 г, 1,669 ммоль) и карбонатом калия (0,346 г, 2,503 ммоль). Реакционную смесь перемешивали при 50°C в течение дополнительных 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением трет-бутил 4-(4-(N-(2-фтор-4-(метоксикарбонил)бензил)этилсульфонамидо)бензил)пиперазин-1-карбоксилата в виде желтого твердого вещества (0,780 г, 85,0%).
[1612] [Стадия 2] метил 3-фтор-4-((N-(4-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)бензоат гидрохлорид
[1613] 
[1614] Раствор трет-бутил 4-(4-(N-(2-фтор-4-(метоксикарбонил)бензил)этилсульфонамидо)бензил)пиперазин-1-карбоксилата (0,780 г, 1,419 ммоль) и хлористоводородной кислоты (4,00 M раствор в 1,4-диоксане, 1,419 мл, 5,676 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (гидрохлорид метил 3-фтор-4-((N-(4-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)бензоата, 0,680 г, 98,6%, белое твердое вещество).
[1615] [Стадия 3] метил 4-((N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)-3-фторбензоат
[1616] 
[1617] Раствор гидрохлорида метил 3-фтор-4-((N-(4-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)бензоата (0,200 г, 0,412 ммоль), триэтиламина (0,086 мл, 0,617 ммоль) и уксусного ангидрида (0,047 мл, 0,494 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (метил 4-((N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)-3-фторбензоат, 0,130 г, 64,3%, желтое масло).
[1618] [Стадия 4] N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этансульфонамид
[1619] 
[1620] Раствор метил 4-((N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)-3-фторбензоата (0,130 г, 0,264 ммоль) и моногидрата гидразина (0,129 мл, 2,645 ммоль) в этаноле (5 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этансульфонамид, 0,096 г, 73,8%, желтое твердое вещество).
[1621] [Стадия 5] Соединение 11402
[1622] 
[1623] Смесь N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этансульфонамида (0,096 г, 0,195 ммоль), триэтиламина (0,109 мл, 0,781 ммоль) и 2,2-дифторуксусного ангидрида (0,042 мл, 0,391 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(4-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)этансульфонамида в виде желтого масла (0,021 г, 19,5%).
[1624] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (дд, 1H, J=8,0, 1,7 Гц), 7,76-7,66 (м, 2H), 7,30 (т, 4H, J=4,7 Гц), 7,10-6,72 (м, 1H), 5,05 (с, 2H), 3,62 (с, 2H), 3,52-3,42 (м, 4H), 3,20-3,08 (м, 2H), 2,41 (с, 4H), 2,08 (д, 3H, J=1,5 Гц), 1,51-1,39 (м, 3H); LRMS (ES) m/z 552,45 (M++1).
[1625] Пример 112: Соединение 11403, N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)этансульфонамид
[1626] [Стадия 1] трет-бутил 4-(3-(N-(2-фтор-4-(метоксикарбонил)бензил)этилсульфонамидо)бензил)пиперазин-1-карбоксилат
[1627] 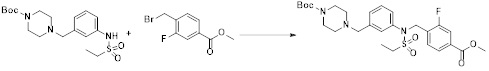
[1628] Раствор метил 4-(бромметил)-3-фторбензоата (0,454 г, 1,836 ммоль) и йодида калия (0,055 г, 0,334 ммоль) в N,N-диметилформамиде (30 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с трет-бутил 4-(3-(этилсульфонамидо)бензил)пиперазин-1-карбоксилатом (0,640 г, 1,669 ммоль) и карбонатом калия (0,346 г, 2,503 ммоль). Реакционную смесь перемешивали при 50°C в течение дополнительных 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением трет-бутил 4-(3-(N-(2-фтор-4-(метоксикарбонил)бензил)этилсульфонамидо)бензил)пиперазин-1-карбоксилата в виде желтого твердого вещества (0,780 г, 85,0%).
[1629] [Стадия 2] метил 3-фтор-4-((N-(3-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)бензоат гидрохлорид
[1630] 
[1631] Раствор трет-бутил 4-(3-(N-(2-фтор-4-(метоксикарбонил)бензил)этилсульфонамидо)бензил)пиперазин-1-карбоксилата (0,780 г, 1,419 ммоль) и хлористоводородной кислоты (4,00 M раствор в 1,4-диоксане, 1,419 мл, 5,676 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (гидрохлорид метил 3-фтор-4-((N-(3-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)бензоата, 0,680 г, 98,6%, белое твердое вещество).
[1632] [Стадия 3] метил 4-((N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)-3-фторбензоат
[1633] 
[1634] Раствор гидрохлорида метил 3-фтор-4-((N-(3-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)бензоата (0,200 г, 0,412 ммоль), триэтиламина (0,086 мл, 0,617 ммоль) и уксусного ангидрида (0,050 мл, 0,535 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением метил 4-((N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)-3-фторбензоата в виде желтого масла (0,160 г, 79,1%).
[1635] [Стадия 4] N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этансульфонамид
[1636] 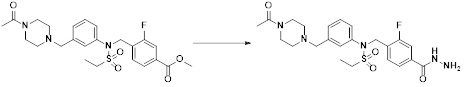
[1637] Раствор метил 4-((N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)-3-фторбензоата (0,160 г, 0,325 ммоль) и моногидрата гидразина (0,158 мл, 3,255 ммоль) в этаноле (5 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этансульфонамид, 0,096 г, 60,0%, желтое твердое вещество).
[1638] [Стадия 5] Соединение 11403
[1639] 
[1640] Смесь N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этансульфонамида (0,096 г, 0,195 ммоль), триэтиламина (0,109 мл, 0,781 ммоль) и 2,2-дифторуксусного ангидрида (0,042 мл, 0,391 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)этансульфонамида в виде белого твердого вещества (0,021 г, 19,5%).
[1641] 1H-ЯМР (400 МГц, CDCl3) δ 7,85 (дд, 1H, J=8,0, 1,6 Гц), 7,73-7,63 (м, 2H), 7,34-7,25 (м, 2H), 7,27-7,18 (м, 2H), 7,11-6,77 (м, 1H), 5,05 (с, 2H), 3,57 (д, 2H, J=6,2 Гц), 3,51-3,39 (м, 4H), 3,15 (кв, 2H, J=7,4 Гц), 2,33 (т, 4H, J=10,2 Гц), 2,06 (с, 3H), 1,45 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 552,51 (M++1).
[1642] Пример 113: Соединение 11404, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этансульфонамид
[1643] [Стадия 1] метил 3-фтор-4-((N-(3-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)бензоат
[1644] 
[1645] Раствор гидрохлорида метил 3-фтор-4-((N-(3-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)бензоата (0,200 г, 0,412 ммоль), триэтиламина (0,086 мл, 0,617 ммоль) и метансульфонилхлорида (0,041 мл, 0,535 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением метил 3-фтор-4-((N-(3-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)бензоата в виде желтого масла (0,130 г, 59,9%).
[1646] [Стадия 2] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этансульфонамид
[1647] 
[1648] Раствор метил 3-фтор-4-((N-(3-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)бензоата (0,130 г, 0,246 ммоль) и моногидрата гидразина (0,120 мл, 2,464 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этансульфонамид, 0,092 г, 70,8%, желтое твердое вещество).
[1649] [Стадия 3] Соединение 11404
[1650] 
[1651] Смесь N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этансульфонамида (0,160 г, 0,303 ммоль), триэтиламина (0,169 мл, 1,213 ммоль) и 2,2-дифторуксусного ангидрида (0,066 мл, 0,606 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 12 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)этансульфонамида в виде желтого масла (0,110 г, 61,7%).
[1652] 1H-ЯМР (400 МГц, CDCl3) δ 7,86 (дд, 1H, J=8,0, 1,7 Гц), 7,73-7,63 (м, 2H), 7,36-7,16 (м, 4H), 7,11-6,75 (м, 1H), 5,04 (с, 2H), 3,52 (с, 2H), 3,21-3,10 (м, 6H), 2,78 (с, 3H), 2,45 (с, 4H), 1,51-1,40 (м, 3H); LRMS (ES) m/z 588,48 (M++1).
[1653] Пример 114: Соединение 11405, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-((4-метилпиперазин-1-ил)метил)фенил)этансульфонамид
[1654] [Стадия 1] метил 3-фтор-4-((N-(3-((4-метилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)бензоат
[1655] 
[1656] Раствор гидрохлорида метил 3-фтор-4-((N-(3-(пиперазин-1-илметил)фенил)этилсульфонамидо)метил)бензоата (0,200 г, 0,412 ммоль), формальдегида (0,037 г, 1,235 ммоль) и уксусной кислоты (0,026 мл, 0,453 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с триацетоксиборгидридом (0,131 г, 0,617 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением метил 3-фтор-4-((N-(3-((4-метилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)бензоата в виде желтого масла (0,120 г, 62,9%).
[1657] [Стадия 2] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-((4-метилпиперазин-1-ил)метил)фенил)этансульфонамид
[1658] 
[1659] Раствор метил 3-фтор-4-((N-(3-((4-метилпиперазин-1-ил)метил)фенил)этилсульфонамидо)метил)бензоата (0,120 г, 0,259 ммоль) и моногидрата гидразина (0,126 мл, 2,589 ммоль) в этаноле (5 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-((4-метилпиперазин-1-ил)метил)фенил)этансульфонамид, 0,089 г, 74,2%, желтое твердое вещество).
[1660] [Стадия 3] Соединение 11405
[1661] 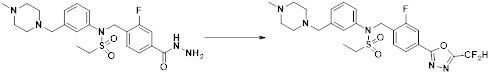
[1662] Смесь N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-((4-метилпиперазин-1-ил)метил)фенил)этансульфонамида (0,150 г, 0,324 ммоль), триэтиламина (0,180 мл, 1,294 ммоль) и 2,2-дифторуксусного ангидрида (0,070 мл, 0,647 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 12 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-((4-метилпиперазин-1-ил)метил)фенил)этансульфонамида в виде желтого масла (0,090 г, 53,1%).
[1663] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,1, 1,7 Гц), 7,75-7,65 (м, 2H), 7,34-7,18 (м, 4H), 7,12-6,73 (м, 1H), 5,06 (с, 2H), 3,50 (с, 2H), 3,15 (кв, 2H, J=7,4 Гц), 2,71-2,40 (м, 8H), 2,37 (с, 3H), 1,47 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 524,50 (M++1).
[1664] Пример 115: Соединение 11406, N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)этансульфонамид
[1665] 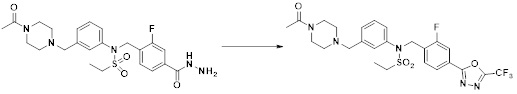
[1666] Смесь N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этансульфонамида (0,052 г, 0,106 ммоль), триэтиламина (0,059 мл, 0,423 ммоль) и трифторуксусного ангидрида (0,030 мл, 0,212 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 12 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 100%) с получением N-(3-((4-ацетилпиперазин-1-ил)метил)фенил)-N-(2-фтор-4-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)бензил)этансульфонамида в виде желтого твердого вещества (0,021 г, 34,9%).
[1667] 1H-ЯМР (400 МГц, CDCl3) δ 7,88 (дд, 1H, J=8,0, 1,6 Гц), 7,77-7,68 (м, 2H), 7,61 (с, 1H), 7,48-7,32 (м, 3H), 5,07 (с, 2H), 4,18 (с, 2H), 3,85 (с, 2H), 3,18 (кв, 3H, J=7,4 Гц), 3,07 (с, 5H), 2,13 (с, 3H), 1,46 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 570,56 (M++1).
[1668] Пример 116: Соединение 11411, N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[1669] [Стадия 1] N-(3-хлор-4-фторфенил)этансульфонамид
[1670] 
[1671] Раствор 3-хлор-4-фторанилина (2,000 г, 13,740 ммоль), пиридина (1,328 мл, 16,488 ммоль) и этансульфонилхлорида (1,943 г, 15,114 ммоль) в дихлорметане (100 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлор-4-фторфенил)этансульфонамид, 2,100 г, 64,3%, черное твердое вещество).
[1672] [Стадия 2] метил 6-((N-(3-хлор-4-фторфенил)этилсульфонамидо)метил)никотинат
[1673] 
[1674] Раствор метил 6-(бромметил)никотината (0,658 г, 2,861 ммоль) и йодида калия (0,086 г, 0,520 ммоль) в N,N-диметилформамиде (30 мл) смешивали с N-(3-хлор-4-фторфенил)этансульфонамидом (0,600 г, 2,601 ммоль) и карбонатом калия (0,539 г, 3,902 ммоль) при 50°C. Реакционную смесь перемешивали при той же температуре в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((N-(3-хлор-4-фторфенил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,510 г, 50,7%).
[1675] [Стадия 3] N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1676] 
[1677] Раствор метил 6-((N-(3-хлор-4-фторфенил)этилсульфонамидо)метил)никотината (0,510 г, 1,318 ммоль) и моногидрата гидразина (0,641 мл, 13,184 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,300 г, 58,8%, белое твердое вещество).
[1678] [Стадия 4] Соединение 11411
[1679] 
[1680] Раствор N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,150 г, 0,388 ммоль), триэтиламина (0,216 мл, 1,551 ммоль) и 2,2-дифторуксусного ангидрида (0,084 мл, 0,776 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамида в виде белого твердого вещества (0,092 г, 53,1%).
[1681] 1H-ЯМР (400 МГц, CDCl3) δ 9,26 (дд, 1H, J=2,3, 0,9 Гц), 8,42 (ддд, 1H, J=8,3, 2,3, 0,7 Гц), 7,70 (дд, 1H, J=8,2, 0,9 Гц), 7,54 (ддд, 1H, J=6,5, 2,7, 0,7 Гц), 7,38-7,26 (м, 1H), 7,16-7,09 (м, 1H), 7,09-6,81 (м, 1H), 5,13 (с, 2H), 3,21 (квд, 2H, J=7,4, 0,7 Гц), 1,45 (тд, 3H, J=7,4, 0,8 Гц); LRMS (ES) m/z 447,44 (M++1).
[1682] Пример 117: Соединение 11412, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилэтансульфонамид
[1683] [Стадия 1] N-фенилэтансульфонамид
[1684] 
[1685] К раствору анилина (0,980 мл, 10,738 ммоль) в дихлорметане (12 мл), полученному при 0°C, добавляли триэтиламин (1,946 мл, 13,959 ммоль) и смесь перемешивали в течение 20 мин при той же температуре. Реакционную смесь обрабатывали этансульфонилхлоридом (1,119 мл, 11,811 ммоль и перемешивали в течение дополнительных 24 ч при комнатной температуре. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 15%) с получением N-фенилэтансульфонамида в виде желтого масла (1,400 г, 70,4%).
[1686] [Стадия 2] метил 6-((N-фенилэтилсульфонамидо)метил)никотинат
[1687] 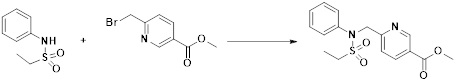
[1688] Раствор метил 6-(бромметил)никотината (0,710 г, 3,088 ммоль) и йодида калия (0,093 г, 0,561 ммоль) в N,N-диметилформамиде (30 мл) смешивали при комнатной температуре с N-фенилэтансульфонамидом (0,520 г, 2,807 ммоль) и карбонатом калия (0,582 г, 4,211 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 100%) с получением метил 6-((N-фенилэтилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,500 г, 53,3%).
[1689] [Стадия 3] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилэтансульфонамид
[1690] 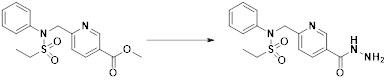
[1691] Раствор метил 6-((N-фенилэтилсульфонамидо)метил)никотината (0,300 г, 0,897 ммоль) и моногидрата гидразина (0,436 мл, 8,972 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилэтансульфонамид, 0,220 г, 73,3%, белое твердое вещество).
[1692] [Стадия 4] Соединение 11412
[1693] 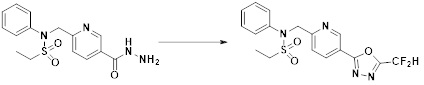
[1694] Раствор N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилэтансульфонамида (0,220 г, 0,658 ммоль), триэтиламина (0,367 мл, 2,632 ммоль) и 2,2-дифторуксусного ангидрида (0,143 мл, 1,316 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилэтансульфонамида в виде белого твердого вещества (0,120 г, 46,2%).
[1695] 1H-ЯМР (400 МГц, CDCl3) δ 9,23 (дд, 1H, J=2,2, 0,8 Гц), 8,42 (дд, 1H, J=8,3, 2,2 Гц), 7,80 (дд, 1H, J=8,3, 0,8 Гц), 7,48-7,24 (м, 5H), 7,09-6,80 (м, 1H), 5,22 (с, 2H), 3,21 (кв, 2H, J=7,4 Гц), 1,46 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 395,43 (M++1).
[1696] Пример 118: Соединение 11426, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-1-(метилсульфонил)-N-фенилпиперидин-4-сульфонамид
[1697] [Стадия 1] метил 6-(((1-(метилсульфонил)-N-фенилпиперидин)-4-сульфонамидо)метил)никотинат
[1698] 
[1699] Раствор гидрохлорида метил 6-((N-фенилпиперидин-4-сульфонамидо)метил)никотината (0,165 г, 0,387 ммоль), триэтиламина (0,081 мл, 0,581 ммоль) и метансульфонилхлорида (0,036 мл, 0,465 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 80%) с получением метил 6-(((1-(метилсульфонил)-N-фенилпиперидин)-4-сульфонамидо)метил)никотината в виде желтого твердого вещества (0,110 г, 60,7%).
[1700] [Стадия 2] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-(метилсульфонил)-N-фенилпиперидин-4-сульфонамид
[1701] 
[1702] Раствор метил 6-(((1-(метилсульфонил)-N-фенилпиперидин)-4-сульфонамидо)метил)никотината (0,110 г, 0,235 ммоль) и моногидрата гидразина (0,118 г, 2,353 ммоль) в этаноле (10 мл) перемешивали при комнатной температуре в течение 12 ч и концентрировали при пониженном давлении для удаления растворителя. Затем к концентрату добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-(метилсульфонил)-N-фенилпиперидин-4-сульфонамид, 0,086 г, 78,2%, желтое твердое вещество).
[1703] [Стадия 3] Соединение 11426
[1704] 
[1705] Смесь N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-(метилсульфонил)-N-фенилпиперидин-4-сульфонамида (0,086 г, 0,184 ммоль), триэтиламина (0,103 мл, 0,736 ммоль) и 2,2-дифторуксусного ангидрида (0,040 мл, 0,368 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 12 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-1-(метилсульфонил)-N-фенилпиперидин-4-сульфонамида в виде желтого твердого вещества (0,053 г, 54,6%).
[1706] 1H-ЯМР (400 МГц, CDCl3) δ 9,23 (с, 1H), 8,40 (дд, 1H, J=8,3, 2,2 Гц), 7,71 (д, 1H, J=8,2 Гц), 7,46-7,32 (м, 3H), 7,34-7,26 (м, 2H), 7,11-6,78 (м, 1H), 5,21 (с, 2H), 3,96-3,88 (м, 2H), 3,31-3,21 (м, 1H), 2,86-2,76 (м, 5H), 2,32-2,23 (м, 2H), 2,15-2,01 (м, 2H); LRMS (ES) m/z 528,51 (M++1).
[1707] Пример 119: Соединение 11427, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-(1-метилпиперидин-4-ил)фенил)этансульфонамид
[1708] [Стадия 1] трет-бутил 4-(3-(этилсульфонамидо)фенил)-3,6-дигидропиридин-1(2H)-карбоксилат
[1709] 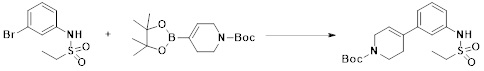
[1710] Смесь N-(3-бромфенил)этансульфонамида (1,000 г, 3,786 ммоль), трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилата (1,288 г, 4,164 ммоль), дихлорида [1,1'-бис(ди-трет-бутилфосфино)-ферроцен]палладия(II) (0,247 г, 0,379 ммоль) и карбоната натрия (0,602 г, 5,679 ммоль) в смеси 1,4-диоксан (50 мл)/вода (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 12 ч, охлаждали до температуры окружающей среды и фильтровали через слой целита для удаления твердых веществ. Затем к фильтрату добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 30%) с получением трет-бутил 4-(3-(этилсульфонамидо)фенил)-3,6-дигидропиридин-1(2H)-карбоксилата в виде желтого твердого вещества (1,300 г, 93,7%).
[1711] [Стадия 2] трет-бутил 4-(3-(этилсульфонамидо)фенил)пиперидин-1-карбоксилат
[1712] 
[1713] Раствор трет-бутил 4-(3-(этилсульфонамидо)фенил)-3,6-дигидропиридин-1(2H)-карбоксилата (0,900 г, 2,456 ммоль) в Pd/C (50 мг) и метаноле (20 мл) перемешивали при комнатной температуре в течение 12 ч в присутствии газообразного H2 и фильтровали через слой целита для удаления твердых веществ. Затем к фильтрату добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (трет-бутил 4-(3-(этилсульфонамидо)фенил)пиперидин-1-карбоксилат, 0,820 г, 90,6%, желтое твердое вещество).
[1714] [Стадия 3] трет-бутил 4-(3-(N-(2-фтор-4-(метоксикарбонил)бензил)этилсульфонамидо)фенил)пиперидин-1-карбоксилат
[1715] 
[1716] Раствор метил 4-(бромметил)-3-фторбензоата (0,605 г, 2,448 ммоль) и йодида калия (0,074 г, 0,445 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 30 мин, и смешивали с трет-бутил 4-(3-(этилсульфонамидо)фенил)пиперидин-1-карбоксилатом (0,820 г, 2,225 ммоль) и карбонатом калия (0,461 г, 3,338 ммоль). Реакционную смесь перемешивали при 50°C в течение дополнительных 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением трет-бутил 4-(3-(N-(2-фтор-4-(метоксикарбонил)бензил)этилсульфонамидо)фенил)пиперидин-1-карбоксилата в виде желтого твердого вещества (0,900 г, 75,6%).
[1717] [Стадия 4] гидрохлорид метил 3-фтор-4-((N-(3-(пиперидин-4-ил)фенил)этилсульфонамидо)метил)бензоата
[1718] 
[1719] Раствор трет-бутил 4-(3-(N-(2-фтор-4-(метоксикарбонил)бензил)этилсульфонамидо)фенил)пиперидин-1-карбоксилата (0,900 г, 1,683 ммоль) и хлористоводородной кислоты (4,00 M раствор в 1,4-диоксане, 1,683 мл, 6,734 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (гидрохлорид метил 3-фтор-4-((N-(3-(пиперидин-4-ил)фенил)этилсульфонамидо)метил)бензоата, 0,750 г, 94,6%, желтое твердое вещество).
[1720] [Стадия 5] метил 3-фтор-4-((N-(3-(1-метилпиперидин-4-ил)фенил)этилсульфонамидо)метил)бензоат
[1721] 
[1722] Раствор гидрохлорида метил 3-фтор-4-((N-(3-(пиперидин-4-ил)фенил)этилсульфонамидо)метил)бензоата (0,300 г, 0,637 ммоль), формальдегида (0,057 г, 1,911 ммоль) и уксусной кислоты (0,044 мл, 0,764 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 30 мин, и смешивали с триацетоксиборгидридом натрия (0,202 г, 0,955 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением метил 3-фтор-4-((N-(3-(1-метилпиперидин-4-ил)фенил)этилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,264 г, 92,4%).
[1723] [Стадия 6] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-(1-метилпиперидин-4-ил)фенил)этансульфонамид
[1724] 
[1725] Раствор метил 3-фтор-4-((N-(3-(1-метилпиперидин-4-ил)фенил)этилсульфонамидо)метил)бензоата (0,264 г, 0,589 ммоль) и моногидрата гидразина (0,286 мл, 5,886 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-(1-метилпиперидин-4-ил)фенил)этансульфонамид, 0,176 г, 66,7%, желтое твердое вещество).
[1726] [Стадия 7] Соединение 11427
[1727] 
[1728] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(3-(1-метилпиперидин-4-ил)фенил)этансульфонамида (0,176 г, 0,392 ммоль), триэтиламина (0,219 мл, 1,569 ммоль) и 2,2-дифторуксусного ангидрида (0,085 мл, 0,785 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(3-(1-метилпиперидин-4-ил)фенил)этансульфонамида в виде желтого твердого вещества (0,098 г, 49,1%).
[1729] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,0, 1,7 Гц), 7,76-7,64 (м, 2H), 7,29 (д, 1H, J=15,5 Гц), 7,24-7,11 (м, 3H), 7,08-6,73 (м, 1H), 5,05 (с, 2H), 3,14 (кв, 4H, J=7,4 Гц), 2,54 (тт, 1H, J=11,9, 3,8 Гц), 2,48 (с, 3H), 2,35-2,24 (м, 2H), 2,07-1,91 (м, 2H), 1,89-1,81 (м, 2H), 1,46 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 509,40 (M++1).
[1730] Пример 120: Соединение 11428, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилтетрагидрофуран-3-сульфонамид
[1731] [Стадия 1] N-фенилтетрагидрофуран-3-сульфонамид
[1732] 
[1733] Раствор анилина (0,147 мл, 1,611 ммоль), триэтиламина (0,337 мл, 2,416 ммоль) и тетрагидрофуран-3-сульфонилхлорида (0,330 г, 1,933 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением N-фенилтетрагидрофуран-3-сульфонамида в виде желтого твердого вещества (0,300 г, 82,0%).
[1734] [Стадия 2] метил 6-(((N-фенилтетрагидрофуран)-3-сульфонамидо)метил)никотинат
[1735] 
[1736] Раствор N-фенилтетрагидрофуран-3-сульфонамида (0,300 г, 1,320 ммоль), карбоната калия (0,274 г, 1,980 ммоль), метил 6-(бромметил)никотината (0,334 г, 1,452 ммоль) и йодида калия (0,110 г, 0,660 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 70%) с получением метил 6-(((N-фенилтетрагидрофуран)-3-сульфонамидо)метил)никотината в виде желтого твердого вещества (0,120 г, 24,2%).
[1737] [Стадия 3] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилтетрагидрофуран-3-сульфонамид
[1738] 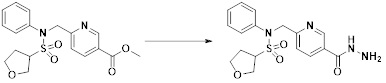
[1739] Раствор метил 6-(((N-фенилтетрагидрофуран)-3-сульфонамидо)метил)никотината (0,120 г, 0,319 ммоль) и моногидрата гидразина (0,155 мл, 3,188 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Затем к концентрату добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилтетрагидрофуран-3-сульфонамид, 0,082 г, 68,3%, белое твердое вещество).
[1740] [Стадия 4] Соединение 11428
[1741] 
[1742] Раствор N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилтетрагидрофуран-3-сульфонамида (0,082 г, 0,218 ммоль), триэтиламина (0,121 мл, 0,871 ммоль) и 2,2-дифторуксусного ангидрида (0,047 мл, 0,436 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-фенилтетрагидрофуран-3-сульфонамида в виде желтого твердого вещества (0,051 г, 53,6%).
[1743] 1H-ЯМР (400 МГц, CDCl3) δ 9,23 (дд, 1H, J=2,3, 0,9 Гц), 8,39 (дд, 1H, J=8,3, 2,2 Гц), 7,72 (дд, 1H, J=8,2, 0,8 Гц), 7,47-7,25 (м, 5H), 7,11-6,77 (м, 1H), 5,28-5,13 (м, 2H), 4,20-3,91 (м, 4H), 3,85 (ддд, 1H, J=8,8, 7,3, 6,1 Гц), 2,45-2,20 (м, 2H); LRMS (ES) m/z 437,41 (M++1).
[1744] Пример 121: Соединение 11429, N-(3-хлор-4-фторфенил)-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[1745] 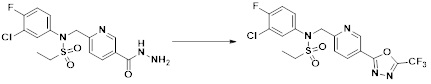
[1746] Раствор N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,068 г, 0,176 ммоль), триэтиламина (0,098 мл, 0,703 ммоль) и трифторуксусного ангидрида (0,050 мл, 0,352 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением N-(3-хлор-4-фторфенил)-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамида в виде желтого твердого вещества (0,042 г, 51,4%).
[1747] 1H-ЯМР (400 МГц, CDCl3) δ 9,26 (дд, 1H, J=2,3, 0,8 Гц), 8,42 (дд, 1H, J=8,2, 2,2 Гц), 7,70 (дд, 1H, J=8,3, 0,8 Гц), 7,54 (дд, 1H, J=6,4, 2,7 Гц), 7,34 (ддд, 1H, J=8,9, 4,1, 2,7 Гц), 7,12 (т, 1H, J=8,6 Гц), 5,13 (с, 2H), 3,20 (кв, 2H, J=7,4 Гц), 1,45 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 465,30 (M++1).
[1748] Пример 122: Соединение 11430, N-фенил-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[1749] 
[1750] Раствор N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилэтансульфонамида (0,056 г, 0,167 ммоль), триэтиламина (0,093 мл, 0,670 ммоль) и трифторуксусного ангидрида (0,047 мл, 0,335 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 60%) с получением N-фенил-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамида в виде желтого твердого вещества (0,036 г, 52,1%).
[1751] 1H-ЯМР (400 МГц, CDCl3) δ 9,22 (дд, 1H, J=2,2, 0,8 Гц), 8,38 (дд, 1H, J=8,3, 2,2 Гц), 7,78 (дт, 1H, J=8,3, 0,7 Гц), 7,47-7,40 (м, 2H), 7,45-7,32 (м, 2H), 7,36-7,24 (м, 1H), 5,20 (с, 2H), 3,20 (кв, 2H, J=7,4 Гц), 1,50-1,41 (м, 3H); LRMS (ES) m/z 413,0 (M++1).
[1752] Пример 123: Соединение 11431, N-фенил-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)тетрагидро-2H-пиран-4-сульфонамид
[1753] 
[1754] Раствор N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-фенилтетрагидро-2H-пиран-4-сульфонамида (0,095 г, 0,243 ммоль), триэтиламина (0,136 мл, 0,973 ммоль) и трифторуксусного ангидрида (0,069 мл, 0,487 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 60%) с получением N-фенил-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)тетрагидро-2H-пиран-4-сульфонамида в виде белого твердого вещества (0,056 г, 49,1%).
[1755] 1H-ЯМР (400 МГц, CDCl3) δ 9,20 (дт, 1H, J=2,1, 1,0 Гц), 8,39 (дт, 1H, J=8,3, 2,0 Гц), 7,78 (дт, 1H, J=8,3, 1,1 Гц), 7,43 (ддд, 2H, J=8,3, 1,8, 0,8 Гц), 7,44-7,32 (м, 2H), 7,36-7,21 (м, 1H), 5,22 (д, 2H, J=1,5 Гц), 4,19-4,07 (м, 2H), 3,46-3,28 (м, 3H), 2,10-1,96 (м, 4H); LRMS (ES) m/z 469,30 (M++1).
[1756] Пример 124: Соединение 11432, N-(3-хлор-4-фторфенил)-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамид
[1757] [Стадия 1] N-(3-хлор-4-фторфенил)метансульфонамид
[1758] 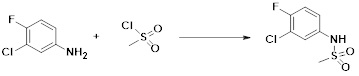
[1759] Раствор 3-хлор-4-фторанилина (2,000 г, 13,740 ммоль), пиридина (1,217 мл, 15,114 ммоль) и метансульфонилхлорида (1,276 мл, 16,488 ммоль) в дихлорметане (80 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлор-4-фторфенил)метансульфонамид, 2,600 г, 84,6%, черное твердое вещество).
[1760] [Стадия 2] метил 6-((N-(3-хлор-4-фторфенил)метилсульфонамидо)метил)никотинат
[1761] 
[1762] Раствор метил 6-(бромметил)никотината (0,339 г, 1,476 ммоль) и йодида калия (0,111 г, 0,671 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с N-(3-хлор-4-фторфенил)метансульфонамидом (0,300 г, 1,341 ммоль) и карбонатом калия (0,278 г, 2,012 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением метил 6-((N-(3-хлор-4-фторфенил)метилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,290 г, 58,0%).
[1763] [Стадия 3] N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид
[1764] 
[1765] Раствор метил 6-((N-(3-хлор-4-фторфенил)метилсульфонамидо)метил)никотината (0,100 г, 0,268 ммоль) и моногидрата гидразина (0,130 мл, 2,682 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Затем к концентрату добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамид, 0,071 г, 71,0%, желтое твердое вещество).
[1766] [Стадия 4] Соединение 11432
[1767] 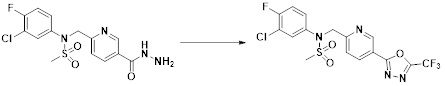
[1768] Раствор N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида (0,071 г, 0,190 ммоль), триэтиламина (0,106 мл, 0,762 ммоль) и трифторуксусного ангидрида (0,054 мл, 0,381 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(3-хлор-4-фторфенил)-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамида в виде желтого твердого вещества (0,036 г, 41,9%).
[1769] 1H-ЯМР (400 МГц, CDCl3) δ 9,29 (дд, 1H, J=2,3, 0,8 Гц), 8,43 (дд, 1H, J=8,2, 2,2 Гц), 7,67 (дт, 1H, J=8,3, 0,7 Гц), 7,54 (дд, 1H, J=6,4, 2,7 Гц), 7,41-7,26 (м, 1H), 7,14 (т, 1H, J=8,6 Гц), 5,11 (с, 2H), 3,09 (д, 3H, J=0,4 Гц); LRMS (ES) m/z 451,38 (M++1).
[1770] Пример 125: Соединение 11433, N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамид
[1771] 
[1772] Раствор N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)метансульфонамида (0,070 г, 0,188 ммоль), триэтиламина (0,105 мл, 0,751 ммоль) и 2,2-дифторуксусного ангидрида (0,047 мл, 0,376 ммоль) в тетрагидрофуране (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)метансульфонамида в виде желтого твердого вещества (0,046 г, 56,6%).
[1773] 1H-ЯМР (400 МГц, CDCl3) δ 9,29 (д, 1H, J=2,1 Гц), 8,42 (дд, 1H, J=8,2, 2,2 Гц), 7,65 (дд, 1H, J=8,1, 0,8 Гц), 7,54 (дд, 1H, J=6,5, 2,7 Гц), 7,34 (ддд, 1H, J=8,8, 4,1, 2,7 Гц), 7,14 (т, 1H, J=8,7 Гц), 7,10-6,81 (м, 1H), 5,10 (с, 2H), 3,09 (с, 3H); LRMS (ES) m/z 433,40 (M++1).
[1774] Пример 126: Соединение 11447, 1-(1-ацетилазетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)пиперидин-4-сульфонамид
[1775] [Стадия 1] трет-бутил 4-(N-(3-хлор-4-фторфенил)сульфамоил)пиперидин-1-карбоксилат
[1776] 
[1777] Смесь 3-хлор-4-фторанилина (2,200 г, 15,114 ммоль) и трет-бутил 4-(хлорсульфонил)пиперидин-1-карбоксилата (4,289 г, 15,114 ммоль) в дихлорметане (20 мл) обрабатывали при комнатной температуре триэтиламином (2,528 мл, 18,137 ммоль). Реакционную смесь перемешивали при той же температуре в течение 18 ч. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 10% до 30%) с получением трет-бутил 4-(N-(3-хлор-4-фторфенил)сульфамоил)пиперидин-1-карбоксилата в виде светло-фиолетового твердого вещества (2,940 г, 49,5%).
[1778] [Стадия 2] трет-бутил 4-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)пиперидин-1-карбоксилат
[1779] 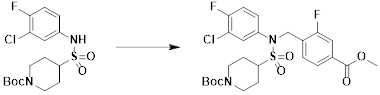
[1780] Смесь трет-бутил 4-(N-(3-хлор-4-фторфенил)сульфамоил)пиперидин-1-карбоксилата (1,500 г, 3,818 ммоль), метил 4-(бромметил)-3-фторбензоата (1,132 г, 4,582 ммоль), карбоната калия (0,792 г, 5,727 ммоль) и йодида калия (0,951 г, 5,727 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 16 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 20% до 50%) с получением трет-бутил 4-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)пиперидин-1-карбоксилата в виде белого твердого вещества (1,860 г, 87,1%).
[1781] [Стадия 3] гидрохлорид метил 4-((N-(3-хлор-4-фторфенил)пиперидин-4-сульфонамидо)метил)-3-фторбензоата
[1782] 
[1783] Раствор трет-бутил 4-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)пиперидин-1-карбоксилата (1,860 г, 3,327 ммоль) в 1,4-диоксане (8 мл) смешивали при комнатной температуре с хлористоводородной кислотой (4,00 M раствор в 1,4-диоксане, 8,318 мл, 33,273 ммоль) и перемешивали при той же температуре в течение 1 ч. Реакционную смесь разбавляли этилацетатом (10 мл) и гексаном (50 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали гексаном и сушили с получением гидрохлорида метил 4-((N-(3-хлор-4-фторфенил)пиперидин-4-сульфонамидо)метил)-3-фторбензоата в виде бежевого твердого вещества (1,620 г, 98,3%).
[1784] [Стадия 4] трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилат
[1785] 
[1786] Смесь гидрохлорида метил 4-((N-(3-хлор-4-фторфенил)пиперидин-4-сульфонамидо)метил)-3-фторбензоата (1,300 г, 2,624 ммоль), трет-бутил 3-оксоазетидин-1-карбоксилата (0,674 г, 3,937 ммоль) и N,N-диизопропилэтиламина (0,686 мл, 3,937 ммоль) в дихлорметане (50 мл) обрабатывали при комнатной температуре триацетоксиборгидридом натрия (1,112 г, 5,249 ммоль) и перемешивали при той же температуре в течение 16 ч. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 40% до 70%) с получением трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилата в виде белого твердого вещества (1,178 г, 73,1%).
[1787] [Стадия 5] трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилат
[1788] 
[1789] Трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилат (1,178 г, 1,918 ммоль) и моногидрат гидразина (0,932 мл, 19,183 ммоль) смешивали при комнатной температуре в этаноле (20 мл), перемешивали при 110°C в течение 2 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли водой (100 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилата в виде белого твердого вещества (1,149 г, 97,5%).
[1790] [Стадия 6] трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилат
[1791] 
[1792] Раствор трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилата (1,149 г, 1,871 ммоль) в тетрагидрофуране (30 мл) смешивали с 2,2-дифторуксусным ангидридом (0,244 мл, 2,245 ммоль) и N,N-диизопропилэтиламином (0,489 мл, 2,807 ммоль) при 70°C, перемешивали при той же температуре в течение 1 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 30% до 60%) с получением трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилата в виде белого твердого вещества (1,058 г, 81,7%).
[1793] [Стадия 7] трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилат
[1794] 
[1795] Раствор трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(4-(2-(2,2-дифторацетил)гидразин-1-карбонил)-2-фторбензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилата (1,000 г, 1,445 ммоль) в дихлорметане (30 мл) смешивали при комнатной температуре с метансульфонилхлоридом (0,134 мл, 1,734 ммоль) и N,N-диизопропилэтиламином (0,377 мл, 2,167 ммоль) и перемешивали при той же температуре в течение 1 ч. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 40% до 70%) с получением трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилата в виде светло-желтого твердого вещества (0,680 г, 69,8%).
[1796] [Стадия 8] дигидрохлорид 1-(азетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)пиперидин-4-сульфонамида
[1797] 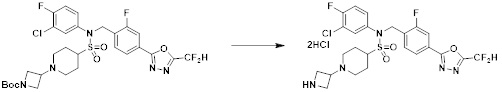
[1798] Раствор трет-бутил 3-(4-(N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)сульфамоил)пиперидин-1-ил)азетидин-1-карбоксилата (0,680 г, 1,009 ммоль) в 1,4-диоксане (10 мл) смешивали при комнатной температуре с хлористоводородной кислотой (4,00 M раствор в 1,4-диоксане, 5,044 мл, 20,175 ммоль) и перемешивали при той же температуре в течение 1 ч. Реакционную смесь разбавляли этилацетатом (10 мл) и гексаном (70 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали гексаном и сушили с получением дигидрохлорида 1-(азетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)пиперидин-4-сульфонамида в виде белого твердого вещества (0,620 г, 95,0%).
[1799] [Стадия 9] Соединение 11447
[1800] 
[1801] Взвесь дигидрохлорида 1-(азетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)пиперидин-4-сульфонамида (0,050 г, 0,077 ммоль) в дихлорметане (5 мл) смешивали при комнатной температуре с ацетилхлоридом (0,008 мл, 0,116 ммоль) и N,N-диизопропилэтиламином (0,047 мл, 0,271 ммоль) и перемешивали при той же температуре в течение 3 ч. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 10%) с получением 1-(1-ацетилазетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)пиперидин-4-сульфонамида в виде бежевого твердого вещества (0,023 г, 48,3%).
[1802] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,88 (дд, 2H, J=7,9, 1,6 Гц), 7,83-7,75 (м, 2H), 7,71-7,62 (м, 1,25H), 7,54 (с, 0,5H), 7,51-7,47 (м, 1H), 7,44-7,36 (м, 1,25H), 5,12 (с, 2H), 4,10 (т, 1H, J=7,9 Гц), 3,92 (дд, 1H, J=8,6, 5,0 Гц), 3,82 (т, 1H, J=8,5 Гц), 3,63 (м, 1H), 3,12-3,06 (м, 1H), 2,89 (т, 2H, J=12,8 Гц), 2,11 (д, 2H, J=11,2 Гц), 2,01-1,89 (м, 2H), 1,89 (с, 3H), 1,75-1,71 (м, 2H); LRMS (ES) m/z 616,5 (M++1).
[1803] Пример 127: Соединение 11448, N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-(1-(метилсульфонил)азетидин-3-ил)пиперидин-4-сульфонамид
[1804] 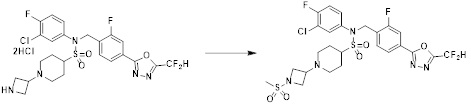
[1805] Взвесь дигидрохлорида 1-(азетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)пиперидин-4-сульфонамида (0,050 г, 0,077 ммоль) в дихлорметане (5 мл) смешивали при комнатной температуре с метансульфонилхлоридом (0,009 мл, 0,116 ммоль) и N,N-диизопропилэтиламином (0,047 мл, 0,271 ммоль) и перемешивали при той же температуре в течение 3 ч. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 50% до 80%) с получением N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-(1-(метилсульфонил)азетидин-3-ил)пиперидин-4-сульфонамида в виде светло-желтого твердого вещества (0,026 г, 51,6%).
[1806] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,88 (дд, 1H, J=8,0, 1,7 Гц), 7,83-7,75 (м, 2H), 7,70-7,61 (м, 1,25H), 7,54 (с, 0,5H), 7,49 (м, 1H), 7,44-7,36 (м, 1,25H), 5,12 (с, 2H), 3,85 (т, 2H, J=7,7 Гц), 3,75 (дд, 2H, J=8,4, 6,0 Гц), 3,16 (кв, 1H, J=6,5 Гц), 3,00 (с, 3H), 2,87 (д, 2H, J=11,0 Гц), 2,10 (д, 2H, J=12,1 Гц), 1,97-1,86 (м, 2H), 1,76-1,62 (м, 2H); LRMS (ES) m/z 652,4 (M++1).
[1807] Пример 128: Соединение 11451, N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-(1-метилазетидин-3-ил)пиперидин-4-сульфонамид
[1808] 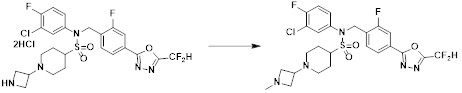
[1809] Смесь дигидрохлорида 1-(азетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)пиперидин-4-сульфонамида (0,100 г, 0,155 ммоль) и формальдегида (37,00% раствор в воде, 0,023 мл, 0,309 ммоль) в дихлорметане (5 мл) обрабатывали при комнатной температуре триацетоксиборгидридом натрия (0,066 г, 0,309 ммоль) и перемешивали при той же температуре в течение 3 ч. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 15%) с получением неочищенного продукта, а затем неочищенный продукт растворяли в этилацетате (1 мл) и гексан (10 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали гексаном и сушили с получением N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-(1-метилазетидин-3-ил)пиперидин-4-сульфонамида в виде светло-желтого твердого вещества (0,022 г, 24,2%).
[1810] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,87 (дд, 2H, J=8,0, 1,7 Гц), 7,83-7,74 (м, 2H), 7,70-7,61 (м, 1,25H), 7,54 (с, 0,5H), 7,48 (м, 1H), 7,45-7,35 (м, 1,25H), 5,11 (с, 2H), 3,50-3,47 (м, 2H), 2,92-2,86 (м, 3H), 2,79 (д, 2H, J=11,2 Гц), 2,31 (с, 3H), 2,08-2,04 (м, 2H), 1,83 (т, 2H, J=11,5 Гц), 1,67 (дт, 2H, J=12,2, 6,3 Гц); LRMS (ES) m/z 588,6 (M++1).
[1811] Пример 129: Соединение 11452, N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-(1-(2-гидроксиацетил)азетидин-3-ил)пиперидин-4-сульфонамид
[1812] 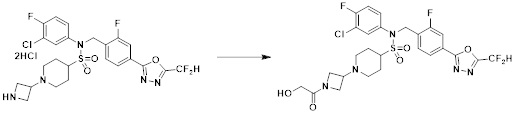
[1813] Смесь дигидрохлорида 1-(азетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)пиперидин-4-сульфонамида (0,100 г, 0,155 ммоль), 2-гидроксиуксусной кислоты (0,013 г, 0,170 ммоль) и 1H-бензо[d][1,2,3]триазол-1-ола (HOBt, 0,031 г, 0,232 ммоль) в дихлорметане (5 мл) обрабатывали при комнатной температуре 1-этил-3-(3-диметиламинопропил)карбодиимидом (EDC, 0,036 г, 0,232 ммоль) и N,N-диизопропилэтиламином (0,121 мл, 0,696 ммоль) и перемешивали при той же температуре в течение 16 ч. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 10%) с получением неочищенного продукта, а затем неочищенный продукт растворяли в этилацетате (1 мл) и гексане (10 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали гексаном и сушили с получением N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-(1-(2-гидроксиацетил)азетидин-3-ил)пиперидин-4-сульфонамида в виде светло-желтого твердого вещества (0,041 г, 42,0%).
[1814] 1H-ЯМР (400 МГц, DMSO-d6) δ 7,87 (дд, 1H, J=8,0, 1,7 Гц), 7,83-7,75 (м, 2H), 7,70-7,62 (м, 1,25H), 7,54 (с, 0,5H), 7,49 (м, 1H), 7,44-7,35 (м, 1,25H), 5,12 (с, 2H), 4,88 (т, 1H, J=6,0 Гц), 4,16 (м, 1H), 3,98 (м, 1H), 3,91-3,87 (м, 2H), 3,69 (дд, 1H, J=10,0, 5,1 Гц), 3,37 (м, 1H), 3,14 (дкв, 1H, J=12,4, 6,6, 5,9 Гц), 2,92-2,84 (м, 2H), 2,10 (д, 2H, J=12,0 Гц), 1,93-1,86 (м, 2H), 1,77-1,62 (м, 2H); LRMS (ES) m/z 632,6 (M++1).
[1815] Пример 130: Соединение 11460, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3-фтор-4-метилфенил)этансульфонамид
[1816] [Стадия 1] N-(3-фтор-4-метилфенил)этансульфонамид
[1817] 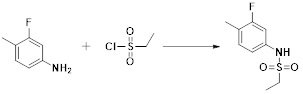
[1818] Раствор 3-фтор-4-метиланилина (0,457 мл, 3,995 ммоль), пиридина (0,483 мл, 5,993 ммоль) и этансульфонилхлорида (0,453 мл, 4,794 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали 1 M водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 80%) с получением N-(3-фтор-4-метилфенил)этансульфонамида в виде желтого твердого вещества (0,623 г, 71,8%).
[1819] [Стадия 2] Метил 6-((N-(3-фтор-4-метилфенил)этилсульфонамидо)метил)никотинат
[1820] 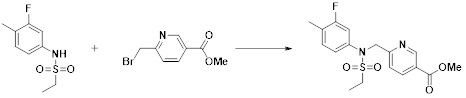
[1821] Раствор N-(3-фтор-4-метилфенил)этансульфонамида (0,250 г, 1,151 ммоль), метил 6-(бромметил)никотината (0,318 г, 1,381 ммоль), карбоната калия (0,239 г, 1,726 ммоль) и йодида калия (0,019 г, 0,115 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 100%) с получением метил 6-((N-(3-фтор-4-метилфенил)этилсульфонамидо)метил)никотината в виде белого твердого вещества (0,290 г, 68,8%).
[1822] [Стадия 3] N-(3-фтор-4-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1823] 
[1824] Метил 6-((N-(3-фтор-4-метилфенил)этилсульфонамидо)метил)никотинат (0,290 г, 0,791 ммоль) и моногидрат гидразина (1,154 мл, 23,744 ммоль) смешивали при комнатной температуре в смеси этанол (8 мл)/вода (2 мл), перемешивали при 90°C в течение 18 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-фтор-4-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,259 г, 89,3%, желтое твердое вещество).
[1825] [Стадия 4] N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(3-фтор-4-метилфенил)этансульфонамид
[1826] 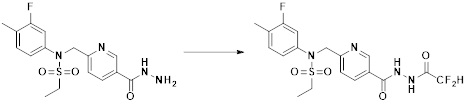
[1827] Раствор N-(3-фтор-4-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,080 г, 0,218 ммоль) и триэтиламина (0,046 мл, 0,328 ммоль) в тетрагидрофуране (10 мл) смешивали при комнатной температуре с 2,2-дифторуксусным ангидридом (0,029 мл, 0,262 ммоль), перемешивали при 50°C в течение 18 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(3-фтор-4-метилфенил)этансульфонамид, 0,087 г, 89,7%, желтое масло).
[1828] [Стадия 5] Соединение 11460
[1829] 
[1830] Смесь N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(3-фтор-4-метилфенил)этансульфонамида (0,090 г, 0,203 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,145 г, 0,608 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения, охлаждали до комнатной температуры. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 100%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3-фтор-4-метилфенил)этансульфонамида в виде желтого твердого вещества (0,050 г, 57,9%).
[1831] 1H-ЯМР (400 МГц, CDCl3) δ 9,21 (дд, 1H, J=2,2, 0,9 Гц), 8,37 (дд, 1H, J=8,2, 2,2 Гц), 7,75-7,66 (м, 1H), 7,16-7,07 (м, 3H), 6,86 (д, 1H, J=51,6 Гц), 5,14 (с, 2H), 3,18 (кв, 2H, J=7,4 Гц), 2,20 (д, 3H, J=1,9 Гц), 1,42 (т, 3H, J=7,4 Гц) ; LRMS (ES) m/z 427,3 (M++1).
[1832] Пример 131: Соединение 11461, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(4-фтор-3-метилфенил)этансульфонамид
[1833] [Стадия 1] N-(4-фтор-3-метилфенил)этансульфонамид
[1834] 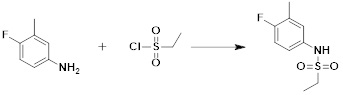
[1835] Раствор 4-фтор-3-метиланилина (0,500 г, 3,995 ммоль), пиридина (0,483 мл, 5,993 ммоль) и этансульфонилхлорида (0,453 мл, 4,794 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали 1 M водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 80%) с получением N-(4-фтор-3-метилфенил)этансульфонамида в виде желтого твердого вещества (0,633 г, 72,9%).
[1836] [Стадия 2] метил 6-((N-(4-фтор-3-метилфенил)этилсульфонамидо)метил)никотинат
[1837] 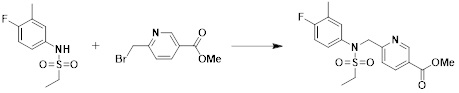
[1838] Раствор N-(4-фтор-3-метилфенил)этансульфонамида (0,250 г, 1,151 ммоль), метил 6-(бромметил)никотината (0,318 г, 1,381 ммоль), карбоната калия (0,239 г, 1,726 ммоль) и йодида калия (0,019 г, 0,115 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 100%) с получением метил 6-((N-(4-фтор-3-метилфенил)этилсульфонамидо)метил)никотината в виде белого твердого вещества (0,230 г, 54,6%).
[1839] [Стадия 3] N-(4-фтор-3-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1840] 
[1841] Метил 6-((N-(4-фтор-3-метилфенил)этилсульфонамидо)метил)никотинат (0,230 г, 0,628 ммоль) и моногидрат гидразина (0,915 мл, 18,831 ммоль) смешивали при комнатной температуре в смеси этанол (8 мл)/вода (2 мл), перемешивали при 90°C в течение 18 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-фтор-3-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,222 г, 96,5%, желтое твердое вещество).
[1842] [Стадия 4] N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(4-фтор-3-метилфенил)этансульфонамид
[1843] 
[1844] Раствор N-(4-фтор-3-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,080 г, 0,218 ммоль) и триэтиламина (0,046 мл, 0,328 ммоль) в тетрагидрофуране (10 мл) смешивали при комнатной температуре с 2,2-дифторуксусным ангидридом (0,029 мл, 0,262 ммоль), перемешивали при 50°C в течение 18 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(4-фтор-3-метилфенил)этансульфонамид, 0,088 г, 94,5%, желтое масло).
[1845] [Стадия 5] Соединение 11461
[1846] 
[1847] Смесь N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(4-фтор-3-метилфенил)этансульфонамида (0,090 г, 0,203 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,145 г, 0,608 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения, охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 100%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(4-фтор-3-метилфенил)этансульфонамида в виде желтого твердого вещества (0,070 г, 81,1%).
[1848] 1H-ЯМР (400 МГц, CDCl3) δ 9,21 (дд, 1H, J=2,2, 0,8 Гц), 8,39 (дд, 1H, J=8,3, 2,2 Гц), 7,74 (дд, 1H, J=8,3, 0,9 Гц), 7,25-7,12 (м, 2H), 7,07-6,78 (м, 2H), 5,12 (с, 2H), 3,17 (кв, 2H, J=7,4 Гц), 2,22 (д, 3H, J=2,0 Гц), 1,44 (т, 3H, J=7,4 Гц) ; LRMS (ES) m/z 427,3 (M++1).
[1849] Пример 132: Соединение 11462, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3,4-дифторфенил)этансульфонамид
[1850] [Стадия 1] N-(3,4-дифторфенил)этансульфонамид
[1851] 
[1852] Раствор 3,4-дифторанилина (0,384 мл, 3,873 ммоль), пиридина (0,468 мл, 5,809 ммоль) и этансульфонилхлорида (0,439 мл, 4,647 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали 1 M водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 80%) с получением N-(3,4-дифторфенил)этансульфонамида в виде желтого твердого вещества (0,670 г, 78,2%).
[1853] [Стадия 2] Метил 6-((N-(3,4-дифторфенил)этилсульфонамидо)метил)никотинат
[1854] 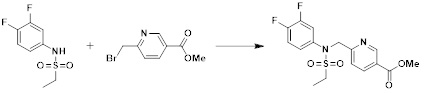
[1855] Раствор N-(3,4-дифторфенил)этансульфонамида (0,250 г, 1,130 ммоль), метил 6-(бромметил)никотината (0,312 г, 1,356 ммоль), карбоната калия (0,234 г, 1,695 ммоль) и йодида калия (0,019 г, 0,113 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 100%) с получением метил 6-((N-(3,4-дифторфенил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,151 г, 36,1%).
[1856] [Стадия 3] N-(3,4-дифторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1857] 
[1858] Метил 6-((N-(3,4-дифторфенил)этилсульфонамидо)метил)никотинат (0,160 г, 0,432 ммоль) и моногидрат гидразина (0,630 мл, 12,960 ммоль) смешивали при комнатной температуре в смеси этанол (8 мл)/вода (2 мл), перемешивали при 90°C в течение 18 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3,4-дифторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,152 г, 95,0%, желтое твердое вещество).
[1859] [Стадия 4] N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(3,4-дифторфенил)этансульфонамид
[1860] 
[1861] Раствор N-(3,4-дифторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,080 г, 0,216 ммоль) и триэтиламина (0,045 мл, 0,324 ммоль) в тетрагидрофуране (10 мл) смешивали при комнатной температуре с 2,2-дифторуксусным ангидридом (0,028 мл, 0,259 ммоль), перемешивали при 50°C в течение 18 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(3,4-дифторфенил)этансульфонамид, 0,090 г, 92,9%, желтое масло).
[1862] [Стадия 5] Соединение 11462
[1863] 
[1864] Смесь N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(3,4-дифторфенил)этансульфонамида (0,090 г, 0,201 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,143 г, 0,602 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения, охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 100%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3,4-дифторфенил)этансульфонамида в виде желтого твердого вещества (0,053 г, 61,4%).
[1865] 1H-ЯМР (400 МГц, CDCl3) δ 9,24 (дд, 1H, J=2,2, 0,8 Гц), 8,42 (дд, 1H, J=8,2, 2,2 Гц), 7,69 (дд, 1H, J=8,2, 0,8 Гц), 7,32 (ддд, 1H, J=11,0, 7,0, 2,6 Гц), 7,22-7,08 (м, 2H), 6,93 (т, 1H, J=51,6 Гц), 5,13 (с, 2H), 3,18 (кв, 2H, J=7,4 Гц), 1,42 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 431,3 (M++1).
[1866] Пример 133: Соединение 11463, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3,5-дифторфенил)этансульфонамид
[1867] [Стадия 1] N-(3,5-дифторфенил)этансульфонамид
[1868] 
[1869] Раствор 3,5-дифторанилина (0,500 г, 3,873 ммоль), пиридина (0,468 мл, 5,809 ммоль) и этансульфонилхлорида (0,439 мл, 4,647 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали 1 M водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 80%) с получением N-(3,5-дифторфенил)этансульфонамида в виде желтого твердого вещества (0,611 г, 71,3%).
[1870] [Стадия 2] Метил 6-((N-(3,5-дифторфенил)этилсульфонамидо)метил)никотинат
[1871] 
[1872] Раствор N-(3,5-дифторфенил)этансульфонамида (0,250 г, 1,130 ммоль), метил 6-(бромметил)никотината (0,312 г, 1,356 ммоль), карбоната калия (0,234 г, 1,695 ммоль) и йодида калия (0,019 г, 0,113 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 100%) с получением метил 6-((N-(3,5-дифторфенил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,175 г, 41,8%).
[1873] [Стадия 3] N-(3,5-дифторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1874] 
[1875] Метил 6-((N-(3,5-дифторфенил)этилсульфонамидо)метил)никотинат (0,180 г, 0,486 ммоль) и моногидрат гидразина (0,709 мл, 14,580 ммоль) смешивали при комнатной температуре в смеси этанол (8 мл)/вода (2 мл), перемешивали при 90°C в течение 18 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3,5-дифторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,177 г, 98,3%, желтое твердое вещество).
[1876] [Стадия 4] N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(3,5-дифторфенил)этансульфонамид
[1877] 
[1878] Раствор N-(3,5-дифторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,080 г, 0,216 ммоль) и триэтиламина (0,045 мл, 0,324 ммоль) в тетрагидрофуране (10 мл) смешивали при комнатной температуре с 2,2-дифторуксусным ангидридом (0,028 мл, 0,259 ммоль), перемешивали при 50°C в течение 18 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(3,5-дифторфенил)этансульфонамид, 0,092 г, 95,0%, желтое масло).
[1879] [Стадия 5] Соединение 11463
[1880] 
[1881] Смесь N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)-N-(3,5-дифторфенил)этансульфонамида (0,090 г, 0,201 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,143 г, 0,602 ммоль) в тетрагидрофуране (10 мл) нагревали при 150°C в течение 30 мин под действием микроволнового излучения, охлаждали до комнатной температуры. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 100%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(3,5-дифторфенил)этансульфонамида в виде желтого твердого вещества (0,046 г, 53,2%).
[1882] 1H-ЯМР (400 МГц, CDCl3) δ 9,25 (дд, 1H, J=2,2, 0,9 Гц), 8,39 (дд, 1H, J=8,3, 2,2 Гц), 7,65 (д, 1H, J=8,2 Гц), 7,10-7,00 (м, 2H), 6,87 (д, 1H, J=51,6 Гц), 6,70 (тт, 1H, J=8,6, 2,3 Гц), 5,16 (с, 2H), 3,22 (кв, 2H, J=7,4 Гц), 1,41 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 431,2 (M++1).
[1883] Пример 134: Соединение 11497, 1,1-диоксид N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)тетрагидро-2H-тиопиран-4-сульфонамида
[1884] [Стадия 1] 1,1-диоксид N-(3-хлор-4-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида
[1885] 
[1886] Раствор 3-хлор-4-фторанилина (0,300 г, 2,061 ммоль), триэтиламина (0,575 мл, 4,122 ммоль) и 1,1-диоксида тетрагидро-2H-тиопиран-4-сульфонилхлорида (0,528 г, 2,267 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 20%) с получением 1,1-диоксида N-(3-хлор-4-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида в виде желтого твердого вещества (0,265 г, 37,6%).
[1887] [Стадия 2] метил 6-(((N-(3-хлор-4-фторфенил)-1,1-диоксидотетрагидро-2H-тиопиран)-4-сульфонамидо)метил)никотинат
[1888] 
[1889] Раствор 1,1-диоксида N-(3-хлор-4-фторфенил)тетрагидро-2H-тиопиран-4-сульфонамида (0,265 г, 0,775 ммоль), карбоната калия (0,161 г, 1,163 ммоль), метил 6-(бромметил)никотината (0,196 г, 0,853 ммоль) и йодида калия (0,064 г, 0,388 ммоль) в N,N-диметилформамиде (15 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 60%) с получением метил 6-(((N-(3-хлор-4-фторфенил)-1,1-диоксидотетрагидро-2H-тиопиран)-4-сульфонамидо)метил)никотината в виде желтого твердого вещества (0,370 г, 97,2%).
[1890] [Стадия 3] 1,1-диоксид N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)тетрагидро-2H-тиопиран-4-сульфонамида
[1891] 
[1892] Раствор метил 6-(((N-(3-хлор-4-фторфенил)-1,1-диоксидотетрагидро-2H-тиопиран)-4-сульфонамидо)метил)никотината (0,370 г, 0,754 ммоль) и моногидрата гидразина (0,377 г, 7,536 ммоль) в этаноле (5 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли бикарбонатом натрия (20 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением 1,1-диоксида N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)тетрагидро-2H-тиопиран-4-сульфонамида в виде белого твердого вещества (0,220 г, 59,5%).
[1893] [Стадия 4] 1,1-диоксид N-(3-хлор-4-фторфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)тетрагидро-2H-тиопиран-4-сульфонамида
[1894] 
[1895] Раствор 1,1-диоксида N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)тетрагидро-2H-тиопиран-4-сульфонамида (0,220 г, 0,448 ммоль), триэтиламина (0,250 мл, 1,792 ммоль) и 2,2-дифторуксусного ангидрида (0,111 мл, 0,896 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (1,1-диоксид N-(3-хлор-4-фторфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)тетрагидро-2H-тиопиран-4-сульфонамида, 0,140 г, 54,9%, желтое твердое вещество).
[1896] [Стадия 5] Соединение 11497
[1897] 
[1898] Раствор 1,1-диоксида N-(3-хлор-4-фторфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)тетрагидро-2H-тиопиран-4-сульфонамида (0,140 г, 0,246 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,176 г, 0,738 ммоль) в тетрагидрофуране (15 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 60%) с получением 1,1-диоксида N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)тетрагидро-2H-тиопиран-4-сульфонамида в виде белого твердого вещества (0,095 г, 70,1%).
[1899] 1H-ЯМР (400 МГц, CDCl3) δ 9,30 (дд, 1H, J=2,2, 0,9 Гц), 8,42 (дд, 1H, J=8,2, 2,2 Гц), 7,57-7,48 (м, 2H), 7,35-7,27 (м, 1H), 7,13 (т, 1H, J=8,6 Гц), 7,10-6,82 (м, 1H), 5,09 (с, 2H), 3,49-3,31 (м, 3H), 3,07-2,95 (м, 2H), 2,70-2,61 (м, 4H); LRMS (ES) m/z 551,45 (M++1).
[1900] Пример 135: Соединение 11501, N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-1-(оксетан-3-ил)пиперидин-4-сульфонамид
[1901] [Стадия 1] метил 6-(((1-(трет-бутоксикарбонил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотинат
[1902] 
[1903] Трет-бутил 4-(N-(3-хлор-4-фторфенил)сульфамоил)пиперидин-1-карбоксилат (1,440 г, 3,665 ммоль), метил 6-(бромметил)никотинат (1,012 г, 4,398 ммоль), карбонат калия (0,760 г, 5,498 ммоль) и йодид калия (0,913 г, 5,498 ммоль) смешивали при комнатной температуре в N,N-диметилформамиде (30 мл), а затем перемешивали при той же температуре в течение 16 ч. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 80g; этилацетат/гексан=от 20% до 50%) с получением метил 6-(((1-(трет-бутоксикарбонил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотината в виде бежевого твердого вещества (1,920 г, 96,6%).
[1904] [Стадия 2] дигидрохлорид метил 6-((N-(3-хлор-4-фторфенил)пиперидин-4-сульфонамидо)метил)никотината
[1905] 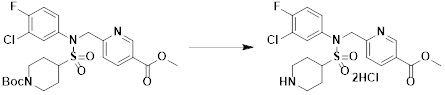
[1906] Раствор метил 6-(((1-(трет-бутоксикарбонил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотината (1,920 г, 3,542 ммоль) в 1,4-диоксане (10 мл) смешивали при комнатной температуре с хлористоводородной кислотой (4,00 M раствор в 1,4-диоксан, 8,856 мл, 35,423 ммоль), перемешивали при той же температуре в течение 3 ч и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли этилацетатом (20 мл) и гексаном (20 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали гексаном и сушили с получением дигидрохлорида метил 6-((N-(3-хлор-4-фторфенил)пиперидин-4-сульфонамидо)метил)никотината в виде коричневого твердого вещества (1,760 г, 96,5%).
[1907] [Стадия 3] метил 6-(((N-(3-хлор-4-фторфенил)-1-(оксетан-3-ил)пиперидин)-4-сульфонамидо)метил)никотинат
[1908] 
[1909] Смесь дигидрохлорида метил 6-((N-(3-хлор-4-фторфенил)пиперидин-4-сульфонамидо)метил)никотината (0,300 г, 0,583 ммоль), оксетан-3-она (0,084 г, 1,165 ммоль) и N,N-диизопропилэтиламина (0,254 мл, 1,457 ммоль) в дихлорметане (20 мл) обрабатывали при комнатной температуре триацетоксиборгидридом натрия (0,247 г, 1,165 ммоль) и перемешивали при той же температуре в течение 16 ч. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 50% до 80%) с получением метил 6-(((N-(3-хлор-4-фторфенил)-1-(оксетан-3-ил)пиперидин)-4-сульфонамидо)метил)никотината в виде бежевого твердого вещества (0,286 г, 98,6%).
[1910] [Стадия 4] N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-(оксетан-3-ил)пиперидин-4-сульфонамид
[1911] 
[1912] Взвесь метил 6-(((N-(3-хлор-4-фторфенил)-1-(оксетан-3-ил)пиперидин)-4-сульфонамидо)метил)никотината (0,286 г, 0,574 ммоль) в этаноле (5 мл) смешивали при комнатной температуре с моногидратом гидразина (0,558 мл, 11,487 ммоль), перемешивали 110°C в течение 16 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли этилацетатом (5 мл) и гексаном (30 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали гексаном и сушили с получением N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-(оксетан-3-ил)пиперидин-4-сульфонамида в виде белого твердого вещества (0,243 г, 85,0%).
[1913] [Стадия 5] Соединение 11501
[1914] 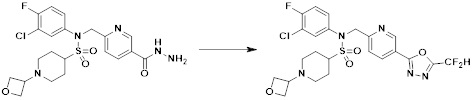
[1915] Раствор N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-(оксетан-3-ил)пиперидин-4-сульфонамида (0,243 г, 0,488 ммоль) в тетрагидрофуране (10 мл) смешивали при 70°C с 2,2-дифторуксусным ангидридом (0,152 мл, 1,220 ммоль) и N,N-диизопропилэтиламином (0,255 мл, 1,464 ммоль). Реакционную смесь перемешивали при той же температуре в течение 1 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 60% до 90%) с получением неочищенного продукта, а затем неочищенный продукт растворяли в дихлорметане (3 мл) и гексане (30 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали гексаном и сушили с получением N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-1-(оксетан-3-ил)пиперидин-4-сульфонамида в виде белого твердого вещества (0,126 г, 46,3%).
[1916] 1H-ЯМР (400 МГц, DMSO-d6) δ 9,11 (с, 1H), 8,42 (м, 1H), 7,83 (м, 1H), 7,73-7,69 (м, 1,25H), 7,56-7,54 (м, 1,5H), 7,46-7,36 (м, 1,25H), 5,18 (с, 2H), 4,53 (т, 2H, J=6,5 Гц), 4,42 (т, 2H, J=6,1 Гц), 3,44 (м, 1H), 2,80 (д, 2H, J=10,9 Гц), 2,11 (д, 2H, J=11,9 Гц), 1,86 (т, 2H, J=11,7 Гц), 1,72 (т, 2H, J=12,1 Гц); LRMS (ES) m/z 558,5 (M++1).
[1917] Пример 136: Соединение 11502, 1-(1-ацетилазетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)пиперидин-4-сульфонамид
[1918] [Стадия 1] метил 6-(((1-(1-(трет-бутоксикарбонил)азетидин-3-ил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотинат
[1919] 
[1920] Смесь дигидрохлорида метил 6-((N-(3-хлор-4-фторфенил)пиперидин-4-сульфонамидо)метил)никотината (1,600 г, 3,108 ммоль), трет-бутил 3-оксоазетидин-1-карбоксилата (0,798 г, 4,662 ммоль) и N,N-диизопропилэтиламина (1,353 мл, 7,770 ммоль) в дихлорметане (50 мл) обрабатывали при комнатной температуре триацетоксиборгидридом натрия (1,317 г, 6,216 ммоль) и перемешивали при той же температуре в течение 16 ч. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 30% до 60%) с получением метил 6-(((1-(1-(трет-бутоксикарбонил)азетидин-3-ил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотината в виде бежевого твердого вещества (1,520 г, 81,9%).
[1921] [Стадия 2] тригидрохлорид метил 6-(((1-(азетидин-3-ил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотината
[1922] 
[1923] Раствор метил 6-(((1-(1-(трет-бутоксикарбонил)азетидин-3-ил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотината (1,520 г, 2,546 ммоль) в 1,4-диоксане (20 мл) смешивали при комнатной температуре с хлористоводородной кислотой (4,00 M раствор в 1,4-диоксане, 9,546 мл, 38,185 ммоль), перемешивали при той же температуре в течение 3 ч и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли этилацетатом (20 мл) и гексаном (50 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали гексаном и сушили с получением тригидрохлорида метил 6-(((1-(азетидин-3-ил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотината в виде бежевого твердого вещества (1,420 г, 92,0%).
[1924] [Стадия 3] Метил 6-(((1-(1-ацетилазетидин-3-ил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотинат
[1925] 
[1926] Раствор тригидрохлорида метил 6-(((1-(азетидин-3-ил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотината (0,300 г, 0,604 ммоль) и N,N-диизопропилэтиламина (0,210 мл, 1,207 ммоль) в дихлорметане (10 мл) смешивали при комнатной температуре с уксусным ангидридом (0,085 мл, 0,905 ммоль). Реакционную смесь перемешивали при той же температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 15%) с получением метил 6-(((1-(1-ацетилазетидин-3-ил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотината в виде бесцветного масла (0,320 г, 98,3%).
[1927] [Стадия 4] 1-(1-ацетилазетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)пиперидин-4-сульфонамид
[1928] 
[1929] Метил 6-(((1-(1-ацетилазетидин-3-ил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотинат (0,330 г, 0,612 ммоль) и моногидрат гидразина (0,893 мл, 18,367 ммоль) смешивали при комнатной температуре в смеси этанол (8 мл)/вода (2 мл), перемешивали при 80°C в течение 18 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (1-(1-ацетилазетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)пиперидин-4-сульфонамид, 0,288 г, 87,3%, белое твердое вещество).
[1930] [Стадия 5] Соединение 11502
[1931] 
[1932] Раствор 1-(1-ацетилазетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)пиперидин-4-сульфонамида (0,288 г, 0,534 ммоль) и триэтиламина (0,223 мл, 1,603 ммоль) в тетрагидрофуране (10 мл) смешивали при комнатной температуре с 2,2-дифторуксусным ангидридом (0,199 мл, 1,603 ммоль), перемешивали при 80°C в течение 1 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 20%) с получением 1-(1-ацетилазетидин-3-ил)-N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)пиперидин-4-сульфонамида в виде белого твердого вещества (0,020 г, 6,2%).
[1933] 1H-ЯМР (400 МГц, CDCl3) δ 9,20 (дд, 1H, J=2,2, 0,8 Гц), 8,37 (дд, 1H, J=8,2, 2,2 Гц), 7,63 (дд, 1H, J=8,2, 0,8 Гц), 7,49 (дд, 1H, J=6,4, 2,7 Гц), 7,29 (ддд, 1H, J=8,9, 4,1, 2,7 Гц), 7,12-7,03 (м, 1H), 6,86 (д, 1H, J=51,6 Гц), 5,09 (д, 2H, J=1,6 Гц), 4,12 (т, 1H, J=7,8 Гц), 4,05-3,91 (м, 2H), 3,84 (дд, 1H, J=10,0, 5,3 Гц), 3,20-3,06 (м, 2H), 3,00-2,89 (м, 1H), 2,16 (д, 1H, J=13,5 Гц), 1,95 (тд, 6H, J=12,7, 10,8, 5,1 Гц), 1,86 (с, 3H); LRMS (ES) m/z 599,5 (M++1).
[1934] Пример 137: Соединение 11503, N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-1-(1-(метилсульфонил)азетидин-3-ил)пиперидин-4-сульфонамид
[1935] [Стадия 1] метил 6-(((N-(3-хлор-4-фторфенил)-1-(1-(метилсульфонил)азетидин-3-ил)пиперидин)-4-сульфонамидо)метил)никотинат
[1936] 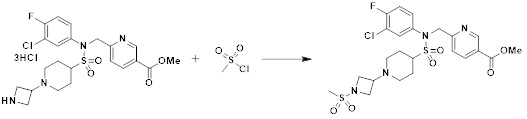
[1937] Раствор тригидрохлорида метил 6-(((1-(азетидин-3-ил)-N-(3-хлор-4-фторфенил)пиперидин)-4-сульфонамидо)метил)никотината (0,300 г, 0,604 ммоль) и N,N-диизопропилэтиламина (0,210 мл, 1,207 ммоль) в дихлорметане (10 мл) смешивали при комнатной температуре с метансульфонилхлоридом (0,070 мл, 0,905 ммоль). Реакционную смесь перемешивали при той же температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 15%) с получением метил 6-(((N-(3-хлор-4-фторфенил)-1-(1-(метилсульфонил)азетидин-3-ил)пиперидин)-4-сульфонамидо)метил)никотината в виде желтого твердого вещества (0,280 г, 80,7%).
[1938] [Стадия 2] N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-(1-(метилсульфонил)азетидин-3-ил)пиперидин-4-сульфонамид
[1939] 
[1940] Метил 6-(((N-(3-хлор-4-фторфенил)-1-(1-(метилсульфонил)азетидин-3-ил)пиперидин)-4-сульфонамидо)метил)никотинат (0,280 г, 0,487 ммоль) и моногидрат гидразина (0,710 мл, 14,607 ммоль) смешивали при комнатной температуре в смеси этанол (8 мл)/вода (2 мл), перемешивали при 80°C в течение 18 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-(1-(метилсульфонил)азетидин-3-ил)пиперидин-4-сульфонамид, 0,245 г, 87,5%, белое твердое вещество).
[1941] [Стадия 3] Соединение 11503
[1942] 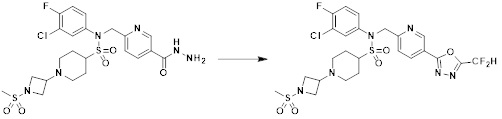
[1943] Раствор N-(3-хлор-4-фторфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-1-(1-(метилсульфонил)азетидин-3-ил)пиперидин-4-сульфонамида (0,245 г, 0,426 ммоль) и триэтиламина (0,178 мл, 1,278 ммоль) в тетрагидрофуране (10 мл) смешивали при комнатной температуре с 2,2-дифторуксусным ангидридом (0,159 мл, 1,278 ммоль), перемешивали при 80°C в течение 1 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 20%) с получением N-(3-хлор-4-фторфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-1-(1-(метилсульфонил)азетидин-3-ил)пиперидин-4-сульфонамида в виде белого твердого вещества (0,120 г, 44,4%).
[1944] 1H-ЯМР (400 МГц, CDCl3) δ 9,19 (дд, 1H, J=2,3, 0,8 Гц), 8,35 (дд, 1H, J=8,2, 2,2 Гц), 7,61 (дд, 1H, J=8,3, 0,9 Гц), 7,48 (дд, 1H, J=6,4, 2,7 Гц), 7,33-7,27 (м, 2H), 7,10-7,05 (м, 2H), 7,05-6,78 (м, 1H), 5,07 (с, 2H), 3,85 (ддд, 4H, J=30,8, 8,0, 6,6 Гц), 3,18 (кв, 1H, J=6,6 Гц), 3,10 (с, 1H), 2,87 (с, 3H), 2,12 (с, 2H), 1,93 (т, 4H, J=9,7 Гц); LRMS (ES) m/z 635,5 (M++1).
[1945] Пример 138: Соединение 11504, N-(4-хлор-3-метилфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[1946] [Стадия 1] N-(4-хлор-3-метилфенил)этансульфонамид
[1947] 
[1948] Раствор 4-хлор-3-метиланилина (0,500 г, 3,531 ммоль) и пиридина (0,427 мл, 5,297 ммоль) в дихлорметане (20 мл) смешивали при комнатной температуре с этансульфонилхлоридом (0,400 мл, 4,237 ммоль) и перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли 1 M водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 5% до 50%) с получением N-(4-хлор-3-метилфенил)этансульфонамида в виде бежевого твердого вещества (0,440 г, 53,3%).
[1949] [Стадия 2] метил 6-((N-(4-хлор-3-метилфенил)этилсульфонамидо)метил)никотинат
[1950] 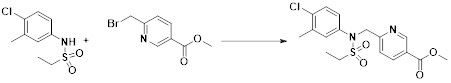
[1951] Раствор N-(4-хлор-3-метилфенил)этансульфонамида (0,200 г, 0,856 ммоль), карбоната калия (0,177 г, 1,284 ммоль), метил 6-(бромметил)никотината (0,217 г, 0,941 ммоль) и йодида калия (0,071 г, 0,428 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((N-(4-хлор-3-метилфенил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,150 г, 45,8%).
[1952] [Стадия 3] N-(4-хлор-3-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1953] 
[1954] Раствор метил 6-((N-(4-хлор-3-метилфенил)этилсульфонамидо)метил)никотината (0,150 г, 0,392 ммоль) и моногидрата гидразина (0,190 мл, 3,918 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-хлор-3-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,077 г, 51,3%, желтое масло).
[1955] [Стадия 4] Соединение 11504
[1956] 
[1957] Раствор N-(4-хлор-3-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,077 г, 0,201 ммоль), триэтиламина (0,112 мл, 0,804 ммоль) и 2,2-дифторуксусного ангидрида (0,050 мл, 0,402 ммоль) в тетрагидрофуране (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 20%) с получением N-(4-хлор-3-метилфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамида в виде желтого твердого вещества (0,035 г, 39,3%).
[1958] 1H-ЯМР (400 МГц, CDCl3) δ 9,23 (дд, 1H, J=2,2, 0,9 Гц), 8,41 (дд, 1H, J=8,2, 2,2 Гц), 7,75 (дд, 1H, J=8,2, 0,9 Гц), 7,35-7,26 (м, 2H), 7,19 (ддд, 1H, J=8,6, 2,7, 0,7 Гц), 7,10-6,80 (м, 1H), 5,16 (с, 2H), 3,20 (кв, 2H, J=7,4 Гц), 2,35 (с, 3H), 1,46 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 443,3 (M++1).
[1959] Пример 139: Соединение 11505, N-(3-хлор-4-метилфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[1960] [Стадия 1] N-(3-хлор-4-метилфенил)этансульфонамид
[1961] 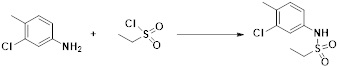
[1962] Раствор 3-хлор-4-метиланилина (0,500 г, 3,531 ммоль), этансульфонилхлорида (0,501 мл, 5,297 ммоль) и пиридина (0,341 мл, 4,237 ммоль) в дихлорметане (15 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали 1 M водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 80%) с получением N-(3-хлор-4-метилфенил)этансульфонамида в виде красного твердого вещества (0,528 г, 64,0%).
[1963] [Стадия 2] метил 6-((N-(3-хлор-4-метилфенил)этилсульфонамидо)метил)никотинат
[1964] 
[1965] Раствор метил 6-(бромметил)никотината (0,217 г, 0,941 ммоль) и йодида калия (0,071 г, 0,428 ммоль) в N,N-диметилформамиде (10 мл) смешивали при комнатной температуре с N-(3-хлор-4-метилфенил)этансульфонамидом (0,200 г, 0,856 ммоль) и карбонатом калия (0,177 г, 1,284 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением метил 6-((N-(3-хлор-4-метилфенил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,140 г, 42,7%).
[1966] [Стадия 3] N-(3-хлор-4-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1967] 
[1968] Раствор метил 6-((N-(3-хлор-4-метилфенил)этилсульфонамидо)метил)никотината (0,140 г, 0,366 ммоль) и моногидрата гидразина (0,178 мл, 3,657 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлор-4-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,088 г, 62,9%, желтое масло).
[1969] [Стадия 4] Соединение 11505
[1970] 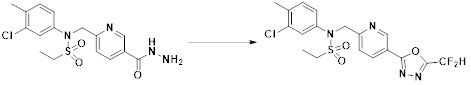
[1971] Раствор N-(3-хлор-4-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,088 г, 0,230 ммоль), триэтиламина (0,128 мл, 0,919 ммоль) и 2,2-дифторуксусного ангидрида (0,057 мл, 0,460 ммоль) в тетрагидрофуране (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 20%) с получением указанного в заголовке соединения в виде желтого масла (0,055 г, 54,0%).
[1972] 1H-ЯМР (400 МГц, CDCl3) δ 9,23 (дд, 1H, J=2,2, 0,9 Гц), 8,40 (дд, 1H, J=8,3, 2,2 Гц), 7,73 (дд, 1H, J=8,3, 0,9 Гц), 7,44 (д, 1H, J=2,1 Гц), 7,33-7,16 (м, 2H), 7,10-6,80 (м, 1H), 5,14 (с, 2H), 3,20 (кв, 2H, J=7,4 Гц), 2,33 (с, 3H), 1,45 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 443,43 (M++1).
[1973] Пример 140: Соединение 11506, N-(3,5-дихлорфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[1974] [Стадия 1] N-(3,5-дихлорфенил)этансульфонамид
[1975] 
[1976] Раствор 3,5-дихлоранилина (0,500 г, 3,086 ммоль) и пиридина (0,298 мл, 3,703 ммоль) в дихлорметане (15 мл) смешивали при комнатной температуре с этансульфонилхлоридом (0,437 мл, 4,629 ммоль). Реакционную смесь перемешивали при той же температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 30%) с получением N-(3,5-дихлорфенил)этансульфонамида в виде белого твердого вещества (0,638 г, 81,3%)
[1977] [Стадия 2] метил 6-((N-(3,5-дихлорфенил)этилсульфонамидо)метил)никотинат
[1978] 
[1979] Раствор метил 6-(бромметил)никотината (0,199 г, 0,866 ммоль) и йодида калия (0,065 г, 0,393 ммоль) в N,N-диметилформамиде (10 мл) смешивали при комнатной температуре с N-(3,5-дихлорфенил)этансульфонамидом (0,200 г, 0,787 ммоль) и карбонатом калия (0,163 г, 1,180 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((N-(3,5-дихлорфенил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,160 г, 50,4%).
[1980] [Стадия 3] N-(3,5-дихлорфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1981] 
[1982] Раствор метил 6-((N-(3,5-дихлорфенил)этилсульфонамидо)метил)никотината (0,160 г, 0,397 ммоль) и моногидрата гидразина (0,193 мл, 3,968 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Затем к концентрату добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3,5-дихлорфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,087 г, 54,4%, желтое масло).
[1983] [Стадия 4] Соединение 11506
[1984] 
[1985] Раствор N-(3,5-дихлорфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,087 г, 0,216 ммоль), триэтиламина (0,120 мл, 0,863 ммоль) и 2,2-дифторуксусного ангидрида (0,054 мл, 0,431 ммоль) в тетрагидрофуране (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 20%) с получением N-(3,5-дихлорфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамида в виде желтого масла (0,039 г, 39,0%).
[1986] 1H-ЯМР (400 МГц, CDCl3) δ 9,28 (дд, 1H, J=2,2, 0,9 Гц), 8,43 (дд, 1H, J=8,2, 2,2 Гц), 7,67 (дт, 1H, J=8,2, 0,7 Гц), 7,41 (д, 2H, J=1,8 Гц), 7,28 (д, 1H, J=1,8 Гц), 7,10-6,81 (м, 1H), 5,15 (с, 2H), 3,23 (кв, 2H, J=7,4 Гц), 1,45 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 463,35 (M++1).
[1987] Пример 141: Соединение 11507, N-(3,4-дихлорфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[1988] [Стадия 1] N-(3,4-дихлорфенил)этансульфонамид
[1989] 
[1990] Раствор 3,4-дихлоранилина (0,500 г, 3,086 ммоль) и пиридина (0,373 мл, 4,629 ммоль) в дихлорметане (20 мл) смешивали при комнатной температуре с этансульфонилхлоридом (0,350 мл, 3,703 ммоль) и перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли 1 M водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 5% до 50%) с получением N-(3,4-дихлорфенил)этансульфонамид в виде красного твердого вещества (0,430 г, 54,8%).
[1991] [Стадия 2] метил 6-((N-(3,4-дихлорфенил)этилсульфонамидо)метил)никотинат
[1992] 
[1993] Раствор метил 6-(бромметил)никотината (0,199 г, 0,866 ммоль) и йодида калия (0,065 г, 0,393 ммоль) в N,N-диметилформамиде (10 мл) смешивали при комнатной температуре с N-(3,4-дихлорфенил)этансульфонамидом (0,200 г, 0,787 ммоль) и карбонатом калия (0,163 г, 1,180 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением метил 6-((N-(3,4-дихлорфенил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,110 г, 34,7%).
[1994] [Стадия 3] N-(3,4-дихлорфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[1995] 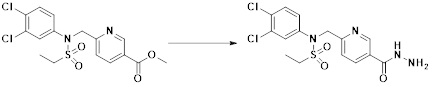
[1996] Раствор метил 6-((N-(3,4-дихлорфенил)этилсульфонамидо)метил)никотината (0,110 г, 0,273 ммоль) и моногидрата гидразина (0,133 мл, 2,728 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3,4-дихлорфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,046 г, 41,8%, желтое масло).
[1997] [Стадия 4] N-(3,4-дихлорфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)этансульфонамид
[1998] 
[1999] Раствор N-(3,4-дихлорфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,046 г, 0,114 ммоль), триэтиламина (0,064 мл, 0,456 ммоль) и 2,2-дифторуксусного ангидрида (0,028 мл, 0,228 ммоль) в тетрагидрофуране (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3,4-дихлорфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)этансульфонамид, 0,029 г, 52,8%, желтое масло)
[2000] [Стадия 5] Соединение 11507
[2001] 
[2002] Раствор N-(3,4-дихлорфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)этансульфонамида (0,029 г, 0,060 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,029 г, 0,121 ммоль) в тетрагидрофуране (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(3,4-дихлорфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамида в виде желтого твердого вещества (0,012 г, 43,0%).
[2003] 1H-ЯМР (400 МГц, CDCl3) δ 9,26 (дд, 1H, J=2,2, 0,9 Гц), 8,41 (дд, 1H, J=8,2, 2,2 Гц), 7,68 (дд, 1H, J=8,2, 0,9 Гц), 7,60 (д, 1H, J=2,5 Гц), 7,42 (д, 1H, J=8,7 Гц), 7,36-7,25 (м, 1H), 7,16-6,77 (м, 1H), 5,15 (с, 2H), 3,21 (кв, 2H, J=7,4 Гц), 1,49-1,38 (м, 3H); LRMS (ES) m/z 463,35 (M++1).
[2004] Пример 142: Соединение 11508, N-(3-хлор-5-метилфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамид
[2005] [Стадия 1] N-(3-хлор-5-метилфенил)этансульфонамид
[2006] 
[2007] Раствор 3-хлор-5-метиланилина (0,500 г, 3,531 ммоль) и пиридина (0,427 мл, 5,297 ммоль) в дихлорметане (20 мл) смешивали при комнатной температуре с этансульфонилхлоридом (0,400 мл, 4,237 ммоль) и перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли 1 M водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 5% до 50%) с получением N-(3-хлор-5-метилфенил)этансульфонамида в виде бежевого твердого вещества (0,380 г, 46,0%).
[2008] [Стадия 2] метил 6-((N-(3-хлор-5-метилфенил)этилсульфонамидо)метил)никотинат
[2009] 
[2010] Раствор метил 6-(бромметил)никотината (0,217 г, 0,941 ммоль) и йодида калия (0,071 г, 0,428 ммоль) в N,N-диметилформамиде (10 мл) смешивали при комнатной температуре с N-(3-хлор-5-метилфенил)этансульфонамидом (0,200 г, 0,856 ммоль) и карбонатом калия (0,177 г, 1,284 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 50%) с получением метил 6-((N-(3-хлор-5-метилфенил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,130 г, 39,7%).
[2011] [Стадия 3] N-(3-хлор-5-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид
[2012] 
[2013] Раствор метил 6-((N-(3-хлор-5-метилфенил)этилсульфонамидо)метил)никотината (0,130 г, 0,340 ммоль) и моногидрата гидразина (0,165 мл, 3,395 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлор-5-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамид, 0,063 г, 48,5%, желтое масло).
[2014] [Стадия 4] N-(3-хлор-5-метилфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)этансульфонамид
[2015] 
[2016] Раствор N-(3-хлор-5-метилфенил)-N-((5-(гидразинкарбонил)пиридин-2-ил)метил)этансульфонамида (0,063 г, 0,165 ммоль), триэтиламина (0,092 мл, 0,658 ммоль) и 2,2-дифторуксусного ангидрида (0,041 мл, 0,329 ммоль) в тетрагидрофуране (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(3-хлор-5-метилфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)этансульфонамид, 0,034 г, 44,8%, желтое масло).
[2017] [Стадия 5] Соединение 11508
[2018] 
[2019] Раствор N-(3-хлор-5-метилфенил)-N-((5-(2-(2,2-дифторацетил)гидразин-1-карбонил)пиридин-2-ил)метил)этансульфонамида (0,034 г, 0,074 ммоль) и 1-метокси-N-триэтиламмониосульфонилметилимидата (реагент Бургесса, 0,035 г, 0,148 ммоль) в тетрагидрофуране (5 мл) перемешивали при 90°C в течение 5 ч, и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(3-хлор-5-метилфенил)-N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)этансульфонамида в виде желтого твердого вещества (0,026 г, 79,6%).
[2020] 1H-ЯМР (400 МГц, CDCl3) δ 9,25 (дд, 1H, J=2,2, 0,9 Гц), 8,41 (дд, 1H, J=8,2, 2,2 Гц), 7,73 (дд, 1H, J=8,2, 0,8 Гц), 7,26 (тд, 1H, J=2,0, 0,6 Гц), 7,16 (ддт, 1H, J=2,3, 1,5, 0,8 Гц), 7,12-7,06 (м, 1H), 7,02-6,79 (м, 1H), 5,15 (с, 2H), 3,21 (кв, 2H, J=7,4 Гц), 2,32 (с, 3H), 1,46 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 443,36 (M++1).
[2021] Пример 143: Соединение 11514, N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-2-(пирролидин-1-ил)этан-1-сульфонамид
[2022] [Стадия 1] N-(3-хлор-4-фторфенил)этенсульфонамид
[2023] 
[2024] Раствор 3-хлор-4-фторанилина (3,000 г, 20,610 ммоль) и 2-хлорэтан-1-сульфонилхлорида (2,369 мл, 22,671 ммоль) в дихлорметане (14 мл) смешивали при комнатной температуре с пиридин (2,158 мл, 26,793 ммоль) и перемешивали при той же температуре в течение 6 ч. Затем к реакционной смеси добавляли 0,1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 24g; этилацетат/гексан=от 0% до 20%) с получением N-(3-хлор-4-фторфенил)этенсульфонамида в виде серого твердого вещества (3,800 г, 78,2%).
[2025] [Стадия 2] метил 4-((N-(3-хлор-4-фторфенил)винилсульфонамидо)метил)-3-фторбензоат
[2026] 
[2027] Раствор N-(3-хлор-4-фторфенил)этенсульфонамида (2,000 г, 8,487 ммоль), метил 4-(бромметил)-3-фторбензоата (3,145 г, 12,730 ммоль) и карбоната калия (1,290 г, 9,335 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 16 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 24g; этилацетат/гексан=от 0% до 30%) с получением метил 4-((N-(3-хлор-4-фторфенил)винилсульфонамидо)метил)-3-фторбензоата в виде светло-желтого твердого вещества (2,700 г, 91,1%).
[2028] [Стадия 3] метил 4-(((N-(3-хлор-4-фторфенил)-2-(пирролидин-1-ил)этил)сульфонамидо)метил)-3-фторбензоат
[2029] 
[2030] Раствор метил 4-((N-(3-хлор-4-фторфенил)винилсульфонамидо)метил)-3-фторбензоата (0,200 г, 0,498 ммоль), N,N-диизопропилэтиламина (0,104 мл, 0,597 ммоль) и пирролидина (0,071 г, 0,995 ммоль) в тетрагидрофуране (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 60%) с получением метил 4-(((N-(3-хлор-4-фторфенил)-2-(пирролидин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата в виде желтого твердого вещества (0,150 г, 63,7%).
[2031] [Стадия 4] N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(пирролидин-1-ил)этан-1-сульфонамид
[2032] 
[2033] Раствор метил 4-(((N-(3-хлор-4-фторфенил)-2-(пирролидин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата (0,150 г, 0,317 ммоль) и моногидрата гидразина (0,154 мл, 3,172 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли бикарбонатом натрия (10 мл) и водой (5 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой, и сушили с получением N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(пирролидин-1-ил)этан-1-сульфонамида в виде белого твердого вещества (0,100 г, 66,7%).
[2034] [Стадия 5] Соединение 11514
[2035] 
[2036] Раствор N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(пирролидин-1-ил)этан-1-сульфонамида (0,100 г, 0,211 ммоль), триэтиламина (0,147 мл, 1,057 ммоль) и 2,2-дифторуксусного ангидрида (0,079 мл, 0,634 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-2-(пирролидин-1-ил)этан-1-сульфонамида в виде желтого масла (0,045 г, 39,9%).
[2037] 1H-ЯМР (400 МГц, CDCl3) δ 7,90 (дд, 1H, J=8,1, 1,6 Гц), 7,75 (дд, 1H, J=9,9, 1,7 Гц), 7,67 (дд, 1H, J=8,0, 7,2 Гц), 7,51 (дд, 1H, J=6,4, 2,6 Гц), 7,25 (ддд, 1H, J=8,8, 4,2, 2,7 Гц), 7,10 (т, 1H, J=8,6 Гц), 7,06-6,77 (м, 1H), 5,04 (с, 2H), 3,32 (дд, 2H, J=7,4, 6,5 Гц), 3,05 (дд, 2H, J=7,4, 6,4 Гц), 2,75-2,49 (м, 4H), 1,96-1,84 (м, 4H); LRMS (ES) m/z 533,40 (M++1).
[2038] Пример 144: Соединение 11518, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиразин-2-ил)метил)-N-фенилметансульфонамид
[2039] [Стадия 1] метил 5-(бромметил)пиразин-2-карбоксилат
[2040] 
[2041] Смесь метил 5-метилпиразин-2-карбоксилата (3,000 г, 19,717 ммоль), 1-бромпирролидин-2,5-диона (NBS, 3,685 г, 20,703 ммоль) и азобисизобутиронитрила (AIBN, 1,295 г, 7,887 ммоль) в тетрахлорметане (20 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 10 ч, и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 15%) с получением метил 5-(бромметил)пиразин-2-карбоксилата в виде серого твердого вещества (1,500 г, 32,9%).
[2042] [Стадия 2] метил 5-((N-фенилметилсульфонамидо)метил)пиразин-2-карбоксилат
[2043] 
[2044] Раствор метил 5-(бромметил)пиразин-2-карбоксилата (0,567 г, 2,453 ммоль) и йодида калия (0,039 г, 0,234 ммоль) в N,N-диметилформамиде (6 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с N-фенилметансульфонамидом (0,400 г, 2,336 ммоль) и карбонатом калия (0,420 г, 3,037 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 8 ч. Реакционную смесь разбавляли водой и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением метил 5-((N-фенилметилсульфонамидо)метил)пиразин-2-карбоксилата в виде белого твердого вещества (0,710 г, 94,6%).
[2045] [Стадия 3] N-((5-(гидразинкарбонил)пиразин-2-ил)метил)-N-фенилметансульфонамид
[2046] 
[2047] Раствор метил 5-((N-фенилметилсульфонамидо)метил)пиразин-2-карбоксилата (0,400 г, 1,245 ммоль) и карбоната калия (0,860 г, 6,224 ммоль) в этаноле (4 мл) смешивали с моногидратом гидразина (0,605 мл, 12,447 ммоль) при комнатной температуре. Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 2 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиразин-2-ил)метил)-N-фенилметансульфонамид, 0,350 г, 87,5%, белое твердое вещество).
[2048] [Стадия 4] Соединение 11518
[2049] 
[2050] Раствор N-((5-(гидразинкарбонил)пиразин-2-ил)метил)-N-фенилметансульфонамида (0,100 г, 0,311 ммоль) и триэтиламина (0,130 мл, 0,934 ммоль) в тетрагидрофуране (5 мл) смешивали при комнатной температуре с 2,2-дифторуксусным ангидридом (0,085 мл, 0,685 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 60%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиразин-2-ил)метил)-N-фенилметансульфонамида в виде белого твердого вещества (0,070 г, 59,0%).
[2051] 1H-ЯМР (400 МГц, CDCl3) δ 9,39 (д, 1 H, J=1,4 Гц), 8,90 (д, 1 H, J=1,4 Гц), 7,41- 7,35 (м, 4 Гц), 7,32 (м, 1 Гц), 7,07 (с, 0,25 H), 6,94 (с, 0,5 H), 6,81 (с, 0,25 H), 5,19 (с, 2 H), 3,05 (с, 3 H); LRMS (ES) m/z 382,34 (M++1).
[2052] Пример 145: Соединение 11520, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(1-метил-1H-индазол-4-ил)этансульфонамид
[2053] [Стадия 1] N-(1-метил-1H-индазол-4-ил)этансульфонамид
[2054] 
[2055] Раствор 1-метил-1H-индазол-4-амина (0,300 г, 2,038 ммоль), пиридина (0,197 мл, 2,446 ммоль) и этансульфонилхлорида (0,231 мл, 2,446 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(1-метил-1H-индазол-4-ил)этансульфонамид, 0,350 г, 71,8%, желтое масло).
[2056] [Стадия 2] метил 3-фтор-4-((N-(1-метил-1H-индазол-4-ил)этилсульфонамидо)метил)бензоат
[2057] 
[2058] Раствор метил 4-(бромметил)-3-фторбензоата (0,216 г, 0,873 ммоль) и йодида калия (0,066 г, 0,397 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с N-(1-метил-1H-индазол-4-ил)этансульфонамидом (0,190 г, 0,794 ммоль) и карбонатом калия (0,165 г, 1,191 ммоль). Реакционную смесь перемешивали при 50°C в течение дополнительных 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(1-метил-1H-индазол-4-ил)этилсульфонамидо)метил)бензоата в виде желтого твердого вещества (0,250 г, 77,7%).
[2059] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(1-метил-1H-индазол-4-ил)этансульфонамид
[2060] 
[2061] Раствор метил 3-фтор-4-((N-(1-метил-1H-индазол-4-ил)этилсульфонамидо)метил)бензоата (0,250 г, 0,617 ммоль) и моногидрата гидразина (0,300 мл, 6,166 ммоль) в этаноле (15 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Затем к концентрату добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(1-метил-1H-индазол-4-ил)этансульфонамид, 0,200 г, 80,0%, желтое масло).
[2062] [Стадия 4] Соединение 11520
[2063] 
[2064] Смесь N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(1-метил-1H-индазол-4-ил)этансульфонамида (0,200 г, 0,493 ммоль), триэтиламина (0,344 мл, 2,466 ммоль) и 2,2-дифторуксусного ангидрида (0,184 мл, 1,480 ммоль) в тетрагидрофуране (15 мл), полученную при комнатной температуре нагревали при температуре кипения с обратным холодильником в течение 12 ч, и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(1-метил-1H-индазол-4-ил)этансульфонамида в виде белого твердого вещества (0,110 г, 47,9%).
[2065] 1H-ЯМР (400 МГц, CDCl3) δ 8,01 (д, 1H, J=0,9 Гц), 7,82 (дт, 1H, J=8,1, 1,5 Гц), 7,71-7,62 (м, 2H), 7,42-7,30 (м, 2H), 7,13 (дд, 1H, J=7,0, 1,1 Гц), 7,07-6,74 (м, 1H), 5,17 (с, 2H), 4,08 (с, 3H), 3,20 (кв, 2H, J=7,4 Гц), 1,48 (тд, 3H, J=7,4, 1,1 Гц); LRMS (ES) m/z 466,42 (M++1).
[2066] Пример 146: Соединение 11521, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(1-метил-1H-индазол-6-ил)этансульфонамид
[2067] [Стадия 1] N-(1-метил-1H-индазол-6-ил)этансульфонамид
[2068] 
[2069] Раствор 1-метил-1H-индазол-6-амина (0,300 г, 2,038 ммоль), пиридина (0,197 мл, 2,446 ммоль) и этансульфонилхлорида (0,231 мл, 2,446 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(1-метил-1H-индазол-6-ил)этансульфонамид, 0,360 г, 73,8%, желтое масло).
[2070] [Стадия 2] метил 3-фтор-4-((N-(1-метил-1H-индазол-6-ил)этилсульфонамидо)метил)бензоат
[2071] 
[2072] Раствор метил 4-(бромметил)-3-фторбензоата (0,261 г, 1,057 ммоль) и йодида калия (0,080 г, 0,481 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при комнатной температуре в течение 30 мин, и смешивали с N-(1-метил-1H-индазол-6-ил)этансульфонамидом (0,230 г, 0,961 ммоль) и карбонатом калия (0,199 г, 1,442 ммоль). Реакционную смесь перемешивали при 50°C в течение дополнительных 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(1-метил-1H-индазол-6-ил)этилсульфонамидо)метил)бензоата в виде желтого масла (0,200 г, 51,3%).
[2073] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(1-метил-1H-индазол-6-ил)этансульфонамид
[2074] 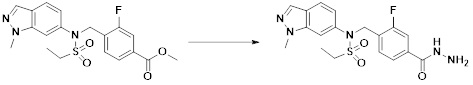
[2075] Раствор метил 3-фтор-4-((N-(1-метил-1H-индазол-6-ил)этилсульфонамидо)метил)бензоата (0,200 г, 0,493 ммоль) и моногидрата гидразина (0,240 мл, 4,933 ммоль) в этаноле (20 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Затем к концентрату добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(1-метил-1H-индазол-6-ил)этансульфонамид, 0,180 г, 90,0%, белое твердое вещество).
[2076] [Стадия 4] Соединение 11521
[2077] 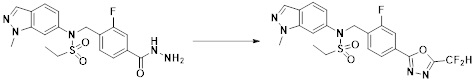
[2078] Смесь N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(1-метил-1H-индазол-6-ил)этансульфонамида (0,180 г, 0,444 ммоль), триэтиламина (0,309 мл, 2,220 ммоль) и 2,2-дифторуксусного ангидрида (0,166 мл, 1,332 ммоль) в тетрагидрофуране (15 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 12 ч, и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(1-метил-1H-индазол-6-ил)этансульфонамида в виде желтого масла (0,130 г, 62,9%).
[2079] 1H-ЯМР (400 МГц, CDCl3) δ 7,96 (д, 1H, J=1,0 Гц), 7,88 (дд, 1H, J=8,0, 1,6 Гц), 7,77-7,66 (м, 3H), 7,42 (дт, 1H, J=1,8, 0,8 Гц), 7,11 (дд, 1H, J=8,6, 1,8 Гц), 7,06-6,76 (м, 1H), 5,16 (с, 2H), 4,04 (с, 3H), 3,17 (кв, 2H, J=7,4 Гц), 1,49 (д, 3H, J=7,3 Гц); LRMS (ES) m/z 466,30 (M++1).
[2080] Пример 147: Соединение 11522, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(1-метил-1H-индазол-7-ил)этансульфонамид
[2081] [Стадия 1] N-(1-метил-1H-индазол-7-ил)этансульфонамид
[2082] 
[2083] Раствор 1-метил-1H-индазол-7-амина (0,500 г, 3,397 ммоль), пиридина (0,328 мл, 4,077 ммоль) и этансульфонилхлорида (0,385 мл, 4,077 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали 1 Н водным раствором хлористоводородной кислоты, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(1-метил-1H-индазол-7-ил)этансульфонамид, 0,550 г, 67,7%, желтое твердое вещество).
[2084] [Стадия 2] метил 3-фтор-4-((N-(1-метил-1H-индазол-7-ил)этилсульфонамидо)метил)бензоат
[2085] 
[2086] Раствор метил 4-(бромметил)-3-фторбензоата (0,227 г, 0,919 ммоль) и йодида калия (0,069 г, 0,418 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 30 мин, и смешивали с N-(1-метил-1H-индазол-7-ил)этансульфонамидом (0,200 г, 0,836 ммоль) и карбонатом калия (0,173 г, 1,254 ммоль). Реакционную смесь перемешивали при 50°C в течение дополнительных 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 3-фтор-4-((N-(1-метил-1H-индазол-7-ил)этилсульфонамидо)метил)бензоата в виде желтого масла (0,240 г, 70,8%).
[2087] [Стадия 3] N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(1-метил-1H-индазол-7-ил)этансульфонамид
[2088] 
[2089] Раствор метил 3-фтор-4-((N-(1-метил-1H-индазол-7-ил)этилсульфонамидо)метил)бензоата (0,240 г, 0,592 ммоль) и моногидрата гидразина (0,288 мл, 5,919 ммоль) в этаноле (20 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Затем к концентрату добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(1-метил-1H-индазол-7-ил)этансульфонамид, 0,200 г, 83,3%, желтое масло).
[2090] [Стадия 4] Соединение 11522
[2091] 
[2092] Смесь N-(2-фтор-4-(гидразинкарбонил)бензил)-N-(1-метил-1H-индазол-7-ил)этансульфонамида (0,200 г, 0,493 ммоль), триэтиламина (0,344 мл, 2,466 ммоль) и 2,2-дифторуксусного ангидрида (0,184 мл, 1,480 ммоль) в тетрагидрофуране (15 мл) нагревали при температуре кипения с обратным холодильником в течение 12 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-N-(1-метил-1H-индазол-7-ил)этансульфонамида в виде желтого масла (0,150 г, 65,3%).
[2093] 1H-ЯМР (400 МГц, CDCl3) δ7,98 (д, 1H, J=1,5 Гц), 7,80 (дд, 1H, J=8,0, 1,7 Гц), 7,78-7,71 (м, 2H), 7,42 (т, 1H, J=7,6 Гц), 7,27-7,20 (м, 1H), 7,12 (дд, 1H, J=8,0, 7,4 Гц), 7,07-6,76 (м, 1H), 5,07 (д, 2H, J=1,0 Гц), 4,13 (с, 3H), 3,29 (квд, 2H, J=7,4, 1,8 Гц), 1,52 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 466,42 (M++1).
[2094] Пример 148: Соединение 11539, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-4-ил)этансульфонамид
[2095] [Стадия 1] метил 6-((N-(1-метил-1H-индазол-4-ил)этилсульфонамидо)метил)никотинат
[2096] 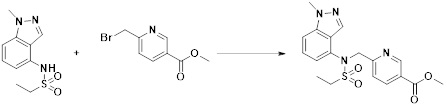
[2097] Раствор метил 6-(бромметил)никотината (0,159 г, 0,690 ммоль) и йодида калия (0,052 г, 0,313 ммоль) в N,N-диметилформамиде (15 мл) смешивали при комнатной температуре с N-(1-метил-1H-индазол-4-ил)этансульфонамидом (0,150 г, 0,627 ммоль) и карбонатом калия (0,130 г, 0,940 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((N-(1-метил-1H-индазол-4-ил)этилсульфонамидо)метил)никотината в виде желтого масла (0,190 г, 78,0%).
[2098] [Стадия 2] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-4-ил)этансульфонамид
[2099] 
[2100] Раствор метил 6-((N-(1-метил-1H-индазол-4-ил)этилсульфонамидо)метил)никотината (0,190 г, 0,489 ммоль) и моногидрата гидразина (0,245 г, 4,891 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли водой (10 мл) и бикарбонатом натрия (5 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-4-ил)этансульфонамида в виде белого твердого вещества (0,150 г, 78,9%).
[2101] [Стадия 3] Соединение 11539
[2102] 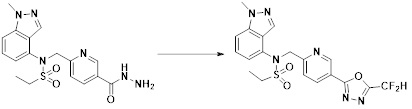
[2103] Смесь N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-4-ил)этансульфонамида (0,080 г, 0,206 ммоль), триэтиламина (0,144 мл, 1,030 ммоль) и 2,2-дифторуксусного ангидрида (0,077 мл, 0,618 ммоль) в тетрагидрофуране (5 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 12 ч, и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 40%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-4-ил)этансульфонамида в виде желтого масла (0,056 г, 60,6%).
[2104] 1H-ЯМР (400 МГц, CDCl3) δ 9,17 (дд, 1H, J=2,2, 0,9 Гц), 8,35 (дд, 1H, J=8,3, 2,3 Гц), 8,08 (д, 1H, J=0,8 Гц), 7,78 (дд, 1H, J=8,3, 0,9 Гц), 7,42-7,26 (м, 2H), 7,21 (дд, 1H, J=6,6, 1,5 Гц), 7,10-6,76 (м, 1H), 5,28 (с, 2H), 4,08 (с, 3H), 3,26 (кв, 2H, J=7,4 Гц), 1,48 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 449,40 (M++1).
[2105] Пример 149: Соединение 11540, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-6-ил)этансульфонамид
[2106] [Стадия 1] метил 6-((N-(1-метил-1H-индазол-6-ил)этилсульфонамидо)метил)никотинат
[2107] 
[2108] Раствор метил 6-(бромметил)никотината (0,212 г, 0,919 ммоль) и йодида калия (0,069 г, 0,418 ммоль) в N,N-диметилформамиде (15 мл) смешивали с N-(1-метил-1H-индазол-6-ил)этансульфонамидом (0,200 г, 0,836 ммоль) и карбонатом калия (0,173 г, 1,254 ммоль) при 50°C. Реакционную смесь перемешивали при той же температуре в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((N-(1-метил-1H-индазол-6-ил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,220 г, 67,8%).
[2109] [Стадия 2] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-6-ил)этансульфонамид
[2110] 
[2111] Раствор метил 6-((N-(1-метил-1H-индазол-6-ил)этилсульфонамидо)метил)никотината (0,200 г, 0,515 ммоль) и моногидрата гидразина (0,258 г, 5,149 ммоль) в этаноле (20 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток разбавляли водой (10 мл) и бикарбонатом натрия (5 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-6-ил)этансульфонамида в виде желтого твердого вещества (0,170 г, 85,0%).
[2113] [Стадия 3] Соединение 11540
[2114]
[2115] Смесь N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-6-ил)этансульфонамида (0,100 г, 0,257 ммоль), триэтиламина (0,179 мл, 1,287 ммоль) и 2,2-дифторуксусного ангидрида (0,096 мл, 0,772 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре нагревали при температуре кипения с обратным холодильником в течение 12 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-6-ил)этансульфонамида в виде белого твердого вещества (0,089 г, 77,1%).
[2116] 1H-ЯМР (400 МГц, CDCl3) δ 9,22 (дд, 1H, J=2,2, 0,9 Гц), 8,38 (дд, 1H, J=8,2, 2,2 Гц), 7,95 (д, 1H, J=1,0 Гц), 7,78 (дд, 1H, J=8,3, 0,9 Гц), 7,70 (дд, 1H, J=8,6, 0,7 Гц), 7,54 (дт, 1H, J=1,7, 0,9 Гц), 7,19 (дд, 1H, J=8,6, 1,8 Гц), 7,10-6,75 (м, 1H), 5,27 (с, 2H), 4,06 (с, 3H), 3,23 (кв, 2H, J=7,4 Гц), 1,47 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 449,34 (M++1).
[2117] Пример 150: Соединение 11541, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-7-ил)этансульфонамид
[2118] [Стадия 1] метил 6-((N-(1-метил-1H-индазол-7-ил)этилсульфонамидо)метил)никотинат
[2119]
[2120] Раствор метил 6-(бромметил)никотината (0,212 г, 0,919 ммоль) и йодида калия (0,069 г, 0,418 ммоль) в N,N-диметилформамиде (15 мл) смешивали при 50°C с N-(1-метил-1H-индазол-7-ил)этансульфонамидом (0,200 г, 0,836 ммоль) и карбонатом калия (0,173 г, 1,254 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 40%) с получением метил 6-((N-(1-метил-1H-индазол-7-ил)этилсульфонамидо)метил)никотината в виде желтого твердого вещества (0,230 г, 70,8%).
[2121] [Стадия 2] N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-7-ил)этансульфонамид
[2122]
[2123] Раствор метил 6-((N-(1-метил-1H-индазол-7-ил)этилсульфонамидо)метил)никотината (0,230 г, 0,592 ммоль) и моногидрата гидразина (0,296 г, 5,921 ммоль) в этаноле (20 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток разбавляли водой (10 мл) и бикарбонатом натрия (5 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-7-ил)этансульфонамида в виде желтого твердого вещества (0,180 г, 78,3%).
[2125] [Стадия 3] Соединение 11541
[2126] 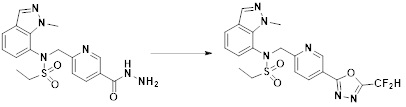
[2127] Смесь N-((5-(гидразинкарбонил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-7-ил)этансульфонамида (0,050 г, 0,129 ммоль), триэтиламина (0,090 мл, 0,644 ммоль) и 2,2-дифторуксусного ангидрида (0,048 мл, 0,386 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 12 ч, и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридин-2-ил)метил)-N-(1-метил-1H-индазол-7-ил)этансульфонамида в виде желтого масла (0,039 г, 67,6%).
[2128] 1H-ЯМР (400 МГц, CDCl3) δ 9,34 (дд, 1H, J=2,2, 0,8 Гц), 8,33 (дд, 1H, J=8,1, 2,3 Гц), 8,01 (с, 1H), 7,71 (дд, 1H, J=8,0, 1,0 Гц), 7,36 (дд, 1H, J=8,1, 0,9 Гц), 7,17 (дд, 1H, J=7,4, 1,0 Гц), 7,02 (дд, 1H, J=8,0, 7,4 Гц), 6,97-6,81 (м, 1H), 5,39 (д, 1H, J=15,1 Гц), 4,91 (д, 1H, J=15,1 Гц), 4,33 (с, 3H), 3,61 (дкв, 1H, J=13,6, 7,5 Гц), 3,42 (дкв, 1H, J=13,5, 7,4 Гц), 1,51 (т, 3H, J=7,4 Гц); LRMS (ES) m/z 449,46 (M++1).
[2129] Пример 151: Соединение 11552, N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-2-(4-метилпиперазин-1-ил)этан-1-сульфонамид
[2130] [Стадия 1] трет-бутил 4-(2-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)этил)пиперазин-1-карбоксилат
[2131] 
[2132] Раствор метил 4-((N-(3-хлор-4-фторфенил)винилсульфонамидо)метил)-3-фторбензоата (1,000 г, 2,489 ммоль), N,N-диизопропилэтиламина (0,650 мл, 3,733 ммоль) и трет-бутилпиперазин-1-карбоксилата (0,603 г, 3,235 ммоль) в тетрагидрофуране (5 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением трет-бутил 4-(2-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)этил)пиперазин-1-карбоксилата в виде белого твердого вещества (1,300 г, 88,8%).
[2133] [Стадия 2] метил 4-(((N-(3-хлор-4-фторфенил)-2-(пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоат гидрохлорид
[2134] 
[2135] Раствор трет-бутил 4-(2-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)этил)пиперазин-1-карбоксилата (1,300 г, 2,211 ммоль) и хлористоводородной кислоты (4,00 M раствор в 1,4-диоксане, 1,105 мл, 4,421 ммоль) в дихлорметане (50 мл) перемешивали при комнатной температуре в течение 5 ч. Преципитат собирали фильтрацией, промывали дихлорметаном и сушили с получением гидрохлорида метил 4-(((N-(3-хлор-4-фторфенил)-2-(пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата в виде белого твердого вещества (1,150 г, 99,2%).
[2136] [Стадия 3] метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-метилпиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоат
[2137] 
[2138] Раствор гидрохлорида метил 4-(((N-(3-хлор-4-фторфенил)-2-(пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата (0,200 г, 0,381 ммоль), формальдегида (0,023 г, 0,763 ммоль) и уксусной кислоты (0,024 мл, 0,420 ммоль) в дихлорметане (10 мл) смешивали при комнатной температуре с триацетоксиборгидридом натрия (0,162 г, 0,763 ммоль). Реакционную смесь перемешивали при той же температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-метилпиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата в виде желтого масла (0,150 г, 78,4%).
[2139] [Стадия 4] N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-метилпиперазин-1-ил)этан-1-сульфонамид
[2140] 
[2141] Раствор метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-метилпиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата (0,150 г, 0,299 ммоль) и моногидрата гидразина (0,145 мл, 2,988 ммоль) в этаноле (20 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли водой (10 мл) и бикарбонатом натрия (5 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-метилпиперазин-1-ил)этан-1-сульфонамида в виде белого твердого вещества (0,120 г, 80,0%).
[2142] [Стадия 5] Соединение 11552
[2143] 
[2144] Смесь N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-метилпиперазин-1-ил)этан-1-сульфонамида (0,080 г, 0,159 ммоль), триэтиламина (0,111 мл, 0,797 ммоль) и 2,2-дифторуксусного ангидрида (0,059 мл, 0,478 ммоль) в тетрагидрофуране (10 мл) нагревали при температуре кипения с обратным холодильником в течение 12 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-2-(4-метилпиперазин-1-ил)этан-1-сульфонамида в виде белого твердого вещества (0,056 г, 62,5%).
[2145] 1H-ЯМР (400 МГц, CDCl3) δ 7,91 (дд, 1H, J=7,9, 1,6 Гц), 7,76 (дд, 1H, J=9,9, 1,6 Гц), 7,66 (т, 1H, J=7,6 Гц), 7,50 (дд, 1H, J=6,5, 2,6 Гц), 7,24 (ддд, 1H, J=8,8, 4,1, 2,7 Гц), 7,11 (т, 1H, J=8,6 Гц), 7,07-6,74 (м, 1H), 5,03 (с, 2H), 3,28 (т, 2H, J=6,9 Гц), 2,94 (т, 2H, J=6,9 Гц), 2,59 (с, 8H), 2,36 (с, 3H); LRMS (ES) m/z 562,47 (M++1).
[2146] Пример 152: Соединение 11553, 2-(4-ацетилпиперазин-1-ил)-N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)этан-1-сульфонамид
[2147] [Стадия 1] метил 4-(((2-(4-ацетилпиперазин-1-ил)-N-(3-хлор-4-фторфенил)этил)сульфонамидо)метил)-3-фторбензоат
[2148] 
[2149] Раствор гидрохлорида метил 4-(((N-(3-хлор-4-фторфенил)-2-(пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата (0,200 г, 0,381 ммоль), триэтиламина (0,080 мл, 0,572 ммоль) и уксусного ангидрида (0,047 мл, 0,496 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 80%) с получением метил 4-(((2-(4-ацетилпиперазин-1-ил)-N-(3-хлор-4-фторфенил)этил)сульфонамидо)метил)-3-фторбензоата в виде желтого масла (0,160 г, 79,2%).
[2150] [Стадия 2] 2-(4-ацетилпиперазин-1-ил)-N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этан-1-сульфонамид
[2151] 
[2152] Раствор метил 4-(((2-(4-ацетилпиперазин-1-ил)-N-(3-хлор-4-фторфенил)этил)сульфонамидо)метил)-3-фторбензоата (0,160 г, 0,302 ммоль) и моногидрата гидразина (0,147 мл, 3,019 ммоль) в этаноле (20 мл) перемешивали при 90°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток разбавляли водой (10 мл) и бикарбонатом натрия (5 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением 2-(4-ацетилпиперазин-1-ил)-N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этан-1-сульфонамида в виде белого твердого вещества (0,130 г, 81,2%).
[2153] [Стадия 3] Соединение 11553
[2154] 
[2155] Смесь 2-(4-ацетилпиперазин-1-ил)-N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)этан-1-сульфонамида (0,080 г, 0,151 ммоль), триэтиламина (0,105 мл, 0,755 ммоль) и 2,2-дифторуксусного ангидрида (0,056 мл, 0,453 ммоль) в тетрагидрофуране (10 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 12 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением 2-(4-ацетилпиперазин-1-ил)-N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)этан-1-сульфонамида в виде желтого твердого вещества (0,051 г, 57,3%).
[2156] 1H-ЯМР (400 МГц, CDCl3) δ 7,91 (дд, 1H, J=8,1, 1,7 Гц), 7,77 (дд, 1H, J=9,9, 1,6 Гц), 7,64 (т, 1H, J=7,6 Гц), 7,45 (дд, 1H, J=6,4, 2,6 Гц), 7,22 (ддд, 1H, J=8,9, 4,2, 2,6 Гц), 7,12 (т, 1H, J=8,6 Гц), 7,08-6,77 (м, 1H), 5,01 (с, 2H), 3,68 (т, 2H, J=5,1 Гц), 3,57-3,49 (м, 2H), 3,29 (дд, 2H, J=8,1, 6,1 Гц), 2,94 (дд, 2H, J=8,0, 6,1 Гц), 2,57-2,45 (м, 4H), 2,12 (с, 3H); LRMS (ES) m/z 590,42 (M++1).
[2157] Пример 153: Соединение 11554, N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-2-(4-(метилсульфонил)пиперазин-1-ил)этан-1-сульфонамид
[2158] [Стадия 1] метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-(метилсульфонил)пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоат
[2159] 
[2160] Раствор гидрохлорида метил 4-(((N-(3-хлор-4-фторфенил)-2-(пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата (0,200 г, 0,381 ммоль), триэтиламина (0,106 мл, 0,763 ммоль) и метансульфонилхлорида (0,038 мл, 0,496 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-(метилсульфонил)пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата в виде желтого твердого вещества (0,180 г, 83,4%).
[2161] [Стадия 2] N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-(метилсульфонил)пиперазин-1-ил)этан-1-сульфонамид
[2162] 
[2163] Раствор метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-(метилсульфонил)пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата (0,180 г, 0,318 ммоль) и моногидрата гидразина (0,155 мл, 3,180 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли водой (10 мл) и бикарбонатом натрия (5 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-(метилсульфонил)пиперазин-1-ил)этан-1-сульфонамида в виде белого твердого вещества (0,130 г, 72,2%).
[2164] [Стадия 3] Соединение 11554
[2165] 
[2166] Смесь N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-(метилсульфонил)пиперазин-1-ил)этан-1-сульфонамида (0,080 г, 0,141 ммоль), триэтиламина (0,098 мл, 0,707 ммоль) и 2,2-дифторуксусного ангидрида (0,053 мл, 0,424 ммоль) в тетрагидрофуране (5 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 12 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-2-(4-(метилсульфонил)пиперазин-1-ил)этан-1-сульфонамида в виде желтого твердого вещества (0,034 г, 38,4%).
[2167] 1H-ЯМР (400 МГц, CDCl3) δ 7,95-7,86 (м, 1H), 7,81-7,73 (м, 1H), 7,63 (т, 1H, J=7,7 Гц), 7,44 (дт, 1H, J=6,5, 2,2 Гц), 7,27-7,16 (м, 1H), 7,17-7,07 (м, 1H), 7,08-6,75 (м, 1H), 5,01 (с, 2H), 3,34-3,25 (м, 6H), 2,98 (тд, 2H, J=7,0, 1,7 Гц), 2,82 (с, 3H), 2,68-2,61 (м, 4H); LRMS (ES) m/z 626,39 (M++1).
[2168] Пример 154: Соединение 11564, N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиримидин-2-ил)метил)-N-фенилметансульфонамид
[2169] [Стадия 1] метил 2-(бромметил)пиримидин-5-карбоксилат
[2170] 
[2171] Смесь метил 2-метилпиримидин-5-карбоксилата (1,000 г, 6,572 ммоль), 1-бромпирролидин-2,5-диона (NBS, 1,228 г, 6,901 ммоль) и азобисизобутиронитрила (AIBN, 0,432 г, 2,629 ммоль) в тетрахлорметане (6 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 10 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 24g; этилацетат/гексан=от 0% до 15%) с получением метил 2-(бромметил)пиримидин-5-карбоксилата в виде серого твердого вещества (0,390 г, 25,7%).
[2172] [Стадия 2] метил 2-((N-фенилметилсульфонамидо)метил)пиримидин-5-карбоксилат
[2173] 
[2174] Раствор метил 2-(бромметил)пиримидин-5-карбоксилата (0,383 г, 1,656 ммоль) и йодида калия (0,026 г, 0,158 ммоль) в N,N-диметилформамиде (4 мл) смешивали при комнатной температуре с N-фенилметансульфонамидом (0,270 г, 1,577 ммоль) и карбонатом калия (0,262 г, 1,892 ммоль). Реакционную смесь перемешивали при той же температуре в течение 30 мин. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 80%) с получением метил 2-((N-фенилметилсульфонамидо)метил)пиримидин-5-карбоксилата в виде белого твердого вещества (0,370 г, 73,0%).
[2175] [Стадия 3] N-((5-(гидразинкарбонил)пиримидин-2-ил)метил)-N-фенилметансульфонамид
[2176] 
[2177] Смесь метил 2-((N-фенилметилсульфонамидо)метил)пиримидин-5-карбоксилата (0,200 г, 0,622 ммоль) и моногидрата гидразина (0,151 мл, 3,112 ммоль) в этаноле (5 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 5 ч, охлаждали до температуры окружающей среды и концентрировали при пониженном давлении для удаления растворителя. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((5-(гидразинкарбонил)пиримидин-2-ил)метил)-N-фенилметансульфонамид, 0,150 г, 75,0%, белое твердое вещество).
[2178] [Стадия 4] Соединение 11564
[2179] 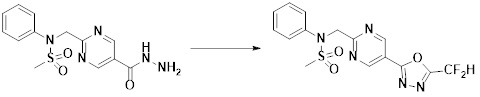
[2180] Раствор N-((5-(гидразинкарбонил)пиримидин-2-ил)метил)-N-фенилметансульфонамида (0,070 г, 0,218 ммоль), триэтиламина (0,152 мл, 1,089 ммоль) и 2,2-дифторуксусного ангидрида (0,081 мл, 0,653 ммоль) в тетрагидрофуране (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 60%) с получением N-((5-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиримидин-2-ил)метил)-N-фенилметансульфонамида в виде желтого твердого вещества (0,049 г, 59,0%).
[2181] 1H-ЯМР (400 МГц, CDCl3) δ 9,43 (с, 2H), 7,54-7,46 (м, 2H), 7,43-7,27 (м, 3H), 7,17-6,79 (м, 1H), 5,30 (с, 2H), 3,24 (с, 3H); LRMS (ES) m/z 382,34 (M++1).
[2182] Пример 155: Соединение 11565, N-фенил-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиримидин-2-ил)метил)метансульфонамид
[2183] 
[2184] Раствор N-((5-(гидразинкарбонил)пиримидин-2-ил)метил)-N-фенилметансульфонамида (0,056 г, 0,174 ммоль), триэтиламина (0,121 мл, 0,871 ммоль) и трифторуксусного ангидрида (0,074 мл, 0,523 ммоль) в тетрагидрофуране (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением N-фенил-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиримидин-2-ил)метил)метансульфонамида в виде белого твердого вещества (0,031 г, 44,5%).
[2185] 1H-ЯМР (400 МГц, CDCl3) δ 9,44 (с, 2H), 7,55-7,46 (м, 2H), 7,43-7,27 (м, 3H), 5,31 (с, 2H), 3,23 (с, 3H); LRMS (ES) m/z 400,30 (M++1).
[2186] Пример 156: Соединение 11566, N-((6-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридазин-3-ил)метил)-N-фенилметансульфонамид
[2187] [Стадия 1] метил 6-(бромметил)пиридазин-3-карбоксилат
[2188] 
[2189] Смесь метил 6-метилпиридазин-3-карбоксилата (1,000 г, 6,572 ммоль), 1-бромпирролидин-2,5-диона (NBS, 1,228 г, 6,901 ммоль) и азобисизобутиронитрила (AIBN, 0,432 г, 2,629 ммоль) в тетрахлорметане (6 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 10 ч и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 24g; этилацетат/гексан=от 0% до 15%) с получением метил 6-(бромметил)пиридазин-3-карбоксилата в виде белого твердого вещества (0,490 г, 32,3%).
[2190] [Стадия 2] метил 6-((N-фенилметилсульфонамидо)метил)пиридазин-3-карбоксилат
[2191] 
[2192] Раствор метил 6-(бромметил)пиридазин-3-карбоксилата (0,468 г, 2,024 ммоль) и йодида калия (0,032 г, 0,193 ммоль) в N,N-диметилформамиде (5 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с N-фенилметансульфонамидом (0,330 г, 1,927 ммоль) и карбонатом калия (0,346 г, 2,506 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 24 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 70%) с получением метил 6-((N-фенилметилсульфонамидо)метил)пиридазин-3-карбоксилата в виде белого твердого вещества (0,450 г, 72,7%).
[2193] [Стадия 3] N-((6-(гидразинкарбонил)пиридазин-3-ил)метил)-N-фенилметансульфонамид
[2194] 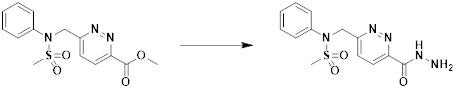
[2195] Смесь метил 6-((N-фенилметилсульфонамидо)метил)пиридазин-3-карбоксилата (0,200 г, 0,622 ммоль) и моногидрата гидразина (0,151 мл, 3,112 ммоль) в этаноле (5 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 3 ч, охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((6-(гидразинкарбонил)пиридазин-3-ил)метил)-N-фенилметансульфонамид, 0,150 г, 75,0%, белое твердое вещество).
[2196] [Стадия 4] Соединение 11566
[2197] 
[2198] Раствор N-((6-(гидразинкарбонил)пиридазин-3-ил)метил)-N-фенилметансульфонамида (0,080 г, 0,249 ммоль), триэтиламина (0,173 мл, 1,245 ммоль) и 2,2-дифторуксусного ангидрида (0,093 мл, 0,747 ммоль) в дихлорметане (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 60%) с получением N-((6-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиридазин-3-ил)метил)-N-фенилметансульфонамида в виде белого твердого вещества (0,059 г, 62,1%).
[2199] 1H-ЯМР (400 МГц, CDCl3) δ 8,42 (д, 1H, J=8,8 Гц), 8,01 (д, 1H, J=8,8 Гц), 7,47-7,41 (м, 2H), 7,42-7,36 (м, 2H), 7,35-7,29 (м, 1H), 7,14-6,82 (м, 1H), 5,40 (с, 2H), 3,10 (с, 3H); LRMS (ES) m/z 381,90 (M++1).
[2200] Пример 157: Соединение 11567, N-фенил-N-((6-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридазин-3-ил)метил)метансульфонамид
[2201] 
[2202] Раствор N-((6-(гидразинкарбонил)пиридазин-3-ил)метил)-N-фенилметансульфонамида (0,067 г, 0,208 ммоль), триэтиламина (0,145 мл, 1,042 ммоль) и трифторуксусного ангидрида (0,088 мл, 0,625 ммоль) в дихлорметане (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 60%) с получением N-фенил-N-((6-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиридазин-3-ил)метил)метансульфонамида в виде белого твердого вещества (0,042 г, 50,4%).
[2203] 1H-ЯМР (400 МГц, CDCl3) δ 8,44 (д, 1H, J=8,8 Гц), 8,03 (д, 1H, J=8,8 Гц), 7,48-7,34 (м, 4H), 7,37-7,28 (м, 1H), 5,40 (с, 2H), 3,10 (с, 3H); LRMS (ES) m/z 400,2 (M++1).
[2204] Пример 158: Соединение 11573, N-фенил-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиразин-2-ил)метил)метансульфонамид
[2205] 
[2206] Раствор N-((5-(гидразинкарбонил)пиразин-2-ил)метил)-N-фенилметансульфонамида (0,080 г, 0,249 ммоль) и триэтиламина (0,104 мл, 0,747 ммоль) в тетрагидрофуране (5 мл) смешивали при комнатной температуре с трифторуксусного ангидрида (0,077 мл, 0,548 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 60%) с получением N-фенил-N-((5-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиразин-2-ил)метил)метансульфонамида в виде белого твердого вещества (0,055 г, 55,3%).
[2207] 1H-ЯМР (400 МГц, CDCl3) δ 9,40 (д, 1 H, J=1,4 Гц), 8,92 (д, 1 H, J=1,5 Гц), 7,41- 7,35 (м, 4 H), 7,33-7,29 (м, 1 H), 5,19 (с, 2 H), 3,00 (с, 3 H); LRMS (ES) m/z 400,32 (M++1).
[2208] Пример 159: Соединение 11582, N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-2-(4-(1-(метилсульфонил)азетидин-3-ил)пиперазин-1-ил)этан-1-сульфонамид
[2209] [Стадия 1] трет-бутил 3-(4-(2-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)этил)пиперазин-1-ил)азетидин-1-карбоксилат
[2210] 
[2211] Раствор гидрохлорида метил 4-(((N-(3-хлор-4-фторфенил)-2-(пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата (0,400 г, 0,763 ммоль), трет-бутил 3-оксоазетидин-1-карбоксилата (0,157 г, 0,915 ммоль), уксусной кислоты (0,065 мл, 1,144 ммоль) и триацетоксиборгидрида натрия (0,323 г, 1,526 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением трет-бутил 3-(4-(2-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)этил)пиперазин-1-ил)азетидин-1-карбоксилата в виде белого твердого вещества (0,350 г, 71,3%).
[2212] [Стадия 2] гидрохлорид метил 4-(((2-(4-(азетидин-3-ил)пиперазин-1-ил)-N-(3-хлор-4-фторфенил)этил)сульфонамидо)метил)-3-фторбензоата
[2213] 
[2214] Раствор трет-бутил 3-(4-(2-(N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(метоксикарбонил)бензил)сульфамоил)этил)пиперазин-1-ил)азетидин-1-карбоксилата (0,350 г, 0,544 ммоль) и хлористоводородной кислоты (4,00 M раствор в 1,4-диоксане, 0,272 мл, 1,088 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 12 ч. Преципитат собирали фильтрацией, промывали дихлорметаном и сушили с получением гидрохлорида метил 4-(((2-(4-(азетидин-3-ил)пиперазин-1-ил)-N-(3-хлор-4-фторфенил)этил)сульфонамидо)метил)-3-фторбензоата в виде белого твердого вещества (0,300 г, 95,1%).
[2215] [Стадия 3] метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-(1-(метилсульфонил)азетидин-3-ил)пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоат
[2216] 
[2217] Раствор гидрохлорида метил 4-(((2-(4-(азетидин-3-ил)пиперазин-1-ил)-N-(3-хлор-4-фторфенил)этил)сульфонамидо)метил)-3-фторбензоата (0,100 г, 0,173 ммоль), триэтиламина (0,036 мл, 0,259 ммоль) и метансульфонилхлорида (0,016 мл, 0,207 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-(1-(метилсульфонил)азетидин-3-ил)пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата в виде белого твердого вещества (0,083 г, 77,4%).
[2218] [Стадия 4] N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-(1-(метилсульфонил)азетидин-3-ил)пиперазин-1-ил)этан-1-сульфонамид
[2219] 
[2220] Раствор метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-(1-(метилсульфонил)азетидин-3-ил)пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата (0,100 г, 0,161 ммоль) и моногидрата гидразина (0,078 мл, 1,610 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, и охлаждали до комнатной температуры для завершения реакции, и концентрировали при пониженном давлении для удаления растворителя. Концентрат разбавляли водой (10 мл) и бикарбонатом натрия (5 мл) и перемешивали. Полученный преципитат собирали фильтрацией и сушили с получением N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-(1-(метилсульфонил)азетидин-3-ил)пиперазин-1-ил)этан-1-сульфонамида в виде белого твердого вещества (0,083 г, 83,0%).
[2221] [Стадия 5] Соединение 11582
[2222] 
[2223] Раствор N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-(1-(метилсульфонил)азетидин-3-ил)пиперазин-1-ил)этан-1-сульфонамида (0,070 г, 0,113 ммоль), триэтиламина (0,079 мл, 0,563 ммоль) и 2,2-дифторуксусного ангидрида (0,042 мл, 0,338 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли 1,0 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; метанол/дихлорметан=от 0% до 5%) с получением N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-2-(4-(1-(метилсульфонил)азетидин-3-ил)пиперазин-1-ил)этан-1-сульфонамида в виде белого твердого вещества (0,041 г, 53,4%).
[2224] 1H-ЯМР (400 МГц, CDCl3) δ 7,90 (дд, 1H, J=8,0, 1,6 Гц), 7,76 (дд, 1H, J=9,8, 1,6 Гц), 7,64 (т, 1H, J=7,6 Гц), 7,47 (дд, 1H, J=6,4, 2,6 Гц), 7,28-7,20 (м, 1H), 7,11 (т, 1H, J=8,6 Гц), 7,08-6,77 (м, 1H), 5,02 (с, 2H), 3,99-3,84 (м, 4H), 3,35-3,30 (м, 2H), 3,31-3,20 (м, 1H), 2,97 (т, 2H, J=7,1 Гц), 2,91 (с, 3H), 2,63 (с, 4H), 2,50 (с, 4H); LRMS (ES) m/z 681,52(M++1).
[2225] Пример 160: Соединение 11583, N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-2-(4-(оксетан-3-ил)пиперазин-1-ил)этан-1-сульфонамид
[2226] [Стадия 1] метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-(оксетан-3-ил)пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоат
[2227] 
[2228] Раствор гидрохлорида метил 4-(((N-(3-хлор-4-фторфенил)-2-(пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата (0,200 г, 0,381 ммоль), оксетан-3-она (0,036 г, 0,496 ммоль) и уксусной кислоты (0,024 мл, 0,420 ммоль) в дихлорметане (10 мл) смешивали при комнатной температуре с триацетоксиборгидридом натрия (0,162 г, 0,763 ммоль). Реакционную смесь перемешивали при той же температуре в течение 30 мин. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-(оксетан-3-ил)пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата в виде желтого твердого вещества (0,150 г, 72,3%).
[2229] [Стадия 2] N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-(оксетан-3-ил)пиперазин-1-ил)этан-1-сульфонамид
[2230] 
[2231] Раствор метил 4-(((N-(3-хлор-4-фторфенил)-2-(4-(оксетан-3-ил)пиперазин-1-ил)этил)сульфонамидо)метил)-3-фторбензоата (0,150 г, 0,276 ммоль) и моногидрата гидразина (0,134 мл, 2,757 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли водой (10 мл) и бикарбонатом натрия (5 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали водой и сушили с получением N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-(оксетан-3-ил)пиперазин-1-ил)этан-1-сульфонамида в виде белого твердого вещества (0,120 г, 80,0%).
[2232] [Стадия 3] Соединение 11583
[2233] 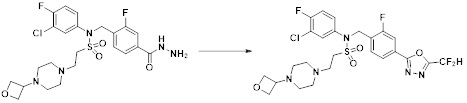
[2234] Раствор N-(3-хлор-4-фторфенил)-N-(2-фтор-4-(гидразинкарбонил)бензил)-2-(4-(оксетан-3-ил)пиперазин-1-ил)этан-1-сульфонамида (0,070 г, 0,129 ммоль), триэтиламина (0,090 мл, 0,643 ммоль) и 2,2-дифторуксусного ангидрида (0,048 мл, 0,386 ммоль) в тетрагидрофуране (10 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли 1,0 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(3-хлор-4-фторфенил)-N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-2-(4-(оксетан-3-ил)пиперазин-1-ил)этан-1-сульфонамида в виде белого твердого вещества (0,040 г, 51,5%).
[2235] 1H-ЯМР (400 МГц, CDCl3) δ 7,91 (дд, 1H, J=8,1, 1,7 Гц), 7,77 (дд, 1H, J=9,9, 1,7 Гц), 7,65 (т, 1H, J=7,6 Гц), 7,48 (дд, 1H, J=6,4, 2,7 Гц), 7,27-7,21 (м, 1H), 7,11 (т, 1H, J=8,6 Гц), 7,07-6,77 (м, 1H), 5,02 (с, 2H), 4,68 (дт, 4H, J=22,2, 6,4 Гц), 3,64-3,53 (м, 1H), 3,34 (с, 2H), 2,99 (т, 2H, J=7,0 Гц), 2,68 (с, 4H), 2,50 (с, 4H); LRMS (ES) m/z 604,45 (M++1).
[2236] Пример 161: Соединение 11588, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-3-морфолино-N-фенилпропан-1-сульфонамид
[2237] [Стадия 1] 3-хлор-N-фенилпропан-1-сульфонамид
[2238] 
[2239] Раствор анилина (0,980 мл, 10,738 ммоль), триэтиламина (1,796 мл, 12,885 ммоль) и 3-хлорпропан-1-сульфонилхлорида (2,091 г, 11,811 ммоль) в дихлорметане (30 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 24g; этилацетат/гексан=от 0% до 5%) с получением 3-хлор-N-фенилпропан-1-сульфонамида в виде желтого масла (2,000 г, 79,7%).
[2240] [Стадия 2] метил 4-(((3-хлор-N-фенилпропил)сульфонамидо)метил)-3-фторбензоат
[2241] 
[2242] Раствор 3-хлор-N-фенилпропан-1-сульфонамида (2,000 г, 8,558 ммоль), карбоната калия (1,774 г, 12,836 ммоль), метил 4-(бромметил)-3-фторбензоата (2,326 г, 9,413 ммоль) и йодида калия (0,710 г, 4,279 ммоль) в N,N-диметилформамиде (5 мл) перемешивали при комнатной температуре в течение 30 мин и в течение дополнительных 12 ч при 50°C, а затем охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию хлоридом аммония. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 24g; этилацетат/гексан=от 0% до 30%) с получением метил 4-(((3-хлор-N-фенилпропил)сульфонамидо)метил)-3-фторбензоата в виде желтого масла (2,800 г, 81,8%).
[2243] [Стадия 3] метил 3-фтор-4-(((3-морфолино-N-фенилпропил)сульфонамидо)метил)бензоат
[2244] 
[2245] Раствор метил 4-(((3-хлор-N-фенилпропил)сульфонамидо)метил)-3-фторбензоата (0,200 г, 0,500 ммоль), йодида калия (0,042 г, 0,250 ммоль), карбоната калия (0,104 г, 0,750 ммоль) и морфолина (0,056 мл, 0,650 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 50°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли 1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением метил 3-фтор-4-(((3-морфолино-N-фенилпропил)сульфонамидо)метил)бензоата в виде желтого масла (0,110 г, 48,8%).
[2246] [Стадия 4] N-(2-фтор-4-(гидразинкарбонил)бензил)-3-морфолино-N-фенилпропан-1-сульфонамид
[2247] 
[2248] Раствор метил 3-фтор-4-(((3-морфолино-N-фенилпропил)сульфонамидо)метил)бензоата (0,100 г, 0,222 ммоль) и моногидрата гидразина (0,108 мл, 2,220 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли водой (5 мл) и насыщенным водным раствором бикарбоната натрия (3 мл) и перемешивали. Полученный преципитат собирали фильтрацией и сушили с получением N-(2-фтор-4-(гидразинкарбонил)бензил)-3-морфолино-N-фенилпропан-1-сульфонамида в виде белого твердого вещества (0,089 г, 89,0%).
[2249] [Стадия 5] Соединение 11588
[2250] 
[2251] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-3-морфолино-N-фенилпропан-1-сульфонамида (0,089 г, 0,198 ммоль), триэтиламина (0,138 мл, 0,988 ммоль) и 2,2-дифторуксусного ангидрида (0,074 мл, 0,593 ммоль) в тетрагидрофуране (5 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли 1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-3-морфолино-N-фенилпропан-1-сульфонамида в виде желтого масла (0,040 г, 39,7%).
[2252] 1H-ЯМР (400 МГц, CDCl3) δ 7,85 (дд, 1H, J=8,0, 1,7 Гц), 7,73 (дд, 1H, J=9,9, 1,6 Гц), 7,59 (т, 1H, J=7,6 Гц), 7,41-7,27 (м, 5H), 7,07-6,75 (м, 1H), 5,04 (с, 2H), 4,01 (т, 4H, J=4,8 Гц), 3,31 (т, 4H, J=6,9 Гц), 3,21 (т, 4H, J=7,8 Гц), 2,51-2,31 (м, 2H); LRMS (ES) m/z 511,40 (M++1).
[2253] Пример 162: Соединение 11589, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-3-(4-метилпиперазин-1-ил)-N-фенилпропан-1-сульфонамид
[2254] [Стадия 1] метил 3-фтор-4-(((3-(4-метилпиперазин-1-ил)-N-фенилпропил)сульфонамидо)метил)бензоат
[2255] 
[2256] Раствор метил 4-(((3-хлор-N-фенилпропил)сульфонамидо)метил)-3-фторбензоата (0,200 г, 0,500 ммоль), йодида калия (0,042 г, 0,250 ммоль), карбоната калия (0,104 г, 0,750 ммоль) и 1-метилпиперазина (0,072 мл, 0,650 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 50°C в течение 12 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли 1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением метил 3-фтор-4-(((3-(4-метилпиперазин-1-ил)-N-фенилпропил)сульфонамидо)метил)бензоата в виде желтого масла (0,160 г, 71,2%).
[2257] [Стадия 2] N-(2-фтор-4-(гидразинкарбонил)бензил)-3-(4-метилпиперазин-1-ил)-N-фенилпропан-1-сульфонамид
[2258] 
[2259] Раствор метил 3-фтор-4-(((3-(4-метилпиперазин-1-ил)-N-фенилпропил)сульфонамидо)метил)бензоата (0,088 г, 0,190 ммоль) и моногидрата гидразина (0,092 мл, 1,898 ммоль) в этаноле (10 мл) перемешивали при 90°C в течение 12 ч, охлаждали до комнатной температуры для завершения реакции и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли водой (5 мл) и бикарбонатом натрия (2 мл) и перемешивали. Полученный преципитат собирали фильтрацией и сушили с получением N-(2-фтор-4-(гидразинкарбонил)бензил)-3-(4-метилпиперазин-1-ил)-N-фенилпропан-1-сульфонамида в виде белого твердого вещества (0,070 г, 79,5%).
[2260] [Стадия 3] Соединение 11589
[2261] 
[2262] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-3-(4-метилпиперазин-1-ил)-N-фенилпропан-1-сульфонамида (0,070 г, 0,151 ммоль), триэтиламина (0,105 мл, 0,755 ммоль) и 2,2-дифторуксусного ангидрида (0,079 г, 0,453 ммоль) в тетрагидрофуране (5 мл) перемешивали при 90°C в течение 5 ч и охлаждали до комнатной температуры для завершения реакцииЗатем к реакционной смеси добавляли 1 Н водный раствор хлористоводородной кислоты, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; метанол/дихлорметан=от 0% до 5%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-3-(4-метилпиперазин-1-ил)-N-фенилпропан-1-сульфонамида в виде белого твердого вещества (0,031 г, 39,2%).
[2263] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,1, 1,6 Гц), 7,74 (дд, 1H, J=9,9, 1,6 Гц), 7,63 (т, 1H, J=7,6 Гц), 7,42-7,27 (м, 5H), 7,08-6,76 (м, 1H), 5,06 (с, 2H), 3,28-3,19 (м, 4H), 3,07-3,02 (м, 4H), 2,80-2,72 (м, 5H), 2,21-2,08 (м, 4H); LRMS (ES) m/z 524,44 (M++1).
[2264] Пример 163: Соединение 11605, N-((2-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиримидин-5-ил)метил)-N-фенилметансульфонамид
[2265] [Стадия 1] метил 5-(бромметил)пиримидин-2-карбоксилат
[2266] 
[2267] Смесь метил 5-метилпиримидин-2-карбоксилата (0,500 г, 3,286 ммоль), 1-бромпирролидин-2,5-диона (NBS, 0,643 г, 3,615 ммоль) и азобисизобутиронитрила (AIBN, 0,216 г, 1,314 ммоль) в тетрахлорметане (4 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 10 ч, и охлаждали до температуры окружающей среды. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 30%) с получением метил 5-(бромметил)пиримидин-2-карбоксилата в виде белого твердого вещества (0,380 г, 50,0%).
[2268] [Стадия 2] метил 5-((N-фенилметилсульфонамидо)метил)пиримидин-2-карбоксилат
[2269] 
[2270] Раствор метил 5-(бромметил)пиримидин-2-карбоксилата (0,270 г, 1,168 ммоль) и йодида калия (0,019 г, 0,117 ммоль) в N,N-диметилформамиде (5 мл) перемешивали при комнатной температуре в течение 20 мин и смешивали с N-фенилметансульфонамидом (0,200 г, 1,168 ммоль) и карбонатом калия (0,194 г, 1,402 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 8 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 80%) с получением метил 5-((N-фенилметилсульфонамидо)метил)пиримидин-2-карбоксилата в виде светло-желтого твердого вещества (0,220 г, 58,6%).
[2271] [Стадия 3] N-((2-(гидразинкарбонил)пиримидин-5-ил)метил)-N-фенилметансульфонамид
[2272] 
[2273] Смесь метил 5-((N-фенилметилсульфонамидо)метил)пиримидин-2-карбоксилата (0,220 г, 0,685 ммоль) и моногидрата гидразина (0,166 мл, 3,423 ммоль) в этаноле (4 мл), полученную при комнатной температуре, нагревали при температуре кипения с обратным холодильником в течение 5 ч, охлаждали до температуры окружающей среды, и концентрировали при пониженном давлении для удаления растворителя. Затем к концентрату добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-((2-(гидразинкарбонил)пиримидин-5-ил)метил)-N-фенилметансульфонамид, 0,190 г, 86,4%, белое твердое вещество).
[2274] [Стадия 4] Соединение 11605
[2275] 
[2276] Раствор N-((2-(гидразинкарбонил)пиримидин-5-ил)метил)-N-фенилметансульфонамида (0,045 г, 0,140 ммоль) и триэтиламина (0,059 мл, 0,420 ммоль) в тетрагидрофуране (1,5 мл) смешивали при комнатной температуре с 2,2-дифторуксусным ангидридом (0,038 мл, 0,308 ммоль), перемешивали при 60°C в течение 2 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-((2-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)пиримидин-5-ил)метил)-N-фенилметансульфонамида в виде белого твердого вещества (0,040 г, 74,9%).
[2277] 1H-ЯМР (400 МГц, CDCl3) δ 8,87 (с, 2 H), 7,41-7,34 (м, 3 H), 7,31 (д, 2 H, J=9,8 Гц), 7,07 (с, 0,25 H), 6,94 (с, 0,5 H), 6,81 (с, 0,25 H), 5,00 (с, 2 H), 3,01 (с, 3 H); LRMS (ES) m/z 382,34 (M++1).
[2278] Пример 164: Соединение 11606, N-фенил-N-((2-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиримидин-5-ил)метил)метансульфонамид
[2279] 
[2280] Раствор N-((2-(гидразинкарбонил)пиримидин-5-ил)метил)-N-фенилметансульфонамида (0,030 г, 0,093 ммоль) и триэтиламина (0,039 мл, 0,280 ммоль) в тетрагидрофуране (1,5 мл) смешивали при комнатной температуре с трифторуксусного ангидрида (0,029 мл, 0,205 ммоль), перемешивали при 60°C в течение 2 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Двухфазную смесь пропускали через пластмассовую фритту для удаления твердого остатка и водного слоя, и собранный органический слой концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 50%) с получением N-фенил-N-((2-(5-(трифторметил)-1,3,4-оксадиазол-2-ил)пиримидин-5-ил)метил)метансульфонамида в виде белого твердого вещества (0,028 г, 75,1%).
[2281] 1H-ЯМР (400 МГц, CDCl3) δ 8,89 (с, 2 H), 7,42-7,28 (м, 5 H), 5,00 (с, 2 H), 3,01 (с, 3 H); LRMS (ES) m/z 400,38 (M++1).
[2282] Пример 165: Соединение 11625, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-(оксетан-3-ил)-N-фенилпиперидин-4-сульфонамид
[2283] [Стадия 1] метил 3-фтор-4-(((1-(оксетан-3-ил)-N-фенилпиперидин)-4-сульфонамидо)метил)бензоат
[2284] 
[2285] Раствор гидрохлорида метил 3-фтор-4-((N-фенилпиперидин-4-сульфонамидо)метил)бензоата (0,100 г, 0,226 ммоль), оксетан-3-она (0,020 г, 0,271 ммоль) и уксусной кислоты (0,014 мл, 0,248 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 30 мин и смешивали с триацетоксиборгидридом натрия (0,096 г, 0,452 ммоль). Реакционную смесь перемешивали при той же температуре в течение дополнительных 12 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 12g; этилацетат/гексан=от 0% до 60%) с получением метил 3-фтор-4-(((1-(оксетан-3-ил)-N-фенилпиперидин)-4-сульфонамидо)метил)бензоата в виде белого твердого вещества (0,090 г, 86,2%).
[2286] [Стадия 2] N-(2-фтор-4-(гидразинкарбонил)бензил)-1-(оксетан-3-ил)-N-фенилпиперидин-4-сульфонамид
[2287] 
[2288] Раствор метил 3-фтор-4-(((1-(оксетан-3-ил)-N-фенилпиперидин)-4-сульфонамидо)метил)бензоата (0,100 г, 0,216 ммоль) и моногидрата гидразина (0,105 мл, 2,162 ммоль) в этаноле (10 мл) перемешивали при комнатной температуре в течение 18 ч, и концентрировали при пониженном давлении для удаления растворителя. Остаток разбавляли водой (10 мл) и бикарбонатом натрия (5 мл) и перемешивали. Полученный преципитат собирали фильтрацией, промывали гексаном и сушили с получением N-(2-фтор-4-(гидразинкарбонил)бензил)-1-(оксетан-3-ил)-N-фенилпиперидин-4-сульфонамида в виде белого твердого вещества (0,089 г, 89,0%).
[2289] [Стадия 3] соединение 11625
[2290] 
[2291] Раствор N-(2-фтор-4-(гидразинкарбонил)бензил)-1-(оксетан-3-ил)-N-фенилпиперидин-4-сульфонамида (0,050 г, 0,108 ммоль), триэтиламина (0,075 мл, 0,540 ммоль) и 2,2-дифторуксусного ангидрида (0,040 мл, 0,324 ммоль) в тетрагидрофуране (10 мл) перемешивали при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида аммония, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 4g; этилацетат/гексан=от 0% до 70%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)-2-фторбензил)-1-(оксетан-3-ил)-N-фенилпиперидин-4-сульфонамида в виде белого твердого вещества (0,023 г, 40,7%).
[2292] 1H-ЯМР (400 МГц, CDCl3) δ 7,87 (дд, 1H, J=8,1, 1,6 Гц), 7,73 (дд, 1H, J=9,9, 1,6 Гц), 7,60 (т, 1H, J=7,6 Гц), 7,41-7,27 (м, 5H), 7,10-6,75 (м, 1H), 5,07 (с, 2H), 4,98-4,91 (м, 2H), 4,74 (т, 2H, J=7,2 Гц), 3,93 (с, 1H), 3,37-3,16 (м, 3H), 2,65-2,60 (м, 2H), 2,48-2,43 (м, 2H), 2,40-2,31 (м, 2H); LRMS (ES) m/z 523,38 (M++1).
[2293] Пример 166: Соединение 11628, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиридин-3-ил)метансульфонамид
[2294] [Стадия 1] метил 4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоат
[2295] 
[2296] N-(пиридин-3-ил)метансульфонамид (1,000 г, 5,807 ммоль), метил 4-(бромметил)бензоат (1,995 г, 8,711 ммоль), карбонат калия (1,204 г, 8,711 ммоль) и йодид калия (0,096 г, 0,581 ммоль) смешивали при комнатной температуре в N,N-диметилформамиде (20 мл), перемешивали при 50°C в течение 18 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 80%) с получением метил 4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоата в виде красного твердого вещества (1,510 г, 81,2%).
[2297] [Стадия 2] N-(4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамид
[2298] 
[
[2299] Метил 4-((N-(пиридин-3-ил)метилсульфонамидо)метил)бензоат (1,500 г, 4,682 ммоль) и моногидрат гидразина (5,689 мл, 117,056 ммоль) смешивали при комнатной температуре в смеси этанол (20 мл)/вода (5 мл), перемешивали при 80°C в течение 18 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Указанное в заголовке соединение использовали без дальнейшей очистки (N-(4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамид, 1,120 г, 74,7%, желтое твердое вещество).
[2300] [Стадия 3] Соединение 11628
[2301] 
[2302] Раствор N-(4-(гидразинкарбонил)бензил)-N-(пиридин-3-ил)метансульфонамида (0,200 г, 0,624 ммоль) и триэтиламина (0,261 мл, 1,873 ммоль) в тетрагидрофуране (10 мл) смешивали при комнатной температуре с 2,2-дифторуксусным ангидридом (0,233 мл, 1,873 ммоль), перемешивали при 80°C в течение 1 ч и охлаждали до комнатной температуры для завершения реакции. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (пластина из SiO2, 20×20×1 мм; метанол/дихлорметан=10%) с получением N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-(пиридин-3-ил)метансульфонамида в виде белого твердого вещества (0,023 г, 9,7%).
[2303] 1H-ЯМР (400 МГц, DMSO-d6) δ 8,57 (д, 1H, J=2,4 Гц), 8,43 (дд, J=4,8, 1,1 Гц, 1H), 7,98 (д, 2H, J=8,2 Гц), 7,90 (д, 1H, J=8,2 Гц), 7,65-7,38 (м, 4H), 5,03 (с, 2H), 3,20 (с, 3H); LRMS (ES) m/z 380,9 (M++1).
[2304] Пример 167: Соединение 11629, N-(4-(5-(дифторметил)-1,3,4-оксадиазол-2-ил)бензил)-N-фенил-2-(пиперидин-1-ил)этан-1-сульфонамид
[2305] [Стадия 1] N-фенилэтенсульфонамид
[2306] 
[2307] Раствор анилина (0,980 мл, 10,738 ммоль), 2-хлорэтан-1-сульфонилхлорида (1,233 мл, 11,811 ммоль) и пиридина (1,730 мл, 21,475 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 18 ч. Затем к реакционной смеси добавляли воду, а затем проводили экстракцию дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии (SiO2, кассета 40g; этилацетат/гексан=от 0% до 20%) с получением N-фенилэтенсульфонамида в виде желтого масла (0,945 г, 48,0%).
[2308] [Стадия 2] метил 4-((N-фенилвинилсульфонамидо)метил)бензоат
[2309] 
Изобретение относится к новым соединениям формулы I, их стереоизомерам или их фармацевтически приемлемым солям, к их применению для получения терапевтических средств, к фармацевтическим композициям, содержащим их, и к способу лечения опосредованных HDAC6 заболеваний. Технический результат: получены новые соединения, обладающие активностью ингибирования деацетилазы гистонов 6 (HDAC6), которые являются эффективными для предупреждения или лечения заболеваний, опосредуемых HDAC6. 4 н. и 6 з.п. ф-лы, 2 табл., 339 пр.
Формула I

1. Производное 1,3,4-оксадиазолсульфонамида, соответствующее представленной ниже формуле I, его стереоизомер или его фармацевтически приемлемая соль:
[Формула I]

где R1 представляет собой -CX2H или -CX3;
R2 представляет собой -(C1-C4 алкил), -(C1-C4 алкил)-O(C1-C4 алкил), -(C1-C4)-C(=O)-O(C1-C4 алкил), -(C1-C4 алкил)-O-C(=O)-(C1-C4 алкил), -(C1-C4 алкил)-NRARB, -(C1-C4 алкил)5-13-членный гетероарил, включающий 1-3 гетероатома N, -фенил, -пиридинил,  ,
,  или
или  ,
,
где по меньшей мере один H в -(C1-C4 алкиле) или -(C1-C4 алкил)-O-C(=O)-(C1-C4 алкиле) может быть замещен -X или -OH,
по меньшей мере один H в -(C1-C4 алкил)5-13-членном гетероариле, включающем 1-3 гетероатома N, -фениле или -пиридиниле может быть замещен -O(C1-C4 алкилом), -(C1-C4 алкилом), -(C1-C4 алкил)-OH или -C(=O)-CF2H, и
по меньшей мере один H в  ,
,  или
или  может быть замещен -X, -OH, -NRARB, -CN, -(C1-C4 алкилом), -(C1-C4 алкил)-OH, -C(=O)-NRARB, -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкил)-OC(=O)-CF2H, 6-членным гетероциклоалкилом), включающим один гетероатом, выбранный из группы, состоящей из N и О, -(C1-C4 алкил)фенилом, -фенилом или 5-членным гетероарилом, включающим 1-3 гетероатома, выбранных из группы, состоящей из N и О, где по меньшей мере один H в -(C1-C4 алкил)фениле, -фениле или -гетероариле может быть замещен -X, -O(C1-C4 алкилом) или -(C1-C4 алкилом);
может быть замещен -X, -OH, -NRARB, -CN, -(C1-C4 алкилом), -(C1-C4 алкил)-OH, -C(=O)-NRARB, -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкил)-OC(=O)-CF2H, 6-членным гетероциклоалкилом), включающим один гетероатом, выбранный из группы, состоящей из N и О, -(C1-C4 алкил)фенилом, -фенилом или 5-членным гетероарилом, включающим 1-3 гетероатома, выбранных из группы, состоящей из N и О, где по меньшей мере один H в -(C1-C4 алкил)фениле, -фениле или -гетероариле может быть замещен -X, -O(C1-C4 алкилом) или -(C1-C4 алкилом);
R3 представляет собой -H, -(C1-C4 алкил) -фенил, 5-9-членный гетероарил, включающий 1-3 гетероатома, выбранных из группы, состоящей из S, N и О,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  , где по меньшей мере один H в –фениле или 5-9-членном гетероариле, включающем 1-3 гетероатома, выбранных из группы, состоящей из S, N и О, может быть замещен -X, -O(C1-C4 алкилом), -(C1-C4 алкилом), -CF3, -C(=O)-(C1-C4 алкилом),
, где по меньшей мере один H в –фениле или 5-9-членном гетероариле, включающем 1-3 гетероатома, выбранных из группы, состоящей из S, N и О, может быть замещен -X, -O(C1-C4 алкилом), -(C1-C4 алкилом), -CF3, -C(=O)-(C1-C4 алкилом),  или
или  ,
,
R4 представляет собой -CX2H или -CX3;
каждый из L1-L4 независимо представляет собой связь или -(C1-C2 алкилен)-;
каждый из Z1-Z8 независимо представляет собой N или CRZ, где по меньшей мере три из Z1-Z4 не могут одновременно представлять собой N, и RZ представляет собой -H, -X или -O(C1-C4 алкил);
каждый из Z9 и Z10 независимо представляет собой N или S;
каждый из Y1-Y3 независимо представляет собой -CH2-, -NRC-, -O- или -S(=O)2-;
каждый из Y4-Y7 независимо представляет собой -CH2-, -NRD- или -O-;
Y8 представляет собой -C(=O), -CH2- или -NRE-;
каждый из Y9 и Y10 независимо представляет собой -NRF- или -S(=O)2-;
каждый из RA и RB независимо представляет собой -H, -(C1-C4 алкил), -(C1-C4 алкил)фенил, -C(=O)-CF2H или -C(=O)-O(C1-C4 алкил);
каждый из RC-RE независимо представляет собой -H, -(C1-C4 алкил), -(C1-C4 алкил)-OH, -(C1-C4 алкил)-O-(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-O(C1-C4 алкил), -C(=O)-(C3-C7 циклоалкил), -(C1-C4 алкил)-C(=O)-(6-членный гетероциклоалкил), включающий два гетероатома, выбранных из группы, состоящей из N и О, -S(=O)2-(C1-C4 алкил), -(C1-C4 алкил)фенил, -(C2-C4 алкенил)фенил, -(C1-C4 алкил)-6-членный гетероарил, включающий один гетероатом N, -фенил, 6-9-членный гетероарил, включающий 1-2 гетероатома, выбранных из группы, состоящей из S, N и О, или  или
или  ,
,
где по меньшей мере один H в  может быть замещен -X, -OH, -O(C1-C4 алкилом), -(C1-C4 алкилом) или -CF3;
может быть замещен -X, -OH, -O(C1-C4 алкилом), -(C1-C4 алкилом) или -CF3;
Y11 представляет собой -CH2-, -NRF- или -O-;
RF представляет собой -(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-(C1-C4 алкил)-OH, -C(=O)-(C3-C7 циклоалкил) или -S(=O)2-(C1-C4 алкил);
 представляет собой одинарную связь;
представляет собой одинарную связь;
каждый из a-e независимо представляет собой целое число, равное 0, 1, 2 или 3, при условии, что a и b не могут одновременно быть равны 0 и c и d не могут быть одновременно равны 0; и
X представляет собой F, Cl, Br или I.
2. Производное 1,3,4-оксадиазолсульфонамида, соответствующее формуле I, его стереоизомер или фармацевтически приемлемая соль по п.1,
где R1 представляет собой -CX2H или -CX3;
R2 представляет собой -(C1-C4 алкил), -(C1-C4 алкил)-O(C1-C4 алкил), -(C1-C4 алкил)-C(=O)-O(C1-C4 алкил), -(C1-C4 алкил)-O-C(=O)-(C1-C4 алкил), -(C1-C4 алкил)-NRARB, -(C1-C4 алкил)имидазолил,-(C1-C4 алкил)-триазолил, -(C1-C4 алкил)изоиндолинил), -(C1-C4 алкил)-бензо[dе]изохинолинил, -фенил, -пиридинил,  ,
,  или
или  ,
,
где по меньшей мере один H в -(C1-C4 алкиле), или -(C1-C4 алкил)-O-C(=O)-(C1-C4 алкиле) может быть замещен -X или -OH,
по меньшей мере один H в -(C1-C4алкил)-имидазолиле, -(C1-C4 алкил)-тризаолиле, -(C1-C4 алкил)изоиндолиниле, -(C1-C4 алкил)-бензо[dе]изохинолиниле, фениле, может быть замещен -O(C1-C4 алкилом), -(C1-C4 алкилом), -(C1-C4 алкил)-OH или -C(=O)-CF2H, и
по меньшей мере один H в  ,
,  или
или  может быть замещен -X, -OH, -NRARB, -CN, -(C1-C4 алкилом), -(C1-C4 алкил)-OH, -C(=O)-NRARB, -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкил)-OC(=O)-CF2H, морфолинилом, -(C1-C4 алкил)фенилом, -фенилом или -оксадиазолилом, где по меньшей мере один H в -(C1-C4 алкил)фениле, -фениле или –оксадиазолиле может быть замещен -X, -O(C1-C4 алкилом) или -(C1-C4 алкилом);
может быть замещен -X, -OH, -NRARB, -CN, -(C1-C4 алкилом), -(C1-C4 алкил)-OH, -C(=O)-NRARB, -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкил)-OC(=O)-CF2H, морфолинилом, -(C1-C4 алкил)фенилом, -фенилом или -оксадиазолилом, где по меньшей мере один H в -(C1-C4 алкил)фениле, -фениле или –оксадиазолиле может быть замещен -X, -O(C1-C4 алкилом) или -(C1-C4 алкилом);
R3 представляет собой -H, -(C1-C4 алкил), -фенил, -пиридинил, -пиримидинил, -индазолил, -тиазолил, -тиодиазолил, -бензо[d]тиазолил, -оксазолил, -бензо[d]оксазолил  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  , где по меньшей мере один H в –фениле, пиридиниле, -пиримидиниле, -индазолиле, -тиазолиле, -тиодиазолиле, -бензо[d]тиазолиле, -оксазолиле, или -бензо[d]оксазолиле может быть замещен -X, -O(C1-C4 алкилом), -(C1-C4 алкилом), -CF3, -C(=O)-(C1-C4 алкилом),
, где по меньшей мере один H в –фениле, пиридиниле, -пиримидиниле, -индазолиле, -тиазолиле, -тиодиазолиле, -бензо[d]тиазолиле, -оксазолиле, или -бензо[d]оксазолиле может быть замещен -X, -O(C1-C4 алкилом), -(C1-C4 алкилом), -CF3, -C(=O)-(C1-C4 алкилом),  или
или  ,
,
R4 представляет собой -CX2H или -CX3;
каждый из L1 и L4 независимо представляет собой связь или -(C1-C2 алкилен)-;
L2 представляет собой -(C1 алкилен)-;
L3 представляет собой связь или -(C1 алкилен)-;
каждый из Z1-Z8 независимо представляет собой N или CRZ, где по меньшей мере три из Z1-Z4 не являются одновременно N, и RZ представляет собой -H, -X или -O(C1-C4 алкил);
каждый из Z9 и Z10 независимо представляет собой N или S;
Y1 представляет собой -CH2-, -NRC-, -O- или -S(=O)2-;
Y2 представляет собой -CH2-, -NRC- или -O-;
Y3 представляет собой -NRC-;
Y4 представляет собой -CH2- или -NRD-;
Y5 представляет собой -NRD-;
Y6 и Y7 независимо представляют собой –CH2-, -NRD- или -O-;
Y8 представляет собой -C(=O), -CH2- или -NRE-;
Y9 представляет собой -NRF-;
Y10 представляет собой -NRF- или -S(=O)2-;
каждый из RA и RB независимо представляет собой -H, -(C1-C4 алкил), -(C1-C4 алкил)фенил, -C(=O)-CF2H или -C(=O)-O(C1-C4 алкил);
каждый из RC-RE независимо представляет собой -H, -(C1-C4 алкил), -(C1-C4 алкил)-OH, -(C1-C4 алкил)-O-(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-O(C1-C4 алкил), -C(=O)-(C3-C7 циклоалкил), -(C1-C4 алкил)-C(=O)морфолинил, -S(=O)2-(C1-C4 алкил), -(C1-C4 алкил)фенил, -(C2-C4 алкенил)фенил, -(C1-C4 алкил)пиридинил, -фенил, -пиридинил, -бензо[d]изоксазолил,  или
или  ,
,
где по меньшей мере один H в  может быть замещен -X, -OH или -CF3;
может быть замещен -X, -OH или -CF3;
Y11 представляет собой -CH2-, -NRF- или -O-;
RF представляет собой -(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-(C1-C4 алкил)-OH, -C(=O)-(C3-C7 циклоалкил) или -S(=O)2-(C1-C4 алкил);
 представляет собой одинарную связь;
представляет собой одинарную связь;
каждый из a-e независимо представляет собой целое число, равное 0, 1, 2 или 3, при условии, что a и b не могут одновременно быть равны 0 и c и d не могут быть одновременно равны 0; и
X представляет собой F, Cl, Br или I.
3. Производное 1,3,4-оксадиазолсульфонамида, соответствующее формуле I, его стереоизомер или его фармацевтически приемлемая соль по п.2,
где R1 представляет собой -CF2H или -CF3;
R2 представляет собой -(C1-C4 алкил), -(C1-C4 алкил)-O(C1-C4 алкил), -(C1-C4 алкил)-C(=O)-O(C1-C4 алкил), -(C1-C4 алкил)-O-C(=O)-(C1-C4 алкил),-(C1-C4алкил)-NRARB, -(C1-C4 алкил)-имидазолил, -(C1-C4 алкил)-триазолил, -(C1-C4 алкил)изоиндолинил, -(C1-C4 алкил)-бензо[dе]изохинолинил, -фенил, -пиридинил,  ,
,  или
или  ,
,
где по меньшей мере один H в -(C1-C4 алкиле) или -(C1-C4 алкил)-O-C(=O)-(C1-C4 алкиле) может быть замещен -X или -OH,
по меньшей мере один H в -(C1-C4 алкил)-имидазолиле, -(C1-C4 алкил)-триазолиле, -(C1-C4 алкил)изоиндолиниле, -(C1-C4 алкил)-бензо[dе]изохинолиниле или -фениле может быть замещен -O(C1-C4 алкилом), -(C1-C4 алкилом) или -(C1-C4 алкил)-OH или -C(=O)-CF2H, и
по меньшей мере один H в  ,
,  или
или  может быть замещен -X, -OH, -NRARB, -CN, -(C1-C4 алкилом), -(C1-C4 алкил)-OH, -C(=O)-NRARB, -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкилом)-OC(=O)-CF2H, морфолинилом, -(C1-C4 алкил)-фенилом, -фенилом или -оксадиазолилом, где по меньшей мере один Н в -(C1-C4 алкил)-фениле, -фениле или –оксадиазолиле может быть замещен -X, -O(C1-C4 алкилом) или -(C1-C4 алкилом);
может быть замещен -X, -OH, -NRARB, -CN, -(C1-C4 алкилом), -(C1-C4 алкил)-OH, -C(=O)-NRARB, -C(=O)-O(C1-C4 алкилом), -(C1-C4 алкилом)-OC(=O)-CF2H, морфолинилом, -(C1-C4 алкил)-фенилом, -фенилом или -оксадиазолилом, где по меньшей мере один Н в -(C1-C4 алкил)-фениле, -фениле или –оксадиазолиле может быть замещен -X, -O(C1-C4 алкилом) или -(C1-C4 алкилом);
R3 представляет собой -фенил, -пиридинил, -пиримидинил, -индазолил, -тиазолил, -тиодиазолил, бензо[d]тиазолил, -оксазолил, -бензо[d]оксазолил, 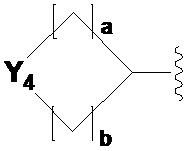 ,
,  ,
,  ,
, 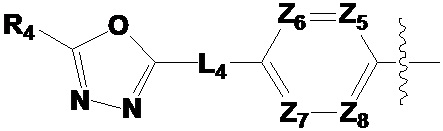 ,
,  ,
,  или
или  ,
,
где по меньшей мере один H в –фениле,–пиридиниле, -пиримидиниле, -индазолиле, -тиазолиле, -тиодиазолиле, -бензо[d]тиазолиле, -оксазолиле, -бензо[d]оксазолиле может быть замещен -X, -O(C1-C4 алкилом), -(C1-C4 алкилом), -CF3, -C(=O)-(C1-C4 алкилом),  или
или  и
и
R4 представляет собой -CX2H или -CX3;
каждый из L1 и L4 независимо представляет собой связь;
L2 представляет собой -(C1 алкилен)-;
L3 представляет собой связь или -(C1 алкилен)-;
каждый из Z1-Z8 независимо представляет собой N или CRZ, где по меньшей мере три из Z1-Z4 не являются одновременно N, и RZ представляет собой –H, –X или -O(C1-C4 алкил);
каждый из Z9 и Z10 независимо представляет собой N или S;
Y1 представляет собой -CH2-, -NRC-, -O- или -S(=O)2-;
Y2 представляет собой -CH2-, -NRC- или –O-;
Y3 представляет собой -NRC-;
Y4 представляет собой -CH2- или -NRD-;
Y5 представляет собой -NRD-;
Y6 и Y7 независимо представляют собой –CH2-, -NRD- или -O-;
Y8 представляет собой -C(=O), -CH2- или -NRE-;
Y9 представляет собой -NRF-;
Y10 представляет собой -NRF- или –S(=O)2-;
каждый из RA и RB независимо представляет собой Н, -(C1-C4 алкил), -(C1-C4 алкил)-фенил, -C(=O)-CF2H или -C(=O)-O(C1-C4 алкил);
каждый из RC-RE представляет собой Н, -(C1-C4 алкил), -(C1-C4 алкил)-OH, -(C1-C4 алкил)-O-(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-O(C1-C4 алкил), -C(=O)-(C3-C7 циклоалкил), -(C1-C4 алкил)-C(=O)-морфолинил, -S(=O)2-(C1-C4 алкил), -(C1-C4 алкил)-фенил, -(C2-C4алкенил)-фенил, -(C1-C4 алкил)-пиридинил, -фенил, -пиридинил, -бензо[d]изоксазолил,  или
или  ,
,
где по меньшей мере один H в  может быть замещен -X, -OH или -CF3;
может быть замещен -X, -OH или -CF3;
Y11 представляет собой -CH2-, -NRF- или -O-;
RF представляет собой -(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-(C1-C4 алкил)-OH, -C(=O)-(C3-C7 циклоалкил) или -S(=O)2-(C1-C4 алкил);
 представляет собой одинарную связь;
представляет собой одинарную связь;
каждый из a и b независимо представляет собой целое число, равное 0, 1, 2 или 3, при условии, что a и b не могут быть одновременно равны 0;
c или d независимо представляют собой 1,
e представляет собой целое число 1 или 2; и
X представляет собой F, Cl или Br.
4. Производное 1,3,4-оксадиазолсульфонамида, соответствующее формуле I, его стереоизомер или его фармацевтически приемлемая соль по п.3,
где R1 представляет собой -CF2H;
R2 представляет собой -(C1-C4 алкил), -(C1-C4 алкил)-NRARB,  или
или  ,
,
где по меньшей мере один H в -(C1-C4 алкиле) может быть замещен -X или -OH, и
по меньшей мере один H в  или
или  может быть замещен -(C1-C4 алкилом);
может быть замещен -(C1-C4 алкилом);
R3 представляет собой –фенил, –пиридинил, -пиримидинил, -индазолил, -тиазолил, -тиодиазолил, -бензо[d]тиазолил, -оксазолил или -бензо[d]оксазолил,
где по меньшей мере один H в -фениле или -пиридиниле, -пиримидиниле, -индазолиле, -тиазолиле, -тиодиазолиле, -бензо[d]тиазолиле, -оксазолиле или -бензо[d]оксазолиле может быть замещен -X или -(C1-C4 алкилом);
каждый из L1 и L3 независимо представляет собой связь;
L2 представляет собой -(C1 алкилен)-;
каждый из Z1-Z4 независимо представляет собой N или CRZ, где по меньшей мере два из Z1-Z4 не могут одновременно представлять собой N, и RZ представляет собой H или -X;
Y1 представляет собой -NRC-, -O- или -S(=O)2-;
Y2 представляет собой -NRC-;
каждый из RA и RB независимо представляет собой -(C1-C4 алкил);
RC представляет собой -(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -S(=O)2-(C1-C4 алкил) или  ,
,
где по меньшей мере один H в  может быть замещен -X, -OH или -CF3;
может быть замещен -X, -OH или -CF3;
Y11 представляет собой -NRF- или -O-;
RF представляет собой -(C1-C4 алкил), -C(=O)-(C1-C4 алкил), -C(=O)-(C1-C4 алкил)-OH или -S(=O)2-(C1-C4 алкил);
 представляет собой одинарную связь;
представляет собой одинарную связь;
каждый a или b независимо представляет собой целое число, равное 0, 1 или 2, при условии, что a и b не могут быть одновременно равны 0;
e представляет собой целое число, равное 1 или 2; и
X представляет собой F, Cl или Br.
5. Производное 1,3,4-оксадиазолсульфонамида, соответствующее формуле I, его стереоизомер или его фармацевтически приемлемая соль по п.1, где соединение, соответствующее формуле I, выбрано из группы, состоящей из соединений, описанных в следующей таблице:



















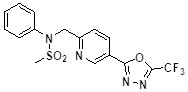


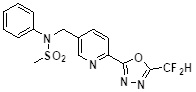

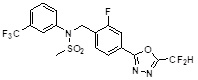

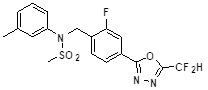


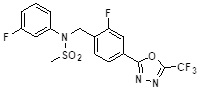
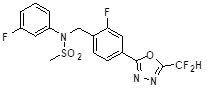

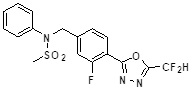



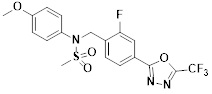





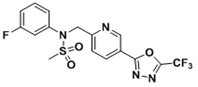

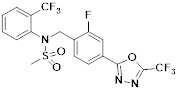


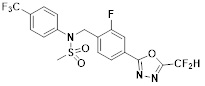





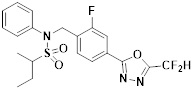


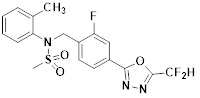





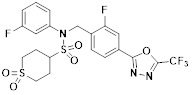
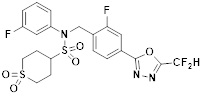
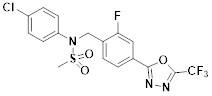
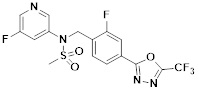



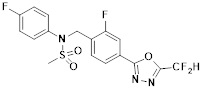



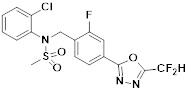






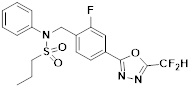



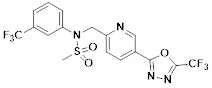
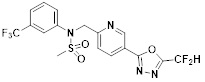

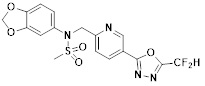
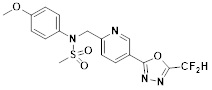


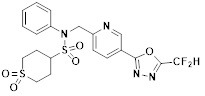



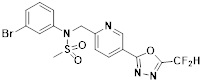



















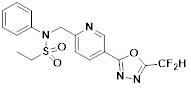







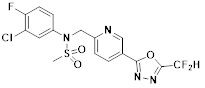





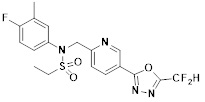









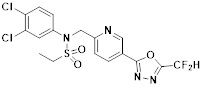

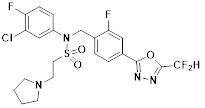





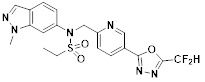



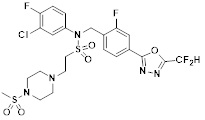

















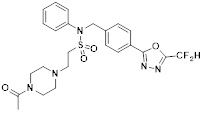



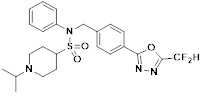





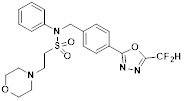
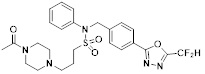

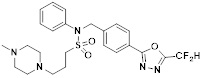
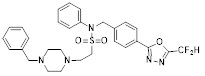





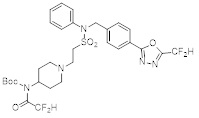

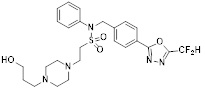



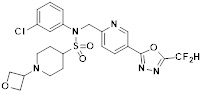




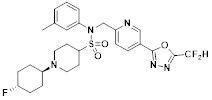
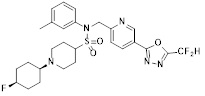






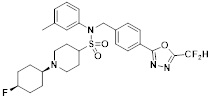




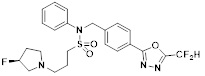


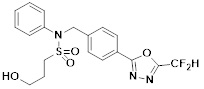
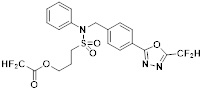







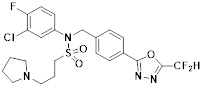
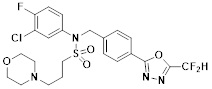








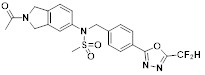



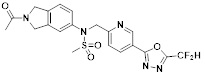
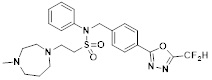

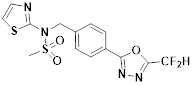
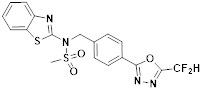
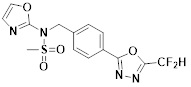


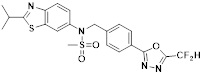

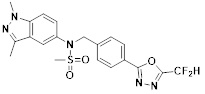


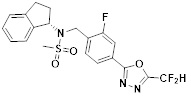



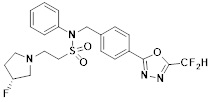









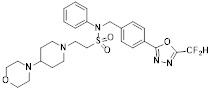

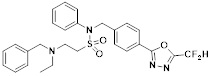
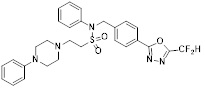
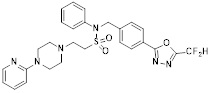


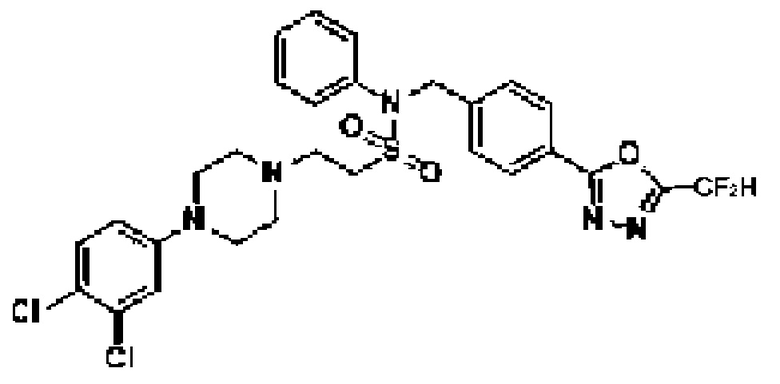

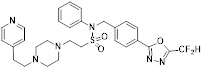



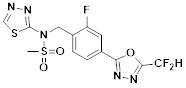





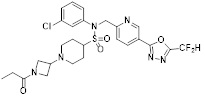





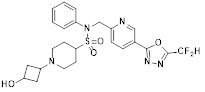
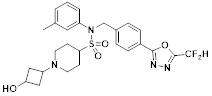


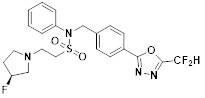
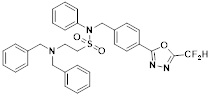


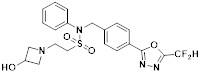

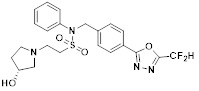










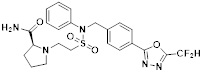




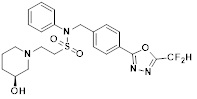




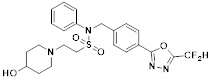
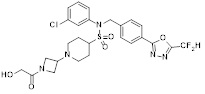












6. Производное 1,3,4-оксадиазолсульфонамида, соответствующее формуле I, его стереоизомер или его фармацевтически приемлемая соль по п.5, где соединение, соответствующее формуле I, выбрано из группы, состоящей из соединений, описанных в следующей таблице:






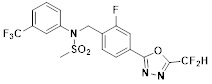
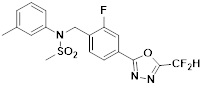
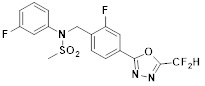




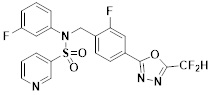
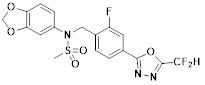









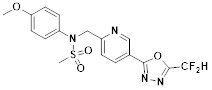


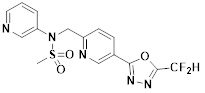




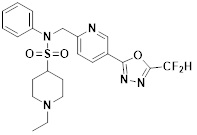
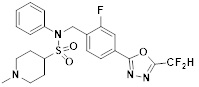





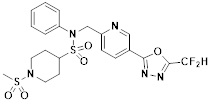





































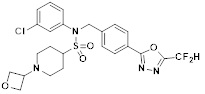



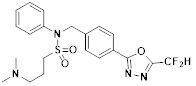








7. Производное 1,3,4-оксадиазолсульфонамида, соответствующее формуле I, его стереоизомер или его фармацевтически приемлемая соль по п.6, где соединение, соответствующее формуле I, выбрано из группы, состоящей из соединений, описанных в следующей таблице:

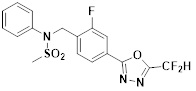











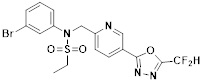




































8. Фармацевтическая композиция для предупреждения или лечения заболевания, опосредуемого деацетилазой гистонов 6 (HDAC6), содержащая в качестве активного ингредиента терапевтически эффективное количество соединения, соответствующего формуле I, его стереоизомера или его фармацевтически приемлемой соли по любому одному из пп.1-7 и по меньшей мере один фармацевтически приемлемый носитель.
9. Способ лечения заболевания, опосредуемого деацетилазой гистонов 6, включающий введение терапевтически эффективного количества соединения, соответствующего формуле I, его стереоизомера или его фармацевтически приемлемой соли по любому одному из пп.1-7.
10. Применение соединения, соответствующего формуле I, его стереоизомера или его фармацевтически приемлемой соли по любому одному из пп.1-7 для получения лекарственного средства для лечения заболевания, опосредуемого деацетилазой гистонов 6.
| Chen Jian Jeffrey et al, Discovery of 2-methylpyridine-based biaryl amides as γ-secretase modulators for the treatment of Alzheimer’s, Bioorganic & Medicinal Chemistry Letters, 23, 23, стр.:6447 - 6454 | |||
| WO2012013716 A1, 02.02.2012 | |||
| WO2010123933A1, 28.10.2010 | |||
| WO2010126002A1, 04.11.2010 | |||
| WO2009010479A2, 22.01.2009 | |||
| ИНГИБИТОРЫ ДЕАЦЕТИЛАЗЫ И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2515611C2 |
Авторы
Даты
2019-08-16—Публикация
2016-07-27—Подача