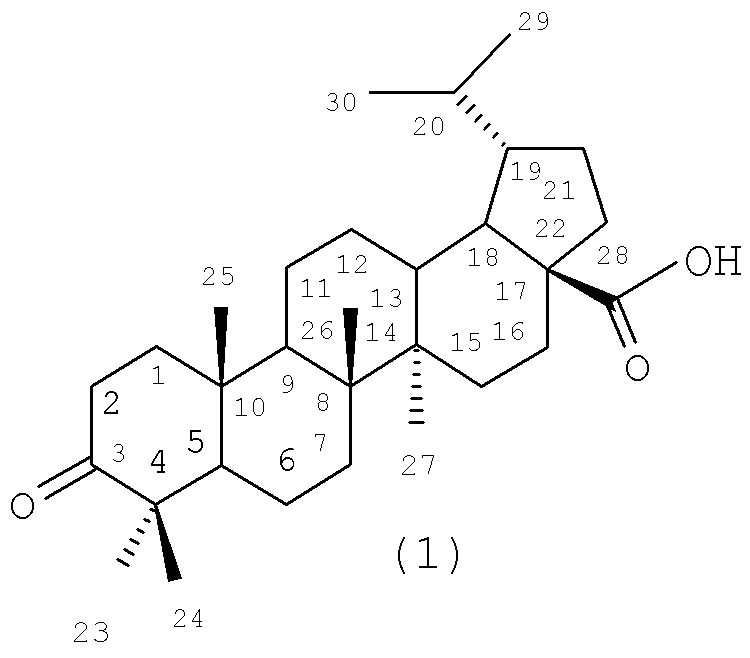
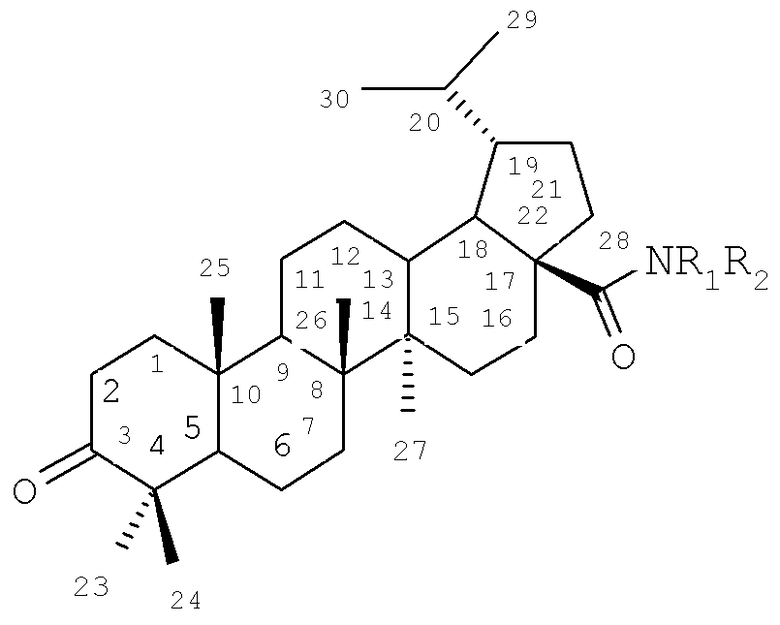
Изобретение относится к новому ряду химических соединений, а именно к гидрированной бетулоновой кислоте формулы (1) и ее амидам формулы (2-8):
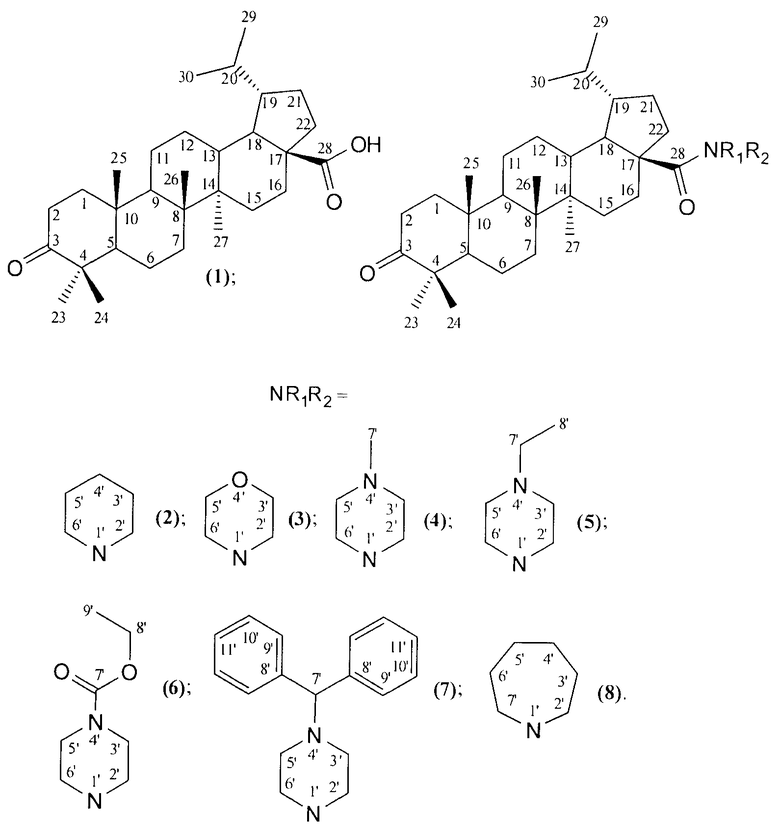
которые могут быть использованы в медицине в качестве лекарственных средств, обладающих противоопухолевым действием.
Современные схемы лечения различного типа злокачественных опухолей используют хирургические методы в комплексе в высокодозной агрессивной терапией, серьезным недостатком которой является высокая токсичность современных противоопухолевых препаратов в отношении жизненно-важных органов и систем организма. Сопутствующие побочные эффекты снижают эффективность, а в ряде случаев ограничивают применение противоопухолевых средств. Другой проблемой в лечении онкологических заболеваний является проблема остаточного опухолевого клона. Опухолевые клетки, пережившие химиотерапию, обычно проявляют лекарственную устойчивость к широкому кругу препаратов и вызывают рецидив заболевания в более тяжелой форме. В связи с этим актуальной задачей является поиск новых противоопухолевых препаратов, обеспечивающих высокую избирательность и эффективность лечения.
Важным направлением медицинской химии, позволяющим получать новые, эффективные противоопухолевые препараты, является использование синтетических трансформаций растительных метаболитов. Наиболее приемлемым считается исследование растительных метаболитов, о биологической активности которых имеются достоверные сведения и которые являются доступными в настоящее время или станут доступными в ближайшем будущем по мере формирования сырьевой базы. К данному классу соединений относятся тритерпеновые кислоты, широкий спектр биологической активности которых (противовоспалительная, противовирусная, противоопухолевая, иммуностимулирующая и т.д.) приковывает к ним пристальный интерес исследователей.
Задачей изобретения является создание новых эффективных, низкотоксичных лекарственных средств, обладающих противоопухолевым действием и получаемых из доступного растительного сырья.
Поставленная задача решается новыми соединениями тритерпеновой природы, а именно гидрированной бетулоновой кислотой формулы (1) и ее амидами формулы (2-8), которые могут использоваться в качестве противоопухолевых средств.
Из литературных источников известно, что производные тритерпенов, в частности, лупанового ряда перспективны как противовирусные и противоопухолевые препараты [Толстикова Т.Г., Сорокина И.В., Толстиков Г.А., Толстиков А.Г., Флехтер О.Б. // Биоорган. химия, 2006, 32, 291-307]. На примере производных бетулиновой кислоты показана связь структуры и противоопухолевой активности в отношении широкого спектра раковых клеток (IС50 10-6-10-9 М) [Mukherjee R., Kumar V., Srivastava S.K, Agarwal S.K., Burman A.C. // Anti-cancer agents in Medicinal Chemistry, 2006, V.6, P.271-279]. В этой же работе есть примеры того, что гидрированные аналоги зачастую показывают большую активность по сравнению с обычными производными бетулиновой кислоты. Анти-ВИЧ активность 3-O-глутарилдигидробетулина увеличивается минимум на три порядка при переходе от обычного производного бетулина [Kashiwada Y., Sekiya M., Ikeshiro Y., Fujioka Т., Kilgore N.R., Wild C.T., Allaway G.P., Lee K.-H. // Bioorgan. Med. Chem. Lett., 2004, 14, P.5851-5853]. Производные бетулоновой кислоты, содержащие фрагменты ω-аминокислот, являются активными индукторами апоптоза в лейкозных клетках и клетках гепатокарциномы in vitro [Шинтяпина А.Б., Шульц Э.Э., Петренко Н.И., Узенкова Н.В., Толстиков Г.А., Пронкина Н.В., Кожевников B.C., Покровский А.Г. // Биоорган. химия, 2007, 33, 624]. Важной чертой амидов бетулоновой кислоты является то, что амид, например, содержащий фрагмент β-аланина, проявляет антиоксидантную активность и обладает способностью снижать органотоксическое действие противоопухолевых препаратов [Сорокина И.В., Толстикова Т.Г., Жукова Н.А., Петренко Н.И., Шульц Э.Э., Толстиков Г.А. // Докл. АН, 2004, 399, с.274]. Обстоятельством, повышающим привлекательность тритерпенов, является их широкое распространение в природе и во многих случаях относительная простота технологии получения из многотоннажного растительного сырья.
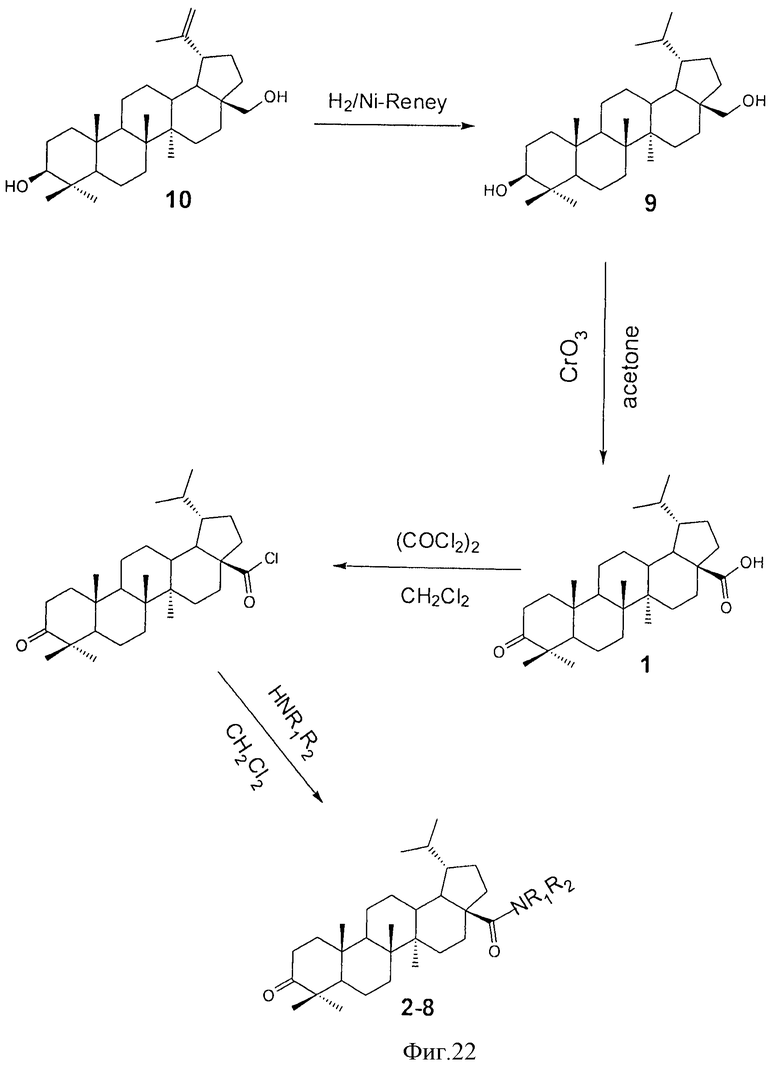
Одним из соединений тритерпеновой природы с ярко выраженными физиологическими свойствами является дигидробетулоновая кислота формулы (1), которая получается окислением дигидробетулина формулы (9). Дигидробетулин формулы (9) получается гидрированием бетулина формулы (10) - широкодоступным сырьем, выделяемым из внешней коры березы семейства Betula [Krasutsky P.A. // Nat. prod. rep., 2006, 23, Р.919-942].
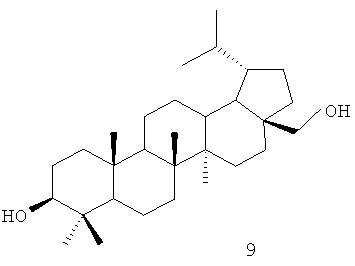
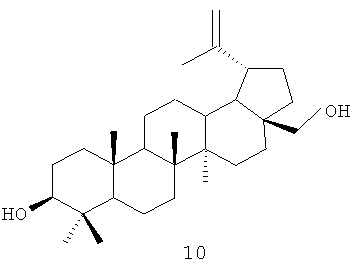
Для достижения поставленной цели мы провели ряд химических модификаций, представленных на схеме 1, Фиг.22. В качестве исходного соединения был взят бетулин (10), полученный экстракцией коры березы бензолом. Гидрирование бетулина (10) водородом в автоклаве над Ni-Ренея давал дигидробетулин (9), который окисляли раствором Физера. Следующим этапом было получение хлорангидрида дигидробетулоновой кислоты (1), который далее использовался без промедления. Взаимодействие хлорангидрида дигидробетулоновой кислоты (1) с двойным избытком соответствующего амина легко приводило к целевым соединениям формулы (2-8) с противоопухолевой активностью.
ИК-спектры записывали на приборе "VECTOR 22" в KBr. Удельное вращение определяли на спектрометре polAAr 3005, концентрации растворов приведены в г/100 мл. Точки плавления определяли на приборе Termosystem FP 900 фирмы Mettler Toledo и на столике Кофлера S 30 A/G (Германия).
Элементный состав полученных веществ определяли из элементного анализа и из масс-спектров высокого разрешения, записанных на приборе DFS (Double Focusing Sector) фирмы Thermo Electron Corporation.
Спектры ЯМР 1Н и 13С регистрировали на спектрометрах AV-400 (рабочие частоты 400.13 MHz для 1Н и 100.61 MHz для 13С) и DRX-500 (500.13 MHz и 125.76 MHz соответственно) фирмы Bruker для растворов веществ в СDСl3. В качестве внутреннего стандарта использовали сигналы растворителя (δH 7.24 и δC 76.9 м.д). Строение полученных соединений устанавливали на основании анализа спектров ЯМР 1Н с привлечением спектров двойного резонанса 1Н-1Н, а также анализа спектров ЯМР 13С с использованием стандартных методик записи спектров в режиме J-модуляции (JMOD), с внерезонансным и селективным подавлением протонов, двумерных спектров гетероядерной 13C-1H корреляции на прямых константах спин-спинового взаимодействия (С-Н COSY, 1JC,H 135 Гц) и двумерных и одномерных спектров гетероядерной 13С-1Н корреляции на дальних константах спин-спинового взаимодействия (COLOC, LRJMD, 2,3JC,H 10 Гц).
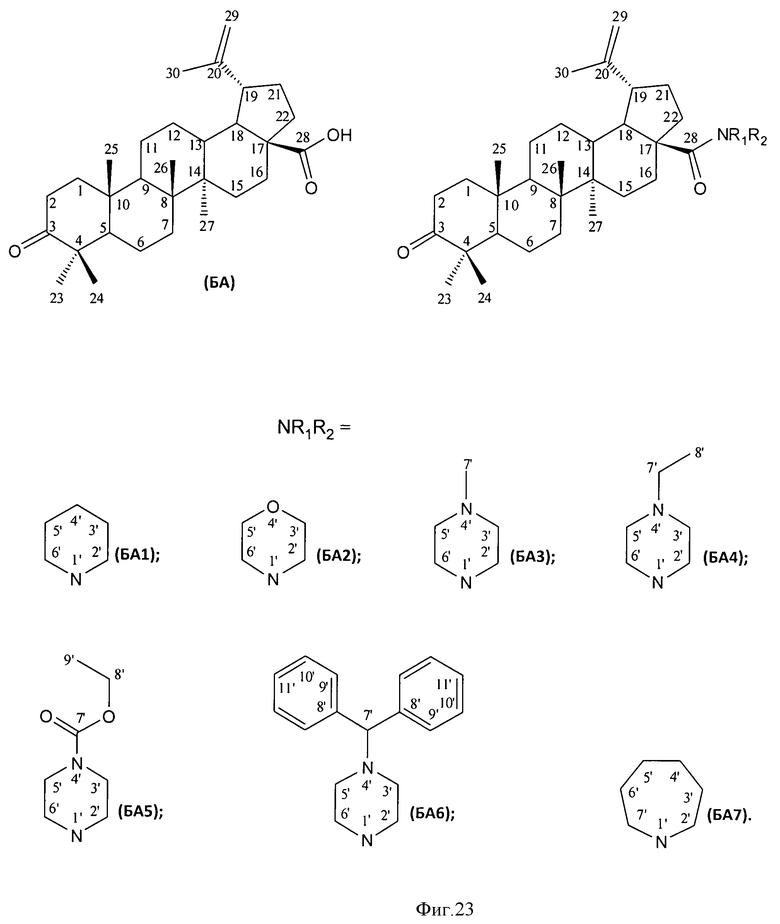
Было исследовано влияние заявляемой гидрированной бетулоновой кислоты формулы (1) и ее амидов (2-8) на жизнеспособность клеток карциномных линий человека. Значения CCID гидрированной бетулоновой кислоты (1) и ее амидов (2-8) для различных карциномных линий клеток человека приведены в таблице 1. В качестве препаратов сравнения использовали бетулоновую кислоту (БА) и ее соответствующие амиды (БА1-БА7) (Фиг.23, схема 2 Бетулоновая кислота (БА) и ее производные (БА1-БА7)).
В результате было показано, что заявляемые соединения (1-8) проявляют высокую противоопухолевую активность по отношению ко всем использованным опухолевым клеточным культурам, а именно СЕМ-13, U-937, МТ-4. Показано, что значения ССID50 для соединений (1-8) имеют сходный порядок величины для всех опухолевых клеток и лежат в диапазоне 2.9-69.5 µM. Полученные данные по противоопухолевой активности соединений (1-8) позволяют рассматривать их как перспективные лекарственные агенты. Изобретение иллюстрируется следующими примерами.
Пример 1. Получение луп-20(29)-ен-3β,28-диола (бетулина, 10)
Измельченную кору березы (344 г) кипятят в бензоле (1.6 л) с обратным холодильником 8 ч, далее горячий раствор декантирют. В оставшуюся кору добавляют еще 1 л бензола, кипятят 1 ч, горячий раствор снова декантирют. Выпавший из бензола осадок отфильтровывают, высушивают и получают 52 г бетулина-сырца. После перекристаллизации в изопропаноле получают 38 г бетулина с т.пл. 260-262°С (лит. т.пл. 258-260°C [Hayek // Phytochem. 1989, 28, P.22.]). Выход бетулина на исходную кору составляет 11%.
Пример 2. Получение лупан-3β,28-диола (дигидробетулина, 9)
Гидрирование бетулина (10) проводят аналогично известной методике [Ruzicka L., Brener М., Rey Е. // Helv. Chim. Acta, 1941, 24, P.515-529]. В 5 л автоклав с мешалкой помещают 132 г бетулина (10), 13.2 г Ni-Ренея и 2.5 л этанола, далее все перемешивают в атмосфере водорода (100 атм) при 180°С в течение 14 ч. Освобождаются от катализатора горячим фильтрованием в диоксане, после отгонки растворителя получают 124 г дигидробетулина (9) (выход - 93%). Т.пл. 282-284°С (из спирта). Лит. т.пл. 278-280°С [Ruzicka L., Brener М., Rey Е. // Helv. Chim. Acta, 1941, 24, Р.515-529].
Пример 3. Получение 3-оксо-лупан-28-овой кислоты (дигидробетулоновой кислоты, 1)
Суспензию 10 г (22.5 ммоля) дигидробетулина (9) в 165 мл ледяной уксусной кислоте и 110 мл ацетона охлаждают при 0°С и в течение 1 ч при перемешивании прибавляют свежеприготовленный раствор Физера (11 г, 0.11 моля хромового ангидрида в 12 мл ледяной уксусной кислоты и 15 мл Н2О). Выдерживают при комнатной температуре 3 ч. По окончании реакции добавляют 50 мл метанола, прибавляют 300 мл бензола и 300 мл 10% раствора NaCl. Бензольный слой отделяют, а водный экстрагируют 2×150 мл бензола. Объединенные экстракты промывают 3×200 мл 10% раствором NaCl, сушат MgSO4, осушитель отфильтровывают, бензол отгоняют приблизительно до 100 мл и выливают в 200 мл 5% раствора KОН. Осадок калиевой соли дигидробетулоновой кислоты (1) отфильтровывают и высушивают. Сухую соль растворяют в 50 мл этанола, не растворившуюся часть отфильтровывают, фильтрат выливают в 250 мл 5% раствор НСl. Выделившуюся кислоту (1) отфильтровывают, промывают H2O, высушивают. В итоге получают 5.5 г (54% от теории) дигидробетулоновой кислоты (1). Точка плавления и спектры ЯМР 1Н и 13С соответствуют литературным [Wahab A., Ottosen M., Bachelor F.W. // Can.J.Chem., 1991, 69, P.570-577].
Пример 4. Получение 3-оксо-лупано-28-ил хлорида (хлорангидрида дигидробетулоновой кислоты, 1)
К раствору 5.7 г (12.48 ммоля) дигидробетулоновой кислоты (1) в 70 мл безводного СН2Сl2 добавляют 2.3 мл (26.36 ммоля) оксалилхлорида и выдерживают при комнатной температуре 4 ч. После отгонки растворителя к остатку прибавляют столько же СН2Сl2 и повторно упаривают. Остаток обрабатывают безводным эфиром, осадок отфильтровывают, промывают эфиром, получают 4.6 г хлорангидрида ДГБК с т.пл. 225-232°С (выход - 91%). Хлорангидрид сразу же вводят в дальнейшую реакцию.
Пример 5. Получение амидов гидрированной бетулоновой кислоты (2-8). Общая методика
К раствору 0.5 г (1.05 ммоля) хлорангидрида дигидробетулоновой кислоты (1) в 40 мл сухого CH2Cl2 при перемешивании прибавляют 2.2 ммоля соответствующего амина. Реакционную смесь выдерживали при комнатной температуре 18-20 ч, затем разбавляют CH2Cl2 до 100 мл, промывают 3×20 мл Н2О, высушивают MgSO4, осушитель отфильтровывают, растворитель отгоняют. Остаток перекристаллизовывают либо делят колоночной хроматографией на силикагеле фракции 60-200 мкм фирмы Merk. Элюенты приведены для каждого продукта. Данные спектров ЯМР 13С для синтезированных амидов дигидробетулоиовой кислоты (2-8) в СDСl3 (δ, м.д.) приведены в таблице 2.




Примечания: а) для атомов С(2′,6′) наблюдается широкий сигнал при 46.2 м.д., ХС сигнала С(4′) 24.62 м.д.; b) для атомов С(2′,6′) наблюдается широкий сигнал при 45.6 м.д.; с) для атомов С(2′,6′) соединений (4-6) наблюдаются очень широкие сигналы около 45 м.д.; d) для атомов С(2′,6′) соединения (7) и атомов С(2′,7′) соединения (8) сигналы наблюдать не удается; для соединения (7) ХС дублетных сигналов ароматической части следующие: 128.43 С(10′) и 126.94 С(11′) м.д.
Пример 6. Влияние гидрированиой бетулоновой кислоты (1) и ее амидов (2-8) на жизнеспособность опухолевых клеток Т-клеточного лейкоза человека МТ-4
Клетки линии МТ-4 (клетки Т-клеточного лейкоза человека) культивировали в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина), в атмосфере 5%-ного СО2 при 37°С.
Жизнеспособность клеток после инкубации с соединениями (1-8) определяли с помощью МТТ теста, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки высаживали в 96-луночные планшеты (100 мкл клеток с концентрацией 500 тыс. клеток/мл). Затем к клеткам добавляли раствор соединений (1-8) в ДМСО до конечной концентрации в среде от 0.1 до 100 мкг/мл. В качестве препарата сравнения использовали бетулоновую кислоту (БА) и ее соответствующие амиды (БА1-БА7). Клетки инкубировали в присутствии соединений еще в течение 3-х суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана, и измеряли оптическую плотность на многоканальном спектрофотометре на длинах волн 570 и 630 нм, где А570 - поглощение формазана, а А630 - фон клеток.
Данные представляли в виде количества живых клеток относительно контроля. За 100% принимали количество клеток в контроле, где клетки инкубировали в отсутствие соединения, но в присутствии растворителя ДМСО.
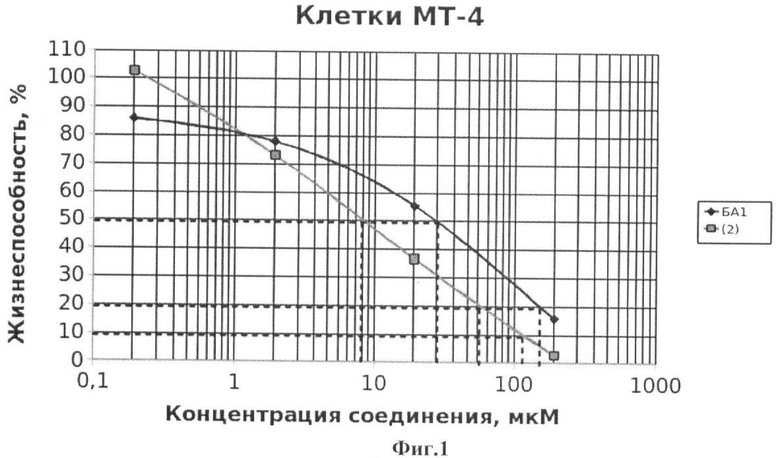
Данные по обработке лейкозных клеток МТ-4 соединениями (1-8) приведены на Фиг 1-7.
На Фиг.1 показана жизнеспособность клеток линии МТ-4 после инкубации с соединением (2) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (2). В качестве препарата сравнения использовано аналогичное производное БК (БА1)
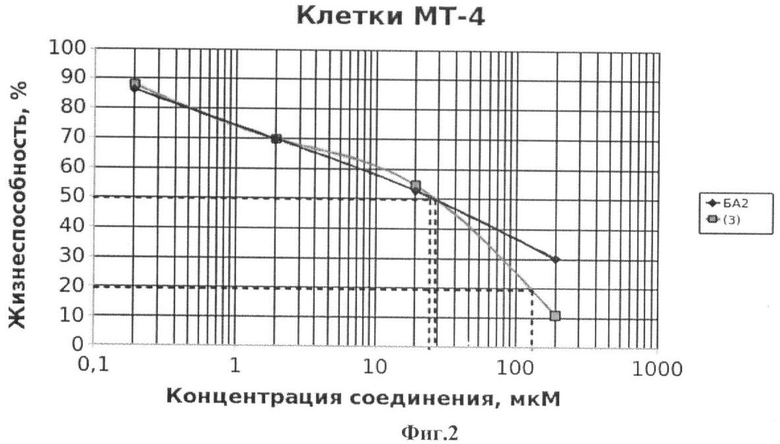
На Фиг.2 - жизнеспособность клеток линии МТ-4 после инкубации с соединением (3) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (3). В качестве препарата сравнения использовано аналогичное производное БК (БА2).
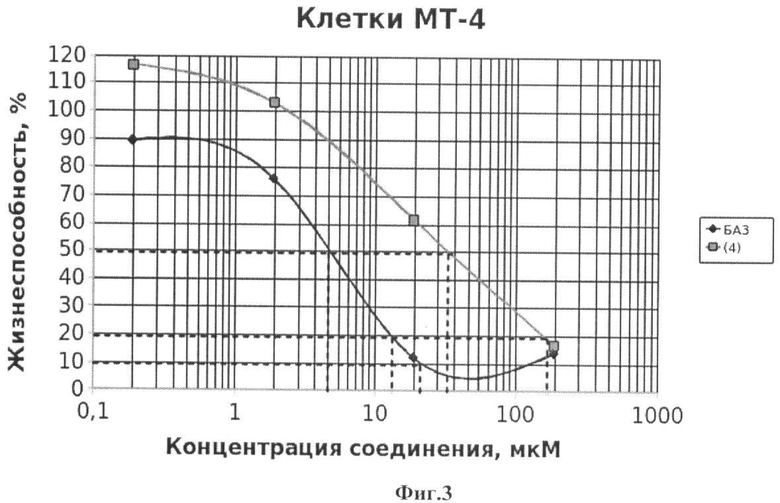
На Фиг.3 - жизнеспособность клеток линии МТ-4 после инкубации с соединением (4) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (4). В качестве препарата сравнения использовано аналогичное производное БК (БА3).
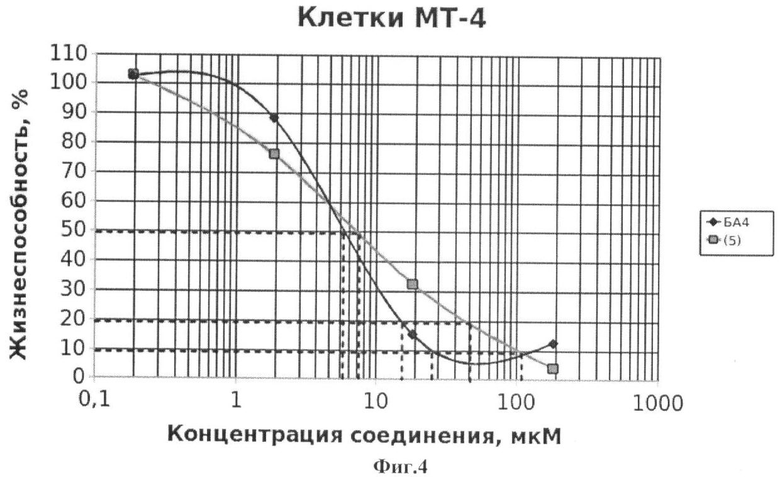
На Фиг.4 - жизнеспособность клеток линии МТ-4 после инкубации с соединением (5) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (5). В качестве препарата сравнения использовано аналогичное производное БК (БА4).
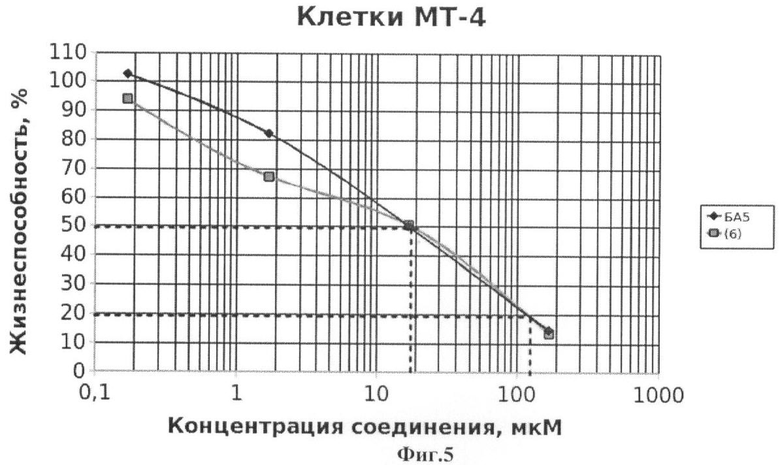
На Фиг.5 - жизнеспособность клеток линии МТ-4 после инкубации с соединением (6) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (6). В качестве препарата сравнения использовано аналогичное производное БК (БА5).
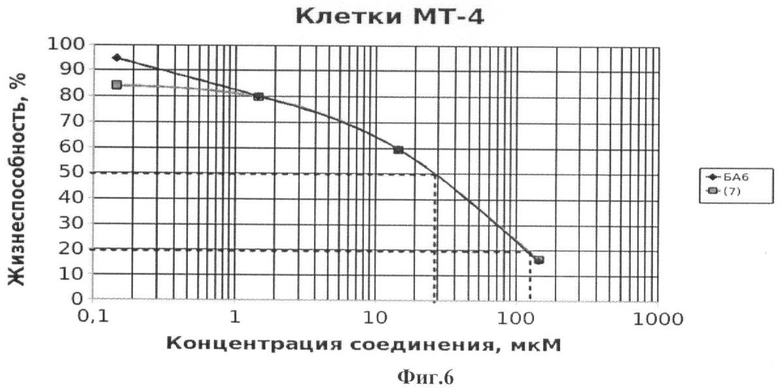
На Фиг.6 - жизнеспособность клеток линии МТ-4 после инкубации с соединением (7) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (7). В качестве препарата сравнения использовано аналогичное производное БК (БА6).
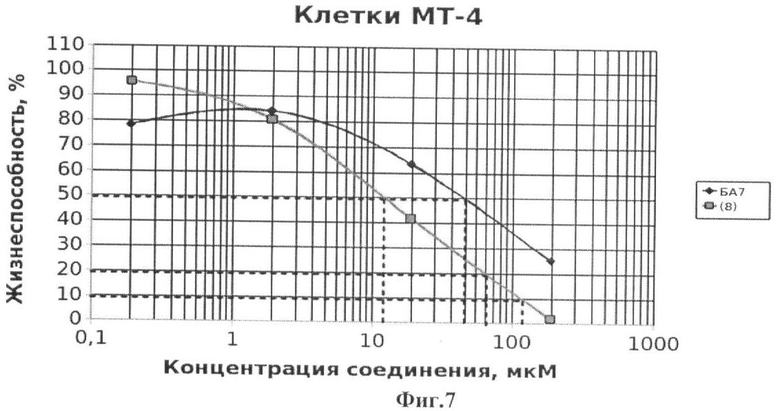
На Фиг.7 - жизнеспособность клеток линии МТ-4 после инкубации с соединением (8) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (8). В качестве препарата сравнения использовано аналогичное производное БК (БА7).
Из данных, приведенных на Фиг.1-7, видно, что обработка лейкозных клеток МТ-4 соединениями (1-8) вызывает их эффективную гибель уже при концентрации соединений 10-6 М. Значения CCID50 - концентрация соединения, при которой наблюдается гибель 50% клеток, а также CCID80 и CCID90 (концентрации, при которых наблюдается гибель 80 и 90% клеток, соответственно) приведены в таблице 1.
Из данных, приведенных в таблице 1, видно, что соединения (1-8) обладают таким же или более выраженным противоопухолевым эффектом по сравнению с ранее описанными аналогичными производными бетулоновой кислоты (БА1-БА7), за исключением соединения (4), противоопухолевый эффект которого на клетках МТ-4 менее выражен по сравнению с аналогичным производным бетулоновой кислоты.
Пример 7. Влияние гидрированной бетулоновой кислоты (1) и ее амидов (2-8) на жизнеспособность опухолевых клеток Т-клеточного лейкоза человека СЕМ-13
Клетки линии СЕМ-13 (линия клеток Т-клеточного лейкоза человека) культивировали в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина), в атмосфере 5%-ного СО2 при 37°С.
Жизнеспособность клеток после инкубации с соединениями (1-8) определяли с помощью МТТ теста, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки высаживали в 96-луночные планшеты (100 мкл клеток с концентрацией 500 тыс. клеток/мл). Затем к клеткам добавляли раствор соединения (1) в ДМСО до конечной концентрации в среде от 0.1 до 100 мкг/мл. В качестве препарата сравнения использовали аналогичные производные бетулоновой кислоты (2). Клетки инкубировали в присутствии исследуемых соединений еще в течение 3-х суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана, и измеряли оптическую плотность на многоканальном спектрофотометре на длинах волн 570 и 630 нм, где А570 - поглощение формазана, а А630 - фон клеток.
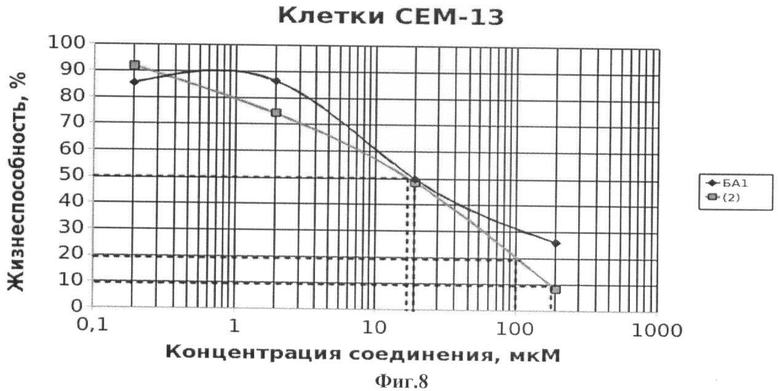
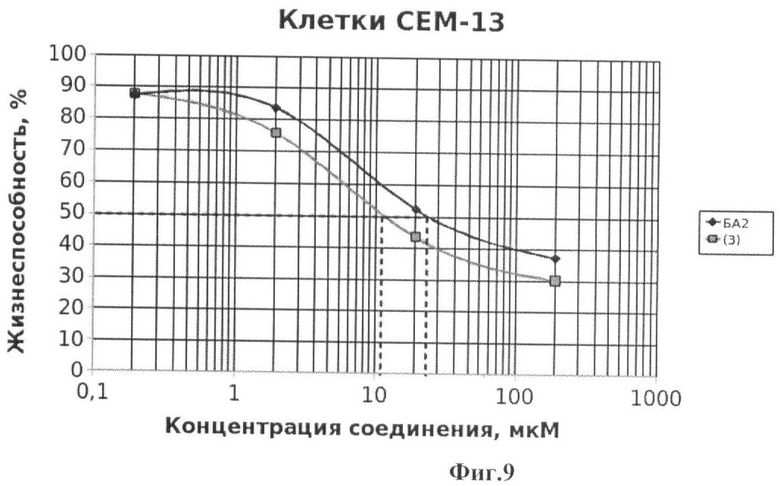
Подсчет значений CCID проводили как описано в примере 5. Значения CCID50 - концентрация соединения, при которой наблюдается гибель 50% клеток, а также CCID80 и CCID90 (концентрации, при которых наблюдается гибель 80 и 90% клеток, соответственно) приведены в таблице 1. Все исследованные соединения (1-8) обладают таким же или более выраженным противоопухолевым эффектом по сравнению с ранее описанными аналогичными производными бетулоновой кислоты (БА1-БА7), за исключением соединения (4), противоопухолевый эффект которого на клетках СЕМ-13 менее выражен по сравнению с аналогичным производным бетулоновой кислоты.
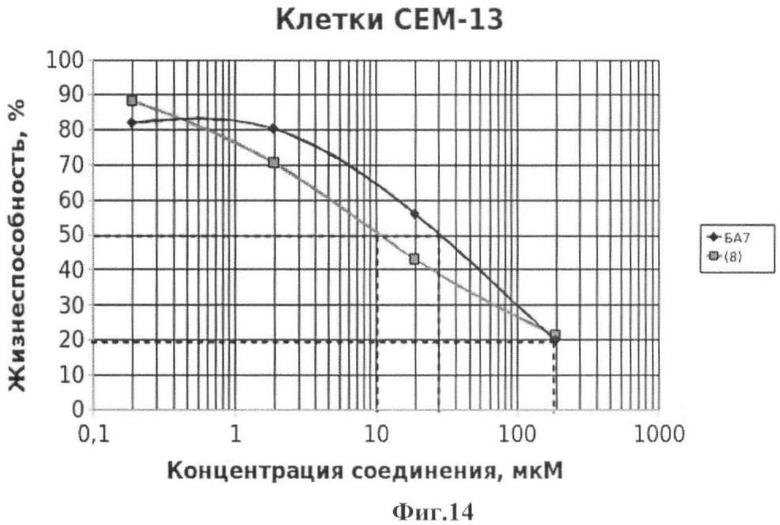
Жизнеспособность клеток линии СЕМ-13 после инкубации с соединениями (2-8) иллюстрируется Фиг.8-14.
Фиг.8 - жизнеспособность клеток линии СЕМ-13 после инкубации с соединением (2) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (2). В качестве препарата сравнения использовано аналогичное производное БК (БА1)
Фиг.9 - жизнеспособность клеток линии СЕМ-13 после инкубации с соединением (3) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (3). В качестве препарата сравнения использовано аналогичное производное БК (БА2).
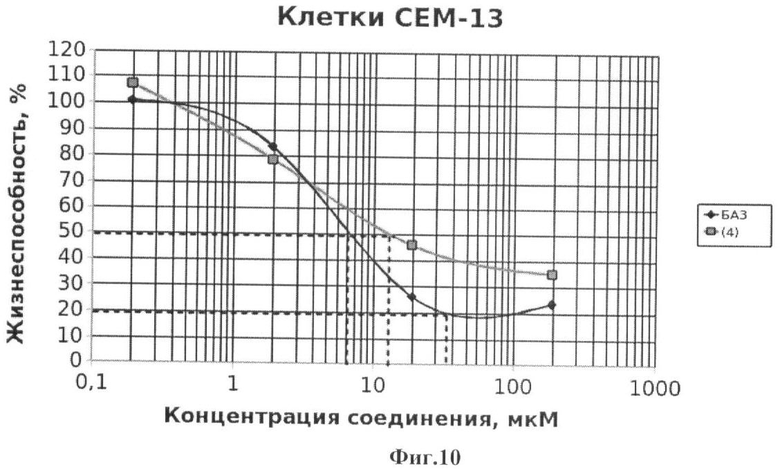
Фиг.10 - жизнеспособность клеток линии СЕМ-13 после инкубации с соединением (4) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (4). В качестве препарата сравнения использовано аналогичное производное БК (БА3).
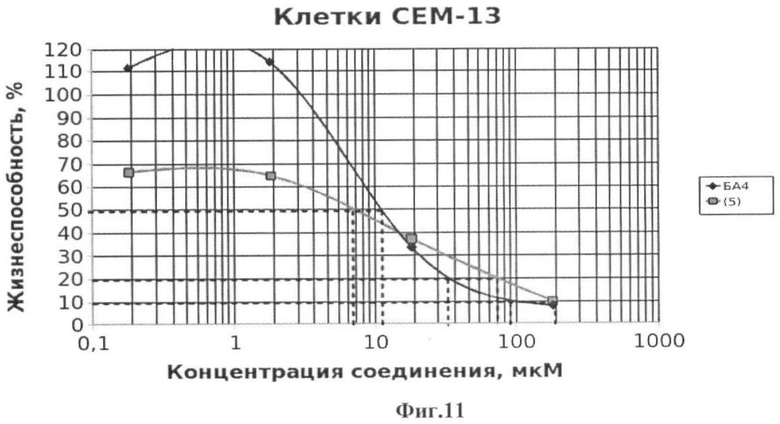
Фиг.11 - жизнеспособность клеток линии СЕМ-13 после инкубации с соединением (5) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (5). В качестве препарата сравнения использовано аналогичное производное БК (БА4).
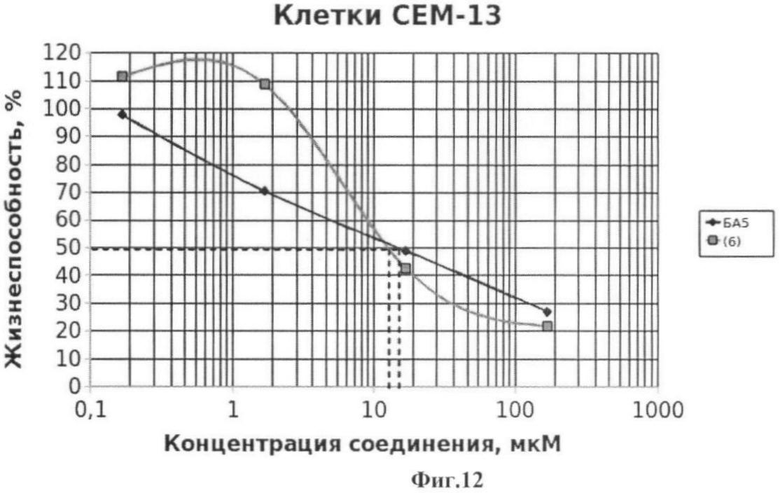
Фиг.12 - жизнеспособность клеток линии СЕМ-13 после инкубации с соединением (6) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (6). В качестве препарата сравнения использовано аналогичное производное БК (БА5).
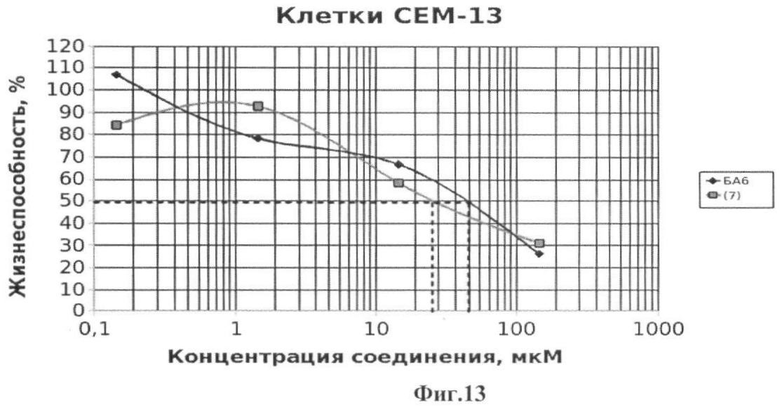
Фиг.13 - жизнеспособность клеток линии СЕМ-13 после инкубации с соединением (7) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (7). В качестве препарата сравнения использовано аналогичное производное БК (БА6).
Фиг.14 - жизнеспособность клеток линии СЕМ-13 после инкубации с соединением (8) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (8). В качестве препарата сравнения использовано аналогичное производное БК (БА7).
Пример 8. Влияние гидрированной бетулоновой кислоты (1) и ее амидов (2-8) на жизнеспособность опухолевых клеток человека U-937
Клетки линии U-937 (опухолевая линия моноцитов человека) культивировали в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина), в атмосфере 5%-ного СО2 при 37°С.
Жизнеспособность клеток после инкубации с соединениями (1-8) определяли с помощью МТТ теста, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки высаживали в 96-луночные планшеты (100 мкл клеток с концентрацией 400 тыс. клеток/мл). Затем к клеткам добавляли раствор исследуемых соединений в ДМСО до конечной концентрации в среде от 0.1 до 100 мкг/мл. В качестве препарата сравнения использовали бетулоновую кислоту (2). Клетки инкубировали в присутствии соединений еще в течение 3-х суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана, и измеряли оптическую плотность на многоканальном спектрофотометре на длинах волн 570 и 630 нм, где А570 - поглощение формазана, а А630 - фон клеток.
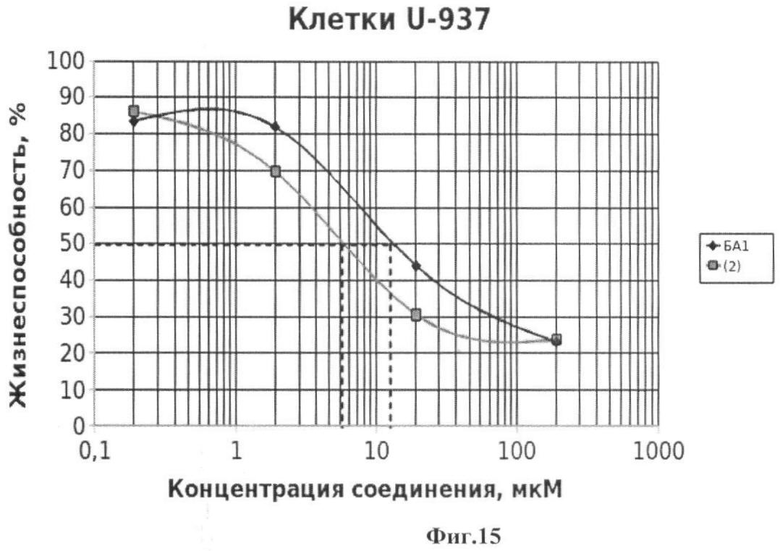
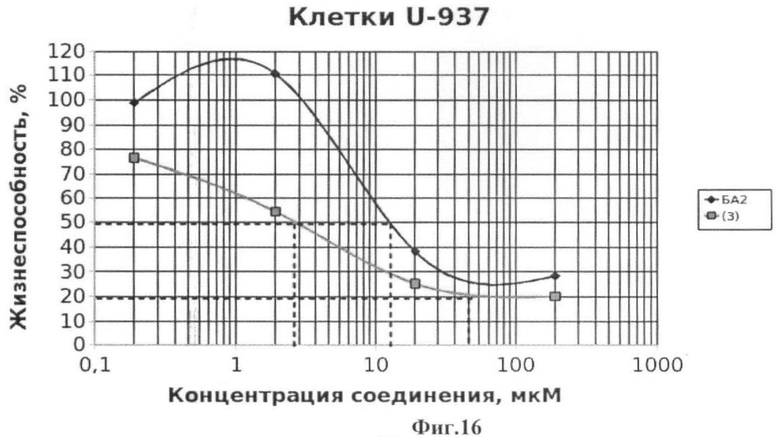
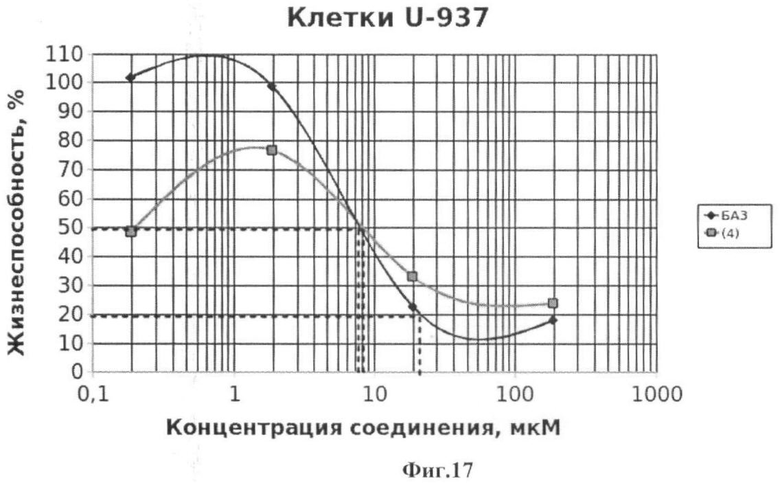
Подсчет значений CCID проводили как описано в примере 5. Значения CCID50 - концентрация соединения, при которой наблюдается гибель 50% клеток, а также CCID80 и CCID90 (концентрации, при которых наблюдается гибель 80 и 90% клеток, соответственно) приведены на Фиг.15-22.
Фиг.15 - жизнеспособность клеток линии U-937 после инкубации с соединением (2) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (2). В качестве препарата сравнения использовано аналогичное производное БК (БА1).
Фиг.16 - жизнеспособность клеток линии U-937 после инкубации с соединением (3) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (3). В качестве препарата сравнения использовано аналогичное производное БК (БА2).
Фиг.17 - жизнеспособность клеток линии U-937 после инкубации с соединением (4) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (4). В качестве препарата сравнения использовано аналогичное производное БК (БА3).
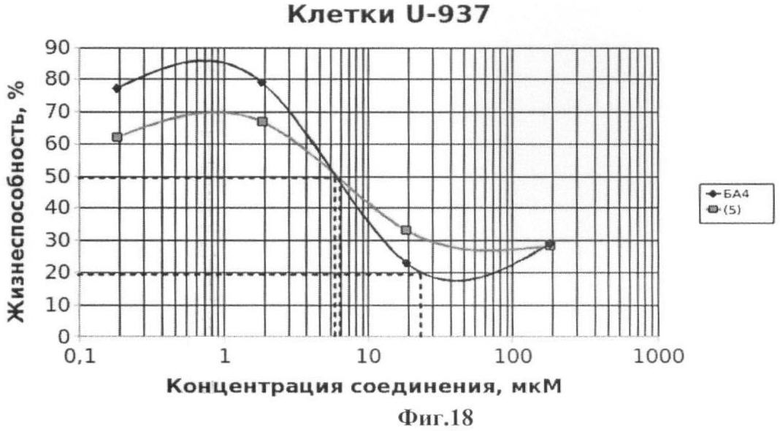
Фиг.18 - жизнеспособность клеток линии U-937 после инкубации с соединением (5) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (5). В качестве препарата сравнения использовано аналогичное производное БК (БА4).
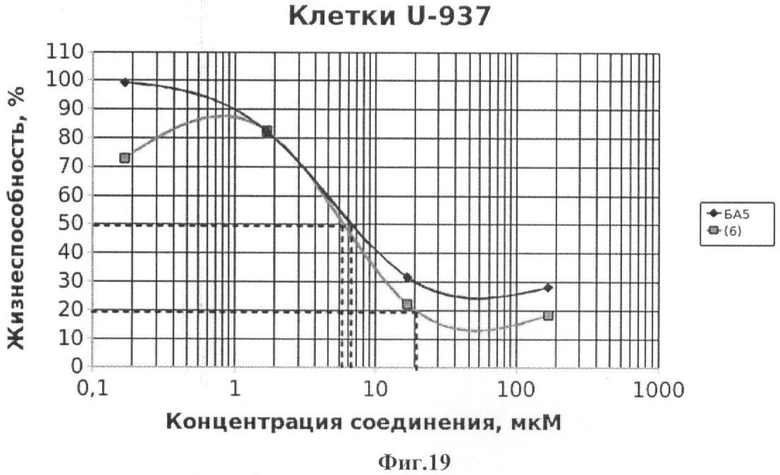
Фиг.19 - жизнеспособность клеток линии U-937 после инкубации с соединением (6) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (6). В качестве препарата сравнения использовано аналогичное производное БК (БА5).
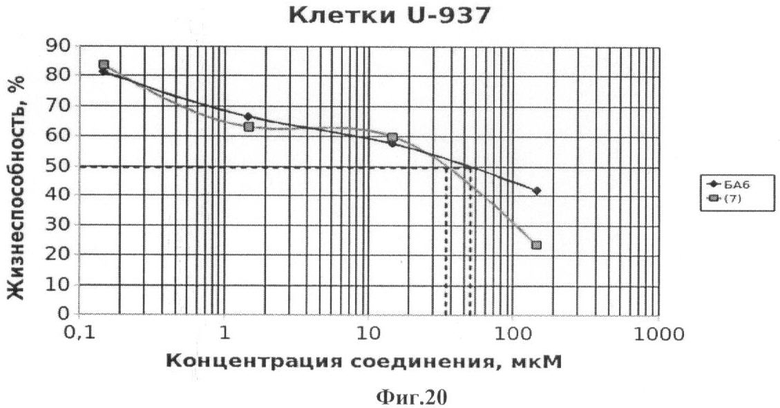
Фиг.20 - жизнеспособность клеток линии U-937 после инкубации с соединением (7) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (7). В качестве препарата сравнения использовано аналогичное производное БК (БА6).
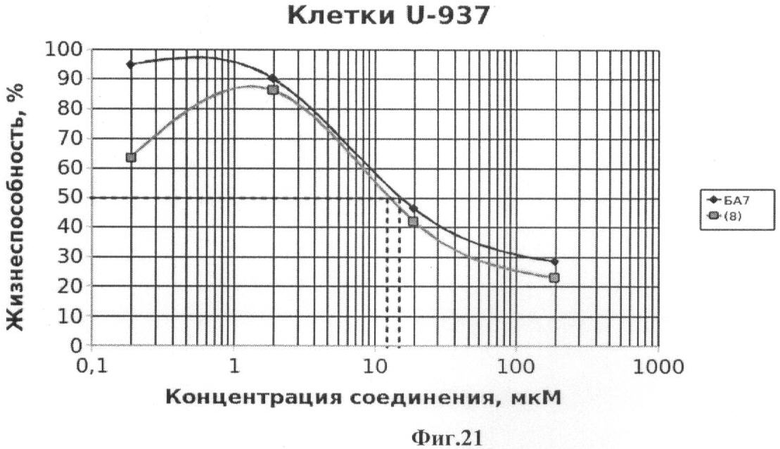
Фиг.21 - жизнеспособность клеток линии U-937 после инкубации с соединением (8) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (8). В качестве препарата сравнения использовано аналогичное производное БК (БА7).
Таким образом, соединения (1-8) обладают более выраженным противоопухолевым эффектом в отношении исследованных опухолевых клеток U-937 по сравнению с бетулоновой кислотой и ее аналогичными производными (БА1-БА8), для которой ранее было показано наличие выраженной противоопухолевой активности.
Пример 9. Влияние гидрированной бетулоновой кислоты (1) и ее амидов (2-8) на жизнеспособность опухолевых линий клеток человека
Значения CCID - концентрация соединений (1-8), при которой наблюдается гибель карциномных клеток, - приведены в таблице 1. CCID50 - концентрация соединения, при которой наблюдается гибель 50% клеток, а также CCID80 и CCID90 (концентрации, при которых наблюдается гибель 80 и 90% клеток, соответственно). Таким образом, соединения (1-8) обладают таким же или более выраженным противоопухолевым эффектом в отношении исследованных опухолевых клеток МТ-4, СЕМ-13 и U-937 по сравнению с бетулоновой кислотой и ее аналогичными производными (БА1-БА8), для которой ранее было показано наличие выраженной противоопухолевой активности.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-ЭТИЛПИПЕРАЗИЛАМИД БЕТУЛОНОВОЙ КИСЛОТЫ КАК ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО ТРИТЕРПЕНОВОЙ ПРИРОДЫ | 2010 |
|
RU2445317C1 |
| 4-ИЗОПРОПИЛ-7-МЕТОКСИ-2А-МЕТИЛ-2,2А,2А,3,5А,9B-ГЕКСАГИДРОФЛУОРЕНО[9,1-BC]ФУРАН-8-ОЛ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2535926C1 |
| ПРОИЗВОДНЫЕ УСНИНОВОЙ КИСЛОТЫ КАК ПРОТИВООПУХОЛЕВЫЕ АГЕНТЫ | 2013 |
|
RU2536873C1 |
| Лекарственное средство, обладающее противовоспалительной активностью | 2016 |
|
RU2617123C1 |
| N-[3-ОКСОЛУП-20(29)-ЕН-28-ОИЛ]-2,2,6,6-ТЕТРАМЕТИЛПИПЕРИДИН-4-ИЛАМИН, ОБЛАДАЮЩИЙ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА | 2017 |
|
RU2641900C1 |
| N'-{N-[3-ОКСО-ЛУПАН-28-ОИЛ]-9-АМИНОНОНАНОИЛ}-3-АМИНО-3-ФЕНИЛ-ПРОПИОНОВАЯ КИСЛОТА И ЕЕ СОЛИ КАК ПРОТИВОВИРУСНЫЕ И ИММУНОСТИМУЛИРУЮЩИЕ АГЕНТЫ | 2006 |
|
RU2317996C1 |
| N,N'-(АЛКАНДИИЛ)БИС[ЛАБДА-7(9),13,14-ТРИЕН-4-КАРБОКСАМИДЫ], ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2654201C1 |
| 16-(1,2,4-ОКСАДИАЗОЛ-3-ИЛ)-15,16-ЭПОКСИЛАБДАНОИДЫ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2011 |
|
RU2473550C1 |
| 6-ГИДРОКСИНАФТОХИНОНЫ ЛАБДАНОВОГО ТИПА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2012 |
|
RU2479582C1 |
| N'-{N-[3-ОКСО-20(29)-ЛУПЕН-28-ОИЛ]-9-АМИНОНОНАНОИЛ}-3-АМИНО-3-ФЕНИЛПРОПИО НОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ ИММУНОСТИМУЛИРУЮЩЕЙ И ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2002 |
|
RU2211843C1 |
Изобретение относится к новому ряду химических соединений, а именно к гидрированной бетулоновой кислоте формулы (1) и ее амидам формулы (2-8):
NR1R2=
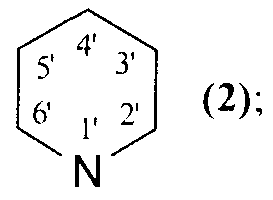
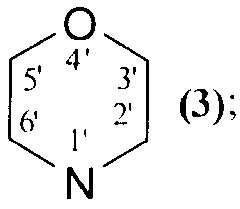
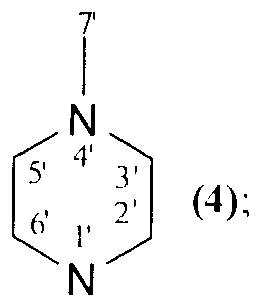
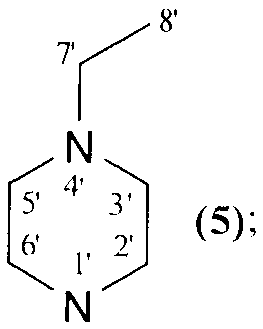
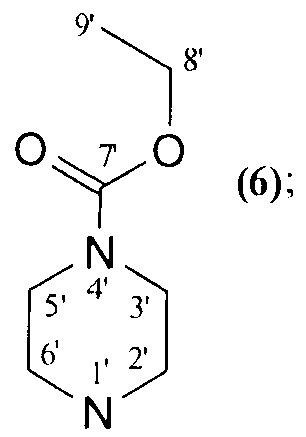
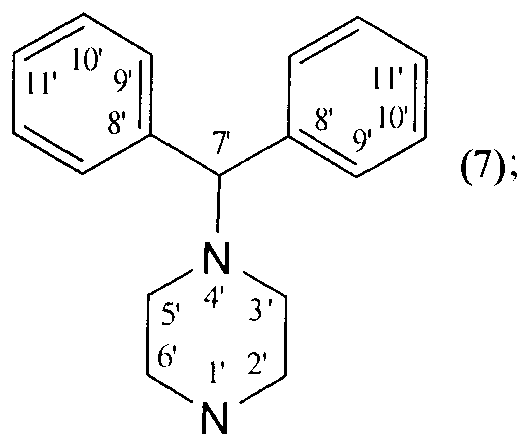
которые могут быть использованы в медицине в качестве лекарственных средств, обладающих противоопухолевым действием. 8 пр., 2 табл., 23 ил.
Гидрированная бетулоновая кислота формулы (1) и ее амиды формулы (2-8)


NR1R2=







обладающие противоопухолевой активностью.
| N'-{N-[3-ОКСО-20(29)-ЛУПЕН-28-ОИЛ]-9-АМИНОНОНАНОИЛ}-3-АМИНО-3-ФЕНИЛПРОПИО НОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ ИММУНОСТИМУЛИРУЮЩЕЙ И ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2002 |
|
RU2211843C1 |
| RU 2007121729 A, 14.11.2005 | |||
| КОРРЕКТОР ПАРАНЕОПЛАСТИЧЕСКИХ ПОВРЕЖДЕНИЙ И ТОКСИЧЕСКИХ ЭФФЕКТОВ ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2008 |
|
RU2385324C1 |
| US 5679828 A, 21.10.1997 | |||
| СОРОКИНА И.В | |||
| и др | |||
| // Докл | |||
| АН, 2004, 399, с.274. | |||
Авторы
Даты
2012-04-20—Публикация
2010-12-20—Подача