Изобретение относится к новому химическому соединению, а именно к N-этилпиперазиламиду бетулоновой кислоты формулы (I):
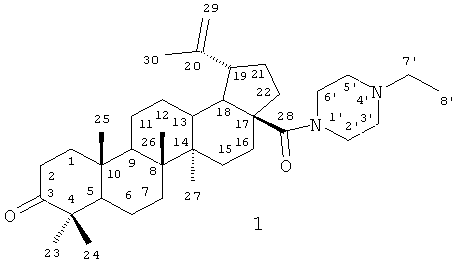
которое может быть использовано в медицине в качестве лекарственного средства, обладающего противоопухолевым действием.
Современные схемы лечения различного типа злокачественных опухолей используют хирургические методы в комплексе с высокодозной агрессивной терапией, серьезным недостатком которой является высокая токсичность современных противоопухолевых препаратов в отношении жизненно важных органов и систем организма. Сопутствующие побочные эффекты снижают эффективность, а в ряде случаев, ограничивают применение противоопухолевых средств. Другой проблемой в лечении онкологических заболеваний является проблема остаточного опухолевого клона. Опухолевые клетки, пережившие химиотерапию, обычно проявляют лекарственную устойчивость к широкому кругу препаратов и вызывают рецидив заболевания в более тяжелой форме. В связи с этим актуальной задачей является поиск новых противоопухолевых препаратов, обеспечивающих высокую избирательность и эффективность лечения.
Важным направлением медицинской химии, позволяющим получать новые, эффективные противоопухолевые препараты, является использование синтетических трансформаций растительных метаболитов. Наиболее приемлемым считается исследование растительных метаболитов, о биологической активности которых имеются достоверные сведения и которые являются доступными в настоящее время или станут доступными в ближайшем будущем по мере формирования сырьевой базы. К данному классу соединений относятся тритерпеновые кислоты, широкий спектр биологической активности которых (противовоспалительная, противовирусная, противоопухолевая, иммуностимулирующая и т.д.) приковывает к ним пристальный интерес исследователей.
Задачей изобретения является создание нового эффективного, низкотоксичного лекарственного средства, обладающего противоопухолевым действием и получаемого из доступного растительного сырья.
Поставленная задача решается новым соединением тритерпеновой природы, а именно, N-этилпиперазиламид бетулоновой кислоты формулы (1), которое может использоваться в качестве противоопухолевого средства.
Из литератрурных источников известно, что производные тритерпенов, в частности, лупанового ряда перспективны как противовирусные и противоопухолевые препараты [Толстикова Т.Г., Сорокина И.В., Толстиков Г.А., Толстиков А.Г., Флехтер О.Б. // Биорган. химия, 2006, 32, 291-307] [1]. На примере бетулиновой кислоты показана связь структуры и противоопухолевой активности в отношении широкого спектра раковых клеток (IC 50 10 -6 -10 -9 М) [Mukherjee R., Kumar V., Srivastava S.K., Agarwal S.K., Burman A.C. // Anti-cancer agents in Medicinal Chemistry, 2006, V.6, P.271-279] [2]. Показано, что производные бетулоновой кислоты, содержащие фрагменты со-аминокислот, являются активными индукторами апоптоза в лейкозных клетках и клетках гепатокарциномы in vitro [Шинтяпина А.Б., Шульц Э.Э., Петренко Н.И., Узенкова Н.В., Толстиков Г.А., Пронкина Н.В., Кожевников B.C., Покровский А.Г. // Биорган. химия, 2007, 33, 624] [3]. Важной чертой амидов бетулоновой кислоты является то, что амид, например, содержащий фрагмент β-аланина, проявляет антиоксидантную активность и обладает способностью снижать органотоксическое действие противоопухолевых препаратов [Сорокина И.В., Толстикова ТТ., Жукова Н.А., Петренко Н.И., Шульц Э.Э., Толстиков Г.А. // Докл. АН, 2004, 399, С.274] [4]. Обстоятельством, повышающим привлекательность тритерпенов, является их широкое распространение в природе и, во многих случаях, относительная простота технологии получения из многотоннажного растительного сырья.
Одним из соединений тритерпеновой природы с ярко выраженными физиологическими свойствами, является бетулоновая кислота формулы (2), которая легко получается окислением бетулина формулы (3) - широкодоступным сырьем, выделяемым из внешней коры березы семейства Betula [Krasutsky P.A // Nat. prod. rep., 2006, 23, Р.919-942] [5].
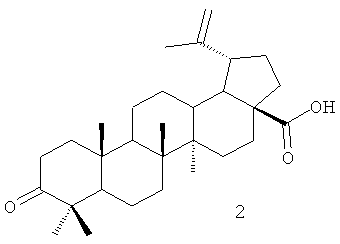
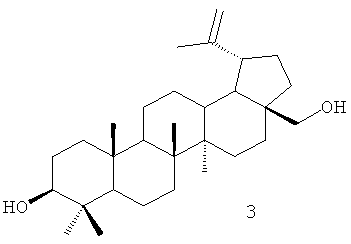
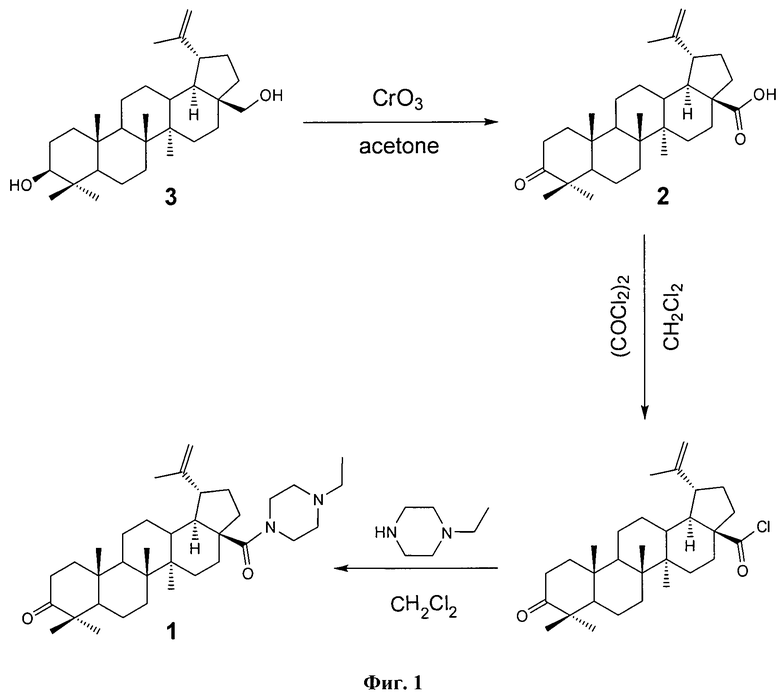
Для достижения поставленной цели мы провели ряд химических модификаций, представленных на схеме - Фиг.1. В качестве исходного соединения был взят бетулин (3), полученный экстракцией коры березы бензолом. Бетулин (3) окисляли раствором Физера. Следующим этапом являлось получение хлорангидрида бетулоновой кислоты (2), который далее использовался без выделения. Взаимодействие хлорангидрида бетулоновой кислоты (2) с N-этилпиперазином легко приводит к целевому соединению формулы (1) с противоопухолевой активностью.
Элементный состав полученных веществ определяли из масс-спектров высокого разрешения, записанных на приборе DFS (Double Focusing Sector) фирмы Thermo Electron Corporation.
Спектры ЯМР 1Н и 13С регистрировали на спектрометрах AV-400 (рабочие частоты 400.13 MHz для 1Н и 100.61 MHz для 13С) и DRX-500 (500.13 MHz и 125.76 MHz соответственно) фирмы Bruker для растворов веществ в CDCl 3. В качестве внутреннего стандарта использовали сигналы растворителя (δ H 7.24 и 8 с 76.9 м.д). Строение полученных соединений устанавливали на основании анализа спектров ЯМР 1Н с привлечением спектров двойного резонанса 1Н-1Н, а также анализа спектров ЯМР 13С с использованием стандартных методик записи спектров в режиме J-модуляции (JMOD), с внерезонансным и селективным подавлением протонов, двумерных спектров гетероядерной 13 C- 1 H корреляции на прямых константах спин-спинового взаимодействия (С-Н COSY, 1 j c,h 135 Гц) и двумерных и одномерных спектров гетероядерной 13 C- 1 H корреляции на дальних константах спин-спинового взаимодействия (COLOC, LRJMD, 2,3 j c,h 10 Гц).
Было исследовано влияние заявляемого N-этилпиперазиламида бетулоновой кислоты формулы (1) на жизнеспособность различных опухолевых клеток человека.
В результате было показано, что заявляемое соединение (1) проявляет высокую противоопухолевую активность по отношению ко всем использованным опухолевым клеточным культурам, а именно СЕМ-13, U-937, МТ-4. Показано, что значения CCID 50 для соединения (1) имеют сходный порядок величины для всех опухолевых клеток и лежат в диапазоне 5.8-10.5 µM. Полученные данные по противоопухолевой активности соединения (1) позволяют рассматривать его как перспективный лекарственный агент. Изобретение иллюстрируется следующими примерами.
Пример 1. Получение луп-20(29)-ен-3β,28-диола (бетулина, 3). Измельченную кору березы (344 г) кипятили в бензоле (1.6 л) с обратным холодильником 8 ч, далее горячий раствор декантировали. В оставшуюся кору добавляли еще 1 л бензола, кипятили 1 ч, горячий раствор снова декантировали. Выпавший из бензола осадок отфильтровывали, высушивали и получали 52 г бетулина-сырца. После перекристаллизации в изопропаноле получали 38 г бетулина с т.пл. 260-262°С (лит. т.пл. 258-260°C [Hayek // Phytochem. 1989, 28, Р.22.] [6]). Выход бетулина на исходную кору составил 11%.
Пример 2. Получение 3-оксо-луп-20(29)-ен-28-овой кислоты (бетулоновой кислоты, 5).
Суспензию 10 г (22.6 ммоля) бетулина (3) в 165 мл ледяной уксусной кислоте и 110 мл ацетона охлаждали при 0°С и в течение 1 ч при перемешивании прибавляли свежеприготовленный раствор Физера (11 г (0.11 моля) хромового ангидрида в 12 мл ледяной уксусной кислоты и 15 мл Н2О). Выдерживали при комнатной температуре 3 ч. По окончании реакции добавляли 50 мл метанола, прибавляли 300 мл бензола и 300 мл 10% раствора NaCl. Бензольный слой отделяли, а водный экстрагировали 2×150 мл бензола. Объединенные экстракты промывали 3×200 мл 10% раствором NaCl, сушат MgSO 4, осушитель отфильтровывали, бензол отгоняли приблизительно до 100 мл и выливали в 200 мл 5% раствора КОН. Осадок калиевой соли бетулоновой кислоты отфильтровывали и высушивали. Сухую соль растворяли в 50 мл этанола, не растворившуюся часть отфильтровывали, фильтрат выливали в 250 мл 5% раствор HCl. Выделившуюся кислоту (2) отфильтровывали, промывали H 2 O, высушивали. В итоге получали 7.2 г (69% от теории) бетулоновой кислоты (2). Точка плавления и спектры ЯМР соответствуют литературным [Barthel A., Stark S., Csuk R. // Tetrahedron, 2008, 64, Р.9225-9229] [6].
Пример 3. Получение N-[3-оксо-луп-20(29)-сио-28-ил]-4'-этилпиперазина (N-этилпиперазиламида бетулоновой кислоты, 1).
К раствору бетулоновой кислоты (2) (1 г, 2.2 ммоль) в 50 мл CH 2 Cl 2 прибавляли оксалилхлорид (0.5 мл, 5.7 ммоль) и две капли ДМФА, раствор выдерживали при перемешивании 4 ч при комнатной температуре. Растворитель упаривали, добавляли 20 мл CH 2 Cl 2 и снова упаривали, в конце прибавляли 20 мл CH 2 Cl 2. Полученный раствор хлорангидрида бетулоновой кислоты (2) по каплям прибавляли к раствору N-этилпиперазина (0.55 г, 4.8 ммоль) в 30 мл CH 2 Cl 2 . Реакционную массу оставляли при комнатной температуре на 18 ч, разбавляли CH 2 Cl 2 до 100 мл, промывали 3×20 мл H 2 O, сушили MgSO 4 , осушитель отфильтровывали, растворитель отгоняли. К остатку прибавляли небольшое количество метанола и оставляли до выпадения осадка. Осадок отфильтровывали и перекристаллизовывали из метанола. Масса полученного продукта (1) 0.88 г (выход 73% на кислоту). Т.пл. 232-234°С Найдено, m/z: 550.4488 [М] + . C 36 H 58 N 2 O 2. Вычислено М 550.4493. Спектр ЯМР 1Н соединения (1), δ, м.д. (J, Гц): 0.87 с (С25Н3 ), 0.91 с (С27Н3 ), 0.92 с (С26Н3 ), 0.96 с (С24Н3 ), 1.00 с (С23Н3 ), 1.13 т (С8'Н3 , J 8',7' 7.2), 1.62 уш. с (С30Н3 ). 0.90 м (H 12a ), 1.12 д.м (H 15e , J 15e,15a 13.3), 1.26 д.д (Н5а , J 5a,6а 11.5, J 5a,6e 2.3 Гц), 1.47 М (H 16a ), 1.50 д.д (H 18a , J 18a,13a 11.2, J 18a,19 11.2 Гц), 1.68 д.м (H 12e , J 12e,12a 12.5), 1.76-1.88 м (2Н, Н21α, Н1 ), 1.93 д.д (Н22α , J 22α,22β 10.2, J 22α,21 7.6 Гц), 2.06 д.д.д (H 16e , J 16e,16a 13.3, J 16e,15a , 3.7, J 16e,15a 3.0 Гц), 2.34 м (5Н, Н2, 2Н3', 2Н5' ), 2.36 к (2Н, Н7' , J 7',8' 7.2), 2.43 д.д.д (H 2a , J 2a,2e 15.7, J 2a,1a 9.6, J 2a,1e 7.2 Гц), 2.87 д.д.д (H 13a , J 13a,12a 12.8, J 13a,18a 11.2, J 13a,12e 3.4), 2.93 д.д.д (Н19 , J 19,18a 11.2, J 19,21α 11.2, J 19,21β 3.4), 3.56 уш.с (4Н, 2Н2', 2Н6' ), 4.52 м и 4.66 м (2Н, 2Н29). Сигналы остальных протонов наблюдаются в области 1.23-1.47 м.д. (11Н). Спектр ЯМР 13С соединения (1), δ, м.д.: 39.49 т (С1 ), 33.96 т (С2 ), 217.91 с (С3 ), 47.13 с (С4 ), 54.90 д (С5 ), 19.47 т (С6 ), 33.57 т (С7 ), 40.43 с (С8 ), 50.05 д (С9 ), 36.76 с (С10 ), 21.50 т (С11 ), 25.50 т (С12 ), 36.77 д (С15 ), 41.75 с (С14 ), 29.58 т (С15 ), 32.26 т (С16 ), 54.32 с (С17 ), 52.44 д (С18 ), 45.44 д (С19 ), 151.12 с (С20 ), 31.14 т (С21 ), 35.73 т (С22 ), 26.43 к (С23 ), 20.83 к (С24 ), 15.81 к (С25 ), 15.73 к (С26 ), 14.41 к (С27 ), 173.16 с (С28 ), 108.9 т (С29 ), 19.50 к (С30 ), 52.87 т (С3',5' ), 52.08 т (С7' ), 11.74 к (С8'). Сигналы (С2',6' ) сильно уширены и наблюдаются в области 45 м.д.
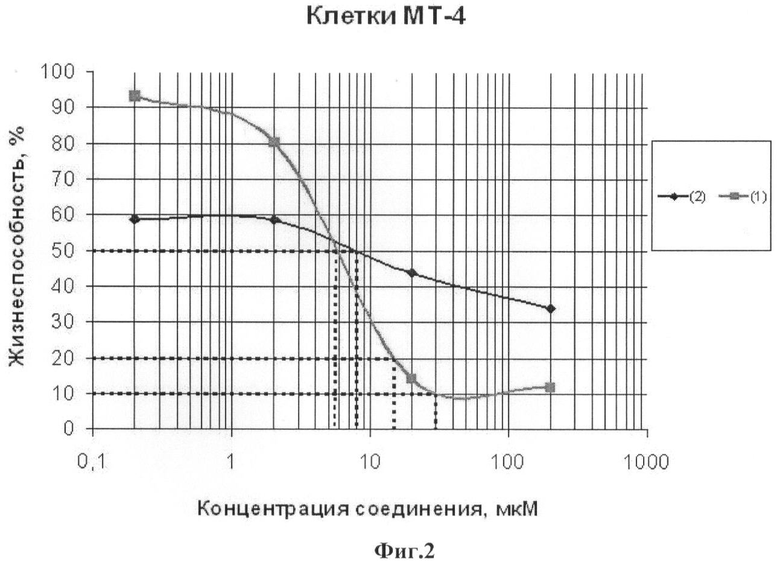
Пример 4. Влияние N-этилпиперазиламида бетулоновой кислоты (1) на жизнеспособность опухолевых клеток Т-клеточного лейкоза человека МТ-4
Клетки линии МТ-4 (клетки Т-клеточного лейкоза человека) культивировали в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина), в атмосфере 5%-ного СО2 при 37°С.
Жизнеспособность клеток после инкубации с соединением (1) определяли с помощью МТТ теста, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки высаживали в 96-луночные планшеты (100 мкл клеток с концентрацией 500 тыс клеток/мл. Затем к клеткам добавляли раствор соединения (1) в ДМСО до конечной концентрации в среде от 0.1 до 100 мкг/мл. В качестве препарата сравнения использовали бетулоновую кислоту (2). Клетки инкубировали в присутствии соединения (1) еще в течение 3-х суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана и измеряли оптическую плотность на многоканальном спектрофотометре на длинах волн 570 и 630 нм, где А570 - поглощение формазана, а А630 - фон клеток.
Данные представляли в виде количества живых клеток относительно контроля. За 100% принимали количество клеток в контроле, где клетки инкубировали в отсутствие соединения, но в присутствии растворителя ДМСО.
На Фиг.2. приведены данные по жизнеспособности клеток линии МТ-4 после инкубации с соединением (1) в течение 72 ч. Количество живых клеток оценивали с помощью МТТ теста. За 100% принимали количество живых клеток, инкубированных в присутствии ДМСО, но без соединения (1). В качестве препарата сравнения использована бетулоновая кислота (2)
Из данных, приведенных на фиг.1, видно, что обработка лейкозных клеток МТ-4 соединением (1) вызывает их эффективную гибель уже при концентрации соединения 10 -6 М. Значения CCID 50 - концентрация соединения (1), при которой наблюдается гибель 50% клеток, а также CCID 80 и CCID 90 (концентрации, при которых наблюдается гибель 80 и 90% клеток соответственно) приведены в таблице 1. Из данных, приведенных в таблице 1, видно, что соединение (1) обладает большим противоопухолевым эффектом по сравнению с описанным ранее соединением (2). Обработка клеток линии МТ-4 соединением (1) вызывает 50% гибель при концентрации соединения 5.8 мкМ, а 80% гибель при концентрации 14,5 мкМ, в отличие от соединения сравнения (2), для которого при обработке клеток в используемых концентрациях не достигается 80% гибели клеток, а 50% гибель клеток наблюдается при более высокой концентрации 8.2 мкМ.
Пример 5. Влияние N-этилпиперазиламида бетулоновой кислоты (1) на жизнеспособность опухолевых клеток Т-клеточного лейкоза человека СЕМ-13
Клетки линии СЕМ-13 (линия клеток Т-клеточного лейкоза человека), культивировали в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина), в атмосфере 5%-ного CO 2 при 37°С.
Жизнеспособность клеток после инкубации с соединением (1) определяли с помощью МТТ теста, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки высаживали в 96-луночные планшеты (100 мкл клеток с концентрацией 500 тыс клеток/мл. Затем к клеткам добавляли раствор соединения (1) в ДМСО до конечной концентрации в среде от 0.1 до 100 мкг/мл. В качестве препарата сравнения использовали бетулоновую кислоту (2). Клетки инкубировали в присутствии соединения (1) еще в течение 3-х суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана и измеряли оптическую плотность на многоканальном спектрофотометре на длинах волн 570 и 630 нм, где А570 - поглощение формазана, а А630 - фон клеток.
Подсчет значений CCID проводили как описано в примере 4. Значения CCID 50 - концентрация соединения (1), при которой наблюдается гибель 50% клеток, а также CCID 80 и CCID 90 (концентрации, при которых наблюдается гибель 80 и 90% клеток соответственно) приведены в таблице 2. Обработка клеток линии СЕМ-13 соединением (1) вызывает 50% гибель при концентрации соединения 10.5 мкМ, а 80% гибель при концентрации 42,7 мкМ, в отличие от соединения сравнения (2), для которого 50% гибель клеток наблюдается при сравнимой концентрации 11.6 мкМ, но 80% гибель клеток не достигаеится даже в максимальной использованной концентрации 200 мкМ.
Пример 6. Влияние N-этилпиперазиламида бетулоновой кислоты (1) на жизнеспособность опухолевых клеток человека U-937.
Клетки линии U-937 (опухолевая линия моноцитов человека) культивировали в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина), в атмосфере 5%-ного СО2 при 37°С.
Жизнеспособность клеток после инкубации с соединением (1) определяли с помощью МТТ теста, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки высаживали в 96-луночные планшеты (100 мкл клеток с концентрацией 400 тыс клеток/мл. Затем к клеткам добавляли раствор соединения (1) в ДМСО до конечной концентрации в среде от 0.1 до 100 мкг/мл. В качестве препарата сравнения использовали бетулоновую кислоту (2). Клетки инкубировали в присутствии соединения (1) еще в течение 3-х суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана и измеряли оптическую плотность на многоканальном спектрофотометре на длинах волн 570 и 630 нм, где А570 - поглощение формазана, а А630 - фон клеток.
Подсчет значений CCID проводили как описано в примере 4. Значения CCID 50 - концентрация соединения (1), при которой наблюдается гибель 50% клеток, а также CCID 80 и CCID 90 (концентрации, при которых наблюдается гибель 80 и 90% клеток соответственно) приведены в таблице 2. Значения CCID 50 - концентрация соединения (1), при которой наблюдается гибель 50% клеток, а также CCID 80 и CCID 90 (концентрации, при которых наблюдается гибель 80 и 90% клеток соответственно) приведены в таблице 3. Обработка клеток линии U-937 соединением (1) вызывает 50% гибель при концентрации соединения 6 мкМ, а 80% гибель при концентрации 30.9 мкМ, в отличие от соединения сравнения (2), для которого 50% гибель клеток наблюдается при сравнимой концентрации 18.4 мкМ, но 80% гибель клеток не достигается даже в максимальной использованной концентрации 200 мкМ. Таким образом, соединение (1) обладает более выраженным противоопухолевым эффектом в отношении исследованных опухолевых клеток (МТ-4, СЕМ-13, U-937) по сравнению с бетулоновой кислотой, для которой ранее было показано наличие выраженной противоопухолевой активности.
Источники информации
1. Толстикова Т.Г., Сорокина И.В., Толстиков Г.А., Толстиков А.Г., Флехтер О.Б. // Биорган. химия, 2006, 32, 291-307].
2. Mukherjee R., Kumar V., Srivastava S.K., Agarwal S.K., Burman A.C. // Anti-cancer agents in Medicinal Chemistry, 2006, V.6, P.271-279.
3. Шинтяпина А.Б., Шульц Э.Э., Петренко Н.И., Узенкова Н.В., Толстиков Г.А., Пронкина Н.В., Кожевников B.C., Покровский А.Г. // Биорган. химия, 2007, 33, 624.
4. Сорокина И.В., Толстикова Т.Г., Жукова Н.А., Петренко Н.И., Шульц Э.Э., Толстиков Г.А. // Докл. АН, 2004, 399, С.274.
5. Krasutsky P.A // Nat. prod. rep., 2006, 23, Р.919-942.
6. Hayek // Phytochem. 1989, 28, Р.22.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРИРОВАННАЯ БЕТУЛОНОВАЯ КИСЛОТА И ЕЕ АМИДЫ КАК ПРОТИВООПУХОЛЕВЫЕ СРЕДСТВА ТРИТЕРПЕНОВОЙ ПРИРОДЫ | 2010 |
|
RU2448115C1 |
| ПРОИЗВОДНЫЕ УСНИНОВОЙ КИСЛОТЫ КАК ПРОТИВООПУХОЛЕВЫЕ АГЕНТЫ | 2013 |
|
RU2536873C1 |
| 4-ИЗОПРОПИЛ-7-МЕТОКСИ-2А-МЕТИЛ-2,2А,2А,3,5А,9B-ГЕКСАГИДРОФЛУОРЕНО[9,1-BC]ФУРАН-8-ОЛ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2535926C1 |
| 16-(1,2,4-ОКСАДИАЗОЛ-3-ИЛ)-15,16-ЭПОКСИЛАБДАНОИДЫ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2011 |
|
RU2473550C1 |
| N,N'-(АЛКАНДИИЛ)БИС[ЛАБДА-7(9),13,14-ТРИЕН-4-КАРБОКСАМИДЫ], ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2654201C1 |
| 6-ГИДРОКСИНАФТОХИНОНЫ ЛАБДАНОВОГО ТИПА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2012 |
|
RU2479582C1 |
| N'-{N-[3-ОКСО-20(29)-ЛУПЕН-28-ОИЛ]-9-АМИНОНОНАНОИЛ}-3-АМИНО-3-ФЕНИЛПРОПИО НОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ ИММУНОСТИМУЛИРУЮЩЕЙ И ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2002 |
|
RU2211843C1 |
| N-[3-ОКСОЛУП-20(29)-ЕН-28-ОИЛ]-2,2,6,6-ТЕТРАМЕТИЛПИПЕРИДИН-4-ИЛАМИН, ОБЛАДАЮЩИЙ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА | 2017 |
|
RU2641900C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО ТРИТЕРПЕНОВОЙ ПРИРОДЫ | 2008 |
|
RU2393165C2 |
| N'-{N-[3-ОКСО-ЛУПАН-28-ОИЛ]-9-АМИНОНОНАНОИЛ}-3-АМИНО-3-ФЕНИЛ-ПРОПИОНОВАЯ КИСЛОТА И ЕЕ СОЛИ КАК ПРОТИВОВИРУСНЫЕ И ИММУНОСТИМУЛИРУЮЩИЕ АГЕНТЫ | 2006 |
|
RU2317996C1 |
Изобретение относится к новому химическому соединению, а именно к N-этилпиперазиламиду бетулоновой кислоты формулы (I):
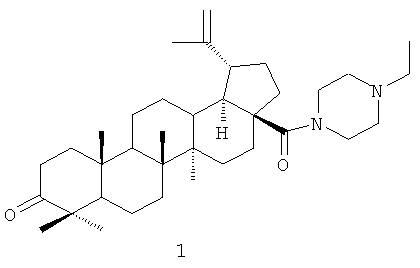
которое может быть использовано в медицине в качестве лекарственного средства, обладающего противоопухолевым действием. 6 пр., 3 табл., 2 ил.
N-Этилпиперазиламид бетулоновой кислоты формулы (1)
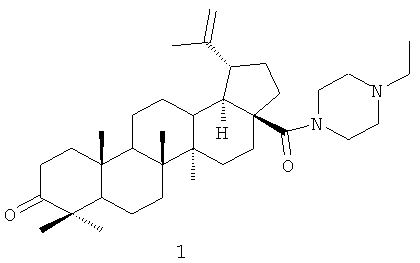
обладающий противоопухолевой активностью.
| КОРРЕКТОР ПАРАНЕОПЛАСТИЧЕСКИХ ПОВРЕЖДЕНИЙ И ТОКСИЧЕСКИХ ЭФФЕКТОВ ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2008 |
|
RU2385324C1 |
| N'-{N-[3-ОКСО-20(29)-ЛУПЕН-28-ОИЛ]-9-АМИНОНОНАНОИЛ}-3-АМИНО-3-ФЕНИЛПРОПИО НОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ ИММУНОСТИМУЛИРУЮЩЕЙ И ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2002 |
|
RU2211843C1 |
| КОРРЕКТОР ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2007 |
|
RU2353623C1 |
| СОРОКИНА И.В | |||
| и др | |||
| Докл | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2012-03-20—Публикация
2010-10-28—Подача