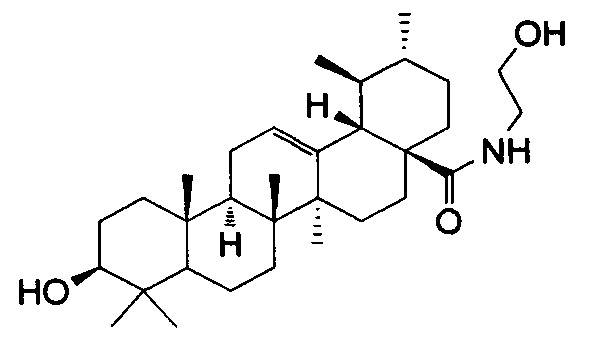
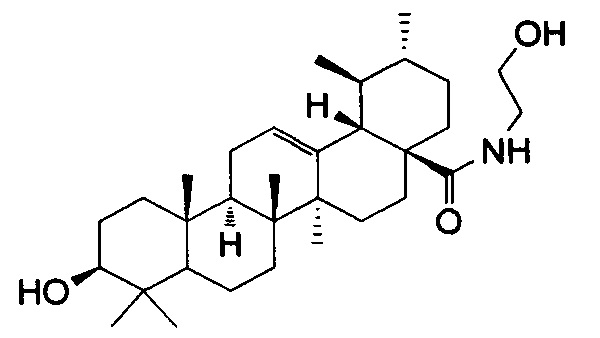
Изобретение относится к медицине и касается производного урсоловой кислоты (N-(2-гидроксиэтил)-3β-гидроксиурс-12-ен-28-амид), обладающего противоопухолевой и противовоспалительной активностью, которое может быть использовано в качестве лекарственного средства.
Современные схемы лечения различного типа злокачественных опухолей используют хирургические методы в комплексе в высокодозной агрессивной терапией, серьезным недостатком которой является высокая токсичность современных противоопухолевых препаратов в отношении жизненноважных органов и систем организма. Сопутствующие побочные эффекты снижают эффективность, а в ряде случаев ограничивают применение противоопухолевых средств. При опухолевых заболеваниях также часто наблюдаются сопутствующие воспалительные реакции. В связи с этим актуальным является поиск новых противоопухолевых препаратов, обеспечивающих противоопухолевую и противоспалительную активность.
Важным направлением медицинской химии, позволяющим получать новые, эффективные противоопухолевые препараты, является использование синтетических трансформаций растительных метаболитов. Наиболее приемлемым считается исследование растительных метаболитов, о биологической активности которых имеются достоверные сведения и которые являются доступными в настоящее время или станут доступными в ближайшем будущем по мере формирования сырьевой базы. К данному классу соединений относится урсоловая кислота - вещество входит в ряд пентациклических тритерпеновых кислот. Урсоловая кислота обнаружена не менее чем в сотне растений, причем встречается как в виде гликозидов, так и свободного агликона [Szakiel A, Mroczek A. Distribution of triterpene acids and their derivatives in organs of cowberry (Vaccinium vitis-idaea L.) plant, Acta Biochim Pol., 2007 v. 54, №4. С. 733-740]1. Известны ее антимикробные, гепатопротекторные, антивоспалительные, антиаллергические, антивирусные, цитотоксические, противоопухолевые свойства [Sultana N. Clinically useful anticancer, antitumor, and antiwrinkle agent, ursolic acid and related derivatives as medicinally important natural product, Journal of Enzyme Inhibition and Medicinal Chemistry. 2011, T. 26, №5. C. 616-642]. Противоопухолевая активность урсоловой кислоты описана в литературе, показана ее цитотоксическая активность в отношении широкого ряда опухолевых клеточных культур.
Одно из первых сообщений о противоопухолевой активности урсоловой кислоты относится к 1996 году [Es-Saady D, Simon A, Jayat-Vignoles С, Chulia AJ, Delage С. MCF-7 cell cycle arrested at Gl through ursolic acid, and increased reduction of tetrazolium salts. Anticancer Res. 1996; 16(1):481-486]. В работе было показано, что урсоловая кислота обладает цитотоксической активностью в отношении опухолевых клеток рака молочной железы MCF-7 в концентрации около 20 мкМ. Показана противоопухолевая активность урсоловой кислоты против клеток рака мочевого пузыря [eng, Q.Y.; Li, P.P.; Jin, F.S.; Yao, С.; Zhang, G.H.; Zang, Т.; Ai, X. Ursolic acid induces ER stress response to activate ASK1-JNK signaling and induce apoptosis in human bladder cancer T24 cells. Cell Signal. 2013. 25, 206-213.], рака шейки матки [Mallavadhani, U.V.; Mahapatra, A.; Pattnaik, В.; Vanga, N.; Suri, N.; Saxena, A.K. Synthesis and anti-cancer activity of some novel C-17 analogs of ursolic and oleanolic acids. Med. Chem. Res. 2013, 22, 1263-1269], глиомы [Wang, J.; Li, Y.; Wang, X.; Jiang, C. Ursolic acid inhibits proliferation and induces apoptosis in human glioblastoma cell lines U251 by suppressing TGF -1/miR-21/PDCD4 pathway. Basic Clin. Pharmacol. Toxicol. 2012, 111, 106-112] и других опухолей.
Описаны также противовоспалительные свойства урсоловой кислоты [Hwang YJ, Song J, Kim HR, Hwang KA. Oleanolic acid regulates NF-кВ signaling by suppressing MafK expression in RAW 264.7 cells. BMB Rep. 2014; 47(9):524-9]. Предполагается, что противовоспалительная активность соединения связана с ингибированием транскрипционного фактора NF-κB.
Недостатками природной урсоловой кислоты является относительно низкая эффективность по сравнению с существующими противовоспалительными препаратами, такими как дексаметазон.
Задачей изобретения является создание нового эффективного лекарственного средства, обладающего противоопухолевым и противовоспалительным действием и получаемого из доступного растительного сырья.
Поставленная задача решается полученным соединением, которое является полусинтетическим производным урсоловой кислоты, содержащим гидроксиэтиламидный фрагмент, проявляющим цитотоксическую активность в отношении опухолевых клеток линий СЕМ-13, U-937, МТ-4 и обладающим противовоспалительным действием.
Для достижения поставленной цели провели химическую модификацию урсоловой кислоты, представленную на схеме 1.
В качестве исходного соединения была взята урсоловая кислота, полученная по методике [Малыхин Е.В., Попов С.А., Шеремет О.П., Козлова Л.П., Обут С.М. Способ получения урсоловой кислоты (RU 2329048)].
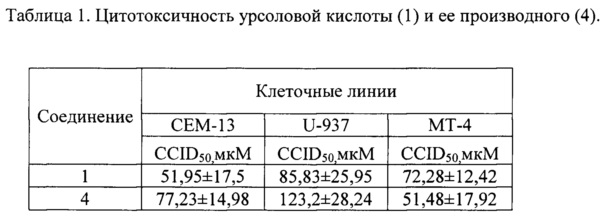
Следующим этапом было получение целевого соединения (4) с противоопухолевой и противоспалительной активностью реакцией хлорангидрида ацетата урсоловой кислоты 2 с моноэтаноламином с последующим гидролизом. Было исследовано влияние N-(2-Гидроксиэтил)-3β-гидроксиурс-12-ен-28-амида(4) на жизнеспособность опухолевых клеток человека. Значения CCID50 урсоловой кислоты (1) и ее производного (4) для различных карциномных линий клеток человека приведены в таблице 1. В качестве препарата сравнения использовали урсоловую кислоту (1). В результате было показано, что урсоловая кислота (1) и заявляемое соединение (4) проявляют умеренную цитотоксическую активность по отношению к опухолевым клеточным культурам СЕМ, U-937 и МТ-4. Показано, что значение CCID50 для соединения (4) для клеток МТ-4 несколько ниже, чем для урсоловой кислоты, и составляет 8,98 мкМ. Была также исследована противовоспалительная активность полученного соединения (4) по ингибированию уровня продукции NO в макрофагах, стимулированных липополисахаридом. Показано, что в этом тесте противовоспалительная активность соединения (4) сравнима с активностью препарата сравнения - дексаметазона (ДМ) и примерно в 3 раза превосходит противовоспалительную активность урсоловой кислоты (рис. 1). Нами также были получены данные о влиянии соединения (4) кислоты на уровень экспрессии генов фактора некроза альфа (ФНОα), интерлейкина-1 (ИЛ-1) и интерлейкина =10 (ИЛ-10) (Рис. 2). Экспрессия м-РНК провоспалительного цитокина ФНОα в ЛПС-стимулированных макрофагах, культивированных с производным урсоловой кислоты (4), уменьшена в 2,5 раза по сравнению с макрофагами, культивированными только с ЛПС. Экспрессия провоспалительного цитокина IL-1 в ЛПС-стимулированных макрофагах, культивированных с соединением (4), уменьшена в 10 раз по сравнению с макрофагами, культивированными только с ЛПС. Однако уровень экспрессии противовоспалительного цитокина ИЛ-10 тоже уменьшен в ЛПС-стимулированных макрофагах, культивированных с соединением (4), в 3,5 раза по сравнению с макрофагами, культивированными только с ЛПС. Таким образом, механизм противовоспалительного действия производного урсоловой кислоты (4) связан с значительным ингибированием экспрессии продукции провоспалительных цитокинов ФНОα, ИЛ-1.
Полученные данные по противоопухолевой и противовоспалительной активности соединения (4) позволяют рассматривать его как перспективный лекарственный противовоспалительный агент, обладающий цитотоксической активностью в отношении опухолевых клеток.
Изобретение поясняется следующими примерами.
Пример 1. Синтез N-(2-гидроксиэтил)-3β-гидроксиурс-12-ен-28-амида
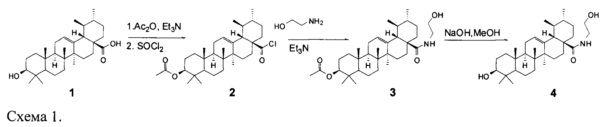
Синтез N-(2-гидроксиэтил)-3β-гидроксиурс-12-ен-28-амида-3β-ацетокси-урсолоил хлорид (2)
Раствор урсоловой кислоты (1) 4.57 г (10 ммоль) кипятили в смеси CHCl3 (50 мл), уксусного ангидрида 5.0 г (50 ммоль) и пиридина 3.2 г (40 ммоль) в течение 5 ч. Смесь концентрировали в вакууме водоструйного насоса, к остатку добавили воду (20 мл) и смесь кипятили с обратным холодильником в течение 3 ч. Смесь охлаждали до комнатной температуры, фильтровали, промывали водой (3×50 мл) и сушили на воздухе, получали ацетат урсоловой кислоты 4.7 г (94%) в виде белого порошка, т.пл. 295-297°C (EtOH).
Ацетат урсоловой кислоты 4.0 г (8,0 ммоль) в 12 г хлористого тионила (100 ммоль) кипятили в течение 2 ч. Избыток хлористого тионила отгоняли в вакууме водоструйного насоса и получали хлорангидрид ацетата урсоловой кислоты (2) в виде желтой кристаллической массы 4.05 (98%).
Синтез N-(2-гидроксиэтил)-3β-ацетокси-урс-12-ен-28-амид (3)
К смеси моноэтаноламина (1.05 г, 17 ммоль) и 1.0 г (10 ммоль) триэтиламина в CH2Cl2 (10 мл) добавлен хлорангидрид ацетата урсоловой кислоты 1 г (1.9 ммоль). Смесь перемешивали при комнатной температуре в течение 5 ч, промывали 0.1 N HCl (2×20 мл), водой (2×50 мл), сушили (Na2SO4), концентрировали в вакууме и перколировали на короткой колонке (SiO2, CH2Cl2) с получением амида 3 0.9 г (87%).
Синтез N-(2-гидроксиэтил)-3β-гидрокси-урс-12-ен-28-амид (4)
К раствору ацетата амида (4) 0.9 г, (1.7 ммоль) в этаноле (20 мл) добавлен КОН (0.4 г, 7.2 ммоль). Смесь кипятили в течение 1 ч, охлаждали до комнатной температуры и концентрировали в вакууме. Остаток промывали 1 N водной HCl (30 мл) и водой (3×20 мл) и сушили на воздухе, в результате получали целевое соединение 1 (0.76 г, 84%) в виде белого порошка т.пл. 224-226°C (EtOH).
Результаты ЯМР анализа
ЯМР 1Н (400.13 МГц, ДМСО-d6, δ, м.д., J/Гц): 0.67 (3H, с, Н-26§), 0.69 (3H, с, Н-25§), 0.82 (3H, д, J29,19=6.3, Н-29), 0.85 (3H, с, Н-24§), 0.89 (3H, с, Н-23§), 0.91 (3H, д, JA,B=2.4, Н-30), 1.03 (3H, с, Н-27), 2.11 (1Н,уш.д, J18,19=10.7, Н-18), 2.98 (2Н, м, H-1'b), 3.12 (1H, м, H-1'a), 3.33 (2Н, м, Н-2'), 4.30 (1Н, д, JOH,2'=5.1, -СН2ОН), 4.61 (1Н, дд, J3,2акс=J3,2экв=5.3, Н-3), 5.20 (1H, дд, J12,11акс=J12,11экв=3.3, Н-12), 7.04 (1Н, дд, JNH,1'a=JNH,1'a=5.4, NH). ЯМР 13С (100.61 МГц, ДМСО-d6, δ, м.д.): 15.5 (к, С-25), 16.4 (к, С-24§), 17.1 (к, С-26§), 17.5 (к, С-29§), 18.3 (т, С-6), 21.5 (к, С-30), 23.2 (т, С-11#), 23.6 (к, С-27), 23.9 (т, С-2#), 27.3 (т, С-16), 27.7 (т, С-15), 28.6 (к, С-23), 30.8 (т, С-21), 33.0 (т, С-7), 36.8 (с, С-10), 37.4 (т, С-22), 38.6 (т, С-1), 38.7 (с, С-4), 38.8 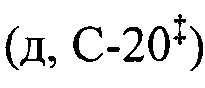 , 39.1
, 39.1 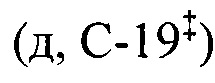 , 39.4 (с, С-8), 41.9
, 39.4 (с, С-8), 41.9 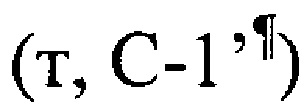 , 41.9
, 41.9  , 46.9 (с, С-17), 47.4 (д, С-9), 52.4 (д, С-18), 55.21 (д, С-5), 60.1 (т, С-2'), 77.2 (д, С-3), 125.0 (д, С-12), 138.7 (с, С-13), 176.7 (с, С-28).
, 46.9 (с, С-17), 47.4 (д, С-9), 52.4 (д, С-18), 55.21 (д, С-5), 60.1 (т, С-2'), 77.2 (д, С-3), 125.0 (д, С-12), 138.7 (с, С-13), 176.7 (с, С-28).
Пример 2. Исследование цитотоксической активности N-(2-гидроксиэтил)-3β-гидроксиурс-12-ен-28-амида
В работе использовали линии опухолевых клеток человека МТ-4, CEN-13 (клетки Т-клеточных лейкозов человека) и U-937 (клетки моноцитов человека). Клетки культивировали в среде RPMI-1640, содержащей 10% сыворотки крови эмбрионов крупного рогатого скота, 2 ммоль/л L-глутамина, 80 мкг/мл гентамицина и 30 мг/мл линкомицина, при температуре 37°C в CO2 инкубаторе. Исследуемые вещества растворяли в ДМСО и добавляли к клеточной культуре в необходимых концентрациях. Использовали по 3 лунки на каждую концентрацию. Для эксперимента использовали клетки на 3 сутки культивирования после оценки морфологии, подсчета концентрации и жизнеспособности клеток. Клетки CEM-13, U-937 или МТ-4 помещали в лунки 96-луночного планшета («Cel-Cult», Англия) по 100 мкл в лунку, в посевной концентрации 0.5×106 клеток в мл. Исследуемые вещества добавляли к клеткам, получая конечные концентрации 0.01-1000 мкМ, используя по 3 лунки на каждую концентрацию. Клетки, инкубируемые в тех же условиях без добавления препаратов, являлись контрольными. Клетки культивировали 72 часа. Водный раствор МТТ (5 мг/мл) профильтровывали через 0.22 мкм фильтр («Flow laboratories», Англия), добавляли в каждую исследуемую культуру в соотношении 1:10 к ее объему, смесь инкубировали 3-4 часа при температуре 37°C в CO2 инкубаторе. По окончании инкубации супернатант осторожно удаляли, затем в каждую анализируемую лунку добавляли по 100 мкл ДМСО. Осадок ресуспендировали и 30 мин инкубировали в темноте при комнатной температуре до полного растворения кристаллов формазана.
Оптическую плотность (OD) образцов измеряли на мультилуночном спектрофотометре BioRad 680 (США) при длине волны равной 490 нм. Процент ингибирования роста клеток определяли по формуле 100 - (среднее значение OD в опыте/среднее значение OD в контроле) ×100. Полученное значение для контрольного триплета (первые три лунки без добавления соединений, параллельных для каждого исследуемого экспериментального агента) принималось за 100%. Рассчитывали среднее значение и ошибку среднего для каждой концентрации анализируемого соединения. По результатам строили диаграмму зависимости жизнеспособности клеток (%) от концентрации исследуемого цитотоксического вещества, определяли дозу, на 50% ингибирующую жизнеспособность клеток (CCID50), а также стандартную ошибку (SE) показателя ЦД50.
Соединение (4) ингибирует рост опухолевых клеток человека CEN-13, U-937 и МТ-4 в концентрациях 77,23, 123,2 и 51,48 мкМ соответственно. Цитотоксическая активность этого соединения проявляется для клеток CEN-13, U-937 в более высоких дозах по сравнению с цитотоксичностью урсоловой кислотой (1) - 51,95 мкМ и 85,83 мкМ, а для опухолевых клеток МТ-4 в более низких концентрациях - 51,48 мкМ против 72,28 мкМ.
Таким образом, для исследуемых линий опухолевых клеток соединение (4) сравнимо по своей цитотоксической активности с урсоловой кислотой (1).
Пример 3. Оценка противовоспалительной активности производного урсоловой кислоты (4) на ЛПС-стимулированных макрофагах.
Противовоспалительную активность соединения (4) оценивали на ЛПС-стимулированной культуре перевиваемых макрофагах мыши (линия ANA-1). Клетки культивировали в на ростовой питательной среде DMEM, содержащей 10% сыворотки крови эмбрионов крупного рогатого скота, 2 ммоль/л L-глютамина, 80 мкг/мл гентамицина, при температуре 37°C во влажной атмосфере, содержащей 5% CO2 (в CO2-инкубаторе). Посевная концентрация составляла 0,5×106 клеток/мл. Навеску соединений (1) и (4) растворяли в диметилсульфоксиде (ДМСО) до концентрации 10 мг/мл. В качестве положительного контроля использовали известный противовоспалительный препарат дексаметазон (ДМ). Перевиваемые макрофаги мыши были стимулированы 10 мкг/мл ЛПС Е. coli («Sigma», США), через час добавляли последовательные разведения соединений 1 мкМ, 10 мкМ и 100 мкМ. Затем клетки культивировали в течение 48 ч. По окончании инкубационную среду собирали, замораживали при -20°C и хранили несколько суток. Продукцию оксида азота, как маркера воспалительного ответа макрофагов, оценивали по аккумуляции нитритов в культуральной среде колориметрическим методом с помощью реактива Грисса, который готовили как смесь равных объемов 1% сульфаниламида («Sigma») в 30% уксусной кислоте и 0,1% N-[нафтил]-этилендиаминдигидрохлорида («Sigma») в 60% уксусной кислоте. Аликвоты культуральных супернатантов в количестве по 50 мкл смешивали с равным количеством реагента в 96-луночных плоскодонных микропланшетах, инкубировали в темноте при комнатной температуре 10 мин и далее с помощью микропланшетного фотометра TEC AN Sunrise при длине волны 570 нм измеряли светопоглощение. Контролем служила такая же культуральная среда, инкубированная в отсутствие клеток. Концентрацию нитритов подсчитывали, используя в качестве стандартной калибровочной кривой последовательные разведения 1 мМ раствора нитрита натрия в культуральной среде. Определения проводились в трипликатах в трех независимых экспериментах.
На Рис. 1 показан уровень продукции NO с ЛПС-стимулированными макрофагами ANA-1, инкубированными с дексаметазоном (ДМ), урсоловой кислотой (1) и N-(2-гидроксиэтил)-3β-гидроксиурс-12-ен-28-амидом (4). По результатам видно, что при концентрации соединения (4) в 10 мкМ концентрация оксида азота снижалась до 19% от ЛПС контроля, а в концентрации 100 мкМ – до 7 %. При этом для урсоловой кислоты (1) соответствующий уровень ингибирования составил 47% и 24%. Таким образом, противовоспалительная активность соединения (4) более чем в 2 раза выше, чем у препарата сравнения - урсоловой кислоты.
Пример 4. Оценка эффекта N-(2-Гидроксиэтил)-3β-гидроксиурс-12-ен-28-амида на уровень экспрессии м-РНК про- и противовоспалительных цитокинов
Противовоспалительную активность соединения SP-2 оценивали на ЛПС-стимулированной культуре перевиваемых макрофагах мыши (линия ANA-1). Оценивали влияние соединения (4) на уровень экспрессии про- и противовоспалительных цитокинов. Клетки культивировали на ростовой питательной среде DMEM, содержащей 10% сыворотки крови эмбрионов крупного рогатого скота, 2 ммоль/л L-глютамина, 80 мкг/мл гентамицина, при температуре 37°C во влажной атмосфере, содержащей 5% CO2 (в CO2-инкубаторе). Посевная концентрация составляла 0,5×106 клеток/мл. Навеску соединения (4) растворяли в диметилсульфоксиде (ДМСО) до концентрации 10 мг/мл. Перевиваемые макрофаги мыши были стимулированы 10 мкг/мл ЛПС Е. coli («Sigma», США), через час добавляли последовательные разведения тестируемых соединений до конечных концентраций 1 мкМ, 10 мкМ и 100 мкМ. Через 6 часов после ЛПС стимуляции выделяли суммарную мРНК. Выделение суммарной мРНК из клеток осуществляли с помощью набора RNeasyMiniKit («Qiagen») согласно рекомендаций производителя. Качество выделенной мРНК оценивали по наличию бэндов рибосомальной РНК при электрофорезе в 1% агарозном геле. Для определения количества выделенной суммарной РНК измеряли концентрацию РНК в растворе на спектрофотометре Implen в объеме раствора 1 мкл. Синтезировали кДНК из 2 мкг суммарной РНК с использованием набора для обратной транскрипции M-MuLVRH («БиолабМикс», Россия) в соответствии с протоколом производителя. В качестве затравки в реакции обратной транскрипции применяли гексануклеотидные случайные праймеры. Полимеразная цепная реакция в режиме реального времени проводилась на приборе CFX 96™ Real-Time PCR DetectionSystems («Bio-Rad») с использованием интеркалирующего флуоресцентного красителя SYBR Green из набора qPCRMix SYBR (2×) («БиолабМикс», Россия) согласно рекомендациям производителя. В качестве эндогенного внутреннего контроля выбран ген домашнего хозяйства GAPDH.
Реакцию амплификации для всех генов проводили в следующих условиях: предварительная денатурация при 95°C - 5 мин, далее 45 циклов при 95°C - 15 с, далее при 60°C - 20 с, далее при 72°C - 30 с, далее при 80°C - 20 с. По окончании осуществлялась детекция уровня флюоресценции.
На Рис. 2 показано изменение относительного уровня экспрессии м-РНК генов ИЛ-10, ФНОα, ИЛ-1 под действием N-(2-гидроксиэтил)-3β-гидроксиурс-12-ен-28-амида (4). По данным ОТ-ПЦР экспрессия цитокинов ФНОα, ИЛ-1 и ИЛ-10 уменьшалась в 2,2, 7,2 и 1,6 раз соответственно по сравнению с макрофагами, культивированными только с ЛПС.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-[3-ОКСОЛУП-20(29)-ЕН-28-ОИЛ]-2,2,6,6-ТЕТРАМЕТИЛПИПЕРИДИН-4-ИЛАМИН, ОБЛАДАЮЩИЙ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА | 2017 |
|
RU2641900C1 |
| N,N'-(АЛКАНДИИЛ)БИС[ЛАБДА-7(9),13,14-ТРИЕН-4-КАРБОКСАМИДЫ], ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2654201C1 |
| N-ЭТИЛПИПЕРАЗИЛАМИД БЕТУЛОНОВОЙ КИСЛОТЫ КАК ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО ТРИТЕРПЕНОВОЙ ПРИРОДЫ | 2010 |
|
RU2445317C1 |
| Фосфониевые соли на основе гликозидов бетулиновой кислоты, обладающие противоопухолевой активностью | 2022 |
|
RU2803739C1 |
| (17S)-N-БЕНЗИЛ-5-((3β-АЦЕТОКСИ-28-НОР-УРС-12-ЕН)-17-ИЛ)-1,3,4-ОКСАДИАЗОЛ-2-АМИН, ОБЛАДАЮЩИЙ СЕЛЕКТИВНОЙ ЦИТОТОКСИЧНОСТЬЮ В ОТНОШЕНИИ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ MCF-7 | 2019 |
|
RU2708400C1 |
| ГИДРИРОВАННАЯ БЕТУЛОНОВАЯ КИСЛОТА И ЕЕ АМИДЫ КАК ПРОТИВООПУХОЛЕВЫЕ СРЕДСТВА ТРИТЕРПЕНОВОЙ ПРИРОДЫ | 2010 |
|
RU2448115C1 |
| ПРОИЗВОДНЫЕ УСНИНОВОЙ КИСЛОТЫ КАК ПРОТИВООПУХОЛЕВЫЕ АГЕНТЫ | 2013 |
|
RU2536873C1 |
| ((3β-АЦЕТОКСИ-УРС-12-ЕН-28-ОИЛ-ОКСИАЦЕТОКСИ)МЕТИЛ)-1H-1,2,3-ТРИАЗОЛ-1-ИЛ) МЕТИЛ)-4-МЕТИЛ-1,2,5-ОКСАДИАЗОЛ-2-ОКСИД, ОБЛАДАЮЩИЙ СЕЛЕКТИВНОЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ MCF-7 | 2020 |
|
RU2739559C1 |
| Гибридные производные урсоловой кислоты и галловой кислоты, содержащие 1,2,3-триазольные линкеры, обладающие антиоксидантной и противовоспалительной активностью | 2022 |
|
RU2802957C1 |
| 6-ГИДРОКСИНАФТОХИНОНЫ ЛАБДАНОВОГО ТИПА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2012 |
|
RU2479582C1 |
Изобретение относится к лекарственному средству, обладающему противовоспалительной активностью, содержащему в качестве активного ингредиента N-(2-гидроксиэтил)-3β-гидроксиурс-12-ен-28-амид формулы
 .
.
Технический результат: получено новое эффективное лекарственное средство, обладающее противовоспалительной активностью. 2 ил., 1 табл., 4 пр.
Лекарственное средство, обладающее противовоспалительной активностью, содержащее в качестве активного ингредиента N-(2-гидроксиэтил)-3β-гидроксиурс-12-ен-28-амид формулы
| Liu Dan et al | |||
| "Synthesis and Anti-tumor Activity of Novel Amide Derivatives of Ursolic Acid" Chemical Research in Chinese Universities, vol | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Jung-Wei Shao et al | |||
| "In vitro and in vivo anticancer activity evaluation of ursolic acid derivatives" European Journal of Medicinal Chemistry, vol | |||
| Способ изготовления звездочек для французской бороны-катка | 1922 |
|
SU46A1 |
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| CN 1887899 A, 03.01.2007 | |||
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИОКСИДАНТНЫМИ, ГЕПАТОПРОТЕКТОРНЫМИ И ПРОТИВОВОСПАЛИТЕЛЬНЫМИ СВОЙСТВАМИ | 2010 |
|
RU2436793C1 |
Авторы
Даты
2017-04-21—Публикация
2016-03-14—Подача