Изобретение относится к области медицины, конкретно к фармацевтической композиции, обладающей противовоспалительной, бронхолитической и противотуберкулезной активностью, представляющей собой N-(5-Этил-1,3,4-тиадиазол-2-ил)-4-нитробензамид.
Указанные свойства позволяют предполагать возможность применения предлагаемой фармацевтической композиции на основе нового соединения для профилактики и лечения воспалительных, бронхолегочных (бронхиты, пневмонии, бронхиальная астма) заболеваний, туберкулеза.
Известным противовоспалительным средством, широко применяемым в медицинской практике для лечения бронхолегочных заболеваний, является кортикостероид будесонид. Однако этот популярный препарат, как и все кортикостероидные лекарственные средства, обладает существенными нежелательными побочными реакциями (М.Д.Машковский, Лекарственные средства, М., ООО "Новая волна", 2004, т.II, стр.26, 33; РЛС, Энциклопедия лекарств, 2007, стр.162-163).
Популярными средствами лечения туберкулеза являются такие препараты, как изониазид, пиразинамид, этамбутол и др., которые обладают комплексом нежелательных побочных реакций (РЛС, Энциклопедия лекарств, 2007 г., стр.349, 697, 1051).
Целью изобретения является фармацевтическая композиция, обладающая противовоспалительной, бронхолитической и противотуберкулезной активностью, представляющей собой N-(5-Этил-1,3,4-тиадиазол-2-ил)-4-нитробензамид (1), а также возможность применения предлагаемой фармацевтической композиции на основе данного соединения для профилактики и лечения воспалительных, бронхолегочных (бронхиты, пневмонии, бронхиальная астма) заболеваний, туберкулеза.
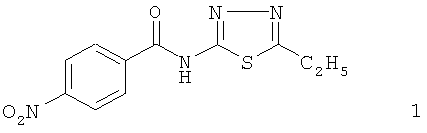
Данное соединение зарегистрировано в CAS Registry под №313662-95-2, однако никаких сведений о его биологической активности и способах получения не выявлено. Заявитель считает, что выявленная им фармакологическая активность делает соединение 1 перспективным для создания лекарственного средства, обладающего противовоспалительной, бронхолитической и противотуберкулезной активностью, поэтому были разработаны способы получения соединения 1 и фармацевтической композиции на его основе.
Соединение 1 получают реакцией ацилирования 2-амино-5-этил-1,3,4-тиадиазола 4-нитробензоилхлоридом в различных условиях: в апротонных растворителях при нагревании без акцепторов гидрохлорида, а также в присутствии акцепторов гидрохлорида.
Твердая дозированная фармацевтическая композиция в виде таблеток, капсул, порошков для приготовления суспензий, содержащая активное вещество - N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамид - и целевые добавки, получают как путем смешения и гомогенизации сухих порошков, так и путем предварительного гранулирования с последующим таблетированием, заполнением капсул и других контейнеров.
При этом соотношение активного вещества и целевых добавок составляет, мас.%:
В качестве целевых добавок фармацевтическая композиция содержит не обязательно одновременно крахмал, натрия кроскармеллозу, поливинилпирролидоны, сахара, производные целлюлозы, органические и неорганические соли цинка и кальция, кремния диоксид, соли бензойной кислоты, соли стеариновой кислоты, 2-(диметиламино)этанол, N-ацетил-L-глутаминовую кислоту, коррегирующие вещества, при следующем соотношении компонентов, мас.%:
Заявляемые соотношения компонентов найдены экспериментальным путем, являются оптимальными и позволяют получить технический результат, соответствующий поставленной задаче: новое вещество и твердую фармацевтическую композицию на его основе, выполненную в виде таблеток, капсул, порошков, суспензий и растворов, соответствующих требованиям Государственной Фармакопеи XI и XII изд., имеющих срок годности не менее 2-х лет и обеспечивающих высокий фармакотерапевтический эффект активного вещества.
Синтез нового вещества, состав и способы получения заявляемых фармацевтических композиций приведены в следующих примерах.
Пример 1. Получение N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида.
В трехгорлую колбу, снабженную мешалкой, термометром и холодильником, заливают 600 мл ацетонитрила, загружают 38,4 г 2-амино-5-этил-1,3,4-тиадиазола. Реакционную массу перемешивают, затем при температуре 20-25°С загружают 55,8 г 4-нитробензоилхлорида. Реакционную массу нагревают на водяной бане до температуры кипения и выдерживают в течение 1-2 часов, далее реакционную массу охлаждают до 20-25°С. Выпавший осадок отфильтровывают, на фильтре его промывают сначала ацетонитрилом, затем дистиллированной водой до рН в промывной воде 3,5-4,0. Получают 103,2 г влажного осадка, который загружают в колбу с мешалкой, заливают 750 мл дистиллированной воды, массу нагревают при перемешивании до 90-95°С и выдерживают в течение 1 часа. Осадок отфильтровывают и промывают дистиллированной водой до отсутствия Сl- ионов, сушат при 50-70°С до постоянного веса
Получают 78,46 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида с выходом 94,29%, считая на исходный 2-амино-5-этил-1,3,4-тиадиазол, т.пл. 283-285°С.
Найдено %: С 47,48; Н 3,57; N 20,31; S 11,49
С11Н10N4O3S, М.м 278,31
Вычислено %: С 47,43; Н 3,59; N 20,22; S 11,51
ИК-спектр, ν см-1: 3400 (NH), 1790 (-N=C), 1605 (-C=С ар.),
1520 (СО NН амид)
УФ-спектр: 0,001% раствор в 0,1 М растворе натрия гидроксида имеет максимум поглощения при 262±2 нм.
Пример 2. Аналогично примеру 1 вместо ацетонитрила загружают 600 мл ацетона, перемешивают при 55-60°С 3-4 ч. Получают 72,93 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида с т.пл. 284-286°С.
ИК-спектр, ν см-1: 3400 (NH), 1790 (-N=C), 1605 (-С=С ар.), 1520 (CO NH амид)
УФ-спектр: 0,001% раствор в 0,1М растворе натрия гидроксида имеет максимум поглощения при 262±2 нм.
Пример 3. В трехгорлую колбу, снабженную мешалкой, термометром и обратным холодильником, загружают 25,6 г 2-амино-5-этил-1,3,4-тиадиазола, приливают 150 мл ацетона, смесь нагревают до 40°С. В стакане растворяют 18,6 г 4-нитробензоилхлорида в 40 мл ацетона, раствор постепенно добавляют к полученной массе в колбе. Реакционную массу выдерживают при перемешивании и температуре 56-57°С в течение 2 часов. Окончание реакции определяют методом ТСХ (на хроматограмме не должно быть пятна 4-нитробензоилхлорида).
Полученный осадок отделяют на фильтре, промывают горячим ацетоном и сушат при 50°С до постоянной массы. Получают 23,52 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида с выходом 84,6%, считая на исходный 2-амино-5-этил-1,3,4-тиадиазол, т.пл. 283-285°С.
ИК-спектр, ν см-1: 3400 (NH), 1790 (-N=C), 1605 (-С=С ар.), 1520 (СО NH амид)
УФ-спектр: 0,001% раствор в 0,1 М растворе натрия гидроксида имеет максимум поглощения при 262±2 нм.
Пример 4. Аналогично примеру 3 смешивают 100 мл ацетона, 25 мл пиридина и 6,4 г 2-амино-5-этил-1,3,4-тиадиазола. Реакционную массу охлаждают до 5-10°С, загружают 9,3 г 4-нитробензоилхлорида, массу нагревают до 56-57°С и выдерживают в течение 1 часа. Конец реакции оценивают хроматографически по отсутствию на хроматограмме пятна 2-амино-5-этил-1,3,4-тиадиазола. Массу охлаждают до 18-20°С, приливают 50 мл воды, перемешивают 5-10 мин, осадок отделяют, на фильтре промывают водой до отсутствия Cl-ионов, сушат до постоянной массы при 50-70°С.
Получают 9,2 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида с выходом 85,4%, считая на исходный 2-амино-5-этил-1,3,4-тиадиазол, т.пл. 283-285°С.
ИК-спектр, ν см-1: 3400 (NH), 1790 (-N=C), 1605 (-С=С ар.), 1520 (СО NН амид)
УФ-спектр: 0,001% раствор в 0,1 М растворе натрия гидроксида имеет максимум поглощения при 262±2 нм.
Пример 5. Аналогично примеру 4 получают из 6,4 г 2-амино-5-этил-1,3,4-тиадиазола, 9,3 г 4-нитробензоилхлорида в присутствии 30 мл триэтиламина и 100 мл ацетона 9,1 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида с выходом 85,13%, считая на исходный 2-амино-5-этил-1,3,4-тиадиазол, т.пл. 283-285°С.
ИК-спектр, ν см-1: 3400 (NH), 1790 (-N=C), 1605 (-C=С ар.),
1520 (СО NН амид)
УФ-спектр: 0,001% раствор в 0,1 М растворе натрия гидроксида имеет максимум поглощения при 262±2 нм.
Пример 6. В аппарат с мешалкой загружают 170,0 г 1,5% водного раствора гидроксипропилцеллюлозы, к раствору при перемешивании постепенно добавляют 266,0 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида, 16,0 г кальция дигидрофосфата. Смесь тщательно перемешивают до образования равномерно увлажненной массы, которую гранулируют до размера гранул 1,5-2,0 мм. Гранулы сушат при 50-60°С (гранулят №1). Высушенные гранулы измельчают на грануляторе до размера гранул 0,6-0,07 мм. Гранулы в смесителе смешивают с 3,0 г талька (гранулят №2). Полученный гранулят №2 заполняют в капсулы.
В одной капсуле содержится 250,0 мг N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида.
Капсулы соответствуют требованиям Госфармакопеи XI и XII изд.
Пример 7. Аналогично примеру 6 гранулят №1 получают исходя из 170,0 г 2,0% водного раствора гидроксипропилметилцеллюлозы, 266,0 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида, 15,0 г цинка сернокислого, 5,0 г маннита, 5,0 г натрия бензоата. Гранулят №2 получают, добавляя к грануляту №1 3,0 г магния стеарата и 3,0 г ароматизатора.
Массу таблетируют, получая в одной таблетке 250,0 мг N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида.
Таблетки соответствуют требованиям Госфармакопеи XI и XII изд.
Пример 8. Аналогично примеру 7 гранулят №1 получают, исходя из 150,0 г 10,0% водного раствора поливинилпирролидона, 266,0 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида, 5,0 г сорбита, 5,0 г N-ацетил-L-глутаминовой кислоты, 4,0 г 2-(диметиламино)этанола, 3,0 г целлюлозы микрокристаллической. Гранулят №2 получают, добавляя к грануляту №1 5,0 г натрия кроскармеллозы, 3,0 г кремния диоксида и 3,0 г ароматизатора.
Массу таблетируют, получая в одной таблетке 250,0 мг N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида.
Таблетки соответствуют требованиям Госфармакопеи XI и XII изд.
Пример 9. Аналогично примеру 8 гранулят №1 получают исходя из 160,0 г 5,0% водного раствора крахмала, 266,0 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида, 5,0 г цинка сернокислого, 15,0 г натрия бензоата, 5,0 г N-ацетил-L-глутаминовой кислоты, 4,0 г 2-(диметиламино)этанола, 5,0 г целлюлозы микрокристаллической. Гранулят №2 получают, добавляя к грануляту №1 3,0 г кремния диоксида, 1,0 г магния стеарата.
Массу таблетируют и покрывают пленочной оболочкой, используя раствор гидроксипропилметилцеллюлозы.
Получают таблетки, содержащие по 250,0 мг N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида.
Таблетки соответствуют требованиям Госфармакопеи XI и XII изд.
Пример 10. Аналогично примеру 7 гранулят №1 получают исходя из 160,0 г 5,0% водного раствора крахмала, 266,0 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида, 15,0 г цинка сернокислого, 10,0 г маннита, 10,0 г натрия бензоата. Гранулят №2 получают, добавляя к грануляту №1 5,0 г натрия кроскармеллозы, 3,0 г кремния диоксида и 3,0 г ароматизатора.
Полученный гранулированный порошок рассыпают в ламинированные пакеты.
В одной дозе порошка, используемого в виде суспензии, содержится 250,0 мг N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида.
Порошок соответствует требованиям Госфармакопеи XI и XII изд.
Пример 11. В смеситель-гомогенизатор загружают 100,0 г N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида, 10,0 г маннита, 100,0 г натрия бензоата, массу тщательно гомогенизируют. Полученный порошок рассыпают в многодозовые дозированные ингаляторы, однодозовые контейнеры или готовят суспензии и растворы для ингаляции через небулайзер.
Полученные порошки для ингаляции соответствуют требованиям Госфармакопеи XI и XII изд.
Показатели качества фармацевтических композиций приведены в таблице 1.
Биологические и фармакологические исследования
1. Изучение противовоспалительной и бронхолитической активностей N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида (далее ЛХТ-15-06)
В экспериментах были использованы морские свинки обоего пола массой 400-600 г, крысы-самцы Wistar массой 200-250 г, нелинейные белые мыши-самцы массой 20-25 г. Животные содержались в стандартных условиях вивария ОАО «ВНЦ БАВ» при 12-часовом режиме освещения, доступе к воде и корму - ad libitum.
Экспериментальные исследования проведены в соответствии с «Руководством по экспериментальному доклиническому изучению новых фармакологических веществ» (М., 2005).
В качестве референтных препаратов использовали кромогликат натрия и будесонид.
1.1. Бронхорасширяющее действие ЛХТ 15-06 на модели гистамин-индуцированного бронхоспазма in vivo у ненаркотизированной морской свинки с аэрозольным воздействием бронхоконстриктора.
У морских свинок индуцировали бронхоспазм аэрозольным введением гистамина (1000 мкг/кг) с помощью небулайзера ("Amron"). Через сутки превентивно (за 1 час до повторного введения гистамина) аэрозольным способом животным однократно вводили тестируемое вещество в виде 1%-ного водного раствора и ингаляционный кортикостероид будесонид в виде референтного препарата в терапевтической дозе 30 мкг/кг. Полученные данные представлены в таблице 2.
Контрольные морские свинки реагировали на аэрозольное воздействие гистамина выраженной бронхоспастической реакцией, проявляющейся в тихипноэ и падении животного на бок. Длительность острой фазы бронхоспазма составляла в среднем 190±10 секунд, а затем после возвращения животного в нормальное положение учащение дыхания сохранялось еще на протяжении 300±15 секунд. В группе морских свинок, получавших ингаляционно через небулайзер ЛХТ 15-06, острая фаза бронхоспастической реакции на гистамин либо практически не развивалась (у 90% животных), либо значительно сокращалась продолжительность острой и подострой фаз бронхоспастической реакции (на 43±4,0% и 58±8,8%, соответственно). При применении препарата сравнения будесонида регистрировалась гибель 40,0±10,0% животных от острого удушья, в 40,0±5,5% случаев препарат полностью предотвращал бронхоспазм, а в 20,0±2,0% сокращал продолжительность острой и подострой фаз (на 27,5±3,0% и 40,0±4,5%, соответственно). Таким образом, протективный эффект ЛХТ 15-06 соответствовал уровню активности референтного препарата будесонида. Кроме того, в данной группе, в отличие от всех остальных групп, не отмечалось гибели животных от острого удушья.
Аналогичный результат выявлен при ингаляционном введении ЛХТ 15-06 в концентрации в 10 раз меньшей (0,1%-ный р-р): ингаляция вещества в данной концентрации вызывала полную профилактику развития бронхоспазма в 33% случаев. У остальных 67% животных острая фаза не развивалась и отмечалось значительное сокращение продолжительности подострой фазы бронхоспастической реакции - на 60,9%, соответственно. Важно отметить, что в отличие от контрольной группы, в которой от бронхоспазма погибло 65% животных, в группе, получавшей ингаляции ЛХТ 15-06, гибель животных от острого бронхоспазма не была зарегистрирована (таблица 3).
Таким образом, ингаляционное применение ЛХТ 15-06 в обеих концентрациях (1%-ный и 0,1%-ный раствор) вызывало сопоставимые бронхопротективные эффекты и не уступало по эффективности референтному препарату будесонид, что свидетельствует о высокой специфической фармакологической активности ЛХТ 15-06.
1.2. Изучение бронхопротективного действия ЛХТ 15-06 на модели гистамин-индуцированного бронхоспазма по методу Konzett et Rossler (1940)
У наркотизированной морской свинки (этаминал натрий 70 мг/кг, интраперитонеально) выделяли трахею, вставляли ее в канюлю, которую подсоединяли с помощью системы полихлорвиниловых трубочек к датчику бронхоспазма и аппарату искусственного дыхания (Ugo Basile). В течение эксперимента поддерживали определенный режим дыхания. В качестве индуктора бронхоспазма вводили гистамин (10 мкг/кг). ЛХТ 15-06 и препарат сравнения вводили однократно интраперитонеально в дозе 10 мг/кг. С помощью самописца, присоединенного к датчику, регистрировали изменения сопротивления дыхательных путей воздушному потоку (величину бронхоконстрикторной реакции). Эффект изучаемого вещества оценивали по степени торможения бронхоконстрикторной реакции, выраженной в процентах по отношению к максимальной. Максимальный бронхоспазм вызывали полным пережатием трубочки, соединенной с трахеальной канюлей (принимали за 100%). Полученные результаты представлены в таблице 4.
Как видно из данных таблиц 4 и 5, гистамин вызывал развитие мощной бронхоконстрикторной реакции: амплитуда дыхания составляла 91,9% от максимальной. ЛХТ 15-06 значительно тормозил развитие гистамин-индуцированной бронхоспастической реакции (торможение составило 64,9%) у наркотизированных морских свинок. Препарат сравнения - кромогликат натрий - оказывал менее выраженный эффект, составивший 54,8%. Следовательно, не только при ингаляционном, но и интраперитонеальном введении ЛХТ 15-06 существенно редуцировал бронхоспазм у морских свинок, вызванный гистамином.
1.3. Изучение бронхопротективного действия ЛХТ 15-06 на модели антиген-индуцированного бронхоспазма у активно сенсибилизированных ненаркотизированных морских свинок
Бронхоспастическую реакцию у активно сенсибилизированных морских свинок вызывали разрешающей дозой овальбумина (ОА), который вводили в виде аэрозоля (0,5%-ного в 0,9%-ном растворе NaCl) с помощью небулайзера до появления признаков анафилактического бронхоспазма с регистрацией экспозиции, длительности острой и подострой фаз удушья. ЛХТ 15-06 вводили однократно путем небулизации в виде 0,1%-ного раствора в течение 3 минут. Была использована именно эта концентрация вещества, поскольку ранее было показано, что в данной концентрации на модели гистамин-вызванного бронхоспазма у неиммунных морских свинок препарат высоко активен именно в этой концентрации. Через 60 минут после запыления исследуемого вещества животным таким же способом вводили раствор овальбумина.
В контрольной группе после ингаляции разрешающей дозы антигена (овальбумина) у морских свинок развивалась сильная бронхоспастическая реакция, от которой погибло 50% животных.
При ингаляционном введении 1%-ного ЛХТ 15-06 достоверно сокращалась продолжительность острой и подострой фаз бронхоспазма, кроме того, в 50% случаев острая фаза отсутствовала, что говорит о высокой активности тестируемого вещества, способного в ряде случаев полностью предотвращать ОА-ндуцированный бронхоспазм. В условиях данной модели ЛХТ 15-06 несколько уступал по своей эффективности референтному препарату - будесониду (30 мкг/кг).
Таким образом, результаты изучения ЛХТ 15-06 на моделях бронхоспазма in vivo при ингаляционном и интраперитонеальном введении показали его высокую бронхопротективную активность, по степени выраженности которой он либо сопоставим с препаратом сравнения, либо превосходит его.
1.4. Изучение противовоспалительной активности ЛХТ 15-06 на модели сефадекс-индуцированного бронхоальвеолита у крыс
Для постановки эксперимента были сформированы следующие группы: 1) интактный контроль; 2) контроль, крысы, получавшие только сефадекс (модель); 3) крысы, получавшие ЛХТ 15-06 на фоне индукции бронхоальвеолита; 4) животные, получавшие будесонид в качестве референтного препарата. ЛХТ 15-06 в разовой дозе 10 мг/кг вводили интраперитонеально за 30 минут до введения сефадекса. Инсуффляцию сефадекса повторяли на следующие (вторые) сутки эксперимента. Тестируемые препараты вводили на протяжении 7 суток.
Курсовое внутрибрюшинное введение ЛХТ 15-06 в дозе 10 мг/кг вызывает выраженное противовоспалительное действие в отношении развития сефадекс-индуцированного бронхоальвеолита.
Данные цитологического исследования БАЛ представлены таблице 7.
Показатель цитологического исследования БАЛ представляется крайне важным, поскольку воспаление, индуцированное сефадексом, имеет прежде всего, нейтрофильный характер. А противовоспалительное действие нового препарата может играть важную роль в терапии ассоциированных с воспалением, в том числе и нейтрофильной его составляющей, бронхолегочных заболеваний (бронхиальной астмы, ХОБЛ).
1.5. Противовоспалительное действие ЛХТ 15-06 при ингаляционном введении на модели бронхоальвеолита у крыс
Животные были разделены на 5 групп: 1) контроль, интактные; 2) сефадекс (модель); 3) крысы, получавшие ЛХТ 15-06 на фоне индукции бронхоальвеолита; 4) животные, получавшие будесонид на фоне введения сефадекса. За один час до введения сефадекса животным ингаляционно через небулайзер ("Amron") вводили ЛХТ 15-06 в виде суспензии 5 мг/кг, будесонид в виде суспензии - 1 мг/кг. Сефадекс (5 мг/кг) вводили с помощью инсуффлятора под легким эфирным наркозом. Запыление сефадекса повторяли на следующие (вторые) сутки эксперимента. Изучаемые вещества ингалировали животным ежедневно на протяжении всего эксперимента (7 суток).
Данные по влиянию ЛХТ 15-06 на цитологические характеристики БАЛ приведены в таблице 8.
Полученные экспериментальные данные свидетельствуют, что ЛХТ 15-06 показал хорошую активность в условиях моделирования бронхоальвеолита у крыс, индуцированного инсуффляцией сефадекса. При его ингаляционном введении цитологические и гистологические характеристики практически отвечали параметрам нормы и эквивалентны таковым в группе интактного контроля. Лечение ЛХТ 15-06 способствовало более быстрому разрешению островоспалительного процесса в бронхах и паренхиме легкого, что подтвердилось данными цитологического исследования БАЛ.
Результаты экспериментального изучения фармакологической активности оригинального вещества N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида (ЛХТ 15-06) показали, что изучаемое оригинальное вещество проявляет существенное прямое бронхорелаксирующее действие в отношении всех видов контрактур гладкомышечного препарата изолированной трахеи, индуцированных гистамином, овальбумином. Бронхолитический эффект, выявленный in vitro, нашел свое подтверждение в условиях моделирования бронхоспазма in vivo, что подтверждает его антиастматическую эффективность. В проявлении бронхопротективных эффектов ЛХТ 15-06 не уступал референтным препаратам - кромогликату натрия и будесониду.
2. Изучение противотуберкулезной активности
При проведении внеэкспериментального компьютерного прогноза структура-активность по базе данных фармакологически активных веществ установлено, что N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамида (ЛХТ 15-06) по своей структуре в высокой степени вероятности обладает противотуберкулезной активностью.
Экспериментальное изучение ЛХТ 15-06 проведено на моделях in vitro и in vivo на культурах микобактерий туберкулеза человеческого и бычьего типов, свеже выделенных от больных туберкулезом легких.
Микробиологические исследования свидетельствуют, что ЛХТ 15-06 в концентрации 40 мкг/мл обладает бактерицидным, а в концентрации 10 мкг/мл и 20 мкг/мл проявляет бактериостатическое действие в отношении чувствительных к противотуберкулезному препарату изониазид лабораторных штаммов клинических изолятов микобактерий туберкулеза (МБТ).
Изучение ингибирующей концентрации ЛХТ 15-06 определяли на лабораторных штаммах МБТ, используя плотную яичную среду Попеску. Препаратом сравнения выбран противотуберкулезный препарат изониазид. Результаты представлены в таблице 9.
По минимальной ингибирующей концентрации ЛХТ 15-06 не уступает препарату сравнения изониазиду.
Изучение бактериостатической эффективности ЛХТ 15-06 в сравнении с изониазидом проводили на мышах-самцах линии CBA/L. Животных подвергали действию клинических изолятов микобактерий туберкулеза человеческого типа. Затем внутрибрюшинно в течение 30 дней ежедневно по 2 раза вводили в виде суспензии ЛХТ 15-06 5 мг/кг и изониазид 25 мг/кг. Данные представлены в таблице 10.
Таким образом, ЛХТ 15-06 по экспериментальным данным, по минимальной ингибирующей концентрации, индексу эффективности не уступает широко применяемому в медицине противотуберкулезному препарату изониазид.
Полученные фармакологические данные позволяют предполагать возможность применения предлагаемой фармацевтической композиции на основе нового соединения для профилактики и лечения воспалительных, бронхолегочных (бронхиты, пневмонии, бронхиальная астма) заболеваний, туберкулеза.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ ГЛУТАРИМИДОВ, И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЭОЗИНОФИЛЬНЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2552929C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ N-АЦИЛЬНЫЕ ПРОИЗВОДНЫЕ АМИНОКИСЛОТ, И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОАЛЛЕРГИЧЕСКИХ, АНТИАНАФИЛАКТИЧЕСКИХ И ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ | 2008 |
|
RU2406727C2 |
| Фармацевтическая композиция на основе глюкокортикостероида будесонида и фосфатидилхолина для сухой ингаляции | 2019 |
|
RU2730488C1 |
| N-АЦИЛЬНЫЕ ПРОИЗВОДНЫЕ АМИНОКИСЛОТ, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕВЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГИПОЛИПИДЕМИЧЕСКИХ СРЕДСТВ | 2005 |
|
RU2335495C2 |
| ПРОТИВОТУБЕРКУЛЕЗНОЕ СРЕДСТВО В ВИДЕ РАСТВОРА ДЛЯ ИНЪЕКЦИИ | 2007 |
|
RU2358742C2 |
| Производные 5-этил-2-амино-1, 3, 4-тиадиазола, обладающие обезболивающей, противовоспалительной, противоаллергической и анальгетической активностями | 2016 |
|
RU2651572C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2013 |
|
RU2523792C9 |
| СПОСОБЫ ПОЛУЧЕНИЯ N-АЦИЛЬНЫХ ПРОИЗВОДНЫХ АМИНОКИСЛОТ (ВАРИАНТЫ) | 2008 |
|
RU2378284C2 |
| ИЗОНИКОТИНОИЛГИДРАЗОН 2-ГИДРОКСИ-3-МЕТОКСИБЕНЗАЛЬДЕГИДА, ПРОЯВЛЯЮЩИЙ АНТИАСТМАТИЧЕСКУЮ, ПРОТИВОВОСПАЛИТЕЛЬНУЮ И АНТИАЛЛЕРГИЧЕСКУЮ АКТИВНОСТЬ | 1997 |
|
RU2139711C1 |
| НОВЫЙ ИНГИБИТОР ГЛУТАМИНИЛЦИКЛАЗ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЛЕГКИХ И ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2017 |
|
RU2662559C1 |
Изобретение относится к фармацевтической композиции, обладающей противовоспалительной, бронхолитической и противотуберкулезной активностью, представляющей собой N-(5-Этил-1,3,4-тиадиазол-2-ил)-4-нитробензамид. Полученные результаты фармакологического изучения показали, что данное соединение обладает высокой противовоспалительной, бронхолитической, противотуберкулезной активностями, не уступающей, а в некоторых случаях превосходящей известные применяемые в медицине препараты. Разработана твердая дозированная фармацевтическая композиция на основе этого соединения, выполненная в виде таблеток, или капсул, или в виде порошка для приготовления суспензии для питья. Указанные свойства позволяют предполагать возможность применения предлагаемых фармацевтических композиций на основе данного соединения для профилактики и лечения воспалительных, бронхолегочных (бронхиты, пневмонии, бронхиальная астма) заболеваний, туберкулеза. 3 з.п. ф-лы, 10 табл., 11 пр.
1. Фармацевтическая композиция, обладающая противовоспалительной, бронхолитической и противотуберкулезной активностью, представляющая собой N-(5-этил-1,3,4-тиадиазол-2-ил)-4-нитробензамид.
2. Твердая дозированная фармацевтическая композиция по п.1, отличающаяся тем, что она выполнена в виде таблеток, или капсул, или в виде порошка для приготовления суспензии для питья.
3. Твердая дозированная фармацевтическая композиция по пп.1 и 2, отличающаяся тем, что она содержит активное вещество и целевые добавки при следующем соотношении компонентов, мас.%:
4. Твердая дозированная фармацевтическая композиция по пп.1-3, отличающаяся тем, что в качестве целевых добавок она содержит необязательно одновременно крахмал, натрия кроскармеллозу, поливинил-пирролидоны, сахара, производные целлюлозы, органические и неорганические соли цинка и кальция, кремния диоксид, соли бензойной кислоты, соли стеариновой кислоты, 2-(диметиламино)этанол, N-ацетил-L-глутаминовую кислоту, коррегирующие вещества при следующем соотношении компонентов, мас.%:
| STN on the Web, БД CHEMCATS, CAS RN 313662-95-2, 12.01.2001 | |||
| Способ получения производных тиа(окса) диазола | 1976 |
|
SU639451A3 |
| Способ получения производных @ -арилбензамида или их солей | 1982 |
|
SU1160932A3 |
| Импульсный преобразователь напряжения | 1982 |
|
SU1064273A1 |
| ПРОКЛЕЙКА БУМАГИ | 1998 |
|
RU2177521C2 |
Авторы
Даты
2012-04-27—Публикация
2011-02-03—Подача