ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
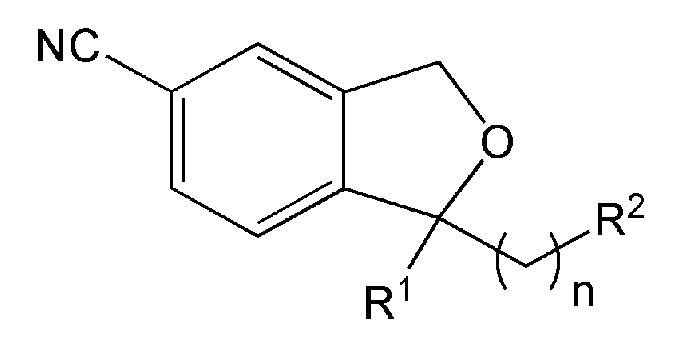
Изобретение относится к производным 1,3-дигидро-5-изобензофуранкарбонитрила, представленным формулой 1 ниже, или к их фармацевтически приемлемым солям и к фармацевтическим композициям для лечения или профилактики преждевременной эякуляции, включающим тот же действующий компонент.
[Формула 1]
УРОВЕНЬ ТЕХНИКИ
Существуют различные концепции в отношении преждевременной эякуляции. Отсутствует общепризнанное определение преждевременной эякуляции. Согласно DSM-IV-TR (Diagnostic and Statistical Manual of Mental Disorders, четвертое переработанное издание), преждевременная эякуляция определяется как стойкое или периодически повторяющееся начало оргазма и эякуляция с минимальной половой стимуляцией до, в течение или вскоре после проникновения и до момента, когда пациенту это желательно.
Преждевременная эякуляция, как установлено, является наиболее обычным мужским половым расстройством, встречающимся у приблизительно 30% мужчин. Уровень распространения этого расстройства в три раза выше, чем уровень эректильной дисфункции (Int. J. Impot. Res. 2005 17:39-57). Эректильная дисфункция является обычной для мужчин среднего возраста, так же как для старых мужчин, в то время как преждевременная эякуляция встречается у мужчин всех возрастов и имеет вредное влияние на качество жизни. Преждевременная эякуляция в целом классифицируется как первичная или вторичная. Первичная форма относится к мужчинам, которые имеют состояние непосредственно после того, как они стали способны к половому функционированию (то есть в постпубертатный период). Первичная преждевременная эякуляция (PE) ассоциирована с изменениями в нейромедиаторах, которые вовлечены в разнообразные психологические процессы. PE считается вторичной, если индивидуум был способен контролировать эякуляцию и не сталкивался с проблемой ранее, но затем оказался неспособен из-за психической нагрузки, эректильной дисфункции, простатита, уретрита или введения лекарства.
Две главные причины, вносящие вклад в преждевременную эякуляцию, представляют собой биологические и психогенные факторы. Биологические факторы включают гиперчувствительность члена, чрезмерную возбудимость эякуляторного рефлекса, увеличенную половую возбудимость, эндокринопатию, генетическую предрасположенность и дисфункцию 5-HT рецептора. Психогенные факторы риска включают в себя страх, ранние половые эксперименты, методики контроля эякуляции и психодинамические факторы (J. Sex. Med. 2004 1:58-65).
Процесс эякуляции опосредуется сложным взаимодействием нейромедиаторов, таких как 5-гидрокситриптамин (5-HT) и допамин. Холинергические, адренергическиие, GABA-ергические и окситосинергические нейроны также, как было показано, вовлечены в регуляцию эякуляции. Среди них 5-HT, как известно, играет основную роль в регуляции эякуляции (Urology 2003 61:623-628). Общая роль серотонина (5-HT) при эякуляции, как было показано, является подавляющей (Physiol. Behav. 2004 83:291-307). 5-HT, высвобождаемый в L3-L5 спинальных сегментах из окончаний аксонов, исходящих из ростральной области парагигантоклеточных ядер (nPGi) в стволовой части мозга, оказывает подавляющее действие на эякуляцию (Exp Brain Res 1992 88:313-320). Кроме того, эякуляция ингибируется, когда 5-HT высвобождается из серотонинергических нейронов в срединном предзрительном поле (MPOA), которое представляет собой часть гипоталамуса (Eur J Pharmacol 1992 210:121-129). Серотонин высвобождается из пресинаптических нейронов и действует на рецепторы постсинапсических нейронов, в которых 5-HT2C рецептор опосредует влияние серотонина на эякуляцию. Пресинаптические 5-HT1B и соматодендритные 5-HT1A ауторецепторы индуцируют отрицательный контроль отклика высвобождения 5-HT и предотвращают избыточную стимуляцию постсинаптических 5-HT рецепторов для ингибирования эякуляции. Затем молекулы 5-HT, присутствующие в синапсе, вновь попадают обратно в пресинаптический нейрон действием транспортера 5-HT, который локализован на мембране клетки пресинаптического нейрона. Таким образом, 5-HT вовлечен в контроль эякуляции (European Urology 2006 50:454-466).
Существуют немедикаментозное лечение и медикаментозное лечение преждевременной эякуляции.
Немедикаментозное лечение преждевременной эякуляции представляет собой упомянутые поведенческие терапии. Наиболее популярными способами являются методика сжатия, предложенная Мастерсом и Джонсоном (Masters & Johnson) (1970) и методика остановки-начала, предложенная Семансом (Semans) (1956). Однако существуют проблемы с обеими методиками в отношении того, что они являются времязатратными и требуют участия их партнера, что ведет к трудностям на практике и низким уровням успеха (Contemp Urol 2001 13:51-59).
Ни одно из лекарств не одобрено Управлением по контролю за продуктами и лекарствами США для лечения преждевременной эякуляции. Однако в многочисленных исследованиях было показано, что местные анестетики, недокументированное применение антидепрессантов и подобного является эффективным для лечения преждевременной эякуляция. Наиболее применяемым местным анестезирующим кремом для снижения чувствительности головки пениса является крем или спрей EMLA, который содержит лидокаин и прилокаин. Лидокаин-прилокаиновая рецептура, как было показано, является частично эффективной при преждевременной эякуляции и улучшает половое удовлетворение, когда наносится за 30 минут до полового контакта, но вызывает уменьшенную чувствительность пениса и вагинальное онемение у партнера-женщины (Int J Impot Res 2003 15:277-281). Крем отечественного производства SS, который приготовляется на основе лекарственного средства из экстракта из девяти китайских трав, значительно увеличивает внутривагинальное время задержки эякуляции (IVELT) при клинических испытаниях, но в настоящее время не продается ввиду его низкой эффективности и побочных эффектов, включая локальное жжение и боль (Yonsei.Med.J. 1997 38:91-95).
Трициклические антидепрессанты (TCA) и селективные ингибиторы обратного захвата серотонина (SSRI) в настоящее время применяются без документированного описания. TCA являются менее селективным для ингибирования обратного захвата серотонина и имеют больше побочных эффектов, чем SSRI (Contemp Urol 2001 13:51-59).
SSRI, такие как флуоксетин, пароксетин, сертралин, циталопрам и флувоксамин, как было показано, являются эффективными при лечении преждевременной эякуляции. В частности, USP 4136193 впервые описывает антидепрессантные 1-диметиламинопропил-1-фенилфталаны, которые включают в себя циталопрам, который аналогичен соединениям по настоящему изобретению. Когда тестировали различные дозы и схемы введения, постоянное ежедневное введение SSRI в течение 2-недельного периода увеличивало IVELT на 3-10 минут и было, таким образом, более эффективным при преждевременной эякуляции, чем однократная дозировка перед контактом (J Urol 1998 159:1935-1938).
Однако долговременное применение SSRI увеличивает величину побочных эффектов, таких как рвота, сухость во рту, дремота, уменьшенное либидо и неспособность к эякуляции (J Sex Marital Ther 1999 25:89-101). В отношении эффективности, SSRI имеют другой решающий недостаток в том, что нет показаний для их применения при лечении преждевременной эякуляции. Кроме того, SSRI предназначены для постоянного применения в большей степени, чем для применения по запросу, так как они имеют долгий период полувыведения и долгий Tmax, который представляет собой время до максимальной концентрации в плазме, и это делает продолжительным время до достижения SSRI их терапевтических эффектов, и эффективность этих препаратов трудно предсказать.
Когда SSRI-лекарства применяются в комбинации с ингибиторами моноаминоксидазы, такими как литий, суматриптан и триптофан, возникает увеличенный риск серотонинового синдрома с побочными эффектами, включая лихорадку, бред, коматозное состояние, потение и головокружение (N Eng J Med 2005 352:1112-1120).
В этом отношении, авторы настоящего изобретения провели интенсивное и исчерпывающее исследование с целью найти соединение, которое имеет хороший эффект отсроченной эякуляции, приблизительно в три раза более короткий период полувыведения и улучшенную безопасность и является, таким образом, пригодным для применения по требованию для лечения преждевременной эякуляции. Исследование привело к результату, что новые производные 1,3-дигидро-5-изобензофуранкарбонитрила или их фармацевтически приемлемые соли имеют хороший эффект отсроченной эякуляции с коротким периодом полувыведения, что привело, таким образом, к настоящему изобретению.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Проблема техники
Таким образом, целью настоящего изобретения являлось предоставить новые производные 1,3-дигидро-5-изобензофуранкарбонитрила или их фармацевтически приемлемые соли и способ их получения.
Другой целью настоящего изобретения являлось предоставить фармацевтическую композицию для лечения или профилактики преждевременной эякуляции, где композиция имеет короткий период полувыведения и хороший эффект отсроченной эякуляции.
Техническое решение
Для того чтобы соответствовать указанным выше целям, настоящее изобретение предоставляет новые производные 1,3-дигидро-5-изобензофуранкарбонитрила или их фармацевтически приемлемые соли.
Благоприятные эффекты
Согласно настоящему изобретению, производные 1,3-дигидро-5-изобензофуранкарбонитрила имеют короткий период полувыведения и ингибируют процесс эякуляции селективным ингибированием обратного захвата серотонина действием транспортера обратного захвата серотонина, присутствующим в пресинаптическом нейроне. Таким образом, настоящее изобретение может быть применено при лечении или профилактике преждевременной эякуляции.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТА ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано подробно.
В одном аспекте, настоящее изобретение предоставляет производные 1,3-дигидро-5-изобензофуранкарбонитрила, представленные формулой 1 ниже, или их фармацевтически приемлемые соли:
[Формула 1]
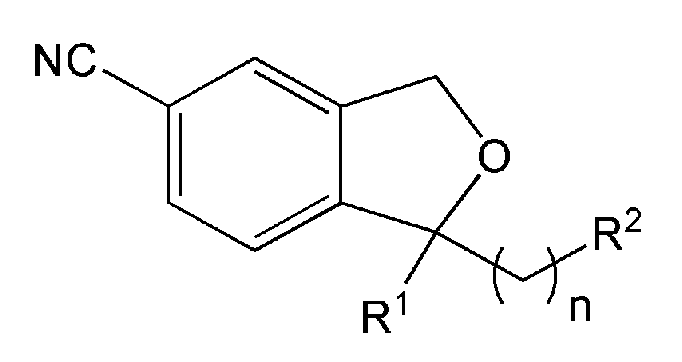
Настоящее изобретение включает следующие производные.
1) Производное, представленное формулой 1, или его фармацевтически приемлемая соль,
где R1 представляет собой замещенный или незамещенный фенил или гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила;
R2 представляет собой C1-C6-диалкиламино или замещенный или незамещенный гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и
n представляет собой целое число от 1 до 3.
2) Производное, представленное формулой 1, или его фармацевтически приемлемая соль,
где R1 представляет собой замещенный или незамещенный фенил или гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и в случае если R1 содержит заместитель, заместитель представляет собой C1-C6-алкил, C1-C6-алкилокси, C1-C6-диалкиламин или галоген;
R2 представляет собой C1-C6-диалкиламино или замещенный или незамещенный гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и
n представляет собой целое число от 1 до 3.
3) Производное, представленное формулой 1, или его фармацевтически приемлемая соль,
где R1 представляет собой замещенный или незамещенный фенил или гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила;
R2 представляет собой C1-C6-диалкиламино, пиразолил или имидазолил и
n представляет собой целое число от 1 до 3.
4) Производное, представленное формулой 1, или его фармацевтически приемлемая соль,
где R1 представляет собой фенил, замещенный C1-C6-алкилокси;
R2 представляет собой C1-C6-диалкиламино или замещенный или незамещенный гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и
n представляет собой целое число от 1 до 3.
В предпочтительном варианте осуществления изобретения, R1 представляет собой метоксифенил;
R2 представляет собой C1-C6-диалкиламино или замещенный или незамещенный гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и
n представляет собой целое число от 1 до 3.
В более предпочтительном варианте осуществления изобретения, R1 представляет собой метоксифенил;
R2 представляет собой диметиламино, пиразолил или имидазолил; и
n представляет собой целое число от 1 до 3.
5) Производное, представленное формулой 1, или его фармацевтически приемлемая соль:
где R1 представляет собой незамещенный фенил или фенил, замещенный C1-C6-алкилом;
R2 представляет собой C1-C6-диалкиламино или замещенный или незамещенный гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и
n представляет собой целое число от 1 до 3.
В предпочтительном варианте осуществления изобретения, R1 представляет собой незамещенный фенил или толил;
R2 представляет собой C1-C6-диалкиламино или замещенный или незамещенный гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и
n представляет собой целое число от 1 до 3.
В более предпочтительном варианте осуществления по изобретению, R1 представляет собой незамещенный фенил или толил;
R2 представляет собой C1-C6-диалкиламино, пиразолил или имидазолил; и
n представляет собой целое число от 1 до 3.
6) Производное, представленное формулой 1, или его фармацевтически приемлемая соль,
где R1 представляет собой фенил, замещенный C1-C6-диалкиламино;
R2 представляет собой C1-C6-диалкиламино или замещенный или незамещенный гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и
n представляет собой целое число от 1 до 3.
В предпочтительном варианте осуществления изобретения, R1 представляет собой диметиламинофенил;
R2 представляет собой C1-C6-диалкиламино или замещенный или незамещенный гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и
n представляет собой целое число от 1 до 3.
В более предпочтительном варианте осуществления изобретения, R1 представляет собой диметиламинофенил;
R2 представляет собой диметиламино, пиразолил или имидазолил; и
n представляет собой целое число от 1 до 3.
7) Производное, представленное формулой 1, или его фармацевтически приемлемая соль,
где R1 представляет собой тиенил;
R2 представляет собой C1-C6-диалкиламино или замещенный или незамещенный гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и
n представляет собой целое число от 1 до 3.
В предпочтительном варианте осуществления изобретения, R1 представляет собой тиенил;
R2 представляет собой диметиламино, пиразолил или имидазолил; и
n представляет собой целое число от 1 до 3.
8) Производное, представленное формулой 1, или его фармацевтически приемлемая соль,
где R1 представляет собой фенил, замещенный галогеном;
R2 представляет собой замещенный или незамещенный гетероциклил, выбранный из пиридинила, изоксазолила, тиазолила, пиримидинила, инданила, бензтиазолила, пиразолила, тиадиазолила, оксазолила, пиперидинила, морфолинила, имидазолила, пирролидинила, тиенила, триазолила, пирролила и фурила; и
n представляет собой целое число от 1 до 3.
В предпочтительном варианте осуществления изобретения, R1 представляет собой фенил, замещенный галогеном;
R2 представляет собой пиразолил или имидазолил; и
n представляет собой целое число от 1 до 3.
Фармацевтически приемлемые соли соединения формулы 1 включают соли присоединения кислоты, образуемые с неорганической кислотой или органической кислотой. Примеры неорганических кислот включают соляную кислоту, бромоводородную кислоту, йодоводородную кислоту, серную кислоту и фосфорную кислоту. Примеры органических кислот включают p-толуолсульфокислоту, метансульфонокислоту, щавелевую кислоту, p-бромфенилсульфоновую кислоту, угольную кислоту, янтарную кислоту, лимонную кислоту, бензойную кислоту и уксусную кислоту. Примеры таких фармацевтически приемлемых солей включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрогенфосфат, дигидрогендфосфат, метафосфат, пирофосфат, бромид, йодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, хлорид, дихлорид, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, гидроксибензоат, метоксибензоат, фталат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, альфа-гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат и манделат. Предпочтительными фармацевтически приемлемыми солями присоединения кислоты являются те, что образуются с неорганическими кислотами, такими как соляная кислота и бромоводородная кислота, и те, что образуются с органическими кислотами, такими как щавелевая кислота и малеиновая кислота.
Особенно предпочтительные примеры соединения формулы 1 по настоящему изобретению включают следующие:
1-{3-(диметиламино)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрил;
оксалат 1-{3-(диметиламино)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорид 1-{3-(диметиламино)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(имидазол-1-ил)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{3-(имидазол-1-ил)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(имидазол-1-ил)этил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{2-(имидазол-1-ил)этил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-метоксифенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-(4-метоксифенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-метоксифенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-(4-метоксифенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(диметиламино)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{3-(диметиламино)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(диметиламино)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{2-(диметиламино)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(имидазол-1-ил)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{3-(имидазол-1-ил)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(имидазол-1-ил)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{2-(имидазол-1-ил)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
1-фенил-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-фенил-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(диметиламино)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{3-(диметиламино)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(диметиламино)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{2-(диметиламино)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(имидазол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{3-(имидазол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(имидазол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{2-(имидазол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(пиразол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{3-(пиразол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(пиразол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{2-(пиразол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-диметиламинофенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрил;
оксалат 1-(4-диметиламинофенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорид 1-(4-диметиламинофенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-диметиламинофенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-(4-диметиламинофенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(диметиламино)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрил;
оксалат 1-{3-(диметиламино)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорид 1-{3-(диметиламино)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(диметиламино)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{2-(диметиламино)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(имидазол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрил;
оксалат 1-{3-(имидазол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорид 1-{3-(имидазол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(имидазол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{2-(имидазол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(пиразол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{3-(пиразол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(пиразол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-{2-(пиразол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-фторфенил)-1-{3-(имидазол-1-ил)пропил)-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-(4-фторфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-фторфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-(4-фторфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-фторфенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-(4-фторфенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-фторфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-(4-фторфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-хлорфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-(4-хлорфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-хлорфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-(4-хлорфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-хлорфенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрил;
гидрохлорид 1-(4-хлорфенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-хлорфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрил и
гидрохлорид 1-(4-хлорфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила.
В другом аспекте, настоящее изобретение предоставляет способ получения соединения, представленного формулой 1, или его фармацевтически приемлемой соли.
Способ по настоящему изобретению представлен на схеме реакции 1 ниже.
[Схема реакции 1]
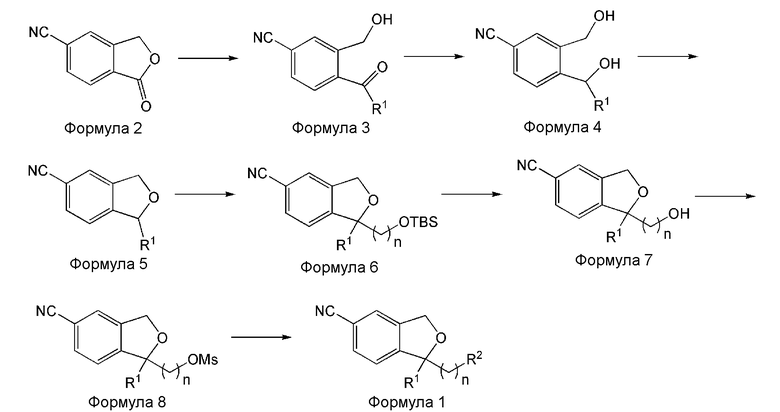
Соединение формулы 1 по настоящему изобретению, как представлено на схеме реакции 1, может быть получено через последовательность стадий из 5-цианофталимидного соединения формулы 2 на схеме реакции 1. R1, R2 и n являются теми же, как определено в Формуле 1. Способ включает:
1) получение соединения формулы 3 реакцией 5-цианофталимидного соединения формулы 2 с R1MgBr (стадия 1);
2) получение соединения формулы 4 реакцией восстановления соединения формулы 3 (стадия 2);
3) получение соединения формулы 5 реакцией циклизации соединения формулы 4 (стадия 3);
4) получение соединения формулы 6 путем введения алкильной группы в положение 1 соединения формулы 5 (стадия 4);
5) получение соединения формулы 7 снятием защиты с соединения формулы 6 (стадия 5);
6) получение соединения формулы 8 реакцией соединения формулы 7 с метансульфонилхлоридом (стадия 6);
7) получение соединения формулы 1 по реакции замещения соединения формулы 8 на R2 группу и образованием соли (с HCl или щавелевой кислотой) (стадия 7).
Каждая стадия способа будет описана ниже подробно.
5-цианофталимид формулы 2, применяемый в качестве исходного соединения на стадии 1, может быть получен с применением известного способа (Il Farmaco 2001, 56, 715). На стадии 1, проводили реакцию Гриньяра с R1MgBr. Примеры растворителей, которые могут быть применены в реакции, включают тетрагидрофуран, 1,4-диоксан, диэтиловый эфир, диметоксиэтан и хлористый метилен. Хлористый метилен является предпочтительным. Реакцию проводили при температуре между 0°C и комнатной температурой в течение от 10 до 20 часов.
На стадии 2, реакция восстановления может быть проведена с применением борогидрида натрия в качестве восстанавливающего реагента. Восстанавливающий реагент применяется в количествах, варьирующих от 0,5 до 3 эквивалентов, и предпочтительно 2 эквивалента.
На стадии 3, реакцию циклизации соединения формулы 4 проводили в кислых условиях. Примеры кислот, которые могут быть применены, включают соляную кислоту, серную кислоту и фосфорную кислоту, фосфорная кислота является предпочтительной.
На стадии 4, могут быть применены основания, такие как диизопропиламид лития, гидрид натрия, n-бутиламин, метоксид натрия и трет-бутоксид калия. Гидрид натрия является предпочтительным. Примеры пригодных растворителей включают диметилсульфоксид, диметилформамид, N-метилпирролидин-2-он, тетрагидрофуран и 1,4-диоксан. Диметилсульфоксид является предпочтительным. Реакцию проводили при температуре от 50°C до 110°C в течение 12-36 часов.
На стадии 5, защитная группа в соединении формулы 6 может быть удалена с применением фтористого водорода, фторида калия, фторида тетрабутиламмония, соляной кислоты, серной кислоты или подобного. Фторид тетрабутиламмония является предпочтительным. Реакцию снятия защиты проводили с применением в качестве растворителя тетрагидрофурана при комнатной температуре в течение приблизительно 1 часа.
На стадии 6, уходящая группа может быть введена в соединение формулы 8 с применением метансульфонилхлорида, p-толуолсульфонилхлорида, трихлорметансульфонилхлорида или подобных. Метансульфонилхлорид является предпочтительным. Реакцию проводили в присутствии дихлорметана в качестве растворителя при 0°C в течение приблизительно 1 часа.
На стадии 7, основания, пригодные для применения в реакции с замещением R2, включают карбонаты, такие как карбонат натрия, карбонат кальция, карбонат калия и карбонат цезия, и гидроксиды, такие как гидроксид натрия, гидроксид кальция и гидроксид калия. Карбонат калия является предпочтительным. Примеры растворителей, пригодных для применения в реакции, включают диметилсульфоксид, диметилформамид, N-метилпирролидин-2-он, тетрагидрофуран и 1,4-диоксан, и диметилформамид является предпочтительным. Реакцию проводили при температуре 50°C-110°C в течение 12-36 часов для получения целевого соединения формулы 1, производного 1,3-дигидро-5-изобензофуранкарбонитрила. Необязательно, соединение вводится в реакцию с соляной кислотой или щавелевой кислотой в течение 10-60 минут для получения солевого производного 1,3-дигидро-5-изобензофуранкарбонитрила в форме гидрохлорида или оксалата.
В следующем аспекте, настоящее изобретение предоставляет фармацевтическую композицию для лечения или профилактики преждевременной эякуляции, включающую в себя новое производное 1,3-дигидро-5-изобензофуранкарбонитрила, представленное формулой 1 ниже, или его фармацевтически приемлемую соль в качестве эффективного компонента, где композиция имеет короткий период полувыведения и хороший подавляющий эффект на эякуляцию.
Производные 1,3-дигидро-5-изобензофуранкарбонитрила по настоящему изобретению имеют короткий период полувыведения и ингибируют процесс эякуляции путем селективного ингибирования обратного захвата серотонина действием транспортера обратного захвата серотонина, присутствующего в пресинаптическом нейроне. Соединения по настоящему изобретению, таким образом, могут быть применены для лечения и профилактики преждевременной эякуляции.
Фармацевтическая композиция, содержащая новое производное 1,3-дигидро-5-изобензофуранкарбонитрила по настоящему изобретению или его фармацевтически приемлемую соль в качестве эффективного компонента, может быть применена в обычных фармацевтических дозированных формах. То есть соединения по настоящему изобретению могут быть введены в широко разнообразных пероральных и парентеральных дозированных формах при клиническом применении, пероральное введение является предпочтительным в настоящем изобретении. Фармацевтическая композиция может быть получена с обычно применяемыми разбавителями или наполнителями, такими как наполнители, загустители, связующие, увлажнители, дезинтегрирующие агенты и поверхностно-активные вещества.
Твердые рецептуры для перорального введения могут включать таблетки, пилюли, порошки, гранулы и капсулы и приготовляются путем смешения производного 1,3-дигидро-5-изобензофуранкарбонитрила или его фармацевтически приемлемой соли с одним или несколькими наполнителями, такими как крахмал, карбонат кальция, сахароза, лактоза и желатин. Также твердые рецептуры могут включать, в добавление к простому наполнителю, смазку, такую как стеарат магния или тальк. Жидкие рецептуры для перорального введения могут включать в себя суспензии, растворы для внутреннего ведения, эмульсиии и сиропы. Жидкие рецептуры могут включать в себя, в добавление к обычно применяемым простым разбавителям, таким как вода и жидкий парафин, различные наполнители, например увлажнители, подсластители, ароматические добавки и консерванты. Рецептуры для парентерального введения могут включать в себя стерильные водные растворы, неводные растворы, суспензии, эмульсии, лиофилизованные препараты и суппозитории. Неводные растворы и суспензии могут быть приготовлены с пропиленгликолем, полиэтиленгликолем, растительными маслами, такими как оливковое масло, и эфирами, пригодными для инъекций, такими как этил олеат. В качестве основания для суппозиториев могут быть применены Witepsol®, макрогол, Tween 61®, масло кокоса, лауриновое масло и обработанный глицерином желатин.
Дозировка фармацевтической композиции по настоящему изобретению, включающая в себя производное 1,3-дигидро-5-изобензофуранкарбонитрила или его фармацевтически приемлемую соль в качестве эффективного компонента, может варьировать в зависимости от массы, возраста, пола и режима питания пациента, режима и способа введения, скоростей выведения и тяжести заболевания. Композиция по настоящему изобретению может быть введена в эффективном количестве, находящемся в диапазоне от 0,1 до 1000 мг, и предпочтительно с дневной дозировкой 10 до 50 мг. Дневная дозировка может приниматься как одиночная доза или может быть разделена на несколько доз.
ПРИМЕРЫ
Лучшее понимание настоящего изобретения может быть достигнуто с помощью следующих примеров, которые приведены для иллюстрации, но не должны считаться ограничивающими объем настоящего изобретения.
Молекулярные структуры настоящего соединения формулы 1 устанавливали с помощью инфракрасной спектроскопии, спектроскопии в УФ и видимом диапазоне, спектроскопии ядерного магнитного резонанса, масс-спектроскопии и сравнением вычисленных и экспериментальных величин элементного анализа репрезентативного соединения.
ПРИМЕР 1: Получение 1-(4-метоксифенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила (соединение 1)
Стадия 1: Получение 3-гидроксиметил-4-(4-метоксибензоил)бензонитрила
200 г (125,6 ммоль) 5-цианофталимида растворяли в 200 мл безводного дихлорметана. Раствор охлаждали до -78°C и по каплям добавляли 188 мл 4-метоксифенилмагний бромида (1 M в THF, 188 ммоль). Смесь нагревали до комнатной температуры и перемешивали в течение 16 часов, затем добавляли насыщенный раствор хлорида аммония. Органический слой сушили над безводным сульфатом магния и фильтровали. Растворитель упаривали под уменьшенным давлением, что дало желтое соединение, представленное формулой 3. Соединение, полученное таким образом, применяли в следующей реакции без дополнительной очистки.
1H ЯМР (400 МГц, CDCl3): 3,89 (с, 3H), 4,60 (д, J=6,0 Гц, 2H), 6,95 (д, J=7,2 Гц, 2H), 7,48 (д, J=7,6 Гц, 1H), 7,65 (д, J=7,6 Гц, 1H), 7,75 (д, J=7,2 Гц, 2H), 7,86 (с, 1H).
Стадия 2: Получение 4-{гидрокси(4-метоксифенил)метил}-3-(гидроксиметил)бензонитрила
33,6 г (125,6 ммоль) 3-гидроксиметил-4-(4-метоксибензоил)бензонитрила, полученного на стадии 1, растворяли в 200 мл дихлорметана и 100 мл метанола. Раствор охлаждали до 0°C и медленно добавляли 95 г (251,1 ммоль) борогидрида натрия.
Смесь нагревали до комнатной температуры и перемешивали в течение 3 часов, затем добавляли насыщенный раствор хлорида аммония. Органический слой сушили над безводным сульфатом магния и фильтровали. Растворитель упаривали под уменьшенным давлением, что дало желтое соединение, представленное формулой 4. Соединение, полученное таким образом, применяли на следующей стадии без дополнительной очистки.
1H ЯМР (400 МГц, ДМСО-d6): 3,70 (с, 3H), 4,28 (дд, J=14,8 Гц, 5,4 Гц, 1H), 4,57 (дд, J=14,8 Гц, 5,4 Гц, 1H), 5,37 (т, J=5,4 Гц, 1H), 5,83 (д, J=4,2 Гц, 1H), 5,94 (д, J=4,2 Гц, 1H), 6,85 (д, J=8,8 Гц, 2H), 7,15 (д, J=8,8 Гц, 2H), 6,69-7,73 (м, 2H), 7,75 (с, 1H).
Стадия 3: Получение 1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила
33,82 г (125,6 ммоль) 4-{гидрокси(4-метоксифенил)метил}-3-(гидроксиметил)бензонитрила, полученного на стадии 2, растворяли в 150 мл этилацетата и при комнатной температуре добавляли 150 мл 85% водного раствора фосфорной кислоты. Смесь нагревали до 80°C и перемешивали в течение 3 часов. Затем реакционную смесь охлаждали снова до комнатной температуры, промывали водой и насыщенным раствором NaCl. Органический слой сушили над безводным сульфатом магния и фильтровали. Растворитель упаривали под уменьшенным давлением. Остаток обрабатывали 2-пропанолом, что дало 180 г белого твердого вещества (выход: 57%).
1H ЯМР (400 МГц, CDCl3): 2,73 (с, 3H), 5,10 (д, J=13,0 Гц, 1H), 5,27 (дд, J=13,0 Гц, 1H), 6,17 (с, 1H), 6,91 (д, J=8,4 Гц, 2H), 7,17-7,24 (м, 3H), 7,70 (д, J=8,0 Гц, 1H), 7,87 (с, 1H).
Стадия 4: Получение 1-(3-трет-бутилдиметилсилилоксипропилил-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила
230 г (1,3 ммоль) 1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила, полученного на стадии 3, растворяли в 200 мл диметилсульфоксида. 5,5 г (137,0 ммоль) гидрида натрия медленно добавляли к раствору при комнатной температуре. Раствор перемешивали в течение 0,5 часа. Затем к смеси добавляли 34,7 г (1370 ммоль) бром-1-(трет-бутилдиметилсилил)пропана. Полученную смесь нагревали до 80°C, перемешивали в течение 12 часов и охлаждали вновь до комнатной температуры. Реакционную смесь смешивали с водой, экстрагировали этилацетатом и промывали водой и насыщенным раствором NaCl. Органический слой сушили над безводным сульфатом магния и фильтровали. Растворитель упаривали под уменьшенным давлением. Остаток очищали с применением колоночной хроматографии, что дало 34,1 г (выход: 88%) целевого соединения бледно-желтого цвета.
1H ЯМР (400 МГц, CDCl3): 0,06 (с, 6H), 0,89 (с, 9H), 1,34 (м, 1H), 1,52 (м, 1H), 1,95 (м, 1H), 2,21 (м, 1H), 3,57 (т, J=6,2 Гц, 1H), 3,65 (т, J=6,2 Гц, 1H), 3,76 (с, 3H), 5,16 (м, 2H), 6,85 (д, J=8,2 Гц, 2H), 7,33-7,35 (м, 3H), 7,49 (с, 1H), 7,57 (д, J=8,0 Гц, 1H).
Стадия 5: Получение 1-(3-гидроксипропил)-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила
34,1 г (80,8 ммоль) 1-(3-трет-бутилдиметилсилилоксипропил)-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила, полученного на стадии 4, растворяли в 200 мл тетрагидрофурана. 121,1 мл (121,1 ммоль) 1 M фторида тетрабутиламмония в тетрагидрофуране добавляли по каплям к раствору при комнатной температуре и смесь перемешивали в течение 2 часов. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором NaCl. Органический слой сушили над безводным сульфатом магния и фильтровали. Растворитель упаривали под уменьшенным давлением. Остаток очищали с применением колоночной хроматографии, что дало 15,0 г целевого соединения бледно-желтого цвета (выход: 60%).
1H ЯМР (400 МГц, CDCl3): 1,46 (м, 1H), 1,55 (м, 1H), 2,18 (м, 1H), 2,30 (м, 1H), 3,59 (м, 2H), 3,76 (с, 3H), 5,15 (м, 2H), 6,83 (д, J=8,8 Гц, 2H), 7,31-7,38 (м, 3H), 7,48 (с, 1H), 7,57 (д, J=8,0 Гц).
Стадия 6: Получение 1-(3-метансульфонилоксипропил)-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила
150 г (48,5 ммоль) 1-(3-гидроксипропил)-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила, полученного на стадии 5, растворяли в 200 мл дихлорметана и 7,4 г (72,7 ммоль) триэтиламина и 6,7 г (58,2 моль) метансульфонилхлорида добавляли по каплям при 0°C. Затем раствор перемешивали в течение 1 часа. Реакционную смесь промывали водой и насыщенным раствором NaCl. Органический слой сушили над безводным сульфатом магния и фильтровали. Растворитель упаривали под уменьшенным давлением, что дало 18,2 г целевого соединения желтого цвета (выход: 79%). Соединение, полученное таким образом, применяли на следующей стадии без дополнительной очистки.
1H ЯМР (400 МГц, CDCl3): 1,64 (м, 1H), 1,71 (м, 1H), 2,19 (м, 1H), 2,30 (м, 1H), 2,94 (с, 3H), 3,76 (с, 3H), 4,20 (м, 2H), 5,15 (м, 2H), 6,84 (д, J=8,8 Гц, 2H), 7,32 (д, J=8,8 Гц, 2H), 7,37 (д, J=8,0 Гц, 1H), 7,47 (с, 1H), 7,57 (д, J=8,0 Гц, 1H).
Стадия 7: Получение 1-{5-(диметиламино)пропил}-1,3-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила (соединение 1)
18,2 г (470 ммоль) 1-(3-метансульфонилоксипропил)-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила, полученного на стадии 6, растворяли в 300 мл диметилформамида и при комнатной температуре добавляли 13,0 г (94,0 ммоль) карбоната калия и 94,0 мл (188,0 ммоль) 2 M диметиламина в тетрагидрофуране. Температуру раствора затем повышали до 80°C и перемешивали в течение 12 часов. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором NaCl. Полученный органический слой сушили над безводным сульфатом магния и фильтровали. Затем растворитель упаривали под уменьшенным давлением, остаток очищали колоночной хроматографией, что дало 8,3 г (выход: 53%) бледно-желтого соединения, 1-(4-метоксифенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила.
1H ЯМР (400 МГц, CDCl3): 1,42 (м, 1H), 1,55 (м, 1H), 2,11-2,31 (м, 7H), 2,42 (м, 2H), 3,75 (с, 3H), 4,20 (м, 2H), 5,15 (м, 2H), 6,83 (д, J=8,8 Гц, 2H), 7,34 (д, J=8,8 Гц, 2H), 7,40 (д, J=7,8 Гц, 1H), 7,46 (с, 1H), 7,59 (д, J=7,8 Гц, 1H).
ПРИМЕР 2: Получение оксалата 1-{3-(диметиламино)пропил}-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила
8,3 г (24,7 ммоль) 1-{3-(диметиламино)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила, полученного в Примере 1, растворяли в 85 мл этанола и при комнатной температуре медленно добавляли 3,4 г (27,2 ммоль) щавелевой кислоты. Раствор перемешивали при комнатной температуре в течение 0,5 часа, охлаждали до 0°C и далее перемешивали в течение 1 часа. Раствор фильтровали для отделения осадка. Осадок промывали гексаном и высушивали, что дало 7,1 г целевого соединения в виде твердого вещества белого цвета (выход: 67%).
1H ЯМР (400 МГц, ДМСО-d6): 1,41 (м, 1H), 1,49 (м, 1H), 2,18 (м, 2H), 2,61 (с, 6H), 295 (т, J=7,8Гц, 2H), 3,65 (с, 3H), 5,19 (д, J=13,2 Гц, 1H), 5,12 (д, J=13,2 Гц, 1H), 6,88 (д, J=8,8 Гц, 2H), 7,42 (д, J=8,8 Гц, 2H), 7,68 (д, J=7,6 Гц, 1H), 7,77 (д, J=7,6 Гц, 1H), 7,78 (с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 19,3, 36,9, 42,2, 55,0, 56,6, 70,9, 90,2, 110,2, 113,6, 118,6, 122,8, 125,5, 125,9, 131,8, 135,5, 139,6, 149,2, 158,1, 164,1.
ПРИМЕР 3: Получение гидрохлорида 1-{3-(диметиламино)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила
8,3 г (24,7 ммоль) 1-{3-(диметиламино)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила, полученного в Примере 1, растворяли в 50 мл дихлорметана и при комнатной температуре по каплям добавляли 24,7 мл (49,4 ммоль) 2 M соляной кислоты в диэтиловом эфире. Затем смесь перемешивали в течение 0,5 часа. Затем раствор отделяли, осадок промывали диэтиловым эфиром и высушивали, что дало 8,7 г целевого соединения бледно-желтого цвета (выход: 95%).
1H ЯМР (400 МГц, ДМСО-d6): 1,45 (м, 1H), 1,56 (м, 1H), 2,24 (т, J=7,6 Гц, 2H), 2,59 (с, 3H), 2,61 (с, 3H), 2,98 (м, 2H), 3,70 (с, 3H), 5,12 (д, J=13,2 Гц, 1H), 5,21 (д, J=13,2 Гц, 1H), 6,87 (д, J=8,4 Гц, 2H), 7,44 (д, J=8,4 Гц, 2H), 7,70 (д, J=7,6 Гц, 1H), 7,77 (д, J=7,6 Гц, 1H), 7,78 (с, 1H), 10,62 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 19,0, 36,9, 41,8, 41,9, 55,0, 56,3, 70,6, 90,2, 110,2, 113,6, 118,6, 122,9, 125,5, 125,8, 131,7, 135,6, 139,6, 149,2, 158,1.
Согласно тому же способу, который описан в Примерах 1-3, получали соединения Примеров 4-68 ниже с применением реагента Гриньяра, амина и кислоты, соответствующих указанным заместителям в соединениях Примеров 4-68.
ПРИМЕР 4: Получение 1-{3-(имидазол-1-ил)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,69 (м, 1H), 1,78 (м, 1H), 1,98 (м, 1H), 2,14 (м, 3,72 (с, 3H), 3,94 (т, J=7,0 Гц, 2H), 5,13 (м, 2H), 6,78-6,85 (м, 3H), 7,05 (с, 1H), 7,23-7,29 (м, 3H), 7,45 (с, 1H), 7,54-7,57 (м, 2H).
ПРИМЕР 5: Получение гидрохлорида 1-{3-(имидазол-1-ил)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,67 (м, 1H), 1,71 (м, 1H), 2,14 (м, 2H), 3,69 (с, 3H), 4,17 (т, J=7,0 Гц, 2H), 5,09 (д, J=13,4 Гц, 1H), 5,17 (д, J=13,4 Гц, 1H), 6,86 (д, J=8,8 Гц, 2H), 7,39 (д, J=8,8 Гц, 2H), 7,64-7,67 (м, 2H), 7,73-7,77 (м, 3H), 9,18 (с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 24,9, 36,7, 48,3, 55,0, 70,9, 90,1, 110,2, 113,6, 118,0, 119,5, 121,7, 122,9, 125,4, 125,8, 131,7, 134,9, 135,5, 139,6, 149,1, 158,1.
ПРИМЕР 6: Получение 1-{2-(имидазол-1-ил)этил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,62 (м, 1H), 2,77 (м, 1H), 3,77 (с, 3H), 4,00 (т, J=7,8 Гц, 2H), 5,17 (м, 2H), 6,84-6,88 (м, 3H), 7,05 (с, 1H), 7,36 (д, J=7,2 Гц, 2H), 7,45 (д, J=8,0 Гц, 1H), 7,50 (с, 1H), 7,59 (д, J=8,0 Гц, 1H), 7,92 (с, 1H).
ПРИМЕР 7: Получение гидрохлорида 1-{2-(имидазол-1-ил)этил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,85 (м, 2H), 3,71 (с, 3H), 4,10 (м, 2H), 5,13 (д, J=13,4 Гц, 1H), 5,22 (д, J=13,4 Гц, 1H), 6,89 (д, J=8,2 Гц, 2H), 7,44 (д, J=8,2 Гц, 2H), 7,56 (с, 1H), 7,65-7,75 (м, 3H), 7,79 (с, 1H), 8,95 (с, 1H), 14,23 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 40,1, 44,7, 55,1, 71,1, 89,1, 110,4, 113,7, 118,5, 119,3, 121,8, 122,8, 125,5, 125,7, 131,8, 135,0, 135,1, 139,3, 148,2, 158,2.
ПРИМЕР 8: Получение 1-(4-метоксифенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,74 (м, 1H), 1,85 (м, 1H), 2,03 (м, 1H), 2,15 (м, 1H), 3,74 (с, 3H), 4,09 (м, 2H), 5,12 (м, 2H), 6,20 (с, 1H), 6,34 (с, 1H), 6,81 (д, J=7,6 Гц, 2H), 7,23-7,29 (м, 3H), 7,45 (с, 1H), 7,53 (д, J=7,6 Гц, 1H), 7,61 (с, 1H).
ПРИМЕР 9: Получение гидрохлорида 1-(4-метоксифенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,54 (м, 1H), 1,63 (м, 1H), 2,09 (м, 2H), 3,69 (с, 3H), 4,04 (т, J=7,0 Гц, 2H), 5,07 (д, J=13,6 Гц, 1H), 5,14 (д, J=13,6 Гц, 1H), 6,16 (м, 1H), 6,29 (м, 1H), 6,85 (д, J=8,8 Гц, 2H), 7,36 (д, J=8,8 Гц, 2H), 7,59-7,75 (м, 4H).
13C ЯМР (100 МГц, ДМСО-d6): 25,3, 37,2, 50,9, 55,1, 70,9, 90,3, 105,1, 110,2, 113,6, 118,7, 122,9, 125,5, 125,9, 130,3, 131,8, 135,7, 137,6, 139,7, 149,4, 158,1.
ПРИМЕР 10: Получение 1-(4-метоксифенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,78 (м, 2H), 4,14 (м, 2H), 5,18 (м, 2H), 6,10 (с, 1H), 6,84 (д, J=8,8 Гц, 2H), 7,16 (с, 1H), 7,34-7,37 (м, 3H), 7,44-7,46 (м, 2H), 7,52 (д, J=8,1 Гц, 1H).
ПРИМЕР 11: Получение гидрохлорида 1-(4-метоксифенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,72 (м, 2H), 3,71 (с, 3H), 3,97 (м, 2H), 5,15 (д, J=13,4 Гц, 1H), 5,25 (д, J=13,4 Гц, 1H), 6,11 (с, 1H), 6,88 (д, J=7,6 Гц, 2H), 7,32 (с, 1H), 7,47 (д, J=7,6 Гц, 2H), 7,59 (с, 1H), 7,68-7,74 (м, 2H), 7,78 (с, 1H), 11,82 (уш.с, 1Н).
13C ЯМР (100 МГц, ДМСО-d6): 40,4, 47,1, 55,1, 71,2, 89,2, 105,0, 110,3, 113,7, 118,6, 122,9, 125,5, 125,8, 130,2, 131,8, 135,3, 137,7, 139,4, 148,6, 158,2.
ПРИМЕР 12: Получение 1-{3-(диметиламино)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,40 (м, 1H), 1,52 (м, 1H), 2,10-2,48 (м, 10H), 5,17 (м, 2H), 7,22-7,33 (м, 4H), 7,43-7,47 (м, 3H), 7,57 (д, J=8,0 Гц, 1H).
ПРИМЕР 13: Получение гидрохлорида 1-{3-(диметиламино)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,43 (м, 1H), 1,52 (м, 1H), 2,25 (м, 2H), 2,56 (с, 6H), 2,96 (м, 2H), 5,16 (м, 2H), 7,20 (м, 1H), 7,29 (м, 2H), 7,53 (м, 2H), 7,65-7,85 (м, 3H), 10,69 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 18,8, 36,8, 41,7, 41,8, 56,1, 71,0, 90,2, 110,1, 118,3, 122,8, 124,3, 125,3, 126,8, 128,0, 131,6, 139,3, 143,3, 148,5.
ПРИМЕР 14: Получение 1-{2-(диметиламино)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,22 (с, 6H), 2,29 (м, 2H), 2,41 (м, 2H), 5,14 (м, 2H), 7,23-7,42 (м, 6H), 7,47 (с, 1H), 7,57 (д, J=7,8 Гц, 1H).
ПРИМЕР 15: Получение гидрохлорида 1-{2-(диметиламино)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,66-2,70 (м, 4H), 2,71 (с, 3H), 287 (с, 3H), 5,17 (д, J=13,4 Гц, 1H), 5,24 (д, J=13,4 Гц, 1H), 7,27 (м, 1H), 7,36 (м, 2H), 7,57 (д, J=7,6 Гц, 2H), 7,77-7,82 (м, 2H), 7,94 (с, 1H), 10,75 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 35,0, 42,8, 42,9, 53,4, 72,2, 89,9, 111,5, 119,3, 123,9, 125,3, 126,6, 128,3, 129,3, 132,9, 140,2, 143,6, 148,7.
ПРИМЕР 16: Получение 1-{3-(имидазол-1-ил)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDC13): 1,68 (м, 1H), 1,70 (м, 1H), 2,03 (м, 1H), 2,16 (м, 3,91 (м, 2H), 5,28 (м, 2H), 6,80 (с, 1H), 7,02 (с, 1H), 7,23-7,39 (м, 6H), 7,47 (с, 1H), 7,59 (д, J=8,0 Гц, 1H), 7,99 (с, 1H).
ПРИМЕР 17: Получение гидрохлорида 1-{3-(имидазол-1-ил)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,62 (м, 1H), 1,70 (м, 1H), 2,17 (т, J=7,4 Гц, 2H), 4,15 (т, J=7,2 Гц, 2H), 5,13 (д, J=13,4 Гц, 1H), 5,19 (д, J=13,4 Гц, 1H), 7,21-7,34 (м, 3H), 7,51 (д, J=8,0 Гц, 2H), 7,64 (с, 1H), 7,71-7,79 (м, 4H), 9,08 (с, 1H), 14,44 (уш.с, 1Н).
13C ЯМР (100 МГц, ДМСО-d6): 24,1, 36,0, 47,9, 70,6, 89,3, 109,2, 117,4, 118,9, 121,3, 122,4, 123,7, 124,8, 126,2, 127,5, 131,1, 134,3, 138,5, 142,5, 147,6.
ПРИМЕР 18: Получение 1-{2-(имидазол-1-ил)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,69 (м, 1H), 2,79 (м, 1H), 4,02 (м, 2H), 5,16 (д, J=12,8 Гц, 1H), 5,23 (д, J=12,8 Гц, 1H), 6,86 (с, 1H), 7,08 (с, 1H), 7,32 (д, J=8,4 Гц, 2H), 7,42-7,44 (м, 3H), 7,51 (с, 1H), 7,54 (д, J=7,8 Гц, 1H), 7,61 (д, J=7,8 Гц, 1H), 8,29 (с, 1Н).
ПРИМЕР 19: Получение гидрохлорида 1-{2-(имидазол-1-ил)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,80 (м, 1H), 2,93 (м, 1H), 4,22 (м, 2H), 5,17 (д, J=13,4 Гц, 1H), 5,26 (д, J=13,4 Гц, 1H), 7,41 (д, J=8,4 Гц, 2H), 7,56-7,61 (м, 3H), 7,68-7,78 (м, 4H), 7,82 (с, 1H), 9,00 (с, 1H), 14,80 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 38,1, 44,5, 71,3, 88,9, 110,7, 118,4, 119,2, 121,8, 122,9, 125,6, 126,4, 128,3, 131,9, 132,0, 135,0, 139,3, 142,3, 147,3.
ПРИМЕР 20: Получение 1-фенил-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,74 (т, J=6,8 Гц, 2H), 4,10 (т, J=6,8 Гц, 2H), 5,15 (д, J=13,0 Гц, 1H), 5,23 (д, J=13,0 Гц; 1H), 6,06 (с, 1H), 7,12 (с, 1H), 7,27 (д, J=8,0 Гц, 2H), 7,32-7,40 (м, 5H), 7,46 (с, 1H), 7,51 (д, J=7,6 Гц, 1H).
ПРИМЕР 21: Получение гидрохлорида 1-фенил-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,75 (м, 2H), 3,99 (т, J=7,6 Гц, 2H), 5,18 (д, J=13,4 Гц, 1H), 5,28 (д, J=13,4 Гц, 1H), 6,11 (с, 1H), 7,25 (м, 1H), 7,32-7,36 (м, 3H), 7,58-7,60 (м, 3H), 7,74-7,78 (м, 3H), 12,00 (уш.с, 1Н).
ПРИМЕР 22: Получение 1-{3-(диметиламино)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,51 (м, 1H), 1,64 (м, 1H), 2,17 (м, 1H), 2,29 (с, 3H), 2,32 (м, 1H), 2,37 (с, 6H), 2,56 (с, 2H), 5,14 (д, J=13,2 Гц, 1H), 5,19 (д, J=13,2 Гц, 1H), 7,12 (д, J=7,6 Гц, 2H), 7,33 (д, J=7,6 Гц, 2H), 7,43-7,46 (м, 2H), 7,56 (д, J=8,4 Гц, 1H).
ПРИМЕР 23: Получение гидрохлорида 1-{3-(диметиламино)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,46 (м, 1H), 1,55 (м, 1H), 2,14-2,31 (м, 5H), 2,59 (с, 6H), 2,99 (м, 2H), 5,12 (д, J=13,0 Гц, 1H), 5,21 (д, J=13,0 Гц, 1H), 7,12 (д, J=7,6 Гц, 2H), 7,42 (д, J=7,6 Гц, 2H), 7,70-7,77 (м, 3H), 10,82 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 19,0, 20,5, 36,9, 41,8, 56,2, 71,0, 90,4, 110,2, 118,6, 122,9, 124,5, 125,4, 128,8, 131,7, 136,1, 139,5, 140,6, 149,1.
ПРИМЕР 24: Получение 1-{2-(диметиламино)этил}-1-[4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,26 (с, 6H), 2,29 (с, 3H), 2,32-2,50 (м, 4H), 5,13 (д, J=12,8 Гц, 1H), 5,17 (д, J=12,8 Гц, 1H), 7,13 (д, J=80 Гц, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,43 (д, J=8,0 Гц, 1H), 7,47 (с, 1H), 7,57 (д, J=8,0 Гц, 1H).
ПРИМЕР 25: Получение гидрохлорида 1-{2-(диметиламино)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,24 (с, 3H), 2,67 (с, 6H), 2,70-2,87 (м, 4H), 5,15 (д, J=13,2 Гц, 1H), 5,23 (д, J=13,2 Гц, 1H), 7,16 (д, J=8,4 Гц, 2H), 7,45 (д, J=8,4 Гц, 2H), 7,74-7,81 (м, 3H), 11,13 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 20,6, 34,1, 41,8, 52,5 71,1, 89,0, 110,6, 118,5, 122,9, 124,4, 125,6, 129,0, 131,9, 136,6, 139,3, 139,7, 148,2.
ПРИМЕР 26: Получение 1-{3-(имидазол-1-ил)pпропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,72 (м, 1H), 1,77 (м, 1H), 1,99 (м, 1H), 2,16 (м, 1H), 2,29 (с, 3H), 3,97 (т, J=7,0 Гц, 2H), 5,14 (м, 2H), 6,84 (с, 1H), 7,07 (с, 1H), 7,11 (д, J=8,4 Гц, 2H), 7,25 (д, J=8,4 Гц, 2H), 7,32 (д, J=7,8 Гц, 1H), 7,46 (с, 1H), 7,55 (д, J=7,8 Гц, 1H), 7,69 (с, 1H).
ПРИМЕР 27: Получение гидрохлорида 1-{3-(имидазол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,61 (м, 1H), 1,70 (м, 1H), 2,16 (м, 2H), 2,20 (с, 3H), 4,19 (м, 2H), 5,09 (д, J=13,0 Гц, 1H), 5,18 (д, J=13,0 Гц, 1H), 7,10 (д, J=7,6 Гц, 2H), 7,37 (д, J=7,6 Гц, 2H), 7,64-7,93 (м, 5H), 9,24 (с, 1H), 15,17 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 20,7, 25,1, 36,9, 48,5, 71,1, 90,4, 110,4, 118,7, 119,6, 121,9, 123,1, 124,6, 125,6, 129,0, 131,9, 135,0, 136,3, 139,8, 140,7, 149,2.
ПРИМЕР 28: Получение 1-{2-(имидазол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,31 (с, 3H), 2,57 (м, 1H), 2,74 (м, 1H), 3,96 (м, 2H), 5,16 (д, J=13,2 Гц, 1H), 5,21 (д, J=13,2 Гц, 1H), 6,82 (с, 1H), 7,02 (с, 1H), 7,15 (д, J=8,0 Гц, 2H), 7,33 (д, J=8,0 Гц, 2H), 7,44 (д, J=8,0 Гц, 1H), 7,49 (с, 1H), 7,58 (д, J=8,0 Гц, 1H), 7,69 (с, 1H).
ПРИМЕР 29: Получение гидрохлорида 1-{2-(имидазол-1-ил)этил}-1-[4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,23 (с, 3H), 2,80 (м, 1H), 2,95 (м, 1H), 4,11 (м, 2H), 5,15 (д, J=13,4 Гц, 1H), 5,25 (д, J=13,4 Гц, 1H), 7,13 (д, J=7,2 Гц, 2H), 7,44 (д, J=7,2 Гц, 2H), 7,57 (с, 1H), 7,70-7,77 (м, 3H), 7,78 (с, 1H), 9,08 (с, 1H), 14,89 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 20,6, 40,1, 44,7, 71,2, 89,2, 110,4, 118,6, 119,2, 121,8, 122,9, 124,3, 125,5 128,9, 131,8, 134,9, 136,5, 139,4, 140,2, 148,1.
ПРИМЕР 30: Получение 1-{3-(пиразол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,79 (м, 1H), 1,88 (м, 1H), 2,05 (м, 1H), 2,20 (м, 1H), 2,28 (с, 3H), 4,20 (т, J=6,8 Гц, 2H), 5,14 (м, 2H), 6,26 (с, 1H), 7,11 (д, J=8,0 Гц, 2H), 7,23-7,35 (м, 4H), 7,45 (с, 1H), 7,52-7,56 (м, 2H).
ПРИМЕР 31: Получение гидрохлорида 1-{3-(пиразол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,57 (м, 1H), 1,66 (м, 1H), 2,09 (м, 2H), 2,18 (с, 3H), 4,13 (м, 2H), 5,06 (д, J=13,2 Гц, 1H), 5,13 (д, J=13,2 Гц, 1H), 6,29 (с, 1H), 7,07 (д, J=7,4 Гц, 2H), 7,33 (д, J=7,4 Гц, 2H), 7,58-7,70 (м, 4H), 7,79 (с, 1H), 13,47 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 20,6, 25,2, 37,1, 50,9, 70,9, 90,4, 105,3, 110,2, 118,7, 122,9, 124,5, 125,4, 128,8, 130,8, 131,8, 136,1, 137,3, 139,7, 140,7, 149,1.
ПРИМЕР 32: Получение 1-{2-(пиразол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,29 (с, 3H), 2,79 (м, 2H), 4,15 (м, 2H), 5,19 (м, 2H), 6,11 (с, 1H), 7,13 (д, J=8,4 Гц, 2H), 7,17 (с, 1H), 7,34 (д, J=8,4 Гц, 2H), 7,39 (д, J=7,6 Гц, 1H), 7,45-7,53 (м, 3H).
ПРИМЕР 33: Получение гидрохлорида 1-{2-(пиразол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,21 (с, 3H), 277 (м, 2H), 4,05 (м, 2H), 5,13 (д, J=12,8 Гц, 1H), 5,24 (д, J=12,8 Гц, 1H), 6,18 (с, 1H), 7,12 (д, J=7,0 Гц, 2H), 7,43 (д, J=7,0 Гц, 2H), 7,51 (с, 1H), 7,60-7,80 (м, 4H), 11,81 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 20,6, 40,2, 47,1, 71,2, 89,3, 105,2, 110,3, 118,6, 122,9, 124,4, 125,4, 128,9, 130,6, 131,8, 136,3, 137,4, 139,4, 140,4, 148,4.
ПРИМЕР 34: Получение 1-(4-диметиламинофенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,32 (м, 1H), 1,50 (м, 1H), 2,08-2,27 (м, 10H), 2,91 (с, 6H), 5,29 (м, 2H), 6,66 (д, J=7,2 Гц, 2H), 7,27 (д, J=7,2 Гц, 2H), 7,35 (д, J=8,0 Гц, 1H), 7,47 (с, 1H), 7,55 (д, J=8,0 Гц, 1H).
ПРИМЕР 35: Получение оксалата 1-(4-диметиламинофенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,41 (м, 1H), 1,53 (м, 1H), 2,14 (м, 2H), 2,62 (с, 6H), 2,83 (с, 6H), 2,97 (т, J=8,0 Гц, 2H), 5,08 (д, J=13,6 Гц, 1H), 5,17 (д, J=13,6 Гц, 1H), 6,65 (д, J=8,0 Гц, 2H), 7,28 (д, J=8,0 Гц, 2H), 7,62 (д, J=7,6 Гц, 1H), 7,75 (д, J=7,6 Гц, 1H), 7,77 (с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 19,3, 30,7, 36,8, 42,1, 56,6, 70,8, 90,3, 110,0, 112,0, 118,7, 122,8, 125,3, 125,4, 130,9, 131,7, 139,6, 149,3, 149,7, 164,1.
ПРИМЕР 36: Получение гидрохлорида 1-(4-диметиламинофенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,44 (м, 1H), 1,52 (м, 1H), 2,23 (т, J=7,2 Гц, 2H), 2,69 (с, 3H), 2,70 (с, 3H), 2,94 (с, 6H), 3,00 (м, 2H), 5,13 (д, J=13,4 Гц, 1H), 5,21 (д, J=13,4 Гц, 1H), 6,64 (д, J=7,8 Гц, 2H), 7,25 (д, J=7,8 Гц, 2H), 7,70-7,80 (м, 3H), 9,91 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 19,3, 36,8, 41,8, 41,9, 56,2, 71,2, 90,2, 110,5, 112,0, 118,6, 122,9, 125,6, 126,0, 130,9, 131,9, 139,6, 148,4, 149,3.
ПРИМЕР 37: Получение 1-(4-диметиламинофенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц; CDCl3): 1,69 (м, 1H), 1,80 (м, 1H), 2,01 (м, 1H), 2,17 (м, 1H), 2,92 (с, 6H), 3,92 (м, 2H), 5,30 (м, 2H), 6,66 (д, J=7,4 Гц, 2H), 6,83 (с, 1H), 7,04 (с, 1H), 7,19-7,23 (м, 3H), 7,41 (с, 1H), 7,48 (с, 1H), 7,56 (д, J=7,6 Гц, 1H).
ПРИМЕР 38: Получение гидрохлорида 1-(4-диметиламинофенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,62 (м, 1H), 1,72 (м, 1H), 2,12 (м, 2H), 2,88 (с, 6H), 4,15 (т, J=7,0 Гц, 2H), 5,09 (д, J=13,6 Гц, 1H), 5,15 (д, J=13,6 Гц, 1H), 6,82 (д, J=8,2 Гц, 2H), 7,34 (д, J=8,2 Гц, 2H), 7,62-7,94 (м, 5H), 9,08 (с, 1H).
ПРИМЕР 39: Получение 1-{3-(диметиламино)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,56 (м, 1H), 1,73 (м, 1H), 2,25 (м, 1H), 2,35-2,50 (м, 7H), 2,62 (м, 2H), 5,19 (д, J=13,2 Гц, 1H), 5,24 (д, J=13,2 Гц, 1H), 6,92-6,95 (м, 2H), 7,19 (м, 1H), 7,41 (д, J=7,6 Гц, 1H), 7,50 (с, 1H), 7,60 (д, J=7,6 Гц, 1Н).
ПРИМЕР 40: Получение оксалата 1-{3-(диметиламино)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,41 (м, 1H), 1,59 (м, 1H), 2,26 (т, J=7,6 Гц, 2H), 2,62 (с, 6H), 2,97 (т, J=7,8 Гц, 2H), 5,16 (д, J=13,2 Гц, 1H), 5,21 (д, J=13,2 Гц, 1H), 6,99 (м, 1H), 7,12 (д, J=3,6 Гц, 1H), 7,40 (д, J=5,2 Гц, 1H), 7,64 (д, J=7,8 Гц, 1H), 7,80 (д, J=7,8 Гц, 1H), 7,83 (с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 19,2, 37,5, 42,1, 56,4, 71,4, 89,2, 110,7, 118,6, 122,7, 122,8, 124,9, 125,7, 127,4, 132,0, 139,3, 148,1, 148,7, 164,3.
ПРИМЕР 41: Получение гидрохлорида 1-{3-(диметиламино)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,45 (м, 1H), 1,56 (м, 1H), 2,29 (т, J=1,6 Гц, 2H), 2,64 (с, 3H), 2,65 (с, 3H), 3,01 (м, 2H), 5,17 (д, J=13,2 Гц 1H), 5,22 (д, J=13,2 Гц, 1H), 7,00 (м, 1H), 7,13 (д, J=3,6 Гц, 1H), 7,40 (д, J=5,2 Гц, 1H), 7,67 (д, J=7,6 Гц, 1H), 7,82 (д, J=8,2 Гц, 1H), 7,85 (с, 1H), 9,92 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 18,9, 37,5, 41,7, 41,8, 56,1, 71,4, 89,2, 110,7, 118,5, 122,7, 122,8, 124,8, 125,7, 127,3, 132,0, 139,2, 148,1, 148,7.
ПРИМЕР 42: Получение 1-{2-диметиламино)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,58-2,70 (м, 8H), 2,80 (м, 2H), 5,19 (д, J=13,0 Гц, 1H), 5,24 (д, J=13,0 Гц, 1H), 6,92-7,00 (м, 2H), 7,22 (м, 1H), 7,47-7,52 (м, 2H), 7,63 (д, J=8,0 Гц, 1H).
ПРИМЕР 43: Получение гидрохлорида 1-{2-(диметиламино)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,60-2,78 (м, 8H), 2,82 (м, 2H), 5,18 (д, J=13,4 Гц, 1H), 5,23 (д, J=13,4 Гц, 1H), 7,02 (м, 1H), 7,25 (д, J=28 Гц, 1H), 7,42 (д, J=4,4 Гц, 1H), 7,69 (д, J=7,6 Гц, 1H), 7,82-7,85 (м, 2H), 11,21 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 34,5, 41,8, 41,9, 52,3, 71,4, 87,8, 111,0, 118,4, 122,8, 123,0, 125,3, 125,8, 127,5, 132,2, 138,9, 147,4, 147,3.
ПРИМЕР 44: Получение 1-{3-(имидазол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,78 (м, 1H), 1,92 (м, 1H), 2,10 (м, 1H), 2,28 (м, 1H), 407 (т, J=7,0 Гц, 2H), 5,18 (д, J=12,8 Гц, 1H), 5,25 (д, J=12,8 Гц, 1H), 6,86 (м, 1H), 6,91 (с, 1H), 6,95 (м, 1H), 7,14 (с, 1H), 7,22 (м, 1H), 7,32 (д, J=8,2 Гц, 1H), 7,52 (с, 1H), 7,61 (д, J=8,2 Гц, 1H), 795 (с, 1H).
ПРИМЕР 45: Получение оксалата 1-{3-(имидазол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,55 (м, 1H), 1,75 (м, 1H), 2,18 (м, 2H), 4,05 (т, J=7,0 Гц, 2H), 5,16 (м, 2H), 6,98 (м, 1H), 7,06 (д, J=3,2 Гц, 1H), 7,25 (с, 1H), 7,38 (д, J=4,8 Гц, 1H), 7,41 (с, 1H), 7,60 (д, J=7,8 Гц, 1H), 7,80 (д, J=8,0 Гц, 1H), 7,81 (с, 1H), 8,34 (с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 25,3, 37,6, 47,0, 71,4, 89,2, 110,7, 118,5, 120,4, 122,6, 122,7, 123,8, 124,8, 125,7, 127,3, 132,0, 136,0, 139,2, 148,1, 148,7, 162,7.
ПРИМЕР 46: Получение гидрохлорида 1-{3-(имидазол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,61 (м, 1H), 1,79 (м, 1H), 2,21 (м, 2H), 4,02 (т, J=7,0 Гц, 2H), 5,20 (м, 2H), 6,98 (м, 1H), 7,08 (д, J=3,6 Гц, 1H), 7,39 (д, J=4,8 Гц, 1H), 7,63 (д, J=7,8 Гц, 1H), 7,65 (с, 1H), 7,72 (с, 1H), 7,81 (д, J=7,8 Гц; 1H), 7,83 (с, 1H), 9,09 (с, 1H), 14,42 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 24,8, 37,3, 48,2, 71,4, 89,1, 110,7, 118,5, 119,5, 121,7, 122,7, 122,8, 124,8, 125,7, 127,3, 132,0, 134,9, 139,2, 148,0, 148,6.
ПРИМЕР 47: Получение 1-{2-(имидазол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,66 (м, 1H), 2,84 (м, 1H), 4,07 (м, 2H), 5,22 (д, J=13,2 Гц, 1H), 5,28 (д, J=13,2 Гц, 1H), 6,88 (с, 1H), 6,96-6,99 (м, 2H), 7,07 (с, 1H), 7,25 (м, 1H), 7,43 (д, J=8,0 Гц, 1H), 7,55 (с, 1H), 7,63 (д, J=8,0 Гц, 1H), 7,90 (с, 1H).
ПРИМЕР 48: Получение гидрохлорида 1-{2-(имидазол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,95 (м, 2H), 4,16 (м, 2H), 5,21 (м, 2H), 7,00 (м, 1H), 7,22 (д, J=2,4 Гц, 1H), 7,41 (д, J=4,4 Гц, 1H), 7,57-7,75 (м, 5H), 9,12 (с, 1H), 14,94 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 40,1, 44,5, 71,5, 88,0, 110,8, 118,5 119,1, 121,8, 122,8, 123,0, 125,1, 125,8, 127,5, 132,0, 134,9, 139,0, 147,2, 148,0.
ПРИМЕР 49: Получение 1-{3-(пиразол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,82 (м, 1H), 1,99 (м, 1H), 2,14 (м, 1H), 2,29 (м, 1H), 4,26 (т, J=7,0 Гц, 2H), 5,18 (д, J=13,0 Гц, 1H), 5,24 (д, J=13,0 Гц, 1H), 6,30 (с, 1H), 6,86 (с, 1H), 6,93 (м, 1H), 7,20 (м, 1H), 7,32 (д, J=8,0 Гц, 1H), 7,40 (с, 1H), 7,51 (с, 1H), 7,57-7,61 (м, 2H).
ПРИМЕР 50: Получение гидрохлорида l-{3-(пиразол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,56 (м, 1H), 1,74 (м, 1H), 2,16 (м, 2H), 4,14 (м, 2H), 5,13 (м, 2H), 6,26 (с, 1H), 6,94 (с, 1H), 7,03 (с, 1H), 7,33 (с, 1H), 7,53-7,57 (м, 2H), 7,73-7,79 (м, 2H), 8,27 (с, 1H), 13,64 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 25,1, 37,8, 50,8, 71,4, 89,3, 105,3, 110,9, 118,6, 121,6, 122,7, 124,8, 125,7, 127,3, 130,7, 132,0, 137,4, 139,3, 148,2, 148,8.
ПРИМЕР 51: Получение 1-{2-(пиразол-1-ил)этил}-1 (2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,87 (м, 2H), 4,22 (м, 2H), 5,26 (м, 2H), 6,13 (с, 1H), 6,92-6,96 (м, 2H), 7,19-7,22 (м, 2H), 7,34 (д, J=7,6 Гц, 1H), 7,47 (с, 1H), 7,51 (с, 1H), 7,55 (д, J=7,6 Гц, 1H).
ПРИМЕР 52: Получение гидрохлорида 1-{2-(пиразол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,83 (м, 2H), 4,11 (м, 2H), 5,20 (м, 2H), 6,19 (с, 1H), 6,95 (с, 1H), 7,15 (с, 1H), 7,36 (с, 1H), 7,50-7,59 (м, 2H), 7,68-7,76 (м, 2H), 8,23 (с, 1H), 14,18 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 40,5, 46,9, 71,7, 88,1, 105,4, 110,7, 118,6, 122,8, 122,9, 125,0, 125,7, 127,5, 131,1, 132,0, 133,3, 139,0, 147,5, 148,4.
ПРИМЕР 53: Получение 1-(4-фторфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,68 (м, 1H), 1,76 (м, 1H), 1,99 (м, 1H), 2,14 (м, 1H), 3,96 (т, J=6,8 Гц, 2H), 5,12 (м, 2H), 6,82 (с, 1H), 6,98 (м, 2H), 7,05 (с, 1H), 7,28-7,38 (м, 3H), 7,48 (с, 1H), 7,57 (д, J=8,0 Гц, 1H), 7,64 (с, 1H).
ПРИМЕР 54: Получение гидрохлорида 1-(4-фторфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,62 (м, 1H), 1,70 (м, 1H), 2,17 (м, 2H), 4,15 (т, J=7,0 Гц, 2H), 5,13 (д, J=13,6 Гц, 1H), 5,19 (д, J=13,6 Гц, 1H), 7,15 (м, 2H), 7,55 (м, 2H), 7,64-7,80 (м, 5H), 9,09 (с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 24,9, 36,8, 48,3, 71,0, 90,1, 110,4, 115,0 (д, 2JCf = 21 Гц), 118,5, 119,5, 121,7, 123,0, 125,5, 126,7 (д, 3JCF = 8 Гц), 131,9, 134,9, 139,6, 139,7, 148,5, 161,0 (д, 1JCF = 242 Гц).
ПРИМЕР 55: Получение 1-(4-фторфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,79 (м, 1H), 2,91 (м, 1H), 4,13 (м, 2H), 5,15 (д, J=13,0, Гц, 1H), 5,23 (д, J=13,0 Гц, 1H), 6,93 (с, 1H), 7,03 (м, 2H), 7,18 (с, 1H), 7,48-7,51 (м, 3H), 7,61-7,68 (м, 2H), 9,03 (с, 1H).
ПРИМЕР 56: Получение гидрохлорида 1-(4-фторфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,81 (м, 1H), 2,90 (м, 1H), 4,10 (м, 2H), 5,17 (д, J=13,4 Гц, 1H), 5,25 (д, J=13,4 Гц, 1H), 7,18 (м, 2H), 7,56-7,62 (м, 3H), 7,76-7,78 (м, 3H), 7,81 (с, 1H), 8,95 (с, 1H), 14,00 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 40,1, 44,6, 71,3, 89,0, 110,6, 115,1 (д, 2JCF=21 Гц), 118,5, 119,2, 121,8, 122,9, 125,6, 126,6 (д, 3JCF=8 Гц), 131,9, 135,0, 139,3, 147,6, 162,2 (д, 1JCF=242 Гц).
ПРИМЕР 57: Получение 1-(4-фторфенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,74 (м, 1H), 1,90 (м, 1H), 2,04 (м, 1H), 2,15 (м, 1H), 4,09 (м, 2H), 5,10 (д, J=13,0 Гц, 1H), 5,16 (д, J=13,0 Гц, 1H), 6,20 (с, 1H), 6,39 (с, 1H), 6,97 (м, 2H), 7,23-7,35 (м, 4H), 7,46 (с, 1H), 7,55 (д, J=7,6 Гц, 1H).
ПРИМЕР 58: Получение гидрохлорида 1-(4-фторфенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,55 (м, 1H), 1,62 (м, 1H), 2,12 (т, J=7,6 Гц, 2H), 4,05 (т, J=7,2 Гц, 2H), 5,10 (д, J=13,4 Гц, 1H), 5,16 (д, J=13,4 Гц, 1H), 6,17 (м, 1H), 6,38 (м, 1H), 7,14 (м, 2H), 7,37 (м, 1H), 7,52 (м, 2H), 7,63-7,78 (м, 3H).
ПРИМЕР 59: Получение 1-(4-фторфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,76 (м, 2H), 4,12 (м, 2H), 5,16 (д, J=12,8 Гц, 1H), 5,23 (д, J=12,8 Гц, 1H), 6,08 (с, 1H), 7,00 (м, 2H), 7,14 (с, 1H), 7,35 (д, J=7,6 Гц, 1H), 7,40-7,44 (м, 3H), 7,48 (с, 1H), 7,53 (д, J=7,6 Гц, 1H).
ПРИМЕР 60: Получение гидрохлорида 1-(4-фторфенил)-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,77 (м, 2H), 402 (д, J=70 Гц, 2H), 5,17 (д, J=13,4 Гц, 1H), 5,25 (д, J=13,4 Гц, 1H), 6,15 (с, 1H), 7,14 (м, 2H), 7,43 (с, 1H), 7,59-7,65 (м, 3H), 7,73-7,77 (м, 3H), 12,03 (уш.с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 40,4, 47,0, 71,3, 89,1, 105,0, 110,5, 115,1 (д, 2JCF =20 Гц), 118,6, 123,0, 125,5, 126,7 (д, 3JCF =8 Гц), 130,1, 131,9, 137,8, 139,4, 139,6 (д, 4JCF =3Гц), 148,1, 161,1 (д, 1JCF =242 Гц).
ПРИМЕР 61: Получение 1-(4-хлорфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,72 (м, 2H), 2,00 (м, 1H), 2,11 (м, 1H), 3,97 (т, J=7,0 Гц, 2H), 5,14 (м, 2H), 6,83 (с, 1H), 7,06 (с, 1H), 7,24-7,32 (м, 5H), 7,48 (с, 1H), 7,57 (д, J=8,0 Гц, 1H), 7,66 (с, 1H).
ПРИМЕР 62: Получение гидрохлорида 1-(4-хлорфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,62 (м, 2H), 2,16 (м, 2H), 4,14 (т, J=70 Гц, 2H), 5,13 (д, J=13,6 Гц, 1H), 5,19 (д, J=13,6 Гц, 1H), 7,39 (д, J=8,6 Гц, 2H), 7,54 (д, J=8,6 Гц, 2H), 7,64 (с, 1H), 7,71-7,80 (м, 4H), 9,08 (с, 1H).
13C ЯМР (100 МГц, ДМСО-d6): 24,8, 36,6, 48,3, 71,1, 90,0, 110,5, 118,5, 119,5, 121,7, 123,0, 125,6, 126,6, 128,2, 131,8, 131,9, 134,9, 139,6, 142,5, 148,3.
ПРИМЕР 63: Получение 1-(4-хлорфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,60 (м, 1H), 2,71 (м, 1H), 3,96 (м, 2H), 5,15 (д, J=13,0 Гц, 1H), 5,22 (д, J=13,0 Гц, 1H), 6,81 (с, 1H), 7,01 (с, 1H), 7,30-7,41 (м, 4H), 7,45 (д, J=8,4 Гц, 1H), 7,51 (с, 1H), 7,60 (д, J=8,4 Гц, 1H), 7,74 (с, 1H).
ПРИМЕР 64: Получение гидрохлорида 1-(4-хлорфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 2,81 (м, 1H), 2,91 (м, 1H), 4,12 (м, 2H), 5,17 (д, J=13,4 Гц, 1H), 5,25 (д, J=13,4 Гц, 1H), 7,42 (д, J=7,2 Гц, 2H), 7,57-7,61 (м, 3H), 7,68-7,78 (м, 3H), 7,82 (с, 1H), 8,97 (с, 1H), 14,00 (уш.с, 1Н).
13C ЯМР (100 МГц, ДМСО-d6): 40,1, 44,6, 71,4, 89,0, 110,7, 118,5, 119,2, 121,8, 122,9, 125,6, 126,5, 128,3, 131,9, 132,1, 135,0, 139,3, 142,1, 147,3.
ПРИМЕР 65: Получение 1-(4-хлорфенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 1,74 (м, 1H), 1,83 (м, 1H), 2,03 (м, 1H), 2,15 (м, 1H), 4,10 (м, 2H), 5,10 (д, J=13,0 Гц, 1H), 5,15 (д, J=13,0 Гц, 1H), 6,20 (с, 1H), 7,24-7,32 (м, 5H), 7,45-7,46 (м, 2H), 7,55 (д, J=8,0 Гц, 1H), 7,73 (с, 1H).
ПРИМЕР 66: Получение гидрохлорида 1-(4-хлорфенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 1,59 (м, 2H), 2,12 (м, 2H), 4,05 (д, J=7,2 Гц, 2H), 5,11 (д, J=13,4 Гц, 1H), 5,17 (д, J=13,4 Гц, 1H), 6,17 (м, 1H), 7,35-7,38 (м, 3H), 7,52 (д, J=8,4 Гц, 2H), 7,63-7,69 (м, 2H), 7,76-7,78 (м, 2H).
13C ЯМР (100 МГц, ДМСО-d6): 25,2, 37,1, 50,8, 71,1, 90,2, 105,0, 110,5, 118,6, 122,9, 125,6, 126,6, 128,2, 130,1, 131,9, 133,3, 137,8, 139,6, 142,7, 148,5.
ПРИМЕР 67: Получение 1-(4-хлорфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, CDCl3): 2,78 (м, 2H), 4,14 (т, J=7,6 Гц, 2H), 5,16 (д, J=13,2 Гц, 1H), 5,23 (д, J=13,2 Гц, 1H), 6,09 (с, 1H), 7,14 (с, 1H), 7,27-7,43 (м, 5H), 7,44 (с, 1H), 7,47 (с, 1H), 7,53 (с, 1H).
ПРИМЕР 68: Получение гидрохлорида 1-(4-хлорфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила
1H ЯМР (400 МГц, ДМСО-d6): 27,5 (м, 2H), 3,98 (м, 2H), 5,18 (д, J=14,0 Гц, 1H), 5,28 (д, J=14,0 Гц, 1H), 6,10 (м, 1H), 7,33-7,41 (м, 3H), 7,58-7,63 (м, 3H), 7,52-7,79 (м, 3H).
13C ЯМР (100 МГц, ДМСО-d6): 40,3, 46,9, 71,4, 89,1, 104,9, 110,6, 118,6, 122,9, 125,4 126,5, 128,3, 129,9, 131,9, 137,9, 139,4, 142,4, 143,8, 147,8.
Структуры соединений примеров 1-68 представлены в таблицах 1 и 2 ниже.
ПРИМЕР ТЕСТИРОВАНИЯ 1: Оценка эффекта отсроченной эякуляции
Соединения, полученные в примерах выше, исследовали для определения того, имеют ли они влияние на отсроченную эякуляцию. Измерение проводили с применением модели на животном согласно способу, описанному в Yonezawa et al., Life Sci. 2000, 67(25) p3031-9. Применяли самцов крыс Вистара (Wistar) с массой тела 240-260 г. Каждое соединение суспендировали в 1% HPMC и затем вводили перорально каждому животному. Через 60 мин животных анестезировали и закрепляли. Через 20 мин вводили внутрибрюшинно пара-хлорамфетамин (p-PCA) в дозе 5 мг/кг для того, чтобы индуцировать эякуляцию. Затем эякуляторный отклик на p-PCA у анастезированных крыс наблюдали в течение 30 мин. Эякуляторный отклик считался возбужденным, если имели место ритмичные сокращения бульбокавернозной мышцы и истечение спермы. Шесть или более животных применяли для каждого соединения. Тест на экстракт Фишера проводили для сравнения соотношения реагирующих крыс (эякулирующих крыс) для определения значимости различий между обрабатываемой группой и контрольной группой. Время до достижения эякуляции выражали в виде: значение ± стандартное отклонение.
Соединения, полученные в Примерах 1-68, как было найдено, имеют хорошие подавляющие эффекты на эякуляцию. Эффекты ингибирования эякуляции репрезентативных соединений приведены в таблице 3 ниже. Каждое тестовое соединение вводилось в дозе 50 мг/кг. Эякуляция происходила у всех семи животных контрольной группы. В противоположность этому, введение соединений, полученных в Примерах 1-68, значительно уменьшало число реагирующих крыс. Эти результаты показывают, что соединения по настоящему изобретению являются очень эффективными для ингибирования эякуляции. Циталопрам, который представляет собой традиционное SSRI-лекарство, который, как известно, имеет эффект отсроченной эякуляции, применяли в качестве контрольного соединения.
Задержка: время (с) для проявления эякуляторного отклика.
ПРИМЕР ТЕСТИРОВАНИЯ 2: Определение периодов полувыведения соединений на крысах
Периоды полувыведения соединений по настоящему изобретению определяли по следующей процедуре. Каждое соединение вводили перорально самцам крыс Спрейга-Доули (Sprague-Dawley) с массой тела приблизительно 270 г при дозе 10 мг/кг. 5 мг/кг каждого соединения суспендировали в 0,5% метилцеллюлозе и затем вводили крысам. Образцы крови собирали через 0,017, 0,083, 0,25, 0,5, 1, 2, 3, 5, 7 и 24 часа после введения и центрифугировали при 1000 об/мин в течение 3 мин для отделения плазмы. Концентрацию каждого соединения в плазме определяли с применением жидкостной хроматографии высокого давления, которую проводили с подвижной фазой 10 мМ формиата аммония (pH 3,0) и ацетонитрила (50:50), колонки Atlanis dC18 (2,1×100 мМ, 3 мкм), и скорости потока 0,2 мл/мин.
Результаты представлены в таблице 4 ниже. Настоящие соединения имели величины Tmax (время достижения максимальной концентрации в плазме), подобные величине для циталопрама, который представляет собой традиционное SSRI-лекарство, который, как известно, имеет эффект отсроченной эякуляции, но величины времени полувыведения являлись в три раз более короткими, чем период полувыведения циталопрама. Эти результаты показывают, что настоящие соединения быстро абсорбируются в теле и быстро выводятся из тела, что уменьшает риск возможности побочных эффектов и улучшает безопасность.
ПРИМЕР ТЕСТИРОВАНИЯ 3: Исследование механизма дейстия представленных соединений
Механизм действия представленных производных исследовали путем оценки их подавляющих эффектов на нейромедиаторы и сродство к связыванию лиганда серотониновых рецепторов.
Во-первых, влияния настоящих соединений на клеточный захват допамина, норэпинефрина и серотонина исследовали с человеческими линиями клеток CHO-1, MDCK и HEK-293. К каждой клеточной линии дозировали от 10-5 мкМ до 104 мкМ соединений Примеров 2, 35, 40 и 45 и затем инкубировали с [3H]допамином,
[3H]норэпинефрином и [3H]серотонином в буфере. Через 10 мин количество каждого нйромедиатора, захваченного клетками, определяли путем измерения радиоактивности с применением жидкостного сцинтилляционного счетчика (LSC).
Результаты представлены в таблице 5 ниже. Настоящие соединения, как было найдено, не влияют на обратный захват допамина или норэпинефрина, но, как было установлено, селективно воздействуют на обратный захват серотонина, ингибируя его.
Кроме того, лигандное связывание с 5HT1A, 5-HT1B и 5-HT2C рецепторами и 5-HT транспортером исследовали на человеческих рекомбинантных CHO клетках, церебральных корковых клетках, полученных от крыс Вистара (Wistar), человеческих рекомбинантных CHO-K1 клетках и человеческих рекомбинантных HEK-293 клетках. К каждой клеточной линии дозировали от 10-5 мкМ до 104 мкМ соединений Примеров 2, 35, 40 и 45 и затем инкубировали с радиоактивно-меченным лигандом для конкурентного связывания. Применялись лиганды [3H]-8-OH-DPAT, [125I]-цианопиндолол, [3H]месулергин и [3H]пароксетин, соответственно. Исследование конкурентного связывания проводили в буфере 50 мМ Трис-HCl при 25°C или 37°C в течение 60-90 мин.
Радиолигандное исследование показало, что настоящие соединения высоко ассоциированы с 5-HT2C рецептором и 5-HT транспортером. Эти результаты показывают, что производные 1,3-дигидро-5-изобензофуранкарбонитрила ингибируют эякуляторный отклик путем селективного ингибирования обратного захвата серотонина действием транспортера обратного захвата серотонина, присутствующего в пресинаптическом нейроне, что представляет собой один из нескольких механизмов центральной нервной системы, вовлеченных в процесс эякуляции.
транспортер
ПРИМЕР ТЕСТИРОВАНИЯ 4: Тест на острую токсичность
Для исследования безопасности настоящих производных в сравнении с контрольным лекарством, тест на острую токсичность проводили с 5-недельными крысами Спрейга-Доули (Sprague-Dawley) (SD). Настоящие производные и циталопрам индивидуально вводились перорально и внутривенно SD-крысам как отдельная доза. Затем крыс исследовали на смертность. Результаты представлены в таблице 6 ниже.
Как показано в таблице 6, минимальные летальные дозы соединений примеров 2, 35, 40 и 45 являются более высокими, чем дозы циталопрама. Это означает, что соединения примеров 2, 35, 40 и 45 являются более безопасными, чем циталопрам. В особенности, было найдено, что соединение примера 2 более чем в два раза безопаснее циталопрама.
ПРИМЕР ТЕСТИРОВАНИЯ 5: Тест на кардиотоксичность
Для исследования безопасности настоящих производных в сравнении с контрольным лекарством, проводили исследование на hERG (ген hERG), которое представляло собой репрезентативный тест на исследование медицинской безопасности. Для проведения этого теста был запрошен институт MDS Pharma, который проводил этот тест. Результаты представлены в таблице 7 ниже.
Как представлено в таблице 7, IC50 величины примера 3 приблизительно в четыре раз более высокие, чем величины циталопрама. Это значит, что активности в отношении ингибирования калиевого канала производными по настоящему изобретению являются очень низкими, так что вероятность развития кардиотоксичности, такой как аритмия, является очень небольшой. Следовательно, настоящие производные являются более безопасными, чем циталопрам.
ПРИМЕР ТЕСТИРОВАНИЯ 6: Тест на мутагеничность
Для исследования безопасности настоящих производных проводили тест на мутагеничность. Тест AMES и тест хромосомной аберрации проводили с примерами 2, 35, 40 и 45. Результаты представлены в таблице 8 ниже.
Как показано в таблице 8, результаты примеров 2, 35, 40 и 45 являются отрицательными. С другой стороны, сообщалось, что результат циталопрама в том же тесте являлся положительным, таким образом, найдено, что производные по настоящему изобретению являются более безопасными, чем циталопрам.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТИЕНО[3,2-d]ПИРИМИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ПРОТЕИНКИНАЗЫ | 2011 |
|
RU2524210C2 |
| НОВОЕ ТРИЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2470934C1 |
| 2-ПИРИДИЛЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ALK5 И/ИЛИ ALK4 | 2012 |
|
RU2612958C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛО[2,3-c] ПИРИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2385320C2 |
| АГОНИСТЫ РЕЦЕПТОРА МЕЛАНОКОРТИНА | 2007 |
|
RU2411240C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К PDE9A, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2788148C2 |
| СОЕДИНЕНИЯ ИНДОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ КЛЕТОЧНОГО НЕКРОЗА | 2008 |
|
RU2477282C2 |
| НОВЫЕ БЕНЗАМИДНЫЕ ПРОИЗВОДНЫЕ | 2011 |
|
RU2536688C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ МОДУЛЯЦИИ КИНАЗНОЙ АКТИВНОСТИ МУТАНТОВ EGFR | 2015 |
|
RU2822389C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К PDE9A, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2788147C2 |
Изобретение относится к новым производным 1,3-дигидро-5-изобензофуранкарбонитрила формулы 1,
или их фармацевтически приемлемым солям, где R1 представляет собой фенил, фенил, замещенный C1-C6-алкилокси, фенил, замещенный C1-C6-алкилом, фенил, замещенный C1-C6-диалкиламином, фенил, замещенный галогеном или тиенилом; R2 выбран из группы, состоящей из C1-C6-диалкиламино, пиразолила и имидазолила, за исключением C1-C6-диалкиламино, если R1 представляет собой фенил, замещенный галогеном; n представляет собой целое число от 1 до 3, и способу их получения. Изобретение также относится к фармацевтическим композициям, включающим в себя соединение формулы 1, и способу лечения или профилактики преждевременной эякуляции. 5 н. и 13 з.п. ф-лы, 8 табл., 68 пр.
1. Производное, представленное формулой 1, или его фармацевтически приемлемая соль:
[Формула 1]
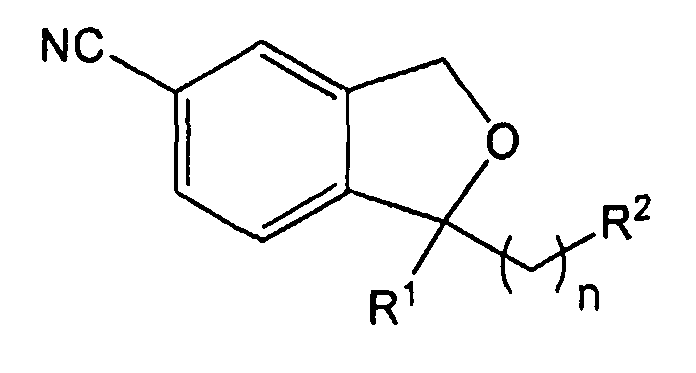 ,
,
где R1 представляет собой фенил, фенил, замещенный C1-C6-алкилокси, фенил, замещенный C1-C6-алкилом, фенил, замещенный C1-C6-диалкиламином, фенил, замещенный галогеном или тиенилом;
R2 выбран из группы, состоящей из C1-C6-диалкиламино, пиразолила и имидазолила, но за исключением C1-C6-диалкиламино, если R1 представляет собой фенил, замещенный галогеном; и
n представляет собой целое число от 1 до 3.
2. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.1, в котором R1 представляет собой фенил.
3. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.1, в котором R1 представляет собой фенил, замещенный C1-C6-алкилокси.
4. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.3, в котором фенил, замещенный C1-C6-алкилокси, в R1 представляет собой метоксифенил.
5. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.4, в которой R2 выбран из группы, состоящей из диметиламино, пиразолила и имидазолила.
6. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.1, в котором R1 представляет собой фенил, замещенный C1-C6-алкилом.
7. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.6, в котором фенил, замещенный C1-C6-алкилом, в R1 представляет собой толил.
8. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.1, в котором R1 представляет собой фенил, замещенный C1-C6-диалкиламино.
9. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.8, в котором фенил, замещенный C1-C6-диалкиламино, в R1 представляет собой диметиламинофенил.
10. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.9, в котором R2 выбран из группы, состоящей из диметиламино, пиразолила и имидазолила.
11. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.1, в котором R1 представляет собой тиенил.
12. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.11, в котором R2 выбран из группы, состоящей из диметиламино, пиразолила и имидазолила.
13. Производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.1, в котором R1 представляет собой фенил, замещенный атомом галогена; и
R2 выбран из группы, состоящей из диметиламино, пиразолила и имидазолила.
14. Производное, представленное формулой 1, или его фармацевтически приемлемая соль, где соль образована с соляной кислотой или с щавелевой кислотой.
15. Производное, или его фармацевтически приемлемая соль по п.1, выбранное из группы, состоящей из следующих соединений:
1-{3-(диметиламино)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
оксалата 1-{3-(диметиламино)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{3-(диметиламино)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(имидазол-1-ил)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{3-(имидазол-1-ил)пропил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(имидазол-1-ил)этил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{2-(имидазол-1-ил)этил}-1-(4-метоксифенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-метоксифенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-метоксифенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-метоксифенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-метоксифенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(диметиламино)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{3-(диметиламино)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(диметиламино)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{2-(диметиламино)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(имидазол-1-ил)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{3-(имидазол-1-ил)пропил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(имидазол-1-ил)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{2-(имидазол-1-ил)этил}-1-фенил-1,3-дигидро-5-изобензофуранкарбонитрила;
1-фенил-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-фенил-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(диметиламино)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{3-(диметиламино)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(диметиламино)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{2-(диметиламино)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(имидазол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{3-(имидазол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(имидазол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{2-(имидазол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(пиразол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{3-(пиразол-1-ил)пропил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(пиразол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{2-(пиразол-1-ил)этил}-1-(4-толил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-диметиламинофенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
оксалата 1-(4-диметиламинофенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-диметиламинофенил)-1-{3-(диметиламино)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-диметиламинофенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-диметиламинофенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(диметиламино)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
оксалата 1-{3-(диметиламино)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{3-(диметиламино)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(диметиламино)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{2-(диметиламино)этил}-1-(2-тиенил)-1,3-дигидро-5 изобензофуранкарбонитрила;
1-{3-(имидазол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
оксалата 1-{3-(имидазол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{3-(имидазол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(имидазол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{2-(имидазол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{3-(пиразол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{3-(пиразол-1-ил)пропил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-{2-(пиразол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-{2-(пиразол-1-ил)этил}-1-(2-тиенил)-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-фторфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-фторфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-фторфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-фторфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-фторфенил)-1-(3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-фторфенил)-1-{3-(пиразол-1-ил)пропил}-1 3-дигидро-5-изобензофуранкарбонитрила;
1-(4-фторфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-фторфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-хлорфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-хлорфенил)-1-{3-(имидазол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-хлорфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-хлорфенил)-1-{2-(имидазол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-хлорфенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
гидрохлорида 1-(4-хлорфенил)-1-{3-(пиразол-1-ил)пропил}-1,3-дигидро-5-изобензофуранкарбонитрила;
1-(4-хлорфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила; и
гидрохлорида 1-(4-хлорфенил)-1-{2-(пиразол-1-ил)этил}-1,3-дигидро-5-изобензофуранкарбонитрила.
16. Фармацевтическая композиция для лечения или профилактики преждевременной эякуляции, содержащая производное, представленное формулой 1, или его фармацевтически приемлемая соль по п.1; и фармацевтически приемлемый носитель.
17. Способ лечения или профилактики преждевременной эякуляции, включающий введение пациенту, имеющему такую необходимость, лечебного или профилактического терапевтически эффективного количества такого производного, представленного формулой 1, или его фармацевтически приемлемой соли по п.1.
18. Способ получения производного по п.1, включающий:
1) получение соединения формулы 3 по реакции 5-цианофталимидного соединения формулы 2 с R1MgBr (стадия 1);
2) получение соединения формулы 4 реакцией восстановления соединения формулы 3 (стадия 2);
3) получение соединения формулы 5 реакцией циклизации соединения формулы 4 (стадия 3);
4) получение соединения формулы 6 введением алкильной группы в положение 1 соединения формулы 5 (стадия 4);
5) получение соединения формулы 7 снятием защиты с соединения формулы 6 (стадия 5);
6) получение соединения формулы 8 реакцией соединения формулы 7 с метансульфонилхлоридом (стадия 6);
7) получение соединения формулы 1 реакцией замещения соединения формулы 8 на R2 группу и образованием соли (стадия 7):
[Формула 1]
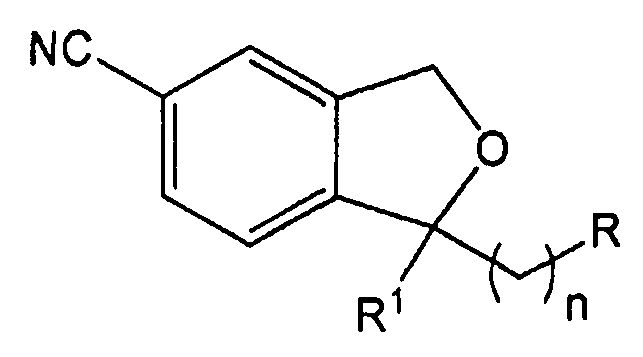
[Формула 2]
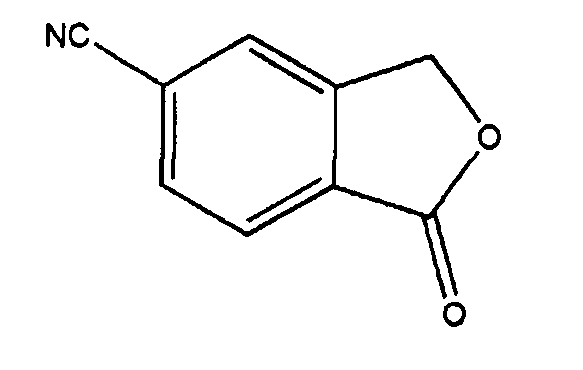
[Формула 3]
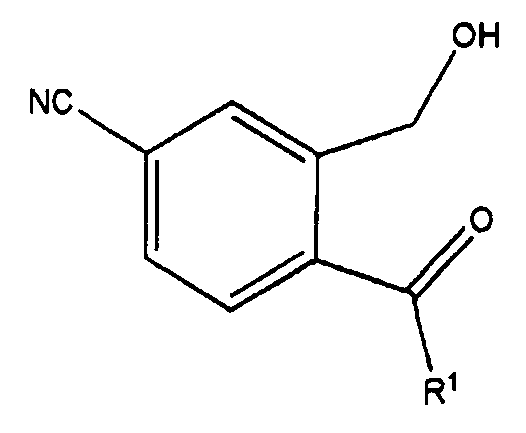
[Формула 4]
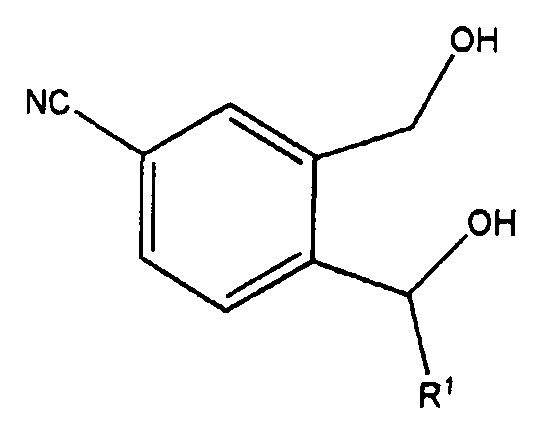
[Формула 5]
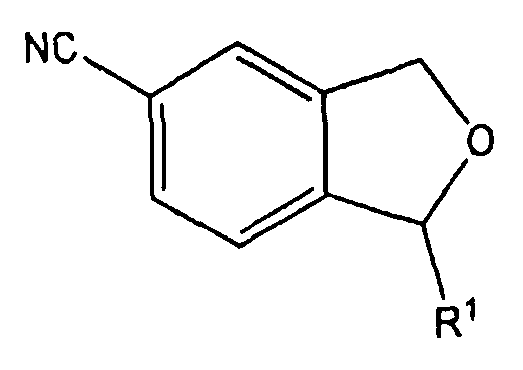
[Формула 6]
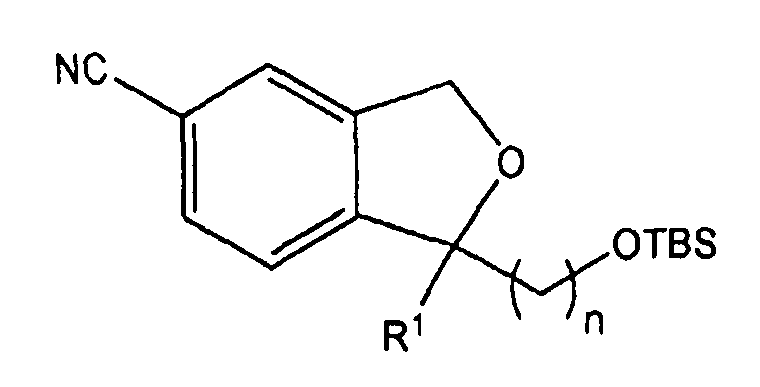
[Формула 7]
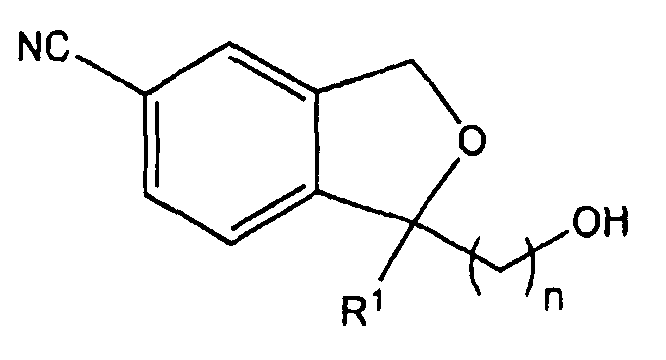
[Формула 8]
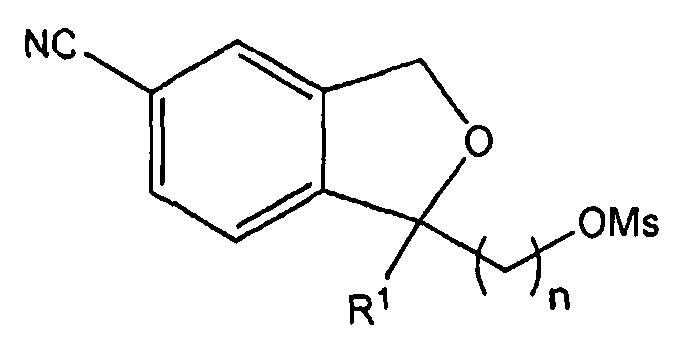 ,
,
где R1, R2 и n определены в п.1, и TBS представляет собой третбутилдиметилсиллил.
| M.Atmaca et al | |||
| International J | |||
| of Impotence Researt, 2002, v.14, no.6, p.502-550 | |||
| US 4136193 A, 23.01.1979 | |||
| WO 2003042202 A1, 22.05.2003 | |||
| СПОСОБ ПОЛУЧЕНИЯ ФТАЛАНОВ | 2002 |
|
RU2276148C2 |
Авторы
Даты
2012-04-27—Публикация
2008-10-31—Подача