Настоящее изобретение относится к применению соединения три-замещенного глицерина или его фармацевтически приемлемой соли для производства лекарственного средства для профилактики и/или лечения радиационных поражений. Кроме того, настоящее изобретение относится к соответствующим in vitro способам профилактики или лечения радиационного повреждения или поражения в одной или более клетках, включающим контактирование указанных клеток с лекарственным средством, как описано в настоящем изобретении.
Воздействие излучения (такого как рентгеновское излучение, гамма-излучение и альфа- или бета-излучение) может вызывать повреждение клеток. Такое повреждение может приводить к гибели клеток (например, через апоптоз) или может вызывать генетические изменения в клетке, приводящие к неконтролируемой пролиферации клеток и, как следствие, к развитию и прогрессированию опухолей.
Хотя воздействие такого излучения в целом нежелательно, воздействие тщательно контролируемых доз излучения является общепринятым способом лечения некоторых видов рака, таких как лейкемия, рак молочной железы, рак предстательной железы или рак толстой кишки. Воздействием излучения на опухоль можно разрушать раковые клетки.
Частым осложнением лучевой терапии является облучение нормальных тканей, окружающих раковые ткани. Такие нормальные ткани часто повреждаются излучением, что приводит к нежелательному радиационному поражению нормальных клеток и тканей, что может иметь тяжелые последствия для подвергающегося лечению пациента.
Можно подвергнуться воздействию радиации и некоторыми другими путями, включая воздействие нормальных фоновых уровней излучения (таких как космическое излучение или излучение от присутствующих на нашей планете естественных изотопов) или повышенную радиоактивность окружающей среды (включая профессиональное облучение людей в медицинских учреждениях или на атомных электростанциях, а также воздействие рентгеновского излучения при медицинской диагностике). Другим потенциальным источником воздействия некоторых типов излучения является случайное или намеренное высвобождение радиоактивных материалов, например, в результате аварии или в результате террористической деятельности, например в результате применения радиологического оружия, такого как так называемая "грязная ядерная бомба" (взрывное устройство, предназначенное для разброса радиоактивных материалов для заражения окружающего пространства).
Основной формой защиты от радиационного поражения является избегание воздействия излучения. Защитные материалы, способные предотвратить проникновение излучения в организм, можно использовать в тех случаях, когда известен источник излучения. Например, можно использовать защитные свинцовые фартуки для блокирования рентгеновского излучения. Можно использовать защитную одежду для предотвращения загрязнения организма радиоактивными материалами, а для удаления радиоактивных материалов можно использовать методики очистки от загрязнений.
Обработка противолучевыми химическими соединениями представляет собой способ предотвращения некоторых типов радиационных повреждений, таких как повреждение ДНК свободными радикалами (или другими реакционноспособными частицами), образующимися под действием излучения.
Широко используемым противолучевым средством является амифостин, органическое тиофосфатное пролекарство (2-[(3-аминопропил)амино]этантиол дигидрофосфат), которое дефосфорилируется in vivo щелочной фосфатазой до активного тиолового метаболита (смотри, например, Патент США 7073072, а также международные патентные заявки WO 02/092103 и WO 02/062350). Считается, что избирательная защита незлокачественных тканей осуществляется за счет более высокой активности щелочной фосфатазы, более высокого pH и проницаемости сосудов в нормальных тканях. Амифостин терапевтически используют, среди прочего, для снижения частоты возникновения вызванного нейтропенией лихорадочного состояния, для снижения кумулятивной почечной токсичности, вызванной платина-содержащими средствами, и для снижения частоты возникновения ксеростомии у пациентов, подвергающихся лучевой терапии для лечения от рака головы и шеи. Однако было продемонстрировано, что амифостин эффективен в качестве средства лучевой защиты только при введении незадолго до воздействия излучения. Введение после воздействия излучения не дает терапевтического эффекта. Кроме того, введение амифостина или родственных тиольных соединений связано с выраженными вредными побочными эффектами, такими как системная цитотоксичность, а также желудочно-кишечные несовместимости, такие как тошнота и рвота.
Действие другого соединения, 5-андростендиола, в качестве средства защиты от облучения было изучено в доклинических исследованиях на животных. Сообщается, что данное соединение улучшает выживаемость у мышей, подвергаемых излучению, возможно за счет стимулирования выработки нейтрофилов и других клеток иммунной системы, и таким образом предотвращает заражение, частую причину смерти субъектов, пораженных излучением. Однако данное соединение представляет собой спасательное средство и не противодействует патогенному механизму облучения, а также не защищает другие органы, помимо системы кроветворения. Оно еще не одобрено для применения на людях.
Насколько перспективным может казаться описанное профилактическое действие защиты от облучения, настолько же скромными являются результаты попыток разработать терапию химическими веществами, вводимыми после облучения. Известны попытки лечения поврежденных излучением нуклеиновых кислот посредством замещения ДНК или РНК. Первые результаты данных исследований, однако, не содействуют дальнейшему развитию терапевтической концепции. Таким образом, единственным оставшимся вариантом является лечение косвенных последствий клеточных повреждений, например воздействие на недостаточность костного мозга, которое определяет клинический исход после облучения всего организма в больших дозах. Вторичными эффектами повреждений костного мозга являются инфекции, вызываемые лейкопенией и сопровождающиеся лихорадочным состоянием, агранулоцитозом, петехией и профузным кровотечением как следствие тромбоцитопении. В тяжелых случаях данные симптомы могут приводить к смерти. Терапия перечисленных вторичных эффектов повреждений костного мозга включает лечение антибиотиками, а также заместительную терапию клетками крови, которых не хватает, такими как гранулоциты и тромбоциты. Последним средством в случаях очень высокой дозовой нагрузки облучения является пересадка костного мозга.
Несмотря на то что уровень интенсивной терапии для летально облученных жертв может быть очень высоким, такая терапия доступна только ограниченному количеству пациентов в небольшом количестве специализированных клиник. В случае реальной ядерной катастрофы, скорее всего сопровождающейся появлением сотен сильно облученных пациентов, такое сложное специализированное лечение неосуществимо. Интенсивная терапия с применением пересадки костного мозга может спасти людей с облучением всего организма на уровне 10 Гр (Грэй). Однако в случае не подвергавшихся лечению или подвергавшихся недостаточному лечению пациентов смертельная доза снижается до 3-4 Гр. Таким образом, адекватным терапевтическим подходом в данной ситуации была бы химиотерапия, которая эффективно улучшает прогноз для среднелетально облученных людей.
Соединения три-замещенного глицерина, относящиеся к классу синтетических алкил-лизофосфолипидов с эфирными мостиками, могут быть соединениями-кандидатами для такой противолучевой терапии. В предварительных анализах некоторые алкил-лизофосфолипидные аналоги продемонстрировали благоприятное действие на клетки после воздействия небольших доз рентгеновского излучения у мышей (Berdel, W. et al. (1983) Radiation Res. 94, 166-170). Однако данное исследование ничего не говорит о распространении на другие типы излучения, а также о дозах облучения, которые поддаются лечению. Кроме того, еще предстоит разобраться, способны ли алкил-лизофосфолипидные аналоги как предотвращать, так и лечить радиационное повреждение или поражение.
Известно, что синтетические алкил-лизофосфолипиды с эфирными мостиками обладают противораковым действием (обобщено, например, в Arthur, G., and Bittman, R. (1998) Biochim. Biophys. Acta 1390, 85-102; Jendrossek, V., and Handrick, R. (2003) Curr. Med. Chem. Anti-Canc. Agents 3, 343-353; Mollinedo, F. et al. (2004) Curr. Med. Chem. 11, 3163-3184). 1-О-октадецил-2-O-метил-глицеро-3-фосфохолин (также называемый ЕТ-18-ОСН3, АР-121 или эдельфозин) считают прототипом данных липидов. 1-О-октадецил-2-O-метил-глицеро-3-фосфохолин представляет собой синтетический аналог фактора активации тромбоцитов (PAF; 1-O-алкил-2-ацетил-sn-глицеро-3-фосфохолин), сильного фосфолипидного активатора и медиатора многих лейкоцитных функций, включая агрегацию тромбоцитов, воспаление и анафилаксию. В отличие от большинства обычных химиотерапевтических лекарств данные синтетические эфирные липиды не воздействуют непосредственно на клеточные ДНК, но воздействуют скорее на липидный состав клеточной мембраны и/или вмешиваются в различные пути сигнальной трансдукции. Таким образом, способ их действия не зависит от наличия определенных клеточных рецепторов и не зависит от клеточного цикла.
Противораковая химиотерапия обычно нацелена на замедление роста или разрушение раковых клеток, в то же время избегая побочного повреждения окружающих клеток и тканей. Следовательно, наиболее эффективными противораковыми средствами являются те средства, которые способны селективно воздействовать на раковые клетки, оставляя при этом нормальные клетки относительно незатронутыми. Было показано, что синтетические эфирные липиды оказывают такое действие (смотри, например, Magistrelli, A. et al. (1995) Drug. Metab. Dispos. 23, 113-118). Было предложено несколько механизмов действия для объяснения токсичности эфирных липидов в отношении раковых клеток, включая отсутствие в таких клетках ферментов, отщепляющих алкил. Наблюдающаяся в результате неспособность гидролизовать эфирные липиды приводит к их накоплению внутри клетки и последующему повреждению липидной структуры клеточной мембраны. Другие возможные механизмы действия эфирных липидов включают эффекты на уровнях внутриклеточного фосфорилирования протеина и нарушение клеточного липоидного обмена. Нормальные клетки обычно обладают средствами для предотвращения или преодоления потенциально токсичных воздействий эфирных липидов, в то время как раковые клетки их не имеют.
До настоящего момента синтетические эфирные липиды использовались для лечения различных типов опухолей, таких как опухоли головного мозга или карциномы молочной железы (смотри, например, патент Германии DE 2619686, а также международные патентные заявки WO 99/59599 и WO 00/01392 соответственно).
Хотя противоопухолевое действие указанных синтетических эфирных липидов было экспериментально подтверждено на нескольких животных опухолевых моделях, их клиническое применение часто затруднено из-за системных цитотоксических эффектов, включая гемолиз, особенно в желудочно-кишечном тракте, но также, среди прочих, в легких, печени или почках. У 10-20% пациентов, которых лечили такими растворами на основе воды и/или молока, содержащими эфирные липиды, наблюдались тяжелые желудочно-кишечные несовместимости, соответствующие III и IV степеням токсичности ВОЗ, которые связаны с тошнотой, рвотой, диареей или констипацией (смотри, например, Drings, P. et al. (1992) Onkologie 15, 375-382).
Таким образом, помимо оказания желательного фармацевтического действия, существует потребность в лекарственном средстве, которое обеспечивает легкое и удобное введение. В частности, сохраняется потребность в лекарственном средстве, которое одновременно пригодно для профилактики радиационного повреждения или поражения перед воздействием излучения и для облегчения или лечения радиационного повреждения или поражения после воздействия излучения.
Соответственно, задачей настоящего изобретения является предоставление лекарственного средства для профилактики и/или лечения радиационного повреждения или поражения, обладающего данными свойствами.
Данная цель достигается путем применения соединения три-замещенного глицерина, обладающего признаками независимого п.1, для производства соответствующего лекарственного средства. Некоторые предпочтительные варианты выполнения настоящего изобретения определяются содержанием зависимых пунктов формулы изобретения.
Неожиданно было обнаружено, что соединения три-замещенного глицерина, такие как 1-O-октадецил-2-O-метил-глицеро-3-фосфохолин, которые известны в качестве противораковых средств, также оказывают противолучевое действие на клетки и ткани, что обеспечивает эффективную профилактику и/или лечение радиационного повреждения или поражения как ответ на воздействие различных типов излучения. Изобретенное лекарственное средство обеспечивает необходимую эффективность, может с удобством вводиться пациенту и не проявляет вредных побочных эффектов.
В контексте настоящего изобретения любое указанное числовое значение обычно связано с интервалом точности, в котором, как понятно специалисту в данной области техники, все еще обеспечивается технический эффект конкретного признака. При применении в данном тексте отклонение от указанного числового значения находится в пределах ±10%, и предпочтительно ±5%.
В первом аспекте настоящее изобретение относится к применению соединения три-замещенного глицерина, отвечающего формуле (I)
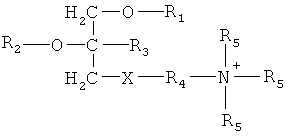
или его энантиомера, или диастереомера, или фармацевтически приемлемой соли, и по меньшей мере одного фармацевтически приемлемого наполнителя для производства лекарственного средства для профилактики и/или лечения радиационного повреждения или поражения, где
X выбран из группы, состоящей из фосфата и сульфата;
R1 выбран из группы, состоящей из С16-С20алкилов;
R2 выбран из группы, состоящей из С1-С3алкилов и С1-С3гидроксиалкилов;
R3 выбран из группы, состоящей из водорода и С1-С3алкилов;
R4 выбран из группы, состоящей из С1-С3алкилов и С3-С6циклоалкилов;
и
R5 выбран из группы, состоящей из водорода и метила.
Соединение три-замещенного глицерина может присутствовать в аморфной или кристаллической форме. Термин "аморфный", при использовании в данном тексте, относится к твердой фазе, в которой отсутствует дальний порядок расположения атомов, т.е. к некристаллическому материалу. В предпочтительных вариантах выполнения настоящего изобретения соединение три-замещенного глицерина присутствует в кристаллической форме.
Термины "Cn алкил", "Cn гидроксиалкил" и "Cn циклоалкил" при использовании в данном тексте означают соответственно алкильную группу, гидроксиалкильную группу или циклоалкильную группу, содержащую n атомов углерода. Например, термин "C18 алкил" относится к алкильной группе, содержащей 18 атомов углерода. Алкильные группы или гидроксиалкильные группы по настоящему изобретению могут быть прямыми или разветвленными.
Соединения три-замещенного глицерина формулы (I) имеют один или более центров асимметрии и поэтому могут существовать в форме энантиомеров или диастереомеров. Таким образом, лекарственное средство, описанное в настоящем изобретении, может содержать один или более отдельных индивидуальных изомеров (таких как L форма и D форма) или смеси изомеров, предпочтительно рацемические смеси.
В некоторых вариантах выполнения настоящего изобретения соединения три-замещенного глицерина формулы (I) присутствуют в лекарственном средстве в форме фармацевтически приемлемых солей. Такие соли могут включать любой фармацевтически приемлемый анион, "нейтрализующий" положительный заряд азота (например, хлорид, бромид или иодид), или любой фармацевтически приемлемый катион, "нейтрализующий" негативный заряд фосфатного или сульфатного фрагмента (например, катионы натрия или калия).
В особенно предпочтительном варианте выполнения настоящего изобретения фармацевтическая твердая лекарственная форма содержит соединение три-замещенного глицерина, отвечающее формуле (I), где X представляет собой фосфат, R1 представляет собой -(СН2)17-СН3, R2 представляет собой СН3, R3 представляет собой Н, R4 представляет собой -(СН2)2- и R5 представляет собой СН3.
Лекарственное средство по настоящему изобретению может представлять собой любую фармацевтическую лекарственную форму, которая является терапевтически эффективной. Примеры таких фармацевтических лекарственных форм включают, среди прочих, таблетки, пилюли, капсулы, суспензии, эмульсии, растворы для инъекций или инфузий, настойки, порошки и тому подобные.
Используемые в настоящем изобретении лекарственные средства содержат по меньшей мере один фармацевтически приемлемый наполнитель. Термин "фармацевтически приемлемый наполнитель" при использовании в данном тексте, означает любое вещество, используемое для получения фармацевтических лекарственных форм, такое как материалы покрытия, пленкообразующие материалы, наполнители, дезинтегрирующие средства, материалы, модифицирующие высвобождение, носители, разбавители, связующие средства и другие добавки, все добавки хорошо известны в данной области техники (см. приведенные ниже ссылки). Предпочтительно, используемый в настоящем изобретении наполнитель включает по меньшей мере один наполнитель, по меньшей мере одно связующее средство, по меньшей мере одно дезинтегрирующее средство, по меньшей мере одно средство, контролирующее текучесть, и по меньшей мере одно смазывающее средство.
Лекарственное средство можно вводить любым парентеральным или непарентеральным способом. Способы парентерального применения включают, например, методики внутрикожной, подкожной, внутримышечной или внутривенной инъекции и инфузий. Непарентеральные способы введения включают, например, пероральное введение или наружное нанесение. Кроме того, лекарственное средство можно вводить местно или системно.
Предпочтительно, используемое в настоящем изобретении лекарственное средство представляет собой фармацевтическую лекарственную форму, пригодную для перорального применения. Особенно предпочтительно лекарственная форма представляет собой твердую лекарственную форму. Примеры таких лекарственных форм включают, среди прочего, таблетки, пилюли, капсулы, гранулы, крупинки, порошки, препараты, состоящие из множества частиц (например, шарики, гранулы или кристаллы) и драже. Стандартные дозировки препаратов, состоящих из множества частиц, можно включать в фармацевтическую твердую лекарственную форму, например, посредством прессования или формования в таблетки или посредством помещения требуемого количества внутрь желатиновой капсулы.
Все указанные твердые лекарственные формы для перорального применения, а также способы их получения хорошо известны в данной области техники (смотри, например, Gennaro, A.L. and Gennaro, A.R. (2000) Remington: The Science and Practice of Pharmacy, 20th Ed., Lippincott Williams & Wilkins, Philadelphia, PA; Ritschel, W.A. & Bauer-Brandl, A. (2002) Die Tablette: Handbuch der Entwicklung, Herstellung und Qualitätssicherung. Editio-Cantor Verlag, Aulendorf, Germany; Crowder, Т.M. et al. (2003) A Guide to Pharmaceutical Particulate Science. Interpharm/CRC, Boca Raton, FL; Strieker, H. (2003) Arzneiformenentwicklung, Springer Verlag, Berlin, Germany; Niazi, S.K. (2004) Handbook of Pharmaceutical Manufacturing Formulations, CRC Press, Boca Raton, FL).
В предпочтительных вариантах выполнения настоящего изобретения фармацевтическая твердая лекарственная форма выбрана из группы, состоящей из таблеток, пилюль, капсул и гранул, при этом таблетки являются особенно предпочтительными.
Твердая лекарственная форма предпочтительно представляет собой кишечнорастворимую лекарственную форму. То есть лекарственная форма остается устойчивой в желудке, т.е. в кислой среде со значениями pH в диапазоне ≤2.5. Этого можно достичь с помощью твердой лекарственной формы, имеющей пленочную оболочку. Например, изобретенная лекарственная форма может иметь форму так называемой таблетки, покрытой оболочкой.
Способы получения покрытых оболочкой лекарственных форм также хорошо определены в данной области техники (смотри, например, приведенные выше ссылки). Кроме того, специалисту в данной области техники также известно, как получать пленочные оболочки с определенными свойствами, такие как энтеросолюбильные покрытия, пленочные оболочки, которые растворяются при контакте с жидкостями организма, оболочки с контролируемым высвобождением, оболочки, маскирующие вкус, или дезинтегрирующие оболочки. В особенно предпочтительном варианте выполнения твердая лекарственная форма по настоящему изобретению имеет энтеросолюбильное покрытие.
Согласно настоящему изобретению следует понимать, что соединение три-замещенного глицерина присутствует в лекарственном средстве в любом количестве, эффективном для достижения требуемого фармакологического эффекта при введении пациенту. Эффективные количества обычно выбирают в соответствии с несколькими факторами, например, возраст, вес и общее состояние пациента, и медицинское состояние, которое необходимо вылечить, и определяют разными способами, например исследованием эффективности лекарственного средства в диапазоне дозировок, хорошо знакомыми и легко осуществляемыми специалистами в данной области техники, которым известна суть настоящего изобретения.
Обычно в лекарственном средстве, описанном в настоящем изобретении, количество соединения три-замещенного глицерина формулы (I) составляет менее 400 мг, предпочтительно оно находится в диапазоне от 30 до 250 мг, и наиболее предпочтительно в диапазоне от 50 до 150 мг. В особенно предпочтительных вариантах выполнения настоящего изобретения количество соединения три-замещенного глицерина формулы (I) составляет 75 мг и 100 мг соответственно.
Вводимая пациенту суточная доза соединения три-замещенного глицерина составляет менее 1200 мг, обычно менее 900 мг, предпочтительно в диапазоне от 30 до 600 мг, более предпочтительно в диапазоне от 40 до 400 мг и наиболее предпочтительно в диапазоне от 50 до 350 мг. В частных вариантах выполнения суточная доза составляет 75, 100, 150, 200, 225 и 300 мг. Предпочтительно, суточную дозу соединения три-замещенного глицерина вводят в виде однократной дозы, например в форме от одной до четырех таблеток или капсул. Однако возможно также вводить соединение многократными дозами, такими как две или три отдельные дозы, вводимые в течение дня, например утром, днем и вечером.
Лекарственное средство по настоящему изобретению можно использовать для профилактики и/или лечения радиационного повреждения или поражения отдельно или в комбинации, по меньшей мере, с одним другим лекарственным средством, содержащим, по меньшей мере, один дополнительный активный ингредиент. То есть в объем настоящего изобретения также входит применение лекарственного средства, содержащего соединение три-замещенного глицерина, определенное в формуле изобретения, вместе, по меньшей мере, с одним другим лекарственным средством, содержащим один или более разных активных ингредиентов, таких как средства химиотерапии или моноклональные антитела.
Термин "радиационное повреждение или поражение" при использовании в данном тексте относится к любому негативному или вредному воздействию, которое облучение - независимо от полученной дозы облучения и времени облучения соответственно - может оказывать на клетки, ткани, органы или организмы, приводя к неконтролируемой клеточной пролиферации и/или дифференцировке и, как следствие, к развитию и прогрессированию опухолей. Примеры таких радиационных повреждений или поражений включают, среди прочего, генетические изменения в клетке (например, мутации ДНК и/или РНК, разрушение ДНК и/или РНК, хромосомные аберрации), а также гибель клеток (например, запрограммированная гибель клеток/апоптоз).
В некоторых вариантах выполнения настоящего изобретения радиационное повреждение или поражение вызвано ионизирующим излучением. Термин «ионизирующее излучение», при использовании в данном тексте, означает корпускулярное излучение или электромагнитное излучение, при котором отдельная частица/фотон обладает достаточным количеством энергии, чтобы ионизировать атом или молекулу путем полного удаления электрона с его орбиты. Если отдельные частицы не обладают таким количеством энергии, то даже большой поток частиц фактически неспособен вызвать ионизацию. Если такая ионизация происходит в существенном масштабе, она может быть очень разрушительной для живой ткани. Примеры корпускулярного излучения, являющегося ионизирующим, могут представлять собой быстрые электроны, нейтроны, ионы атомов или фотоны. Электромагнитное излучение может вызывать ионизацию, если энергия на фотон или частота достаточно высока, и, таким образом, длина волны достаточно мала. Необходимое количество энергии варьируется в зависимости от ионизируемых молекул.
Предпочтительно, ионизирующее излучение выбрано из группы, состоящей из нейтронного излучения, альфа-излучения, бета-излучения, гамма-излучения и рентгеновского излучения.
Нейтронное излучение обычно называют косвенно ионизирующим излучением. Оно не ионизирует атомы таким же образом, как протоны, фотоны и электроны, поскольку нейтроны не имеют заряда. Однако взаимодействия с нейтронами являются в значительной степени ионизирующими, например, когда поглощение нейтронов приводит к гамма-излучению, и гамма-излучение затем выбивает электрон из атома, или ядро атома, вылетающее вследствие взаимодействия с нейтроном, ионизируется и приводит к более традиционной последующей ионизации в других атомах. Поскольку нейтроны не заряжены, они являются более проникающими, чем альфа-излучение (ядра гелия) и бета-излучение (электроны или позитроны). В некоторых случаях они являются более проникающими, чем гамма-излучение (электромагнитное излучение), которое затруднено в материалах с большим атомным номером.
Рентгеновские лучи представляют собой вид электромагнитного излучения с длиной волны в диапазоне от 10 до 0.01 нм, что соответствует частотам в диапазоне от 30 до 30000 ПГц (1015 Гц). Рентгеновские лучи в основном используются для диагностической радиографии и кристаллографии. Рентгеновские лучи представляют собой форму ионизирующего излучения.
В объеме настоящего изобретения радиационное повреждение или поражение, которое необходимо предотвратить и/или вылечить, может быть результатом воздействия естественного излучения или искусственного излучения.
Воздействию радиации, в контексте настоящего изобретения, можно подвергнуться и некоторыми другими путями, включая воздействие нормальных фоновых уровней радиации (таких как космическое излучение или излучение от присутствующих на нашей планете естественных изотопов) или повышенную радиоактивность окружающей среды (включая профессиональное облучение людей в медицинских учреждениях или на атомных электростанциях, а также воздействие рентгеновского излучения при медицинской диагностике, например, компьютерной томографии). Другим потенциальным источником воздействия некоторых типов излучения является случайное или намеренное высвобождение радиоактивных материалов, например, в результате аварии или в результате террористической деятельности, например в результате применения радиологического оружия, такого как так называемая "грязная ядерная бомба" (взрывное устройство, предназначенное для разброса радиоактивных материалов для заражения окружающего пространства).
В предпочтительных вариантах выполнения настоящего изобретения радиационное повреждение или поражение связано с терапией рака, т.е. является результатом лучевой терапии рака. В особом варианте выполнения настоящего изобретения радиационное повреждение или поражение связано с пересадкой костного мозга при терапии рака.
Во втором аспекте настоящее изобретение относится к соединению три-замещенного глицерина, описанному в данном тексте, предназначенному для профилактики и/или лечения радиационного повреждения или поражения. В предпочтительных вариантах выполнения радиационное повреждение или поражение связано с терапией рака или с пересадкой костного мозга во время терапии рака.
В третьем аспекте настоящее изобретение относится к соответствующему способу профилактики и/или лечения радиационного повреждения или поражения, где данный способ включает введение пациенту лекарственного средства, описанного в настоящем изобретении.
Как указано выше, лекарственное средство по настоящему изобретению можно вводить любым парентеральным или непарентеральным способом. Предпочтительно, лекарственное средство вводят перорально. Кроме того, лекарственное средство предпочтительно можно вводить в форме однократной дозы, такой как одна таблетка или капсула в день. Однако можно также вводить лекарственное средство многократными дозами, такими как две или три отдельные дозы, вводимые в течение дня. Для профилактики радиационного повреждения или поражения лекарственное средство предпочтительно вводят до воздействия излучения. Однако можно также вводить лекарственное средство во время и/или после воздействия излучения.
В четвертом аспекте настоящее изобретение относится к способам in vitro профилактики радиационного повреждения или поражения и лечения или профилактики радиационного повреждения или поражения в одной или более клетках, соответственно, каждый способ включает контактирование одной или более клеток, подвергшихся облучению, с лекарственным средством, описанным в настоящем изобретении. По первому способу клетки контактируют с лекарственным средством до воздействия излучения.
Предпочтительно, одна или более клеток являются не-раковыми клетками (т.е. не-онкогенными контрольными клетками), такими как клетки костного мозга.
Изобретение дополнительно описано с помощью следующих далее чертежей и примеров, которые предназначены только для иллюстрации частных вариантов выполнения настоящего изобретения и не должны пониматься как каким-либо образом ограничивающие объем настоящего изобретения.
Материалы, используемые в описанных ниже тестах, коммерчески доступны или могут быть легко получены из коммерчески доступных материалов специалистами в данной области техники.
ЧЕРТЕЖИ
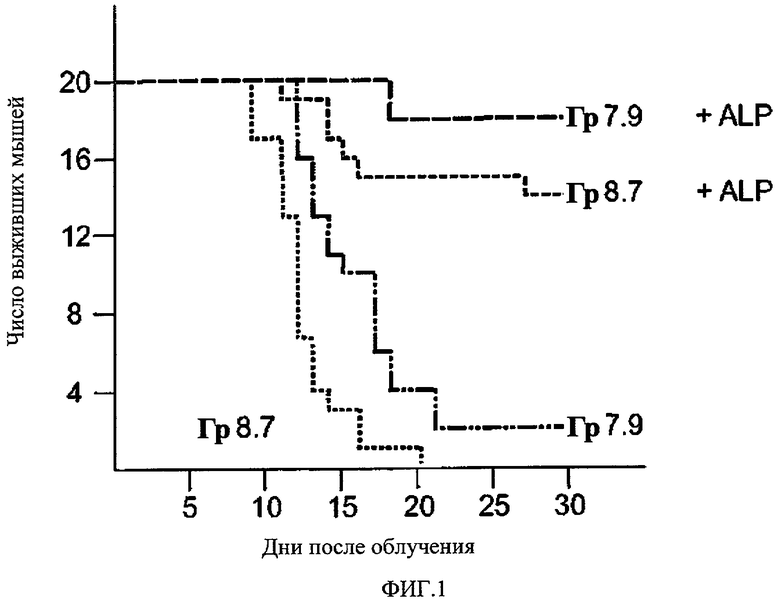
На Фиг.1 представлено противолучевое воздействие ЕТ18-ОСН3 на выживаемость мышей. ЕТ18-ОСН3 вводили в виде однократной дозы 50 мг/кг массы тела каждой из 40 мышей (20 контрольных мышей, 20 тестовых мышей). Через 24 часа 20 тестовых мышей подвергали воздействию гамма-излучения, доза 7.9 Гр (Грэй) и 8.7 Гр соответственно. Выживаемость отслеживали в течение 30 дней.
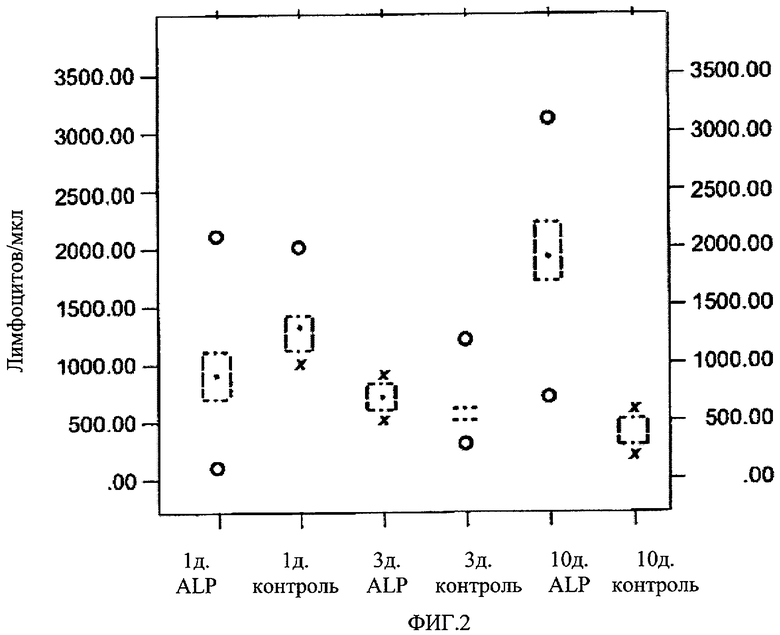
На Фиг.2 представлено противолучевое воздействие ЕТ 18-ОСН3 (обозначено как "ALP") на число лимфоцитов у мышей. Мышам вводили однократную дозу 70 мг/кг ЕТ 18-ОСН3 (подкожное введение) за 24 часа до воздействия нейтронного излучения (доза излучения 2.0 Гр). Число лимфоцитов на мкл крови не подвергавшихся обработке (облученных) контрольных мышей и подвергавшихся обработке (тестовых) мышей определяли через 1, 3 и 10 дней после облучения.
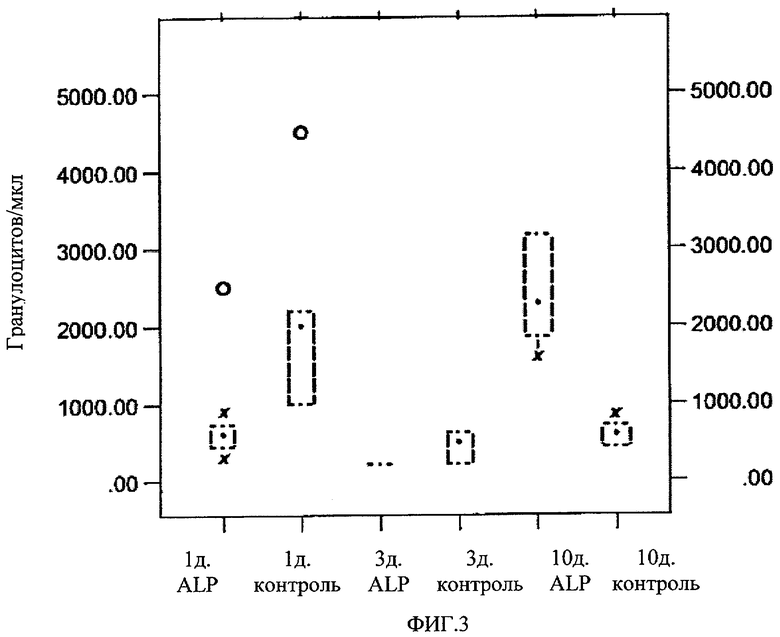
На Фиг.3 представлено противолучевое воздействие ЕТ 18-ОСНЗ (обозначено как "ALP") на число гранулоцитов у мышей. Эксперимент осуществляли способом, аналогичным описанному на Фиг.2.
ПРИМЕРЫ
Эффективность 1-O-октадецил-2-O-метил-глицеро-3-фосфохолина (в дальнейшем обозначается как "ЕТ 18-ОСН3") в качестве противолучевого средства в лечении острого радиационного поражения, вызванного (средне)летальными дозами облучения, анализировали посредством определения его влияния на уровень выживаемости мышей и на гематологический синдром радиационного поражения как ответ на воздействие различных типов излучения.
Пример 1: Эффективность ЕТ18-ОСН3 в ответ на воздействие рентгеновского излучения
Однократную дозу 25 мг/кг ЕТ 18-ОСН3 одновременно вводили внутривенно 25 мышам через 12 часов после воздействия рентгеновского излучения, доза 650 сГр (сантиГрэй). Погибла только одна из 25 подвергавшихся обработке мышей по сравнению с 6 из 25 мышей в контрольной группе.
После внутривенного введения 25 мг/кг ЕТ18-ОСН3 через 6 часов и 12 часов после рентгеновского облучения соответственно были получены следующие результаты (Таблица 1). Хи-квадрат-распределение представлено для всех положительных значений. Критерий хи-квадрат использовали для сопоставления результатов для подвергавшихся обработке животных в сравнении с контрольными животными.
LD50/30 рентгеновского облучения повысилась с 688.1±38.6 до 749±37.1 сГр для подвергавшихся обработке животных в сравнении с не подвергавшимися обработке контрольными животными. Вызванная рентгеновским излучением летальность у подвергавшихся обработке мышей была замедлена по сравнению с контрольными мышами.
После перорального введения 25 мг/кг ЕТ18-ОСНЗ через 6 часов и 24 часа после воздействия рентгеновского излучения с дозой рентгеновского облучения 700 сГр погибли соответственно 2 из 25 подвергавшихся обработке животных по сравнению с 7 из 25 контрольных животных.
Пример 2: Эффективность ЕТ18-ОСН3 в ответ на воздействие нейтронного излучения
Мышей облучали с помощью генератора Ван-де-Граафа нейтронами с 3-8 МэВ. Используемые в последующих анализах дозы облучения составляли 400, 410 и 420 сГр для каждой третьей из подвергавшихся обработке и контрольных мышей, соответственно. Однократную дозу 50 мг/кг ЕТ18-ОСН3 вводили половине мышей подкожной инъекцией. Полученные результаты представлены в Таблице 2.

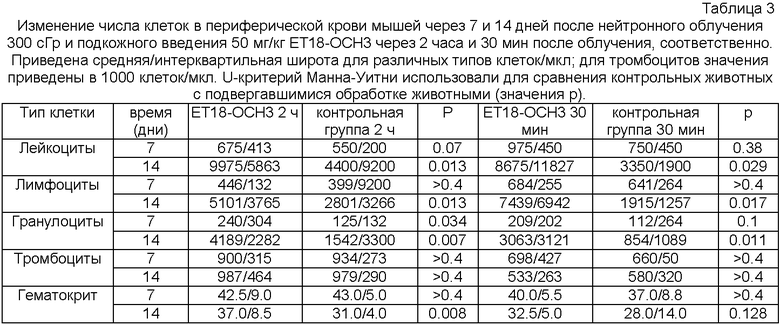
Из приведенных результатов можно сделать вывод, что лечение однократной дозой ЕТ18-ОСН3 необходимо осуществлять как можно быстрее после нейтронного облучения. Так как терапевтические эксперименты осуществляли в диапазоне доз облучения, при котором преобладает гематологический синдром радиационного поражения, важно определение терапевтического эффекта лекарства на систему кроветворения (гематопоэтическую систему). Из Таблицы 3 становится понятно, что ЕТ18-ОСН3 значительно повышает концентрацию лейкоцитов и гранулоцитов в периферической крови в период времени, в течение которого погибли облученные мыши (день 10-15 после облучения).
Пример 3: Эффективность ЕТ18-ОСН3 до применения гамма-излучения
Эффект профилактической обработки соединением ЕТ18-ОСН3 на выживаемость облученных гамма-излучением мышей суммирован в Таблице 4.
Таким образом, обработка мышей соединением ЕТ18-ОСН3 дала в результате значительный противолучевой эффект, который был практически одинаков при введении ЕТ18-ОСН3 за 24 часа или незадолго перед облучением. В этом заключается отличие от действия обычных противолучевых средств, которое выражено только при введении противолучевого средства непосредственно перед облучением. При введении ЕТ18-ОСН3 за один день до облучения доза LD50/30 гамма-излучения возрастала с 7.47 Гр (не подвергавшиеся обработке облученные контрольные животные) до 8.98 Гр (подвергавшиеся обработке облученные мыши) (определено пробит-анализом). Влияние ЕТ 18-ОСН3 на выживаемость мышей при двух разных дозах облучения представлено на Фиг.1.
Пример 4: Эффективность ЕТ18-ОСН3 до воздействия нейтронного излучения
Эффект ЕТ 18-ОСН3 до воздействия различных доз нейтронного излучения на уровни выживаемости мышей суммирован в Таблице 5.
Пример 5: Влияние ЕТ18-ОСН3 на уровень лейкоцитов в крови (гемограмма)
После введения 50 мг/кг и 70 мг/кг ЕТ-18-ОСН3 соответственно и воздействия нейтронного облучения снижение числа лейкоцитов (как лимфоцитов, так и гранулоцитов) незначительно увеличилось по сравнению с не подвергавшимися обработке контрольными животными (не статистически значимо; 5 экспериментов, n=90).
Однако начиная с 3 дня после облучения обработка соединением ЕТ-18-ОСН3 привела к повышению числа лейкоцитов (как лимфоцитов, так и гранулоцитов), которое стало значимым на 7 день (4 эксперимента; n=30, р<0.003). Не наблюдалось статистически значимого различия между введением 50 мг/кг и 70 мг/кг ЕТ18-ОСН3. Противолучевое воздействие ЕТ18-ОСН3 на число лимфоцитов и гранулоцитов мышей представлено на Фиг.2 и Фиг.3 соответственно.
Несмотря на значительное увеличение, вызванное введением ЕТ18-ОСНЗ, при среднелетальных дозах облучения число лимфоцитов остается на низком уровне, который составляет в среднем около одной десятой от нормального значения, тогда как число лейкоцитов у подвергавшихся обработке животных показывает значительно большее отклонение, чем отклонение у контрольных животных. Так, на 7-10 день после облучения подвергавшихся обработке животных можно классифицировать на две группы, в одной из которых число лейкоцитов практически не изменилось по сравнению с контрольной группой. Эти мыши обычно погибали на 10-14 день после облучения. Соответствующие доли лейкоцитных фракций были непостоянны, однако в целом число и лейкоцитов, и гранулоцитов значительно увеличивалось.
Настоящее изобретение, иллюстративно описанное в данном тексте, может применяться на практике в отсутствие любого элемента или элементов, ограничения или ограничений, не описанных конкретно в данном тексте. Так, например, термины "состоящий", "включающий", "содержащий" и т.д. следует понимать широко и без ограничения. Кроме того, применяемые в данном тексте термины и выражения использовались в качестве терминов описания, а не ограничения, и использование таких терминов и выражений не предполагает исключение каких-либо эквивалентов указанных и описанных признаков или их частей, но следует отметить, что возможны различные модификации в рамках объема заявленного изобретения. Так, следует понимать, что хотя настоящее изобретение было конкретно раскрыто посредством предпочтительных вариантов выполнения и необязательных признаков, специалистами в данной области техники могут осуществляться модификации и изменения изобретений, описанных в данном тексте, и что такие модификации и изменения считаются входящими в объем настоящего изобретения.
Все документы, процитированные или приведенные в виде ссылки в данном тексте, включая любые инструкции производителей, описания, спецификации продуктов и технологические карты для любых продуктов, указанных в данном тексте или в любом документе, приведенном в виде ссылки, включены в данный текст в виде ссылки и могут использоваться в применении изобретения на практике. Цитирование или указание какого-либо документа в настоящей заявке не является признанием того, что такой документ выступает в качестве предшествующего уровня техники для настоящего изобретения.
В данном тексте изобретение было описано широко и общо. Каждый из более узких представителей и более мелких групп, подпадающих под общее описание, также образует часть изобретения. Это включает общее описание изобретения с условием или отрицательным ограничением, удаляющим из общей группы любой объект, вне зависимости от того, был ли исключенный материал конкретно указан в данном тексте.
Другие варианты выполнения находятся в рамках следующей далее формулы изобретения. Кроме того, при описании элементов или аспектов изобретения посредством групп Маркуша, специалистам в данной области техники понятно, что настоящее изобретение тем самым описано также для любого отдельного члена или подгруппы членов группы Маркуша.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ фармакологической защиты от ионизирующих излучений | 2017 |
|
RU2663465C1 |
| ПРИМЕНЕНИЕ СЕСКВИТЕРПЕНОВОГО ЛАКТОННОГО СОЕДИНЕНИЯ ПРИ ПОЛУЧЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ОБЛЕГЧЕНИЯ ВЫЗВАННЫХ ЛУЧЕВОЙ ТЕРАПИЕЙ ПОВРЕЖДЕНИЙ | 2021 |
|
RU2822760C1 |
| РАДИОЗАЩИТНОЕ ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО | 2020 |
|
RU2733883C2 |
| Способ получения препарата для лечения животных при радиационно-кадмиевом поражении | 2024 |
|
RU2837735C1 |
| Радиопротекторное, радиомитигаторное и радиосенсибилизирующее средство на основе натриевой соли аминодигидрофталазиндиона натрия (лекарственного препарата Тамерон) и других солей щелочных и щелочноземельных металлов аминодигидрофталазиндиона | 2022 |
|
RU2804886C1 |
| СРЕДСТВО РАННЕЙ ПАТОГЕНЕТИЧЕСКОЙ ТЕРАПИИ ОСТРОЙ ЛУЧЕВОЙ БОЛЕЗНИ | 2003 |
|
RU2281092C2 |
| ПРОТИВОЛУЧЕВОЕ СРЕДСТВО | 1996 |
|
RU2123348C1 |
| СРЕДСТВО ЛЕЧЕНИЯ ОСТРЫХ РАДИАЦИОННЫХ ПОРАЖЕНИЙ | 2004 |
|
RU2260425C1 |
| СРЕДСТВО РАННЕЙ ТЕРАПИИ РАДИАЦИОННЫХ ПОРАЖЕНИЙ | 1998 |
|
RU2164139C2 |
| Способ получения препарата для лечения радиационных поражений организма животных | 2024 |
|
RU2837739C1 |
Настоящее изобретение относится к применению для производства лекарственного средства для профилактики и/или лечения радиационного повреждения или поражения соединения три-замещенного глицерина, отвечающего формуле
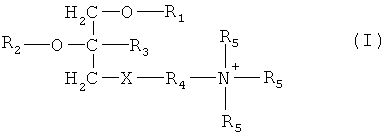
где Х выбран из фосфата и сульфата, R1 выбран из С16-С20алкила, R2 выбран из С1-С3алкила и С1-С3гидроксиалкила, R3 выбран из водорода и C1-С3 алкила, R4 выбран из C1-С3алкила и С3-С6циклоалкила, R5 выбран из водорода и метила, или его энантиомера, или диастереомера, или фармацевтически приемлемой соли, и по меньшей мере одного фармацевтически приемлемого наполнителя. Предложено новое применение известных соединений. 11 з.п. ф-лы, 3 ил., 5 пр., 5 табл.
1. Применение соединения три-замещенного глицерина, отвечающего формуле (I)
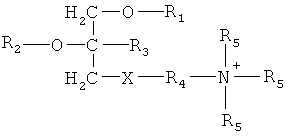
I
или его энантиомера, или диастереомера, или фармацевтически приемлемой соли, и по меньшей мере одного фармацевтически приемлемого наполнителя для производства лекарственного средства для профилактики и/или лечения радиационного повреждения или поражения,
где Х выбран из группы, состоящей из фосфата и сульфата;
R1 выбран из группы, состоящей из С16-С20алкилов;
R2 выбран из группы, состоящей из С1-С3алкилов и С1-С3гидроксиалкилов;
R3 выбран из группы, состоящей из водорода и C1-С3алкилов;
R4 выбран из группы, состоящей из С1-С3алкилов и С3-С6циклоалкилов; и
R5 выбран из группы, состоящей из водорода и метила.
2. Применение по п.1, где Х представляет собой фосфат, R1 представляет собой -(CH2)17-СН3, R2 представляет собой СН3, R3 представляет собой Н, R4 представляет собой -(СН2)2-, и R5 представляет собой СН3.
3. Применение по п.1, где лекарственное средство представляет собой лекарственную форму для перорального применения.
4. Применение по п.3, где лекарственная форма представляет собой твердую лекарственную форму.
5. Применение по п.4, где лекарственная форма выбрана из группы, состоящей из таблеток, пилюль, капсул и гранул.
6. Применение по п.1, где количество соединения три-замещенного глицерина в лекарственном средстве находится в диапазоне от 30 до 250 мг.
7. Применение по п.6, где количество соединения три-замещенного глицерина в лекарственном средстве находится в диапазоне от 50 до 150 мг.
8. Применение по п.1, где суточная доза соединения три-замещенного глицерина находится в диапазоне от 50 до 350 мг.
9. Применение по п.1, где радиационное повреждение или поражение вызвано ионизирующим излучением.
10. Применение по п.9, где ионизирующее излучение выбрано из группы, состоящей из нейтронного излучения, альфа-излучения, бета-излучения, гамма-лучей и рентгеновских лучей.
11. Применение по любому из пп.1-10, где радиационное повреждение или поражение связано с терапией рака.
12. Применение по п.11, где радиационное повреждение или поражение связано с пересадкой костного мозга во время терапии рака.
| US 6514519 B1, 04.02.2003 | |||
| НАБОР ДЛЯ РАДИОАКТИВНОГО МЕЧЕНИЯ И АНАЛИЗ СВЯЗЫВАНИЯ | 2000 |
|
RU2251110C2 |
| WO 2005020935 А, 10.03.2005 | |||
| УТЮЖНО-МЕРИЙНАЯ МАШИНА | 0 |
|
SU176357A1 |
| Pinchuk A.N | |||
| et al | |||
| Pharmaceutical chemistry journal, 1992, с.174-176 | |||
| WOLFGANG E | |||
| BERDEL et al | |||
| Radiation research, 1983, 94, 166-170. | |||
Авторы
Даты
2012-04-27—Публикация
2007-11-09—Подача