Настоящее изобретение относится к новым производным камптотецина, обладающим противоопухолевой активностью, способам их получения, их применению в качестве противоопухолевых лекарственных средств и фармацевтическим композициям, их содержащим.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Камптотецин является алкалоидом, экстрагированным из Camptotheca acuminata (Nyssaceae), впервые описанным Wall и Wani в 1966 г. (J. Am. Chem. Soc. 1966, 88, 3888-3890). Камптотецин, хотя и обладает широким спектром противоопухолевой активности, особенно против опухоли толстой кишки и других сòлидных опухолей и лейкозов, не применяют в терапии из-за его высокой токсичности, которая, в частности, проявляется в форме геморрагического цистита, желудочно-кишечной токсичности и миелосупрессии.
Ряд аналогов камптотецина был синтезирован с целью получения соединений, обладающих низкой токсичностью и высокой растворимостью. В настоящее время в клинической практике применяют два лекарственных средства, а именно СРТ-11 и топотекан. Другие производные, такие как белотекан, рубитекан, эксатекан, гиматекан, пегамотекан, луртотекан, каренитецин, афелетекан, гомокамптотецин, дифломотекан и многие другие, проходят клинические испытания. Соединение СРТ-11 является хорошо растворимым пролекарством для 10-гидрокси-7-этилкамптотецина (общеизвестного как SN-38), разрешенного для лечения многих солидных опухолей и асцитов (толстой и прямой кишки, кожи, желудка, легкого, шейки матки, яичников, неходжкинской лимфомы).
Топотекан является соединением, растворимым в физиологическом растворе, активным против опухолей легкого, желудка, печени, яичника, груди, простаты, пищевода, прямой кишки, сарком мягких тканей, головы и шеи, глиобластомы, хронических и острых миелоцитарных лейкозов. Однако топотекан показывает важные побочные эффекты, такие как нейтропения и тромбоцитопения.
Луртотекан является более растворимым производным, обладающим активностью в отношении опухолей шеи, яичника, груди, толстой и прямой кишки и легочной микроцитомы. Однако луртотекан также обладает гематотоксичностью.
Рубитекан является пролекарстом для перорального применения, эффективным против опухолей поджелудочной железы, яичника и груди.
Камптотецин и его аналоги, как это имеет место со всеми ингибиторами топоизомеразы I, эффективны против опухолей, невосприимчивых к традиционным лекарственным средствам, включая ингибиторы топоизомеразы II; поддерживают высокие уровни топоизомеразы в течение всего клеточного цикла, не вызывая множественной лекарственной резистентности (Pgo или MRP) или метаболизма детоксификации, опосредуемого ферментом.
В настоящее время исследования сфокусированы на новых ингибиторах топоизомеразы I, обладающих более низкой токсичностью, чем лекарственные средства, применяемые в настоящее время.
Производные камптотецина с открытым кольцом показывают высокое белковое связывание (в частности, с альбумином) и низкое распределение в опухолевых тканях. Вследствие этого продукт накапливается в организме и на опухоли оказывается лишь слабое воздействие.
Напротив, высокая липофильность лактоновой формы способствует адгезии производных камптотецина к клеточным мембранам, в частности эритроцитов, что влияет на отношение распределения между тканями и плазмой. По этой причине исследования фокусируют на двух альтернативных подходах: а) создание продуктов с низким белковым связыванием, но еще обладающих хорошей растворимостью; b) создание высокоэффективных продуктов, обладающих терапевтическим эффектом даже в крайне малых дозах.
Модификации в положениях 7, 9, 10 и 11 обычно оказываются хорошо переносимыми и не влияющими на стабильность тройного комплекса ДНК-топоизомераза-I-камптотецин, образование которого отвечает за противоопухолевую активность данных соединений.
Продукты с 20R-конфигурацией оказались либо неактивными, либо значительно менее активными, чем продукты с 20S-конфигурацией, которая совпадает с естественной конфигурацией.
Как правило, модификации в положении 5 считают неблагоприятными для образования тройного комплекса, тогда как модификации в пиридоновых кольцах D и E, согласно некоторым сообщениям, вредны для активности продукта.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение относится к производным камптотецина общей формулы I:
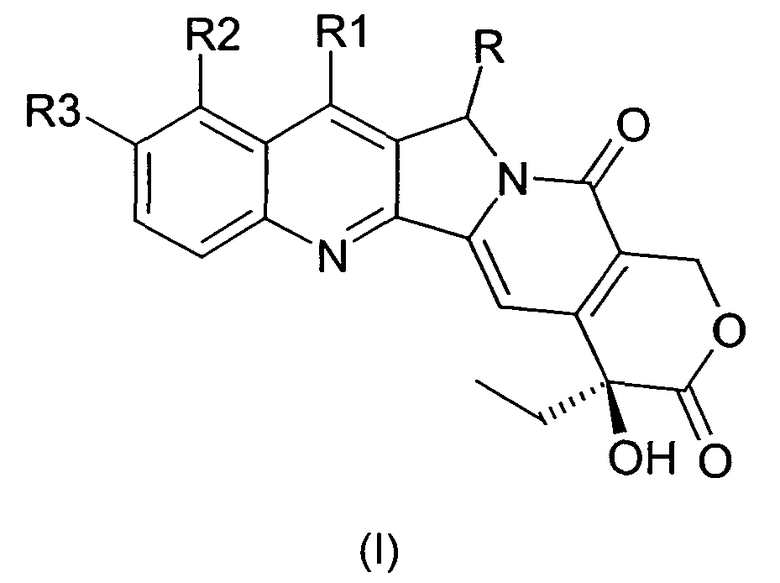
где
R представляет собой F, Cl, Br, I, -N3, NH2, -NR'R", -COOR', -CONR'R", -NHR'"-NR'R", в котором R', R" и R'" могут представлять собой H, алкил, арил, арилалкил, ацил, алкоксикарбонил, арилоксикарбонил;
R1 представляет собой алкил, аминоалкил, гидроксиалкил, нитрил, алкоксиминогруппу, арилоксиминогруппу, силилалкил;
R2 представляет собой водород, гидроксил, алкоксигруппу, аминоалкил;
R3 представляет собой водород, необязательно защищенный гидроксил, алкоксигруппу, аминоалкил;
где алкил, ацил, алкоксигруппа, аминоалкил или алкоксиминогруппа могут содержать от 1 до 8, предпочтительно от 1 до 4 атомов углерода в прямой или разветвленной цепи, и арил и арилоксигруппа могут содержать от 5 до 10 атомов углерода;
их фармацевтически приемлемым солям, изомерам, энантиомерам, диастереомерам и соответствующим смесям.
Соединения согласно настоящему изобретению показывают низкое белковое связывание и обладают хорошей растворимостью и высокой эффективностью даже в очень малых дозах.
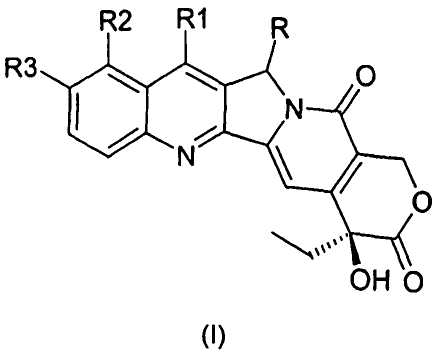
Предпочтительный путь синтеза для получения соединений согласно настоящему изобретению иллюстрирован на схеме и включает в себя следующие стадии:
a) защиту гидроксигрупп предшественника;
b) дериватизацию в положении 5 посредством образования карбаниона и реакции с электрофильным реагентом;
c) снятие защиты с гидроксигрупп.
Схема
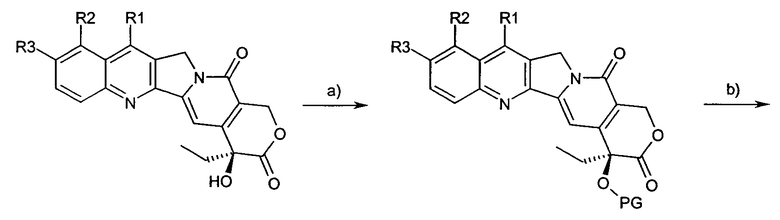
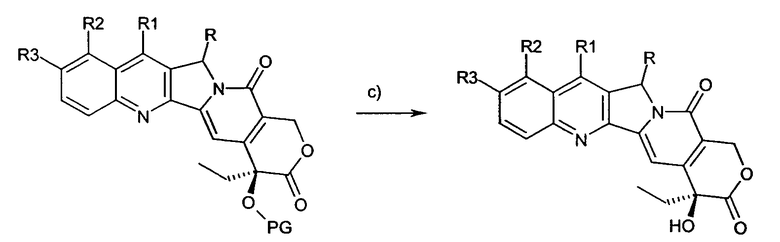
На схеме R, R1, R2 и R3 имеют значения, описанные выше, и PG представляет собой защитную группу гидроксила.
Предшественники могут быть доступными коммерчески или их можно получить, как описано в литературе.
Карбанионы в положении 5 можно получить обработкой предшественника сильным органическим основанием, предпочтительно LiHMDS.
Карбанион реагирует in situ с электрофильным реагентом, таким как источник галогена или азадикарбоксилат, изоцианат, хлоркарбонильное производное, тозилазид.
В качестве защитных групп гидроксилов предпочтительны силилы и карбаматы или их комбинации.
Соединения согласно настоящему изобретению испытывали в тестах на цитотоксичность в широкой группе опухолевых клеток. В качестве примера сообщают данные о цитотоксичности на линии клеток NCI-H460 (рак NSCL), относящиеся к двум соединениям формулы (I), с использованием камптотецина и препаратов топотекана и SN-38 в качестве сравнительных веществ:
IC50 (мкг/мл)
Количество клеток
мол.м.=348,36
C20H16N2O4

мол.м.=421
C23H23N3O5
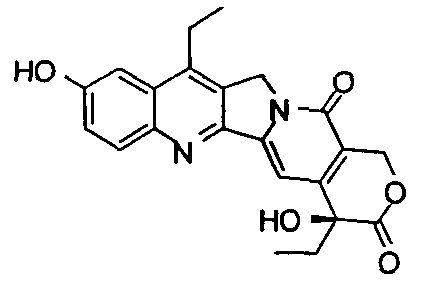
мол.м.=392,42
C22H20N2O5
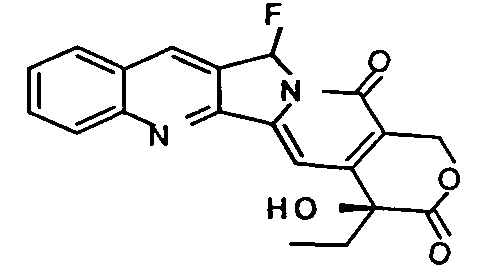
мол.м.=366
C20H15FN2O4
20,6±6,8
Изомер 2:
20±5,1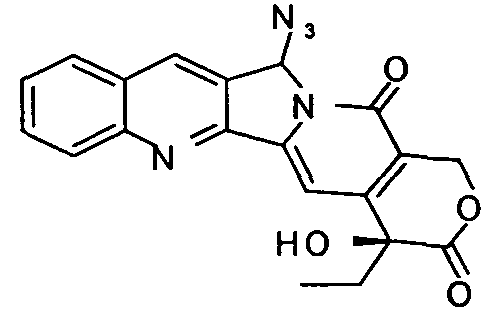
мол.м.=389
C20H15N5O4
4,18±1,2
Изомер 2:
2,59±0,7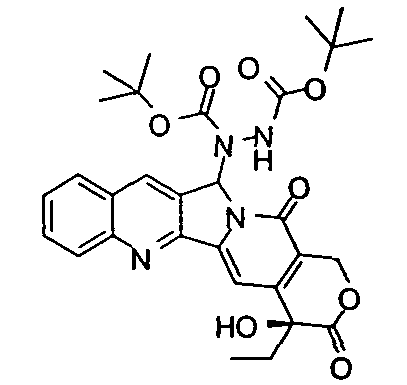
мол.м.=578,63
C30H34N4O8
50±16
Изомер 2: >100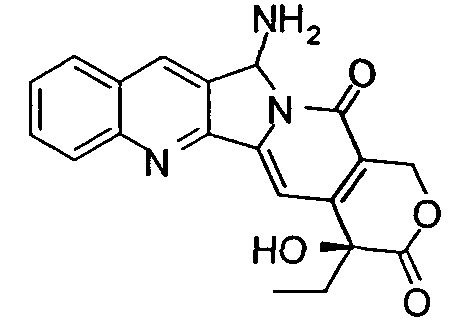
мол.м.=363,38
C20H17N3O4
мол.м.=646,66
C36H30N4O8
55±15
Изомеры 2:
39±9,7
Наиболее активные соединения оценивали в исследовании расщепления ДНК, измеряя активную концентрацию и устойчивость к повреждению (см. раздел “Примеры”). Производные формулы (I) демонстрируют удивительно более высокую устойчивость в блокировании репликации ДНК, чем сравнительные стандарты (особенно топотекан и камптотецин), сохраняя при этом эффективную цитотоксическую активность.
В следующем аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим соединение формулы (I) вместе с фармацевтически приемлемыми носителями и эксципиентами. Фармацевтические формы, подходящие для перорального или парентерального введения соединений (I), могут быть твердыми, предпочтительно капсулами, таблетками и гранулами, или жидкими, предпочтительно растворами для инъекций или инфузий.
Подходящим образом разработанные рецептуры соединения согласно настоящему изобретению можно применять для лечения солидных опухолей и лейкозов, в частности опухолей легкого, яичника, груди, желудка, печени, простаты, сарком мягких тканей, головы и шеи, пищевода, поджелудочной железы, толстой кишки, прямой кишки, глиобластомы, хронических и острых миелоцитарных лейкозов.
ПРИМЕРЫ
ПРИМЕР I - 20-OTES-камптотецин
Камптотецин (0,100 г, 0,287 ммоль) суспендировали в безводном диметилформамиде (3 мл) в инертной атмосфере и к полученной суспензии добавляли имидазол (0,980 г, 1,44 ммоль). Смесь перемешивали 10 минут, затем в нее по каплям добавляли триэтилсилилхлорид (TES-Cl) (0,193 мл, 1,15 ммоль), с последующим добавлением 4-диметиламинопиридина (DMAP) (0,040 г 0,287 ммоль). Спустя 46 ч реакционную смесь выпаривали в вакууме (контролируя с помощью ТСХ полное исчезновение реагента, элюент CH2Cl2/MeOH=30/1). Твердое вещество затем снова растворяли в CH2Cl2 и промывали H2O и насыщенным NH4Cl. Водную фазу экстрагировали CH2Cl2 (2×10 мл). Органические фазы объединяли, сушили над Na2SО4, фильтровали и концентрировали в вакууме, получая желаемый продукт (0,133 г, 0,287 ммоль) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,37 (с, 1H, Ar, H-7), 8,25 (д, 1H, J=8,4 Гц, Ar), 7,92 (д, 1H, J=8,0 Гц, Ar), 7,82 (т, 1H, J=8,0 Гц, Ar), 7,65 (т, 1H, J=8,4 Гц, Ar), 7,57 (с, 1H, H-14), 5,67 (д, 1H, J=16,4 Гц, H-17), 5,29 (с, 2H, H-5), 5,25 (д, 1H, J=16,4 Гц, H-17), 2,00-1,84 (м, 2H, H-19), 1,03-0,93 (м, 12H), 0,80-0,71 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,7, 157,6, 152,5, 151,5, 149,0, 145,9, 130,9, 130,4, 130,0, 128,4, 128,1, 128,0, 127,9, 118,9, 94,4, 75,3, 66,0, 50,0, 33,2, 7,9, 7,2, 6,4.
ПРИМЕР II - 20-OTES SN-38
SN-38 (0,100 г, 0,255 ммоль) суспендировали в безводном диметилформамиде (5 мл) в инертной атмосфере и к полученной суспензии добавляли имидазол (0,087 г, 1,28 ммоль). Смесь перемешивали 10 минут, затем в нее по каплям добавляли триэтилсилилхлорид (TES-Cl) (0,171 мл, 1,02 ммоль), с последующим добавлением 4-диметиламинопиридина (DMAP) (0,031 г 0,255 ммоль). Спустя 52 ч реакционную смесь выпаривали в вакууме, контролируя с помощью ТСХ (CH2Cl2/MeOH=10/1) полное исчезновение реагента. Твердое вещество затем снова растворяли в CH2Cl2 и промывали H2O и насыщенным NH4Cl. Водную фазу экстрагировали CH2Cl2 (2×10 мл). Органические фазы объединяли, сушили над Na2SО4, фильтровали и концентрировали в вакууме, получая желаемый продукт (0,121 г, 0,240 ммоль, 94%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 9,26 (ушир.с, 1H, OH), 8,14 (д, 1H, J=9,2 Гц, Ar, H-12), 7,58 (с, 1H, H-14), 7,49 (дд, 1H, J1=9,2 Гц, J2=2,2 Гц, H-11), 7,46 (д, 1H, J=2,2 Гц, H-9), 5,70 (д, 1H, J=16,5 Гц, H-17), 5,28 (д, 1H, J=16,5 Гц, H-17), 5,23 (с, 2H, H-5), 3,05 (кв, 2H, J=7,5 Гц), 1,97-1,81 (м, 2H, H-19), 1,32 (т, 3H, J=7,5 Гц, Me), 0,98-0,88 (м, 12H), 0,77-0,68 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 172,1, 157,9, 156,6, 152,1, 149,0, 146,7, 144,6, 143,6, 131,9, 128,7, 126,9, 122,8, 117,9, 105,5, 98,5, 75,4, 65,9, 49,5, 32,9, 23,2, 13,5, 7,8, 7,2, 6,4.
ПРИМЕР III - 10-OTBDMS-20-OTES SN-38
20-OTES SN-38 (0,121 г, 0,240 ммоль) растворяли в безводной смеси CH2Cl2/THF = 1:1 (8 мл) в инертной атмосфере. Туда же добавляли имидазол (0,081 г, 1,20 ммоль), с последующим добавлением через 10 минут трет-бутилдиметилсилилхлорида (TBDMS-Cl) (0,144 мг, 0,957 ммоль) и затем 4-диметиламинопиридина (DMAP) (0,029 г, 0,240 ммоль). Спустя 18 ч реакционную смесь выпаривали в вакууме, контролируя с помощью ТСХ (гексан/AcOEt = 1/1) исчезновение реагента. Затем твердое вещество снова растворяли в CH2Cl2 и промывали H2O и насыщенным NH4Cl. Водную фазу экстрагировали CH2Cl2 (2×10 мл) и органические фазы объединяли, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией (SiО2, гексан/AcOEt = 1/1), таким образом получая желаемый продукт (0,127 г, 0,205 ммоль, 85%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,14 (д, 1H, J=8,8 Гц, Ar, H-12), 7,49 (с, 1H, H-14), 7,40 (д, 1H, J=2,2 Гц, H-9), 7,38 (дд, 1H, J1=8,8 Гц J2=2,5 Гц, H-11), 5,67 (д, 1H, J=16,5 Гц, H-17), 5,25 (д, 1H, J=16,5 Гц, H-17), 5,23 (с, 2H, H-5), 3,11 (кв, 2H, J=7,6 Гц), 1,99-1,82 (м, 2H, H-19), 1,38 (т, 3H, J=7,6 Гц, Me), 1,04 (с, 9H), 1,00-0,92 (м, 12H), 0,78-0,69 (м, 6H), 0,30 (с, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,9, 157,7, 155,1, 151,5, 150,1, 146,8, 145,6, 143,5, 132,2, 128,2, 126,9, 125,9, 118,0, 110,5, 97,7, 75,4, 66,0, 49,3, 33,2, 25,6, 23,1, 18,3, 13,7, 7,9, 7,2, 6,4, 4,3.
ПРИМЕР IV - 20-OTES топотекан
Топотекан (0,100 г, 0,238 ммоль) суспендировали в безводном диметилформамиде (5 мл) в инертной атмосфере и к полученной суспензии добавляли имидазол (0,081 г, 1,19 ммоль). Смесь перемешивали 10 минут, затем в нее по каплям добавляли триэтилсилилхлорид (TES-Cl) (0,160 мл, 0,952 ммоль), с последующим добавлением 4-диметиламинопиридина (DMAP) (0,029 г, 0,238 ммоль). Спустя 52 ч реакционную смесь выпаривали в вакууме, контролируя с помощью ТСХ (CH2Cl2/MeOH = 10/1) полное исчезновение реагента. Твердое вещество затем снова растворяли в CHCl3 и H2O и насыщенном NH4Cl, водную фазу экстрагировали CHCl3 (2×15 мл). Органические фазы объединяли, сушили над Na2SО4, фильтровали и концентрировали в вакууме, таким образом получая желаемый продукт (0,120 г, 0,224 ммоль, 94%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 9,65 (ушир.с, 1H), 8,26 (с, 1H, Ar, H-7), 8,14 (д, 1H, J=8,8 Гц, Ar, H-12), 7,80 (д, 1H, J=8,8 Гц, Ar, H-11), 7,58 (с, 1H, H-14), 5,67 (д, 1H, J=16,5 Гц, H-17), 5,25 (д, 1H, J=16,5 Гц, H-17), 5,20 (с, 2H, H-5), 4,71 (с, 2H), 2,81 (с, 6H, 2 Me), 1,97-1,81 (м, 2H, H-19), 0,98-0,88 (м, 12H), 0,77-0,68 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 172,1, 157,9, 156,6, 152,1, 150,8, 146,8, 144,3, 134,3, 131,2, 129,9, 127,9, 123,0, 118,9, 110,1, 98,5, 75,4, 65,9, 51,1, 50,0, 43,1, 32,9, 7,8, 7,2, 6,4.
ПРИМЕР V - 10-OTBDMS 20-OTES топотекан
20-OTES топотекан (0,120 г, 0,224 ммоль) растворяли в безводной смеси CH2Cl2/THF = 1:1 (8 мл) в инертной атмосфере. Добавляли имидазол (0,076 г, 1,12 ммоль), с последующим добавлением через 10 минут трет-бутилдиметилсилилхлорида (TBDMS-Cl), (0,135 мг, 0,896 ммоль), а затем 4-диметиламинопиридина (DMAP), (0,027 г, 0,224 ммоль). Спустя 21 ч реакционную смесь выпаривали в вакууме, контролируя с помощью ТСХ (гексан/AcOEt = 1/1) исчезновение реагента. Затем твердое вещество снова растворяли в CHCl3 и H2O и насыщенном NH4Cl, водную фазу экстрагировали CHCl3 (2×15 мл). Органические фазы объединяли и сушили над Na2SО4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией (SiО2, гексан/AcOEt = 1/1), таким образом получая желаемый продукт (0,116 г, 0,179 ммоль, 80%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,26 (с, 1H, Ar, H-7), 8,14 (д, 1H, J=8,8 Гц, Ar, H-12), 7,81 (д, 1H, J=8,8 Гц, Ar, H-11), 7,59 (с, 1H, H-14), 5,64 (д, 1H, J=16,5 Гц, H-17), 5,22 (д, 1H, J=16,5 Гц, H-17), 5,19 (с, 2H, H-5), 4,71 (с, 2H), 2,81 (с, 6H, 2 Me), 1,97-1,81 (м, 2H, H-19), 1,04 (с, 9H), 0,98-0,88 (м, 12H), 0,77-0,68 (м, 6H), 0,30 (с, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,7, 157,7, 155,1, 151,5, 150,0, 146,8, 144,3, 134,3, 131,2, 129,9, 127,9, 123,0, 118,9, 110,1, 98,5, 75,4, 65,9, 51,1, 50,0, 43,9, 32,9, 25,6, 18,3, 7,8, 7,2, 6,4, -4,3.
ПРИМЕР VI - Получение 20-OTES 10-гидроксикамптотецина
10-Гидроксикамптотецин (0,100 г, 0,275 ммоль) суспендировали в безводном диметилформамиде (5 мл) в инертной атмосфере и к полученной суспензии добавляли имидазол (0,225 г, 3,31 ммоль). Смесь перемешивали 10 минут, затем в нее по каплям добавляли триэтилсилилхлорид (TES-Cl) (0,460 мл, 2,75 ммоль), с последующим добавлением 4-диметиламинопиридина (DMAP) (0,068 г, 0,550 ммоль). Спустя 24 ч реакционную смесь выпаривали в вакууме, контролируя с помощью ТСХ полное исчезновение реагента (CH2Cl2/MeOH = 20/1). Твердое вещество затем снова растворяли в CH2Cl2 и промывали H2O и насыщенным NH4Cl. Водную фазу экстрагировали CH2Cl2 (2×10 мл). Органические фазы объединяли, сушили над Na2SО4, фильтровали и концентрировали в вакууме, таким образом получая желаемый продукт (0,124 г, 0,259 ммоль, 94%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3 + 5% CD3OD, 400 МГц) δ 8,10 (с, 1H, Ar, H-7), 8,05 (д, 1H, J=9,2 Гц, Ar), 7,50 (с, 1H, H-14), 7,39 (дд, 1H, J1=9,2 Гц, J2=2,4 Гц, H-11), 7,11 (д, 1H, J=2,2 Гц, H-9), 5,60 (д, 1H, J=16,4 Гц, H-17), 5,21 (д, 1H, J=16,4 Гц, H-17), 5,15 (с, 2H, H-5), 1,97-1,81 (м, 2H, H-19), 0,98-0,88 (м, 12), 0,76-0,68 (м, 6H). 13C ЯМР (CDCl3 + 5% CD3OD, 100 МГц) δ 172,2, 157,8, 156,7, 151,8, 149,2, 146,1, 144,1, 130,9, 129,8, 129,0, 128,6, 123,2, 117,8, 108,8, 98,1, 75,4, 65,8, 50,0, 32,9, 7,7, 7,1, 6,3.
ПРИМЕР VII - 10-OTBDMS-20-OTES камптотецин
10-Гидрокси-20-OTES-камптотецин (0,105 г, 0,219 ммоль) растворяли в безводной смеси CH2Cl2/THF = 1:1 (4 мл) и в инертной атмосфере. Добавляли имидазол (0,097 г, 1,42 ммоль), с последующим добавлением через 10 минут трет-бутилдиметилсилилхлорида (TBDMS-Cl), (0,164 мг, 1,10 ммоль), а затем 4-диметиламинопиридина (DMAP), (0,040 г, 0,329 ммоль). Спустя 18 ч реакционную смесь выпаривали в вакууме, контролируя с помощью ТСХ (циклогексан/AcOEt = 1/3) исчезновение реагента. Затем твердое вещество снова растворяли в CH2Cl2 и промывали H2O и насыщенным NH4Cl, водную фазу экстрагировали CH2Cl2 (2×10 мл). Органические фазы объединяли и сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией (SiО2, циклогексан/AcOEt = 1/3), таким образом получая желаемый продукт (0,117 г, 0,197 ммоль, 90%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,22 (с, 1H, Ar, H-7), 8,13 (д, 1H, J=9,2 Гц, Ar, H-12), 7,51 (с, 1H, H-14), 7,39 (дд, 1H, J1=9,2 Гц, J2=2,8 Гц, H-11), 7,22 (д, 1H, J=2,8 Гц, H-9), 5,66 (д, 1H, J=16,5 Гц, H-17), 5,25 (с, 2H, H-5), 5,24 (д, 1H, J=16,5 Гц, H-17), 1,99-1,82 (м, 2H, H-19), 1,03 (с, 9H), 1,00-0,92 (м, 12H), 0,78-0,69 (м, 6H), 0,29 (с, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 172,0, 157,7, 155,1, 151,5, 150,6, 146,1, 145,1, 131,4, 129,4, 129,3, 128,7, 126,7, 118,3, 114,5, 97,7, 75,3, 66,0, 49,9, 33,1, 25,6, 18,3, 7,9, 7,2, 6,4, -4,3.
ПРИМЕР VIII - 5-F-20-OTES-камптотецин
Камптотецин 20-OTES (0,100 г, 0,216 ммоль) растворяли в безводном THF (6 мл) при перемешивании в инертной атмосфере, затем охлаждали до температуры -78°C и по каплям добавляли 1,0M раствор LiHMDS в THF (0,260 мл, 0,260 ммоль). Через 20 минут добавляли NFSI (0,089 г, 0,281 ммоль) в безводном THF (2 мл). После инкубирования при -78°C в течение 2 ч температуре давали подняться до 25°C и исчезновение реагента контролировали с помощью ТСХ (гексан/AcOEt = 1/2). Наблюдали образование двух диастереомеров. После инкубирования при комнатной температуре в течение 3 ч реакцию гасили добавлением насыщенного NH4Cl. Водную фазу экстрагировали CH2Cl2 (3×15 мл) и органические фазы объединяли, сушили над Na2SО4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией (SiО2, гексан/AcOEt = 3/1, затем 2/1 и окончательно 1/1), таким образом получая смесь двух изомеров (0,101 г, 0,210 ммоль, 97%) (отношение изомеров 1:1) в виде бледно-желтого твердого вещества. Два изомера разделяли дополнительной хроматографией. В порядке элюции:
Первый диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,52 (с, 1H, Ar, H-7), 8,25 (д, 1H, J=8,4 Гц, Ar), 7,96 (д, 1H, J=8,4 Гц, Ar), 7,87 (т, 1H, J=8,4 Гц, Ar), 7,69 (т, 1H, J=8,4 Гц, Ar), 7,47 (д, 1H, 1JHF=61,2 Гц, H-5), 7,45 (с, 1H, H-14), 5,62 (д, 1H, J=16,8 Гц, H-17), 5,22 (д, 1H, J=16,8 Гц, H-17), 2,02-1,84 (м, 2H, H-19), 1,03-0,93 (м, 12H), 0,80-0,71 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,4, 157,5, 152,3, 151,1, 150,2 (д, J=1,5 Гц), 150,3 (д, J=1,5 Гц), 143,6 (д, J=5,3 Гц), 133,7, 131,7, 130,2, 128,9, 128,4, 127,9 (д, J=15,0 Гц), 126,3 (д, J=15,0 Гц), 121,8, 98,9, 93,8 (д, 1JCF = 213,2 Гц, C-5), 75,1, 65,7, 33,1, 7,8, 7,2, 6,4.
Второй диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,51 (с, 1H, Ar, H-7), 8,25 (д, 1H, J=8,4 Гц, Ar), 7,96 (д, 1H, J=8,4 Гц, Ar), 7,87 (т, 1H, J=8,4 Гц, Ar), 7,68 (т, 1H, J=8,4 Гц, Ar), 7,51 (д, 1H, 1JHF=60,8 Гц, H-5), 7,42 (с, 1H, H-14), 5,62 (д, 1H, J=17,2 Гц, H-17), 5,20 (д, 1H, J=17,2 Гц, H-17), 2,02-1,82 (м, 2H, H-19), 1,04-0,93 (м, 12H), 0,80-0,71 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,2, 157,8, 152,5, 151,2, 150,3, 143,7, 133,7 (д, J=2,4 Гц), 131,7, 130,2, 128,9, 128,3, 127,9 (д, J=2,3 Гц), 126,3 (д, J=16,7 Гц), 121,8 (д, J=1,5 Гц), 99,0, 93,8 (д, 1JCF=214,8 Гц, C-5), 75,0, 65,8, 33,3, 7,9, 7,1, 6,4.
ПРИМЕР IX - Получение первого диастереомера 5-F-камптотецина
Первый диастереомер 5-F-20-OTES-камптотецина (0,025 г, 0,052 ммоль) растворяли в безводном THF (5 мл) при перемешивании в инертной атмосфере. Затем по каплям добавляли Et3N·3HF (0,060 мл, 0,368 ммоль). Реакционной смеси давали реагировать в течение 28 ч при комнатной температуре, контролируя с помощью ТСХ исчезновение реагента (гексан/AcOEt = 1/2). Растворитель выпаривали в вакууме и остаток хроматографировали (SiO2, гексан/AcOEt=1/1), таким образом получая желаемый продукт (0,019 г, 0,051 ммоль, 98%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,52 (с, 1H, Ar, H-7), 8,25 (д, 1H, J=8,4 Гц, Ar), 7,96 (д, 1H, J=8,4 Гц, Ar), 7,87 (т, 1H, J=8,4 Гц, Ar), 7,69 (т, 1H, J=8,4 Гц, Ar), 7,59 (с, 1H, H-14), 7,46 (д, 1H, 1JHF=61,2 Гц, H-5), 5,69 (д, 1H, J=16,8 Гц, H-17), 5,26 (д, 1H, J=16,8 Гц, H-17), 3,87 (ушир.с, 1H, OH), 2,01-1,81 (м, 2H, H-19), 1,05 (т, 3H, J=7,6 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,5, 157,6, 151,1, 151,0, 150,2, 144,1, 133,9, 131,9, 130,0, 129,0, 128,5, 127,8, 126,4, 121,7, 98,8, 93,8 (д, 1JCF=214,0 Гц, C-5), 72,5, 66,0, 31,5, 7,8.
ПРИМЕР X - Получение второго диастереомера 5-F-камптотецина
Второй диастереомер 5-F-20-OTES-камптотецина (0,025 г, 0,052 ммоль) растворяли в безводном THF (5 мл) при перемешивании в инертной атмосфере. Затем по каплям добавляли Et3N·3HF (0,060 мл, 0,368 ммоль). Реакционной смеси давали реагировать в течение 28 ч при комнатной температуре, контролируя с помощью ТСХ исчезновение реагента (гексан/AcOEt = 1/2). Растворитель выпаривали в вакууме и остаток хроматографировали (SiO2, гексан/AcOEt = 1/1), таким образом получая желаемый продукт (0,018 г, 0,050 ммоль, 97%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,52 (с, 1H, Ar, H-7), 8,24 (д, 1H, J=8,4 Гц, Ar), 7,96 (д, 1H, J=8,4 Гц, Ar), 7,88 (т, 1H, J=8,4 Гц, Ar), 7,69 (т, 1H, J=8,4 Гц, Ar), 7,56 (с, 1H, H-14), 7,51 (д, 1H, 1JHF=60,4 Гц, H-5), 5,69 (д, 1H, J=16,4 Гц, H-17), 5,25 (д, 1H, J=16,4 Гц, H-17), 3,87 (ушир.с, 1H, OH), 1,98-1,78 (м, 2H, H-19), 1,04 (т, 3H, J=7,6 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,3, 157,7, 151,2, 151,2, 150,2, 144,2, 133,8, 131,9, 130,0, 129,0, 128,5, 127,8, 126,4, 121,6, 98,9, 93,7 (д, 1JCF=214,0 Гц, C-5), 72,5, 66,1, 31,6, 7,8.
ПРИМЕР XI - Получение 5-N 3 -20-OTES-камптотецина
Камптотецин 20-OTES (0,100 г, 0,216 ммоль) растворяли в безводном THF (6 мл) при перемешивании в инертной атмосфере, затем охлаждали до температуры -78°C и по каплям добавляли 1,0M раствор LiHMDS в THF (0,260 мл, 0,260 ммоль). Через 20 минут добавляли тозилазид (TsN3) (0,055 г, 0,281 ммоль) в безводном THF (2 мл). После инкубирования при -78°C в течение 2 ч температуре давали подняться до 25°C и исчезновение реагента контролировали с помощью ТСХ (гексан/AcOEt = 2/1). Наблюдали образование двух диастереомеров. После инкубирования при комнатной температуре в течение 2 ч 30 мин реакцию гасили добавлением насыщенного NH4Cl. Водную фазу экстрагировали CH2Cl2 (3×15 мл) и органические фазы объединяли, сушили над Na2SО4, фильтровали и концентрировали в вакууме. Остаток, состоящий из двух диастереомеров, очищали флэш-хроматографией (SiО2, гексан/AcOEt = 3/1, затем 2/1 и окончательно 1/1), таким образом получая (0,106 г, 0,210 ммоль, 97%) смесь двух изомеров (отношение изомеров 1:1) в виде бледно-желтого твердого вещества. Два изомера разделяли дополнительной хроматографией. В порядке элюции:
Первый диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,45 (с, 1H, Ar, H-7), 8,25 (д, 1H, J=8,4 Гц, Ar), 7,95 (д, 1H, J=8,4 Гц, Ar), 7,86 (т, 1H, J=8,4 Гц, Ar), 7,68 (т, 1H, J=8,4 Гц, Ar), 7,49 (с, 1H, H-14), 6,97 (с, 1H, H-5), 5,65 (д, 1H, J=16,8 Гц, H-17), 5,26 (д, 1H, J=16,8 Гц, H-17), 2,01-1,84 (м, 2H, H-19), 1,03-0,94 (м, 12H), 0,80-0,71 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,6, 158,3, 152,2, 150,8, 150,0, 144,0, 132,9, 131,4, 130,1, 128,6, 128,3, 128,2, 128,1, 120,8, 98,7, 75,4, 75,2, 65,7, 33,1, 7,9, 7,2, 6,4.
Второй диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,45 (с, 1H, Ar, H-7), 8,24 (д, 1H, J=8,4 Гц, Ar), 7,95 (д, 1H, J=8,4 Гц, Ar), 7,86 (т, 1H, J=8,4 Гц, Ar), 7,68 (т, 1H, J=8,4 Гц, Ar), 7,46 (с, 1H, H-14), 6,99 (с, 1H, H-5), 5,66 (д, 1H, J=16,8 Гц, H-17), 5,22 (д, 1H, J=16,8 Гц, H-17), 2,02-1,84 (м, 2H, H-19), 1,03-0,94 (м, 12H), 0,80-0,71 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,4, 158,4, 152,3, 150,9, 150,0, 144,0, 132,9, 131,4, 130,1, 128,6, 128,3, 128,2, 128,1, 120,8, 98,7, 75,3, 75,1, 65,8, 33,3, 7,9, 7,2, 6,4.
ПРИМЕР XII - Получение первого диастереомера 5-N 3 -камптотецина
Диастереомер 1 5-N3-20-OTES-камптотецина (0,070 г, 0,139 ммоль) растворяли в безводном THF (6 мл) при перемешивании в инертной атмосфере, затем по каплям добавляли Et3N·3HF (0,170 мл, 1,016 ммоль). Реакционной смеси давали реагировать в течение 26 ч при комнатной температуре, контролируя с помощью ТСХ исчезновение реагента (гексан/AcOEt = 1/1). Растворитель выпаривали в вакууме и остаток очищали флэш-хроматографией (SiO2, гексан/AcOEt = 1/1), таким образом получая желаемый продукт (0,053 г, 0,136 ммоль, 98%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,44 (с, 1H, Ar, H-7), 8,24 (д, 1H, J=8,4 Гц, Ar), 7,93 (д, 1H, J=8,4 Гц, Ar), 7,85 (т, 1H, J=8,4 Гц, Ar), 7,67 (т, 1H, J=8,4 Гц, Ar), 7,63 (с, 1H, H-14), 6,97 (с, 1H, H-5), 5,70 (д, 1H, J=16,8 Гц, H-17), 5,29 (д, 1H, J=16,8 Гц, H-17), 3,99 (ушир.с, 1H, OH), 2,00-1,84 (м, 2H, H-19), 1,04 (т, 3H, J=7,6 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,6, 158,3, 150,8, 150,7, 149,8, 144,4, 133,1, 131,5, 129,9, 128,6, 128,3, 128,3, 128,1, 120,6, 98,6, 75,4, 72,7, 66,0, 31,5, 7,8.
ПРИМЕР XIII - Получение второго диастереомера 5-N 3 -камптотецина
Диастереомер 2 5-N3-20-OTES-камптотецина (0,055 г, 0,109 ммоль) растворяли в безводном THF (6 мл) при перемешивании в инертной атмосфере, затем по каплям добавляли Et3N·3HF (0,135 мл, 0,820 ммоль). Реакционной смеси давали реагировать в течение 26 ч при комнатной температуре, контролируя с помощью ТСХ исчезновение реагента (гексан/AcOEt = 1/1). Растворитель выпаривали в вакууме и остаток очищали флэш-хроматографией (SiO2, гексан/AcOEt = 1/1), таким образом получая желаемый продукт (0,042 г, 0,107 ммоль, 98%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3, 400 МГц) δ 8,45 (с, 1H, Ar, H-7), 8,23 (д, 1H, J=8,4 Гц, Ar), 7,95 (д, 1H, J=8,4 Гц, Ar), 7,85 (т, 1H, J=8,4 Гц, Ar), 7,68 (т, 1H, J=8,4 Гц, Ar), 7,60 (с, 1H, H-14), 7,00 (с, 1H, H-5), 5,74 (д, 1H, J=16,8 Гц, H-17), 5,28 (д, 1H, J=16,8 Гц, H-17), 3,86 (ушир.с, 1H, OH), 1,98-1,82 (м, 2H, H-19), 1,04 (т, 3H, J=7,6 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,4, 158,4, 150,9, 150,7, 149,8, 144,5, 133,0, 131,5, 129,9, 128,6, 128,4, 128,3, 128,1, 120,6, 98,6, 75,3, 72,6, 66,1, 31,6, 7,8.
ПРИМЕР XIV - Получение 5-NH 2 -камптотецина
Диастереомер 2 5-N3-20-OH-камптотецина (0,050 г, 0,129 ммоль) растворяли в смеси безводного THF (1,5 мл) и безводного MeOH (6 мл) при перемешивании в инертной атмосфере, после чего добавляли Pd/C (14 мг, ~10%) и проводили два цикла вакуум/H2 (H2 при давлении баллона). Реакционной смеси давали реагировать в течение 3 ч при комнатной температуре, контролируя с помощью ТСХ (гексан/AcOEt = 1/3) исчезновение реагента, затем фильтровали через целит и промывали CH2Cl2 (2×15 мл). Растворитель выпаривали в вакууме. 1H-ЯМР-спектроскопия неочищенной реакционной смеси выявляла присутствие желаемого продукта в виде 1:1-смеси двух эпимеров в положении С5. Флэш-хроматография (SiO2, CH2Cl2/MeOH = 35/1, затем 25/1) позволяла получить смесь двух диастереомеров (0,046 г, 0,126 ммоль, 98%).
1H ЯМР (CDCl3, 400 МГц) δ 8,48 (с, 1H, Ar, H-7), 8,22-8,17 (м, 1H, Ar), 7,95-7,90 (м, 1H, Ar), 7,85-7,78 (м, 1H, Ar), 7,68-7,60 (м, 1H, Ar), 7,58 (с, 0,5H, H-14), 7,54 (с, 0,5H, H-14), 6,50 (с, 0,5H, H-5), 6,47 (с, 0,5H, H-5), 5,74-5,64 (м, 1H, H-17), 5,28-5,22 (м, 1H, H-17), 4,00-2,40 (ушир.с, 3H, OH + NH2), 1,98-1,82 (м, 2H, H-19), 1,07-1,01 (м, 3H, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,8 (2C), 158,5 (2C), 151,2 (2C), 150,4 (2C), 149,7 (2C), 144,5 (2C), 132,7 (2C), 131,0 (2C), 129,8 (2C), 128,5 (2C), 128,3 (2C), 128,0 (2C), 127,8 (2C), 120,2 (2C), 113,8 (2C), 97,7 (2C), 72,7 (2C), 66,3, 66,0, 31,5 (2C), 7,8, 7,8.
ПРИМЕР XV - 5-ди-трет-бутоксикарбонилгидразино-20-OTES-камптотецин
Камптотецин 20-OTES (0,100 г, 0,216 ммоль) растворяли в безводном THF (6 мл) при перемешивании в инертной атмосфере, затем охлаждали до температуры -78°C и по каплям добавляли 1,0M раствор LiHMDS в THF (0,281 мл, 0,281 ммоль). Спустя 20 минут добавляли ди-трет-бутилазодикарбоксилат (DTBAC) (0,075 г, 0,324 ммоль) в безводном THF (2 мл). После инкубирования в течение 4 ч при -78°C контролировали исчезновение реагента с помощью ТСХ (гексан/AcOEt = 3/1). Наблюдали образование двух диастереомеров. Реакцию гасили добавлением насыщенного NH4Cl. Водную фазу экстрагировали CH2Cl2 (3×15 мл) и органические фазы объединяли, сушили над Na2SО4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией (SiО2, гексан/AcOEt = 3/1), таким образом получая смесь двух изомеров (0,145 г, 0,210 ммоль, 97%). Два изомера разделяли дополнительной хроматографией. В порядке элюции:
Первый диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,80 (ушир.с, 1H, Ar), 8,23 (д, 1H, J=8,4 Гц, Ar), 8,01 (ушир.д, 1H, Ar), 7,90-7,71 (м, 2H, Ar), 7,70-7,45 (м, 2H, Ar + H-14), 6,52 (ушир.с, 1H, H-5), 5,61 (д, 1H, J=16,8 Гц, H-17), 5,23 (д, 1H, J=16,8 Гц, H-17), 2,03-1,81 (м, 2H, H-19), 1,79-1,08 (ушир.с, 18H), 1,06-0,92 (м, 12H), 0,80-0,70 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,7, 157,8, 155,5, 155,5, 152,0, 152,0, 151,2, 149,4, 145,0, 132,1, 130,6, 130,0, 128,7, 128,4, 127,9, 119,9, 98,2, 82,7, 81,5, 79,7, 75,2, 65,7, 33,2, 28,3, 27,6, 7,7, 7,2, 6,4.
Второй диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,79 (ушир.с, 1H, Ar), 8,23 (д, 1H, J=8,4 Гц, Ar), 8,01 (ушир.д, 1H, Ar), 7,85-7,76 (м, 2H, Ar), 7,65 (ушир.т, 1H, J=8,4 Гц, Ar), 7,52 (с, 1H, H-14), 6,54 (ушир.с, 1H, H-5), 5,61 (д, 1H, J=16,8 Гц, H-17), 5,22 (д, 1H, J=16,8 Гц, H-17), 2,03-1,82 (м, 2H, H-19), 1,76-1,08 (ушир.с, 18H), 1,04-0,92 (м, 12H), 0,80-0,70 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,5, 157,9, 155,5, 155,5, 152,3, 152,0, 151,2, 149,4, 145,1, 132,1, 130,6, 130,0, 128,7, 128,4, 127,9, 119,9, 98,2, 82,9, 81,5, 79,6, 75,2, 65,8, 33,3, 28,3, 27,4, 7,8, 7,2, 6,4.
ПРИМЕР XVI - Получение первого диастереомера 5-ди-трет-бутоксикарбонилгидразинокамптотецина
Первый диастереомер 5-ди-трет-бутоксикарбонилгидразино-20-OTES-камптотецина (0,050 г, 0,072 ммоль) растворяли в безводном THF (4 мл) при перемешивании в инертной атмосфере, после чего по каплям добавляли Et3N·3HF (0,088 мл, 0,542 ммоль). Реакционной смеси давали реагировать в течение 35 ч при комнатной температуре, контролируя с помощью ТСХ исчезновение реагента (гексан/AcOEt = 3/2). Растворитель выпаривали в вакууме и остаток очищали флэш-хроматографией (SiО2, гексан/AcOEt = 3/2), таким образом получая желаемое соединение (0,041 г, 0,071 ммоль, 98%) в виде бледно-желтого твердого вещества.
Продукт дополнительно очищали кристаллизацией из смеси CH2Cl2/пентан = 1/50.
1H ЯМР (CDCl3, 400 МГц) δ 8,77 (ушир.с, 1H, Ar), 8,16 (ушир.д, 1H, J=8,0 Гц, Ar), 7,97 (ушир.с, 1H, Ar), 7,86-7,50 (м, 4H, Ar), 6,51 (ушир.с, 1H, H-5), 5,66 (д, 1H, J=16,4 Гц, H-17), 5,24 (д, 1H, J=16,4 Гц, H-17), 3,86 (ушир.с, 1H, OH), 2,00-1,80 (м, 2H, H-19), 1,79-1,13 (ушир.с, 18H), 1,03 (т, 3H, J=7,6 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,7, 157,9, 155,5, 155,5, 152,1, 151,3, 150,7, 149,6, 145,7, 132,3, 130,7, 129,9, 128,7, 127,9, 127,6, 120,0, 97,9, 82,8, 81,6, 79,7, 72,7, 66,1, 31,8, 28,3, 27,7, 7,7.
ПРИМЕР XVII - Получение второго диастереомера 5-ди-трет-бутоксикарбонилгидразинокамптотецина
Второй диастереомер 5-ди-трет-бутоксикарбонилгидразино-20-OTES-камптотецина (0,050 г, 0,072 ммоль) растворяли в безводном THF (4,5 мл) при перемешивании в инертной атмосфере, после чего по каплям добавляли Et3N·3HF (0,088 мл, 0,542 ммоль). Реакционной смеси давали реагировать в течение 35 ч при комнатной температуре, контролируя с помощью ТСХ исчезновение реагента (гексан/AcOEt = 3/2). Растворитель выпаривали в вакууме и остаток очищали флэш-хроматографией (SiО2, гексан/AcOEt = 3/2), таким образом получая желаемое соединение (0,040 г, 0,069 ммоль, 96%) в виде бледно-желтого твердого вещества. Продукт дополнительно очищали кристаллизацией из смеси CH2Cl2/пентан = 1/50.
1H ЯМР (CDCl3, 400 МГц) δ 8,79 (ушир.с, 1H, Ar), 8,22 (ушир.д, 1H, J=8,4 Гц, Ar), 7,99 (ушир.с, 1H, Ar), 7,88-7,50 (м, 4H, Ar), 6,53 (ушир.с, 1H, H-5), 5,65 (д, 1H, J=16,4 Гц, H-17), 5,26 (д, 1H, J=16,4 Гц, H-17), 3,80 (ушир.с, 1H, OH), 2,00-1,80 (м, 2H, H-19), 1,79-1,13 (ушир.с, 18H), 1,03 (т, 3H, J=7,2 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,6, 157,9, 155,4, 155,4, 152,1, 151,3, 150,8, 149,5, 145,6, 132,3, 130,8, 129,8, 128,7, 127,9, 127,8, 119,8, 98,0, 83,0, 81,5, 79,7, 72,7, 66,3, 31,8, 28,3, 27,7, 7,8.
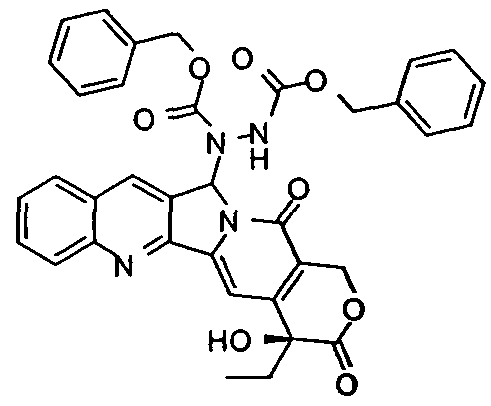
ПРИМЕР XVIII - Получение 5-дибензилоксикарбонилгидразино-20-OTES-камптотецина
Камптотецин 20-OTES (0,100 г, 0,216 ммоль) растворяли в безводном THF (6 мл) при перемешивании в инертной атмосфере, затем охлаждали до температуры -78°C и по каплям добавляли 1,0M раствор LiHMDS в THF (0,281 мл, 0,281 ммоль). Спустя 20 минут добавляли дибензилазодикарбоксилат (0,097 г, 0,324 ммоль) в безводном THF (2 мл). После инкубирования при -78°C в течение 3 ч температуре давали подняться до 25°С и исчезновение реагента контролировали с помощью ТСХ (гексан/AcOEt = 3/1). Наблюдали образование двух диастереомеров. После инкубирования при комнатной температуре в течение 90 мин реакцию гасили добавлением насыщенного NH4Cl. Водную фазу экстрагировали CH2Cl2 (3×15 мл) и органические фазы объединяли, сушили над Na2SО4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией (SiО2, гексан/AcOEt = 4/1, затем 7/2), таким образом получая бледно-желтое твердое вещество (0,161 г, 0,212 ммоль, 98%). Два изомера разделяли дополнительной хроматографией. В порядке элюции:
Первый диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,70 (ушир.с, 1H, Ar), 8,39 (ушир.с, 1H, Ar), 8,22 (ушир.д, 1H, J=7,6 Гц, Ar), 7,95 (ушир.д, 1H, J=7,6 Гц, Ar), 7,83 (ушир.т, 1H, J=7,6 Гц, Ar), 7,65 (ушир.т, 1H, J=7,6 Гц, Ar), 7,64-7,00 (м, 11H, Ar + H-14), 6,49 (ушир.с, 1H, H-5), 5,57 (д, 1H, J=16,4 Гц, H-17), 5,47-4,44 (м, 5H), 1,98-1,82 (м, 2H, H-19), 1,02-0,89 (м, 12H), 0,80-0,70 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,6, 158,0, 156,3, 156,3, 153,0, 152,2, 151,0, 149,6, 144,8, 135,3, 132,1, 130,6, 130,0, 128,6-127,8 (11C), 119,9, 98,4, 79,5, 75,2, 68,4, 67,9, 65,6, 33,0, 7,9, 7,2, 6,4.
Второй диастереомер: 1H ЯМР (CDCl3, 400 МГц) δ 8,85 (ушир.с, 1H, Ar), 8,58 (ушир.с, 1H, Ar), 8,20 (ушир.с, 1H, Ar), 7,93 (ушир.с, Ar), 7,81 (ушир.т, 1H, J=7,6 Гц, Ar), 7,63 (ушир.т, 1H, J=7,6 Гц, Ar), 7,56-6,90 (м, 11H, Ar + H-14), 6,52 (ушир.с, 1H, H-5), 5,55 (д, 1H, J=16,8 Гц, H-17), 5,44-4,71 (м, 5H), 1,98-1,80 (м, 2H, H-19), 1,05-0,90 (м, 12H), 0,81-0,70 (м, 6H). 13C ЯМР (CDCl3, 100 МГц) δ 171,5, 157,9, 156,4, 156,4, 152,9, 152,4, 150,9, 149,4, 144,8, 135,3, 132,1, 130,6, 129,9, 128,6-127,8 (11C), 119,9, 98,5, 79,3, 75,2, 68,4, 67,8, 65,6, 32,9, 7,8, 7,2, 6,4.
ПРИМЕР XIX - Получение первого диастереомера 5-дибензилоксикарбонилгидразинокамптотецина
Первый диастереомер 5-дибензилоксикарбонилгидразино-20-OTES-камптотецина (0,140 г, 0,184 ммоль) растворяли в безводном THF (6 мл) при перемешивании в инертной атмосфере, после чего по каплям добавляли Et3N·3HF (0,225 мл, 1,380 ммоль). Реакционной смеси давали реагировать в течение 52 ч при комнатной температуре, контролируя с помощью ТСХ исчезновение реагента (гексан/AcOEt = 1/3). Растворитель выпаривали в вакууме и остаток очищали флэш-хроматографией (SiО2, гексан/AcOEt = 1/1, затем 2/3), таким образом получая желаемое соединение (0,113 г, 0,175 ммоль, 95%) в виде бледно-желтого твердого вещества. Продукт дополнительно очищали кристаллизацией из смеси CH2Cl2/пентан = 1/50.
1H ЯМР (CDCl3, 400 МГц) δ 8,67 (ушир.с, 1H, Ar), 8,39 (ушир.с, 1H, Ar), 8,12 (ушир.д, 1H, J=7,6 Гц, Ar), 7,95 (ушир.с, 1H, Ar), 7,74 (ушир.т, 1H, J=7,6 Гц, Ar), 7,65-6,66 (м, 12H, Ar + H-14), 6,48 (ушир.с, 1H, H-5), 5,55 (д, 1H, J=16,0 Гц, H-17), 5,42-4,44 (м, 5H), 3,86 (ушир.с, 1H, OH), 1,92-1,72 (м, 2H, H-19), 0,95 (т, 3H, J=7,6 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,5, 158,0, 156,2, 156,0, 153,0, 150,9, 150,9, 149,5, 145,3, 135,4, 132,2, 130,7, 129,8, 128,7-127,8 (11C), 119,9, 98,2, 79,6, 72,7, 68,5, 68,0, 65,9, 31,6, 7,8.
ПРИМЕР XX - Получение второго диастереомера 5-дибензилоксикарбонилгидразинокамптотецина
Второй диастереомер 5-дибензилоксикарбонилгидразино-20-OTES-камптотецина (0,140 г, 0,184 ммоль) растворяли в безводном THF (6 мл) при перемешивании в инертной атмосфере, после чего по каплям добавляли Et3N·3HF (0,150 мл, 0,921 ммоль). Реакционной смеси давали реагировать в течение 55 ч при комнатной температуре, контролируя с помощью ТСХ исчезновение реагента (гексан/AcOEt = 3/2). Растворитель выпаривали в вакууме и остаток очищали флэш-хроматографией (SiО2, гексан/AcOEt = 1/1), таким образом получая желаемое соединение (0,113 г, 0,175 ммоль, 95%) в виде бледно-желтого твердого вещества. Продукт дополнительно очищали кристаллизацией из смеси CH2Cl2/пентан = 1/50.
1H ЯМР (CDCl3, 400 МГц) δ 8,71 (ушир.с, 1H, Ar), 8,34 (ушир.с, 1H, Ar), 8,18 (ушир.с, 1H, Ar), 7,94 (ушир.с, 1H, Ar), 7,79 (ушир.т, 1H, J=7,6 Гц, Ar), 7,70-6,70 (м, 12H, Ar + H-14), 6,52 (ушир.с, 1H, H-5), 5,53 (д, 1H, J=16,4 Гц, H-17), 5,44-4,48 (м, 5H), 3,87 (ушир.с, 1H, OH), 1,90-1,70 (м, 2H, H-19), 0,99 (т, 3H, J=7,6 Гц, Me). 13C ЯМР (CDCl3, 100 МГц) δ 173,4, 158,0, 156,3, 156,1, 153,0, 151,0, 150,9, 149,6, 145,3, 135,5, 132,3, 130,8, 129,8, 128,7-127,8 (11C), 119,8, 98,4, 79,5, 72,7, 68,5, 67,8, 66,0, 31,6, 7,7.
ПРИМЕР XXI - Исследование ингибирования роста клеток
Клетки H460 из крупноклеточной опухоли легкого человека культивировали в среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки. Чувствительность клеток определяли, анализируя ингибирование роста клеток после 1 или 72 часов воздействия лекарственного средства. Клетки в логарифмической фазе роста собирали и высевали в дупликатах в 6-луночные планшеты. Через двадцать четыре часа после посева клетки подвергали воздействию лекарственных средств и подсчитывали с помощью счетчика Coulter conter через 72 часа после воздействия лекарственного средства для определения значений IC50. IC50 определяли как концентрацию, ингибирующую рост клеток на 50% по сравнению с ростом в необработанном контроле.
ПРИМЕР XXII - Исследование разрывов ДНК, зависимых от топоизомеразы I
Разрывы ДНК определяли с использованием очищенного геля BamHI-EcoRI-фрагмента (длиной 751 п.о.) ДНК SV40 (Beretta GL, Binaschi M, Zagni AND, Capuani L, Capranico G. Tethering a type IB topoisomerase to a DNA site by enzyme fusion to a heterologous site-selective DNA-binding protein domain. Cancer Res 1999; 59:3689-97). Фрагменты ДНК были мечеными только на 3'-конце. Реакцию разрыва (20000 импульсов в минуту в образце) проводили в 20 мл 10 мМ Трис-HCl (pH 7,6), 150 мМ KCl, 5 мМ MgCl2, 15 мкг/мл BSA, 0,1 мМ тиотреитола и с человеческим рекомбинантным ферментом (для топов полной длины) в течение 30 мин при 37°C. Реакцию блокировали, применяя 0,5% SDS и 0,3 мг/мл K-протеиназы в течение 45 мин при 42°C. Устойчивость ДНК к повреждениям испытывали в течение различных периодов времени, добавляя 0,6M NaCl после 30 мин инкубирования с 10 мкМ лекарственного средства. После осаждения ДНК снова суспендировали в буфере денатурации (80% формамида, 10 мМ NaOH, 0,01 M EDTA и 1 мг/мл красителя) перед посевом в денатурирующий гель (7% полиакриламида в буфере TBE). Все уровни разрыва ДНК измеряли с помощью Phospholmager model 425 (Molecular Dynamics) (Dallavalle S, Ferrari A, Biasotti B, et al. Novel 7-oxyiminomethyl camptothecin derivatives with potent in vitro и in vivo antitumor activity. J Med Chem 2001; 44:3264-74).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ КАМПТОТЕЦИНА С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2450008C2 |
| ПРОИЗВОДНЫЕ КАМПТОТЕЦИНА С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2441009C2 |
| ПРОИЗВОДНЫЕ ТАКСАНА, ФУНКЦИОНАЛИЗИРОВАННЫЕ ПО 14-ПОЛОЖЕНИЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2320652C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ АРИЛКОНДЕНСИРОВАННЫХ АЗАПОЛИЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2282619C9 |
| ИНГИБИТОРЫ ДВУХ САЙТОВ СВЯЗЫВАНИЯ АЦЕТИЛХОЛИНЭСТЕРАЗЫ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2003 |
|
RU2325379C2 |
| СПИРО- ИЛИ ДИСПИРО-1, 2, 4-ТРИОКСОЛАН, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 2002 |
|
RU2271357C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ПОВЫШЕННОЙ ЭФФЕКТИВНОСТЬЮ, СВЯЗЫВАЮЩИЕСЯ С РЕЦЕПТОРОМ ХЕМОКИНА | 2002 |
|
RU2325387C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, МОДЕЛИРУЮЩИЕ АКТИВНОСТЬ ХЕМОКИНОВОГО РЕЦЕПТОРА, ИХ ПРИМЕНЕНИЕ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2297413C2 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ ДИГИДРОПИРАН-2-ОНА | 2007 |
|
RU2444519C2 |
| ПРОИЗВОДНЫЕ РЕТИНОИДА С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2748838C2 |
Изобретение относится к новым производным 5-замещенного камптотецина формулы I, где R представляет собой F, R1 представляет собой водород; R2 представляет собой водород; и R3 представляет собой водород; его фармацевтически приемлемым солям, диастереомерам и соответствующим смесям, которые обладают противоопухолевой активностью. Изобретение также относится к способу получения этих соединений, их применению в качестве противоопухолевых лекарственных средств и фармацевтическим композициям, их содержащим. 4 н. и 2 з.п. ф-лы, 2 табл., 22 пр.
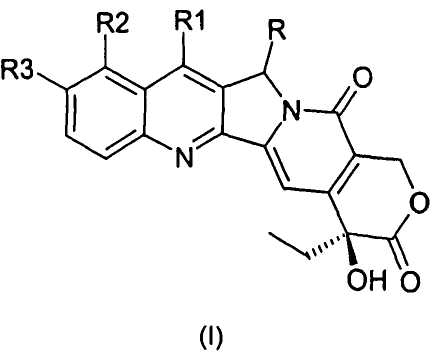
1. Соединение общей формулы I:
где R представляет собой F,
R1 представляет собой водород;
R2 представляет собой водород;
R3 представляет собой водород;
его фармацевтически приемлемые соли, диастереомеры и
соответствующие смеси.
2. Способ получения соединения формулы (I), по существу, включающий стадии, показанные на следующей схеме, где
a) защита гидроксигрупп предшественника;
b) дериватизация в положении 5 посредством образования карбаниона и реакции с электрофильным реагентом;
c) снятие защиты с гидроксигрупп;
Схема
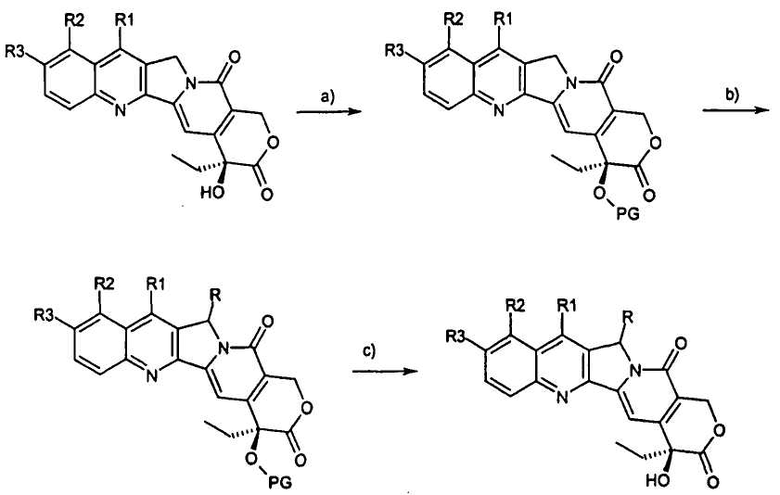
где R, R1, R2 и R3 имеют значения, описанные выше, и PG представляет собой защитную группу для ОН.
3. Фармацевтическая композиция для лечения опухолей, содержащая соединение формулы (I) вместе с фармацевтически приемлемыми носителями и эксципиентами.
4. Фармацевтическая композиция по п.3 в форме, подходящей для перорального или парентерального введения.
5. Применение соединения по п.1 или композиции по пп.3-4 для получения лекарственного средства для лечения опухолей.
6. Применение по п.5, при котором указанное лекарственное средство применяют для лечения солидных опухолей и лейкозов, в частности опухолей легкого, яичника, груди, желудка, печени, простаты, сарком мягких тканей, пищевода, поджелудочной железы, головы и шеи, глиобластомы, хронических и острых миелоцитарных лейкозов.
| US 5972955 А, 26.10.1999 | |||
| Brunin et al, Tetrahedron, 2006, v.62, №17, p.3959, 3960 | |||
| Subrahmanyam D.D | |||
| et al, Bioorganic & Medicinal Chemistry Letters, 2000, v.10, №4, p.369-371 | |||
| RU 98117449 A, 10.09.2000. |
Авторы
Даты
2012-05-10—Публикация
2007-07-16—Подача