Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии и направлено на способ получения рекомбинантных белков паутины пауков-кругопрядов, слитые белки, содержащие последовательности рекомбинантных белков паутины пауков-кругопрядов и последовательности убиквитин подобных белков, рекомбинантные ДНК, кодирующие слитые белки, хозяйские клетки дрожжей и векторы экспрессии, используемые для осуществления способа, а также штаммы-продуценты рекомбинантных белков паутины пауков-кругопрядов.
Уровень техники
Паутина является уникальным биоматериалом, сочетающим в себе удивительную прочность и эластичность. По этим показателям она не имеет аналогов как в природе, так и среди материалов, созданных человеком. Так, например, каркасная нить паутины паука-кругопряда Nephila clavipes по значениям прочности на разрыв превосходит сталь и сопоставима с кевларом, а по величине энергии разрыва превосходит и кевлар; в то же время она может растягиваться до 35% своей длины [Gosline J.M. et al. Endeavor, 1986, v.10, 37-43].
Получение промышленных количеств таких материалов возможно лишь с помощью генно-инженерных и биотехнологических методов. К настоящему времени несколько генов, кодирующих белки паутины, выделены и достаточно полно охарактеризованы [Xu М. & Lewis R. Proc. Natl. Acad. Sci., USA, 1990, v.87, 7120-7124; Hinnman M. & Lewis R. J. Biol. Chem., 1992, v.267, 19320-19324; Guerette P. et al. J. Science, 1996, v.272, 112-115; Hayashi C.Y. & Lewis R.V. J. Mol. Biol., 1998, v.275, 773-784]. Эти гены относятся к наиболее протяженным из известных цистронов (размеры мРНК лежат в диапазоне от 7,5 до 15,5 т.н.) и состоят из большого числа тандемно повторяющихся протяженных последовательностей, которые заметно различаются у разных генов. Наиболее изученная каркасная нить паука-кругопряда Nephila clavipes состоит из двух белков - спидроина 1 и спидроина 2 (MaSp1 и MaSp2, соответственно), синтезируемых большой ампуловидной железой [Hinnman M. & Lewis R. J. Biol. Chem., 1992, v.267, 19320-19324; Guerette P. et al. Science, 1996, v.272, 112-115]. Повторяющийся элемент спидроина 1 можно представить в виде следующей консенсусной последовательности:
[GGAGQGGYGGLGSQGAGRGGLGGQGAG(A)4-7],
а повторяющуюся последовательность спидроина 2 - в виде
[GPGGYGPGQQGPGGYAPGQQPSGPGS(A)6-10],
Принципиальным различием между этими белками является то, что в случае спидроина 1 элементарным повтором является трипептид GGX (X=А, S или Y), а в случае спидроина 2 - пентапептиды GPGGX и GPGQQ. При этом для спидроина 1 характерна повышенная прочность, а для спидроина 2, способного образовывать β-спирали [Hayashi et al., 1999, Int. J. Biol. Macromol., v.24, 271-275], - большая эластичность. Взаимодействие этих белков в составе каркасной нити паутины и обеспечивает уникальное сочетание ее свойств.
Белки MiSp1 и MiSp2, синтезируемые малой ампуловидной железой, и белок Flag ловчей нити паука-кругопряда также имеют повторяющуюся структуру. Повторяющиеся области обогащены аланином и глицином. Мотивы GGX и GA представлены по всей длине аминокислотной последовательности как белка MiSp1, так и белка MiSp2 [K.Vasanthavada et al. Cell. Mol. Life Sci, 2006, v.63, 1986-1999]. В последовательности белка Flag ловчей нити доминантные повторяющияся мотивы представлены пентапептидом GPGGlX и трипептидом GGX.
Результаты исследования белков каркасной нити паука-кругопряда Nephila clavipes, а также белка ловчей нити и белков, синтезируемых малой ампуловидной железой [Kohler T. & Vollrath F. J. Exp. Zool., 1995, v.271, 1-17; Colgin M.A. & Lewis R., Protein Sci., 1998, v.7, 667-672], позволили выдвинуть модульную гипотезу строения белков паутины [Hinman at al., 2000, TIBTECH, v.1, 374-379]. Структурный анализ белков паутины свидетельствует о наличии в них кристаллических областей, образованных β-складчатыми структурами (считается, что они формируются блоками (А)n и (GA)n), которые обеспечивают прочность нитей паутины и которые погружены в менее структурированный Gly-обогащенный матрикс, ответственный за эластичность. На концах молекул содержатся неповторяющиеся (NR) уникальные консервативные последовательности, которые необходимы, как полагают, для повышения растворимости белков в концентрированном растворе внутри железы, а также для правильной подгонки молекул при формировании нити при прядении.
Были предприняты попытки клонирования и оптимизации экспрессии кДНК-копий природных генов, кодирующих белки каркасной нити паутины, в клетках Е.coli [Arcidiacono S. et al. Appl. Microbiol. Biotechnol., 1998, v.49, 1-38]. Однако достигнутый уровень экспрессии был достаточно низким, что объясняется, в первую очередь, несоответствием частоты встречаемости определенных аминокислотных кодонов в генах паука и генах использованного микроорганизма-реципиента.
Более успешным оказался путь химико-ферментативного синтеза генов белков паутины с последующим клонированием в клетках бактерий, дрожжей, табака, картофеля, используя синтетические модули ДНК с частотой использования кодонов, адаптированной к соответствующей хозяйской клетке [Prince J.T. et al. Biochemistry, 1995, v.34, 10879-10884; Winkler S. et al. Int. J. Biol. Macromol, 1999, v.24, 265-270; Fahnestock S.R. & Bedzyk L.A. Appl. Microbiol. Biotechnol, 1997, v.47, 33-39; Fahnestock S.R. & Irwin S.L., Appl. Microbiol. Biotechnol., 1997, v.47, 23-32; Lewis, R.V. et al., 1996, Protein Expr. Purif., v.7, 400-406; Scheller, J. et al., 2001, Nat. Biotechnol., v.19, 573-577]. Указанные работы в основном касались экспрессии генов, кодирующих рекомбинантные белки каркасной нити паутины пауков-кругопрядов, содержащих консенсусную последовательность или ее небольшие фрагменты. В результате экспрессии синтетических генов были получены искусственные белки, содержащие варианты первичных повторов спидроинов 1 и 2, сходные с повторяющимися областями природных белков. Эти белки хотя и обладали особенностями вторичной структуры, характерными для белков паутины, но созданные на их основе нити по механическим свойствам были далеки от нитей природной паутины. Ни один из этих искусственных белков не содержал С-концевых NR-областей, которые найдены во всех белках каркасной нити. Свойствами, наиболее близкими к свойствам природных белков, обладали искусственные аналоги, содержавшие 800 и 1600 аминокислотных остатков, полученные в результате экспрессии синтетических генов в клетках E.coli [Fahnestock & Irwin, 1997, Appl. Microbiol. Biotechnol., v.47, 23-32] или дрожжей Pichia pastoris [Fahnestock & Bedzyk, 1997, Appl. Microbiol. Biotechnol, v.47, 33-39].
Первым шагом в направлении исследований молекулярных механизмов сборки нитей паутины было изучение первичной структуры каркасных белков ADF-3 и ADF-4 паутины садового паука (Araneus diadematus), соответствующих белкам MaSp2 и MaSp1 (спидроины 2 и 1 большой ампуловидной железы). Рекомбинантные белки паутины, состоящие из синтетических повторяющихся последовательностей и уникальных аутентичных NR-областей на концах молекул, были экспрессированы в клетках Е. coli, выход очищеного белка составлял около 1 г на литр бактериальной культуры [WO/2006/008163].
Сравнительный анализ вторичной структуры, растворимости и агрегационных свойств полученных белков позволил выявить роль различных элементов первичной структуры белков паутины. Было обнаружено, что повторяющиеся области, занимающие основную по протяженности часть белков паутины и содержащие консенсусную последовательность, включающую поли-А блок, детерминируют растворимость синтетических белков. Важным для обеспечения растворимости является чередование гидрофобных и гидрофильных сегментов в первичных повторах.
Неповторяющиеся области С-конца играют важную роль в инициации сборки белков. В этой системе экспрессии были использованы в качестве синтетических строительных блоков два модуля: модуль поли-А и второй модуль, состоящий из четырх повторов GPGQQ. Модули такого типа также описаны Хаммерих с соавторами [Hummerich, D. et al., 2004, Biochemistry, v.43, 13604-13612].
Процесс сборки паутины был изучен на модели двух рекомбинантных аналогов спидроина 1 (белок 1F9) и спидроина 2 (белок 2Е12), входящих в состав каркасных нитей паутины пауков Nephila clavipes и Nephila madagascariensis, соответственно [Bogush V.G. & Debabov V.G., 2009, J. Neuroimmune Pharmacol., v.4, 17-27].
Синтетический ген белка 1F9 был экспрессирован в дрожжах Saccharomyces cerevisiae под контролем промотора GAL1 с использованием бирепликонного экспрессионного вектора [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, стр.11-22] и в клетках метилотрофных дрожжей Pichia pastoris под контролем метанолиндуцибельного промотора AOXI с использованием интегративного вектора pHIL-D2 [Богуш В.Г. с соавт., 2006, Биотехнология, т.4, 3-12].
В первом случае более 80% целевого белка обнаруживалось в водонерастворимой фракции, и средний выход составлял 6-8 мг белка на 1 литр ферментационной культуры дрожжей. В дрожжах Pichia pastoris средний выход чистого белка 1F9 составил приблизительно 70 мг на 1 кг влажной клеточной массы (приблизительно 23 мг/л ферментационной культуры). Последовательности рекомбинантных белков были максимально приближены к последовательностям природных белков, в частности, повторяющаяся область белка 1F9 содержала 9 повторов «мономера», состоящего из пяти вариантов первичных повторов, обнаруженных в природном спидроине 1. С целью увеличения уровня синтеза рекомбинантного белка в клетках дрожжей структура генов 1f9 и 2Е12 была модифицирована путем замены "редких" триплетов на кодоны, характерные для эффективно экспрессирующихся генов дрожжей, а количество внутренних повторов нуклеотидных последовательностей сведено к минимуму. Фрагменты ДНК, кодирующие соответствующие мономеры обоих белков, были получены в результате химико-ферментативного синтеза и затем амплифицированы. Конечный ген белка 1F9 кодировал девять повторов соответствующего «мономера», составляющих белок с молекулярной массой 94 кДа; белок 2Е12 (молекулярная масса 113 кДа) содержал 12 «мономерных» повторов.
В растворах белков 1F9 и 2Е12, очищенных с использованием катионобменной хроматографии, были исследованы структурные переходы, возникающие при определенных воздействиях [Bogush V.G. & Debabov V.G., 2009, J. Neuroimmune Pharmacol., v.4, 17-27]. Несмотря на отсутствие гидрофильных N- и С-концевых уникальных последовательностей (NR), которые, как предполагалось ранее, необходимы для формирования нанофибрилл и мицелл, оба белка в водном растворе спонтанно формировали нанофибриллы длиной 100 нм - 1 мкм и мицеллы диаметром около 1 мкм. Причем нанофибриллы имели спиралевидную структуру с периодом в 40 нм.
Однако уровень синтеза рекомбинантных белков паутины с использованием известных способов не позволял нарабатывать белки паутины в количествах, достаточных не только для изучения их структуры и свойств, но и для разработки и испытания нового класса медицинских материалов и изделий из них. Одним из способов увеличения экспрессии слабо экспрессируемого белка методами генной инженерии является его биосинтез в виде гибридного белка, в котором целевой белок слит с эффективно экспрессируемым белком [Shatzman and Rosenberg, 1987, Methods Enzynol., v.152, 661-673]. Однако обычно преимущества такого подхода в значительной степени нивелируются необходимостью на завершающих стадиях очистки осуществлять процессинг гибридного продукта для высвобождения из его состава целевого белка, что нетехнологично в случае рекомбинантных белков паутины. Было показано, что при использовании дрожжевого убиквитина в качестве эффективно экспрессируемого компонента гибриды подвергаются высокоспецифичному внутриклеточному процессингу в клетках дрожжей. Убиквитин дрожжей, состоящий из 76 аминокислотных остатков, является представителем семейства убиквитин-подобных белков эукариот, к которому относятся сравнительно небольшие структурно консервативные белки, обладающие экстраординарной скоростью сворачивания, высокой растворимостью и термостабильностью; in vivo белки этого семейства служат для обратимой модификации и изменения функционального состояния других белков. Представители семейства убиквитин-подобных белков содержат консервативный С-концевой мотив Gly-Gly, являющийся сайтом процессинга [Müller et al., 2001, Nature, v.2, 202-210]. Присутствие этого сайта в составе гибридных белков с убиквитином приводит к тому, что в клетках дрожжей гибриды подвергаются высокоспецифичному внутриклеточному процессингу под действием убиквитин-специфичных протеиназ DUB, в результате чего в составе конечных продуктов экспрессии убиквитиновый компонент отсутствует.
Позднее было обнаружено, что помимо убиквитина для усиления экспрессии могут использоваться и другие представители белков убиквитинового семейства, в частности, дрожжевой вариант белка SUMO. Зрелый белок SUMO дрожжей Saccharomyces cerevisiae, кодируемый уникальным геном SMT3 (Johnson et al., 1997, EMBO J, v.16, 5509-5519; Muller et al., 1998, EMBO J, v.17, 61-70), содержит в своем составе 98 аминокислотных остатков, из которых остатки 13-98 важны для формирования его нативной структуры [Mossessova Е. & Lima CD., 2000, Mol. Cell, v.5, 865-876]. Аналогично убиквитин-специфичным протеиназам, SUMO-специфичные протеиназы дрожжей обеспечивает высокую эффективность и специфичность процессинга SUMO-содержащих гибридных белков [Malakhov et al., 2004, J. Struct. Funct. Genom., v.5, 75-86; Butt et al., 2005, Protein Expr. Purif., v.43, 1-9].
Однако эффективность технологии гибридизации рекомбинантных белков паутины с убиквитином или другими убиквитин-подобными белками для увеличения биосинтеза белков паутины не была продемонстрирована. Таким образом, разработка способа микробиологического биосинтеза, позволяющего существенно повысить продукцию рекомбинантных белков паутины, обладающих свойствами, приближенными к свойствам природных белков, является актуальной задачей, решение которой открывает принципиальную возможность создания на основе рекомбинантных белков паутины биоматериалов с уникальными свойствами.
Раскрытие изобретения
Авторами настоящего изобретения впервые предложен способ получения рекомбинантных белков паутины пауков-кругопрядов (Araneidae) в клетках дрожжей, обеспечивающий продукцию рекомбинантных белков в количествах, в десятки раз превышающих количества рекомбинантных белков паутины, продуцируемых в соответствии со способами, известными из предшествующего уровня техники.
Согласно предложенному способу рекомбинантные белки паутины пауков-кругопрядов экспрессируют в клетках дрожжей в виде гибрида с убиквитин-подобным белком, занимающим в составе гибрида N-концевое положение и содержащим сайт процесинга, распознаваемый природными дрожжевыми протеиназами, предпочтительно, убиквитин-специфичными протеиназами DUB или SUMO-специфичными протеиназами дрожжей, в результате чего в ходе экспрессии гибридные белки подвергаются процессингу под действием протеиназ, что обеспечивает накопление в клетках дрожжей зрелого белка паутины, не содержащего гибридный компонент, причем белок накапливается в водонерастворимой фракции дрожжевых клеток.
Предпочтительно, способ согласно изобретению предусматривает получение рекомбинантного белка паутины, консенсусные последовательности которого происходят из каркасных белков большой ампуловидной железы и/или белков малой ампуловидной железы, или белка ловчей нити паука-кругопряда.
В одном из предпочтительных воплощений способ согласно изобретению предусматривает получение рекомбинантных белков паутины, консенсусные последовательности которых происходят из каркасных белков большой ампуловидной железы Nephila clavipes и/или Nephila madagascariensis, и убиквитин-подобный белок выбирают из группы, включающей убиквитин и белок SUMO дрожжей Saccharomyces cerevisiae.
В одном из наиболее предпочтительных воплощений способ согласно изобретению направлен на получение рекомбинантного белка 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis в клетках Saccharomyces cerevisiae под контролем промотора гена GAL1 дрожжей, причем ген рекомбинантного белка слит с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В еще одном наиболее предпочтительном воплощении способ согласно изобретению направлен на экспрессию гена рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes в клетках Saccharomyces cerevisiae под контролем промотора гена GAL1 дрожжей, причем ген рекомбинантного белка слит с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В одном из аспектов изобретение направлено на слитый белок, включающий последовательности рекомбинантного белка паутины паука-кругопряда и убиквитин-подобного белка, занимающего в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, причем последовательность рекомбинантного белка паутины включает консенсусные последовательности, которые происходят из повторяющихся последовательностей белков каркасной нити MaSp1 и MaSp2 большой ампуловидной железы, белков MiSp1 и MiSp2 малой ампуловидной железы и белка Flag ловчей нити паука-кругопряда.
В одном из предпочтительных воплощений изобретение направлено на слитый белок, в котором убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, и последовательность рекомбинантного белка паутины включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков каркасной нити MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
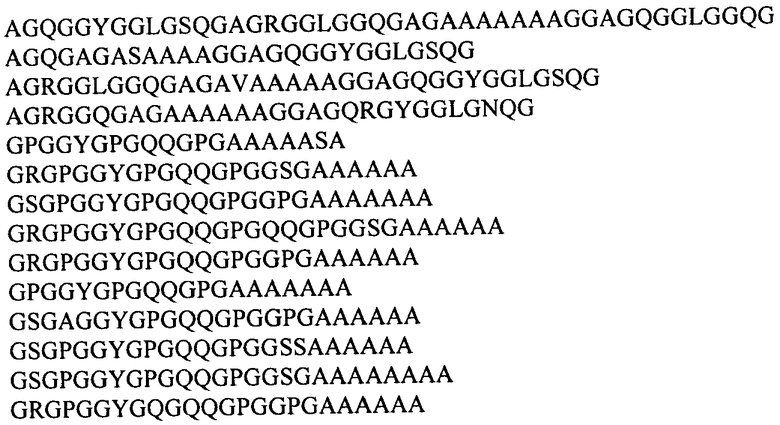
Наиболее предпочтительно, слитый белок включает рекомбинантный белок 1F9 каркасной нити паука-кругопряда Nephila clavipes, последовательность которого слита с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В еще одном наиболее предпочтительном воплощении слитый белок включает рекомбинантный белок 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis, последовательность которого слита с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В одном из аспектов изобретение направлено на рекомбинантную ДНК, кодирующую слитый белок, включающий в себя рекомбинантный белок паутины паука-кругопряда и убиквитин-подобный белок, занимающий в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, причем последовательность рекомбинантного белка паутины включает консенсусные последовательности, которые происходят из повторяющихся последовательностей белков каркасной нити MaSp1 и MaSp2 большой ампуловидной железы, белков MiSp1 и MiSp2 малой ампуловидной железы и белка ловчей нити паука-кругопряда.
Предпочтительно, рекомбинантная ДНК кодирует слитый белок, в котором убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, и последовательность рекомбинантного белка паутины паука-кругопряда включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
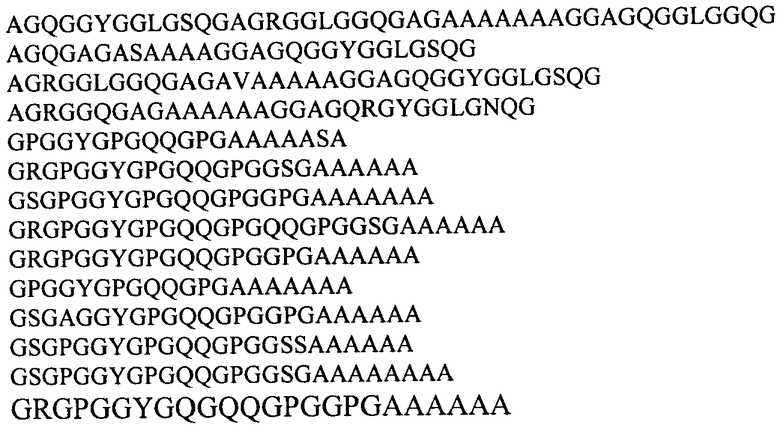
Наиболее предпочтительно, рекомбинантная ДНК согласно изобретению кодирует слитый белок, включающий последовательности рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes и убиквитина или белка SUMO дрожжей Saccharomyces cerevisiae, и имеющий последовательность, как представлено в Перечне последовательностей (SEQ ID NO: 1 и SEQ ID NO: 3, соответственно).
В еще одном наиболее предпочтительном воплощении рекомбинантная ДНК кодирует слитый белок, включающий последовательности рекомбинантного белка 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis и убиквитина или белка SUMO Saccharomyces cerevisiae.
В одном из аспектов изобретение касается векторов экспрессии, которые включают последовательности ДНК, кодирующие рекомбинантные белки паутины паука-кругопряда, слитые с последовательностью гена убиквитин-подобного белка, занимающего в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, и последовательности высокоэффективных регулируемых промоторов дрожжей.
В предпочтительном воплощении изобретение обеспечивает векторы экспрессии, которые содержат рекомбинантную ДНК, кодирующую слитый белок, в котором убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, а последовательность рекомбинантного белка паутины включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
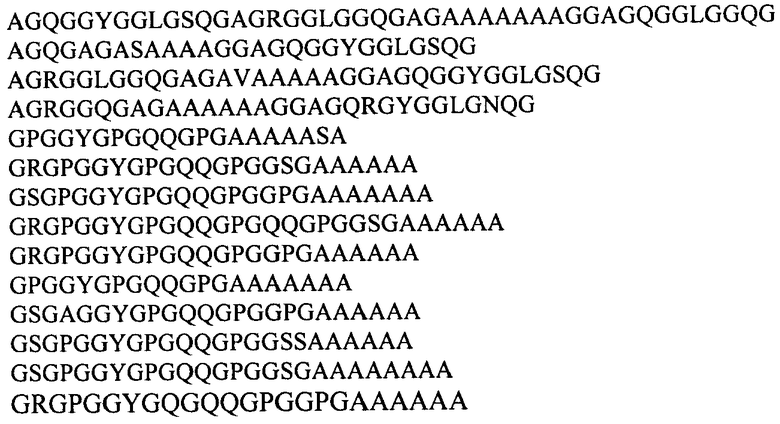
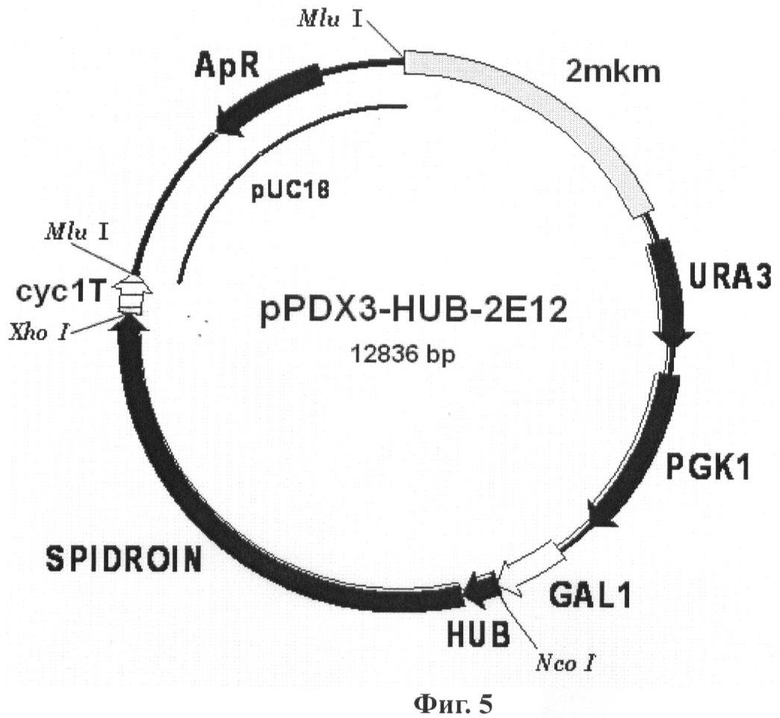
В одном из наиболее предпочтительных воплощений изобретение обеспечивает вектор экспрессии, представляющий бирепликонный вектор pPDX3-HUB-2E12, содержащий область инициации репликации эндогенной 2 мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный белок 2Е12, слитую последовательностью, кодирующей убиквитин Saccharomyces cerevisiae.
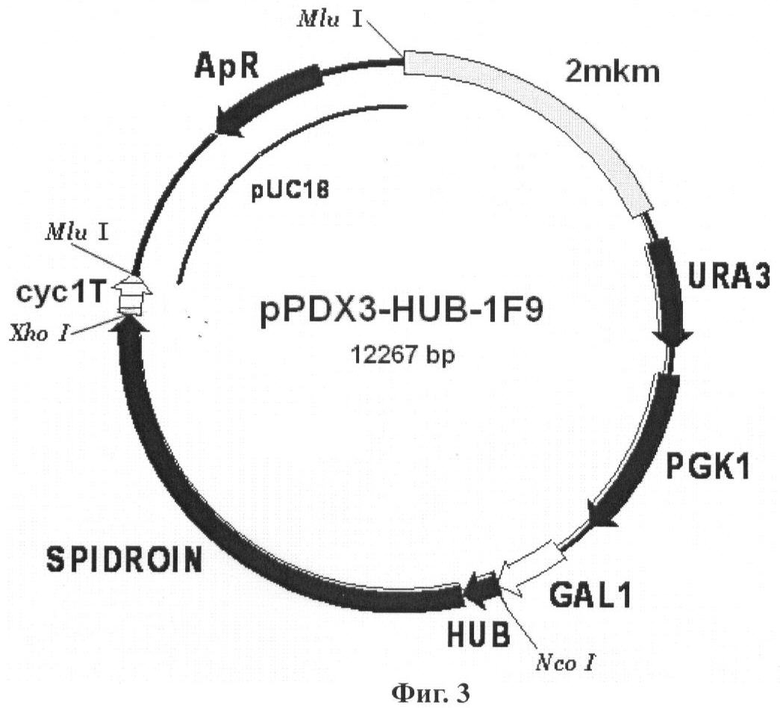
В другом наиболее предпочтительном воплощении изобретение обеспечивает вектор экспрессии, представляющий бирепликонный вектор pPDX3-HUB-1F9, содержащий область инициации репликации эндогенной 2-мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный белок 1F9, слитую с последовательностью, кодирующей убиквитин Saccharomyces cerevisiae.
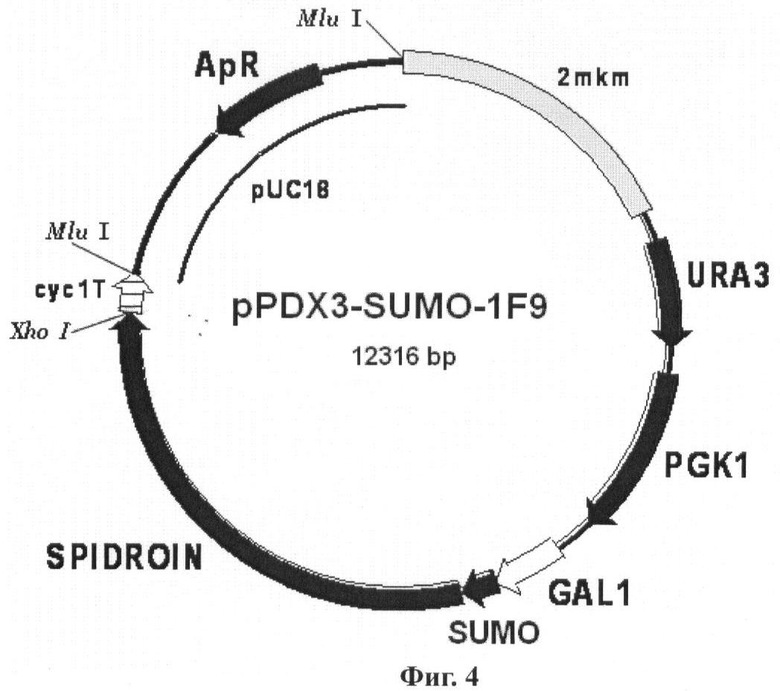
В еще одном наиболее предпочтительном воплощении изобретение обеспечивает вектор экспрессии, представляющий бирепликонный вектор pPDX3-SUMO-1F9, включающий область инициации репликации эндогенной 2-мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный белок 1F9, слитую с последовательностью, кодирующей белок SUMO Saccharomyces cerevisiae.
В соответствии с еще одним аспектом изобретение обеспечивает хозяйские клетки дрожжей, продуцирующие рекомбинантные белки паутины паука-кругопряда. Наиболее предпочтительными хозяйскими клетками согласно изобретению являются клетки дрожжей Saccharomyces cerevisisae. В еще одном аспекте изобретение обеспечивает штаммы-продуценты рекомбинантых белков 1F9 и 2Е12 каркасной нити паука-кругопряда.
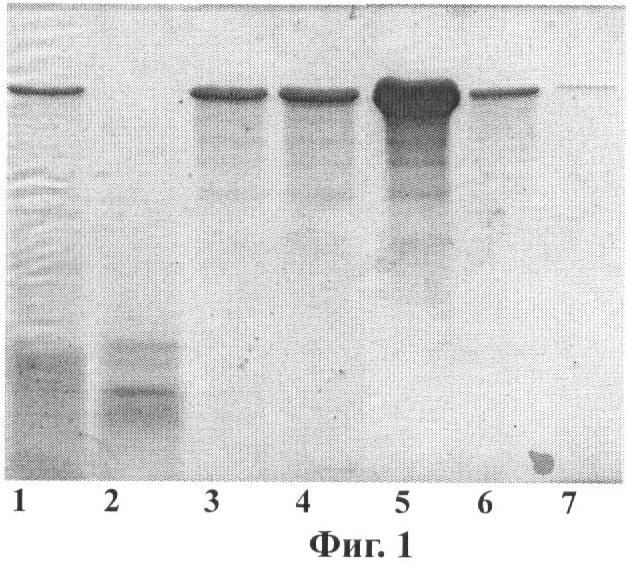
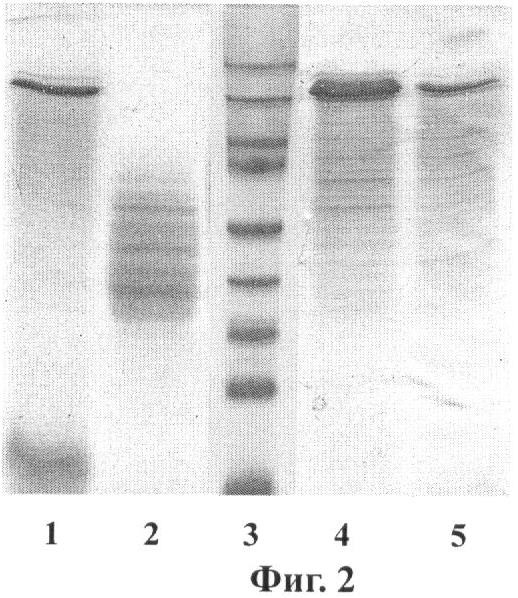
Краткое описание чертежей Фиг.1. Электрофорез в 12% ПААГ с ДДС-Na фракций 1F9 после хроматографии на катионообменной колонке HiPrep 16/10 SP FF. Дорожки: 1 - исходный раствор перед нанесением на колонку; 2 - проскок; 3-6 - фракции, содержащие белок 1F9, 7 - образец стандартного 1F9. Фиг.2. Электрофорез в 12% ПААГ с ДДС-Na фракций 2Е12 после хроматографии на катионообменной колонке HiPrep 16/10 SP FF. Дорожки: 1 - Исходный раствор перед нанесением на колонку; 2 - проскок; 3 - Стандарты молекулярных масс (сверху вниз, в кДа): 170, 130, 95, 72, 55, 43, 34, 26, 17; 4 - фракция, содержащая 2Е12, 5 - образец стандартного 2Е12. Фиг.3. Карта вектора pPDX3-HUB-1F9.
Обозначения: SPIDROIN - синтетический ген рекомбинантного белка 1F9 (спидроин-1 паука N. clavipes); HUB - ген убиквитина дрожжей S.cerevisiae; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae, соответственно; cyc1T - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2-микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации, обеспечивающий селективную амплификацию вектора в клетках E.coli.
Фиг.4. Карта вектора pPDX3-SUMO-1F9.
Обозначения: SPIDROIN - синтетический ген рекомбинантного белка 1F9 (рекомбинантный спидроин-1 паука N. clavipes); SUMO - ген SMT3 дрожжей S.cerevisiae, кодирующий белок SUMO; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae, соответственно; cyc1T - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2 - микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации дрожжей; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации для обеспечения селективной амплификации вектора в клетках Е. coli. Фиг.5. Схема вектора pPDX3-HUB-2E12.
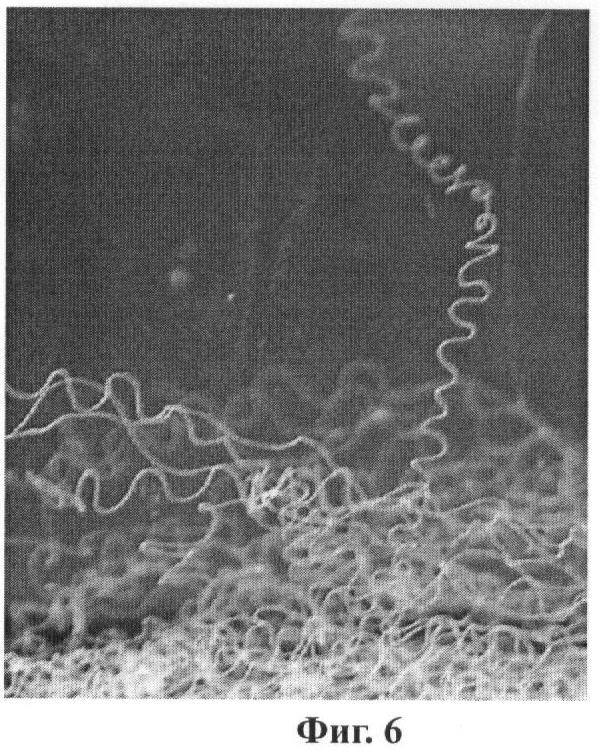
Условные обозначения: SPIDROIN - последовательность ДНК, кодирующая рекомбинантный белок 2Е12; HUB - последовательность ДНК, кодирующая убиквитин дрожжей S.cerevisiae; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae, соответственно; cyc1T - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2-микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации, обеспечивающий селективную амплификацию вектора в клетках E.coli. Фиг.6. Фотография искусственной нити из белка 1F9 в сосуде с этанолом.
Осуществление изобретения
Настоящее изобретение основано на неожиданном открытии, что экспрессия рекомбинантного белка паутины паука-кругопряда в клетках дрожжей в виде слитого белка с убиквитин-подобным белком, занимающим в составе гибрида N-концевое положение, позволяет в десятки раз увеличить продукцию рекомбинантного белка паутины, причем рекомбинантный белок, экспрессируемый в виде гибридного белка, накапливается в клетках дрожжей в водонерастворимой фракции в виде процессированного белка, не содержащего гибридный компонент.
Следовательно, в одном из аспектов настоящее изобретение обеспечивает способ получения рекомбинантного белка паутины паука-кругопряда в клетках дрожжей, предусматривающий конструирование вектора экспрессии, трансформацию клеток дрожжей полученным вектором экспрессии и экспрессию в трансформированных клетках гена рекомбинантного белка паутины паука-кругопряда, отличающийся тем, что используют вектор экспрессии, который включает последовательность ДНК, кодирующую рекомбинантный белок паутины паука-кругопряда, слитую с последовательностью, кодирующей убиквитин-подобный белок, занимающий в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины и содержащий сайт процессинга, распознаваемый природными дрожжевыми протеиназами, предпочтительно, убиквитин-специфичными протеиназами DUB или SUMO-специфичными протеиназами дрожжей, в результате чего в ходе экспрессии гибридные белки подвергаются процессингу под действием протеиназ, что обеспечивает накопление в клетках дрожжей в водонерастворимой фракции рекомбинантного белка паутины в виде процессированного белка, не содержащего гибридный компонент.
Рекомбинантные белки, получаемые способом согласно изобретению, имеют явно выраженную перидическую структуру, которая может быть представлена в виде ряда консенсусных последовательностей, выведенных путем выравнивания повторяющихся единиц природных белков паутины пауков-кругопрядов. Рекомбинантные белки согласно изобретению представляют собой белки, последовательности которых содержат как повторы одной консенсусной последовательности, так и комбинации повторов консенсусных последовательностей различного типа, происходящих из каркасных белков большой ампуловидной железы и/или белков малой ампуловидной железы, и/или белков Flag ловчей нити паука-кругопряда, в частности, выбираемых из группы, включающей консенсусные последовательности:
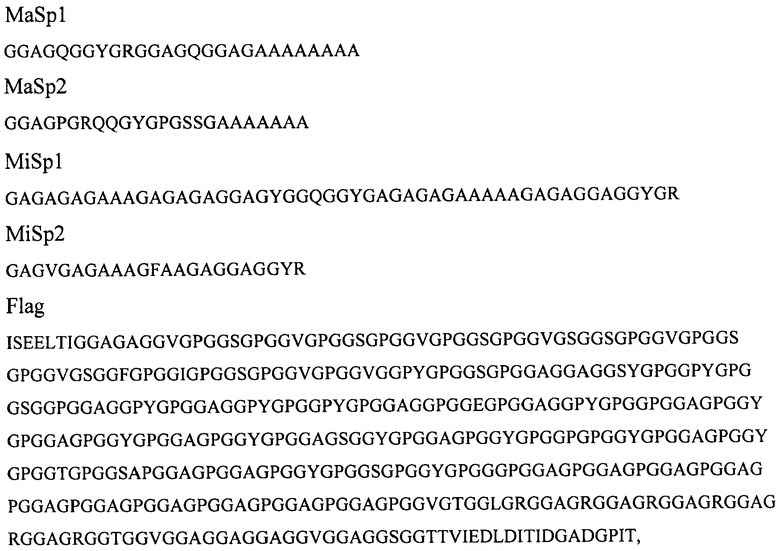
где MaSp1 и MaSp1 - белки каркасной нити большой ампуловидной железы Latrodectus hesperus [Lawrence В.A. et al., 2004, Biomacromolecules, v.5, 689-695];
MiSp1 и MiSp1 - белки малой ампуловидной железы Nephila clavipes [Colgin M.A. & Lewis R.V., 1998, Protein Sci., v.7, 667-672];
Flag - белок ловчей нити Nephila madagascariensis [Hayashi C. & Lewis R.V., 1998, J. Mol. Biol., v.275, 773-784].
Предпочтительно, согласно предложенному способу используют консенсусные последовательности, происходящие из повторяющихся последовательностей белков большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
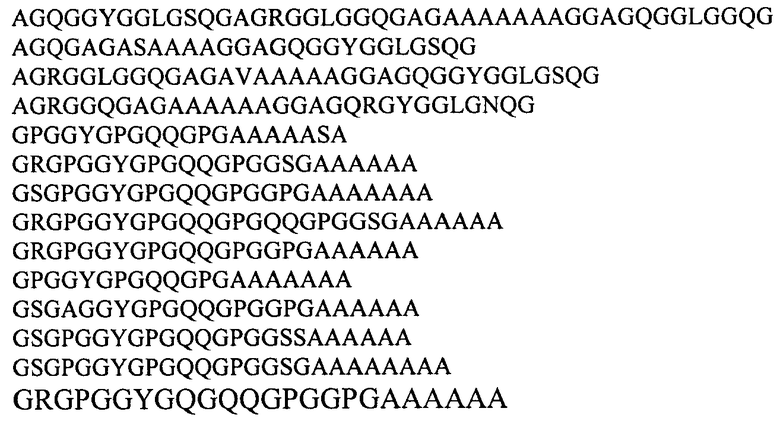
Конструирование искусственных генов, кодирующих рекомбинантные белки большой и/или малой ампуловидных желез, или белки Flag ловчей нити паука-кругопряда, включает реконструкцию последовательности ДНК, кодирующей консенсусную последовательность или комбинации повторов консенсусных последовательностей различного типа, происходящие из повторяющихся последовательностей указанных выше белков; конструирование и химический синтез серии праймеров к консенсусной последовательности/последовательностям; единовременный отжиг смеси всех синтезированных праймеров, необходимых для образования двухцепочечной молекулы ДНК, и последующую обработку их лигазой для удаления однонитевых разрывов ДНК, или реакцию ПЦР с последовательным использованием необходимых праймеров и поэтапным достраиванием растущего фрагмента ДНК, причем образуемый фрагмент («мономер») затем подвергается поэтапному удвоению в составе плазмиды до получения гена необходимой длины [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22; Богуш В.Г. с соавт., 2006, Биотехнология, т.4, 3-12; Bogush V.G. & Debabov V.G., 2009, J. Neuroimmune Pharmacol., v.4, 17-27].
Последовательности соответствующих кДНК могут быть выведены на основе последовательности природного белка с учетом вырожденности кода и частоты встречаемости кодонов у дрожжей. В частности, при конструировании гена, кодирующего белок 1F9 и содержащего 9 копий "мономера", фрагменты, кодирующие наиболее типичные первичные повторы, были выбраны из последовательности природного белка и отличались друг от друга набором делеций. Реконструированная последовательность ДНК включала приблизительно 400 п.н. и кодировала полипептид, соответствующий 134 аминокислотным остаткам. «Редкие» кодоны в последовательности искусственного гена были заменены на наиболее часто используемые у дрожжей. «Мономер» был получен с помощью химико-ферментативного синтеза и мультимерная форма получена путем пошаговой мультипликации мономера в составе рекомбинантной плазмиды [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22].
При конструировании гена 2Е12 были использованы последовательности спидроинов типа 2 большой ампуловидной железы, содержащиеся в базе данных белковых последовательностей NCBI и включающие более 200 аминокислотных остатков. На основании математического анализа всех последовательностей были разработаны последовательности блоков (каждый состоял из 3-5 первичных повторов) и составлена формула полного искусственного гена [Bogush V.G. et al., 2009, J. Neuroimmune Pharmacol., v.4, 17-27].
В одном из предпочтительных воплощений предложенный способ получения рекомбинантного белка паутины паука-кругопряда в клетках дрожжей предусматривает слияние гена рекомбинантного белка паутины с последовательностью ДНК, кодирующей убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae.
В одном из наиболее предпочтительных воплощений изобретения в клетках Saccharomyces cerevisiae получают рекомбинантный белок 1F9 каркасной нити паутины паука-кругопряда Nephila clavipes, причем структурный ген белка 1F9 слит с последовательностью ДНК, кодирующей убиквитин Saccharomyces cerevisiae. Еще в одном наиболее предпочтительном воплощении изобретения в клетках Saccharomyces cerevisiae получают рекомбинантный белок 2Е12 каркасной нити паутины паука-кругопряда Nephila madagascariensis, причем ген белка 2Е12 слит с последовательностью ДНК, кодирующей убиквитин Saccharomyces cerevisiae.
В еще одном наиболее предпочтительном воплощении изобретения в клетках дрожжей Saccharomyces cerevisiae экспрессируют слитый белок, содержащий последовательность рекомбинантного белка 1F9, причем последовательность белка 1F9 слита с последовательностью белка SUMO дрожжей Saccharomyces cerevisiae. Рекомбинантные белки, получаемые согласно предложенному способу, были выделены из водонерастворимой фракции хозяйских клеток Saccharomyces cerevisiae с помощью хроматографии на катионообменной колонке (примеры 9 и 11). Электрофоретический анализ фракций (Фиг.1 и 2) показал, что рекомбинантные белки 1F9 и 2Е12 накапливаются во фракции водонерастворимых белков клеток дрожжей (в водорастворимой фракции рекомбинантные белки практически отсутствуют) и не содержат компонент убиквитин-подобного белка. На это указывает электрофоретическая подвижность анализируемых белков и отсутствие в геле полос, соответствующих по подвижности слитым белкам (убиквитин-1F9 и убиквитин-2Е12). Аналогичные результаты получены для рекомбинантных белков, выделенных и очищенных из водонерастворимой фракции хозяйских клеток Saccharomyces cerevisiae, продуцирующих рекомбинантные белки паутины, слитые с белком SUMO. Продукция рекомбинантных белков клетками Saccharomyces cerevisiae составляет не менее 100 мг/л ферментационной культуры.
Отсутствие рекомбинантных белков, получаемых в соответствии с предложенным изобретением, в водорастворимой фракции позволяет практически избежать потери белка в процессе выделения и очистки в отличие от известного способа [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22], согласно которому только около 80% целевого белка обнаруживалось в водонерастворимой фракции.
Таким образом, при осуществлении способа получения рекомбинантного белка паутины согласно изобретению рекомбинантный белок, синтезируемый в клетках Saccharomyces cerevisiae, накапливается во фракции водонерастворимых белков в виде процессированного белка, не содержащего гибридный компонент, причем клетки, экспрессирующие рекомбинантный белок паутины, накапливают в десятки раз больше рекомбинантного белка, чем в соответствии со способами, известными из предшествующего уровня техники.
Очищенные рекомбинантные белки паутины паука-кругопряда, согласно изобретению, способны образовывать надмолекулярные структуры различных типов, в частности анализируемые белки формируют не растворяющиеся в воде нити (Пример 12, Фиг.8).
В еще одном из аспектов изобретение направлено на слитые белки, включающие последовательности рекомбинантного белка паутины паука-кругопряда и убиквитин-подобный белок, занимающий в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, причем последовательность рекомбинантного белка паутины включает консенсусные последовательности, которые происходят из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы, белков MiSp1 и MiSp2 малой ампуловидной железы и белка Flag ловчей нити паука-кругопряда.
В одном из предпочтительных воплощений изобретение направлено на слитый белок, в котором убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, и последовательность рекомбинантного белка паутины паука-кругопряда включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
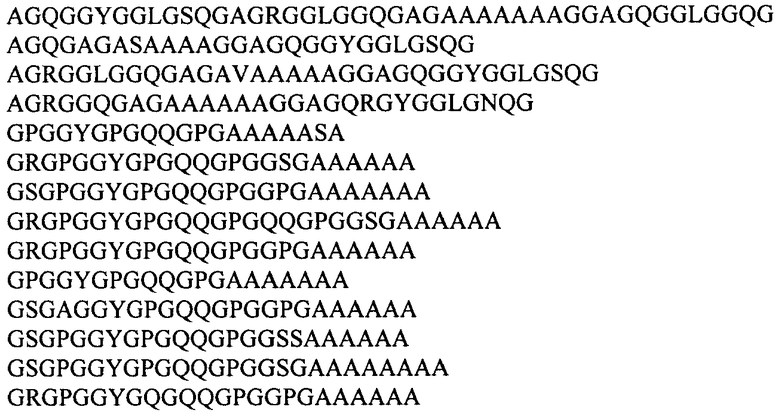
Наиболее предпочтительно, слитый белок содержит последовательность рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes, слитую с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae, как представлено в Перечне последовательностей (SEQ ID NO:1 и SEQ ID NO:3, соответственно).
В еще одном наиболее предпочтительном воплощении слитый белок содержит последовательность рекомбинантного белка 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis, слитую с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В еще одном аспекте изобретение охватывает рекомбинантные ДНК, кодирующие слитые белки. Синтезированные и клонированные последовательности ДНК, используемые в соответствии с изобретением для получения рекомбинантных белков паутины, кодируют слитые белки, включающие последовательности рекомбинантного белка паутины паука-кругопряда и убиквитин-подобного белка, занимающего в составе слитого белка N-концевое положение по отношению к рекомбинантному белку, причем последовательность рекомбинантного белка паутины включает консенсусные последовательности, которые происходят из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы, белков MiSp1 и MiSp2 малой ампуловидной железы и белка ловчей нити Flag паука-кругопряда.
Предпочтительно, рекомбинантная ДНК кодирует слитый белок, в котором убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, и последовательность рекомбинантного белка паутины паука-кругопряда включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
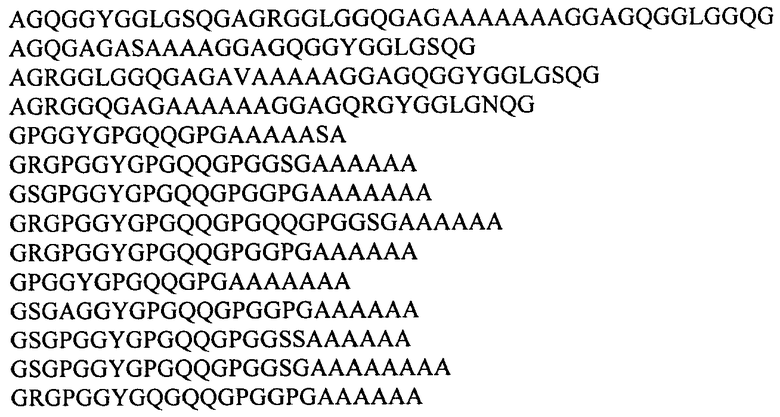
Наиболее предпочтительно, рекомбинантные ДНК, используемые в соответствии с изобретением для получения рекомбинантных белков паутины, кодируют рекомбинантный белок 1f9 каркасной нити паука-кругопряда Nephila clavipes или рекомбинантный белок 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis, последовательности которых слиты с последовательностью, кодирующей убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, как представлено в Перечне последовательностей (SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3). ДНК настоящего изобретения включают также кодирующие последовательности с учетом вырожденности кода и последовательности, используемые в качестве праймеров в реакциях амплификации.
Белки согласно изобретению получают в клетках дрожжей с использованием векторов экспрессии, в состав которых входят ген слитого белка, содержащего последовательности рекомбинантного белка паутины паука-кругопряда и убиквитин-подобного белка, и высокоэффективные регулируемые промоторы дрожжей, в частности такие промоторы, как GAL1, GPD1, CUP1. В качестве подходящих векторов для конструирования векторов экспрессии в соответствии с изобретением могут быть использованы эписомные векторы, содержащие область инициации репликации эндогенной 2-мкм плазмиды дрожжей, что обеспечивает их способность поддерживаться в клетках дрожжей в эписомном многокопийном состоянии.
В одном из предпочтительных воплощений изобретения конструируют векторы экспрессии, несущие рекомбинантную ДНК, кодирующую слитый белок, где убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, и последовательность рекомбинантного белка паутины паука-кругопряда включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis.
В одном из наиболее предпочтительных воплощений изобретения конструируют экспрессионные бирепликонные векторы pPDX3-HUB-1F9 (Фиг.3) и pPDX3-FIUB-2E12 (Фиг.5), которые получают путем клонирования последовательностей структурных генов белка 1F9 или белка 2Е12, соответственно, в плазмиде pPDX3-FIUB, несущей в своем составе под контролем промоторной области GAL1 дрожжей ген убиквитина Saccharomyces cerevisiae, причем в каждом случае осуществляют слияние в одной рамке считывания последовательности структурного гена белка 1F9 или белка 2Е12 и гена убиквитина.
В еще одном из наиболее предпочтительных воплощений изобретения конструируют экспрессионный бирепликонный вектор pPDX3-SUMO-1F9, который получают путем клонирования последовательности гена белка 1F9 в плазмиде pPDX3-SUMO, несущей в своем составе под контролем промоторной области GAL1 дрожжей структурный ген SMT3 Saccharomyces cerevisiae, кодирующий белок SUMO Saccharomyces cerevisiae, причем в результате клонирования осуществляют слияние в одной рамке считывания последовательности гена белка 1F9 и гена SMT3 (Фиг.4). Векторы экспрессии pPDX3-HUB-1F9, pPDX3-HUB-2E12 и pPDX3-SUMO-1F9 содержат область инициации репликации эндогенной 2-мкм плазмиды дрожжей, что обеспечивает их способность поддерживаться в клетках дрожжей Saccharomyces. cerevisiae в эписомном многокопийном состоянии.
В соответствии с одним из аспектов изобретение обеспечивает хозяйские клетки дрожжей, продуцирующие рекомбинантные белки паутины пауков-кругопрядов. В качестве подходящих хозяйских клеток для получения рекомбинантных белков паутины используют клетки дрожжей, которые выбирают из группы, включающей Saccharomyces cerevisiae, Kluyveromyces lactis, Hansenula polymorpha, Pichia pastoris и Schizosaccharomyces pombe. Предпочтительными хозяйскими клетками являются клетки Saccharomyces cerevisisae. Наиболее предпочтительно, в качестве хозяйских клеток используют реципиентный штамм Saccharomyces cerevisiae D702, который является диплоидным, что обеспечивает повышенную стабильность его экспрессионных характеристик. Saccharomyces cerevisiae D702 содержит гомозиготные мутации в хромосомных аллелях структурного гена PGK1, кодирующего фосфоглицерат киназу, что обеспечивает стабильное поддержание вектора на средах, содержащих любой единственный источник углерода, усваиваемый дрожжами Saccharomyces cerevisiae, и гена GAL80, кодирующего белок-репрессор промотора GAL1, а также гомозиготную мутацию, приводящую к изменению регуляции гена GAL4, кодирующего белок-активатор промотора GAL1, вследствие чего осуществляется галактозорегулируемая экспрессия генов, находящихся под контролем промотора GAL1.
В одном из наиболее предпочтительных воплощений изобретения клетки реципиентного штамма Saccharomyces cerevisiae D702 трансфомируют экспрессионным вектором pPDX3-HUB-1F9. Полученный в результате штамм SCR-702-1F9, продуцирующий рекомбинантный белок 1F9 каркасной нити паутины паука-кругопряда Nephila clavipes, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) как штамм Saccharomyces cerevisiae ВКПМ Y-3583.
Еще в одном из наиболее предпочтительных воплощений изобретения клетки реципиентного штамма Saccharomyces cerevisiae D702 трансформируют экспрессионным вектором pPDX3-HUB-2E12. Полученный в результате штамм SCR-702-2E12, продуцирующий рекомбинантный белок 2Е12 каркасной нити паутины паука-кругопряда Nephila madagascariensis, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) как штамм Saccharomyces cerevisiae ВКПМ Y-3584.
Еще в одном из наиболее предпочтительных воплощений изобретения клетки реципиентного штамма Saccharomyces cerevisiae D702 трансформируют экспрессионным вектором pPDX3-SUMO-1F9.
Характеристика штаммов-продуцентов. Генотип:
SCR-702-1f9 (а/α lеu2/lеu2 urа3/ura3 trp1/trp1 gal80::LEU2/gal80::LEU2 lys7/LYS7 his3/HIS3 his4/HIS4 pgk1:URA3/pgk1:URA3 GAL4:(STA2p-GAL4,TRP1)/GAL4:(STA2p-GAL4, TRP1) STA2/STA2 suc°/SUC2)/pPDX3-1f9
SCR-702-2E12 (a/α leu2/leu2 ura3/ura3 trp1/trp1 gal80:LEU2/gal80:LEU2 lys7/LYS7 his3/HIS3 his4/HIS4 pgk1:URA3/pgk1:URA3 GAL4:(STA2p-GAL4, TRP1)/GAL4:(STA2p-GAL4, TRP1) STA2/STA2 suc°/SUC2)/pPDX3-2E12
Морфологические признаки:
При культивировании при температуре 28°C в течение 48 часов на агаризованной среде YPD следующего состава (в мас.%): пептон - 2, дрожжевой экстракт - 1, глюкоза - 2, агар - 2, вода - остальное, клетки штаммов-продуцентов Saccharomyces cerevisiae имеют овальную форму, 3-7 мкм в диаметре. Клетки почкуются. Почкование истинное, многостороннее. Истинного мицелия не образуют. Колонии имеют следующий вид:
1) на агаризованной среде YPD колонии белого цвета с ровным краем, матовой поверхностью, линзовидным профилем и сметанообразной консистенцией;
2) на агаризованной среде с крахмалом (состав в мас.%: пептон - 2, дрожжевой экстракт - 1, крахмал - 1, агар - 2, вода - остальное) колонии белого цвета с узорчатым краем, матовой поверхностью, линзовидным профилем и крупчатой консистенцией.
Рост в жидкой среде с крахмалом: при 28°C в течение первых 24 ч культивирования - жидкость мутная, осадок белый, не комкуется, пристеночных пленок не образует.
Физико-химические признаки:
Оба штамма - факультативные анаэробы. Температура роста - 20-33°C (оптимум - 28°C). pH культивирования - 3,8-7,4 (оптимум - 5,0).
Ассимиляция источников углерода:
Оба штамма сбраживают глюкозу, фруктозу, мальтозу, сахарозу, декстрины, крахмал. Не сбраживают лактозу, галактозу, инулин, ксилозу, арабинозу.
Ассимиляция источников азота:
Оба штамма усваивают аминокислоты, сернокислый аммоний, азотнокислый аммоний.
Хранение:
Штаммы хранят при температуре -70°C в 20% водном растворе глицерина. Возможно хранение на агаризованной богатой среде с глюкозой в течение 3 месяцев при +4°С.
Стабильность:
Стабильность заявляемых штаммов сохраняется при 20 последовательных пересевах на агаризованной среде YPD при температуре 28°C.
Патогенность: не являются патогененными.
Изобретение илюстрируется следующими примерами, представленными для подтверждения, но не ограничения объема притязяний.
Примеры.
Пример 1. Конструирование вектора pPDX3-HUB
Структурный ген убиквитина дрожжей, кодирующий белок с последовательностью, представленной в SEQ ID NO 1 или 2, амплифицируют в реакции ПЦР с использованием в качестве матрицы хромосомной ДНК лабораторного штамма S. cerevisiae Y618 [Kartasheva et al, 1996, Yeast, v.12, 1297-13], выделяемой по методу Сидорука [Сидорук с соавт., 2008, Сборник тезисов и докладов «Актуальные вопросы генетики, радиобиологии и радиоэкологии», Дубна, ОИЯИ, стр.100]. Праймерами для амплификации служат N513 (5'-ataccatggaacatcatcatcatcatcatggaggcatgcagatcttcgtcaagactttga) и N514 (5'-actggatccacctcttagccttagcacaac). Полученный в результате амплификации фрагмент ДНК размером 510 п.о. элюируют из агарозного геля с использованием кита Qiagen (Qiagen, cat. №28706), обрабатывают рестриктазами Ncol и BamHI и клонируют в расщепленной по тем же сайтам лабораторной плазмиде pUC18x-GAL1-Ncol, несущей Hindlll/Ncol фрагмент ДНК, кодирующий промоторную область гена GAL1 дрожжей. S.cerevisiae. В результате получают плазмиду p101-25, содержащую в своем составе нуклеотидную последовательность, кодирующую убиквитин дрожжей S.cerevisiae, слитую с нуклеотидной последовательностью промоторной области гена GAL1 дрожжей S.cerevisiae. Плазмида pi01-25 содержит сайт узнавания рестриктазы XhoI в полилинкерной области следом за сайтом клонирования BamHI.
HindIII/XholI фрагмент ДНК плазмиды p101-25, включающий промоторную область гена GAL1 и нуклеотидную последовательность, кодирующую убиквитин, клонируют в лабораторном векторе pPDX3, ДНК которого расщеплена по тем же сайтам. В результате клонирования получают вектор pPDX3-HUB, который используют для клонирования генов рекомбинантных белков паутины.
Пример 2. Конструирование экспрессионного вектора pPDX3-HUB-1F9
Экспрессионный вектор pPDX3-HUB-1F9 (Фиг.3) получают в результате клонирования BgllllXhol фрагмента ДНК лабораторной плазмиды pUC21-1F9 размером 3.6 т.п.н., включающего ген белка 1F9, в векторе pPDX3-HUB, ДНК которого расщеплена по сайтам BamHI и Xhol. В результате клонирования получают экспрессионный вектор pPDX3-HUB-1F9, в составе которого структурный ген белка 1F9 слит в одной рамке считывания со структурным геном, кодирующим убиквитин. Вектор используют для экспрессии белка 1F9 в клетках дрожжей S.cerevisiae.
Пример 3. Конструирование экспрессионного вектора pPDX3-HUB-2E12
Экспрессионный вектор pPDX3-HUB-2E12 получают в результате клонирования BgIII/XhoI фрагмента ДНК лабораторной плазмиды pUC21-2Е12 размером 4.2 т.п.н., включающего ген белка 2Е12, в векторе pPDX3-HUB, ДНК которого расщеплена по сайтам BamHI и Xhol. В результате клонирования получают экспрессионный вектор pPDX3-HUB-2E12, в составе которого структурный ген белка 2Е12 слит в одной рамке считывания со структурным геном, кодирующим убиквитин. Вектор используют для экспрессии белка 2Е12 в клетках дрожжей S.cerevisiae.
Пример 4. Конструирование вектора pPDX3-SUMO.
Структурный ген SMT3 дрожжей S.cerevisiae, кодирующий белок SUMO с последовательностью, представленной в SEQ ID NO 3, амплифицируют в реакции ПНР с использованием в качестве матрицы хромосомной ДНК лабораторного штамма S.cerevisiae как в примере 1.
Амплификацию проводят в две стадии. Сначала амплифицируют два перекрывающихся фрагмента ДНК, для чего используют следующие пары праймеров:
Фрагмент 1 размером 129 п.о.:

Амплифицированные фрагменты ДНК элюируют из агарозного геля и используют для ПЦР-лигирования. Для этого смесь фрагментов 1 и 2 используют в качестве матрицы для ПЦР, праймерами служат N450 и N452. Полученный в результате ПЦР фрагмент ДНК размером 290 п.о. элюируют из агарозного геля, обрабатывают рестриктазами BglII и BamHI и клонируют в сайт BamHI лабораторной плазмиды pUC18x-GALl -BamHI, несущей HindIII/BamHI фрагмент ДНК, кодирующий промоторную область гена GAL1 дрожжей S.cerevisiae, содержащую ATG кодон и сайт BamHI (подчеркнут) в последовательности ATGCATGGATCC. В результате осуществляют слияние последовательности гена SMT3 дрожжей S.cerevisiae и последовательности, кодирующей промоторную область гена GAL1 дрожжей S.cerevisiae. В результате получают плазмиду р101-18, в составе которой клонированный ген SMT3 секвенируют.
Полученная плазмида р101-18 содержит фрагмент ДНК, в составе которого ген SMT3 дрожжей слит с промоторной областью гена GAL1 дрожжей. В полилинкерной части плазмиды р101-18 следом за сайтом клонирования BamHI находится сайт узнавания рестриктазы XhoI. HindIII/XhoI фрагмент ДНК плазмиды р101-18, включающий промоторную область гена GAL1 и клонированный ген SMT3, клонируют в лабораторном векторе pPDX3, ДНК которого расщеплена по тем же сайтам. В результате клонирования получают вектор pPDX3-SUMO, который используют для клонирования генов рекомбинантных белков паутины.
Пример 5. Конструирование экспрессионного вектора pPDX3-SUMO-1F9.
Экспрессионный вектор pPDX3-SUMO-1F9 (Фиг.4) получают в результате клонирования BglII/XhoI фрагмента ДНК лабораторной плазмиды pUC21-1F9 размером 3.6 т.п.н., включающего ген белка 1F9, в векторе pPDX3-SUMO, ДНК которого расщеплена по сайтам BamHI и XhoI. В результате клонирования получают экспрессионный вектор pPDX3-HUB-1F9, в составе которого структурный ген белка 1F9 слит в одной рамке считывания со структурным геном, кодирующим убиквитин. Вектор используют для экспрессии белка 1F9 в клетках дрожжей S.cerevisiae.
Пример 6. Конструирование штамма SCR-702-1F9 - продуцента белка 1F9 (ВКПМ Y-3583).
Штамм SCR-702-1F9 получают в результате трансформации лабораторного штамма D702 экспрессионным вектором pPDX3-HUB-1F9. Для осуществления трансформации клетки штамма D702 подращивают в течение 18-24 часов при температуре 28°C на агаризованной среде YPGE, следующего состава в мас.%: бактопептон - 2, дрожжевой экстракт - 1, бактоагар - 2, этанол - 2, глицерин - 3, вода - остальное. Трансформацию выращенных клеток штамма D702 проводят по методу Ito с соавт. [Ito et al., 1983, J. Bacteriol., v.153, 163-168]. Трансформанты отбирают по способности расти на среде YPD следующего состава в мас.%: бактопептон - 2, дрожжевой экстракт - 1, глюкоза - 2, бактоагар - 2, вода - остальное. Один из полученных трансформантов называют SCR-702-1F9.
Пример 7. Конструирование штамма SCR-702-2E12 - продуцента белка 2Е12.
Штамм SCR-702-2E12 получают в результате трансформации лабораторного штамма D702 экспрессионным вектором pPDX3-HUB-2E12. Трансформацию осуществляют как в примере 6. Штамм SCR-702-2E12 депонирован во Всероссийской Коллекции Промышленных Микроорганизмов как штамм Saccharomyces cerevisiae ВКПМ Y-3584.
Пример 8. Конструирование штамма D702-SUMO-1F9-продуцента белка 1F9.
Штамм D702-SUMO-1F9 получают в результате трансформации лабораторного штамма D702 экспрессионным вектором pPDX3-SUMO-1F9. Трансформацию осуществляют как в примере 4 за исключением того, что используют плазмиду pPDX3-SUMO-1F9.
Пример 9. Анализ экспрессии рекомбинантных белков 1F9 и 2Е12 в клетках штаммов Saccharomyces cerevisiae.
Клетки S. cerevisiae ВКПМ Y-3583, ВКПМ Y-3584 или D702-SUMO-1F9 культивируют в колбах при 30°C на ротационной качалке со скоростью 250 об/мин на жидкой среде YPD состава, в мас.%: бактопептон - 2, дрожжевой экстракт - 1, глюкоза - 2, вода - остальное, засевая в титре 5×105 - 5×106 мл-1. Образцы для анализа отбирают через 46 часов роста культуры. Конечная оптическая плотность культуры составляет ОД600=40-45. Клетки отделяют от среды культивирования осаждением с помощью центрифугирования при 10000 g в течение 1 мин и используют для последующего анализа экспрессии белков 1F9 и 2Е12 микрометодом в пробирке на 1,5 мл. Для этого осадок клеток суспендируют в "буфере для разрушения" (0,05 М фосфата натрия, 2,5 мМ ЭДТА, 5% глицерина) из расчета 100 мкл буфера на 100 мкл влажного осадка клеток. Разрушение клеток осуществляют с помощью стеклянных шариков (d=0,45-0,65 мм) на встряхивателе для пробирок типа «Вортекс». Для этого 570 мг шариков смешивают с 200 мкл суспензии клеток, смесь встряхивают при 0°C в течение 90 сек, к содержимому пробирок добавляют 250 мкл «буфера для разрушения» и встряхивание повторяют еще 60 сек. В пробирки вносят 500 мкл «буфера для разрушения», содержимое пробирок перемешивают, после чего полученные образцы центрифугируют в течение 10 мин при 16000 g. В супернатанте, содержащем водорастворимые белки дрожжевых клеток, с помощью 1 М раствора ацетата натрия доводят pH до 4,0 и выпавший материал удаляют центрифугированием в течение 5 мин при 16 тыс.об/мин; супернатант затем прогревают при 65°C 20 минут и выпавшие в осадок балластные белки удаляют центрифугированием; полученный раствор диализуют 40 минут против 10 мМ ацетата натрия, pH 4,0. Осадок водонерастворимых белков суспендируют в 750 мкл «буфера для разрушения», переносят в новые пробирки и центрифугируют в течение 15 мин при 16000 g. Полученный осадок (100 мкл), содержащий целевые белки, суспендируют в 400 мкл буфера «6,5G» (6,5 М раствор гуанидин гидрохлорида или гуанидин тиоцианата в буфере, содержащем 0.1 М фосфата натрия, 0.01 М Tris-HCl, pH 6.5) и целевые белки экстрагируют в течение ночи на магнитной мешалке при температуре +4°C. Затем суспензию центрифугируют в течение 15 мин при 16000 g, супернатант с перешедшим в него целевым белком диализуют против 300 мл 5 мМ ацетата натрия в течение 1,5 часов. Полученный образец центрифугируют в течение 15 мин при 16000 g и супернатант используют для электрофоретического анализа уровня продукции целевого белка.
Электрофоретический анализ целевого белка проводят 12% ПААГ-ДДС-Na по стандартной процедуре Лэммли [Laemmli, 1970, Nature, v.227, 680-685]. Для анализа раствор разводят приблизительно в 500 - 1000 раз «буфером для образцов» (0.0625 М Tris-HCl, pH 6.8, 2 мас.% ДДс-Na, 0.0025 мас.% бромфенол blue). И кипятят в водяной бане в течение 5 минут. Аликвоты в 3-15 мкл наносят на 12% ПААГ и подвергают электрофорезу в аппарате Bio Rad MiniPROTEAN пока фронт красителя будет на расстоянии 1 см до конца геля. Гели отмывают в воде и окрашивают в 0,2% растворе Кумасси R-250 (Fermentas). Электрофоретический анализ показывает, что белки 1F9 и 2Е12 накапливаются во фракции водонерастворимых белков клеток дрожжей S. cerevisiae и не содержат компонент SUMO или убиквитина (Фиг.1 и 2). На это указывает электрофоретическая подвижность анализируемых белков и отсутствие в геле полос белка, соответствующих по подвижности гибридным белкам 1F9 и 2Е12, слитых с белком SUMO или убиктивином.
Количественную оценку чистоты препаратов осуществляли с помощью программы «Видеоденситометр Сорбфил 1.0», для чего окрашенные гели после электрофореза сканировали, полученное изображение вводили в компьютер и оценку количества белка в пятне и на каждой дорожке определяли с помощью указанной программы. В качестве стандартов сравнения использовали высокоочищенные препараты исследуемых белков, известное количество которых наносили на соседние дорожки в том же геле. Чистота препаратов белков, оцененная таким способом составляла 96% и выше.
Пример 10. Продукция белков 1F9 и 2Е12 штаммами Saccharomyces cerevisiae ВКПМ Y-3583 и ВКПМ Y-3584
Для получения посевного материала штаммы ВКПМ Y-3583 и ВКПМ Y-3584 выращивают в среде YPD на ротационной качалке со скоростью 250 об/мин при температуре 28°C в течение 20-24 часов. 50 мл посевного материала используют для засева 3-литрового ферментера Anglicon, содержащего 950 мл среды YPD. Ферментацию проводят при температуре 28°C, аэрации 1 л/мин и скорости перемешивания 1000 об/мин. Через 24 часа после засева ферментера начинают подпитку среды культивирования 50%-ным раствором глюкозы со скоростью 2 мл/ч и устанавливают pH-статирование культуры на уровне pH 6.8±0.1, используя для подтитровки растворы 10% серной кислоты и 10% NaOH. Среднее общее время ферментирования составляет 72 часа. По данным электрофоретического анализа продукция белка 1F9 в этих условиях составляет не менее 200 мг/л культуральной жидкости и продукция белка 2Е12 в этих условиях составляет не менее 100 мг/л культуральной жидкости.
Пример 11. Выделение и очистка рекомбинантных белков 1F9 и 2Е12 из водонерастворимой фракции клеток Saccharomyces cerevisiae
Выделение и очистку белков 1F9 и 2Е12 из водонерастворимой фракции клеток штаммов-продуцентов ВКПМ Y-3583 и ВКПМ Y-3583 проводят с использованием методов, описанных Богушем с соавт. [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22; Богуш В.Г. с соавт., 2006, Биотехнология, т.4, 3-12; Bogush V.G. et al., 2009, J. Neuroimmune Pharmacol., v.4, 17-27]. При наращивании биомассы дрожжей S.cerevisiae в 3-литровом ферментере на среде YPD без подпитки в присутствии 2% глюкозы в стартовой среде с одной ферментации получают в среднем 400-500 г влажной клеточной биомассы. 1 кг промытой влажной биомассы суспендируют в «буфере для разрушения» и клетки разрушают с помощью стеклянных шариков в проточной мельнице в течение 1,5 часов, центрифугируют полученную суспензию и собирают осадок. Экстракцию целевого белка из осадка осуществляют с помощью раствора 10% лития хлористого в 90%-ной муравьиной кислоте в течение 16-18 часов с последующим центрифугированием. Осадок отбрасывают, а супернатант подвергают ультрафильтрации с последующей диафильтрацией через мембрану М50 для перевода в 10 мМ ацетат натрия, pH 4,0 и удаления белков клетки хозяина с молекулярной массой ниже 50 кДа.
Окончательную очистку проводят с помощью ионно-обменной хроматографии на катионообменной колонке HiPrep 16/10 SP FF (GE Healthcare) в системе ФПЛС. После прохождения фильтрата через колонку и последующей промывки колонки 10 мМ Na-фосфатным буфером, pH 7,0 и затем 10 мМ натрий-ацетатным буфером, pH 4,0, белки 1F9 и 2Е12 элюируют с колонки 10%-ным раствором NaCl в том же буфере и идентифицируют электрофоретически в 12% ПААГ-ДДс-Na, фракции с целевым белком объединяют, диализуют против деионизованной воды, замораживают при -70C° и лиофильно высушивают. Лиофилизованный препарат представляет собой субстанцию белого цвета, похожую на вату.
Пример 12. Определение характеристик белков 1F9 и 2Е12
Для проведения анализа полученного препарата чистого рекомбинантного белка предварительно растворяют навеску препарата в 90%-ной муравьиной кислоте с 10%-ным хлоридом лития в течение не менее 2 часов, диализуют против деионизованной воды (1-1,5 часа) и анализируют с помощью SDS-электрофореза в 12% ПААГ. Наличие одной полосы в геле, соответствующей молекулярномой массе рекомбинантного белка, подтверждает гомогенность получаемого препарата. Полученные препараты обоих белков характеризуются коэффициентом экстинкции, равным приблизительно 0,48±0,02 ОЕ280/мг. Эта величина соответствует теоретически рассчитанной, исходя из аминокислотного состава этих белков (0,49 ОЕ280/м), и свидетельствует о высокой чистоте полученных препаратов.
Для анализа способности очищенных рекомбинантных белков паутины паука-кругопряда образовывать надмолекулярные структуры различных типов эти белки были протестированы на способность формировать не растворяющиеся в воде нити. Нити получают в результате спиннинга (прядения) концентрированного раствора белка через узкое отверстие. Для этого навеску очищенного лиофильно высушенного препарата белка растворяют в 90%-ной муравьиной кислоте с 10%-ным хлоридом лития в течение не менее 2 часов, диализируют против деионизованной воды в течение 1-1,5 часов и нерастворившийся материал удаляют центрифугированием. Раствор белка пропускают через специально сконструированный микроспиннерет с внутренним диаметром около 50 мкм со скоростью 5-10 мкл/мин в коагуляционную ванну с 96% этанолом. При этом образуется водонерастворимая нить, которая свободно ниспадает на дно сосуда. Вновь образованные искусственные нити в сосуде с этанолом представлены на Фиг.8. Новообразованную нить выдерживают в сосуде с 96% спиртом в течение 20 минут, затем максимально растягивают в 75%-ном этаноле, отжигают, выдерживают в деионизованной воде и высушивают на воздухе. Нити, подвергнутые всем этапам воздействия, характеризуются значениями относительной разрывной нагрузки в 10-15 сН/текс (13 мПа).
Приведенные результаты показывают, что при осуществлении предложенного способа получения рекомбинантных белков паутины паука-кругопряда достигнуто существенное повышение выхода рекомбинантных белков, причем получаемые рекомбинантные белки характеризуются высокой чистотой и физико-химическими свойствами, характерными для природных белков паутины. Предложенный способ получения рекомбинантного белка паутины позволяет получать препараты рекомбинантного белка с очень высокой степенью очистки в промышленном масштабе, разрабатывать способы микропрядения для получения на его основе искусственных волокон, а также способы формирования пленок, гидрогелей, микрогелей и микрокапсул на основе рекомбинантных белков паутины для использования в биотехнологии, медицине, косметологии, автомобильной и авиационной промышленности и других областях техники.












Изобретение относится к области биотехнологии и касается способа получения рекомбинантных белков паутины паука-кругопряда в клетках дрожжей, слитых белков, содержащих последовательности рекомбинантных белков паутины паука-кругопряда, рекомбинантных ДНК, кодирующих слитые белки, клеток-хозяев дрожжей и векторов экспрессии, используемых для осуществления способа, а также штаммов - продуцентов рекомбинантных белков паутины паука-кругопряда. Способ включает конструирование вектора экспрессии, содержащего последовательность ДНК, кодирующую рекомбинантный белок паутины паука-кругопряда, слитую с последовательностью, кодирующую убиквитин или убиквитин-подобный белок SUMO дрожжей Saccharomyces cerevisiae, которая занимает в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, трансформацию клеток дрожжей полученным вектором экспрессии и экспрессию в трансформированных клетках белка паутины паука-кругопряда. Представленный способ позволяет увеличить продукцию рекомбинантного белка паутины при накоплении последнего в клетках дрожжей в водонерастворимой фракции в виде белка, не содержащего гибридный компонент. 7 н. и 17 з.п. ф-лы, 6 ил., 12 пр.
1. Способ получения белка паутины паука-кругопряда в клетках дрожжей Saccharomyces cerevisiae, предусматривающий конструирование вектора экспрессии, содержащего последовательность ДНК, кодирующую рекомбинантный белок паутины паука-кругопряда, слитую с последовательностью, кодирующей убиквитин или убиквитин-подобный белок SUMO дрожжей Saccharomyces cerevisia, которая занимает в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, трансформацию клеток дрожжей полученным вектором экспрессии и экспрессию в трансформированных клетках белка паутины паука-кругопряда, причем убиквитин имеет последовательность, выбранную из группы SEQ ID NO: 1 или 2, а белок SUMO, имеет последовательность SEQ ID NO: 3.
2. Способ по п.1, отличающийся тем, что используют вектор экспрессии, который содержит последовательность ДНК, кодирующую рекомбинантный белок паутины паука-кругопряда, консенсусные последовательности которого происходят из каркасных белков большой и/или малой ампульных желез или белков ловчей нити.
3. Способ по п.1, отличающийся тем, что используют вектор экспрессии, который содержит последовательность ДНК, кодирующую рекомбинантный белок паутины паука-кругопряда, консенсусные последовательности которого происходят из каркасных белков большой ампульной железы Nephila clavipes и/или Nephila madagascariensis.
4. Способ по п.1, отличающийся тем, что используют бирепликонный вектор pPDX3-HUB-2E12, включающий область инициации репликации эндогенной 2-мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный белок 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis, слитую с последовательностью, кодирующей убиквитин Saccharomyces cerevisiae.
5. Способ по п.1, отличающийся тем, что используют бирепликонный вектор pPDX3-HUB-1F9, включающий область инициации репликации эндогенной 2-мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный белок 1F9 каркасной нити паука кругопряда Nephila clavipes, слитую с последовательностью, кодирующей убиквитин Saccharomyces cerevisiae.
6. Способ по п.1, отличающийся тем, что используют бирепликонный вектор pPDX3-SUMO-1F9, включающий область инициации репликации эндогенной 2-мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный белок 1F9 каркасной нити паука-кругопряда Nephila clavipes, слитую с последовательностью, кодирующей белок SUMO Saccharomyces cerevisiae.
7. Слитый белок, включающий рекомбинантный белок паутины паука-кругопряда и убиквитин или убиквитин-подобный белок SUMO дрожжей Saccharomyces cerevisiae, занимающий в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, причем последовательность рекомбинантного белка паутины включает консенсусные последовательности, которые происходят из повторяющихся последовательностей белков каркасной нити MaSp1 и/или MaSp2 большой ампульной железы, белков MiSp1 и/или MiSp2 малой ампульной железы, или белка Flag ловчей нити паука-кругопряда, последовательности, кодирующие убиквитин представлены в SEQ ID NO: 1 или 2, а последовательность, кодирующая убиквитин-подобный белок, представлена в SEQ ID NO: 3.
8. Слитый белок по п.7, в котором последовательность рекомбинантного белка паутины паука-кругопряда включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков каркасной нити MaSp1 и MaSp2 большой ампульной железы Nephila clavipes и Nephila madagascariensis и выбранные из группы:
AGQGGYGGLGSQGAGRGGLGGQGAGAAAAAAAGGAGQGGLGGQG
AGQGAGASAAAAGGAGQGGYGGLGSQG
AGRGGLGGQGAGAVAAAAAGGAGQGGYGGLGSQG
AGRGGQGAGAAAAAAGGAGQRGYGGLGNQG
GPGGYGPGQQGPGAAAAASA
GRGPGGYGPGQQGPGGSGAAAAAA
GSGPGGYGPGQQGPGGPGAAAAAAA
GRGPGGYGPGQQGPGQQGPGGSGAAAAAA
GRGPGGYGPGQQGPGGPGAAAAAA
GPGGYGPGQQGPGAAAAAAA
GSGAGGYGPGQQGPGGPGAAAAAA
GSGPGGYGPGQQGPGGSSAAAAAA
GSGPGGYGPGQQGPGGSGAAAAAAAA
GRGPGGYGQGQQGPGGPGAAAAAA.
9. Слитый белок по п.7, отличающийся тем, что содержит последовательности рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes и убиквитина дрожжей Saccharomyces cerevisiae и имеет последовательность SEQ ID NO: 1.
10. Слитый белок по п.7, отличающийся тем, что содержит последовательности рекомбинантного белка каркасной нити 2Е12 паука-кругопряда Nephila madagascariensis и убиквитина дрожжей Saccharomyces cerevisiae и имеет последовательность SEQ ID NO: 2.
11. Слитый белок по п.7, отличающийся тем, что содержит последовательности рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes и белка SUMO дрожжей Saccharomyces cerevisiae и имеет последовательность SEQ ID NO: 3.
12. Рекомбинантная ДНК, кодирующая слитый белок по п.7, включающий последовательности рекомбинантного белка паутины паука-кругопряда и убиквитина или убиквитин-подобного белка SUMO дрожжей Saccharomyces cerevisiae, занимающего в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, причем последовательность рекомбинантного белка паутины включает консенсусные последовательности, которые происходят из повторяющихся последовательностей белков каркасной нити MaSp1 и/или MaSp2 большой ампульной железы, белков MiSp1 и/или MiSp2 малой ампульной железы или белка Flag ловчей нити паука-кругопряда, последовательности, кодирующие убиквитин, представлены в SEQ ID NO: 1 или 2, а последовательность, кодирующая убиквитин-подобный белок, представлена в SEQ ID NO: 3.
13. Рекомбинантная ДНК по п.12, где консенсусные последовательности рекомбинантного аналога белка паутины паука-кругопряда представляют последовательности, происходящие из повторяющихся последовательностей белков каркасной нити MaSp1 и MaSp2 большой ампульной железы Nephila clavipes и Nephila madagascariensis и выбранные из группы:
AGQGGYGGLGSQGAGRGGLGGQGAGAAAAAAAGGAGQGGLGGQG
AGQGAGASAAAAGGAGQGGYGGLGSQG
AGRGGLGGQGAGAVAAAAAGGAGQGGYGGLGSQG
AGRGGQGAGAAAAAAGGAGQRGYGGLGNQG
GPGGYGPGQQGPGAAAAASA
GRGPGGYGPGQQGPGGSGAAAAAA
GSGPGGYGPGQQGPGGPGAAAAAAA
GRGPGGYGPGQQGPGQQGPGGSGAAAAAA
GRGPGGYGPGQQGPGGPGAAAAAA
GPGGYGPGQQGPGAAAAAAA
GSGAGGYGPGQQGPGGPGAAAAAA
GSGPGGYGPGQQGPGGSSAAAAAA
GSGPGGYGPGQQGPGGSGAAAAAAAA
GRGPGGYGQGQQGPGGPGAAAAAA.
14. Рекомбинантная ДНК по п.12, кодирующая слитый белок, содержащий последовательности рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes и убиквитина дрожжей Saccharomyces cerevisiae и имеющий последовательность SEQ ID NO:1.
15. Рекомбинантная ДНК по п.12, кодирующая слитый белок, содержащий последовательности рекомбинантного белка 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis и убиквитина дрожжей Saccharomyces cerevisiae и имеющий последовательность SEQ ID NO:2.
16. Рекомбинантная ДНК по п.12, кодирующая слитый белок, содержащий последовательности рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes и белка SUMO дрожжей Saccharomyces cerevisiae и имеющий последовательность SEQ ID NO:3.
17. Вектор экспрессии, содержащий рекомбинантную ДНК по п.12.
18. Вектор экспрессии по п.17, включающий рекомбинантную ДНК, кодирующую белок паутины паука-кругопряда, консенсусные последовательности которого происходят из повторяющихся последовательностей каркасных белков большой ампульной железы Nephila clavipes и/или Nephila madagascariensis, и убиквитин или убиквитин-подобный белок SUMO дрожжей Saccharomyces cerevisiae.
19. Вектор экспрессии по п.17, представляющий бирепликонный вектор pPDX3-HUB-2E12 и содержащий область инициации репликации эндогенной 2-мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный аналог белка 2Е12, слитую с последовательностью, кодирующей убиквитин Saccharomyces cerevisiae.
20. Вектор экспрессии по п.17, представляющий бирепликонный вектор pPDX3-HUB-1F9 и содержащий область инициации репликации эндогенной 2-мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный аналог белка 1F9, слитую с последовательностью, кодирующей убиквитин Saccharomyces cerevisiae.
21. Вектор экспрессии по п.17, представляющий бирепликонный вектор pPDX3-SUMO-1F9, включающий область инициации репликации эндогенной 2-мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный белок 1F9, слитую с последовательностью, кодирующей белок SUMO Saccharomyces cerevisiae.
22. Клетка-хозяин Saccharomyces cerevisiae, продуцирующая рекомбинантный белок каркасной нити паутины паука-кругопряда, трансформированная вектором экспрессии по п.17.
23. Штамм Saccharomyces cerevisiae ВКПМ Y-3583, продуцирующий рекомбинантный белок 1F9 каркасной нити паутины паука-кругопряда и трансформированный вектором экспрессии pPDX3-HUB-1F9.
24. Штамм Saccharomyces cerevisiae ВКПМ Y-3584, продуцирующий рекомбинантный белок 2Е12 каркасной нити паутины паука-кругопряда и трансформированный вектором экспрессии pPDX3-HUB-2E12.
| БОГУШ В.Г | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 2009226969 A1, 10.09.2009 | |||
| MICHAEL P | |||
| MALAKHOV et al., SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins | |||
| Journal of | |||
Авторы
Даты
2012-05-20—Публикация
2010-11-25—Подача