Область техники, к которой относится изобретение.
Изобретение относится к области биотехнологии и направлено на способ получения суспензий гелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины и их применению.
Уровень техники
Паутина является уникальным биоматериалом, сочетающим в себе удивительную прочность и эластичность. По этим показателям она не имеет аналогов как в природе, так и среди материалов, созданных человеком. Так, например, каркасная нить паутины паука-кругопряда Nephila clavipes no значениям прочности на разрыв превосходит сталь и сопоставима с кевларом, а по величине энергии разрыва превосходит и кевлар; в то же время она может растягиваться до 35% своей длины [Gosline J.M. et al. Endeavor, 1986, v.10, 37-43].
Получение промышленных количеств таких материалов возможно лишь с помощью генно-инженерных и биотехнологических методов. К настоящему времени выделены и достаточно полно охарактеризованы несколько генов, кодирующих белки паутины [Xu M. & Lewis R. Proc. Natl.Acad.Sci, USA, 1990, v.87, 7120-7124; HinnmanM. & Lewis R.J.Biol. Chem, 1992, v.267, 19320-19324; Guerette P. et al. J.Science, 1996, v.272, 112-115; Hayashi C.Y.& Lewis R.V.J.Mol. Biol.,1998, v.275, 773-784]. Эти гены относятся к наиболее протяженным из известных цистронов (размеры мРНК лежат в диапазоне от 7,5 до 15,5 т.н.) и состоят из большого числа тандемно повторяющихся протяженных последовательностей, которые заметно различаются у разных генов. Наиболее изученная каркасная нить паука-кругопряда Nephila clavipes состоит из двух белков - спидроина 1 и спидроина 2 (MaSp1 и MaSp2 соответственно) синтезируемых большой ампуловидной железой [Hinnman M. & Lewis R.J.Biol. Chem., 1992, v.267, 19320-19324; Guerette P. et al. Science, 1996, v.272, 112-115]. Повторяющийся элемент спидроина 1 можно представить в виде следующей консенсусной последовательности:
[GGAGQGGYGGLGSQGAGRGGLGGQGAG(A)4-7],
а повторяющуюся последовательность спидроина 2 - в виде
[GPGGYGPGQQGPGGYAPGQQPSGPGS(A)6-10].
Принципиальным различием между этими белками является то, что в случае спидроина 1 элементарным повтором является трипептид GGX (Х=А, S или Y), а в случае спидроина 2 - пентапептиды GPGGY и GPGQQ. При этом для спидроина 1 характерна повышенная прочность, а для спидроина 2, способного образовывать (β-спирали [Hayashi et al., 1999, Int. J.Biol. Macromol., v.24, 271-275], - большая эластичность. Взаимодействие этих белков в составе каркасной нити паутины и обеспечивает уникальное сочетание ее свойств.
Белки MiSp1 и MiSp2, синтезируемые малой ампуловидной железой, и белок Flag ловчей нити паука-кругопряда также имеют повторяющуюся структуру. Повторяющиеся области обогащены аланином и глицином. Мотивы GGX и GA представлены по всей длине аминокислотной последовательности как белка MiSpl, так и белка MiSp2 [К. Vasanthavada et al. Cell. Mol. Life Sci, 2006, v.63, 1986-1999]. В последовательности белка Flag ловчей нити доминантные повторяющияся мотивы представлены пентапептидом GPGG1X и трипептидом GGX.
Результаты исследования белков каркасной нити паука-кругопряда Nephila clavipes, а также белка ловчей нити и белков, синтезируемых малой ампуловидной железой [KohlerT. & VollrathF. J. Exp.ZooL, 1995, v.271, 1-17; Colgin M.A. & Lewis R., Protein Sci., 1998, v.7, 667-672], позволили выдвинуть модульную гипотезу строения белков паутины [Hinman at al., 2000, TIBTECH, V.1, 374-379]. Структурный анализ белков паутины свидетельствует о наличии в них кристаллических областей, образованных β-складчатыми структурами (считается, что они формируются блоками (А)n и (GA)n), которые обеспечивают прочность нитей паутины и которые погружены в менее структурированный Gly-обогащенный матрикс, ответственный за эластичность. На концах молекул содержатся неповторяющиеся (NR) уникальные консервативные последовательности, которые необходимы, как полагают, для повышения растворимости белков в концентрированном растворе внутри железы, а также для правильной подгонки молекул при формировании нити при прядении.
В первом случае более 80% целевого белка обнаруживалось в водонерастворимой фракции, и средний выход составлял 6-8 мг белка на 1 литр ферментационной культуры дрожжей. В дрожжах Pichia pastoris средний выход чистого белка 1F9 составил приблизительно 70 мг на 1 кг влажной клеточной массы (приблизительно 23 мг/л ферментационной культуры). Последовательности рекомбинантных белков были максимально приближены к последовательностям природных белков, в частности, повторяющаяся область белка 1F9 содержала 9 повторов «мономера», состоящего из пяти вариантов первичных повторов, обнаруженных в природном спидроине 1. С целью увеличения уровня синтеза рекомбинантного белка в клетках дрожжей структура генов 1F9 и 2Е12 была модифицирована путем замены "редких" триплетов на кодоны, характерные для эффективно экспрессирующихся генов дрожжей, а количество внутренних повторов нуклеотидных последовательностей сведено к минимуму. Фрагменты ДНК, кодирующие соответствующие мономеры обоих белков, были получены в результате химико-ферментативного синтеза и затем амплифицированы. Конечный ген белка 1F9 кодировал девять повторов соответствующего «мономера», составляющих белок с молекулярной массой 94 кДа; белок 2Е12 (молекулярная масса 113 кДа), содержал 12 «мономерных» повторов.
В растворах белков 1F9 и 2Е12, очищенных с использованием катионообменной хроматографии, были исследованы структурные переходы, возникающие при определенных воздействиях [Bogush V.G. & Debabov V.G., 2009, J.Neuroimmune PharmacoL, v.4, 17-27]. Несмотря на отсутствие гидрофильных N- и С-концевых уникальных последовательностей (NR), которые, как предполагалось ранее, необходимы для формирования нанофибрилл и мицелл, оба белка в водном растворе спонтанно формировали нанофибриллы длиной 100 нм - 1 мкм и мицеллы диаметром около 1 мкм. Причем нанофибриллы имели спиралевидную структуру с периодом в 40 нм.
Из уровня техники известен способ получения гидрогеля из аналога паучьего спидроина 1, который был взят в качестве ближайшего аналога [Rammensee S, Huemmerich D, Hermanson KD, Scheibel T, Bausch AR (2006) Rheological characterization of hydrogels formed by recombinantly produced spider silk. Appl Phys A Mater Sci Process 82:261-264].
Для получения гидрогеля в статье использован аналог паучьего спидроина 1-ADF-4 с 16 повторами консенсусной последовательности (С16):
(GSSAAAAAAAASGPGGYGPENQGPSGPGGYGPGGP), с молекулярной массой 48 кДа.
Белок был экспрессирован в E.coli BLR (DE3). Очищенный белок промывали в 8 М мочевине, растворяли в 6М GdmSCN и диализовали против 10 мМ NH4HCO3. Нерастворившиеся фрагменты удаляли ЦФ при 50000 g, 30 мин. Оставшийся раствор белка лиофилизировали.
Лиофилизированный белок растворяли в 6М GdmSCN и диализовали против 5 мМ фосфата калия рН 8,0. Нерастворившиеся фрагменты удаляли ЦФ при 125000 g, 30 мин. Осадок отбрасывали.
Добавляли метанол до концентрации 10%. При этом белок собирался в нанофибриллы при концентрации от 5 до 30 мг/мл.
В зависимости от концентрации нанофибриллы образовывали гидрогель за период от нескольких дней до 1 недели.
Этот гидрогель легко разрушался при встряхивании и струении.
Для упрочнения гидрогель сшивали аммоний пероксодисульфатом (APS) и Tris(2,2'-bipiridyl)dichlororuthenium(II)(Rubpy). Количество реагентов рассчитывали так, чтобы финальная концентрация составляла 10 мМ APS и 100 мкм Rubpy. Реагенты добавляли к гидрогелю и давали впитаться в течение ночи. Затем гидрогель экспонировали на видимом свету под вольфрамовой лампой в течение 1 мин и остатки жидкости удаляли с поверхности гидрогеля.
Отличие предложенной методики от известной:
- использовали другие последовательности белков;
- два белка - аналога спидроинов 1 и 2, а не один;
- более разнообразные последовательности (более приближенные к природным);
- белки имеют высокие молекулярные массы - 94 и 113 кД, что должно давать более плотные гидрогели;
- экспрессия генов - в клетках дрожжей, а не в E.coli.
- гели получали в течение ночи, а не нескольких дней;
- получены суспензии гидрогелевых микрочастиц с заданными диапазонами размеров и различной плотностью.
Возможность получать гидрогели в виде суспензии гидрогелевых микрочастиц имеет большое преимущество по сравнению с неизмельченными гидрогелями: частицы могут быть покрыты монослоем клеток (это уже показано авторами) и вводиться с помощью шприца в организм. Заявленный метод позволяет использовать значительно большее количество клеток на единицу объема материала и способствует лучшей выживаемости клеток благодаря более эффективной доставке питательных веществ. Суспензия микрогелей может использоваться для нанесения на поверхность ран, что имеет определенные преимущества по сравнению с пленками (не надо подбирать размер, лучший газообмен и доступ лекарственных веществ). Кроме того, суспензии гидрогелевых микрочастиц с заданными размерами позволяют использовать их в медицине в случаях, когда необходимо достичь равномерной и программируемой скорости биодеградации микрочастиц.
Раскрытие изобретения
Авторами настоящего изобретения впервые предложен способ получения рекомбинантных белков паутины пауков-кругопрядов (Araneidae) в клетках дрожжей, обеспечивающий продукцию рекомбинантных белков в количествах, в десятки раз превышающих количества рекомбинантных белков паутины, продуцируемых в соответствии со способами, известными из предшествующего уровня техники, и способ получения суспензий гидрогелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины и их медицинское применение.
Согласно предложенному способу рекомбинантные белки паутины пауков-кругопрядов экспрессируют в клетках дрожжей в виде гибрида с убиквитин-подобным белком, занимающим в составе гибрида N-концевое положение и содержащим сайт процесинга, распознаваемый природными дрожжевыми протеиназами, предпочтительно убиквитин-специфичными протеиназами DUB или SUMO-специфичными протеиназами дрожжей, в результате чего в ходе экспрессии гибридные белки подвергаются процессингу под действием протеиназ, что обеспечивает накопление в клетках дрожжей зрелого белка паутины, не содержащего гибридный компонент, причем белок накапливается в водонерастворимой фракции дрожжевых клеток.
Предпочтительно способ согласно изобретению предусматривает получение рекомбинантного белка паутины, консенсусные последовательности которого происходят из каркасных белков большой ампуловидной железы и/или белков малой ампуловидной железы или белка ловчей нити паука-кругопряда.
В одном из предпочтительных воплощений способ, согласно изобретению, предусматривает получение рекомбинантных белков паутины, консенсусные последовательности которых происходят из каркасных белков большой ампуловидной железы Nephila clavipes и/или Nephila madagascariensis, и убиквитин-подобный белок выбирают из группы, включающей убиквитин и белок SUMO дрожжей Saccharomyces cerevisiae.
В одном из наиболее предпочтительных воплощений способ согласно изобретению, направлен на получение рекомбинантного белка 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis в клетках Saccharomyces cerevisiae под контролем промотора гена GAL1 дрожжей, причем ген рекомбинантного белка слит с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
Еще в одном наиболее предпочтительном воплощении способ согласно изобретению направлен на экспрессию гена рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes в клетках Saccharomyces cerevisiae под контролем промотора гена GAL1 дрожжей, причем ген рекомбинантного белка слит с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В соответствии с еще одним аспектом изобретение обеспечивает хозяйские клетки дрожжей, продуцирующие рекомбинантные белки паутины паука-кругопряда. Наиболее предпочтительными хозяйскими клетками, согласно изобретению, являются клетки дрожжей Saccharomyces cerevisisae. В еще одном аспекте изобретение обеспечивает штаммы-продуценты рекомбинантых белков 1F9 и 2Е12 каркасной нити паука-кругопряда.
Краткое описание чертежей
Фиг.1. Электрофорез в 12% ПААГ с ДДС-Na фракций 1F9 после хроматографии на катионообменной колонке HiPrep 16/10 SP FF. Дорожки: 1 - исходный раствор перед нанесением на колонку; 2 - проскок; 3-6 - фракции, содержащие белок 1F9, 7 - образец стандартного 1F9.
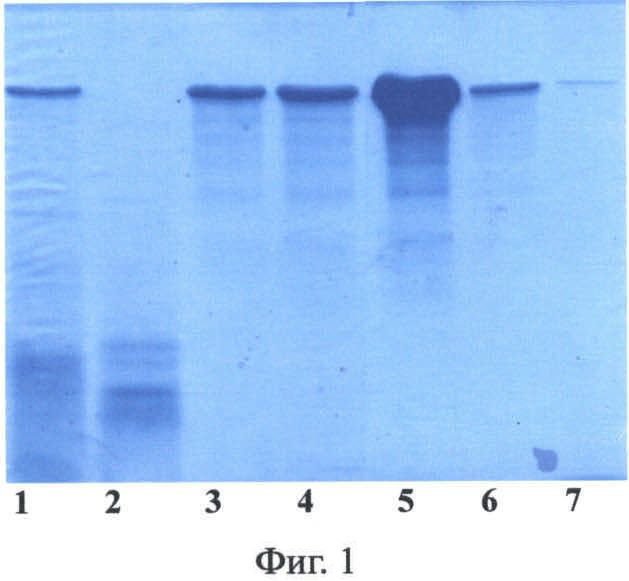
Фиг.2. Электрофорез в 12% ПААГ с ДДС-Na фракций 2Е12 после хроматографии на катионообменной колонке HiPrep 16/10 SP FF. Дорожки: 1 - исходный раствор перед нанесением на колонку; 2 - проскок; 3 - стандарты молекулярных масс (сверху вниз, в кДа): 170, 130, 95, 72, 55, 43, 34, 26, 17; 4 - фракция, содержащая 2Е12, 5 - образец стандартного 2Е12.
Фиг.3. Карта вектора pPDX3-HUB-1F9.
Обозначения: SPIDROIN - синтетический ген рекомбинантного белка 1F9 (спидроин-1 паука N.clavipes); HUB - ген убиквитина дрожжей S.cerevisiae; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae соответственно; сус1Т - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2-микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации, обеспечивающий селективную амплификацию вектора в клетках E.coli.
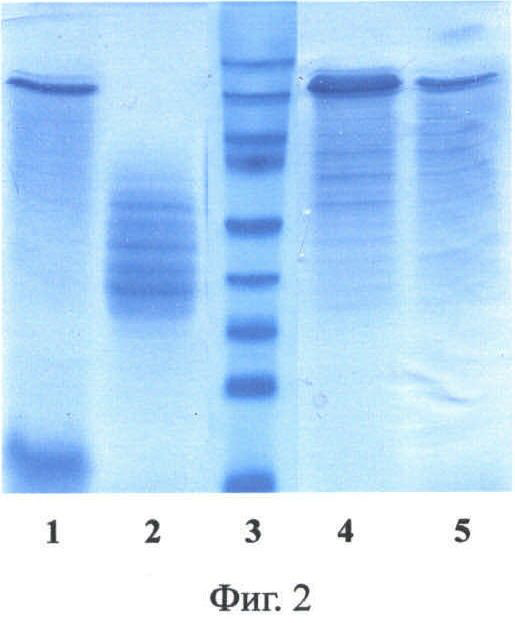
Фиг.4. Карта вектора pPDX3-SUMO-1F9.
Обозначения: SPIDROIN - синтетический ген рекомбинантного белка 1F9 (рекомбинантный спидроин-1 паука N.clavipes); SUMO - ген SMT3 дрожжей S.cerevisiae, кодирующий белок SUMO; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae соответственно; сус1Т - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2-микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации дрожжей; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации для обеспечения селективной амплификации вектора в клетках Е.coli.
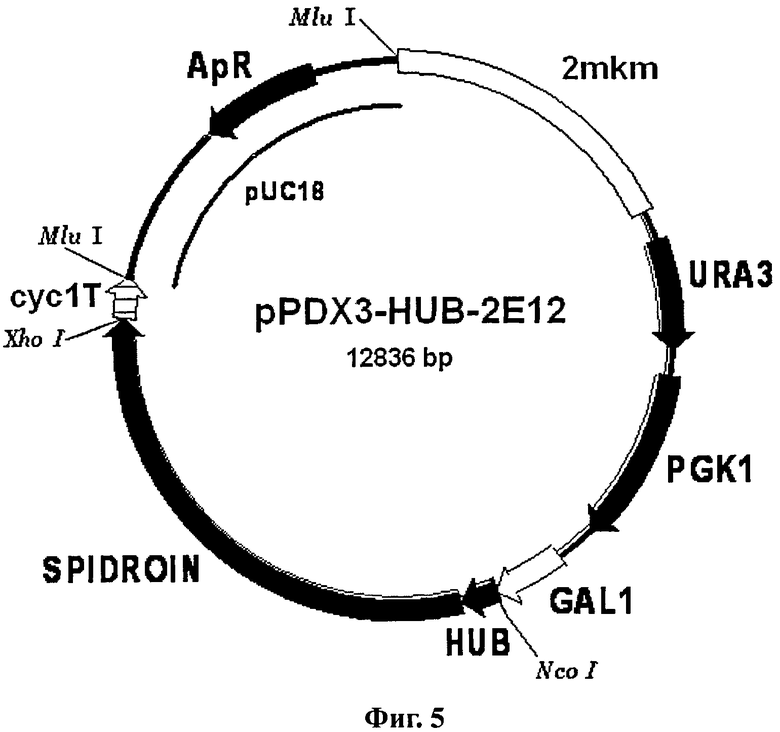
Фиг.5. Схема вектора pPDX3-HUB-2E12.
Условные обозначения: SPIDROIN - последовательность ДНК, кодирующая рекомбинантный белок 2Е12; HUB - последовательность ДНК, кодирующая убиквитин дрожжей S.cerevisiae; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae соответственно; cyc1T - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2-микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации, обеспечивающий селективную амплификацию вектора в клетках E.coli.
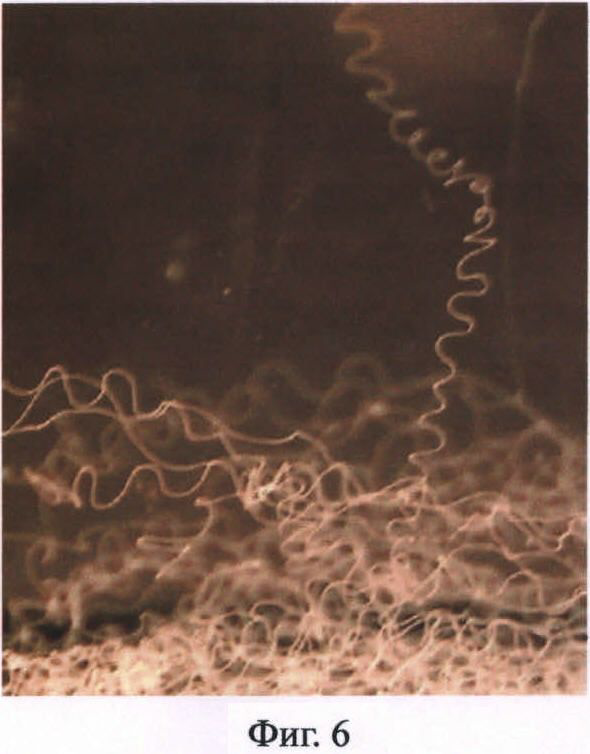
Фиг.6. Фотография искусственной нити из белка 1F9 в сосуде с этанолом.
Осуществление изобретения
Настоящее изобретение основано на неожиданном открытии, что экспрессия рекомбинантного белка паутины паука-кругопряда в клетках дрожжей в виде слитого белка с убиквитин-подобным белком, занимающим в составе гибрида N-концевое положение, позволяет в десятки раз увеличить продукцию рекомбинантного белка паутины, причем рекомбинантный белок, экспрессируемый в виде гибридного белка, накапливается в клетках дрожжей в водонерастворимой фракции в виде процессированного белка, не содержащего гибридный компонент.
Следовательно, в одном из аспектов настоящее изобретение обеспечивает способ получения рекомбинантного белка паутины паука-кругопряда в клетках дрожжей, предусматривающий конструирование вектора экспрессии, трансформацию клеток дрожжей полученным вектором экспрессии и экспрессию в трансформированных клетках гена рекомбинантного белка паутины паука-кругопряда, отличающийся тем, что используют вектор экспрессии, который включает последовательность ДНК, кодирующую рекомбинантный белок паутины паука-кругопряда, слитую с последовательностью, кодирующей убиквитин-подобный белок, занимающий в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, и содержащий сайт процессинга, распознаваемый природными дрожжевыми протеиназами, предпочтительно убиквитин-специфичными протеиназами DUB или SUMO-специфичными протеиназами дрожжей, в результате чего в ходе экспрессии гибридные белки подвергаются процессингу под действием протеиназ, что обеспечивает накопление в клетках дрожжей в водонерастворимой фракции рекомбинантного белка паутины в виде процессированного белка, не содержащего гибридный компонент.
Рекомбинантные белки, получаемые способом согласно изобретению, имеют явно выраженную периодическую структуру, которая может быть представлена в виде ряда консенсусных последовательностей, выведенных путем выравнивания повторяющихся единиц природных белков паутины пауков-кругопрядов. Рекомбинантные белки согласно изобретению представляют собой белки, последовательности которых содержат как повторы одной консенсусной последовательности, так и комбинации повторов консенсусных последовательностей различного типа, происходящих из каркасных белков большой ампуловидной железы, и/или белков малой ампуловидной железы, и/или белков Flag ловчей нити паука-кругопряда, в частности, выбираемых из группы, включающей консенсусные последовательности:

где MaSpl и MaSpl - белки каркасной нити большой ампуловидной железы Latrodectus hesperus [Lawrence B.A. et al., 2004, Biomacromolecules, v.5, 689-695];
MiSp1 и MiSp1 - белки малой ампуловидной железы Nephila clavipes [Colgin M.A. & Lewis R.V., 1998, Protein ScL, v.7, 667-672];
Flag - белок ловчей нити Nephila madagascariensis [Hayashi С.& Lewis R.V., 1998, J.Mol.Biol, v.275, 773-784].
Предпочтительно, согласно предложенному способу, используют консенсусные последовательности, происходящие из повторяющихся последовательностей белков большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
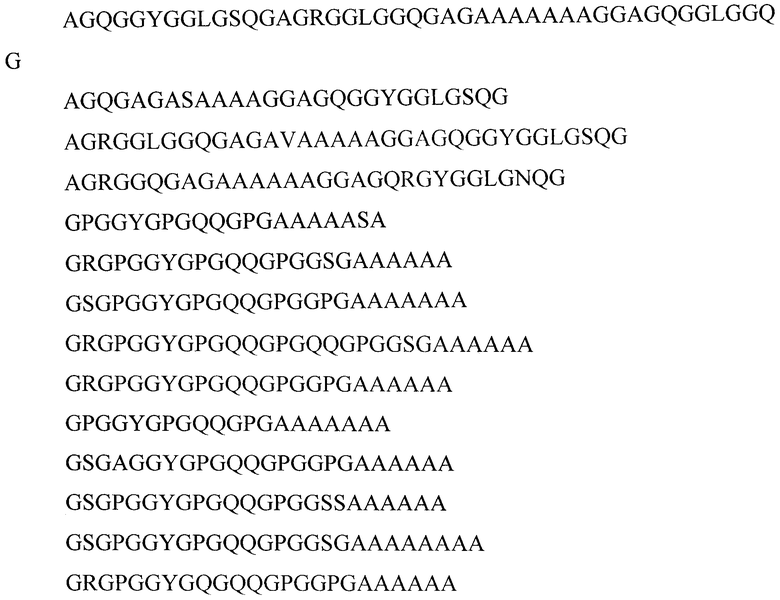 Конструирование искусственных генов, кодирующих рекомбинантные белки большой и/или малой ампуловидных желез, или белки Flag ловчей нити паука-кругопряда включает реконструкцию последовательности ДНК, кодирующей консенсусную последовательность или комбинации повторов консенсусных последовательностей различного типа, происходящие из повторяющихся последовательностей указанных выше белков; конструирование и химический синтез серии праймеров к консенсусной последовательности/последовательностям; единовременный отжиг смеси всех синтезированных праймеров, необходимых для образования двухцепочечной молекулы ДНК, и последующую обработку их лигазой для удаления однонитевых разрывов ДНК или реакцию ПЦР с последовательным использованием необходимых праймеров и поэтапным достраиванием растущего фрагмента ДНК, причем образуемый фрагмент («мономер») затем подвергается поэтапному удвоению в составе плазмиды до получения гена необходимой длины [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22; Богуш В.Г. с соавт., 2006, Биотехнология, т.4, 3-12; Bogush V.G. & Debabov V.G., 2009, J. Neuroimmune PharmacoL, v.4, 17-27].
Конструирование искусственных генов, кодирующих рекомбинантные белки большой и/или малой ампуловидных желез, или белки Flag ловчей нити паука-кругопряда включает реконструкцию последовательности ДНК, кодирующей консенсусную последовательность или комбинации повторов консенсусных последовательностей различного типа, происходящие из повторяющихся последовательностей указанных выше белков; конструирование и химический синтез серии праймеров к консенсусной последовательности/последовательностям; единовременный отжиг смеси всех синтезированных праймеров, необходимых для образования двухцепочечной молекулы ДНК, и последующую обработку их лигазой для удаления однонитевых разрывов ДНК или реакцию ПЦР с последовательным использованием необходимых праймеров и поэтапным достраиванием растущего фрагмента ДНК, причем образуемый фрагмент («мономер») затем подвергается поэтапному удвоению в составе плазмиды до получения гена необходимой длины [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22; Богуш В.Г. с соавт., 2006, Биотехнология, т.4, 3-12; Bogush V.G. & Debabov V.G., 2009, J. Neuroimmune PharmacoL, v.4, 17-27].
Последовательности соответствующих кДНК могут быть выведены на основе последовательности природного белка с учетом вырожденности кода и частоты встречаемости кодонов у дрожжей. В частности, при конструировании гена, кодирующего белок 1F9 и содержащего 9 копий "мономера", фрагменты, кодирующие наиболее типичные первичные повторы, были выбраны из последовательности природного белка и отличались друг от друга набором делеций. Реконструированная последовательность ДНК включала приблизительно 400 п.н. и кодировала полипептид, соответствующий 134 аминокислотным остаткам. «Редкие» кодоны в последовательности искусственного гена были заменены на наиболее часто используемые у дрожжей. «Мономер» был получен с помощью химико-ферментативного синтеза, и мультимерная форма получена путем пошаговой мультипликации мономера в составе рекомбинантной плазмиды [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22].
При конструировании гена 2Е12 были использованы последовательности спидроинов типа 2 большой ампуловидной железы, содержащиеся в базе данных белковых последовательностей NCBI и включающие более 200 аминокислотных остатков. На основании математического анализа всех последовательностей были разработаны последовательности блоков (каждый состоял из 3-5 первичных повторов) и составлена формула полного искусственного гена [Bogush V.G. et al., 2009, J. Neuroimmune PharmacoL, v.4, 17-27].
В одном из предпочтительных воплощений предложенный способ получения рекомбинантного белка паутины паука-кругопряда в клетках дрожжей предусматривает слияние гена рекомбинантного белка паутины с последовательностью ДНК, кодирующей убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae.
В одном из наиболее предпочтительных воплощений изобретения в клетках Saccharomyces cerevisiae получают рекомбинантный белок 1F9 каркасной нити паутины паука-кругопряда Nephila clavipes, причем структурный ген белка 1F9 слит с последовательностью ДНК, кодирующей убиквитин Saccharomyces cerevisiae. Еще в одном наиболее предпочтительном воплощении изобретения в клетках Saccharomyces cerevisiae получают рекомбинантный белок 2Е12 каркасной нити паутины паука-кругопряда Nephila madagascariensis, причем ген белка 2Е12 слит с последовательностью ДНК, кодирующей убиквитин Saccharomyces cerevisiae.
В еще одном наиболее предпочтительном воплощении изобретения в клетках дрожжей Saccharomyces cerevisiae экспрессируют слитый белок, содержащий последовательность рекомбинантного белка 1F9, причем последовательность белка 1F9 слита с последовательностью белка SUMO дрожжей Saccharomyces cerevisiae. Рекомбинантные белки, получаемые согласно предложенному способу, были выделены из водонерастворимой фракции хозяйских клеток Saccharomyces cerevisiae с помощью хроматографии на катионообменной колонке (примеры 9 и 11). Электрофоретический анализ фракций (Фиг.1 и 2) показал, что рекомбинантные белки 1F9 и 2Е12 накапливаются во фракции водонерастворимых белков клеток дрожжей (в водорастворимой фракции рекомбинантные белки практически отсутствуют) и не содержат компонент убиквитин-подобного белка. На это указывает электрофоретическая подвижность анализируемых белков и отсутствие в геле полос, соответствующих по подвижности слитым белкам (убиквитин-1F9 и убиквитин-2Е12). Аналогичные результаты получены для рекомбинантных белков, выделенных и очищенных из водонерастворимой фракции хозяйских клеток Saccharomyces cerevisiae, продуцирующих рекомбинантные белки паутины, слитые с белком SUMO. Продукция рекомбинантных белков клетками Saccharomyces cerevisiae составляет не менее 100 мг/л ферментационной культуры.
Отсутствие рекомбинантных белков, получаемых в соответствии с предложенным изобретением, в водорастворимой фракции позволяет практически избежать потери белка в процессе выделения и очистки в отличие от известного способа [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22], согласно которому только около 80% целевого белка обнаруживалось в водонерастворимой фракции.
Таким образом, при осуществлении способа получения рекомбинантного белка паутины согласно изобретению рекомбинантный белок, синтезируемый в клетках Saccharomyces cerevisiae, накапливается во фракции водонерастворимых белков в виде процессированного белка, не содержащего гибридный компонент, причем клетки, экспрессирующие рекомбинантный белок паутины, накапливают в десятки раз больше рекомбинантного белка, чем в соответствии со способами, известными из предшествующего уровня техники.
Очищенные рекомбинантные белки паутины паука-кругопряда, согласно изобретению, способны образовывать надмолекулярные структуры различных типов, в частности анализируемые белки формируют не растворяющиеся в воде нити (Пример 12, Фиг.6).
В соответствии с одним из аспектов изобретение обеспечивает клетки-хозяева дрожжей, продуцирующие рекомбинантные белки паутины пауков-кругопрядов. В качестве подходящих клеток-хозяев для получения рекомбинантных белков паутины используют клетки дрожжей, которые выбирают из группы, включающей Saccharomyces cerevisiae, Kluyveromyces lactis, Hansenula polymorpha, Pichia pastoris и Schizosaccharomyces pombe. Предпочтительными клетками-хозяевами являются клетки Saccharomyces cerevisisae. Наиболее предпочтительно, в качестве клеток-хозяев используют реципиентный штамм Saccharomyces cerevisiae D702, который является диплоидным, что обеспечивает повышенную стабильность его экспрессионных характеристик. Saccharomyces cerevisiae D702 содержит гомозиготные мутации в хромосомных аллелях структурного гена PGK1, кодирующего фосфоглицерат киназу, что обеспечивает стабильное поддержание вектора на средах, содержащих любой единственный источник углерода, усваиваемый дрожжами Saccharomyces cerevisiae, и гена GAL80, кодирующего белок - репрессор промотора GAL1, а также гомозиготную мутацию, приводящую к изменению регуляции гена GAL4, кодирующего белок - активатор промотора GAL1, вследствие чего осуществляется галактозо-регулируемая экспрессия генов, находящихся под контролем промотора GAL1.
В одном из наиболее предпочтительных воплощений изобретения клетки реципиентного штамма Saccharomyces cerevisiae D702 трансфомируют экспрессионным вектором pPDX3-HUB-1F9. Полученный в результате штамм SCR-702-1F9, продуцирующий рекомбинантный белок 1F9 каркасной нити паутины паука-кругопряда Nephila clavipes, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) как штамм Saccharomyces cerevisiae ВКПМ Y-3583.
Еще в одном из наиболее предпочтительных воплощений изобретения клетки реципиентного штамма Saccharomyces cerevisiae D702 трансфомируют экспрессионным вектором pPDX3-HUB-2E12. Полученный в результате штамм SCR-702-2E12, продуцирующий рекомбинантный белок 2Е12 каркасной нити паутины паука-кругопряда Nephila madagascariensis, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) как штамм Saccharomyces cerevisiae ВКПМ Y-3584.
Еще в одном из наиболее предпочтительных воплощений изобретения клетки реципиентного штамма Saccharomyces cerevisiae D702 трансфомируют экспрессионным вектором pPDX3-SUMO-1F9.
Характеристика штаммов-продуцентов. Генотип:
 Морфологические признаки:
Морфологические признаки:
При культивировании при температуре 28°С в течение 48 часов на агаризованной среде YPD следующего состава (в мас.%): пептон-2, дрожжевой экстракт - 1, глюкоза - 2, агар - 2, вода - остальное, клетки штаммов-продуцентов Saccharomyces cerevisiae имеют овальную форму, 3-7 мкм в диаметре. Клетки почкуются. Почкование истинное, многостороннее. Истинного мицелия не образуют. Колонии имеют следующий вид:
1) на агаризованной среде YPD колонии белого цвета с ровным краем, матовой поверхностью, линзовидным профилем и сметанообразной консистенцией;
2) на агаризованной среде с крахмалом (состав в мас.%: пептон - 2, дрожжевой экстракт - 1, крахмал - 1, агар - 2, вода - остальное) колонии белого цвета с узорчатым краем, матовой поверхностью, линзовидным профилем и крупчатой консистенцией.
Рост в жидкой среде с крахмалом: при 28°С в течение первых 24 ч культивирования - жидкость мутная, осадок белый, не комкуется, пристеночных пленок не образует.
Физико-химические признаки:
Оба штамма - факультативные анаэробы. Температура роста - 20-33°С (оптимум - 28°С). рН культивирования - 3,8-7,4 (оптимум - 5,0).
Ассимиляция источников углерода:
Оба штамма сбраживают глюкозу, фруктозу, мальтозу, сахарозу, декстрины, крахмал. Не сбраживают лактозу, галактозу, инулин, ксилозу, арабинозу. Ассимиляция источников азота:
Оба штамма усваивают аминокислоты, сернокислый аммоний, азотнокислый аммоний.
Хранение:
Штаммы хранят при температуре -70°С в 20% водном растворе глицерина. Возможно хранение на агаризованной богатой среде с глюкозой в течение 3 месяцев при +4°С.
Стабильность:
Стабильность заявляемых штаммов сохраняется при 20 последовательных пересевах на агаризованной среде YPD при температуре 28°С.
Патогенность:
Не являются патогененными.
Изобретение илюстрируется следующими примерами, представленными для подтверждения, но не ограничения оъема притязаний.
Еще одним аспектом изобретения является способ получения суспензий гелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины.
Другим аспектом изобретения является применение суспензий гелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины в медицинских целях.
Примеры
Пример 1. Конструирование вектора pPDX3-HUB
Структурный ген убиквитина дрожжей амплифицируют в реакции ПЦР с использованием в качестве матрицы хромосомной ДНК лабораторного штамма S.cerevisiae Y618 [Kartasheva et al, 1996, Yeast, v.l2, 1297-13], выделяемой по методу Сидорука [Сидорук с соавт., 2008, Сборник тезисов и докладов «Актуальные вопросы генетики, радиобиологии и радиоэкологии», Дубна, ОИЯИ, стр.100]. Праймерами для амплификации служат N513 (5'-ataccatggaacatcatcatcatcatcatggaggcatgcagatcttcgtcaagactttga) и N514 (5'-actggatccacctcttagccttagcacaac). Полученный в результате амплификации фрагмент ДНК размером 510 п.о. элюируют из агарозного геля с использованием набора Qiagen (Qiagen, cat. №28706), обрабатывают рестриктазами NcoI и BamHI и клонируют в расщепленной по тем же сайтам лабораторной плазмиде pUC18x-GALl-NcoI, несущей HindIII/Ncol фрагмент ДНК, кодирующий промоторную область гена GAL1 дрожжей. S.cerevisiae. В результате получают плазмиду р101-25, содержащую в своем составе нуклеотидную последовательность, кодирующую убиквитин дрожжей S.cerevisiae, слитую с нуклеотидной последовательностью промоторной области гена GAL1 дрожжей S.cerevisiae. Плазмида p101-25 содержит сайт узнавания рестриктазы XhoI в полилинкерной области следом за сайтом клонирования BamHI.
HindIII/XhoI фрагмент ДНК плазмиды р101-25, включающий промоторную область гена GAL1 и нуклеотидную последовательность, кодирующую убиквитин, клонируют в лабораторном векторе pPDX3, ДНК которого расщеплена по тем же сайтам. В результате клонирования получают вектор pPDX3-HUB, который используют для клонирования генов рекомбинантных белков паутины.
Пример 2. Конструирование экспрессионного вектора pPDX3-HUB-1F9
Экспрессионный вектор pPDX3-HUB-1F9 (Фиг.3) получают в результате клонирования BgIIIXhoI фрагмента ДНК лабораторной плазмиды pUC21-1F9 размером 3.6 т.п.н., включающего ген белка 1F9, в векторе pPDX3-HUB, ДНК которого расщеплена по сайтам BamHI и XhoI. В результате клонирования получают экспрессионный вектор pPDX3-HUB-1F9, в составе которого структурный ген белка 1F9 слит в одной рамке считывания со структурным геном, кодирующим убиквитин. Вектор используют для экспрессии белка 1F9 в клетках дрожжей S.cerevisiae.
Пример 3. Конструирование экспрессионного вектора pPDX3-HUB-2Е12
Экспрессионный вектор pPDX3-HUB-2E12 получают в результате клонирования BgIII/XhoI фрагмента ДНК лабораторной плазмиды pUC21-2Е12 размером 4.2 т.п.н., включающего ген белка 2Е12, в векторе pPDX3-HUB, ДНК которого расщеплена по сайтам BamHI и XhoI. В результате клонирования получают экспрессионный вектор pPDX3-HUB-2E12, в составе которого структурный ген белка 2Е12 слит в одной рамке считывания со структурным геном, кодирующим убиквитин. Вектор используют для экспрессии белка 2Е12 в клетках дрожжей S.cerevisiae.
Пример 4. Конструирование вектора pPDX3-SUMO.
Структурный ген SMT3 дрожжей S.cerevisiae, кодирующий белок SUMO, амплифицируют в реакции ПНР с использованием в качестве матрицы хромосомной ДНК лабораторного штамма S.cerevisiae, как в примере 1. Амплификацию проводят в две стадии. Сначала амплифицируют два перекрывающихся фрагмента ДНК, для чего используют следующие пары праймеров:
Фрагмент 1 размером 129 п.о.:
N450 (5'-atatccatggaaaagagatctgactcagaagtcaatcaagaa)
N454 (5'-cttgaagaaaatctctgaa)
Фрагмент 2 размером 230 п.о.:
N453 (5'-ttcagagattttcttcaag)
N452 (5'atatcaattggatccaccaatctgttctctgtga).
Амплифицированные фрагменты ДНК элюируют из агарозного геля и используют для ПЦР-лигирования. Для этого смесь фрагментов 1 и 2 используют в качестве матрицы для ПЦР, праймерами служат N450 и N452. Полученный в результате ПЦР фрагмент ДНК размером 290 п.о. элюируют из агарозного геля, обрабатывают рестриктазами BgIII и BamHI и клонируют в сайт BamHI лабораторной плазмиды pUC18x-GAL1-BamHI, несущей HindIII/BamHI фрагмент ДНК, кодирующий промоторную область гена GAL1 дрожжей S.cerevisiae, содержащую ATG кодон и сайт BamHI (подчеркнут) в последовательности ATGCATGGATCC. В результате осуществляют слияние последовательности гена SMT3 дрожжей S.cerevisiae и последовательности, кодирующей промоторную область гена GAL1 дрожжей S.cerevisiae. В результате получают плазмиду p101-18, в составе которой клонированный ген SMT3 секвенируют.
Полученная плазмида p101-18 содержит фрагмент ДНК, в составе которого ген SMT3 дрожжей слит с промоторной областью гена GAL1 дрожжей. В полилинкерной части плазмиды p101-18 следом за сайтом клонирования BamHI находится сайт узнавания рестриктазы XhoI. HindIII/XhoI фрагмент ДНК плазмиды p101-18, включающий промоторную область гена GAL1 и клонированный ген SMT3, клонируют в лабораторном векторе pPDX3, ДНК которого расщеплена по тем же сайтам. В результате клонирования получают вектор pPDX3-SUMO, который используют для клонирования генов рекомбинантных белков паутины.
Пример 5. Конструирование экспрессионного вектора pPDX3-SUMO-1F9.
Экспрессионный вектор pPDX3-SUMO-1F9 (Фиг.4) получают в результате клонирования BgIII/XhoI фрагмента ДНК лабораторной плазмиды pUC21-1F9 размером 3.6 т.п.н., включающего ген белка 1F9, в векторе pPDX3-SUMO, ДНК которого расщеплена по сайтам BamHI и XhoI. В результате клонирования получают экспрессионный вектор pPDX3-HUB-1F9, в составе которого структурный ген белка 1F9 слит в одной рамке считывания со структурным геном, кодирующим убиквитин. Вектор используют для экспрессии белка 1F9 в клетках дрожжей S.cerevisiae.
Пример 6. Конструирование штамма SCR-702-1F9 - продуцента белка 1F9(ВКПМ Y-3583).
Штамм SCR-702-1F9 получают в результате трансформации лабораторного штамма D702 экспрессионным вектором pPDX3-HUB-1F9. Для осуществления трансформации клетки штамма D702 подращивают в течение 18-24 часов при температуре 28°С на агаризованной среде YPGE следующего состава в мас.%: бактопептон - 2, дрожжевой экстракт - 1, бактоагар - 2, этанол - 2, глицерин - 3, вода - остальное. Трансформацию выращенных клеток штамма D702 проводят по методу Ito с соавт. [Ito et al., 1983, J.BacterioL, v.153, 163-168]. Трансформанты отбирают по способности расти на среде YPD следующего состава в мас.%: бактопептон - 2, дрожжевой экстракт - 1, глюкоза - 2, бактоагар - 2, вода - остальное. Один из полученных трансформантов называют SCR-702-1F9.
Пример 7. Конструирование штамма SCR-702-2E12 - продуцента белка 2Е12.
Штамм SCR-702-2E12 получают в результате трансформации лабораторного штамма D702 экспрессионным вектором pPDX3-HUB-2E12. Трансформацию осуществляют, как в примере 6. Штамм SCR-702-2E12 депонирован во Всероссийской Коллекции Промышленных Микроорганизмов как штамм Saccharomyces cerevisiae ВКПМ Y-3584.
Пример 8. Конструирование штамма D702-SUMO-1F9 - продуцента белка 1F9.
Штамм D702-SUMO-1F9 получают в результате трансформации лабораторного штамма D702 экспрессионным вектором pPDX3-SUMO-1F9. Трансформацию осуществляют, как в примере 4, за исключением того, что используют плазмиду pPDX3-SUMO-1F9.
Пример 9. Анализ экспрессии рекомбинантных белков 1F9 и 2Е12 в клетках штаммов Saccharomyces cerevisiae.
Клетки S.cerevisiae ВКПМ Y-3583, ВКПМ Y-3584 или D702-SUMO-1F9 культивируют в колбах при 30°С на ротационной качалке со скоростью 250 об/мин на жидкой среде YPD состава, в мас.%: бактопептон - 2, дрожжевой экстракт - 1, глюкоза - 2, вода - остальное, засевая в титре 5×105-5×106 мл-1. Образцы для анализа отбирают через 46 часов роста культуры. Конечная оптическая плотность культуры составляет ОД600=40-45. Клетки отделяют от среды культивирования осаждением с помощью центрифугирования при 10000 g в течение 1 мин и используют для последующего анализа экспрессии белков 1F9 и 2Е12 микрометодом в пробирке на 1,5 мл. Для этого осадок клеток суспендируют в "буфере для разрушения" (0,05 М фосфата натрия, 2,5 мМ ЭДТА, 5% глицерина) из расчета 100 мкл буфера на 100 мкл влажного осадка клеток. Разрушение клеток осуществляют с помощью стеклянных шариков (d=0,45-0,65 мм) на встряхивателе для пробирок типа «Вортекс». Для этого 570 мг шариков смешивают с 200 мкл суспензии клеток, смесь встряхивают при 0°С в течение 90 сек, к содержимому пробирок добавляют 250 мкл «буфера для разрушения» и встряхивание повторяют еще 60 сек. В пробирки вносят 500 мкл «буфера для разрушения», содержимое пробирок перемешивают, после чего полученные образцы центрифугируют в течение 10 мин при 16000 g. В супернатанте, содержащем водорастворимые белки дрожжевых клеток, с помощью 1М раствора ацетата натрия доводят рН до 4,0 и выпавший материал удаляют центрифугированием в течение 5 мин при 16 тыс.об/мин; супернатант затем прогревают при 65°С 20 минут и выпавшие в осадок балластные белки удаляют центрифугированием; полученный раствор диализуют 40 минут против 10 мМ ацетата натрия, рН 4,0. Осадок водонерастворимых белков суспендируют в 750 мкл «буфера для разрушения», переносят в новые пробирки и центрифугируют в течение 15 мин при 16000 g. Полученный осадок (100 мкл), содержащий целевые белки, суспендируют в 400 мкл буфера «6,5G» (6,5 М раствор гуанидин гидрохлорида или гуанидин тиоцианата в буфере, содержащем 0.1 М фосфата натрия, 0.01 М Tris-HCl, рН 6.5) и целевые белки экстрагируют в течение ночи на магнитной мешалке при температуре +4°С. Затем суспензию центрифугируют в течение 15 мин при 16000 g, супернатант с перешедшим в него целевым белком диализуют против 300 мл 5 мМ ацетата натрия в течение 1,5 часов. Полученный образец центрифугируют в течение 15 мин при 16000 g и супернатант используют для электрофоретического анализа уровня продукции целевого белка.
Электрофоретический анализ целевого белка проводят 12% ПААГ-ДДС-Na по стандартной процедуре Лэммли [Laemmli, 1970, Nature, v.227, 680-685]. Для анализа раствор разводят приблизительно в 500-1000 раз «буфером для образцов» (0.0625 М Tris-HCl, рН 6.8, 2 мас.% ДДс-Na, 0.0025 мас.% бромфенол blue). И кипятят в водяной бане в течение 5 минут. Аликвоты в 3-15 мкл наносят на 12% ПААГ и подвергают электрофорезу в аппарате Bio Rad MiniPROTEAN, пока фронт красителя будет на расстоянии 1 см до конца геля. Гели отмывают в воде и окрашивают в 0,2% растворе Кумасси R-250 (Fermentas). Электрофоретический анализ показывает, что белки 1F9 и 2Е12 накапливаются во фракции водонерастворимых белков клеток дрожжей S.cerevisiae и не содержат компонент SUMO или убиквитина (Фиг.1 и 2). На это указывает электрофоретическая подвижность анализируемых белков и отсутствие в геле полос белка, соответствующих по подвижности гибридным белкам 1F9 и 2Е12, слитых с белком SUMO или убиктивином.
Количественную оценку чистоты препаратов осуществляли с помощью программы «Видеоденситометр Сорбфил 1.0», для чего окрашенные гели после электрофореза сканировали, полученное изображение вводили в компьютер и оценку количества белка в пятне и на каждой дорожке определяли с помощью указанной программы. В качестве стандартов сравнения использовали высокоочищенные препараты исследуемых белков, известное количество которых наносили на соседние дорожки в том же геле. Чистота препаратов белков, оцененная таким способом, составляла 96% и выше.
Пример 10. Продукция белков 1F9 и 2Е12 штаммами Saccharomyces cerevisiae ВКПМ Y-3583 и ВКПМ Y-3584
Для получения посевного материала штаммы ВКПМ Y-3583 и ВКПМ Y-3584 выращивают в среде YPD на ротационной качалке со скоростью 250 об/мин при температуре 28°С в течение 20-24 часов. 50 мл посевного материала используют для засева 3-литрового ферментера Anglicon, содержащего 950 мл среды YPD. Ферментацию проводят при температуре 28°С, аэрации 1 л/мин и скорости перемешивания 1000 об/мин. Через 24 часа после засева ферментера начинают подпитку среды культивирования 50%-ным раствором глюкозы со скоростью 2 мл/ч и устанавливают рН-статирование культуры на уровне рН 6.8±0.1, используя для подтитровки растворы 10% серной кислоты и 10% NaOH. Среднее общее время ферментирования составляет 72 часа. По данным электрофоретического анализа продукция белка 1F9 в этих условиях составляет не менее 200 мг/л культуральной жидкости, и продукция белка 2Е12 в этих условиях составляет не менее 100 мг/л культуральной жидкости.
Пример 11. Выделение и очистка рекомбинантных белков 1F9 и 2Е12 из водонерастворимой фракции клеток Saccharomyces cerevisiae.
Выделение и очистку белков 1F9 и 2Е12 из водонерастворимой фракции клеток штаммов-продуцентов ВКПМ Y-3583 и ВКПМ Y-3583 проводят с использованием методов, описанных Богушем с соавт. [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22; Богуш В.Г. с соавт., 2006, Биотехнология, т.4, 3-12; Bogush V.G. et al., 2009, J. Neuroimmune Pharmacol., v.4, 17-27]. При наращивании биомассы дрожжей S.cerevisiae в 3-литровом ферментере на среде YPD без подпитки в присутствии 2% глюкозы в стартовой среде с одной ферментации получают в среднем 400-500 г влажной клеточной биомассы. 1 кг промытой влажной биомассы суспендируют в «буфере для разрушения» и клетки разрушают с помощью стеклянных шариков в проточной мельнице в течение 1,5 часов, центрифугируют полученную суспензию и собирают осадок. Экстракцию целевого белка из осадка осуществляют с помощью раствора 10% лития хлористого в 90%-ной муравьиной кислоте в течение 16-18 часов с последующим центрифугированием. Осадок отбрасывают, а супернатант подвергают ультрафильтрации с последующей диафильтрацией через мембрану М50 для перевода в 10 мМ ацетат натрия, рН 4,0 и удаления белков клетки хозяина с молекулярной массой ниже 50 кДа.
Окончательную очистку проводят с помощью ионно-обменной хроматографии на катионообменной колонке HiPrep 16/10 SP FF (GE Healthcare) в системе ФПЛС. После прохождения фильтрата через колонку и последующей промывки колонки 10 мМ Na-фосфатным буфером, рН 7,0 и затем 10 мМ натрий-ацетатным буфером, рН 4,0, белки 1F9 и 2Е12 элюируют с колонки 10%-ным раствором NaCl в том же буфере и идентифицируют электрофоретически в 12% ПААГ-ДДс-Na, фракции с целевым белком объединяют, диализуют против деионизованной воды, замораживают при
-70°С и лиофильно высушивают. Лиофилизованный препарат представляет собой субстанцию белого цвета, похожую на вату.
Пример 12. Определение характеристик белков 1F9 и 2Е12
Для проведения анализа полученного препарата чистого рекомбинантного белка предварительно растворяют навеску препарата в 90%-ной муравьиной кислоте с 10%-ным хлоридом лития в течение не менее 2 часов, диализуют против деионизованной воды (1-1,5 часа) и анализируют с помощью SDS-электрофореза в 12% ПААГ. Наличие одной полосы в геле, соответствующей молекулярномой массе рекомбинантного белка, подтверждает гомогенность получаемого препарата. Полученные препараты обоих белков характеризуются коэффициентом экстинкции, равным приблизительно 0,48±0,02 ОЕ280/мг. Эта величина соответствует теоретически рассчитанной, исходя из аминокислотного состава этих белков (0,49 ОЕ280/м), и свидетельствует о высокой чистоте полученных препаратов.
Для анализа способности очищенных рекомбинантных белков паутины паука-кругопряда образовывать надмолекулярные структуры различных типов эти белки были протестированы на способность формировать не растворяющиеся в воде нити. Нити получают в результате спиннинга (прядения) концентрированного раствора белка через узкое отверстие. Для этого навеску очищенного лиофильно высушенного препарата белка растворяют в 90%-ной муравьиной кислоте с 10%-ным хлоридом лития в течение не менее 2 часов, диализируют против деионизованной воды в течение 1-1,5 часов и нерастворившийся материал удаляют центрифугированием. Раствор белка пропускают через специально сконструированный микроспиннерет с внутренним диаметром около 50 мкм со скоростью 5-10 мкл/мин в коагуляционную ванну с 96%-ным этанолом. При этом образуется водонерастворимая нить, которая свободно ниспадает на дно сосуда. Вновь образованные искусственные нити в сосуде с этанолом представлены на Фиг.6. Новообразованную нить выдерживают в сосуде с 96%-ным спиртом в течение 20 минут, затем максимально растягивают в 75%-ном этаноле, отжигают, выдерживают в деионизованной воде и высушивают на воздухе. Нити, подвергнутые всем этапам воздействия, характеризуются значениями относительной разрывной нагрузки в 10-15 сН/текс (13 мПа).
Приведенные результаты показывают, что при осуществлении предложенного способа получения рекомбинантных белков паутины паука-кругопряда достигнуто существенное повышение выхода рекомбинантных белков, причем получаемые рекомбинантные белки характеризуются высокой чистотой и физико-химическими свойствами, характерными для природных белков паутины. Предложенный способ получения рекомбинантного белка паутины позволяет получать препараты рекомбинантного белка с очень высокой степенью очистки в промышленном масштабе, разрабатывать способы микропрядения для получения на его основе искусственных волокон, а также способы формирования пленок, гидрогелей, микрогелей и микрокапсул на основе рекомбинантных белков паутины для использования в биотехнологии, медицине, косметологии, автомобильной и авиационной промышленности и других областях.
Пример 12. Получение микрогелевых частиц с заданным размером.
1. Получение раствора белка.
Белок рекомбинантной паутины (10-20 мг) растворяют 12-18 час в 250 мкл 10% лития хлористого в 90%-ной муравьиной кислоте.
2. Освобождение от растворителя.
2.1. Диализ раствора против 1 л калий-фосфатного буфера (КФБ), рН 8,0).
2.2. Диализ ведут 3 часа с двумя сменами диализного буфера (интервал смены - 1 час).
2.3. ЦФ (20 мин).
2.4. Определение концентрации белка по СФ (λ=280 нм).
3. Получение геля.
3.1. 200 мкл раствора белка озвучивают ультразвуком 10 сек (УЗВ).
3.2. Раствор оставляют при комнатной температуре до образования геля (20-25 час).
4. Получение микрогелевой суспензии.
4.1. 50 мг геля протирают через сито с размером ячеек 200 мкм.
4.2. Частицы микрогеля собирают шпателем в пробирку, добавляют 300 мкл 96%-ного этилового спирта, встряхивают и выдерживают 5 мин.
4.3. Частицы осаждают ЦФ 5 мин.
4.4. К осадку приливают 300 мкл воды, встряхивают.
5. Определение размера микрогелевых частиц. Размер частиц контролируют под микроскопом, используя камеру Горяева. В суспензии превалируют частицы с размерами 50-200 мкм.
6. Получения микрогелевых частиц с размерами 10-100, 50-200, 150-300, 200-400 мкм.
6.1. Метод дифференциального ЦФ.
- к осадку микрогелевых частиц добавляют 600 мкл воды, встряхивают вручную;
- ЦФ 5 сек и отбирают 300 мкл с частицами в другую пробирку;
- в первую пробирку вновь добавляют 300 мкл воды, встряхивают;
- ЦФ 5 сек и отбирают 300 мкл с частицами во вторую пробирку;
- вторую пробирку ЦФ (10 мин, 14500 об/мин);
- осадок суспендируют в нужном объеме воды.
6.2. Метод просеивания.
Как в п.4, но используют сито с размером ячеек 100, 200, 300, 400 мкм, в суспензии превалируют частицы с размерами соответственно 10-100, 50-200, 150-300, 200-400 мкм.
Пример 13. Адгезия и пролиферация мышиных фибробластов на поверхности гидрогелевых микрочастиц из рекомбинантного спидроина.
Культивирование клеток
Суспензию гидрогелевых микрочастиц размером 400 мкм помещали в лунки 24-луночного планшета для культивирования клеток и добавляли 1000 мкл суспензии мышиных фибробластов 3Т3 в концентрации 24000 клеток в 1 мл культуральной среды DMEM (Sigma), содержащей 10% фетальной бычьей сыворотки. Через 2 часа отмывали не прикрепившиеся к субстрату клетки и инкубировали при 37°С в присутствии 6.1% CO2. Культуральную среду меняли каждые 2 дня. Изучали адгезию и рост клеточной культуры методом лазерной сканирующей конфокальной микроскопии.
Лазерная конфокальная микроскопия
Для сканирующей лазерной конфокальной микроскопии использовали микроскоп Axiovert 200M LSM510 МЕТА (Carl Zeiss, Jena, Germany) с объективом Plan-Neofluar 10х/0,3. Серии оптических срезов для получения изображений с высоким разрешением получали с одного или синхронно с двух каналов с установленным согласно рекомендациям производителей размером пинхола (pinhole). Диаметр пинхола был 1 диск Эйри (Airy unit), дающий оптимальное соотношение сигнала к шуму. Настраивали Пример 13. Адгезия и пролиферация мышиных фибробластов на поверхности гидрогелевых микрочастиц из рекомбинантного спидроина.
Изучение адгезии и роста клеток на поверхности гидрогелевых микрочастиц
Для определения количества прикрепленных клеток изучали образцы методом конфокальной микроскопии через 24 часа после инокуляции. Изменение количества клеток наблюдали через 4, 7 и 14 дней инкубации. Образцы фиксировали формалином и выявляли клетки флуоресцентным красителем SYTOX® Green nucleic acid stain (Invitrogen, Карлсбадам, США), ядерным красителем с высокой афинностью к нуклеиновым кислотам. Гидрогелевые микрочастицы с клетками инкубировали в растворе в течение 20 минут при постоянном перемешивании. После связывания SYTOX Green с ДНК наблюдается увеличение его флюоресценции в 500 раз (согласно инструкциям производителя). На 4-й, 7-й и 14-й день культивирования наблюдалось увеличение количества фибробластов, свидетельствующее об активной пролиферации клеток
Пример 14. Имплантация гидрогелевых микрочастиц под кожу мышам. Для исследования местного действия после имплантации и способности к деградации гидрогель из аналога спидроина 1 имплантировали подкожно лабораторным мышам линии Balb/c четырехмесячного возраста. Перед операцией животные в течение 7 дней содержались в виварии для акклиматизации. Содержание животных и условия проведения экспериментов in vivo соответствовали ГОСТ Р ИСО 10993-2-2009 "Требования к обращению с животными" и ГОСТ Р ИСО 10993-6-2009 "Исследование местного действия после имплантации".
Условия хирургического вмешательства и эксперимента
Перед процедурой имплантации удаляли шерсть с поверхности кожи мышей депиляционным кремом. Проводили премедикацию карпрофеном (carprofen): препарат Римадил (Pfizer Animal Health, США) (с действующим веществом карпрофен) вводили из расчета 5 мг на 1 кг согласно рекомендациям производителя.
Операцию проводили в стерильных условиях под общей анестезией препаратом Золетил 100 (Virbac Sante Animale, Kappoc, Франция) в дозе 5 мг на 100 г. Введение препарата внутрибрюшинное. Перед имплантацией участок кожи в месте разреза обеззараживали 0,05%-ным раствором хлоргексидина (Биоген, РФ), а излишки антисептика удаляли стерильными салфетками. Для имплантации делали разрез длиной 5 мм на спине животного абаксиально относительно срединной линии; подкожный карман формировали с помощью заостренного шпателя, отделяя подкожные ткани от мышечного слоя. 200 мкл образца в виде суспензии микрочастиц в фосфатно-солевом стерильном буфере помещали в образовавшуюся полость с помощью стерильного пинцета. Разрез закрывали нерассасывающейся полипропиленовой нитью, накладывая простые узелковые хирургические швы. Рану обрабатывали антисептиком и закрывали клеем медицинским БФ-6 (Вертекс ЗАО, РФ).
После пробуждения животные были активны и не проявляли признаков дискомфорта. Через 2 месяца имплантированные образцы извлекали для гистологических исследований.
Извлечение имплантата и подготовка образцов тканей
Исследования проводились в соответствии с ГОСТ Р ИСО 10993-6-2009 "Исследование местного действия после имплантации".
Имплантированные образцы с прилежащей тканью извлекали, промывали фосфатно-солевым буфером и фиксировали в смеси Буэна согласно стандартной методике. Образцы дегидратировали в растворах этанола возрастающей концентрации (растворы этанола 50%, 60%, 70%, 80%, 96%, 100%) по 2 часа в каждом, удаляли спирт инкубацией в смеси изопропанола и O-ксилола (1:1) в течение 2 часов и в двух сменах чистого O-ксилола по 30 минут. Обезвоженные образцы подготавливали к заливке в парафин последовательной инкубацией в расплавленной смеси Histomix® (BioVitrum, РФ) и O-ксилола (1:1) в течение 1 часа и далее в трех сменах расплавленного Histomix® при 52°С по 30 минут в каждой. Подготовленные образцы ткани помещали в формы для заливки блоков и заливали расплавленным Histomix®.
Подготовка срезов для гистологических исследований
Для приготовления срезов толщиной 5 мкм из заключенных в парафин образцов использовали микротом Ротмик-1 (Орион Медик, РФ). Срезы наклеивали на поверхность предметных стекол. Срезы перед гистологическими исследованиями депарафинировали последовательной инкубацией в двух сменах O-ксилола и в 100% этаноле, ополаскивали в 100% этаноле, двух сменах 96% спирта и двух сменах дистиллированной воды.
Депарафинированные срезы окрашивали смесью гематоксилина и эозина по стандартной методике. Перед окрашиванием срезы промывали дистиллированной водой. Далее срез инкубировали в растворе квасцового гематоксилина по Эрлиху, промывали в водопроводной воде, инкубировали в 1%-ном водном растворе эозина и промывали в водопроводной воде. После удаления излишков воды срезы последовательно инкубировали в 96% этаноле и ксилоле, а затем заключали в бальзам.
Микроскопические исследования имплантата
Микроскопические исследования для изучения местного действия после имплантации проводились согласно ГОСТ Р ИСО 10993-6-2009. Гистологические срезы изучали с использованием микроскопа Zeiss Imager Al (Zeiss) с объективами Zeiss ЕС Plan-Neofluar 40х/0,75 Ph2 и А-plan 20х/0,45 Ph2. Изображения получали с помощью камеры AxioCam MRc 5 (Zeiss), изображения обрабатывали с помощью программного обеспечения Axio Vision 4.7.2 (Zeiss). Также срезы изучали на микроскопе Leica DM 1000 (Leica Microsystems, Inc., Банокберн, США) с объективами Leica Hi-Plan 40x/0,65 и 10х/0,25 и камерой Leica DFC 295 и полученные изображения обрабатывали при помощи программного обеспечения Leica Application Suite Version 3.4.0.
В результате было установлено, что при имплантации гидрогеля происходит интеграция имплантата в окружающие ткани и новообразование ткани. Гистологическое изучение имплантатов не показало никаких фенотипических изменений прорастающих в имплантат тканей, которые могли бы свидетельствовать о нарушениях физиологии контактирующих с гидрогелем клеток: адипоциты и фибробласты имеют характерные для клеток этого типа морфологию и размер. Обнаруженный высокий уровень неоваскуляризации подтверждает отсутствие токсического действия на эндотелиальные клетки. Признаков формирования неблагоприятных условий для роста клеток в местах активной деструкции имплантата не обнаружено, в местах разрушения гидрогеля происходит активный рост ткани и выявляются молодые фибробласты.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА ПАУТИНЫ, СЛИТЫЙ БЕЛОК, РЕКОМБИНАНТНАЯ ДНК, ВЕКТОР ЭКСПРЕССИИ, КЛЕТКА-ХОЗЯИН И ШТАММЫ-ПРОДУЦЕНТЫ | 2010 |
|
RU2451023C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКА E7-HSP70 И ШТАММ ДРОЖЖЕЙ Saccharomyces cerevisiae ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2489481C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ГИБРИДНОГО БЕЛКА Е7-HSP70 (ВАРИАНТЫ) | 2013 |
|
RU2546917C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА СЕКРЕТИРУЕМОГО СОМАТОТРОПИНА ЧЕЛОВЕКА И ШТАММ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE - ПРОДУЦЕНТ СЕКРЕТИРУЕМОГО СОМАТОТРОПИНА ЧЕЛОВЕКА | 2011 |
|
RU2460795C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗРЕЛОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE И ШТАММ-ПРОДУЦЕНТ ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА (ВАРИАНТЫ) | 2011 |
|
RU2446172C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТЕИНАЗЫ Ulp275 | 2011 |
|
RU2451076C1 |
| РЕКОМБИНАНТНЫЙ БЕЛОК ШЕЛКА ПАУКОВ, КОДИРУЮЩАЯ ЕГО НУКЛЕИНОВАЯ КИСЛОТА, ВЕКТОР И КЛЕТКА-ХОЗЯИН, ПОДХОДЯЩИЕ ДЛЯ ЕГО ЭКСПРЕССИИ, СПОСОБ ЕГО АГРЕГАЦИИ, СПОСОБ ПОЛУЧЕНИЯ МАТЕРИАЛА ИЗ НЕГО, СОДЕРЖАЩИЙ ЕГО ПРОДУКТ И ПРИМЕНЕНИЕ | 2005 |
|
RU2415938C2 |
| ГИБРИДНЫЙ БЕЛОК (ВАРИАНТЫ), ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА | 2011 |
|
RU2453604C1 |
| ГИБРИДНЫЙ БЕЛОК, ОБЛАДАЮЩИЙ ПРОЛОНГИРОВАННЫМ ДЕЙСТВИЕМ, НА ОСНОВЕ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА (ВАРИАНТЫ), СПОСОБ ЕГО ПОЛУЧЕНИЯ И ШТАММ Saccharomyces cerevisiae ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТОГО СПОСОБА (ВАРИАНТЫ) | 2013 |
|
RU2515913C1 |
| ГИБРИДНЫЙ БЕЛОК, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2b ЧЕЛОВЕКА ИЗ ЭТОГО ГИБРИДНОГО БЕЛКА | 2010 |
|
RU2441072C1 |

Изобретение представляет собой способ получения суспензии гидрогелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины. Способ включает получение раствора белка, который освобождают от растворителя, получение гидрогеля и получение микрогелевой суспензии, определение размера гелевых микрочастиц, получение гелевых микрочастиц с заданными размерами. При этом используют рекомбинантный белок паутины паука-кругопряда, который растворяют в растворе лития хлористого в муравьиной кислоте. Диализ раствора проводят против калий-фосфатного буфера, центрифугируют. Раствор белка подвергают воздействию ультразвука. Раствор оставляют при комнатной температуре до образования геля. Гель протирают через сито, помещают в 96% этиловый спирт, встряхивают, выдерживают. Микрочастицы разделяют дифференциальным центрифугированием. Изобретение относится также к применению суспензии гидрогелевых микрочастиц, полученных описанным способом, для адгезии и пролиферации клеток человека или животных на поверхности гидрогелевых микрочастиц или имплантации гидрогелевых микрочастиц в организм человека или животных. Изобретение позволяет эффективно получать суспензии гидрогелевых микрочастиц с заданными размерами. 2 н. и 3 з.п. ф-лы, 6 ил., 14 пр.
1. Способ получения суспензии гидрогелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины, включающий получение раствора белка, освобождение от растворителя, получение гидрогеля, получение микрогелевой суспензии, определение размера гелевых микрочастиц, получение гелевых микрочастиц с заданными размерами, отличающийся тем, что используют рекомбинантный белок паутины паука-кругопряда, консенсусные последовательности которого происходят из повторяющихся последовательностей белков каркасной нити MaSp1 и/или MaSp2 большой ампуловидной железы, белков MiSp1 и/или MiSp2 малой ампуловидной железы или белка Flag ловчей нити паука-кругопряда, который растворяют в растворе лития хлористого в муравьиной кислоте, диализ раствора проводят против калий-фосфатного буфера (КФБ), центрифугируют, раствор белка подвергают воздействию ультразвука, раствор оставляют при комнатной температуре до образования геля в течение 20-25 ч, гель протирают через сито с нужным размером ячеек, помещают в 96%-ный этиловый спирт, встряхивают, выдерживают 5 мин, микрочастицы разделяют дифференциальным центрифугированием.
2. Способ по п.1, в котором последовательность рекомбинантного белка паутины паука-кругопряда включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков каркасной нити MaSp1 и MaSp2 большой ампуловидной железы пауков Nephila clavipes и Nephila madagascariensis, выбранные из группы:
AGQGGYGGLGSQGAGRGGLGGQGAGAAAAAAAGGAGQGGLGGQG
AGQGAGASAAAAGGAGQGGYGGLGSQG
AGRGGLGGQGAGAVAAAAAGGAGQGGYGGLGSQG
AGRGGQGAGAAAAAAGGAGQRGYGGLGNQG
GPGGYGPGQQGPGAAAAASA
GRGPGGYGPGQQGPGGSGAAAAAA
GSGPGGYGPGQQGPGGPGAAAAAAA
GRGPGGYGPGQQGPGQQGPGGSGAAAAAA
GRGPGGYGPGQQGPGGPGAAAAAA
GPGGYGPGQQGPGAAAAAAA
GSGAGGYGPGQQGPGGPGAAAAAA
GSGPGGYGPGQQGPGGSSAAAAAA
GSGPGGYGPGQQGPGGSGAAAAAAAA
GRGPGGYGQGQQGPGGPGAAAAAA
3. Способ по п.1, отличающийся тем, что содержит последовательности рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes.
4. Способ по п.1, отличающийся тем, что содержит последовательности рекомбинантного белка каркасной нити 2Е12 паука-кругопряда Nephila madagascariensis.
5. Применение суспензии гидрогелевых микрочастиц, полученных способом по п.1, для адгезии и пролиферации клеток человека или животных на поверхности гидрогелевых микрочастиц или имплантации гидрогелевых микрочастиц в организм человека или животных.
| RAMMENSEE S | |||
| et al | |||
| Rheological characterization of hydrogels formed by recombinantly produced spider silk | |||
| Applied Physics | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| HINMAN M.B | |||
| et al | |||
| Synthetic spider silk: a modular fibre | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| БОГУШ В.Г | |||
| и др | |||
| Получение, очистка и прядение рекомбинантного аналога спидроина 1 | |||
| Биотехнология, 2006, N4, с.3-12. | |||
Авторы
Даты
2013-04-10—Публикация
2011-12-23—Подача