Изобретение относится к области биотехнологии и касается способа увеличения секреции рекомбинантных белков клетками дрожжей Saccharomyces cerevisiae.
Под секретируемыми белками понимаются такие целевые растворимые белки, биосинтез которых в клетках дрожжей Saccharomyces cerevisiae сопровождается их экскрецией во внеклеточную среду. Под секрецией белка понимают такую совокупность внутриклеточных процессов, которые приводят к экскреции синтезируемого белка во внеклеточную среду.
Известно, что эффективность секреции в клетках дрожжей Saccharomyces cerevisiae зависит от выбора лидерных полипептидов (лидерных областей), направляющих секрецию белков [Romanes et al., 1992, Yeast 8: 423-488]. Необходимой частью лидерного полипептида является сигнальный пептид (пре-область), дополнительной - про-область. Каждая из частей лидерного полипептида, входящих в состав секретируемого белка на этапе его биосинтеза, в процессе секреции удаляется из его состава по мере выполнения своей функции.
Основная функция сигнального пептида заключается в обеспечении процесса транслокации белка, т.е. пересечения секретируемым белком мембранного слоя, отделяющего область клетки, в которой осуществляется синтез белка, от области ретикулума, в которой происходит сворачивание секретируемого белка и его пост-трансляционная модификация. Сигнальный пептид удаляется из состава секретируемого белка непосредственно в процессе транслокации. Про-область может выполнять двоякую функцию: с одной стороны про-область обеспечивает удлинение белков, в особенности коротких белков, влияющее на их транслокацию. Вторая известная функция про-области реализуется на этапе транспорта белков из ретикулума и заключается во взаимодействии последовательности про-области с транспортными рецепторами, которые опосредуют включение секретируемых белков в секреторные гранулы, в которых секретируемые белки перемещаются внутри клетки. На одном из заключительных этапов внутриклеточного транспорта в комплексе Гольджи происходит ферментативное отщепление (процессинг) про-области от зрелой части секретируемого белка, который в дальнейшем направляется к плазматической мембране и выходу из клетки.
В дрожжах S.cerevisiae в качестве лидерных областей обычно используются лидерные области дрожжевых секретируемых белков. Одной из наиболее широко применяемых лидерных областей дрожжевого происхождения, используемых для секреции гетерологичных белков в клетках S.cerevisiae, является лидерная пре-про область предшественника α-фактора (MFα-1) - полового фактора, секретируемого дрожжевыми клетками α-типа спаривания. Эффективность этой лидерной области продемонстрирована многократно, в том числе в отношении секреции таких белков, как инсулиноподобный фактор роста I [Bayne et al., 1988, Gene, 66: 235-244], гранулоцитарный колониестимулирующий фактор человека [Ernst, 1988, DNA, 7: 355-360], лизоцимы человека и курицы [Oka et al., 1999, Biosci.Biotechnol.Biochem., 63: 1977-1983; Hashimoto et al., 1998, Protein Engineering, 11: 75-77].
Другим известным секреторным лидером дрожжевого происхождения является пре-про-область гликопротеина HSP150 S. cerevisiae, положительное влияние которой на секрецию гетерологичных белков в клетках дрожжей установлено, например, для β-лактамазы [Simonen et al., 1994, JBiol Chem, 269: 13887-92] и внеклеточного домена рецептора фактора роста нервов крысы [Simonen et al., 1996, Yeast, 12: 457-66].
Примером последовательности искусственного происхождения, эффективно выполняющей в клетках дрожжей функции лидерного полипептида, является фрагмент белка интерлейкина-1-бета [Lee J et al., 1999, Biotechnol Prog, 15: 884-890].
Увеличение эффективности секреции белков в клетках дрожжей является одним из приоритетных направлений исследований в области биотехнологии. Проводимые исследования, в том числе, касаются модификации про-областей лидерных полипептидов, которые обеспечивают улучшение процессинга [Kjeldsen Т. et al., 1996, Gene, 170: 107-112] и секреторной активности [Kjeldsen Т., 2000, Appi Microbiol Biotechnol, 54: 277-286]. В частности некоторые искусственно сконструированные про-пептиды обеспечивают 4-кратное увеличение секреции инсулина человека по сравнению со стандартным вариантом пре-про-области α-фактора дрожжей [Kjeldsen Т., 2000, Appi Microbiol Biotechnol, 54: 277-286].
К интерферону альфа-2 человека (IFN-α2) относятся два аллельных варианта интерферон альфа-2b и интерферон альфа-2а, отличающихся в кодирующей области одиночной нуклеотидной заменой в позиции 137 (2а:А, 2b:G). [Kaluz et al., 1993, Acta Virol, 37: 97-100; Kaluz et al., 1994, Acta Virol, 38: 101-104; Lee et al., 1995, J Interferon Cytokine Res, 15: 341-349], которая приводит к аминокислотной замене (2а: Lys, 2b:Arg).
Интерфероны альфа-2 человека относятся к классу цитокинов, обладающих антивирусной активностью, и являются представителями семейства альфа-интерферонов, секретируемых практически всеми типами вирус-инфицированных клеток человека [Pfeffer et al., 1998, Cancer Research, 58: 2489-2499].
Рекомбинантные IFN-α2 применяют для терапии вирусных и опухолевых заболеваний [Samuel, 2001.Clinical Microbiology Reviews, 14: 778-809; Schadendorf et al., 2009, Annals of Oncology, 20 (Supplement 6): vi41-vi50; Pfeffer et al., 1998, Cancer Research, 58: 2489-2499], в том числе для лечения твердых опухолей, таких как рак мочевого пузыря, рак почки, ВИЧ-индуцированная саркома Капоши и др. [Torti et al., 1988, J din Oncol, 6: 476-483; Vugrin et al., 1985, Cancer Treat Rep, 69: 817-820; Rios et al., 1985, J din Oncol, 3: 5 06-512]. IFN-a2 являются основными терапевтическими средствами, используемыми для лечения хронических форм гепатитов В и С [dark & Nelson, 2009, din Liver Dis, 13: 351-363].
В недавних работах [Shi et al., 2007, Protein Expr Purif, 54: 220-6; Ghosalkar et al., 2008, Protein Expr Purif, 60: 103-109; Salunkhe et al 2010, Protein Expr Purif, 71: 139-46] показано, что пре-про область α-фактора дрожжей эффективно направляет секрецию зрелого интерферона альфа-2b в клетках дрожжей Pichia pastoris. Уровень накопления биологически активного интерферона в среде культивирования составляет до 300 мг/л. В условиях высокоплотного культивирования Р. pastoris получают до 600 мг/л зрелого IFN-α2 [Ayed et al., 2008, Enzyme Microb Technol, 42: 173-180].
Возможность использования дрожжей S.cerevisiae для получения до 280 мг/л биологически активного интерферона альфа-2а показана в работе Cbu et al. [2003].
Задача заявляемой группы изобретений является расширение арсенала лидерных полипептидов, направляющих секрецию целевых белков в дрожжах Saccharomyces cerevisiae в культуральную среду, и конструирование штаммов дрожжей Saccharomyces cerevisiae - продуцентов секретируемого интерферона альфа-2 человека, обладающих повышенной продукцией этих белков.
Задача решена путем
- конструирования генов, кодирующих новые лидерные полипептиды, в состав которых вместо уникальной про-области α-фактора дрожжей вводят две или более последовательностей про-областей α-фактора дрожжей;
- конструирования векторов, несущих гены зрелого интерферона альфа-2 человека, слитые в одной рамке считывания с генами новых лидерных полипептидов;
- конструирования штаммов дрожжей Saccharomyces cerevisiae ВКПМ Y-3582 и ВКПМ Y-3581 - продуцентов зрелого интерферона альфа-2b человека или зрелого интерферона альфа-2а человека, соответственно, секреция которых направляется лидерным полипептидом, сконструированным на основе удвоенной про-области α-фактора дрожжей S. cerevisiae.
В основу заявляемой группы изобретений положен установленный авторами факт, заключающийся в том, что амплификация (удвоение, утроение и т.д.) последовательности про-области α-фактора дрожжей в составе лидерного полипептида, направляющего секрецию целевого белка в клетках S. cerevisiae, приводит к увеличению секреции этого целевого белка.
Способ осуществляют следующим образом.
Этап 1 - конструируют варианты генов, кодирующих новые лидерные полипептиды, заключающих в своем составе последовательности, кодирующие эффективный сигнальный пептид и комбинацию про-областей α-фактора дрожжей. Под комбинацией понимают мультипликацию уникальной про-области α-фактора дрожжей. Новые лидерные полипептиды на С-конце содержат уникальный сайт узнавания процессирующей протеиназы КЕХ2.
Этап 2 - конструируют варианты экспрессионных векторов, каждый из которых содержит в своем составе ген, кодирующий целевой белок, прецизионно слитый с одним из вариантов новых лидерных полипептидов, содержащих в своем составе комбинацию про-областей. При этом в области слияния целевого белка и лидерного полипептида локализован сайт узнавания протеиназы КЕХ2, что позволяет в ходе секреции в результате ферментативного процессинга слитого белка с участием внутриклеточной протеиназы КЕХ2 высвобождать из его состава зрелый целевой белок, содержащий корректный N-концевой аминокислотный остаток.
Этап 3 - полученными вариантами экспрессионных векторов трансформируют реципиентные штаммы дрожжей S. cerevisiae, после чего, анализируя в подходящих условиях секреторную активность полученных трансформантов, выбирают тот вариант штамма с новым лидерным полипептидом, который демонстрирует наибольшую эффективность секреции целевого белка.
Этап 4 - с использованием выбранного штамма дрожжей и ферментационного оборудования в оптимизированных условиях проводят биосинтез целевого белка.
Заявляемые штаммы дрожжей Saccharomyces cerevisiae - продуценты зрелого интерферона альфа-2b человека или зрелого интерферона альфа-2а человека, соответственно, получают согласно описанному выше способу с использованием генов зрелого интерферона альфа-2b человека или зрелого интерферона альфа-2а человека, соответственно. В результате осуществления способа получают штаммы SCR-2b-FF - продуцент зрелого интерферона альфа-2b человека и SCR-2a-FF - продуцент зрелого интерферона альфа-2а человека. Секреция зрелых интерферонов альфа-2 человека в клетках штаммов SCR-2b-FF и SCR-2a-FF направляется лидерным полипептидом, содержащим удвоенную про-область α-фактора дрожжей S. cerevisiae. Полученные штаммы депонированы во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как штаммы Saccharomyces cerevisiae ВКПМ Y-3582 и ВКПМ Y-3581, соответственно.
Характеристика заявляемых штаммов
Генотип заявляемых штаммов


Все заявляемые штаммы характеризуются следующими культурально-морфологическими и физиолого-биохимическими признаками:
Морфологические признаки:
При культивировании при температуре 28°С в течение 48 часов на агаризованной среде YPD следующего состава (в мас.%): пептон-2, дрожжевой экстракт - 1, глюкоза - 2, агар -2, вода - остальное, клетки заявляемых штаммов Saccharomyces cerevisiae имеют овальную форму, 3-7 мкм в диаметре. Клетки почкуются. Почкование истинное, многостороннее. Истинного мицелия не образуют.
Колонии имеют следующий вид:
1) на агаризованной среде YPD колонии белого цвета с ровным краем, матовой поверхностью, линзовидным профилем и сметанообразной консистенцией;
2) на агаризованной среде с крахмалом (состав в мас.%: пептон-2, дрожжевой экстракт - 1, крахмал - 1, агар -2, вода - остальное) колонии белого цвета с узорчатым краем, матовой поверхностью, линзовидным профилем и крупчатой консистенцией.
Рост в жидкой среде с крахмалом: при 28°С в течение первых 24 ч культивирования - жидкость мутная, осадок белый, не комкуется, пристеночных пленок не образует.
Физико-химические признаки. Все заявляемые штаммы факультативные анаэробы. Температура роста - 20-33°С (оптимум - 28°С). рН культивирования - 3,8-7,4 (оптимум - 5,0).
Ассимиляция источников углерода. Все заявляемые штаммы сбраживают глюкозу, фруктозу, мальтозу, сахарозу, декстрины, крахмал. Не сбраживают лактозу, галактозу, инулин, ксилозу, арабинозу.
Ассимиляция источников азота. Все заявляемые штаммы усваивают аминокислоты, сернокислый аммоний, азотнокислый аммоний.
Патогенность. Заявляемые штаммы Saccharomyces cerevisiae непатогененны.
Хранение: Штаммы хранят при температуре -70°С в 20% водном растворе глицерина. Возможно хранение на агаризованной богатой среде с глюкозой в течение 3 месяцев при +4°С.
Стабильность. Стабильность заявляемых штаммов сохраняется при 20 последовательных пересевах на агаризованной среде YPD при температуре 28°С.
Продукция интерферона алъфа-2: При выращивании в ферментере клетки заявляемых штаммов Saccharomyces cerevisiae SCR-2b-FF и SCR-2a-FF продуцируют зрелый интерферон IFN-α2.
Изобретение проиллюстрировано следующими фигурами:
Фиг.1. Электрофореграмма образцов культуральной жидкости, полученных в результате культивирования штаммов-продуцентов интерферона альфа-2 человека: SCR-2a-F (дор. 1), SCR-2b-F (дор. 2), SCR-2a-FF (дор. 3), SCR-2b-FF (дор. 4), SCR-2a-FFF (дор. 5) и SCR-2b-FFF (дор. 6). На дорожки нанесен белок из 5 мкл культуральной жидкости. На элекрофореграмме представлены маркеры молекулярного веса (дор. М, слева приведены значения молекулярного веса белковых маркеров (в кДа)). В верхней части электрофореграммы приведены данные измерений содержания интерферона альфа-2 в соответствующих образцах культуральной жидкости, полученные с помощью аналитической высокоэффективной жидкостной хроматографии (мг/л).
Пример 1. Конструирование гена лидерного полипептида, содержащего удвоенную про-область α-фактора дрожжей S. cerevisiae
Конструирование гена, кодирующего лидерный полипептид, содержащий удвоенную про-область α-фактора дрожжей S. cerevisiae, проводят с использованием плазмиды pUC18x-GALlppI-IFN2b. Ген интерферона альфа-2b человека амплифицируют в реакции ПЦР с использованием праймеров N466 (ataccatggaaaagagatgtgatctgcctcaaacccacagcctaggtagccgt) и N467 (atctcgagtcattctttacttcttaaggattgcaagttt). Матрицей служит ДНК плазмы pSX50[RU2319502]. Полученный в результате амплификации фрагмент ДНК размером 510 п.о. элюируют из агарозного геля с использованием набора Qiagen (Qiagen, cat.JNo 28706), обрабатывают рестриктазами Ncol и Xhol и клонируют в лабораторной плазмиде pUC18x-GALlppI. В результате получают плазмиду pUC18x-GALlppI-IFN2b. Плазмиду pUC18x-GALlppI-IFN2b расщепляют по сайтам Ncol и Xhol. Больший из образовавшихся фрагментов ДНК, заключающий векторную часть плазмиды и последовательность, кодирующую пре-про область α-фактора дрожжей, слитую с последовательностью, кодирующей промоторную область гена GAL1 дрожжей, называют фрагментом-1. Затем, используя для ПЦР праймеры N449 (5'-atatagatctccagtcaacactacaa) и стандартный обратный pUC-праймер, называемый N169 (5'- gagcggataacaatttcacacagg), амплифицируют фрагмент ДНК плазмиды pUC18x-GALlppI-IFN2b, заключающий последовательность про-области α-фактора дрожжей и слитый с ней ген интерферона. Амплифицированный фрагмент ДНК расщепляют по уникальным концевым сайтам BglII и Xhol и называют фрагментом-2. Затем в результате отжига друг на друга двух синтетических олигонуклеотидов N573 (5'-catgttggaattcg) и N574 (5'-gatccgaattccaa) получают синтетический адаптер, называемый фрагментом-3. В результате совместного лигирования трех полученных фрагментов ДНК получают плазмиду pUC18x-GALlpFF-IFN2b.
Полученная плазмида pUC18x-GALlpFF-IFN2b содержит ген интерферона альфа-2b человека, слитый с фрагментом ДНК, кодирующим лидерный полипептид, содержащий в своем составе удвоенную про-область α-фактора дрожжей.
Пример 2. Конструирование гена лидерного полипептид а, содержащего утроенную про-область α-фактора дрожжей S. cerevisiae
Конструирование гена лидерного полипептида, содержащего утроенную про-область α-фактора дрожжей S. cerevisiae, проводят с использованием плазмиды pUC18x-GALlpFF-IFN2b (пример 1). Для этого плазмиду pUC18x-GALlpFF-IFN2b расщепляют по сайтам Ncol и Xhol. Больший из образовавшихся фрагментов ДНК, заключающий векторную часть плазмиды и последовательность промоторной области гена GAL1 дрожжей, слитую с лидерным полипептидом, заключающим удвоенную про-область α-фактора дрожжей, называют фрагментом-4. В результате совместного лидирования трех фрагментов ДНК, фрагментов 2 и 3 (пример 1) и фрагмента-4 получают плазмиду pUC18x-GALlpFFF-IFN2b.
Полученная плазмида pUC18x-GALlpFFF-IFN2b содержит ген интерферона альфа-2b человека, слитый с фрагментом ДНК, кодирующим лидерный полипептид, содержащий в своем составе утроенную про-область α-фактора дрожжей.
Пример 3. Конструирование дрожжевых экспрессионных векторов, несущих ген альфа-2b интерферона человека
Конструирование проводят с использованием лабораторного вектора pPDX3, отличающегося от вектора pPDX2 одиночной заменой в последовательности сайта NcoI (ccatgg изменен на ccatga), локализованной в области структурного гена URA3 и не приводящей к инактивации этого гена. Конструирование проводят следующим образом. HindIII/XhoI фрагмент ДНК вектора pPDX3 лигируют с HindIII/XhoI фрагментом ДНК плазмиды pUC18x-GAL1ppI-IFN2b или pUC18x-GALlpFF-IFN2b или pUC18x-GALlpFFF-IFN2b, заключающим последовательности промотора GAL1 и гена интерферона альфа-2b человека, слитого с соответствующим лидерным полипептидом. В результате получают экспрессионные вектора pPDX3-F-2b или pPDX3-FF-2b или pPDX3-FFF-2b, соответственно.
Полученные экспрессионные вектора несут в своем составе ген, кодирующий зрелый интерферон альфа-2b человека, слитый с последовательностями лидерных полипептидов, заключающих в своем составе одиночную, удвоенную или утроенную про-области α-фактора дрожжей, соответственно.
Пример 4. Конструирование дрожжевых экспрессионных векторов, несущих ген альфа-2а интерферона человека
Источником гена интерферона альфа-2а человека служит плазмида pUC18x-GALlppI-IFN2a, сконструированная аналогично pUC18x-GALlpFFF-IFN2b, только вместо праймера N466 используют N617 (agcctaggtagccgtcggtaccttgatgctcctggcacagatgcgtaagatctctctttt).
Амплифицированный фрагмент ДНК размером 480 п.о. элюируют из агарозного геля, обрабатывают рестриктазами XmaJI и Xhol и клонируют в плазмиде pUC18x-GALlppI-IFN2b, расщепленной по тем же сайтам. В ходе конструирования в составе экспрессионных векторов pPDX3-F-2b, pPDX3-FF-2b или pPDX3-FFF-2b ген интерферона альфа-2b человека замещают на ген интерферона альфа-2а человека. Для этого из состава вектора pPDX3-F-2b или pPDX3-FF-2b или pPDX3-FFF-2b выщепляют уникальный NcoI/XhoI фрагмент ДНК, включающий ген интерферона альфа-2b человека, а оставшуюся векторную часть лигируют с NcoI/XhoI фрагментом ДНК плазмиды pUC18x-GALlppI-IFN2a, кодирующим ген интерферона альфа-2а человека. В результате получают экспрессионные вектора pPDX3-F-2a или pPDX3-FF-2a или pPDX3-FFF-2a, соответственно.
Полученные экспрессионные вектора несут в своем составе ген зрелого интерферона альфа-2а человека, слитый с последовательностями лидерных полипептидов, заключающих в своем составе одиночную, удвоенную или утроенную про-области α-фактора дрожжей, соответственно.
Пример 5. Конструирование штаммов дрожжей S. cerevisiae -продуцентов секретируемого альфа-2 интерферона человека
Продуценты секретируемого интерферона альфа-2 человека конструируют на базе штамма S. cerevisiae ВКПМ Y-3550. Для этого сначала клетки штамма ВКПМ Y-3550 освобождают от находящегося в них эписомного вектора. Полученный бесплазмидный штамм называют SCR-8G1.
Клетки бесплазмидного реципиентного штамма SCR-8G1 трансформируют плазмидой pPDX3-F-2b, или pPDX3-FF-2b, или pPDX3-FFF-2b, или pPDX3-F-2a, или pPDX3-FF-2a, или pPDX3-FFF-2a. В результате получают штамм SCR-2b-F, или SCR-2b-FF, или SCR-2b-FFF, или SCR-2a-F, или SCR-2a-FF, или SCR-2a-FFF, соответственно.
Для анализа уровня секреции соматотропина клетки полученных штаммов культивируют на среде YPD. Далее, используя метод электрофореза в ПААГ и стандартный протокол ИФА.
Анализируют уровень продукции соматотропина, секретированного в среду культивирования дрожжей. В качестве отрицательного контроля используют штамм D721W/pPDX2.
Для анализа уровня секреции интерферона альфа-2 человека клетки полученных штаммов SCR-F-2b, SCR-2b-FF, SCR-2b-FFF, SCR-2a-F, SCR-2a-FF и SCR-2a-FFF культивируют на среде YPD следующего состава (в мас.%): пептон - 2, дрожжевой экстракт - 1, глюкоза - 2, агар - 2, вода - остальное, в течение 44 часов при 28°С на роторной качалке со скоростью 250 об/мин. Накопление интерферона в культуральной жидкости анализируют, используя метод электрофореза в ПААГ и метод аналитической обращеннофазовой высокоэффективной жидкостной хроматографии, как описано в патентной заявке.
Результаты анализа (Фиг.1) показывают, что штаммы SCR-2b-FF и SCR-2a-FF, секреция интерферона альфа-2 в которых направляется новыми лидерными полипептидами, заключающими в своем составе удвоенную про-область α-фактора дрожжей, а также штаммы SCR-2b-FFF и SCR-2a-FFF, секреция интерферона альфа-2 в которых направляется новыми лидерными полипептидами, заключающими в своем составе утроенную про-область α-фактора дрожжей, превосходят по продуктивности штаммы SCR-2b-F и SCR-2a-F, являющиеся аналогами штаммов-прототипов ВКПМ Y-3550 и ВКПМ Y-3564, секреция интерферона альфа-2 в которых направляется стандартной пре-про областью α-фактора дрожжей, в 1.3 и 1.2 раза, соответственно.
Штаммы SCR-2b-FF и SCR-2a-FF депонированы во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как штаммы Saccharomyces cerevisiae ВКПМ Y-3582 и ВКПМ Y-3581, соответственно.
Пример 6. Микробиологический синтез интерферона альфа-2b человека с использованием штамма ВКПМ Y-3582
Для получения посевного материала штамм ВКПМ Y-3582 выращивают в среде YPD на качалке (250 об/мин) при температуре 28°С в течение 20-24 ч.
50 мл посевного материала используют для засева 3 л ферментера Anglicon, содержащего 950 мл среды YPD. Ферментацию проводят при температуре 28°С, аэрации 1 л/мин и скорости перемешивания 1000 об/мин. Через 24 ч после засева ферментера начинают подпитку 50% раствором глюкозы со скоростью 2 мл/ч и устанавливают рН-стартирование культуры на уровне рН 6.8, используя для подтитровки растворы 10% серной кислоты и 10% NaOH. Общее время ферментации составляет 72 ч.
Продукция зрелого секретируемого интерферона альфа-2b человека штаммом ВКПМ Y-3582 составляет не менее 550 мг/л. Данный уровень продукции не менее чем на 20% превосходит уровень синтеза интерферона штаммом-прототипом ВКПМ Y-3550.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ЗРЕЛОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА, ШТАММ Saccharomyces cerevisiae - ПРОДУЦЕНТ ЗРЕЛОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА (ВАРИАНТЫ) | 2010 |
|
RU2427645C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА СЕКРЕТИРУЕМОГО СОМАТОТРОПИНА ЧЕЛОВЕКА И ШТАММ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE - ПРОДУЦЕНТ СЕКРЕТИРУЕМОГО СОМАТОТРОПИНА ЧЕЛОВЕКА | 2011 |
|
RU2460795C1 |
| ГИБРИДНЫЙ БЕЛОК, ОБЛАДАЮЩИЙ ПРОЛОНГИРОВАННЫМ ДЕЙСТВИЕМ, НА ОСНОВЕ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА (ВАРИАНТЫ), СПОСОБ ЕГО ПОЛУЧЕНИЯ И ШТАММ Saccharomyces cerevisiae ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТОГО СПОСОБА (ВАРИАНТЫ) | 2013 |
|
RU2515913C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ЦЕЛЕВОГО СЕКРЕТИРУЕМОГО БЕЛКА В ДРОЖЖАХ Saccharomyces cerevisiae | 2012 |
|
RU2502805C1 |
| ГИБРИДНЫЙ БЕЛОК (ВАРИАНТЫ), ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА | 2011 |
|
RU2453604C1 |
| СПОСОБ КОНСТРУИРОВАНИЯ ШТАММОВ ДРОЖЖЕЙ Saccharomyces cerevisiae - СТАБИЛЬНЫХ ПРОДУЦЕНТОВ СОМАТОТРОПИНА ЧЕЛОВЕКА, ШТАММ ДРОЖЖЕЙ Saccharomyces cerevisiae - СТАБИЛЬНЫЙ ПРОДУЦЕНТ СОМАТОТРОПИНА ЧЕЛОВЕКА (ВАРИАНТЫ) | 2009 |
|
RU2420567C1 |
| ГИБРИДНЫЙ БЕЛОК, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2b ЧЕЛОВЕКА ИЗ ЭТОГО ГИБРИДНОГО БЕЛКА | 2010 |
|
RU2441072C1 |
| Фосфолипаза А2 для экспрессии в дрожжах (варианты) | 2018 |
|
RU2716087C1 |
| Способ получения секретируемой полностью функциональной фосфолипазы А2 в дрожжах Saccharomyces cerevisiae, белок-предшественник для осуществления этого способа (варианты) | 2019 |
|
RU2728240C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА ПАУТИНЫ, СЛИТЫЙ БЕЛОК, РЕКОМБИНАНТНАЯ ДНК, ВЕКТОР ЭКСПРЕССИИ, КЛЕТКА-ХОЗЯИН И ШТАММЫ-ПРОДУЦЕНТЫ | 2010 |
|
RU2451023C1 |
Изобретение относится к области биотехнологии и касается способа увеличения секреции рекомбинантных белков клетками дрожжей Saccharomyces cerevisiae. Разработан способ увеличения секреции рекомбинантных белков в клетках дрожжей Saccharomyces cerevisiae, основанный на использовании новых лидерных полипептидов, заключающих в своем составе вместо уникальной про-области комбинацию про-областей, которая представляет собой последовательность двух или более про-областей α-фактора дрожжей S.cerevisiae. С использованием разработанного способа сконструированы штаммы дрожжей Saccharomyces cerevisiae - продуценты секретируемого интерферона альфа-2b и альфа-2а человека. Продуктивность полученных штаммов составляет не менее 550 мг/л интерферона альфа-2 при использовании ферментационного оборудования. 3 н.п. ф-лы, 1 ил., 6 пр.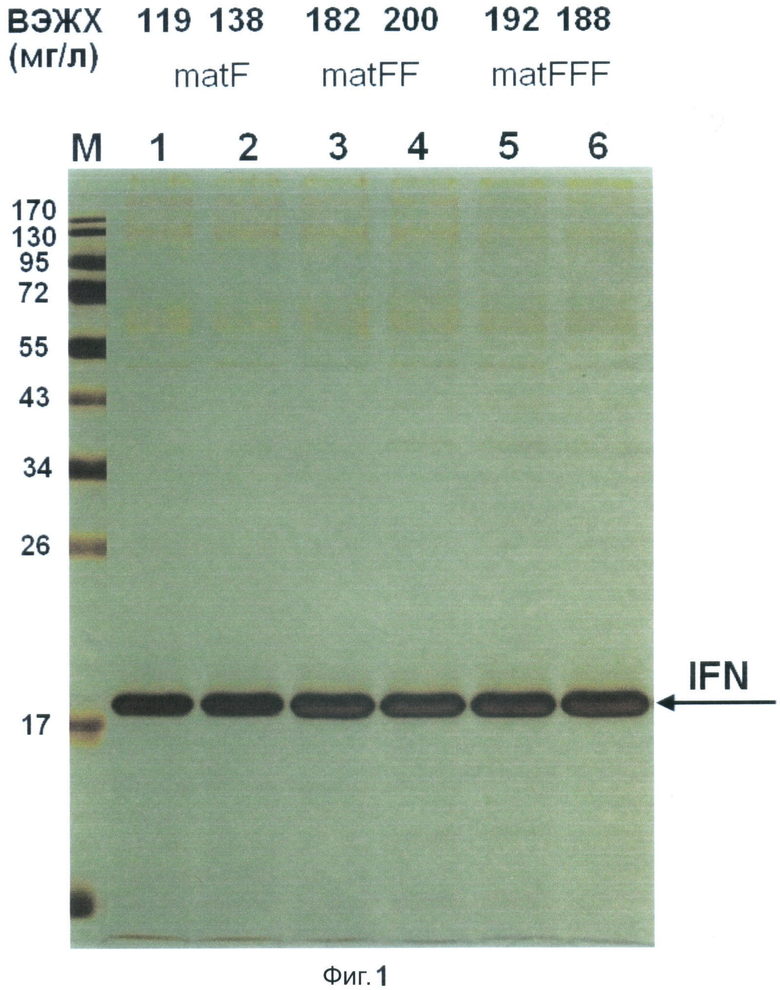
1. Способ получения зрелого интерферона альфа-2 человека с использованием дрожжей Saccharomyces cerevisiae, содержащих эффективный сигнальный пептид и про-область, отличающийся тем, что в состав лидерных полипептидов вместо уникальной про-области вводят комбинацию про-областей, представляющую собой последовательность двух или более про-областей α-фактора дрожжей Saccharomyces cerevisiae.
2. Штамм дрожжей Saccharomyces cerevisiae ВКПМ Y-3582 - продуцент зрелого секретируемого интерферона альфа-2b человека, секрецию которого направляет лидерный полипептид, полученный способом по п.1, включающий удвоенную про-область α-фактора дрожжей Saccharomyces cerevisiae.
3. Штамм дрожжей Saccharomyces cerevisiae ВКПМ Y-3581 - продуцент зрелого секретируемого интерферона альфа-2а человека, секрецию которого направляет лидерный полипептид, полученный способом по п.1, включающий удвоенную про-область α-фактора дрожжей Saccharomyces cerevisiae.
| Способ получения W-интерферона человека | 1988 |
|
SU1551251A3 |
| RU 1660388 С, 20.05.1995 | |||
| CHU J et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2012-03-27—Публикация
2011-03-24—Подача