Изобретение относится к области биотехнологии и касается способа синтеза секретируемого соматотропина человека клетками дрожжей Saccharomyces cerevisiae.
Увеличение производства белков медицинского и технического назначения за счет увеличения эффективности их секреции в клетках микроорганизмов является одним из приоритетных направлений исследований в области биотехнологии. К числу микроорганизмов, используемых для этих целей, относятся дрожжи Saccharomyces cerevisiae.
Под секретируемыми белками будем понимать такие целевые растворимые белки, биосинтез которых в клетках дрожжей S.cerevisiae сопровождается их секрецией во внеклеточную среду.
Известно, что эффективность секреции в клетках дрожжей S.cerevisiae зависит от выбора лидерных полипептидов (лидерных областей), направляющих секрецию белков [Romanos et al., 1992, Yeast 8:423-488]. Необходимой частью лидерного полипептида является сигнальный пептид (пре-область), дополнительной - про-область. Каждая из частей лидерного полипептида, входящих в состав секретируемого белка на этапе его биосинтеза, в процессе секреции удаляется из его состава по мере выполнения своей функции.
Основная функция сигнального пептида заключается в обеспечении процесса транслокации белка, т.е. пересечения секретируемым белком мембранного слоя, отделяющего область клетки, в которой осуществляется синтез белка, от области ретикулума, в которой происходит сворачивание секретируемого белка и его посттрансляционная модификация. Сигнальный пептид удаляется из состава секретируемого белка непосредственно в процессе транслокации. Про-область может выполнять двоякую функцию: с одной стороны, про-область обеспечивает удлинение белков, в особенности коротких белков, влияющее на их транслокацию. Вторая известная функция про-области реализуется на этапе транспорта белков из ретикулума и заключается во взаимодействии последовательности про-области с транспортными рецепторами, которые опосредуют включение секретируемых белков в секреторные гранулы, в которых секретируемые белки перемещаются внутри клетки. На одном из заключительных этапов внутриклеточного транспорта в комплексе Гольджи происходит ферментативное отщепление (процессинг) про-области от зрелой части секретируемого белка, который в дальнейшем направляется к плазматической мембране и выходу из клетки.
В дрожжах S. cerevisiae в качестве лидерных областей обычно используют лидерные области дрожжевых секретируемых белков. Одной из наиболее широко применяемых лидерных областей дрожжевого происхождения, используемых для секреции гетерологичных белков в клетках S.cerevisiae, является лидерная пре-про-область предшественника α-фактора (MFα-1) - полового фактора, секретируемого дрожжевыми клетками α-типа спаривания. Эффективность этой лидерной области продемонстрирована многократно, в том числе в отношении секреции таких белков, как инсулиноподобный фактор роста I [Bayne et al., 1988, Gene, 66:235-244], гранулоцитарный колониестимулирующий фактор человека [Ernst, 1988, DNA, 7:355-360], лизоцимы человека и курицы [Ока et al., 1999, Biosci.Biotechnol.Biochem., 63:1977-1983; Hashimoto et al., 1998, Protein Engineering, 11:75-77].
Другим известным секреторным лидером дрожжевого происхождения является пре-про-область гликопротеина HSP150 S. cerevisiae, положительное влияние которой на секрецию гетерологичных белков в клетках дрожжей установлено, например, для β-лактамазы [Simonen et al., 1994, J Biol Chem, 269:13887-92] и внеклеточного домена рецептора фактора роста нервов крысы [Simonen et al., 1996, Yeast, 12:457-66].
Примером последовательности искусственного происхождения, эффективно выполняющей в клетках дрожжей функции лидерного полипептида, является фрагмент белкаинтерлейкина-1-бета [Lee et al., 1999, Biotechnol Prog, 15:884-890].
Найден ряд модификаций про-областей лидерных полипептидов, которые обеспечивают улучшение их процессинга [Kjeldsen et al., 1996, Gene, 170:107-112] и секреторной активности [Kjeldsen, 2000, Appl Microbiol Biotechnol, 54:277-286]. В частности, известен искусственно сконструированный про-пептид, обеспечивающий 4-кратное увеличение секреции инсулина человека по сравнению со стандартным вариантом про-области α-фактора дрожжей [Kjeldsen, 2000, Appl Microbiol Biotechnol, 54:277-286].
Соматотропин человека (соматотропин) относится к группе анаболических гормонов. Недостаточность его в организме человека приводит к тяжелым последствиям - карликовости, сопровождаемой в большинстве случаев дегенеративными изменениями скелета и мышц, бесплодием, а иногда и задержкой умственного развития. Физиологический эффект соматотропина включает в себя увеличение роста и силы мышц, стимуляцию формирования костной и хрящевой тканей, повышение распада жира, улучшение сердечной деятельности [Hedge et al., 1987, Clinical endocrine physiology. W.B.Saunders company, 1987]. Соматотропин также обладает выраженным антиатерогенным эффектом (повышает уровень содержания липопротеинов высокой плотности и снижает уровень содержания липопротеинов низкой плотности. Показано, что люди с дефицитом гормона роста имеют повышенный риск кардиоваскулярной смертности (Материалы III Всероссийской научно-практической конференции «Актуальные проблемы нейроэндокринологии», Москва, 6-7 октября, 2003 г.).
Описан способ конструирования штаммов S.cerevisiae SCR-H1 и SCR-H2 - стабильных продуцентов секретируемого рекомбинантного соматотропина человека. Клетки этих штаммов содержат по нескольку копий экспрессионных кассет, включающих ген соматотропина, интегрированных в различные хромосомные локусы, что обеспечивает их стабильное наследование. В составе экспрессионных кассет ген соматотропина человека находится под контролем промотора GAL1 S.cerevisiae. Секреция белка направляется либо исключительно лидерной пре-про-областью α-фактора дрожжей (в клетках штамма SCR-H1), либо используют одновременно два лидера, являющихся альтернативными по отношению друг к другу: в части конструкций секреция соматотропина направляется лидерной пре-про-областью α-фактора дрожжей, а в других - гибридной лидерной областью, содержащей модифицированный сигнальный пептид α-фактора дрожжей и про-область белка HSP150 S.cerevisiae (в клетках штамма SCR-H2). Уровень секреции соматотропина составляет 100 мг/л и 150 мг/л, соответственно [RU 2009145487].
Задача заявляемой группы изобретений - расширение арсенала способов микробиологического синтеза секретируемого соматотропина человека клетками дрожжей Saccharomyces cerevisiae.
Задача решена путем
- разработки способа микробиологического синтеза секретируемого соматотропина человека клетками дрожжей Saccharomyces cerevisiae, предусматривающего культивирование штамма-продуцента секретируемого соматотропина человека, содержащего последовательность ДНК, кодирующую зрелый соматотропин человека, слитый в одной рамке считывания с лидерным полипептидом, включающим сигнальный пептид и комбинацию двух-трех последовательно расположенных про-областей, каждая из которых стимулирует секрецию соматотропина человека в дрожжах Saccharomyces cerevisiae, в частности, удвоенной про-области α-фактора дрожжей S.cerevisiae, утроенной про-области α-фактора дрожжей S.cerevisiae, удвоенной про-области белка HSP150 дрожжей S.cerevisiae или про-области белка HSP150 дрожжей S.cerevisiae и про-области α-фактора дрожжей S.cerevisiae;
- конструирования штамма дрожжей Saccharomyces cerevisiae ВКПМ Y-3580 - продуцента секретируемого соматотропина человека.
Способ в общем виде
Посевную культуру одного из штаммов дрожжей Saccharomyces cerevisiae - продуцента секретируемого соматотропина человека, содержащего последовательность ДНК, кодирующую зрелый соматотропин человека, слитый в одной рамке считывания с лидерным полипептидом, включающим сигнальный пептид и комбинацию двух-трех последовательно расположенных про-областей, каждая из которых стимулирует секрецию соматотропина в дрожжах Saccharomyces cerevisiae, получают путем культивирования штамма в течение 16-40 часов при температуре 22-32°С на орбитальной качалке 100-350 об/мин в среде следующего состава, в мас.%: пептон 1-3; дрожжевой экстракт 0,5-3; глюкоза 1-3, вода - остальное, рН среды - естественный.
Посевной культурой засевают ферментер (0,5-1000 л), содержащий ферментационную среду, следующего состава, в мас.%: пептон 1-3; дрожжевой экстракт 0,5-3, глюкоза или сахароза 1-4, вода - остальное, рН среды - естественный. Количество посевной культуры, вносимой в ферментер, составляет 3-15% от объема ферментационной среды.
Ферментацию проводят при температуре 22-32°С, аэрации 0,2-1,5 об/об/мин и скорости перемешивания культуры 200-1500 оборотов/мин. Через 16-30 ч после засева ферментера начинают подпитку водным раствором следующего состава (в граммах на литр): пептон 20-100; дрожжевой экстракт 20-100, глюкоза или сахароза 100-500, со скоростью 1-10 мл/л/ч и устанавливают рН-статирование культуры в диапазоне рН 5,5 - рН 7,2. Общая продолжительность ферментации составляет 48-96 часов.
Способ позволяет синтезировать секретируемый соматотропин человека в количестве 1-2 г/л культуральной жидкости, для определения количества которого используют метод электрофореза в полиакриламидном геле и протокол иммуноферментного анализа [RU 2009145487].
Конструирование штамма Saccharomyces cerevisiae - продуцента секретируемого соматотропина человека.
Этап 1 - конструируют варианты генов новых лидерных полипептидов, заключающих в своем составе белковые последовательности, кодирующие эффективный сигнальный пептид и комбинацию последовательно расположенных про-областей, каждая из которых стимулирует секрецию соматотропина человека в дрожжах Saccharomyces cerevisiae, в частности, удвоенной про-области α-фактора дрожжей S.cerevisiae, или утроенной про-области α-фактора дрожжей S.cerevisiae, или удвоенной про-области белка HSP150 дрожжей S.cerevisiae, или про-области белка HSP150 дрожжей S.cerevisiae и про-области α-фактора дрожжей S.cerevisiae.
Под комбинацией понимают мультипликацию уникальной про-области или комбинацию различных про-областей. Новые лидерные полипептиды на С-конце содержат уникальный сайт узнавания протеиназы КЕХ2.
Этап 2 - конструируют варианты дрожжевых экспрессионных векторов, каждый из которых содержит в своем составе ген, кодирующий зрелый соматотропин человека, слитый с одним из вариантов лидерных полипептидов, содержащих в своем составе комбинацию последовательно расположенных про-областей, способных стимулировать секрецию соматотропина человека клетками дрожжей S.cerevisiae. Наличие в области слияния целевого белка и лидерного полипептида сайта узнавания протеиназы КЕХ2 позволяет в ходе секреции в результате ферментативного процессинга слитого белка с участием внутриклеточной протеиназы КЕХ2 высвобождать из его состава зрелый соматотропин человека (содержащий соответствующий нативному N-концевой аминокислотный остаток). Экспрессионные векторы содержат также область инициации репликации эндогенной 2-мкм плазмиды дрожжей, что обеспечивает их способность поддерживаться в клетках дрожжей S. cerevisiae в эписомном многокопийном состоянии. С целью стабилизации плазмиды в векторы вводят функциональный ген PGK1 дрожжей S. cerevisiae.
Этап 3 - полученными вариантами экспрессионных векторов трансформируют реципиентный штамм дрожжей S.cerevisiae. Предпочтительно в качестве реципиентного штамма дрожжей используют штамм S.cerevisiae D721W, который является диплоидным, что обеспечивает повышенную стабильность его экспрессионных характеристик. Штамм S.cerevisiae D721W содержит гомозиготные мутации в хромосомных аллелях структурного гена PGK1, кодирующего фосфоглицераткиназу, что обеспечивает стабильное поддержание вектора, содержащего в своем составе функциональный ген PGK1, на средах, содержащих любой единственный источник углерода, усваиваемый дрожжами Saccharomyces cerevisiae, и гена GAL80, кодирующего белок - репрессор промотора GAL1, что обеспечивает галактозонезависимую экспрессию генов, находящихся под контролем промотора GAL1.
Этап 4 - на основании результатов сравнительного анализа полученных трансформантов выбирают штамм дрожжей, осуществляющий наиболее эффективную секрецию соматотропина человека.
Этап 5 - используя выбранный штамм дрожжей и ферментационное оборудование, осуществляют биосинтез соматотропина человека.
Конструирование заявляемого штамма - продуцента секретируемого соматотропина человека проводят согласно описанному выше с использованием в качестве комбинации про-областей - удвоенной про-области α-фактора дрожжей S.cerevisiae. В результате получают штамм дрожжей Saccharomyces cerevisiae SCR-GH-FF - продуцент зрелого соматотропина человека, который депонируют во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как Saccharomyces cerevisiae ВКПМ Y-3580.
Характеристика заявляемого штамма
Генотип:
SCR-GH-FF (a/α leu2/leu2 ura3/ura3 trp1/trp1::TRP1 pgk1::URA3/pgk1::URA3 gal80::LEU2/gal80::LEU2 lys7/LYS7 his3/HIS3 his4/HIS4 STA2/STA2 suc°/SUC2) /pPDX3-FF-GH
Морфологические признаки:
При культивировании при температуре 28°С в течение 48 часов на агаризованной среде YPD следующего состава (в мас.%): пептон 2, дрожжевой экстракт 1, глюкоза 2, агар 2, вода остальное, клетки заявляемого штамма имеют овальную форму, 3-7 мкм в диаметре. Клетки почкуются. Почкование истинное, многостороннее. Истинного мицелия не образуют.
Колонии имеют следующий вид:
1) на агаризованной среде YPD колонии белого цвета с ровным краем, матовой поверхностью, линзовидным профилем и сметанообразной консистенцией;
2) на агаризованной среде с крахмалом (состав в мас.%: пептон 2, дрожжевой экстракт 1, крахмал 1, агар 2, вода остальное) колонии белого цвета с узорчатым краем, матовой поверхностью, линзовидным профилем и крупчатой консистенцией.
Рост в жидкой среде с крахмалом: при 28°С в течение первых 24 ч культивирования - жидкость мутная, осадок белый, не комкуется, пристеночных пленок не образует.
Физико-химические признаки: Факультативный анаэроб. Температура роста 20-33°С (оптимум 28°С). рН культивирования 3,8-7,4 (оптимум - 5,0).
Ассимиляция источников углерода: Сбраживает глюкозу, фруктозу, мальтозу, сахарозу, декстрины, крахмал. Не сбраживает лактозу, галактозу, инулин, ксилозу, арабинозу.
Ассимиляция источников азота: Усваивает аминокислоты, сернокислый аммоний, азотнокислый аммоний.
Патогенность: Заявляемый штамм Saccharomyces cerevisiae ВКПМ Y-3580 непатогененен.
Хранение: Штамм хранят при температуре -70°С в 20% водном растворе глицерина. Возможно хранение на агаризованной богатой среде с глюкозой в течение 3 месяцев при +4°С.
Стабильность: Стабилен в течение 20 последовательных пересевов на агаризованной среде YPD при температуре 28°С.
Продукция соматотропина: Секретирует зрелый соматотропин человека в количестве 1-2 г/л.
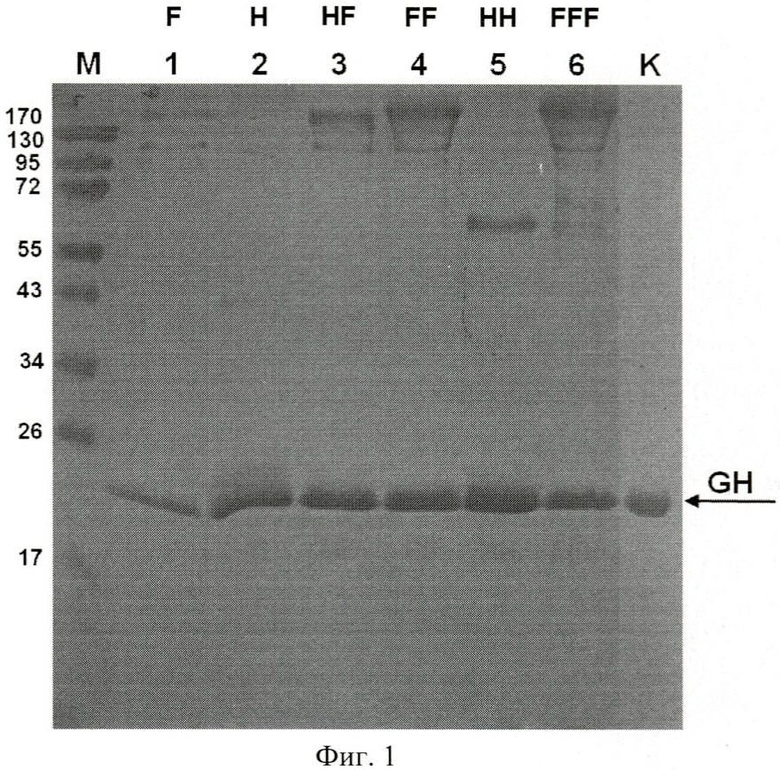
Заявляемая группа изобретений проиллюстрирована следующей фигурой, на которой - электрофореграмма образцов культуральной жидкости, полученных в результате культивирования штаммов-продуцентов соматотропина человека (пример 9): SCR-GH-F (дор.1), SCR-GH-150 (дор.2), SCR-GH-150F (дор.3), SCR-GH-FF (дор.4), SCR-GH-150x2 (дор.5) и SCR-GH-FFF (дор.5 и 6). На дорожки нанесены суммарные белки образцов, полученных из 10 мкл культуральной жидкости. На элекрофореграмме представлен образец аптечного препарата соматотропина человека («Растан», 2.5 мкг, дор.К), а также маркеры молекулярного веса (дор.М, слева приведены значения молекулярного веса белковых маркеров (в кДа). В нижней части электрофореграммы приведены данные измерений содержания соматотропина человека (мг/л) в соответствующих образцах культуральной жидкости, полученные с помощью иммуноферментного анализа (ИФА).
Пример 1. Конструирование ДНК, кодирующей лидерный полипептид, содержащий последовательность удвоенной про-области α-фактора дрожжей S.cerevisiae
Конструирование последовательности ДНК, кодирующей лидерный полипептида, включающий белковую последовательность удвоенной про-области α-фактора дрожжей S.cerevisiae, проводят с использованием плазмиды р91-1, содержащей экспрессионную кассету, включающую промотор GAL1 и ген зрелого соматотропина человека, слитый в одной рамке считывания с последовательностью ДНК, кодирующей лидерную пре-про-область α-фактора S.cerevisiae [RU2009145487]. Плазмиду р91-1 расщепляют по сайтам NcoI и XhoI. Больший из образовавшихся фрагментов ДНК, заключающий векторную часть плазмиды и последовательность ДНК, кодирующую про-область α-фактора дрожжей, слитую с последовательностью промоторной области гена GAL1 дрожжей, элюируют из геля и называют фрагментом-1. Затем, используя для ПЦР праймеры N449 (5′-atatagatctccagtcaacactacaa) и стандартный обратный pUC-праймер, называемый N169 (5′-gagcggataacaatttcacacagg), амплифицируют фрагмент ДНК плазмиды р91-1, заключающий последовательность про-области α-фактора дрожжей и слитый с ней ген зрелого соматотропина человека. Амплифицированный фрагмент ДНК расщепляют по уникальным концевым сайтам BglII и XhoI и называют фрагментом-2. Затем в результате отжига друг на друга двух синтетических олигонуклеотидов N573 (5′-catgttggaattcg) и N574 (5′-gatccgaattccaa) получают синтетический адаптер, называемый фрагментом-3. В результате совместного лигирования трех полученных фрагментов ДНК получают плазмиду pUC18x-GAL1pFF-GH.
Полученная плазмида pUC18x-GAL1pFF-GH содержит ген зрелого соматотропина человека, слитый в одной рамке считывания с фрагментом ДНК, кодирующим лидерный полипептид, состоящий из сигнального пептида и последовательности удвоенной про-области α-фактора дрожжей.
Пример 2. Конструирование ДНК, кодирующей лидерный полипептид, содержащий последовательность утроенной про-области α-фактора дрожжей S.cerevisiae
Конструирование последовательности ДНК, кодирующей лидерный полипептид, включающий белковую последовательность утроенной про-области α-фактора дрожжей S.cerevisiae, проводят с использованием плазмиды pUC18x-GAL1pFF-GH (пример 1). Для этого плазмиду pUC18x-GAL1pFF-GH расщепляют по сайтам NcoI и XhoI. Больший из образовавшихся фрагментов ДНК, заключающий векторную часть плазмиды и последовательность промоторной области гена GAL1 дрожжей, слитую с лидерным полипептидом, заключающим удвоенную про-область α-фактора дрожжей, называют фрагментом-4. В результате совместного лигирования трех фрагментов ДНК, фрагментов 2 и 3 (пример 1) и фрагмента-4 получают плазмиду pUC18x-GAL1pFFF-GH.
Полученная плазмида pUC18x-GAL1pFFF-GH содержит ген зрелого соматотропина человека, слитый в одной рамке считывания с фрагментом ДНК, кодирующим лидерный полипептид, состоящий из сигнального пептида и последовательности утроенной про-области α-фактора дрожжей.
Пример 3. Конструирование ДНК, кодирующей лидерный полипептид, содержащий последовательность удвоенной про-области белка HSP150 дрожжей S.cerevisiae
Конструирование гена лидерного полипептида, содержащего удвоенную про-область белка HSP150 дрожжей S.cerevisiae, проводят с использованием плазмиды р91-15, содержащей экспрессионную кассету, включающую промотор GAL1 и ген зрелого соматотропина человека, слитый в одной рамке считывания с последовательностью ДНК, кодирующей лидерный полипептид, содержащий последовательность про-области (Н) белка HSP150 дрожжей S.cerevisiae [RU 2009145487]. Плазмиду р91-15 расщепляют по сайтам NcoI и XhoI. Больший из образовавшихся фрагментов ДНК, заключающий векторную часть плазмиды и последовательность ДНК, кодирующую про-область белка HSP150, слитую с последовательностью промоторной области гена GAL1 дрожжей, элюируют из геля и называют фрагментом-5. Далее, используя для ПЦР праймеры N616 (5′-aatagatctgcctatgctccatctga) и стандартный обратный pUC-праймер, называемый N169 (5′-gagcggataacaatttcacacagg), амплифицируют фрагмент ДНК плазмиды р91-15, заключающий последовательность, кодирующую про-область белка HSP150 дрожжей S. cerevisiae и слитый с ней ген зрелого соматотропина человека. Амплифицированный фрагмент ДНК расщепляют по уникальным концевым сайтам BglII и XhoI и называют фрагментом 6. В результате совместного лигирования трех фрагментов ДНК, фрагмента 3 (пример 1) и фрагментов 5 и 6 получают плазмиду pUC18x-GAL1matHH-GH.
Полученная плазмида pUC18x-GAL1matHH-GH содержит ген зрелого соматотропина человека, слитый с фрагментом ДНК, кодирующим лидерный полипептид, включающий последовательность удвоенной про-области белка HSP150 дрожжей S.cerevisiae.
Пример 4. Конструирование ДНК, кодирующей лидерный полипептид, содержащий последовательности про-области белка HSP150 дрожжей S.cerevisiae и про-области α-фактора дрожжей S.cerevisiae
Используя для ПЦР праймеры N449 (5′-atatagatctccagtcaacactacaa) и стандартный обратный pUC-праймер, называемый N169 (5′-gagcggataacaatttcacacagg), амплифицируют фрагмент ДНК плазмиды р91-1 [RU 2009145487], заключающий последовательность ДНК, кодирующую про-область α-фактора дрожжей S.cerevisiae и слитый с ней ген зрелого соматотропина человека. Амплифицированный фрагмент ДНК расщепляют по уникальным концевым сайтам BglII и XhoI и называют фрагментом 7.
В результате совместного лигирования трех фрагментов ДНК, фрагмента 5 (пример 3), фрагмента 3 (пример 1) и фрагмента 7, получают плазмиду pUC18x-GALlmatHF-GH.
Полученная плазмида pUC18x-GAL1matHF-GH содержит ген зрелого соматотропина человека, слитый с фрагментом ДНК, кодирующим лидерный полипептид, включающий последовательности про-области белка HSP150 дрожжей S.cerevisiae и про-области α-фактора дрожжей S.cerevisiae.
Пример 5. Конструирование вариантов дрожжевых экспрессионных векторов, включающих различные комбинации про-областей
Конструирование проводят с использованием лабораторного бирепликонного вектора pPDX3. Вектор pPDX3 содержит область инициации репликации эндогенной 2-мкм плазмиды дрожжей, которая обеспечивает его способность поддерживаться в клетках дрожжей Saccharomyces cerevisiae в эписомном многокопийном состоянии, вектор также несет функциональный аллель гена PGK1 дрожжей, который обеспечивает его селективное поддержание в клетках дрожжей, мутантных по хромосомному аллелю этого гена. Вектор pPDX3 содержит одиночную замену в последовательности сайта NcoI (ccatgg изменен на ccatga), локализованной в области структурного гена URA3, которая не приводит к инактивации этого гена.
Конструирование проводят следующим образом. ДНК вектора pPDX3 расщепляют по HindIII/XhoI и лигируют с HindIII/XhoI фрагментом ДНК плазмиды р91-1, или pUC18x-GAL1pFF-GH, или pUC18x-GAL1pFFF-GH, или р91-15, или pUC18x-GAL1matHH-GH, или pUC18x-GAL1matHF-GH, заключающим последовательности промотора GAL1 и гена зрелого соматотропина человека, слитого с последовательностью ДНК, кодирующей соответствующий вариант лидерного полипептида. В результате получают экспрессионные вектора pPDX3-F-GH, или pPDX3-FF-GH, или pPDX3-FFF-GH, или pPDX3-H-GH, или pPDX3-HH-GH, или pPDX3-HF-GH, соответственно.
Полученные бирепликонные экспрессионные вектора содержат в своем составе ген зрелого соматотропина человека, слитый с последовательностями ДНК, кодирующими варианты лидерных полипептидов, заключающих в своем составе одиночную (F), удвоенную (FF) или утроенную (FFF) про-области α-фактора дрожжей, одиночную (Н), удвоенную (НН) про-области белка HSP150 дрожжей S.cerevisiae или комбинацию про-области белка HSP150 дрожжей S.cerevisiae и про-области α-фактора дрожжей S.cerevisiae (HF), соответственно.
Пример 6. Конструирование реципиентного штамма дрожжей S.cerevisiae D721W
Реципиентный штамм S.cerevisiae D721W является производным лабораторного штамма S.cerevisiae D721/pPDX3. Клетки штамма D721/pPDX3 несут гомозиготные мутации в хромосомных аллелях структурных генов PGK1 и GAL80.
Штамм D721W конструируют в два этапа. На первом этапе клетки лабораторного штамма D721/pPDX3 трансформируют полученным любым способом фрагментом ДНК, заключающим нативный ген TRP1 дрожжей S.cerevisiae. Трансформацию осуществляют по методу [Ito H, Fukuda Y, Murata К, Kimura A; J Bacteriol. 1983; 153:163-168]. Трансформанты отбирают на стандартной минеральной среде для выращивания дрожжей, не содержащей триптофана.
Отбирают один из полученных трансформантов и называют его штаммом S.cerevisiae D721W/pPDX3.
На втором этапе клетки штамма D721W/pPDX3 освобождают от находящегося в них эписомного вектора pPDX3. Для этого их культивируют на агаризованной среде YPGE следующего состава в мас.%: бактопептон 2, дрожжевой экстракт 1, бактоагар 2, этанол 2, глицерин 3, вода остальное. На этой среде одинаково эффективно растут клетки, несущие плазмиду pPDX3, в составе которой находится ген PGK1, и клетки, их утратившие. Бесплазмидные клоны селектируют по признаку отсутствия роста на среде YPD с глюкозой. Полученный в результате бесплазмидный штамм называют штаммом S.cerevisiae D721W.
Штамм D721W используют как реципиентный для трансформации дрожжевыми бирепликонными экспрессионными векторами.
Пример 7. Получение заявляемого штамма и других штаммов дрожжей S.cerevisiae-продуцентов секретируемого соматотропина человека
Штамм дрожжей SCR-GH-F, или SCR-GH-FF, или SCR-GH-FFF, или SCR-GH-H, или SCR-GH-HH, или SCR-GH-HF получают в результате трансформации клеток реципиентного штамма D721W экспрессионными векторами pPDX3-F-GH, или pPDX3-FF-GH, или pPDX3-FFF-GH, pPDX3-H-GH, или pPDX3-HH-GH, или pPDX3-HF-GH, соответственно. Для осуществления трансформации клетки штамма D721W культивируют в течение 18-24 часов при температуре 28°С на агаризованной среде YPGE. Трансформацию выращенных клеток проводят по методу Ito [Ito et al., J Bacteriol. 1983; 153: 163-168]. Трансформанты отбирают по способности расти на среде YPD.
Для анализа уровня секреции соматотропина клетки полученных трансформантов культивируют на среде YPD в течение 44 часов при 28°С на роторной качалке со скоростью 250 об/мин. Далее, анализируют уровень секретируемого соматотропина в среде культивирования дрожжей. В качестве отрицательного контроля используют штамм D721W/pPDX2.
Результаты анализа (Фиг.1) показывают, что штаммы SCR-GH-FF, SCR-GH-FFF, SCR-GH-HH и SCR-GH-HF, секреция соматотропина в которых направляется лидерными полипептидами, заключающими в своем составе комбинацию про-областей, значительно превосходят по продуктивности штаммы SCR-GH-F и SCR-GH-H, секреция соматотропина в которых направляется пре-про-областью α-фактора дрожжей или пре-про-областью белка HSP150, соответственно. При этом уровень секреции соматотропина штаммами SCR-GH-FF, SCR-GH-FFF, SCR-GH-HH и SCR-GH-HF составляет не менее 200 мг/л, что выше показателей штаммов SCR-H1 и SCR-H2 [RU 2009145487].
Штамм SCR-GH-FF депонируют во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как штамм Saccharomyces cerevisiae ВКПМ Y-3580.
Пример 8. Микробиологический синтез соматотропина человека с использованием штамма ВКПМ Y-3580
Для получения посевного материала штамм ВКПМ Y-3580 выращивают в среде YPD на качалке (250 об/мин) при температуре 28°С в течение 24 ч.
50 мл посевного материала используют для засева 3 л ферментера Anglicon, содержащего 950 мл среды YPD. Ферментацию проводят при температуре 28°С, аэрации 1 л/1 л/мин и скорости перемешивания 1000 об/мин. Через 24 часа после засева ферментера начинают подпитку водным раствором следующего состава (в граммах на литр): пептон 50, дрожжевой экстракт 50, сахароза 200; со скоростью 8 мл/ч и устанавливают рН-статирование культуры на уровне рН 6.8, используя для подтитровки растворы 10% серной кислоты и 10% NaOH. Общее время ферментации составляет 72 часа.
Количество секретируемого соматотропина человека штаммом ВКПМ Y-3580 в этих условиях составляет 2 г/л.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЗРЕЛОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE И ШТАММ-ПРОДУЦЕНТ ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА (ВАРИАНТЫ) | 2011 |
|
RU2446172C1 |
| СПОСОБ КОНСТРУИРОВАНИЯ ШТАММОВ ДРОЖЖЕЙ Saccharomyces cerevisiae - СТАБИЛЬНЫХ ПРОДУЦЕНТОВ СОМАТОТРОПИНА ЧЕЛОВЕКА, ШТАММ ДРОЖЖЕЙ Saccharomyces cerevisiae - СТАБИЛЬНЫЙ ПРОДУЦЕНТ СОМАТОТРОПИНА ЧЕЛОВЕКА (ВАРИАНТЫ) | 2009 |
|
RU2420567C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ЦЕЛЕВОГО СЕКРЕТИРУЕМОГО БЕЛКА В ДРОЖЖАХ Saccharomyces cerevisiae | 2012 |
|
RU2502805C1 |
| Фосфолипаза А2 для экспрессии в дрожжах (варианты) | 2018 |
|
RU2716087C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ЗРЕЛОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА, ШТАММ Saccharomyces cerevisiae - ПРОДУЦЕНТ ЗРЕЛОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА (ВАРИАНТЫ) | 2010 |
|
RU2427645C1 |
| ГИБРИДНЫЙ БЕЛОК, ОБЛАДАЮЩИЙ ПРОЛОНГИРОВАННЫМ ДЕЙСТВИЕМ, НА ОСНОВЕ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА (ВАРИАНТЫ), СПОСОБ ЕГО ПОЛУЧЕНИЯ И ШТАММ Saccharomyces cerevisiae ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТОГО СПОСОБА (ВАРИАНТЫ) | 2013 |
|
RU2515913C1 |
| Способ получения секретируемой полностью функциональной фосфолипазы А2 в дрожжах Saccharomyces cerevisiae, белок-предшественник для осуществления этого способа (варианты) | 2019 |
|
RU2728240C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА ПАУТИНЫ, СЛИТЫЙ БЕЛОК, РЕКОМБИНАНТНАЯ ДНК, ВЕКТОР ЭКСПРЕССИИ, КЛЕТКА-ХОЗЯИН И ШТАММЫ-ПРОДУЦЕНТЫ | 2010 |
|
RU2451023C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКА E7-HSP70 И ШТАММ ДРОЖЖЕЙ Saccharomyces cerevisiae ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2489481C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУСПЕНЗИЙ ГИДРОГЕЛЕВЫХ МИКРОЧАСТИЦ С ЗАДАННЫМИ РАЗМЕРАМИ НА ОСНОВЕ РЕКОМБИНАНТНОГО БЕЛКА ПАУТИНЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2478706C1 |
Изобретение относится к области биотехнологии и генной инженерии. Получен штамм дрожжей Saccharomyces cerevisiae, способный продуцировать секретируемый соматотропин человека. Данный штамм содержит под контролем промотора последовательность ДНК, кодирующую зрелый соматотропин человека, слитый в одной рамке считывания с лидерным пептидом. Лидерный пептид включает удвоенную про-область α-фактора дрожжей Saccharomyces cerevisiae. Он также может содержать утроенную про-область α-фактора дрожжей Saccharomyces cerevisiae, или удвоенную про-область белка HSP150 дрожжей Saccharomyces cerevisiae, или комбинацию указанных про-областей. Способ получения соматотропина человека предусматривает культивирование штамма-продуцента соматотропина человека. Применение изобретения обеспечивает повышение выхода целевого продукта. 2 н.п. ф-лы, 1 ил., 8 пр.
1. Способ микробиологического синтеза секретируемого соматотропина человека клетками дрожжей Saccharomyces cerevisiae, предусматривающий культивирование штамма-продуцента, содержащего последовательность ДНК, кодирующую зрелый соматотропин человека, находящуюся под контролем промотора, обеспечивающего экспрессию соматотропина человека в клетках дрожжей Saccharomyces cerevisiae, при этом зрелый соматотропин человека слит в одной рамке считывания с лидерным полипептидом, включающим сигнальный пептид и последовательность, выполняющую в клетках дрожжей функцию про-области, отличающийся тем, что в качестве про-области лидерного полипептида используют комбинацию либо двух-трех последовательно расположенных про-областей α-фактора дрожжей Saccharomyces cerevisiae, либо удвоенную про-область белка HSP150 дрожжей Saccharomyces cerevisiae, либо сочетание про-области белка HSP150 дрожжей Saccharomyces cerevisiae и про-области α-фактора дрожжей Saccharomyces cerevisiae.
2. Штамм дрожжей Saccharomyces cerevisiae ВКПМ Y-3580 - продуцент секретируемого соматотропина человека, предназначенный для осуществления варианта способа по п.1, предусматривающего использование двух последовательно расположенных про-областей α-фактора дрожжей Saccharomyces cerevisiae в качестве про-области лидерного полипептида, полученный на основе реципиентного диплоидного штамма Saccharomyces cerevisiae, содержащего гомозиготные мутации гена PGK1 и гена GAL80, путем трансформации реципиентного штамма экспрессионным вектором, содержащим ген PGK1, и находящуюся под контролем промотора GAL1 последовательность ДНК, кодирующую зрелый соматотропин человека, сигнальный пептид α-фактора дрожжей Saccharomyces cerevisiae и комбинацию двух последовательно расположенных про-областей α-фактора дрожжей Saccharomyces cerevisiae.
| TSIOMENKO AB et al., The nature of N-terminal signal sequence determines the type of intracellular distribution and effectiveness of export of human growth hormone in Saccharomyces cerevisiae, Mol Biol (Mosk) | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
| Литьевая форма для полимерных изделий со срезом впускных литников | 1978 |
|
SU763117A1 |
| GR 3036648 T3, 31.12.2001 | |||
| US 2007122876 A1, 31.05.2007 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОЛОГИЧНОГО ПОЛИПЕПТИДА В ДРОЖЖАХ Saccharomyces cerevisiae | 1990 |
|
RU2194758C2 |
Авторы
Даты
2012-09-10—Публикация
2011-07-06—Подача