Область техники, к которой относится изобретение
Изобретение относится к фармацевтической промышленности, а именно к химерным пептидам, первичная структура которых содержит по меньшей мере сегмент, который ингибирует протеазу NS3 вируса семейства Flaviviridae, они также включают в себя сегмент, проникающий в клетку, и они способны ингибировать или ослаблять вирусную инфекцию. Изобретение также относится к фармацевтическим соединениям, которые содержат химерные пептиды, для профилактики и/или лечения инфекции, вызываемой вирусами семейства Flaviviridae.
Описательная часть
Семейство Flaviviridae составлено оболочечными позитивными одноцепочечными РНК-содержащими вирусами, которые принадлежат к одному из трех родов: Flavivirus, Hepacivirus и Pestivirus. Род Flavivirus включает в себя более 70 вирусов, многие из них вызывают серьезные заболевания у людей и у других видов. В этот род входят вирус желтой лихорадки (YFV), вирус денге (DV), вирус японского энцефалита (JEV), вирус клещевого энцефалита (TBE), вирус Западного Нила (WNV), вирус энцефалита Сент-Луис (SLEV) и другие. Вирус гепатита C (HCV) является прототипом Hepacivirus. К членам рода Pestivirus авторы относят вирус бычьей вирусной диареи (BVDV), вирус классической лихорадки свиней (CSFV), вирус пограничной болезни (BDV) и другие.
Вирусы, относящиеся к другим родам семейства Flaviviridae, не проявляют перекрестную антигенную реактивность и показывают другие биологические свойства, однако они демонстрируют очевидные сходства в таких аспектах, как морфология вириона, организация генома и стратегия репликации (Leyssen, P., De Clercq, E., Neyts, J. 2000 Perspectives for the treatment of infections with Flaviviridae. Clin Microbiol Rev., 3: 67-82; Rice, C. M. 1996. Flaviviridae: the viruses and their replication, p. 931-960. In B. N. Fields, D. M. Knipe, and P. M. Howley (ed.), Fields virology, 3 rd ed., vol. 1. Lippincott-Raven Publishers, Philadelphia, Pa.; Westaway, E. G. 1987. Flavivirus replication strategy. Adv. Virus Res. 33: 45-90).
HCV представляет важную проблему для здравоохранения во всем мире. Согласно данным ВОЗ, приблизительно 3% населения земного шара инфицированы вирусом, что свидетельствует о том, что более 170 миллионов хронических носителей имеют риск развития цирроза и/или рака печени (Consensus Panel. EASL International Consensus Conference on Hepatitis C, Paris, 26-28 февраля 1999 года, Consensus Statement. J. Hepatol., 1999, 30, 956). Каждый год в мире отмечается приблизительно 3-4 миллиона новых случаев инфицирования HCV (Tan, S. L., Pause, A., Shi, Y. & Sonenberg, N. (2002) Nat. Rev. Drug Discov. 1,867-881). Не менее чем у 85% инфицированных пациентов развивается хроническая инфекция (Alter, M. J., E. E. Mast, L. A. Moyer, and H. S. Margolis. 1998. Hepatitis C. Infect. Dis. Clin. North Am. 12: 13-26). Хронический гепатит C часто заканчивается циррозом и/или раком, несмотря на то, имеет ли заболевание симптоматику или является бессимптомным. Катамнестические исследования, проводившиеся в течение 10-20 лет, показали развитие цирроза у 20-30% пациентов, и у 1-5% этих пациентов мог развиться рак в последующие 10 лет (Dutta, U., J. Kench, K. Byth, M. H. Khan, R. Lin, C. Liddle, and G. C.Farrell. 1998. Hepatocellular proliferation and development of hepatocellular carcinoma: a case-control study in chronic hepatitis C. Hum. Pathol. 29: 1279-1284; Pontisso, P., C. Belluco, R. Bertorelle, L. De Moliner, L. Chieco Bianchi, D. Nitti, M. Use, and A. Alberti. 1998. Hepatitis C virus infection associated with human hepatocellular carcinoma: lack of correlation with p53 abnormalities in Caucasian patients. Cancer 83: 1489-1494). Установлено, что число смертей за год, вызываемых HCV, к 2008 году может достигнуть в Соединенных Штатах 35000 (Dutta, U., J. Kench, K. Byth, M. H. Khan, R. Lin, C. Liddle, and G. C.Farrell. 1998. Hepatocellular proliferation and development of hepatocellular carcinoma: a case-control study in chronic hepatitis C. Hum. Pathol. 29: 1279-1284; Pontisso, P., C. Belluco, R. Bertorelle, L. De Moliner, L. Chieco Bianchi, D. Nitti, M. Use, and A. Alberti. 1998. Hepatitis C virus infection associated with human hepatocellular carcinoma: lack of correlation with p53 abnormalities in Caucasian patients. Cancer 83: 1489-1494).
В настоящее время, одобренными FDA способами лечения, направленными против HCV, являются монотерапия интерфероном и комбинированная терапия интерфероном и рибавирином (Dymock, B. W. Emerging Drugs 2001, 6(1), 13 и приведенные там ссылки). Недавно было одобрено применение пегилированных вариантов интерферона, которые увеличивают терапевтическую эффективность этих способов лечения, но они все еще далеки от идеала. Из-за серьезности этого заболевания, необходимы новые и более эффективные способы лечения.
Инфицирование людей Flavivirus опосредовано членистоногими, такими как клещи и москиты, которые являются причиной того, что эти заболевания так сложны для излечения (Monath, T. P., and F. X. Heinz. 1996. Flaviviruses, p. 961-1034. In B. N. Fields, D. M. Knipe, and P. M. Howley (ed.), Fields virology, 3rd ed., vol. 1. Lippincott-Raven Publishers, Philadelphia, Pa.). Neurophysiol. 106: 238-243.; Kaluzova, M., E. Eleckova, E. Zuffova, J. Pastorek, S. Kaluz, O. Kozuch, and M. Labuda. 1994. Reverted virulence of attenuated tick-borne encephalitis virus mutant is not accompanied with the changes in deduced viral envelope protein amino acid sequence. Acta Virol. 38: 133-140).
Желтая лихорадка по-прежнему является важной причиной геморрагической лихорадки, с показателями летальности до 50%, несмотря на то что вакцина уже доступна.
Вирус денге является пандемическим в тропических областях, и его появление является возрастающей проблемой для здравоохранения во всем мире. Установлено, что ежегодно отмечается приблизительно 100 миллионов случаев инфицирования вирусом лихорадки, а в эндемических областях проживают 2,5 миллиарда людей (Gubler, D.J. 1998. Clin. Microbiol. Rev. 11, 480-496.; Monath, T.P. (1994) Proc. Natl. Acad. Sci USA 91, 2395-2400). За период с 1990 по 1998 год среднее число случаев геморрагической лихорадки денге (DHF), о которых сообщалось в ВОЗ, ежегодно составляло 514139, включая 15000 смертельных случаев, хотя полагается, что реальный показатель заболеваемости в несколько раз выше. Однако ни вакцины, ни специфичные противовирусные способы лечения не являются коммерчески доступными. Комплекс вируса денге образован из четырех различных вирусов или серотипов (VD1-VD4), которые имеют генетическое и антигенное родство. DV передается человеку через москитов, главным образом Aedes aegypti. Инфекция вызывает разнообразные клинические проявления, варьирующие от бессимптомного и доброкачественного к недифференцированному лихорадочному заболеванию или более тяжелым проявлениям, таким как DHF и потенциально смертельный Денге-шок синдром (DSS). Наиболее тяжелые клинические проявления часто связаны с последовательным инфицированием двумя различными серотипами (Halstead, S.B. Neutralization and antibody-dependent enhancement of dengue viruses. Adv. Virus Res. 60: 421-67., 421-467, 2003. Hammon WMc. New haemorragic fever in children in the Philippines and Thailand. Trans Assoc Physicians 1960; 73: 140-155). Проведены эпидемиологические исследования, которые предоставили доказательства того, что последовательное инфицирование различными серотипами является фактором риска развития тяжелого заболевания (Halstead, S.B. Neutralization and antibody-dependent enhancement of dengue viruses. Adv. Virus Res. 60: 421-67., 421-467, 2003. Hammon WMc. New haemorragic fever in children in the Philippines and Thailand. Trans Assoc Physicians 1960; 73: 140-155). Объяснение этим феноменам доступно благодаря теории "антителозависимого усиления (ADE)", которая устанавливает, что это усиление инфекционности является следствием более эффективного проникновения вируса в клетку, опосредованного FC-рецептором инфицированных клеток (Halstead SB. Pathogenesis of dengue: challenges to molecular biology. Science 1988; 239: 476-481).
Другим Flavivirus является JEV, который является основной причиной вирусного энцефалита во всем мире. В Азии ежегодно встречается приблизительно 50000 случаев с высокой смертностью 30% и развитием продолжительных неврологических расстройств в 30% случаев (Kalita, J., and U. K. Misra. 1998. EEG in Japanese encephalitis: a clinicoradiological correlation. Electroencephalogr. Clin. Neurophysiol. 106: 238-243.; Kaluzova, M., E. Eleckova, E. Zuffova, J. Pastorek, S. Kaluz, O. Kozuch, and M. Labuda. 1994. Reverted virulence of attenuated tick-borne encephalitis virus mutant is not accompanied with the changes in deduced viral envelope protein amino acid sequence. Acta Virol. 38: 133-140).
Тяжелый энцефалит также вызывается другим Flavivirus, таким как TBEV, имеющим два подтипа: восточный тип с сопутствующей смертностью 20% и западный тип с 1-2% (Heinz, F. X., and C. W. Mandl. 1993. The molecular biology of tick-borne encephalitis virus. APMIS 101: 735-745.); энцефалит долины Мюррея (MVE) в Австралии (Mackenzie, J. S., and A. K. Broom. 1995. Australian X disease, Murray Valley encephalitis and the French connection. Vet. Microbiol. 46: 79-90); SLEV на западе Соединенных Штатов и WNV, который является эндемичным в Африке, Ближнем Востоке и Средиземноморье и который также вызвал недавние вспышки инфекции в Соединенных Штатах. Поскольку он появился в Соединенных Штатах в 1999 году, он распространился очень быстро, инфицировав приблизительно 15000 человек, и привел к более чем 600 смертельным случаям. Однако в настоящее время нет доступных вакцин или лекарственных средств, которые защищали бы от WNV (van der Meulen, K. M., Pensaert, M. B. and Nauwynck, H. J. (2005) West Nile virus in the vertebrate world. Arch. Virol. 150, 637-657).
Геморрагические проявления вызываются другими Flavivirus, такими как вирус омской геморрагической лихорадки (OHFV) в России, с показателем летальности в интервале от 0,5 до 3%, и вирус киасанурской лесной болезни (KFDV) в Индии (Monath, T. P., and F. X. Heinz. 1996. Flaviviruses, p. 961-1034. In B. N. Fields, D. M. Knipe, and P. M. Howley (ed.), Fields virology, 3rd ed., vol. 1. Lippincott-Raven Publishers, Philadelphia, Pa.).
Другой Flavivirus, вирус энцефаломиелита овец (LIV), инфицирует главным образом овец, хотя также сообщалось о случайных инфекциях человека (Davidson, M. M., H. Williams, and J. A. Macleod. 1991. Louping ill in man: a forgotten disease. J. Infect. 23: 241-249).
Pestivirus BVDV, CSFV и BDV вызывают серьезные заболевания у животных. У их соответствующих носителей они вызывают тяжелые повреждения, которые обычно приводят к смерти, несмотря на то что эти вирусы могут перекрещиваться с видами, вызывающими более легкие заболевания у других носителей. Часто инфекции передаются носо-ротовым или трансплацентарным путем. Последний ответственен за персистентные инфекции, которые угрожают остальной части домашнего скота (Edwards, S., P. M. Roehe, and G. Ibata. 1995. Comparative studies of border disease and closely related virus infections in experimental pigs and sheep. Br. Vet. J. 151: 181-187).
Предполагается, что члены семейства Flaviviridae совместно используют сходную стратегию репликации. Цикл вирусной репликации начинается с адгезии вируса к поверхности клетки-носителя. Показано, что в случае вируса денге, вирус связывается с гликозаминогликанами, которые могут являться начальным сайтом взаимодействия с клетками. Также показано, что вирус связывается c DC-SIGN, хотя вероятно, что роль этих молекул связана с концентрацией вируса на клеточной поверхности или с распространением вируса по вторичным сайтам репликации in vivo. После начального связывания вирус взаимодействует с высокоаффинными рецепторами и/или сорецепторами, которые опосредуют проникновение вируса в клетку с помощью эндоцитоза. В случае WNV, было установлено, что для этих целей может служить интегрин αvβ3 (Chu, J. J-H., and Ng, M.-L, 2004. Interaction of West Nile Virus with α v β 3 Integrin Mediates Virus Entry into Cells. J. Biol. Chem 279, 54533-54541). Также показано, что HCV связывается с клеточным рецептором CD81 (Pileri, P., Y. Uematsu, S. Campagnoli, G. Galli, F. Falugi, R. Petracca, A. J. Weiner, M. Houghton, D. Rosa, G. Grandi, and S. Abrignani. 1998. Binding of hepatitis C virus to CD81. Science 282: 938-941). После того как вирус локализуется во внутриклеточных пространствах, снижение уровня pH в пространстве индуцирует процесс слияния между вирусом и клеточной мембраной и этот процесс опосредуется структурными изменениями слитого белка оболочки вируса. Этот процесс приводит к опорожнению вирусного капсида в цитоплазму, куда позже высвобождается вирусная РНК.
В цитоплазме геномная РНК вируса взаимодействует посредством ее некодирующей 5' области (5'UTR) с рибосомой, приводя к трансляции вирусной уникальной открытой рамки считывания. Таким образом, синтезируется предшественник вирусного полипротеина, который в случае Flavivirus включает в себя три структурных белка (C, preM и E) и пять неструктурных белков (NS1-5). Затем этот полипротеин модифицируется со- и посттрансляционно, давая начало самостоятельным зрелым функциональным белкам вируса. РНК-зависимая РНК-полимераза вируса с соответствующими кофакторами продуцирует копии негативной-одноцепочечной РНК, которые затем используются в качестве матрицы для синтеза геномной позитивной-одноцепочечной вирусной РНК. Вирусные белки, участвующие в репликации, связаны с мембранными структурами, по-видимому, относящимися к эндоплазматическому ретикулуму (ЭР).
После того как репликация закончена, геномные ассоциаты РНК с нуклеокапсидом, незрелые вирионы почкуются в просвет ЭР (почкование происходит на мембране ЭР или родственных мембранных структурах, индуцированных вирусом), покрываясь липидной оболочкой, содержащей вирусные белки. Проходя по экзоцитозному пути, оболочечные белки гликозилируются и становятся зрелыми, приводя к результирующему высвобождению зрелых вирионов во внеклеточное пространство.
Репликация Flaviviridae требует протеазы NS3pro (локализующейся приблизительно в первых 180 остатках неструктурного белка NS3) для правильного процессинга полипротеина-предшественника, этот путь представляет собой привлекательную потенциальную мишень для разработки противовирусных лекарственных средств (Chappell, K. J., Nail, T. A., Stoermer, M. J., Fang, N. X., Tyndall, J. D., Fairlie, D. P. and Young, P. R. (2005) Site-directed mutagenesis and kinetic studies of the West Nile Virus NS3 protease identify key enzyme-substrate interactions. J. Biol. Chem. 280, 2896-2903. Shiryaev, S.A., Ratnikov, B.I., Chekanov, A.V., Sikora, S., Rozanov, D.V., Godzik,A., Wang, J., Smith, J.W., Huang, Z., Lindberg, I., Samuel, M.A., Diamond, M.S. and Alex Y. Strongin, A.Y., 2006. Cleavage targets and the D-arginine-based inhibitors of the West Nile virus NS3 processing proteinase. Biochem. J. 393, 503-511. Kolykhalov, A. A.; Mihalik, K.; Feinstone, S. M.; Rice, C. M. J. Virol. 2000, 74, 2046; Bartenschlager, R.; Lohmann, V. J. Gen. Virol. 2000, 81, 1631. Matusan, A. E., Kelley, P. G., Pryor, M. J., Whisstock, J. C., Davidson, A. D. and Wright, P. J. (2001) J. Gen. Virol. 82, 1647-1656).
В Flavivirus эта протеаза ответственна за протеолитическое расщепление в области связей NS2A/NS2B, NS2B/NS3, NS3/NS4A и NS4N/NS5, а также за внутреннее расщепление в области C, NS3 и NS4A (Chambers, T. J., Nestorowicz, A., Amberg, S. M. and Rice, C. M. (1993) Mutagenesis of the yellow fever virus NS2B protein: effects on proteolytic processing, NS2B-NS3 complex formation, and viral replication. J. Virol. 67, 6797-6807. Jan, L. R., Yang, C. S., Trent, D. W., Falgout, B. and Lai, C. J. (1995) Processing of Japanese encephalitis virus non-structural proteins: NS2B-NS3 complex and heterologous proteases. J. Gen. Virol. 76, 573-580. Lobigs, M. (1993) Flavivirus premembrane protein cleavage and spike heterodimer secretion require the function of the viral proteinase NS3. Proc. Natl. Acad. Sci. U.S.A. 90, 6218-6222. Yamshchikov, V.F. and Compans, R. W. (1994) Processing of the intracellular form of the west Nile virus capsid protein by the viral NS2B-NS3 protease: an in vitro study. J. Virol. 68, 5765-5771).
В HCV, NS3pro опосредует протеолитический процессинг вирусного полипротеина на сегменте, находящемся между белками NS2-NS5B (R. Bartenschlager, 1999, The NS3/4A proteinase of the hepatitis C virus: unravelling structure and function of an unusual enzyme and a prime target for antiviral therapy. J. Viral Hepat. 6, 165-).
Помимо центральной роли, осуществляемой протеазой NS3pro в цикле вирусной репликации, осуществляющем процессинг вирусных белков, этот белок может также осуществлять процессинг клеточных субстратов, и, следовательно, он может быть задействован в различных механизмах клеточного повреждения и патогенеза (Shiryaev, S. A., Ratnikov, B. I., Chekanov, A. V., Sikora, S., Rozanov, D. V., Godzik, A., Wang, J., Smith, J. W., Huang, Z., Lindberg, I., Samuel, M. A., Diamond, M. S. and Strongin, A. Y. (2005) The cleavage targets and the (D)-arginine-based inhibitors of the West Nile virus NS3 processing proteinase. Biochem. J. 393, 503-511).
Таким образом, показано, что протеаза NS3 из WNV продуцирует протеолитическое расщепление в нейрональном основном миелиновом белке (MBP). В отношении DV и WNV предполагалось, что NS3 задействован в индукции вирус-опосредованного апоптоза (Ramanathan, M. P., Chambes, J. A., Pankhong, P., Chattergoon, M., Attatippaholkun, W., Dang, K., Shah, N. and Weiner, D. B. (2005) Virology doi:10/1016/j. virol. 2005.08.043).
Для оптимального функционирования, протеаза NS3 должна взаимодействовать с другим вирусным белком или кофактором, белком NS2B в Flavivirus и NS4A в Hepacivirus и Pestivirus. В присутствии DV, NS2B индуцирует увеличение протеолитической активности NS3 от 3300 до 6600 раз (Yusof, R., Clum, S., Wetzel, M., Murthy, H.M. & Padmanabhan, R., 2000. J. Biol. Chem. 275, 9963-9969).
В HCV, связывание NS3 с NS4A необходимо для протеолитического расщепления в области NS3/4A, NS4A/B и NS4B/5A, и это увеличивает эффективность процессинга в области NS5A/B (Bartenschlager R, Ahlborn LL, Mows J, Jacobsen H. Kinetic and structural analyses of hepatitis C virus poly protein processing. J Virol 1994; 6: 5045-5055. Failla C, Tomei L, De Francesco R. Both NS3 and NS4A are required for proteolytic processing of hepatitis c virus nonstructural proteins. J Virol 1994; 6: 3753-3760. Lin C, Pragai BM, Grakoui A, Xu J, Rice CM. Hepatitis C virus NS3 serine proteinase: trans-cleavage requirements and processing kinetics. J Virol 1994; 6: 8147-8157. Tanji Y, Hijikata M, Satoh S, Kaneko T, Shimotohno K. Hepatitis C virus-encoded nonstructural protein NS4A has versatile functions in viral protein processing. J Virol 1995; 6: 1575-1581). Добавление фрагмента NS4A в NS3pro в 10-кратном молярном избытке увеличивает коэффициент каталитической эффективности Kcat/Km в приблизительно 40 раз (Shimizu, Y., Yamaji, K., Masuho, Y., Yokota, T., Inoue, H., Sudo, K., Satoh, S. и Shimotohno, K. 1996. Identification of the Sequence on NS4A Required for Enhanced Cleavage of the NS5A/5B Site by Hepatitis C Virus NS3 Protease. J. Virol 70, 127-132).
Кристаллические структуры NS3pro и комплекс NS3pro-NS2B из DV и комплекс, образованный NS3pro-NS2B, из WNV с пептидным ингибитором были выявлены экспериментально (Murthy, H.M., Clum, S. & Padmanabhan, R., 1999. J. Biol. Chem. 274, 5573-5580. Murthy, H.M., Judge, K., DeLucas, L. & Padmanabhan, R., 2000. J. Mol. Biol. 301, 759-767. Erbel P, Schiering N, D'Arcy A, Renatus M, Kroemer M, Lim SP, Yin Z, Keller TH, Vasudevan SG, Hommel U., 2006. Structural basis for the activation of flaviviral NS3 proteases from dengue and West Nile virus. Nat. Struct Mol. Biol.). Подобным образом, также были выявлены кристаллические структуры NS3pro и комплекс NS3pro/NS4A из HCV (Love, R.A., Parge, H.E., Wickersham, J.A., Hostomsky, Z., Habuka, N., Moomaw, E.W., Adachi, T., Hostomska, Z., 1996. The crystal structure of hepatitis C virus NS3 proteinase reveals a trypsin-like fold and a structural zinc binding site. Cell. 87, 331-342. Kim, J.L., Morgenstern, K.A., Lin, C., Fox, T., Dwyer, M.D., Landro, J.A., Chambers, S.P., Markland, W., Lepre, C.A., O'Malley, E.T., Harbeson, S.L, Rice, C.M., Murcko, M.A., Caron, P.R., Thomson, J.A., 1996. Crystal structure of the hepatitis C virus NS3 protease domain complexed with a synthetic NS4A cofactor peptide. Cell. 87, 343-535. Erratum in: Cell, 89: 159, 1997).
Протеаза NS3pro принимает подобную химотрипсину укладку цепи, которая включает в себя две бета-баррели и каталитическую триаду His51-Asp75-Ser135, локализующуюся в щели, образованной между этими доменами. Связывание белка NS2B индуцирует большие изменения в трехмерной структуре NS3pro, влияющие на оба N- и C-концевых домена и включающие изменения локализации и протяженности вторичных структурных сегментов.
Структура комплекса, образованного под воздействием активной протеазы NS3pro-NS2B с пептидным ингибитором, показывает, что NS2B образует пояс вокруг NS3pro, принимая, главным образом, удлиненную структуру и включая в себя пять бета-цепей.
Первые три цепи связаны с бета-цепями белка NS3: цепь Trp53-Ala58 (нумерация WNV) проходит антипараллельно к бета-цепи NS3, соответствуя Gly21-Met26 N-терминальной бета-барреле, а бета-цепи Glu67-Ile68 и Arg74-Asp76 параллельны бета-цепям B2a и B2b в C-концевой бета-барреле NS3.
Цепи 4 и 5 образуют бета-шпильку, которая взаимодействует со связывающим субстрат сайтом, контактирующим с петлей E1b-F1 N-терминальной бета-баррели. Упаковка NS2B ниже бета-шпильки E2b-F2 C-концевой баррели индуцирует конформационное изменение в этой области NS3, которое приводит к расположению остатков, важных для распознавания субстрата (Gly151, Gly153 и Tyr161). Остаток Tyr161 осуществляет пи-катионные взаимодействия с аргинином в положении P1. Отрицательный электростатический потенциал, связанный с карбонильными группами основных цепей остатков Asp82-Gly83, и атом Od1 Asn84 из NS2B делает благоприятным взаимодействие с положительным зарядом гуанидиновой группы аргинина в положении P2. Таким образом, они вносят свой вклад в конформацию сайта S2. Таким образом, связывание NS2B с NS3 дополняет жизненно важные элементы ферментативно-активного сайта, и это также вносит свой вклад в термодинамическую устойчивость упаковки белка. Эти факты обеспечивают структурную основу для понимания процесса активации этой протеазы. В случае HCV, активация NS3 опосредуется связыванием бета-цепи Thr20-Leu31 из NS4A, которая является структурно эквивалентной цепи 1 из NS2B у Flavivirus (Shimizu, Y,, Yamaji, K., Masuho, Y., Yokota, T., Inoue, H., Sudo, K., Satoh, S. and Shimotohno, K. 1996. Identification of the Sequence on NS4A Required for Enhanced Cleavage of the NS5A/5B Site by Hepatitis C Virus NS3 Protease. J. Virol 70, 127-132).
Среди существующих в настоящее время подходов, используемых для получения противовирусных молекул, активных в отношении Flaviviridae, подходы, основанные на ингибировании NS3, сфокусированы главным образом на разработке ингибиторов, направленных на активный сайт. По-видимому, эти подходы являются весьма многообещающими, что подтверждается недавними результатами, полученными в разработке лекарственных средств против HCV. Однако эти данные также ясно показали затруднения, характерные для этих подходов. Одним из наиболее очевидных является генерация "ускользнувших" мутантов. Полимеразы вирусов РНК имеют относительно низкую точность, и, в случае HCV, они включают мутацию в копию вирусного генома. Это приводит к факту, что молекулы, созданные с помощью этого способа, несмотря на их высокую активность, могут иметь ограниченный срок службы. Это приводит к внедрению терапевтических вмешательств, основанных на смесях лекарственных средств, ввиду потребности в противовирусных лекарственных средствах. Также установлено, что "ускользнувшие" мутанты, появившиеся в ответ на применение одного лекарственного средства, могут часто избегать противовирусной активности других лекарственных средств, нацеленных на тот же активный сайт.
В настоящем изобретении описаны новые способы, направленные на разработку антивирусных агентов против Flaviviridae, которые основаны на концепции ингибирования процесса активации протеазы NS3. Ключевой подход этой концепции состоит в разработке пептидных молекул и/или лекарственных средств, способных блокировать взаимодействие между NS3 и его кофактором (NS2B или NS4A), и, следовательно, способных препятствовать правильной упаковке активной протеазы NS3. Такие молекулы способны связываться с областями протеазы NS3, которые участвуют во взаимодействии с кофактором, и конкурируют с ним и/или стабилизируют структуру неактивной протеазы.
Преимущество настоящего изобретения состоит в том, что, как ожидается, вероятность генерации "ускользнувших" мутантов, в отношении которых активны эти молекулы, будет гораздо меньшей, по сравнению с теми ингибиторами активной протеазы, которые конкурируют с субстратом за активный сайт. Молекулы согласно настоящему изобретению связываются со связывающими сайтами NS3, которые участвуют во взаимодействиях белок-белок, необходимых для цикла вирусной репликации, поэтому мутации, генерируемые в этих областях NS3, должны иметь дополнительные компенсаторные мутации в кофакторе.
Другое преимущество состоит в высокой специфичности ингибирующей активности, проявляемой этими молекулами. Это наблюдается вследствие того, что сайты их связывания на NS3 в основном специфичны для вирусной протеазы и они не присутствуют на сериновых протеазах носителя. Кроме того, сериновые протеазы носителя имеют активные сайты, проявляющие специфичность, значительно подобную NS3, и, следовательно, они могут быть потенциальными мишенями для токсичности лекарственных средств, блокирующих активный сайт.
В настоящем изобретении авторы описывают химерные пептидные молекулы, которые ингибируют инфекции, вызванные Flaviviridae, и первичная структура которых может быть описана согласно следующей формуле:
[P]-[L1]-[I]-[L2]-[T] или [I]-[L3]-[P]-[L4]-[T],
где [P] является аминокислотной последовательностью "проникающего в клетку пептида", обычно из 10-30 аминокислот, которая обладает способностью допускать интернализацию целой пептидной молекулы в цитоплазму клетки и получать доступ к контактированию с гранулярной эндоплазматической сетью (ШЭР); [L1, L2, L3, L4] являются линкерными последовательностями из 0-6 остатков; [I] является последовательностью ингибитора активации NS3pro, включающей остатки, которые устанавливают контакты по меньшей мере с одной аминокислотой из бета-цепей B2a и B2b C-концевой бета-баррели или из бета-цепи A1 N-терминальной бета-баррели белка NS3pro из Flavivirus (или соответствующими структурно эквивалентными областями Pestivirus или Hepacivirus) в его активной или неактивной конформации; [T] является аминокислотной последовательностью из 0-10 остатков, которая является обычно одним или двумя сигналами задержки в ЭР (подобно последовательностям KDEL, KKXX и LRRRRL), или последовательностью XRR со способностью связывать субстрат-связывающие сайты P1 и P2 протеазы NS3pro Flavivirus.
В частности, авторы показали, что пептиды, которые были разработаны согласно настоящему изобретению, способны ингибировать вирусную инфекцию, вызываемую DV.
Катионные пептиды, проникающие в клетку
В настоящем изобретении описана разработка химерных пептидов, которые способны ингибировать вирусную инфекцию, вызванную вирусами семейства Flaviviridae. Разработанные пептиды содержат сегмент [I], который ингибирует активацию вирусной протеазы NS3pro. Однако в настоящем изобретении авторы показали, что синтетические пептиды с аминокислотными последовательностями, соответствующими сегменту [I], не способны проникать через клетки-мишени, и следовательно, они не ингибируют вирусную инфекцию в линиях клеток и in vivo. Ингибирование вирусной инфекции достигается с помощью комбинирования сегмента [I] с сегментом [P], проникающим в клетку.
Множество пептидов, полученных из некоторых белков, обладает способностью проникать в клетки и получать доступ в цитоплазму и ядро. Эти пептиды известны как проникающие в клетку пептиды или домены трансдукции белка (PTD) (Joliot, A., and Prochiantz, A. (2004) Transduction peptides: from technology to physiology. Nat. Cell Biol. 6, 189-96. Snyder, E. L., and Dowdy, S. F. (2004) Cell penetrating peptides in drug delivery. Pharm. Res. 21, 389-93. Deshayes, S., Morris, M. C., Divita, G., and Heitz, F. (2005) Cellpenetrating peptides: tools for intracellular delivery of the Papeutics. Cell. Mol. Life Sci. 62, 1839-49). К наиболее изученным PTD относятся катионные пептиды, полученные из белков, таких как фактор транскрипции ВИЧ TAT, homeobox antennapedia (пенетратин) Drosophila melanogaster и белок VP22 вируса простого герпеса. К этим пептидам раскрылся большой интерес в качестве потенциальных носителей для введения транспортируемых молекул в клетки, для усиления их биологической активности, притом что эти транспортные грузы очень разнообразны в природе как малые подобные лекарственным средствам молекулы или гены и белки. Потенциал PTD в качестве векторов для молекул с терапевтическим интересом был показан в системах клетки, а также в животных моделях (Beerens, A. M., Al Hadithy, A. F., Rots, M. G., and Haisma, H. J. (2003) Protein transduction domains and their utility in gene therapy. Curr. Gene Ther. 3, 486-94. Wadia, J. S., and Dowdy, S. F. (2003) Modulation of cellular function by TAT mediated transduction of full length proteins. Curr. Protein Pept. Sci. 4, 97-104. Wadia, J. S., and Dowdy, S. F. (2005) Transmembrane delivery of protein and peptide drugs by TAT-mediated transduction in the treatment of cancer. AdV. Drug Delivery ReV. 57, 579-96. Rudolph, C., Schillinger, U., Ortiz, A., Tabatt, K., Plank, C., Muller, R. H., and Rosenecker, J. (2004) Application of novel solid lipid nanoparticle (SLN)-gene vector formulations based on a dimeric HIV-1 TAT-peptide in vitro and in vivo. Pharm. Res. 21, 1662-9).
Проведено значительное число исследований для объяснения механизмов, с помощью которых эти пептиды могут получать доступ в цитоплазму и ядро, проходя через биологические барьеры, образованные системами клеточных мембран, такие как плазматическая мембрана, мембраны внутриклеточных пространств и ядра. Недавно было показано, что множество ранее зарегистрированных наблюдений в культурах клеток относительно клеточной локализации и проникновения в клетки PTD при низкой и физиологической температуре было обусловлено артефактами, вызванными процедурами фиксации и неспецифичным связыванием пептидов с плазматической мембраной (Richard, J. P., Melikov, K., Vives, E., Ramos, C., Verbeure, B., Gait, M. J., Chernomordik, L. V., and Lebleu, B. (2003) Cellpenetrating peptides. A reevaluation of the mechanism of cellular uptake. J. Biol. Chem. 278, 585-90. Vives, E., Richard, J. P., Rispal, C., and Lebleu, B. (2003) TAT peptide internalization: seeking the mechanism of entry. Curr. Protein Pept. Sci. 4, 125-32).
Новые результаты позволяют предположить, что важную роль в проникновении PTD в клетки играет эндоцитоз. Однако подробное и общепризнанное описание внутриклеточного транспорта этих пептидов все еще не появилось.
Изначально сообщалось, что слитые с пептидом TAT белки проникают в клетки, проходя к нейтральным кариосомам через кавеолу плазматической мембраны, но более поздние исследования показали, что нет необходимости в наличии кавеолы и проникновение пептида TAT осуществляется посредством макропиноцитоза (Ferrari, A., Pellegrini, V., Arcangeli, C., Fittipaldi, A., Giacca, M., and Beltram, F. (2003) Caveolae-mediated internalization of extracellular HIV-1 tat fusion proteins visualized in real time. Mol. Ther. 8, 284-94. Wadia, J. S., Stan, R. V., and Dowdy, S. F. (2004) Transducible TAT-HA fusogenic peptide enhances escape of TAT-fusion proteins after lipid raft macropinocytosis. Nat. Med. 10, 310-5). Согласованно с постулируемым проникновением в клетку, опосредованным эндоцитозом, PTD обнаруживались в ранних и рециркулирующих эндосомах. Однако биологическая активность, проявляемая молекулами, ассоциированными с PTD, указывает, что эти пептиды должны по меньшей мере частично выводиться из внутриклеточных пространств с помощью все еще неизвестного механизма, получая доступ в цитозоль. Сообщалось о солокализации интернализованного пептида TAT с маркером Golgi BODIPY-ceramide согласованно с недостатком его обнаружения в более поздних эндосомах и лизосомах, маркированных Lysotracker (Fischer, R., Kohler, K., Fotin-Mleczek, M., and Brock, R. 2004. A stepwise dissection of the intracellular fate of cationic cellpenetrating peptides. J. Biol. Chem. 279, 12625-35).
Эти данные позволяют предположить, что эти пептиды способны транспортироваться к Golgi непосредственно из ранних эндосом, что совместимо с потенциальным проникновением пептида в цитозоль из ЭР, которому предшествует ретроградный транспорт пептидов из Golgi. Однако в других исследованиях сообщается о солокализации пептидов в кислых поздних внутриклеточных структурах и в лизосомах. О подобных результатах сообщалось для пептида TAT, октааргинина, TAT белка и конъюгатов липосом с пептидом TAT (Al-Taei, S., Penning, N. A., Simpson, J. C., Futaki, S., Takeuchi, T., Nakase I., and Jones, A. T. 2006. Intracellular Traffic and Fate of Protein Transduction Domains HIV-1 TAT Peptide and Octaarginine. Implications for Their Utilization as Drug Delivery Vectors. Bioconjugate Chem. 17, 90-100. Fretz, M. M., Koning, G. A., Mastrobattista, E., Jiskoot, W., and Storm, G. (2004) OVCAR-3 cells internalize TAT-peptide modified liposomes by endocytosis. Biochim. Biophys. Acta 1665, 48-56. Vendeville, A., Rayne, F., Bonhoure, A., Bettache, N., Montcourrier, P., and Beaumelle, B. (2004) HIV-1 Tat enters T cells using coated pits before translocating from acidified endosomes and eliciting biological responses. Mol. Biol. Cell 15, 2347-60).
Однако возможно, что PTD способны использовать различные механизмы проникновения в клетки и внутриклеточного транспорта, в зависимости от нескольких факторов, таких как тип клетки, природа PTD, температура, транспортируемый груз и т.д.
Подробное описание изобретения
В настоящем изобретении описано два топологических варианта химерных пептидов, которые ингибируют вирусную инфекцию, вызываемую Flaviviridae:
[P]-[L1]-[I]-[L2]-[T] или [I]-[L3]-[P]-[L4]-[T].
В качестве проникающего пептида [P] предпочтительно выбирают, но не ограничивась ими, катионные пептиды со способностью переносить транспортируемые молекулы в клетки. По-возможности выбирают такие катионные пептиды, как пенетратин, полиаргинины из 7-10 остатков, такие как нонапептид R9 или декапептид R10, или пептид TAT, хотя может быть выбрана любая другая пептидная последовательность между остатками с 10 по 30, показывающая подобную способность проникновения. Эти проникающие катионные пептиды обладают способностью проникать в цитоплазму клетки посредством эндоцитоза, который может включать в себя транспорт через ЭР. Это свойство благоприятно для биологической активности таких пептидов, поскольку оно гарантирует локализацию пептида вблизи ШЭР, в месте, где осуществляется синтез и процессинг полипротеина предшественника, и определяет мишень для противовирусной активности пептида.
В альтернативном варианте, в качестве сегментов [P] могут быть использованы другие проникающие в клетку пептиды, такие как катионные дендримерические пептиды или пептиды, включающие D-аминокислоты, которые являются очень устойчивыми к протеолитическому разложению. Катионные пептиды также гарантируют хорошее биораспределение пептидов согласно настоящему изобретению in vivo, позволяя достичь их благоприятной эффективной концентрации в органах и тканях, инфицированных Flaviviridae, до более высокого уровня в сравнении с большими молекулами, такими как моноклональные антитела. Одним из примеров может служить использование пептидов, проникаемых через гематоэнцефалический барьер (BBB), для лечения инфекций Flaviviridae, вызывающих энцефалит, таких как TBE, WNV, JEV, SLEV и КВ. Молекулярный транспорт через BBB является значительной проблемой даже для малых лекарственных средств, предназначенных для лечения внутримозговых заболеваний (Temsamani, J. and Vidal, P. 2004. The use of Cell-penetrating peptides for drug delivery. Drug Discov. Today 9, 1012-1019).
Последовательность [I], ингибирующая протеазу NS3pro, обладает способностью ингибировать или модифицировать взаимодействие между белками NS3 и NS2B из Flavivirus (или между NS3 и NS4A из Hepacivirus и Pestivirus), и, таким образом, она воздействует на правильную упаковку NS3pro, что является необходимым для процесса активации протеазы. В одном варианте осуществления настоящего изобретения [I] состоит из последовательности Asp50-Glu62 белка NS2B из DV2 или его гомологичных последовательностей из другого Flavivirus. Эта последовательность включает в себя остатки, соответствующие бета-цепи 1 белка NS2B, который устанавливает контакты с остатками, расположенными в N-терминальной бета-барреле активного белка NS3pro. Таким образом, пептиды согласно топологии, описанной в настоящем изобретении, комплектуют с нативной последовательностью белка кофактора NS2B во время упаковки белка NS3pro для принятия им активной конформации. Это приводит к образованию неактивных комплексов NS3pro-пептид, поскольку полная активация требует структурных перестановок не только в N-концевом домене, но также и в бета-барреле два C-конца. Протеазная активация будет нуждаться в дополнительном связывании области Glu66-Ile86 белка NS2B с C-концевым доменом NS3pro. Кроме того, связывание сегмента [I] служит в качестве якоря для пептидов согласно настоящему изобретению к белку NS3 таким образом, чтобы N- или C-концы этих пептидов были способны изменять поверхностную топографию NS3 и препятствовать его взаимодействиям с белками вируса и/или носителя. Такие взаимодействия включают в себя распознавание субстрата и/или другие взаимодействия, относящиеся к конформации и/или функционированию вирусного комплекса репликации. Таким образом, в одном варианте осуществления настоящего изобретения сегмент [P], соответствующий первому топологическому варианту, является поли-D-аргинином, который, помимо того что обладает свойством проникать в клетку, также является ингибитором NS3pro протеазы Flavivirus (Shiryaev, S.A., Ratnikov, B.I., Chekanov, A.V., Sikora, S., Rozanov, D.V., Godzik.A., Wang, J., Smith, J.W., Huang, Z., Lindberg, I., Samuel, M.A., Diamond, M.S. and Alex Y. Strongin, A.Y., 2006. Cleavage targets and the D-arginine-based inhibitors of the West Nile virus NS3 processing proteinase. Biochem. J. 393, 503-511). Таким образом, связывание сегмента/якоря [I] с NS3pro улучшает соответствие пептидов полиArg с субстрат-связывающим сайтом протеазы, хорошо соответствуя той же цепи, закрепленной с помощью пептида (цис-ингибирование) или другой цепи (транс-ингибирование). Аналогичным образом, пептиды, ингибирующие Hepacivirus и Pestivirus, включают в себя в качестве [I] последовательности сегмент, соответствующий области Thr20-Leu31 белка NS4A (нумерация HCV), который является структурно эквивалентным бета-цепи 1 белка NS2B из Flavivirus.
Во втором варианте осуществления, который относится к Flavivirus, сегмент [I] не относится ни к какому специфичному сегменту последовательности NS2B, но заключен в последовательности пептида со способностью связывать белок NS3pro и стабилизировать N-концевую баррель в ее неактивной конформации. В этом случае последовательность пептида устанавливает контакты с сегментом, соответствующим Tyr23-Tyr33 белка NS3pro из DV2, или гомологичной областью, соответствующей другому Flavivirus. Кроме того, сегмент [I] также устанавливает стабилизирующие структурные контакты с остатками сегментов Ala1-Gly14 и Ala56-Met59 белка NS3pro. Таким образом, эти пептиды стимулируют их ингибирующий эффект, препятствуя нативной упаковке белка NS3, индуцируя путь упаковки, приводящий к неактивной конформации протеазы.
Такие [I] последовательности можно получить с помощью теоретических способов и/или экспериментальных способов, в которых используются комбинаторные библиотеки. В случае разработки с помощью теоретических способов, изобретение предполагает применение одного или различных способов компьютерного молекулярного моделирования и использование трехмерных структурных моделей белка NS3pro в его неактивной конформации. Используя способ(ы) компьютерного моделирования и пространственные координаты модели трехмерной структуры неактивного белка NS3pro, возможно моделирование основной цепи полипептида в растянутой конформации, которая образует антипараллельную бета-цепь с сегментом, соответствующим бета-цепи A1 N-терминальной бета-баррели. Кроме того, также возможно моделирование боковых цепей в цепи полипептида таким образом, что химическая идентичность этих боковых цепей и ее конформеры будут приводить к энергетически благоприятным атомным контактам. Настоящее изобретение включает в себя комбинированное исследование, с помощью компьютерных средств, последовательности и конформационного пространства пептида, ротамерного пространства боковой цепи пептида, а также протеазы и выбора наиболее благоприятных вариантов пептида согласно энергетической оценке полученных моделей, которая показывает потенциально более высокое сродство взаимодействия пептид-белок.
Координаты, соответствующие неактивным структурным моделям NS3pro, могут быть получены из экспериментальных данных, полученных с помощью способов дифракции рентгеновских лучей и/или ЯМР, или с помощью моделей, полученных с помощью способов компьютерного моделирования. В случае DV2, координаты можно получить из файла 1BEF из Банка данных по белкам (PDB). Для другого Flavivirus, можно получить трехмерные модели с помощью способа моделирования гомологии.
В настоящем изобретении авторы описывают последовательность [I]: QWPALPKIEAQDG, которая была разработана согласно второму варианту осуществления настоящего изобретения. На фиг.1D показана компьютерная модель трехмерной структуры комплекса NS3pro-[I], соответствующего этому варианту осуществления. Согласно этой модели, сегмент [I] принимает растянутую структуру бета-цепи, связанную с сегментом Gly29-Y33 из NS3pro (нумерация DV2).
Дополнительно, можно использовать комбинаторные библиотеки синтетических пептидов или библиотеки отображенных пептидов фагов для получения [I] последовательности со свойствами, подобными свойствам пептидов, описанных во втором варианте осуществления настоящего изобретения. В этом случае рекомбинантный белок NS3pro используется в качестве мишени для выбора лиганда или биопаннинга.
В другом варианте осуществления настоящего изобретения [I] сегмент состоит из последовательности Ser70-Gly82 белка NS2B из DV2 или из его гомологичных последовательностей другого Flavivirus. Эта последовательность содержит бета-цепи 3 и 4 белка NS2B, которые контактируют и являются частью активной протеазы NS3pro. Таким образом, пептиды согласно топологии, описанной в настоящем изобретении, конкурируют с соответствующим сегментом белка кофактора NS2B во время упаковки белка NS3 в его активную конформацию и препятствуют протеолитическому процессингу в области соединения NS2B-NS3. Это приводит к образованию неактивных комплексов NS3pro-пептид вследствие того, что эти пептиды препятствуют правильной конфигурации субстрат-связывающего сайта, в частности, в области сайта P2, который является необходимым для каталитической активности фермента.
Кроме того, связывание сегмента [I], соответствующего пептидам настоящего изобретения, служит якорем для белка NS3 таким образом, что N-концевой или C-концевой удлиненные сегменты пептидов могут модифицировать поверхностную топографию NS3 и препятствовать взаимодействию этого белка с другими белками вируса или носителя.
В варианте осуществления, относящемся к одному из предыдущих (пептид 10 в таблице 1), сегмент [I] состоит из последовательности Ser70-Ile86 белка NS2B из DV2 или его гомологичных последовательностей другого Flavivirus. Эта область включает в себя, помимо бета-цепей 3 и 4, также бета-цепь 5 из NS2B. В этом случае пептиды, соответствующие первому топологическому варианту, включают в себя C-концевой удлиненный сегмент, включающий сегмент [L2] 3 или 4 остатков и сегмент [T], состоящий из трипептида XRR, с C-концевой карбоксильной группой. Последовательности этих пептидов допускают их связывание с белком NS3, принимающим активную конформацию, бета-цепь 5 и петля между цепями 4 и 5 гарантируют правильное формирование сайта P2.
Кроме того, связывание сегмента [I] облегчает структурные изменения в бета-баррели C-конца, которые являются необходимыми для активации, такие как изменение ориентации бета-шпильки E2b-F2, что обеспечивает расположение важных остатков, участвующих в распознавании субстрата, таких как Gly151, Gly153 и Tyr161. Однако сформированный комплекс является неактивным, поскольку сегмент [L2] служит в качестве стабилизирующего линкера, обеспечивающего дополнительное связывание сегмента [T] на субстрат-связывающий сайт, с расположением дипептида RR в пределах положений S1 и S2. Таким образом, активный сайт протеазы становится блокированным с помощью пептида.
Сегменты [L1], [L2], [L3] и [L4] согласно настоящему изобретению являются линкерными последовательностями из 0-6 остатков, которые присоединяют сегмент [P], [I] и [T], в зависимости от топологического варианта. Эти линкерные сегменты содержат главным образом малые и/или полярные аминокислоты (Gly, Ser, бета-Ala), которые обеспечивают гибкость. Эти линкерные сегменты также могут состоять из последовательностей, способных благоприятно взаимодействовать с активными групами белка NS3pro, обеспечивая пептиды согласно настоящему изобретению дополнительным стабилизирующим эффектом.
Сегменты [T] согласно настоящему изобретению являются последовательностями из 0-10 аминокислот, локализованных в C-концах пептидов. В варианте осуществления сегмент [T] является сигналом задержки ЭР, подобно последовательности KDEL. Добавление этого сигнала облегчает транспорт пептидов с помощью ретроградного транспорта в ЭР. Увеличение концентрации пептида в ЭР обеспечивает усиление транспорта пептидов в цитозоль. Это приводит к увеличению эффективной концентрации пептида в просвете ЭР, где происходит синтез вирусного полипротеина и, в частности, синтез NS3pro.
Включение сигнала KDEL в последовательность пептида соответствует наличию катионных проникающих в клетку пептидов в качестве сегментов [P], поскольку ретроградный транспорт через ЭР является предполагаемым путем проникновения катионных пептидов в цитозоль. Этот путь проникновения задействует транспорт пептидов от ранних эндосом до ЭР через сеть транс-Golgi (TGN). Последовательность KDEL взаимодействует с рецептором KDEL, находящимся в TGN, который транспортирует пептид к ЭР, куда он высвобождается.
Транспорт пептида из просвета ЭР в цитозоль явялется эффективным процессом, который осуществляется через каналы, находящиеся на мембране ЭР, образованные с помощью белка Sec61 из комплекса транслокона. Этот способ проникновения в цитозоль используется бактериальными токсинами, такими как токсин холеры, рицин и экзотоксин А Pseudomonas и т.д.
Использование сегмента на основе шпильки FG в качестве проникающего в клетку пептида. Ингибирующий эффект этого сегмента на проникновение DV в клетку
Новшеством настоящего изобретения являются модульные структуры, отображаемые с помощью этих пептидов, объединяющие сегменты или модули с различными функциями: сегмент с противовирусной активностью, проникающий в клетку пептид, сигналы для транспорта и внутриклеточной локализации, липидизацию и т.д. Таким образом, можно использовать способность пептидов из 20-30 остатков, для включения в их последовательности большого количества информации, которая позволяет максимально увеличить функциональную активность пептидов в клетках и in vivo. В настоящем изобретении авторы также включили в структуру пептида би- или полифункциональные модули.
Противовирусная активность, проявляемая пептидами согласно настоящему изобретению, основана прежде всего на ингибировании процесса активации протеазы NS3. Сегменты [I] или модули, описанные в настоящем изобретении как ингибиторы процесса активации вирусной протеазы, обладают способностью связывать белок NS3pro и блокировать взаимодействие между этим белком и вирусным белком NS2B из Flavivirus (NS4A в Hepacivirus), которое является необходимым для активации протеазы. Однако наличие этого сегмента не гарантирует, что пептиды будут способны блокировать вирусную инфекцию in vitro и in vivo. Таким образом, авторы показали в примере 3, что сегмент Ser70-Gly82, передающий белок NS2B из DV2, способен ингибировать вирусную инфекцию in vitro, только если он присутствует в одной и той же полипептидной цепи вместе с проникающим в клетку пептидом. Для ингибирования вирусной инфекции пептиды согласно настоящему изобретению должны проникнуть через клетки, получить доступ в цитозоль и связать белок NS3pro, упаковка которого происходит на цитозольной поверхности мембраны ЭР.
В варианте осуществления настоящего изобретения авторы используют в качестве сегмента, проникающего в клетку, последовательность, соответствующую бета-шпильке FG домена III из оболочечного белка DV1-4. В настоящем изобретении авторы показывают, что сегменты [P], находящиеся в этих последовательностях, способны переносить в клетку различные пептидные грузы. Ранее было показано, что циклические пептиды, основанные на последовательности шпильки FG из DV1-2, взаимодействуют с рецептором клетки LRP1 (aplicación de patente: Métodos y moléculas para la prevención y el tratamiento de la infecсión con Flavivirus. CU 2006-0091. Huerta V, Chinea G, Fleitas N, Martín AM, Sarria M, Guirola O, Toledo PG, Sánchez A, Besada VA, Reyes O, Garay HE, Cabrales A, Musacchio A, Padrón GR, González LJ).
Известно, что рецептор LRP1 взаимодействует и интернализирует в клетки приблизительно 30 природных лигандов, среди них экзотоксин А коклюша (Herz J, Strickland DK. (2001) LRP: a multifunctional scavenger and signaling receptor. J Clin Invest. 108:779-84. Kounnas MZ, Morris RE, Thompson MR, FitzerРald DJ, Strickland DK, Saelinger CB, 1992. The alpha 2-macroglobulin receptor/low density lipoprotein receptor-related protein binds and internalizes Pseudomonas exotoxin A. J Biol Chem 267: 12420-12423). Этот рецептор экспрессируется в большинстве типов клеток, тканей и органов. DV также обладает способностью инфицировать многие линии клеток и органов, поэтому использование пептидов, содержащих пенетрирующий клетку пептид, основанный на последовательности шпильки FG, является очень благоприятным для достижения эффективной интернализации в восприимчивые к инфекции клетки. Экспрессия LRP1 высока в печени и мозге, которые являются основными органами-мишенями для заболеваний, вызываемых Flaviviridae. Например, вирусы из комплексов TBE и JEV вызывают энцефалит, а из YFV являются в основном висцеротропными и вызывают гепатит. По той же причине, этот сегмент был бы также эффективен в отношении HCV, в виде присутствия в анти-HCV пептидах, описанных в настоящем изобретении.
В отдельном случае, в химерных пептидах, описанных в настоящем изобретении в качестве ингибиторов инфекции денге, модули, основанные на шпильке FG, обладают бифункциональной особенностью. Помимо уже описанной роли в качестве сегмента, проникающего в клетку, этот сегмент сам по себе проявляет также анти-DV противовирусную активность. Ранее было показано, что пептиды, основанные на шпильке FG, ингибируют инфекционное продуктивное проникновение в клетки DV с помощью механизма, который включает в себя шаг, происходящий после адгезии вируса на плазматической мембране (aplicación de patente: Métodos y moléculas para la prevención y el tratamiento de la infecсión con Flavivirus. CU 2006-0091. Huerta V, Chinea G, Fleitas N, Martín AM, Sarria M, Guirola O, Toledo PG, Sánchez A, Besada VA, Reyes O, Garay HE, Cabrales A, Musacchio A, Padrón GR, González LJ). Эти пептиды очень эффективно ингибируют вирусную инфекцию, когда они присутствуют в растворе в момент проникновения вируса в клетку. Помимо этого, как показано в примере 2, пептиды согласно настоящему изобретению, которые не обладают сегментом, проникающим в клетку, основанным на шпильке FG, и противовирусный эффект которых основан только на их модулях, ингибирующих протеазу NS3, являются менее эффективными, если их вводить в среду одновременно с вирусом. Эти пептиды (в которых отсутствует шпильковый сегмент FG) проявляют свою максимальную противовирусную активность в случае их предварительной инкубации с клетками до добавления вируса, что является совместимым с механизмом ингибирования, требующим проникновения в клетку и эффективной внутриклеточной локализации, чтобы ингибировать активацию протеазы NS3.
Вследствие этого, новый элемент согласно настоящему изобретению состоит в комбинации ингибитора проникновения в клетку (который является также проникающим в клетку пептидом) и сегмента, ингибирующего активацию вирусной протеазы.
Следовательно, эти химерные пептиды обладают более благоприятным профилем биологической активности, в сравнении с пептидами, основанными только на одном из этих сегментов, при рассмотрении зависимости между моментом добавления пептида относительно начала вирусной инфекции.
Проникновение в клетку и путь внутриклеточного метаболизма. N-терминальная липидизация и задержка в ЭР
Настоящее изобретение также применимо для липидизации предварительно описанных химерных пептидов. Упомянутая здесь липидизация обычно включает в себя миристиолирование или пальмитоилирование на N-концах пептидов. В этом патенте под миристиолированием авторы подразумевают химическую модификацию пептидов с помощью ковалентного добавления миристиновой кислоты CH3(CH2)12CO2H к N-терминальной группе пептидов посредством амидной связи, приводя к химической структуре CH3(CH2)12CO2-NH-P, в которой P является аминокислотной последовательностью миристиолированного пептида. Подобным образом пальмитоилирование приводит к добавлению пальмитиновой группы CH3(CH2)14CO2H. Под липидизацией здесь авторы также понимают ковалентное добавление липидной цепи к боковым цепям аминокислотных остатков SER и/или TYR, добавленных к пептидам в качестве N-концевых удлиненных сегментов. Для проявления их противовирусной активности, которая основана прежде всего на ингибировании активации протеазы NS3, пептиды согласно настоящему изобретению должны пройти через различные биологические барьеры, состоящие из разнообразных мембранных систем клетки.
Этим пептидам необходимо переместиться из внеклеточного пространства до места их финального метаболического пути, оптимального для противовирусного эффекта, цитозольной поверхности ЭР. В основном, липидизация увеличивает липофильность пептида, которая является благоприятным свойством в отношении взаимодействия с биологическими мембранами. В настоящем изобретении авторы первоначально комбинировали липидизацию пептида с добавлением некоторых сигналов (последовательностей) транспорта и клеточной локализации, которые усиливают биологическую активность пептидов. Таким образом, эта конструкция направлена на повышение эффективности различных шагов, задействованных в проявлении противовирусной активности пептида на клетках: адсорбции на плазматической мембране, проникновении в клетку, внутриклеточном транспорте/ретроградном транспорте, внутриклеточной локализации на мембране ЭР и взаимодействии с белком NS3pro.
Выбор химической природы липида(ов), подходящей для липидизации пептида, не является хорошо известным. Одна из предпосылок разработки химерного пептида согласно настоящему изобретению состоит в отборе специфичного липида(ов) для его химической конъюгации с пептидами таким образом, чтобы эта химическая модификация благоприятно влияла на физико-химические и функциональные свойства пептидов в отношении различных процессов, задействованных в их противовирусной активности: связывания с плазматической мембраной, проникновения в клетку/эндоцитоза, внутриклеточного транспорта/ретроградного транспорта, транспорта в цитозоль и связывания с NS3pro. Во время этого процесса пептиды должны взаимодействовать с мембранами, имеющими различные биофизические свойства, и участвовать в транспорте между различными внутриклеточными пространствами. Один оптимальный шаг в отношении липида может быть вредным в отношении других шагов и поэтому не будет показан для липидизации противовирусных пептидов согласно настоящему изобретению. Например, в отношении взаимодействия с мембраной ЭР, потенциально благоприятными являются мононасыщенные глицеролипиды. Эти липиды являются обычными для этой мембраны (Keenan T.W. and Morrea, D.J. Phospholipid class and fatty acid composition of Golgi apparatus isolated from rat liver and comparison with other cell fractions. Biochemistry 9: 19-25, 1970), что характеризует ее более высокой текучестью и меньшей толщиной, по сравнению с плазматической мембраной, богатой сфинголипидами, стеролами и двунасыщенными фосфолипидами. Таким образом, ненасыщенный липид с относительно короткой цепью, которая бы подходила для вставки в мембрану ЭР, не будет благоприятным для плазматической мембраны. Этот вид липидов будет локализоваться предпочтительно в наиболее жидких доменах плазматической мембраны, отделенных от доменов, богатых сфинголипидами и холестерином, таких как липидные мостики, которые участвуют в эндоцитозе. Различные предыдущие анализы внутриклеточного направления липидных аналогов, отличающихся по природе их гидрофобных хвостов, показали, что ненасыщенные липиды с короткими хвостами после эндоцитоза эффективно рециркулируют обратно в плазматическую мембрану через внутриклеточное рециркуляционное пространство (ERC), а насыщенные липиды с длинными хвостами направляются по внутриклеточному пути к поздним эндосомам и лизосомам (Mukherjee, S., Soe, T.T and Maxfield, F.R. 1999. J. Cell Biol., 144, 1271-1284; Koval, M., and R.E. Pagano, 1989. J. Cell Biol. 108: 2169-2181; Mayor, S., J.F. Presley, and F.R. Maxfield, 1993. J. Cell Biol. 121: 1257-1269; Sandhoff, K., and A. Klein., 1994. FEBS Lett. 346: 103-107).
В предыдущих исследованиях сообщалось о примерах миристиолирования пептидов, усиливающего проникновение в клетку и биологическую активность пептидов в их соответствующих внутриклеточных мишенях (P.J. Bergman, K.R. Gravitt, C.A. O'Brian, An N-myristoylated protein kinase C-alpha pseudosubstrate peptide that functions as a multidrug resistance reversal agent in human breast cancer cells is not a P-glycoprotein substrate, Cancer Chemother Pharmacol. 40 (1997) 453-456. B.R. Kelemen, K. Hsiao, S.A. Goueli, Selective in vivo inhibition of mitogen-activated protein kinase activation using cell-permeable peptides, J. Biol. Chem. 277 (2002) 8741-8748. T. Eichholtz, D.B. de Bont, J. de Widt, R.M. Liskamp, H.L. Ploegh, A myristoylated pseudosubstrate peptide, a novel protein kinase C inhibitor, J. Biol. Chem. 268 (1993) 1982-1986).
Однако миристиолирование по существу не гарантирует проникновения пептида в клетки. В действительности, существуют примеры миристиолированных пептидов, которые не проникают в клетки, и установлено, что проникновение зависит также от природы пептида, при этом благоприятными свойствами является наличие позитивного суммарного заряда и гомогенное распределение основных остатков между кислотными и гидрофобными остатками (Carrigan, C.N., Imperiali, B. 2005, Anal. Biochem. 341 290-298).
Первыми шагами взаимодействия пептидов согласно настоящему изобретению с клетками являются адгезия к плазматической мембране и/или связывание с молекулами, находящимися на мембране. Добавление миристоиловой или пальмитоиловой групп увеличивает липофильность пептидов согласно настоящему изобретению, облегчая связывание пептида с плазматической мембраной. Помимо наличия липида, пептиды согласно настоящему изобретению включают в себя последовательности проникающих в клетку пептидов, которые взаимодействуют с молекулами, находящимися в мембране. Примером является вариант катионных проникающих в клетку пептидов, которые взаимодействуют с гликозаминогликанами, в частности с подобными гепарину гепарансульфатами.
Показано, что связывание с гепарансульфатами является важным для проникновения в клетку катионных пептидов. Они могут также взаимодействовать с другими отрицательно заряженными молекулами плазматической мембраны, такими как анионные липиды и белки. Подобным образом, другие пептиды, которые взаимодействуют с внутриклеточными рецепторами, могут функционировать как носители или проникающие в клетку пептиды, облегчая поступление молекул груза в клетки. Вследствие этого, липидизация пептидов согласно настоящему изобретению усиливает сродство связывания с плазматической мембраной, предоставляя дополнительный фиксирующий сайт.
В основном, миристиолированные белки, содержащие кластер основных остатков, объединенных в сигнал миристиолирования, благоприятно взаимодействуют с мембранами, богатыми холестерином и сфинголипидами (McCabe, J.B., and Berthiaume, L.G. (1999). Functional roles for fatty acylated amino-terminal domains in subcellular localization. Mol. Biol. Cell 10, 3771-3786. McCabe, J.B., and Berthiaume, L.G. (2001). N-Terminal Protein Acylation Confers Localization to Cholesterol, Sphingolipid-enriched Membranes But Not to Lipid Rafts/Caveolae. Mol. Biol. Cell 12, 3601-3617), которые являются компонентами липидных мостиков, участвующих во внутриклеточных процессах и в направлении белков к различным органеллам и специфичным мембранам клеток (Joost C. M. Holthuis, Thomas Pomorski, Renea'J. Raggers, Hein Sprong, and Gerrit van Meer. 2001. The Organizing Potential of Sphingolipids in Intracellular Membrane Transport. Physiol. Rev. 81, 1689-1723. Simons, K. and Ikonen, E. 1997. Functional rafts in cell membranes. Nature, 387: 569-572). Вследствие этого, миристиолирование является благоприятным для способности пептидов согласно настоящему изобретению проникать в клетки, в частности для пептидов, содержащих катионные проникающие в клетку пептиды и/или полиаргинины в качестве сигналов для задержки на цитозольной поверхности мембраны ЭР. В действительности, показано, что липидизированные пептиды, имеющие некоторый положительный заряд, могут проникать в клетки (Carrigan, C.N., Imperiali, B. 2005, Anal. Biochem. 341 290-298).
По-видимому, устойчивые к детергентам специализированные микродомены мембраны (DRM), богатые гликосфинголипидами и холестерином, являются необходимыми для интернализации различных бактериальных токсинов в клетки (токсин холеры, рицин, токсин Shiga и т.д), и молекулы, связанные с этими DRM, подобные ганглиозиду GM1 и сфинголипиду Gb3, являются рецепторами некоторых из таких токсинов, которые проникают в клетки с помощью эндоцитоза (Spangler, B. D. (1992) Microbiol. Rev. 56, 622-647. Fujinaga Y, Wolf AA, Rodighiero C, Wheeler TE, Tsai B, Allen L, Jobling MG, Rapoport TA, Holmes RK, Lencer WI. 2003. Gangliosides that associate with lipid rafts mediate transport of cholera and related toxins from the plasma membrane to endoplasmic reticulum. Mol Biol Cell 14: 4783-4793. Falguieres T, Mallard F, Baron C, Hanau D, Lingwood C, Goud B, Salamero J, Johannes L. 2001. Targeting of Shiga toxin B-subunit to retrograde transport route in association with detergent-resistant membranes. Mol Biol Cell 12: 2453-2468).
Эти токсины проявляют свою активность в цитозоле после прохождения через процесс ретроградного транспорта, который включает транспорт от эндосом до ЭР, непосредственно в или через TGN (Sandvig K, van Deurs B. 2002. Membrane traffic exploited by protein toxins. Annu Rev Cell Dev Biol 18: 1-24). Затем эти токсины перемещаются из ЭР в цитозоль также с помощью ретроградного транспорта и, очевидно, с использованием ЭР-ассоциированного механизма деградации (ERAD) (Lord, J. M., and Roberts, L. M. (1998) J. Cell Biol. 140, 733-736. Lord, J. M., Deeks, E., Marsden, C. J., Moore, K., Pateman, C., Smith, D. C., Spooner, R. A., Watson, P., and Roberts, L. M. (2003) Biochem. Soc. Trans.31, 7260-1262. AbuJarour, R.J., Dalal, S., Hanson, P.I. and Draper, R.K. 2005. J. Biol. Chem. 280, 15865-15871).
Таким образом, потенциальная солокализация липидизированных пептидов согласно настоящему изобретению в мембранных доменах, богатых сфинголипидами, может быть совместима с их потенциальной способностью использовать механизм проникновения в клетку, основанный на вышеупомянутом липид-зависимом ретроградном транспорте, используемом бактериальными токсинами.
В другом варианте осуществления настоящего изобретения разработанные пептиды используют в качестве проникающего в клетку пептида шпильку FG из домена оболочечного белка DV3 или гомологичные пептиды серотипов 1, 2 и 4. Ранее было показано, что эти пептиды связываются с клеточным рецептором LRP1 (aplicación de patente: Métodos y moléculas para la prevención y el tratamiento de la infecсión con Flavivirus. CU 2006-0091. Huerta V, Chinea G, Fleitas N, Martín AM, Sarria M, Guirola O, Toledo PG, Sánchez A, Besada VA, Reyes O, Garay HE, Cabrales A, Musacchio A, Padrón GR, González LJ). Этот рецептор опосредует эндоцитоз приблизительно 30 лигандов, и он используется для поступления в клетку экзотоксина коклюша PTx (Herz J, Strickland DK. (2001) LRP: a multifunctional scavenger and signaling receptor. J Clin Invest. 108: 779-84, Kounnas MZ, Morris RE, Thompson MR, FitzGerald DJ, Strickland DK, Saelinger CB. The alpha 2-macroglobulin receptor/low density lipoprotein receptor-related protein binds and internalizes Pseudomonas exotoxin A. J Biol Chem 1992; 267: 12420-12423).
В настоящем изобретении авторы показали, что пептиды, соответствующие шпильке FG, способны опосредовать поступление в клетки пептидных грузов. Липидизация (миристиолирование или пальмитоилирование) этих пептидов, содержащих шпильку FG, будет повышать эффективное сродство к их клеточному рецептору с помощью усиления разделения пептидов в липидной мембране. Эта липидизация пептида также согласуется с повышением потенциала проникновения в клетки пептидов посредством эндоцитоза, опосредованного рецептором LRP1.
Одна возможность состоит в том, что эти пептиды проникают в клетки с помощью способа, подобного PTx. Этот токсин получает доступ в цитозоль с помощью ретроградного транспорта из эндосом, проходящих последовательно через TGN, ЭР и затем в цитозоль. PTx обладает способностью использовать по меньшей мере два пути ретроградного транспорта, опосредованных взаимодействием с LRP1: a) липидзависимый путь и b) липиднезависимый путь (Smith, D. C., Spooner, R. A., Watson, P. D., Murray, J. L, Hodge, T. W., Amessou, M., Johannes, L., Lord, J. M. and Roberts, L. M., 2006. Internalized Pseudomonas Exotoxin A can Exploit Multiple Pathways to Reach the Endoplasmic Reticulum. Traffic, 7: 379-393). По-видимому, липидзависимый путь связан с локализацией 20% молекул LRP1 в липидных мостиках плазматической мембраны. Пептиды согласно настоящему изобретению, являющиеся липидизированными и обладающие способностью взаимодействовать с LPR1, могут потенциально использовать более эффективный липидзависимый путь, в частности, пептиды, включающие в себя основной кластер полиаргининов (добавленный в виде сигнала задержки в ЭР), имеют композицию, благоприятную для локализации в сопряженных с мостиками мембранных доменах, богатых холестерином и сфинголипидами.
Другой вариант осуществления настоящего изобретения состоит в пептидах, имеющих сигнал KDEL на C-конце. Эти пептиды синтезируются с карбоксильным C-концом для создания функционального сигнала KDEL для задержки в просвете ЭР (Teasdale, R. D. & Jackson, M. R., 1996. Annu. Rev. Cell Dev. Biol. 12, 27-54). Добавление этого сигнала к пептидным последовательностям благоприятно влияет на их ретроградный транспорт из Golgi в ЭР и более позднюю задержку этих пептидов в просвете ЭР. Таким образом, этот сигнал влияет на проникновение в цитозоль тех пептидов, которые используют по меньшей мере частично путь ретроградного транспорта. Более высокая эффективность транспорта приводит к более высокой цитозольной концентрации пептидов и, следовательно, более высокой активности блокирования активации протеазы NS3. В примере 3 авторы показали, что добавление сигнала KDEL к пептидам согласно настоящему изобретению может приводить к повышению антивирусной активности пептидов.
Добавление сигнала KDEL применимо для пептидов согласно настоящему изобретению, имеющих или не имеющих липидов, присоединенных к их N-концам. Это сопоставимо с фактом, что этот сигнал обнаруживается как в растворимом, так и во II типе мембранных белков ЭР. Липидизированные пептиды согласно настоящему изобретению в просвете ЭР должны иметь топологию, подобную мембранным белкам II типа.
В случае пептидов согласно настоящему изобретению, имеющих проникающий в клетку сегмент, родственный шпильке FG, добавление сигнала KDEL придает этим пептидам дополнительную способность взаимодействия с антероградным транспортом рецептора LRP1 и, следовательно, приводит к уменьшению уровней экспрессии их рецепторов на плазматической мембране. Вследствие этого, комбинация этих последовательностей/сигналов оказывает косвенный негативный эффект на поступление вируса в клетки, уменьшая экспрессию рецептора на плазматической мембране, и этот эффект является дополнительным к вышеописанному прямому эффекту пептидов на основе шпильки FG, блокирующих поступление вируса в клетку. Предшествующие доказательства указывают на то, что пептиды на основе шпильки FG способствуют взаимодействию LRP1 с его белком, ассоциированным с шаперонным рецептором (aplicación de patente: Métodos y moléculas para la prevención y el tratamiento de la infecсión con Flavivirus. CU 2006-0091. Huerta V, Chinea G, Fleitas N, Martín AM, Sarria M, Guirola O, Toledo PG, Sánchez A, Besada VA, Reyes O, Garay HE, Cabrales A, Musacchio A, Padrón GR, González LJ). Это означает, что эти пептиды способны взаимодействовать с внутриклеточным LRP1, присутствующим во внеклеточном пути, во время его перемещения к плазматической мембране. Поскольку эти пептиды содержат также сигнал KDEL, внутриклеточные комплексы пептид-LRP1 и/или пептид-LRP1/RAP способны связывать рецептор KDEL и, таким образом, они могут направляться из Golgi в ЭР, воздействуя на транспорт LRP1 к плазматической мембране и косвенно воздействуя на LRP1-опосредованное проникновение вируса в клетку.
Общим свойством пептидов согласно настоящему изобретению является то, что они проявляют противовирусную активность, основанную на ингибировании активации протеазы NS3. Ингибирование активации протеазы достигается с помощью специфичного блокирования взаимодействия белка NS2B (NS4A в Hepacivirus) с доменом NS3pro, поскольку это взаимодействие является необходимым условием для правильной упаковки и полной активности протеазы.
Упаковка белка и активация протеазы NS3, а также упаковка и процессинг капсидного белка и остальной части неструктурных белков происходит на цитозольной поверхности мембраны ЭР. Вследствие этого, способ усиления противовирусной активности пептидов согласно настоящему изобретению состоит в увеличении их внутриклеточной локализации на мембране ЭР. С этой целью, пептиды могут быть химически липидизированы (миристиолированы или пальмитоилированы) на N-конце. Липидизированные пептиды обладают способностью благоприятно взаимодействовать с липидными мембранами. Наилучшая ассоциация липидизированных пептидов с мембраной ЭР (которой способствует молекула липида) повышает эффективное кажущееся сродство взаимодействия между пептидами и белком NS3pro, и данный эффект связан со следующими факторами: 1) увеличение местной концентрации пептида, 2) бимолекулярное взаимодействие происходит в двух измерениях (плоскость мембраны) и 3) быстрая латеральная диффузия липидизированных пептидов в мембране. Помимо этого, пептиды, липидизированные на их N-конце, при связывании с цитозольной поверхностью мембраны ЭР, топологически моделируют мембранные белки I типа, таким образом они приобретают не только правильную локализацию, но также и ориентацию по отношению к мембране, которая является подобной вирусному белку NS2B (NS4A в Hepacivirus).
В основном, когда нет дополнительных сигналов, таких как пальмитоилирование и/или основные кластеры, миристиолирование цитозольных белков индуцирует локализацию этих белков главным образом на мембране ЭР (McCabe, J.B., and Berthiaume, LG. (1999). Functional roles for fatty acylated amino-terminal domains in subcellular localization. Mol. Biol. Cell 10, 3771-3786). Ассоциация непосредственно миристата с мембраной является недостаточно прочной и не гарантирует полную задержку пептидов в мембране ЭР. Однако мембрана ЭР составляет 60% внутриклеточных мембран, что гарантирует значительную эффективную концентрацию пептидов относительно остальной части мембран. Если в дополнение к миристиолированию также присутствуют основные кластеры, цитозольные белки локализуются главным образом на внутренней поверхности плазматической мембраны и в эндосомах.
Различные пептиды согласно настоящему изобретению содержат катионные сегменты в качестве проникающих в клетку пептидов, которые гарантируют также благоприятное взаимодействие с отрицательно заряженными молекулами, расположенными на наружной поверхности плазматической мембраны. Некоторые пептиды согласно настоящему изобретению содержат в качестве катионного сегмента кластеры аргина, которые также представляют сигналы задержки/перенаправления в ЭР (Teasdale, R. D. & Jackson, M. R. (1996) Annu. Rev. Cell Dev. Biol. 12, 27-54. Zerangue, N., Schwappach, B., Jan, Y. N. & Jan, L. Y. (1999) Neuron 22, 537-548. Schutze, M. P., Peterson, P. A. & Jackson, M. R. (1994) EMBO J. 13, 1696-1705). Эти пептиды были разработаны для проявления одновременно двух свойств: эффективного проникновения в клетку и внутриклеточной локализации главным образом на цитозольной поверхности мембраны ЭР. Основанные на аргинине сигналы транспорта в ЭР весьма эффективны и играют важную роль в механизме контроля качества мембранных белков (Chang, X. B., Cui, L, Hou, Y. X., Jensen, T. J., Aleksandrov, A. A., Mengos, A. & Riordan, J. R. (1999) Mol. Cell 4, 137-142. Margeta-Mitrovic, M., Jan, Y. N. & Jan, L. Y. (2000) Neuron 27, 97-106).
В отличие от дилизинового сигнала, который ограничен C-концом мембраннго белка I типа, сигналы на основе аргинина обнаруживаются во многих положениях в последовательностях мембранных белков, включая в себя N- и C-концы, а также внутренние петли, расположенные в цитозольной поверхности. Универсальность сигналов задержки на основе аргинина использовалась в настоящем изобретении для создания пептидов, которые комбинируют их с C-концевым сигналом KDEL. Таким образом, некоторые липидизированные пептиды согласно настоящему изобретению, содержащие эти сигналы, поступают в клетки и перемещаются в цитозоль с помощью ретроградного транспорта, чему способствует сигнал KDEL во время их перемещения в ЭР, а затем удерживаются на цитозольной поверхности мембраны ЭР, чему способствуют сигналы на основе аргинина.
В один вариант осуществления настоящего изобретения авторы включили разработку липидизированных пептидов, последовательность которых содержит два последовательных предполагаемых сигнала задержки для задержки на цитозольной поверхности мембраны ЭР. Результирующая последовательность следующая - LRRRRLRRRRL, что соответствует двум последовательным последовательностям LRRRRL, перекрывающимся в области центрального остатка Leu. Последовательность четырех последовательных остатков аргинина, которой предшествует гидрофобный остаток, является типичной для последовательностей задержки в ЭР (Zerangue, N., Malan, M.J., Fried, S.R., Dazin, P.P., Jan, Y.N., Jan, L.Y. and Schwappach, B. 2001. PNAS, 98: 2431-2436). В этом отношении, один из новых аспектов настоящего изобретения состоит в том, что результирующая последовательность имеет двойственность, проявляющуюся в том, что она является эффективным сигналом задержки в ЭР, а также проникающим в клетку пептидом. Свойство проникновения в клетку результирующей последовательности обеспечивается с помощью восьми остатков аргинина, являющихся подобными полиаргининовым последовательностям, высокоэффективных катионных PTD.
Описание чертежей
Фиг.1: Создание пептидных ингибиторов активации протеазы NS3pro. A: Множественное выравнивание последовательности белка NS2B из Flavivirus. Описанные здесь сегменты ингибитора активации выделены двойными стрелками, светло-(темно-)серая стрелка соответствует сегменту, связанному с N-концевым (C-концевым) доменом бета-баррели NS3pro. B: Трехмерная структурная модель комплекса NS2B-NS3pro из Flavivirus. Выделен сегмент D50-E62 NS2B из DV2, связывающий домены N-терминальной бета-баррели NS3pro, и сегмент S70-G82 NS2B из DV2, связывающий C-концевой домен. C: Сегменты D50-E62 и S70-I86-GGGGRR, ингибирующие активацию протеазы NS3pro. C-терминальная удлиненная часть последнего пептида связывает активный сайт протеазы, блокируя взаимодействие протеазы с ее субстратами. D: Модель комплекса, образованного с помощью NS3pro в его неактивной конформации (структура белка без NS2B), и смоделированный на компьютере пептид согласно настоящему изобретению.
Фиг.2: Анализ ингибирования инфицирования вирусом денге 2 клеток Vero. A: Уменьшение количества бляшек в процентах вследствие присутствия пептида NS2Bden2+TAT с предварительной инкубацией перед добавлением вируса к клеткам и без. B: Анализ противовирусной активности пептидов TAT и NS2Bden2+TAT в различных концентрациях, с (pre) и без (no pre) предварительной инкубации.
Фиг.3: Влияние времени инкубации на противовирусную активность пептида NS2Bden2+TAT. PX1: не связанный пептид негативного контроля (слияние пептида TAT с не связанной последовательностью); P10: пептид NS2Bden2+TAT (слияние TAT с пептидом из NS2B DV, пептид 1 в таблице 1). Исследовали время предварительной инкубации 0, 30, 60 и 180 минут.
Фиг.4: Роль интернализации в противовирусной активности пептида NS2Bden2+TAT. A: После предварительной инкубации с пептидами, они остаются в среде во время добавления вируса к клеткам. B: Пептиды удаляют из среды с помощью различного промывания перед добавлением вируса к клеткам. pNR+TAT: пептид 18 в таблице 1. Пептид pNR+TAT является отрицательным контролем эксперимента. Его первичная структура является аналогичной пептиду NS2Bden2+TAT, сегмент [I] имеет аминокислотную композицию, идентичную пептиду NS2Bden2+TAT, но последовательность была пермутирована (пептид 18 в таблице 1).
Фиг.5: Влияние идентичности проникающего пептида и сигнала задержки в ЭР на противовирусную активность пептидов. NS2Bden2+TAT: пептид 1 в таблице 1; NS2Bden2+pP2: пептид 2 в таблице 1, проникающий в клетку сегмент - пенетратин; NS2Bden2+pRR: пептид 3 в таблице 1, декааргинин в качестве проникающего в клетку пептида; NS2Bden2+TAT+KDEL: пептид 4 в таблице 1; pNR+TAT: пептид 18 в таблице 1, отрицательный контроль; NS2Bden2: сегмент [I] пептида NS2Bden2+TAT.
Фиг.6: Противовирусная активность пептидов в отношении гомологичных и гетерологичных серотипов DV. Противовирусную активность пептидов определяли посредством уменьшения числа вирусных бляшек в присутствии VD1 (A), VD3 (B) и VD2 (C). Rosseta: пептид компьютерно смоделирован для связывания с N-концевым доменом NS3pro из DV2 (пептид 5 в таблице 1); NS2Bden2+poliR: пептид 3 в таблице 1, декааргинин в качестве проникающего в клетку пептида; NS2Bden2+TAT: пептид 1 в таблице 1; NS2Bden1+TAT: пептид 6 в таблице 1; NS2Bpermutado+TAT: пептид 18 в таблице 1, отрицательный контроль эксперимента. Первичная структура NS2BpЭРmutado+TAT аналогична пептиду NS2Bden2+TAT, сегмент [I] имеет аминокислотную композицию, идентичную NS2Bden2+TAT, но последовательность была пермутирована.
ПРИМЕРЫ
Пример 1
Разработка и синтез химерных пептидов-ингибиторов инфекции Flaviviridae
Химерный пептидный ингибитор инфекции, вызываемой Flaviviridae, описанной в настоящем изобретении, имеет первичную структуру согласно следующей топологии:
[P]-[L1]-[I]-[L2]-[T] или [I]-[L3]-[P]-[L4]-[T],
где [P] является аминокислотной последовательностью проникающего в клетку пептида, включающей в себя обычно от 10 до 30 остатков, которые обладают способностью облегчать интернализацию всей пептидной молекулы в цитоплазму клетки и получить доступ к контакту ШЭР; [L1, L2, L3, L4] являются линкерными последовательностями из 0-6 остатков; [I] является аминокислотной последовательностью, которая блокирует активацию протеазы NS3pro, остатки этого сегмента устанавливают контакты по меньшей мере с одной аминокислотой из бета-цепей B2a и B2b домена C-терминальной бета-баррели или бета-цепи A1 домена N-терминальной бета-«бочки» белка NS3pro из Flavivirus (или структурно соответствующей областью в Hepacivirus или Pestivirus), являясь белком NS3pro в его активной или неактивной конформации (фиг.1); [T] является последовательностью из 0-10 остатков, обычно является одним или двумя сигналами задержки в ЭР, подобными последовательностям KDEL и LRRRRL или последовательности XRR, которая обладает способностью связывания активного сайта протеазы.
В таблицах 1 и 2 показаны последовательности химерных пептидов согласно топологии 1 и 2 соответственно. Основная пептидная композиция основана на присутствии сегмента [I] ингибитора активации протеазы и сегмента [P], проникающего в клетку. В качестве сегментов [I] приведены последовательности D50-E62, S70-G82 и S70-I86 белка NS2B из DV1-4. Также приведены соответствующие последовательности из WNV и HCV. Сегмент D50-E62 связывается с N-концевым доменом NS3pro, а сегменты S70-G82 и S70-I86 связываются с C-концевым доменом (фиг.1A-C).
Структура химерных пептидов согласно топологии [P]-[L1]-[I]-[L2]-[T]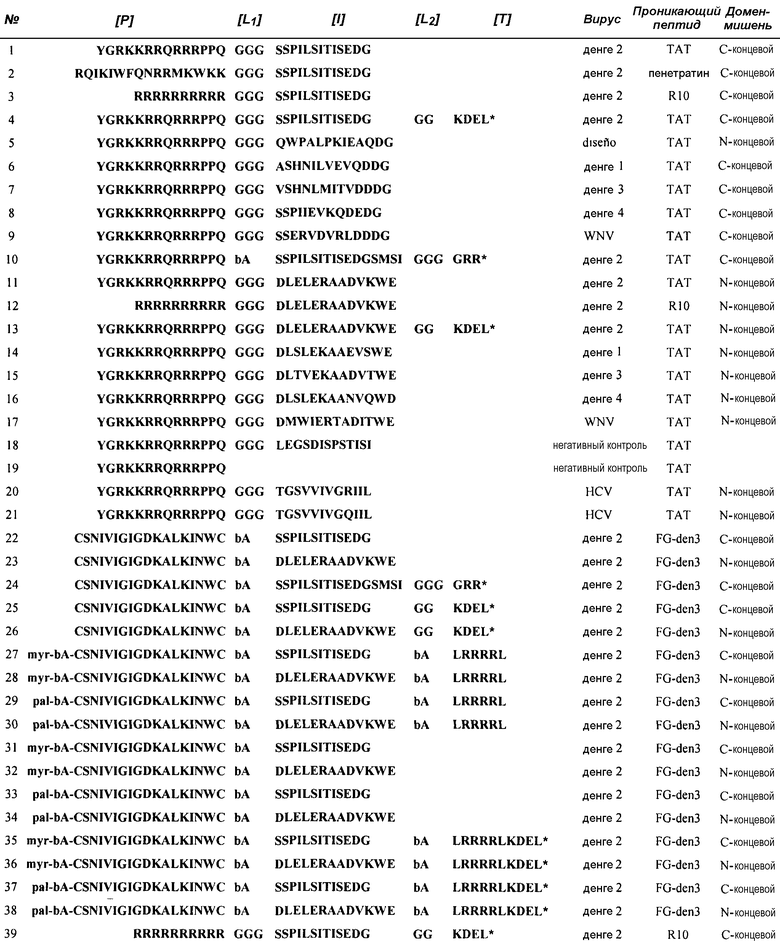
Структура химерных пептидов согласно топологии [I]-[L3]-[P]-[L4]-[T]
Настоящее изобретение также касается разработки противовирусных химерных пептидов против других членов семейства Flaviviridae. Пептидные ингибиторы против других Flaviviridae включают в качестве сегментов [I] аналогичные сегменты из соответствующей последовательности белка NS2B (в Flavivirus) или NS4A (в Hapacivirus). В списке последовательностей настоящего изобретения авторы включили дополнительные химерные пептиды, аналогичные показанным в таблицах 1 и 2, в которых сегмент [I] соответствует другому Flavivirus (YFV, JEV, TBE, WNV) и Hepacivirus HCV.
В качестве сегментов [P] авторы включили пептид TAT, R10, пенетратин, катионные последовательности LRRRRLRRRRL и LRRRRL-bAla-RRRRL и сегмент S376-W391 оболочечного белка DV3 (петля FG домена III). Последний из сегментов включает в себя цистеины в его N- и C-концах, которые образуют дисульфидный мостик и стабилизируют конформацию бета-шпильки, наблюдаемую в трехмерной структуре оболочечного белка.
В качестве концевого сегмента [T] авторы включили сигналы задержки в ЭР LRRRRL, KDEL и их комбинированный LRRRRLKDEL. Присутствие этих сигналов усиливает эффективную локализацию пептидов в ЭР, что благоприятно воздействует на их противовирусную активность. Авторы также включили в качестве сегмента [T] последовательность GRR, связанную трипептидом GGG с сегментом [I] последовательности S70-I86. Как показано на фиг.1C, пептиды с этой первичной структурой связываются с C-концевым доменом белка NS3pro, а сегмент GRR локализуется в активном сайте протеазы, блокируя его взаимодействие с субстратами. В качестве линкерных сегментов авторы включили в таблицы 1 и 2 трипептид GGG, дипептид GG и аминокислоту бета-аланин.
Также включены миристиолированные и пальмитоилированные пептиды на N-конце. Липидизация этих пептидов увеличивает эффективность адгезии к цитоплазматической мембране, проникновения в клетку и результирующую локализацию в мембране ЭР. Липидизация осуществляется с помощью химических способов. В таблицах 1 и 2 липиды присоединены непосредственно к N-концам или к N-концевому остатку бета-аланина.
Различные сегменты пептидов, включенные в таблицы 1 и 2, обладают больше чем одной отдельной функцией. Сегменты LRRRRLRRRRL и LRRRRL-bAla-RRRRL, помимо того что являются проникающими в клетку пептидами, включают два последовательных сигнала задержки в ЭР.
Сегмент [P], соответствующий последовательности области S376-W391 оболочечного белка из DV3, помимо того что является проникающим в клетку пептидом, также является ингибитором проникновения вируса в клетку. Поэтому использование этого сегмента в пептидах согласно настоящему изобретению усиливает ингибирующий эффект этих пептидов.
Пептиды согласно настоящему изобретению могут быть получены с помощью химического синтеза или с помощью технологии рекомбинантных ДНК, в отдельности или в виде части слитых белков. Экспрессия в виде слитых белков может повышать уровни экспрессии и устойчивость пептидов к деградации под воздействием протеаз носителя. Эти пептидные последовательности могут быть присоединены к слитым белкам посредством линкеров, соответствующих последовательностям субстратов специфичных протеаз, и, таким образом, пептиды могут быть изолированы с помощью последовательных протеолиза и очистки.
Синтез пептида
Твердофазный синтез пептидов осуществляли на смоле Fmoc-AM-MBHA, используя алгоритм Fmoc/tBu (Barany, G. и Memfield, R. B. J Am Chem Soc. 99 (1977) 7363-7365). Синтез осуществляли вручную в 10-мл пробирках, оборудованных пористой фриттой, и все реактивы и растворители были удалены с помощью вакуумной фильтрации. Аминокислоты были связаны с помощью активации с DIC/HOBt, при мониторинге завершения реакции связывания с помощью анализа с нингидрином (Kaiser, E., Colescott, R. L., Bossinger, C. D., Cook, P. I. Anal Biochem. 34 (1970) 595-598).
Синтезируемые пептиды отделяли от смолы с помощью обработки раствором TFA/EDT/H2O/TIS (94%/2,5%/2,5%/1%), осаждали с помощью эфира и лиофилизировали в течение 72 часов. Циклизация пептида с помощью образования дисульфидного мостика была достигнута с помощью окисления ДМСО (Andreu, D., Albericio, F., Sol, N. A., Munson, M. C., Ferrer, M. and Barany, G., Pennington, M. W. and Dunn, B. M. (Eds), Peptide Synthesis Protocols, Methods in Molecular Biology, Totowa, NJ, 1994, pp. 91-169). Во всех случаях пептиды были очищены с помощью ВЭЖХ с обращенной фазой, и собранные фракции снова анализировали с помощью аналитической ВЭЖХ с обращенной фазой. Результирующий препарат каждого пептида был получен с помощью объединения фракций с хроматографической чистотой, равной или выше 99%. Масса пептида в каждом результирующем препарате была проверена с помощью ESI-МС масс-спектрометрии.
Масс-спектры были получены с помощью гибридного масс-спектрометра с октагональной геометрией QTOF-2TM (Micromass, UK), оснащенного трехмерным электрораспылительным источником ионизации.
Программное обеспечение для сбора и обработки данных спектра представляет собой MassLinx, ver. 3.5 (Waters, USA).
Пример 2
Ингибирование вирусной инфекции в клетках Vero
Для доказательства противовирусной активности in vitro химерных пептидов, описанных в настоящем изобретении, пептиды тестировали в анализе нейтрализации с уменьшением бляшек в клетках Vero (PRNT). Клетки Vero были выращены в тарелках с 24 лунками приблизительно к 90%-ному слиянию и вымыты дважды в среде MEM без FCS. Разбавление пептида было добавлено согласно специфическому анализу и инкубировалось обычно в течение 1 часа при 37°C. После инкубации вирус был добавлен к различным инфекциям 0,1, с последующей инкубацией в течение 1 часа при 37°C. В некоторых экспериментах пептиды были добавлены одновременно с вирусом (без предварительной инкубации), или время предварительной инкубации пептида было модифицировано. В конце второй инкубации, несвязавшийся вирус был удален с помощью промывания, и клетки инкубировали в течение 5 дней при 37ºC в среде с высокой плотностью (MEM, с добавлением неэссенциальных аминокислот, 1% FCS, 1% карбоксиметилцеллюлозы), для стимуляции появления литических бляшек. Бляшки осматривали с помощью окрашивания 0,1% Naphtol Blue Black в 0,15 моль/л ацетате натрия. В каждом анализе использовали по два репликата на экспериментальную точку и выполняли по три независимых определения. Процентный показатель ингибирования вычисляли согласно формуле:
100×[1-число бляшек/число бляшек вируса. контроль].
На фиг.2 показано, что пептид NS2Bden2+TAT (пептид 1 в таблице 1) ингибирует инфекцию DV2 дозозависимым образом, с IC50, равной приблизительно 50-60 мкМ. Пептиды не показывали никаких признаков токсичности на клетках в условиях анализа. Последовательность пептида NS2Bden2+TAT содержит два необходимых модуля: проникающий в клетку сегмент TAT и сегмент ингибитора активации протеазы NS3pro, который нацелен на C-концевой домен протеазы. Пептид TAT не показывал противовирусную активность и вызывал увеличение числа бляшек (фиг.2B). Этот результат сопоставим со структурой пептида: противовирусная активность свойственна сегменту, специфически относящемуся к VD2 (штамм S16803). Наблюдаемое усиление вирусной инфекции в присутствии пептида TAT могло быть связано с усилением проникновения вируса в клетки, обеспечиваемым PTD свойством этого пептида. Усиление проникновения в клетку вирусов, опосредованное PTD, ранее наблюдалось в других системах (Gratton JP, Yu J, Griffith JW, et al. Cell-permeable peptides improve cellular uptake and therapeutic gene delivery of replication-deficient viruses in cells and in vivo. Nat Med 2003; 9: 357-63).
Присутствие сегмента пептида TAT в последовательности пептида NS2Bden2+TAT является необходимым для его противовирусной активности, поскольку сегмент [I] ингибитора активации протеазы NS3pro самостоятельно не проявляет противовирусной активности in vitro (фиг.5).
На фиг.2 показано, что противовирусная активность химерного пептида NS2Bden2+TAT повышается, если пептид предварительно инкубируется с клетками за 1 час перед добавлением вируса. Этот результат сопоставим с фактом, что цель для противовирусной активности пептида является внутриклеточным объектом и предварительная инкубация позволяет большему количеству пептида проникать в клетки и локализоваться на мембране ЭР до начала репликации вируса.
Чтобы характеризовать влияние предварительной инкубации на противовирусную активность пептида NS2Bden2+TAT, авторы изучили зависимость между нейтрализацией бляшкообразования, временем предварительной инкубации и дозой пептида. В качестве негативного контроля авторы использовали неродственный химерный пептид, имеющий структуру, подобную NS2Bden2+TAT. Этот пептид содержит на N-конце последовательность пептида TAT, а на его C-конце последовательность, которая, как было показано, связывается с белком E7 вируса папилломы человека. На фиг.3 показано, что для концентраций пептида менее 100 мкМ, предварительная инкубация является необходимой для противовирусной активности и эта активность увеличивается при времени предварительной инкубации от 0 до 1 часа. Этот результат сопоставим с внутриклеточной локализацией цели для противовирусного эффекта и потребности в транспортировке пептида из внеклеточного пространства в цитозоль.
Однако для предварительной инкубации от 1 до 3 часов авторы больше не наблюдают различий. Одно возможное объяснение может заключаться в том, что в это время достигается равновесие между кинетикой накопления пептида в цитозоле и внутриклеточной деградацией пептида.
Пептид негативного контроля не проявляет противовирусной активности в любом из условий анализа, указывая на то, что противовирусный эффект пептида NS2Bden2+TAT специфично связан с последовательностью сегмента, соответствующего белку NS2B.
На фиг.4 показано дополнительное доказательство, указывающее, что противовирусная активность пептида NS2Bden2+TAT связана с внутриклеточным эффектом. В этом случае, помимо ранее описанных обычных условий анализа (фиг.4A), противовирусная активность пептида также была определена, когда пептид был удален из среды с помощью последовательного промывания клеток до добавления вируса (фиг.4B). При обоих условиях анализа противовирусная активность пептида была очень похожей, указывая на то, что противовирусный эффект зависит от предварительно интернализованного пептида. В этих анализах пептид 18 в таблице 1 использовали в качестве негативного контроля. Этот пептид имеет структуру, подобную пептиду NS2Bden2+TAT, но C-концевой сегмент состоит из последовательности той же длины и аминокислотная композиция соответствует сегменту [I] ингибитора активации протеазы NS3pro из NS2Bden2+TAT, но первоначальная последовательность была рандомизирована. Этот пептид не проявлял противовирусной активности при любых условиях, указывая на то, что противовирусная активность NS2Bden2+TAT зависит от выбранного фрагмента последовательности NS2B.
Пример 3
Влияние природы проникающего в клетку пептида и сигнала задержки в ЭР на противовирусную активность пептидов
Для определения роли проникающего в клетку пептида и сигнала задержки в ЭР на противовирусную активность пептидов согласно настоящему изобретению, авторы протестировали пептиды № 1, 2, 3 и 4 в таблице 1 на ингибирование вирусной инфекции VD2 в клетках Vero, используя анализ, описанный в примере 2.
Пептиды 2 и 3 имеют первичную структуру, подобную пептиду NS2Bden2+TAT (пептид 1), но демонстрируя пенетратин и декаргинин, соответственно, в качестве проникающих в клетку сегментов. Пептид 4 содержит добавленный сигнал KDEL на C-конце пептида NS2Bden2+TAT. C-концевая группа пептида 4 является карбоксильной для придания функциональности сигналу задержки в ЭР.
На фиг.5 и в таблице 3 показано, что пептид NS2Bden2-pRR (пептид 3 в таблице 1) проявляет более высокую противовирусную активность, почти на порядок выше, чем пептид NS2Bden2+TAT. Одно возможное объяснение заключается в том, что пептид декааргинин является более устойчивым к протеолизу во внутриклеточной среде (Fischer, R., Kohler, K., Fotin-Mleczek, M., and Brock, R. 2004. A stepwise dissection of the intracellular fate ofcationic cell-penetrating peptides. J. Biol. Chem. 279, 12625-35). Пептид NS2Bden2-pP2 (пептид 2) показывает противовирусную активность, подобную NS2Bden2+TAT, однако он проявляет значительную цитотоксичность. Добавление сигнала KDEL несколько повышает противовирусную активность пептида, позволяя предположить, что пептид NS2Bden2+TAT по меньшей мере частично использует ретроградный транспорт для получения доступа в цитозоль.
Пептид NS2Bden2, в котором отсутствует сегмент, проникающий в клетку, не ингибирует вирусную инфекцию, показывая необходимость включения этого вида сегмента в пептиды согласно настоящему изобретению.
PRNT50 и цитотоксичность (СТЕ) пептидов в клетках Vero
Пример 4
Противовирусная активность пептидов в отношении гомологичного и гетерологичного вирусов
Ожидаемым свойством противовирусных агентов является обладание широким спектром противовирусной активности по меньшей мере в отношении родственных наиболее подобных вирусов. Это также является необходимым при разработке противовирусных молекул, активных в отношении вируса денге: 1) денге фактически является комплексом из четырех различных вирусов, 2) существуют трудности для ранней специфичной диагностики и 3) в странах, в которых развивается это заболевание, лихорадка денге часто является эндемичной, с социркуляцией более одного серотипа.
Четыре серотипа денге являются родственными вирусами со сходными аминокислотными последовательностями (идентичность составляет 70-80%) их структурного и неструктурного белков. Вследствие этого, необходимо, чтобы различия в аминокислотных последовательностях NS2B и/или NS3pro могли воздействовать на способность пептидов согласно настоящему изобретению ингибировать инфекцию, вызываемую гетерологичными вирусами.
Для оценки перекрестной реактивности или серологической специфичности противовирусной активности пептидов согласно настоящему изобретению, авторы протестировали пептиды 1, 3 и 6 в таблице 1 на ингибирование вирусной инфекции DV1-3 в клетках Vero, используя анализ, описанный в примере 2. Тестируемыми штаммами вируса были West Pac 74 из DV1, S16803 из DV2 и CH53489 из DV3. Пептид 6 (NS2Bden1+TAT) имеет первичную структуру, подобную NS2Bden2+TAT, но он имеет сегмент ингибитора активации NS3, соответствующий белку NS2B из DV1. Авторы также включили в анализ пептид 5, разработанный с помощью компьютерных способов.
На фиг.6 показано, что пептид NS2Bden2+pRR (пептид 3 в таблице 1) является одинаково эффективным в отношении этих трех серотипов. Пептид NS2Bden2+TAT также ингибирует серотипы 1-3, хотя с более низкой противовирусной активностью. Несмотря на это, пептид NS2Bden1+TAT (пептид 6) показывает только частичное ингибирование серотипов 1 и 3. Этот результат сопоставим с фактом, что серотипы 1 и 3 являются филогенетически более близкими друг другу и их белки являются более подобными.
| название | год | авторы | номер документа |
|---|---|---|---|
| Иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита, на основе мРНК | 2024 |
|
RU2823754C1 |
| ИНФЕКЦИОННЫЕ КЛОНЫ ПОЛНОМЕРНОЙ кДНК КЛЕЩЕВОГО ФЛАВИВИРУСА | 2001 |
|
RU2288266C2 |
| СПОСОБ ИММУНОТЕРАПИИ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА С | 2016 |
|
RU2637631C2 |
| РЕЗИСТЕНТНЫЕ МУТАНТЫ ПРОТЕАЗЫ NS3-NS4A HCV | 2004 |
|
RU2365624C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ГЕПАТИТА С И СПОСОБ ЛЕЧЕНИЯ ГЕПАТИТА С | 2010 |
|
RU2447899C2 |
| Способ получения антигена вируса Зика, обладающего иммуногенными и антигенными свойствами | 2019 |
|
RU2717993C1 |
| Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации РНК JMTV методом ПЦР с гибридизационно-флуоресцентной детекцией | 2023 |
|
RU2818960C1 |
| Плазмидная генетическая конструкция pVEAL3-10H10ch, штамм рекомбинантной клеточной линии CHO-K1-10H10ch и химерное антитело 10H10ch против вируса клещевого энцефалита, продуцируемое указанным штаммом клеточной линии CHO-K1-10H10ch | 2022 |
|
RU2800471C1 |
| ПЕПТИДНЫЕ ПРОИЗВОДНЫЕ 1-(1-АДАМАНТИЛ)ЭТИЛАМИНА И ИХ ПРОТИВОВИРУСНОЕ ДЕЙСТВИЕ | 2013 |
|
RU2524216C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PC-NS3, ОБЕСПЕЧИВАЮЩАЯ ИНТЕГРАЦИЮ КОМПЛЕКСА ГЕНОВ C, PRM, E, NS1, NS2A, NS2B, NS3 ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА (ВКЭ) В ГЕНОМ ВИРУСА ОСПОВАКЦИНЫ (ВОВ) И РЕКОМБИНАНТНЫЙ ШТАММ ВИРУСА ОСПОВАКЦИНЫ, ЭКСПРЕССИРУЮЩИЙ В КЛЕТКАХ ИММУНИЗИРОВАННОГО ОРГАНИЗМА КОМПЛЕКС ГЕНОВ C, PRM, E, NS1, NS2A, NS2B, NS3 ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1995 |
|
RU2112038C1 |



















































































































































































































































































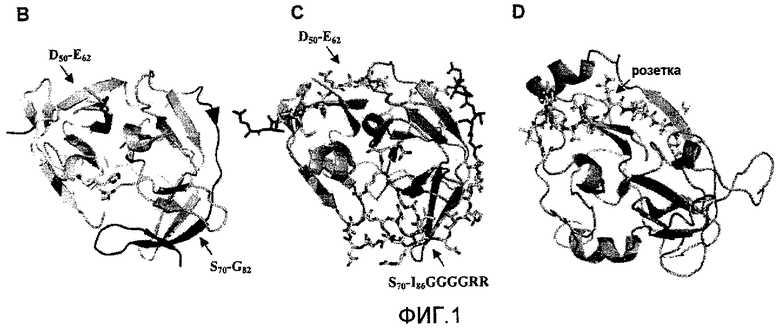
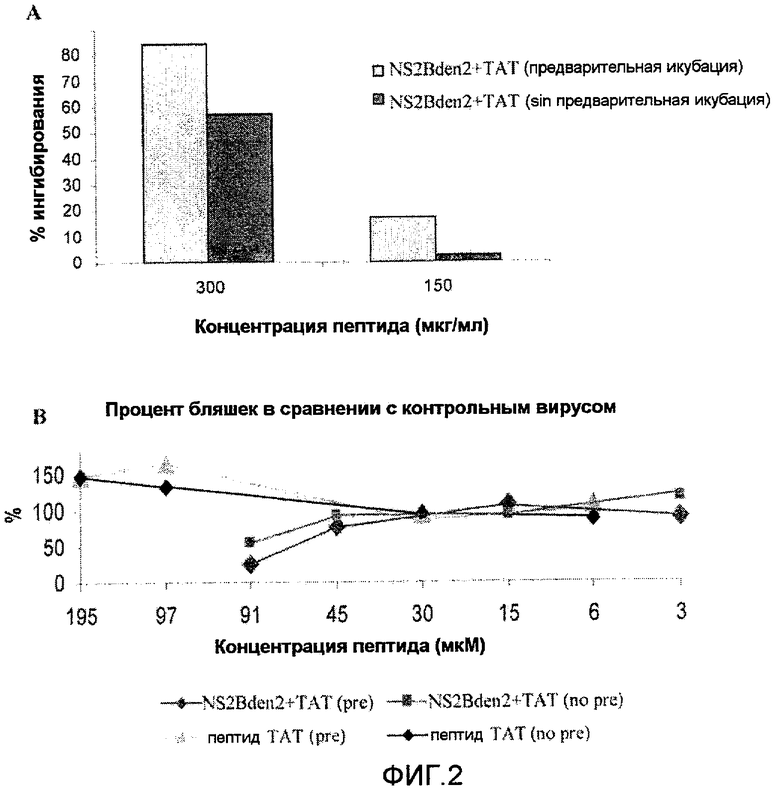
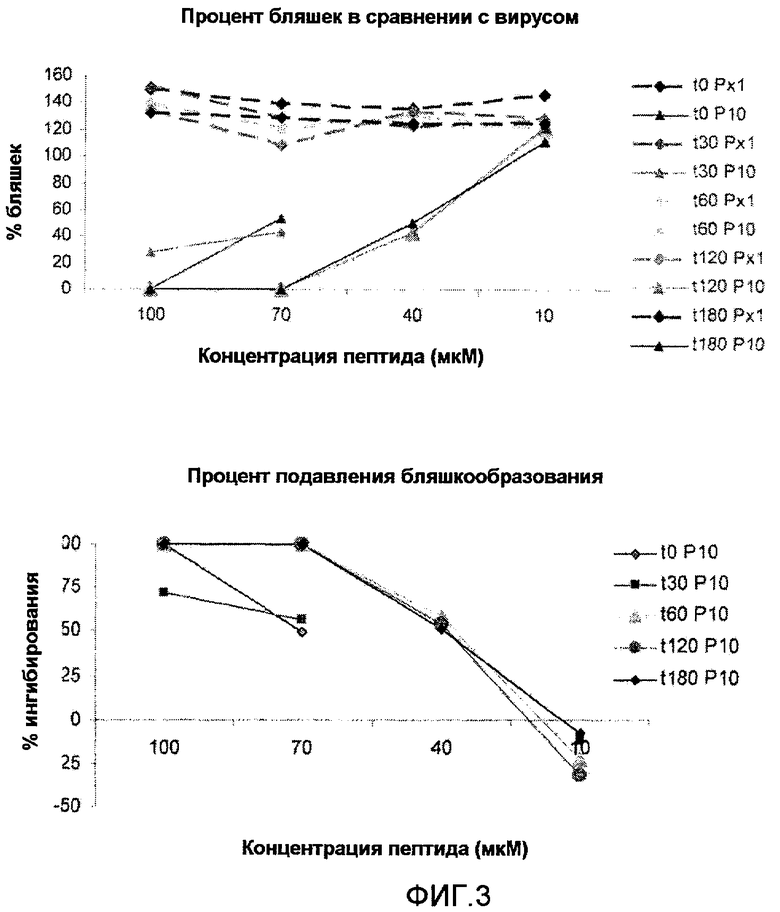
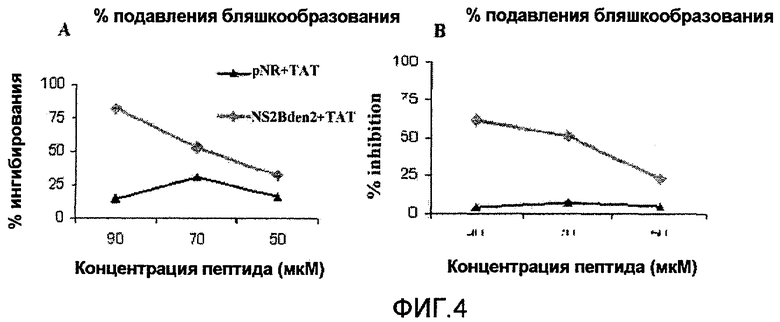
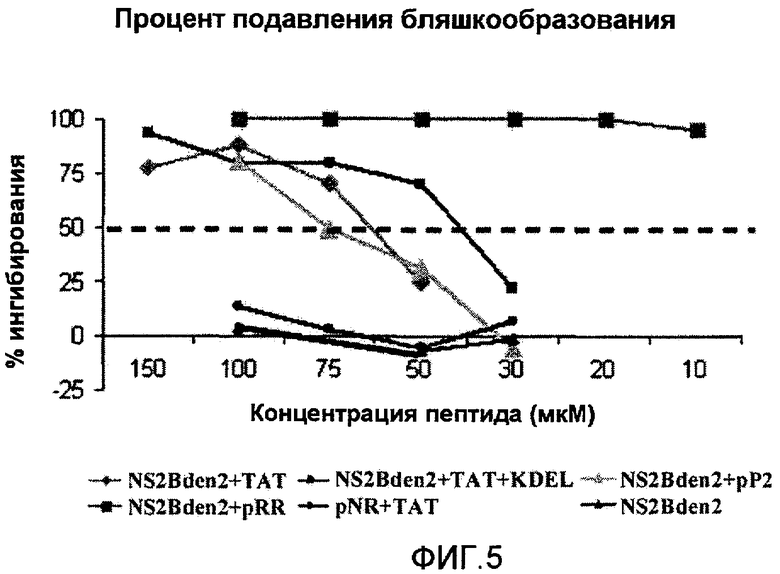
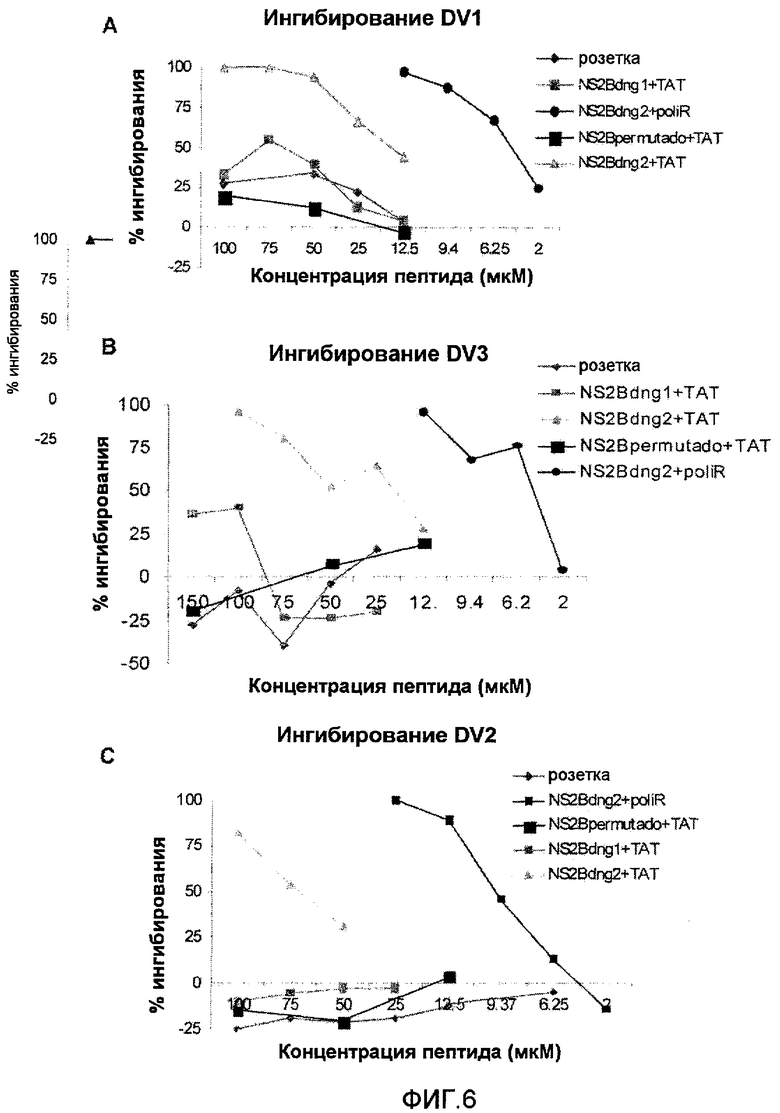
Изобретение относится к области биотехнологии, генной инженерии и вирусологии. Описаны химерные пептиды, способные ингибировать или аттенуировать вирусную инфекцию. Пептиды содержат первичную структуру, которая содержит, по меньшей мере, один сегмент, который замедляет активацию протеазы NS3 вируса семейства Flaviviridae, и сегмент, проникающий в клетку. Также раскрыта фармацевтическая композиция, содержащая такие химерные пептиды. Изобретение может быть использовано в медицине. 2 н. и 3 з.п. ф-лы, 6 ил., 3 табл., 4 пр.
1. Химерный пептид, характеризующийся наличием первичной структуры, включающей, по меньшей мере, один сегмент ингибитора активации протеазы NS3pro из вируса семейства Flaviviridae и сегмент, проникающий в клетку, где указанный химерный пептид способен ингибировать или аттенуировать инфекцию, вызываемую вирусом семейства Flaviviridae, причем указанный химерный пептид имеет последовательность, выбранную из SEQ ID NO:1-62 и 65-364.
2. Химерный пептид по п.1, в котором упомянутый вирус семейства Flaviviridae является одним из следующих Flavivirus: вирус Западного Нила, вирус энцефалита Сент-Луис, DV1, DV2, DV3, DV4, вирус японского энцефалита, вирус желтой лихорадки, вирус Kunjin, вирус киасанурской лесной болезни, вирус клещевого энцефалита, вирус энцефалита долины Мюррея, вирус LANGAT, вирус энцефаломиелита овец, вирус Powassan.
3. Химерный пептид по п.1, в котором упомянутый вирус семейства Flaviviridae является Hepacivirus и, в частности, HCV.
4. Химерный пептид по п.1, характеризующийся тем, что он являются липидизированным, и липидизация повышает противовирусную активность пептида.
5. Фармацевтическая композиция, характеризующаяся содержанием одного или более пептидов по п.1, и эффективная для профилактики и/или терапевтического лечения инфекции, вызываемой одним или более вирусами семейства Flaviviridae.
| WO 2006078657 A2, 27.07.2006 | |||
| WO 9907733 A2, 18.02.1999 | |||
| WO 9743310 A1, 20.11.1997. |
Авторы
Даты
2012-05-20—Публикация
2007-10-30—Подача