Изобретение относится к новым биологически активным производным 1-(1-адамантил)этиламина (ремантадина), представляющим собой адамантил-пептиды, обладающие противовирусным действием, в первую очередь в отношении вируса гепатита C. Изобретение может найти применение в медицине, фармакологии и вирусологии в качестве новых лекарственных веществ для лечения гепатита С.
Известно, что гепатит C представляет серьезную проблему для здравоохранения. По данным ВОЗ 3% населения (около 170 млн человек) инфицированы вирусом гепатита C (ВГС), который в большинстве случаев приводит к хроническим медленно прогрессирующим поражениям печени, а также других органов и тканей человека. Цирроз и гепатоцеллюлярная карцинома являются наиболее частыми осложнениями инфекции, вызванной ВГС. ВГС является главной причиной смертности в результате разрушения печени и одной из наиболее распространенных причин трансплантации донорской печени.
ВГС принадлежит роду Hepacivirus семейству Flaviviridae [1]. Вирусный геном состоит из одноцепочечной положительной РНК длиной около 9,6 Кб. Он кодирует белок предшественник порядка 3000 аминокислотных остатков, который нарезается пост-трансляционно в эндоплазматическом ретикулуме клеточными и вирусными протеазами, что приводит к образованию 10 белков [2]. Их подразделяют на структурные, капсидные белки и два оболочечных гликопротеина E1 и E2, отвечающие за связывание с ко-рецепторами и внедрение в гепатоциты. Также образуются неструктурные короткие мембранные белки p7, которые, как полагают, действуют как виропорины [3]. По крайней мере, доказано, что в культуре клеток p7 демонстрирует функцию ионных каналов, необходимых для сборки вируса и оптимального выхода из инфицированных клеток путем изменения кислотно-щелочного равновесия внутриклеточных везикул [4]. В естественных условиях р7 имеет большое значение для проявления инфекционных свойств вируса [5].
Известно, что для лечения ВГС на сегодня наиболее эффективными являются препараты интерферона (ИФН), или ИФН в сочетании с рибавирином. Однако у большинства пациентов, инфицированных ВГС и в особенности генотипом 1b, доминирующим в циркуляции на территории Российской Федерации, нельзя достичь устойчивого терапевтического эффекта с помощью этих препаратов. Низкий уровень доступности данных препаратов из-за их высокой стоимости, выраженность побочных эффектов при длительном их применении продолжает стимулировать интерес к поиску новых доступных и эффективных препаратов против ВГС. Для решения этой проблемы исследователи ищут новые классы препаратов, которые действуют иначе, нежели ИФН и рибавирин, и нацелены непосредственно на вирусную частицу.
Основная цель состоит в том, чтобы найти препараты "прямого действия", которые атакуют различные механизмы жизнедеятельности вируса и минимизируют риск возникновения резистентности.
Данные кристаллографических исследований показывают, что присутствующий в белковой оболочке ВГС ионоселективный канал содержит 6 одинаковых субъединиц p7 и представляет собой гексамер. Каждый p7 мономер ВГС состоит из 63 аминокислотных остатков в основном гидрофобных и положительно заряженных. Вторичная структура мономера состоит из двух трансмембранных спиралей и короткой петли. Причем петля обращена к цитоплазме, a N- и C-концы полипептида к эндоплазматическому ретикулуму.
Важную роль в воспроизводстве вирусных частиц ВГС играет ионный канал р7 и представляет новую важную терапевтическую мишень [6]. Ранее было определено, что функции p7 протонного канала могут быть заблокированы небольшими молекулами ингибиторами, что приведет к блокаде воспроизводства вирусных частиц [7].
Была подтверждена функция белка p7 ВГС как ионного канала в искусственном липидном бислое. Эксперименты in vitro демонстрировали возможность прекращения работы канала, образованного белком p7, посредством амантадина [8]. Известно, что амантадин (1-аминоадамантан) и ремантадин (1-(1-адамантил)этиламин) используются для лечения и профилактики гриппозной инфекции. Их противовирусная активность связана с угнетением функции виропорина, образованного белком M2 в белковой оболочке вируса гриппа A, который регулирует транспорт протонов через оболочку вируса внутрь вириона. Присутствие объемного карбоцикла адамантана в поре мембраны вируса приводит к нарушению транспорта протонов за счет возникновения водородной связи между аминогруппой амантадина и оксигруппой серина в положении 31 в трансмембранном домене [9]. Многие исследователи полагают, что ионоселективные каналы можно рассматривать как «ахиллесову пяту» вирусов. Принцип действия ионного канала p7 в клеточных мембранах и его блокировка посредством амантадина подтверждают факт того, что этот виропорин можно рассматривать как цель для будущей противовирусной химиотерапии.
Изложенные выше данные дают право предположить, что молекула карбоцикла аминоадамантана, обеспеченная дополнительными функционально активными группами, в процессе взаимодействия с трансмембранным доменом гексамера белка р7 способна нарушить процесс транспорта ионов через мембрану вируса. Источником таких функционально активных групп могут являться пептидные остатки, введенные в ремантадин методами пептидного синтеза. Предположено, что на возникновение ннгибирующих свойств в отношении ионного канала p7 ВГС может влиять как природа функциональной группы аминокислотного остатка, так и расстояние между ней и карбоциклом адамантана.
Задачей настоящего изобретения является разработка и синтез новых производных адамантана в качестве соединений, высокоселективно подавляющих репродукцию ВГС.
Предлагаемые соединения относятся к новым адамантановым производным 1-(1-адамантил)этиламина (ремантадина) и имеют следующие формулы:
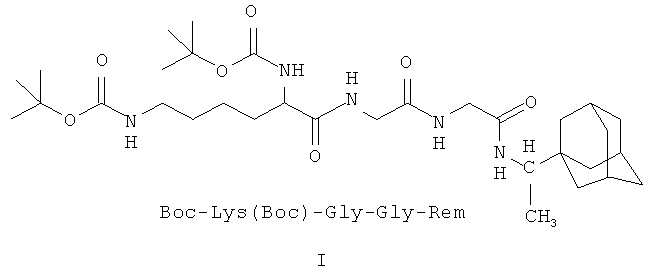
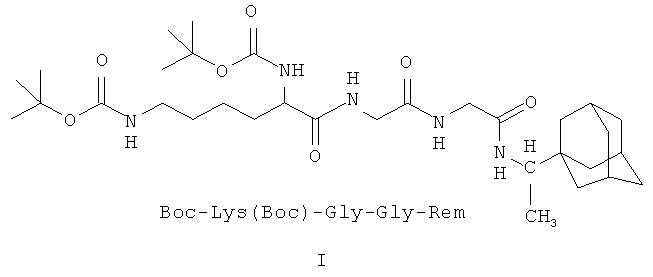
I - Ди(трет-бутилоксикарбонил)-лизил-глицил-глицил-1-(1-адамантил)этиламин;
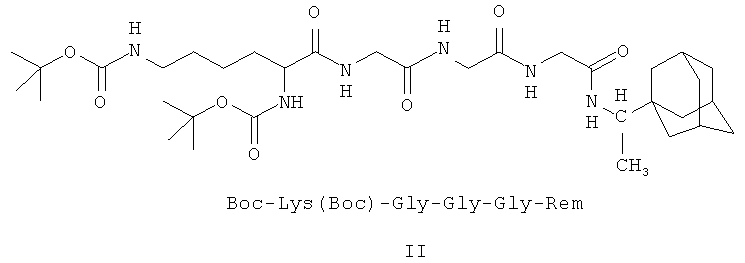
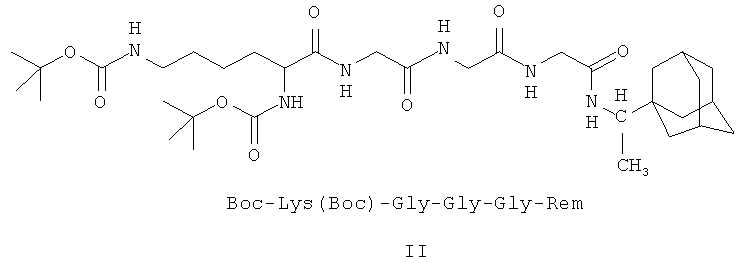
II - Ди(трет-бутилоксикарбонил)-лизил-глицил-глицил-глицил-1-(1-адамантил)этиламин;
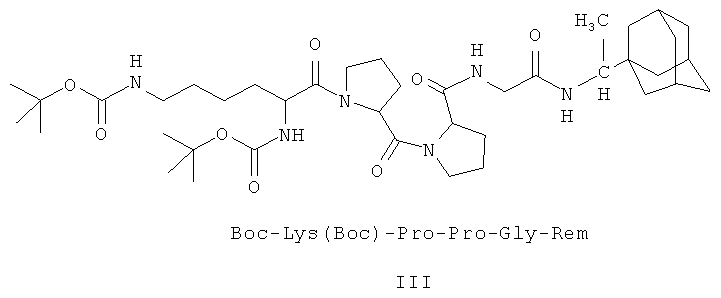
III - Ди(трет-бутилоксикарбонил)-лизил-пролил-пролил-глицил-1-(1-адамантил)этиламин.
Технический результат - получены новые малотоксичные соединения, обладающие избирательной противовирусной активностью в отношении ВГС. Более того, выявлена вирулицидная активность соединения II, снижающая инфекционность ВГС на пять логарифмов по сравнению с вирусным контролем (lgТЦИД50=5,0).
Сущность изобретения заключается в создании новых соединений, являющихся пептидными производными 1-(1-адамантил)этиламина и обладающими противовирусным действием в отношении ВГС. Соединение II обладает вирулицидным эффектом.
Краткое описание чертежей. Для более ясного понимания сути заявленного изобретения, которое отражено в формуле изобретения, а также для демонстрации ее особенностей и преимуществ далее приводится подробное описание со ссылками на фигуры чертежей.
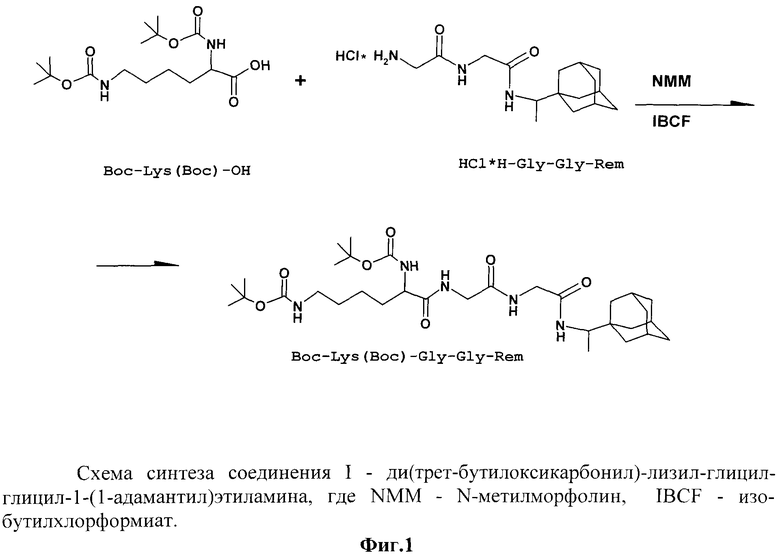
На фиг.1 представлена схема синтеза соединения Ди(трет-бутилоксикарбонил)-лизил-глицил-глицил-1-(1-адамантил)этиламина методом смешанных ангидридов. Соединения вносят в эквимолярных количествах. Исходные компоненты получены методами классического пептидного синтеза в растворе.
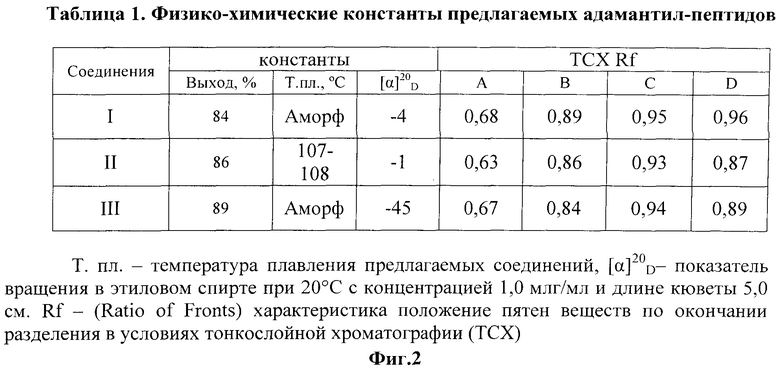
На фиг.2 представлены в виде Таблицы 1 физико-химические константы предлагаемых соединений.
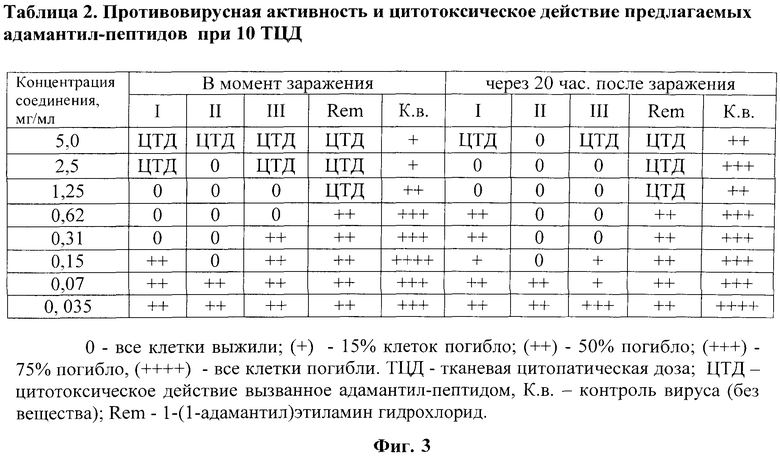
На фиг.3 представлены в виде Таблицы 2 данные о противовирусной и цитотоксической активности соединений при тканевой цитопатической дозе 10 (ТЦД10).
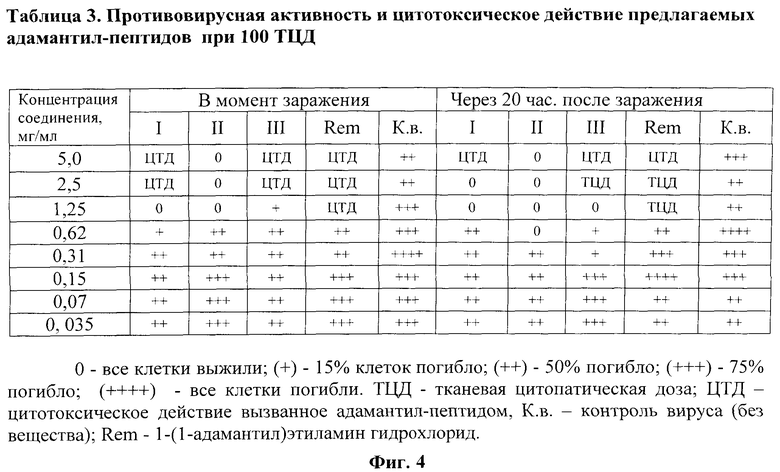
На фиг.4 представлены в виде Таблицы 3 данные о противовирусной и токсической активности соединений при ТЦД100.
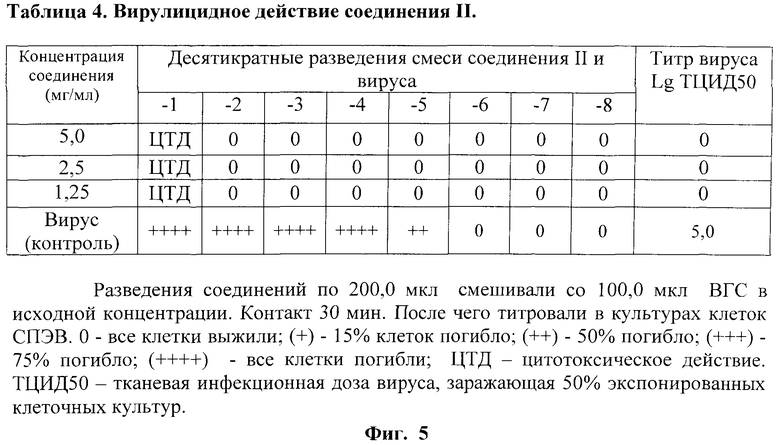
На фиг.5 представлены в виде Таблицы 4 данные вирулицидной активности соединения II при различных концентрациях и разведениях на монослое СПЭВ.
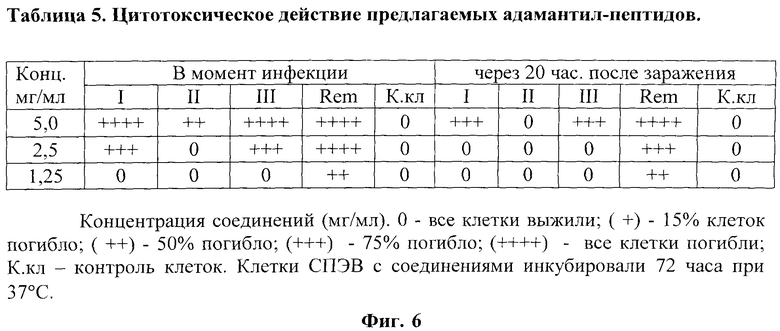
На фиг.6 представлено в виде Таблицы 5 цитотоксическое действие предлагаемых адамантил-пептидов на монослой культуры клеток СПЭВ.
Для получения соединений I-III может быть использован следующий синтетический подход на примере соединения I (фиг.1).
Эфиры N-ацилди- и трипептидов получены методами классического пептидного синтеза в растворе. Эфиры N-ацилди- и трипептидов в процессе синтеза омыляли 0,1н. NaOH (ацетон-вода, 1:1). Образование пептидной связи между 1-(1-адамантил)этиламином, содержащим аминогруппу, и пептидами, защищенными по аминогруппе трет-бутилоксикарбонильными группами (Ищс-), проводили в одну стадию в условиях реакции смешанных ангидридов в эквимолярном соотношении. В последствии трет-бутилоксикарбонильную группу удаляли действием этилацетата насыщенного 4н. HCl, при комнатной температуре. Полученный хлоргидрат адамантил-пептида конденсировался с ди(трет-бутилоксикарбонил)-лизином посредством реакции смешанных ангидридов.
В синтезе пептидов использованы L-аминокислоты фирмы Nova Biochem (США). В синтезе адамантановых производных использованы рацемический ремантадин фирмы Zhejiang Kangyu Pharmaceutical Со (Китай). Использовали изо-бутилхлорформиат (IBCF) фирмы «Fluka» (Швейцария), N-метилморфолин (NMM) фирмы «Koch Light Laboratories); (Англия). Тонкослойную хроматографию (ТСХ) проводили на пластинах Silufol (Чехия) в системах: метанол-хлороформ (13:60) (A), втор-бутанол - 3%-ный аммиак (100:44) (B), н-бутанол - уксусная кислота - вода - пиридин (30:3:12:10) (C), изо-пропанол - вода - 3%-ный аммиак (7:1:2) (D), позволяющих констатировать полное отсутствие в испытуемых образцах следов ремантадина. Физико-химические константы предлагаемых соединений представлены в таблице 1 (фиг.2).
Вирусологические исследования проведены с цитопатогенным вариантом ВГС, генотип 1b, выделенным из сыворотки крови больных хроническим гепатитом C [10]. Вируссодержащий материал использовали в виде пробы культуральной жидкости, собранной через 5 суток после заражения клеточных культур. Изучение противовирусной активности соединений I, II, III проведено на чувствительной к продукции ВГС культуре клеток почки эмбриона свиньи (СПЭВ). Культуры выращивали в виде двухдневного монослоя в 48-луночных пластиковых культуральных панелях в среде 199 (производство НИИ полиомиелита и вирусных энцефалитов им. М.П.Чумакова РАМН) с добавлением 100 ЕД/мл пенициллина и стрептомицина и 10%-ной сыворотки крупного рогатого скота. Контроль культуральных клеток проводили с помощью светооптического микроскопа.
Для более конкретного понимания биологических свойств полученных соединений в предлагаемом изобретении под противовирусной и вирулицидной активностью нужно понимать:
Вирулицидная активность соединения связана с прямым инактивирующим действием на вирионы в составе вирусной популяции, в результате чего частично или полностью утрачивается инфекционная активность вируса. Чтобы проверить вирулицидные свойства вещества (соединения), достаточно провести инкубацию смеси вируса и вещества в течение определенного времени, после чего проверить инфекционные свойства вируса без исследуемого вещества и вируса в смеси с веществом методом титрования в культурах клеток или в организме лабораторных животных. Достоверное снижение инфекционной активности вируса на 1,0 и более логарифмов (1g) или ее полная утрата по сравнению с вирусом без вещества свидетельствует о проявлении вирулицидной активности исследуемого соединения.
Противовирусная активность соединения, как правило, включает как вирулицидную активность вещества, так и его противовирусные свойства, т.е. способность ингибировать ту или иную стадию репликации вируса: от адсорбции вируса на клетки, его проникновения до влияния на сборку и выход вируса из зараженной клетки. Поэтому противовирусную активность исследуемого вещества проверяют путем обработки монослоя клеток или введением вещества лабораторным животным до заражения вирусом (профилактический эффект вещества), в момент заражения (лечебно-профилактический эффект) и через определенный интервал времени после заражения (лечебный эффект). Противовирусный эффект вещества оценивается как по проценту жизнеспособных инфицированных клеток, или здоровых лабораторных животных, сохранившихся в условиях применения вещества, по сравнению с контрольной группой, так и по его свойству снижать способность инфицированных клеток или зараженных животных продуцировать инфекционный вирус.
Для более полной иллюстрации настоящего изобретения ниже приводятся примеры. Однако эти примеры не должны рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
Пример 1. Синтез Boc-Lys(Boc)-Gly-Gly-Gly-Rem (II) {ди-трет-бутилоксикарбонил)-лизил-глицил-глицил-глицил-1-(1-адамантил)этиламин) и его выделение.
К 0,76 г (0,0022 моль) ди-третбутилоксикарбонил-лизина в 10,0 мл СНСl3 прибавляют 0,24 мл (0,0022 моль) NMM. Охлаждают до -25°C и при перемешивании в реакционную массу добавляют 0,30 мл (0,0024 моль) изо-бутилхлорформиата IBCF. Перемешивают 15 мин. Затем добавляют заранее приготовленный и охлажденный до -20°C раствор 0,85 г (0,0022 моль) хлоргидрата глицил-гицил-глицил-1-(1-адамантил)этиламина в 10,0 мл CHCl3 с 0,24 мл (0,0022 моль) NMM. Перемешивают 30 мин, затем еще 1 час при 0°C и 2 часа при комнатной температуре.
Реакционную массу освобождают от CHCl3 в вакууме. Остаток растворяют в 35,0 мл этилацетата. Экстрагируют последовательно H2O (5,0 мл×1), 0,5 н. NaHCO3 (10,0 мл×2), 0,5н. H2SO4 (4,0 мл×1) и H2O (5,0 мл×1). Органический слой сушат безводным Na2SO4.
Этилацетат удаляют в вакууме, получают белую пену, которая закристаллизовывается в смеси гексан-эфир (1:1).
Выход: 1,22 г (82%), Тпл. 107-108°, Rf=0,89 (A); Rf=0,68 (B); Rf=0,95 (C), Rf=0,96 (D), 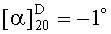
Аналогичным образом были получены соединения I и III.
Пример 2. Исследование противовирусной активности соединений I-III. Противовирусную активность предлагаемых соединений определяли в инфицированных ВГС культурах клеток СПЭВ. Соединения вносили в момент заражения клеток (эксперимент - 1) и через 20 час после заражения (эксперимент - 2) в концентрациях 5,0; 2,5; 1,25; 0,62; 0,15; 0,07 и 0,035 мг/мл. Панели инкубировали при 37°C 24 часа. Противовирусную активность соединений определяли по их способности защищать клетки СПЭВ от цитопатогенного действия вируса в сравнении с референс препаратом (ремантадин) в тех же концентрациях и контрольными инфицированными культурами (без соединения). Исследование проводили при тканевой цитопатической дозе 10 (ТЦД10) (фиг.3) и при ТЦД100 (фиг.4).
Обнаружено, что синтезированные соединения (I-III) показали высокую степень ингибирования репродукции ВГС. Следует отметить выраженный противовирусный эффект соединений и при внесении их в культуру клеток через 20 час после заражения ВГС. Наиболее активным противовирусным действием обладает соединение II, которое эффективно подавляло репликацию ВГС уже при концентрации 0,15 мг/мл как в эксперименте - 1, так и в эксперименте - 2. (фиг.3 и 4).
Пример 3. Исследование вирулицидной активности соединения II в отношении ВГС.
Вирулицидная активность проиллюстрирована на примере соединения II. В опыте использованы соединение в концентрациях 5,0, 2,5 и 1,25 мг/мл, которые смешивали с вирусом следующим образом - 200,0 мкл раствора соединения с добавлением 100,0 мкл ВГС-содержащего материала в исходной концентрации. Экспозиция с вируссодержащим материалом проведена при комнатной температуре в течение 30 минут. После чего титровали инфекционную активность ВГС в каждом варианте опыта в культурах клеток СПЭВ при различных разведениях смеси соединения II с ВГС. Соединение характеризовалось вирулицидной активностью только в том случае, если снижение инфекционного титра ВГС для клеток СПЭВ после экспозиции составило 100 и более раз.
В результате была обнаружена высокая вирулицидная активность соединения II. Снижение инфекционного титра произошло более чем на пять логарифмов (10000 раз) по отношению к вирусному контролю. Данные представлены в таблице 4 (фиг.5).
Пример 4. Определение цитотоксического действия соединений I-III.
Токсичность соединений была изучена при внесении их в концентрациях 5,0, 2,5 и 1,25 мг/мл на монослой клеток культуры ткани СПЭВ в 48-луночных панелях и инкубации при 37°C. Состояние клеточного монослоя проверяли под микроскопом. Максимально переносимой концентрацией (МПК) считают половину концентрации соединения, которая не оказывает на клетки токсического действия.
Отмечено, что цитотоксическое действие соединений I и III значительно меньше, чем у ремантадина; их МПК составляет порядка 0,625 мг/мл, а для соединения II МПК составило порядка 1,25 мг/мл (фиг.6).
Т.о. получены новые соединения формулы I-III на основе адамантил-пептидов, обладающие избирательной противовирусной активностью. Предлагаемые соединения способны ингибировать репликацию ВГС. Соединения с формулой I-III in vitro обладают значительно меньшей токсичностью по сравнению с ремантадином. Причем соединение II имеет наибольшую МПК, а также проявляет вирулицидную активность в отношении ВГС. Эти аминокислотные производные адамантана способны эффективно проникать в мембранный фосфолипидный бислой оболочки вируса. Механизм противовирусного действия полученных соединений до конца не ясен. Основной предполагаемый механизм противовирусного действия, вероятно, сходен с действием амантадина на ионный канал p7 ВГС, которое обнаружили C. Гриффин и сотрудники [8]. Адамантановый карбоцикл проникает в мембрану вирусной частицы, где находится ионоселективный канал p7 ВГС, представляющий наиболее вероятную мишень для предлагаемых соединений. Адамантан в этом случае, очевидно, исполняет роль носителя, к которому «прицеплена» функционально активная группа соответствующего пептида. Предлагаемые соединения могут быть применены для создания новых противовирусных препаратов, ингибиторов функции ионоселективного канала ВГС с использованием как в виде индивидуального лекарства, так и в составе комплексной терапии, подобно высокоактивной антиретровирусной терапии (ВААРТ), которую сейчас применяют для лечения ВИЧ-инфекции.
Литература
1. Jones C.Т., Murray C.L., Eastman D.K. et. al. «Hepatitis С virus p7 and NS2 proteins are essential for production of infectious virus». J. Virol. 2007, v.81(16), p.8374-8383.
2. Cook G.A., Opella S.J. «NMR studies of p7 protein from hepatitis С virus». Eur. Biophys J. 2010, V.39, p.l097-1104.
3. Tedbury P., Welbourn S., Pause A. et al. «The subcellular localization of the hepatitis С virus non-structural protein NS2 regulated by an ion channel-independent function of the p7 protein». J. Gen. Virol. 2011, v.92(4), p.819-30.
4. Murphy S., Martin S., Parton R.G. «Lipid droplet-organelle interactions; sharing the fats». Biochim Biophys Acta. 2009. v.1791(6), p.441-447.
5. Martin S, Parton RG. «Lipid droplets: a unified view of a dynamic organelle)). Nat. Rev. Mol. Cell. Biol. 2006. v.7(5), p.373-378.
6. Griffin S.D.C., Harvey R., Clarke D.S., et al. «A conserved basic loop in hepatitis С virus p7 protein is required for amantadine-sensitive ion channel activity in mammalian cells but is dispensable for localization to mitochondria)). J. Gen. Virol. 2004. v.85, p.451-461.
7. T.L.Foster, M.Verow, A.L.Wozniak, et al. «Resistance Mutations Define Specific Antiviral Effects for Inhibitors of the Hepatitis С Virus p7 Ion Channel)). Hepatolodgy. 2011. v.54(l), p.79-90.
8. Griffin, S.D., Beales, L.P., Clarke, D.S., et. al. «The p7 protein of hepatitis С virus forms an ion channel that is blocked by the antiviral drug, amantadine)). FEBS Lett. 2003. v.30, p.34-38.
9. Cady S.D., Mishanina T.V., Hong M. et. al. «Structure of amantadine-bound M2 transmembrane peptide of influenza A in lipid bilayers from magic-angle-spinning solid-state NMR: The role of Ser31 in amantadine binding)) J. Mol. Biol. 2009. v.385, p.1127-1141.
10. П.Г.Дерябин, Д.К.Львов. «Высокопродуктивный вариант вируса гепатита C. Выделение, характеристика, идентификация». Доклады Академии наук РФ, 1998, т.358, N.5, с.688-691.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИКЛОГЕКСАНОКСИКАРБОНИЛ-ДИПЕПТИД И ЕГО ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ГЕПАТИТА С | 2017 |
|
RU2641297C1 |
| ПРОИЗВОДНЫЕ 1-(1-АДАМАНТИЛ)ЭТИЛАМИН-N-АЦИЛАМИНОКИСЛОТ И ИХ ПРОТИВОГРИППОЗНАЯ АКТИВНОСТЬ | 2014 |
|
RU2572102C1 |
| АДАМАНТИЛАМИДЫ СЕРОСОДЕРЖАЩИХ КИСЛОТ И ИХ ПРОТИВОГРИППОЗНАЯ АКТИВНОСТЬ | 2015 |
|
RU2617850C1 |
| ПРОИЗВОДНЫЕ 2-ХИНАЛЬДИНКАРБОНОВОЙ КИСЛОТЫ И ИХ ПРОТИВОГРИППОЗНАЯ АКТИВНОСТЬ | 2015 |
|
RU2624906C2 |
| ШТАММ VIRUS HEPATITIS C, Д-1, ДЛЯ ПРИГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И ПРОФИЛАКТИЧЕСКИХ ПРЕПАРАТОВ | 1997 |
|
RU2130967C1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО | 2014 |
|
RU2564919C1 |
| ПРОИЗВОДНЫЕ 1-(1-АДАМАНТИЛ)ЭТИЛАМИНА И ИХ ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ | 2011 |
|
RU2461544C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОРБЕНТА ПОЛИСУРЬМИН | 2007 |
|
RU2324535C1 |
| ПРОТИВОВИРУСНОЕ СОЕДИНЕНИЕ МНОЖЕСТВЕННОГО ДЕЙСТВИЯ, ЕГО СОСТАВ И СПОСОБ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2597150C2 |
| Средство, обладающее противовирусным действием в отношении вируса клещевого энцефалита | 2022 |
|
RU2812292C1 |
Изобретение относится к новым биологически активным производным 1-(1-адамантил)этиламина (ремантадина), представляющим собой адамантил-пептиды, обладающие противовирусным действием. Полученные новые малотоксичные соединения обладают избирательной противовирусной активностью в отношении ВГС. Изобретение может найти применение в медицине, фармакологии и вирусологии в качестве новых лекарственных средств для лечения гепатита С. 2 з.п. ф-лы, 6 ил., 4 пр.
1. Пептидные производные 1-(1-адамантил)этиламина и имеющие следующие формулы:
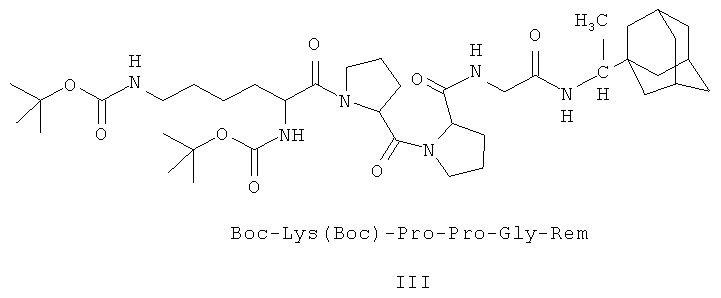
2. Соединения I-III по п.1, обладающие избирательной противовирусной активностью в отношении вируса гепатита C.
3. Соединения II по п.1, обладающие вирулицидной активностью в отношении вируса гепатита C.
| ПРОИЗВОДНЫЕ 1-(1-АДАМАНТИЛ)ЭТИЛАМИНА И ИХ ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ | 2011 |
|
RU2461544C1 |
| RU 2008100606 A, 27.07.2009 | |||
Авторы
Даты
2014-07-27—Публикация
2013-04-09—Подача