ССЫЛКИ НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка претендует на приоритет предварительной заявки на патент США № 60/771090, поданной 7 февраля 2006 г., которая полностью включена в настоящую заявку в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам лечения заболеваний и состояний центральной и периферической нервной системы путем стимуляции или усиления нейрогенеза с помощью производного 4-ациламинопиридина. Настоящее изобретение включает способы, основанные на применении производного 4-ациламинопиридина для стимуляции или активации образования новых нервных клеток.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Нейрогегенез представляет собой жизненно важный процесс, протекающий в головном мозге животных и человека, в ходе которого непрерывно, на протяжении всей жизни организма, образуются новые нервные клетки. Вновь созданные клетки способны к дифференцировке в функциональные клетки центральной нервной системы и к последующей их интеграции в существующие невральные циклы мозга. Известно, что в зрелом возрасте нейрогенез существует в двух участках мозга млекопитающих: в субвентрикулярной зоне (SVZ) латеральных желудочков и в зубчатой извилине гиппокампа. В этих участках мультипотентные клетки-предшественники нервных клеток (NPC) продолжают делиться, создавая возможности для появления новых функциональных нейронов и глиальных клеток (см. обзор Gage 2000). Было показано, что нейрогенез в гиппокампе зрелого организма может стимулировать множество факторов, таких как адреналэктомия, двигательная активность, хорошие экологические условия, зависимый от гиппокапма процесс обучения и антидепрессанты (Yehuda 1989, van Praag 1999, Brown J 2003, Gould 1999, Malberg 2000, Santarelli 2003). Другие факторы, такие как гормоны надпочечников, стресс, возрастные изменения и лекарственная зависимость, оказывают отрицательный эффект на нейрогенез (Cameron 1994, McEwen 1999, Kuhn 1996, Eisch 2004).
В патенте США № 5397785 описывается большое число производных 4-ациламинопиридина и композиций, включающих их, а также их использование при лечении старческой деменции и болезни Альцгеймера. В патенте США № 6884805 описываются полиморфные кристаллы производного 4-ациламинопиридина и их использование для активации нарушенной функции холинергических нейронов, которые ассоциированы с потерей памяти. Однако ни в одном из этих патентов не рассматривается использование производного 4-ациламинопиридина применительно к нейрогенезу.
Указанные выше документы процитированы не с точки зрения описания уровня знаний, достигнутого в данной области. Все ссылки, касающиеся даты материалов или их содержания, основаны на информации, доступной заявителю, и не могут рассматриваться как полностью корректные по временным параметрам и всеобъемлющие по содержанию.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении описываются способы профилактики и лечения заболеваний, состояний и повреждений центральной и периферической нервной системы путем стимуляции или усиления нейрогенеза. Различные аспекты настоящего изобретения включают усиление нейрогенеза в случаях заболевания, расстройства или патологического состояния нервной системы. Описываемые варианты осуществления настоящего изобретения охватывают способы лечения нейродегенеративного расстройства, неврологической травмы, включающей травму головного мозга или травму центральной нервной системы, и/или восстановления после нее, способы лечения депрессии, тревожного состояния, психоза, расстройств обучения и памяти, а также ишемии центральной и/или периферической нервной системы.
В одном аспекте настоящее изобретение относится к способам стимуляции или усиления нейрогенеза. Рассматриваемый нейрогенез может определяться уровнем клетки или ткани. Указанная клетка или ткань может присутствовать в организме животного или человека или, альтернативно, может быть представлена как структура in vitro или ex vivo. В некоторых вариантах осуществления настоящего изобретения нейрогенез стимулируют или усиливают в нервной клетке или ткани, такой как центральная или периферическая нервная система животного или человека. В случае животного или человека, указанные способы могут осуществляться применительно к одному или нескольким заболеваниям, расстройствам или состояниям нервной системы, имеющимся в организме животного или человека. Таким образом, различные варианты осуществления настоящего изобретения включают способы лечения заболевания, расстройства или состояния путем введения неврологического агента, приведенного в настоящем описании.
В другом аспекте настоящее изобретение относится к способам использования химических веществ в качестве неврологических агентов для целей усиления нейрогенеза. В нескольких вариантах указанное химическое вещество представляет собой производное 4-ациламинопиридина, описанное в патенте США № 5397785, который полностью включен в настоящее описание в качестве ссылки. В одном неограничивающем варианте указанное производное представляет собой 2-(2-оксипирролидин-1-ил)-N-(2,3-диметил-5,6,7,8-тетрагидрофуро(2,3-b)хинолин-4-ил)ацетамид. В других вариантах указанное производное представлено в форме полиморфных кристаллов, как описано в патенте США № 6884805, который полностью включен в настоящее описание в качестве ссылки. Разумеется, настоящее изобретение не ограничивается использованием только одного производного. В других вариантах своего осуществления настоящее изобретение относится к использованию одного или нескольких производных в сочетании с другим неврологическим агентом.
В другом аспекте осуществления настоящего изобретения рассматриваемые в нем способы включают идентификацию пациента, страдающего от одного или нескольких заболеваний, расстройств или состояний, или идентификацию их симптомов и введение указанному пациенту по меньшей мере одного нейрогенного агента согласно настоящему описанию. В рамках неограничивающего примера, указанным агентом является производное 4-ациламинопиридина, такое как 2-(2-оксипирролидин-1-ил)-N-(2,3-диметил-5,6,7,8-тетрагидро(2,3-b)хинолин-4-ил)ацетамид. В некоторых вариантах своего осуществления настоящее изобретение относится к способу, включающему идентификацию субъекта, которому необходимо усилить нейрогенез, и введение указанному субъекту одного или нескольких нейрогенных агентов согласно настоящему описанию. В других вариантах осуществления настоящего изобретения указанный субъект представляет собой пациента, такого как человек.
Настоящее изобретение также относится к способу, включающему введение одного или нескольких нейрогенных агентов субъекту, у которого выявлены признаки недостаточности нейрогенеза или его неадекватных уровней. В некоторых вариантах указанным субъектом может быть субъект, которому вводят агент, который снижает или ингибирует нейрогенез. Неограничивающие примеры ингибитора нейрогенеза включают агонисты опиоидного рецептора, такие как агонист мю-рецептора наподобие морфина. Кроме того, настоящее изобретение относится к введению одного или нескольких нейрогенных агентов субъекту или индивидууму, для лечения которого используют агент, снижающий или ингибирующий нейрогенез. В некоторых вариантах указанный субъект или индивидуум может представлять собой такого субъекта или индивидуума, которому вводят морфин или другой агонист опиоидного рецептора, типа опиата, так чтобы достичь у данного субъекта снижения или ингибирования нейрогенеза. Соответствующие неограничивающие примеры включают введение нейрогенного агента субъекту до, одновременно или после введения указанному субъекту морфина или другого опиата, в сочетании с хирургической процедурой.
В настоящем изобретении описываются также способы получения популяции стволовых невральных клеток, пригодных для трансплантации, включающие культивирование популяции стволовых невральных клеток (NSC) in vitro, и контактирование указанных стволовых невральных клеток по меньшей мере с одним нейрогенным агентом согласно настоящему изобретению. В некоторых вариантах стволовые клетки получают и затем переносят в организм-хозяин человека или животного. Неограничивающие примеры указанного способа получения включают 1) контактирование с клетками до тех пор, пока клетки не вступят в нейрогенез, так чтобы его результат можно было выявить путем визуального осмотра или подсчета клеток или 2) контактирование с клетками до тех пор, пока клетки не станут в достаточной мере стимулированными или индуцированными для вступления в нейрогенез или в направлении его усиления. Полученные в рамках такого неограничивающего способа клетки могут быть далее трансплантированы субъекту, необязательно при одновременном, почти одновременном или последовательном введении нейрогенного агента указанному субъекту. Поскольку указанные невральные стволовые клетки могут быть представлены в виде культуры или клеточной линии in vitro, в ряде других вариантов осуществления настоящего изобретения указанные клетки могут быть частью ткани, которая позже может быть трансплантирована субъекту.
В еще одном аспекте настоящее изобретение относится к способам стимуляции или усиления нейрогенеза у субъекта за счет введения производного 4-ациламинопиридина и одного или нескольких дополнительных нейрогенных агентов. В некоторых вариантах нейрогенез проводят в сочетании со стимуляцией ангиогенеза, что обеспечивает поступление новых клеток в систему кровообращения.
Детали дополнительных вариантов осуществления настоящего изобретения приведены в следующем ниже описании и в сопровождающих его чертежах. Другие признаки, цели и преимущества настоящего изобретения станут понятны специалистам из прилагаемых чертежей, подробного описания и формулы изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 приведена кривая зависимости доза-ответ, демонстрирующая эффект нейрогенного агента MKC-231 на дифференциацию нейронов. Данные представляют собой процент относительно положительного нейронального контроля, при соответствующем вычитании показателей, характерных для базальной среды. Показатель ЭК50 соответствует концентрации MKC-231, равной 5,1 мкМ, в исследуемых клетках, тогда как аналогичный показатель для клеток, взятых в качестве положительного контроля, оставляет 4,7 мкМ.
На фиг. 2 приведена кривая зависимости доза-ответ, демонстрирующая эффект нейрогенного агента MKC-231 на дифференциацию астроцитов. Показанные данные представляют собой процент относительно положительного контроля на астроциты, при соответствующем вычитании показателей, характерных для базальной среды. Показатель ЭК50 не определяется для MKC-231 (превышает исследованные концентрации), тогда как аналогичный показатель для клеток, взятых в качестве положительного контроля, оставляет 19,9 мкМ.
На фиг. 3 приведена кривая зависимости доза-ответ, показывающая эффект токсичности/тропизма MKC-231 на популяцию культивируемых невральных стволовых клеток. Показанные данные представляют собой процент относительно числа клеток в базальной среде.
На фиг. 4 приведена кривая зависимости доза-ответ, демонстрирующая усиление эффектов MKC-231 на дифференциацию нейронов при его объединении с агонистом AMPA (AMPA). Показанные данные представляют собой процент относительно положительного нейронального контроля, при соответствующем вычитании показателей, характерных для базальной среды. Показатель ЭК50 соответствует концентрации MKC-231, равной 0,99 мкМ, при использовании в сочетании с AMPA, тогда как при использовании одного MKC-231 указанный показатель составляет 5,1 мкМ.
На фиг.5 показана серия иммунофлуоресцентных снимков под микроскопом монослойных человеческих невральных стволовых клеток (hNSC) после иммуногистохимического окрашивания маркером нейронов TUJ-1 (зеленый маркер), маркером астроцитов GFAP (красный маркер) и маркером клеточных ядер (Hoechst 33342, синий цвет). Верхний левый снимок представляет собой отрицательный контроль (базальная среда), верхний снимок в середине представляет собой положительный контроль на нейроны (базальная среда плюс известный промотор дифференцировки нейронов) и верхний правый снимок представляет собой положительный контроль на астроциты (базальная среда плюс известный индуктор дифференцировки астроцитов). Нижний левый снимок иллюстрирует эффект MKC-231 в концентрации 31,6 мкM на дифференцировку hNSC и нижний левый снимок иллюстрирует эффект MKC-231 в концентрации 31,6 мкM в сочетании с 0,3161 мкM AMPA на дифференцировку нейронов.
На фиг. 6 показана кривая, построенная по усредненным значениям результатов множества экспериментов (N=6), демонстрирующая усиление эффектов агента MKC-231 на нейрональную дифференцировку при его использовании в сочетании с фиксированной концентрацией агониста AMPA (0,32 мкM AMPA). AMPA в использованной концентрации сам по себе не усиливает дифференцировку нейронов (серая пунктирная линия). Показанные данные представляют собой процент относительно положительного нейронального контроля, при соответствующем вычитании показателей, характерных для базальной среды. Показатель ЭК50 соответствует концентрации MKC-231, равной 0,22 мкM, в случае наличия фиксированной концентрации AMPA (черная пунктирная линия), в сравнении со значением 3,7 мкM, при использовании одного MKC-231 (жирная черная линия).
На фиг. 7 приведена кривая зависимости доза-ответ, демонстрирующая ингибирование эффектов агента MKC-231 на нейрональную дифференцировку при его сочетании с антагонистом AMPA (NBQX).
Показанные данные представляют собой процент относительно положительного нейронального контроля, при соответствующем вычитании показателей, характерных для базальной среды. Показатель ЭК50 определяется в концентрации MKC-231 >31,6 мкM, в случае его использования в сочетании с AMPA, тогда как при использовании одного MKC-231 указанный показатель составляет 5,1 мкM.
На фиг.8 показана диаграмма, иллюстрирующая изменение в нейрогенезе гиппокампа (увеличение числа новых нейронов), в сравнении с носителем, взятым в качестве контроля (±СКО). На оси y приведены данные по изменению в процентах относительно использованного контроля-носителя. Ежедневное введение от 1,0 до 4,0 мг/кг BCI-540 в течение 28 дней приводит к 22% и 20% увеличению числа новых нейронов в слое гранулярных клеток в зубчатой извилине, соответственно.
На фиг.9 показана диаграмма, иллюстрирующая изменение в периоде латентности применительно к приему пище в тесте по вновь созданной супрессии пищевого рефлекса (модель депрессии на животных), в сравнении с контролем-носителем (±СКО). На оси y показаны данные по изменению в процентах относительно контроля-носителя. Ежедневное введение 1,0 мг/кг BCI-540 и 10,0 мг/кг флуоксетина в течение 21 дня приводит к 35% и 38% снижению периода латентности к приему пищи, соответственно.
На фиг. 10 приведена диаграмма, показывающая среднее значение времени, в процентах, потраченное на открывание ручки в лабиринте (модель беспокойства на животных), в сравнении с контролем-носителем (±СКО).
Ежедневное введение BCI-540 в дозе 1,0 мг/кг в течение 21 дней привело к 20% повышению времени, потраченного на открывание ручек. Однократное введение классического анксиолитика диазепама привело к 12% повышению времени, потраченного на открывание ручек.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ НАСТОЩЕГО ИЗОБРЕТЕНИЯ
Термин "нейрогенез" используется в настоящем описании для обозначения пролиферации, дифференцировки, миграции и/или выживания нервных клеток in vivo или in vitro. В различных вариантах осуществления настоящего изобретения нервная клетка представляет собой зрелую, фетальную или эмбриональную стволовую нервную клетку или популяцию таких клеток. Указанные клетки могут быть локализованы в центральной нервной системе или в любом другом месте в организме животного или человека. Указанные клетки могут также находиться в ткани, такой как нервная ткань. В некоторых вариантах осуществления настоящего изобретения нервная клетка представляет собой зрелую, фетальную или эмбриональную родительскую клетку или популяцию клеток, включающих смесь стволовых клеток и родительских клеток. Нервные клетки включают все стволовые клетки головного мозга, все родительские клетки головного мозга и все клетки-предшественники (при дифференцировке) головного мозга. Рассматриваемый нейрогенез включает нейрогенез, осуществляемый при нормальном развитии, а также включает нервную регенерацию, имеющую место после болезни, повреждения или терапевтического вмешательства, такого как лечение, приведенное в настоящем описании.
Термин "нейрогенный агент" в контексте настоящего описания определяется как химический агент или химическое вещество, которые способны усиливать, стимулировать или иным способом повышать степень или уровень или усиливать природу нейрогенеза, осуществляемого in vivo или ex vivo или in vitro, относительно количества, степени или природы нейрогенеза, происходящего в отсутствие указанного агента или вещества. В некоторых вариантах считается, что лечение нейрогенным агентом усиливает нейрогенез, если оно повышает нейрогенез по меньшей мере примерно на 5%, по меньшей мере примерно на 10%, по меньшей мере примерно на 25%, по меньшей мере примерно на 50%, по меньшей мере примерно на 100%, по меньшей мере примерно на 500% или более, в сравнении со степенью, уровнем и/или природой нейрогенеза в отсутствие данного агента, в условиях способа, использованного для выявления или оценки нейрогенеза. В качестве неограничивающих примеров, можно отметить, что указанный агент может представлять собой низкомолекулярное органическое вещество, такое как производное 4-ациламинопиридина.
Термин "стволовая клетка" (или невральная стволовая клетка (NSC)), в контексте настоящего описания, относится к недифференцированной клетке, которая способна к самообновлению и к дифференцировке в нейроны, астроциты и/или олигодендроциты.
Термин "клетка-предшественник" (например, невральная родительская клетка), в контексте настоящего описания, относится к клетке, полученной из стволовой клетки, которая сама не является стволовой клеткой. Некоторые клетки-предшественники могут давать потомство, которое способно к дифференцировке с образованием клеток более чем одного типа.
Настоящее изобретение относится к способам повышения нейрогенеза путем контакта клеток с производным 4-ациламинопиридина, используемым в качестве нейрогенного агента. Указанные клетки могут быть представлены клетками in vitro или in vivo и включают клетки, которые присутствуют в ткани или органе животного или человека. Производное 4-ациламинопиридина может представлять собой такое производное, которое стимулирует или повышает нейрогенез. В одном неограничивающем примере указанное производное представляет собой 2-(2-оксипирролидин-1-ил)-N-(2,3-диметил-5,6,7,8-тетрагидро(2,3-b)хинолин-4-ил)ацетамид (известный также как MKC-231 или колурацетам, имеющий в системе классификации CAS номер 135463-81-9). Рассматриваемые клетки способны осуществлять нейрогенез, так что в результате образуются, либо путем прямой дифференцировки, либо путем пролиферации и дифференцировки, дифференцированные нейрональные или глиальные клетки. Репрезентативные и неограничивающие примеры других соединений-производных 4-ациламинопиридина, которые могут использоваться в рамках настоящего изобретения, описаны ниже, в разделе «Примеры».
Не ограничивая себя рамками каких-либо теорий и, несмотря на то, что некоторые производные 4-ациламинопиридина рассматриваются в контексте ингибирования активности ацетилхолинэстеразы (AChE), авторы настоящего изобретения не связывают его эффект с ингибированием AChE, поскольку MKC-231 не обладает такой ингибиторной активностью. Аналогично, настоящее изобретение не рассматривается в контексте связывания производного с мускариновыми или никотиновыми рецепторами. Считается, однако, что нейрогенное действие MKC-231 может проявляться через потенцирование или сенсибилизацию эффекта AMPA. Высказанные предположения имеют своей целью облегчить понимание изобретения, но не направлены на его ограничение.
Настоящее изобретение, в тех вариантах его осуществления, которые относятся к человеку или животному, описывает способ приведения данных клеток в контакт с нейрогенным агентом или с эффективным количеством указанного агента, так чтобы в результате достичь усиления нейрогенеза, в сравнении с вариантом отсутствия такого агента. Один неограничивающий пример включает введение агента животному или человеку. Указанный нейрогенный агент может рассматриваться как экзогенно введенный в клетку или ткань организма.
В некоторых вариантах термин "животное" или "животное-объект" относится к млекопитающему, отличному от человека, такому как примат, кошка или собака. В других вариантах данные термины применяются для обозначения одомашненного животного (таких как, например, домашний скот) или иного животного, за которым человек ухаживает и/или существование которого он поддерживает (например, животные в зоопарке, а также другие животные, используемые для показа). В рамках других неограничивающих примеров, указанные термины относятся к жвачным животным или к плотоядным животным, таким как кошки, собаки, птицы, лошади, крупный рогатый скот, овцы, козы, морские животные, в том числе млекопитающие, пингвины, олени, лоси и лисы.
Настоящее изобретение также относится к способам лечения заболеваний, расстройств и состояний центральной и/или периферической нервной системы (ЦНС и ПНС, соответственно) путем введения одного или нескольких нейрогенных агентов. В контексте настоящего описания термин "лечение" включает предупреждение, ослабление, облегчение и/или устранение заболевания, расстройства или состояния, как результата лечения, или одного или нескольких симптомов заболевания, расстройства или состояния, как результата лечения, а также улучшение общего самочувствия пациента, по данным оценки объективных и/или субъективных критериев. В некоторых вариантах рассматриваемое лечение применяют для реверсирования, ослабления, минимизации, супрессии или остановки нежелательных или вредных эффектов или эффектов, определяемых прогрессированием заболевания, расстройства или состояния центральной и/или периферической нервной системы. В других вариантах в рамках настоящего изобретения указанный способ лечения может с успехом использоваться в тех случаях, где добавочный нейрогенез должен будет замещать, восполнять или повышать число клеток, потерянных в связи с повреждением или заболеванием, рассматривая их как неограничивающие примеры.
Неограничивающие примеры симптомов, которые могут подвергаться лечению способами согласно настоящему описанию, включают аномальное поведение, аномальную двигательную активность, гиперактивность, галлюцинации, острый бред, агрессивность, враждебность, негативизм, абстиненцию, потребность в уединении, дефекты памяти, сенсорные дефекты, когнитивные дефекты и напряженное состояние. Неограничивающие примеры аномального поведения включают раздражительность, импульсивное поведение, нервно-психическое возбуждение и агрессивность.
В некоторых вариантах способы согласно настоящему изобретению включают использование производного 4-ациламинопиридина в качестве нейрогенного агента. Таким образом, настоящее изобретение включает способы контактирования клетки с производным 4-ациламинопиридина или введения такого производного субъекту с целью достижения нейрогенеза. Некоторые варианты включают использование одного производного, такого как MKC-231, или сочетания двух или более производных, такого как сочетание MKC-231 и другого производного, в качестве нейрогенного агента.
В некоторых вариантах один или несколько нейрогенных агентов, используемых в описанных способах согласно настоящему изобретению, являются по существу неактивными относительно других рецепторов, таких как мускариновые рецепторы, никотиновые рецепторы, допаминовые рецепторы и опиоидные рецепторы, рассматриваемых в качестве неограничивающих примеров.
В некоторых вариантах производное 4-ациламинопиридина вводят животному или человеку с достижением нейрогенеза. Производное 4-ациламинопиридина может, таким образом, использоваться для лечения заболевания, расстройства или состояния, приведенных в настоящем описании. В других вариантах производное 4-ациламинопиридина может использоваться для повышения нейрогенеза in vitro.
Нейрогенные агенты, используемые в различных вариантах осуществления настоящего изобретения, включают указанный выше MKC-231. Данное соединение описывается приведенной ниже формулой:
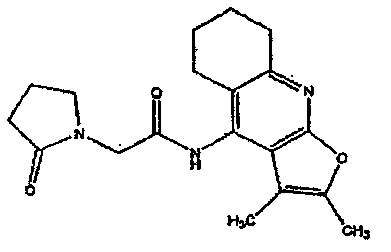
В некоторых вариантах производное 4-ациламинопиридина представляет собой производное, описанное в патенте США № 5536728, или имеет полиморфную кристаллическую форму, как описано в патенте США № 6884805. Структуры, данные по биологической активности, способы оценки указанной биологической активности, способы синтеза, режимы введения и фармацевтические композиции на основе таких соединений описаны в настоящей заявке.
Способы оценки природы и/или степени нейрогенеза in vivo и in vitro, для целей выявления природы и/или степени нейрогенеза, для идентификации агентов, модулирующих нейрогенез, для выделения и культивирования невральных стволовых клеток и для получения невральных стволовых клеток с целью трансплантации или для других целей описаны, например, в предварительной заявке на патент США № 60/697905 и в патентных публикациях США № 2005/0009742, 2005/0009847, 20050032702, 2005/0031538, 2005/0004046, 2004/0254152, 2004/0229291 и 2004/0185429, которые, все, полностью включены в настоящее описание в качестве ссылки.
Нейрогенез включает дифференцировку невральных клеток вместе с другими возможными линиями клеток. В некоторых аспектах осуществления настоящего изобретения дифференцировка невральных клеток или клеток-предшественников происходит вместе с линиями невральных и/глиальных клеток, необязательно с исключением дифференцировки по линии астроцитов.
Нейрогенные агенты согласно настоящему описанию включают фармацевтически приемлемые соли, производные, пролекарства и метаболиты рассматриваемых агентов. Способы получения и введения солей, производных, пролекарств и метаболитов различных агентов известны в данной области.
Соединения из числа приведенных в настоящем описании, которые содержат хиральный центр, включают все возможные стереоизомеры данного соединения, в том числе композиции, включающие рацемическую смесь двух энантиомеров, а также композиции, включающие каждый из энантиомеров, по отдельности, и которые по существу не содержат другой энантиомер. Таким образом, например, в настоящем изобретении рассматривается композиция, включающая S энантиомер соединения, и которая по существу не содержит R энантиомер, или включающая R энантиомер, и которая по существу не содержит S энантиомер. Если указанное соединение включает более чем один хиральный центр, область настоящего изобретения также охватывает композиции, включающие смеси диастереомеров в варьирующих пропорциях, а также композиции, включающие один или несколько диастереомеров, и которые по существу не содержат один или несколько других диастереомеров. Термин "по существу не содержит" обозначает в контексте настоящего описания композицию, которая включает менее чем 25%, 15%, 10%, 8%, 5%, 3% или менее чем 1% минорного энантиомера или одного или нескольких диастереомеров. Способы синтеза, выделения, получения и введения различных стереоизомеров известны в данной области.
Приведенные в настоящем описании способы могут использоваться для лечения любого заболевания или состояния, в случае которого полезно усиливать или иным образом стимулировать или повышать нейрогенез. Одним из главных аспектов описанных способов является достижение терапевтического результата за счет повышения нейрогенеза, при лечении старческой деменции, болезни Альцгеймера или нарушении памяти/потере памяти. Таким образом, некоторые приведенные в настоящем описании способы могут использоваться для лечения любого заболевания или состояния, чувствительного к лечению путем повышения нейрогенеза. Например, в некоторых вариантах осуществления настоящего изобретения описываемые в нем способы используются для лечения заболеваний или состояний, которые не ассоциированы с выраженной деменцией или значительным ухудшением памяти, таких как болезнь Паркинсона, которая характеризуется дегенерацией допаминергических нейронов. Таким образом, настоящее изобретение, в одном аспекте своего осуществления, относится к обнаружению новых терапевтических показаний для применения производного 4-ациламинопиридина.
В некоторых вариантах заболевание или состояние, подлежащее лечению, ассоциировано с болью и/или аддикцией, однако, в отличие от известных способов, проводимое согласно настоящему изобретению лечение сопровождается в существенной мере повышением нейрогенеза. Так, например, в некоторых вариантах осуществления настоящего изобретения описываемые в нем способы включают повышение нейрогенеза ex vivo, и в этом случае композиция, содержащая невральные стволовые клетки, клетки, являющиеся родительскими для невральных клеток, и/или дифференцированные стволовые клетки могут быть последовательно введены индивидууму для целей лечения заболевания или состояния. В некоторых вариантах осуществления настоящего изобретения описываемые в нем способы позволяют лечить заболевания, характеризующиеся наличием боли, аддикцией и/или депрессией, так что при этом проводится непосредственное восполнение, замещение и/или добавление нейронов/или глиальных клеток. В других вариантах осуществления настоящего изобретения описываемые в нем способы позволяют усилить рост и/или повысить выживание имеющихся невральных клеток и/или замедлить или реверсировать потерю таких клеток при нейродегенеративном состоянии.
Примеры заболеваний и состояний, поддающихся лечению с использованием способов настоящего изобретения, включают, без ограничения, нейродегенеративные нарушения, такие как болезнь Паркинсона, расстройства по типу болезни Паркинсона, болезнь Хантингтона (хорея Хантингтона), болезнь Лу Герига, рассеянный склероз, болезнь Пика, паркинсоновский синдром деменции, прогрессирующий субкортикальный глиоз, прогрессирующий супрануклеарный паралич, синдром дегенерации таламуса, наследственную афазию, боковой амиотрофический склероз, синдром Шай-Драгера и болезнь диффузных телец Леви.
Настоящее изобретение также относится к лечению расстройства нервной системы, относящегося к клеточной дегенерации, психическому состоянию, клеточной травме и/или повреждению клеток или к другому неврологическому состоянию. На практике, настоящее изобретение может быть применено в случае субъекта или пациента, пораженного одним или несколькими расстройствами центральной или периферической нервной системы или диагностированного как имеющего такие расстройства, в любом их сочетании. Диагностика может быть проведена специалистом в данной области с использованием известных стандартных подходов, которые позволяют идентифицировать и/или распознать указанные расстройства нервной системы среди других возможных состояний.
Неограничивающие примеры расстройств нервной системы, относящихся к клеточной дегенерации, включают нейродегенеративные расстройства, расстройства, определяемые невральными стволовыми клетками, расстройства, определяемые невральными клетками-предшественниками, дегенеративные заболевания сетчатки и ишемические расстройства. В некоторых вариантах осуществления настоящего изобретения ишемическое расстройство включает недостаточность или определяется снижением кислорода или ангиогенеза, и соответствующие неограничивающие примеры включают ишемию спинного мозга, ишемический инсульт, церебральный инфаркт, мультиинфарктную деменцию. Поскольку указанные состояния могут присутствовать по отдельности у субъекта или пациента, настоящее изобретение также относится к лечению субъекта или пациента, пораженного одним или несколькими указанными состояниями в любом их сочетании или диагностированного как имеющего такие состояния.
Неограничивающие примеры расстройств нервной системы, связанных с психическим состоянием, включают нервно-психиатрические расстройства и аффективные расстройства. В контексте настоящего описания аффективное расстройство обозначает расстройство настроения, такое как, без ограничения, депрессия, посттравматическое стресс-расстройство (PTSD), гипомания, панические атаки, чрезмерная экзальтация, биполярная депрессия, биполярное расстройство (мания-депрессия) и сезонные эмоциональные нарушения (или аффективное расстройство). Другие неограничивающие примеры включают шизофрению и другие психозы, лиссэнцефалический синдром, синдромы беспокойства, расстройства беспокойства, фобии, стресс и родственные синдромы, расстройства познавательной функции, агрессию, злоупотребление лекарственными препаратами и алкоголем, синдромы обсессивно-компульсивного поведения, пограничное расстройство личности, несенильную деменцию, послеболевую депрессию, послеродовую депрессию и церебральный паралич.
Примеры расстройств нервной системы, связанных с травмой и/или повреждением клеток или ткани, включают, без ограничения, неврологические травмы и повреждения, травму и/или повреждение, связанную с хирургическим вмешательством, повреждение и травму сетчатки, повреждение, определяемое эпилепсией, повреждение спинного мозга, повреждение головного мозга, хирургическое вмешательство на головном мозге, повреждение головного мозга, связанное с травмой, повреждение спинного мозга, связанное с травмой, повреждение головного мозга, связанное с лечением рака, повреждение спинного мозга, связанное с лечением рака, повреждение головного мозга, связанное с инфекцией, повреждение головного мозга, связанное с воспалением, повреждение спинного мозга, связанное с инфекцией, повреждение спинного мозга, связанное с воспалением, повреждение головного мозга, связанное с токсинами из окружающей среды, повреждение спинного мозга, связанное с токсинами из окружающей среды.
Неограничивающие примеры расстройств нервной системы, связанных с другими неврологически родственными состояниями, включают расстройства функции обучения, расстройства памяти, возрастное ухудшение памяти (AAMI) или возрастную потерю памяти, аутизм, расстройства дефицита внимания, нарколепсию, расстройства сна, когнитивные расстройства, эпилепсию и эпилепсию височной доли головного мозга.
Дополнительно, настоящее изобретение относится к использованию нейрогенного агента для лечения у субъекта или пациента состояния, связанного с анти-нейрогенными эффектами опиатных или опиоидных анальгетиков. В некоторых вариантах осуществления настоящего изобретения введение опиатного или опиоидного анальгетика, такого как опиат-подобный морфин или другой агонист опиоидного рецептора, субъекту или пациенту приводит к снижению или ингибированию нейрогенеза. Введение нейрогенного агента согласно настоящему изобретению в сочетании с опиатным или опиоидным анальгетиком будет снижать анти-нейрогенный эффект. В качестве одного из неограничивающих примеров можно привести вариант введения нейрогенного агента согласно настоящему изобретению в сочетании с агонистом опиоидного рецептора после хирургии (например, для лечения послеоперативной боли).
Так, настоящее изобретение включает способ лечения послеоперативной боли у субъекта или пациента путем объединенного введения опиатного или опиоидного анальгетика с нейрогенным агентом согласно настоящему изобретению. Анальгетик может вводиться до производного 4-ациламинопиридина, одновременно с ним или после введения указанного производного. В некоторых случаях анальгетик или агонист опиоидного рецептора представляет собой морфин или другой опиат.
Настоящее изобретение, в других вариантах его осуществления, относится к способу лечения или предупреждения снижения или ингибирования нейрогенеза в других ситуациях, где используется агонист опиоидного рецептора. Неограничивающие примеры включают случаи применения агониста опиоидного рецептора, который снижает или ингибирует нейрогенез, а также лекарственную аддикцию, антинаркотическую реабилитацию и/или предупреждение рецидива аддикции. В некоторых вариантах указанный агонист опиоидного рецептора представляет собой морфин, опиум или другой опиат.
Соединения, идентифицированные с помощью способов настоящего изобретения, могут также использоваться для лечения заболеваний периферической нервной системы (ПНС), включающих, без ограничения, нейропатии ПНС (например, сосудистые нейропатии, диабетическую нейропатию, амилоидные нейропатии и т.п.), невралгии, неоплазмы, заболевания миелиновой природы и т.п.
Известны также другие заболевания, которые могут успешно лечиться за счет повышения нейрогенеза (см., например, публикации по патентам США №№ 20020106731, 2005/0009742, 2005/0009847, 20050032702, 2005/0031538, 2005/0004046, 2004/0254152, 2004/0229291 и 2004/0185429, включенные в настоящее описание полностью, в качестве ссылки).
В некоторых вариантах нейрогенные агенты, которые используются в описываемых здесь способах, включают фармацевтические композиции, которые содержат фармацевтически приемлемый эксципиент. В контексте настоящего описания термин "фармацевтически приемлемый эксципиент" включает любой эксципиент, который известен в данной области как подходящий для фармацевтического применения. Подходящие фармацевтические эксципиенты и композиции известны в данной области и описаны, например, в руководстве Ремингтона (Remington's Pharmaceutical Sciences (19th ed.) (Genarro, ed. (1995) Mack Publishing Co., Easton, Pa.)). Предпочтительно, фармацевтические носители выбирают с учетом предполагаемого режима введения нейрогенного агента. Фармацевтически приемлемый носитель может включать, например, средства, способствующие разложению, связующие вещества, замасливатели, средства, способствующие скольжению, смягчители, увлажнители, загустители, силиконы, вкусовые агенты и воду.
Нейрогенный агент может быть включен вместе с эксципиентами в состав композиции и далее введен в виде проглатываемых таблеток, трансбуккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток или в виде любой другой формы, известной в фармацевтической области. Фармацевтические композиции согласно настоящему изобретению могут также изготавливаться в виде средств с пролонгированным высвобождением. Композиции с пролонгированным высвобождением, препараты с энтеросолюбильным покрытием и аналогичные формы известны в данной области. Альтернативно, рассматриваемые композиции могут быть представлены композицией с быстрым высвобождением.
В некоторых вариантах способы лечения согласно настоящему изобретению включают стадию введения млекопитающему нейрогенного агента, приведенного в данном описании, в течение периода времени и в концентрации, которые являются достаточными для лечения состояния, подлежащего лечению. Способы настоящего изобретения могут быть использованы применительно к индивидуумам, имеющим расстройства, относящиеся к невральной дегенерации, повреждению и/или к демиелинизации нервных клеток, или предрасположенным к развитию таких расстройств. В некоторых вариантах осуществления настоящего изобретения описываемые в нем способы включают стадию выбора популяции или субпопуляции пациентов или выбора индивидуального пациента, который в большей мере подходит для данного лечения и/или в меньшей степени чувствителен к побочным эффектам, чем другие пациенты, имеющие такое же заболевание или такое же состояние. Так, например, в некоторых вариантах осуществления настоящего изобретения идентифицируют субпопуляцию пациентов как более подходящую для проведения нейрогенеза под действием нейрогенного агента путем отбора образца клетки или ткани от таких предполагаемых пациентов, выделения и культивирования нервных клеток из образца и определения эффекта одного или нескольких нейрогенных агентов на уровень или природу нейрогененеза, что позволить провести отбор пациентов, для которых терапевтический агент оказал выраженный эффект на нейрогенез. При этом, использование таких стадий выбора приводит к более эффективному лечению заболевания или состояния, чем в случае известных способов при использовании таких же или аналогичных соединений.
В других вариантах осуществления настоящего изобретения рассматриваемый в нем способ лечения включает идентификацию, образование и/или размножение нервных клеток ex vivo с использованием одного или нескольких нейрогенных агентов и с последующей трансплантацией этих клеток в организм субъекта. В другом варианте осуществления настоящего изобретения рассматриваемый в нем способ лечения включает стадии осуществления контакта невральной стволовой клетки для родительской клетки с одним или несколькими нейрогенными агентами для стимуляции нейрогенеза и с последующей трансплантацией этих клеток в организм пациента, при необходимости такого лечения. В настоящем изобретении также описываются способы получения популяции невральных стволовых клеток, подходящих для трансплантации, включающие культивирование популяции невральных стволовых клеток (NSC) in vitro и с последующим осуществлением контакта культивированных невральных стволовых клеток по меньшей мере с одним нейрогенным агентом согласно настоящему изобретению. Настоящее изобретение также включает способы лечения описываемых здесь заболеваний, расстройств и состояний путем трансплантации таких клеток в организм субъекта или пациента.
Приведенные в настоящем описании способы включают введение рассматриваемому субъекту эффективного количества соединения или фармацевтической композиции. В основном, эффективное количество соединения согласно настоящему изобретению представляет собой такое количество, которое является достаточным для стимуляции или повышения нейрогенеза у субъекта, подлежащего лечению, в сравнении с вариантом лечения в отсутствие этого соединения. Эффективное количество композиции может варьировать в зависимости от множества факторов, включающих, без ограничения, активность одного или нескольких активных соединений, физиологические характеристики субъекта, природу состояния, подлежащего лечению, и режим и/или способ введения. Способы согласно настоящему изобретению в типичном случае включают введение описываемого в нем агента в диапазоне дозировок от 0,001 нг/кг/день до 500 нг/кг/день, предпочтительно в диапазоне дозировок от 0,05 до 200 нг/кг/день. При этом, способы согласно настоящему изобретению позволяют проводить лечение соответствующих показаний со сниженными уровнями побочных эффектов, дозировок, частотой введения доз, длительностью лечения, с лучшей переносимость режима лечения пациентом и при наличии других благоприятных факторов.
В некоторых вариантах осуществления способов настоящего изобретения использование нейрогенных агентов, обладающих селективной активностью, позволяет добиться эффективного лечения со значительно сниженным количеством побочных эффектов и/или с их меньшей выраженностью, в сравнении с вариантом проведения лечения по практикуемым в настоящее время способам. Так, например, нейрогенные агенты, обладающие селективностью применительно к ЦНС, могут снизить побочные эффекты, ассоциированные с активностью опиоидных рецепторов, развивающихся за пределами целевой ткани/целевого органа. Известно, что установленные способы лечения различных состояний ЦНС и ПНС соединениями, обладающими активностью против опиоидных рецепторов, вызывают побочные эффекты, включающие, без ограничения, потоотделение, диарею, прилив крови, гипотензию, брадикардию, бронхостеноз, сокращение мочевого пузыря, тошноту, рвоту, паркинсонизм и повышенный риск смертности. В некоторых вариантах осуществления настоящего изобретения описываемые в нем способы включают лечение некоторых состояний с использованием доз, которые позволяют минимизировать такие побочные эффекты.
В зависимости от желательного клинического результата, фармацевтические композиции согласно настоящему изобретению вводят с использованием любого способа, подходящего для достижения такого желательного эффекта. В данной области известно множество способов, позволяющих осуществить доставку исследуемого агента субъекту или непосредственно в NSC или в родительские клетки ткани, представляющей интерес. При этом выбор способа доставки зависит, в частности, от таких факторов, как ткань, представляющая определенный интерес, природа используемого соединения (например, его стабильность и способность проходить через гематоэнцефалический барьер), а также длительность эксперимента. Так, например, в нейрогенный участок, такой как боковой желудочек, может быть имплантирован осмотический мининасос. Альтернативно, соединения могут вводиться путем непосредственной инъекции в цереброспинальную жидкость головного мозга или позвоночника или в глаз. Соединения могут вводиться путем периферической инъекции (например, путем внутривенной или подкожной инъекции или путем пероральной доставки), так чтобы они впоследствии прошли через гематоэнцефалический барьер.
В различных вариантах осуществления настоящего изобретения описываемые в нем композиции вводят таким образом, чтобы они могли контактировать с субвентрикулярной областью (SVZ) латеральных желудочков и/или с зубчатой извилиной гиппокампа. Примеры соответствующих способов введения включают парентеральное введение, например, внутривенное, внутрикожное, подкожное, пероральное (например, путем ингаляции), чрескожное (местное), чресслизистое и ректальное введение. Интраназальное введение обычно включает, без ограничения, ингаляцию аэрозольных суспензий для целей доставки указанных суспензий в слизистую носовой полости, в трахеи и бронхиолы.
В некоторых вариантах осуществления настоящего изобретения описываемые в нем композиции вводят таким образом, чтобы они могли либо пройти через гематоэнцефалический барьер, либо обойти его. В настоящее время известны способы, использование которых позволяет провести те или иные факторы через гематоэнцефалический барьер, которые включают минимизацию размера такого фактора, за счет присутствия гидрофобных компонентов, которые облегчают такое прохождение, и конъюгацию нейрогенного агента или другого агента с молекулой носителя, которая характеризуется выраженной способностью к проникновению через гематоэнцефалический барьер. В некоторых случаях, указанный нейрогенный агент может вводиться путем хирургической имплантации катетера, соединенного с насосным устройством. Указанное насосное устройство может быть также имплантировано или введено экстракорпорально. Введение нейрогенного агента может осуществляться в перемежающемся режиме или путем непрерывной инфузии. Устройства, позволяющие осуществлять инъекцию в отдельные участки головного мозга, известны в данной области. В предпочтительном варианте осуществления настоящего изобретения указанный нейрогенный агент вводят локально в желудочек головного мозга, в черное вещество, в полосатое тело, в locus ceruleous, в базальное ядро Мейнерта, в педункулопонтиновое ядро, в кору головного мозга и/или в спинной мозг, например, путем инъекции. В данной области известны способы, композиции и устройства, позволяющие доставлять терапевтические агенты, включая средства для лечения заболеваний и состояний ЦНС и ПНС.
В некоторых вариантах осуществления настоящего изобретения доставка нейрогенных агентов на нейрогенный участок, такой как зубчатая извилина или субвентрикулярная область, или целевое воздействие с помощью таких агентов на указанную область, повышает эффективность лечения и снижает побочные эффекты, в сравнении с вариантами применения известных способов, включающих введение тех же или аналогичных соединений.
В тех вариантах осуществления настоящего изобретения, которые относятся к лечению субъектов и пациентов, рассматриваемые в нем способы включают идентификацию пациента, страдающего от одного или нескольких заболеваний, расстройств или состояний, или их симптома, и далее введение указанному субъекту или пациенту по меньшей мере одного нейрогенного агента согласно настоящему описанию. Идентификация субъекта или пациента, имеющего одно или несколько заболеваний, расстройств или состояний, или их симптом, может быть проведена любым специалистом со средним уровнем знаний в данной области с использованием подходящих известных средств.
В других вариантах осуществления настоящего изобретения используемые в нем способы могут быть применимы для лечения клетки, ткани или субъекта, в которых отмечается сниженный нейрогенез или повышенная нейродегенерация. В некоторых случаях указанные клетку, ткань или субъект подвергают взаимодействию или приводят в контакт с агентом, который снижает или ингибирует нейрогенез. Одним такого рода неограничивающим примером, иллюстрирующим указанное положение, является субъект, которому вводился морфин или другой агент, снижающий или ингибирующий нейрогенез. Неограничивающие примеры других агентов включают агонисты опиатного и опиоидного рецептора, такие как агонисты рецептора мю-подтипа, которые ингибируют или снижают нейрогенез.
Таким образом, в дополнительных вариантах осуществления настоящего изобретения рассматриваемые в нем способы могут использоваться для лечения субъектов, имеющих или диагностированных как имеющие депрессию или другие синдромы абстиненции, связанные с приемом морфина или других агентов, которые снижают или ингибируют нейрогенез. Такой подход отличается от варианта лечения субъектов, имеющих или диагностированных как имеющие депрессию независимой от опиата природы, в частности, психиатрической природы, согласно настоящему описанию. В других вариантах осуществления настоящего изобретения рассматриваемые в нем способы могут использоваться для лечения субъекта с одной или несколькими аддикциями или зависимостями, в частности, применительно к морфину или другим опиатам, и в этих случаях имеющаяся аддикция или зависимость ослабляется или облегчается при повышении нейрогенеза.
В тех вариантах осуществления настоящего изобретения, которые относятся к лечению депрессии, рассматриваемые в нем способы также включают использование одного или нескольких антидепрессантов. Так, в случае лечения депрессии у субъекта или пациента, указанный способ может включать использование нейрогенного агента согласно настоящему описанию, в сочетании с одним или несколькими антидепрессантами, известными специалистам в данной области. Неограничивающие примеры антидепрессантов, которые могут использоваться вместе с нейрогенным агентом согласно настоящему изобретению, включают SSRI, такой как флуоксетин (Прозак® (Prozac®)), циталопрам, эсциталопрам, флувоксамин, пароксетин (Паксил® (Paxil®)) и сертралин (Золофт® (Zoloft®)), а также активные ингредиенты известных лекарственных препаратов, включающих Лувокс® (Luvox®) и Серозон® (Serozone®); селективные ингибиторы обратного захвата норэпинефрина (SNRI), такие как ребоксетин (Эндронакс® (Edronax®)) и атомоксетин (Страттера® (Strattera®)); селективные ингибиторы обратного захвата серотонина и норэпинефрина (SSNRI), такие как венлафаксин (Эффексор (Effexor)) и дулоксетин ((Цимбалта (Cymbalta)); и агенты типа баклофена, дегидроэпиандростерона (ДГЭА (DHEA)) и ДГЭА-сульфата (DHEAS). В некоторых вариантах осуществления настоящего изобретения предусматривается использование агониста опиоидного рецептора каппа-подтипа и SSRI, или баклофена. Такая объединенная терапия может быть успешной с точки зрения улучшения состояния субъекта или пациента. Неограничивающие примеры такой объединенной терапии включают использование дозировок, которые позволяют снизить побочные реакции, возникающие при приеме только антидепрессанта. Так, например, антидепрессант типа флуоксетина, или пароксетина, или сертралина может вводиться в сниженной или в ограниченной дозе, и необязательно также со сниженной частотой введения, в сочетании с нейрогенным агентом согласно настоящему изобретению. Такая сниженная доза в сочетании с нейрогенным агентом обеспечивает достаточный антидепрессантный эффект, тогда как побочные реакции применения одного антидепрессанта при этом снижаются или вовсе устраняются.
В тех вариантах осуществления настоящего изобретения, которые относятся к лечению избыточного веса и/или направлены на индукцию снижения веса, нейрогенный агент согласно настоящему изобретению может использоваться в сочетании с другим агентом, используемым для лечения избыточного веса и/или позволяющим запустить процесс снижения веса. Неограничивающие примеры такого другого агента, который может применяться для лечения избыточного веса и/или для индукции снижения веса, включают различные коммерчески доступные диетические препараты.
В других вариантах осуществления настоящего изобретения, относящихся к сочетанной терапии, рассматриваемые в нем способы включают повышение нейрогенеза у субъекта иди пациента путем введения производного 4-ациламинопиридина или одного или нескольких дополнительных нейрогенных агентов или одного или нескольких агентов, модулирующих нейрогенез. Таким образом, хотя нейрогенные агенты согласно настоящему изобретению могут вводиться в качестве единственного фармацевтического средства, они также могут использоваться в сочетании с одним или несколькими дополнительными активными агентами, такими как другой нейрогенный агент, который необязательно может функционировать в рамках альтернативного механизма. При введении в сочетании, терапевтические агенты могут быть изготовлены для целей введения в виде отдельных композиций, которые вводятся в одно и то же время или в последовательном режиме, в разное время, или указанные терапевтические средства могут вводиться в виде единой композиции. Настоящее изобретение не ограничивается какой-либо одной последовательностью введения.
Один или несколько дополнительных нейрогенных агентов может (могут) представлять собой опиоидный или неопиоидный (который действует независимо от опиоидого рецептора) агент(ы). В некоторых вариантах осуществления настоящего изобретения указанный дополнительный нейрогенный агент представляет собой такой агент, который выполняет функцию антагониста относительно одного или нескольких опиоидных рецепторов или функцию обратного агониста по меньшей мере одного опиоидного рецептора. Антагонист опиоидного рецептора или обратный агонист согласно настоящему изобретению может обладать специфичностью или селективностью (или, альтернативно, может быть неспецифичным или неселективным) для подтипов опиоидного рецептора. Так, указанный антагонист может быть неспецифическим или неселективным, так что он действует как антагонист более чем одного из трех известных подтипов опиоидного рецептора, идентифицированных как OP1, OP2 и OP3 (которые также известны как дельтa или δ, каппa или κ, и мю или μ, соответственно). Таким образом, антагонист, который действует как антагонист любых двух или всех трех указанных подтипов или который действует как обратный агонист, который характеризуется специфичностью или селективностью для любых двух или всех трех указанных подтипов, может быть использован в практике осуществления настоящего изобретения. Альтернативно, указанный антагонист или обратный агонист может быть специфичным или селективным для одного из трех подтипов, таких как каппа-подтип, рассматривая его в качестве неограничивающего примера.
В некоторых вариантах осуществления настоящего изобретения один или несколько дополнительных нейрогенных агентов, используемых в приведенных здесь способах обладает(ют) "селективной" активностью (такой как в случае антагониста или обратного агониста) в определенных условиях, применительно к одному или нескольким подтипам опиоидного рецептора, в том что касается степени и/или природы активности относительно одного или нескольких других подтипов опиоидного рецептора. Так, например, в некоторых вариантах осуществления настоящего изобретения указанный нейрогенный агент оказывает антагонистский эффект применительно к одному или нескольким подтипам и значительно меньший эффект или по существу отсутствие эффекта относительно других подтипов. В качестве другого примера можно отметить дополнительный нейрогенный агент, используемый в рамках способов согласно настоящему изобретению, который может действовать как агонист для одного или нескольких подтипов опиоидного рецептора и как антагонист для одного или нескольких других подтипов опиоидного рецептора. В некоторых вариантах осуществления настоящего изобретения указанный нейрогенный агент обладает активностью против каппа-опиоидных рецепторов, демонстрируя при этом меньшую активность против одного из дельта- и мю-подтипов рецептора или против обоих указанных подтипов. В некоторых вариантах осуществления настоящего изобретения указанный нейрогенный агент обладает активностью против двух подтипов опиоидного рецептора, таких как каппа- и дельта-подтипы. В качестве неограничивающих примеров, можно отметить агенты налоксон и налтрексон, которые обладают неселективной антагонистской активностью против более чем одного подтипа опиоидного рецептора. В некоторых вариантах осуществления настоящего изобретения селективная активность одного или нескольких опиоидных антагонистов сказывается на повышении эффективности, уменьшении побочных эффектов, снижении эффективных дозировок, уменьшении частоты дозирования или приводит к другим желательным результатам.
Антагонист опиоидного рецептора представляет собой агент, способный ингибировать одну или несколько характерных реакций опиоидного рецептора или соответствующего подтипа рецептора. В качестве неограничивающего примера, можно отметить, что антагонист может конкурентно или не конкурентно связываться с опиоидным рецептором, агонистом или частичным агонистом (или с другим лигандом) рецептора и/или с сигнальной молекулой в направлении считывания информации, ингибируя функцию рецептора.
Может также использоваться обратный агонист, способный блокировать или ингибировать конститутивную активность опиоидного рецептора. Обратный агонист может конкурентно или не конкурентно связываться с опиоидным рецептором и/или с сигнальной молекулой в направлении считывания информации, ингибируя функцию рецептора. Неограничивающие примеры обратных агонистов, которые могут использоваться в практике осуществления настоящего изобретения, включают ICI-174864 (N,N-диаллил-Tyr-Aib-Aib-Phe-Leu), RTI-5989-1, RTI-5989-23 и RTI-5989-25 (см. Zaki et al. J. Pharmacol. Exp. Therap. 298(3): 1015-1020, 2001).
В других вариантах осуществления настоящего изобретения дополнительный нейрогенный агент может представлять собой модулятор мускаринового рецептора. Неограничивающие примеры таких агентов включают мускариновый агент миламелин (CI-979) и ксаномелин; мускариновый агент алвамелин (LU 25-109), 2,8-диметил-3-метилен-1-окса-8-азаспиро[4,5]декан (YM-796) или YM-954, цевимелин (AF102B), сабкомелин (SB 202026), талсаклидин (WAL 2014 FU), CD-0102 (5-(3-этил-1,2,4-оксадиазол-5-ил)-1,4,5,6-тетрагидропиримидин-трифторуксусная кислота), производное 1-метил-1,2,5,6-тетрагидропиридил-1,2,5-тиадиазола, такое как тетра (этиленгликоль)(4-метокси-1,2,5-тиадиазол-3-ил)[3-(1-метил-1,2,5,6-тетрагидропирид-3-ил)-1,2,5-тиадиазол-4-ил]эфир или соединение, которое функционально или структурно близко к производному 1-метил-1,2,5,6-тетрагидропиридил-1,2,5-тиадиазола, безипиридин, SR-46559, L-689,660, S-9977-2, AF-102 или тиопилокарпин, аналог клозапина или диарил[a,d]циклогептен, такой как его амино-замещенная форма, производное бензимидазолидинона и спироазациклическое соединение, такое как 1-окса-3,8-диазаспиро[4,5]декан-2-он, аналог тетрагидрохинолина; и агонист мускаринового ml рецептора, выбранный из 55-LH-3B, 55-LH-25A, 55-LH-30B, 55-LH-4-1A, 40-LH-67, 55-LH-15A, 55-LH-16B, 55-LH-11C, 55-LH-31A, 55-LH-46, 55-LH-47, 55-LH-4-3A.
В других вариантах осуществления настоящего изобретения дополнительный агент может представлять собой агент, который повышает уровень эндогенного мускаринового агониста, такой как ацетилхолин. Неограничивающие примеры таких дополнительных агентов включают ингибиторы ацетилхолинэстеразы, Такрин, Донепезил, Итоприд, Ривастигмин и Галантамин.
Еще в других вариантах осуществления настоящего изобретения указанный дополнительный нейрогенный агент может представлять собой модулятор андрогенного рецептора. Неограничивающие примеры включают агонисты андрогенного рецептора дегидроэпиандростерон (ДГЭА (DHEA)) и ДГЭА-сульфат (ДГЕА-С (DHEAS)).
Очевидно, что в рамках комбинированной терапии нейрогенный агент согласно настоящему изобретению может использоваться в сочетании с терапией, включающей иные подходы, нехимической природы. Неограничивающие примеры включают использование психотерапии для лечения многих описанных в данной заявке состояний, таких как психиатрические состояния, а также терапии, направленной на модификацию поведения индивидуума, в частности, в сочетании с программой снижения веса.
Выше было приведено основное описание настоящего изобретения и в дальнейшем для более полного его представления даны примеры, целью которых является лишь иллюстрация, но которые никоим образом не ограничивают область настоящего изобретения, если особо не указано иное.
ПРИМЕРЫ
Пример 1 - Эффект на нейрональную дифференцировку человеческих невральных стволовых клеток
Человеческие невральные стволовые клетки (hNSCs) выделяют и растят в виде монослойной культуры, высевают на чашки Петри, обрабатывают различными концентрациями MKC-231 (исследуемое соединение) и окрашивают антителом TUJ-1, как описано в предварительной заявке на патент США № 60/697905 (которая включена в настоящее описание в качестве ссылки). Исследуемую среду без митогена с положительным контролем на нейрональную дифференцировку используют вместе с базальной средой, которая не содержит ростовых факторов и которая выполняет функцию отрицательного контроля.
На фиг. 1 показаны результаты, которые демонстрируют кривые зависимости доза-ответ в процессе нейрональной дифференцировки при соответствующем вычитании показателей, характерных для базальной среды. Кривая доза-ответ для нейронального положительного контроля показана в качестве эталона сравнения. Приведенные данные представлены в виде процента от показателей, характерных для положительного контроля на нейрональную дифференцировку. Полученные данные указывают на то, что MKC-231 усиливает нейрональную дифференцировку относительно уровней, характерных для базального фона.
Пример 2 - Эффект на дифференцировку астроцитов в hNSC
Эксперименты проводят по процедуре, описанной в примере 1, за исключением того, что положительный контроль на дифференцировку астроцитов содержит исследуемую среду без митогена в качестве положительного контроля на дифференцировку астроцитов, а клетки окрашивают антителом GFAP.
Полученные результаты показаны на фиг. 2, где приведены кривые зависимости доза-ответ, при соответствующем вычитании показателей, характерных для базального фона. В данном случае MKC-231 не продемонстрировал существенного усиления дифференцировки астроцитов относительно показателей, характерных для базальной среды.
Пример 3 - Токсический/трофный эффект на человеческие невральные стволовые клетки
Эксперименты проводят по процедуре, описанной в примере 1, за исключением того, что клетки окрашивают красителем для клеточных ядер (Hoechst 33342).
Полученные результаты показаны на фиг. 3. Приведенные данные представляют собой процент от числа клеток, выявленных при использовании базальной среды. Концентрации, которые являются токсичными, демонстрируют падение числа клеток ниже 80% относительно числа клеток в базальной среде.
Трофные соединения демонстрируют зависимое от дозы повышение числа клеток. MKC-231 не продемонстрировал токсичности в концентрациях до 31,6 мкM.
Пример 4 - Эффект MKC-231 в сочетании с агонистом AMPA на дифференцировку человеческих невральных стволовых клеток
Эксперименты с различными концентрациями MKC-231, одного или в сочетании с 0,316 мкM агониста AMPA (AMPA), проводят в основном по процедуре, описанной в примере 1 для варианта исследования нейрональной дифференцировки. Результаты показаны на фиг. 4, где приведены кривые зависимости доза-ответ для дифференцировки нейронов, при соответствующем вычитании показателей, характерных для базальной среды. Агонист АМРА в концентрации 0,316 мкM усиливает стимуляцию дифференцировки нейронов под действием нейрогенного агента MKC-231. Приведенные данные показывают, что агонисты AMPA действуют как средство, потенцирующее или сенсибилизирующее действие MKC-231 на дифференцировку нейронов. Полученные данные также указывают на то, что один из аспектов нейрогенного эффекта MKC-231, по всей видимости, связан с потенцирующим или сенсибилизирующим действием на AMPA.
На фиг. 6 также приведены данные, относящиеся к использованию BCI-540 в сочетании с AMPA и их эффекту на нейрональную дифференцировку.
Пример 5 - Эффект MKC-231 в сочетании с антагонистом AMPA на дифференцировку человеческих невральных стволовых клеток
Эксперимент с различными концентрациями MKC-231, одного или в сочетании с 1,0 мкM антагониста AMPA (NBQX) проводят, по существу, по процедуре, описанной в примере 1, применительно к дифференцировке нейронов. Полученные результаты показаны на фиг. 7, которые демонстрируют кривые зависимости доза-ответ для дифференцировки нейронов, при соответствующем вычитании показателей, характерных для базальной среды. Антагонист AMPA NBQX в концентрации 1,0 мкМ ингибирует стимуляцию дифференцировки нейронов под действием нейрогенного агента MKC-231. Приведенные данные показывают, что антагонист AMPA действует в качестве ингибитора MKC-231-опосредованной нейрональной дифференцировки. Приведенные данные также указывают на то, что некоторые аспекты нейрогенного эффекта MKC-231 связаны с активацией рецептора AMPA.
Пример 6 - Эффект на нейрогенез в гиппокампе крыс
BCI-540 вводят самцам крыс F344 с помощью перорального зонда один раз в день, ежедневно, в течение 28 дней (в дозе 1,0 и 4,0 мг/кг/день, перорально). BrdU вводят один раз в день, ежедневно, в течение 5 дней (дни 9-14, в дозе 100 мг/кг/день, внутрибрюшинно). Животных умерщвляют на 28-ой день. У животных отбирают головной мозг и обрабатывают для оценки нейрогенеза.
На фиг. 8 показаны изменения в уровне нейрогенеза в сравнении с контролем-носителем (±СКО). На оси у показаны изменения в процентах относительно контроля-носителя. На оси х приведены результаты обработки носителем, откорректированные до 100% (зачерненный прямоугольник) и при использовании BCI-540 в дозе 1,0 и 4,0 мг/кг/день (зачерненные заштрихованные прямоугольники). Жирные линии отмечают 100% значение от контроля-наполнителя. Ежедневное введение BCI-540 в дозе 1,0 и 4,0 мг/кг в течение 28 дней приводит к статистически значимому повышению числа новых нейронов в слое гранулярных клеток в пределах зубчатой извилины.
Пример 7 - Эффект, наблюдаемый в рамках теста на подавление пищевого рефлекса у крыс
BCI-540 вводят самцам крыс F344 через пищевой зонд один раз в день, ежедневно, в течение 21 дня (1,0 мг/кг/день, перорально). Флуоксетин вводят через желудочный зонд один раз в день, ежедневно, в течение 21 дня (10 мг/кг/день, перорально). BrdU вводят один раз день, ежедневно, в течение 5 дней (дни 9-14, 100 мг/кг/день, внутрибрюшинно). Животных исследуют по прошествии 21 дня после введения препарата.
На фиг. 9 показаны данные по изменению периода латентности к еде в сравнении с контролем-носителем (± СКО). На оси у показаны изменения в процентах относительно контроля-носителя. На оси х обозначены условия лечения. Носитель откорректирован до значения 100%. Жирная линия указывает 100% значение от величины контроля-носителя. 21-дневное введение BCI-540 и флуоксетина приводит к статистически значимому снижению периода латентности в отношении потребности в гранулированном корме, что указывает на антидепрессантную активность.
Пример 8 - Токсический/трофный эффект на человеческие нейрональные стволовые клетки
BCI-540 вводят самцам крыс Спрэг Доули (Sprague Dawley) с помощью перорального зонда один раз в день, ежедневно, в течение 21 дня (1,0 мг/кг/день, перорально). В качестве положительного контроля используют анксиолитический препарат диазепам (1,5 мг/кг, внутрибрюшинно), который вводят один раз, за 30 минут до исследования.
На фиг. 10 показано изменение в процентах времени, проведенного в лабиринте с открытой перегородкой, для животных в группах введения BCI-540 и диазепама (±СКО). На оси у показано значение в процентах времени, проведенного с открытой перегородкой. На оси х приведены данные, относящиеся к использованию носителя (зачерненный прямоугольник), к диазепаму, в качестве положительного контроля (серый прямоугольник), и к животным, которым вводили BCI-540 (черные заштрихованные прямоугольники) (n=15/группа). Введение в хроническом режиме BCI-540 приводит к значительному повышению времени, проведенного в лабиринте с открытой перегородкой, что является показателем анксиолитической активности. BCI-540 демонстрирует анксиолитическую эффективность, сравнимую с вариантом введения диазепама в остром режиме.
Пример 9 - Иммуногистохимия с использованием маркеров на нейроны и астроциты
Иммуногистохимический анализ проводят по методике, описанной в предварительной заявке на патент США № 60/697905 (которая включена в настоящее описание в качестве ссылки), с использованием TUJ-1 в качестве маркера нейрональных клеток и GFAP в качестве маркера астроцитов. Полученные результаты показаны на фиг. 5, где включены контрольные снимки верхней части чертежа с целью сравнения, а также в нижней левой части чертежа показаны клетки, обработанные только МКС-231 в концентрации 31,6 мкM, а также сочетанием 31,6 мкM MKC-231 с 0,316 мкM АМРА, в нижней правой части чертежа.
Пример 10 - Репрезентативные нейрогенные агенты
В данном примере описываются репрезентативные производные 4-ациламинопиридина, используемые в различных аспектах настоящего изобретения. Производное 4-ациламинопиридина согласно настоящему изобретению описывается приведенной ниже формулой (1):
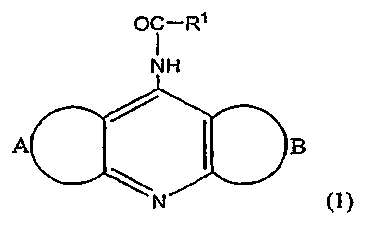
где R1 обозначает C2-C6 алкильную группу или группу, описываемую приведенной ниже формулой (2):
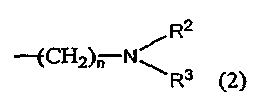
где каждый из R2 и R3 независимо обозначает атом водорода, C1-C6 алкильную группу, C3-C6 циклоалкильную группу или группу, описываемую приведенной ниже формулой (3):
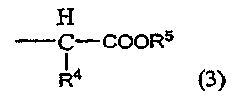
где каждый из R4 и R5 независимо обозначает атом водорода или C1-C6 алкильную группу, или R2 и R3 вместе с атомом азота, к которому присоединены R2 и R3, обозначают
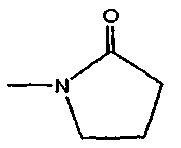 или
или 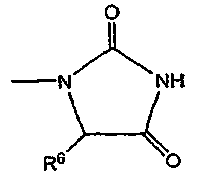
где R6 обозначает атом водорода или C1-C6 алкильную группу и n равен 0 или целому числу от 1 до 3; и
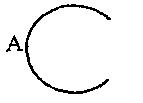
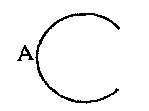
обозначает
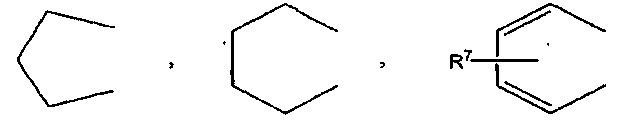
где R7 обозначает атом водорода, C1-C6 алкильную группу или атом галогена,
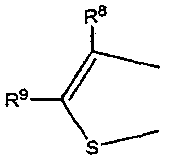
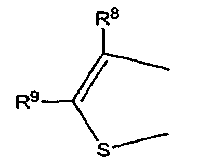
где каждый из R8 и R9 независимо обозначает атом водорода или C1-C4 алкильную группу,
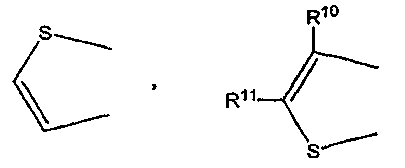
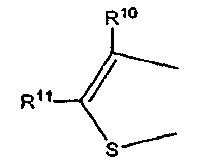
где каждый из R10 и R11 независимо обозначает атом водорода или C1-C4 алкильную группу,
 или
или  и
и 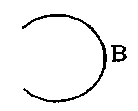
обозначает
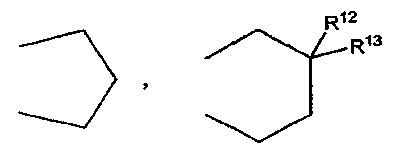
где каждый из R12 и R13 независимо обозначает атом водорода или C1-C4 алкильную группу или R12 и R13 могут объединяться с образованием C2-C6 алкиленовой группы,
при условии, что когда R1 обозначает C2-C6 алкильную группу или группу, описываемую формулой (2), где один из R2 и R3 обозначают атом водорода или C1-C6 алкильную группу и второй из R2 и R3 обозначает атом водорода или -СH2COOR5, где R5 был определен выше, или R2 и R3 вместе с атомом азота, к которому и R2 и R3 присоединяются, обозначают

и n равен 1 или 2,
не может представлять собой
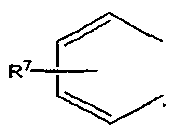
где R7 определен выше или не обозначает
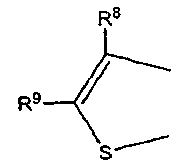
где R9 определен выше; и
не может обозначать
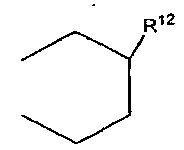
где R12 обозначает атом водорода или C1-C4 алкильную группу или не обозначает
В формуле (1), неограничивающие примеры C2-C6 алкильной группы (или алкильной группы, содержащей от 2 до 6 атомов углерода), описываемые R1, включают следующие группы: этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу и н-гексильную группу. В некоторых вариантах используется C2-C4 алкильная группа в способах и практике осуществления настоящего изобретения.
Неограничивающие примеры C1-C6 алкильной группы, обозначаемой любым из фрагментов R2-R7, включают следующие группы: метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу и н-гексильную группу. В некоторых вариантах используется C1-C4 алкильная группа в способах и практике осуществления настоящего изобретения.
Неограничивающие примеры C3-C6 циклоалкильной группы, обозначаемой каждым из фрагментов R2 и R3, включают следующие группы: циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу.
Атом галогена, обозначаемый R7, выбирают из атома фтора, атома хлора, атома брома и атома йода.
Неограничивающие примеры C1-C4 алкильной группы, обозначаемой каждым из фрагментов R8-R13, включают следующие группы: метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу и трет-бутильную группу.
Среди соединений, описываемых формулой (1), и в некоторых вариантах осуществления настоящего изобретения, соединение, в котором R1 обозначает C2-C6 алкильную группу или группу, описываемую формулой (2), где R2 обозначает атом водорода или C1-C6 алкильную группу, R3 обозначает атом водорода, C1-C6 алкильную группу, C3-C6 циклоалкильную группу или группу, описываемую формулой (3), где каждый из R4 и R5 независимо обозначает атом водорода или C1-C6 алкильную группу, или R2 и R3 вместе с атомом азота, к которому R2 и R3 присоединяются, обозначают
 или
или 
где R6 обозначает атом водорода или C1-C6 алкильную группу и n равен 0 или целому числу от 1 до 3; и
обозначает
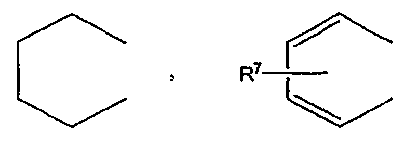
где R7 обозначает атом водорода, C1-C6 алкильную группу или атом галогена,
где каждый из R8 и R9 независимо обозначает атом водорода или C1-C4 алкильную группу, или
где каждый из R10 и R11 независимо обозначает атом водорода или C1-C4 алкильную группу; и
обозначает
где каждый из R12 и R13 независимо обозначает атом водорода или C1-C4 алкильную группу или R12 и R13 могут объединяться с образованием C2-C6 алкиленовой группы, или
Более предпочтительным является соединение, в котором
обозначает
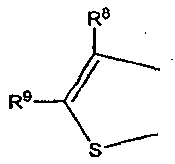 или
или 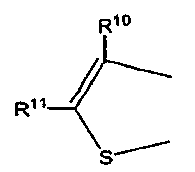
где R7-R11 были определены выше.
Дополнительно к указанным выше репрезентативным молекулам в рамках настоящего изобретения могут использоваться фармацевтически приемлемые аддитивные соли кислоты описанных молекул. В некоторых вариантах аддитивная соль кислоты соединения, описываемого формулой (1), представляет собой фармацевтически и физиологически приемлемую соль. В качестве неограничивающих примеров могут быть указаны аддитивные соли неорганической кислоты, такие как гидрохлоридные, гидробромидные, гидроиодидные, сульфатные и фосфатные соли, а также аддитивные соли органической кислоты, такие как оксалатные, малеатные, фумаратные, лактатные, малатные, цитратные, тартратные, бензоатные, метансульфонатные и камфорсульфонатные соли. Соединение, описываемое формулой (1), и его аддитивная соль кислоты могут быть представлены в форме гидрата или сольвата. Гидрат и сольват могут также использоваться в способах и практике осуществления настоящего изобретения.
Способы получения указанных выше соединений описаны в патенте США 5397 785, который включен в настоящее описание в качестве ссылки. В примере 25 указанной заявки описано получение MKC-231.
Пример 11 - Репрезентативные композиции и дозировки
В настоящем изобретении представлены, кроме указанных выше композиций, также дополнительные композиции, включающие нейрогенный агент. Такая композиция может необязательно включать дополнительный нейрогенный агент, описанный выше. В некоторых вариантах осуществления настоящего изобретения указанные композиции включают фармацевтически эффективное количество производного 4-ациламинопиридина, описываемого указанной выше формулой (1), или его фармацевтически приемлемую аддитивную соль кислоты и фармацевтически приемлемый адъювант.
Нейрогенное соединение согласно настоящему изобретению может использоваться в качестве терапевтического агента или лекарственного средства путем введения его одного или в смеси с фармацевтически приемлемым носителем. Необязательно указанное соединение может быть введено в состав композиции в сочетании с одним или несколькими дополнительными нейрогенными агентами, приведенными в настоящем описании. Состав композиции может быть определен стандартными способами специалистом в данной области на основе данных по растворимости и свойствам соединения, используемого в качестве активного ингредиента, с учетом способа введения и режима дозирования. В качестве неограничивающего примера можно отметить, что соединение согласно настоящему изобретению может вводиться перорально в форме гранулы, мягкой гранулы, порошка, таблетки, твердой капсулы, мягкой капсулы, сиропа, эмульсии, суспензии и раствора. Соединение согласно настоящему изобретению может также вводиться путем внутривенной, внутримышечной или подкожной инъекции. Соединение согласно настоящему изобретению может быть получено в виде порошка, подлежащего инъекции, и далее указанное вещество может быть инъецировано после растворения или суспендирования в соответствующем растворителе перед употреблением.
Указанное соединение может использоваться в сочетании с органическим или неорганическим, твердым или жидким, носителем или разбавителем, который подходит для перорального, кишечного, парентерального или местного введения. В качестве неограничивающих примеров носителя, используемого для получения твердого препарата, можно отметить лактозу, сахарозу, крахмал, тальк, целлюлозу, декстрин, каолин и карбонат кальция. Жидкий препарат для перорального введения, например, эмульсия, сироп, суспензия, раствор и т.п., может содержать разбавитель, такой как вода, растительное масло и т.п., в качестве неограничивающих примеров такого рода разбавителей. Жидкий препарат может содержать вспомогательное вещество, такое как увлажнитель, средство, способствующее супендированию, подсластитель, ароматический компонент, краситель, консервант и т.п., дополнительно к инертному разбавителю. В некоторых вариантах жидкий препарат может быть инкапсулирован в вещество, абсорбируемое в оболочку, такое как желатин. В качестве растворителя или суспендирующего агента, используемого при получении парентерального препарата, такого как инъецируемый препарат, может использоваться вода, пропиленгликоль, полиэтиленгликоль, бензиловый спирт, этилолеат и лецитин. Такие композиции могут быть получены с использованием стандартных методик, известных специалистам в данной области.
Ежедневные клинические дозировки соединения согласно настоящему изобретению при пероральном введении могут составлять от примерно 1 до примерно 1000 мг, и составлять от примерно 10 до примерно 100 мг для взрослого человека. Специалист в данной области в состоянии определить, в зависимости от возраста пациента, степени заболевания, состояния здоровья пациента, что желательно в данном случае, повысить или снизить дозу соединения, и следует или не следует вводить другое лекарственное средство или активный агент. Суточная доза соединения согласно настоящему изобретению может вводиться в виде одной или двух или трех порций, при наличии между ними соответствующих интервалов. Может также использоваться вариант перемежающегося введения.
Дневная дозировка соединения согласно настоящему изобретению при проведении инъекций может составлять примерно от 0,1 до примерно 100 мг и составлять от примерно 0,5 до примерно 50 мг для взрослого человека.
Кроме того, соединение согласно настоящему изобретению характеризуется очень низкой токсичностью и вызывает незначительные побочные эффекты.
Пример 12 - Репрезентативные кристаллические формы
В способах и практике осуществления настоящего изобретения могут использоваться чистые или по существу чистые кристаллы производного 4-ациламинопиридина. В некоторых вариантах осуществления настоящего изобретения используют кристаллическую форму N-(2,3-диметил-5,6,7,8-тетрагидрофуро[2,3-b]хинолин-4-ил)-2-(2-оксопирролидин-1-ил)ацетамида (или MKC-231), описанную в патенте США № 6884805. Кристаллическая форма может быть представлена формой А или формой В кристалла. В настоящем патенте также дается описание получения кристаллических форм, включая получение в физиологически приемлемых растворителях.
Форма А кристалла характеризуется наличием одного или нескольких показателей: (i) точка плавления, вычисленная по кривой, построенной на основе дифференциальной сканирующей калориметрии, ниже, чем примерно 220°C, в особенности, точка плавления, вычисленная по кривой, полученной по данным дифференциальной сканирующей калориметрии, составляющая примерно 217,6°C, (ii) пик угла дифракции рентгеновских лучей 2θ составляет 9,8° (±0,2°), (iii) отсутствие пика при угле дифракции рентгеновских лучей 2θ, равном 7,3° (±0,2°), (iv) растворимость в воде ниже, чем примерно 0,5 мг/мл, в особенности, растворимость воде, составляющая примерно 0,35 мг/мл, и (v) более высокая стабильность при хранении, чем кристаллов формы В.
Кристаллы формы В характеризуются наличием одного или нескольких следующих показателей: (i) точка плавления, вычисленная по кривой, построенной на основе дифференциальной сканирующей калориметрии, выше, чем примерно 220°C, в особенности, точка плавления, полученная при расчете кривой, полученной по данным дифференциальной сканирующей калориметрии, составляющая примерно 222,6°C, (ii) пик угла дифракции рентгеновских лучей 2θ составляет 7,3° (±0,2°), (iii) отсутствие пика при угле дифракции рентгеновских лучей 2θ, равном 9,8° (±0,2°), (iv) растворимость в воде ниже, чем примерно 0,5 мг/мл, в особенности, растворимость воде, составляющая примерно 0,73 мг/мл, и (v) более низкая стабильность при хранении, чем кристаллов формы А.
Кристалл может быть представлен фармацевтическим препаратом в объемной форме, которая включает либо кристаллы формы А, либо кристаллы формы В. Кроме того, настоящее изобретение включает фармацевтическую композицию, которая содержит фармацевтически приемлемый носитель и кристаллы либо формы А, либо формы В.
Если говорить более детально, то кристаллы формы А характеризуются наличием одной или нескольких следующих особенностей: (a) точка плавления (при экстраполяции относительно начала плавления), вычисленная по кривой, полученной при дифференциальной сканирующей калориметрии, ниже, чем примерно 220°C, и находится в диапазоне примерно 213-220°C или в диапазоне примерно 215-220°C, в диапазоне примерно 216-218°C, составляет примерно 218°C и примерно 217,6°C, (b) по меньшей мере, один пик в спектре дифракции рентгеновских лучей при угле дифракции 2θ составляет 8,7°, 9,8°, 11,4°, 13,3°, 15,5°, 16,8° и/или 17,6° (±0,2°, соответственно), так что по меньшей мере один пик в спектре дифракции рентгеновских лучей при угле дифракции 2θ составляет примерно 9,8° (±0,2°), (c) отсутствие пика (с учетом базального фона и вариаций, связанных с измерениями) при угле дифракции рентгеновских лучей 2θ, равном 7,3°, 9,3°, 11,9° и/или 14,8° (±0,2°, соответственно), (d) растворимость в воде (при температуре примерно 25°C) ниже, чем примерно 0,5 мг/мл, и находится в диапазоне, таком как примерно 0,1-0,5 мг/мл, в диапазоне примерно 0,2-0,45 мг/мл, в диапазоне примерно 0,3-0,4 мг/мл и составляет примерно 0,35 мг/мл, и (e) повышенная стабильность при комнатной температуре (примерно 25°C) и при хранении (с течением времени), чем в случае кристаллов формы В.
Кристаллы формы В характеризуются наличием одной или нескольких следующих особенностей: (a) точка плавления (при экстраполяции относительно начала плавления), рассчитанная по кривой, полученной при дифференциальной сканирующей калориметрии, выше, чем примерно 220°C и находится в диапазоне примерно 220-225°C, в диапазоне примерно 221-224°C, в диапазоне примерно 222-223°C, и составляет примерно 223°C и примерно 222,6°C, (b) по меньшей мере, один пик в спектре дифракции рентгеновских лучей при угле дифракции 2θ составляет 7,3°, 9,3°, 11,9°, 13,5°, 14,8°, 15,9°, 17,5° и/или 18,6° (±0,2°, соответственно), так что по меньшей мере один пик в спектре дифракции рентгеновских лучей при угле дифракции 2θ составляет примерно 7,3° (±0,2°), (c) отсутствие пика (с учетом базального фона и вариаций, связанных с измерениями) при угле дифракции рентгеновских лучей 2θ, равном 8,7°, 9,8° и/или 16,8° (±0,2°, соответственно), (d) растворимость в воде (при температуре примерно 25°C) выше, чем примерно 0,5 мг/мл, и находится в диапазоне, таком как примерно 0,5-1 мг/мл, в диапазоне примерно 0,6-0,9 мг/мл, в диапазоне примерно 0,7-0,8 мг/мл и составляет примерно 0,73 мг/мл, и (e) сниженная стабильность при комнатной температуре (примерно 25°C) и при хранении (с течением времени), чем в случае кристаллов формы А.
Настоящее изобретение также относится к стабильным, чистым или по существу чистым кристаллическим формам A и B MKC-231. Кристаллические формы могут быть получены с хорошей воспроизводимостью результатов при использовании физиологически совместимого растворителя, такого как этанол, вода или их смесь. Термин «по существу чистый» показывает, что либо кристаллы формы А, либо кристаллы формы В содержат менее, чем примерно 10 вес.% другой полиморфной формы, например, меньше, чем примерно 5 вес.% другой полиморфной формы. В идеале, указанные проценты относятся к любой другой полиморфной форме с учетом того, что могут существовать полиморфные формы, отличные от формы А и формы В, которые указаны в настоящем описании.
Кристаллическая форма может использоваться в фармацевтической композиции, включающей фармацевтически приемлемый (например, физиологически приемлемый и фармакологически совместимый) носитель, для лечения заболеваний, расстройств или состояний, приведенных в настоящем описании. Рассматриваемые в изобретении кристаллические формы (и их фармацевтические композиции) могут использоваться в способе лечения млекопитающих, в особенности человека, имеющего соответствующее заболевание.
Способ введения кристаллов формы А или формы В согласно настоящему изобретению особо не ограничивается. Кристаллическая форма соединения может вводиться либо перорально, либо парентерально, и необязательно соединение остается в кристаллической форме. Альтернативно, проводят введение в виде фармацевтической композиции, содержащей активный ингредиент и добавки, которые являются фармацевтически приемлемыми (т.е. фармакологически совместимыми). Выбор носителя проводят с учетом, в частности, свойств конкретной композиции и конкретного используемого способа введения описанной выше композиции.
Могут быть использованы фармацевтически приемлемые добавки. Неограничивающие примеры таких добавок включают наполнители, средства, способствующие разложению, вспомогательные вещества, способствующие разложению, связующие вещества, замасливатели, агенты покрывающих оболочек, пигменты, разбавители, основы, средства, способствующие растворению, вспомогательные вещества, способствующие растворению, агенты, способствующие достижению изотоничности, регуляторы рН, стабилизаторы, пропелленты и адгезивные вещества. Неограничивающие примеры препаратов, подходящих для перорального введения, включают таблетки, капсулы, порошки, мелкие гранулы, гранулы, растворы и сиропы. Неограничивающие примеры препаратов, подходящих для парентерального введения, включают инъецируемые формы, капли, мази, кремы, агенты, абсорбируемые при чрескожном нанесении, глазные капли, ушные капли, ингаляторы и суппозитории. Указанные композиции могут быть представлены в виде контейнеров с однократной дозой или в виде закрытых контейнеров с множеством доз, в составе таких контейнеров, как ампулы и флаконы, подходящих для хранения в лиофилизированном состоянии, в случае которых для инъекции непосредственно перед употреблением требуется добавление только стерильного жидкого носителя, например воды. Форма препарата для данной фармацевтической композиции не ограничивается указанными выше формами.
К препаратам, подходящим для перорального введения, могут быть добавлены дополнительные наполнители. Подходящие дополнительные носители включают глюкозу, лактозу, D-маннит, крахмал и кристаллическую целлюлозу; средства, способствующие разложению, или вспомогательные вещества, способствующие разложению, такие как карбоксиметилцеллюлоза, крахмал и кальциевая соль карбоксиметилцеллюлозы; связующие вещества, такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поли(винилпирролидон) и желатин; замасливатели, такие как стеарат магния и тальк; агенты покрывающих оболочек, такие как гидроксипропилметилцеллюлоза, сахароза, полиэтиленгликоль и оксид титана; и основы, такие как вазелин, жидкий парафин, полиэтиленгликоль, желатин, каолин, глицерин, очищенная вода и твердый жир. Типичные добавки, используемые в препаратах, подходящих для инъецируемых форм или для глазных капель, включают агенты, способствующие растворению, или вспомогательные вещества, способствующие растворению, которые используют для получения водных инъецируемых форм или инъецируемых форм, растворяемых перед употреблением, такие как дистиллированная вода для инъекций, физиологические солевые растворы и пропиленгликоль; агенты, способствующие достижению изотоничности, такие как глюкоза, хлорид натрия, D-маннит и глицерин; регуляторы pH, такие как неорганические кислоты, органические кислоты, неорганические соли и органические соли.
Дозировка лекарственного средства согласно настоящему изобретению может быть соответствующим образом повышена или снижена, в зависимости от природы заболевания, цели лечения (например, профилактика или терапия) и от состояния пациента, его возраста, веса и симптомов. Однако в целом дневная дозировка для взрослого пациента при пероральном введении составляет от примерно 0,05 до примерно 500 мг в день. В основном, указанная дозировка может вводиться один раз, несколько раз в день или каждые несколько дней.
Кристаллические формы достаточно подробно описаны в литературе (Chaki et al., Bioorganic & Medical Chemistry Letters, 5(14), 1489-1494 (1995); Chaki et a., Bioorganic & Medical Chemistry Letters, 5(14), 1495-1500 (1995); Bessho et al., Arznein.Forsh./Drug Res., 46(I), 369-373 (1996); Murai et al., J. Neuron. Transm. [GenSect], 98, 1-13 (1994); и Akaike et al., Jpn. J. Pharmacol., 76, 219-222 (1998)).
Все цитированные в описании работы, в том числе патенты, патентные заявки и публикации, включены в настоящее изобретение в качестве ссылки, независимо от того, были они ранее конкретно указаны или нет.
На основе приведенного выше полного описания изобретения специалист в данной области может сделать вывод, что настоящее изобретение может быть осуществлено с использованием широкого диапазона эквивалентных параметров, концентраций и состояний, без отхода от принципов и области настоящего изобретения и без длительных экспериментов.
Несмотря на то, что настоящее изобретение было описано применительно к конкретным вариантам его осуществления, следует понимать, что возможны и другие модификации. Настоящая заявка охватывает любые варианты, направления использования или адаптации настоящего изобретения, которые следуют, в основном, принципам настоящего изобретения, и включает такие отступления от основного описания, которые согласуются с известной или обычной практикой в той области, к которой относится настоящее изобретение, в соответствии с основными особенностями, указанными ниже.
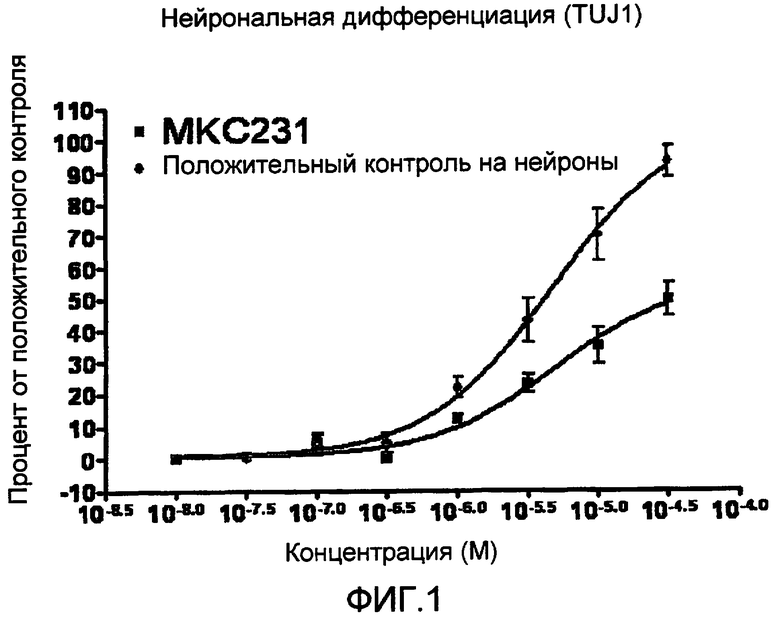
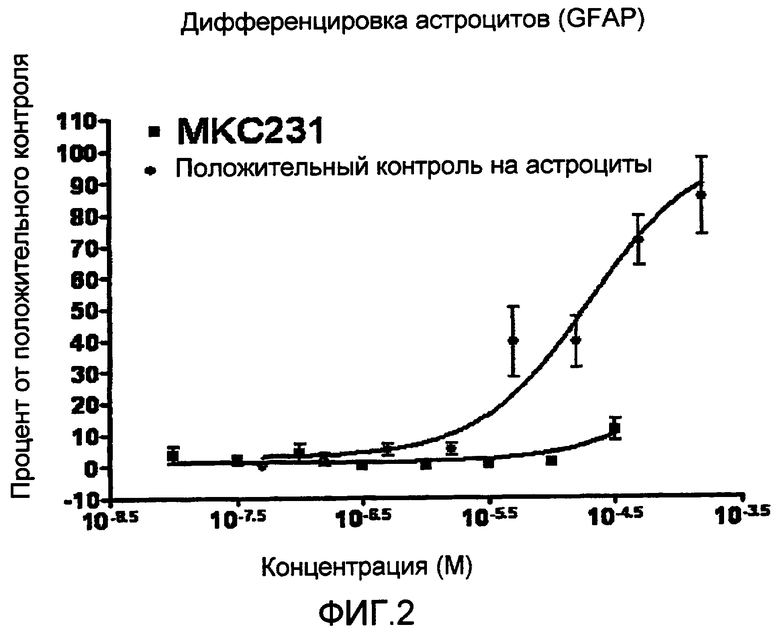

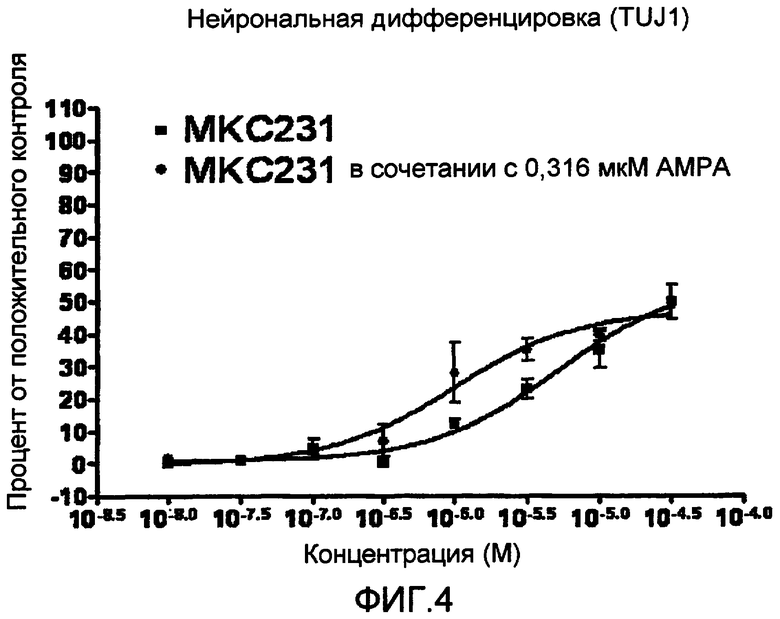
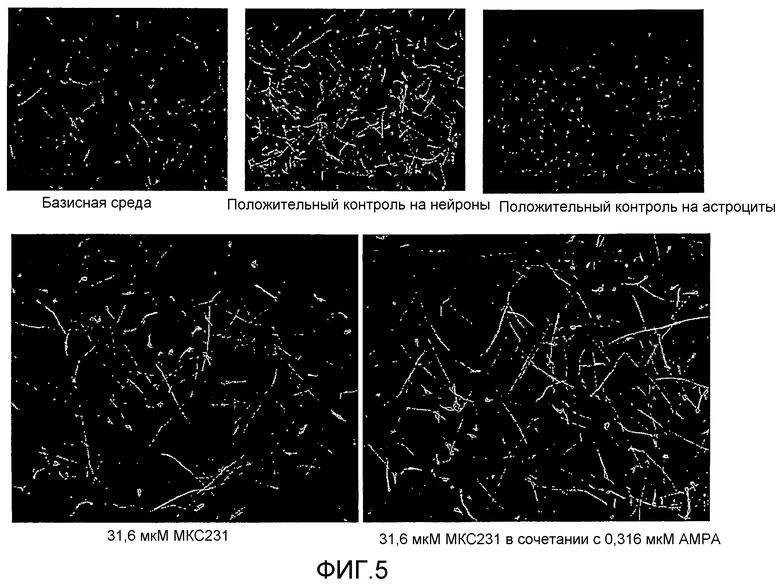
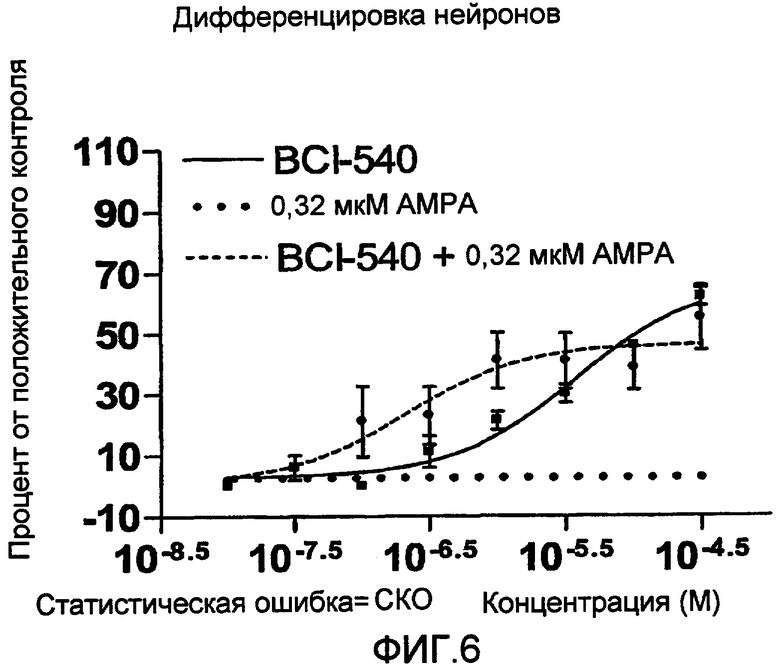
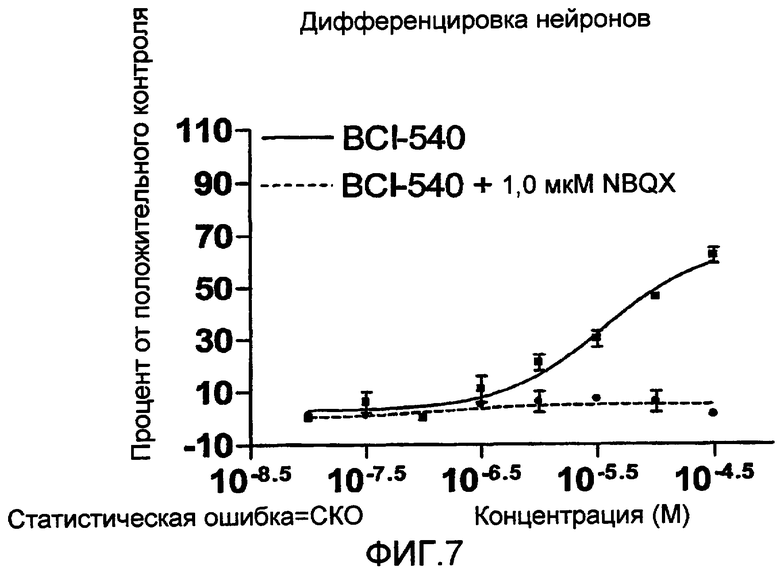

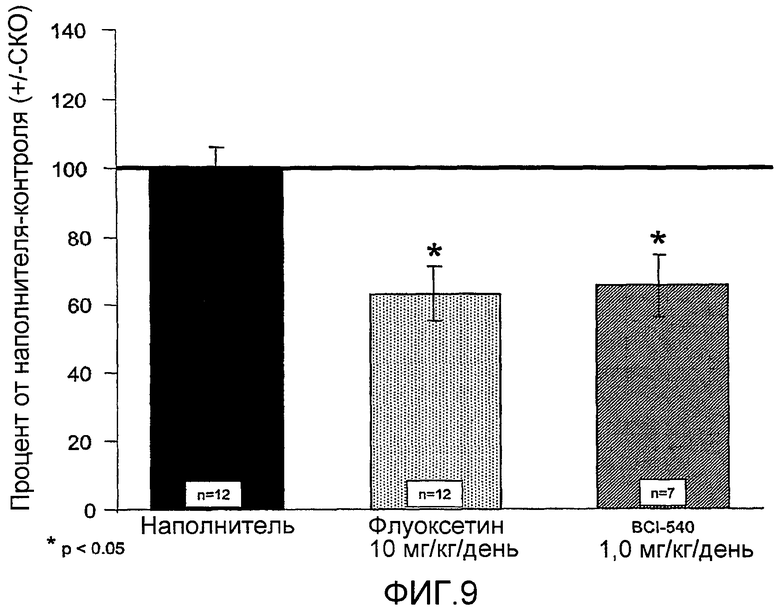
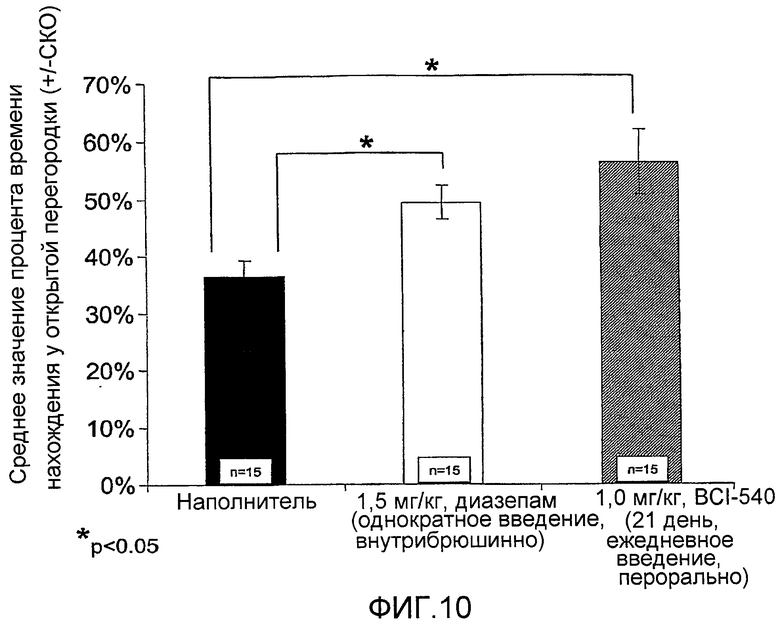
Настоящая группа изобретений относится к медицине, а именно к неврологии, и касается стимуляции нейрогенеза и лечения депрессивных состояний. Для этого вводят 2-(2-оксипирролидин-1-ил)-N-(2,3-диметил-5,6,7,8-тетрагидрофуро(2,3-b)хинолин-4-ил)ацетамида в количествах, эффективных для образования новых нервных клеток. 3 н. и 7 з.п. ф-лы 10 ил., 12 пр.
1. Способ лечения расстройства нервной системы, связанного с психиатрическим состоянием, выбранным из группы, состоящей из депрессии, биполярной депрессии, биполярного расстройства (маниакально-депрессивного расстройства), послеболевой депрессии и послеродовой депрессии у субъекта или пациента, где указанный способ включает введение 2-(2-оксипирролидин-1-ил)-N-(2,3-диметил-5,6,7,8-тетрагидрофуро(2,3-b)хинолин-4-ил)ацетамида указанному субъекту или пациенту.
2. Способ по п.1, где указанное психическое состояние является депрессией.
3. Способ по п.2, где указанный способ дополнительно включает введение антидепрессанта указанному субъекту или пациенту.
4. Способ по п.2, где указанная депрессия связана с использованием морфина субъектом или пациентом.
5. Способ стимуляции или повышения нейрогенеза у пациента, нуждающегося в этом, где указанный способ включает введение 2-(2-оксипирролидин-1-ил)-N-(2,3-диметил-5,6,7,8-тетрагидрофуро(2,3-b)хинолин-4-ил)ацетамида.
6. Способ получения клеток или ткани для трансплантации субъекту или пациенту, где указанный способ включает стимуляцию или повышение нейрогенеза в указанной клетке или ткани путем контакта указанной клетки или ткани с 2-(2-оксипирролидин-1-ил)-N-(2,3-диметил-5,6,7,8-тетрагидрофуро(2,3-b)хинолин-4-ил)ацетамидом.
7. Способ по п.6, где указанный способ дополнительно включает контактирование указанной клетки или ткани с опиоидным или неопиоидным нейрогенным агентом.
8. Способ по п.7, где указанный неопиоидный нейрогенный агент представляет собой лиганд мускаринового рецептора, такой как сабкомелин.
9. Способ по п.7, где указанный опиоид представляет собой антагонист каппа-опиоидного рецептора.
10. Способ по п.7, где указанная клетка или ткань демонстрирует сниженный нейрогенез или подвергалась действию агента, который снижает или ингибирует нейрогенез.
| RU 96121599 A, 20.02.1999 | |||
| US 5397785 A, 14.03.1995 | |||
| Решетка к устройству для измельчения | 1979 |
|
SU782867A1 |
| US 2004122034 A1, 24.06.2004 | |||
| WO 03028651 A2, 10.04.2003 | |||
| SCHLETT К | |||
| Glutamate as modulator of embryonic and adult neurogenesis// Curr Top MeChem | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2012-05-27—Публикация
2007-02-06—Подача