Область изобретения
Настоящее изобретение относится к составам бензимидазолилпиридилэфиров. Более подробно настоящее изобретение относится к лекарственным составам, включающим {1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензимидазол-2-ил} (4-трифторметилфенил)амин, его таутомер, фармацевтически приемлемую соль, фармацевтически приемлемую соль таутомера или любую смесь двух или более указанных соединений, и к способам получения и применения указанных составов.
Предпосылки создания настоящего изобретения
Известно, что киназы принимают участие в развитии рака. Например, известно, что киназы, такие как серин/треонин киназы Raf и рецепторные тирозинкиназы (RTK), связаны с онкогенезом. Оба указанных типа киназ являются компонентами пути передачи сигнала, в результате которого фосфорилируются факторы транскрипции. В указанном пути киназы Raf входят в состав сигнального модуля Ras/митоген-активированной протеинкиназы (МАРК), которая оказывает влияние и регулирует многие клеточные функции, такие как пролиферация, дифференциация, выживание, онкогенная трансформация и апоптоз.
Известно, что некоторые ингибиторы киназ Raf эффективно ингибируют пролиферацию опухолевых клеток при анализе in vitro и/или in vivo (см., например, патенты US №6391636, 6358932, 6037136, 5717100, 6458813, 6204467 и 6268391). В других патентах и заявках предполагается, что ингибиторы киназы Raf можно использовать для лечения лейкоза (см., например, патенты US №6268391 и 6204467, и заявки US №20020137774, 20020082192, 20010016194 и 20010006975), или для лечения рака молочной железы (см., например, патенты US №6358932, 5717100, 6458813, 6268391 и 6204467 и заявку US №20010014679). На первых стадиях клинических испытаний было установлено, что ингибиторы киназы Raf-1, которые ингибируют также киназу B-Raf, можно использовать в качестве перспективных терапевтических агентов при лечении рака (Crump, Current Pharmaceutical Design, 8, cc. 2243-2248 (2002), Sebastien и др., Current Pharmaceutical Design, 8, cc. 2249-2253 (2002)).
Рецепторные тирозинкиназы (RTK), например, рецепторы эндотермального фактора роста сосудов (VEGFR), являются трансмембранными полипептидами, регулирующими рост и дифференциацию клеток, регулирование и регенерацию тканей у взрослых субъектов. Mustonen Т. и др., J.Cell Biology, 129, cc. 895-898 (1995), van der Geer P. и др., Ann Rev. Cell Biol., 10, cc.251-337 (1994). VEGF и члены подсемейства VEGF влияют на проницаемость сосудов, миграцию и пролиферацию эндотелиальных клеток, а кроме того индуцируют ангиогенез и васкулогенез. Ferrara N. и др., Endocrinol. Rev., 18, сс.4-25 (1997), Connolly D. и др., J. Biol. Chem., 264, cc.20017-20024 (1989), Connolly D. и др., J. Clin. Invest., 84, cc.1470-1478 (1989), Leung D. и др.. Science, 246, cc.1306-1309 (1989), Plouet J. и др., EMBO J., 8, cc.3801-3806 (1989).
Ангиогенез представляет собой процесс образования новых кровеносных сосудов в тканях и играет важную роль в росте раковых клеток. В ходе развития рака после достижения группой раковых клеток определенных размеров, диаметром приблизительно от 1 до 2 мм, для дальнейшего роста опухоли требуется источник кровоснабжения, т.к. простой диффузии недостаточно для обеспечения раковых клеток кислородом и питательными веществами. Таким образом, полагают, что подавление ангиогенеза за счет ингибирования киназ, принимающих участие в ангиогенезе, может приостановить рост раковых клеток.
Один из классов соединений, подавляющих ангиогенез, рост опухолей, оказывающих леченое действие на рак, модулирующих остановку клеточного цикла и/или ингибирующих киназы, такие как Ras, Raf, мутант B-Raf, VEGFR2 (KDR, Flk-1), FGFR2/3, c-Kit, PDGFRp, CSF-1R, включает соединения, известные как бензимидазолилпиридилэфиры. Способы получения и применения различных бензимидазолилпиридилэфиров описаны в патентах WO 2003/082272 и WO 2005/032458 и заявках US №60/712539, поданной 30 августа 2005 г., 60/731591, поданной 27 октября 2005 г., 60/774684, поданной 17 февраля 2006 г. и 60/713108, поданной 30 августа 2005 г., включенных в данный контекст в полном объеме в качестве ссылок. Несмотря на высокую биологическую активность бензимидазолилипиридилэфиров возникают проблемы при их переработке в лекарственные средства из-за низкой растворимости указанных соединений в воде при физиологических значениях рН.
Краткое изложение сущности изобретения
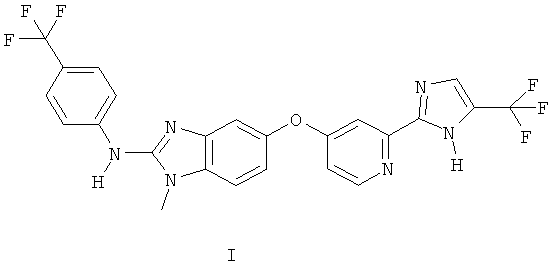
В одном объекте настоящего изобретения предлагаются составы и лекарственные средства, содержащие бензимидазолилпиридилэфиры, и способы получения и применения таких составов и лекарственных средств. Составы включают твердые и жидкие составы, включающие {1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензимидазол-2-ил}(4-трифторметилфенил)амин, в форме капсул или таблеток. Составы можно вводить перорально или другими известными способами. Предлагаемые составы обладают повышенной растворимостью в воде и повышенной биодоступностью/фармакокинетикой in vivo бензимидазолилпиридилэфиров по сравнению с другими соединениями.
В другом объекте настоящего изобретения предлагается состав, включающий соединение формулы I, его фармацевтически приемлемую соль или смесь двух или более вышеуказанных соединений, и ингредиент, выбранный из группы, включающей гидрофильный растворитель, липофильный растворитель, эмульгатор или смесь любых двух или более указанных соединений:
Например, ингредиент означает смесь гидрофильного и липофильного растворителей или смесь гидрофильного растворителя, липофильного растворителя и эмульгатора.
В некоторых вариантах состав включает соединение формулы I, его фармацевтически приемлемую соль или смесь любых двух или более указанных соединений, гидрофильный растворитель, липофильный растворитель и эмульгатор.
В некоторых вариантах состав представляет собой жидкий состав. В других вариантах состав представляет собой твердый состав.
В одном объекте описанные в данном контексте составы содержатся в капсуле или таблетке. В других вариантах общая масса соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более указанных соединений, содержащихся в таблетке или капсуле, составляет от приблизительно 1 мг до приблизительно 400 мг включительно. В некоторых вариантах капсула или таблетка покрыта полимером или желатином или покрыта желатиновой оболочкой. Капсула представляет собой капсулу с твердой оболочкой и, кроме того, может состоять из корпуса и верхней части, которые герметично запаяны.
В другом объекте предлагаются способы получения состава, включающего комбинирование и/или смешивание соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более указанных соединений, с ингредиентом, выбранным из группы, включающей гидрофильный растворитель, липофильный растворитель, эмульгатор или смесь любых двух или более указанных соединений. Способы получения состава, кроме того, включают смешивание соединения, соли или смеси ингредиента с антиоксидантом, консервантом, подсластителем, ароматизатором, красителем или смесью двух или более указанных соединений. В некоторых вариантах соединение, соль или смесь и ингредиент смешивают со вспомогательным веществом, выбранным из группы, включающей, например, метанол, этанол или их смесь.
В некоторых вариантах, кроме того, предлагается фармацевтический упаковочный контейнер, включающий емкость для хранения, содержащую одну или более капсул или таблеток, и одну или более капсул или таблеток, включающих состав по настоящему изобретению.
Составы по изобретению можно использовать в качестве фармацевтических составов или лекарственных средств для лечения рака и/или подавления ангиогенеза у субъекта, нуждающегося в таком лечении. Таким образом, в другом объекте предлагаются способы лечения рака и/или подавления ангиогенеза у субъекта, которые заключаются во введении составов субъекту. В некоторых вариантах, относящихся к способам лечения рака, состав вводят в количестве, которое обеспечивает величину Cmax в плазме субъекта от приблизительно 0,1 до приблизительно 10 мкг/мл соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более указанных соединений. В других вариантах способа лечения рака состав вводят в количестве, которое обеспечивает величину AUC (площади под фармакокинетической кривой) в плазме субъекта от приблизительно 0,01 до приблизительно 10 мг×мин/мл соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более указанных соединений. В указанных способах лечения состав вводят один, два, три, четыре или более раз в сутки или в неделю. В других вариантах способа лечения рака заболевание выбирают из группы, включающей рак мочевого пузыря, молочной железы, мозга, карциному, хронический лимфоидный лейкоз, хронический миелогенный лейкоз, рак ободочной кишки, желудка, желудочно-кишечного тракта, глиому, лимфому, меланому, множественную миелому, миелопролиферативное заболевание, нейроэндокринное заболевание, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак поджелудочной железы, рак предстательной железы, почек, острый мелкоклеточный миелогенный лейкоз, саркому и/или рак щитовидной железы.
Подробное описание вариантов осуществления настоящего изобретения
Предлагаются составы, включающие бензимидазолилпиридилэфиры. Указанные составы можно использовать для ингибирования киназы RAF, основного фермента, принимающего участие в пути МАРК. Составы можно использовать, например, для лечения пациентов, страдающих раком и/или нуждающихся в ингибировании киназы RAF.
В настоящей заявке используются следующие сокращения и определения:
Термин «адсорбирующий носитель» означает материал, обычно твердый, применяемый для адсорбции и/или абсорбции жидких составов.
«API» означает сокращенное название активного фармацевтического ингредиента. В данном контексте, если не указано иное, API означает соединение: {1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензимидазол-2-ил}(4-трифторметилфенил)амин.
«AUC» означает сокращенное название площади под фармакокинетической кривой зависимости концентрации соединения в плазме крови от времени.
«BCS» означает сокращенное название биофармацевтической системы классификации, которая используют для классификации лекарственных соединений по их растворимости в воде и проницаемости в кишечнике. См., например, Guidance for Industry: Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based on a Biopharmaceutics Classification System, отдел здравоохранения и пищевой промышленности США и управление по контролю за продуктами и лекарствами США (CDER), август 2000, и Amidon G.L., H.Lennernäs, V.Р.Shah и J.R.Crison, Pharmaceutical Research, 12, cc.413-420 (1995).
Термин «целлюлоза» означает различные формы целлюлозы, используемые в фармацевтических составах, включая, без ограничения перечисленным, этилцеллюлозу, ацетат целлюлозы, кальциевую соль карбоксиметилцеллюлозы, натриевую соль карбоксиметилцеллюлозы, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу (например, №2208, 2906, 2910), фталат гидроксипропилметилцеллюлозы, микрокристаллическую целлюлозу и их смеси. Пригодные формы микрокристаллической целлюлозы, используемые в составах по настоящему изобретению, включают, без ограничения перечисленным, материалы с торговыми названиями AVICEL-PH-101, AVICEL-PH-103 AVICEL RC-581, AVICEL-PH-105 (фирмы FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, Pa.) и их смеси.
Термин «Cmax» означает максимальную наблюдаемую концентрацию соединения в плазме, ткани или крови субъекта, которому вводят соединение. Значение Cmax обычно определяют в течение от нескольких минут до нескольких часов после введения соединения субъекту и оно зависит от физико-химических и биологических свойств конкретного соединения.
Натриевая соль кроскармеллозы означает натриевую соль сшитой карбоксиметилцеллюлозы.
«Кросповидон» означает нерастворимый в воде сшитый гомополимер 1-винил-2-пирролидона, обычно характеризующийся средней молекулярной массой более 1000000, определенной эмпирическим способом.
«Циклодекстрин» относится к семейству циклических олигосахаридов, содержащих по крайней мере шесть D-(+)-глюкопиранозных звеньев.
Термин «эмульгатор», использованный в данном контексте, означает материал, ускоряющий образование эмульсии.
Термин «эмульсия», использованный в данном контексте, означает дисперсию одной несмешивающейся жидкости в другой жидкости. Термин «микроэмульсия» означает прозрачную изотропную жидкую смесь липофильной жидкости, гидрофильной жидкости и одного или более ПАВ.
«EtoAc» означает этилацетат.
«EtOH» означает этиловый спирт.
Термин «жирная кислота», использованный в данном контексте, означает любую кислоту из группы одноосновных кислот, прежде всего, из животных и растительных жиров и масел. В некоторых вариантах жирная кислота означает кислоту с прямой или разветвленной алкильной или алкиленовой цепью, содержащей от 6 до 22 атомов углерода, и остаток карбоновой кислоты расположен в конце углеводородной цепи.
Термин «глицериды», использованный в данном контексте, означает сложные эфиры одной или более кислот и глицерина. В некоторых вариантах кислота означает жирную кислоту. Глицериды со средней длиной цепи означают сложные эфиры жирных кислот со средней длиной цепи, содержащих от 6 до 12 атомов углерода, в некоторых вариантах от 6 до 10 атомов углерода. Жирные кислоты со средней длиной цепи включают капроновую кислоту (С6), каприловую кислоту (С8), каприновую кислоту (С10) и лауриновую кислоту (С12). Глицериды с длинной цепью означают сложные эфиры глицерина и жирных кислот с длинной цепью, содержащих от 12 до 22 атомов углерода, или в некоторых вариантах от 12 до 18 атомов углерода.
«ПЭВП» означает полиэтилен высокой плотности.
«ТЖК» означает твердые желатиновые капсулы.
«ЖХВР» означает жидкостную хроматографию высокого разрешения.
«ГПМЦ» означает гидроксипропилметилцеллюлозу.
Термин «гидрофильный», использованный в данном контексте, означает материал, быстро растворяющийся в воде или смешивающийся с водой. Термин «гидрофильный растворитель» означает растворитель, растворяющий или диспергирующий растворенное вещество, который сам растворяется в воде или растворяет воду.
«LAH» означает литийалюминийгидрид.
Термин «липид», использованный в данном контексте, означает любую группу органических соединений, включая, без ограничения перечисленным, жиры, масла, воски, стерины и триглицериды, нерастворимые в воде, но растворимые в органических растворителях, маслянистые на ощупь.
Термин «липофильный», использованный в данном контексте, означает материал, быстрорастворимый в липидах или растворяющий липиды. Термин «липофильные растворители» означает растворители, растворяющие или диспергирующие растворенное вещество, которые сами растворяются в липидах или растворяют липиды.
Термин «ЖХ-МС» означает тандем жидкостной хроматографии и масс-спектрометрии.
«МеОН» означает метанол.
«МПЭГ» означает метоксиполиэтиленгликоль, полиэфир общей формулы СН3О[CH2CH2O]nH, со средней молекулярной массой в широком диапазоне. В данном контексте, если не указано иное, МПЭГ характеризуется средней молекулярной массой от приблизительно 100 до приблизительно 20000 г/моль или более.
«МТБЭ» означает метил-трет-бутиловый эфир.
«ЯМР» означает ядерный магнитный резонанс.
«ПЭГ» означает полиэтиленгликоль, полиэфир полиэтиленоксида общей формулы НО[CH2CH2O]nH, со средней молекулярной массой в широком диапазоне. В некоторых вариантах ПЭГ характеризуется средней молекулярной массой от приблизительно 100 г/моль до приблизительно 1000 г/моль. В некоторых вариантах ПЭГ характеризуется средней молекулярной массой более приблизительно 1000 г/моль. В других вариантах ПЭГ характеризуется средней молекулярной массой от приблизительно 1000 г/моль до приблизительно 20000 г/моль.
Термин «фосфолипид», использованный в данном контексте, означает фосфорсодержащие липиды, содержащие в основном жирные кислоты, фосфатную группу и простую органическую молекулу, например, глицерин. Фосфолипиды, кроме того, могут означать фосфатиды.
«ПОЭ» означает полиоксиэтилен. В данном контексте, если не указано иное, полиоксиэтилен означает полиэфир этиленгликоля, со средней молекулярной массой более 20000 г/моль. В некоторых вариантах средняя молекулярная масса ПОЭ составляет от приблизительно более 20000 до 300000 г/моль. ПОЭ необязательно используют в виде сополимеров с другими полимерами.
Термин «повидон», использованный в данном контексте, означает полимер 1-винил-2-пирролидона со средней молекулярной массой в широком диапазоне. В некоторых вариантах повидон характеризуется средней молекулярной массой от приблизительно 2500 г/моль до приблизительно 300000 г/моль или более.
«OB означает относительную влажность.
«КТ» означает комнатную температуру.
«СЭСДЛ» означает самоэмульгирующуюся систему для доставки лекарственных средств.
«СМЭСДЛ» означает самомикроэмульгирующуюся систему для доставки лекарственных средств.
Термин «сорбитан», использованный в данном контексте, означает дегидратированный сорбит.
Термин «крахмал» означает сложный углевод, состоящий из амилазы и амилопектина. «Предварительно желатинизированный крахмал» означает крахмал, который обрабатывают химическим и/или механическим способом, чтобы в присутствии воды разрушить все или часть гранул, и который затем высушивают. Некоторые виды желатинизированных крахмалов модифицируют для придания им сжимаемости и текучести.
Термин «сахаро-жирная кислота» означает жирную кислоту, к которой присоединен остаток сахара.
«ТБАХ» означает трет-бутиламмонийхлорид.
«ТФУ» означает трифторуксусную кислоту.
«ТГФ» означает тетрагидрофуран.
«ТСХ» означает тонкослойную хроматографию.
Термин «фармацевтически приемлемая соль» включает соль неорганического основания, органического основания, неорганической кислоты, органической кислоты или основной или кислотной аминокислоты. Соли неорганических оснований включают, например, соли щелочных металлов, таких как натрий или калий, щелочноземельных металлов, таких как кальций и магний, или алюминия и соли аммония. Соли органических оснований включают, например, соли триметиламина, триэтиламина, пиридина, пиколина, этаноламина, диэтаноламина и триэтаноламина. Соли неорганических кислот включают, например, соли соляной, гидроборной, азотной, серной и фосфорной кислот. Соли органических кислот включают, например, соли муравьиной, уксусной, фумаровой, щавелевой, винной, малеиновой, молочной, лимонной, янтарной, яблочной, метансульфоновой кислот, бензенсульфокислоты и пара-толуолсульфокислоты. Соли основных аминокислот включают, например, соли аргинина, лизина и орнитина. Кислотные аминокислоты включают, например, соли аспарагиновую и глутаминовую кислоты.
Термин «субъект», использованный в данном контексте, означает любое животное, которое можно использовать для оценки преимуществ действия составов и способов, описанных в настоящем изобретении. Таким образом, соединение формулы I, его фармацевтически приемлемую соль или смесь двух или более указанных соединений можно вводить любому животному, которое используют для оценки преимущества действия соединения согласно способам лечения рака, описанным в данном контексте. Предпочтительно животное означает млекопитающее, прежде всего человека, без ограничения перечисленным. Примеры других пригодных животных включают, без ограничения перечисленным, крыс, мышей, обезьян, собак, кошек, крупный рогатый скот, лошадей, свиней, овец и т.п.
Термин «лечение», использованный в данном контексте, означает снижение интенсивности симптомов, связанных с нарушением или заболеванием, приостановку или замедление развития или ухудшения указанных симптомов или предотвращение или профилактику заболевания или нарушения. Например, в случае рака успешное лечение может означать снижение интенсивности симптомов или приостановку или замедление развития заболевания, которые определяют по снижению скорости роста опухоли или по приостановке роста опухоли, уменьшению размеров опухоли, частичной или полной ремиссии рака или по повышенному коэффициенту выживаемости или по клиническим преимуществам.
Термин «сольват», использованный в данном контексте, означает ассоциацию растворителя с соединением в кристаллической форме. Ассоциация с растворителем обычно происходит при взаимодействии с растворителем в ходе синтеза, кристаллизации и/или перекристаллизации соединения.
Термин «гидрат», использованный в данном контексте, означает ассоциацию воды и соединения в кристаллической форме. Ассоциация с водой обычно происходит при взаимодействии с водой в ходе синтеза, кристаллизации и/или перекристаллизации соединения и в результате гигроскопичности соединения.
Термин «приблизительно», использованный в данном контексте вместе с численным значением, означает указанное значение ±10%.
Если не указано иное, объект в единственном числе означает «один или более».
Специалисту в данной области представляется очевидным, что некоторые нижеперечисленные материалы, которые относятся к категории гидрофильных растворителей, липофильных растворителей, эмульгаторов, абсорбирующих носителей, полимерных носителей и дополнительных ингредиентов или материалов для нанесения покрытия, могут относиться к одной или нескольким указанным категориям, хотя они и не перечислены в других категориях. Например, в некоторых вариантах гидроксипропилцеллюлозу используют в качестве полимерного носителя и/или в других вариантах ее можно использовать в качестве покрытий для капсул или таблеток. Например, соединение марки GELUCIRE 44/14 одновременно можно использовать в качестве эмульгатора и липофильного растворителя. Другие подобные материалы, принадлежащие к нескольким категориям, но перечисленные только в одной категории, представляются очевидным для специалиста в данной области.
Кроме того, предлагаются составы бензимидазолилпиридилэфира. Более подробно настоящее изобретение в основном относится к составам, включающим соединение формулы I, его фармацевтически приемлемую соль или смесь любых двух или более указанных соединений, и к способам получения и применения таких составов. В данном контексте соединение формулы I означает {1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензимидазол-2-ил}(4-трифторметилфенил)амин, соединение формулы

Следует понимать, что соединение формулы I, кроме того, может существовать в форме сольватов и/или гидратов, все сольваты и гидраты включены в объем соединения и структуры формулы I.
Следует также понимать, что органические соединения по настоящему изобретению могут существовать в таутомерных формах. Хотя химическое соединение показано только в одной возможной таутомерной форме, следует понимать, что соединение формулы I может образовывать любую таутомерную форму указанной структуры. Например, одним из возможных таутомеров соединения формулы I, является изображенный ниже таутомер Ia
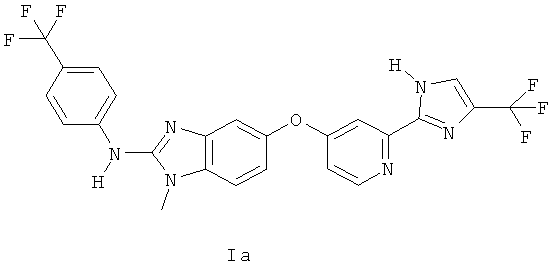
Специалистам в данной области техники представляется очевидным, что соединения формулы I и его таутомеры могут кроме того существовать в форме сольватов и/или гидратов, которые также включены в объем соединения и/или структуры формулы I. Кроме того, фармацевтически приемлемые соли соединения формулы I также включают соответствующие сольваты и/или гидраты фармацевтически приемлемых солей соединения формулы I.
В некоторых вариантах составы включают соединение формулы I, его фармацевтически приемлемую соль или смесь любых двух или более указанных соединений, выбранных из группы, включающей гидрофильный растворитель, липофильный растворитель, эмульгатор или смесь любых двух или более указанных соединений. В некоторых вариантах ингредиент включает смесь гидрофильного и липофильного растворителей. В других вариантах ингредиент включает смесь гидрофильного, липофильного растворителей и эмульгатор.
Жидкие составы
В одном объекте составы по настоящему изобретению представляют собой жидкие составы. В некоторых из указанных вариантов гидрофильный растворитель по настоящему изобретению выбирают из группы, включающей, без ограничения перечисленным, моноэтиловый эфир диэтиленгликоля, этанол, глицерин, гликофурол, МПЭГ, N-метил-2-пирролидон, ПЭГ, пропиленкарбонат, пропиленгликоль или смесь любых двух или более указанных соединений. В других вариантах ПЭГ характеризуется средней молекулярной массой от приблизительно 100 г/моль до приблизительно 1000 г/моль. В некоторых вариантах МПЭГ характеризуется средней молекулярной массой от приблизительно 100 г/моль до приблизительно 1000 г/моль.
В других вариантах гидрофильным растворителем является этанол, ПЭГ или смесь любых двух или более указанных соединений. В некоторых таких вариантах этанол содержится в концентрации до приблизительно 15% в расчете на общую массу состава. В других вариантах ПЭГ содержится в концентрации до приблизительно 90% в расчете на общую массу состава.
Липофильные растворители, пригодные для использования в настоящем изобретении, могут включать, без ограничения перечисленным, жирные кислоты, такие как, без ограничения перечисленным, линолевая, линоленовая, олеиновая, пальмитостеариновая и стеариновая кислоты, глицериды со средней длиной цепи, такие как, без ограничения перечисленным, моно-, ди- или триглицериды каприловой кислоты и каприновой кислоты, а также известные моно-, ди- и триглицериды со средней длиной цепи, с торговым названием MIGLYOL® 812, LABRAFAC СС® и CAPMUL® МСМ, глицериды с длинной цепью (жирных кислот, включающих 12-18 атомов углерода), такие как, без ограничения перечисленным, кукурузное масло, хлопковое масло, глицерилбегенат, глицерилмоноолеат, глицерилмоностеарат, глицерилпальмитостеарат, оливковое масло, арахисовое масло, масло перечной мяты, сафлоровое масло, кунжутное масло и соевое масло, этиловый эфир жирной кислоты, такой как этиллинолеат и этилолеат, DL-α-токоферол, сложный эфир пропиленгликоля и жирной кислоты, такой как, без ограничения перечисленным, моно- и дилаурат пропиленгликоля, сложный эфир сорбитана и жирной кислоты, такой как, без ограничения перечисленным, сорбитанмонолаурат, сорбитанмоноолеат, сорбитанмонопальмитат, сорбитанмоностеарат и сорбитантриолеат, сложные эфиры полиглицерина и жирных кислот, полученные из различных простых эфиров глицерина и жирных кислот. В некоторых вариантах липофильным растворителем является олеиновая кислота. В других вариантах липофильные растворители являются твердыми или полутвердыми при КТ, хотя состав, полученный с использованием липофильного растворителя, представляет собой жидкость. Примеры полиглицеринов, используемых для этерификации, включают диглицерин, тетраглицерин, гексаглицерин, декаглицерин и т.п. Примеры жирных кислот, взаимодействующих с полиглицеринами, включают олеиновую кислоту, линолевую кислоту, стеариновую кислоту и т.п. Примеры сложных эфиров полиглицерина и жирных кислот включают PLUROL OLEIQUE СС 497 (полиглицерилолеат, Gattefosse Co.), PLUROL STEARIQUE (полиглицерилпальмитостеарат, Gattefosse Co.), DGMO-C (диглицерилмоноолеат, Nikkol Co.), TETRAGLYN 1-0 (тетраглицерилмоноолеат, Nikkol Co.), HEXAGLYN 1-0 (гексаглицерилмоноолеат, Nikkol Co.), HEXAGLYN 5-0 (гексаглицерилпентаолеат, Nikkol Co.), DECAGLYN 5-0 (декаглицерилпентаолеат, Nikkol Co.), DECAGLYN 10-0 (декаглицерилдекаолеат, Nikkol Co.) и т.п.
Эмульгаторы, пригодные для получения составов по настоящему изобретению, могут включать, без ограничения перечисленным, сложные эфиры сахара и жирных кислот, сложные эфиры полиоксиэтиленсорбита и жирной кислоты, такие как, без ограничения перечисленным, полисорбат 20, полисорбат 40, полисорбат 60 и полисорбат 80, сложные эфиры полиоксиэтилена и моно- и двухосновных жирных кислот, включая, без ограничения перечисленным, полиоксил(40)стеарат и полиоксил(40)олеат, смесь моно- и диэфиров полиоксиэтилена и жирных С8-С22киcлот, моно-, ди- и триэфиров глицерина и жирных С8-С22кислот с торговым названием LABRASOL®, GELUCIRE® 44/14, GELUCIRE® 50/13, LABRAFIL® M 1944 CS и LABRAFIL® M2125 CS, соединения полиоксиэтилена и касторового масла, такие как, без ограничения перечисленным, полиоксил(35)касторовое масло, полиоксил(40)гидрированное касторовое масло и полиоксил(60)гидрированное касторовое масло с торговым названием CREMOPHOR® ELP, CREMOPHOR® RH 40 и CREMOPHOR® RH 60, соответственно, полиоксиэтиленалкиловые эфиры, включая, без ограничения перечисленным, полиоксил(20)цетостеариловый эфир и полиоксил(10)олеиловый эфир, DL-α-токоферол-полиэтиленгликоль-сукцинат с торговым названием VITAMIN E TPGS®, моно-, ди- и триглицерид, моно-, ди- и триэфиры C8-C22 жирных кислот и глицерина, моно-, ди- и триэфир сахарозы, диоктилсульфосукцинат натрия, лаурилсульфат натрия или смесь любых двух или более указанных соединений.
Жидкие составы по настоящему изобретению могут кроме того содержать фармацевтически приемлемые добавки, такие как антиоксиданты, красители, ароматизаторы, консерванты, подсластители или смесь любых двух и более указанных соединений. Пригодные антиоксиданты включают, без ограничения перечисленным, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, этилендиаминтетрауксусную кислоту, соли этилендиаминтетрауксусной кислоты, пропилгаллат, метабисульфит натрия, витамин Е, сложные эфиры витамина Е или смесь любых двух или более указанных соединений. Пригодные консерванты включают, без ограничения перечисленным, бутилпарабен, сорбат кальция, этилпарабен, метилпарабен, монотиоглицерин, сорбат калия, пропилпарабен, бензоат натрия, сорбат натрия, сорбиновую кислоту или смесь любых двух или более указанных соединений. Пригодные подсластители включают, без ограничения перечисленным, аспартам, соли глицирризина, глицирризинат моноаммония, сахарин, кальциевую соль сахарина, натриевую соль сахарина, сахар, сукралозу или смесь любых двух или более указанных соединений. Ароматизаторы включают, без ограничения перечисленным, лимонную кислоту, ментол, масло перечной мяты, цитрат натрия, ванилин, этилванилин или смесь любых двух или более указанных соединений. Красители включают, без ограничения перечисленным, FD&C голубой #1, FD&C голубой #2, FD&C зеленый #3, FD&C красный #3, FD&C красный #4, FD&C желтый #5, FD&C желтый #6, D&C голубой #4, D&C зеленый #5, D&C зеленый #6, D&C оранжевый #4, D&C оранжевый #5, оксиды железа или смесь любых двух или более указанных соединений.
Количество активного фармацевтического ингредиента в жидком составе по настоящему изобретению изменяется в зависимости от назначения, специалист в данной области может определить требуемое количество для каждого конкретного случая с учетом приведенного описания. В некоторых вариантах в жидких составах по настоящему изобретению содержится соединение формулы I, его фармацевтически приемлемая соль или смесь любых двух или более указанных соединений в количестве от приблизительно 0,1 мас.% до приблизительно 40 мас.% в расчете на общую массу состава. В других вариантах соединение формулы I, его фармацевтически приемлемая соль или смесь любых двух указанных соединений содержится в количестве от приблизительно 0,2 мас.% до приблизительно 20 мас.% в расчете на общую массу состава. В некоторых вариантах соединение формулы I, его фармацевтически приемлемая соль или смесь любых двух или более указанных соединений содержится в количестве от приблизительно 0,5 мас.% до приблизительно 10 мас.% в расчете на общую массу состава.
В других вариантах гидрофильный растворитель содержится в количестве до приблизительно 90 мас.% в расчете на общую массу состава. В некоторых вариантах эмульгатор содержится в количестве от приблизительно 5 ма.% до приблизительно 50 мас.% в расчете на общую массу состава. В других вариантах липофильный растворитель содержится в количестве до приблизительно 50 мас. % в расчете на общую массу состава.
Жидкие составы могут содержаться в капсуле. В некоторых вариантах капсула представляет собой капсулу с твердой оболочкой, твердую желатиновую капсулу, мягкую желатиновую капсулу, капсулу из природного пуллулана или капсулу из гидроксипропилметилцеллюлозы. В других вариантах общая масса содержащегося в капсуле соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух указанных соединений составляет от приблизительно 1 мг до приблизительно 400 мг. В некоторых вариантах капсула покрыта полимером или желатином или капсула покрыта желатиновой оболочкой. Капсула представляет собой капсулу с твердой оболочкой и, кроме того, может состоять из корпуса и верхней части, которые герметично запечатаны.
Составы по настоящему изобретению характеризуются стабильностью. В таблице 5 и разделе Примеры приведены подробные данные о стабильности жидких составов. Таким образом, в некоторых вариантах, количество продуктов разложения API в составах по настоящему изобретению обычно составляет менее 10 мас.% в расчете на общую массу состава после хранения состава в течение трех месяцев при 50°С и относительной влажности 75%. В других вариантах количество продуктов разложения составляет менее 8%, менее 5%, менее 4%, менее 3%, менее 2% или даже менее 1% в расчете на общую массу состава после хранения в течение трех месяцев при 50°С и относительной влажности 75%.
Твердые составы
В другом объекте составы по настоящему изобретению являются твердыми составами. В некоторых вариантах гидрофильный растворитель включает, без ограничения перечисленным, ПЭГ, МПЭГ, ПОЭ или смесь любых двух или более указанных соединений. В некоторых вариантах гидрофильный растворитель является твердым при КТ. Такими твердыми при КТ гидрофильными растворителями являются гидрофильные воски. В других вариантах ПЭГ характеризуется средней молекулярной массой приблизительно 1000 г/моль или более. В некоторых вариантах ПЭГ характеризуется средней молекулярной массой от приблизительно 1000 г/моль до приблизительно 20000 г/моль. В других вариантах ПЭГ характеризуется средней молекулярной массой от приблизительно 3000 г/моль до приблизительно 20000 г/моль. В некоторых вариантах МПЭГ характеризуется средней молекулярной массой приблизительно 1000 г/моль или более. В других вариантах МПЭГ характеризуется средней молекулярной массой от приблизительно 1000 г/моль до приблизительно 20000 г/моль. В некоторых вариантах МПЭГ характеризуется средней молекулярной массой от приблизительно 3000 г/моль до приблизительно 20000 г/моль. В других вариантах ПОЭ характеризуется средней молекулярной массой приблизительно 20000 г/моль или более. В некоторых вариантах ПОЭ характеризуется средней молекулярной массой от приблизительно 20000 г/моль до приблизительно 300000 г/моль.
Пригодные для использования в составах по настоящему изобретению липофильные растворители при КТ являются жидкими, полутвердыми или твердыми и включают, без ограничения перечисленным, жирную кислоту, такую как, без ограничения перечисленным, линолевая, линоленовая, олеиновая, пальмитостеариновая и стеариновая кислоты, глицериды со средней длиной цепи, такие как, без ограничения перечисленным, моно-, ди- и триэфиры глицерина и каприловой или каприновой кислоты, известные как моно- ди- и триглицериды со средней длиной цепи с торговым названием MIGLYOL® 812, LABRAFAC СС® и CAPMUL® МСМ, глицериды с длинной цепью (жирных кислот C12-C18), такие как, без ограничения перечисленным, кукурузное масло, хлопковое масло, глицерилбегенат, глицерилмоноолеат, глицерилмоностеарат, глицерилпальмитостеарат, оливковое масло, арахисовое масло, масло перечной мяты, сафлоровое масло, кунжутное масло и соевое масло, этиловые сложные эфиры жирных кислот, такие как, этиллинолеат и этилолеат, DL-α-токоферол, сложные эфиры пропиленгликоля и жирной кислоты, такие как, без ограничения перечисленным, моно- или дилаураты пропиленгликоля, сложные эфиры сорбитана и жирной кислоты, такие как, без ограничения перечисленным, монолаурат сорбитана, моноолеат сорбитана, монопальмитат сорбитана, моностеарат сорбитана и триолеат сорбитана, сложные эфиры полиглицерина и жирной кислоты, которые образуются из различных простых эфиров глицерина и жирных кислот. Примеры полиглицеринов, используемых для этерификации, включают диглицерин, тетраглицерин, гексаглицерин, декаглицерин и т.п. Примеры жирных кислот, взаимодействующих с полиглицеринами, включают олеиновую, линолевую, стеариновую кислоты и т.п. Примеры сложных эфиров полиглицерина и жирной кислоты включают PLUROL OLEIQUE СС 497 (полиглицерилолеат, Gattefbsse Co.), PLUROL STEARIQUE (полиглицерилпальмитостеарат, Gattefosse Co.), DGMO-C (диглицерилмоноолеат, Nikkol Co.), TETRAGLYN 1-0 (тетраглицерилмоноолеат, Nikkol Co.), HEXAGLYN 1-0 (гексаглицерилмоноолеат, Nikkol Co.), HEXAGLYN 5-0 (гексаглицерилпентаолеат, Nikkol Co.), DECAGLYN 5-0 (декаглицерилпентаолеат, Nikkol Co.), DECAGLYN 10-0 (декаглицерилдекаолеат, Nikkol Co.) и т.п. В некоторых вариантах липофильный растворитель означает олеиновую кислоту.
Эмульгаторы, пригодные для использования в составах по настоящему изобретению, включают, без ограничения перечисленным, сложные эфиры Сахаров и жирных кислот, сложные эфиры полиоксиэтиленсорбитана и жирных кислот, такие как, без ограничения перечисленным, полисорбат 20, полисорбат 40, полисорбат 60 и полисорбат 80, моно- и диэфиры жирных кислот и полиоксиэтилена, включая, без ограничения перечисленным, полиоксил(40)стеарат и полиоксил(40)олеат, смесь моно- и диэфиров полиоксиэтилена и жирных C8-C22 кислот, моно-, ди- и триэфиров глицерина и жирных C8-C22 кислот с торговыми названиями LABRASOL®, GELUCIRE® 44/14, GELUCIRE® 50/13, LABRAFIL® M 1944 CS и LABRAFIL® M2125 CS, соединения касторового масла и полиоксиэтилена, такие как, без ограничения перечисленным, полиоксил(35)касторовое масло, гидрированное полиоксил(40)касторовое масло и гидрированное полиоксил(60)касторовое масло с торговыми названиями CREMOPHOR® ELP, CREMOPHOR® RH 40 и CREMOPHOR® RH 60 соответственно, простой алкиловый эфир полиоксиэтилена, включая, без ограничения перечисленным, поликсил(20)цетостеариловый эфир и полиоксил(10)олеиловый эфир, полиэтиленгликольсукцинат DL-α-токоферола с торговым названием VITAMIN Е TPGS®, моно-, ди- и триэфиры глицерина, моно-, ди- и триэфиры сахарозы, диоктилсульфосукцинат натрия, лаурилсульфат натрия или смесь любых двух или более указанных соединений.
В некоторых вариантах гидрофильный растворитель содержится в количестве до приблизительно 90 мас.% в расчете на общую массу состава. В других вариантах эмульгатор содержится в количестве от приблизительно 5 мас.% до приблизительно 50 мас.% в расчете на общую массу состава. В еще одном варианте липофильный растворитель содержится в количестве до приблизительно 50 мас.% в расчете на общую массу состава. В некоторых вариантах ПЭГ содержится в количестве до приблизительно 90 мас.% в расчете на общую массу состава.
В других вариантах твердые составы, кроме того, содержат полимерный носитель. Полимерные носители по настоящему изобретению означают пригодные для использования в качестве среды для доставки лекарственного средства полимеры. Таким образом, например, полимерным носителем является адсорбент-носитель, дезинтегрирующий агент, связующий агент или разбавитель, которые ускоряют доставку лекарственного средства в организм субъекта. Пригодные для использования в составах по настоящему изобретению полимерные носители включают, без ограничения перечисленным, фталат-ацетат целлюлозы, натриевую соль кроскармелозы, кросповидон, циклодекстрины, β-циклодекстрины, гидроксипропил-β-циклодекстрины, γ-циклодекстрины, полианионные β-циклодекстрины, сульфобутиловый эфир 7-β-циклодекстрина, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, фталат гидроксипропилметилцеллюлозы, метилцеллюлозу, микрокристаллическую целлюлозу, сополимеры метакриловой кислоты, полиметакрилаты, сополимер метакриловой кислоты и метилметакрилата, сополимер метакриловой кислоты и этилакрилата, сополимер аммонийметакрилата, сополимер этилакрилата, метилметакрилата и хлорида триметиламмонийэтилметакрилата, сополимер этилакрилата и метилметакрилата, поливиниловый спирт, характеризующиеся средней молекулярной массой от приблизительно 20000 до приблизительно 200000 г/моль, поливинилпирролидин/винилацетат, повидон, характеризующиеся средней молекулярной массой от приблизительно 2500 до приблизительно 300000 г/моль, натриевая соль гликолята крахмала, крахмал, желатинизированный крахмал или смесь двух или более указанных соединений.
В других вариантах твердые составы, кроме того, содержат фосфолипидный носитель, такой как, без ограничения перечисленным, дифосфатидилглицерин, гликолипид, фосфатидную кислоту, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилглицерин, фосфатидилинозит, фосфатидилсерин, сфингомиелин или смесь любых двух или более указанных соединений.
В некоторых вариантах твердые составы, кроме того, включают адсорбент-носитель. Пригодные для использования в составах по настоящему изобретению адсорбенты-носители включают, без ограничения перечисленным, магний алюмосиликат, силикат алюминия, бентонит, карбонат кальция, дикальцийфосфат, лактозу, маннит, микрокристаллическую целлюлозу, диоксид кремния, натриевую соль гликолята крахмала, сорбит, крахмал, сахарозу, тальк или смесь любых двух или более указанных соединений.
Кроме перечисленных выше ингредиентов и материалов, твердые составы по настоящему изобретению могут содержать дополнительные ингредиенты. Такие дополнительные ингредиенты выбирают из группы, включающей, без ограничения перечисленным, сшитый повидон, натриевую соль сшитой карбоксиметицеллюлозы, сшитый полимер β-циклодекстрина, сшитый декстран, кроскармеллозу, сшитый карбомер, сукцинат-ацетат гидроксипропилметилцеллюлозы, поливинилпирролидон, акриловые смолы, выбранные из группы, включающей гомополимеры акриловой кислоты, производные гомополимеров акриловой кислоты, сополимеры акриловой кислоты и производных акриловой кислоты или смесь любых двух или более указанных соединений. В данном контексте производные акриловой кислоты означают соединения, содержащие акрилатные связи, способные полимеризоваться, включающие, без ограничения перечисленным, метакриловую кислоту, метилметакрилат, бутилметакрилат, диметиламиноэтилметакрилат, хлорид триметиламмонийэтилметакрилата, этилакрилат и т.п. или смесь любых двух или более указанных соединений.
Твердые составы по настоящему изобретению могут, кроме того, включать фармацевтически приемлемые добавки, такие как антиоксиданты, красители, ароматизаторы, консерванты, подсластители или смесь двух или более указанных соединений. Пригодные для использования в настоящем изобретении антиоксиданты включают, без ограничения перечисленным, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, этилендиаминтетрауксусную кислоту, соли этилендиаминтетрауксусной кислоты, пропилгаллат, метабисульфит натрия, витамин Е, эфиры витамина Е или смесь двух или более указанных соединений. Пригодные для использования в настоящем изобретении консерванты включают, без ограничения перечисленным, бутилпарабен, сорбат кальция, этилпарабен, метилпарабен, монотиоглицерин, сорбат калия, пропилпарабен, бензоат натрия, сорбат натрия, сорбиновую кислоту или смесь двух или более указанных соединений. Пригодные для использования в составах по настоящему изобретению подсластители включают, без ограничения перечисленным, аспартам, соли глициррезина, глицирризинат моноаммония, сахарин, кальциевую соль сахарина, натриевую соль сахарина, сахар, сукралозу или смесь любых двух или более указанных соединений. Пригодные для использования в составах по настоящему изобретению ароматизаторы включают, без ограничения перечисленным, лимонную кислоту, ментол, масло перечной мяты, цитрат натрия, ванилин, этилванилин или смесь любых двух или более указанных соединений. Пригодные красители включают, без ограничения перечисленным, FD&C голубой #1, FD&C голубой #2, FD&C зеленый #3, FD&C красный #3, FD&C красный #4, FD&C желтый #5, FD&C желтый #6, D&C голубой #4, D&C зеленый #5, D&C зеленый #6, D&C оранжевый #4, D&C оранжевый #5, оксиды железа или смесь любых двух или более указанных соединений.
Количество фармацевтически активного ингредиента в твердом составе по настоящему изобретению изменяется в зависимости от назначения, специалист в данной области может определить пригодное количество для каждого конкретного случая с учетом данного описания. В некоторых вариантах в твердых составах по настоящему изобретению содержится соединение формулы I, его фармацевтически приемлемая соль или смесь любых двух или более указанных соединений в количестве от приблизительно 0,1 мас.% до приблизительно 40 мас.% в расчете на общую массу состава. В некоторых вариантах соединение формулы I, его фармацевтически приемлемая соль или смесь любых двух или более указанных соединений содержится в количестве от приблизительно 0,2 мас.% до приблизительно 20 мас.% в расчете на общую массу состава. В других вариантах соединение формулы I, его фармацевтически приемлемая соль или два или более указанных соединения содержатся в количестве от приблизительно 0,5 мас.% до приблизительно 10 мас.% в расчете на общую массу состава.
В других вариантах составы по настоящему изобретению представляют собой твердые растворы или дисперсии. В некоторых вариантах составы содержатся в капсуле или таблетке. В других вариантах капсула представляет собой капсулу с твердой оболочкой, твердую желатиновую капсулу, мягкую желатиновую капсулу, капсулу из природного пуллана или капсулу с оболочкой из гидроксипропилметилцеллюлозы. В некоторых вариантах общая масса соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более указанных соединений в капсуле или таблетке составляет от приблизительно 1 мг до приблизительно 400 мг. В некоторых вариантах капсула или таблетка покрыта полимером или желатином или покрыта желатиновой оболочкой. Капсула представляет собой капсулу с твердой оболочкой и, кроме того, может состоять из корпуса и верхней части, которые герметично запаяны, Капсулы или таблетки иногда покрыты желатиновой оболочкой, которая, в свою очередь, необязательно включает фармацевтически приемлемый краситель, подсластитель, замутнитель или смесь любых двух или более указанных соединений. Необязательно капсулы или таблетки покрыты подсластителем, полимером целлюлозы, полиметакрилатом, поливинилацетат-фталатом, желатином или смесью двух или более указанных соединений. В некоторых вариантах, если для покрытия капсулы или таблетки используют полимеры целлюлозы, указанные полимеры выбирают из группы, включающей метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксиэтилметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, этилцеллюлозу, фталат-ацетат целлюлозы или смесь двух или более указанных соединений. Если для покрытия капсул или таблеток используют полиметакрилаты, указанные полимеры выбирают из группы, включающей сополимеры метакриловой кислоты, сополимеры метакриловой кислоты и метилметакрилата, сополимеры метакриловой кислоты и этилакрилата, сополимеры аммонийметакрилата, сополимеры этилакрилата и хлорида триметиламиноэтилметакрилата, сополимеры этилакрилата и метилметакрилата или смесь двух или более указанных соединений.
Способы
В другом объекте предлагаются способы получения составов по настоящему изобретению. Таким образом, в некоторых вариантах способы заключаются в том, что включают смешивание соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более указанных соединений с ингредиентом, выбранным из группы, включающей гидрофильный растворитель, липофильный растворитель, эмульгатор или смесь двух или более указанных соединений, при этом получают состав. В других вариантах соединение формулы I, его фармацевтически приемлемую соль или смесь любых двух или более указанных соединений, кроме того, смешивают с антиоксидантом, красителем, ароматизатором, консервантом, подсластителем или смесью любых двух или более указанных соединений. Пригодные гидрофильные, липофильные растворители, эмульгаторы, антиоксиданты, консерванты, подсластители, ароматизаторы и красители перечислены выше. В некоторых вариантах гидрофильный растворитель содержится в количестве до приблизительно 90 мас.% в расчете на общую массу состава. В других вариантах липофильный растворитель содержится в количестве до приблизительно 50 мас.% в расчете на общую массу состава. В некоторых вариантах эмульгатор содержится в количестве от приблизительно 10 мас.% до приблизительно 50 мас.% в расчете на общую массу состава. В других вариантах антиоксидант содержится в количестве приблизительно 1 мас.% в расчете на общую массу состава. В других вариантах подсластитель содержится в количестве до приблизительно 2 мас.% в расчете на общую массу. В других вариантах ароматизатор содержится в количестве до приблизительно 2 мас.% в расчете на общую массу.
В некоторых вариантах предлагается способ получения жидких составов, описанных выше. В некоторых таких вариантах гидрофильный растворитель включает ПЭГ или смесь любых двух или более указанных соединений и составляет до приблизительно 90 мас.% в расчете на обую массу состава. В других вариантах гидрофильный растворитель включает этанол и содержится в количестве до приблизительно 15 мас.% в расчете на общую массу состава. В некоторых вариантах предлагается получение по крайней мере одной капсулы, содержащей состав. В таких капсулах общая масса соединения формулы I, его фармацевтически приемлемой соли или смеси двух или более указанных соединений составляет от приблизительно 1 мг до приблизительно 400 мг. В некоторых указанных способах получения капсул указанная капсула представляет собой, без ограничения перечисленным, описанные выше капсулы. В других вариантах капсула может состоять из корпуса и верхней части, которые герметично запаяны.
Запаивание капсул осуществляют с использованием известных в данной области техники способов. В некоторых вариантах способ запаивания включает распыление смеси спирта и воды на внутренний край основного корпуса капсулы, при этом образуется адгезивный гель, затем на основной корпус помещают верхнюю часть капсулы и получают капсулу, которую выдерживают при повышенной температуре от приблизительно 35°С до приблизительно 55°С, при этом адгезивный гель отверждается. В других вариантах капсулы запаивают пленкой.
В некоторых вариантах предлагаются способы получения твердых составов, описанных выше. В других вариантах соединение формулы I, его фармацевтически приемлемую соль или смесь двух или более указанных соединений смешивают со вспомогательным веществом. В некоторых вариантах указанное вспомогательное вещество выбирают из группы, включающей метанол, этанол или их смесь. В других вариантах вспомогательное вещество удаляют сушкой с распылением и/или нанесением состава для покрытия в виде спрея на фармацевтически приемлемый носитель с образованием твердой дисперсии и/или размалыванием твердой дисперсии с образованием гранул. В некоторых вариантах гранулы, полученные указанным способом, характеризуются размером менее 250 мкм. В других вариантах гранулы просеивают (т.е. пропускают через сито), чтобы обеспечить однородное распределение по размеру для наполнения гранулами капсул. В тех вариантах, когда вместо капсул получают таблетки, гранулы смешивают с носителем, антиоксидантом, красителем или замутнителем и/или смесью любых двух или более указанных соединений, при этом получают вторичную смесь, которую затем прессуют в таблетки.
В некоторых вариантах способы заключаются в смешивании соединения формулы I, его фармацевтически приемлемой соли или смеси двух или более указанных соединений с ингредиентом, выбранным из группы, включающей гидрофильный растворитель, липофильный растворитель, эмульгатор или смесь любых двух или более указанных соединений, при этом получают состав, расплавляют его и получают расплавленный состав. Затем в одном варианте расплав помещают в капсулы. Пригодные капсулы состоят из одной или двух частей. В другом варианте расплав состава сферонизируют, при этом получают сферонизированный состав, которым заполняют капсулы или который прессуют в таблетки. Термин «сферонизировать», использованный в данном контексте, означает изменение формулы гранул с приданием им сферической формы. Специалистам в данной области известно множество способов получения гранул сферической формы, включая механические способы. В еще одном варианте из расплава состава формируют таблетки. В другом варианте расплав охлаждают и полученный охлажденный состав размалывают, просеивают, смешивают с эксципиентом и/или прессуют в таблетки. В некоторых вариантах расплав в виде спрея сушат или замораживают. Таблетки, которые получают указанными способами, в некоторых вариантах получают при использовании каландра с парой вращающихся в противоположном направлении охлажденных формующих валков. Таким образом, способы получения твердых составов включают, без ограничения перечисленным, способы переработки горячего расплава, описанные выше и ниже в разделе Примеры, и способы растворения/упаривания, описанные выше и ниже в разделе Примеры.
Упаковка
Упаковка фармацевтических составов известна в фармацевтической промышленности и является пригодной для составов по настоящему изобретению. Фармацевтические упаковки и/или контейнеры для составов по настоящему изобретению включают емкость для хранения одной или более капсул, таблеток, пакетиков или лепешек, содержащих состав по настоящему изобретению. Указанные варианты емкостей для хранения включают емкости, изготовленные из любого фармацевтически пригодного полимера, стекла и металла, включая, например, полиэтилен высокой плотности. Фармацевтически пригодные упаковки включают блистеры, содержащие по крайней мере одну капсулу, таблетку, пакетик или лепешку, содержащие состав(вы) по настоящему изобретению. Кроме того, указанные емкости для хранения могут включать хлопковые или вискозные вкладыши и/или термореактивный уплотняющий материал. Пригодные способы упаковки известны специалистам в данной области и не ограничиваются перечисленным.
Способы лечения
В другом объекте предлагаются способы лечения рака, подавления ангиогенеза и/или ингибирования киназы RAF в организме у субъекта. В некоторых вариантах способы включают введение субъекту, нуждающемуся в лечении рака, состава по настоящему изобретению. В других вариантах способ включает введение субъекту, нуждающемуся в подавлении ангиогенеза, состава по настоящему изобретению. В некоторых вариантах способы включают введение субъекту, нуждающемуся в ингибировании киназы RAF, соединения по настоящему изобретению. Соединения обычно вводят в количестве, достаточном для обеспечения значения Cmax от приблизительно 0,1 до приблизительно 10 мгк/мл и/или значения AUC0→∞ от приблизительно 0,01 до приблизительно 10 мг×мин/мл соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более указанных соединений, в плазме субъекта. В таблицах 2 и 6 ниже приведены экспериментальные данные для нескольких различных составов API, полученные в плазме собак натощак, после введения в указанных дозах. Однако, указанные в контрольных исследованиях дозы API при введении субъекту можно изменять от приблизительно 1,0 до приблизительно 50 мг на кг массы тела субъекта.
Предлагаются также курсы лечения и способы лечения субъекта соединением формулы I, его фармацевтически приемлемой солью или смесью любых двух или более указанных соединений. В некоторых вариантах способы лечения рака и/или подавления ангиогенеза у субъекта включают введение состава, содержащего соединение формулы I, его фармацевтически приемлемую соль или смесь любых двух или более указанных соединений, один, два, три, четыре или более раз в сутки. В других вариантах введение указанных составов включает курсы лечения с введением составов один раз в сутки в течение 7, 14, 21 или 28 сут, с последующим перерывом во введении состава в течение 7 или 14 сут. В некоторых вариантах курс лечения включает введение состава один раз в сутки в течение 7 сут с последующим перерывом в течение 7 сут. В других вариантах курс лечения повторяют один или более раз.
Как указано выше, соединение формулы I, его фармацевтически приемлемую соль или смесь любых двух или более указанных соединений можно использовать для лечения различных видов рака у субъекта. В некоторых вариантах рак выбирают из группы, включающей, без ограничения перечисленным, рак мочевого пузыря, молочной железы, мозга, карциному, хронический лимфоидный лейкоз, хронический миелоидный лейкоз, колоректальный рак, рак желудка, стромальный рак желудочно-кишечного тракта, глиому, лимфому, меланому, множественную миелому, миело-пролиферативное заболевание, нейроэндокринное заболевание, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак поджелудочной железы, предстательной железы, почечноклеточный рак, мелкоклеточный острый миелогенный лейкоз, саркому и/или рак щитовидной железы.
В любом составе, способе или упаковке по настоящему изобретению, в случае, если описаны капсулы, подразумеваются также таблетки, а в случае, если описаны таблетки, подразумеваются капсулы. Если описаны таблетки и/или капсулы, подразумеваются также пакетики и/или лепешки.
Специалисту представляется очевидным, что все интервалы, описанные в данном контексте, также обязательно включают поддозы для всех вариантов и все такие поддозы также включены в объем настоящего изобретения. Любой указанный интервал доз можно разделить по крайней мере на равные половины, трети, четверти, пятые, десятые части и т.п. В качестве примера без ограничения перечисленным, каждый интервал, указанный в данном контексте, можно разделить на первую треть, вторую треть и третью треть и т.п.
Все публикации, заявки на выдачу патентов, патенты и другие документы, цитированные в данном контексте, включены в данное описание в качестве ссылок, а также каждая публикация, заявка на выдачу патента, патент или другой документ, цитированные отдельно, включены в данный контекст в качестве ссылок. Определения, использованные в ссылках исключены, если они противоречат определениям, приведенным в настоящем описании.
Варианты осуществления настоящего изобретения, описанные в общем виде, иллюстрируются в примерах, которые не ограничивают объем настоящего изобретения.
Примеры
Номенклатура соединений приведена в соответствии с программным обеспечением ACD Name версии 5,07 (14 ноября, 2001), разработанной Advanced Chemistry Development, Inc., Chemlnnovation NamExpert+программное обеспечение Nomenclator™, разработанное Chemlnnovation Software, Inc. и программное обеспечение AutoNom версии 2,2, разработанное ChemOffice® Ultra версии 7,0 CambridgeSoft Corporation (Cambridge, MA). Некоторые соединения и исходные материалы названы с использованием стандартной номенклатуры IUPAC.
Различные исходные материалы использовали в виде коммерческих препаратов или их получали по известным методикам.
Пример 1
Получение {1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензимидазол-2-ил}(4-трифторметилфенил)амина (формула I)
Стадия 1
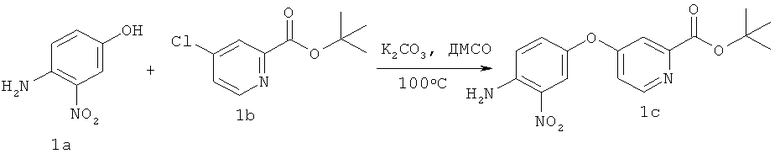
В трехгорлую колбу объемом 500 мл, снабженную магнитной мешалкой, помещали К2СО3 (4,15 г, 30 ммолей). Сосуд закрывали, вакуумировали и сушили над пламенем. Прибор охлаждали до КТ и продували аргоном. В реакционный сосуд добавляли 4-амино-3-нитрофенол 1а (3,08 г, 20 ммолей), трет-бутиловый эфир 4-хлорпиридин-2-карбоновой кислоты 1b (5,2 г, 24 ммоля) и сухой ДМСО (30 мл). Полученную смесь интенсивно перемешивали и нагревали при 100°С в течение -14 ч. Реакционную смесь выливали в охлажденный льдом фосфатный буферный раствор (рН=7) и колбу тщательно промывали МТВЕ и водой. Объединенную двухфазную смесь фильтровали через целит (толщина >2 см). Слои разделяли и отделенную водную фазу экстрагировали МТВЕ (3×100 мл). Объединенные органические слои промывали водой (5×100 мл), сушили (MgSO4) и растворитель упаривали. Неочищенный остаток наносили на SiO2 и очищали экспресс-хроматографией (элюент: гексан/EtOAc 4:1, 2:1, 1:1), при этом получали 4,92 г (14,9 ммоля, выход 74%) продукта 1 с в виде твердого вещества желто-коричневого цвета. 1H ЯМР (300 МГц, CDCl3): δ (част./млн.) 8,58 (d, J 5,8 Гц, 1Н), 7,90 (d, J 2,8 Гц, 1Н), 7,56 (d, J 2,5 Гц, 1Н), 7,17 (dd, J 2,8, 8,8 Гц, 1Н), 6,94 (dd, J 2,8, 5,8 Гц, 1Н), 6,91 (d, J 9,1 Гц, 1Н), 6,15 (ушир s, 2H), 1,62 (s. 9H), 13С ЯМР (75 МГц, CDCl3): δ 165,8, 164,0, 151,8, 151,5, 143,4, 143,2, 131,5, 129,8, 121,0, 118,0, 114,2, 113,1, 83,0, 28,4, Тпл 163-166°С.
Стадия 2
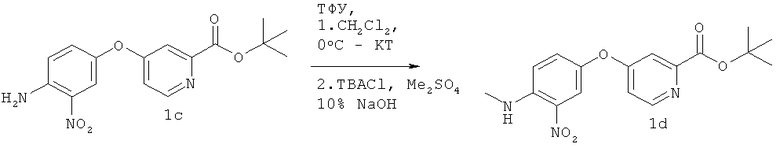
В раствор соединения 1 с (5,62 г, 17 ммолей) в CH2Cl2 (85 мл) при 0°С добавляли ТФУ (2,4 мл, 3,6 г, 17 ммолей). Охлаждающую баню удаляли и реакцию проводили при КТ в течение 2 ч. Реакционную смесь охлаждали до 0°С и добавляли ТВАС1 (2,5 г, 8,5 ммоля), Me2SO4 (3,2 мл, 4,3 г, 34 ммоля) и 10% NaOH (34 мл). Полученную смесь интенсивно перемешивали в течение 4 ч при КТ, разбавляли водой и полученные слои разделяли. Водную фазу экстрагировали CH2Cl2 (3×100 мл) и объединенные органические слои промывали солевым раствором (2×100 мл), сушили (MgSO4) и упаривали. Неочищенный продукт наносили на силикагель и очищали экспресс-хроматографией (элюент: гексан/EtOAc 4:1, 2:1, 1:1, 1:2), при этом получали 4,5 г (13,0 ммоля, выход 76%) соединения Id в виде твердого вещества желто-оранжевого цвета. 1Н ЯМР (300 МГц, CDCl3): δ (част./млн.) 8,54 (d, J 5,5 Гц, 1Н), 8,04 (ушир. d, J 4,7 Гц, 1H), 7,93 (d, J 2,8 Гц, 1H), 7.53 (d, J 2,5 Гц, 1Н), 7,25 (app.dd, J 2,8, 9,1 Гц, 1H), 6,91 (m, 2H), 3,04 (d, J 4,9 Гц, 3Н), 1,59 (s, 9H), 13С ЯМР (75 МГц, CDCl3): δ (част./млн.) 165,9, 164,1, 151,5, 144,7, 142,1, 130,4, 118,8, 115,5, 114,1, 112,9, 82,9, 30,4, 28,5, Тпл 187-189°С.
Стадия 3
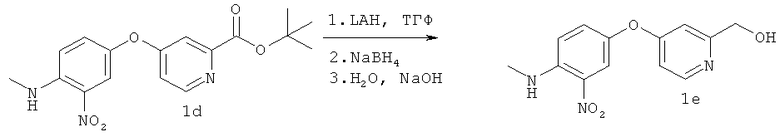
Трехгорлую круглодонную колбу объемом 500 мл, высушенную над пламенем, продували N; и в колбу помещали LAH (3,0 г, 75 ммолей) и сухой ТГФ (240 мл). Полученную суспензию охлаждали до 0°С и медленно добавляли соединение Id (20,7 г, 60 ммолей), при этом в реакционной смеси поддерживали температуру менее 5°С. Реакционную смесь перемешивали при 0°С в течение 2 ч, а затем перемешивали при КТ в течение ночи. В смесь добавляли NaBH4 (2,27 г, 60 ммолей) и смесь перемешивали при КТ в течение еще 1 ч. После завершения реакции в смесь последовательно добавляли по каплям воду (3 мл), 15% NaOH (3 мл) и воду (9 мл). Полученную смесь фильтровали через целит и полученное твердое вещество промывали EtOAc и МеОН. Объединенные органические слои упаривали, полученный неочищенный остаток наносили на SiO2 и очищали экспресс-хроматографией (элюент: CH2Cl2/MeOH, 97:3), при этом получали 7,63 г (27,7 ммоля, выход 46%) продукта 1е в виде твердого вещества красно-оранжевого цвета. 1H ЯМР (300 МГц, CDCl3): δ (част./млн.) 8,40 (d, J 5,5 Гц, 1H), 8,05 (ушир. s, 1H), 7,96 (d, J 2,75 Гц, 1H), 7,29 (d, J 2,75 Гц, 1H), 6,92 (d, J 9,35 Гц, 1H), 6,75 (m, 2H), 4,68 (s, 2H), 3,07 (d, J 5,23 Гц, 3Н).
Стадия 4
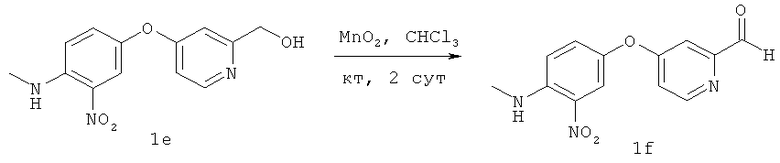
В круглодонную колбу объемом 100 мл помещали продукт 1е (1,38 г, 5,0 ммоля), MnO2 (6,52 г, 75 ммолей) и CHCl3 (20 мл). Полученную суспензию перемешивали при КТ в течение 2 сут. Реакционную смесь фильтровали через целит и полученный твердый остаток последовательно промывали CHCl3 и EtOH. Объединенные органические слои упаривали, наносили на силикагель и очищали экспресс-хроматографией (элюент; CH2Cl2/MeOH, 98:2), при этом получали 790 мг (2,89 ммоля, выход 58%) твердого вещества 1f оранжевого цвета. 1Н ЯМР (300 МГц, CDCl3): δ (част./млн.) 10,01 (s, 1H), 8,64 (d, J 5,5 Гц, 1Н), 8,09 (ушир. s, 1H), 7,96 (d, J 2,5 Гц, 1H), 7,37 (d, J 2,48 Гц, 1H), 7,29 (d, J 2,75 Гц, 1H), 7,08 (dd, J 2,47, 5,5 Гц, 1H), 6.94 (d, J 9,35 Гц, 1H), 3,08 (d, J 5,23 Гц, 3Н).
Стадия 5
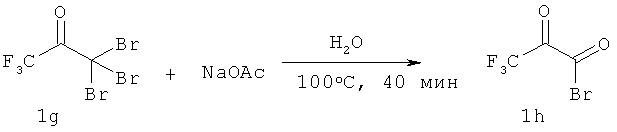
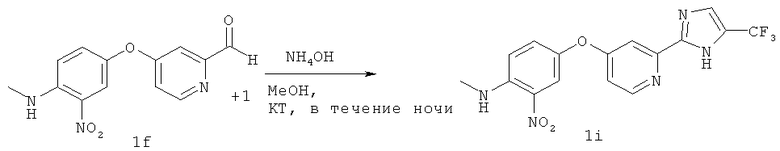
В раствор ацетата натрия (NaOAc) (22,4 г, 273 ммоля) в H2O (60 мл) добавляли кетон lg (реагент Ланкастера, 25,75 мл, 136,5 ммоля) и полученный раствор нагревали при 100°С в течение 10 мин. После охлаждения до КТ раствор соединения 1h добавляли в суспензию соединения 1f (25 г, 91 ммоль) в NH4OH (150 мл) и МеОН (450 мл). Полученную смесь перемешивали при КТ в течение ночи. Результаты ТСХ (элюент: CH2Cl2/MeOH, 95:5) свидетельствуют о полном превращении соединения If. Неочищенный продукт концентрировали до образования в водной суспензии и распределяли между насыщенным раствором Na2CO3 и CH2Cl2. Водную фазу экстрагировали три раза CH2Cl2 и объединенные органические фазы промывали солевым раствором, сушили над MgSO4 и концентрировали, при этом получали 31,6 г соединения И (83 ммоля) в виде твердого вещества оранжевого цвета (выход 91%). Полученный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 6
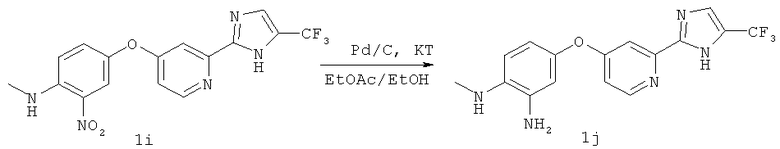
Суспензию соединения 1i (45,76 г, 120 ммолей) в МеОН (220 мл) и EtOAc (200 мл) продували N2 в течение 20 мин и добавляли суспензию 10% Pd/C (12,77 г, 120 ммолей) в МеОН (60 мл). Реакционную смесь продували Н2 и выдерживали в атмосфере Н2 в течение 2 сут. Реакционную смесь фильтровали через слой целита и полученное твердое вещество последовательно промывали МеОН и EtOAc. Объединенные органические фильтраты упаривали, полученное твердое соединение перегоняли в виде азеотропной смеси с CH2Cl2 и сушили в течение ночи в вакууме, при этом получали 40,17 г (115 ммолей) соединения 1j в виде порошка желто-коричневого цвета (выход 96%) ЖХ-МС m/z 336,1 (МН+), tR 1,81 мин.
Стадия 7
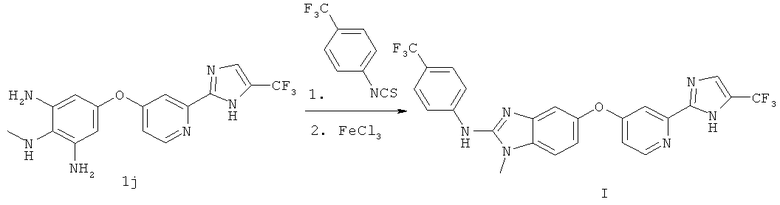
В перемешиваемый раствор соединения 1j (40,17 г, 115 ммолей) в МеОН (460 мл) при КТ добавляли 4-(трифторметил)фенилизотиоцианат (23,37 г, 115 ммолей). Реакционную смесь выдерживали при КТ в течение 16 ч. После завершения реакции добавляли раствор FeCl3 (20,52 г, 126,5 ммоля) в МеОН (50 мл) и реакционную смесь перемешивали при КТ в течение ночи. Неочищенную реакционную смесь переносили в делительную воронку объемом 3 л, содержащую EtOAc (750 мл) и воду (750 мл). Слои разделяли и водную фазу экстрагировали EtOAc (водную фазу сохраняли). Органические слои объединяли, промывали насыщенным водным раствором Na2CO3, водой и солевым раствором, сушили (MgSO4) и концентрировали. Сохраненную водную фазу подщелачивали (рН=10) добавлением насыщенного водного раствора Na2CO3 и полученную суспензию переносили в делительную воронку объемом 3 л, содержащую EtOAc (500 мл). Смесь встряхивали и полученную эмульсию фильтровали через фильтровальную бумагу, слои разделяли и водную фазу экстрагировали EtOAc (2×500 мл). Органические слои объединяли, промывали солевым раствором и сушили (MgSO4), объединяли с предварительно экстрагированным материалом и концентрировали. Объединенный продукт растирали в CH2Cl2 (500 мл), наносили на SiO2 и очищали экспресс-хроматографией. После растирания материала в CH2Cl2 получали соединение формулы I в виде очищенного вещества белого цвета. ЖХ-МС m/z 519,1 (МН+), 1Н ЯМР (300 МГц, CDCl3): δ (част./млн.) 8,44 (d, J 5,5 Гц, 1Н), 7,75 (d, J 8,8 Гц, 2H), 7,61 (dd, J 2,2, 8,5 Гц, 1Н), 7,59 (d, J 8,8 Гц, 2Н), 7,56 (d, J 2,5 Гц, 1Н), 7,38 (app d, J 8,5 Гц, 1Н), 7,23 (d, J 1,9 Гц, 1Н), 6,96 (dd, J 2,2, 8,5 Гц, 1Н), 6.93 (dd, J 2,5, 5,5 Гц, 1Н), 3,76 (s, 3H), ЖХ-МС m/z 519,0, tR 2,57 мин (МН+), элементный анализ, рассч. для C24H16F6N6O: С 55,6, Н 3,11, N 16,21, найд.: С 55,81, Н 3,43, N 16,42, Тпл 217-220°С(разл.).
Пример 2
Растворимость API
{1-Метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензимидазол-2-ил}(4-трифторметилфенил)амин практически нерастворим в воде. Растворимость соединения в воде при различных рН показана в таблице 1.
Исследовали также пригодность различных неводных растворителей для использования в процессе переработки соединения формулы I. На основании полученных результатов были выбраны следующие пригодные растворители для соединения формулы I: ПЭГ 400, олеиновая кислота, полиоксил (35)касторовое масло, полисорбат 20, полисорбат 80, монолаурат сорбитана и моноолеат сорбитана
Пример 3
Составы, на основе растворов API. для перорального введения
Для оценки действия API in vivo использовали модели собак и различные способы переработки активного соединения, чтобы усилить эффективность их воздействия на организм собаки. Указанные способы включали: микронизацию, получение твердых дисперсий, жидких и полутвердых составов, включающих растворы с использованием сорастворителей, растворы, содержащие сорастворители, полимер в качестве замедлителя кристаллизации, мицеллообразующие составы, СЭСДЛ и СМЭСДЛ.
Составы, содержащие микронизированные порошки, получали растворением API (1,0 г) в ацетоне (20 мл) в круглодонной колбе объемом 200 мл. Затем колбу помещали на магнитную мешалку, внутрь помещали перемешивающий стержень и раствор перемешивали при самой высокой скорости. При постоянном перемешивании в колбу добавляли по 5 мл воды каждые 10 с, до общего объема воды 100 мл. Полученную суспензию лекарственного средства перемешивали в течение 20 мин. Затем суспензию фильтровали в вакууме на воронке со стеклянным фильтром (средний размер пор). Твердый материал сушили в течение ночи при 40°С в вакууме (30 мм рт.ст.). Твердый материал помещали в ступку и растирали в порошок пестиком. Образцы порошка исследовали под микроскопом в поляризованном свете для подтверждения кристаллической структуры и определения размеров частиц. Когда средний размер частиц составлял 3-5 мкм, капсулу ТЖК заполняли 50 мг порошка.
Составы, содержащие твердые дисперсии, получали при смешивании и растворении API и повидона (молекулярная масса 40 кДа) в соотношениях 1:9 и 1:19 в метаноле в стеклянных флаконах объемом 20 мл с завинчивающейся крышкой. Для полного растворения 1,5 г смеси лекарственное средство/повидон, 1:19 требуется приблизительно 2 мл МеОН. Для полного растворения 0,5 г смеси лекарственное средство/повидон, 1:9 требуется приблизительно 1 мл МеОН. Полученные вязкие растворы помещали на магнитную мешалку. При перемешивании вязкие растворы частично упаривали в потоке азота. Очень вязкие растворы затем помещали в вакуум-сушильный шкаф при 40°С и шкаф вакуумировали до появления первых признаков кипения. Флаконы выдерживали в вакуум-сушильном шкафу в течение ночи до полного упаривания растворителя. Полученную во флаконах сухую массу измельчали шпателем. Капсулу ТЖК заполняли 0,5 г смеси 1:9 и 1,0 г смеси 1:19.
Составы, содержащие сорастворитель, получали при растворении 50 мг API в 950 мг растворителя или смеси растворителей при 60°С с одновременным озвучиванием. Капсулу ТЖК заполняли 1 г каждого состава. Кроме того, в растворы API, содержащие сорастворитель в качестве потенциального замедлителя кристаллизации лекарственного средства, добавляли гидрофильные полимеры, ГПМЦ и повидон. Использовали 2 мас.% раствор ГПМЦ (120 сП) в системе сорастворителей 59 мас.% ПЭГ 400 и 39 мас.% пропиленгликоля. ГПМЦ добавляли постепенно, но полного растворения не происходило, образующейся суспензией заполняли капсулы ТЖК. Повидон с массой 10 кДа и 40 кДа растворяли в ПЭГ 400, получали составы, содержащие 10, 20, 30 и 40 мас.% повидона, которыми заполняли капсулы ТЖК. Повидон также добавляли в смеси продукта LABRASOL® и ПЭГ 400 или полисорбата (TWEEN®) и ПЭГ 400.
Мицеллярные составы содержали одно или более ПАВ, растворенных в системе растворителей, которые солюбилизируют API. Все носители получали при взвешивании ингредиентов в указанных процентных соотношениях. API добавляли в количестве 50 мг на 950 мг носителя. Некоторые использованные ПАВ являются твердыми при КТ. Таким образом, в некоторых случаях при необходимости смеси носитель/лекарственное средство нагревали при озвучивании для растворения лекарственного средства в смеси. В некоторых случаях для заполнения капсул ТЖХ составами требовалось нагревание полутвердых составов (до 60°С). Каждую капсулу ТЖК заполняли 1 г состава.
Составы СЭСДЛ и СМЭСДЛ содержали одно или более ПАВ, полярный/гидрофильный компонент(ы) и компоненты масло(а)/липофильное соединение(я) (например, жирные кислоты и/или сложные эфиры жирных кислот). Несмотря на присутствие масла или нескольких масел составы являлись изотропными, т.е. представли собой прозрачные однофазные системы. Носители получали при взвешивании каждого эксципиента в указанных процентных соотношениях. API добавляли в количестве 50 мг на 950 мг носителя. Для полного растворения лекарственного средства смеси лекарственное соединение/носитель озвучивали при нагревании (при температуре до 60°С). Каждую капсулу ТЖК заполняли 1 г соединения.
В таблице 2 приведены значения Cmax (нг/мл) и AUC0→∞ (нг×мин/мл) для различных фармацевтических составов в плазме собак натощак после введения в дозе 5 мг API на кг массы тела.
Несмотря на малый размер частиц микронизированного порошка API (3-5 мкм), полученный материал характеризуется чрезвычайно низкими фармакокинетическими параметрами in vivo. Полученные результаты согласуются с низкой растворимостью и низкой скоростью растворения API в водной среде. Растворимость в воде при рН 7 составляет менее 1 мг/мл. Так как микронизированная твердая лекарственная форма API характеризуется низкой биодоступностью, для повышения биодоступности можно использовать жидкие составы.
Примеры жидких составов водонерастворимых соединений включают составы, содержащие неводные системы сорастворителей (например, ПЭГ 400/ пропиленгликоль, 60:40) или системы, содержащие неводные сорастворители в смеси с гидрофильным полимером (например, ПЭГ 400/пропиленгликоль/ ГПМЦ, 59:39:2). Последний состав, содержащий ГПМЦ, характеризуется низкими фармакокинетическими параметрами по сравнению с составом, не содержащим полимер. Добавление пропиленгликоля в качестве сорастворителя к растворам ПЭГ или мицеллярным составам улучшает свойства составов по сравнению с составами, содержащими 100% ПЭГ 400, в отношении биодоступности и зависимости доза-воздействие.
При исследовании in vivo составов, содержащих СЭСДЛ и СМЭСДЛ, было установлено, что указанные составы характеризуются более высокой эффективностью API в отношении величин Cmax и AUC в моделях собак. В связи с перспективностью полученных результатов in vivo для образцов составов СЭСДЛ и СМЭСДЛ проводили более подробные исследования указанного способа получения составов.
В таблице 3 приведены материалы, использованные для получения пероральных растворов, которые описаны в таблице 4, а также указаны фирмы производители и используемые сокращения. Для получения каждого из составов 1-33, указанных в таблице 4, липофильный компонент и эмульгатор взвешивали в стеклянные флаконы объемом 40 мл и тщательно перемешивали. Затем добавляли антиоксидант, подсластитель и ароматизатор, если указанные соединения присутствуют в составе, и растворяли в смеси эмульгатор/липофильный компонент при использовании озвучивания и перемешивания на мешалке vortex. Указанный состав-плацебо использовали для получения растворов, содержащих API. Смесь 50 мг/г (т.е. 5 мас.%) получали при растворении 1,1 г API в 20,9 г каждого состава-плацебо. Полученную смесь нагревали на водяной бане до приблизительно 45°С при периодическом озвучивании и перемешивании на мешалке vortex, при этом получали прозрачный раствор. Аналогичным образом растворы 5 мг/г (т.е. 0,5 мас.%) получали при растворении 0,1 г API в 19,9 г каждого состава-плацебо. Растворы разливали в прозрачные стеклянные флаконы объемом 20 мл и оценивали физическую и химическую стабильность при 50°С и относительной влажности 75% в течение двух или трех месяцев. Информация о стабильности составов приведена в таблице 5.
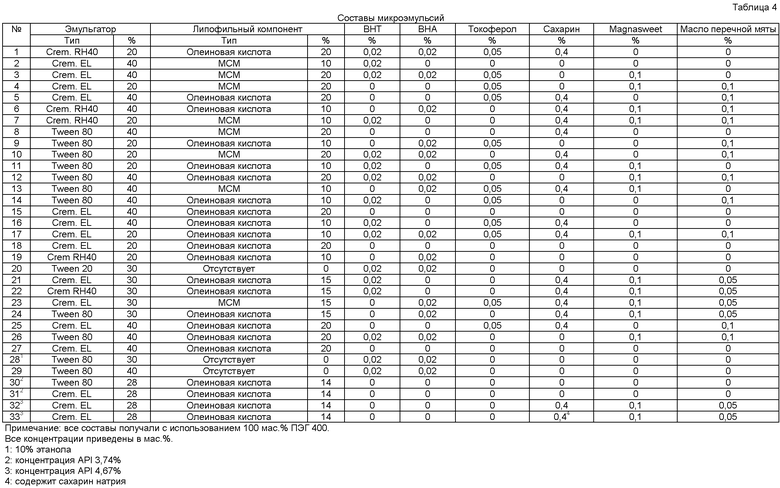
Раствор состава 30 вводили перорально, один раз в сут в дозе API 1, 3, 6 и 10 мг/кг/сут в течение 28 сут самцам и самкам гончих собак. Фармакокинетические параметры в плазме представлены в таблице 6.
Пример 4
Составы, содержащие API, в капсулах с твердой оболочкой
Капсулы с твердой оболочкой (желатин и ГПМЦ), содержащие API, получали заполнением 0,7 мл раствора API в составах 1 и 2 (эквивалент API 28 мг) капсул размера 00 (прозрачные, твердые желатиновые капсулы, состоящие из 2 частей (ТЖК) и капсулы размера 00 (прозрачные, капсулы из ГПМЦ, состоящие из 2-х частей, с использованием системы PROFILL® (TORPAC®, Fairfield, NJ), как описано ниже в методике 1. Содержащие раствор капсулы с твердой оболочкой запечатывали следующим образом: распыляли аэрозоль раствора вода/этанол (1:1) на внутренний край основного корпуса капсулы (увлажнение) при этом образовывался адгезионный гель, затем на основной корпус помещали верхнюю часть капсулы, плотно прижимали и выдерживали при 35-55°С в течение 10-15 мин (нагревание), затем адгезионный гель отверждался, при этом получали запаянную капсулу. При промышленном производстве капсулы, кроме того, можно запаивать пленкой для предотвращения утечки, защиты от вскрытия и/или для идентификации названия и дозы, однако в указанных примерах использовали незапаянные пленкой капсулы. Указанные капсулы, заполненные составом, включающим 28 мг API, использовали для оценки физической и химической стабильности.
Методика 1
А. Растворяли API в выбранном неводном носителе, как указано для составов 1-33 в табл.4 и 34-57 в табл.7.
В. Перемешивали до образования прозрачного раствора
С. Фильтровали и удаляли воздух
D. Смесью заполняли капсулы ТЖК или ГПМЦ размера 00
Е. Капсулы запаивали с помощью водно-спиртового раствора
F. Капсулы упаковывали
Физическую и химическую стабильность составов, содержащих по 28 мг API в капсулах с твердой оболочкой, оценивали в условиях окружающей среды и при 40±2°С и относительной влажности 75±5% (условия ускоренной оценки стабильности). Физическую стабильность капсул, содержащих API, оценивали по изменению внешнего вида и рекристаллизации API в содержимом капсулы. Химическую стабильность оценивали методом анализа исходного API и продуктов его разложения с использованием пригодного метода ЖХВР. Растворимость содержимого капсул оценивали согласно инструкциям USP.
Использовали несколько типов твердых капсул, состоящих из двух частей, включая, без ограничения перечисленным, состоящие из двух частей твердые желатиновые капсулы (ТЖК), капсулы из гидроксипропилметилцеллюлозы (ГПМЦ) и из природного пуллалана (NPCAPS®). Использованные капсулы необязательно содержали замутнители, такие как диоксид титана и красители. Использовали также промышленные машины для заполнения капсул ТЖК, такие как QUALICAPS F-40-LIQFIL SUPER40, QUALICAPS F-80-LIQFIL SUPER80, QUALICAPS F-120-LIQFIL SUPER120, QUALICAPS F-150-LIQFIL SUPER150 и машину для заполнения и запаивания капсул CAPSUGEL CFS 1000. Использовали промышленные машины для запаивания капсул ТЖК, включая QUALICAPS S-40 HICAPSEAL и QUALICAPS S-100 HICAPSEAL.
Составы, представленные в таблице 7, приведены для иллюстрации составов, содержащих API, которые получают при инкапсулировании в капсулы с твердой оболочкой в лабораторных условиях, и указанные составы ни в коей мере не ограничивают объем настоящего изобретения.
тав
Пример 5
Составы, содержащие API, в капсулах с мягкой оболочкой
Составы, содержащие API, получали при растворении API в растворителе-носителе при концентрациях от 50 до 200 мг/г. В каждый состав добавляли деионизированную воду в количестве 4%, 8%, 10%, 12% и 16% в расчете на массу состава (например, 4 мг и 16 мг воды добавляли в 100 мг состава и получали составы с содержанием воды 4% и 16% соответственно) и перемешивали при низкой скорости. Указанные количества воды добавляли в составы для имитации миграции воды из желатиновой оболочки в инкапсулированный состав и наоборот в процессе получения капсулы с мягкой оболочкой в соответствующих равновесных условиях. Физическую стабильность указанных составов оценивали при -20°С, 5°С и КТ. При этом вид растворов исследовали визуально и под микроскопом через определенные интервалы времени и определяли содержание кристаллической формы API. Химическую стабильность составов оценивали в условиях окружающей среды и при температуре 40±2°С и относительной влажности 75±5% (условия ускоренной оценки стабильности).
Жидкие составы, проявляющие стабильность в различных условиях хранения, которую определяли по отсутствию кристаллической формы API, использовали для дальнейших исследований совместимости мягких желатиновых капсул и содержимого. Концентрации, при которых API характеризуется физической стабильностью, для каждого носителя рассчитывали с использованием составов, содержащих до 8% воды, поскольку было установлено, что указанная концентрация соответствует равновесному содержанию воды в инкапсулированном составе.
Мягкие желатиновые капсулы, содержащие API, получали инкапсулированием 0,5 мл раствора составов 31 и 35 в содержащие воздух капсулы, которые затем запаивали расплавленным желатином. Указанные типы капсул, содержащих API, использовали для оценки физической и химической стабильности.
Физическую и химическую стабильность мягких желатиновых капсул, содержащих API, оценивали в условиях окружающей среды и при 40±2°С и относительной влажности 75±5% (условия ускоренной оценки стабильности). Физическую стабильность капсул, содержащих API, определяли по изменениям внешнего вида и по рекристаллизации API в содержимом капсулы. Химическую стабильность оценивали методом анализа исходного API и продуктов его разложения с использованием ЖХВР. Растворимость содержимого капсул определяли согласно инструкции USP.
Мягкие желатиновые капсулы получали при использовании пригодного способа ротационного штампования, при котором расплавленную массу желатина для корпуса капсул подавали из резервуара на два охлаждаемых барабана и получали две ленты для корпуса капсул в полурасплавленном состоянии. Полученные ленты затем накручивали на роллеры и соединяли вместе под сходящимся углом между парой роликовых штампов, в которых расположены соответствующие полости.
Состав для инкапсулирования подавали в клиновидный узел, из которого состав впрыскивали в полости штампа, покрытые желатиновой лентой. Желатиновые ленты непрерывно перемещали между штампами, при этом определенное количество состава попадает в полости штампов. Затем ленты прижимали друг к другу и обрезали вокруг каждого штампа, при этом противоположные концы ленты соединяются и образуют непрерывную желатиновую оболочку вокруг инкапсулируемого состава. Полученные мягкие желатиновые капсулы собирали и сушили в контролируемых условиях. Высушенные мягкие желатиновые капсулы сортировали, осматривали, шлифовали, наносили на них печатный текст и упаковывали.
Для инкапсулирования составов по настоящему изобретению использовали различные известные составы для корпуса капсул. Пригодные составы для корпуса капсул могут включают желатин, пластификатор(ы), воду, замутнители, красители, модификаторы вкуса и удерживающие влагу агенты. Желатин обычно характеризуется прочностью геля по Блуму (т.е. силой в граммах, которая необходима для вдавливания поршня диаметром 12,5 мм на 4 мм в 112 г стандартного 6,667 мас.% желатинового геля при 10°С) в интервале от приблизительно 50 до приблизительно 300, и представляет собой желатин типа А или В или их смесь. Используют известково-костный желатин, кислый костный желатин, бычий, свиной желатин или желатин из рыб или смесь любых двух или более указанных веществ. Пластификатором предпочтительно является глицерин, сорбит, специальный сорбит (смесь сорбита и сорбитана), малтит или смесь любых двух или более указанных веществ.
В качестве замутнителя в желатиновых составах для получения корпуса капсул обычно используют диоксид титана. Модификаторы вкуса включают невосстановленные сахара, такие как ксилит, мальтит или продукт Lycasin RTM. Некоторые примеры пригодных удерживающих влагу агентов включают целлюлозу, соединения целлюлозы, крахмалы, соединения крахмалов, растительные смолы, негигроскопичные моно-, ди- и олигосахариды и диоксид кремния. Для окрашивания капсул используют различные красители типа FD&C и D&С.
Пример 6
Составы, содержащие твердые лекарственные формы API
Описанные выше составы СЭСДЛ и СМЭСДЛ используют для получения капсул меньшего размера, которые легче проглатывать, и в то же время необходимая доза API снижается. Однако размер капсулы, требуемой для инкапсулирования больших объемов составов СЭСДЛ и СМЭСДЛ для доставки больших доз API, может оказаться слишком большим для проглатывания, прежде всего для пациентов младшего и более старшего возраста. Для соответствия требованиям потребителя размер фармацевтических лекарственных форм не должен препятствовать проглатыванию. Прессованные твердые лекарственные формы (т.е. таблетки и/или уплотненные порошки) позволяют получать лекарственные формы меньшего размера, содержащие даже большие дозы. Таким образом, в одном объекте настоящего изобретения предлагается повышение скорости растворения API в желудочно-кишечном тракте и, таким образом, повышение его биодоступности из указанных прессованных твердых лекарственных форм.
Первичные твердые лекарственные составы получают методом горячего расплава или растворения/упаривания.
Способы горячего расплава
Указанный способ включает смешивание компонентов первичного состава в смесителе до образования порошкообразной смеси, которую расплавляли, полученный расплав интенсивно перемешивали и получали гомогенный раствор или дисперсию лекарственного агента. В другом варианте смешивание и плавление порошкообразной смеси проводили в экструдере, предпочтительно в одношнековом или двухшнековом экструдере при температуре от приблизительно 40 до приблизительно 160°С. Затем расплавленной массой непосредственно заполняли капсулы из двух частей или массу предварительно сферонизировали, а затем смесью заполняли капсулы из двух частей. Из расплавленной массы, кроме того, можно получать таблетки требуемой формы с использованием каландера, состоящего из пары вращающихся в противоположные стороны охлажденных формующих валков. В другом варианте расплавленную массу охлаждали и затем обрабатывали при измельчении, просеивании, смешивании с другими эксципиентами и прессовании в таблетки, содержащие лекарственное средство.
Состав 58
Повидон и API растворяли в расплавленном носителе ПЭГ 8000 и поликсил(150)стеарате при 70±10°С при интенсивном перемешивании в смесителе с высоким сдвигом. Полученный раствор переносили в резервуар гранулятора с высоким сдвигом VMA10 (L.B.Bohle, Inc.) при 70±10°С. В другом варианте раствор получали непосредственно в резервуаре VMA10 при 70±10°С. При перемешивании раствора в резервуар медленно добавляли кросповидон. После завершения добавления кросповидона содержимое резервуара интенсивно перемешивали и получали гомогенную дисперсию. Полученную дисперсию медленно охлаждали до КТ при постоянном перемешивании и периодическом включении измельчителя. Полученные гранулы первичного состава отбирали по размерам и просеивали. Просеянные гранулы (334 мг, эквивалент API 50 мг) помещали в твердые, состоящие из двух частей желатиновые капсулы размера 0 с использованием системы PROFILL® (TORPAC®, Fairfield, NJ). В другом варианте просеянные гранулы смешивали с кросповидоном, микрокристаллической целлюлозой и диоксидом кремния в V-образном смесителе. Полученный материал прессовали в таблетки со средней массой 400 мг (эквивалент API 50 мг). Таблетки и капсулы упаковывали во флаконы из ПЭВП или блистерные упаковки.
Первичный состав
Состав таблетки
Состав 59
Состав получали аналогично тому, как описано для состава 58.
Первичный состав
Состав таблетки
Состав 60
API растворяли в расплавленном носителе МПЭГ 5000 (МПЭГ 5000, Dow Chemical Со.) и DL-α-токоферилполиэтиленгликоль(1000)сукцинате (витамин Е TPGS™, Eastman Chemical Со.) при 60±10°С и интенсивном перемешивании в смесителе с высоким сдвигом. Полученный раствор переносили в резервуар гранулятора с высоким сдвигом VMA10 (L.B. Bohle Inc.) при 60±10°С. В другом варианте раствор получали непосредственно в резервуаре гранулятора VMA10 при 60±10°С. При перемешивании раствора в резервуар медленно добавляли косповидон. После завершения добавления кросповидона содержимое резервуара интенсивно перемешивали и получали гомогенную дисперсию. Дисперсию медленно охлаждали до КТ при постоянном перемешивании и периодическом включении измельчителя. Полученные гранулы первичного состава, представляющего собой твердую дисперсию, отбирали по размерам и просеивали. Просеянные гранулы смешивали с кросповидоном и тальком в V-образном смесителе. Материал прессовали в таблетки средней массы 600 мг (эквивалент 50 мг API). Таблетки упаковывали во флаконы из ПЭВП или блистерные упаковки.
Первичный состав
Состав таблетки
Состав 61
API растворяли в расплавленном носителе ПЭГ 1000 и GELUCIRE® 44/14 при 70±10°С при интенсивном перемешивании с помощью лопастной мешалки. Полученный раствор охлаждали до 50±10°С и аликвотную часть (250 мг) горячего расплавленного раствора вручную заливали в твердые желатиновые капсулы размера 2 (ТЖК) с помощью пипетки вытеснительного типа. Полученные капсулы с твердой оболочкой запаивали следующим методом:
распыляли спрей раствора вода/этанол (1:1) на внутренний край верхней части корпуса капсулы (увлажнение) для образования адгезионного геля, затем на основной корпус капсулы помещали верхнюю часть и плотно прижимали друг к другу, полученную капсулу выдерживали при 35-55°С в течение 10-15 мин (при нагревании), при этом адгезионный гель отверждается и запаивает капсулу. Таким образом, каждая капсула содержала 50 мг API и 200 мг носителя. Капсулы упаковывали во флаконы из ПЭВП.
Первичный состав
Состав таблетки
Твердые растворы и дисперсии, полученные методом растворения/упаривания
Способы
При использовании способов растворения/упаривания компоненты первичного состава смешивали и растворяли в стандартном растворителе. Растворитель удаляли из смеси в пригодной лотковой сушилке в вакууме или в распылительной сушилке. Полученную твердую массу измельчали, просеивали и смесью заполняли твердые капсулы из двух частей. В другом варианте составы затем обрабатывали при измельчении, просеивании и/или смешивании с другими эксципиентами и прессовании в таблетки, содержащие лекарственное средство.
Состав 62
Повидон и API растворяли в специальной среде, такой как МеОН (2 мл МеОН на каждые 100 мг API) при 70±10°С в круглодонной колбе при перемешивании, и получали прозрачный раствор. Затем при интенсивном перемешивании добавляли ПЭГ 8000. Колбу с раствором присоединяли к роторному испарителю и МеОН удаляли в вакууме при 70±10°С. После удаления МеОН из смеси колбу помещали в баню с холодной водой и смесь упаривали в вакууме в течение еще 2 ч. Полученное твердое вещество переносили из колбы в лоток и сушили в вакууме при КТ в течение еще 6 ч для удаления остатков МеОН. Дисперсию измельчали и отбирали гранулы, размером 250 мкм и менее при просеивании, которые использовали для дальнейшего исследования.
Просеянными гранулами (400 мг, эквивалент 100 мг API) заполняли твердые желатиновые капсулы размера 0, состоящие из двух частей. В другом варианте просеянные гранулы смешивали с кросповидоном, микрокристаллической целлюлозой (МКЦ) и диоксидом кремния в минисмесителе. Полученный материал прессовали в таблетки средней массы 550 мг (эквивалент 100 мг API). Таблетки и капсулы упаковывали во флаконы из ПЭВП или блистерные упаковки.
Первичный состав
Состав таблетки
Смешивание, экструзию, отбор по размерам, инкапсулирование, запаивание, заполнение, прессование и другие стадии получения фармацевтических составов проводили на любом пригодном оборудовании. Различные типы твердых состоящих из двух частей капсул включают, без ограничения перечисленным, капсулы ТЖК, из ГПМЦ и из природного пуллулана. Все корпуса капсул могут содержать замутнитель, такой как тальк и диоксид титана, и красители. В данном контексте перечислено различное оборудование, которое использовали для проведения экспериментов, которое не ограничивается перечисленными установками различных известных конструкций, моделей и производителей. Например, смесители могут включать V-образные РК смесители, конические барабанные смесители, грануляторы с псевдоожиженным слоем, производства Glatt Air Techniques и Niro Pharma System, планетарные смесители и ленточно-винтовые смесители. Установки экструзии из горячего расплава включают ZSE 18 HP, ZSE 27 HP, ZSE 40 HP, Micro 18 и Micro 27 двухшнековые экструдеры, вращающиеся в одну или разные стороны, производства American Leistritz Extruder Corporation, одношнековые 19/20 Dn и двухшнековые DSE 25 и DSE 35 экструдеры, вращающиеся в одну или в разные стороны, производства Brabender Measurement & Control Systems) и экструдеры Caleva, модели 20, 40 и 100, производства Caleva Process Solutions Ltd. Оборудование для отбора по размерам включает калибровочные машины Comil Sizers, производства Quadro, Hammermill sizers производства Fitzpatrick, Oscillator sizers различных производителей. Оборудование для заполнения твердых капсул для заполнения расплавленной массой, включают, например, QUALICAPS F-40-LIQFILsuper 40, QUALICAPS F-80-LIQFILsuper 80, QUALICAPS F-120-LIQFILsuper 120, QUALICAPS F-150-LIQFILsuper 150 и установку для заполнения и запаивания капсул Capsugel CFS 1000, установку для запаивания капсул, например, QUALICAPS S-40 HICAPSEAL и QUALICAPS S-100 HICAPSEAL, установку для заполнения капсул твердым порошком, включая MG производства MG2, GKF производства Bosch и Zanasi производства IMA, оборудование для прессования таблеток производства Manesty, Fette и Courtoy, оборудование для нанесения покрытия на таблетки производства Niro Pharma Systems, например, SIROCCO®, MULTI-PROCESSOR®, MP-MICRO®, STREA-1® и МР-1 MULTI-PROCESSOR® и Glatt, например, установка для гранулирования/сушки/покрытия в псевдоожиженном слое.
Дополнительные способы модификации лекарственных форм в виде таблеток
На лекарственные формы в виде таблеток наносят также покрытия для улучшения внешнего вида и/или вкуса. В некоторых случаях таблетки покрывают сахаром, полимерами целлюлозы и/или полиметакрилатами. Некоторые примеры коммерческих материалов для покрытия имеют торговые названия OPADRY®, SURELEASE®, AQUACOAT® и EUDRAGIT®. Материалы для покрытия могут содержать фармацевтически приемлемый краситель и/или фармацевтически приемлемый замутнитель, включая, без ограничения перечисленным, такие замутнители, как диоксид титана или тальк. В другом варианте состав для получения таблетки покрывают желатином или инкапсулируют в желатиновую оболочку. В желатиновой оболочке может кроме того содержаться фармацевтически приемлемый краситель и/или фармацевтически приемлемый замутнитель.
Группа изобретений относится к фармакологии и касается жидких составов, предназначенных для ингибирования RAF киназы, ипгибирования ангиогенеза и/или для лечения рака, а также способов получения жидких составов. Составы включают {1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензимидазол-2-ил} (4-трифторметилфенил)амин (соединение формулы I), его фармацевтически приемлемую соль или смесь любых двух или более из указанного соединения или его солей, гидрофильный растворитель, включающий этанол, полиэтиленгликоль или их смесь, липофильный растворитель, включающий жирную кислоту и эмульгатор. Способ получения жидкого состава включает смешивание вышеназванных компонентов. Группа изобретений обеспечивает увеличение биодоступности соединения формулы I. 4 н. и 35 з.п. ф-лы, 7 табл., 6 пр.
1. Жидкий состав, предназначенный для ингибирования RAF киназы, ингибирования ангиогенеза и/или для лечения рака, включающий:
- соединение формулы I, его фармацевтически приемлемую соль или смесь любых двух или более из указанного соединения или его солей; и
- гидрофильный растворитель, включающий этанол, полиэтиленгликоль или их смесь;
- липофильный растворитель, включающий жирную кислоту; и
- эмульгатор;
где соединение формулы I характеризуется структурой:

2. Жидкий состав по п.1, где гидрофильным растворителем является полиэтиленгликоль.
3. Жидкий состав по п.1, где эмульгатор выбран из группы, включающей сложный эфир сахара и жирной кислоты; сложный моно-, ди- и триэфир сахарозы или жирной кислоты; соединение полиоксиэтилена и касторового масла; эфир полиоксиэтиленсорбитана и жирной кислоты; сложный моно- или диэфир полиоксиэтилена и жирной кислоты;
полиоксиэтиленалкиловый эфир; сложный моно-, ди- или триэфир жирной кислоты и глицерина; смеси моно- или диэфиров полиоксиэтилена и жирных С8-С22кислот; и сложный моно-, ди- или триэфир глицерина и жирных С8-С22кислот или смесь любых двух или более указанных соединений.
4. Жидкий состав по п.1, где липофильным растворителем является олеиновая кислота.
5. Жидкий состав по п.1, где эмульгатор выбран из группы, включающей полиоксил(35)касторовое масло; полиоксил(40)гидрированное касторовое масло; полиоксил(60)гидрированное касторовое масло; полисорбат 20; полисорбат 40; полисорбат 60; полисорбат 80; полиоксил(40)стеарат; полиоксил(40)олеат; полиоксил(20)цетостеариловый эфир; полиоксил(10)олеиловый эфир и сукцинат DL-α-токофериллполиэтиленгликоля или смесь любых двух или более указанных соединений.
6. Жидкий состав по п.1, дополнительно включающий антиоксидант, краситель, циклодекстрин, ароматизатор, консервант, подсластитель или смесь двух или более указанных соединений.
7. Жидкий состав по п.1, где полиэтиленгликоль характеризуется средней молекулярной массой от приблизительно 100 г/моль до приблизительно 1000 г/моль, и метоксиполиэтиленгликоль характеризуется средней молекулярной массой от приблизительно 100 г/моль до приблизительно 1000 г/моль.
8. Жидкий состав по п.1, где соединение формулы I, его фармацевтически приемлемая соль или смесь любых двух или более из указанного соединения или его солей содержится в количестве от приблизительно 0,1 мас.% до приблизительно 40 мас.% в расчете на общую массу состава.
9. Жидкий состав по п.8, где соединение формулы I, его фармацевтически приемлемая соль или смесь любых двух или более из указанного соединения или его солей содержится в количестве от приблизительно 0,2 мас.% до приблизительно 20 мас.% в расчете на общую массу состава.
10. Жидкий состав по п.9, где соединение формулы I, его фармацевтически приемлемая соль или смесь любых двух или более из указанного соединения или его солей содержится в количестве от приблизительно 0,5 мас.% до приблизительно 10 мас.% в расчете на общую массу состава.
11. Жидкий состав по п.1, где гидрофильный растворитель содержится в количестве до приблизительно 90 мас.% в расчете на общую массу состава.
12. Жидкий состав по п.1, где эмульгатор, если он присутствует в составе, содержится в количестве от приблизительно 5 мас.% до приблизительно 50 мас.% в расчете на общую массу состава.
13. Жидкий состав по п.1, где липофильный растворитель содержится в количестве до приблизительно 50 мас.% в расчете на общую массу состава.
14. Жидкий состав по п.1, где составом заполняют капсулу.
15. Жидкий состав по п.14, где общая масса соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более из указанного соединения или его солей в капсуле составляет от приблизительно 1 мг до приблизительно 400 мг.
16. Жидкий состав по п.1, где состав содержит фармацевтически приемлемую соль соединения формулы I.
17. Жидкий состав по п.1, где гидрофильный растворитель включает этанол.
18. Жидкий состав по п.17, где этанол содержится в количестве до приблизительно 15 мас.% в расчете на общую массу состава.
19. Жидкий состав по п.1, где полиэтиленгликоль содержится в количестве до 90 мас.% в расчете на общую массу состава.
20. Способ получения жидкого состава, включающий:
(а) смешивание соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более из указанного соединения или его солей, с гидрофильным растворителем, включающем этанол, полиэтиленгликоль или их смесь, липофильным растворителем, включающем жирную кислоту, и эмульгатором, с получением указанного жидкого состава;
где соединение формулы I характеризуется структурой:

21. Способ по п.20, где гидрофильный растворитель содержится в количестве до приблизительно 90 мас.% в расчете на общую массу состава.
22. Способ по п.20, где эмульгатор содержится в количестве от приблизительно 10 мас.% до приблизительно 50 мас.% в расчете на общую массу состава.
23. Способ по п.20, где липофильный растворитель содержится в количестве до приблизительно 50 мас.% в расчете на общую массу состава.
24. Способ по п.20, дополнительно включающий смешивание соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более из указанного соединения или его солей, гидрофильного растворителя, липофильного растворителя и эмульгатора, с антиоксидантом, красителем, ароматизатором, консервантом, подсластителем или смесью любых двух или более указанных соединений.
25. Способ по п.24, где гидрофильным растворителем является полиэтиленгликоль, или смесь любых двух или более указанных соединений в количестве до приблизительно 90 мас.% в расчете на общую массу состава.
26. Способ по п.24, где гидрофильным растворителем является этанол в количестве до приблизительно 15 мас.% в расчете на общую массу состава.
27. Способ по п.24, дополнительно включающий стадию (б) получения по крайней мере одной капсулы, содержащей указанный состав.
28. Способ по п.27, где общая масса соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более из указанного соединения или его соли в капсуле составляет от приблизительно 1 мг до приблизительно 400 мг.
29. Способ по п.27, где капсула представляет собой желатиновую капсулу или твердую капсулу с оболочкой.
30. Жидкий состав, предназначенный для ингибирования RAF киназы, ингибирования ангиогенеза и/или для лечения рака, включающий
- соединение формулы I

или его фармацевтически приемлемую соль, или смесь любых двух или более из указанного соединения или его солей; и
- полиэтиленгликоль 400, олеиновую кислоту и эмульгатор;
где эмульгатор выбран из группы, включающей моно- и диглицериды каприловой и каприновой кислот, полиоксил(40)гидрированное касторовое масло, полиоксил(35)касторовое масло, полисорбат 80 и полисорбат 20 или их смесь.
31. Жидкий состав по п.30, где эмульгатор представляет собой полисорбат 80.
32. Жидкий состав по п.30, где эмульгатор представляет собой полиоксил(35)касторовое масло.
33. Жидкий состав по п.30, дополнительно включающий подсластитель и ароматизатор.
34. Жидкий состав по п.33, где подсластитель включает сахарин и глициррезинат моноаммония, и ароматизатор включает масло перечной мяты.
35. Жидкий состав по п.30, где полиэтиленгликоль 400 содержится в количестве до 90 мас.% в расчете на общую массу состава.
36. Жидкий состав по п.30, где олеиновая кислота содержится в количестве до 50 мас.% в расчете на общую массу состава.
37. Жидкий состав по п.30, где эмульгатор содержится в количестве от 10 мас.% до 50 мас.% в расчете на общую массу состава.
38. Жидкий состав по п.30, где соединение формулы I, его фармацевтически приемлемая соль или смесь любых двух или более из указанного соединения или его солей содержится в количестве от 0,5 мас.% до 10 мас.% в расчете на общую массу состава.
39. Способ получения жидкого состава по п.30, включающий смешивание соединения формулы I, его фармацевтически приемлемой соли или смеси любых двух или более из указанного соединения или его солей, с полиэтиленгликолем 400, олеиновой кислотой и эмульгатором, с получением указанного жидкого состава.
| Переходная камера для поверки манометров | 1929 |
|
SU14230A1 |
| Приспособление для подъема колпака сухопарника в паровозных котлах | 1925 |
|
SU2270A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2012-06-10—Публикация
2007-07-20—Подача