Изобретение относится к биотехнологии, иммунологии и медицине и может быть применено для определения аутоантител, специфичных к β1-адренорецептору в плазме и сыворотке крови человека.
Показано, что наличие повышенного титра аутоантител к β1-адренорецептору может быть одним из факторов развития тяжелых сердечно-сосудистых заболеваний, таких как дилатационная кардиомиопатия, тахиаритмия и острая сердечная недостаточность [1-3].
Дилатационная кардиомиопатия (ДКМП) - заболевание сердечной мышцы (миокарда) неизвестной этиологии, приводящее к увеличению размеров, изменению толщины стенок, дилатацией полостей, снижению фракции выброса, а также нарушению проводимости и ритма сердца [4]. Смертность от ДКМП составляет 1 на 10000 человек среди мужчин молодого и среднего возраста (от 35-55 лет) [5], пятилетняя выживаемость среди европейской расы составляет 31,4% [6]. Прогноз течения заболевания очень плохой и многие больные нуждаются в пересадке сердца. В крови больных ДКМП выявляются различные аутоантитела, которые являются антителами против собственных антигенов, таких как миозин, адениннуклеотидный транслокатор, сарколемальный ламинин, β1-адренорецептор, белок мускаринового М2-рецептора, рибосомальных и митохондриальных белков и др. Это может служить свидетельством причастности аутоиммунных нарушений к патогенезу заболевания [7].
Молекула β1-адренорецептора относится к семейству G белков, имеет 7 трансмембранных доменов и несколько экстраклеточных петель. Встречаемость повышенного титра аутоантител к β1-адренорецептору у больных с ДКМП варьирует в различных исследованиях в широком диапазоне, однако литературные данные однозначно говорят о том, что эти аутоантитела, равно как и аутоантитела к мускариновому М2 рецептору - наиболее часто встречающиеся аутоантитела у больных с ДКМП [8, 9]. На опытах с кроликами показано, что введение синтетического пептида, соответствующего последовательности второй экстраклеточной петли молекулы β1-адренорецептора, приводит к развитию ДКМП [3], а комбинированная иммунизация пептидами, соответствующими β1-адренорецептору и мускариновому М2-рецептору, вызывает гипертрофию сердечной мышцы [9].
Для определения титра аутоантител к β1-адренорецептору используют способ твердофазного иммуноферментного анализа (ИФА) на основе синтетических пептидов, поскольку данный подход является более простым, технологичным, воспроизводимым и перспективным для возможного последующего внедрения в клиническую диагностику. В литературе описано несколько способов ИФА с использованием пептида, соответствующего внеклеточному участку (197-222) 2-й петли β1-адренорецептра [8, 10]. В группе обследованных больных, у 18 из которых был поставлен диагноз ДКМП, у 14 - ИБС, было проведено определение уровня аутоантител к β1-адренорецепторам способом ИФА с использованием вышеописанного пептида (197-222) [11]. При этом только у 3 пациентов из 18 (16,6%) с диагнозом ДКМП и у 3 пациентов из 14 (21,4%) с диагнозом ИБС был обнаружен достоверный положительный ответ (превышение сигнала в ИФА в 2 и более раз относительно фона здоровых доноров n=20) [10].
Другой описанный способ ИФА позволяет определять наличие аутоантител к β1-адренорецептору и мускариновому М2-рецептору с использованием пептидов, представляющих собой участок (169-192) 2-й внеклеточной петли мускаринового ацетилхолинового рецептора-2 и участок (197-222) 2-й петли β1-адренорецептора. Частота получения положительного ответа в группе больных ДМКП и здоровых доноров достоверно не отличалась и составила: 5 из 36 (14%) больных и 4 из 36 здоровых доноров (12%) [8].
Аналогом предложенного иммуноферментного анализа является способ, описанный Magnusson Y. [11]. В качестве антигена также использовался пептид, представляющий собой участок (197-222) 2-й петли β1-адренорецептора. Частота выявления аутоантител к β1-адренорецептору у больных ДКМП, определяемых данным способом, составляла 13 положительных ответов из 42 больных (30%), тогда как на популяции здоровых доноров доля положительных ответов - 12% [11].
Таким образом, чувствительность диагностического метода, определяемая как процент положительных результатов теста при наличии диагностируемого заболевания (ДКМП), для описанных способов с использованием пептида (197-222) 2-й петли β1-адренорецептора не превышает 30%.
Собственные исследования показали, что у больных ДКМП выявляются аутоантитела против как 1-й или 2-й петли, так и комплекса этих двух петель, связанных в нативной молекуле β1-адренорецептора дисульфидной связью [12].
Таким образом, ограниченная антигенная специфичность используемого пептида может, в свою очередь, объяснять заниженную чувствительность описанных способов ИФА у больных ДКМП.
Прототипом предложенного способа ИФА является анализ аутоантител с использованием синтетического антигена - химерной молекулы, представляющего собой индивидуальное химическое соединение, в котором пептиды последовательности (125-133) 1-й петли и (206-218) 2-й петли β1-адренорецептора соединены дисульфидной связью [12]. Использование данной химерной молекулы позволило увеличить чувствительность определения аутоантител к β1-адренорецептору до 44% [13].
В связи со сложностью постановки диагноза и тяжестью заболевания ДКМП определение уровня аутоантител к β1-адренорецептору является чрезвычайно значимым для возможной дифференциальной диагностики сердечно-сосудистых заболеваний и, в частности, ДКМП. В связи с этим чувствительность способа должна быть более высокой.
Задачей настоящего изобретения является разработка иммунологического метода, позволяющего с высокой чувствительностью определять аутоантитела к β1-адренорецептору.
Поставленная задача решается использованием в качестве антигена эквимолярной смеси синтетических пептидов, представляющих собой - нонапептид (125-133) 1-й петли, тридекапептид (208-218) 2-й петли последовательности β1-адренорецептора и синтетический антиген, включающий в себя нонапептид и тридекапептид, соединенные между собой дисульфидной связью.
Синтез пептидов последовательности (125-133) 1-й внеклеточной петли β1-адренорецептора (нонапептид) и последовательности (206-218) 2-й петли молекулы β1-адренорецептора (тридекапептид) осуществляли по стандартной технологии синтеза на твердой фазе с использованием Fmoc*-методологии на полимере Ванга. В работе использовали производные L-аминокислот фирмы «Bachem» (Швейцария), DIC, HOBT, TIBS фирмы «Fluka» (Швейцария). Для синтеза применяли N-метилпирролидон, дихлорметан, пиперидин, метанол и трифторуксусную кислоту («Applied Biosystems», США). DMF очищали перегонкой над нингидрином и окисью бария. Для блокирования функциональных групп боковых цепей аминокислот применяли следующие защиты: трет-бутильную для карбоксильных групп аспарагиновой и глутаминовой кислот, гидроксильной функции серина и тирозина; трет-бутилоксикарбонильную (Вос) - защиту для ε-аминогруппы лизина; тритильную (Trt) - группу для карбоксамидной функции аспарагина и Pmc - для гуанидиновой функции аргинина.
О защите цистеиновых остатков см. примеры 1 и 2. Аминокислотную цепь наращивали по одной аминокислоте, начиная с С-конца, с использованием карбодиимидного метода с добавкой 1-гидроксибензотриазола.
Пример 1. Синтез нонапептида последовательности (125-133) 1-й петли β1-адренорецептора H-Glu-Tyr-Gly-Ser-Phe-Phe-Cys-Glu-Leu-OH (предшественник I).
Синтез проводили на автоматическом пептидном синтезаторе «Applied Biosystems» модель 431А по стандартной программе для однократной конденсации Fmoc-аминокислот. В каждом случае исходили из 0,25 ммоль Fmoc-аминоацилполимера («Bachem», Швейцария). Для твердофазного синтеза использовали сополимер стирола с 1% дивинилбензола с гидроксиметилфеноксиметильной якорной группой, с размером частиц 200-400 меш фирмы «Bachem» (Швейцария). Стандартный протокол твердофазного синтеза включает следующие стадии:
Протокол твердофазного синтеза
Отщепление и деблокирование пептидов осуществляли действием трифторуксусной кислоты со специальными добавками, предотвращающими побочные реакции. Деблокирование сульфгидрильных групп цистеиновых остатков осуществляли действием ацетата ртути. Линейные нонапептид и тридекапептид очищали с помощью препаративной ВЭЖХ до 97-98% чистоты. Препаративную ВЭЖХ проводили на приборе «Beckman» (США), пептиды детектировали при 226 нм. Пептиды элюировали градиентом концентрации ацетонитрила в 0,1% TFA. Для ВЭЖХ использовали ацетонитрил фирмы «Technopharm» (РФ). Аналитическую ВЭЖХ проводили на колонках Ultrasphere ODS («Beckman», США), (5 мкм, 4,6×250 мм); на хроматографе фирмы «Gilson» (Франция). В качестве элюентов использовали буфер А - 0,1% TFA, pH 2,0, буфер Б - 80% ацетонитрила в буфере А, элюция градиентом концентрации буфера Б в буфере А со скоростью потока 1 мл/мин.
Синтезированные пептиды характеризовали данными 1H-ЯМР-спектроскопии 1Н-ЯМР-спектры снимали на спектрометре WH-500 «Bruker» 500 МГц (ФРГ) в DMSO-d при 300 K, концентрация пептидов составляла 2-3 мг/мл. Химические сдвиги измерялись относительно тетраметилсилана), масс-спектрометрии (Масс-спектры регистрировали на приборе PC-Kompact MALDI, «Kratos», Англия).
Стадия 1. Твердофазный синтез H-Glu-Tyr-Gly-Ser-Phe-Phe-Cys(Acm)-Glu-Leu-OH (предшественник IAcm) проводили, исходя из 0,34 г Fmoc-Leu-полимера, содержащего 0,25 ммоль стартовой аминокислоты, в соответствии с вышеприведенным стандартным протоколом. Сульфгидрильную группу остатка цистеина защищали ацетамидометильной защитой.
Заключительное деблокирование и отщепление нонапептида (IAcm) от полимера проводили в одну стадию путем обработки соответствующего нонапептидилполимера смесью 10 мл TFA и 0,5 мл Н2О в течение 2 ч. Затем полимер отфильтровывали, промывали 2×2 мл деблокирующей смеси, фильтрат упаривали и к остатку прибавляли сухой эфир. Осадок отфильтровывали, промывали дихлорметаном (3×3 мл), эфиром (3×5 мл), сушили в вакуум-эксикаторе. Получено 0,25 г сырого продукта (IAcm), содержащего по данным ВЭЖХ 94% целевого пептида.
Очистку пептида проводили с помощью препаративной ВЭЖХ на приборе «Beckman» (США), используя колонку Диасорб-С16 130Т (25×250 мм), размер частиц сорбента - 10 мкм. В качестве элюентов использовали: буфер А - 0,1% водный раствор TFA и буфер Б - 80% ацетонитрила в воде, элюцию проводили градиентом 0,5% в минуту буфера Б от 100% буфера А, скорость потока 10 мл/мин. Пептиды детектировали при длине волны 226 нм. Фракции, содержащие целевой продукт, объединили и лиофилизовали. В итоге получено 0,15 г (51% в расчете на стартовую аминокислоту, присоединенную к полимерному носителю) трифторацетата пептида (IAcm). Гомогенность продукта, определенная с помощью аналитической ВЭЖХ, составила 98%. Аминокислотный состав по данным 1H-ЯМР-спектроскопии: Glu 2, Ser 1, Gly 1, Leu 1, Phe 2, Tyr 1, Cys 1.
Масс-спектр, m/z: 1165,5 [М+Н]+, вычислено 1164,7, для C54H72N10O17S1.
Стадия 2. Получение нонапептида H-Glu-Tyr-Gly-Ser-Phe-Phe-Cys-Glu-Leu-OH (предшественник I).
0,05 г (0,043 ммоль) H-Glu-Tyr-Gly-Ser-Phe-Phe-Cys(Acm)-Glu-Leu-OH (IAcm) растворяли в 5 мл 30% АсОН, добавляли 0,03 г (0,09 ммоль) ацетата ртути в 1,5 мл 30% АсОН, так как пептид плохо растворим, доводили концентрацию раствора до 50% АсОН и перемешивали 1,5 ч при 20°С, затем пропускали ток сероводорода в течение 30 мин. Осадок отфильтровывали, промывали 2×5 мл 30% АсОН. Фильтрат упаривали до объема ~2 мл и хроматографировали на колонке (25×250 мм) с Диасорбом. Элюцию проводили градиентом буфера Б (0,5% в мин, от 20 до 80%) в буфере А со скоростью потока 10 мл/мин. Фракции, соответствующие целевому продукту, объединяли, упаривали, остаток растворяли в воде и лиофилизовали. Выход 0,038 г (80,0%). Масс-спектр, m/z: 1095,2 ([М+Н+]), вычислено 1094,2 для C51H67N9O16S.
Пример 2. Синтез тридекапептида последовательности (206-218) 2-й петли β1-адренорецептора H-Ala-Arg-Arg-Cys-Tyr-Asn-Asp-Pro-Lys-Cys-Cys-Asp-Phe-OH (предшественник II)
Стадия 1. Твердофазный синтез H-Ala-Arg-Arg-Cys-Tyr-Asn-Asp-Pro-Lys-Cys-Cys(Acm)-Asp-Phe-OH (предшественник IIAcm) проводили, исходя из 0,37 г Fmoc-Phe-полимера, содержащего 0,25 ммоль стартовой аминокислоты, в соответствии с вышеприведенным стандартным протоколом. Сульфгидрильные группы остатков Cys4 и Cys10 цистеина защищали тритильной защитой, а Cys11 - ацетамидометильной.
Заключительное деблокирование и отщепление тридекапептида (IIAcm) от полимера проводили в одну стадию путем обработки соответствующего тридекапептидилполимера смесью 10 мл TFA, 0,25 мл Н2О и 0,25 мл TIBS в течение 2 ч. Затем полимер отфильтровывали, промывали (2×2 мл) деблокирующей смесью, фильтрат упаривали и к остатку прибавляли сухой эфир. Осадок отфильтровывали, промывали дихлорметаном (3×3 мл), эфиром (3×5 мл), сушили в вакуум-эксикаторе. Получали 0,42 г сырого продукта (IIAcm), содержащего по данным ВЭЖХ 60% целевого пептида.
После этого проводили очистку пептида с помощью препаративной ВЭЖХ так же, как в примере 1. В итоге получали 0,13 г (32% в расчете на стартовую аминокислоту, присоединенную к полимерному носителю) трифторацетата пептида (IIAcm). Гомогенность продукта, определенная с помощью аналитической ВЭЖХ, составляла 98%. Аминокислотный состав по данным 1H-ЯМР-спектроскопии: Asn 1, Asp 2, Ala 1, Phe 1, Tyr 1, Lys 1, Arg 2, Pro 1, Cys 3. Масс-спектр, m/z: 1661,2 [M+H]+, вычислено 1661,9, для C68H104N22O21S3.
Стадия 2. Получение тридекапептида H-Ala-Arg-Arg-Cys-Tyr-Asn-Asp-Pro-Lys-Cys-Cys-Asp-Phe-OH (предшественник II).
Деблокирование остатка цистеина Cys11 в тридекапептиде H-Ala-Arg-Arg-Cys-Tyr-Asn-Asp-Pro-Lys-Cys-Cys(Acm)-Asp-Phe-OH (IIAcm) проводили действием ацетата ртути, как описано в примере 1. Выход тридекапептида 0,027 г (90,0%). Масс-спектр: m/z 1591,9 ([М+Н+]), вычислено 1590,8 для C65H99N21O20S3.
Пример 3. Синтетический антиген, включающий в себя нонапептид (125-133) и тридекапептид (208-218) последовательности β1-адренорецептора, соединенные дисульфидной связью.
0,007 г (0,006 ммоль) нонапептида (участок 125-133 β1-адренорецептора) и тридекапептида (участок 208-218 β1-адренорецептора) 0,009 г (0,006 ммоль) растворяли в 20 мл 10% водного диоксана, добавляли 1 мл 5% водного аммиака до pH 8,0. Вносили в смесь 0,1 мл 3% водной перекиси водорода и перемешивали в течение 10 мин. Полноту окисления SH-групп контролировали с помощью реагента Эллмана (бесцветный раствор). По окончании реакции целевой продукт хроматографировали на колонке 25×600 мм с сефадексом G-25, уравновешенной 2% раствором уксусной кислоты, с целью удаления низкомолекулярных примесей. Фракции, содержащие целевой продукт, объединяли и лиофилизовали. Получено 0,013 г синтетического антигена (81%). Масс-спектр: 2679,8 ([М+Н+]), вычислено 2680,9, для C116H162N30O36S4.
Пример 4. Твердофазный иммуноферментный анализ аутоантител к β1-адренорецептору в образцах плазмы и сыворотки крови человека, использующий в качестве антигена эквимолярную смесь синтетических пептидов - нонапептид (125-133), тридекапептид (208-218) и синтетический антиген (см. пример 3) последовательности β1-адренорецептора.
В состав набора реагентов для определения аутоантител входили следующие компоненты: 96-луночный планшет для иммуноанализа, фирма «Costar»; смесь синтетического антигена (см. пример 3) и пептидов (см. примеры 1 и 2); буфер 0,1 М Na2CO3 pH 9,6 для разведения пептидов; блокирующий раствор и раствор для отмывки планшетов - буферная смесь 0,01М NaH2PO4-NaOH pH 7,2, содержащая 0,15М NaCl, 3% обезжиренное сухое молоко и бактериостатик катон CG 2,0 мл/л (ФСБМ); раствор для разведения образцов и конъюгатов - 0,01М NaH2PO4-NaOH pH 7,2, содержащий 0,15 М NaCl, 3% обезжиренное сухое молоко, бактериостатик катон CG 2,0 мл/л и 0,1% Твин-20 (ФСБМ-Т); конъюгат - реагент для анализа: мышиные моноклональные антитела против IgG человека, меченые биотином; конъюгат стрептавидин-пероксидаза; раствор тетраметилбензидина (ТМБ), 1 мМ в диметилформамиде; субстратный буферный раствор - натрий цитрат 5,5-водный, 26 г/л; лимонная кислота 6,92 г/л, натрия перборат 1,1 г/л и катон CG 2,0 мл/л; стоп-реагент - фосфорная кислота 5%.
Протокол анализа
Перед проведением анализа компоненты набора выдерживали при температуре 20°С в течение 60 мин. Для иммобилизации антигена на планшетах для проведения ИФА использовали смесь (4,5 нмоль/лунку) трех пептидов в эквимолярном соотношении (1,5:1,5:1,5 нмоль/лунку), которые разводили в 0,1 М Na2CO3 pH 9,6 и вносили в лунки планшетов по 100 мкл, затем инкубировали при температуре 37°C в течение 2 часов. Для удаления несвязанных антигенов лунки планшета промывали 4 раза по 250 мкл ФСБМ. Исследуемые образцы плазмы/сыворотки, положительный и отрицательный контроли разводили в ФСБМ-Т в 20 и 50 раз, вносили пипеткой в соответствующие лунки по 100 мкл, инкубировали при температуре 4°C в течение 20 часов. Лунки планшета промывали 4 раза по 250 мкл ФСБМ. Рабочий раствор конъюгата в ФСБМ-Т с концентрацией 0,26 мгл/мл вносили в лунки планшета по 100 мкл и инкубировали при температуре 20°C в течение 60 минут со встряхиванием. Лунки планшета промывали 4 раза по 250 мкл ФСБМ. Конъюгат Str-ПХ разводили в ФСБМ-Т 1:50 и немедленно вносили в лунки планшета по 100 мкл, инкубировали при температуре 20°С в течение 30 минут со встряхиванием. Лунки планшета промывали 4 раза по 250 мкл субстратным буферным раствором. Готовили раствор субстратной смеси (7 объемов субстратного буфера и 1 объем ТМБ) и немедленно вносили в лунки планшета по 100 мкл, закрывали крышкой и инкубировали при температуре 20°С в течение 15 минут без встряхивания. В лунки планшета вносили по 100 мкл стоп-реагента в той же последовательности и тем же методом, каким вносили субстратную смесь. В течение 5 минут после добавления стоп-реагента регистрировали оптическую плотность в планшете на спектрофотометре для ИФА при длине волны 450 нм.
Результаты.
Чувствительность и специфичность предлагаемого способа ИФА для определения аутоантител к β1-адренорецептору в сыворотке и плазме крови человека.
Определение аутоантител к β1-адренорецептору проводили в сыворотках и плазмах, полученных от больных с клиническим диагнозом ДКМП (группа 1, n=42), в группе больных ишемической болезнью сердца (ИБС) без ДКМП и аритмий (группа 2, n=15) и в группе здоровых доноров (группа 3, n=41).
О наличии в сыворотке аутоантител к β1-адренорецептору (положительный ответ в анализе) судили по превышению сигнала оптической плотности (ОП) в исследуемом образце над ОПкрит в соответствующем разведении.
Критическую оптическую плотность (ОПкрит.) рассчитывали по формуле:
ОПкрит=2×ОП отрицательного контроля.
В качестве отрицательного контроля использовали плазму обследованного здорового донора с доказанным отсутствием аутоантител, определенных независимым способом.
% превышения над ОПкрит. рассчитывали по формуле:
% превышения=(ОПобразец/ОПкрит.-1)×100
Согласно принятым определениям, чувствительность диагностического теста рассчитывается как процент лиц с заболеванием, у которых наблюдаются положительные результаты теста, а специфичность - как процент лиц без заболевания, имеющих отрицательные результаты теста.
Результаты выявления положительных и отрицательных ответов ИФА при определении аутоантител к β1-адренорецептору в образцах плазмы/сыворотки крови пациентов исследуемых групп и здоровых доноров приведены в таблице 1.
В группе больных с сердечно-сосудистыми заболеваниями, но без диагноза тахиаритмии и ДКМП доля положительных ответов составляла 26% (4 из 15), доля отрицательных 74% (1 из 15), что было сравнимо с результатами, полученными в группе здоровых доноров.
Таким образом, чувствительность и специфичность данного способа для выявления аутоантител к β1-адренорецептору составляет 79% и 74% соответственно. Положительная предсказательная ценность данного способа для определения ДКМП (вероятность наличия заболевания при положительном результате ИФА) составляет 75%, отрицательная предсказательная ценность (процент лиц с отрицательными результатами ИФА, у которых не имеется ДКМП) - 77%. Следовательно, предлагаемый способ ИФА для определения аутоантител к β1-адренорецептору позволяет с высокой предсказательной точностью выявлять больных ДКМП.
Сравнительный анализ чувствительности предложенного способа ИФА с прототипом.
Сравнение чувствительности заявляемого способа иммуноферментного анализа с прототипом, описанным в собственном патенте RU 2356576 и использующим только синтетический антиген, представляющий собой нонапептид (125-133) и тридекапептид (208-218) последовательности β1-адренорецептора, соединенные дисульфидной связью, проводили на 26 образцах плазмы и сыворотки крови больных ДКМП. Методика и условия постановки ИФА были аналогичными и соответствовали описанным в разделе «Протокол анализа».
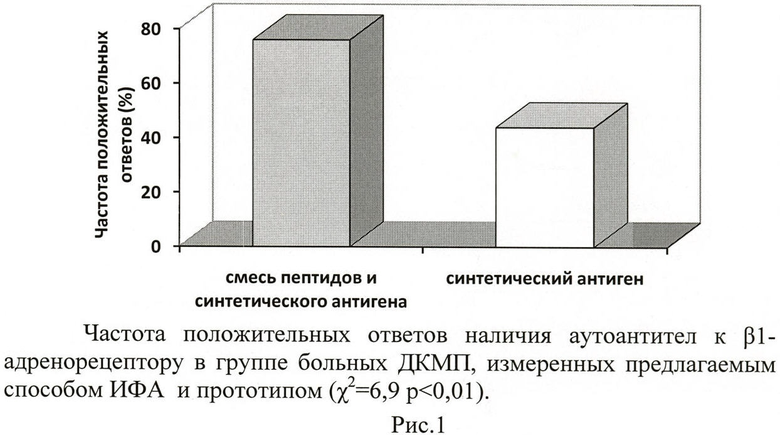
При анализе одних и тех же образцов плазмы и сыворотки больных ДКМП, с использованием в качестве антигена - синтетического антигена (прототип) или эквимолярной смеси пептидов и синтетического антигена количество положительных результатов определения аутоантител к β1- адренорецептору составило 12 (42%) и 20 (76%) из 26 измеренных образцов, соответственно (рис.1).
Таким образом, предлагаемый способ твердофазного иммуноферментного анализа позволяет с достоверно большей чувствительностью (76% положительных ответов) определять наличие аутоантител к β1-адренорецептору в плазме и сыворотке больных ДКМП по сравнению с прототипом (42% положительных ответов).


| название | год | авторы | номер документа |
|---|---|---|---|
| СИНТЕТИЧЕСКИЙ АНТИГЕН, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬ АУТОАНТИТЕЛА К β-АДРЕНОРЕЦЕПТОРУ | 2007 |
|
RU2356576C1 |
| СИНТЕТИЧЕСКИЙ АНТИГЕН, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬ АУТОАНТИТЕЛА К МУСКАРИНОВОМУ М2-РЕЦЕПТОРУ | 2012 |
|
RU2502743C1 |
| СИНТЕТИЧЕСКИЕ ОЛИГОПЕПТИДЫ, СПЕЦИФИЧЕСКИ ВЗАИМОДЕЙСТВУЮЩИЕ С АНТИТЕЛАМИ К ВИРУСУ ГЕПАТИТА С, СПОСОБЫ ДИАГНОСТИКИ HCV-ИНФЕКЦИИ (ВАРИАНТЫ) | 1994 |
|
RU2104284C1 |
| ПОЛИКЛОНАЛЬНОЕ АНТИТЕЛО, СПЕЦИФИЧЕСКИ РЕАГИРУЮЩЕЕ С ПРИОННЫМ ПРОТЕИНОМ В ТКАНИ МОЗГА МЛЕКОПИТАЮЩИХ, И ДИАГНОСТИЧЕСКИЙ РЕАГЕНТ НА ЕГО ОСНОВЕ | 2005 |
|
RU2281511C1 |
| Способ получения нанодисков, содержащих β1-адренорецептор в нативной конформации | 2023 |
|
RU2829120C1 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ НА ОСНОВЕ СИНТЕТИЧЕСКИХ ПЕПТИДОВ, КОПИРУЮЩИХ АКТУАЛЬНЫЕ ДЕТЕРМИНАНТЫ gp120 ВИЧ1 | 2014 |
|
RU2577132C1 |
| ИММУНОСОРБЕНТ ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ К ЯДЕРНОМУ БЕЛКУ ВИРУСА ГЕПАТИТА С В СЫВОРОТКЕ КРОВИ | 1997 |
|
RU2138286C1 |
| АНТИТЕЛА К ФАКТОРУ IX PADUA | 2017 |
|
RU2770006C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОВЫШЕННОГО УРОВНЯ АУТОАНТИТЕЛ К ПЛАЗМИНОГЕНУ ЧЕЛОВЕКА И ПРОДУКТАМ ЕГО ДЕГРАДАЦИИ И ДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2014 |
|
RU2597783C2 |
| Антитела против анафилатоксина C5a человека | 2019 |
|
RU2731516C1 |
Изобретение предназначено для определения аутоантител, специфичных к β1-адренорецептору, в плазме и сыворотке крови человека. Изобретение раскрывает способ твердофазного иммуноферментного анализа, в котором в качестве антигена на пластик иммобилизована эквимолярная смесь синтетических пептидов: нонапептида (положение 125-133), тридекапептида (положение 208-218) аминокислотной последовательности молекулы β1-адренорецептора человека и химерная конструкция из этих же пептидов, связанных между собой дисульфидной связью. Предложенный способ обладает принципиально большей чувствительностью при определении наличия аутоантител к β1-адренорецептору в плазме и сыворотке крови больных дилатационной кардиомиопатией. Изобретение может быть также применено для диагностики больных с различными сердечно-сосудистыми заболеваниями. 1 табл., 1 ил., 4 пр.
Иммуноферментный способ определения аутоантител к β1-адренорецептору в плазме и сыворотке крови человека с использованием синтетического антигена, представляющего собой нонапептид (125-133) и тридекапептид (208-218) последовательности β1-адренорецептора человека, связанных дисульфидной связью, отличающийся тем, что антиген дополнительно содержит нонапептид (125-133) и тридекапептид (208-218) при эквимолярном соотношении всех трех компонентов смеси.
| СИНТЕТИЧЕСКИЙ АНТИГЕН, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬ АУТОАНТИТЕЛА К β-АДРЕНОРЕЦЕПТОРУ | 2007 |
|
RU2356576C1 |
| WO 2010086337 A1, 05.08.2010 | |||
| ПРОИЗВОДНЫЕ 5-ГИДРОКСИБЕНЗОТИАЗОЛА В КАЧЕСТВЕ АГОНИСТОВ β-АДРЕНОРЕЦЕПТОРОВ | 2005 |
|
RU2402540C2 |
| TW 200831510 A, 01.08.2008. | |||
Авторы
Даты
2012-06-10—Публикация
2011-04-15—Подача