Представленное изобретение обеспечивает новые рекомбинантные вирусные вакцины. В особенности, представленное изобретение обеспечивает конбинированные продукты, которые включают рекомбинантные вирусные векторы и специфичные составы, способные повысить иммунную реакцию, образующуюся в условиях in vivo на указанные рекомбинантные вирусные векторы.
Традиционные способы вакцинации, которые включают введение в систему животных антигена, который может вызвать имунную реакцию, и таким образом защитить животное от инфекции, были известны много лет назад. Эти способы включали существование как живых, так и инактивированных вакцин. Живые вакцины - это типично аттенуированные не патогенные версии инфекционного агента, которые способны к праймированию имунной реакции, направленной против патогенной версии инфекционного агента. В последние годы были достигнуты успехи в развитии рекомбинантных вакцин, особенно рекомбинантных живых вакцин, в которых нативные антигены, которые представляют интерес, закодированы и экспрессированы с помощью вектора. Среди них являются представленными те векторы, которые основаны на рекомбинантных вирусах, и они показали большую перспективу и играют важную роль в развитии новых вакцин. Многие из вирусов были исследованы относительно их способности экспрессировать белки, которые происходят от чужеродных болезнетворных микроорганизмов или от опухолевой ткани, и относительно способности вызывать специфичные иммунологические ответы против этих антигенов в условиях in vivo. В целом же, эти основанные на гене вакцины могут стимулировать мощные гуморальные и клеточные иммунные ответы, и вирусные векторы могли бы быть эффективной стратегией и для доставки кодирующих антиген генов, и для помощи в повышении презентации антигена. Для того чтобы быть использованным как носитель для вакцины, идеальный вирусный вектор должен быть безопасным и позволить эффективно презентировать необходимых патоген-специфичных для болезнетворного микроорганизма антигенов к иммунной системе. Это должно также показать низкосвойственную иммуногенность, чтобы учесть ее репредставление для того, чтобы повысить соответствующие специфичные иммунные ответы. Кроме того, векторная система должна соответствовать критериям, которые позволяют реализовывать ее производство на крупномасштабной основе. Несколько вирусных векторов вакцины таким образом появились до настоящего времени, все они имеют относительные преимущества и пределы в зависимости от предложенного применения, и к настоящему времени ни один из них, как оказалось, не был идеальными носителем для вакцины.
Рекомбинантные поксвирусные векторы явлются примерами вирусных векторов для вакцин. Они были использованы как индукторы как гуморальных, так и клеточных свободных ответов, индуцируя как СD4+, так и СD8+Т клетки, и поэтому представляют систему доставки, особенно предпочтительно для лечения рака или антивирусной иммунотерапии (Arlen и др., 2005, Semin Oncol., 32, 549-555 или Essajee и Kaufman, 2004, Expert Opin Biol Ther., 4, 575-588). Несмотря на преимущества, связанные с поксвирусной вакцинацией, и относительно других способов лечения вакцинированием (см., например, Souza и др., 2005, Braz J Med Biol Res 509-522), является, тем не менее, желательным выявить те адъювантные составы, которые адаптированы к этому вирусному вектору, и которые будут предназначены для того, чтобы усилить имунную реакцию, вызванную указанной вакциной.
Было предпринято серьезное усилие в последние годы, и завершившееся существенным успехом, которое было направлено на то, чтобы обнаружить новые составы препарата, которые действуют, стимулируя специфичные ключевые аспекты иммунной системы. Эти составы, известные как свободные модификаторы ответа (IRMs) или адъюванты, как предполагают, действуют через основные механизмы иммунной системы через Toll - подобные рецепторы (TLRs) для того, чтобы вызвать биосинтез различных специфичных цитокинов (например, это интерфероны, интерлейкины, факторы некроза опухоли и т.д.). Такие составы, как было показано, стимулировали быстро высвобождаемый выход специфичных моноцит / макрофаг - дочерних цитокинов и также способны к стимулированию В клеток для того, чтобы секретировать антитела, которые играют важную роль в антивирусной и антиопухолевой активности составов IRM. Один из преобладающих иммуностимулирующих ответов, вызванных IRMs, является индукцией интерферон IFN - альфа - продуцирования, которое, как полагают, очень важно в остром антивирусном и антиопухолевом действиях. Кроме того, регулирование других цитокинов, таких как, например, фактор некроза опухоли (TNF), IL-1 и IL-6 также имеет потенциально выгодную активность и, как полагают, способствует антивирусным свойствам и антиопухолевым свойствам этих составов. Свободные модификаторы ответа (IRMs) были раскрыты как такие, которые являются полезными для лечения большого количества болезней и расстройств, включая вирусные заболевания (например, вирус папилломы человека, гепатит, герпес), неоплазии (например, базальноклеточная карцинома, плоскоклеточная карцинома, актинический кератоз, меланома), и ТН 2 - медиированные заболевания (например, астма, аллергический ринит, атопический дерматит).
Примеры таких свободных модификаторов ответа (IRMs), включают Ср G олигонуклеотиды (см., например, US 6194388; US 2006094683; WO 2004039829), липополисахариды, кислотные комплексы полиинозил: полицитидил (Kadowaki и др., 2001, J. Immunol. 166, 2291-2295), и полипептиды и белки, известные как индуцирующие продукцию цитокинов из дендритных клеток и/или моноцит / макрофагов. Другими примерами таких свободных модификаторов ответа (IRMs) являются маленькие органические молекулы, такие как имидазолхинолин амины, имидазолпиридин амины, 6,7 сплавленные циклоалкил имидазолпиримидин амины, имидазол пиримидин амины, оксазолхинолин амины, триазолохинолин амины и 1,2 соединенные имидазолхинолин амины (см., например, US 4689338; US 5389640; US 6110929; и US 6331539).
В частности, имидазолхиполин амины продемонстрировали сильную потенцию в качестве индукторов интерферона альфа (IFN), фактора некроза опухоли альфа (TNF), интерлейкина бета IL-1, IL-6, альфа IL-1, антагониста рецептора IL-1, IL-10, фактора стимулирования колонии макрофагов гранулоцитов (GM-CSF), гранулоцит CSF (Г-CSF), и макрофаг воспалительных белков 1 альфа в условиях in vitro и в условиях in vivo (Gibson и др., 1995, J Interferon Cytokine Res., 15, 537-545; Tomai и др., 1995, Antiviral Res., 28, 253-264; Testerman и др., 1995, J Leukoc Biol., 58, 365-372) и, как показано, вызвали разнообразные биологические функции, включая антивирусную, антипролиферативную и антиопухолевую активность (для обзора, см. Syed, 2001, Expert Opin Pharmacother., 2, 877-882 или Li и др., 2005, J Drugs Dermatol., 4, 708-717). Более подробно, изобретатели заявки на патент WO 93/20847 показали, что имидазолхинолин амины были в состоянии усилить имунную реакцию к определенным антигенам, таким как живые вирусные и бактериальные иммуногены, полученные из опухоли, протозоа, полученные из организмов, грибковые и бактериальные иммуногены, токсоиды, токсины, полисахариды, белки, гликопротеины, пептиды и т.п., когда эти антигены были введены с составами этой категории. Антивирусная активность составов имидазолхинолин аминов была далее продемонстрирована относительно многих вирусов, особенно поксвирусов (Bikowski, 2004, Cutis., 73, 202-206; US 20050048072), и их клиническая эффективность была продемонстрирована против остроконечных бородавок (Scheinfeld и Lehman, 2006, Dermatol Online J., 12, 5), генитального герпеса (Miller и др., 2002, Int Immunopharmacol., 2, 443-451) и контагиозного моллюска (Stulberg и Galbraith Hutchinson, 2003, Am. Fam. Physician, 67, 1233-1240).
После наблюдения в начале 1990-х о том, что векторы ДНК плазмиды могли непосредственно трансфецировать клетки животных в условиях in vivo, были предприняты существенные усилия по исследованию, направленные на то, чтобы развить способы вакцинирования, основанные на использовании плазмид ДНК для того, чтобы вызвать имунную реакцию, прямым введением в животных ДНК, которая кодирует аллергенные пептиды. Такие способы, которые широко отнесены к ДНК вакцинации, теперь используются для того, чтобы выявить защитные иммунные ответы в большом количестве моделей болезней. Позже, имидазол хинолин амины были предложены как адъюванты для вакцинации ДНК (WO 02/24225), особенно в иммунотерапии рака (WO 2006/042254; Smorlesi и др, 2005, Gene Therapy, 12, 1324-1332). Для обзора ДНК вакцин, см. Reyes - Sandoval и Ertl, 2001 (Current Molecular Medicine, 1, 217-243).
Существующее изобретение имеет отношение к усовершенствованным рекомбинантным вирусным вакцинам, которые экспрессируют в условиях in vivo no крайней мере одну гетерологичную последовательность нуклеотида, особенно последовательность нуклеотида, которая кодирует антиген. Это имеет отношение в особенности к рекомбинантной вирусной вакцине, содержащей по крайней мере один рекомбинантный вирусный вектор, который экспрессирует по крайней мере один антиген и по крайней мере один адъювант, который способен к значительному усиление иммунности, ориентированной на указанный антиген относительно той же самой рекомбинантной вирусной вакцины без адъюванта, и который является совершенно подходящим для этого типа вакцины. Это далее имеет отношение к способам вакцинации.
Заявитель неожиданно пришел к выводу о том, что специфичные имидазолилхинолин аминовые составы способны обладать сильной антивирусной потенцией, которая явлется направленной на то, чтобы усилить имунную реакцию в ответ на действие рекомбинантных вирусных вакцин к антигену, закодированному рекомбинантным вирусным вектором, и, более подробно, для вакцины, основанной на рекомбинантном гене поксвирусного вектора, и это проявляется в неочевидных пропорциях.
Предметом существующего изобретения, посему, является рекомбинантная вирусная вакцина, содержащая (i) по крайней мере один рекомбинантный вирусный вектор, который экспрессирует в условиях in vivo по крайней мере одну гетерологичную последовательность нуклеотида, особенно гетерологичную последовательность нуклеотида, которая кодирует антиген, и (ii) по крайней мере одну 1Н-имидазо[4,5-с]хинолин-4-амин производную.
Согласно одному воплощению существующего изобретения, указанная 1Н-имидазо[4,5-с]-хинолин-4-амин производная усиливает иммунные ответы у пациента к упомянутому антигену, где упомянутую рекомбинантную вирусную вакцину вводят указанному пациенту.
Так, как используется здесь по всему описанию, артикли используются в том смысле, что они подразумевают "по крайней мере один", "по крайней мере первое", "один или более" или "множество" составов, на которые ссылаются, или этапов, если контекст не имеет в виду иное. Например, термин "клетка" включает множество клеток, включая смесь указанных. Более определенно, "по крайней мере один" и "одно или более" средств являются значением, которое является единицей или более чем единица, со специальным предпочтением в единицу, два или три.
Термин "и/или" везде, как используется здесь, включает значение "и", "или" и "все или любая другая комбинация элементов, связанных указанным термином".
Термин "об" или "приблизительно" так, как используется здесь, означает средства в пределах 20%, предпочтительно в пределах 10%, и, более предпочтительно, в пределах 5% данного значения или диапазона.
Как используется здесь, термин "включение", "содержание" определяет те продукты, составы и способы, которые предназначены для того, чтобы означать, что продукты, составы и способы включают составы, на которые ссылаются, или этапы, но не исключая другие.
Термин "пациент" относится к позвоночному животному, особенно к тем членам семейства, которые относятся к разновидностям млекопитающих, и включает, но не ограничивает, домашних животных, диких животных, приматов, включая людей.
Термин "пациент" никоим образом не ограничен отдельным статусом болезни, он охватывает и пациентов, у которых уже развилась болезнь, представляющая интерес, и пациентов, которые еще не больны.
В том значении, как использующийся здесь, термин "лечить" или "лечение" охватывает профилактику и/или терапию. Соответственно, рекомбинантные вирусные вакцины существующего изобретения не ограничены терапевтическими применениями и могут использоваться для профилактики.
Согласно более преимущественному воплощению, рекомбинантный вирусный вектор согласно существующему изобретению - это поксвирусный вектор (см., например, Сох и др. in "Viruses in Human Gene Therapy" Ed J.M.Hos, Carolina Academic Press). Согласно другому преимущественному воплощению изобретения, он является выбранным из группы, состоящей из вируса коровьей оспы, подходящие вирусы коровьей оспы включают, однако не ограничены, Копенгагенский штамм (Goebel и др., 1990, Virol. 179, 247-266 и 517-563; Johnson и др., 1993, Virol. 196, 381-401), штамм Wyeth и сильно аттенутированный вирус, полученный из указанного, включая MVA (для обзора см. Mayr, А., и др., 1975, Infection 3, 6-14), а также производные указанного (такие как штаммы вируса коровьей оспы MVA 575 (ЕСАСС V00120707 - US 6913752), NYVAC (см. WO 92/15672 - Tartaglia и др., 1992, Virology, 188, 217-232). Он может также быть получен от любого другого представителя поксвирусов, при специфическом оспа - дифтерите птиц (TROVAC, см. Paoletti и др., 1995, Dev Biol Stand., 84, 159-163); вирус оспы канареек (ALVAC, WO 95/27780, Paoletti и др., 1995, Dev Biol Stand., 84, 159-163); вирус оспы голубей, вирус оспы свиней и т.п. Посредством примера специалисты, квалифицированные в данной отрасли техники, могут обратиться к WO 9215672 (включено здесь в качестве ссылки), в которой описано производство векторов экспрессии, основанных на поксвирусах, которые способны к экспрессии такой гетерологической последовательности нуклеотида, особенно последовательности нуклеотида, которая кодирует антиген.
В том значении, как используется здесь, термин "антиген" относится к любому веществу, которое является способным к тому, чтобы быть мишенью для иммунного ответа. Антиген может быть мишенью, например, для медиированных клеток и/или гуморальных имунных реакций, возникающих у пациентов. Термин "антиген" охватывает, например, вирусные антигены, опухоль - специфические или - связанные антигены, бактериальные антигены, антигены, происходящие от паразитов, аллергены и т.п.:
- вирусные антигены включают, например, антигены, происходящие из вирусов гепатита А, В, С, D и Е, ВИЧ, вирусы герпеса, цитомегаловирус, ветряная оспа зостер, вирусы папилломы, вирус Эпштейна Барра, вирусы гриппа, вирусы парагриппа, аденовирусы, вирусы коксаки, пикорна вирусы, рота вирусы, дыхательные сцинцитиальные вирусы, вирусы сифилиса, рино вирусы, вирус краснухи, папо вирусы, вирус свинки, вирус кори; некоторые не ограничивающие примеры известных вирусных антигенов включают следующее: антигены, полученные из ВИЧ 1 такие, как tat, nef, gp 120 или gp 160, gp 40, p 24, gag, env, vif, vpr, vpu, rev или часть и/или комбинации указанных; антигены, которые имеют происхождение из человеческих вирусов герпеса, такие как gH, gL gM gB gC gK gE или gD или часть и/или комбинации указанных или медиированный ранний белок такой, как as ICP27, ICP47, ICP4, ICP36 из HSV1 или HSV2; антигены, которые имеют происхождение из цитомегаловируса, особенно из человеческого цитомегаловируса, такие как gB или производные указанного; антигены, которые имеют происхождение из вируса Эпштейна Барра, такие как gp 350 или производные указанного; антигены, которые имеют происхождение из вируса Varicella Zoster, такие как asgp 1, 11, 111 и IE 63; антигены, которые имеют происхождение из вируса гепатита, такие как гепатит В, гепатит С или гепатит Е вирусные антигены (например, env белок Е1 или Е2, коровый белок, NS2, NS3, NS4a, NS4b, NS5a, NS5b, p7, или часть и/или комбинации указанных HCV); антигены, которые имеют происхождение из человеческих вирусов папилломы (например, HPV 6, 11, 16, 18, например, L1, L2, Е1, Е2, Е3, Е4, Е5, Е6, Е7, или часть и/или комбинации указанных); антигены, которые имеют происхождение из других вирусных болезнетворных микроорганизмов, таких как сцинцитиальный вирус дыхательных путей (например, F и белки Г или производные указанного), вирус пара гриппа, вирус кори, вирус свинки, флави вирусы (например, вирус желтой лихорадки, вирус лихорадки, тик-борн энцефалитный вирус, вирус японского энцефалита) или вирусы гриппа, поражающие клетки (например, ХА, NP, NA или М белки, или части и/или комбинаций указанных);
- опухоль - специфичные или связанные антигены включают, например, антигены, которые имеют происхождение от рака молочной железы, рака ободочной кишки, ректального рака, рака головы и шеи, почечного рака, малигнизированной меланомы, гортанного рака, рака яичников, рака шейки матки, рака простаты. Антигены рака - это те антигены, которые могут потенциально стимулировать только специфичные для опухоли иммунные ответы. Некоторые из этих антигенов являются закодированными, хотя не обязательно являются выраженными, нормальными клетками. Эти антигены могут быть охарактеризованы как те, которые обычно спокойны (то есть не являются выраженными) в нормальных клетках, те, которые экспрессированы только на специфичных стадиях дифференцирования, и те, которые временно экспрессированы, такие как эмбриональные и эмбриональные антигены. Другие антигены рака закодированы мутантными клеточными генами такие, как онкогены (например, активизированный ras онкоген), гены супрессоры (например, мутантный р53), сплавляющиеся белки, возникающие благодаря существованию внутренних делеций или хромосомных аббераций. Тем не менее другие антигены рака могут быть закодированы вирусными генами, такими как продолженные РНК и вирусные опухолевые ДНК. Некоторые неограничивающие примеры специфичных опухолевых или связанных антигенов включают MART-1/Melan-A, gp100, дипептид пептидазу IV (DPPIV), аденозин деаминаз - обязательный белок (ADA bp), циклофилин b, колоректальный связанный антиген (CRC)-С017-1А/GA 733, эмбриокарциномный антиген (СЕА) и его иммуногенный кеп антигенных детерминант 1 и кеп 2, etv 6, am 11, простат - специфичный антиген (PSA) и его иммуногенные антигенные детерминанты PSA-1, PSA-2 и PSA-3, специфичный для простаты мембранный антиген (PSMA), Т-клеточный рецептор / CD3 - зетта цепи, MAGE - семейство антигенов опухоли (например, MAGE-А1, MAGE-А2, MAGE-А3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-A11, MAGE-A12, MAGE-Xp2 (MAGE-B2), MAGE-Xp3 (MAGE-В3), MAGE-Xp4 (MAGE-В4), MAGE-С1, MAGE-С2, MAGE-С3, MAGE-С4, MAGE-С5), GAGE - семейство антигенов опухоли (например, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, GAGE-9), BAGE, RAGE, LAGE-1, NAG, Gn Т-V, MUM-1, CDK4, тирозиназа, р53, семейство MUC (например, MUC-1), HER 2/neu, р21ras, RCAS1, альфа-фетопротеин, бета-катенин, альфа-катенин, бета-катенин и гамма-катенин, р120ctn, gp100.sup. Pme 1117, PRAME, NY-ESO-1, cdc27, аденоматный полиозный поли - белок (АРС), фодрин, Connexin 37, Ig-идиотип, р15, gp 75, GM2 и GD2 ганглиозиды, вирусные продукты, такие как человеческие вирусные папилломные белки, семейство Smad антигенов опухоли. Imp-1, P1A, EBV - закодированный ядерный антиген (EBNA)-1, брэйн гликоген фосфорилаза, SSX-1, SSX-2 (НОМ-MEL-40), SSX-1, SSX-4, SSX-5, SCP-1 и ЦЕМЕНТ 7, и с-erbB-2.;
- бактериальные антигены включают, например, антигены, которые имеют происхождение из Mycobacteria, порожденнные ТВ и лепрой, пневмоцисты, аэробные грамм - отрицательные бациллы, микоплазмы, стафилококковые инфекции, стрептококковые инфекции, сальмонеллы, хламидии, нейсеррии;
- другие антигены включают, например, антигены которые имеют происхождение от малярии, лейшманиоза, трипаносомы, токсоплазмы, шистозомиазы, филлариазы;
- аллергены являются таким веществом, которое может вызвать аллергический или астматический ответ в отношении к восприимчивому субъекту. Перечень аллергенов огромен и может включать пыльцу, яды насекомого, пыль от животных, грибковые споры и лекарственные средства (например, пенициллин). Примеры естественных, животных и аллергенных растений включают, но не являются ограниченными белками


В особенно преимущественном воплощении гетерологичная последовательность нуклеотида существующего изобретения, кодирует один или больше или часть из всех следующих антигенов HBV - PreS1 PreS2 и Surface env белки, коровый и polHIV - gp120, gp40, gp160, p24, gag, pol, env, vif, vpr, vpu, tat, rev, nef; HPV - E1, E2, E3, E4, E5, E6, E7, E8, L1, L2 (см., например, примеры из WO 90/10459, WO 98/04705, WO 99/03885); HCV env белок E1 или E2, коровый белок, NS2, NS3, NS4a, NS4b, NS5a, NS5b, p7; Muc-1 (см., например, US 5861381; US 6054438; WO 98/04727; WO 98/37095).
Нуклеиновая кислота, которая кодирует антиген, является операбельно линкированной с последовательностью экспрессированного гена, которая направляет экспрессию нуклеиновой кислоты антигена в пределах эукариотической клетки. Последовательность экспрессированного гена - это любая регуляторная последовательность нуклеотида, такая как последовательность промотора или комбинация энхансер - промотор, которая облегчает эффективную транскрипцию и трансляцию нуклеиновой кислоты антигена, к операбельному линкеру. Последовательность экспрессии гена может, например, иметь отношение к млекопитающим или вирусным промоторам, таким как конститутивный или индуцибельный промотор. Конститутивные и те, которые имеют отношение к млекопитающим, промоторы включают, но не являются ограничеными, промоторы для следующих генов: гипоксантин фосфорибозил трансфераза (HPRT), аденозин деаминаза, пируават киназа, b - актиновый промотор и другие конститутивные промоторы. Среди ярких вирусных промоторов, которые функционируют конститутивным образом, в эукариотических клетках, например, являются промоторы из цитомегаловируса (CMV), обезьяноподобный вирус (например, SV40), вирус папилломы, аденовирус, вирус иммунодефицита человека (ВИЧ), вируса саркомы Роуса, цитомегаловирус, длинные терминальные повторения (LTR) вируса лейкемии Молони и другого ретровируса, и промотора киназы тимидина вируса герпеса простого. Другие конститутивные промоторы известны как таковые для средних специалистов данной отрасли техники. Среди промоторов, полезных как последовательности экспрессии гена изобретения, также являются индуцибельные промоторы. Индуцибельные промоторы экспрессированы в присутствии агента стимулирования. Например, металлотиониновый промотор вынужден способствовать транскрипции и трансляции в присутствии специфичных ионов металлов. Другие индуцибельные промоторы известны как таковые для средних специалистов данной отрасли техники. В целом же, последовательность экспрессии гена должна включать, по мере необходимости, 5' не - транскрибирующиеся и 5' не - транслирующиеся последовательности, которые являются связанными с инициированием транскрипции и трансляции, соответственно, такие как ТАТА box, последовательность кэпа, последовательность СААТ, и т.п. В особенности, такие 5' не - транскрибирующиеся последовательности будут включать регион промотора, который включает последовательность промотора для транскрипционного контроля операбельно присоединенной нуклеиновой кислоты антигена. Последовательности экспрессии гена произвольно включают последовательности энхансера или последовательности активатора в качестве преимущественных. Среди преимущественных промоторов для использования в поксвирусном векторе (см. ниже) без ограничения, используются, промоторы вируса коровьей оспы 7.5К, H5R, ТК, р28, р11 и K1L, химерные промоторы, которые расположены между ранними и поздними поксвирусными промоторами, так же как синтетические промоторы, такие, как описано в Chakrabarti и др. (1997, Biotechniques 23, 1094-1097), Hammond и др. (1997, J. Virological Methods 66, 135-138) и Kumar и Boyle (1990, Virology 179, 151-158).
Согласно другому особенному воплощению существующего изобретения, указанная гетерологичная последовательность нуклеотида кодирует все или часть антигена (ов) HPV, которые являются выбранными из группы, которая состоит из Е6, рано кодирующего региона HPV, Е7, рано кодирующего региона HPV и производных или комбинации указанного.
Антиген HPV, закодированный рекомбинантным вирусным вектором согласно изобретению, является выбранным из грппы, которая состоит из HPV Е6 полипептида, HPV Е7 полипептида или обоих, HPV Е6 полипептида и HPV Е7 полипептида. Существующее изобретение охватывает использование любого HPV Е6 полипептида, который является связанным с р53, является измененным или по крайней мере значительно уменьшенным и/или использование любого HPV Е7 полипептида, который является связанным с Rb, является измененным или по крайней мере значительно уменьшенным (Monger и др., 1989, EMBO J. 8, 4099-4105; Crook и др., 1991, Cell 67, 547-556; Heck и др., 1992, Proc. Natl. Acad. Sci. USA 89, 4442-4446; Phelps и др., 1992, J. Virol. 66, 2148-2427). У не онкогенного HPV-16 Е6 варианта, который является подходящим для целей существующего изобретения, является удаленным один или более остатков аминокислоты, которые являются расположенными от приблизительно положения 118 к приблизительно положению 122 (+1 представление первого остатка метионина нативного HPV-16 Е6 полипептида), со специальным преимуществом полного удаления остатков 118-122 (СРЕЕК). У не онкогенного HPV-16 Е7 варианта, который является подходящим для целей существующего изобретения, является удаленным один или более остатков аминокислоты, которые являются расположенными от приблизительно положения 21 к приблизительно положению 26 (+1 представление первой аминокислоты нативного HPV-16 Е7 полипептида, со специальным преимуществом полного удаления остатков от 21 к 26 (DLYCYE). Согласно преимущественному воплощению, одно или большее количеству HPV-16 раннего полипептида(-ов) в использовании для изобретения являются далее измененными для того, чтобы усилить класс I МНС и/или представление класса II МНС, и/или стимулировать анти - HPV иммунитет. HPV Е6 и Е7 полипептиды являются ядерными белками, и было ранее уже показано то, что мембранное представление разрешает усиливать их терапевтическую эффективность (см., например, WO 99/03885). Таким образом, может быть желательным изменение по крайней мере одного из HPV раннего полипептида(ов) для того, чтобы быть представленным на мембране клетки. Мембранное закрепление может быть легко реализовано путем инкорпорирования в HPV ранний полипептид мембран - презентированной последовательности и в том случае, если нативный полипептид испытывает недостаток секреторной последовательности (то есть сигнального пептида). Мембран - закрепленные и секреторные последовательности являются известными для специалистов данной отрасли техники. Вкратце, секреторные последовательности присутствуют на N - конце мембраны и являются представленными или секретированными полипептидами и их проникновение является инициированным на эндоплазматическом ретикулуме (ER). Они обычно включают 15-35 сильно гидрофобных аминокислот, которые потом могут быть разрушены определенным образом локализированной ER - эндопептидазой для того, чтобы дать возможность образоваться зрелому полипептиду. Мембран - закрепленные последовательности являются обычно сильно гидрофобными в природе и не природных условиях для того, чтобы закрепить на мембране полипептиды (см., например, Branden и Tooze, 1991, in Introduction to Protein Structure p.202-214, NY Garland).
Спектр мембран - закрепленных последовательностей и секреторных последовательностей, которые могут использоваться в контексте существующего изобретения, является широким. Они могут быть получены из любого мембранзакрепленного и/или секреторного полипептида, включающего такие полипептиды, как, например, клеточные или вирусные полипептиды, такие как гликопротеин вирусной гидрофобии, вирусный гликопротеин ВИЧ или F белок вируса кори, или могут быть синтетическими. У мембранзакрепленных последовательностей и/или секреторных последовательностей, инсертированных в каждый из ранних полипептидов HPV-16, используемых согласно изобретению, может быть общее или различное происхождение. Преимущественный участок вставки секреторной последовательности-N-терминальный конец в направлении вниз по ходу кодона для инициирования трансляции, а мембранзакрепленная последовательность является С-терминальным концом, например, по направлению вверх от стоп кодона.
HPV Е6 полипептид для использования в существующем изобретении предпочтительно изменен вставкой секреторных и мембранзакрепленных сигналов F белка кори. Произвольно или в комбинации, HPV E7 полипептид для использования в существующем изобретении предпочтительно изменен вставкой секреторных и мембранзакрепленных сигналов гликопротеина вирусной гидрофобии.
Терапевтическая эффективность рекомбинантного вирусного вектора может также быть усилена при использовании одной или более нуклеиновых кислот, кодирующих иммунопотенциирующие полипептид(ы). Например, может быть выгодно связать HPV ранний полипептид(ы) с полипептидом, таким как кальцийретикулярный полипептид (Chen и др., 2000, Cancer Res. 60, 1035-1042), убихитин (Rodriguez и др., 1997, J. Virol. 71, 8497-8503) или область перемещения бактериального токсина, такого как экхотоксин Pseudomonas (ETA(dIII)) (Hung и др., 2001 Cancer Res. 61, 3698-3703).
Согласно другому и предпочтительному воплощению существующего изобретения, рекомбинантный вирусный вектор согласно изобретению включает нуклеиновую кислоту, которая кодирует один или более ранний полипептид(ы), как было выше указано, и более подробно HPV-16 и/или HPV-18 ранние Е6 и/или полипептиды Е7.
Согласно другому специальному воплощению существующего изобретения, указанная гетерологичная последовательность нуклеотида, кодирует все или часть MUC1 антигена или производные указанного.
Если это является необходимым, то молекула нуклеиновой кислоты для использования в данном изобретении, может быть оптимизирована для того, чтобы обеспечить высокий уровень экспрессии антигена (например, HPV ранний полипептид(ы)) в специфической клетке хозяине или организме, например, в человеческой клетке хозяине или в организме. Как правило, оптимизация кодона является выполненной, заменяя один или более "нативных" (например, HPV) кодонов, которые являются соответствующими кодону, который является используемым в относящейся к млекопитающим клетке хозяине одним или более кодонами, кодирующими ту же самую аминокислоту, которая используется более часто. Это может быть достигнуто обычным мутагенезом или химическими синтетическими способами (например, приводящими к синтезу нуклеиновой кислоты). Не является необходимым заменить все нативные кодоны, соответствующие не часто используемым кодонам, так как усиленная экспрессия может быть достигнута даже с частичной заменой. Кроме того, некоторые отклонения от строгой придерженности к оптимизированному использованию кодона могут быть реализованы, если использовать введение сайта(ов) рестрикции.
Как уже было упомянуто выше, поксвирусный вектор является предпочтительным, и более определенно сильно аттенуированным штаммом вируса коровьей оспы. Определение полной последовательности генома MVA и сравнение с вирусный геном копенгагенским вирусом коровьей оспы позволило точно идентифицировать семь делеций (от I до VII), которые произошли в геноме MVA (Antoine и др., 1998, Virology 244, 365-396), любая из которых может использоваться для того, чтобы инсерцировать антиген (например, HPV ранний полипептид или MUC1), кодирующий нуклеиновую кислоту.
Основная техника, которая используется для того, чтобы инсерцировать нуклеиновую кислоту и связанные регулирующие элементы, требуемые для экспрессии в поксвирусном геноме, уже является описанной во многих документах, доступных для среднего специалиста, квалифицированного в данной отрасли техники (Paul и др., 2002, Cancer gene Ther. 9, 470-477; Piccini и др., 1987, Methods of Enzymology 153, 545-563; US 4769330; US 4772848; US 4603112; US 5100587 и US 5179993). Обычно, процедура реализуется благодаря гомологичной рекомбинации между наложившимися последовательностями (то есть желаемым сайтом рестрикции), и является представленной в вирусном геноме и в плазмиде, несущей нуклеиновую кислоту для инсерции.
Нуклеиновая кислота, которая кодирует антиген согласно существующему изобретению, является предпочтительно инсерцированной в несущественный локус поксвирусного генома для того, чтобы рекомбинантный поксвирусный ген остался жизнеспособным и инфекционным. Несущественные области не кодируют интегриновые области или любой ген, для которого инактивация или удаление значительно не ослабляют вирусный рост, репликацию или инфекцию. Можно также предусмотреть вставку в существенном вирусном местоположении при том условии, что дефектная функция будет супплиирована во время продуцирования вирусных частиц, например, при использовании клеточной линии адъюванта, несущей комплементарные последовательности, которые, соответственно, являются удаленными в поксвирусном геноме.
Можно использовать копенгагенский вирус коровьей оспы, который кодирует нуклеиновую кислоту антигена, предпочтительно вставленную в ген тимидин киназы (tk) (Hruby и др., 1983, Proc. Natl. Acad. Sci USA 80, 3411-3415; Weir и др, 1983, J. Virol. 46, 530-537). Однако, другие участки вставки являются также соответствующими, например, в гемагглютининовом гене (Guo и др., 1989, J. Virol. 63, 4189-4198), в местоположении K1L, в и гене (Zhou и др., 1990, J. Gen. Virol. 71, 2185-2190) или в левом конце генома вирус коровьей оспы, где множество непосредственных или сконструированных делеций были уже описаны в литературных источниках (Altenburger и др., 1989, Archives Virol. 105, 15-27; Moss и др. 1981, J. Virol. 40, 387-395; Panicali и др., 1981, J. Virol. 37, 1000-1010; Perkus и др., 1989, J. Virol. 63, 3829-3836; Perkus и др., 1990, Virol. 179, 276-286; Perkus и др., 1991, Virol. 180, 406-410).
При использовании MVA, которая кодирует антиген нуклеиновая кислота может быть инсерцирована в любую из идентифицированных делеций от I к VII, так же как в местоположении D 4R, но вставка в удалении II или III является предпочтительной (Меуег и др., 1991, J. Gen. Virol. 72, 1031-1038; Sutter и др., 1994, Vaccine 12, 1032-1040).
Используя вирус fowlpox, хотя вставку в пределах гена тимидин киназы можно определить, нуклеиновая кислота, которая кодирует антиген, является предпочтительно введенной в интергенную область, которая расположена между ORFs 7 и 9 (см., например, ЕР 314569 и US 51806755).
Предпочтительно, нуклеиновая кислота, которая кодирует антиген, для использования в данном изобретении, находится в форме, подходящей для ее экспрессии в клетке хозяине или организме, и это означает то, что последовательность нуклеиновой кислоты, которая кодирует антиген (например, полипептид Е6 и/или последовательность нуклеиновой кислоты, которая кодирует полипептид Е7), помещена под контроль одной или более регуляторных последовательностей, необходимых для экспрессии в клетке хозяине или организме. В том значении, как используется в данном описании, термин "регуляторная последовательность" относится к любой последовательности, которая обеспечивает, привносит или модулирует экспрессию нуклеиновой кислоты в данной клетке хозяине, включая репликацию, дупликацию, транскрипцию, сплайсинг, трансляцию, стабилизацию и/или транспортирование нуклеиновой кислоты или одной из ее производных (то есть м РНК) в клетку хозяина. Это будет высоко оценено специалистами, которые являются квалифицированными в данной отрасли техники, потому что выбор регулирующих последовательностей может зависеть от факторов, таких как клетка хозяин, вектор и уровень желательной экспрессии.
Промотор имеет особое значение, и существующее изобретение охватывает использование конститутивных промоторов, которые непосредственно обеспечивают экспрессию нуклеиновой кислоты во многих типах клеток хозяина, и тех, которые непосредственно обеспечивают экспрессию только в специфичных клетках хозяина или в ответ на специфические явления или внешние факторы (например, температура, пищевые добавки, гормоны или другие лиганды). Подходящие промоторы широко описаны в литературных источниках, можно указать, более точно, такие вирусные промоторы, как RSV, SV40, CMV и промоторы MLP. Среди преимущественных промоторов для использования в поксвирусных векторах, но, не ограничиваясь ими, - это промоторы вируса коровьей оспы 7.5К, H5R, ТК, р28, р11 и K1L, химерные промоторы между ранними и поздними поксвирусными промоторами, а также, такие, как синтетические промоторы, такие как промоторы, которые описаны в Chakrabarti и др. (1997, Biotechniques 23, 1094-1097), Hammond и др. (1997, J. Virological Methods 66, 135-138) и Kumar и Boyle (1990, Virology 179, 151-158).
Специалисты, которые являются квалифицированными в данной отрасли техники, будут ценить то, что регулирующие элементы, которые контролируют экспрессию молекулы нуклеиновой кислоты согласно данному изобретению, могут далее включать дополнительные элементы для последующей инициации, регулирования и/или терминации транскрипции (например, поли А последовательности терминации транскрипции), транспорта м РНК (например, ядерные последовательности сигнальной локализации), процессинга (например, сплайсирующие сигналы), и стабилизации (например, интроны и некодирующие 5' и 3' последовательности), трансляции (например, сигнальные пептиды, пропептиды, трехсторонние лидерные последовательности, связывающие участки рибосомы, последовательности Шайн-далгамо, и т.д.) клетки хозяина или организма.
В альтернативном варианте, рекомбинантный вирусный вектор для использования в данном изобретении может далее включать по крайней мере одну нуклеиновую кислоту, которая кодирует по крайней мере один цитокин. Подходящие цитокины включают без ограничения IL-2, IL-7, IL-15, IL-18, IL-21 и IFN гамма, с преимущественным предпочтением IL-2. Те случаи, когда рекомбинантная вирусная вакцина, согласно данному изобретению, включает экспрессирующую цитокин нуклеиновую кислоту, указывают на то, что нуклеиновую кислоту может нести рекомбинантный вирусный вектор, кодирующий тот или иной HPV ранний полипептид(ы) или независимый рекомбинантный вектор, который может иметь то же самое или иное происхождение.
Преимущественное воплощение данного изобретения направлено на использование рекомбинантной вирусной вакцины, включающей вектор MVA, кодирующий HPV Е6 полипептид, помещенный под 7.5К промотор, HPV Е7 полипептид, помещенный под 7.5К промотор и ген человеческого IL-2, помещенный под контролем промотора Н 5R. Предпочтительно, нуклеиновые кислоты, кодирующие HPV Е6 полипептид, HPV Е7 полипептид и человеческий IL-2, являются инсерцированными в делению III генома MVA.
Другое преимущественное воплощение данного изобретения направлено на использование рекомбинантной вирусной вакцины, включающей вектор MVA, кодирующий MUC1 полипептид, помещенный под 7.5К промотор, и ген человека IL-2, помещенный под контролем промотора H5R.
Инфекционные вирусные частицы, включающие вышеописанный рекомбинантный вирусный вектор, могут быть произведены обычным способом. Тпичный способ включает шаги:
а) введение вирусного вектора в подходящую клеточную линию,
b) культивирование указанной клеточной линии при подходящих условиях для того, чтобы дать возможность продуцировать указаннные инфекционные вирусные частицы,
с) восстановление произведенной инфекционной вирусной частицы из культуры указанной клеточной линии, и
d) оптимальная очистка указанных восстановленных инфекционных вирусных частиц.
Клетки, которые являются соответствующими для того, чтобы размножить поксвирусные векторы, являются птичьими клетками, и наиболее предпочтительно первичными эмбрионами куриных фибробластов (СЕF), подготовленными из куриных эмбрионов, полученных из оплодотворенных яйцеклеток.
Инфекционные вирусные частицы могут быть восстановлены от супернатанта культуры или из клеток после лизиса (например, химическими средствами, замораживанием / размораживанием, осмотическим шоком, механическим воздействием, соникацией и т.п.). Вирусные частицы могут быть изолированы последовательными этапами очистки и затем последующей очисткой с использованием способов, известных в данной отрасли (хроматографические способы, ультрацентрифугирование в хлориде цезия или градиенте сахарозы).
Согласно другому воплощению, 1Н-имидазо[4,5-с]хинолин-4-амин-производная согласно существующему изобретению - это соединение, который является выбранным из одной из следующих общих формул I-V:

или аналоги, сольваты или соли указанного, причем
R11 является выбранным из группы, которая состоит из неразветвленного или разветвленного алкила, гидроксиалкила, бензила, (фенил) этила и фенила, указанного бензила, (фенил) этила или заместителя фенила, произвольно замещенного на бензольное кольцо одного или двух радикалов, которые являются выбранными, независимо друг от друга, из группы, которая состоит из С1-4 алкильного радикала, С1-4 алкоксильного радикала и галогена, при том условии что, если указанное бензольное кольцо является замещенным двумя из указанных радикалов, то указанные радикалы вместе содержат не больше, чем 6 атомов углерода;
R21 является выбранным из группы, которая состоит из водорода, С1-8 алкильного радикала, бензила, (фенил) этила и фенила, бензил, (фенил) этила или заместителя фенила, произвольно замещенного на бензольное кольцо одного или двух радикалов, которые являются выбранными, независимо от друг друга, из группы, которая состоит из С1-4 алкильного радикала, С1-4 алкоксильного радикала и галогена, при том условии, что, если указанное бензольное кольцо заменено двумя из указанных радикалов, то указанные радикалы вместе содержат не больше, чем 6 атомов углерода;
и каждый R1 является выбранным, независимо друг от друга, из группы, которая состоит из водорода, С1-4 алкоксильного радикала, галогена и С1-4 алкоксильного радикала, и где n - это целое число от 0 до 2, при том условии, что если n равняется 2, то указанный R1 является сгруппированным и таким, что содержит не больше, чем 6 атомов углерода;
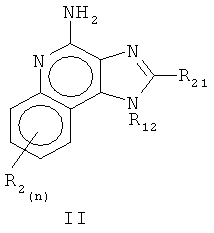
или аналоги, сольваты или соли указанного,
причем
R12 является выбранным из группы, которая состоит из неразветвленного или разветвленного С2-10 алкенила, и замененным на неразветвленный или разветвленный С2-10 алкенил, причем заместитель является выбранным из группы, которая состоит из неразветвленного или разветвленного алкильного радикала С1-4 и циклоалкильного радикала С3-6; и циклоалкильного радикала С3-6, которой является замещенным неразветвленным или разветвленным алкильным радикалом C1-4; и
R22 является выбранным из группы, которая состоит из водорода, неразветвленного или разветвленного С1-8 алкильного радикала, бензила, (фенил) этила и фенила, бензил, (фенил) этила или заместителя фенила, произвольно замещенного на бензольное кольцо одного или двух радикалов, которые являются выбранными, независимо друг от друга, из группы, которая состоит из неразветвленного или разветвленного C1-4 алкильного радикала, неразветвленного или разветвленного C1-4 алкоксильного радикала и галогена, при том условии, что, если указанное бензольное кольцо заменено двумя из указанных радикалов, то указанные радикалы вместе содержат не больше, чем 6 атомов углерода;
и каждый R2 является выбранным, независимо от друг друга, из группы, которая состоит из водорода, неразветвленного или разветвленного C1-4 алкоксильного радикала, галогена и неразветвленного или разветвленного C1-4 алкоксильного радикала, и где n - это целое число от 0 до 2, при том условии, что, если n равняется 2, то указанный R2 является сгруппированным и таким, что содержит не больше, чем 6 атомов углерода;
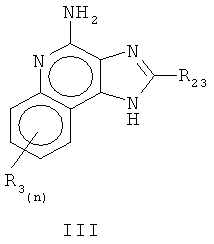
или аналоги, сольваты или соли указанного, причем
R23 является выбранным из группы, которая состоит из водорода, неразветвленного или разветвленного С1-8 алкильного радикала, бензила, (фенил) этила и фенила, бензил, (фенил) этила или заместителя фенила, произвольно замещенного на бензольное кольцо одного или двух радикалов, которые являются выбранными, независимо друг от друга, из группы, которая состоит из неразветвленного или разветвленного C1-4 алкильного радикала, неразветвленного или разветвленного C1-4 алкоксильного радикала и галогена, при том условии, что, если указанное бензольное кольцо заменено двумя из указанных радикалов, то указанные радикалы вместе содержат не больше, чем 6 атомов углерода;
и каждый R3 является выбранным, независимо друг от друга, из группы, которая состоит из водорода, неразветвленного или разветвленного C1-4 алкоксильного радикала, галогена и неразветвленного или разветвленного C1-4 алкоксильного радикала, и n - это целое число от 0 до 2, при том условии, что, если n равняется 2, то указанный R2 является сгруппированным и таким, что содержит не больше, чем 6 атомов углерода;
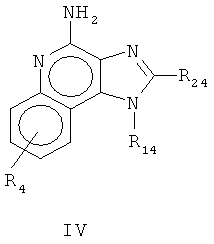
или аналоги, сольваты или соли указанного,
причем
R14 является представленным CHR34R44, причем R44 - это водород или карбон -карбоновое соединение, при том условии, что когда R44 является водородом, R34 является C1-4 алкоксильным радикалом, C1-4 гидроксиалкильным радикалом, С2-10 1-алкинильным радикалом, тетрагидропиранилом, алкоксиалкилом, причем алкоксильный радикал является содержащим от одного до четырех углеродных атомов, и алкиловый радикал содержит от одного до четырех углеродных атомов, 2-, 3- или 4-пиридил, и при таком дальнейшем условии, что, когда R44 является карбон-карболовым соединением, то R44 и R34 вместе образуют тетрагидрофураниловую группу, которая произвольно является замещенной на один или более заместителей, которые являются независимо друг от друга выбранными из группы, которая состоит из гидрокси и C1-4 гидроксиалкильного радикала;
R24 является выбранным из группы, которая состоит из водорода, C1-4 алкила, фенила, причем фенил произвольно является замещенным на один или два радикала, которые независимо друг от друга являются выбранными из группы, которая состоит из неразветвленного или разветвленного C1-4 алкильного радикала, неразветвленного или разветвленного C1-4 алкоксильного радикала и галогена;
и R4 является выбранным из группы, которая состоит из водорода, неразветвленного или разветвленного C1-4 алкоксильного радикала, галогена и неразветвленного или разветвленного C1-4 алкоксильного радикала;
или аналоги, сольваты или соли указанного,
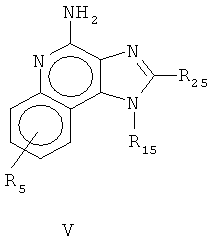
причем
R15 является выбранным из группы, которая состоит из водорода; неразветвленного или разветвленного С1-10 алкильного радикала и замещенного неразветвленного или разветвленного С1-10 алкильного радикала, причем заместитель является выбранным из группы, которая состоит из С3-6 циклоалкила и С3-6 циклоалкила замещенного неразветвленного или разветвленного C1-4 алкоксильного радикала; неразветвленного или разветвленного С2-10 алкенильного радикала, причем заместитель является выбранным из группы, которая состоит из С3-6 циклоалкила и С3-6 замещенного циклоалкила неразветвленным или разветвленным C1-4 алкильным радикалом; С1-6 гидроксиалкила; алкоксиалкила, причем алкоксильный радикал содержит от одного до приблизительно четырех атомов углерода, и алкильный радикал содержит от одного до приблизительно шести атомов углерода; циклоалкила, причем ацилоксильный радикал является представленным алканилоксилом с приблизительно двумя атомами углерода или бензоилоксилом, и алкилированный радикал содержит от одного до приблизительно шести атомов углерода; бензила; (фенил) этила; и фенила; указанный бензил, (фенил) этил или заместитель фенила, произвольно являются замещенными в бензольном кольце одним или двумя радикалами, которые являются выбранными, независимо друг от друга, из группы, которая состоит из C1-4 алкильного радикала, C1-4 алкоксильного радикала, и галогена, при том условии, что когда указанное бензольное кольцо является замещенным на два из указанных радикала, тогда оба радикала вместе содержат не больше, чем шесть атомов углерода;
R25 является представленным
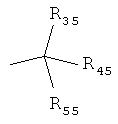
причем
R35 является выбранным из группы, которая состоит из C1-4 алкоксильного радикала, алкоксиалкила, причем алкоксильный радикал содержит от одного до приблизительно четырех атомов углерода; C1-4 алкоксильного радикала; алкиламидо, причем алкильная группа содержит от одного до приблизительно четырех атомов углерода; амино; амино замещенного C1-4 алкила или C1-4 гидроксиалкила; азидо; C1-4 алкилтио;
R55 и R45 являются выбранными, независимо из друг друга, из группы, которая состоит из водорода, C1-4 алкила, фенила, причем где указанный фенил является произвольно замещенным на один или два радикала, которые являются выбранными, независимо друг от друга, из группы, которая состоит из неразветвленного или разветвленного C1-4 алкильного радикала, неразветвленного или разветвленного C1-4 алкоксильного радикала и галогена;
R5 является выбранным из группы, которая состоит из водорода, неразветвленного или разветвленного C1-4 алкоксильного радикала, галогена, и неразветвленного или разветвленного С1-4 алкильного радикала.
Согласно отдельному воплощению, C1-4 алкильный радикал является, например представленным метилом, этилом, пропилом, 2-метил пропилом и бутилом. Согласно преимущественному воплощению, C1-4 алкильный радикал является, например представленным таким образом, что выбран из группы, которая состоит из метила, этила и 2-метил пропила.
Согласно отдельному воплощению, алкоксильный радикал является представленным таким образом, что выбран из группы, которая состоит из метокси, этокси и этокси метила.
Согласно преимущественному воплощению, n является представленным нолем или единицей.
Согласно преимущественному воплощению, группы R1-R5 являются представленными водородом.
Согласно преимущественному воплощению, группы R11-R15 являются представленными таким образом, что выбраны из группы, которая состоит из 2-метил пропила и 2-гидрокси-2-метил пропила.
Согласно преимущественному воплощению, группы R21-R25 являются представленными таким образом, что выбраны из группы, которая состоит из водорода, С1-6 алкильного радикала, алкокси алкила, причем, алкоксильный радикал содержит от одного до приблизительно четырех атомов углерода, и алкильный радикал содержит от одного до приблизительно четырех атомов углерода. В наиболее преимущественном воплощении группы R21-R25 являются представленными таким образом, что выбраны из группы, которая состоит из водорода, метила или этокси метила.
Согласно одному преимущественному воплощению, 1Н-имидазо[4,5-с]хинолин-4-амин-производное существующего изобретения является представленным соединением, который является определенным следующей общей формулой VI:
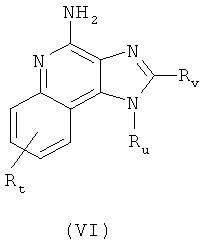
или аналоги, сольваты или соли указанного,
причем
Rt является выбранным из группы, которая состоит из водорода, неразветвленного или разветвленного C1-4 алкоксильного радикала, галогена, и неразветвленного или разветвленного C1-4 алкильного радикала;
Ru является представленным 2-метил пропилом или 2-гидрокси-2-метил пропилом; и
Rv является представленным водородом, С1-6 алкилом, или алкоксиалкилом, причем алкоксильный радикал содержит от одного до приблизительно четырех атомов углерода, и алкильный радикал содержит от одного до приблизительно четырех атомов углерода.
Согласно преимущественному воплощению, в формуле VI Rt является представленным водородом, Ru является представленным 2-метил пропилом или 2 гидрокси-2-метил пропилом, и Rv является представленным водородом, метилом или этокси метилом.
Согласно другому преимущественному воплощению, 1Н-имидазо[4,5-с]хинолин-4-амин производное существующего изобретения является представленным соединением, которое выбрано из следующей группы:
1-(2-метил пропил)-1Н-имидазо[4,5-с]хинолин-4-амин (соединение формулы VI, в котором Rt является представленным водородом, Ru является представленным 2 -метил пропилом и Rv является представленным водородом);
1-(2-гидрокси-2-метил пропил)-2-метил-1Н-имидазо[4,5-с]хинолин-4-амин (соединение формулы VI, в котором Rt является представленным водородом, Ru является представленным 2-гидрокси-2-метил пропилом, и Rv является представленным метилом;
1-(2-гидрокси-2-метил пропил)-1Н-имидазо[4,5-с]хинолин-4-амин (соединение формулы VI, в котором Rt является представленным водородом, Ru является представленным 2-гидрокси-2-метил пропилом, и Rv является представленным водородом);
1-(2-гидрокси-2-метил пропил-2-этокси метил-1-Н-имидазо[4,5-с]хинолин-4-амин (соединение формулы VI, в котором Rt является представленным водородом, Ru является представленным 2-гидрокси-2-метил пропилом, и Rv является представленным этокси метилом);
или аналоги, сольваты или соли указаного.
Средние специалисты, которые являются квалифицированными в данной отрасли техники, могут обратиться, например, к US 4689338, US 4929624, EP 0385630 или WO 94/17043 (которые включены в данное описание в качестве ссылки), в которых описаны соединения, о которых было упомянуто выше и способы, подходящие для их получения.
Более конкретно, 1-(2-метил пропил)-1Н-имидазо[4,5-с]хинолин-4-амин (также известный под названием имихимод или Aldara) был подробно описан, в качестве ссылки, могут быть, приведены Buck, 1998, Infect. Dis. Obstet. Gynecol., 6, 49-51; Dockrell и Kinghorn, 2001, J. Antimicrob. Chemother., 48, 751-755 или Garland, 2003, Curr. Opin. Infect. Dis., 16, 85-89; 1-(2-гидрокси-2-метил пропил)-2-метил-1Н-имидазо[4,5-с]хинолин-4-амин и 1-(2-гидрокси-2-метил пропил)-1Н-имидазо[4,5-с]хинолин-4-амин был раскрыт в US 2004/0076633, и 1-(2-гидрокси-2-метил пропил)-2-этоксиметил-1-Н-имидазо[4,5-с]хинолин-4-амин (также известный под названием резиквимод) описан в Dockrell и Kinghorn, 2001, J. Antimicrob. Chemother. 48, 751-755 или Jones, Curr. Opin. Investig. Drugs., 2003, 4, 214-218.
Если иначе не обозначено, то указание на 1Н-имидазо[4,5-с]хинолин-4-амин-производное может иметь в виду то, что оно включает в свой состав любую фармацевтически приемлемую форму, включая любой изомер (например, диастереомер или энантиомер), соль, сольват, полиморф и т.п. В частности, в том случае, если состав является оптически активным, то указание на соединение включает в его состав каждый из энантиомеров состава так же, как рацемические смеси энантиомеров.
Согласно одному преимущественному воплощению, рекомбинантная вирусная вакцина и более подробно рекомбинантный вирусный вектор не включают иммуностимулирующие средства или основу, которая вызывает отдельно имунную реакцию, особенно последовательность нуклеотида, которая обладает иммуностимулирующими свойствами или основу, такую как Ср G, поли G, поли Т, ТG, метилированный Ср G, Ср I и Т или фосфортиолатовые основы (см. содержание US 2003/0139364, US 6207646 или WO 01/22972, которые включены в данное описание в качестве ссылки).
Согласно одному воплощению, концентрация 1Н-имидазо[4,5-с]хинолин-4-амин производной в конечной рекомбинантной вирусной вакцине будет приблизительно от 0.0001% приблизительно до 10% (если иначе не обозначено, все проценты, которые указаны здесь, означают вес/вес относительно всей композиции), приблизительно от 0.01% приблизительно до 2%, более подробно от приблизительно 0.06 приблизительно до 1%, предпочтительно от приблизительно 0.1 приблизительно до 0.6%.
Согласно другому воплощению, соответствующая дозировка рекомбинантного вирусного вектора может быть отображена в качестве функции различных параметров, в особенности способ введения; используемый состав; возраст, состояние здоровье, и вес организма хозяина; природа и степень признаков; вид параллельного лечения; частота лечения; и/или потребность в профилактике или терапии. Дальнейшая обработка вычислений, необходимых для того, чтобы определить соответствующую дозировку для лечения, обычно делается на практике, в свете соответствующих обстоятельств. Для общего руководства подходящая дозировка для MVA -содержащего состава изменяется приблизительно от 104-1010 pfu (бляшко образующая единица), по желанию приблизительно от 105 и 108 pfu, тогда как включающий аденовирус состав изменяется приблизительно от 105-1013 iu (инфекционные единицы), по желанию приблизительно от 107 и 1012 iu. Составы, которые основаны на векторных плазмидах, можно назначать в дозах между 10 мкг и 20 мг, полезно между 100 мкг и 2 мг. Преимущественный состав назначают в дозе (ах), включающей от 5×105 pfu до 5×107 pfu вектора вируса коровьей оспы MVA.
Режим дозирования может зависеть, по крайней мере частично от многих факторов, известных для специалиста, квалифицированного в данной отрасли техники, которые включают, но не являются ограниченными, природой имидазо[4,5-с]хинолин-4-амин производной и используемым рекомбинантным вирусным вектором, природой носителя, количеством имидазо[4,5-с]хинолин-4-амин производной и применением рекомбинантного вирусного вектора, состоянием иммунной системы суббъекта (например, подавленный, находящийся под угрозой, стимулируемый), и способом применения имидазо[4,5-с]хинолин-4-амин производной и/или рекомбинантпых вирусных векторных составов. Соответственно это не является практичным, чтобы сформулировать вообще режим дозирования, который будет эффективным, для того, чтобы усилить эффективность рекомбинантной вирусной вакцины для всех возможных применений. Таковые являются известными для специалиста, квалифицированного в данной отрасли техники, однако, могут быть определены для соответствующего режима дозирования с определенным учетом некоторых факторов. В некоторых воплощениях существующего изобретения имидазо[4,5-с]хинолин-4-амин производные и/или рекомбинантные вирусные векторные составы можно применять, например, единожды, приблизительно один раз в день, хотя в некоторых воплощениях имидазо[4,5-с]хинолин-4-амин производные и/или рекомбинантные вирусные векторные составы можно применять так часто, что будет отличаться от указанного диапазона. В специфичных воплощениях имидазо[4,5-с]хинолин-4-амин производные и/или рекомбинантные вирусные векторные составы можно применять приблизительно от одного раза в неделю до приблизительно одного раза в день. В одном специфическом воплощении имидазо[4,5-с]хинолин-4-амин производные и/или рекомбинантные вирусные векторные составы применяют один раз каждую неделю. По желанию, имидазо[4,5-с]хинолин-4-амин производные и/или рекомбинантные вирусные векторные составы применяют 1-10 раз с интервалом в одну неделю. Предпочтительно, имидазо[4,5-с]хинолин-4-амин производные и/или рекомбинантные вирусные векторные составы, или любой состав, содержащий указанные, применяют 3 раза с еженедельным интервалом путем введения под кожу.
В дальнейшем аспекте существующее изобретение обеспечивает способ усиления иммунного ответа на антиген у пациентов, при этом указанный способ включает введение, или последовательно или одновременно, (i) рекомбинантного вирусного вектора, который экспрессирует в условиях in vivo по крайней мере одну гетерологичную последовательность нуклеотида, особенно гетерологичную последовательность нуклеотида, который кодирует антиген и (ii) имидазо[4,5-с]хинолин-4-амин производную.
В другом аспекте существующее изобретение обеспечивает способ профилактики возникновения и/или лечения рака у пациента, при этом указанный способ включает введение, или последовательно или одновременно, (i) рекомбинантного вирусного вектора, который экспрессирует в условиях in vivo по крайней мере одну гетерологичную последовательность нуклеотида, особенно гетерологичную последовательность нуклеотида, который кодирует антиген и (ii) имидазо[4,5-с]хинолин-4-амин производную.
В другом аспекте существующее изобретение обеспечивает способ профилактики возникновения и/или лечения инфекционного заболевания у пациента, при этом указанный способ включает введение, или последовательно или одновременно, (i) рекомбинантного вирусного вектора, который экспрессирует в условиях in vivo по крайней мере одну гетерологичную последовательность нуклеотида, особенно гетерологичную последовательность нуклеотида, который кодирует антиген и (ii) имидазо[4,5-с]хинолин-4-амин производную. Согласно преимущественному воплощению существующего изобретения указанное инфекционное заболевание является заболеванием, которое является вызванным вирусом, таким как, например, заболевания, которые вызваны ВИЧ, HCV, HBV, HPV и т.п.
В дальнейшем воплощении существующее изобретение обеспечивает использование имидазо[4,5-с]хинолин4-амина производной для изготовления рекомбинантной вирусной вакцины для усиления иммунного ответа на антиген, закодированный рекомбинантным вирусным вектором, при этом указанный рекомбинантный вирусный вектор, является введенным или последовательно или одновременно с указанной производной.
"Вводимый последовательно" в значении, которое используется в данном описании, означает то, что рекомбинантный вирусный вектор [состав (i)] и имидазо[4,5-с]хинолин 4-амина производная [состав (ii)] существующей рекомбинантной вирусной вакцины вводятся независимо от друг друга; например, первое введение одного из упомянутых составов и отдельное второе введение, состоящее во введении второго состава. Согласно существующему изобретению, первое введение может быть сделано до, одновременно с или последующим за вторым введением, и наоборот. Терапевтическое введение состава и второе введение могут быть выполнены различными или идентичными путями введения (системное введение и дробное введение, или системно-дробные введения, например). В преимущественном воплощении каждый должен быть поставлен в ту же самую целевую ткань и, что является наиболее предпочтительным, парентеральным путем введения.
В преимущественном воплощении введение рекомбинантного вирусного вектора и имидазо[4,5-с]хинолин-4-амин производной являются по сути одновременными. И более предпочтительно, оба состава являются со - вводимыми.
В другом воплощении имидазо[4,5-с]хинолин-4-амин производную вводят перед применением рекомбинантного вирусного вектора. В этом специальном воплощении, "перед" средствами должно пройти приблизительно от 5 минут приблизительно до 2 недель, более подробно приблизительно от 1 часа приблизительно до 1 недели, более подробно приблизительно от 6 часов до приблизительно 48 часов.
Рекомбинантную вирусную вакцину согласно существующему изобретению вводят пациенту как фармацевтически приемлемый раствор, который может обычно содержать фармацевтически приемлемые концентрации соли, буферизующие агенты, консерванты, совместимые носители, адьюванты (например, квасцы, BCG, свободные модификаторы ответа), и, произвольно, другие терапевтические компоненты.
Термин «фармацевтически приемлемый носитель» в значении, которое является использукемым в данном описании, подразумевает один или более совместимых твердых или жидких наполнителей, разжижителей или веществ, которые являются заключенными в капсулу, и которые являются подходящими для применения для человека или другого позвоночного животного. Термин «носитель» в значении, которое является используемым в данном описании, подразумевает органический или неорганический компонент, естественный или синтетический, с которым активный компонент объединен для того, чтобы облегчить применение. Компоненты фармацевтических составов также могут быть способны к тому, чтобы быть смешанными с составами существующего изобретения, и друг с другом, таким образом, чтобы между ними не было никакого взаимодействия, которое существенно ослабило бы желаемую фармацевтическую эффективность.
Рекомбинантная вирусная вакцина может быть введена любым обычным путем введения, которые используются для того, чтобы вводить лекарства. Многие из путей введения являются доступными. Специфически выбранный путь введения будет зависеть, конечно, от специфического рекомбинантного вирусного содержимого вакцины, специфических условий, которые будут рассмотрены и дозировки, которая будет необходима для терапевтической эффективности. Способы этого изобретения, вообще говоря, могут быть осуществлены таким образом, что если использовать любой способ введения, который является с медицинской точки зрения приемлемым, и это означает любой способ, который дает эффективные уровни иммунного ответа, не вызывая при этом клинически недопустимые отрицательные воздействия. Преимущественные способы применения обсуждены в данном описании. Для использования в терапевтически эффективном количестве 1Н-имидазо[4,5-с]хинолин-4-амин производная может быть введена пациенту любым способом, который поставляет агент на желаемую поверхность, например, на слизистую оболочку, системно или в любой другой форме, например, в форме крема, в форме раствора.
Рекомбинантная вирусная вакцина, или ее отдельные составы (i) и (ii), может использоваться согласно изобретению множеством способов применения, включая системное, местное и локальное применение. Инъекция может быть выполнена каким-либо образом, например под кожу, внутрь кожи, внутрь мышц, внутрь вены, внутрь брюшины, внутрь опухоли, внутрь сосуда, внутрь артерии инъекциями или прямой инъекцией в артерию (например, вливанием в печеночную артерию) или в вену, которая входит в печень (например, инъекция в портальную вену). Инъекции могут быть осуществлены обычными для вены сиринксами и иглами, или любыми другими соответствующими устройствами, доступными для специалиста, квалифицированного в данной отрасли техники. Альтернативно, активный состав или любой состав, содержащий указанное, можно вводить путем проникновения через слизистую оболочку, такую как пероральный / через пищевой тракт, через нос, внутри трахеальный, внутри легочный, внутри влагалищный или внутри ректальный пути введения. Актуальное применение может также быть выполнено, используя трансдермальные средства (например, в форме крема, сливок и т.п.). В контексте существующего изобретения внутримышечные и подкожные пути введения составляют преимущественные пути введения.
Для орального применения рекомбинантная вирусная вакцина может быть сформулирована таким образом, что активный состав(ы) является скомбинированным с фармацевтически приемлемыми носителями, известными для специалистов, квалифицированных в данной отрасли техники. Такие носители позволяют составам согласно данного изобретения быть сформулированными в таком виде, как таблетки, пилюли, драже, капсулы, жидкости, гели, сиропы, жидкие растворы, суспензии и т.п., в виде орального приема пациентом, которого будут лечить. Фармацевтические препараты для орального использования могут быть получены благодаря добавлению таких добавок, как твердый наполнитель, произвольно размолотый в полученную смесь, и обработанный в смесь гранул, после добавления подходящих вспомогательных добавок, если желательно получить ядра драже или таблетки. Подходящие наполнители представлены, в частности наполнителями, такими как сахар, включая лактозу, сахарозу, маннит, или сорбитол, препараты целлюлозы такие как, например, крахмал кукурузы, крахмал пшеницы, крахмал риса, картофельный крахмал, желатин, резина траггакант, метилцеллюлоза, гидроксипропилметил - целлюлоза, натрий карбокси метилцеллюлоза, и/или поливинилпирролидон (PVP). Если желательно, могут быть добавлены дезинтегрирующие агенты, такие как поперечно связанный поливинилпирролидон, агар, или альгиновая кислота или соль указанных, такая как альгинатный натрий. Произвольно оральные композиции могут также быть сформулированы в pane или буферах для того, чтобы нейтрализовать внутренние кислотные воздействия или могут быть введены без каких бы то ни было носителей. Рекомбинантная вирусная вакцина, которая может использоваться орально, включает твердые капсулы, сделанные из желатина, так же как и мягкие, запечатанные капсулы, сделанные из желатина и пластификатора, таких как глицерин или сорбитол. Пригодные твердые капсулы могут содержать активные компоненты в примеси с наполнителем, таким как лактоза, связывающие агенты, такие как крахмалы, и/или смазки, такие как тальк или стеарат магния и, произвольно, стабилизаторы. В мягких капсулах активные составы могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий керосин, или жидкие гликоли полиэтилена. Кроме того, могут быть добавлены стабилизаторы. Микросферы, сформулированные для орального применения, также могут быть использованы. Такие микросферы были хорошо раскрыты у данной отрасли техники. Все композиции для орального применения должны присутствовать в дозировках, подходящих для такого применения.
Рекомбинантная вирусная вакцина в том случае, когда является необходимой системная доставка, может быть сформулирована для парентерального введения инъекцией, например, болюсным вливанием или непрерывным вливанием. Композиции для инъекции могут быть представлены в форме дозированной единицы, например, в ампулах или в контейнерах мультидозы, с добавленным консервантом. Рекомбинантная вирусная вакцина может иметь такие формы как суспензии, растворы или эмульсии в масляных или водных везикулах, и может содержать вспомогательные вещества, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Рекомбинантная вирусная вакцина для парентерального введения включает водные растворы активных составов в растворимой в воде форме. Дополнительно, суспензии активных составов (i) и/или (ii) могут быть подготовлены как соответствующие масляные суспензии для инъекции. Подходящие липофильные растворители или везикулы включают жирные масла, такие как кунжутное масло, или синтетические эстеры жирных кислот, такие как этил олеат или триглицериды, или липосомы. Водные суспензии для инъекции могут содержать вещества, которые увеличивают вязкость суспензии, такие как натрий карбоксиметил целлюлоза, сорбитол, или декстран. Произвольно, суспензия может также содержать подходящие стабилизаторы или такие агенты, которые увеличивают растворимость составов для того, чтобы обеспечить приготовление сильно сконцентрированных растворов.
Альтернативно, активные составы (i) и/или (ii) могут быть в порошковой форме для объединения перед использованием с подходящими везикулами, например, стерильной апирогенной водой. Рекомбинантная вирусная вакцина может также быть сформулирована в ректальных или влагалищных составах, таких как свечи или клизмы, например, содержащие обычные основы для свечей, такие как масло какао или другие глицериды. В дополнение к рекомбинантной вирусной вакцине, можно также приготовить и депо-препарат. Такие длительно сохраняющие активность композиции могут быть сформулированы с подходящими полимерными или гидрофобными материалами (например, такими как эмульсия в приемлемом масле) или смолы, получаемые путем ионного обмена, или как умеренно растворимые производные, например, как умеренно растворимая соль. Рекомбинантная вирусная вакцина также может включать подходящую твердую фазу или гелевый носитель или наполнитель. Примеры таких носителей или наполнителей включают, но не являются ограниченными, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатины, и полимеры, такие как гликоли полиэтилена.
Подходящие жидкие или твердые формы рекомбинантной вирусной вакцины являются, например, водными или солевыми растворами для ингаляции, микро инкапсулированными, хелатированными, нанесенными на микроскопические золотые частицы, содержавшиеся в липосомах, распыленными, аэрозолями, пеллетами для имплантации в кожу, или высушенными контрастными объектами, которые будут введены в кожу. Фармацевтические составы также включают гранулы, порошки, таблетки, покрытые таблетки, (микро) капсулы, свечи, сиропы, эмульсии, суспензии, кремы, лекарства или препараты с длительным высвобождением активных составов, в которых присутствуют вспомогательные добавки и наполнители такие, как дезинтегрирующие агенты, связующие агенты, агенты для покрытия, агенты для вспучивания, смазки, красители, подслащивающие вещества или солюбилизаторы, которые обычно используются так, как описано выше.
1Н-имидазо[4,5-с]хинолин-4-амин производная может быть введена по сути или в форме фармацевтически приемлемой соли. В тех случаях, когда используют фармацевтически приемлемые в медицине соли, они должны быть таковыми, но не фармацевтически приемлемыми солями, и могут быть использованы для того, чтобы подготовить фармацевтически приемлемые соли указанной производной. Такие соли включают, но не являются ограниченными, полученные из следующих кислот: хлористоводородная, гидробромистая, серная, азотная, фосфорная, малеиновая, уксусная, салициловая, р-толуол сульфоновая, винная, лимонная, метан сульфоновая, муравьиная, малоновая, сукциновая, нафтален-2-сульфоновая, и бензол сульфоновая. Кроме того, такие соли могут быть получены как щелочные металлические или щелочные земельные соли, такие как натрий, калий или соли кальция карбоксильной кислотной группы.
Подходящие буферизующие агенты включают следующее: уксусная кислота и соль (1-2% в/в); лимонная кислота и соль (1-3% в/в); борная кислота и соль (0.5-2.5% в/в); и фосфорная кислота и соль (0.8-2% в/в). Подходящие консерванты включают бензалконий хлорид (0.003-0.03% в/в); хлор бутанол (0.3-0.9% в/в); парабены (0.01-0.25% в/в) и тимеросал (0.004-0.02% в/в).
Рекомбинантная вирусная вакцина может удобно быть представлена в форме дозированной единицы и может быть подготовлена любым из способов, известных в фармацевтической отрасли техники. Все способы включают этап обеспечения составов (i) и (ii) в объединение с носителем, который составляет один или более дополнительных компонентов. Вообще, составы являются подготовленными однородными и тщательными при помощи составов путем ассоциирования с жидким носителем, потом разделенные твердым носителем, или обоими, и затем, в случае необходимости, с формированием продукта. Для жидких - единицами дозирования являются пузырьки или ампулы. Для твердых - единицами дозирования являются таблетки, капсулы и свечи. Для лечения пациента, в зависимости от активности состава, способа введения, цели иммунизации (то есть является это профилактикой или терапией), природы и серьезности заболевания, возраста и массы тела пациентов, могут различаться формы введения. Введение данной дозы может быть выполнено обоими способами, одноразовым введением в форме отдельной единицы дозы или другим способом в несколько меньших единицах дозы. Многократные введения доз в специфичных интервалах недель или месяцев, типично применяются для повышения специфичных антигенных реакций.
Другие системы доставки могут включать зависящие от времени, отсроченные введения или поддерживающие системы доставки лекарственного средства. Такие системы могут избежать повторных введений составов рекомбинантной вирусной вакцины, увеличивая удобство для пациента и для врача. Много типов систем доставки лекарственного средства доступны и являются уже известными для среднего специалиста, который квалифицирован в данной отрасли техники. Они включают системы, которые являются основанными на полимере, такие как поли (лактид-гликоцид), сополиоксадлаты, поликапролактоны, полиэстерамиды, полиортоэстеры, полигидроксибутировая кислота и полиангидриды. Микрокапсулы указанных полимеров, содержащих лекарственные средства, описаны в, например, US 5075109. Системы доставки также включают системы не полимерные по своей природе, которыми являются: липиды, включая при этом стерины, такие как холестерин, холестерин эстеры и жирные кислоты или нейтральные жиры, такие как моно- ди- и триглицериды; гидрогелевые высвобождающиеся системы даставки, силастичные системы; системы, которые являются основанными на пептидах; покрытые воском; пресованные таблетки, при использовании обычных смазочных агентов и наполнителей; частично расплавляющиеся имплантанты; и т.п. Специфичные примеры включают, но не являются ограничеными: (а) эрозионные системы, в которых вещество согласно данному изобретению содержится форма в пределах матрицы, такой как описанные в US 4452775, 4675189, и 5736152, и (b) диффузионные системы, в которых активный компонент проникает в контролируемом количестве из полимера, такого, как описано в US 3854480, 5133974 и 5407686. Кроме того, могут так же использоваться помповые системы доставки лекарственных средств, некоторые из которых являются пригодными для имплантации.
Форма введения рекомбинантного вирусного вектора [состав (i)] и 1Н-имидазо[4,5-с]хинолин-4-амин производная [состав (ii)] может быть идентичным или различным для одной указанной рекомбинантной вирусной вакцины согласно данному изобретению (например, состав (i) вводимый в виде раствора и состав (ii) вводимый в виде крема).
В других аспектах днное изобретение имеет отношение к комплектам. Один комплект согласно изобретению включает контейнер, который содержит (i) по крайней мере один рекомбинантный вирусный вектор согласно изобретению и контейнер, который содержит (ii) по крайней мере одну 1Н-имидазо[4,5-с]хинолин-4-амин производную и инструкции для того, чтобы рассчитать применение состава. Контейнер может быть единственным контейнером и (i) по крайней мере содержать одну рекомбинантную вирусную вакцину и (ii) по крайней мере одну 1Н-имидазо[4,5-с]хинолин-4-амин производную вместе, или это могут быть многодозовые контейнеры или камеры, которые содержат индивидуальную дозу составов (i) и (ii), такие как прозрачная упаковка. В комплекте также есть инструкции для того, чтобы рассчитать применение состава рекомбинантной вирусной вакцины. Инструкции ориентируют пациента относительно того, как применить рекомбинантную вирусную вакцину в подходящее время. Для растворимых, подходящее время для доставки рекомбинантной вирусной вакцины может зависеть от симптоматических признаков. Альтернативно, подходящее время для введения рекомбинантной вирусной вакцины может быть и типичным, таким как ежемесячное или ежегодное. Составы (i) и (ii) могут быть введены одновременно или раздельно так долго, пока их вводят достаточно определенное время, чтобы вызвать синергистический имунную реакцию.
Если есть желание, то способ или использование изобретения могут быть выполнены в комбинации с одним или более обычными терапевтическими способами лечения (например, радиация, химиотерапия и/или хирургия). Использование многократных терапевтических подходов предоставляет пациенту более широкое, более основательное вмешательство. В одном воплощении способу согласно изобретения может предшествовать или способ может сопровождаться хирургическим вмешательством. В другом воплощении этому может предшествовать, или способ может сопровождаться радиотерапией (например, гамма радиация). Специалисты, которые являются квалифицированными в данной отрасли техники, могут с готовностью сформулировать соответствующие радиационные протоколы терапии и параметры, которые могут быть использованы (см., например, Perez и Brady, 1992, Principles и Practice of Radiation Oncology, 2nd Ed. JB Lippincott Co; использование соответствующей адаптации и модификаций будет проводиться так, как будет очевидно для специалистов, которые являются квалифицированными в данной отрасли техники). В еще одном воплощении, способе или использовании согласно данного изобретения, можно использовать объединение с химиотерапией с одним или более лекарственными средствами (например, лекарственные средства, которые традиционно используются для лечения или профилактики инфекций HPV, HPV - ассоциированных патологических состояний).
Далее существующее изобретение решает проблемы, которые направлены на способы, ориентированные на увеличение эффективности лечения больного раком, который подвергается химиотерапевтическому лечению химиотерапевтическим агентом, который включает совместное лечение указанного пациента рекомбинантной вирусной вакциной, как описано выше.
Существующее изобретение в дальнейшем имеет отношение к улучшению способа цитотоксической эффективности цитотоксических препаратов или радиотерапии, которая включает совместное лечение пациента, который нуждается в таком лечении, рекомбинантной вирусной вакциной, как описано выше.
В другом воплощении, способ или использования данного изобретения, является реализованным согласно основному повышению терапевтической модальности, которая включает последовательное введение одного или более составов(ов) праймера и одного или более составов(ов) вспомогательного вещества. Как правило, праймированный и улучшенный составы используют различных посредников, которые включают или кодируют по крайней мере аллергенную область вместе. Праймированный состав первоначально вводят в организм хозяина, и впоследствии вводят улучшенный состав тому же самому организму хозяина после истечения периода, который изменяется от одного дня до двенадцати месяцев. Способ согласно данному изобретению может включать от одного до десяти последовательных введений праймированного состава, который сопровождается от одного до десяти последовательных введений улучшенного состава. По желанию, интервалы между инъекциями могут составлять от одной недели до шести месяцев. Кроме того, праймированный и улучшенный составы можно вводить на том же самом участке или на альтернативных участках при том же самом пути введения или различными путями введения. Например, составы, основанные на HPV раннем полипептиде, могут включать путем введения через слизистую оболочку, тогда как рекомбинантная вирусная вакцина предпочтительно может быть введена, например, путем подкожной инъекции для вектора MVA.
Способность индуцировать или стимулировать анти-HPV имунную реакцию после введения в животный или человеческий организм может быть оценена в условиях in vitro или в условиях in vivo путем проведения ряда экспериментов, которые являются стандартными для данной отрасли техники. Для общего описания технических способов, доступных для того, чтобы оценить начало и активацию иммунной реакции, см., например, Coligan и др. (1992 и 1994, Current Protocols in Immunology; ed J Wiley & Sons Inc, National Institute of Health). Измерение клеточной иммунности может быть выполнено измерением профилей цитокина, секретированного эффекторными активированными клетками, которые включают полученные из CD4+ и CD8+Т - клетки (например, определение количества IL-10 или продуцирующих гамма IFN клеток при помощи ELI spot), определением статуса активации иммуноэффекторных клеток (например, Т-клеточная пролиферация клеток, которая оценена классическим [3Н] поглощением тимидина), путем оценки антиген-специфичных Т-лимфоцитов у чувствительных субъектов (например, пептид специфичный лизис в испытании на цитотоксичность). Способность стимулировать гуморальный ответ может быть определена в связывании антитела и/или конкуренцией в связывании (см., например, Harlow, 1989, Antibodies, Cold Spring Harbor Press). Способ согласно изобретению может также быть далее валидирован на моделях животных, которых активируют путем соответствующего индуцирующего опухоль агента (например, HPV-Е6 и Е7 - экспрессии клеток ТС1) для того, чтобы определить антиопухолевую активность, рефлексирование индукции или повышение анти-HPV иммунного ответа.
Примерами заболеваний, которые можно особенно рассматривать в соответствии с существующим изобретением, являются, например, рак шейки матки или повреждения прекурсора указанной малигнизированной неоплазии, которые называют цервикальной внутриэпителиальной неоплазией (CIN) или покрытой чешуйками внутриэпителиальной болезни (SIL). Рекомбинантная вирусная вакцина согласно данному изобретению может также быть полезной в лечении бессимптомных инфекций цервикального канала у пациентов, у которых проведено ДНК диагностику, или бессимптомных инфекций, которые, как предполагается, остаются после хирургического лечения рака шейки матки, CIN или SIL, или бессимптомных инфекций, которые, как предполагают, существовали после эпидемиологического расстройства. Примерами заболеваний, которые также можно рассматривать, включают генитальные бородавки, и обычные бородавки, и бородавки, которые располагаются на подошвах. Все эти расстройства также вызваны большим разнообразием других типов HPV, и агенты, составы и способы согласно данному изобретению, могут также быть эффективно применены против этих вирусов. Все эти расстройства, по-видимому, происходят в виде бессимптомных инфекций, которые чаще всего не являются диагностированными. Существующее изобретение может также быть эффективно применено относительно всех этих бессимптомных инфекций.
Изобретение было описано при помощи иллюстирования, и нужно понимать, что терминология, которая была использована, предназначена для того, чтобы понимать смысл согласно описания, а не ограничивая его. Очевидно, что возможны разнообразные модификации и изменения существующего изобретения в свете вышеупомянутого изложения. Поэтому нужно понимать, что в рамках приложенной формулы изобретения, изобретение может быть осуществлено по-разному исходя лишь из того, что было изложено.
Все вышеупомянутые процитированные раскрытия патентов, публикаций и баз данных определенным образом включены в данное описание в качестве ссылки в их всей полноте в той же самой степени, как будто каждый такой отдельный патент, публикация или база данных были бы специально и индивидуально указанным для того, чтобы быть включенными в качестве ссылки.
Описание фигур
Фиг.1а/b/c/d: Терапевтический эффект комбинации между местным применением имиквимода с подкожной инъекцией MVATG8042. Фиг.1b: Эксперимент 1: 2·105 TCI sc, 3 sc инъекции с 5·106 pfu, 15 мышей в группе; фиг.1с: Эксперимент 2: 2·105 TCI sc, 3 sc инъекции с 5·106 или 5·105 pfu, 15 мышей в группе; фиг.1d: Эксперимент 3: 2·105 TCI sc, 3 sc инъекции с 5·106 pfu, 15 мышей в группе.
Фиг.2а/2b: Степень частоты Е7/Е6 специфичных лимфоцитов, которые секретируют IFN гамма. Фиг.2b: Е7/Е6 специфичная IFN гамма / Elispot реакция.
Фиг.3: IL-4 ELISPOT анализ. Е7, специфичная IL-4/Elispot реакция Th 2.
Фиг.4а/4b: анализ проточной цитометрии R9F - специфичных CD8+Т клеток. Степень частоты Tet_R9F+Е7 специфичных CD8+Т клеток.
Фиг.5а/5b: Е7 - специфичная гуморальная имунная реакция. Степень Th 1/Th 2 появления изотипа Ig G.
Фиг.6: MVA - специфичный нейтрализирующий титр антитела (NAT 50).
Фиг.7: Терапевтический эффект Aldara+комбинация MVAT G 9931 на модели опухоли Ren Са-Muc1.
Фиг.8: Эффект имиквимода на MUC1 - специфичном Th 1 типе Т - клеток против коротких или длинных антигенных детерминант.
Фиг.9: IL-4 elispot анализ: Эффект имиквимода на специфичном ответе Th 2 MUC-1 типе Т-клеток.
Фиг.10: MUC1 специфичный гуморальный иммунный ответ (появление изотипа: эффект имиквимода на MUC1 специфичный гуморальный ответ.
Примеры
А - Рекомбинантный вирусный вектор, который экспрессирует антигены HPV.
1. Материалы и Способы
1.1. Перечень тестов
Название и краткое описание каждой рекомбинантной векторной конструкции (основанной на MVA)
Условия хранения:
Вирусы были поддержаны при -80°С до дня инъекции. Вирусная суспензия быстро немедленно была поддана оттаиванию до растворения и введения.
Вирусы были растворены в буфере Tris / HCl 10 м М, сахароза 5% (в/в), 10 м М Na Glu, 50 - м М NaCl, pH 8,0 для того, чтобы получить необходимую дозу в 100 мкл объеме.
1.2. Животные модели
Разновидность / штамм/поставщик:
SPF здоровые мыши женского пола С57Bl/6 были получены от Charles River (Les Oncins, Франция). По прибытию животные находились в возрасте 6 недель. В начале эксперимента они находились в возрасте 7 недель. Животные были размещены в единственной, исключительной комнате, которая была поддана кондиционированию для того, чтобы обеспечить минимум 11 изменений объема воздуха в час. Диапазоны температурной и относительной влажности были в пределах 20°С и 24°С и 40-70% соответственно. Освещение управлялось автоматически для того, чтобы получить цикл 12 часов света и 12 часов темноты. Специфичный патогенный свободный статус был проверен регулярным контролем чувствительности животных.
В течение всего исследования у животных был свободный доступ к стерильному типу диеты RM 1 (Dietex Франция, Saint Gratien). Стерильная вода была обеспечена свободным доступом через бутылки.
Все животные были акклиматизированы в течение одной недели перед началом эксперимента.
1.3. Описание клеток опухоли
ТС 1 клетки опухоли, которые были получены из легкого мышей С57Вl6, были трансдуцированы с двумя ретровирусами: LXSN16E 6Е 7, который экспрессирует Е6 и Е7 от HPV16 и pVEJB, который экспрессирует ras ген. Клетки были культивированы в DMEM, которая содержала G418 0.5 мг/мл и гидромицина 0.2 мг/мл. Прилипающие клетки были удалены при помощи трипсиновой обработки и после того, как было проведено три промывки, проверка иммунности к специфическому опухолевому агенту была выполнена под кожу с 2·105 ТС 1 жизнеспособными клетками.
1.4. Aldara™ (3 М Pharmaceuticals)
Aldara™ является фирменным знаком для имиквимода. Каждый грамм 5%-го крема содержит 50 мг имиквимода в форме масло-в-воде белого цвета с сероватым оттенком, который является быстро впитывающимся косметическим кремом, который состоит из изостеариновой кислоты, цетил алкоголя, стеарил алкоголя, медицинского вазелина, полисобрата 60, сорбитан моностеарата, глицерина, ксантановой резины, очищенной воды, алкоголь бензила, метил парабена и полипропил парабена.
1.5. Протокол
Протокол иммунизации:
Для иммунотерапевтических экспериментов, 15 самкам мыши С57Вl6 было введено под кожу с расположением внутрь 2·105 ТСl cells в Dl. Мышей обрабатывали три раза, под кожу на трех отдельных участках, 5·106 pfu или 5·105 pfu вируса коровьей оспы по D8, D15 и D22. Имиквимод (крем 5% Aldara; 3 М Pharmaceuticals), был применен актуально как раз перед каждой иммунизацией на участках инъекции на побритой коже мышей (приблизительно 1 см2). Каждая мышь получила приблизительно 0,8 мг или 1,6 мг / мышь активного имиквимода на одну иммунизацию. Рост опухоли был проверен два раза в неделю в течение 80 дней, при помощи кронциркуля. Мыши были подвергнуты эвтаназии по этическим причинам, когда размер их опухоли превосходил 25 мм по диаметру или когда они испытывали боль, даже если опухоль была не большой по своему размеру.
Для исследования иммуногенности 3 самкам мыши С57Вl6 без опухолей были привиты под кожу отдельных участках 5·107 pfu или 5·106 pfu вируса коровьей оспы по D8, D15. Эта доза была использована для того, чтобы обнаружить клеточную иммунность против специфичных антигенов HPV. Имиквимод был применен местно как раз перед каждой иммунизацией на участках инъекции на побритой коже мышей (приблизительно 1 см2). Каждая мышь получила приблизительно 0,8 мг или 1,6 мг / мышь активного имиквимода на одну иммунизацию. Селезенка и сыворотка были удалены в D22 для иммунологического анализа.
Параметры контроля:
* Оценка числа/частоты IFN гамма (Th 1) или IL-4 (у Th 2 секретирующих клеток при помощи Elispot
Свежие клетки селезенки были приготовлены при использовании клеточного фильтра (BD Falcon). Все пептиды были синтезированы при помощи Neosystem на иммунном уровне (10 мг). Каждый из пептидов был растворен в диметилсульфоксиде в 10 мг/мл и был созранен при 4°С. Анализ Elispot был выполнен при использовании мыши Mabtech АВ и комплекта IFN гамма ELISPOTPLUS или мыши и комплекта IL-4 ELISPOTPLUS (Mabtech, Франция) согласно инструкциям изготовителя. 96 - ячеячная нитроцеллюлозная пластина была покрыта количеством в 3 мкг/мл моноклональным антимышиным крысиным антителом IFN гамма (Clone R4-6А2; Pharmingen, cat. nr551216, Lot M072862; 100 мкл/ячейку) в карбонатно натриевом буфере. Ячейки были быстро инкубированы при 4°С или в течение 1 часа при 37°С. Пластины были вымыты три раза с 10%-ным FCS DMEM и насыщены в течение 2 часов при 37°С с 100 мкл DMEM 10%-ный FCS/ячейку. Спленоциты были платированы при концентрации 106 клеток/100 мкл. Интерлейкин 2 был добавлен во все ячейки при концентрации 6 ЕД/50 мкл/ячейку (Системы R&D) 10 нг/мл). Конкавалин А был использован в качестве позитивного контроля (5 мкг/мл). HPV специфичные пептиды были использованы при концентрации 5 мкг/мл. Пластины были инкубированы в течение 48 часов при 37°С, в 5%-ном СО2. Пластины были далее промыты один раз с PBS 1X и 5 раз с PBS - Tween 0.05%. Антимышиный биотинилированный IFN гамма (клон XMG1.2, Pharmingen) был введен при концентрации 0.3 мкг/100 мкл/ячейку и был проинкубирован в течение 2 часов при комнатной температуре при медленной выдержке. Пластины была далее промыты один раз с PBS 1X и 5 раз с PBS - Tween 0.05%. Экстравидин АКР (Sigma, St. Louis, МО) был дилюированным в 1/5000 PBS - Tween 0.05% - FCS 1% и был далее добавлен к ячейкам (100 мкл/ячейку). Пластина была инкубирована в течение 45 минут при комнатной температуре и затем промыта 5 раз с PBS - Tween 0.05%. Секреция IFN гамма была продемонстрирована при помощи использования комплекта Biorad. 100 мкл субстрата (NBT+BCIP) было добавлено в ячейки, и далее пластину оставляли при комнатной температуре в течение ½ часов. Пластина была далее промыта с водой и размещена для того, чтобы быстро высохнуть при комнатной температуре. Пятна были посчитаны при помощи диссекционного микроскопа. Пятна были посчитаны, используя Elispot reader Bioreader 4000 Pro-X (BIOSYS-Gmbh; Serlabo Франция).
Листинг тестированных пептидов:
SCVYCKKEL (E6; Db): S9L пептид
RCIICQRPL (E6; Db): R9L пептид
SEYRHYQYS (E6; Kb): S9S пептид
ECVYCKQQL (E6; Db): E9L пептид
TDLHCYEQL (E7; Kb): T9L пептид
RAHYNIVTF (E7; Db): R9F пептид
Иррелеваптный пептид (MUC1 специфичный)
D 38L (E7; Db) является 38 удлиненный аминокислотой Е7 - специфичным пептидом.
Рекомбинантный очищенный Е7 белок был использован в сложном ELISPOT исследовании.
* Оценка частоты R9F тетрамера, специфичного к Т-клеткам CD8+
Свежие клетки селезенки были собраны и приготовлены для использования в BD фильтре с фитовидной трубкой. Спленоциты были стимулированы в течение 5 дней с пептидом R 9F (5 мкг/мл) в 24 ячеечных пластинах или были использованы непосредственно для специфичной маркировки. 1·106 клеток были покрыты 1 мкл АРС - мышиным CD8 специфичным антителом BD (Pharmingen 553035; клон 53-6.7; lot n° 32567) и 10 мкл специфичного тетрамера Н-2Db R9F (Beckman Coulter T20071; Н-2Db/РЕ; петид RAHYNIVTF; lot C507117; С602110) в течение 30 минут при 4°С. Клетки были промыты потом и растворены в PBS/0,5% PFA.
* Оценка Th 1/Th 2 связанного изотипа Is G против Е7 антигенов
* 96-ячеечные пластины были быстро покрыты при 4°С 3 мкг/мл очищенного белка Е7 (Р#2101 cahier PC00001; page 157; Oct.2002). Белок был растворен в покрывающем буфере (200 - мМ NaHCO3, 80 - мМ Na2CO3, pH фактор 9.5) и 100 мкл были добавлены в ячейку.
* Ячейки были промыты пять раз при помощи моечной машины для пластин (PBS, 0.1% Tween 20, 10 мМ ЭДТА) и сатурированы в течение 1 часа при комнатной температуре с 300 мкл PBS+3% BSA.
* Ячейки были промыты 5 раз и инкубированы с ½ последовательными разведениями сыворотки мыши (от 1/25 до 1/1600 в PBS+1% BSA) в течение 2 часов при комнатной температуре.
* Пластина была вымыта 5 раз. Конъюгированный пероксидазой антимышиный крысиный Ig G 2a (BD Pharmingen 553391) или антимышиный крысиный Ig G1 (BD Pharmingen 559626) были дилюированы в 1/1000 в % PBS+1 BSA и были добавлены (100 мкл/ячейку) и инкубированы в течение 1 часа при комнатной температуре.
* Ячейки были промыты пять раз и покрыты 100 мкл раствором субстрата (0.05 М лимонной кислоты, 0.05 М ацетат натрия, 1% тетраметил бензидина, H2O2 на 0.015%)/ячейку.
ТМВ раствор (10 мл)=140 мкл ТМВ+2 мкл H2O2+ацетат Na на 5 мл (0,1 М)+соль лимонной кислоты на 5 мл (0,1 М).
* Реакция была остановлена при помощи добавления 100 мкл 0.8 М H2SO4/ячейку. Спектральная поглотительная способность была измерена для 450 нм (система Genesys).
* Analysis MVA - нейтрализации антитела, которое является индуцированным вакцинацией
Клетки: ВНК-21 (фибробласт хомяка, Ref ATCC:CCL-10)
MVA-GFP (MVATG15938): Репортерный зеленый флуоресцентный белок был инсертирован в MVA делецию III под контролем р11 К7.5 промотора.
Этап 1: Нейтрализация сыворотки:
- Все сыворотки были декомплементированны при нагревании в течение 30 минут при 56°С перед использованием.
Позитивный контроль: сыворотка, полученная от кролика, иммунизированного с поксвирусом (штамм WR) (Ref. Ac WR IMVQC34).
Этап 2: анализ нейтрализации сыворотки (SOP измерение титра нейтрализации анти-MVA антител)
- Плазма была последовательно растворена в культуральной среде (диапазон растворения от 50× до 3200×) и инкубирована в 96-ячеечной микропластине с MVA-GFP (5×103 pfu/ячейку) в течение 1 часа при в 37°С (этап нейтрализации). Клетки ВНК-21 (105 клеток/ячейку) были далее селектированы и инкубированы в течение дополнительных 16-18 часов при 37°С, 5% СО2.
- На следующий день, 96-ячеечная микропластина была промыта с 250 мкл PBS, и 100 мкл РВ далее было добавлено в каждую ячейку для определения интенсивности флюоресценции микропластин (VICTOR™ PerkinElmer®). Титр нейтрализации антитела это такой титр, при котором происходит ингибирование 50%-ной вирусной активности. Титр нейтрализации антитела (NAT50) был определен при использовании способа Spearman - Kärber.
2 - Результаты
Три независимых терапевтических эксперимента были выполнены после модели, описанной в секции Материалы и Способы.
Во всех экспериментах последовательно заметили, что местное применение крема Aldara™ (5%) на участке вакцинации увеличивает значительно терапевтическую эффективность MVATG8042 (см. фиг.1а, b, с и d). В этом задании вакцинация с 5·106 pfu MVATG8042 давала в среднем 45% мышей, у которых не было опухоли к концу каждого эксперимента, в то время как 75% и 95% животных, у которых не было опухоли, были выявлены в том случае, когда MVATG 8042 использовался в комбинации с 0,8 мг или 1,6 мг имиквимода, соответственно.
В одной серии эксперимента (см. фиг.1с), также заметили, что дополнение Aldara™ позволяет достигать той же самой терапевтической эффективности при одной более низкой дозе вируса (5·105 pfu).
Статистические отличия в условиях in vivo в экспериментах выживания между различными группами были оценены, используя способ Log Rank (Statistica 5.1 software, Statsoft Inc.) по кривым выживания Kaplan - Meier. Те случаи, когда р≤0.05, являются статистически значимыми.
Параллельно были выполнены два независимых исследования для того, чтобы оценить индукцию и клеточных и гуморальных ответов против Е6 и Е7 HPV антигенов. Мыши были вакцинированы так, как описано в секции Протокол. В обоих экспериментах количество Е6 или Е7 - специфичных IFN гамма секретирующих клеток было вычислено при помощи анализа ELISPOT. Эти результаты показывают, что местное применение Aldara™ приводит к существенному усилению количеств рестрикций в классе I МНС СD8+Т клеток, относительно единицы, полученной с MVATG8042 (фиг.2а и b). Низкие ответы при более широком диапазоне антигенных детерминант присутствуют в Aldara™+группа MVATG8042 (пептид S9S и T9L). Параллельно, в отдельном эксперименте, количество Е7 - специфичных IL-4 секретирующих клеток было ниже в MVATG8042+Aldara™, чем в одной MVA группе (фиг.3). Взятые вместе, эти данные указывают на то, что комбинация MVATG8042+Aldara™ улучшает Th 1 - основанную клеточную имунную реакцию против Е6 и антигенов Е7.
Частота CD8+/R9F тетрамер+спленоциты была далее проанализирована при помощи проточной цитометрии, до того или после того, как в пробирке была стимулирована Е7 - специфичная иммуннодоминирующая антигенная детерминанта R9F (фиг.4а). Эти результаты указывают на то, что стумилирование R9F иммуннодоминирующей антигенной детерминанты ясно установлено для CD8+ специфичных Т-клеток. Частота R9F-Db-рестрикции в популяции CD8+ является низкой для селезенки, и эта популяция лучше обнаруживается после стимулирования с пептидом в пробирке. Предварительная обработка с Aldara™ улучшила значительно количество R9F-Db-специфичных CD8+Т-клеток в эксперименте, что показано в фиг.4b.
В конце концов, была также определена мера гуморального ответа против антигена Е7 при помощи ELISA. Для того чтобы лучше характеризовать тип ответа, вызванного комбинацией Aldara™+MVATG8042, был проанализирован пул изотипа Ig G. Были обнаружены Е7 - специфичные Ig G1 и Ig G2 а. Данные (фиг.5) показывают, что местное введение Aldara™ вызывает типичный профиль Th 1 (выше титр Ig G 2а, чем Ig G1, Фиг.5а), который мог иметь такие же значения эффективности, как для совместного применения. Эти результаты подтверждены во втором эксперименте (Фиг.5b).
В конце концов, был измерен уровень MVA - определенного нейтрализирующего антитела для того, чтобы проанализировать воздействие комбинации Aldara с MVATG8042 (фиг.6). Результаты указывают на то, что объединение MVATG8042 и Aldara™ уменьшает титр MVA - специфичного нейтрализирующего антитела, по сравнению с таким же отдельно введенным MVA. Это явление можно объяснить с учетом той среды, которую создает местное применение крема Aldara™, что может стать защитой против специфичных нейтрализирующих антител.
В - Рекомбинантный вирусный вектор, который экспрессирует опухолевый антиген MUC1.
2.1. Перечень тестов
Название и краткое описание каждой рекомбинантной векторной конструкции (основанной на MVA)
Условия хранения:
Вирусы были получены из Molecular Immunology Department и потом были поддержаны при - 80°С до дня инъекции. Вирусная суспензия быстро немедленно была поддана оттаиванию до растворения и введения.
Условия растворения перед использованием
Вирусы были растворены в буфере Tris/HCl 10 м М, сахароза 5% (в/в), 10 м М Na Glu, 50 - м М NaCl, pH 8,0 для того, чтобы получить необходимую дозу в 100 мкл объеме.
2.2. Животные модели
Разновидность / штамм/поставщик:
SPF здоровые мыши женского пола С57Bl/6 были получены от Charles River (Les Oncins, Франция). По прибытию животные находились в возрасте 6 недель. В начале эксперимента они находились в возрасте 7 недель. Животные были размещены в единственной, исключительной комнате, которая была поддана кондиционированию для того, чтобы обеспечить минимум 11 изменений объема воздуха в час. Диапазоны температурной и относительной влажности были в пределах 20°С и 24°С и 40-70% соответственно. Освещение управлялось автоматически для того, чтобы получить цикл 12 часов света и 12 часов темноты. В течение всего исследования у животных был свободный доступ к стерильному типу диеты RM1 (Dietex Франция, Saint Gratien). Стерильная вода была обеспечена свободным доступом через бутылки.
2.3. Описание клеток
Клетки опухоли Ren Са-MUC1: Ren Ca - экспериментальная крысиная почечная модель рака. Клетки Ren Са были трансфектированны с pH MG-ЕТА tm (MUC-1) и pY3 (стойкий к гидромоцину В) с использованием классического Са2+ способа фосфатной трансфекции. Клоны были отобраны после того, как было проведено клоновое растворение в DMEM (Dulbecco Modified), было добавлено 10% инактивированной фетальной сыворотки теленка, L-глутамина (2 мм), гентамицина (0,04 г/л) и гидромоцин (600 мкг/мл, Roche Diagnostic). Анализ экспрессии MUC-1 был осуществлен при помощи цитофлуориметрического анализа (при использовании FACScan, Becton Dickinson) с моноклональным антителом Н23. Прилипшие клетки были удалены обработкой PBS/EDTA и после того, как было проведено трехкратное промывание, необходимые жизнеспособные опухолевые клетки были введены под кожу 3·105 RenCa-MUC1 (клон 4).
2.4. Протокол
Протокол иммунизации
Для иммунотерапевтических экспериментов, 15 самкам мыши В6 D2 было введено под кожу с расположением внутрь 3·105 RenСа-MUC1 клеток в D1. Мышей обрабатывали три раза, под кожу на трех отдельных участках, 5·107 pfu поксвируса (MVA штамм) по D8, D15 и D22. Имиквимод (крем 5% Aldara; 3 М Pharmaceuticals), был применен как раз перед каждой иммунизацией на участках инъекции на побритой коже мышей (приблизительно 1 см2). Каждая мышь получила приблизительно 1 мг/мышь активного имиквимода на одну иммунизацию. Рост опухоли был проверен два раза в неделю в течение 80 дней, при помощи кронциркуля. Мыши были подвергнуты эвтаназии по этическим причинам, когда размер их опухоли превосходил 25 мм по диаметру или, когда они испытывали боль, даже если опухоль была не большой по своему размеру.
Для исследования иммуногенности 3 самкам мыши С57Вl6 без опухолей были привиты под кожу на отдельных участках 5·107 pfu поксвируса (MVA штамм) по D8, D15. Эта доза была использована для того, чтобы обнаружить клеточную иммунность против MUC1 специфичных антигенов, Имиквимод был применен местно как раз перед каждой иммунизацией на участках инъекции на побритой коже мышей (приблизительно 1 см2). Каждая мышь получила приблизительно 1 мг/мышь активного имиквимода на одну иммунизацию. Селезенка и сыворотка были удалены в D22 для иммунологического анализа.
Параметры контроля:
* Оценка числа/частоты IFN гамма секретирующих клеток при помощи Elispot
Свежие клетки селезенки были приготовлены, используя Lympholite очищающий буфер. Все пептиды были синтезированы при помощи Neosystem на иммунном уровне (10 мг). Каждый из пептидов был растворен в диметилсульфоксиде в 10 мг/мл и был сохранен при 4°С. Анализ Elispot был выполнен при использовании мыши Mabtech АВ и комплекта IFN гамма ELISPOTPLUS или мыши и комплекта IL-4 ELISPOTPLUS (Mabtech, Франция) согласно инструкциям изготовителя. 96-ячеечная нитроцеллюлозная пластина была покрыта количеством в 3 мкг/мл моноклонального антимышиного крысиного антитела IFN гамма (Clone R4-6А2; Pharmingen, cat. Nr 551216, Lot M072862; 100 мкл/ячейку) в карбонатно натриевом буфере. Клетки были быстро инкубированы при 4°С или в течение 1 часа при 37°С. Пластины были вымыты три раза с 10%-ным FCS DMEM и насыщены в течение 2 часов при 37°С с 100 мкл DMEM 10%-ный FCS/ячейку. Спленоциты были платированы при концентрации 106 клеток/100 мкл. Интерлейкин 2 был добавлен во все ячейки при концентрации 6 ЕД/50 мкл/ячейку (Системы R&D) 10 нг/мл). Конкавалин А был использован в качестве позитивного контроля (5 мкг/мл). MUC1 специфичные пептиды были использованы при концентрации 5 мкг/мл. Пластины были инкубированы в течение 48 часов при 37°С, в 5%-ном CO2. Пластины была далее промыты один раз с PBS 1X и 5 раз с PBS-Tween 0.05%. Антимышиный биотинилированный IFN гамма (клон XMG1.2, Pharmingen) был введен при концентрации 0.3 мкг/100 мкл/ячейку и был проинкубирован в течение 2 часов при комнатной температуре при медленной выдержке. Пластины были далее промыты один раз с PBS 1X и 5 раз с PBS-Tween 0.05%. Экстравидин АКР (Sigma, St. Louis, МО) был дилюированным в 1/5000 PBS-Tween 0.05%-FCS 1% и был далее добавлен в ячейки (100 мкл/ячейку). Пластина была инкубирована в течение 45 минут при комнатной температуре и затем промыта 5 раз с PBS-Tween 0.05%. Секреция IFN гамма была продемонстрирована при помощи использования комплекта Biorad. 100 мкл субстрата (NBT+BCIP) было добавлено в ячейки, и далее пластину оставляли при комнатной температуре в течение ½ часов. Пластина была далее промыта с водой и размещена для того, чтобы быстро высохнуть при комнатной температуре. Пятна были посчитаны при помощи диссекционного микроскопа.
* Оценка числа/частоты IL-4 секретирующих клеток при помощи Elispot
Свежие клетки селезенки были приготовлены, используя Lympholite очищающий буфер. Все пептиды были синтезированы при помощи Neosystem на иммунном уровне (10 мг). Каждый из пептидов был растворен в диметилсульфоксиде в 10 мг/мл и был созранен при 4°С. Анализ Elispot был выполнен при использовании мыши Mabtech AB и комплекта IFN гамма ELISPOTPLUS или мыши и комплекта IL-4 ELISPOTPLUS (Mabtech, Франция) согласно инструкциям изготовителя. 96-ячеечная нитроцеллюлозная пластина была покрыта количеством в 3 мкг/мл моноклональным антимышиным IL-4 антителом (Pharmingen, cat. nr551878, Lot 27401; 100µl/well) 100 мкл/ячейку) в карбонатно натриевом буфере. Ячейки были быстро инкубированы при 4°С или в течение 1 часа при 37°С. Пластины были вымыты три раза с 10%-ным FCS DMEM и насыщены в течение 2 часов при 37°C с 100 мкл DMEM 10%-ный FCS/ячейку. Спленоциты были платированы при концентрации 106 клеток/100 мкл. Интерлейкин 2 был добавлен во все ячейки при концентрации 6 ЕД/50 мкл/ячейку (Системы R&D) 10 нг/мл). Конкавалин А был использован в качестве позитивного контроля (5 мкг/мл). MUC1 специфичные пептиды были использованы при концентрации 5 мкг/мл. Пластины были инкубированы в течение 48 часов при 37°С, в 5%-ном CO2. Пластины были далее промыты однин раз с PBS 1X и 5 раз с PBS-Tween 0.05%. Антимышиный биотинилированный IL-4 (Pharmingen) был введен при концентрации 0.3 мкг/100 мкл/ячейку и был проинкубирован в течение 2 часов при комнатной температуре при медленной выдержке. Пластины была далее промыты один раз с PBS 1X и 5 раз с PBS-Tween 0.05%. Экстравидин АКР (Sigma, St. Louis, МО) был дилюированным в 1/5000 PBS-Tween 0.05%-FCS 1% и был далее добавлен к ячейкам (100 мкл/ячейку). Пластина была инкубирована в течение 45 минут при комнатной температуре и затем промыта 5 раз с PBS-Tween 0.05%. Секреция IFN гамма была продемонстрирована при помощи использования комплекта Biorad. 100 мкл субстрата (NBT+BCIP) было добавлено в ячейки, и далее пластину оставляли при комнатной температуре в течение ½ часов. Пластина была далее промыта с водой и размещена для того, чтобы быстро высохнуть при комнатной температуре. Пятна были посчитаны при помощи диссекционного микроскопа.
Листинг тестированных пептидов:
F9L FLSFHISNL (Н-2Kb; Heukamp, 2001)
А9А APGSTAPPA (Н-2Db)
Т24Р TAPPAHGVTSAPDTRPAPGSTAPP
G23D GQDVTLAPATEPASGSAATWGQD
V23S VTGSGHASSTPGGEKETSATQRS
Инрелевантный пептид/R9F RAHYNIVTF (E7; Db)
* Оценка Th 1/Th 2 связанного изотипа Ig G против MUC1 антигена
* 96-ячеечные пластины были покрыты быстро при 4°С 3 мкг/мл Т24Р MUC1 специфичного пептида. Пептид был растворен в покрывающем буфере (200-мМ NaHCO3, 80 - мМ Na2CO3, pH фактор 9.5) и 100 мкл были добавлены в ячейку.
* Ячейки были промыты пять раз при помощи моечной машины для пластин (PBS, 0.1% Tween 20, 10 мМ ЭДТА) и сатурированы в течение 1 часа при комнатной температуре с 300 мкл PBS+3% BSA.
* Ячейки были промыты 5 раз и инкубированы с ½ последовательными разведениями сыворотки мыши (от 1/25 до 1/1600 в PBS+1% BSA) в течение 2 часов при комнатной температуре.
* Пластина была вымыта 5 раз. Конъюгированный пероксидазой антимышиный крысиный Ig G 2a (BD Pharmingen 553391) или антимышиный крысиный Ig Gl (BD Pharmingen 559626) были дилюированы в 1/1000 в % PBS+1 BSA и были добавлены (100 мкл/ячейку) и инкубированы в течение 1 часа при комнатной температуре.
* Ячейки были промыты пять раз и покрыты 100 мкл раствором субстрата (0.05 М лимонной кислоты, 0.05 М ацетат натрия, 1% тетраметил бензидина, H2O2 на 0.015%)/ячейку.
ТМВ раствор (10 мл)=140 мкл ТМВ+2 мкл H2O2+ацетат Na на 5 мл (0,1 М)+соль лимонной кислоты на 5 мл (0,1 М).
* Реакция была остановлена при помощи добавления 100 мкл 0.8 М H2SO4/ячейку. Спектральная поглотительная способность была измерена в 450 нм (система Genesys).
3 - Результаты
Терапевтический эксперимент был выполнен на подкожной модели RenCa-MUC1, описанной в секции Протокол. Мы заметили, что предварительное лечение местным применением крема Aldara™ в 5% увеличивает значительно терапевтическую эффективность MVATG 9931 от 5% до 35% свободных от опухоли мышей в конце эксперимента. В этом эксперименте, никаких мышей не лечили только местным применением Aldara™. Однако, согласно опубликованной информации относительно сложных моделей рака (OVA экспрессирующие опухоли) описано, что местное применение Aldara™ на участке, который отличается от опухолевого, не имеет никакого терапевтического эффекта (Craft и др., 2005). Статистические отличия в условиях in vivo в экспериментах выживания между различными группами были оценены, используя Log Rank способ (Statistica 5.1 software, Statsoft Inc.) кривых выживания Kaplan-Meier. Случаи, когда р≤0.05 являются статистически значимыми.
Фиг.7 иллюстрирует терапевтический эффект комбинации Aldara+MVATG 9931 на модели опухоли renCa - MUC1.
Исследование иммуногенности было также выполнено параллельно для того, чтобы отыскать индукцию как клеточных, так и гуморальных ответов против антигена MUC1. Мыши были вакцинированы так, как было описано в секции Протокол.
В первой секции эксперимента было определено количество секретирующих MUC1 - специфичных IFN гамма клеток, при использовании анализа ELISPOT, MUC1 Н-2Db, Н-2Kb и длительно рестрикционные пептиды были использованы для мониторинга ответа обеих Т-клеток, и CD4 и CD8, после иммунизации. Заметили, что предварительное лечение местным применением Aldara не улучшает значительно количество класса I MHC и класса II и уменьшает количество Т-клеток CD4 и CD8, которые получены с MVATG 9931 (фиг.8).
Во второй секции эксперимента было определено количество MUC1 - специфичных секретирующих IL-4 клеток, при использовании анализа ELISPOT. MUC1 рестрикционные пептиды были использованы для мониторинга ответа обеих Т-клеток, и CD4 и CD8, после иммунизации. Заметили, что предварительное лечение местным применением Aldara сокращает значительно количество реагирующих Т-клеток, которые получены с MVATG 9931 (фиг.9).
В конце концов, степень гуморального ответа против антигена MUC1 также была определена при помощи ELISA. Для того чтобы лучше охарактеризовать тип ответа, который был индуцирован комбинацией Aldara™+MVATG 9931, был проанализирован пул изотипа Ig G. Были обнаружены MUC1 - специфичный Ig G1 и Ig G2a (фиг.10). Заметили, предварительное лечение местным применением Aldara™ вызывает типичный ответ по типу Th 1 (титр выше Ig G2a, чем Ig G1), что может быть использовано для эффективного лечения.
С - Заключения и Обсуждения
Представленные эксперименты впервые продемонстрировали, что лечение местным применением Aldara™ может усилить терапевтическую эффективность (усилить имунную реакцию) вакцины, которая основана на MVA антигенах.
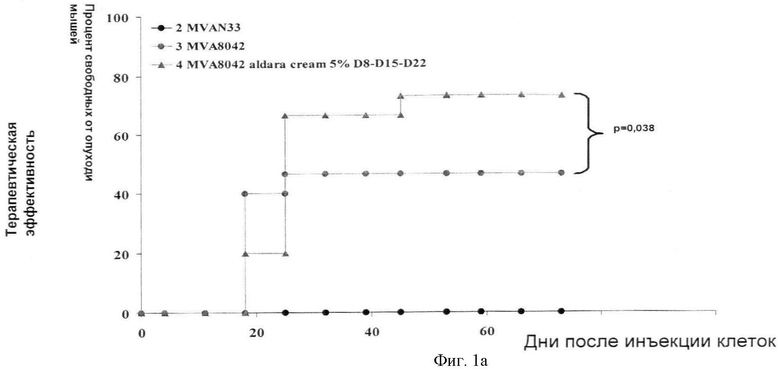
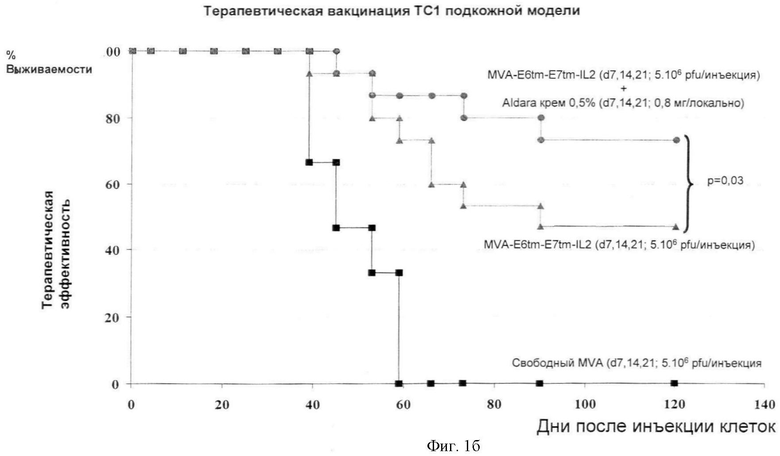


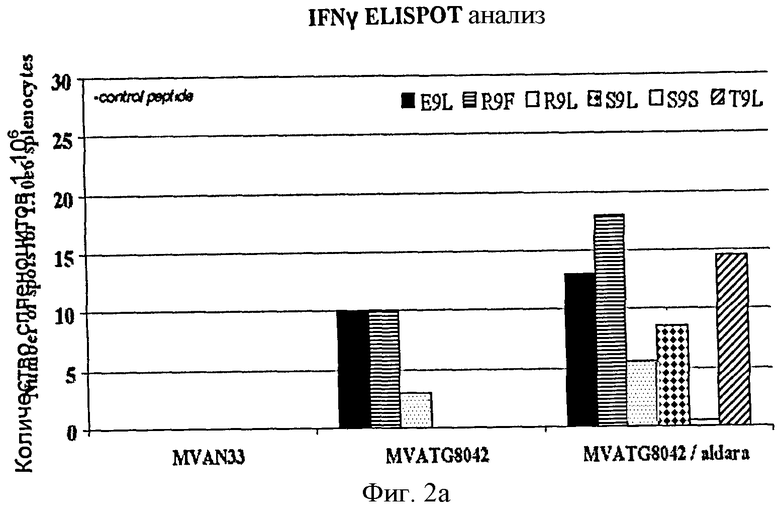
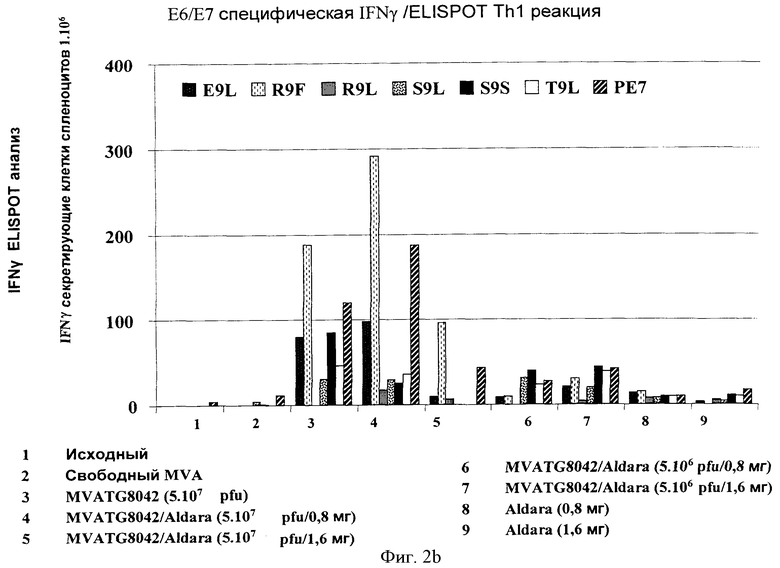
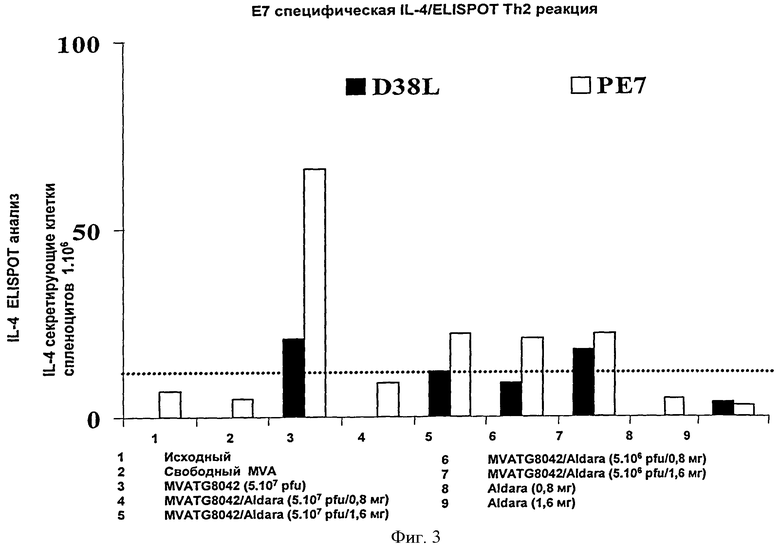
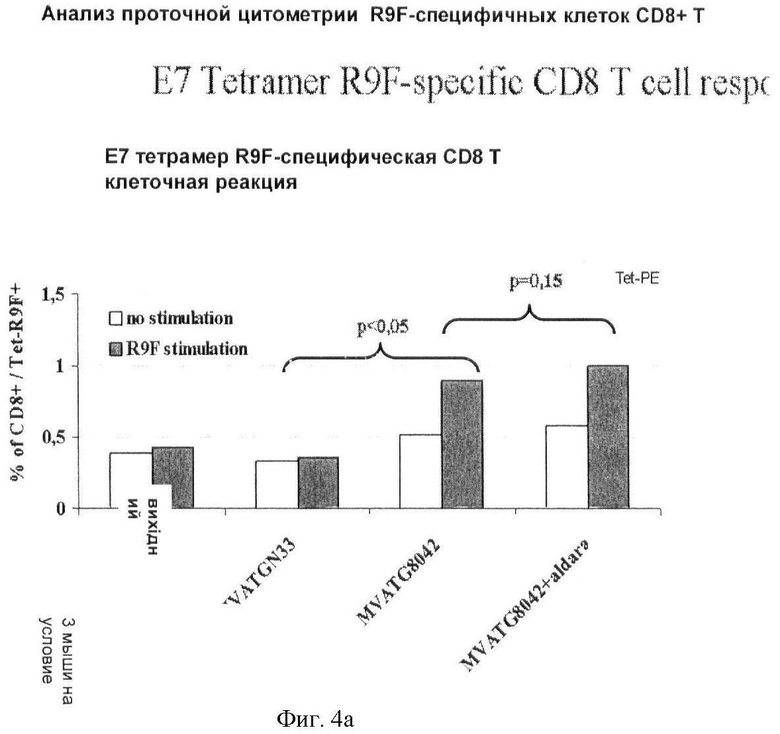
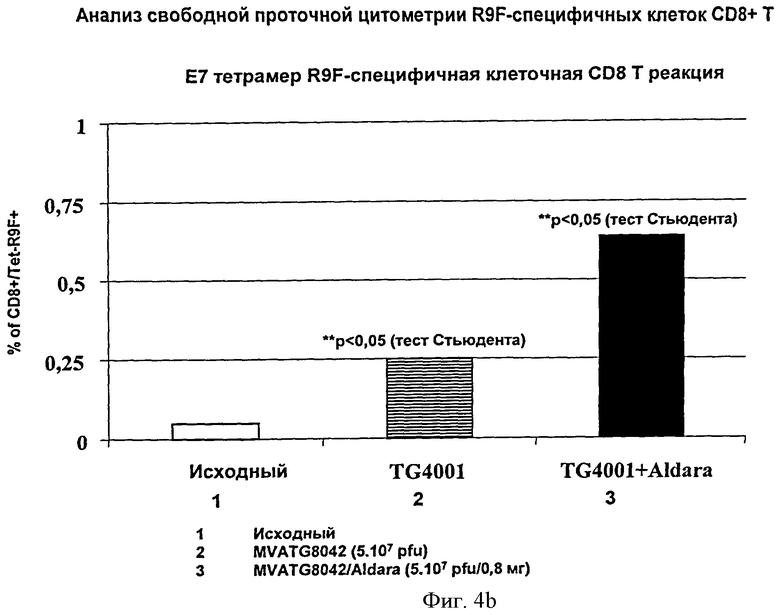
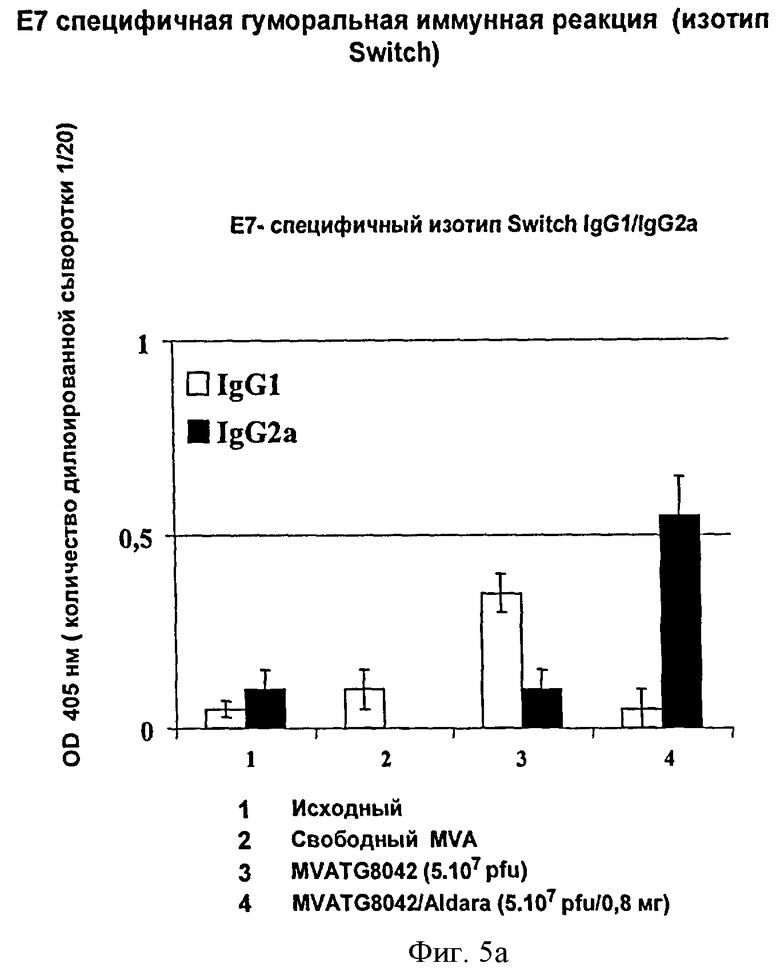
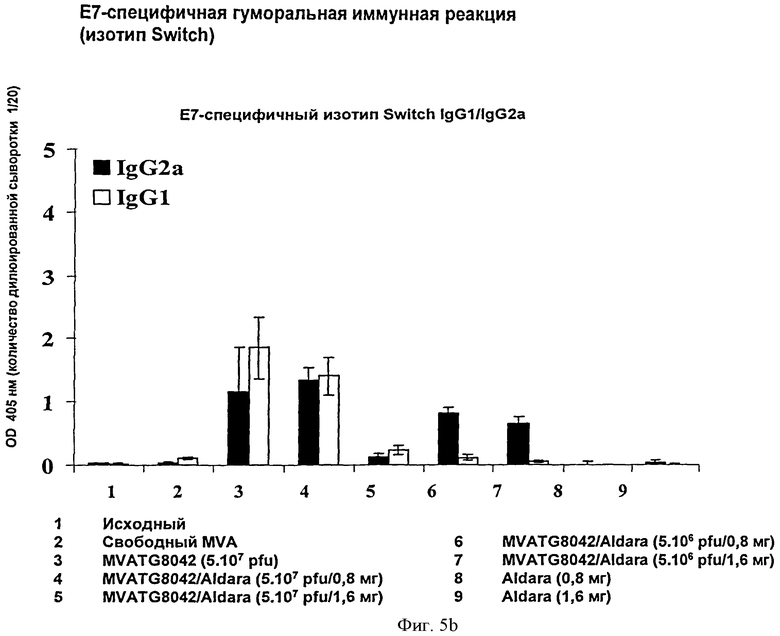
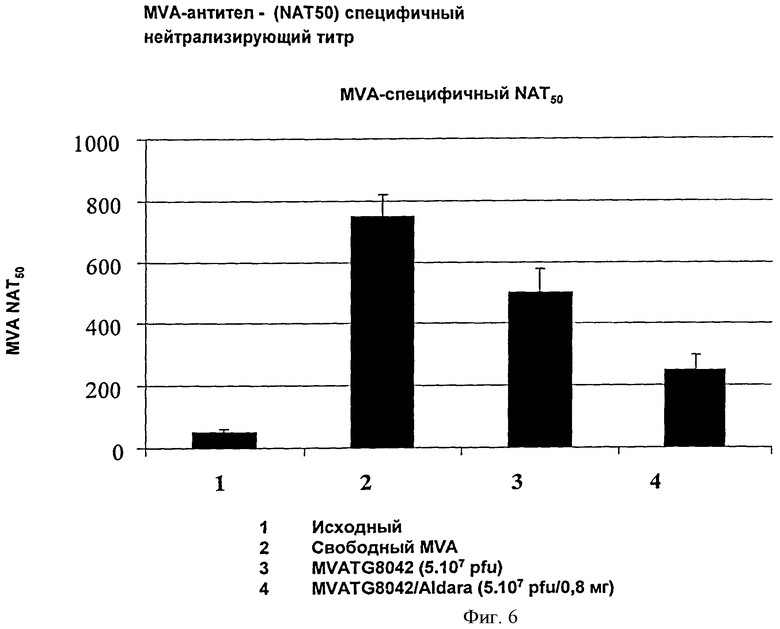
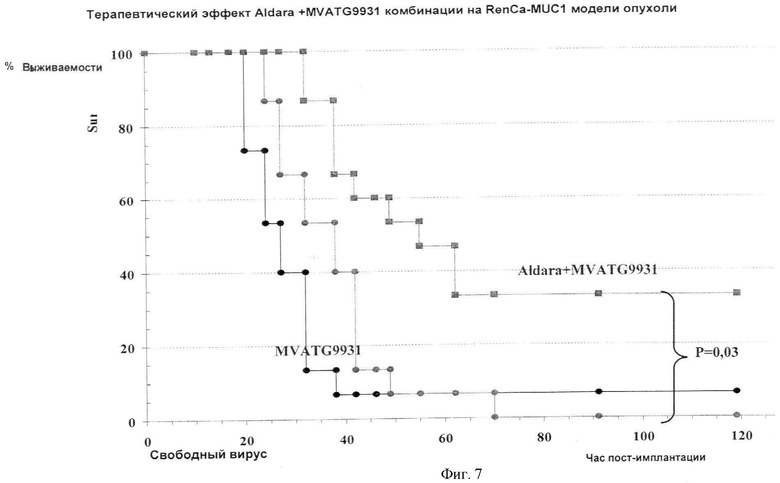
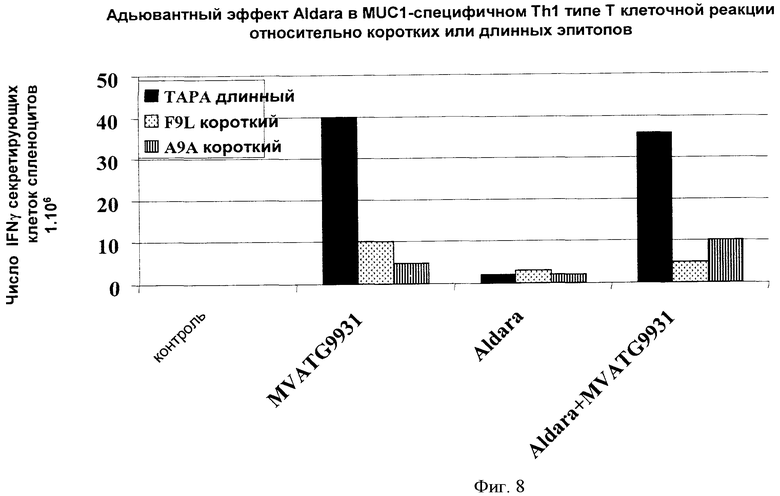
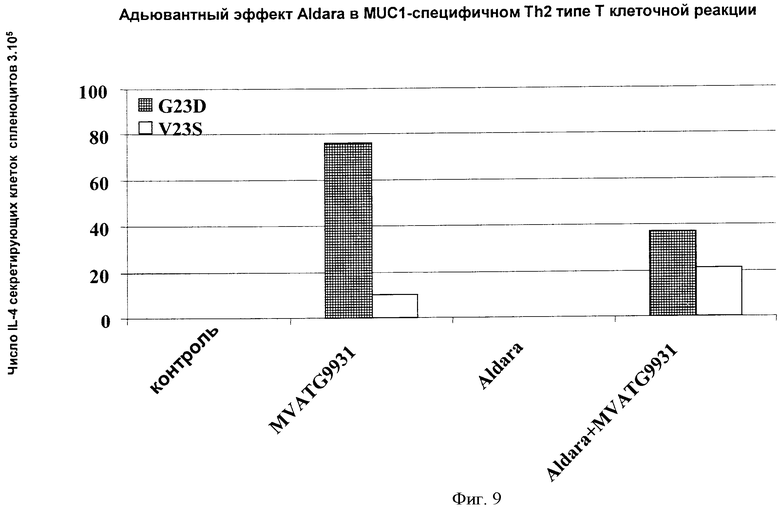
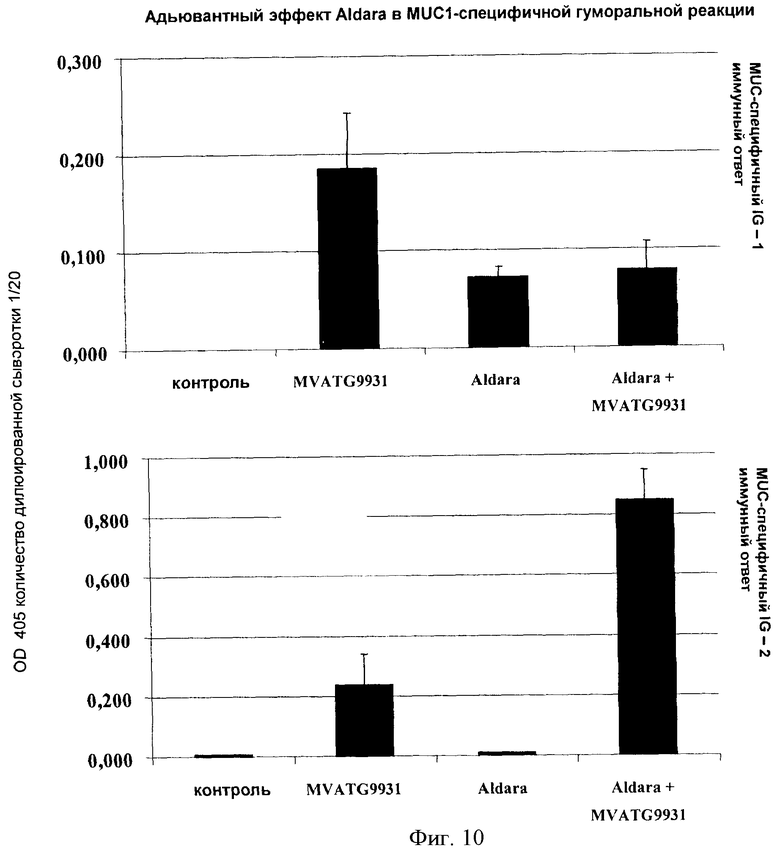
Группа изобретений относится к области медицины и касается рекомбинантных вирусных вакцин. Сущность изобретений включает рекомбинантные вирусные вакцины, содержащие рекомбинантный поксвирусный вектор, который экспрессирует в условиях in vivo, по крайней мере, одну гетерологичную последовательность нуклеотида, которая кодирует антиген и, по крайней мере, одно производное 1H-имидазо[4,5-с]хинолин-4-амина, при этом указанный поксвирусный вектор является MVA. В особенности, представленное изобретение раскрывает комбинированные вакцины, которые включают рекомбинантные вирусные векторы MVA, содержащие нуклеотид, кодирующий один или более антигенов HPV, которые являются способными усилить иммунную реакцию, которая возникает в условиях in vivo под воздействием указанных рекомбинантных вирусных векторов. Преимущество группы изобретений заключается в усилении иммунных реакций. 5 н. и 13 з.п. ф-лы, 2 пр., 10 ил.
1. Рекомбинантная вирусная вакцина, которая содержит (i) по крайней мере один рекомбинантный поксвирусный вектор, который экспрессирует в условиях in vivo по крайней мере одну гетерологичную последовательность нуклеотида, особенно гетерологичную нуклеотидную последовательность, которая кодирует антиген, и (ii) по крайней мере одно производное 1H-имидазо[4,5-с]хинолин-4-амина, где указанный поксвирусный вектор является MVA, а указанное производное
1H-имидазо[4,5-с]хинолин-4-амина выбрано из группы, включающей:
1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-гидрокси-2-метилпропил)-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-гидрокси-2-метилпропил)-2-метил-1Н-имидазо[4,5-с]хинолин-4-амин,
или их сольваты, или соли.
2. Рекомбинантная вирусная вакцина по п.1, где указанная гетерологичная нуклеотидная последовательность (i) кодирует один или большее количество или часть антигенов HPV - Е1, Е2, Е3, Е4, Е5, Е6, Е7, Е8, L1, L2.
3. Рекомбинантная вирусная вакцина по п.1 или 2, где указанная гетерологичная нуклеотидная последовательность (i) кодирует все или часть антигенов MUC1 или их производные.
4. Набор для вакцинации, который включает контейнер, который содержит (i) по крайней мере один рекомбинантный поксвирусный вектор, который экспрессирует в условиях in vivo по крайней мере одну гетерологичную нуклеотидную последовательность, особенно гетерологичную последовательность нуклеотида, которая кодирует антиген, и (ii) по крайней мере одно производное 1H-имидазо[4,5-с]хинолин-4-амина, где указанный поксвирусный вектор является MVA, а указанное производное 1H-имидазо[4,5-с]хинолин-4-амина выбрано из группы, включающей:
1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-гидрокси-2-метилпропил)-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-гидрокси-2-метилпропил)-2-метил-1Н-имидазо[4,5-с]хинолин-4-амин,
или их сольваты, или соли.
5. Набор по п.4, где указанная гетерологичная нуклеотидная последовательность (i) кодирует один или большее количество или часть антигенов HPV - Е1, Е2, Е3, Е4, Е5, Е6, Е7, Е8, L1, L2.
6. Набор по п.4 или 5, где указанная гетерологичная нуклеотидная последовательность (i) кодирует все или часть антигенов MUC1 или их производные.
7. Способ применения по крайней мере одного производного 1Н-имидазо[4,5-с]хинолин-4-амина, который включает приготовление рекомбинантной вирусной вакцины, которая включает (i) по крайней мере один рекомбинантный MVA, который экспрессирует в условиях in vivo по крайней мере одну гетерологичную нуклеотидную последовательность, которая кодирует антиген, и (ii) по меньшей мере одно производное 1Н-имидазо[4,5-с]хинолин-4-амина для усиления иммунного ответа к указанному антигену у пациента, которому вводят указанное производное 1H-имидазо[4,5-с]хинолин-4-амина, которое вводится независимо от другого введения, которое включает введение указанного рекомбинантного MVA, и которое выполняют до указанного второго введения, где указанный поксвирусный вектор является MVA, а указанное производное 1H-имидазо[4,5-с]хинолин-4-амина выбрано из группы, включающей:
1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-гидрокси-2-метилпропил)-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-гидрокси-2-метилпропил)-2-метил-1Н-имидазо[4,5-с]хинолин-4-амин,
или их сольваты, или соли.
8. Способ по п.7, в котором указанная гетерологичная нуклеотидная последовательность (i) кодирует один или несколько или часть антигенов HPV - Е1, Е2, Е3, Е4, Е5, Е6, Е7, Е8, L1, L2.
9. Способ по п.8, в котором указанная гетерологичная нуклеотидная последовательность (i) кодирует все или часть антигенов MUC1 или их производные.
10. Способ по п.7, в котором производное 1H-имидазо[4,5-с]хинолин-4-амина вводится местно.
11. Способ применения по крайней мере одного производного 1Н-имидазо[4,5-с]хинолин-4-амина, который включает приготовление рекомбинантной вирусной вакцины, которая включает (i) по крайней мере один рекомбинантный MVA, который экспрессирует в условиях in vivo по крайней мере одну гетерологичную нуклеотидную последовательность, которая кодирует антиген, и (ii) по меньшей мере одного производного 1Н-имидазо[4,5-с]хинолин-4-амина для усиления иммунного ответа к указанному антигену у пациента, которому вводят указанное производное 1Н-имидазо[4,5-с]хинолин-4-амин, которое вводится в одно и то же время с другим введением, которое включает введение указанного рекомбинантного MVA, где указанный поксвирусный вектор является MVA, а указанное производное 1H-имидазо[4,5-с]хинолин-4-амина выбрано из группы, включающей:
1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-гидрокси-2-метилпропил)-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-гидрокси-2-метилпропил)-2-метил-1Н-имидазо[4,5-с]хинолин-4-амин,
или их сольваты, или соли.
12. Способ по п.11, в котором указанная гетерологичная нуклеотидная последовательность (i) кодирует один или несколько или часть антигенов HPV - Е1, Е2, Е3, Е4, Е5, Е6, Е7, Е8, L1, L2.
13. Способ по п.12, в котором указанная гетерологичная нуклеотидная последовательность (i) кодирует все или часть антигенов MUC1 или их производные.
14. Способ по п.11, в котором производное 1Н-имидазо[4,5-с]хинолин-4-амина вводится местно.
15. Способ применения по крайней мере одного производного 1H-имидазо[4,5-с]хинолин-4-амина, который включает приготовление рекомбинантной вирусной вакцины, которая включает (i) контейнер, который содержит по крайней мере один рекомбинантный MVA, который экспрессирует в условиях in vivo по крайней мере одну гетерологичную нуклеотидную последовательность, которая кодирует антиген, и (ii) контейнер, который содержит по меньшей мере одно производное 1Н-имидазо[4,5-с]хинолин-4-амина для усиления иммунного ответа к указанному антигену у пациента, которому вводят указанное производное 1H-имидазо[4,5-с]хинолин-4-амина, которое вводят в одно и то же время с другим введением, которое включает введение указанного рекомбинантного MVA, а указанное производное 1H-имидазо[4,5-c]хинолин-4-амина выбрано из группы, включающей:
1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-гидрокси-2-метилпропил)-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-гидрокси-2-метилпропил)-2-метил-1Н-имидазо[4,5-с]хинолин-4-амин,
или их сольваты, или соли.
16. Способ по п.15, в котором указанная гетерологичная нуклеотидная последовательность (i) кодирует один или несколько или часть антигенов HPV - Е1, Е2, Е3, Е4, Е5, Е6, Е7, Е8, L1, L2.
17. Способ по п.16, в котором указанная гетерологичная нуклеотидная последовательность (i) кодирует все или часть антигенов MUC1 или их производные.
18. Способ по п.15, в котором производное 1H-имидазо[4,5-с]хинолин-4-амина вводится местно.
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| US 6331539 B1, 18.12.2001 | |||
| Faynsod M | |||
| et al | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| ALCAMF A | |||
| et al | |||
| Vaccinia virus strains Lister, USSR and Evans express soluble and cell-surface tumour necrosis factor receptors, J | |||
| of General Virology, 1999, v | |||
| Капельная масленка с постоянным уровнем масла | 0 |
|
SU80A1 |
Авторы
Даты
2012-06-20—Публикация
2007-06-15—Подача