Настоящее изобретение относится к применению молекулы нуклеиновой кислоты, либо вектора, либо инфекционной вирусной частицы, кодирующих по меньшей мере один полипептид Е2 папилломавируса, для изготовления лекарства, предназначенного для лечения папилломавирусных инфекций. Изобретение представляет весьма специальный интерес в области иммунотерапии, и более конкретно для лечения пациента, страдающего персистентной папилломавирусной инфекцией.
Папилломавирусы выделены в ряде высших организмов, где они инфицируют эпителиальные ткани кожи и слизистых оболочек. В настоящее время у людей идентифицировано более 100 генотипов папилломавируса человека (HPV) (Stoler, 2000, Int. J. Gynecol. Path 19, 16-28), которые можно классифицировать как генотипы "низкого риска", обычно связанные с доброкачественными опухолями (например, HPV-6 и HPV-11), и генотипы "высокого риска", которые связаны с повреждениями с потенциалом прогрессирования до предраковых повреждений (например, интраэпителиальная цервикальная неоплазия, ИЦН) и, в конечном счете, до злокачественных опухолей. Например, более 99% раков шейки матки содержат ДНК HPV, и пять генотипов "высокого риска" HPV (HR-HPV) распознаны как основной причинный фактор, причем HPV-16 и HPV-18 обнаруживают примерно в 70% инвазивных раков шейки матки, диагностированных во всем мире (Clifford et al., 2003, Br J Cancer 88, 63-73), a HPV-31, HPV-33 и HPV-45 ответственны за дополнительные 10% (Cohen et al., 2005, Science 308, 618-621).
Папилломавирусы представляют собой мелкие ДНК-вирусы, окруженные белковым капсидом (см., например, Pfister, 1987, в The papovaviridae: The Papillomaviruses, Saizman and Howley edition, Plenum Press, New York, p.1-38). Геном представляет собой двунитевую кольцевую ДНК примерно 7900 пар оснований, которая состоит из трех функциональных областей, ранней (Е), поздней (L) и длинной регуляторной области (LCR). Области LCR содержат транскрипционные регуляторные последовательности, такие как энхансеры и промоторы. Поздняя область кодирует структурные белки L1 и L2, соответственно, главный и малый капсидные белки, где ранняя область кодирует регуляторные белки (Е1-Е7), обнаруженные преимущественно в ядре, которые регулируют вирусную репликацию, транскрипцию и клеточную трансформацию.
Белок Е1 является самым большим (длина HPV-16 Е1 составляет 649 аминокислот) и наиболее консервативным белком, кодируемым геномом папилломавируса. Е1 представляет собой ДНК-связывающий фосфопротеин с АТФ-зависимой геликазной активностью, которая требует димеризации и взаимодействия с Е2 для стимуляции вирусной репликации (Desaintes and Demeret, 1996, Semin. Cancer Biol. 7, 339-347; Wilson et a/, 2002, Virus Gene 24, 275-290). Геликазная активность локализована в С-концевом домене Е1, а ДНК-связывающий домен в центральном домене. Белок Е2 (длина HPV-16 Е2 составляет 365 аминокислот) представляет собой многофункциональный ДНК-связывающий фосфопротеин, который регулирует транскрипцию вирусных генов и контролирует репликацию ДНК (Bechtold et al., 2003, J. Virol. 77, 2021-2028). Регуляция вирусной транскрипции требует димеризации и связывания димеров Е2 с Е2-связывающим сайтом (консенсус-последовательностью ACCN6GGT), окружение которого определяет, имеет ли место трансактивация или репрессия вирусной транскрипции (Ham et al., 1991, Trends Biochem. Sci. 16, 440-444; Me Bride et al., 1991, J. Biol. Chem. 266, 18411-18444). Е2 также обеспечивает репрессию промотора HPV-16 р97, который контролирует экспрессию онкобелков Е6 и Е7. Наконец, Е2 вовлечен в деление вирусного генома в дочерних клетках. N-концевой домен HPV-16 Е2 ответственен за трансактивацию, взаимодействие с Е1 и стимуляцию репликации, тогда как С-концевой домен вовлечен в связывание ДНК и димеризацию (McBride et al., 1989, Proc. Natl. Acad. Sci. USA, 86, 510-514). Белок, кодируемый Е4, связывает и прерывает цитоплазматическую кератиновую сеть и играет роль в созревании вируса. Функция белка Е5 все еще является спорной. Белки Е6 и Е7 вовлечены в онкогенную трансформацию клеток, инфицированных HR-HPV (Kanda et al., 1988, J. Virol. 62, 610-613; Vousden et al., 1988, Oncogene Res. 3, 1-9; Bedell et al., 1987, J. Virol. 61, 3635-3640), посредством связывания этих вирусных белков с продуктами клеточного гена опухолевого супрессора р53 и ретинобластомы (Rb), соответственно (обзор в Howley, 1996, Papillomaviruses and their replication, p.2045-2076, в B.N. Fields, D.M. Knipe and P.M. Howley (ed), Virology, 3rd ed. Lippincott-Raven Press, New York, N.Y.).
Инфекция HPV является одной из наиболее частых инфекций, передающихся половым путем, и примерно 25% взрослых людей, живущих половой жизнью, инфицировано HPV (Woodman et al., 2001, The Lancet 357, 1831-1836). Примерно у 80% субъектов достигается спонтанная эрадикация вируса в течение 6-12 месяцев (Но et al., 1998, N EngI J Med 338, 423-428). Однако у остальных 20% инфекция HPV прогрессирует до предраковых повреждений ИЦН, которые, если они не диагностированы, могут привести к инвазивным ракам (O'Shaughnessy et al., 2002, Clinical cancer Research 2, 314-346). Оказалось, что в механизм, вызывающий неоплазию, вовлечена интеграция генома HPV в клеточные хромосомы (Cullen et al., 1991, J. Virol. 65, 606-612). В большинстве случаев это приводит к прерыванию геномной ДНК HPV в области Е1/Е2, высвобождению промотора Е6/Е7 от репрессорного эффекта Е2 и, следовательно, к повышенной регуляции экспрессии Е6 и Е7 и клеточной трансформации.
Профилактические вакцины, направленные на предупреждение инфекции HPV, в настоящее время близки к достижению рынка. Они направлены на капсидные белки, экспрессируемые на поверхности вируса, с целью блокирования вируса прежде, чем он проникнет в клетки-хозяева, главным образом, посредством индукции нейтрализующих антител. Они в целом основаны на белках L1, продуцируемых рекомбинантным путем, которые спонтанно претерпевают повторную сборку в ВПЧ (вирусоподобные частицы). Две вакцины HPV, изготавливаемые фирмами Merck и GlaxoSmithKline (GSK), успешно прошли завершение клинических испытаний фазы III, показав почти 100% эффективность при предупреждении типоспецифичных инфекций шейки матки. Вакцина GSK содержит смесь ВПЧ HPV-16 и HPV-18, тогда как в вакцину Merck также включены ВПЧ от HPV-6 и HPV-11, которые вызывают остроконечные кондиломы.
Однако субъекты, уже инфицированные HPV, непригодны для профилактической вакцинации, и терапевтические вакцины представляют интерес для лечения инфицированных пациентов, имеющих риск развития повреждений с онкогенным потенциалом. Поскольку онкогенная активность свойственна экспрессии генов HPV E6 и Е7 в инфицированных клетках, огромные усилия направлены на блокирование их экспрессии или на индукцию клеточного иммунного ответа против этих трансформирующих генных продуктов. В литературе описаны различные подходы, например, основанные на применении антисенс-РНК (Steele et al., 1993, Cancer Res 53, 2330-2337; He et al., 1997, Cancer Res. 57, 3993-3999; Choo et al., 2000, Gynecol. Oncol. 78, 293-301), рибозимов (Chen et al., 1996, Cancer gen Ther. 3, 18-23; Pan et al., 2004, Mol. Ther. 9, 596-606), миРНК (малых интерферирующих РНК) (Butz et al., 2003, Oncogene 22, 5938-5945; Koivusalo et al., 2005, Mol. Pharmacol. 68, 372-382), иммуногенных пептидов (Feltkamp et al., 1993, Eur. J. Immunol. 23, 2242-2249), плазмид, кодирующих E6 и/или Е7 (Peng et al., 2004, J. Virol. 78, 8468-8476), и вирусных векторов (W090/10459; W099/03885; Kaufmann et al., 2002, Clinical Cancer Res. 8, 3676-3685).
Поскольку белок Е2 экспрессируется на ранней стадии инфекции HPV, он представляет вторую потенциальную мишень для терапевтической вакцинации. Доклинические исследования, проведенные на кроликах, инфицированных папилломавирусом американского кролика (CRPV), показали защиту против внедренных повреждений, обусловленных папилломавирусом, вследствие экспрессии Е2. Например, введение рекомбинантного аденовирусного вектора, экспрессирующего белок CRPV E2, привело в результате к клиренсу CRPV-индуцированной папилломы и инфекции, вероятно, посредством клеточно-опосредованного иммунитета (Brandsma et al, 2004, J. Virol. 78, 116-123). Введение ДНК, кодирующей белки CRPV E1 и E2, было также эффективным для предупреждения или по меньшей мере замедления развития карциномы CRPV-индуцированных кожных папиллом (Нап et al., 2000, J. Virol. 74, 9712-9716), хотя было показано, что защитный иммунитет зависит от пути введения (Нап et al., 2000, Vaccine 18, 2937-2944). Терапевтический потенциал E2 для лечения повреждений, обусловленных папилломавирусом, был также подтвержден у субъекта человека, который был подвергнут воздействию HPV. Анти-Е2 специфичный Т-хелперный иммунитет часто обнаруживали у здоровых субъектов (De Jong et al., 2002, Cancer Res. 62, 472-479), тогда как нарушенный CD4+Т-клеточный иммунитет против E2 и Е6 наблюдали у женщин, страдающих раками шейки матки, обусловленными HPV-16 (De Jong et al., 2004, Cancer Res. 64, 5449-5455).
Клинические испытания фазы II проходят у пациентов с обусловленной HPV ИЦН высокой степени 2 и 3, применяющих рекомбинантный вектор MVA (модифицированный вирус Анкара), кодирующий белок E2 бычьего папилломавируса (BPV). Вирусные частицы инъецируют непосредственно в повреждения ИЦН и ожидают, что продуцирование E2 в клетках, экспрессирующих Е6 и Е7, приводит к апоптозу. Регрессию повреждений ИЦН действительно наблюдали у большинства пролеченных пациентов. Однако в некоторых случаях вирусная ДНК не элиминировалась, и рецидив повреждений был обнаружен спустя 1 год (Garcia-Hernandez et al., 2006, Cancer Gene Ther. 13, 592-597).
Можно ожидать, что HPV будет продолжать представлять серьезную глобальную угрозу для здоровья в течение многих лет вследствие персистентной природы инфекции, ее высокой распространенностью и значительной заболеваемостью HPV-индуцированными раками. Действительно, продемонстрировано, что женщины с персистентной инфекцией HR-HPV обладают значительно более высоким риском, вплоть до 200-кратного, развития повреждений ИЦН по сравнению с неинфицированными женщинами или женщинами, у которых достигнут спонтанный клиренс вируса (Bory et al., 2002, Int J Cancer 102, 519-525).
Инфекцию HPV, как правило, обнаруживают, осуществляя скрининг на патологии (например, пап-тест мазка со слизистой шейки матки). В настоящее время единственным медицинским достижением диагностики инфекции HPV является применение более частого обследования с целью обнаружения повреждений (например, ИЦН 2/3 высокой степени), как только они возникают, которые затем могут быть удалены с помощью абляционных процедур, таких как электрохирургическая эксцизия петлей (ЭЭП) и клиновидная биопсия (конизация) шейки матки. Такие процедуры в глобальном масштабе эффективны на 90%, однако, вызывают риск акушерских осложнений (например, которые могут влиять на возможность вынашивания ребенка женщинами в репродуктивном возрасте). Эта ситуация, кроме того, что она не является полностью удовлетворительной с медицинской точки зрения, также приводит к дискомфорту (тревоге) для пациента.
Следовательно, существует необходимость в разработке вакцины для лечения пациентов с персистентной инфекцией HPV, особенно в свете высокого риска у данного населения прогрессирования до предраковых повреждений и впоследствии до рака.
Таким образом, в этой связи настоящее изобретение представляет значительное преимущество. В настоящем изобретении предложен неинвазивный и безопасный способ, который дает возможность более ранней защиты против инфекций, вызванных генотипами HR-HPV. Оно обладает преимуществом обеспечения лечения инфицированных пациентов до появления повреждений, обусловленных папилломавирусом, и, следовательно, снижения риска развития предраковых и раковых опухолей. Настоящее изобретение успешно дает возможность снизить риск, связанный с общепринятыми абляционными процедурами (например, акушерские осложнения), в то же время, улучшая комфорт для пациентов (например, уменьшение тревоги, связанной с обследованием на повреждения). Важно, что настоящее изобретение может также дать возможность уменьшить риск будущих рецидивов вследствие повторной инфекции HPV посредством уничтожения инфекционного папилломавируса и его родственных изолятов.
Данная техническая задача решена путем разработки воплощений, которые определены в формуле изобретения.
Другие и дополнительные аспекты, признаки и преимущества настоящего изобретения станут очевидными на основании последующего описания предпочтительных в настоящий момент воплощений изобретения. Эти воплощения приведены в целях описания.
Соответственно, в первом аспекте в настоящем изобретении предложено применение молекулы нуклеиновой кислоты, кодирующей по меньшей мере один полипептид Е2 папилломавируса, либо вектора, либо инфекционной вирусной частицы, содержащих указанную молекулу нуклеиновой кислоты, для изготовления лекарства, предназначенного для лечения организма-хозяина, страдающего персистентной папилломавирусной инфекцией, вызванной по меньшей мере одним папилломавирусом. Настоящее изобретение также относится к указанной молекуле нуклеиновой кислоты, вектору или инфекционной вирусной частице для применения при лечении персистентной папилломавирусной инфекции у организма-хозяина. Согласно одному воплощению указанную молекулу нуклеиновой кислоты, вектор или инфекционную вирусную частицу вводят после воздействия на организм-хозяин по меньшей мере одного папилломавируса и до обнаружения/выявления повреждения, обусловленного папилломавирусом.
На протяжении всей заявки, когда употребляют единственное число, подразумевают "по меньшей мере один", "по меньшей мере первый", "один или более чем один" или "множество" упоминаемых соединений или стадий, если контекстом не продиктовано иное. Например, термин "полипептид Е2 папилломавируса" охватывает уникальный тип полипептида Е2 папилломавируса а также множество полипептидов Е2 папилломавируса, включая их смесь.
Термин "и/или" при использовании здесь включает значение "и", "или" и "все или любая другая комбинация элементов, объединенных указанным термином".
Термин "примерно" или "приблизительно", как используют здесь, означает в пределах 20%, предпочтительно в пределах 10% и более предпочтительно в пределах 5% данного значения или интервала.
Термины "аминокислоты" и "остатки" являются синонимами и охватывают как природные аминокислоты, так и аналоги аминокислот (например, неприродные, синтетические и модифицированные аминокислоты, включая D или L оптические изомеры).
Термины "полипептид", "пептид" и "белок" используют здесь взаимозаменяемо как относящиеся к полимерам аминокислотных остатков, которые включают девять или более чем девять аминокислот, связанных пептидными связями. Этот полимер может быть нормальным, разветвленным или циклическим и может включать встречающиеся в природе аминокислоты и/или аналоги аминокислот, а также может быть прерван не аминокислотами. В качестве общего указания, если аминокислотный полимер является длинным (например, более чем 50 аминокислотных остатков), на него предпочтительно ссылаются как на полипептид или белок, тогда как, если он имеет длину 50 аминокислот или менее, на него ссылаются как на "пептид".
В контексте настоящего изобретения термины "нуклеиновая кислота", "молекула нуклеиновой кислоты", "полинуклеотид" и "нуклеотидная последовательность" используют взаимозаменяемо, и они определяют полимер любой длины, либо молекулы полидезоксирибонуклеотидов (ДНК) (например, кДНК, геномную ДНК, плазмиды, векторы, вирусные геномы, изолированную ДНК, зонды, праймеры и любую их смесь), либо полирибонуклеотидов (РНК) (например, мРНК, антисенс-РНК), либо смешанных полирибо-полидезоксирибонуклеотидов. Они охватывают одно- или двунитевые, линейные или циклические, природные или синтетические полинуклеотиды. Кроме того, полинуклеотид может включать не встречающиеся в природе нуклеотиды, такие как метилированные нуклеотиды и нуклеотидные аналоги (см. US 5525711, US 4711955 или ЕРА 302175 как примеры модификаций), а также может быть прерван не нуклеотидными компонентами. Модификации нуклеотида, если они присутствуют, могут быть приданы до или после полимеризации.
Как используют здесь, при использовании для определения продуктов, композиций и способов под термином "включающий" следует подразумевать, что продукты, композиции и способы включают упоминаемые компоненты или стадии, но не исключают другие. Под "состоящим по существу из" следует подразумевать исключающий другие компоненты или стадии какой-либо существенной значимости. Таким образом, композиция, состоящая по существу из перечисленных компонентов, не должна исключать следовые примеси и фармацевтически приемлемые носители. Под "состоящим из" следует подразумевать исключающий более чем следовые элементы других компонентов или стадий. Например, полипептид, "состоит из" аминокислотной последовательности, когда этот полипептид не содержит какие-либо другие аминокислоты, кроме перечисленной аминокислотной последовательности. Полипептид "состоит по существу из" аминокислотной последовательности, когда такая аминокислотная последовательность присутствует вместе только с несколькими дополнительными аминокислотными остатками, типично от примерно 1 до примерно 50 дополнительных остатков или около того. Полипептид "включает" аминокислотную последовательность, когда эта аминокислотная последовательность составляет по меньшей мере часть конечной аминокислотной последовательности полипептида. Такой полипептид может иметь от нескольких вплоть до нескольких сотен дополнительных аминокислотных остатков. Такие дополнительные аминокислотные остатки могут играть роль, среди прочего, в переносе полипептида, облегчении продуцирования или очистки полипептида;
продлении времени полужизни. То же можно применить к нуклеотидным последовательностям.
Термин "клетка-хозяин" следует понимать в широком смысле как охватывающий изолированные клетки, группу клеток, а также особую организацию клеток, например, в ткани или органе. Такие клетки могут представлять собой первичные, трансформированные или культивируемые клетки. Они могут быть прокариотическими (например, Escherichia coli), дрожжевыми (например, Saccharomyces cerevisiae, Saccharomyces pombe или Pichia pastoris), эукариотическими (например, клетками насекомых, растений и млекопитающих, включая человеческие клетки). Термин "клетка-хозяин" включает клетки, которые могут быть или являются реципиентом молекулы нуклеиновой кислоты, вектора или инфекционной вирусной частицы при применении в данном изобретении, и потомство таких клеток.
Термин "организм-хозяин" относится к позвоночному, в частности, к члену вида млекопитающих, и особенно к домашним животным, сельскохозяйственным животным, спортивным животным и приматам, включая людей. Предпочтительно организм-хозяин представляет собой пациента, страдающего персистентной папилломавирусной инфекцией, вызванной по меньшей мере одним папилломавирусом.
"Папилломавирус" относится к вирусу, который принадлежит к подсемейству Papillomavirinae. Это определение охватывает папилломавирус как животных происхождения от видов, отличных от человека, включающих, но не ограниченных ими, крупный рогатый скот, лошадей, кроликов, овец, собак, приматов, отличных от человека, и грызунов, так и человеческий папилломавирус (HPV).
"HPV" относится более конкретно к папилломавирусу происхождения от вида человек и/или способному инфицировать человека. К настоящему времени идентифицировано более чем 100 генотипов HPV, и они пронумерованы в хронологическом порядке их выделения. По договоренности классификация HPV основана на степени родства их геномов. Филогенетическое древо было сконструировано на основании выравнивания доступных нуклеотидных последовательностей (Van Ranst et al., 1992, J. Gen. Virol. 73, 2653; De Villiers et al., 2004, Virology 324, 17-27). HPV можно подразделить как "высокого риска" (HR-HPV) и "низкого риска" (LR-HPV). HR-HPV относится к HPV, который имеет сильную связь с клеточной трансформацией, которая может привести к повреждениям с потенциалом прогрессирования до злокачественных повреждений. Типы HR-HPV включают без ограничения HPV-16, HPV-18, HPV-30, HPV-31, HPV-33, HPV-35, HPV-39, HPV-45, HPV-51, HPV-52, HPV-56, HPV-58, HPV-59, HPV-66, HPV-68, HPV-70 и HPV-85. LR-HPV относится к HPV, который имеет слабый потенциал клеточной трансформации, которая может привести к доброкачественным повреждениям, таким как папилломы, с низким потенциалом прогрессирования до злокачественных повреждений. Типы LR-HPV включают без ограничения HPV-6 и HPV-11.
Папилломавирус может быть изолирован, клонирован или выделен из любого источника в природе. Такие источники включают биологические образцы, культивируемые клетки, а также рекомбинантные материалы. Как используют здесь, "биологический образец" охватывает разнообразие образцов, собранных из организма-хозяина, подвергнутого воздействию папилломавируса, которые можно использовать в качестве источника папилломавируса, либо при диагностическом или мониторинговом анализе. В контексте изобретения с биологическим образцом можно манипулировать любым путем после его сбора, как, например, путем обработки реагентами, солюбилизации или обогащения определенными компонентами (например, полипептидами или молекулами нуклеиновых кислот). Это определение охватывает биологические жидкости (например, кровь, плазму, сыворотку), жидкие образцы (например, вагинальные, цервикальные жидкости, цитологические образцы), твердые тканевые образцы (например, тканевые срезы, пробу биопсии) и тканевые культуры. Термин "культивируемые клетки' охватывает клетки в культуре (например, клетки CaSki, имеющиеся в АТСС), надосадочные жидкости клеток и клеточные лизаты. Рекомбинантные материалы включают без ограничения папилломавирус (например, имеющийся в депозитных учреждениях), папилломавирусный геном, геномные или кДНК библиотеки, плазмиды, содержащие фрагмент(ы) папилломавирусного генома или любой вектор предшествующего уровня техники, известный как включающий такие элементы.
В качестве общей информации нуклеотидные последовательности ряда папилломавирусных геномов и аминокислотные последовательности кодируемых полипептидов описаны в литературе и доступны в специализированных базах данных, например, Genbank, номера по каталогу МС_01526 и К02718 в связи с HPV-16; NCJ501357 и Х05015 в связи с HPV-18; J04353 в связи с HPV-31; М12732 в связи с HPV-33; МС_001529 в связи с HPV-35; NC_001535 в связи с HPV-39; Х74479 в связи с HPV-45; МС_001533 в связи с HPV-51; МС_001592 в связи с HPV-52; Х74483 в связи с HPV-56; D90400 в связи с HPV-58; NC 001635 в связи с HPV-59; Х67160 и М73258 в связи с HPV-68; U21941 в связи с HPV-70 и AF131950 в связи с HPV-85.
Как используют здесь, термин "полипептид Е2 папилломавируса" охватывает нативные полипептиды Е2 (то есть такие, которые экспрессируются с ОРС Е2 в источнике папилломавируса в природе), модифицированные полипептиды Е2 и их иммуногенные пептиды.
Иммуногенный пептид Е2 имеет по меньшей мере 9 аминокислот, и данный термин включает эпитопы Е2 (например, специфичные аминокислотные мотивы, которые способны индуцировать или активировать иммунный ответ посредством биохимического пути, опосредованного ГКГ класса I и/или класса II, такие как описаны в ЕР 523395), конструкцию из множества эпитопов (например, как описано в WO 2005/089164) и укороченные полипептиды Е2. Укорочение может варьировать от 1 до 300 аминокислотных остатков, которые могут быть непрерывными или нет и локализованы в N-конце и/или С-конце и/или внутренней части.
Полипептид Е2, кодируемый молекулой нуклеиновой кислоты, при применении в изобретении может иметь происхождение из любого папилломавирусного генотипа при особом предпочтении для генотипа HR-HPV, такого как генотип, выбранный из группы, состоящей из вышеперечисленных, и более конкретно HPV-16, HPV-18, HPV-33 или HPV-52, или любой их комбинации (например, обоих генотипов HPV-16 и HPV-18). Большое число нативных полипептидов Е2 описано в литературе, например, HPV-18 Е2 в Cole et al. (1987, J. Mol. Biol. 193, 599-608); HPV-16 Е2 в Seedorf et al. (1985, Virology. 145, 181-185) и Kennedy et al., (1991, J. Virol.,,65, 2093-2097), HPV-31 Е2 в Goldsborough et al. (1989, Virology 171, 306-311), HPV-33 Е2 в Cole et al. (1986, J. Virol., 58,991-995) и Е2 бычьего папилломавируса BPV-1 в Chen et al. (1982, Nature 299, 529-534) и в Danos et al. (1983, J. Virol. 46, 557-566). В целях иллюстрации аминокислотная последовательность полипептида Е2 HPV-16 приведена в SEQ ID NO: 1.
Однако настоящее изобретение не ограничено этими примерными последовательностями. В действительности нуклеотидные и аминокислотные последовательности могут варьировать между различными изолятами папилломавируса, и эта природная генетическая вариация включена в объем изобретения как и неприродная модификация(и), как описано ниже. Термин "модификация" включает делецию, замену или добавление одного или более чем одного нуклеотидного остатка или любую комбинацию этих возможностей. Когда рассматривают несколько модификаций, они могут касаться последовательных остатков и/или не последовательных остатков. Модификация(и) может быть получена в молекуле нуклеиновой кислоты при применении в изобретении с помощью ряда путей, известных специалистам в данной области техники, таких как сайт-направленный мутагенез (например, с использованием системы мутагенеза SculptorTM in vitro формы Amersham, Les Ullis, France), ПЦР мутагенез, перестройки ДНК, а также с помощью методик химического синтеза (например, приводящего в результате к синтетической молекуле нуклеиновой кислоты).
Модификация(и), рассматриваемая настоящим изобретением, охватывает как молчащие модификации, которые не изменяют аминокислотную последовательность кодируемого Е2 папилломавируса, так и модификации, которые транслируются в кодируемый полипептид Е2, приводя в результате к модифицированной аминокислотной последовательности по сравнению с соответствующей нативной последовательностью.
Модификации, которые являются молчащими на уровне кодируемого полипептида Е2, типично осуществляют путем замены одного или более чем одного кодона кодирующей последовательности Е2 одним или более чем одним кодоном, кодирующим ту же аминокислоту. Если остаток Met или Тrр кодирует уникальный кодон, в данной области техники хорошо известно, что 6 различных кодонов могут быть использованы для кодирования аргинина, лейцина или серина, и четыре различных кодона для кодирования аланина, глицина, пролина, треонина и валина. Поэтому возможно изменить Е2-кодирующую нуклеотидную последовательность без изменения аминокислотной последовательности. Желательно целью таких модификаций является улучшение экспрессии полипептида Е2 папилломавируса в данной клетке-хозяине или в данном организме-хозяине, например, у млекопитающего, включая человеческие клетки-хозяева. Репрезентативные примеры таких модификаций включают без ограничения супрессию редко используемого кодона(ов) за счет оптимизации кодонов, супрессию негативных элементов последовательности, для которых ожидают отрицательное влияние на уровень экспрессии, и/или супрессию гомологичных последовательностей, для которых ожидают отрицательное влияние на стабильность молекулы нуклеиновой кислоты или вектора, применяемых в настоящем изобретении.
Типично оптимизацию кодонов осуществляют путем замены одного или более чем одного "нативного" (например, HPV) кодона, соответствующего кодону, редко используемому в интересующей клетке-хозяине, одним или более чем одним кодоном, кодирующим ту же аминокислоту, которые используется чаще. Нет необходимости заменять все нативные кодоны, соответствующие редко используемым кодонам, поскольку повышенная экспрессия может быть достигнута даже при частичной замене. Кроме того, можно провести некоторые отклонения от строгого соблюдения оптимизированного использования кодонов для приспособления к введению сайта(ов) рестрикции в полученную в результате молекулу нуклеиновой кислоты. Такие молекулы нуклеиновой кислоты с оптимизированными кодонами описаны в литературе, например, в WO 01/14416, WO 02/08435 и WO 03/018055.
Репрезентативные примеры негативных элементов последовательности, которые пригодны для супрессии в контексте изобретения, включают без ограничения области, имеющие очень высокое (>80%) или очень низкое (<30%) содержание GC; области, имеющие очень высокое содержание AT; нестабильные прямые или инвертированные повторяющиеся последовательности; вторичные структуры РНК и/или внутренние криптические регуляторные элементы, такие как внутренние ТАТА-боксы, Хи-сайты, сайты присоединения рибосомы и/или донорные/акцепторные сайты сплайсинга.
Присутствие гомологичных последовательностей в молекуле нуклеиновой кислоты или векторе, применяемых в изобретении, как ожидают, оказывает отрицательное влияние на их стабильность, в частности, на стадии продуцирования вектора. Между гомологичными последовательностями может происходить рекомбинация, возможно, приводящая к потере участка, содержащегося между двумя гомологичными последовательностями. Как используют здесь, термин "гомологичные последовательности" обозначает нуклеотидные последовательности, которые сохраняют высокую степень идентичности друг другу, выше, чем по меньшей мере для 40, преимущественно по меньшей мере 45, предпочтительно по меньшей мере 50, более предпочтительно по меньшей мере 55 или даже более предпочтительно по меньшей мере 59 последовательных нуклеотидов. Высокая степень идентичности составляет 75% или более чем 75%, преимущественно 80% или более чем 80%, желательно 85% или более чем 85%, предпочтительно 90% или более чем 90%, более предпочтительно 95% или более чем 95%, еще более предпочтительно 97% или более чем 97% (например, 100% идентичности последовательности). Процент идентичности между двумя нуклеотидными последовательностями является функцией числа идентичных положений, общих для последовательностей, с учетом числа гэпов, которые необходимо ввести для оптимального выравнивания, и длины каждого гэпа. Различные компьютерные программы и математические алгоритмы доступны в данной области техники для определения идентичностей в процентах между нукпеотидными последовательностями, такие как пакет программ GCG Wisconsin.
Гомологию между двумя различными нуклеотидными последовательностями предпочтительно супрессируют путем вырожденности использования кодонов по меньшей мере в одной из нуклеотидных последовательностей, так что процент идентичности между ранее гомологичными последовательностями снижается менее чем до 75%. Это можно осуществить путем замены одного или более чем одного "нативного" (например, HPV) кодона, присутствующего в гомологичном участке, одним или более чем одним кодоном, кодирующим ту же аминокислоту. Нет необходимости в вырожденности всех нативных кодонов, поскольку гомологию можно достаточно снизить при частичной замене. Такие модификации особенно полезны, когда молекула нуклеиновой кислоты или вектор, применяемые в изобретении, кодируют два полипептида папилломавируса, нуклеотидные и аминокислотные последовательности которых относительно консервативны (например, последовательности, кодирующие два или более чем два полипептида Е2, такие как полипептиды Е2 HPV-16 и HPV-18), либо которые содержат общий участок (например, HPV-16 Е1 и Е2-кодирующие последовательности, которые имеют 59 общих нуклеотидов). Репрезентативный пример такого воплощения приведен в SEQ ID NO: 6, обеспечивающей пример вырожденных последовательностей, соответствующих участку из 59 нуклеотидов, присутствующему в обеих кодирующих последовательностях, Е1 и Е2.
Модификации, которые транслируются на уровне кодируемого полипептида Е2, приводят в результате к мутации одного или более чем одного аминокислотного остатка полипептида Е2. Преимущественно модифицированный полипептид Е2 сохраняет высокую степень идентичности аминокислотной последовательности с соответствующим нативным полипептидом по всей длине аминокислотной последовательности или ее фрагмента (например, по меньшей мере 9, 20, 50, 100, 200, 300 аминокислот в длину), которая составляет 75% или более чем 75%, преимущественно более чем 80%, желательно более чем 85%, предпочтительно более чем 90%, более предпочтительно более чем 95%, еще более предпочтительно более чем 97% (например, 100% идентичности последовательности). Процент идентичности между двумя полипептидами является функцией числа идентичных положений, общих для последовательностей, с учетом числа гэпов, которые необходимо ввести для оптимального выравнивания, и длины каждого гэпа. Различные компьютерные программы и математические алгоритмы доступны в данной области техники для определения идентичностей в процентах между аминокислотными последовательностями, такие как, например, программа W2H HUSAR и программа Blast (например, Altschul et al., 1997, Nucleic Acids Res. 25, 3389-3402; Altschul et al., 2005, FEBS J. 272, 5101-5109), доступные в NCBI.
В одном воплощении молекула нуклеиновой кислоты, применяемая в изобретении, модифицирована таким образом, что она кодирует полипептид Е2, дефектный по меньшей мере по одной из биологических активностей нативного полипептида Е2, и более конкретно дефектный по активации вирусной репликации и/или транскрипции. Аминокислоты, которые являются принципиальными для этих биологических активностей, можно идентифицировать рутинными способами, как, например, путем структурного и функционального анализа, и специалист в данной области техники может легко определить тип мутации(й), которая способна снизить или запретить данную биологическую активность. В данной области техники хорошо известно, что остатки, вовлеченные в активности транскрипционной активации и репликации Е2, локализованы внутри М-концевого участка, тогда как С-концевой участок ответственен за распознавание сайтов связывания Е2 на вирусной ДНК и за димеризацию. Как используют здесь, М-концевой участок Е2 включает первые 220 аминокислотных остатков, начиная с инициатора Met. Например, можно действовать путем сайт-направленного мутагенеза или методов ПЦР в целях делеции или замены одного или более чем одного из аминокислотных остатков в пределах N-концевого участка Е2, регулирующего вирусную репликацию, таким образом, чтобы значительно снизить или запретить функцию репликации Е2 и создать полипептид Е2, дефектный по репликации папилломавирусного генома. Альтернативно или в сочетании с этим можно делетировать или заменить один или более чем один из аминокислотных остатков в пределах М-концевого участка Е2, ответственного за транскрипционную активацию, таким образом, чтобы значительно снизить или запретить способность Е2 к активации транскрипции с папилломавирусных промоторов. Репрезентативные примеры пригодных дефектных полипептидов Е2 описаны в литературе, доступной специалистам в данной области техники, например, в Demeret et al. (1995, Nucleic Acids Res. 23, 4777-4784), Sakai et al. (1996, J. Virol. 70, 1602-1611), Brokaw et al. (1996, J. Virology 70, 23-29) и Ferguson et al. (1996, J. Virology 70, 4193-4199). Снижение или отсутствие активностей репликации и транскрипционной активации Е2 может быть легко определено в соответствующих анализах с использованием стандартных способов, известных специалистам в данной области техники (Sakai et al., 1996, J. Virol. 70, 1602-1611).
Предпочтительный дефектный по репликации полипептид Е2, кодируемый нуклеиновой кислотой, применяемой в изобретении, имеет происхождение от HPV-16 и включает аминокислотную последовательность, представленную в SEQ ID N0: 1, за исключением того, что по меньшей мере остаток Glu в положении 39 (Е39) модифицирован, например, заменен любым аминокислотным остатком, иным, чем Glu. Другой предпочтительный полипептид Е2, дефектный по транскрипционной активации, имеет происхождение от HPV-16 и включает аминокислотную последовательность, представленную в SEQ ID NO: 1, за исключением того, что по меньшей мере остаток Не в положении 73 (173) модифицирован, например, заменен любым аминокислотным остатком, иным, чем Не. Даже более предпочтительный полипептид Е2, дефектный и по репликации, и по транскрипционной активации, имеет происхождение от HPV-16 и включает аминокислотную последовательность, представленную в SEQ ID NO: 1, за исключением того, что по меньшей мере остаток Glu (E39) в положении 39 и остаток Не в положении 73 (173) модифицированы, например, заменены любым аминокислотным остатком, иным, чем Glu и Не, в соответствующих положениях 39 и 73. Более предпочтительно остаток Glu в положении 39 и/или остаток Не в положении 73 заменены остатком Ala (E39A и/или 173А). В контексте изобретения такой дефектный полипептид Е2 может иметь происхождение от любого папилломавируса, и в пределах компетенции специалистов в данной области техники находится адаптация модификаций, описанных в связи с HPV-16 Е2, к полипептиду Е2, имеющему происхождение от другого генотипа папилломавируса (например, аминокислотные остатки, локализованные в положении, эквивалентном положению 39 и/или положению 73 HPV-16 Е2, могут быть идентифицированы путем сравнения последовательностей и модифицированы с помощью стандартных методик). Для целей изобретения такие остатки соответствуют, соответственно, Glu в положении 43 и Не в положении 77 в HPV-18 Е2, Glu в положении 39 и Не в положении 73 в HPV-33 и HPV-52.
В другом воплощении молекулу нуклеиновой кислоты, применяемую в изобретении, модифицируют таким образом, что она кодирует гибрид полипептида Е2 папилломавируса с одним или более чем одним партнером гибридизации, либо при N-конце, либо при С-конце, либо при обоих N и С-концах Е2. Партнер(ы) гибридизации может иметь папилломавирусное или другое происхождение. Гибридизацию можно осуществить генетическими способами, то есть путем слияния в рамке считывания нукпеотидных последовательностей, кодирующих полипептид Е2, и последовательностей, кодирующих партнер(ы) гибридизации, таким образом, что экспрессия гибридных кодирующих последовательностей приводит в результате к единому полипептиду. Гибридизация может быть прямой (то есть без каких-либо дополнительных аминокислотных остатков между ними), либо посредством линкерного пептида для соединения полипептида Е2 с партнером(амии) гибридизации. Присутствие линкера может облегчить правильное образование, укладку и/или функционирование гибридного белка. Подходящие линкеры в соответствии с изобретением имеют длину от 2 до 30 аминокислот и состоят из аминокислотных остатков, таких как глицин, серин, треонин, аспарагин, аланин и/или пролин (см., например, Wiederrecht et al., 1988, Cell 54, 841; Aumailly et al., 1990 FEBS Lett. 262, 82; и Dekker et al., 1993, Nature 362, 852).
Пригодные не папилломавирусные партнеры гибридизации включают без ограничения калретикулин (Cheng et al., 2001, J. Clin. Invest. 108, 669-678), белок теплового шока 70 (HSP70) Mycobacterium tuberculosis (Chen et al., 2000, Cancer Res. 60, 1035-1042), убихитин (Rodriguez et al., 1997, J. Virol. 71, 8497-8503) и бактериальный токсин, такой как домен транслокации экзотоксина A (ETA(dlll)) Pseudomonas aeruginosa (Hung et al., 2001 Cancer Res. 61, 3698-3703).
Пригодные папилломавирусные партнеры гибридизации могут представлять собой любой папилломавирусный полипептид, поздний или ранний, или любой его фрагмент. Предпочтительный партнер гибридизации имеет происхождение от раннего полипептида HPV, выбранного из группы, состоящей из Е1, Е2, Е4, Е5, Е6 и Е7 или их смеси. Полипептид Е2 и папилломавирусный партнер гибридизации могут иметь происхождение от одного и того же генотипа папилломавируса, как, например, гибридизация полипептидов HPV-16 Е1 и Е2. Альтернативно полипептид Е2 и папилломавирусный партнер гибридизации могут иметь происхождение от разных генотипов папилломавируса, где репрезентативным примером является гибридизация полипептидов HPV-16 Е2 и HPV-18 Е2.
Независимо или в сочетании с определенной выше модификацией(ями) молекула нуклеиновой кислоты, применяемая в изобретении, может, кроме того, включать дополнительные модификации, которые благоприятны для процессинга, стабильности и/или растворимости кодируемого полипептида Е2, например, супрессию потенциального сайта(ов) расщепления, супрессию потенциального сайта(ов) гликозилирования и/или презентацию кодируемого полипептида Е2 на поверхности экспрессирующих клеток-хозяев. Например, супрессия потенциального сайта гликозилирования может быть достигнута путем идентификации потенциального сайта М-гликозилирования (например, включающего мотив Asn-Val-Ser-Val) и замены одного или более чем одного аминокислотного остатка другим остатком (например, замены остатка Ser остатком Gly или Ala) с получением полипептида Е2, который может не претерпевать гликозилирование при экспрессии в эукариотической клетке-хозяине или в организме-хозяине.
В предпочтительном воплощении молекула нуклеиновой кислоты, применяемая в изобретении, модифицирована таким образом, что она кодирует презентированный на мембране полипептид Е2 в целях улучшения презентации ГКГ класса 1 и/или ГКГ класса II и, следовательно, его потенциальной иммуногенности в клетке-хозяине или в организме-хозяине. Ранее показано, что мембранная презентация дает возможность улучшить терапевтическую эффективность полипептидов HPV-16 Е6 и Е7 (см., например, W099/03885). Полипептид Е2 папилломавируса является ядерным белком, хотя типичный сигнал ядерной локализации не идентифицирован. Мембранная презентация может быть достигнута путем гибридизации полипептида Е2 с секреторной последовательностью (например, сигнальным пептидом) и последовательностью заякоривания в мембране. Такие последовательности известны в данной области техники. Кратко, секреторные последовательности обычно присутствуют на N-конце мембранно-презентируемых или секретируемых полипептидов и инициируют их прохождение через эндоплазматический ретикулум (ЭПР). Они содержат от 15 до 35, в основном, гидрофобных аминокислот, которые затем удаляются локализованной в ЭПР эндопептидазой с образованием зрелого полипептида. Последовательности заякоривания в мембране обычно являются высоко гидрофобными по природе и служат для заякоривания полипептидов в клеточной мембране (см., например, Branden and Tooze, 1991, в Introduction to Protein Structure p.202-214, NY Garland).
Выбор последовательностей заякоривания в мембране и/или секреторных последовательностей, которые можно использовать в контексте настоящего изобретения, широк. Они могут быть получены из любого заякориваемого в мембране и/или секретируемого полипептида (например, из клеточных или вирусных полипептидов), таких как гликопротеин вируса бешенства, гликопротеин вирусной оболочки ВИЧ или белок F вируса кори, либо могут быть синтетическими. Предпочтительным сайтом инсерции секреторной последовательности является N-конец ниже кодона инициации трансляции, а сайтом инсерции последовательности заякоривания в мембране является С-конец, например, непосредственно выше стоп-кодона. Кроме того, линкерный пептид можно использовать для соединения секреторной последовательности и/или последовательности заякоривания в мембране с полипептидом Е2.
Полипептид Е2 с мембранной направленностью, кодируемый нуклеиновой кислотой, применяемой в настоящем изобретении, предпочтительно модифицирован путем гибридизации с секреторными последовательностями и последовательностями заякоривания в мембране гликопротеина вируса бешенства, как проиллюстрировано в прилагаемом разделе примеров.
Предпочтительные векторы, применяемые согласно настоящему изобретению, включают:
- Вектор, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е2;
- Вектор, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е2;
- Вектор, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид HPV-33 Е2;
- Вектор, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид HPV-52 Е2.
В соответствии с особенно предпочтительным воплощением молекула нуклеиновой кислоты, кодирующая полипептид Е2, включает аминокислотную последовательность, представленную в SEQ ID NO: 2, по существу состоит из нее или, альтернативно, состоит из нее. Для информации полипептид SEQ ID NO: 2 включает полипептид HPV-16 Е2 (от положения 24 до положения 387), дефектный по активностям репликации и трансактивации (модификации остатка Glu в положении 61 и остатка Не в положении 95 остатками Ala, соответствующими остаткам Glu и Не соответственно в положениях 39 и 73 в нативном полипептиде Е2), гибридный с секреторной последовательностью (от положения 2 до положения 23) и последовательностью заякоривания в мембране (от положения 388 до положения 453) гликопротеина вируса бешенства.
Настоящее изобретение также включает вектор или инфекционную частицу, содержащие молекулы нуклеиновой кислоты, кодирующие по меньшей мере два полипептида Е2, имеющих происхождение от различных генотипов папилломавируса, и применение такого вектора или инфекционной частицы для изготовления лекарства, предназначенного для лечения папилломавирусной инфекции, в частности, персистентной инфекции HR-HPV. В преимущественном воплощении "по меньшей мере два" представляет собой 2, 3 или 4, и каждый из кодируемых полипептидов Е2 имеет происхождение от HR-HPV различных генотипов. Независимо или в сочетании полипептиды Е2 предпочтительно модифицированы, как описано выше (например, дефектны по репликации и/или транскрипционной активации и/или презентированы на мембране). Молекулы нуклеиновой кислоты, кодирующие по меньшей мере два полипептида Е2, могут быть помещены под контролем независимых регуляторных последовательностей, либо могут быть гибридизованы друг с другом для экспрессии в виде единой полипептидной цепи. Как описано здесь, репрезентативные примеры включают вектор, содержащий молекулы нуклеиновой кислоты, кодирующие полипептиды HPV-16 и HPV-18 Е2, а также вектор, содержащий молекулы нуклеиновой кислоты, кодирующие полипептиды HPV-16, HPV-18, HPV-33 и HPV-52 Е2, помещенные под контролем независимых регуляторных последовательностей. Когда вектор по изобретению или применяемый в настоящем изобретении содержит две или более чем две молекулы нуклеиновой кислоты, кодирующие полипептиды Е2, рекомендуют, чтобы Е2-кодирующие нуклеотидные последовательности были вырожденными, так чтобы они проявляли процент гомологии менее чем 75% друг с другом. Предпочтительно указанные Е2-кодирующие молекулы нуклеиновой кислоты не включают участок из 40 или более (например, 50, 55, 59, 70 или даже более) непрерывных нуклеотидов, проявляющих процент идентичности 75% или более чем 75%.
В конкретном воплощении настоящего изобретения молекулу нуклеиновой кислоты, вектор или инфекционную частицу, описанные здесь, можно также применять в комбинации с одним или более чем одним дополнительным полипептидом или с одним или более чем одним из нуклеиновой кислоты, вектора или инфекционной частицы, кодирующих такой дополнительный полипептид(ы). Желательно дополнительный полипептид(ы) способен усиливать терапевтическую активность, обеспечиваемую вышеописанным активным агентом. Нуклеиновая кислота, кодирующая такой дополнительный полипептид(ы), может быть встроена в вектор, применяемый в изобретении, или в независимый вектор, такой как один из описанных здесь, и ее экспрессия может быть помещена под контролем соответствующих регуляторных последовательностей, таких как описаны здесь. Дополнительный полипептид(ы) может иметь папилломавирусное происхождение или не папилломавирусное происхождение.
Пригодный не папилломавирусный дополнительный полипептид(ы) включает без ограничения цитокины (например, ИЛ-2, ИЛ-7, ИЛ-15, ИЛ-18, ИЛ-21, ИФНу) и продукты "суицидальных" генов (например, тимидинкиназу HSV-1, описанную в Caruso et al, 1993, Proc. Natl. Acad. Sci. USA 90, 7024-7028; FCU-1, описанный в WO 99/54481).
Пригодный папилломавирусный дополнительный полипептид(ы) включает без ограничения любой ранний полипептид HPV (или фрагмент), выбранный из группы, состоящей из Е1, Е2, Е4, Е5, Е6 и Е7 или любой их смеси.
В одном аспекте изобретения папилломавирусный дополнительный полипептид(ы) может иметь происхождение от того же генотипа папилломавируса, как и полипептид Е2, кодируемый вышеописанной нуклеиновой кислотой (например, полипептиды Е1 и Е2, имеющие происхождение от HPV-16).
Альтернативно в другом аспекте изобретения папилломавирусный дополнительный полипептид(ы) может иметь происхождение от другого генотипа папилломавируса, чем полипептид Е2, кодируемый вышеописанной нуклеиновой кислотой. Преимущественно такой полипептид Е2 имеет происхождение от HPV-16, а указанный дополнительный папилломавирусный полипептид(ы) имеет происхождение от HPV-18.
Папилломавирусный дополнительный полипептид может быть нативным или модифицированным по сравнению с соответствующей нативной последовательностью. Например, дополнительный полипептид(ы) может быть модифицирован таким образом, чтобы снизить или запретить его/их соответствующую биологическую активность (например, ферментативную активность) при сохранении антигенной активности. Примерные модификации, проиллюстрированные ниже, приведены в отношении полипептидов папилломавируса HPV-16, но специалист в данной области техники способен перенести эти примерные мутации на соответствующие полипептиды других генотипов папилломавируса. Кроме того, папилломавирусный дополнительный полипептид может быть дополнительно модифицирован таким образом, чтобы он был презентирован в клеточной мембране, как описано выше в связи с Е2, а также в WО 99/03885.
Пригодным примером папилломавирусного дополнительного полипептида является модифицированный полипептид Е1, содержащий одну или более чем одну мутацию по сравнению с соответствующим нативным полипептидом Е1, так чтобы он был дефектен по стимуляции вирусной репликации. Желательно модифицированный полипептид Е1 содержит мутацию любого из остатков в положении 412, 439, 482 и/или 496 нативного полипептида Е1, такую как варианты W439R, Y412F, G482D и G496R HPV-16 Е1, описанные Yasugi et al. (1997, J. Virol 71, 5942-5951), где особо предпочтителен вариант G482D, содержащий аминокислотную последовательность нативного полипептида HPV-16 E1 за исключением замены остатка Gly в положении 482 остатком Asp (например, модифицированный полипептид E1, имеющий последовательность, представленную в SEQ ID NO: 3). Другой примерный модифицированный полипептид E1 включает полипептид HPV-18 E1 с заменой остатка Gly в положении 489 остатком Asp.
Другим пригодным примером папилломавирусных дополнительных полипептидов является модифицированный полипептид Е6, который является не онкогенным и измененным по связыванию продукта клеточного гена опухолевого супрессора р53. Еще одним другим пригодным примером папилломавирусных дополнительных полипептидов является модифицированный полипептид Е7, который является не онкогенным и измененным по связыванию продукта клеточного гена опухолевого супрессора Rb. Такие не онкогенные варианты описаны, например, в Pim et al. (1994, Oncogene 9, 1869-1876), Munger et al. (1989, EMBO J. 8, 4099-4105), Crook et al. (1991, Cell 67, 547-556), Heck et al. (1992, Proc. Natl. Acad. Sci. USA 89, 4442-4446) и Phelps et al. (1992, J. Virol. 66, 2148-2427). Предпочтительный не онкогенный полипептид Е6 имеет происхождение от HPV-16 и делегирован по остаткам 118-122 (СРЕЕК) (где +1 представляет собой первую аминокислоту нативного полипептида HPV-16 Е6, начиная с первого остатка Met). Предпочтительный не онкогенный полипептид Е7 имеет происхождение от HPV-16 и делетирован по остаткам 21-26 (DLYCYE) (где +1 представляет собой первую аминокислоту нативного полипептида HPV-16 Е7).
Предпочтительно папилломавирусный дополнительный полипептид для применения в изобретении независимо или в сочетании выбран из группы, состоящей из полипептидов, включающих любую из аминокислотных последовательностей, приведенных в SEQ ID NO: 3-5. Более конкретно в SEQ ID NO: 3 приведена аминокислотная последовательность презентированного на мембране полипептида HPV-16 E1, дефектного по репликационной активности (G482D). В SEQ ID NO: 4 приведена аминокислотная последовательность презентированного на мембране и не онкогенного полипептида HPV-16 Е6, и в SEQ ID NO: 5 приведена аминокислотная последовательность презентированного на мембране и не онкогенного полипептида HPV-16 Е7.
В нативном окружении (например, генома HPV-16 или HPV-18) 3'-конец E1-кодирующей молекулы нуклеиновой кислоты перекрывается с 5'-концом Е2-кодирующей молекулы нуклеиновой кислоты на 59 нуклеотидов. В соответствии с предпочтительным воплощением участок El-кодирующей молекулы нуклеиновой кислоты, который перекрывает Е2-кодирующую молекулу нуклеиновой кислоты, модифицирован таким образом, что проявляет процент идентичности менее чем 75% с перекрывающимися Е2-последовательностями. Желательно модификации осуществляют в E1-кодирующей молекуле нуклеиновой кислоты на нуклеотидном уровне путем вырождения использования кодонов, и они являются молчащими на аминокислотном уровне, то есть такие модификации не транслируются в кодируемый полипептид Е1 папилломавируса. Репрезентативный пример модификаций, которые можно вводить в участке 59 п.о., присутствующем на 3'-конце HPV-16 E1-кодирующей молекулы нуклеиновой кислоты и перекрывающемся в нативном окружении с 5'-участком HPV-16 Е2-кодирующей молекулы нуклеиновой кислоты, приведен в SEQ ID NO: 6.
Изобретение также относится к вектору или к инфекционной вирусной частице (например, для применения при лечении персистентной папилломавирусной инфекции, как описано здесь), содержащим по меньшей мере молекулу нуклеиновой кислоты, кодирующую полипептид Е1 папилломавируса, и по меньшей мере молекулу нуклеиновой кислоты, кодирующую полипептид Е2 папилломавируса, где 3'-участок указанной E1-кодирующей молекулы нуклеиновой кислоты, который в естественном окружении на 100% идентичен 5'-участку указанной Е2-кодирующей молекулы нуклеиновой кислоты, модифицирован таким образом, что он проявляет процент идентичности менее чем 75% с указанным участком указанной Е2-кодирующей молекулы нуклеиновой кислоты. В другом воплощении настоящее изобретение также относится к вектору или к инфекционной вирусной частице, содержащим по меньшей мере молекулу нуклеиновой кислоты, кодирующую полипептид Е1 папилломавируса, и по меньшей мере молекулу нуклеиновой кислоты, кодирующую полипептид Е2 папилломавируса, где E1-кодирующая молекула нуклеиновой кислоты и Е2-кодирующая молекула нуклеиновой кислоты не содержат участок из 40 или более (например, 45, 50, 55, 59, 70) непрерывных нуклеотидов, проявляющих процент идентичности 75% или более чем 75%.
Предпочтительные векторы в соответствии с данным воплощением включают вектор, выбранный из группы, состоящей из:
- вектора, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е2 и дополнительно содержащего (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е2;.
- Вектора, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E2, и (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-33 E2;
- Вектора, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E2, и (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-52 E2;
- Вектора, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-33 E2, и (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-52 E2;
- Вектора, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2 (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E2, (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-33 E2, и (iv) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-52 E2;
- Вектора, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е1;
- Вектора, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е1, (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E2, и (iv) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е1;
- Вектора, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е6;
- Вектора, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е7;
- Вектора, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е1; (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е6, (iv) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е7;
- Вектора, содержащего молекулы нуклеиновой кислоты, кодирующие полипептиды HPV-16 Е1, E2, Е6 и Е7 и полипептиды HPV-18 Е1, E2, Е6 и Е7.
Желательно кодируемый полипептид(ы) Е2 является презентированным на мембране и дефектным по активностям репликации и транскрипционной активации. Предпочтительно полипептид HPV-16 Е2 включает аминокислотную последовательность, показанную в SEQ ID NO: 2, альтернативно по существу состоит из нее или альтернативно состоит из нее; и/или полипептид HPV-18 Е2 включает аминокислотную последовательность, показанную в SEQ ID NO: 29, альтернативно по существу состоит из нее или альтернативно состоит из нее; и/или полипептид HPV-33 Е2 включает аминокислотную последовательность, показанную в SEQ ID NO: 30, альтернативно по существу состоит из нее или альтернативно состоит из нее; и/или полипептид HPV-52 Е2 включает аминокислотную последовательность, показанную в SEQ ID NO: 31, альтернативно по существу состоит из нее или альтернативно состоит из нее.
Независимо или в сочетании полипептид(ы) Е1 является презентированным на мембране и дефектным по репликационной активности. Предпочтительно полипептид HPV-16 Е1 включает аминокислотную последовательность, показанную в SEQ ID NO: 3, альтернативно по существу состоит из нее или альтернативно состоит из нее, и/или полипептид HPV-18 Е1 включает аминокислотную последовательность, показанную в SEQ ID NO: 32, альтернативно по существу состоит из нее или альтернативно состоит из нее. Кодируемый полипептид(ы) Е6 и/или Е7 являются презентированными на мембране и не онкогенными. Предпочтительно полипептид HPV-16 Е6 включает аминокислотную последовательность, показанную в SEQ ID NO: 4, альтернативно по существу состоит из нее или альтернативно состоит из нее; и/или полипептид HPV-16 Е7 включает аминокислотную последовательность, показанную в SEQ ID NO: 5, альтернативно по существу состоит из нее или альтернативно состоит из нее.
Более предпочтительно молекула нуклеиновой кислоты, кодирующая полипептид HPV-16 Е2, включает нуклеотидную последовательность, показанную в SEQ ID NO: 8, альтернативно по существу состоит из нее или альтернативно состоит из нее; и/или молекула нуклеиновой кислоты, кодирующая полипептид HPV-18 Е2, включает нуклеотидную последовательность, показанную в SEQ ID NO:33, альтернативно по существу состоит из нее или альтернативно состоит из нее; и/или молекула нуклеиновой кислоты, кодирующая полипептид HPV-33 Е2, включает нуклеотидную последовательность, показанную в SEQ ID NO: 34 или в SEQ ID NO: 35, альтернативно по существу состоит из нее или альтернативно состоит из нее; и/или молекула нуклеиновой кислоты, кодирующая полипептид HPV-52 Е2, включает нуклеотидную последовательность, показанную в SEQ ID NO: 36 или в SEQ ID NO: 37, альтернативно по существу состоит из нее или альтернативно состоит из нее; и/или молекула нуклеиновой кислоты, кодирующая полипептид HPV-16 E1, включает нуклеотидную последовательность, показанную в SEQ ID NO: 7 (вырожденные последовательности для снижения гомологии с перекрывающимся участком HPV-16 Е2), альтернативно по существу состоит из нее или альтернативно состоит из нее; и/или молекула нуклеиновой кислоты, кодирующая полипептид HPV-18 E1, включает нуклеотидную последовательность, показанную в SEQ ID NO: 38 (вырожденная последовательность для снижения гомологии с HPV-16 E1-кодирующими последовательностями), альтернативно по существу состоит из нее или альтернативно состоит из нее.
Как обсуждено здесь в связи с воплощением, относящимся к векторам, содержащим две или более чем две молекулы нуклеиновой кислоты, кодирующие полипептиды Е2, рекомендуют, чтобы Е2-кодирующие нуклеотидные последовательности были вырождены таким образом, чтобы проявлять процент гомологии менее чем 75% друг с другом, предпочтительно по всей длине последовательности. Предпочтительно, чтобы указанные Е2-кодирующие молекулы нуклеиновой кислоты не содержали участок из 40 или более (например, 45, 50, 55, 59, 70 или даже более) непрерывных нуклеотидов, проявляющих процент идентичности 75% или более чем 75%. Вышеописанные нуклеотидные последовательности соответствуют данному воплощению.
Молекула(ы) нуклеиновой кислоты, применяемая или содержащаяся в векторе или инфекционной вирусной частице по настоящему изобретению, может быть получена с использованием данных о последовательностях, доступных в данной области техники, и информации о последовательностях, предоставленной здесь. Она может быть выделена непосредственно из HPV-содержащих клеток (например, из клеток CaSki, доступных в АТСС под номером по каталогу CRL-1550) или из любого источника папилломавируса, как определено выше, с помощью общепринятых методов молекулярной биологии или ПЦР и, если необходимо, может быть дополнительно модифицирована, как определено здесь, с помощью рутинных методов мутагенеза (например, для оптимизации экспрессии в конкретной клетке-хозяине, для получения дефектного варианта и т.д.). Альтернативно молекула(ы) нуклеиновой кислоты, применяемая в изобретении, может быть также получена путем химического синтеза в автоматизированном процессе (например, сборки из перекрывающихся синтетических олигонуклеотидов, как описано, например, в Edge, 1981, Nature 292, 756; Nambairet al., 1984, Science 223, 1299; Jay et al, 1984, J. Biol. Chem. 259, 6311).
В другом воплощении молекула(ы) нуклеиновой кислоты, применяемая в соответствии с изобретением или содержащаяся в векторе или инфекционной вирусной частице по настоящему изобретению, находится в форме, пригодной для экспрессии кодируемого полипептида(ов) в клетке-хозяине или в организме-хозяине, что означает, что молекула(ы) нуклеиновой кислоты помещена под контролем одной или более чем одной регуляторной последовательности, необходимой для ее экспрессии.
Как используют здесь, термин "регуляторные последовательности" относится к любой последовательности, которая допускает экспрессию, участвует в экспрессии или модулирует экспрессию молекулы нуклеиновой кислоты в данной клетке-хозяине, включая репликацию, дупликацию, транскрипцию, сплайсинг, трансляцию, стабильность и/или транспорт нуклеиновой кислоты или одного из ее производных (то есть мРНК) в клетке-хозяине. Такие регуляторные последовательности хорошо известны в данной области техники (см., например, Goeddel, 1990, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego). Специалистам в данной области техники должно быть понятно, что выбор регуляторной последовательности может зависеть от таких факторов, как тип вектора, клетка-хозяин, желаемый уровень экспрессии и т.д. В контексте настоящего изобретения регуляторные последовательности оперативно сцеплены с молекулой нуклеиновой кислоты, которую следует экспрессировать. Под "оперативно сцепленным" следует подразумевать, что молекула нуклеиновой кислоты сцеплена с регуляторными последовательностями таким образом, чтобы дать возможность ее экспрессии в клетке-хозяине или в организме-хозяине.
Промотор представляет особую важность, и настоящее изобретение охватывает использование конститутивных промоторов, которые направляют экспрессию молекулы нуклеиновой кислоты во многих типах клеток-хозяев, и промоторов, которые направляют экспрессию только в определенных клетках-хозяевах или в ответ на специфичные события или экзогенные факторы (например, температуру, пищевую добавку, гормон или другой лиганд). Пригодные промоторы широко описаны в литературе, и более конкретно могут быть упомянуты вирусные промоторы, такие как промоторы RSV (вируса саркомы Рауса), SV40 (обезьяньего вируса-40), CMV (цитомегаловируса) и MLP (большой поздний промотор). Предпочтительные промоторы для использования в поксвирусном векторе включают без ограничения промоторы вируса осповакцины 7.5К, H5R, ТК, р28, р11 и K1L, химерные промоторы между ранним и поздним поксвирусными промоторами, а также синтетические промоторы, такие как описаны в Chakrabarti et al. (1997, Biotechniques 23, 1094-1097), Hammond et al. (1997, J. Virological Methods 66, 135-138) и Kumar and Boyle (1990, Virology 179, 151-158).
Специалистам в данной области техники должно быть понятно, что регуляторные последовательности, контролирующие экспрессию молекулы нуклеиновой кислоты, могут, кроме того, включать дополнительные элементы для правильной инициации, регуляции и/или терминации транскрипции (например, полиА последовательности терминации транскрипции), транспорта мРНК (например, последовательности сигнала ядерной локализации), процессинга (например, сигналы сплайсинга), стабильности (например, интроны и некодирующие 5'- и 3'-последовательности) и трансляции (например, лидерные последовательности, состоящие из трех частей, сайты связывания рибосомы, последовательности Шайна-Дальгарно и т.д.) в клетке-хозяине или в организме-хозяине.
В контексте настоящего изобретения в указанном векторе или инфекционной вирусной частице, применяемым в соответствии с настоящим изобретением, может содержаться одна или более чем одна копия молекулы нуклеиновой кислоты.
Термин "вектор", как используют здесь, определяет как вирусные, так и невирусные (например, плазмидную ДНК) векторы, включая экстрахромосомные (например, эписомные), многокопийные и интегративные векторы (например, для встраивания в хромосомы хозяина). Особенно важны в контексте настоящего изобретения как векторы для применения в генотерапии (то есть векторы, которые способны к доставке молекулы нуклеиновой кислоты в организм-хозяин), так и экспрессионные векторы для применения в различных экспрессионных системах. При ссылке на вирусный вектор термин "вектор", как используют здесь, относится к любой молекуле нуклеиновой кислоты, которая содержит по меньшей мере один элемент вирусного происхождения, включая полноразмерный вирусный геном, его участок или модифицированный вирусный геном, как описано ниже, а также к вирусным частицам, генерируемым ею (например, к вирусному вектору, упакованному в вирусный капсид с образованием инфекционных вирусных частиц).
Пригодные невирусные векторы включают плазмиды, такие как pREP4, рСЕР4 (Invitrogene), pCI (Promega), pCDM8 (Seed, 1987, Nature 329, 840), pVAX и pgWiz (Gene Therapy System Inc; Himoudi et al., 2002, J. Virol. 76, 12735-12746).
Вирусные векторы могут иметь происхождение от ряда различных вирусов, и, в частности, от вируса, выбранного из группы, состоящей из ретровируса, аденовируса, аденоассоциированного вируса (AAV), поксвируса, вируса герпеса, вируса кори и вируса пенистости обезьян. Вирусные векторы могут быть репликационно-компетентными, либо они могут быть выключены генетическим путем таким образом, что являются репликационно-дефектными или имеют нарушенную репликацию. Термин "репликационно-компетентный", как используют здесь, включает вирусные векторы с избирательной репликацией и условно-репликативные вирусные векторы, которые конструируют генно-инженерным путем для лучшей или избирательной репликации в специфичных клетках-хозяевах (например, в опухолевых клетках).
В одном аспекте вектор, применяемый в изобретении, представляет собой аденовирусный вектор (обзор см. в "Adenoviral vectors for gene therapy", 2002, Ed D. Curiel and J. Douglas, Academic Press). Он может иметь происхождение из ряда человеческих или животных источников и можно применять любой серотип из аденовирусных серотипов 1-51. Особенно предпочтительны человеческие аденовирусы 2 (Ad2), 5 (Ad5), 6 (Ad6), 11 (Ad11), 24 (Ad24) и 35 (Ad35). Такой аденовирус доступен из Американской Коллекции типовых культур (АТСС, Rockville, Md.) и является предметом многочисленных публикаций, в которых описана его последовательность, организация и способы получения, что дает возможность его применения специалистами в данной области техники (см., например, US 6133028; US 6110735; WO 02/40665; WO 00/50573; EP 1016711; Vogels et al., 2003, J. Virol. 77, 8263-8271).
Аденовирус, применяемый в настоящем изобретении, может быть репликационно-компетентным. Многочисленные примеры репликационно-компетентных аденовирусных векторов легко доступны специалистам в данной области техники (Hernandez-Alcoceba et al., 2000, Human Gene Their. 11, 2009-2024; Nemunaitis et al., 2001, Gene Ther. 8, 746-759; Alemany et at., 2000, Nature Biotechnology 18, 723-727). Например, их можно сконструировать из аденовирусного генома дикого типа путем делеции домена Е1А CR2 (например, WO 00/24408) и/или путем замены нативных промоторов Е1 и/или Е4 тканеспецифичными, опухолеспецифичными или специфичными для клеточного статуса промоторами (например, US 5998205, WO 99/25860, US 5698443, WO 00/46355, WO 00/15820 и WO 01/36650).
Альтернативно аденовирусный вектор, применяемый в изобретении, является репликационно-дефектным (см., например, WO 94/28152; Lusky et al., 1998, J. Virol 72, 2022-2032). Предпочтительные репликационно-дефектные аденовирусные векторы являются El-дефектными (например, US 6136594 и US 6013638) с делецией Е1, имеющей продолжительность от примерных положений 459 до 3328 или от примерных положений 459 до 3510 (по отношению к последовательности человеческого аденовируса типа 5, описанной в GeneBank под номером по каталогу М 73260 и в Chroboczek et al., 1992, Virol. 186, 280-285). Клонирующая способность может быть дополнительно улучшена путем делеции дополнительного участка(ов) аденовирусного генома (например, в несущественной области Е3 или в других существенных областях Е2, Е4). Вставку молекулы нуклеиновой кислоты, применяемой в изобретении, можно осуществить посредством гомологической рекомбинации в любой локализации аденовирусного генома, как описано в Chartieret al. (1996, J. Virol. 70, 4805-4810). Предпочтительно ее встраивают при замещении области Е1. Она может быть расположена в смысловой или антисмысловой ориентации относительно естественного направления транскрипции интересующей области.
В другом и предпочтительном аспекте вектор, применяемый в изобретении, представляет собой поксвирусный вектор (см., например, Сох et al. in "Viruses in Human Gene Therapy" Ed J. М. Hos, Carolina Academic Press). Он может быть получен из любого члена семейства Poxviridae, в частности, птичьего вируса Canarypox (например, ALVAC, как описано в WO 95/27780), вируса оспы кур Fowlpox (например, TROVAC, как описано в Paoletti et al., 1995, Dev. Biol. Stand. 84, 159-163) или вируса осповакцины (vaccinia), где последний является предпочтительным. Пригодные вирусы осповакцины включают без ограничения копенгагенский штамм (Copenhagen strain) (Goebel et al., 1990, Virol. 179, 247-266 and 517-563; Johnson et al., 1993, Virol. 196, 381-401), штамм компании Вайет (Wyeth), NYVAC (см. WO 92/15672 и Tartaglia et al., 1992, Virology 188, 217-232) и высоко аттенуированный модифицированный штамм Анкара (MVA) (Мауr et al., 1975, Infection 3, 6-16).
Базовый метод для встраивания молекулы нуклеиновой кислоты и сопутствующих регуляторных элементов, необходимых для экспрессии в поксвирусном геноме, описан в многочисленных документах, доступных специалистам в данной области техники (Paul et al., 2002, Cancer gene Ther. 9, 470-477; Piccini et al., 1987, Methods of Enzymology 153, 545-563; US 4769330; US 4772848; US 4603112; US 5100587 и US 5179993). Обычно это осуществляют посредством гомологической рекомбинации между перекрывающимися последовательностями (то есть фланкирующими желаемый сайт вставки), присутствующими как в вирусном геноме, так и в плазмиде, несущей нуклеиновую кислоту для вставки. Молекулу нуклеиновой кислоты, применяемую в изобретении, предпочтительно встраивают в несущественный локус поксвирусного генома с той целью, чтобы рекомбинантный поксвирус оставался жизнеспособным и инфекционным. Несущественными областями являются некодирующие межгенные области или любой ген, инактивация или делеция которого не нарушает значительно рост, репликацию или инфекцию вируса. Можно также рассматривать вставку в существенный вирусный локус при условии, что дефектная функция обеспечивается in trans во время продуцирования вирусных частиц, например, использованием вспомогательной клеточной линии, несущей комплементирующие последовательности, соответствующие делегированным в поксвирусном геноме.
При использовании копенгагенского вируса осповакцины молекулу нуклеиновой кислоты предпочтительно встраивают в ген тимидинкиназы (tk) (Hruby et al., 1983, Proc. Natl. Acad. Sci USA 80, 3411-3415; Weir et al., 1983, J. Virol. 46, 530-537). Однако другие сайты вставки также пригодны, например, в гене гемагглютинина (Guo et al., 1989, J. Virol. 63, 4189-4198), в локусе K1L, в гене и (Zhou et al., 1990, J. Gen. Virol. 71, 2185-2190) или при левом конце генома вируса осповакцины, где в литературе описан ряд спонтанных или сконструированных генно-инженерным путем делеций (Altenburger et al., 1989, Archives Virol. 105, 15-27; Moss et al. 1981, J. Virol. 40, 387-395; Panicali et al., 1981, J. Virol. 37, 1000-1010; Perkus et al, 1989, J. Virol. 63, 3829-3836; Perkus et al, 1990, Virol. 179, 276-286; Perkus et al, 1991, Virol. 180, 406-410).
При использовании MVA молекулу нуклеиновой кислоты можно встраивать в любую из идентифицированных делеций I-VII, которые встречаются в геноме MVA (Antoine et al., 1998, Virology 244, 365-396), а также в локус D4R, но предпочтительна вставка в делецию II или III (Meyer et al., 1991, J. Gen. Virol. 72, 1031-1038; Sutteret al., 1994, Vaccine 12, 1032-1040).
При использовании вируса fowlpox, хотя можно рассматривать вставку в ген тимидинкиназы, молекулу нуклеиновой кислоты предпочтительно встраивают в межгенную область, расположенную между ОРС 7 и 9 (см., например, ЕР 314569 и US 5180675).
Предпочтительно вектор по изобретению или применяемый в соответствии с настоящим изобретением представляет собой вектор вируса осповакцины при особом предпочтении для вектора MVA. Более предпочтительно молекулу(ы) нуклеиновой кислоты встраивают в делецию III и в конечном счете в противоположном направлении, особенно когда указанные молекулы нуклеиновой кислоты помещают под контролем одного и того же промотора. Предпочтительно, чтобы Е2- и/или Е7-кодирующие молекулы нуклеиновой кислоты были помещены под контролем промотора H5R, а Е1- и/или Е6-кодирующие молекулы нуклеиновой кислоты под контролем промотора р7.5K вируса осповакцины.
Настоящее изобретение также охватывает применение вектора в комплексе с липидами или полимерами с образованием структур в форме частиц, таких как липосомы, липоплексы или наночастицы. Такие технологии доступны в данной области техники (см., например, Arangoa et al., 2003, Gene Ther. 10: 5-14; Eliaz et al., 2002, Gene Ther. 9, 1230-1237 и Betageri et al., 1993, "Liposome drug delivery systems", Technomic Publishing Company, Inc).
Настоящее изобретение также относится к инфекционным вирусным частицам, содержащим вышеописанные молекулы нуклеиновой кислоты или векторы, и к их применению, как определено здесь.
Типично указанные вирусные частицы продуцируют в подходящей клеточной линии, культивируемой в пригодных условиях, и с использованием методов, хорошо известных в данной области техники. Здесь не предприняты попытки подробно описать различные способы, известные для продуцирования инфекционных вирусных частиц.
Когда вирусный вектор является дефектным, инфекционные частицы обычно продуцируют в комплементационной клеточной линии или посредством использования хелперного вируса, который обеспечивает in trans нефункциональные вирусные гены. Например, пригодные клеточные линии для комплементации Е1-делегированных аденовирусных векторов включают клетки 293 (Graham et al., 1997, J. Gen. Virol. 36, 59-72), а также клетки PER-C6 (Fallaux et al., 1998, Human Gene Ther. 9, 1909-1917) и производные PER-C6. Клетками, пригодными для размножения поксвирусных векторов, являются птичьи клетки, и наиболее предпочтительно первичные эмбриональные фибробласты цыпленка (CEF), препарированные из куриных эмбрионов, полученных из оплодотворенных яиц. Клетки-продуценты можно культивировать в общепринятых ферментационных биореакторах, флаконах и чашках Петри при подходящих условиях температуры, pH и содержания кислорода.
Инфекционные вирусные частицы можно выделить из культуральной надосадочной жидкости или из клеток после лизиса. Их можно дополнительно очистить в соответствии со стандартными методиками (хроматографией, ультрацентрифугированием, как описано, например, в WO 96/27677, WO 98/00524, WO 98/22588, WO 98/26048, WO 00/40702, EP 1016700 и WO 00/50573).
Настоящее изобретение также охватывает применение молекул нуклеиновой кислоты, векторов или вирусных частиц, которые модифицированы таким образом, чтобы дать возможность преимущественной направленности на конкретную клетку-мишень (см., например, Wickam et al., 1997, J. Virol. 71, 8221-8229; Arnberg et al., 1997, Virol. 227, 239-244; Michael et al., 1995, Gene Therapy 2, 660-668; WO 94/10323; WO 02/96939 и ЕР 1146125). Характерным признаком направленных векторов и вирусных частиц является присутствие на их поверхности лиганда, способного к распознаванию и связыванию с клеточным или экспонированным на клеточной поверхности компонентом, таким как маркер, специфичный для клетки (например, HPV-инфицированной клетки), тканеспецифичный маркер (например, маркер, специфичный для эпителиальных клеток), а также вирусный антиген (например, HPV). Примеры пригодных лигандов включают антитела или их фрагменты, направленные на антигенный домен HPV. Направленность на клетки можно осуществить путем генетического встраивания лиганда в полипептид, присутствующий на поверхности вируса (например, аденовирусный файбер-протеин, пентон, р1Х или продукт гена р14 вируса осповакцины).
Изобретение также относится к клеткам-хозяевам, содержащим вышеописанные молекулы нуклеиновой кислоты, векторы или инфекционные вирусные частицы для применения, как определено здесь.
Молекулы нуклеиновой кислоты, векторы и инфекционные вирусные частицы, применяемые в изобретении, можно ввести в клетку-хозяина любым способом, известным в данной области техники. Такие способы включают, но не ограничены ими, микроинъекцию (Capechi et al., 1980, Cell 22, 479-488), CaPO4-опосредованную трансфекцию (Chen and Okayama, 1987, Mol. Cell Biol. 7, 2745-2752), трансфекцию, опосредованную ДЭАЭ-декстраном, электропорацию (Chu et al., 1987, Nucleic Acid Res. 15, 1311-1326), липофекцию/слияние с липосомой (Felgner et al., 1987, Proc. Natl. Acad. Sci. USA 84, 7413-7417), бомбардировку частицами (Yang et al., 1990, Proc. Natl. Acad. Sci. USA 87, 9568-9572), генные пушки, трансдукцию, вирусную инфекцию, а также прямое введение в организм-хозяин различными способами. Кроме того, как описано выше, их можно применять в сочетании с реагентами трансфекции с целью облегчения их введения в клетку-хозяина или организм-хозяин, такими как поликатионные полимеры (например, хитозан, полиметакрилат, ПЭИ (полиэтиленимин) и т.д.) и катионные липиды (например, DC-Chol/DOPE, трансфектам липофектин, в настоящее время доступные от фирмы Promega).
В другом аспекте данного изобретения вышеописанные молекулу нуклеиновой кислоты, вектор или инфекционную вирусную частицу (на которые здесь также ссылаются как на "активный агент") или любую их комбинацию включают в композицию. Такая комбинация может включать векторы или вирусные частицы, кодирующие полипептиды Е2 различные генотипов.
Преимущественно композиция представляет собой фармацевтическую композицию, которая содержит дополнительно к терапевтически эффективному количеству активного агента(ов) фармацевтически приемлемый носитель. Как используют здесь, "терапевтически эффективное количество" представляет собой дозу, достаточную для облегчения одного или более чем одного симптома, обычно обусловленного заболеванием или состоянием, котором желательно лечить. Например, терапевтически эффективное количество может представлять собой то количество, которое необходимо для индукции иммунного ответа или активации иммунной системы, приводящей в результате к развитию ответа анти-HPV. Как используют здесь, в "фармацевтически приемлемый носитель" подразумевают включать любой и все носители, растворители, разбавители, эксципиенты, адъюванты, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты и агенты, замедляющие всасывание, и тому подобное, совместимые с фармацевтическим введением.
Желательно композицию, применяемую в изобретении, готовят для применения у человека или животного. Ее предпочтительно включают в изотонический, гипотонический или слабо гипертонический разбавитель, и он имеет относительно низкую ионную силу. Репрезентативные примеры пригодных разбавителей включают стерильную воду, физиологический раствор (например, хлорида натрия), раствор Рингера, растворы глюкозы, трегалозы или сахарозы, раствор Хэнкса и другие водные физиологически сбалансированные солевые растворы (см., например, самое современное издание Remington: The Science and Practice of Pharmacy, A. Gennaro, Lippincott, Williams&Wilkins). Кроме того, композиция может быть забуферена при физиологическом или слегка основном pH (например, между примерно pH 7 и примерно pH 9). Пригодные буферы включают без ограничения фосфатный буфер (например, ФСБ), бикарбонатный буфер и Трис-НСl буфер. В целях иллюстрации препараты, которые особо приспособлены к изобретению, включают:
- 1 М сахароза, 150 мМ NaCl, 1 мМ MgCl2, 54 мл/л Твин 80, 10 мМ Трис-HCl, pH 8,5 (в частности, когда активный агент представляет собой аденовирусный вектор);
- 10 мг/мл маннит, 1 мг/мл ЧСА, 20 мМ Трис, pH 7,2, и 150 мМ NaCl; и
- физиологический раствор.
Такие препараты особенно пригодны для сохранения стабильности композиции, применяемой в изобретении, при замораживании (например, -70°C, -20°C), охлаждении (например, 4°C) или при температуре окружающей среды. Композицию, применяемую в изобретении, можно также готовить в виде препарата в твердой форме. Твердые (например, сухие порошкообразные или лиофилизированные) композиции могут быть получены способом, включающим вакуумную сушку и сушку вымораживанием. Обычно их восстанавливают в пригодном носителе перед применением.
Композиция может также содержать один или более чем один фармацевтически приемлемый эксципиент для обеспечения желательных фармацевтических или фармакологических свойств, включая, например, модификацию или поддержание pH, осмомолярности, вязкости, прозрачности, цвета, стерильности, стабильности, скорости растворения препарата, модификацию или поддержание высвобождения или всасывания в человеческом или животном организме, стимуляцию транспорта через слизистый барьер или проникновение в конкретный орган. Например, композиция, пригодная для вагинального введения, может, в конечном счете, включать один или более чем один усилитель всасывания, полезный для увеличения размера пор слизистых оболочек.
Кроме того, композиция, применяемая в изобретении, может содержать один или более чем один адъювант, пригодный для системного применения или применения на слизистой оболочке у людей. Предпочтительно адъювант способен к стимуляции иммунитета к активному агенту, особенно Т клеточно-опосредованного иммунитета, например, посредством toll-подобных рецепторов (TLR), таких как TLR-7, TLR-8 и TLR-9. Репрезентативные примеры полезных адъювантов включают без ограничения алюминиевые квасцы, эмульсию минерального масла, такую как полный и неполный адъювант Фрейнда (IFA), липополисахарид или его производное (Ribi et al., 1986, Immunology and Immunopharmacology of Bacterial Endotoxins, Plenum Publ. Corp., NY, p407-419), сапонины, такие как QS21 (Sumino et al., 1998, J.Virol. 72, 4931-4939; WO 98/56415), соединения имидазохинолина, такие как Imiquimod (Suader, 2000, J. Am Acad Dermatol. 43, S6-S11), производное 1Н-имидазо(4,5-с)хинолон-4-амина (Aldara™) и родственное соединение S-27609 (Smorlesi, 2005, Gene Ther. 12, 1324-1332), олигодезоксинуклеотиды цитозинфосфата и гуанозина, такие как CpG (Chu et al., 1997, J. Exp.Med. 186: 1623; Tritel et al., 2003, J. Immunol. 171: 2358-2547) и катионные пептиды, такие как IC-31 (Kritsch et al., 2005, J. Chromatogr Anal. Technol Biomed Life Sci 822, 263-270).
Композицию, применяемую в изобретении, можно вводить с помощью ряда способов введения, включая системное, местное введение и введение в слизистую оболочку. Системное введение можно осуществлять любыми способами, например, путем подкожной, внутрикожной, внутримышечной, внутривенной, внутрибрюшинной, внутрисосудистой, внутриартериальной инъекции. Инъекции можно проводить с помощью общепринятых шприцов и игл или любых других подходящих устройств, доступных в данной области техники. Введение в слизистую оболочку можно осуществлять пероральным, назальным, интратрахеальным, внутрилегочным, интравагинальным или интраректальным путем. Местное введение можно проводить с использованием чрескожных средств (например, пластыря и тому подобного). Композицию, применяемую в изобретении, предпочтительно готовят в форме препарата, пригодного для инъекции, где предпочтительно внутримышечное или подкожное введение.
Подходящая дозировка может быть адаптирована в зависимости от различных параметров, в частности, способа введения; применяемого активного агента; возраста, состояния здоровья и массы организма-хозяина; вида сопутствующего лечения и/или частоты лечения. Дополнительное уточнение вычислений, необходимых для определения подходящей дозировки для лечения, рутинно проводятся практикующим врачом в свете релевантных обстоятельств. В качестве общего руководства, пригодная дозировка для аденовирусных частиц варьирует от примерно 105 до примерно 1013 ИЕ (инфекционных единиц), желательно от примерно 107 до примерно 1012 ИЕ и предпочтительно от примерно 108 до примерно 1011 ИЕ. Пригодная дозировка для MVA частиц варьирует от примерно 104 до примерно 1010 БОЕ (бляшкообразующих единиц), желательно от примерно 105 до примерно 109 БОЕ и предпочтительно от примерно 106 до примерно 108 БОЕ. Векторные плазмиды можно вводить в дозах между 10 мкг и 20 мг и предпочтительно между 100 мкг и 2 мг.
Кроме того, введение может иметь место в однократной дозе или альтернативно в многократных дозах в соответствии со стандартными протоколами, дозировками и режимами через периоды несколько часов, суток и/или недель. Кроме того, введение можно осуществлять путем болюсной инъекции или непрерывной инфузии. Например, организм-хозяин можно лечить по меньшей мере двумя (например, от 2 до 10) введениями вышеописанной нуклеиновой кислоты, вектора, инфекционной частицы или композиции. Предпочтительно первую серию введений проводят последовательно через периоды времени, варьирующие от нескольких суток до 4 недель, с последующей второй серией введений (например, одного или двух введений), проводимой в пределах от одного до 6 месяцев после последнего введения первой серии. Период времени между каждым из введений второй серии может составлять от нескольких суток до 4 недель. В предпочтительном воплощении первая серия введений включает три последовательных введения с недельным интервалом, а вторая серия включает одно введение в пределах от 4 до 6 месяцев после первой серии. В качестве общего руководства, при применении инфекционных частиц MVA в соответствии с настоящим изобретением введение предпочтительно осуществляют подкожным путем при дозе частиц MVA, содержащей между 106 и 5×108 БОЕ.
Как упомянуто выше, описанные здесь молекулу нуклеиновой кислоты, вектор, инфекционную вирусную частицу или композицию, либо их комбинацию предпочтительно вводят после воздействия на организм-хозяин (пациента) по меньшей мере одного папилломавируса и до обнаружения/выявления повреждения, обусловленного папилломавирусом. Иными словами, организмы-хозяева с инфекцией HPV, но которые еще не прогрессировали до неоплазии, являются подходящими кандидатами для применения в соответствии с настоящим изобретением для предупреждения или снижения вероятности прогрессирования до неоплазии и, в конечном счете, до рака.
"Воздействие" означает столкновение организма-хозяина по меньшей мере с одним папилломавирусом, которое дает возможность инфекции. В настоящее время в данной области техники доступен ряд диагностических методов, позволяющих диагностировать папилломавирусную инфекцию. Например, биологический образец можно собрать из организма-хозяина, подверженного риску папилломавирусной инфекции, и проанализировать на присутствие вирусной нуклеиновой кислоты папилломавируса (например, ДНК или мРНК) и/или вирусного антигена. Такие способы включают без ограничения ПЦР, гибридизацию in situ, иммунофлуоресценцию, ЭЛАЙЗА, и в настоящее время доступен ряд диагностических тестов. Репрезентативные примеры пригодных тестов включают систему LiPA (WO99/14377; Labo Biomedical products, Netherlands), тест Hybrid Capture II® (HCII; Digene Corp, USA, позволяет обнаруживать ДНК на 13 HR-HPV), тест Linear Array® (Roche, позволяет генотипировать ДНК на 37 генотипов HPV), Thin Prep System (Cytyc Corporate; Marlborough, MA), PreTect-HPV Proofer® (NorChip AS, Norway, позволяет обнаружить мРНК Е6/Е7 на HPV-16, HPV-18, HPV-31, HPV-33 и HPV-45), системы ПЦР/ОТ-ПЦР и ПЦР в реальном времени, описанные Pretet et al. (2004, J. Clin. Virol. 31, 140-147) или Monnier-Benoit et al. (2006, J. Clin. Virol. 31, 140-147). Пригодные праймеры известны специалистам в данной области техники или могут быть легко синтезированы на основании нуклеотидной последовательности обнаруженного папилломавируса.
Как используют здесь, "повреждение, обусловленное папилломавирусом", относится к любому заболеванию или состоянию, вызванному инфекцией папилломавируса. Данный термин охватывает как предраковые, так и злокачественные повреждения. Репрезентативные примеры предраковых повреждений включают без ограничения интраэпителиальную неоплазию низкой, средней или высокой степени, которую можно обнаружить в различных тканях, такую как ИЦН, интраэпителиальная неоплазия вульвы (ИНВ), анальная интраэпителиальная неоплазия (АИН), интраэпителиальная неоплазия полового члена (ИНП) и интраэпителиальная неоплазия влагалища (ИНВл). Репрезентативные примеры злокачественных повреждений включают без ограничения карциному шейки матки, анальную карциному, рак влагалища, рак полового члена и рак полости рта. Предраковое и злокачественное повреждение, обусловленное папилломавирусом, можно визуализировать путем прямого обследования (например, путем кольпоскопии, в конечном счете, после нанесения уксусной кислоты) или диагностировать способами, обычно практикуемыми клиницистами (например, скрининг мазков с помощью пап-теста, обнаружение аномальных клеток из цитологических образцов). Например, локальную биопсию ацидофильных областей или повреждений, визуализированных путем кольпоскопии, можно собрать и исследовать на морфологические аномалии (например, эпителиальную гиперплазию, заметные ядерные аномалии и т.д.). В контексте изобретения повреждения, обусловленные папилломавирусом, не включают слабые аномалии, такие как АМКНЗ (атипичные метапластические клетки неясного значения).
Согласно предпочтительному воплощению описанные здесь молекулу нуклеиновой кислоты, вектор, инфекционную вирусную частицу или композицию, либо их комбинацию применяют для лечения персистентной инфекции, вызванной по меньшей мере одним папилломавирусом, в частности, одним HR-HPV, при особом предпочтении HPV-16, HPV-18, HPV-33 или HPV-52 или любой их комбинации (например, оба HPV-16 и HPV-18). В контексте изобретения полипептид Е2 может иметь происхождение от инфекционного папилломавируса или от папилломавируса, который перекрестно реагирует с инфекционным папилломавирусом.
Вследствие консервативности аминокислотных последовательностей между полипептидами Е2 различных HR-HPV можно ожидать перекрестной реактивности, особенно между HPV16 и HPV31, HPV33, HPV35, HPV52 и HPV58. В одном аспекте в настоящем изобретении применяют молекулу нуклеиновой кислоты, вектор, инфекционную вирусную частицу или композицию, кодирующие полипептид Е2, имеющий происхождение от HPV-16, для лечения пациентов, страдающих инфекцией, вызванной по меньшей мере одним из HPV16, HPV31, HPV33, HPV35, HPV52 и HPV58.
Подобным образом, перекрестной реактивности можно ожидать между HPV-18 и HPV-39, HPV-45, HPV-51, HPV-56, HPV-59, HPV-68, HPV-70 и HPV-85. В другом аспекте в настоящем изобретении применяют молекулу нуклеиновой кислоты, вектор, инфекционную вирусную частицу или композицию, кодирующие полипептид Е2, имеющий происхождение от HPV-18, для лечения пациентов, страдающих инфекцией, вызванной по меньшей мере одним из HPV-18, HPV-39, HPV-45, HPV-51, HPV-56, HPV-59, HPV-68, HPV-70 и HPV-85.
Как используют здесь, "персистентная папилломавирусная инфекция" соответствует бессимптомной фазе папилломавирусной инфекции в организме-хозяине, которая не достигла спонтанной эрадикации вируса после воздействия папилломавируса. Персистентная папилломавирусная инфекция установлена, когда папилломавирус или по меньшей мере один его элемент (например, нуклеиновую кислоту, антигены и тому подобное) обнаруживают в организме-хозяине при 2 последовательных тестированиях с интервалом в несколько месяцев, например, по меньшей мере 6 месяцев, преимущественно по меньшей мере 8 месяцев, предпочтительно по меньшей мере 10 месяцев и более предпочтительно по меньшей мере 12 месяцев, хотя клинических признаков не наблюдают (например, предраковых и/или злокачественных повреждений, обусловленных папилломавирусом). Бессимптомная фаза характеризуется нормальной цитологией (хотя слабые аномалии, такие как АМКНЗ, допускают). Например, персистентная папилломавирусная инфекция установлена у пациентов, проявляющих положительное тестирование HCII примерно с 6-месячным интервалом, несмотря на нормальный пап-тест мазка.
В одном воплощении вышеописанные молекулу нуклеиновой кислоты, вектор, инфекционную вирусную частицу или композицию применяют в соответствии с описанными здесь способами воздействия для индукции или активации иммунного ответа в организме-хозяине, подлежащем лечению, по сравнению с отсутствием применения таких активных агентов.
Индуцированный или активированный иммунный ответ может быть специфическим и/или неспецифическим и может быть гуморальным и/или клеточно-опосредованным. Гуморальные ответы включают продуцирование антител против по меньшей мере папилломавирусного полипептида, тогда как клеточный ответ включает ответ Т-хелперных клеток, и/или CTL, и/или стимуляцию продуцирования цитокинов. Предпочтительно индуцированный или активированный иммунный ответ эффективен для обеспечения антивирусного ответа против по меньшей мере одного из инфекционных папилломавирусов.
Способность вышеописанных молекулы нуклеиновой кислоты, вектора, инфекционной вирусной частицы или композиции к индукции или активации иммунного ответа в организме-хозяине, подлежащем лечению, можно оценить либо in vitro, либо in vivo с помощью ряда анализов, которые являются стандартными в данной области техники (общее описание методов, доступных для оценка появления и активации иммунного ответа см., например, в Coligan et al., 1992 и 1994, Current Protocols in Immunology; ed J Wiley & Sons Inc, National Institute of Health). Измерение клеточного иммунитета можно осуществить путем измерения профилей цитокинов, секретируемых активированными эффекторными клетками, включая клетки, имеющие происхождение от CD4+ и CD8+Т-клеток (например, путем количественного определения клеток, продуцирующих ИЛ-10 или ИФНу, с помощью ELIspot (иммуноферментного спот-анализа)), путем определения состояния активации иммунных эффекторных клеток (например, анализы Т-клеточной пролиферации путем классического захвата [3Н]-тимидина), путем анализа на антигенспецифические Т-лимфоциты у сенсибилизированного субъекта (например, специфичный к пептиду лизис в анализе цитотоксичности). Способность к стимуляции клеточного ответа можно также оценить, например, у сингенных мышей (например, HzD") или у трансгенных мышей (например, HLA A2 и HLA B7) с помощью ELISPOT, аналитических методов на основе тетрамеров или других стандартных методов анализа Т-клеточно-опосредованного иммунитета. Гуморальный ответ можно определить путем анализов связывания антител и/или конкурентных анализов (например, см. Harlow, 1989, Antibodies, Cold Spring Harbor Press). Например, можно разработать иммунологические способы анализа, например, ЭЛАЙЗА, для обнаружения антител анти-Е2 в организме-хозяине, получившем лечение.
В другом воплощении вышеописанные молекулу нуклеиновой кислоты, вектор, инфекционную вирусную частицу или композицию применяют в соответствии с описанными здесь способами воздействия для обеспечения антивирусного ответа против по меньшей мере одного из инфекционных папилломавирусов по сравнению с отсутствием применения таких активных агентов.
Как используют здесь, "антивирусный ответ" относится к уменьшению или элиминации симптомов, обычно обусловленных папилломавирусной инфекцией, у организма, получившего лечение. Например, антивирусный ответ может быть подтвержден на основании способности вышеописанного активного агента(ов) к борьбе с вирусной инфекцией, к сокращению или выведению по меньшей мере одного инфекционного папилломавируса и/или к сокращению или выведению инфицированных клеток или клеток, экспрессирующих последовательности папилломавирусных генов (в частности, потенциально онкогенных генов Е6 и Е7). Это можно оценить на основании значимого снижения или отсутствия обнаружимого уровня маркеров, показательных для папилломавирусной инфекции, например, папилломавируса, вирусной нуклеиновой кислоты и/или вирусных антигенов, в биологическом образце, собранном от организма-хозяина, получающего лечение, по сравнению с уровнем до применения. Сокращение или элиминацию показывают путем сравнения уровня такого маркера(ов), измеренного в момент времени после прекращения применения согласно изобретению с уровнем того же маркера(ов), измеренного перед таким применением, который представляет собой не вылеченную инфекцию. В предпочтительном воплощении антивирусный ответ является таким, что при измерении в биологическом образце, собранном от организма-хозяина, получающего лечение, отсутствует обнаружимый уровень папилломавируса, вирусной нуклеиновой кислоты и/или антигенов в течение нескольких месяцев после прекращения применения согласно изобретению.
Антивирусный ответ может быть также подтвержден на основании способности вышеописанного активного агента(ов) к значимому снижению встречаемости, размера и/или тяжести повреждений, которые типично развиваются у организмов, инфицированных папилломавирусом. Как используют здесь, "снижение" означает предупреждение, отсрочивание, затруднение, замедление, задержку и/или отдаленное развитие встречаемости, размера и/или тяжести повреждений, обусловленных папилломавирусом, как определено здесь. Способность вышеописанного активного агента к снижению встречаемости, размера и/или тяжести повреждений, обусловленных папилломавирусом, можно оценить путем регулярного обследования организма-хозяина, получившего лечение. Предпочтительно снижение является таким, что у организма-хозяина, получившего лечение, не развивается никакого повреждения, обусловленного папилломавирусом (например, подтвержденных гистологически повреждений ИЦН), в течение по меньшей мере одного года, преимущественно в течение по меньшей мере 2 лет, предпочтительно в течение по меньшей мере 3 лет и более предпочтительно в течение по меньшей мере 5 лет после завершения применения согласно изобретению. Более предпочтительно применение согласно изобретению дает возможность отсрочить или устранить необходимость в абляционной процедуре (например, конизации) у организма-хозяина, получившего лечение.
В качестве общего указания, период времени, отделяющий последнее введение активного агента в организм-хозяина от обнаружения антивирусного ответа, может варьировать в зависимости от анамнеза папилломавирусной инфекции, способов применения и/или организма-хозяина, подлежащего лечению. Предпочтительно он составляет от трех месяцев до нескольких лет при особом предпочтении по меньшей мере 3 месяцев, преимущественно по меньшей мере 4 месяца, желательно по меньшей мере 5 месяцев, предпочтительно по меньшей мере 6 месяцев и более предпочтительно по меньшей мере один год. Например, антивирусный ответ подтвержден, если организм-хозяин, который был положительным перед лечением ДНК HPV, что обнаружено в образце из шейки матки, например, с помощью Digen HCII, обнаруживают как отрицательный на тот же папилломавирус по меньшей мере через 6 месяцев после последнего введения вышеописанного активного агента.
Настоящее изобретение также относится к способу индукции, либо активации, либо распространения иммунного ответа против по меньшей мере одного из инфекционных папилломавирусов у организма-хозяина, при котором в указанный организм вводят терапевтически эффективное количество вышеописанных молекулы нуклеиновой кислоты, вектора, инфекционной вирусной частицы или композиции либо для индукции, либо для активации, либо для распространения указанного иммунного ответа, где указанные молекулу нуклеиновой кислоты, вектор, инфекционную вирусную частицу или композицию вводят после воздействия папилломавируса и до обнаружения/выявления повреждения, обусловленного папилломавирусом. Предпочтительно индуцированный или активированный иммунный ответ обеспечивает антивирусный ответ против по меньшей мере одного из инфекционных папилломавирусов, как определено выше.
В одном воплощении способ или применение согласно настоящему изобретению можно осуществлять в сочетании с одним или более чем одним общепринятым терапевтическим способом воздействия. Множество терапевтических методов обеспечивает организм-хозяина вмешательством на более широкой основе. Их введение может предшествовать, быть одновременным или последовательным по отношению к введению молекулы нуклеиновой кислоты, вектора, инфекционной вирусной частицы или композиции, применяемых в изобретении.
В другом воплощении способ или применение согласно настоящему изобретению можно осуществлять в соответствии со способом первичного и вторичного (бустер-инъекции) терапевтического воздействия, который включает последовательное введение одного или более чем одной первичной инъекции и одной или более чем одной вторичной (бустер-инъекции) инъекции антигена. Типично при первичной и вторичной инъекции антигена применяют различные носители, которые включают или кодируют по меньшей мере общий иммуногенный домен. Первичную инъекцию антигена сначала вводят в организм-хозяина, а вторичную инъекцию последовательно вводят в тот же организм-хозяина с интервалом, варьирующим от одних суток до двенадцати месяцев. Способ или применение в соответствии с изобретением может включать от одного до десяти последовательных введений первичной инъекции антигена с последующим введением вторичной инъекции антигена в количестве от одного до десяти. Кроме того, первичную и вторичную инъекцию антигена можно вводить в один и тот же сайт или в альтернативные сайты одним и тем же путем или различными путями введения, например, подкожной инъекцией для вектора MVA, внутримышечной инъекцией для плазмидной ДНК и для аденовирусного вектора.
В контексте изобретения вышеописанные молекулу нуклеиновой кислоты, вектор, инфекционную вирусную частицу или композицию можно применять либо для примирования, либо для усиления, либо как для примирования, так и для усиления анти-папилломавирусного иммунного ответа. Например, аденовирусный вектор или частицы, как определено выше, можно применять в качестве первичной инъекции, а вектор или частицы MVA, как определено выше, в качестве вторичной инъекции антигена, или наоборот. Возможно также применять вышеописанные молекулу нуклеиновой кислоты, вектор, инфекционную вирусную частицу или композицию в комбинации с любым из материалов предшествующего уровня техники, кодирующим или включающим антигенный домен, общий с композицией по изобретению. Источники такого материала широки и включают без ограничения пептиды, белки (например, продуцируемый рекомбинантным путем полипептид Е2), вирусные векторы, плазмидную ДНК, белковоподобные частицы, такие как вирусоподобные частицы, клеточные материалы, такие как облученные клетки, и т.д.
Изобретение описано иллюстративно и должно быть понятно, что терминологию, которая была использована, подразумевают как имеющую скорее описательную, чем ограничивающую природу. Очевидно, что многие модификации и вариации настоящего изобретения возможны в свете вышеизложенных положений. Поэтому должно быть понятно, что в пределах объема прилагаемой формулы изобретения изобретение можно осуществлять на практике путем, отличным от конкретно описанного здесь.
Все цитируемые выше описания патентов, публикаций и доступов к базам данных конкретно включены здесь путем ссылки в их полном объеме до той степени, как если бы каждый индивидуальный патент, публикация или доступ были конкретно и индивидуально указаны для включения путем ссылки.
Комментарии к графическим материалам
Фиг.1 иллюстрирует схематическое изображение плазмиды pTG17408, кодирующей презентированный на мембране и дефектный полипептид HPV-16 Е2.
Фиг.2 иллюстрирует схематическое изображение плазмиды pTG17409, кодирующей презентированный на мембране и репликационно-дефектный полипептид HPV-16 Е1, нуклеотидная последовательность которого является вырожденной в участке из 59 нуклеотидов, общим с кодирующей последовательностью HPV-16 Е2.
Фиг.3 иллюстрирует Е2-специфичный ответ ИФНу Th1, который обнаружен с помощью ELISPOT у мышей, инъецированных MVATG17408 (MVA-E2) или отрицательным контролем MVA-N33.
Приведенные ниже примеры служат для иллюстрации настоящего изобретения.
ПРИМЕРЫ
Конструкции, описанные ниже, выполняют в соответствии с общими методами генной инженерии и молекулярного клонирования, подробно описанными в Maniatis et al. (1989, Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor NY), или в соответствии с рекомендациями изготовителя, когда используют коммерческий набор. Методы ПЦР амплификации известны специалистам в данной области техники (см., например, PCR protocols - A guide to methods and applications, 1990, опубликованы Innis, Gelfand, Sninsky and White, Academic Press). Рекомбинантные плазмиды, несущие ген устойчивости к ампициллину, реплицируют в E. coli С600 (Stratagene), BJ5183 (Hanahan, 1983, J. Mol. Biol. 166, 557-580) и NM522 на агаре или в жидкой среде с добавлением 100 мкг/мл антибиотика. Штамм BJ5183 предпочтительно используют, когда клонирование осуществляют путем гомологической рекомбинации (Bubek et al., 1993, Nucleic acid Res. 21, 3601-3602).
Конструкции рекомбинантных вирусов осповакцины выполняют в соответствии с общепринятой технологией в данной области техники, как процитировано в вышеописанных документах и в Mackett et al. (1982, Proc. Natl. Acad. Sci. USA 79, 7415-7419) и Mackett et al. (1984, J. Virol. 49, 857-864). Селективный ген gpt (ксантингуанинфосфорибозилтрансферазы) Е. coli (Falkner and Moss, 1988, J. Virol. 62, 1849-1854) используют для облегчения отбора рекомбинантных вирусов осповакцины.
Пример 1: Конструирование рекомбинантного вектора MVA. экспрессирующего ген HPV-16 Е2
Клонирование гена HPV16 Е2
Нуклеотидные последовательности, кодирующие HPV16 Е2, были клонированы из геномной ДНК, выделенной из клеток CaSki (ATCC CRL-1550). Ген Е2 амплифицировали, используя праймеры OTG16809 (SEQ ID NO: 9) и OTG16810 (SEQ ID NO: 10). Полученный в результате фрагмент переваривали рестриктазами BamHI и EcoRI и встраивали в pGEX2T (Amersham Biosciences), рестрицированную теми же ферментами, с получением pTG 17239. Секвенирование клонированного гена Е2 показало пять мутаций по сравнению с последовательностью-прототипом HPV16 Е2 (описанной в Genbank NC-01526). Две мутации были молчащими, а три не молчащих мутации (Т2101, S219P, К310Т) были скорректированы, используя набор для сайт-направленного мутагенеза QuikChange Site Directed Mutagenesis (Stratagene), с получением pTG17268.
Модификация полипептида HPV-16 Е2
Нуклеотидные последовательности Е2, включенные в pTG17268, были модифицированы путем сайт-направленного мутагенеза в целях создания варианта HPV-16 Е2 (Е39А и I73A), обозначенного Е2*. Более конкретно функция репликации Е2 была запрещена путем замены остатка Glu в положении 39 на Ala, a функция трансактивации путем замены остатка Не в положении 73 на Аlа. Полученная в результате плазмида pTG17318 содержит модифицированные последовательности, кодирующие HPV-16 E2*.
HPV-16 E2* был дополнительно модифицирован путем гибридизации с последовательностями пептидного сигнала при его N-конце и заякоривания в мембране при его С-конце, имеющими происхождение от гликопротеина изолята вируса бешенства (Genbank ay009097), так чтобы направлять презентацию HPV-16 E2* в экспрессирующих клетках-хозяевах на поверхности плазматической мембраны. Нуклеотидные последовательности (SEQ ID NO: 8), кодирующие презентированный на мембране дефектный вариант E2, обозначенные SS-E2*-TMR, были подвергнуты повторной сборке путем тройной ПЦР, используя приведенные ниже праймеры: OTG17500 (SEQ ID NO: 11), OTG17501 (SEQ ID NO: 12), OTG17502 (SEQ ID NO: 13), OTG17503 (SEQ ID NO: 14), OTG17504 (SEQ ID NO: 15) и OTG17505 (SEQ ID NO: 16). Повторно собранная последовательность была встроена в вектор pBS-происхождения (Stratagene) с получением pTG17360, а затем клонирована в плазмиде для переноса вируса осповакцины ниже промотора pH5R (Rosel et al, 1986, J Virol. 60, 436-449) с получением pTG17408 (фиг.1).
Плазмида для переноса предназначена для того, чтобы дать возможность переноса вставки нуклеотидной последовательности путем гомологической рекомбинации в делецию III генома MVA. Она имеет происхождение от плазмиды pTG1E (описанной в Braun et al., 2000, Gene Ther. 7, 1447-1457), в которой были клонированы фланкирующие последовательности (BRG3 и BRD3), окружающие делецию III MVA, последовательности которых были получены с помощью ПЦР из ДНК MVATGN33.1 (Sutter and Moss, 1992, Proc. Natl. Acad. Sci. USA, 89, 10847-10851). Плазмида для переноса также содержит гибридную последовательность между геном усиленного зеленого флуоресцентного белка Aequorea victoria (геном eGFP, выделенным из pEGP-C1, Clontech) и геном ксантингуанинфосфорибозилтрансферазы Escherichia соli (геном gpt) под контролем раннего и позднего синтетического промотора р11К7.5 вируса осповакцины (любезно предоставленного R. Wittek, University of Lausanne). Синтез ксантингуанинфосфорибозилтрансферазы дает возможность рекомбинантному GPT* MVA образовывать бляшки в селективной среде, содержащей микофеноловую кислоту, ксантин и гипоксантин (Falkner et al, 1988, J. Virol. 62, 1849-1854), и eGFP дает возможность визуализации рекомбинантных бляшек MVA. Селективный маркер eGPP-GPT помещают между двумя гомологичными последовательностями в той же ориентации. Когда клональная селекция достигнута, селективный маркер легко элиминируют путем нескольких пассажей без селекции, дающей возможность роста eGPP-GPF рекомбинантного MVA.
Конструирование рекомбинантного MVA, экспрессирующего ген HPV-16 88-Е2*-ТМР
Получение вируса MVATG17408 осуществляли путем гомологической рекомбинации в первичных эмбриональных фибробластах цыпленка (CEF), инфицированных MVATGN33.1 (при М3 (множественности заражения) 0,1 БОЕ/клетка) и трансфецированных pTG17408 (в соответствии со стандартной кальций-фосфатной преципитацией ДНК). Вирусную селекцию проводили путем трех раундов очистки бляшек в присутствии селективной среды, содержащей микофеноловую кислоту, ксантин и гипоксантин. Как упомянуто выше, селективный маркер затем элиминировали путем пассажа в неселективной среде. Отсутствие загрязнения исходным MVA проверяли с помощью ПЦР.
Анализ экспрессии Е2 проводили с помощью Вестерн-блоттинга. CEF инфицировали при М3 0,2 MVATG17408 и через 24 часа клетки собирали. Вестерн-блот-анализ проводили, используя коммерческое моноклональное антитело анти-Е2 TVG271 (Abeam). Была обнаружена экспрессия белка видимой молекулярной массы 55 кДа, тогда как теоретическая молекулярная масса Е2*-TMR равна 48,9 кДа. После обработки клеточных экстрактов эндогликозидазой F наблюдали уменьшение размера рекомбинантного белка, что позволяет предположить, что E2*-TMR модифицирован М-гликозилированием.
Пример 2: Конструирование рекомбинантного MVA. экспрессирующего ген HPV-16 Е1
Нуклеотидные последовательности, кодирующие полипептид HPV16 Е1, были клонированы из ДНК клеток CaSki (ATCC CRL-1550). Более конкретно ген Е1 был амплифицирован в виде двух частей Е1а (nt 1 - 1102) и E1b (nt 1001-1950). Праймеры OTG16811 (SEQ ID NO: 17) и ОТО 16814 (SEQ ID NO: 18) использовали для амплификации фрагмента Е1а, который переваривали рестриктазами BamHI и EcoRI и встраивали в pGEX2T, рестрицированную теми же ферментами, с получением pTG17240. Фрагмент E1b был получен, используя OTG16813 (SEQ ID NO: 19) и OTG16812 (SEQ ID NO: 20), и переварен BamHI и EcoRI, после чего встроен в pGEX2T с получением в результате pTG17241. Секвенирование показало 4 мутации по сравнению с последовательностью-прототипом HPV-16 Е1 (описанной в Genbank NC-01526). Одна мутация была молчащей и три не молчащих мутации, присутствующие в Е1а (K130Q, N185T и T220S), были скорректированы путем сайт-направленного мутагенеза. Затем полноразмерный ген Е1 был подвергнут повторной сборке путем клонирования скорректированного фрагмента Е1а в pTG17241, переваренной BsrGI и EcoRI. Полученная в результате плазмида была названа pTG 17289.
В геноме HPV-16 59 последних нуклеотидов гена Е1 идентичны 59 первым нуклеотидам гена Е2. Присутствие этих гомологичных последовательностей может привести к событиям гомологической рекомбинации и, следовательно, нестабильности на стадиях получения Е1 и Е2-кодирующего вектора MVA. Следовательно, этот участок El-кодирующих последовательностей был модифицирован путем вырожденности использования кодонов таким образом, чтобы снизить гомологию последовательности Е2-кодирующей последовательности. Вырожденная последовательность была получена путем амплификации 3'-конца гена Е1 с использованием вырожденных праймеров OTG17408 (SEQ ID NO: 21) и OTG17409 (SEQ ID NO: 22). Амплифицированный фрагмент переваривали рестриктазами NsiI и BglII и встраивали в pTG17289, рестрицированную теми же ферментами, с получением pTG17340.
Вырожденные последовательности HPV-16 Е1 были также мутированы путем сайт-направленного мутагенеза в целях запрещения функции репликации кодируемого полипептида Е1 путем замены остатка Gly в положении 482 HPV-16 Е1 остатком Asp (G482D; также обозначен здесь Е1*) с получением в результате pTG 17373.
Последовательности HPV-16 E1deg* были также модифицированы таким образом, чтобы направлять экспрессию кодируемого полипептида на поверхности плазматической мембраны, путем гибридизации с последовательностями пептидного сигнала и заякоривания в мембране, имеющими происхождение от гликопротеина изолята вируса бешенства (описанного в Genbank n(M38452). Последовательность SS-E1deg*-TMR была восстановлена путем тройной ПЦР с использованием приведенных ниже праймеров OTG17560 (SEQ ID NO: 23), OTG17561 (SEQ ID NO: 24), OTG17562 (SEQ ID NO: 25), OTG17563 (SEQ ID NO: 26), OTG17564 (SEQ ID NO: 27) и OTG17565 (SEQ ID NO: 28). Полученная в результате последовательность (SEQ ID NO: 7) была встроена в вектор pBS-происхождения (Stratagene) с получением pTG17404. Затем последовательность SS-E1deg*-TMR клонировали в плазмиде для переноса, как описано в Примере 1, ниже промотора р7.5К (Cochran et al, 1985, J. Virol. 54: 30-37) с получением рТG17409 (фиг.2).
Получение вирусов MVATG17409 осуществляли в CEF путем гомологической рекомбинации, как описано в Примере 1.
Пример 3: Конструирование рекомбинантного MVA, экспрессирующего гены HPV-16 Е1 и Е2
Последовательность SS-E1deg*-TMR под контролем промотора р7.5К выделяли из pTG17409 и встраивали в pTG17408 с получением pTG17410.
Получение вирусов MVATG17410 осуществляли в CEF путем гомологической рекомбинации, как описано в Примере 1.
Пример 4: Конструирование рекомбинантного MVA. экспрессирующего гены HPV-16 Е1.Е2.Е6 и Е7
Ген HPV-16 Е7 был выделен и модифицирован, как описано в WO 99/03885, так чтобы он кодировал не онкогенный и направленный на мембрану полипептид Е7, проиллюстрированный в SEQ ID NO: 5. Не онкогенную мутацию осуществляли путем делеции аминокислотных остатков 21-26 (DLYCYE), а направленность на мембрану путем гибридизации с последовательностями пептидного сигнала и заякоривания в мембране гликопротеина вируса бешенства. Полученную в результате последовательность клонировали под контролем раннего-позднего промотора pH5R. Затем экспрессионную кассету встраивали в pTG17410 с получением pTG17482.
Ген HPV-16 Е6 был выделен и модифицирован, как описано в WO 99/03885, так чтобы он кодировал не онкогенный и направленный на мембрану полипептид Е6, проиллюстрированный в SEQ ID NO: 4. Не онкогенную мутацию осуществляли путем делеции аминокислотных остатков 118-122 (СРЕЕК), а направленность на мембрану путем гибридизации с последовательностями пептидного сигнала и заякоривания в мембране белка F вируса кори. Полученную в результате последовательность клонировали под контролем промотора р7.5К. Затем экспрессионную кассету встраивали в pTG17482 с получением pTG17483.
Получение MVATG174783 осуществляли, как описано в Примере 1.
Пример 5: Оценка HPV-16 Е2-специфичного ответа Th1 у мышей
HPV-16 Е2-специфичный ответ Th1 оценивали с помощью ELISPOT у мышей, которым был инъецирован MVATG17408 (MVA-E2). Предсказанные SYFPEITHI и BIMAS, генотип-специфичные, ограниченные Н2b и ограниченные человеческими HLA-A0201 пептиды ГКГ класса I были выбраны для анализа клеток, продуцирующих ИФНу при ответе против Е2. Эти пептиды представлены в приведенной ниже таблице I.
Самок мышей C57BI/6 иммунизировали подкожно 3 раза (на сутки 0, 7 и 14) 5·107 БОЕ MVATGN33 (отрицательный контроль) или MVATG17408 (MVA-E2). Селезенки брали на сутки 21 после первой иммунизации и проводили ELISPOT на Y-ИФН с использованием вышеописанных пептидов при концентрации 5 мкг/мл. ELISPOT проводили, используя набор Mabtech AB mouse IFNy ELISPOTPLUS (Mabtech, France) в соответствии с инструкциями изготовителя. Мазки считали, используя считывающее устройство для Elispot Bioreader 4000 Pro-X (BIOSYS-Gmbh; Serlabo France). Результаты были получены после вычитания фона несоответствующего пептида.
Как проиллюстрировано на фиг.3, четыре пептида дали значительное число спленоцитов, продуцирующих ИФНу, по сравнению с фоновым ответом, измеренным у животных, вакцинированных MVA-N33. Все эти пептиды являются НРV16-специфичными. F9V и N91 были определены в окружении H2-Db мыши, а A9L и T9V были определены в окружении HLA-A201 человека. Следует отметить, что пептид A9L был описан как индуцирующий специфичный ответ CTL (Konya et al, 1997, J Gen Virol.78 2615-20).
В заключение, как показано ELISPOT, подкожная инъекция MVATG17408 индуцирует Т-клеточные ответы против HPV16 у вакцинированных мышей.
Пример 6: Конструирование рекомбинантного вектора MVA. экспрессируюшего гены HPV-18 Е1 и Е2 (MVATG17582)
Гены HPV-18 Е1 и Е2 были восстановлены в виде синтетических генов, олигонуклеотиды были сконструированы таким образом, чтобы снизить гомологию менее чем до 75% между участком из 59 нуклеотидов, присутствующим как на 3'-конце нативной последовательности HPV-18 E1, так и на 5'-конце последовательности HPV-18 Е2, и чтобы ввести мутации, запрещающие ферментативные функции продуктов генов HPV-18 E1 и Е2 (E1: G489D, Е2: Е43А и I77A). Синтетическая последовательность HPV-18 E1 была также сконструирована таким образом, чтобы снизить процент гомологии между гомологичными участками, общими для нативных последовательностей HPV-16 и HPV-18, менее чем до 75%. С этой целью нуклеотидные последовательности генов HPV-16 и HPV-18 E1 и Е2 выравнивали и олигонуклеотиды конструировали таким образом, чтобы снизить гомологию менее чем до 6 последовательных нуклеотидов.
Последовательность HPV-18 degE1* была восстановлена путем сборки 50 олигонуклеотидов и клонирована в векторе pBS с получением pTG17473. Затем последовательность E1 гибридизовали с нуклеотидной последовательностью, кодирующей сигнальные пептиды от белка F вируса кори (SS-18E1deg*-TMF) с помощью тройной ПЦР, используя праймеры OTG15315 (SEQ ID NO: 39), OTG17881 (SEQ ID NO: 40), OTG17882 (SEQ ID NO: 41), OTG17883 (SEQ ID NO: 42), OTG17884 (SEQ ID NO: 43) и OTG17885 (SEQ ID NO: 44). Полученный в результате фрагмент (SEQ ID NO: 38), кодирующий полипептид SS18deg E1*-TMF, был клонирован в векторе MVA для переноса под контролем промотора р7.5К с получением pTG 17521.
Последовательность HPV-18 degE2* была восстановлена путем сборки 26 олигонуклеотидов и клонирована в векторе pBS с получением pTG 17498. Гибридизацию с сигнальным пептидом и пептидом, заякоренным в мембране, гликопротеина вируса бешенства (штамм ERA; Genbank n(M38452) проводили с помощью тройной ПЦР, используя праймеры OTG17875 (SEQ ID NO: 45), OTG17876 (SEQ ID NO: 46), OTG17877 (SEQ ID NO: 47), OTG17878 (SEQ ID NO: 48), OTG17879 (SEQ ID NO: 49) и OTG17880 (SEQ ID NO: 50). Полученный в результате фрагмент (SEQ ID NO: 33), кодирующий полипептид SS-18E2*-TMR, встраивали в плазмиду для переноса MVA ниже промотора pH5R с получением pTG17552. Наконец, кассету p7.5K-SS-E1deg*-TMF выделяли из pTG17521 и встраивали в pTG17552 с получением pTG 17582.
Получение рекомбинантных MVATG 17521, MVATG 17552 и MVATG 17582 осуществляли, как описано выше. После инфекции культивируемых клеток экспрессию полипептида HPV-18 E1 с конструкций MVA подтверждали с помощью Вестерн-блоттинга, используя сыворотки, полученные от иммунизированных кроликов.
Пример 7: Конструирование поливалентного рекомбинантного вектора MVA, экспрессирующего гены HPV-16 и HPV-18 Е1 и Е2 (MVATG17583)
Кассету p7.5K-SS-18E1deg*-TMF и кассету pH5R-SS-18E2*-TMR вводили в PTG17410 (содержащую кассеты p7.5K-SS-16E1deg*-TMR и pH5R-SS-16E2*-TMR) и полученную в результате плазмиду для переноса назвали pTG17583. Получение MVATG17583 осуществляли, как описано выше. После инфекции MVA TG17583 культивируемых клеток экспрессию полипептидов HPV-16 Е1, HPV-16 Е2 и HPV-18 Е1 подтверждали с помощью Вестерн-блоттинга, используя сыворотки, полученные от иммунизированных кроликов.
Пример 8: Конструирование рекомбинантного вектора MVA. экспрессирующего ген HPV-33 Е2
Синтетический ген, кодирующий полипептид HPV-33 Е2, был синтезирован фирмой Geneart (Regensburg, Germany). Синтетическая последовательность была сконструирована таким образом, чтобы (i) снизить процент гомологии менее чем до 75% с генами Е2 от HPV-16, HPV-18 и HPV-52 (если возможно, гомологичные участки уменьшают менее чем до 6 последовательных нуклеотидов) и (ii) ввести мутации, запрещающие ферментативные функции продукта гена HPV-33 (Е39А и I73A).
Затем последовательность HPV-33 degE2* гибридизовали с нуклеотидной последовательностью, кодирующей сигнальный пептид и пептид, заякоренный в мембране, гликопротеина вируса бешенства (штамм ERA, Genbank n(M38452). Это осуществляли путем тройной ПЦР, используя праймеры OTG18962 (SEQ ID N0: 51), OTG18963 (SEQ ID NO: 52), OTG18964 (SEQ ID NO: 53), OTG18965 (SEQ ID NO: 54), OTG18966 (SEQ ID NO: 55) и OTG18967 (SEQ ID NO: 56). Полученный в результате фрагмент (SEQ ID NO: 35), кодирующий полипептид SS-33degE2*-TMR, был клонирован в векторе MVA для переноса под контролем промотора р7.5К, и вирусные частицы были получены, как описано выше.
Пример 9: Конструирование рекомбинантного вектора MVA. экспрессирующего ген HPV-52 Е2
Синтетический ген, кодирующий полипептид HPV-52 Е2, был синтезирован фирмой Geneart (Regensburg, Germany). Синтетическая последовательность была сконструирована таким образом, чтобы (i) снизить процент гомологии менее чем до 75% с генами Е2 от HPV-16, HPV-18 и HPV-33 (если возможно, гомологичные участки уменьшают менее чем до 6 последовательных нуклеотидов) и (ii) ввести мутации, запрещающие ферментативные функции продукта гена HPV-52 (Е39А и I73A).
Затем синтетическую последовательность HPV-52 E2*deg гибридизовали с нуклеотидной последовательностью, кодирующей сигнальный пептид и пептид, заякоренный в мембране, белка F вируса кори (с получением SS-52E2*deg-TMF) путем тройной ПЦР, используя праймеры OTG 18968 (SEQ ID NO: 57), ОТ018969 (SEQ ID NO: 58), OTG18970 (SEQ ID NO: 59), OTG18971 (SEQ ID NO: 60), OTG18972 (SEQ ID NO: 61) и OTG18973 (SEQ ID NO: 62).
Полученный в результате фрагмент (SEQ ID NO: 37), кодирующий полипептид SS-52E2*deg-TMF, встраивали в плазмиду MVA для переноса ниже промотора р7.5К, и вирусные частицы были получены, как описано выше.
Пример 10: Конструирование поливалентного рекомбинантного вектора MVA. экспрессирующего ген Е2 HPV-16. HPV-18. HPV-33 и HPV-52
Кассету pH5R-SS-18E2*-TMR, кодирующую презентированный на мембране и ферментативно дефектный полипептид HPV-18 Е2 (выделенную из pTG17552), кассету p7.5K-SS-33degE2*-TMR, кодирующую презентированный на мембране и ферментативно дефектный полипептид HPV-33 Е2, и кассету p7.5K-SS-52degE2*-TMF, кодирующую презентированный на мембране и ферментативно дефектный полипептид HPV-52 Е2, вводили в pTG17408 (содержащую кассету pH5R-SS-16E2*-TMR), и вирусные частицы были получены, как описано выше.
Пример 11: Животная модель для оценки терапевтической эффективности рекомбинантных конструкций MVA
Модель CRPV является единственной лабораторной моделью, в которой папилломы, индуцированные вирусом, персистируют, несмотря на иммунокомпетентность, и развиваются при селективном давлении хозяина в инвазивные и метастатические плоскоклеточные карциномы (Brandsma, 1994, Intervirology 37, 189-190, и Brandsma, 1996, Animal models for human papillomavirus vaccine development, p.69-78. In C. Lacey (ed.), Papillomavirus reviews: current research on papillomaviruses. Leeds University Press, Leeds, United Kingdom). MVA, экспрессирующий Е2, можно протестировать в данной модели в целях оценки его терапевтической эффективности в отношении персистентного папилломавируса. Однако вследствие отсутствия перекрестной защиты между антигенами HPV и CRPV рекомбинантные CRPV-специфичные конструкции MVA были созданы с антигенами CRPV (раскрыты в Genbank под номером по каталогу NC_001541), заменяющими их двойники HPV-16. Более конкретно были сконструированы приведенные ниже рекомбинантные MVA: MVATG17535, содержащий вставку в делецию III экспрессионной кассеты, содержащей нуклеотидную последовательность, кодирующую полипептид CRPV Е2 (сравнительная последовательность), гибридизованную с сигнальным пептидом и заякоренным в мембране пептидом гликопротеина F вируса кори (SR-CRPVE2-TMF), помещенную под контролем промотора pH5R; MVATG17534, содержащий вставку в делецию III экспрессионной кассеты, содержащей нуклеотидную последовательность, кодирующую полипептид CRPV E1 (сравнительную последовательность), гибридизованную с сигнальным пептидом и заякоренным в мембране пептидом гликопротеина вируса бешенства (SR-CRPVE1-TMR), помещенную под контролем промотора р7.5К; и MVATG17562, содержащий вставку в делецию III экспрессионных кассет CRPV E2 (pH5R-SR-CRPVE2-TMF) и CRPV E1 (p7.5K.SR-CRPVE1-TMR).
Самок новозеландских белых кроликов заражали ДНК CRPV на сутки 1, используя опосредованный частицами перенос ДНК с помощью системы генной пушки Helios (Biorad). Частицы золота 1,6 мкм покрывали вирусной ДНК, как указано изготовителем, и доставляли в количестве 0,1 мкг на сайт в три сайта и 0,5 мкг на сайт в три других сайта на спине кролика. На сутки 2, 9 и 16 кандидат на рекомбинантный CRPV MVA инъецировали внутрикожным путем на спину кролика. Мониторинг развития папиллом проводили еженедельно в течение 8-12 недель.
В конце эксперимента кроликов умерщвляли и эпидермальные сайты, в которые была инъецирована ДНК CRPV и в которых отсутствовали папилломы, вырезали и замораживали. Экстрагировали ДНК и присутствие ДНК CRPV анализировали путем ПЦР анализа, чтобы определить, вызвала ли вакцинация MVA клиренс вируса.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЕКТОРЫ ДЛЯ МНОЖЕСТВЕННОЙ ГЕННОЙ ЭКСПРЕССИИ | 2008 |
|
RU2462513C2 |
| Мутантные полимеразы вируса гепатита В | 2012 |
|
RU2625021C2 |
| ГИБРИДИЗАЦИЯ ГЕТЕРООЛИГОМЕРНЫХ МИКОБАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 2015 |
|
RU2695462C2 |
| ОПТИМИЗИРОВАННАЯ ЭКСПРЕССИЯ HPV 58 L1 В ДРОЖЖАХ | 2004 |
|
RU2370538C2 |
| ЭКСПРЕССИРУЮЩИЙ ВЕКТОР (ВАРИАНТЫ) | 1995 |
|
RU2177999C2 |
| МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ, КОДИРУЮЩАЯ HPV31 L1, ЭКСПРЕССИРУЮЩИЙ ВЕКТОР, КЛЕТКА-ХОЗЯИН, ВИРУСОПОДОБНАЯ ЧАСТИЦА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ, ВАКЦИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБЫ С ИХ ИСПОЛЬЗОВАНИЕМ | 2004 |
|
RU2356943C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИИ ВИРУСОМ ГЕПАТИТА В | 2010 |
|
RU2555346C2 |
| ВАКЦИНЫ ПРОТИВ HPV | 2012 |
|
RU2644201C2 |
| ИММУНОГЕНЫ ДЛЯ ВАКЦИНАЦИИ ПРОТИВ ВИЧ | 2013 |
|
RU2648791C2 |
| ТЕЛОМЕРАЗНАЯ ОБРАТНАЯ ТРАНСКРИПТАЗА ПТИЦ | 2007 |
|
RU2415867C2 |

























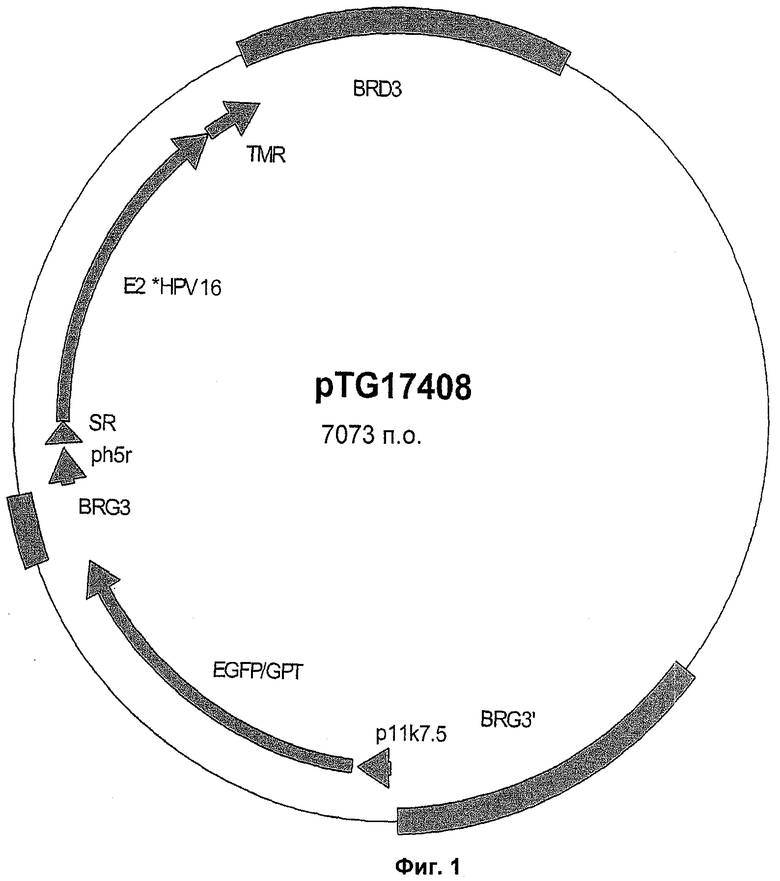
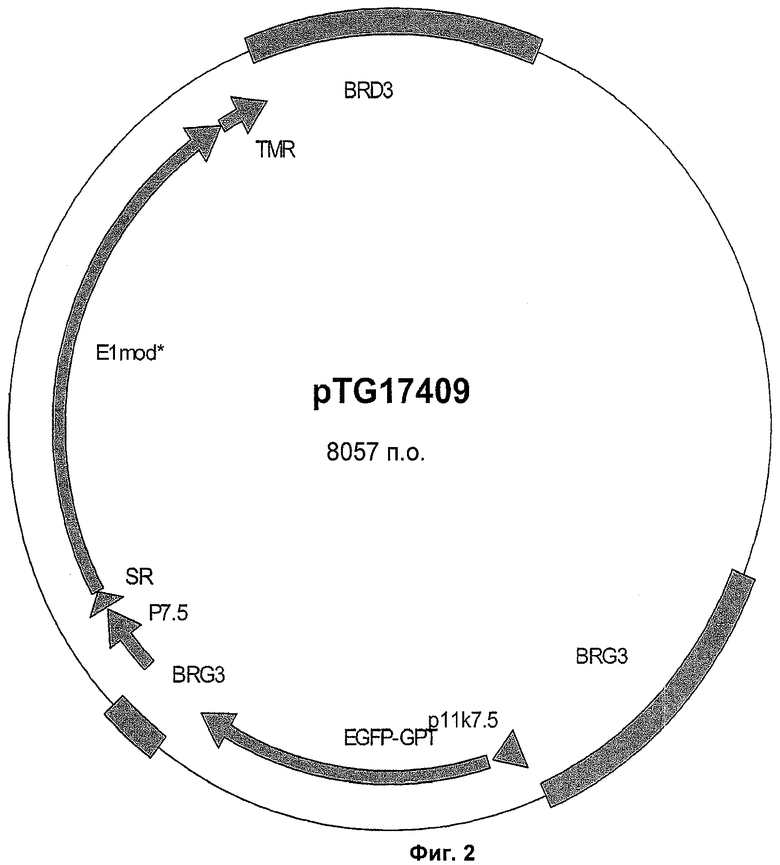
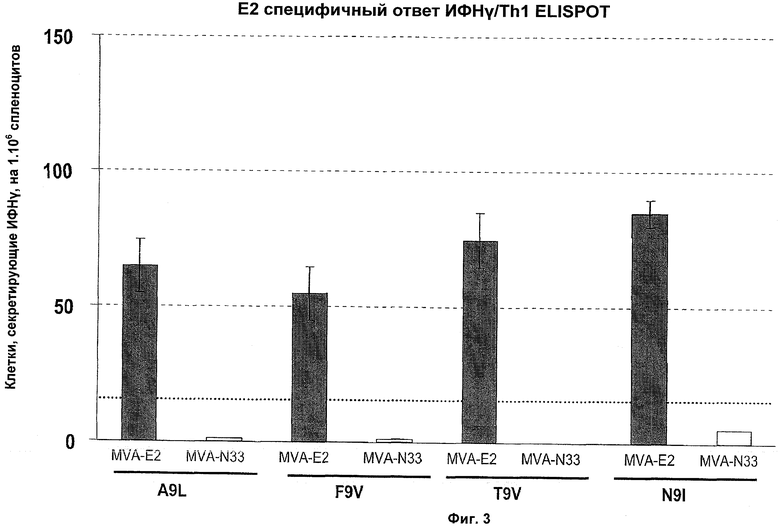
Изобретение относится к области биотехнологии и вирусологии. Раскрыт вектор экспрессии, содержащий молекулы нуклеиновой кислоты, кодирующий по меньшей мере два полипептида Е2 папиломавируса. При этом любые две Е2 кодирующие молекулы нуклеиновой кислоты имеют процент идентичности между собой менее чем 75% на любом участке из 40 или более непрерывных нуклеотидов. Также описаны инфекционная вирусная частица и композиция, содержащие такой вектор экспрессии, а также их применение. 6 н. и 28 з.п. ф-лы, 3 ил., 1 табл., 11 пр.
1. Вектор экспрессии, содержащий молекулы нуклеиновой кислоты, кодирующие по меньшей мере два полипептида Е2 папилломавируса, где любые две из указанных Е2-кодирующих молекул нуклеиновой кислоты имеют процент идентичности между собой менее чем 75% на любом участке из 40 или более непрерывных нуклеотидов.
2. Вектор экспрессии по п.1, где указанная Е2-кодирующая молекула(ы) нуклеиновой кислоты кодирует полипептид Е2, имеющий происхождение от HR-HPV, выбранный из группы, состоящей из HPV-16, HPV-18, HPV-30, HPV-31, HPV-33, HPV-35, HPV-39, HPV-45, HPV-51, HPV-52, HPV-56, HPV-58, HPV-59, HPV-66, HPV-68, HPV-70 и HPV-85, предпочтительно имеющий происхождение от HPV-16, HPV-18, HPV-33 или HPV-52, либо любой их комбинации.
3. Вектор экспрессии по п.1, где указанная молекула нуклеиновой кислоты модифицирована таким образом, что она кодирует полипептид Е2, дефектный по меньшей мере по репликационной активности и/или по активности транскрипционной активации.
4. Вектор экспрессии по п.3, где указанный полипептид Е2 имеет происхождение от HPV-16 и включает аминокислотную последовательность, представленную в SEQ ID NO: 1, за исключением того, что по меньшей мере остаток Glu в положении 39 (Е39) и/или остаток Ile в положении 73 (173) заменен любым аминокислотным остатком, иным, чем Glu и Ile, в соответствующих положениях 39 и 73, предпочтительно остатком Ala.
5. Вектор экспрессии по п.1, где указанная молекула нуклеиновой кислоты модифицирована таким образом, что она кодирует полипептид Е2, презентированный на мембране.
6. Вектор экспрессии по п.5, где указанный презентированный на мембране полипептид Е2 модифицирован путем гибридизации указанного полипептида Е2 папилломавируса с секреторной последовательностью и последовательностью заякоривания в мембране, причем указанная секреторная последовательность и/или последовательность заякоривания в мембране имеет происхождение от гликопротеина вируса бешенства, гликопротеина оболочки вируса ВИЧ или белка F вируса кори, либо является синтетической.
7. Вектор экспрессии по п.6, где указанная молекула нуклеиновой кислоты кодирует полипептид Е2, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2.
8. Вектор экспрессии по п.1, где указанный вектор содержит молекулы нуклеиновой кислоты, кодирующие по меньшей мере два полипептида Е2, имеющих происхождение от различных генотипов папилломавирусов.
9. Вектор экспрессии по п.1, где указанный вектор выбран из группы, состоящей из:
вектора экспрессии, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е2, и содержащего (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е2;
вектора экспрессии, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е2, и (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-33 Е2;
вектора экспрессии, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E2, и (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-52 E2;
вектора экспрессии, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-33 E2, и (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-52 E2;
вектора экспрессии, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E2, (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-33 E2; и (iv) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-52 E2;
вектора экспрессии, содержащего (i) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, (ii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е1, (iii) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E2, и (iv) молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е1;
вектора экспрессии, содержащего молекулы нуклеиновой кислоты, кодирующие полипептиды HPV-16 Е1, E2, Е6 и Е7 и HPV-18 Е1, E2, Е6 и Е7.
10. Вектор экспрессии по п.9, где указанный полипептид HPV-16 E2 включает аминокислотную последовательность, представленную в SEQ ID NO: 2; и/или указанный полипептид HPV-18 E2 включает аминокислотную последовательность, представленную в SEQ ID NO: 29; и/или указанный полипептид HPV-33 E2 включает аминокислотную последовательность, представленную в SEQ ID NO: 30; и/или указанный полипептид HPV-52 E2 включает аминокислотную последовательность, представленную в SEQ ID NO: 31.
11. Вектор экспрессии по п.9, где указанный полипентид HPV-16 E1 включает аминокислотную последовательность, представленную в SEQ ID NO: 3; и/или указанный полипептид HPV-18 E1 включает аминокислотную последовательность, представленную в SEQ ID NO: 32; и/или указанный полипептид HPV-16 Е6 включает аминокислотную последовательность, представленную в SEQ ID NO: 4; и/или указанный полипептид HPV-16 Е7 включает аминокислотную последовательность, представленную в SEQ ID NO: 5.
12. Вектор экспрессии по п.9, где указанная молекула нуклеиновой кислоты, кодирующая полипептид HPV-16 Е2, включает нуклеотидную последовательность, представленную в SEQ ID NO: 8, и/или указанная молекула нуклеиновой кислоты, кодирующая полипептид HPV-18 Е2, включает нуклеотидную последовательность, представленную в SEQ ID NO: 33; и/или указанная молекула нуклеиновой кислоты, кодирующая полипептид HPV-33 Е2, включает нуклеотидную последовательность, представленную в SEQ ID NO: 34 или SEQ ID NO: 35; и/или указанная молекула нуклеиновой кислоты, кодирующая полипептид HPV-52 Е2, включает нуклеотидную последовательность, представленную в SEQ ID NO: 36 или SEQ ID NO: 37; и/или указанная молекула нуклеиновой кислоты, кодирующая полипептид HPV-16 E1, включает нуклеотидную последовательность, представленную в SEQ ID NO: 7; и/или указанная молекула нуклеиновой кислоты, кодирующая полипептид HPV-18 E1, включает нуклеотидную последовательность, представленную в SEQ ID NO: 38.
13. Вектор экспрессии по п.1, где указанный вектор представляет собой вирусный вектор.
14. Вектор экспрессии по п.13, где указанный вирусный вектор представляет собой поксвирусный вектор, полученный из птичьего вируса (canarypox), вируса оспы кур (fowlpox) или вируса осповакцины (vaccinia), предпочтительно вирус осповакцины представляет собой копенгагенский штамм (Copenhagen strain), штамм Вайет (Wyeth strain), NYVAC или модифицированный штамм Анкара (MVA).
15. Вектор экспрессии по п.14, где указанный вирусный вектор (а) имеет происхождение от копенгагенского вируса осповакцины, и где указанная молекула нуклеиновой кислоты встроена в ген тимидинкиназы, или (б) имеет происхождение от вируса осповакцины MVA, и где указанная молекула нуклеиновой кислоты встроена в делецию III.
16. Вектор экспрессии по п.14, где указанная Е2- и/или Е7-кодирующая молекула нуклеиновой кислоты помещена под контролем промотора H5R вируса осповакцины, а Е1- и/или Е6-кодирующая молекула нуклеиновой кислоты под контролем промотора р7.5K.
17. Вектор экспрессии по любому из пп.1-16 для применения при (а) лечении персистентной папилломавирусной инфекции в организме животного или человека (б) индукции или активации иммунного ответа в организме животного или человека или (в) обеспечении антивирусного ответа в организме животного или человека.
18. Инфекционная вирусная частица для применения при (а) лечении персистентной папилломавирусной инфекции в организме животного или человека (б) индукции или активации иммунного ответа в организме животного или человека или (в) обеспечении антивирусного ответа в организме животного или человека, содержащая вектор экспрессии по любому из пп.13-16.
19. Композиция для (а) лечения персистентной папилломавирусной инфекции в организме животного или человека (б) индукции или активации иммунного ответа в организме животного или человека или (в) обеспечения антивирусного ответа в организме животного или человека, содержащая вектор экспрессии по любому из пп.1-16 или инфекционную вирусную частицу по п.18 или любую их комбинацию, предпочтительно приготовленную в форме, пригодной для инъекции, в частности, путем внутримышечного или подкожного введения.
20. Применение вектора экспрессии по любому из пп.1-16 для изготовления лекарства, предназначенного для лечения организма-хозяина, страдающего персистентной папилломавирусной инфекцией, вызванной по меньшей мере одним папилломавирусом, предпочтительно по меньшей мере одним HR-HPV.
21. Применение по п.20 для лечения организма-хозяина, страдающего инфекцией, вызванной по меньшей мере одним из HPV16, HPV31, HPV33, HPV35, HPV52 и HPV58, где указанный вектор содержит молекулу нуклеиновой кислоты, кодирущую полипептид Е2, имеющий происхождение от HPV-16.
22. Применение по п.20 для лечения организма-хозяина, страдающего инфекцией, вызванной по меньшей мере одним из HPV-18, HPV-39, HPV-45, HPV-51, HPV-56, HPV-59, HPV-68, HPV-70 и HPV-85, где указанный вектор содержит молекулу нуклеиновой кислоты, кодирующую полипептид Е2, имеющий происхождение от HPV-18.
23. Применение по п.20, где указанное применение включает первую серию введений, осуществляемых последовательно в интервале времени, варьирующем от нескольких суток до 4 недель, с последующей второй серией введений, осуществляемых в пределах от одного до 6 месяцев после последнего введения первой серии, причем предпочтительно первая серия введений включает три последовательных введения с недельным интервалом, а вторая серия включает одно введение в пределах 5 или 6 месяцев после первой серии.
24. Применение по п.20, где указанный вектор экспрессии применяют (а) для обеспечения антивирусного ответа против по меньшей мере одного из инфекционных папилломавирусов или (б) для индукции или активации иммунного ответа в организме животного или человека.
25. Применение инфекционной вирусной частицы по п.18 для изготовления лекарства, предназначенного для лечения организма-хозяина, страдающего персистентной папилломавирусной инфекцией, вызванной по меньшей мере одним папилломавирусом, предпочтительно по меньшей мере одним HR-HPV.
26. Применение по п.25 для лечения организма-хозяина, страдающего инфекцией, вызванной по меньшей мере одним из HPV16, HPV31, HPV33, HPV35, HPV52 и HPV58, где указанный вектор содержит молекулу нуклеиновой кислоты, кодирущую полипептид Е2, имеющий происхождение от HPV-16.
27. Применение по п.25 для лечения организма-хозяина, страдающего инфекцией, вызванной по меньшей мере одним из HPV-18, HPV-39, HPV-45, HPV-51, HPV-56, HPV-59, HPV-68, HPV-70 и HPV-85, где указанный вектор содержит молекулу нуклеиновой кислоты, кодирующую полипептид Е2, имеющий происхождение от HPV-18.
28. Применение по п.25, где указанное применение включает первую серию введений, осуществляемых последовательно в интервале времени, варьирующем от нескольких суток до 4 недель, с последующей второй серией введений, осуществляемых в пределах от одного до 6 месяцев после последнего введения первой серии, причем предпочтительно первая серия введений включает три последовательных введения с недельным интервалом, а вторая серия включает одно введение в пределах 5 или 6 месяцев после первой серии.
29. Применение по п.25, где указанную инфекционную вирусную частицу применяют (а) для обеспечения антивирусного ответа против по меньшей мере одного из инфекционных папилломавирусов или (б) для индукции или активации иммунного ответа в организме животного или человека.
30. Применение композиции по п.19 для изготовления лекарства, предназначенного для лечения организма-хозяина, страдающего персистентной папилломавирусной инфекцией, вызванной по меньшей мере одним папилломавирусом, предпочтительно по меньшей мере одним HR-HPV.
31. Применение по п.30 для лечения организма-хозяина, страдающего инфекцией, вызванной по меньшей мере одним из HPV16, HPV31, HPV33, HPV35, HPV52 и HPV58, где указанный вектор содержит молекулу нуклеиновой кислоты, кодирующую полипептид Е2, имеющий происхождение от HPV-16.
32. Применение по п.30 для лечения организма-хозяина, страдающего инфекцией, вызванной по меньшей мере одним из HPV-18, HPV-39, HPV-45, HPV-51, HPV-56, HPV-59, HPV-68, HPV-70 и HPV-85, где указанный вектор содержит молекулу нуклеиновой кислоты, кодирующую полипептид Е2, имеющий происхождение от HPV-18.
33. Применение по п.30, где указанное применение включает первую серию введений, осуществляемых последовательно в интервале времени, варьирующем от нескольких суток до 4 недель, с последующей второй серией введений, осуществляемых в пределах от одного до 6 месяцев после последнего введения первой серии, причем предпочтительно первая серия введений включает три последовательных введения с недельным интервалом, а вторая серия включает одно введение в пределах 5 или 6 месяцев после первой серии.
34. Применение по п.30, где указанную композицию применяют (а) для обеспечения антивирусного ответа против по меньшей мере одного из инфекционных папилломавирусов или (б) для индукции или активации иммунного ответа в организме животного или человека.
| US 2002028498 A1, 07.03.2007 | |||
| WO 2004031222 A2, 15.04.2004 | |||
| WO 2005060993 A1, 07.07.2005 | |||
| WO 9746693 A1, 11.12.1997 | |||
| WO 9216636 A1, 01.10.1992 | |||
| ПАПИЛЛОМАВИРУСНЫЕ ВАКЦИНЫ | 1995 |
|
RU2206608C2 |
Авторы
Даты
2013-05-20—Публикация
2008-01-29—Подача