Область техники, к которой относится изобретение
Настоящее изобретение относится к получению фармацевтических композиций, предназначенных для антифибринолитического лечения и лечения геморрагических осложнений, ассоциированных с гиперфибринолитическими состояниями или хирургическими процедурами.
Предпосылки создания изобретения
Система гемостаза обеспечивает поддержание текучести в кровотоке и предупреждение кровоизлияния (кровотечения) в ответ на сосудистый приступ (криз). Физиологический гемостаз контролируется механизмами, которые стимулируют коагуляцию и образование фибрина, и механизмами, которые способствуют его расщеплению или фибринолизу. Избыточная активация коагуляции или нарушение фибринолиза приводят к образованию сгустков, которые закупоривают кровеносные сосуды (внутрисосудистый тромбоз), вызывая ишемию и некроз. Однако в целом состояние гиперфибринолиза способствует началу кровотечений.
Гиперфибринолитические состояния, вызванные врожденными или приобретенными патологиями системы коагуляции-фибринолиза, обусловливают предрасположенность к имеющим важное значение геморрагическим осложнениям. Установлено, что такие состояния ассоциированы с тромболитическим лечением, а также с хирургической операцией на органах, для которых характерны высокие уровни активаторов плазминогена, таких как предстательная железа, матка и легкое. Диссеминированное внутрисосудистое свертывание крови (ДВС-синдром), вторичное состояние, сопровождающее многие медицинские и/или хирургические процедуры, также представляет собой прототип гиперфибринолитического состояния, ассоциированного с массивным кровоизлиянием в различные органы.
Антифибринолитики часто применяют в качестве фармакологических средств для лечения заболеваний, в основе которых лежит геморрагическая физиопатология, обусловленная аномальной коагуляцией или усилением фибринолиза, помимо осуществления трансфузий гемопроизводных, однако примерно в 30% случаев лечение оказывается безуспешным.
Антифибринолитическое лечение направлено на ингибирование расщепления фибрина. Наиболее распространенными средствами, применяемыми при клиническом лечении, являются синтетические аналоги лизина, такие как эпсилон-аминокапроевая кислота (ЕАСА) и транэксамовая кислота (АМСНА), которые конкурируют с плазминогеном за сайты связывания лизина, и апротинин, который получают из бычьего легкого и который представляет собой соединение, обладающее ингибирующей активностью в отношении широкого спектра протеаз.
Установлено, что эти соединения обладают эффективностью в различных клинических ситуациях, возникающих при медицинском (терапевтическом) и хирургическом вмешательстве, таких как внутричерепное кровоизлияние, хирургическая операция, связанная с повышенным риском кровоизлияния, и осложнения после тромболитического лечения.
В случае хирургического вмешательства антифибринолитические средства помимо их использования для уменьшения послеоперационного кровотечения можно применять в качестве альтернативы трансфузии крови и других гемопроизводных при хирургической операции на сердце, печени и ортопедической хирургии. Однако применение таких препаратов не является общепринятым, в частности, из-за того, что к настоящему времени проведено недостаточное количество исследований, демонстрирующих их эффективность, а также из-за того, что они могут повышать риск тромболитических осложнений (Mangano D.T. и др. The risk associated with aprotinin in cardiac surgery, N Engl J Med; 354, 2006, cc.353-365).
Например, при хирургической операции на печени, прежде всего при осуществлении трансплантации печени, применение антифибринолитических средств, таких как апротинин и АМСНА, позволяет снижать геморрагические осложнения, но может вызывать проблемы, связанные с тромболизисом (de Boer М.Т. и др. Minimizing blood loss in liver transplants: progress through research and evolution of techniques. Dig Surg; 22, 2005, сс.265-275).
В руководства для клинической практики не было включено также применение антифибринолитических средств при внутричерепном кровоизлиянии (You Н. и др. Hemostatic drug therapies for acute intracerebral haemorrhage. Cochrane Database Syst Rev 2006; CD 005951). В конкретном случае кровоизлияния в головной мозг, а именно первичного или вторичного кровоизлияния, связанного с тромболитическим лечением, единственное лечение, которое, по-видимому, оказывает некоторое благоприятное действие с точки зрения снижения смертности (29% среди пациентов, которым вводили плацебо, по сравнению с 18% среди пациентов, которым вводили фактор VIIa) и уменьшения неврологических осложнений, заключается в применении рекомбинантного фактора VIIa (Mayer S.A., Brun N.C. и др. «Recombinant Activated Factor VII Intracerebral Hemorrhage Trial Investigators. Recombinant activated factor VII for acute intracerebral hemorrhage»; N Engl J Med.; 352, 2005, cc.777-785).
Диссеминированное внутрисосудистое свертывание крови (ДВС) представляет собой другое клиническое состояние, характеризующееся массивным кровоизлиянием, при котором противопоказано применение современных антифибринолитических средств, поскольку они способствуют развитию генерализованного тромбоза (Paramo J.A., Coagulación intravascular diseminada. Med clin (Barc); 127, 2006, cc.785-789).
Осуществление тромболизиса с помощью tPA или активаторов плазминогена урокиназного типа является одним из предпочтительных методов лечения в случае острого сердечного приступа и ишемического приступа, но оно ассоциировано с высокой встречаемостью случаев массивного кровоизлияния, составляющей вплоть до 14%, и внутричерепного кровоизлияния, составляющей вплоть до 4%. Применение антифибринолитических средств типа ЕАСА или АМСНА в дополнение к лечению с использованием гемопроизводных показано в тех случаях, когда имеется избыточное кровоизлияние, хотя их применение может способствовать рецидиву тромбоза.
Избыточное кровотечение после удаления зуба представляет собой одно из наиболее распространенных осложнений у пациентов с врожденными коагулопатиями, такими как гемофилия А. В таких ситуациях местное применение антифибринолитических средств и антигеморрагических средств (например, транэксамовой кислоты, десмодепрессина и фактора VII) способствует сохранению сгустка и предупреждению кровотечения (Franchini М. и др. Dental procedures in adult patients with hereditary bleeding disorders: 10 years experience in three Italian Hemophila Centers. Haemophilia; 11, 2005, cc.504-509).
Антифибринолитические средства применяют в качестве средств терапии первой линии для женщин, которые страдают гиперменореей, ассоциированной с врожденными коагулопатиями, в сочетании с гормональной терапией (Demers С. и др. Gynaecological and obstetric management of women with inherited bleeding disorders. J Obstet Gynaecol; 27, 2005, cc.707-732).
Применение местной обработки с использованием фибриновых гелей оказалось эффективным в отношении предупреждения кровотечения, связанного с ранами, которые обусловлены хирургическим вмешательством, но оно до настоящего времени не утверждено для клинических целей (Gabay М. Absorbable hemostatic agents. Am J Health Syst Pharm.; 63, 2006, cc.1244-53).
Внутривенное введение или местное применение ингибиторов матриксных металлопротеиназ (ММР) позволяет быстрее восстанавливать гемостаз, уменьшая осложнения, связанные с местным кровотечением или ассоциированные с tPA (Lapchak P.A., Araujo D.M. Reducing bleeding complications after thrombolytic therapy for stroke: clinical potential of metalloproteinase inhibitors and spin trap agents. CNS Drugs.; 15, 2001, cc.819-29), способствуя сохранению сгустка, восстановлению и заживлению ран, обусловленных хирургическим вмешательством. Хотя оно рассматривается в качестве перспективного стратегического направления, большинство клинических опытов с использованием ингибиторов ММР оказались безуспешными; что было обусловлено либо применяемыми низкими дозами (соотношение эффективность:токсичность), либо обнаруженными побочными действиями (скелетно-мышечный синдром). По-видимому, необходимо выявить обладающие большей избирательностью ингибиторы, которые блокируют молекулярные механизмы, ассоциированные только с конкретным ММР, что позволяет избегать нежелательных явлений (Peterson J.T. The importance of estimating the therapeutic index in the development of matrix metalloproteinase inhibitors. Cardiovasc Res.; 69, 2006, cc.677-687).
В основу настоящего изобретения была положена задача разработать альтернативные терапевтические композиции, предназначенные для антифибринолитического лечения и для лечения геморрагических осложнений, которые ингибируют лизис фибриновых сгустков.
Краткое описание чертежей
На чертежах показано:
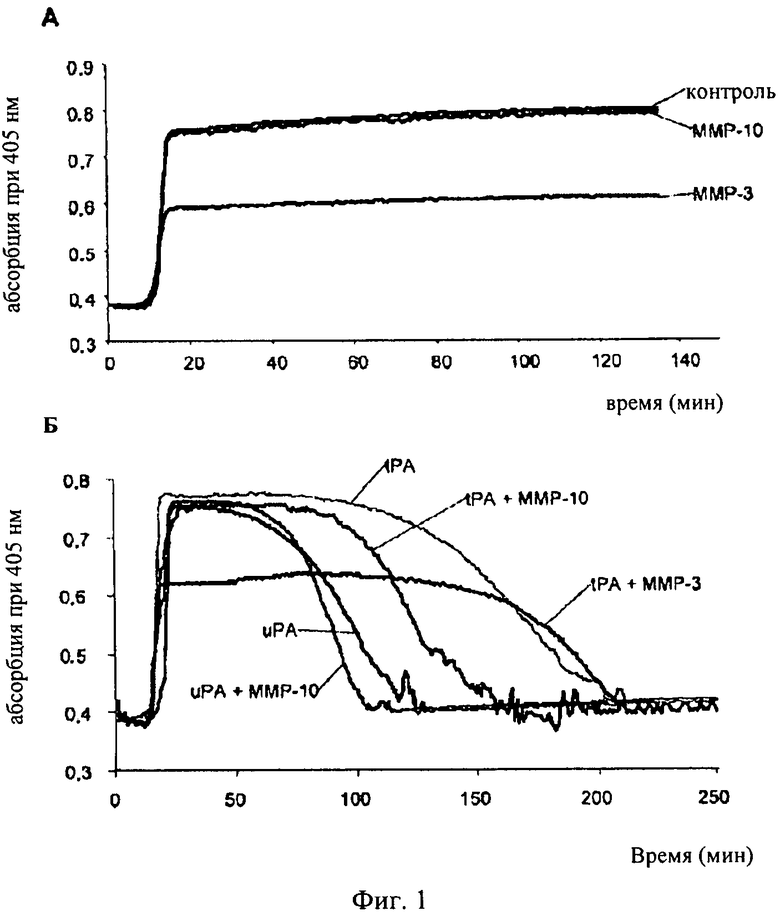
на фиг.1 - результаты турбидиметрического анализа рекальцифицированной плазмы, выраженные в виде зависимости величин абсорбции при 405 нм от продолжительности эксперимента (в минутах). А: График, иллюстрирующий различия в образовании сгустков (максимум абсорбции) только в одной плазме (контроль) или в присутствии ММР-10 (200 нМ) или ММР-3 (200 нМ); Б: График, иллюстрирующий образование и лизис фибринового сгустка в рекальцифицированной плазме в присутствии только активатора плазминогена tPA (30 ед./мл) или uРА (135 ед./мл) или в присутствии одного из них в комбинации с ММР-10 (200 нМ), а также в присутствии эквивалентной дозы ММР-3 (200 нМ) в комбинации с tPA (30 ед./мл);
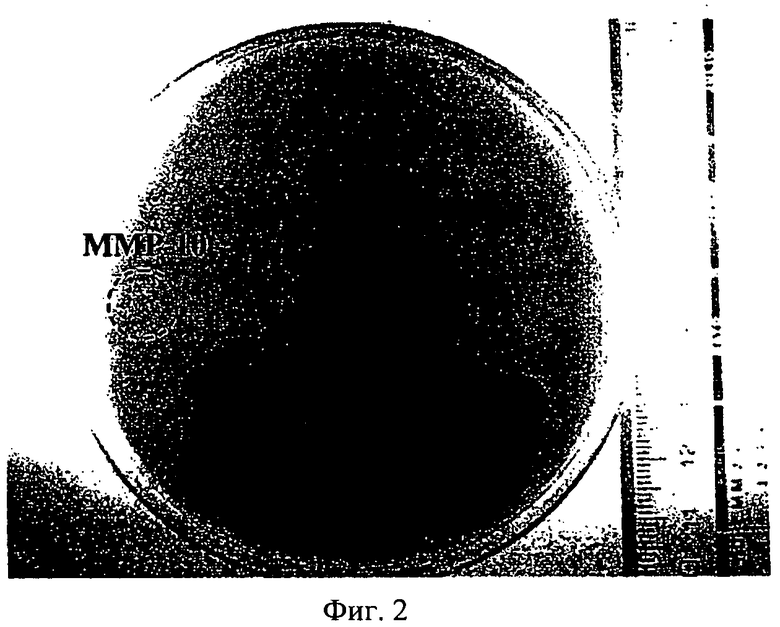
на фиг.2 - изображение полимеризованной фибриновой бляшки, на котором показаны области лизиса, вызванного tPA (1 ед./мл) и ММР-10 (200 нМ), при их применении индивидуально или в сочетании друг с другом;
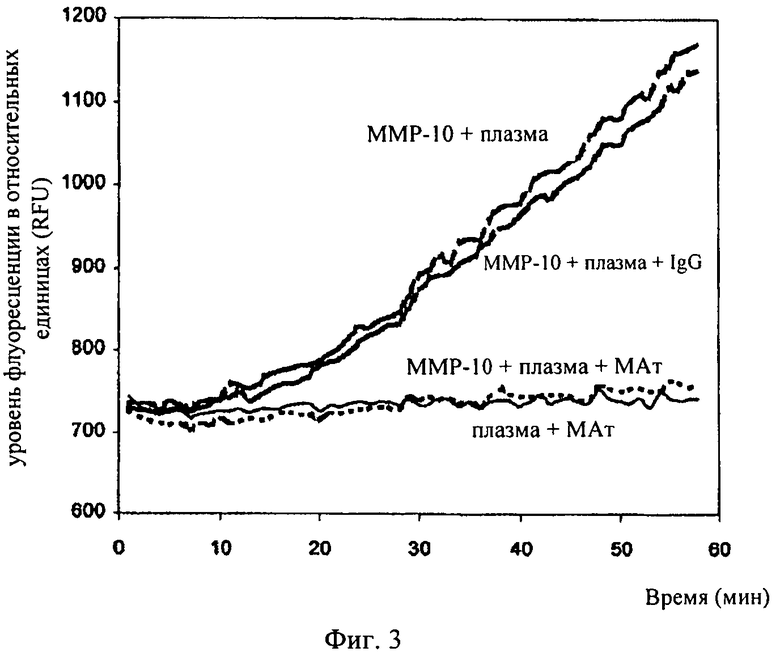
на фиг.3 - результаты анализа активности ММР-10 (100 нМ) в плазме с использованием флуоресцентного субстрата стромелизинов. Концентрацию моноклонального антитела (МАт), вызывающую ингибирование активности ММР-10 в плазме, определяли по уменьшению градиента образования субстрата. В качестве контроля применяли антитело изотипа IgG;
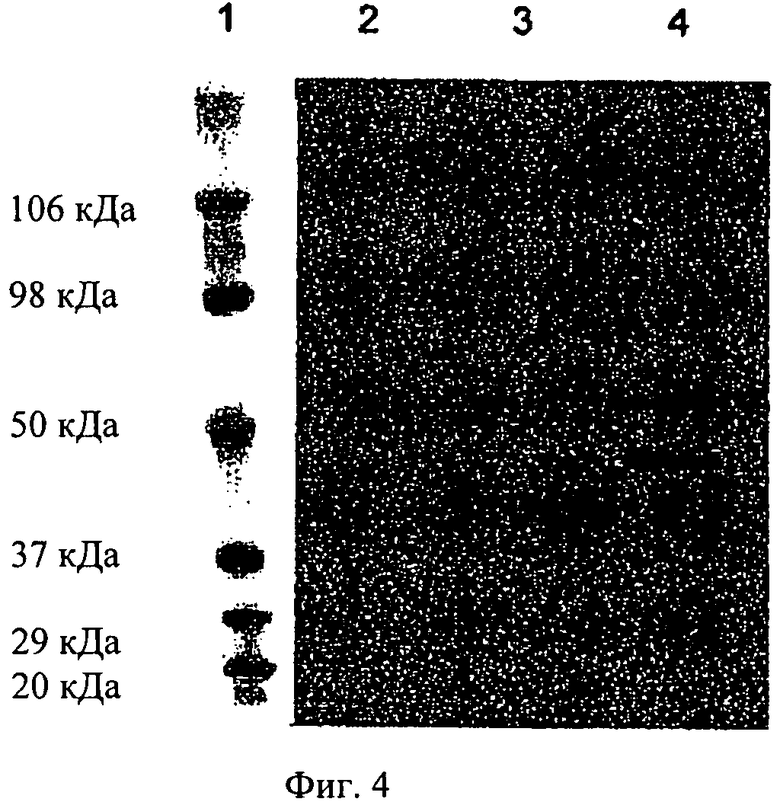
на фиг.4 - результаты анализа методом вестерн-блоттинга с использованием антитела, ингибирующего активность ММР-10. Представлены маркер молекулярной массы (полоса 1), ММР-1 (полоса 3), ММР-3 (полоса 3), ММР-10 (полоса 4). Антитело, являющееся ингибитором активности ММР-10, распознает только профермент (55 кДа) и активный фермент (45 кДа) ММР-10 и не обладает никакой перекрестной реактивностью с другими металлопротеиназами;
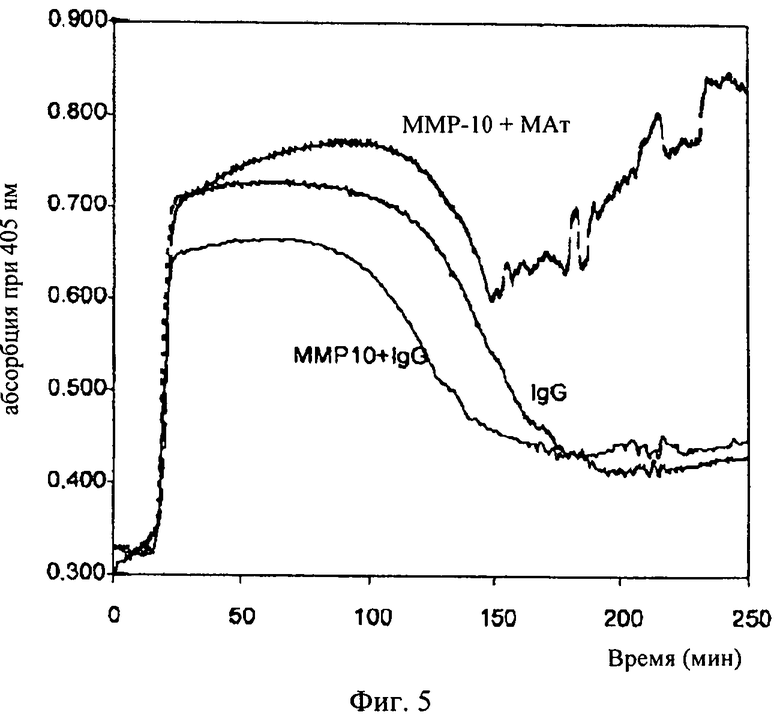
на фиг.5 - результаты турбидиметрического анализа плазмы, рекальцифицированной ММР-10 (200 нМ) в присутствии моноклонального антитела (МАт), ингибирующего активность ММР-10, или без него и в присутствии контрольного антитела изотипа IgG;
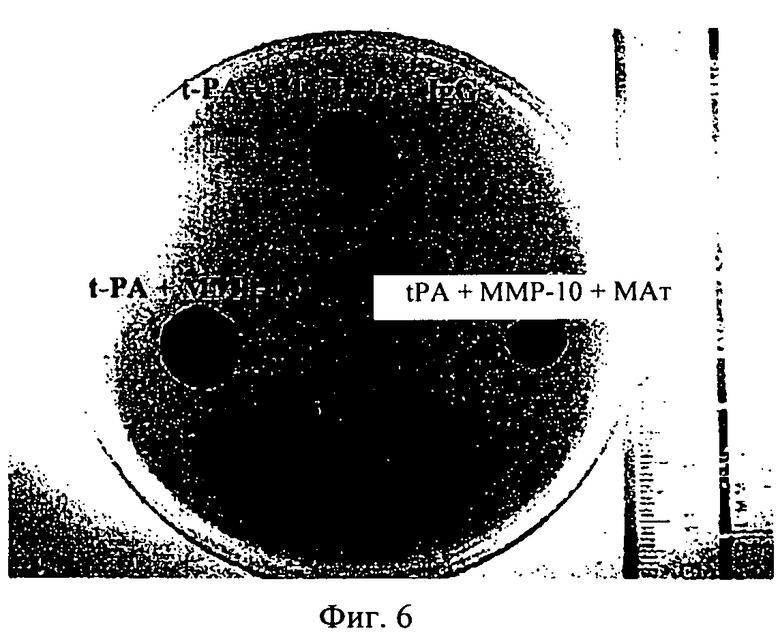
на фиг.6 - изображение фибриновой бляшки, на котором проиллюстрировано изменение области лизиса, вызванного tPA (1 ед./мл) и ММР-10 (200 нМ), в присутствии моноклонального антитела (МАт), ингибирующего активность ММР-10, или без него и в присутствии контрольного антитела изотипа IgG.
Подробное описание изобретения
Первый объект изобретения относится к применению антитела, которое нейтрализует матриксную металлопротеиназу-10 (ММР-10) в медицинском препарате, предназначенном для антифибринолитического лечения.
ММР-10 (код фермента КФ 3.4.24.22) обозначают также как матриксная металлопротеиназа, стромелизин-2 (STMY2), транзин-2 или протеогликаназа-2. У человека ген, кодирующий ММР-10, локализован на хромосоме 11 (11q22.3; Комитет по номенклатуре генов HUGO HGNC-ID: 7156; UniProtKB/Swiss-Prot регистрационный номер: Р09238).
Эта металлопротеиназа экспрессируется в различных типах клеток, таких как эндотелиальные клетки, моноциты и фибробласты. Известно, что она может активироваться плазмином, каликреином, триптазой, эластазой и катепсином G и может расщеплять широкий спектр внеклеточных матриксных субстратов, таких как агрекан, эластин, фибронектин, желатин, ламинин, тенасцин-С, витронектин и коллаген типов II, III, IV, IX, Х и XI. ММР-10 может активировать также другие матриксные металлопротеиназы, такие как проММР-1, -3, -7, -8 и -9 (Nakamura H. и др., Eur. J. Biochem.; 253, 1998, cc.67-75).
Известно также, что ММР-10 участвует в различных физиологических процессах, таких как рост кости и заживление ран. Установлено также, что имеет место ее сверхэкспрессия в роговице пациентов, страдающих диабетической ретинопатией, и она связана с некоторыми типами карцином, а также с лимфоидными опухолями. В различных исследованиях in vitro продемонстрировано, что факторы роста (эпидермальный фактор роста кератиноцитов или TGF-бета) и провоспалительные цитокины (TNF-альфа, IL-1-бета) могут индуцировать экспрессию ММР-10 в культурах кератиноцитов (Rechardt О. и др. J. Invest. DermatoL; 115, 2000, cc.778-787; Li de Q. и др., Invest. Ophthalmol. Vis. Sci.; 44, 2003, cc.2928-2936).
В научных работах, опубликованных до создания настоящего изобретения, описано также, что ММР-10:
- может служить в качестве биомаркера риска воспаления сосудов (Montero I. и др. J. Am. Col. Cardiol.; 47, 2006, cc.1369-1378; Orbe J. и др., J. Thromb. Haemost.; 5, 2007. cc.91-97);
- индуцируется в эндотелиальных клетках, формирующих капилляры в 3D-коллагеновых матриксах, и участвует в регрессе образования капилляров в результате активации ММР-1 (Saunders W.B. и др., J. Cell Sci.; 118, 2005, cc.2325-2340); и
- играет очень важную роль в поддержании внутриклеточных связей, сохраняющих целостность сосудов в процессах ремоделирования и ангиогенеза (Chang S. и др. Cell; 126, 2006, cc.321-334);
- участвует в заживлении ран, усилении миграции кератиноцитов и реорганизации ткани, имеющей место при протеолитическом расщеплении матриксных белков (Krampert М. и др. Mol Biol Cell, 2004 cc.5242-5254).
При создании настоящего изобретения изучали воздействие ММР-10 и ММР-3 на образование и лизис сгустков в человеческой плазме, а также на других моделях in vitro расщепления полимеризованного фибрина.
При создании изобретения удалось продемонстрировать, что ММР-10 не обладает непосредственной тромболитической активностью и не способна сама по себе ни изменять образование сгустка, ни расщеплять фибрин. Неожиданно было установлено также, что в присутствии активирующих тромболизис агентов, прежде всего активаторов плазминогена, ММР-10 способствует растворению фибриновых сгустков и уменьшает время лизиса. Таким образом, ММР-10 функционирует в качестве облегчающего процесс агента или адъюванта, способствующего тромболитическому действию других активаторов тромболизиса.
В отличие от этого, фибринолитическая матриксная металлопротеиназа, такая как ММР-3, обладающая непосредственной протеолитической активностью в отношении фибрина и фибриногена, не снижает время лизиса сгустка, осуществляемого самими активаторами тромболизиса.
Еще более неожиданно при создании изобретения было установлено, что добавление антител, специфических в отношении ММР-10, может ингибировать действие ММР-10, приводя к полной блокаде растворения сгустка даже в присутствии активаторов фибринолиза.
Вследствие этого применение ингибитора ММР-10, например, антитела, может иметь значительное преимущество в области терапии и хирургии с точки зрения контроля кровотечения, а также может служить альтернативой трансфузии крови в случае пациентов с избыточным кровотечением, обусловленным нарушением фибринолиза,
1. - благодаря ее способности уменьшать и блокировать лизис фибринового сгустка даже в присутствии активаторов плазминогена,
2. - благодаря тому, что молекула не изменяет образование фибринового сгустка.
Поскольку ММР-10 не является белком, действие которого обусловлено механизмом, не зависящим от системы гемостаза, то ей не присущи тромболитические осложнения, характерные для общепринятых антифибринолитических средств.
Кроме того, избирательная блокада ММР-10 не должна вызывать побочных действий, ассоциированных с неизбирательным ингибированием ММР, таких как скелетно-мышечный синдром, в котором участвуют другие ММР, такие как ММР-9 и ММР-14.
Нейтрализующее антитело к ММР-10
Во-первых, в контексте изобретения понятие «антитело» включает поликлональные антитела, моноклональные антитела, рекомбинантные антитела, химерные антитела, гуманизированные антитела и полностью человеческие антитела.
Поликлональные антитела представляют собой исходные гетерогенные смеси молекул антител, образовавшихся в сыворотке животных, иммунизированных антигеном. Они могут включать также моноспецифические поликлональные антитела, полученные из гетерогенных смесей, например, с помощью хроматографии на колонках с использованием пептидов одного эпитопа представляющего интерес антигена.
Моноклональное антитело представляет собой гомогенную популяцию антител, специфических в отношении одного эпитопа антигена. Такие моноклональные антитела можно получать общепринятыми методами, которые уже были описаны, например, у Köhler и Milstein (Nature; 256, 1975, cc.495-397) или Harlow и Lane (E.Harlow и D.Lane, «Using Antibodies. A Laboratory Manual», изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York; 1998 (ISBN 978-0879695439)).
Химерное антитело представляет собой моноклональное антитело, сконструированное путем клонирования или рекомбинации антител из различных видов животных. Типичная конфигурация химерного антитела, предлагаемого в изобретении (но, не ограничиваясь только ей), включает фрагмент моноклонального антитела, как правило, вариабельную область (Fv), которая содержит сайты распознавания и связывания с антигеном, и другой фрагмент, соответствующий человеческому антителу, как правило, фрагмент, который содержит константную область и смежные с константной областью участки.
Гуманизированное антитело представляет собой моноклональное антитело, сконструированное путем клонирования и трансплантации гипервариабельных определяющих комплементарность участков (CDR) мышиного моноклонального антитела в человеческое антитело, заменяя ими его собственный гипервариабельный CDR.
Полностью человеческое антитело представляет собой антитело или антитела, которое(ые) получают в организме трансгенных животных, несущих компоненты человеческой иммунной системы, или путем иммунизации in vitro человеческих иммунных клеток (включая как генетическую иммунизацию, так и традиционную, которую осуществляют с использованием адъювантов или без них, с использованием чистого или неочищенного препарата антигена; или с помощью любого метода, позволяющего приводить в контакт антиген с иммунной системой) или с использованием нативных/синтетических библиотек, полученных из человеческих иммунных клеток. Такие антитела можно получать и отбирать из организма трансгенных животных (например, мышей), в которых клонированы гены человеческих иммуноглобулинов и которые иммунизируют антигеном-мишенью. Такие антитела можно получать также путем отбора одноцепочечных вариабельных фрагментов (scFv) или путем связывания с человеческим антигеном (Fab-фрагменты), которые присутствуют в фаговых библиотеках (фаговый дисплей), и последующего клонирования и трансплантации в человеческое антитело, или с помощью любого другого метода получения и дисплея библиотек, которые создают путем клонирования вариабельных областей обеих цепей и последующей их комбинации/мутации с созданием библиотек антител.
Антитело или антитела, предлагаемое(ые) в изобретении, может(гут) относиться к любому классу или подклассу иммуноглобулинов, прежде всего, IgG, IgM, IgA, IgD и IgE.
В конкретном варианте осуществления изобретения антитела представляют собой полные антитела, которые включают все функциональные области, характерные для встречающегося в естественных условиях иммуноглобулина, прежде всего области, ответственные за распознавание и специфическое связывание с антигеном.
Во-вторых, понятие «антитело» включает также фрагмент антитела, полученный из белка или методом рекомбинации, который экспрессируется в прокариотах, дрожжах или эукариотах, является гликозилированным или дегликозилированным, и который может состоять из вариабельных областей антител, сцепленных друг с другом с помощью связывающего пептида (scFv), или вариабельных областей, примыкающих к константной области CHI тяжелой цепи (Fd), сцепленных с легкой цепью с помощью цистеинов или связывающих пептидов и дисульфидного мостика (scFab), или другие варианты, такие как только одни тяжелые цепи, или любые модификации, полученные на их основе с целью придания им большей специфичности, меньшей иммуногенности (гуманизация) или большей стабильности в биологических жидкостях, и которые обладают способностью ингибировать ММР-10 путем связывания с ее активным центром или любой другой областью белка, что приводит к снижению ее активности.
В контексте изобретения понятия «нейтрализующее» или «антагонистическое» антитело к ММР-10 относится к антителу, подпадающему под указанные выше понятия, которое обладает способностью распознавать и специфически связываться с ММР-10 с аффинностью, величина которой находится в наномолярном или пикомолярном диапазоне. Такое антитело обладает также способностью ингибировать или блокировать, полностью или частично, активность ММР-10. В частности, такое антитело обладает способностью ингибировать или блокировать действие ММР-10 в качестве средства, облегчающего растворение фибриновых сгустков, уменьшению времени лизиса (фибринолитическая активность). В конкретном варианте осуществления изобретения нейтрализующее антитело ингибирует адъювантное действие, которое оказывает ММР-10 на активаторы плазминогена (tPA, uPA и т.д.).
Получение нейтрализующих антител к ММР-10
Нейтрализующие антитела, предлагаемые в изобретении, можно получать общепринятыми методами, уже известными для получения антител. Можно применять (но, не ограничиваясь только ими) следующие методы: методы, основанные на иммунизации животных, включая трансгенных животных, несущих человеческие гены иммуноглобулина, получение моноклональных антител с использованием гибридом, получение с использованием библиотек антител, которые могут быть нативными, синтетическими или могут быть выведены из организмов, иммунизированных с использованием представляющего интерес антигена, и которые можно отбирать совершенно различными методами презентации или дисплея (фаговый дисплей, рибосомный дисплей и т.д.) и после этого с помощью методов генной инженерии можно реконструировать и экспрессировать в векторах, созданных с целью производства рекомбинантных антител различных размеров, составов и структур. Обзор основных методов получения и очистки антител можно найти в:
S.Dübel, «Handbook of Therapeutic Antibodies», изд-во Wiley-VCH, 2007, тома I-III (ISBN 978-3527314539);
«Antibodies: Volume 1: Production and Purification» под ред. G.Subramanian, изд-во Springer, 1-е изд., 2004 (ISBN 978-0306482458);
«Antibodies: том 2: Novel Technologies and Therapeutic Use», под ред. G.Subramanian, изд-во Springer, 1-е изд., 2004 (ISBN 978-0306483158);
«Molecular Cloning: a Laboratory manual», под ред. J.Sambrook и D.W.Russel, изд-во Cold Spring Harbour Laboratory Press, 3-е изд., 2001 (ISBN 978-0879695774).
В конкретном не ограничивающем объем изобретения варианте осуществления изобретения способ создания и продуцирования нейтрализующего моноклонального антитела к ММР-10 может заключаться в том, что осуществляют следующие стадии:
1. - иммунизируют мышей раствором ММР-10 или иммуногенного фрагмента ММР-10, или плазмидой, содержащей ММР-10 или его производные;
2. - отбирают животных, у которых выявлен поликлональный ответ на антиген с помощью вестерн-блоттинга, ELISA или иммуногистохимии;
3. - осуществляют слияние клеток селезенки животных с клетками миеломы (SP2/O-Ag14; P3X63-Ag8.6.5.3; P3-NS-l-Ag4-1; и т.д.), создавая гибриды различных типов клеток, и отбирают те гибриды лимфоцитов В животных и клеток миеломы, которые продуцируют антитело и являются иммортализованными в культуре с ГАТ-средой (гипоксантин, аминоптерин и тимидин).
4. - отбирают гибридомы, секретирующие представляющие интерес антитела, иными словами, антитела, которые ингибируют активность ММР-10. Для этой цели отбирают образцы супернатанта во всех лунках, содержащих гибридомы, и подвергают их иммуноанализу: осуществляют анализы методом ELISA с использованием планшетов, сенсибилизированных ММР-10, взятой в нанограммовых или микрограммовых количествах; после инкубации в течение 15 ч при 4°С и блокирования с использованием пригодного белка, добавляют супернатанты культуры, лунки отмывают и затем добавляют вторичное мышиное антитело к иммуноглобулину. После отмывки и проявления с использованием ферментативной реакции выявляют лунки, в которых обнаружено окрашивание или в которых обнаружен повышенный уровень абсорбции, указанные лунки могут содержать клоны гибридом, которые секретируют антитела к ММР-10.
5. - отбирают гибридомы, которые обладают способностью ингибировать активность ММР-10, осуществляя анализ с использованием флуорогенного субстрата. Для этой цели применяют микропланшет, сенсибилизированный взятым в различных концентрациях антителом к ММР-10 (фирма R&D systems, Clon 110343), и флуорогенный субстрат стромелизинов (MCA-Arg-Pro-Lys-Pro-Val-Glu-Nval-Trp-Arg-Lys-[DNP]-NH2) (фирма R&D systems; ES002, Абингдон, Великобритания). Измеряют флуоресценцию (при длине волны возбуждения 320 нм и длине волны испускания 405 нм) с помощью спектрофлуориметра (тип SpectraMAX GeminiXS, фирма Molecular Devices, шт.Калифорния, США) в течение 2 ч, регистрируя данные через каждые 5 мин. Отбирают гибриды, которые снижают активность ММР-10 при постоянной концентрации активной ММР-10 по меньшей мере на 50% (IC50) при их применении в наименьшей концентрации и после предварительной инкубации с белком в течение 30 мин при 37°С.
Выращивают продуцирующие антитела клетки, взятые из лунки, из которой был отобран супернатант, и замораживают в жидком азоте.
6. - проверяют, что каждая культура клеток, секретирующих антитело к ММР-10, является моноклональной. Применяют методы клонирования или лимитирующего разведения и выращивают выделенные клетки в новых культуральных микропланшетах, начиная с исходной культуры или штамма клеток, для которых были получены положительные результаты в первом анализе методом ELISA и анализе активности. После того как новые колонии, образующиеся из одной или нескольких клеток, достигают достаточного размера, отбирают новые образцы их супернатантов и вновь подвергают анализу методом ELISA и анализу активности. Повторяют процесс до тех пор, пока 100% проанализированных супернатантов не будут содержать антитела, обладающие способностью ингибировать активность ММР-10.
7. - очищают антитела из супернатантов с помощью жидкостной хроматографии (высокоаффинная, аффинная, катионообменная хроматография, хроматография на гидроксиапатите, гидрофобная хроматография, гель-фильтрация и т.д.) с использованием оборудования типа АКТА FPLC, фирмы GE Healthcare Bio-Science.
8. - и, наконец, осуществляют анализ чистоты, специфичности, аффинности и фибринолитической активности отобранных антител.
Чистоту антитела можно определять, например, с помощью гель-электрофореза в полиакриламидном геле (ДСН-ПААГ) с использованием окрашивания кумасси бриллиантовым голубым для выявления присутствия одной полосы.
Специфичность антитела можно оценивать путем проведения анализа методом вестерн-блоттинга с использованием других металлопротеаз (прежде всего ММР-3, которая обладает наибольшей гомологией с ней), взятых в нанограммовом-микрограммовом диапазоне концентраций, и выявления хемилюминисценции.
Константу аффинности антитела можно рассчитывать на основе константы диссоциации (Kd), которую определяют как градиент зависимости величин абсорбции, измеренных на планшете для ELISA, сенсибилизированном ММР-10, от возрастающих концентраций антитела.
Нейтрализующую способность указанного антитела в отношении фибринолитической активности можно анализировать методом турбидиметрического анализа образования и лизиса фибриновых сгустков и анализа полимеризованного фибрина, например, с помощью методов, описанных в примерах 1 и 2.
Кроме того, нуклеиновая кислота, кодирующая нейтрализующее антитело к ММР-10, может служить в качестве промежуточного продукта для получения химерного или гуманизированного антитела, которое также обладает способностью нейтрализовать ММР-10.
Следует понимать, что метод получения нейтрализующего антитела к ММР-10 не имеет решающего значения и, следовательно, специалист в данной области легко может получать антитела, предлагаемые в изобретении, с помощью любого общепринятого метода, пригодного для получения антител.
Терапевтические показания для антифибринолитического лечения
В целом, нейтрализующее антитело к ММР-10 (или содержащее его лекарственное средство) применяют для антифибринолитического лечения.
В конкретном варианте осуществления изобретения антитело, предлагаемое в изобретении, применяют для лечения, предупреждения или терапии кровоизлияний или геморрагических осложнений.
В определенных случаях подлежащие лечению геморрагические осложнения могут встречаться у пациентов с гиперфибринолитическими состояниями и нарушениями коагуляции, которые могут быть обусловлены врожденными патологиями (гемофилия А, болезнь Виллебранда, дефицит PAI-1 или альфа-2-антиплазмина) или могут представлять собой приобретенные осложнения, например, после лечения с применением антикоагулянтов, или у пациентов с диссеминированным внутрисосудистым свертыванием крови (DIC), пациентов, подвергавшихся хирургическому вмешательству или имеющих опухоли тканей или органов, богатых активаторами фибринолиза, или в ситуациях, когда нарушена очистка от активаторов плазминогена, например, в случае серьезного заболевания печени или острого промиелоцитного лейкоза, ассоциированного с DIC.
Осложнения, связанные с избыточным кровотечением, включают среди прочего менструальное кровотечение (гиперменорея), желудочно-кишечное кровотечение, кровотечение из мочевого пузыря, зубное кровотечение и прежде всего кровотечение у пациентов с нарушениями коагуляции, вызванными некоторыми из указанных выше причин (гемофилия А, болезнь Виллебранда, лечение антикоагулянтами, DIC и т.д.).
В других случаях подлежащие лечению кровотечение и геморрагические осложнения могут возникать при хирургических процедурах (при хирургических операциях в целом, включая трансплантации и осуществление биопсии), прежде всего при хирургических операциях на органах, богатых активаторами плазминогена (предстательная железа, легкое, матка), и при хирургических операциях на пациентах, имеющих гиперфибринолитические состояния или нарушения коагуляции, как уже указано выше. В этих случаях цель заключается в уменьшении кровотечения, обусловленного хирургическим вмешательством, путем обработки (до, в процессе и/или после хирургического вмешательства) лекарственным средством, содержащим нейтрализующее антитело к ММР-10.
Антитела к ММР-10 можно применять также местно для восстановления сосудистых коммуникаций после осуществления трансплантации сосудов, в частности можно применять ингибитор в составе препаративной формы в виде фибринового геля для предупреждения кровотечения, обусловленного раной при хирургическом вмешательстве.
В контексте изобретения понятие «лечение» включает введение лекарственного средства, содержащего нейтрализующее антитело к ММР-10, для предупреждения или уменьшения возникновения симптомов, осложнений или биохимических показателей гиперфибринолитического состояния, и более конкретно для предупреждения ожидаемого возникновения геморрагических явлений. Лечение может представлять собой профилактическое лечение для предупреждения проявления клинических или субклинических симптомов. Оно может представлять собой также терапевтическое лечение для подавления или ослабления симптомов после их возникновения и при необходимости оно может служить альтернативой трансфузии крови.
Фармацевтическая композиция
Согласно изобретению нейтрализующие антитела применяют для приготовления фармацевтической композиции, служащей в качестве лекарственного средства для антифибринолитического лечения.
Указанная фармацевтическая композиция содержит по меньшей мере нейтрализующее антитело к ММР-10 в фармацевтически приемлемом наполнителе.
Антитело или фармацевтическую композицию, предлагаемое/предлагаемую в изобретении, применяют прежде всего путем парентерального введения, например подкожного, внутримышечного или внутривенного введения.
В конкретном (но не ограничивающим объем изобретения) варианте осуществления изобретения фармацевтическая композиция содержит раствор нейтрализующего антитела или нейтрализующих антител к ММР-10 в приемлемом наполнителе, например в водном наполнителе, таком как вода, забуференный водный раствор, соляной раствор, глицин или другие аналогичные наполнители. Такие растворы должны быть стерильными и, как правило, не должны содержать частиц. Фармацевтическая композиция может содержать дополнительно другие ингредиенты, такие как средства для регулирования значения рН, консерванты и т.д.
В другом варианте осуществления изобретения фармацевтическая композиция может быть пригодна для местного применения, находиться в форме геля или пасты или даже в форме годной для питья жидкости для полоскания рта, находящейся в ампуле, которую применяют в случае кровотечения, возникающего после удаления зуба.
Обзор различных композиций и фармацевтических форм, предназначенных для введения лекарственного средства, и эксципиентов, необходимых для их получения, можно найти, например, в: «Tecnología farmacéutica», под ред. J.L.Vila Jato, тома I и II, 1997, изд-во Síntesis, Madrid; или в «Handbook of pharmaceutical manufacturing formulations», под ред. S.K.Niazi, тома I-VI, 2004, изд-во CRC Press, Boca Raton.
Количество действующего вещества (антител), которое можно объединять с наполнителем для приготовления содержащей однократную дозу формы, как правило, должно представлять собой количество, обладающее терапевтическим действием. Приготовление парентеральной фармацевтической композиции в виде стандартных форм лекарственного средства облегчает введение и однородность дозы, что является очень ценным. Специалист в данной области может приготавливать такие стандартные формы лекарственного средства с помощью общепринятых методов с учетом конкретного терапевтического действия, которое требуется достичь, и конкретного терапевтического показания.
Эффективная доза фармацевтической композиции, предлагаемой в изобретении, должна зависеть от многих факторов, включая методы и пути введения, мишень действия, физиологическое состояние пациента, другие вводимые лекарственные средства, от того, какое требуется лечение, профилактическое или терапевтическое. Однако в конкретном варианте осуществления изобретения предназначенная для введения стандартная доза лекарственного средства, содержащая нейтрализующее антитело, предлагаемое в изобретении, может составлять от 1,0 до 10,0 мг/кг. Как правило, схема введения лекарственного средства предусматривает повторное введение композиции, содержащей антитела, предлагаемые в изобретении, с интервалами между введениями, равными одним суткам, неделе, месяцу, двум месяцам или любому промежутку времени, который устанавливает фармаколог с учетом потребностей пациента (конкретного показания, серьезности и т.д.) и общепринятых стандартных фармакологических протоколов.
Примеры вариантов осуществления изобретения
Ниже описаны примеры, в которых продемонстрированы воздействия на фибринолитическую и тромболитическую активность матриксных металлопротеиназ ММР-10 и ММР-3 либо непосредственно, либо в комбинации с другими активаторами плазминогена: урокиназой (uРА) и тканевым активатором плазминогена (tPA).
В примерах использовали следующие продукты:
- рекомбинантную ММР-10, которую получали в виде профермента с молекулярной массой 58 кДа, содержащего 20-30% зрелого фермента с молекулярной массой 48 кДа (фирма R&D Systems, 910-MP, Абингдон, Великобритания), и которую восстанавливали с помощью TCNB-буфера (50 мМ Трис-HCl, рН 7,5, 10 мМ СаСl2, 150 мМ NaCl, 0,05% Brij35).
- рекомбинантную ММР-3, которую получали в виде профермента с молекулярной массой 52 кДа (фирма R&D Systems, 513-MP, Абингдон, Великобритания), поставляемого в растворе, который содержит 12,5 мМ Трис, 5 мМ CaCl2, 0,025% Brij35 и 50% глицерина.
- урокиназу (uРА) (фирма Vedim Pharma SA; 628602, Барселона, Испания).
- рекомбинантный тканевый активатор плазминогена (tPA) (фирма Boerhinger Ingelheim; 985937 Actilyse®, Ингельхайм, Германия).
Для оценки тромболитической активности применяли турбидиметрический метод, позволяющий осуществлять мониторинг образования и лизиса фибринового сгустка в образцах плазмы, согласно протоколу, описанному ранее von Borne с соавторами (Blood; 86, 1995, cc.3035-3042).
Для оценки активности в отношении лизиса фибрина применяли также анализ фибриновых бляшек согласно процедуре, описанной Edward (J. Clin. Path.; 25, 1972, cc.335-337).
Пример 1: Воздействие ММР-10 и ММР-3 на образование и лизис сгустков
Как указано выше, воздействие ММР-10 и ММР-3 на систему гемостаза оценивали согласно процедуре, описанной Borne с соавторами. С помощью этого метода оценивали изменения мутности/абсорбции, служащие в качестве индикатора образования и лизиса сгустков, которые происходят с течением времени при обоих процессах. Измерение мутности осуществляли на основе регистрации абсорбции при длине волны 405 нм в процессе фаз образования и лизиса сгустков, с использованием фотометрического ридера, в рассматриваемом случае ридера для ELISA (типа Fluostar Optima, фирма BMG Labtech). Повышение мутности/абсорбции свидетельствует об образовании фибринового сгустка, в то время как уменьшение указанного параметра свидетельствует о лизисе сгустка.
Для образования сгустка в лунке микропланшета смешивали 75 мкл цитрированной плазмы, 75 мкл буфера HEPES (25 мМ HEPES, 137 мМ NaCl, 3,5 мМ КСl, 6 мМ CaCl2, 1,2 мМ MgCl2 и 0,1% БСА, рН 7,5) и 10 мкл 150 мМ CaCl2. Планшет инкубировали при 37°С и измеряли абсорбцию при длине волны 405 нм в течение 2 ч, регистрируя данные через каждые 30 с.
Для изучения воздействия ММР-10 на образование сгустка добавляли активированную ММР-10 (50, 100 и 200 нМ) к исходной смеси плазмы и буфера HEPES. Перед применением в экспериментах ММР-10 активировали путем тепловой обработки при 37°С в течение 1 ч.
В параллельных опытах проводили также анализ воздействия ММР-3 (200 нМ) на образование сгустков. В этом случае сначала осуществляли активацию ММР-3 с помощью 1 мМ пара-аминофенилртутьацетата (АРМА, 164610, фирма MD Biosciences, Ла-Джолла, США) при 37°С в течение 24 ч.
Как можно видеть на фиг.1А, ММР-10 не индуцировала изменений ни скорости образования сгустков, ни максимальной достигаемой мутности при всех исследованных дозах (таблица 1). Однако ММР-3 индуцировала снижение на 50% максимальной абсорбции/мутности образовавшегося сгустка, что, по-видимому, обусловлено ее непосредственным протеолитическим воздействием на фибриноген.
Эти результаты свидетельствуют о том, что ММР-10 в отличие от результатов, описанных для ММР-3, не изменяет скорость образования сгустка, поскольку она не обладает никакой активностью в отношении фибриногена.
После этого проводили изучение скорости лизиса фибринового сгустка. Как и в опыте, описанном в предыдущем разделе, применяли рекальцифицированную плазму в буфере HEPES, к которой в момент начала турбидиметрических измерений добавляли ММР-10 (или ММР-3) одновременно с активатором плазминогена, который представлял собой либо тканевый активатор плазминогена (tPA) (30 ед./мл), либо урокиназу (uРА) (135 ед./мл).
Применявшиеся в экспериментах концентрации tPA и uРА были определены в проведенных ранее опытах по изучению дозовой зависимости, в которых выбирали дозу, которая вызывала полный лизис фибринового сгустка в течение периода времени, составлявшего 2 ч.
Как можно видеть из результатов, представленных на фиг.1Б и в таблице 1, ММР-10 в отсутствие tPA и uРА не вызывала лизис фибринового сгустка, в то время как в присутствии любого из двух активаторов, tPA или uРА, она индуцировала существенное увеличение скорости лизиса фибринового сгустка. При применении ММР-10 в максимальной из протестированных доз (200 нМ) уменьшение времени лизиса (время, в течение которого половина сгустка подвергается лизису) составляло 15 мин (52,9 мин по сравнению с 68,3 мин, р<0,01) в присутствии tPA и 5 мин в присутствии uРА (42 мин по сравнению с 47,5 мин, р<0,05). Такое уменьшение времени лизиса соответствует 20% уменьшению в присутствии tPA и 10% уменьшению в присутствии uРА.
В отличие от этого ММР-3 не изменяла скорость лизиса сгустка в присутствии tPA.
Эти результаты свидетельствуют о том, что ММР-10 в отличие от ММР-3 не обладает способностью расщеплять фибрин, но повышает фибринолитическое действие плазминогена и активаторов фибринолиза (tPA и uРА). Поскольку ММР-10 не обладает способностью воздействовать на эндогенный фибринолиз, то она должна предупреждать или ослаблять начинающееся кровотечение, что делает ее перспективным кандидатом с точки зрения применения в качестве коадъюванта в тромболитической терапии.
Пример 2: Воздействие ММР-10 на расщепление фибрина
Воздействие на лизис фибрина изучали согласно описанной выше процедуре Эдварда (Edward) путем оценки гало или области лизиса, имеющего места на полимеризованной фибриновой бляшке.
Фибриновые бляшки создавали, используя раствор, содержащий человеческий фибриноген в концентрации 6 мг/мл (фирма Sigma, F3879, Сент-Луис, шт.Миссури, США) в верональном буфере (фирма Bio Whittaker, 12-624E, Кэмбрекс, шт.Мэриленд, США) при 37°С, который фильтровали и к которому добавляли равный объем 50 мМ CaCl2. Полученный раствор (6 мл) смешивали с 1 международной единицей (NIH-единицы) тромбина (фирма Enzyme Research Lab; HT1200a, Сванзеа, Великобритания) и давали полимеризоваться в течение 6 ч.
Для оценки фибринолитической способности на различные фибриновые бляшки наносили tPA (1 ед./мл), ММР-10 (200 нМ) или комбинацию обоих средств.
Как видно из результатов, представленных на фиг.2, ММР-10 при ее применении индивидуально не вызывала лизис полимеризованного фибрина, в то время как tPA приводил к образованию заметного гало. Однако комбинация tPA с ММР-10 существенно увеличивала область лизиса полимеризованного фибрина (188,6%), этот факт подтверждает то, что МРР-10 облегчает фибринолиз при ее применении в сочетании с активаторами плазминогена, которые являются фибринолитическими средствами.
Пример 3: Ингибирование фибринолиза и лизиса сгустка, индуцируемого tPA, с помощью антител к ММР-10
Принимая во внимание результаты, полученные в примерах 1 и 2, проводили анализ специфичности воздействия ММР-10 на лизис фибрина в сгустке, индуцированный tPA, добавляя в различных дозах активную ММР-10 одновременно с взятым в соотношении 1:2 моноклональным антителом, блокирующим его активность (фирма R&D Systems, MAB9101, Абингтон, Великобритания), или без него, или мышиный IgG2B в качестве контроля изотипа (фирма Bioscience, 16-4732, Сан-Диего, шт.Калифорния, США) в такой же концентрации.
Соотношение фермент:антитело, которое обеспечивает блокаду ферментативной активности, было определено ранее в опыте по оценке активности ММР-10 в микропланшете, сенсибилизированном антителом к ММР-10 (фирма R&D systems, Clon110343), с использованием флуорогенного субстрата стромелизина (MCA-Arg-Pro-Lys-Pro-Val-Glu-Nval-Trp-Arg-Lys-[DNP]-NH2) (фирма R&D systems; ES002, Абингтон, Великобритания) (Lombard и др.; Biochimie; 87, 2005, cc.265-272]. На основе измерений флуоресценции (длина волны возбуждения 320 нм и длина волны испускания 405 нм) с помощью спектрофлуориметра (типа SpectraMAX GeminiXS, фирма Molecular Devices, шт.Калифорния, США) в течение 1 ч было установлено, что соотношение 1:2 обеспечивает полное ингибирование взятого в соответствующей концентрации активного фермента (фиг.3).
Специфичность антитела изучали методом вестерн-блоттинга для того, чтобы исключить возможность наличия перекрестной реакции с другими металлопротеазами (фиг.4). Антитело, являющееся ингибитором ММР-10, распознает только указанную металлопротеазу, т.е. оказывает специфическое ингибирующее воздействие на нее, несмотря на ее высокую степень гомологии с другими представителями семейства металлопротеаз, прежде всего с другой стромелизиновой металлопротеазой ММР-3.
Полученные результаты свидетельствуют о том, что коадъювантное действие на фибринолиз является специфическим для ММР-10, поскольку оно снижается в присутствии антитела к ММР-10. Это действие оказалось очень выраженным в том случае, когда указанное антитело добавляли с целью блокады эндогенной активности присутствующей в плазме ММР-10 (фиг.5). Полученные результаты свидетельствуют о том, что отсутствие ММР-10 в плазме предупреждает лизис фибринового сгустка даже в присутствии tPA или uРА (таблица 1).
Эти результаты были подтверждены в опытах на полимеризованных фибриновых бляшках. Как продемонстрировано на фиг.6, в присутствии антитела к ММР-10 область лизиса, обусловленного комбинацией tPA:MMP-10, уменьшалась (91,2% по сравнению с 188,6%), в то время как контрольное антитело не оказывало действия (184,6%). Эти результаты подтверждают то, что применение специфического в отношении ММР-10 антитела приводит к нейтрализации и блокаде фармакологического растворения фибриновых сгустков.
Пример 4: Время кровотечения
Для анализа воздействия отсутствия ММР-10 проводили изучение времени кровотечения на 17 мышах с «выключенной» ММР-10 («knockout-мыши», KО) и 14 мышах дикого типа (WT) возрастом 1 месяц. Животных анестезировали путем внутрибрюшинной инъекции смеси кетамина (100 мг/кг) и ксилазина (5 мг/кг) и содержали на подстилке с подогревом при 37°С. От хвоста отрезали с помощью скальпеля кончик длиной 5 мм и хвост погружали в 1 мл 0,9% NaCl при 37°С. Измеряли промежуток времени от начала кровотечения до момента спонтанного прекращения кровотечения. Измеряли также количество вытекшей крови по величине абсорбции соляного раствора, содержащего собранную кровь, при длине волны 560 нм и результаты сравнивали со стандартной кривой, построенной на основе известных объемов мышиной крови.
Результаты
Время кровотечения представляет собой еще один параметр, характеризующий гемостаз in vivo.
Как видно из результатов, представленных в таблице 2, время кровотечения у ММР-10 KО-мышей оказалось существенно меньше, чем у мышей дикого типа. Потеря крови в процессе кровотечения была существенно ниже, что свидетельствует о том, что в отсутствие ММР-10, возможность контроля кровотечения больше, чем в том случае, когда она присутствует.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ-10 (ММР-10) ДЛЯ ТРОМБОЛИТИЧЕСКОЙ ТЕРАПИИ | 2008 |
|
RU2489163C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ И ДИАГНОСТИКИ ГИПЕРФИБРИНОЛИЗА | 2007 |
|
RU2358657C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ФАКТОР VIIA И ФАКТОР XIII | 2001 |
|
RU2272648C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ФИБРИНОЛИТИЧЕСКИМ ДЕЙСТВИЕМ | 2007 |
|
RU2323001C1 |
| КОМБИНАТОРНАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЕМОРРАГИЧЕСКОГО ШОКА | 2018 |
|
RU2663464C1 |
| КОМБИНАТОРНАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЕМОРРАГИЧЕСКОГО ШОКА | 2015 |
|
RU2651778C2 |
| Способ лечения хронического простатита | 1985 |
|
SU1281271A1 |
| СПОСОБ ПРОФИЛАКТИКИ ОСЛОЖНЕНИЙ ПРИ ПОЛОСТНОЙ ХИРУРГИИ ГЛАЗА | 1994 |
|
RU2115398C1 |
| СПОСОБ ИНГИБИРОВАНИЯ ТРОМБООБРАЗОВАНИЯ И УСКОРЕНИЯ ФИБРИНОЛИЗА С ПОМОЩЬЮ ДНК АПТАМЕРОВ, ИНГИБИРУЮЩИХ АКТИВНОСТЬ ТРОМБИНА, В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2559545C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ТРОМБОЛИТИЧЕСКИМ И ФИБРИНОЛИТИЧЕСКИМ ДЕЙСТВИЕМ | 2002 |
|
RU2216348C1 |
Изобретение относится к медицине, в частности к применению нейтрализующего антитела, к матриксной металлопротеиназе-10 (ММР-10) для приготовления лекарственного средства, которое можно применять для антифибринолитического лечения и лечения кровотечений и геморрагических осложнений различной этиологии: гиперфибринолитические состояния, обусловленные врожденными патологиями; лечение с помощью антикоагулянтов; хирургические процедуры. Изобретение обеспечивает большую избирательность ингибиторов, которые блокируют молекулярные механизмы, ассоциированные с конкретными матриксными металлопротеиназами, что позволяет избегать нежелательных явлений. 6 з.п. ф-лы, 4 пр., 2 табл., 6 ил.
1. Применение нейтрализующего антитела к матриксной металлопротеиназе-10 (ММР-10) для приготовления лекарственного средства, которое можно применять для антифибринолитического лечения.
2. Применение по п.1 для приготовления лекарственного средства, которое можно применять для лечения кровотечений и геморрагических осложнений.
3. Применение по п.2 для приготовления лекарственного средства, предназначенного для лечения кровотечений и геморрагических осложнений у пациентов с гиперфибринолитическими состояниями, обусловленными врожденными патологиями.
4. Применение по п.2 для приготовления лекарственного средства, предназначенного для лечения кровотечений и геморрагических осложнений у пациентов, подвергающихся лечению с помощью антикоагулянтов.
5. Применение по п.2 для приготовления лекарственного средства, предназначенного для лечения кровотечений и геморрагических осложнений у пациентов с диссеминированным внутрисосудистым свертыванием крови.
6. Применение по п.2 для приготовления лекарственного средства, предназначенного для лечения кровотечений и геморрагических осложнений, обусловленных хирургическими процедурами.
7. Применение по п.2 для приготовления лекарственного средства, применяемого в качестве альтернативы трансфузии крови при остром кровотечении.
| US 5922322 А, 13.07.1999 | |||
| Отбойное устройство причала | 1981 |
|
SU1060747A1 |
| АРОМАТИЧЕСКАЯ СУЛЬФОНГИДРОКСАМОВАЯ КИСЛОТА В КАЧЕСТВЕ ИНГИБИТОРА МЕТАЛЛОПРОТЕАЗ | 1998 |
|
RU2250105C2 |
| ИНГИБИТОРЫ МЕТАЛЛОПРОТЕИНАЗ, ИХ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2002 |
|
RU2293730C2 |
Авторы
Даты
2012-06-20—Публикация
2008-06-26—Подача