ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтической композиции, содержащей фактор VIIa и фактор XIII. Настоящее изобретение относится также к применению комбинации фактора VIIa и фактора XIII для производства лекарственного средства для лечения лиц, страдающих эпизодическими кровотечениями, или для профилактики таких кровотечений. Настоящее изобретение относится также к способу лечения эпизодических кровотечений у пациентов и к способу усиления образования сгустка крови у пациента. Настоящее изобретение относится также к наборам, включающим в себя указанные соединения.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Гемостаз начинается с образования комплекса между тканевым фактором (TF), который появляется в циркулирующей крови после повреждения стенки сосуда, и FVIIa, который присутствует в циркулирующей крови в количестве, соответствующем приблизительно 1% от общей массы белка FVII. Указанный комплекс сцеплен с клеткой, несущей TF, и активирует превращение FX в FXa и FIX в FIXa на клеточной поверхности. FXa активирует превращение протромбина в тромбин, который активирует FVIII, FV, FXI и FXIII. Помимо этого ограниченное количество тромбина, образованного на этой первоначальной стадии гемостаза, также активирует тромбоциты. После воздействия тромбина тромбоциты изменяют форму и обнажают на своей поверхности заряженные фосфолипиды. Указанная поверхность активированного тромбоцита образует матрицу для дальнейшей активации FX и полного образования тромбина. Дальнейшая активация FX на поверхности активированного тромбоцита опосредована комплексом FIXa-FVIIIa, образованным на поверхности активированного тромбоцита, а FXa затем превращает протромбин в тромбин, все еще оставаясь на поверхности. Тромбин затем превращает фибриноген в фибрин, который является нерастворимым и который стабилизирует первоначальную тромбоцитарную пробку. Указанный процесс пространственно разделен, т.е. локализован на участке экспрессии или экспозиции TF, что сводит к минимуму риск системной активации системы свертывания крови. Нерастворимый фибрин, образующий пробку, дополнительно стабилизируется образованием поперечных связей между волокнами фибрина, которое катализируется FXIII.
FVIIa существует в плазме крови главным образом в виде одноцепочечного зимогена, который расщепляется FXa на двухцепочечную, активированную форму FVIIa. В качестве прогемостатического агента был разработан рекомбинантный активированный фактор VIIa (rFVIIa). Введение rFVIIa обеспечивает быстрый и высокоэффективный прогемостатический ответ у лиц, страдающих гемофилией, у которых кровотечения не поддаются лечению продуктами факторов свертывания из-за образования антител. Также с помощью FVIIa можно успешно лечить пациентов с кровотечением, у которых имеется дефицит фактора VII, или пациентов, не имеющих патологии системы свертывания крови, у которых имеет место чрезмерное кровотечение. В данных исследованиях неблагоприятных побочных эффектов rFVIIa (в частности, тромбоэмболий) не наблюдалось.
Дополнительно экзогенно введенный FVIIa увеличивает образование тромбина на поверхности активированных тромбоцитов. Указанное явление наблюдается у лиц, страдающих гемофилией, не имеющих FIX или FVIII, и, таким образом, не имеющих наиболее эффективного пути для полного образования тромбина. Дополнительное введение FVIIa увеличивает образование тромбина также в присутствии уменьшенного количества тромбоцитов или тромбоцитов с нарушенной функцией.
FXIII, фактор, стабилизирующий фибрин, представляет собой трансглутаминазу, которая образует поперечные связи между мономерами фибрина, создавая, таким образом, структуру фибрина с повышенной устойчивостью к растворению плазмином и другими протеолитическими ферментами. Фактор XIII известен также, как "фибринолигаза" и "фактор, стабилизирующий фибрин". Будучи активированным FXIIIa способен образовывать межмолекулярные гамма-глутамил-эпсилон-лизин поперечные связи между боковыми цепями молекул фибрина и между другими субстратами. FXIII обнаружен в плазме и в тромбоцитах. Данный фермент существует в плазме в виде тетрамерного зимогена, состоящего из двух альфа-субъединиц и двух бета-субъединиц (обозначается a2b2), а также в тромбоцитах в виде зимогена, состоящего из двух альфа-субъединиц (обозначается a2-димер).
Оба зимогена активируются тромбином и Са2+. Кальций высвобождается из тромбоцитов после их агрегации на участке повреждения. Тромбин отщепляет N-концевые аминокислотные остатки 1-37 (a2-димера). В случае a2b2-зимогена бета-субъединицы затем диссоциируют от активированных альфа-субъединиц. Кальций одинаково хорошо связывается с зимогеном и с молекулой, модифицированной тромбином. После активации тромбином и кальцием активный центр цистеин на альфа-цепи обнажается, и образуется полностью активированный фермент. Установлено, что у лиц с тяжелой тромбоцитопенией имеются низкие уровни FXIII в плазме.
Хорошо известно, что у лиц с избыточным кровотечением в связи с хирургическим вмешательством или обширной травмой, которые нуждаются в переливаниях крови, развивается больше осложнений, чем у лиц, не имевших кровотечения. Однако также умеренные кровотечения, требующие введения человеческой крови или продуктов крови (тромбоцитов, лейкоцитов, концентратов, полученных из плазмы крови, для лечения дефектов свертывания, и т.п.) могут приводить к осложнениям, связанным с риском переноса человеческих вирусов (гепатита, ВИЧ, парвовируса и других, не известных на настоящий момент вирусов). Большие кровопотери, требующие массивных гемотрансфузий, могут приводить к развитию полиорганной недостаточности, включая нарушения функции легких и почек. При развитии у пациента указанных тяжелых осложнений начинается каскад событий, вовлекающих ряд цитокинов и воспалительные реакции, которые делают лечение крайне затруднительным и, к несчастью, зачастую безуспешным. Таким образом, главная задача при оперативных вмешательствах, а также при лечении обширных тканевых повреждений - избежать кровотечения или свести его к минимуму.
Для того чтобы избежать подобного кровотечения или свести его к минимуму, важно обеспечить образование стабильных и твердых гемостатических пробок, которые нелегко растворяются фибринолитическими ферментами. Кроме того, важно обеспечить быстрое и эффективное образование подобных пробок или сгустков.
Патентная заявка Японии №2-167234 А относится к адгезиву для биологической ткани, который отличается содержанием фибриногена, протромбина, фактора VII свертывания крови, фактора IX свертывания крови, фактора X свертывания крови, фактора XIII свертывания крови, антитромбина, ингибитора протеаз и ионов кальция.
Патентная заявка Японии №59-116213А относится к аэрозольной композиции для применения в качестве клея для тканей, содержащей коагулянт крови в качестве активного компонента. Коагулянт крови может быть выбран из факторов свертывания крови I, II, III, IV, V, VII, VIII, IX, X, XI, XII и XIII, прекалликреина, высомолекулярного полимера кининогена и тромбина. Предпочтительной является комбинация FXIII и тромбина.
WO 93/12813 (ZymoGenetics) относится к применению FXIII для сокращения периоперационной кровопотери у лица, которое подвергается оперативному вмешательству. Данная композиция может также включать в себя апротинин. FXIII вводят пациенту в виде болюсной инъекции, обычно за день до оперативного вмешательства.
Европейский патент №225160 (Novo Nordisk) относится к композициям FVIIa и способам лечения патологических кровотечений, не вызванных дефектами факторов свертывания или ингибиторами факторов свертывания.
Европейский патент №82182 (Baxter Travenol Lab.) относится к композиции фактора VIIa для применения с целью противодействия дефицитам факторов свертывания крови или эффектам ингибиторов факторов свертывания крови у пациента.
Международная патентная публикация №WO 93/06855 (Novo Nordisk) относится к местному применению FVIIa.
Kjalke et al., Thrombosis and Haemostasis, 1999 (Suppl.), 095 1 относится к введению дополнительного экзогенного FVIIa и влиянию на образование тромбина на поверхности активированных тромбоцитов на модельной системе, имитирующей условия гемофилии А или В.
В данной области остается потребность в улучшенном, надежном и широко применимом способе усиления свертывания крови, быстрого образования стабильных гемостатических пробок и достижения полного гемостаза у пациентов, в частности у пациентов с нарушенной выработкой тромбина. Существует также потребность в способе, при котором количество FVIIa, необходимое для достижения полного гемостаза, уменьшено.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Одной целью настоящего изобретения является создание композиций, которые можно эффективно применять для лечения или профилактики эпизодических кровотечений и нарушений свертывания крови.
Второй целью настоящего изобретения является создание композиций в одной лекарственной форме, которые можно эффективно применять для лечения или профилактики эпизодов кровотечения или в качестве прокоагулянта.
Другой целью настоящего изобретения является создание композиций, способов лечения или наборов, оказывающих синергическое действие.
Еще одной целью настоящего изобретения является создание композиций, способов лечения или наборов, не имеющих существенных побочных эффектов, таких как высокий уровень системной активации системы свертывания крови.
Другие цели настоящего изобретения будут ясны после ознакомления с настоящим описанием.
Авторы настоящего изобретения показали, что комбинация фактора VIIa и фактора XIII может уменьшить время образования сгустка в нормальной плазме крови человека более эффективно, чем один из факторов VIIa или XIII по отдельности. Было показано также, что комбинация фактора VIIa и фактора XIII может повышать прочность сгустка более эффективно, чем один из факторов VIIa или XIII по отдельности. Путем объединения фактора VIIa в концентрации, при которой не наблюдалось дальнейшего повышения прочности сгустка, с фактором XIII, также в концентрации, при которой не наблюдалось дальнейшего повышения прочности сгустка, неожиданно было получено дальнейшее повышение прочности сгустка. Было показано также, что комбинация фактора VIIa и фактора XIII может in vitro продлевать время лизиса сгустка в нормальной плазме крови человека более эффективно, чем один из ингибиторов фактора VIIa или фактора XIII по отдельности. Таким образом, путем усиления коагуляции можно добиться более эффективного лечения кровотечения у пациентов. Кроме того, пациентов можно лечить с помощью относительно более низких концентраций фактора VIIa, что уменьшает, таким образом, относительно высокую стоимость лечения по сравнению с обычным лечением одним только фактором VIIa.
В первой своей особенности настоящее изобретение относится к фармацевтической композиции, включающей в себя фактор VIIa и фактор XIII и необязательно фармацевтически приемлемый носитель.
В другой своей особенности настоящее изобретение относится к фармацевтической композиции, включающей в себя только в качестве активных агентов фактор VIIa и фактор XIII и необязательно фармацевтически приемлемый носитель.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, изготовленной для внутривенного введения, и содержащей фактор VIIa, и фактор XIII, и необязательно фармацевтически приемлемый носитель.
Другой аспект настоящего изобретения связан с фармацевтической композицией, изготовленной для внутривенного введения и содержащей фактор VIIa и фактор XIII в качестве единственных активных агентов и необязательно фармацевтически приемлемый носитель.
В одном варианте осуществления настоящего изобретения фактор VIIa представляет собой рекомбинантный фактор VIIa, а фактор XIII представляет собой рекомбинантный фактор XIII.
В одном варианте осуществления настоящего изобретения фактор VIIa представляет собой рекомбинантный фактор VIIa. Еще в одном варианте осуществления настоящего изобретения фактор VIIa представляет собой рекомбинантный человеческий фактор VIIa. Еще в одном варианте осуществления настоящего изобретения фактор VIIa представляет собой вариант фактора VIIa.
В одном варианте осуществления настоящего изобретения варианты фактора VIIa представляют собой варианты аминокислотных последовательностей, имеющие не более 20 аминокислотных замен, делеций или вставок по сравнению с фактором VIIa дикого типа (т.е. полипептид, имеющий аминокислотную последовательность, описанную в патенте США №4784950). В другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 15 аминокислотных замен, делеций или вставок; в другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 10 аминокислотных замен, делеций или вставок; в другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 8 аминокислотных замен, делеций или вставок; в другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 6 аминокислотных замен, делеций или вставок; в другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 5 аминокислотных замен, делеций или вставок; в другом варианте осуществления настоящего изобретения варианты фактора VIIa имеют не более 3 аминокислотных замен, делеций или вставок по сравнению с фактором VIIa дикого типа. В одном варианте осуществления настоящего изобретения варианты фактора VIIa выбраны из [L305V]-FVIIa, [L305V/M306D/D309S]-FVIIa, [L305I]-FVIIa, [L305T]-FVIIa, [F374P]-FVIIa, [V158T/M298Q]-FVIIa, [V158D/E296V/M298Q]-FVIIa и [K337A]-FVIIa.
В одном варианте осуществления настоящего изобретения фактор XIII представляет собой FXIII a2b2. В другом аспекте осуществления настоящего изобретения фактор XIII представляет собой FXIII a2. Еще в одном варианте осуществления настоящего изобретения фактор XIII представляет собой активированный фактор XIII (FXIIIa). В одном из вариантов осуществления настоящего изобретения фактор XIII представляет собой вариант фактора XIII. В одном из вариантов осуществления настоящего изобретения фактор XIII представляет собой человеческий фактор XIII. В одном из вариантов осуществления настоящего изобретения фактор XIII представляет собой рекомбинантный фактор XIII. В одном из вариантов осуществления настоящего изобретения фактор XIII представляет собой рекомбинантный человеческий фактор XIII. В одном из вариантов осуществления настоящего изобретения фактор XIII представляет собой человеческий а2-димер.
В одном из аспектов настоящая композиция дополнительно содержит ингибитор TFPI. В другом аспекте настоящая композиция дополнительно содержит фактор VIII. В другом варианте настоящая композиция дополнительно содержит фактор VIII и ингибитор TFPI.
В одном аспекте настоящая композиция дополнительно содержит ингибитор фибринолитической системы, например апротинин, ε-аминокапроновую кислоту или транэкзамовую кислоту.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В одном варианте указанный набор включает в себя
а) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и ингибитора TFPI и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и ингибитора TFPI и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa, и фактора XIII, и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество фактора VIII и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель в четвертой дозированной лекарственной форме;
е) контейнер для размещения в нем указанных первой, второй, третьей и четвертой дозированных лекарственных форм.
В другом варианте указанный набор включает в себя
а) эффективное количество фактора VIIa и фактора XIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и ингибитора TFPI и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество фактора VIII и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и фактора VIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и фактора XIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIII и ингибитора TFPI и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIII и фактора XIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество ингибитора TFPI и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
d) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора XIII и ингибитора TFPI и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
е) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество ингибитора TFPI и фактора VIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIIa и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
f) эффективное количество фактора XIII и необязательно фармацевтически приемлемый носитель в третьей дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой, второй и третьей дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество ингибитора TFPI и фактора XIII и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIII и фактора VIIa и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом варианте настоящее изобретение относится к набору, содержащему средство для лечения эпизодического кровотечения, включающему в себя
а) эффективное количество фактора VIIa и ингибитора TFPI и необязательно фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора VIII и фактора XIII и необязательно фармацевтически приемлемый носитель во второй дозированной лекарственной форме;
с) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
В другом аспекте настоящее изобретение относится к применению фактора VIIa в комбинации с фактором XIII для производства лекарственного средства для лечения эпизодического кровотечения.
В другом варианте настоящее изобретение относится к применению фактора VIIa в комбинации с фактором XIII для производства лекарственного средства для уменьшения времени образования сгустка крови у пациента.
В другом варианте настоящее изобретение относится к применению фактора VIIa в комбинации с фактором XIII для производства лекарственного средства для увеличения времени лизиса сгустка в плазме крови млекопитающего.
В другом аспекте настоящее изобретение относится к применению фактора VIIa в комбинации с фактором XIII для производства лекарственного средства для повышения прочности сгустка в плазме крови млекопитающего.
В другом аспекте настоящее изобретение относится к применению фактора VIIa в комбинации с фактором XIII для производства лекарственного средства для усиления образования фибринового сгустка в плазме крови млекопитающего.
В одном варианте осуществления настоящего изобретения плазма крови млекопитающего представляет собой плазму крови человека. В другом варианте осуществления настоящего изобретения плазма крови млекопитающего представляет собой нормальную плазму крови; в другом варианте осуществления настоящего изобретения плазма крови млекопитающего представляет собой нормальную плазму крови человека; в одном варианте осуществления настоящего изобретения плазма крови представляет собой плазму крови пациента с нарушенной выработкой тромбина. В одном варианте осуществления настоящего изобретения плазма крови представляет собой плазму крови пациента с пониженной концентрацией фибриногена.
В одном варианте осуществления настоящего изобретения фактор VIIa и фактор XIII продлевают время лизиса сгустка in vitro в нормальной плазме крови человека.
В другом аспекте настоящее изобретение относится к способу усиления образования сгустка фибрина у пациента; указанный способ включает в себя введение пациенту эффективного количества фактора VIIa в комбинации с эффективным количеством фактора XIII.
В другом аспекте настоящее изобретение относится к способу лечения эпизодического кровотечения у пациента, включающему в себя введение пациенту эффективного количества фактора VIIa в комбинации с эффективным количеством фактора XIII.
В другом аспекте настоящее изобретение относится к способу сокращения времени образования сгустка в плазме млекопитающего, включающему в себя контактирование плазмы с эффективным количеством фактора VIIa в комбинации с эффективным количеством фактора XIII. В одном варианте осуществления настоящего изобретения эффективное количество фактора VIIa в комбинации с эффективным количеством фактора XIII вводят пациенту, который нуждается в указанном лечении.
В другом аспекте настоящее изобретение относится к способу усиления образования фибрина у пациента, включающему в себя введение пациенту эффективного количества фактора VIIa в комбинации с эффективным количеством фактора XIII.
В одном варианте осуществления способов согласно изобретению только фактор VIIa и фактор XIII представляют собой активные агенты, которые вводят пациенту. В другом варианте осуществления настоящего изобретения фармацевтическая композиция включает в себя только фактор VIIa и фактор XIII в качестве активных агентов.
В одном варианте осуществления настоящего изобретения фактор VIIa и фактор XIII вводят одновременно и в одной лекарственной форме. В другом варианте осуществления настоящего изобретения фактор VIIa и фактор XIII вводят последовательно. Еще в одном варианте осуществления настоящего изобретения фактор VIIa и фактор XIII вводят друг за другом с интервалами приблизительно 1-2 часа, например через 30 минут один вслед за другим, например через 10 минут один вслед за другим, например, в виде набора, включающего в себя фактор VIIa в первой лекарственной форме и фактор XIII во второй лекарственной форме.
В одном варианте осуществления настоящего изобретения эффективное количество фактора VIIa составляет от 0,05 мг в день до 500 мг в день (для пациента с массой тела 70 кг). В одном варианте осуществления настоящего изобретения эффективное количество фактора XIII составляет от 0,05 мг в день до 500 мг в день (для пациента с массой тела 70 кг).
В одном варианте осуществления настоящего изобретения фармацевтическая композиция (в случае, когда она представляет собой форму единого препарата) состоит преимущественно из фактора VIIa и фактора XIII, и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция (в случае, когда она представляет собой форму единого препарата) состоит преимущественно из фактора VIIa и фактора XIII, и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз, и/или ингибитора TFPI.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция (в случае, когда она представляет собой форму единого препарата) состоит преимущественно из фактора VIIa и фактора XIII, и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз, и/или ингибитора TFPI, и/или фактора VIII.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция (в случае, когда она представляет собой набор) состоит из первой дозированной лекарственной формы, состоящей преимущественно из фактора VIIa и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз; и второй дозированной лекарственной формы, состоящей преимущественно из фактора XIII и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция (в случае, когда она представляет собой набор) состоит из первой дозированной лекарственной формы, состоящей преимущественно из фактора VIIa и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз, и/или ингибитора TFPI; и второй дозированной лекарственной формы, состоящей преимущественно из фактора XIII и необязательно по меньшей мере из одного фармацевтически приемлемого наполнителя или носителя, и/или стабилизатора, и/или детергента, и/или нейтральной соли, и/или антиоксиданта, и/или консерванта, и/или ингибитора протеаз, и/или ингибитора TFPI, и/или фактора VIII.
Еще в одном варианте осуществления настоящего изобретения пациентом является человек; в другом варианте осуществления у пациента имеется нарушение выработки тромбина; в одном варианте осуществления у пациента имеется пониженная концентрация фибриногена в плазме крови (например, в случае, когда пациент перенес многочисленные трансфузии).
Еще в одном аспекте композиция дополнительно содержит фактор VIII. В одном варианте осуществления настоящего изобретения фактор VIII представляет собой активированный фактор VIII (фактор VIIIa). Еще в одном варианте осуществления фактор VIII представляет собой рекомбинантный фактор VIII. Еще в одном варианте осуществления фактор VIII представляет собой рекомбинантный человеческий фактор VIIIa.
Еще в одном варианте композиция дополнительно содержит ингибитор фибринолитической системы, например апротинин, ε-аминокапроновую кислоту или транэкзамовую кислоту.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
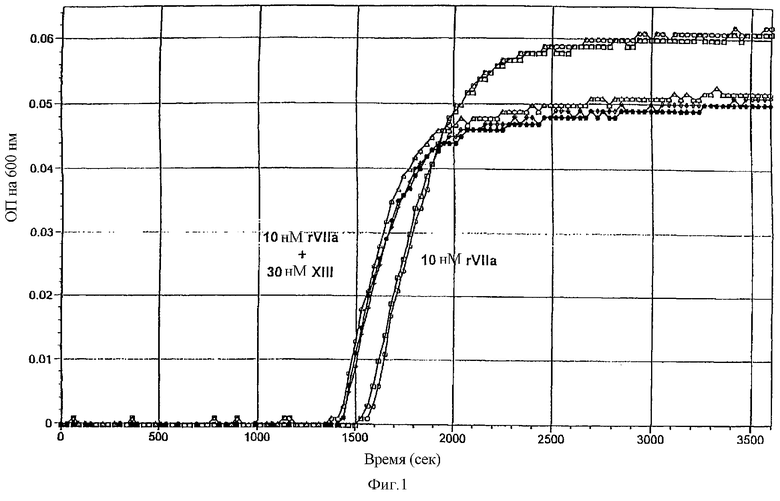
На фигуре 1 показано, что в лунке микротитрационного планшета (общий объем 250 мкл) спонтанное образование сгустка в цитратной нормальной плазме человека (NHP), разбавленной до 1/10 буфером, содержащим 20 нМ Hepes, 150 мМ NaCl и 5 мМ CaCl2, рН 7,4, было получено приблизительно через 2500-3000 сек. Мониторинг образования фибринового сгустка осуществляли по повышению оптической плотности при 600 нм при использовании Spectramax™ 340. Molecular Devices, Sunny-vale CA. На фиг.1 показано, что 10 нМ рекомбинантный фактор VIIa (rFVIIa) от компании Novo Nordisk A/S Bagsvaerd, Дания, сокращает время образования сгустка до 1600 сек (n=2). Дальнейшее сокращение времени образования сгустка было получено, когда добавляли 30 нМ фактора XIII (FXIII) от компании American Diagnostica Inc., Greenwich, CT, вместе с 10 нМ rFVIIa (n=3). Сгусток, образованный в присутствии FXIII, был более прозрачным (более низкая максимальная ОП), чем в его отсутствии, что указывает на то, что добавление FXIII приводит к образованию более мелкоячеистой структуры фибринового геля с более тонкими волокнами.
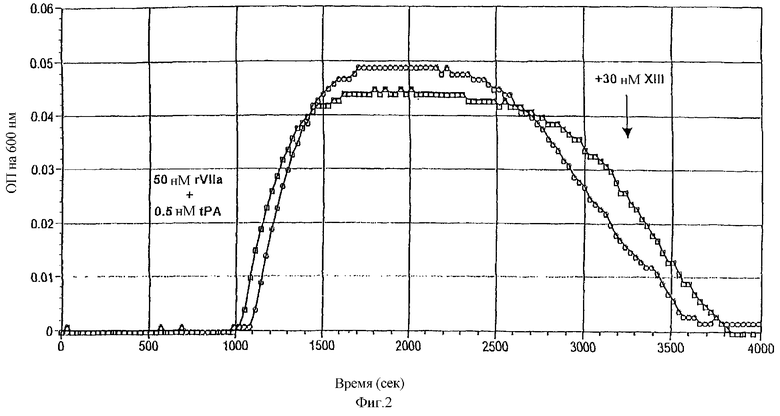
На фигуре 2 показано, что дополнительный FXIII (30 нМ) продлевает время лизиса фибриновых сгустков, образованных в присутствии rFVIIa и активатора тканевого плазминогена (tPA). Образование сгустка было индуцировано в присутствии или в отсутствие 30 нМ XIII путем добавления 25 мкл NHP к 225 мкл 20 нМ Hepes, 150 мМ NaCl, 5 мМ CaCl2, рН 7,4, содержавшего 50 нМ rFVIIa и 0,5 нМ рекомбинантного tPA от компании Novo Nordisk A/S Bagsvaerd, Дания. Образование сгустка и последующий лизис сгустка, индуцированные tPA-опосредованной активацией плазминогена, мониторировали с использованием Spectramax™ 340 при 600 нм по повышению ОП600нм с последующим возвратом следа до исходного уровня. На фиг.2 показано, что время лизиса сгустка при указанных условиях достоверно увеличивается в присутствии FXIII.
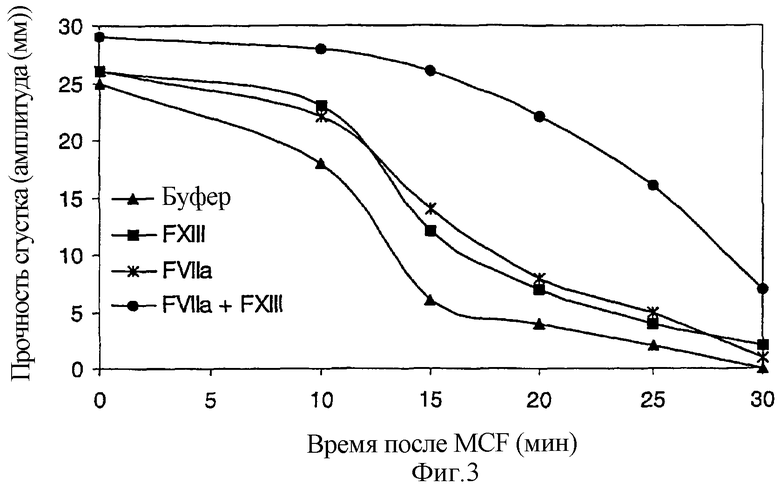
На фигуре 3 показано влияние rFVIIa и FXIII на максимальную прочность сгустка (MCF), а также на устойчивость сгустка к tPA-опосредованному лизису. До добавления rFVIIa и/или FXIII полученная MCF составляла 25 мм, а время, которое требовалось для лизиса половины сгустка, составляло 12,3 минуты (фиг.3). Добавление повышающихся концентраций FXIII (0-40 нМ) не изменяло MCF; однако наблюдалось дозозависимое пролонгирование лизиса половины сгустка, оптимальное при 30 нМ FXIII (время полулизиса сгустка: 14,3 мин, фиг.3). Подобно этому добавление rFVIIa (1 нМ) приводило к защите сгустка от tPA-опосредованного фибринолиза (время полулизиса сгустка: 16,4 мин) при отсутствии какого бы то ни было влияния на MCF (фиг.3). Однако после добавления rFVIIa (1 нМ) вместе с FXIII (30 нМ) наблюдалось повышение MCF (29 мм), а также выраженная защита от фибринолиза (время полулизиса сгустка 27,1 мин) (фиг.3). Вместе данные результаты показывают, что добавление к плазме rFVIIa и FXIII синергическим образом улучшает механическую прочность и резистентность сгустка к tPA-опосредованному фибринолизу.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиции, содержащей комбинацию фактора VIIa и фактора XIII. Настоящее изобретение относится также к композиции, включающей в себя только комбинацию фактора VIIa и фактора XIII в качестве активных ингредиентов. Данная композиция может быть в форме единой композиции или может быть в форме многокомпонентного набора. Настоящие композиции являются пригодными в качестве терапевтических и профилактических прокоагулянтных и стабилизирующих фибриновый сгусток агентов и быстро образуют фибриновые сгустки у млекопитающих, включая приматов и человека.
В данном описании, где бы ни употреблялся термин первая, или вторая, или третья стандартная доза, это не указывает на предпочтительный порядок введения, а сделано только для удобства.
Настоящее изобретение относится также к способу лечения (включая профилактическое лечение или предупреждение) эпизодического кровотечения у пациента, включая человека, например, в результате травмы или оперативного вмешательства, или у пациентов, не имеющих факторов свертывания крови FIX, или FVIII, или тромбоцитов, или имеющих дефекты, связанные с этими факторами.
В настоящее время установлено, что комбинация фактора VIIa и фактора XIIIa является благотворным продуктом, гарантирующим образование твердых, стабильных и быстрых гемостатических пробок.
Для образования твердой стабильной гемостатической пробки необходима полная выработка тромбина. Фибриновая структура подобной пробки зависит как от количества образованного тромбина, так и от скорости первоначальной выработки тромбина. При наличии нарушения выработки тромбина образуется пористая фибриновая пробка, которая имеет высокую проницаемость. Фибринолитические ферменты, которые в норме присутствуют на поверхности фибрина, легко растворяют такую фибриновую пробку. Образование стабильной фибриновой пробки также зависит от наличия фактора XIIIa, который был активирован тромбином и, следовательно, также зависит от полной выработки тромбина. Кроме того, недавно описанный ингибитор фибринолиза, активируемый тромбином, TAFI, требует для своей активации довольно больших количеств тромбина. При наличии не полностью адекватного образования тромбина, таким образом, TAFI может не активироваться, что приводит к образованию гемостатической пробки, которая легче, чем нормальная, растворяется при нормальной фибринолитической активности.
Путем увеличения выработки тромбина фактор VIIa обеспечивает основу для полной активации фактора XIII, что крайне важно для образования полностью стабилизированной гемостатической пробки и, следовательно, для поддержания гемостаза. В ситуациях пониженного количества тромбоцитов, тромбоцитопении более быстрая выработка тромбина инициируется введением дополнительного экзогенного фактора VIIa. Однако общая выработка тромбина фактором VIIa даже в высоких концентрациях не нормализуется.
Путем комбинирования фактора VIIa и фактора XIII, в частности альфа-цепи фактора XIII (а2-димера), облегчается полная активация фактора XIII, что усиливает гемостатический эффект фактора VIIa.
Кроме того, у пациентов с пониженными концентрациями фибриногена в плазме крови (у пациентов, получивших многочисленные трансфузии в связи с множественной травмой или обширным оперативным вмешательством) полной активации фактора XIII не наблюдается. В этом случае более эффективный гемостаз получают с помощью введения комбинации фактора VIIa и фактора XIII.
Другим путем повышения стабильности фибриновых гемостатических пробок является гарантия полного наличия фактора XIIIa (активированного фактора XIII).
Лица с тромбоцитопенией имеют нарушенную выработку тромбина, а также дефектную стабилизацию фибриновых пробок, что делает гемостатические пробки подверженными преждевременному растворению. Кроме того, лица, получившие обширную травму или повреждение органов, которым, как следствие, делали частые переливания крови, часто имеют пониженное содержание тромбоцитов, а также пониженные уровни фибриногена, фактора VIII и других белков свертывания крови. У таких людей развивается нарушение (или понижение) выработки тромбина. Кроме того, их пониженный уровень фибриногена отрицательно влияет на активацию фактора XIII. Указанные лица, таким образом, имеют дефектный или менее эффективный гемостаз, приводящий к образованию фибриновых пробок, которые легко и преждевременно растворяются протеолитическими ферментами; указанные ферменты, кроме того, в больших количествах высвобождаются в ситуациях, характеризующихся обширной травмой и повреждением органов.
С целью облегчения образования полностью стабилизированных пробок, обладающих полной способностью поддерживать гемостаз субъекта, вводят композицию согласно изобретению. Указанная композиция является особенно благоприятной для субъектов с пониженным количеством тромбоцитов и для субъектов с пониженными уровнями фибриногена и/или других белков свертывания в плазме крови.
В присутствии фактора XIII для гарантии удовлетворительного гемостаза могут быть достаточными более низкие концентрации фактора VIIa.
Как сказано выше, фактор XIII существует в плазме крови в виде тетрамерного зимогена, состоящего из двух альфа-субъединиц и двух бета-субъединиц (обозначается a2 b2), но его находят и в другой ткани (например, в тромбоцитах) в виде а2-димера. Любую из указанных форм зимогена или активированный фактор XIII (фактор XIIIa) можно использовать в настоящем изобретении, а также полученные методами генной инженерии варианты фактора XIII, которые сохраняют характерную активность в отношении образования поперечных связей. В одном варианте осуществления настоящего изобретения фактор XIII представляет собой человеческий фактор XIII; в другом варианте осуществления настоящего изобретения фактор XIII представляет собой человеческий а2-димер; еще в одном варианте осуществления настоящего изобретения фактор XIII представляет собой активированный человеческий фактор XIIIa.
Фактор XIII и фактор VIIa, используемые в настоящем изобретении, можно выделять из крови или получать рекомбинантными средствами. Очевидно, что практическое осуществление способов, описанных в настоящем документе, не зависит от того, каким образом были получены очищенный фактор XIII и фактор VIIa и, следовательно, настоящее изобретение включает в себя использование любого способа получения фактора XIII и фактора VIIa, удобного для использования в настоящем изобретении. Предпочтительными являются человеческий фактор VIIa и человеческий фактор XIII. Также в настоящем изобретении можно использовать варианты фактора VIIa и фактора XIII, полученные методами генной инженерии, которые сохраняют характерную активность в отношении гемостаза. Также в настоящем изобретении можно использовать фрагменты фактора VIIa, или фактора XIII, или варианты фактора VIIa, или фактора XIII, которые сохраняют характерную активность в отношении гемостаза. Гемостатическую активность фактора VIIa можно, например, измерить с помощью анализа активности фактора VIIa, представленного в настоящем описании. Гемостатическую активность фактора XIII можно, например, измерить с помощью анализа активности фактора XIII, представленного в настоящем описании.
Неограничивающие примеры вариантов фактора VII, имеющих практически ту же или лучшую биологическую активность по сравнению с фактором VIIa дикого типа, включают в себя, не ограничиваясь ими, примеры, описанные в патентных заявках Дании №№РА 2000 00734, РА 2000 01360, РА 2000 01361 и РА 2001 00477. Неограничивающие примеры включают в себя [L305V]-FVIIa, [L305V/M306D/D309S]-FVIIa, [L305I]-FVIIa, [L305T]-FVIIa, [F374P]-FVIIa, [V158T/M298Q]-FVIIa, [V158D/E296V/M298Q]-FVIIa и [K337A]-FVIIa.
В настоящем контексте трехбуквенные или однобуквенные обозначения аминокислот используются в их общепринятом значении, как указано в таблице 1. Если не указано специально, упомянутые аминокислоты представляют собой L-аминокислоты. Следует понимать, что первая буква, например, в К337 представляет собой аминокислоту, которая присутствует в естественных условиях в указанном положении в факторе VII дикого типа, и что, например, [K337A]-FVIIa означает вариант FVII, в котором аминокислота, представленная однобуквенным кодом К, присутствующая в естественных условиях в указанном положении, заменена аминокислотой, представленной однобуквенным кодом А.
Сокращения для аминокислот:
Термин "фактор VIIa" или "FVIIa" можно использовать взаимозаменяемым образом. Термин "фактор VIIa" включает a себя зимоген фактора VII (одноцепочечный фактор VII). Термин "фактор XIII" или "FXIII" можно использовать взаимозаменяемым образом. Термин "фактор VIII" или "FVIII" можно использовать взаимозаменяемым образом.
Специалистам будет понятно, что можно делать замены вне участков, имеющих принципиальное значение для функции молекулы фактора VIIa или фактора XIII, при которых все равно получается активный полипептид. Аминокислотные остатки, имеющие принципиальное значение для активности полипептида фактора VIIa или фактора XIII и, следовательно, предпочтительно не подлежащие замене, можно идентифицировать с помощью методик, известных специалистам, таких как сайтнаправленный мутагенез или аланинсканирующий мутагенез (см., например, Cunningham and Wells, 1989, Science 244: 1081-1085). В последней методике мутации внедряют в каждый положительно заряженный остаток в молекуле, и полученные мутантные молекулы испытывают в качестве коагулянта, соответственно, на активность в отношении образования поперечных связей для идентификации аминокислотных остатков, которые имеют принципиальное значение для активности молекулы. Участки взаимодействия субстрат-фермент также можно определить путем анализа пространственной структуры с помощью таких методик, как ядерно-магнитный резонанс, кристаллография или фотоаффинное мечение (см., например, de Vos et al., 1992, Science 255: 306-312; Smith et al., 1992, Journal of Molecular Biology 224: 899-904; Wlodaver et al., 1992, FEBS Letters 309: 59-64).
Внесение мутации в последовательность нуклеиновой кислоты для замены одного нуклеотида на другой нуклеотид можно осуществлять путем сайтнаправленного мутагенеза с использованием любого из известных специалистам способов. Особенно полезной является процедура, при которой используют вектор из суперскрученной двухцепочечной ДНК, содержащий вставку, представляющую интерес, и два синтетических праймера, содержащих желательную мутацию. Олигонуклеотидные праймеры, каждый комплементарный противоположным цепям вектора, распрямляются во время температурного циклирования с помощью Pfu ДНК-полимеразы. При инкорпорации праймеров образуется мутированная плазмида, содержащая расположенные в шахматном порядке ники. После температурного циклирования на продукт действуют Dpnl, который является специфичным в отношении метилированной и гемиметилированной ДНК в плане расщепления родительской матрицы ДНК и отбора содержащей мутацию синтезированной ДНК. Можно использовать также другие известные специалистам процедуры для создания, идентификации и выделения вариантов, такие, например, как методики перестановки генов или дисплея фагов.
Термин "фактор VIII" или "FVIII" включает в себя активированный фактор VIII (обозначается как фактор VIIIa), варианты и усеченные формы фактора VIII, сохраняющие характерную коагулянтаую активность. В одном варианте осуществления настоящего изобретения фактор VIII представляет собой человеческий фактор VIII.
Термин "ингибитор TFPI" означает соединения, ингибирующие противосвертывающую активность TFPI (ингибитора пути тканевого фактора). Данный термин включает в себя такие соединения, как соединения, описанные в Европейском патенте №558 529, WO 96/28153 и US 5 622 988. "TFPI" и "EPI" (ингибитор внешнего пути) можно использовать взаимозаменяемым образом.
В настоящем изобретении "эффективное количество" фактора VIIa и "эффективное количество" фактора XIII определяется как количество фактора VIIa и фактора XIII, достаточное для предотвращения или уменьшения кровотечения или кровопотери, так, чтобы излечить, облегчить или частично приостановить заболевание и его осложнения.
Количество фактора VIIa и количество фактора XIII, введенное в соответствии с настоящим изобретением, может варьировать в соотношения приблизительно от 1:100 до 100:1 (мкг фактора VIIa: мкг фактора XIII).
В данном контексте "субъекты с нарушенной выработкой тромбина" означает субъектов, которые не могут генерировать полный тромбиновый взрыв на поверхности активированных тромбоцитов, и включает в себя субъектов, имеющих выработку тромбина, которая меньше, чем у субъектов, имеющих полностью функционирующую, нормальную гемостатическую систему, включающую в себя нормальное количество и функцию факторов свертывания крови, тромбоцитов и фибриногена, и включает в себя субъектов, не имеющих FIX и/или FVIII (гемофилия А и В), или имеющих дефектный FIX и/или FVIII, или имеющих ингибиторы против FIX и/или FVIII; субъектов, не имеющих FXI; субъектов с пониженным содержанием тромбоцитов в крови или тромбоцитами с дефектной функцией (например, с тромбоцитопенией или тромбастенией Гланцманна или субъектов с избыточным кровотечением); и субъектов, имеющих пониженные уровни протромбина, FX или FVII.
Субъекты с пониженными концентрациями фибриногена в плазме крови (например, субъекты, получившие многочисленные трансфузии в связи с множественной травмой или обширным оперативным вмешательством) также часто страдают от образования рыхлых и нестабильных фибриновых пробок, которые легко растворяются.
Термин "полный гемостаз" означает образование стабильного и твердого фибринового сгустка или пробки в месте повреждения, который эффективно останавливает кровотечение и который легко не растворяется фибринолитической системой.
Термин "активность фактора VIIa" или "фактор VIIa-активность" означает способность генерировать тромбин; данный термин включает в себя также способность генерировать тромбин на поверхности активированных тромбоцитов в отсутствии тканевого фактора.
Термин "усиление нормальной гемостатической системы" означает усиление способности генерировать тромбин.
Используемый в настоящем документе термин "нарушение кровотечения" отражает любой дефект, врожденный, приобретенный или индуцированный, клеточной или молекулярной природы, который проявляется в кровотечениях. Примерами являются дефициты факторов свертывания (например, гемофилия А и В или дефицит факторов свертывания XI или VII), ингибиторы факторов свертывания, дефектная функция тромбоцитов, тромбоцитопения или болезнь Виллебранда.
Термин "эпизодическое кровотечение" включает в себя неконтролируемое и избыточное кровотечение, которое представляет собой главную проблему как в связи с оперативными вмешательствами, так и с другими формами повреждения тканей. Неконтролируемое и избыточное кровотечение может наблюдаться у субъектов, имеющих исходно нормальную систему свертывания крови (у таких субъектов, однако, развивается коагулопатия в результате кровотечения - разбавление белков свертывания, повышенный фибринолизис и пониженное содержание тромбоцитов вследствие эффекта разбавления при кровотечении), и у субъектов, имеющих нарушение свертывания крови или нарушение кровотечения. Дефициты факторов свертывания крови (гемофилия А и В, дефицит факторов свертывания XI или VII) или ингибиторы факторов свертывания могут служить причиной нарушений кровотечения. Избыточные кровотечения также наблюдаются у субъектов с нормально функционирующим каскадом свертывания крови (нет дефицита факторов свертывания или ингибиторов против любого из факторов свертывания) и могут вызываться дефектной функцией тромбоцитов, тромбоцитопенией или болезнью Виллебранда. В указанных случаях кровотечения можно сравнить с теми кровотечениями, которые вызваны гемофилией, поскольку гемостатическая система, как при гемофилии, не имеет или имеет патологические главные "составляющие" свертывания крови (такие как тромбоциты или белок фактора Виллебранда), что вызывает обильные кровотечения. У субъектов с обширным повреждением тканей в связи с оперативным вмешательством или обширной травмой нормальный гемостатический механизм может быть перегружен потребностью в немедленном гемостазе, и у них может развиться кровотечение, несмотря на исходно (до травмы) нормальный гемостатический механизм. Достижение удовлетворительного гемостаза также представляет собой проблему, когда кровотечения наблюдаются в таких органах, как головной мозг, область внутреннего уха и глаза, с ограниченной возможностью для хирургического гемостаза. Та же проблема может возникнуть в процессе биопсии различных органов (печени, легкого, опухолевой ткани, желудочно-кишечного тракта), а также при лапароскопических операциях. Общей для всех этих ситуаций является трудность обеспечения гемостаза хирургическим способом (швами, клиппированием и т.п.), что происходит также в случае, когда кровотечение является диффузным (геморрагический гастрит и профузное маточное кровотечение). Острые и профузные кровотечения могут также наблюдаться у субъектов, проходящих лечение антикоагулянтами, у которых дефектный гемостаз индуцирован лекарственной терапией. Таким субъектам может потребоваться оперативное вмешательство, и в этом случае антикоагулянтный эффект необходимо быстро устранить. Радикальная позадилонная простатэктомия представляет собой процедуру, которую часто осуществляют у субъектов с локализованным раком предстательной железы. Данная операция часто осложняется значительной и иногда массивной кровопотерей. Значительная кровопотеря во время простатэктомии связана, главным образом, со осложненной анатомической ситуацией, с различными плотно васкулиризованными участками, которые являются труднодоступными для хирургического гемостаза, что может привести к диффузному кровотечению на большой площади. Другой ситуацией, которая может вызвать проблемы в случае неудовлетворительного гемостаза, является ситуация, когда субъекту с нормальным гемостатическим механизмом осуществляют лечение антикоагулянтами для профилактики тромбоэмболической болезни. Данная лекарственная терапия может включать в себя гепарин, другие формы протеогликанов, варфарин или другие формы антагонистов витамина К, а также аспирин и другие ингибиторы агрегации тромбоцитов.
В одном варианте осуществления настоящего изобретения кровотечение связано с гемофилией. В другом варианте осуществления настоящего изобретения кровотечение связано с гемофилией с приобретенными ингибиторами. В другом варианте осуществления настоящего изобретения кровотечение связано с тромбоцитопенией. В другом варианте осуществления настоящего изобретения кровотечение связано с болезнью Виллебранда. В другом варианте осуществления настоящего изобретения кровотечение связано с тяжелым повреждением тканей. В другом варианте осуществления настоящего изобретения кровотечение связано с тяжелой травмой. В другом варианте осуществления настоящего изобретения кровотечение связано с оперативным вмешательством. В другом варианте осуществления настоящего изобретения кровотечение связано с лапароскопическим оперативным вмешательством. В другом варианте осуществления настоящего изобретения кровотечение связано с геморрагическим гастритом. В другом варианте осуществления настоящего изобретения кровотечение связано с профузным маточным кровотечением. В другом варианте осуществления настоящего изобретения кровотечение наблюдается в органах с ограниченной возможностью механического гемостаза. В другом варианте осуществления настоящего изобретения кровотечение наблюдается в головном мозге, области внутреннего уха или глазах. В другом варианте осуществления настоящего изобретения кровотечение связано с процессом взятия биоптата. В другом варианте осуществления настоящего изобретения кровотечение связано с лечением антикоагулянтами.
Композиция согласно изобретению может дополнительно содержать ингибитор TFPI. Подобную композицию предпочтительно следует вводить субъектам, имеющим гемофилию А или В.
Композиция согласно изобретению может дополнительно содержать фактор VIII. Подобную композицию предпочтительно следует вводить субъектам, которые не имеют ингибиторов к фактору VIII.
В данном контексте термин "лечение" включает в себя как профилактику ожидаемого кровотечения, например, при оперативном вмешательстве, так и регулирование уже имеющегося кровотечения, например, при гемофилии или травме, с целью ингибирования или минимизации кровотечения. Профилактическое введение фактора VIIa и фактора XIII, таким образом, включено в термин "лечение".
Термин "субъект", используемый в настоящем документе, означает любое животное, в частности млекопитающих, таких как человек, и может, где это подходит, использоваться взаимозаменяемым образом с термином "пациент".
Сокращения
Получение соединений
Человеческий очищенный фактор VIIa, подходящий для применения согласно изобретению, предпочтительно получают с помощью технологии рекомбинантной ДНК, например, как описано в Hagen et al., Proc. Natl. Acad. Sci. USA 83; 2412-2416, 1986, или как описано в Европейском патенте №200 421 (ZymoGenetics, Inc.). Фактор VIIa, полученный с помощью рекомбинантной технологии, может представлять собой аутентичный фактор VIIa или более или менее модифицированный фактор VIIa, при условии, что такой фактор VIIa обладает практически такой же биологической активностью в отношении свертывания крови, как и аутентичный фактор VIIa (фактор VIIa дикого типа). Подобный модифицированный фактор VIIa можно получить путем модификации последовательности нуклеиновой кислоты, кодирующей фактор VIIa дикого типа, или путем изменения аминокислотных кодонов или путем удаления некоторых аминокислотных кодонов в нуклеиновой кислоте, кодирующей натуральный фактор VII, с помощью известных средств, например, посредством сайтспецифического мутагенеза.
Фактор VII можно также получить с помощью способов, описанных Broze and Majerus, J. Biol. Chem. 255 (4): 1242-1247, и Hender and Kisiel, J. Clin. Invest. 71: 1836-1841. Данные способы дают фактор VII без определяемых количеств других факторов свертывания крови. Посредством включения дополнительной гель-фильтрации в качестве стадии конечной очистки можно получить даже еще более чистый препарат фактора VII. Фактор VII затем превращают в активированный фактор VIIa с помощью известных средств, например с помощью нескольких различных белков плазмы, таких как фактор XIIa, IX или Xa. Альтернативно, как описано Bjoern et al. (Research Disclosure, 26 сентября, 1986, стр. 564-565), фактор VII можно активировать, пропуская его через колонку для ионообменной хроматографии, такую как Mono Q® (Pharmacia fine Chemicals), или подобную.
Фактор XIII для применения согласно изобретению можно получить из плазмы согласно известным способам, таким которые описаны Cooke and Holbrook (Biochem. J. 141: 79-84, 1974), и Curtis and Lorand (Methods Enzymol. 45: 177-191, 1976), включенных в настоящий документ в качестве ссылок. а2-димерную форму фактора XIII можно получить из плаценты, как описано в патентах США №№3 904 751, 3 931 399, 4 597 899 и 4 285 933, включенных в настоящий документ в качестве ссылок. Предпочтительно, однако, использовать рекомбинантный фактор XIII, чтобы избежать использования продуктов, полученных из крови или тканей, с риском передачи болезней. Способы получения рекомбинантного фактора XIII известны специалистам. См., например, Davie et al., EP 268 772; Grundmann et al., AU-A-69896/87; Bishop et al., Biochemistry 1990, 29: 1861-1869; Board et al., Thromb. Haemost. 1990, 63: 235-240; Jagadeeswaran et al., Gene 1990, 86: 279-283 и Broker et al., FEBS Lett. 1989, 248: 105-110, полностью включенные в настоящий документ в качестве ссылок. В одном варианте осуществления настоящего изобретения а2-димер фактора XIII получают в цитоплазме с использованием дрожжей Saccharomyces cerevisiae, как описано в одновременно рассматриваемой патентной заявке США №07741 263, полностью включенной в настоящий документ в качестве ссылки. Клетки собирают и лизируют и получают осветленный лизат. Лизат фракционируют с помощью анионообменной хроматографии при нейтральном или слабощелочном значении рН с использованием колонки с дериватизированной агарозой, такой как DEAE Fast-Flow Sepharose. TM. (Pharmacia), или подобной. Фактор XIII затем осаждают из колоночного элюата путем концентрирования элюата и доведения рН до 5,2-5,5, например диафильтрованием против буфера сукцината аммония. Преципитат затем растворяют и дополнительно очищают с использованием обычных хроматографических методик, таких как гель-фильтрация и гидрофобная хроматография.
Специалисты оценят, что предпочтительно использовать белки фактор XIII и фактор VIIa, сингенные в отношении субъекта, с целью сведения к минимуму риска индукции иммунного ответа. Получение и характеризация нечеловеческого фактора XIII описано Nakamura et al. (J. Biochem. 78: 1247-1266, 1975). Настоящее изобретение также включает в себя применение подобных белков фактора XIII и фактора VIIa для ветеринарных целей.
Введение и фармацевтические композиции
Для лечения в связи с планируемыми вмешательствами фактор VII и фактор XIII обычно будут вводить приблизительно за 24 часа до выполнения вмешательства и в течение 7 дней или более после него. Введение в качестве коагулянта можно осуществлять различными путями, как описано в настоящем документе.
Доза фактора VII варьирует приблизительно от 0,05 мг до 500 мг в день, например приблизительно от 1 мг до 200 мг в день, или, например, приблизительно от 10 мг до 175 мг в день для субъекта с массой тела 70 кг в качестве ударной и поддерживающей доз в зависимости от массы тела субъекта, состояния и тяжести состояния.
Доза фактора XIII варьирует приблизительно от 0,05 мг до 500 мг в день, например приблизительно от 1 мг до 200 мг в день, или, например, приблизительно от 10 мг до 175 мг в день для субъекта с массой тела 70 кг в качестве ударной и поддерживающей доз в зависимости от массы тела субъекта, состояния и тяжести состояния.
Композиции и наборы согласно изобретению пригодны для использования в медицине и ветеринарии, например для лечения или профилактики у субъектов, страдающих эпизодическими кровотечениями или нарушениями свертывания крови. Для применения согласно изобретению из фактора VII и фактора XIII изготавливают композицию необязательно с фармацевтически приемлемым носителем. Предпочтительно фармацевтические композиции вводят парентерально, т.е. внутривенно, подкожно или внутримышечно, или их можно вводить путем непрерывной или прерывистой инфузии.
Композиции могут дополнительно включать в себя один или более разбавителей, эмульгаторов, консервантов, буферов, наполнителей и т.п. и могут изготавливаться в таких формах, как жидкости, порошки, эмульсии, препараты с контролируемым высвобождением и т.п. Специалист может составлять композиции согласно изобретению подходящим образом в соответствии с принятыми способами, такими которые описаны в Remington's Pharmaceutical Sciences, Gennaro, ed., Muck Publishing Co., Easton, PA, 1990. Композиции для парентерального введения включают в себя фактор VII и фактор XIII в комбинации с фармацевтически приемлемым носителем, предпочтительно водным носителем, предпочтительно растворенные в нем. Можно использовать различные водные носители, такие как вода, вода с буфером, 0,4% солевой раствор, 0,3% раствор глицина и т.п. Варианты фактора VII согласно изобретению могут также изготавливаться в виде липосомных препаратов для доставки или нацеливания на области повреждения. Липосомные препараты в общих чертах описаны, например, в US 4 837 028, US 4 501 728 и US 4 975 282.
Обычную фармацевтическую композицию для внутривенной инфузии можно изготовить таким образом, чтобы она содержала 250 мг стерильного раствора Рингера и 10 мг фактора VIIa и/или фактора XIII. Актуальные способы изготовления композиций для парентерального введения известны или очевидны специалистам и описаны более подробно, например, в Remington's Pharmaceutical Sciences, 18 ed., Muck Publishing Co., Easton, PA (1990).
Кратко, фармацевтические композиции, подходящие для применения согласно изобретению, изготавливают путем смешивания фактора VIIa или фактора XIII или фактора VIIa в комбинации с фактором XIII предпочтительно в очищенном виде с подходящими вспомогательными веществами и подходящим носителем или разбавителем. Подходящие физиологически приемлемые носители или разбавители включают в себя стерильную воду и физиологический раствор. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, которые требуются для приближения к физиологическим условиям, такие как агенты, корригирующие рН, и агенты, придающие буферные свойства, агенты, корригирующие тоничность, и т.п., например ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция и т.п. Подходящие вспомогательные вещества включают в себя также кальций, белки (например, альбумины) или другие инертные пептиды (например, глицилглицин) или аминокислоты (например, глицин или гистидин) для стабилизации очищенного фактора VIIa и/или фактора XIII. Другие физиологически приемлемые вспомогательные вещества представляют собой невосстанавливающие сахара, мнагоатомные спирты (например, сорбит, маннит или глицерин), полисахариды, такие как низкомолекулярные декстрины, детергенты (например, полисорбат) и антиоксиданты (например, бисульфит и аскорбат). Вспомогательные вещества обычно представлены в концентрации от 0,001 до 4% мас./об. Фармацевтическая композиция может также содержать ингибиторы протеаз, например апротинин или транэкзамовую кислоту, и консервирующие агенты. Кроме того, препарат может также содержать ингибитор TFPI и/или фактор VIII.
Композиции можно стерилизовать обычными хорошо известными способами стерилизации. Полученные водные растворы можно упаковывать для применения или фильтровать в асептических условиях и лиофилизировать; лиофилизированный препарат объединяют со стерильным водным раствором перед введением.
Концентрация фактора VIIa, фактора XIII или фактора VIIa в комбинации с фактором XIII может сильно варьировать, т.е. от менее чем приблизительно 0,5% мас., обычно или по меньшей мере около 1% мас., до 15 или 20% мас., и ее будут подбирать, прежде всего, по объемам жидкости, вязкости и т.п. в соответствии с конкретном выбранным способом введения.
Предпочтительным является введение путем инъекции или инфузии, в частности путем инъекции. Так, фактор VIIa и фактор XIII изготавливают в форме, подходящей для внутривенного введения, такой как препарат, который представляет собой или растворенный лиофилизированный порошок или жидкую композицию, содержащие фактор VIIa и фактор XIII в единой лекарственной форме, или растворенный лиофилизированный порошок, или жидкую композицию, содержащие фактор VIIa в единой лекарственной форме, и растворенный лиофилизированный порошок или жидкую композицию, содержащие фактор XIII в другой лекарственной форме.
Местную доставку фактора VIIa и фактора XIII, такую, например, как местное нанесение, можно осуществлять, например, посредством спрея, перфузии, двойных баллонных катетеров, стента, инкорпорированного в сосудистый трансплантат, или стентов, гидрогелей, используемых для покрытия баллонных катетеров, или с помощью других хорошо разработанных методик. Для амбулаторных пациентов, которым требуются ежедневные поддерживающие уровни, фактор VIIa и фактор XIII можно вводить путем непрерывной инфузии с использованием портативной насосной системы. В любом случае фармацевтические композиции должны обеспечить количество фактора VIIa и фактора XIII, достаточное для эффективного лечения субъекта.
Комбинация фактора VIIa и фактора XIII демонстрирует синергическое действие в исследовании in vitro прочности сгустка и времени фибринолизиса. Более того, комбинация фактора VIIa и фактора XIII демонстрирует синергическое действие в отношении образования стабильных фибриновых сгустков, увеличивая полупериод лизиса сгустка, повышая прочность сгустка и повышая его устойчивость к фибринолизису.
Композиции, содержащие фактор VII и фактор XIII, можно вводить для профилактики и/или лечения. При терапевтическом применении композиции вводят субъекту, который уже страдает от заболевания, как описано выше, в количестве, достаточном для излечения, облегчения или частичной приостановки заболевания и его осложнений. Количество, адекватное для того, чтобы сделать это, определяют как "эффективное количество" или "терапевтически эффективное количество". Специалисту будет понятно, что количества, эффективные для указанных целей, будут зависеть от тяжести заболевания или повреждения, а также от массы тела и общего состояния здоровья субъекта. Следует учитывать, что материалы согласно изобретению можно, в общем, применять при состояниях тяжелой болезни или повреждения, то есть в ситуациях, угрожающих или потенциально угрожающих жизни. В подобных случаях, учитывая минимизацию введения веществ извне и обычное отсутствие иммуногенности фактора VII и фактора XIII для человека, возможно, а может быть и желательно, чтобы лечащий врач вводил значительный избыток указанных композиций.
В профилактических целях композиции, содержащие фактор VIIa и фактор XIII, вводят субъекту, склонному или каким-либо другим образом входящему в группу риска болезненного состояния или повреждения, для усиления собственной способности субъекта к свертыванию крови. Указанное количество определяют как "профилактически эффективную дозу".
Можно осуществлять однократное или многократные введения композиций, при которых уровни доз и схемы введения выбирает лечащий врач. Композиции можно вводить один или более раз в день или неделю. Эффективное количество указанной фармацевтической композиции представляет собой количество, которое обеспечивает клинически значимый эффект при эпизодах кровотечения. Указанные количества будут частично зависеть от конкретного состояния, по поводу которого осуществляется лечение, возраста, массы тела и общего состояния здоровья пациента, а также от других факторов, очевидных специалистам.
Композицию обычно вводят в однократной дозе перед ожидаемым кровотечением или в начале кровотечения. Ее можно, однако, вводить и в виде многократных доз предпочтительно с интервалами 2-4 - 6-12 часов в зависимости от введенной дозы и состояния пациента.
Композиция может быть в форме единого препарата, включающего в себя как фактор VIIa, так и фактор XIII, в подходящих концентрациях. Композиция может быть также в форме набора, состоящего из первой дозированной лакарственной формы, содержащей фактор VIIa, и второй дозированной лекарственной формы, содержащей фактор XIII, и, необязательно, одной или более дополнительных дозированных лекарственных форм, содержащих фактор VIII и/или ингибитор TFPI. В данном случае фактор VIIa и фактор XIII следует вводить последовательно, предпочтительно приблизительно с 1-2-часовым интервалом, например через 30 минут один после другого, или предпочтительно через 10 минут, или более предпочтительно через 5 минут один после другого. Первой можно вводить любую из двух дозированных лекарственных форм.
Поскольку настоящее изобретение относится к профилактике или лечению эпизодов кровотечения или для коагуляционного лечения путем воздействия комбинацией активных ингредиентов, которые можно вводить раздельно, настоящее изобретение относится также к комбинированию отдельных фармацевтических композиций в виде набора. Набор включает в себя по меньшей мере две отдельные фармацевтические композиции. Набор включает в себя контейнер для размещения в нем отдельных композиций, такой как мерный флакон или мерная упаковка из фольги. Обычно набор включает в себя инструкции по введению отдельных компонентов. Форма набора является особенно выгодной, когда отдельные компоненты предпочтительно вводятся в разных лекарственных формах, вводятся с различными интервалами времени, или когда желательно титрование отдельных компонентов комбинации лечащим врачом.
Анализы
Тест на активность фактора VIIa
Подходящий анализ для тестирования активности фактора VIIa и, следовательно, для выбора подходящих вариантов фактора VIIa можно осуществлять в виде простого предварительного теста in vitro.
Анализ гидролиза in vitro
Нативный (дикого типа) фактор VIIa и вариант фактора VIIa (оба далее упоминаются как "фактор VIIa") можно исследовать на предмет их специфических свойств. Их можно также исследовать параллельно для прямого сравнения их специфических свойств. Данное исследование выполняют на микротитрационном планшете (MaxiSorp, Nunc, Дания). Хромогенный субстрат D-Ile-Pro-Arg-п-нитроанилид (S-2288, Chromogenix, Швеция), конечная концентрация 1 мМ, добавляют к фактору VIIa (конечная концентрация 100 нМ) в 50 мМ Hepes, рН 7,4, содержащего 0,1 М NaCl, 5 мМ CaCl2 и 1 мг/мл бычьего сывороточного альбумина. Поглощение при 405 нм непрерывно измеряют на планшет-ридере SpectraMax™ 340 (Molecular Devices, США). Поглощение, которое развилось после 20-минутной инкубации, после вычитания поглощения в контрольной лунке, не содержащей фермента, используют для расчета соотношения между активностью варианта фактора VIIa и фактора VIIa дикого типа.
Соотношение=(А405 нм варианта фактора VIIa)/(А405 нм фактора VIIa дикого типа)
На основе этого можно идентифицировать варианты фактора VIIa с активностью, сравнимой с активностью нативного фактора VIIa или превосходящей активность нативного фактора VIIa, такие, например, как варианты, для которых соотношение между активностью варианта и активностью нативного фактора VIIa, показанное на фиг.1, приблизительно составляет 1,0 или выше.
Активность фактора VIIa или вариантов фактора VIIa можно измерить также с использованием физиологического субстрата, такого как фактор Х, в концентрация 100-1000 нМ, когда выработанный фактор Ха измеряют после добавления подходящего хромогенного субстрата (например, S-2765). Помимо этого, анализ активности можно проводить при физиологической температуре.
Способность фактора VIIa или вариантов фактора VIIa генерировать тромбин можно измерить также путем анализа, включающего в себя все, относящиеся к этому факторы и ингибиторы свертывания в физиологических концентрациях (минус фактор VIII, когда имитируются условия гемофилии А) и активированные тромбоциты (как описано на стр. 543 у Monroe et al. (1997) Brit. J. Haematol. 99, 542-547, включенном в настоящий документ в качестве ссылки).
Тест на активность фактора XIII
Подходящее исследование для тестирования активности трансглутаминазы фактора XIII и, следовательно, для выбора подходящих вариантов фактора XIII можно осуществлять в качестве простого теста in vitro, как описано, например, в Methods of Enzymology, Vol. 45 (1976), Proteolytic Enzymes, часть В, стр. 177-191 (Ed. Lorand, L.).
Настоящее изобретение далее иллюстрируется следующими примерами, которые, однако, не должны истолковываться как ограничивающие объем защиты. Признаки, описанные в приведенном ранее описании и в следующих примерах, могут как по отдельности, так и в любом их сочетании, представлять собой материал для реализации настоящего изобретения в различных его формах.
ПРИМЕРЫ
Пример 1
Фактор XIII усиливает индуцированное фактором VIIa образование фибринового сгустка
Цитратную нормальную человеческую плазму (NHP) разбавляли 1/10 в буфере, содержавшем 20 нМ Hepes, 150 мМ NaCl, 5 мМ CaCl2, рН 7,4, в лунке микротитрационного планшета (общий объем 250 мкл) и наблюдали за образованием фибринового сгустка по повышению оптической плотности при 600 нм на Spectramax™ 340 (Molecular Devices, Sunnyvale, США).
Спонтанное образование сгустка получали приблизительно за 2500-3000 сек. На фиг.1 показано, что 10 нМ рекомбинантного фактора VIIa (rFVIIa) (Novo Nordisk A/S Bagsvaerd, Дания) сокращает время образования сгустка до 1600 сек (n=2). Дальнейшее сокращение времени образования сгустка получали, когда добавляли 30 нМ фактора XIII (FXIII) (American Diagnostica Inc., Greenwich, CT) вместе с 10 нМ rFVIIa (n=3). Сгусток, образованный в присутствии FXIII, был более прозрачным (ниже максимальная ОП), чем в его отсутствии, что указывает на то, что добавление FXIII приводит в образованию фибринового геля более мелкоячеистой структуры с более тонкими волокнами.
Пример 2
Присутствие дополнительного фактора XIII во время индуцированного фактором VIIa образования сгустка приводит к повышению устойчивости к фибринолитическому разложению
Фибриновый сгусток, состоящий из тонких волокон, механически прочнее и труднее разлагается, чем сгусток, состоящий из такого же количества фибрина, но из толстых волокон или в меньшей степени поперечно-связанных волокон. Эксперимент, показанный на фиг.2, иллюстрирует, что дополнительный FXIII (30 нМ) пролонгирует время лизиса фибринового сгустка, образованного в присутствии rFVIIa и активатора тканевого плазминогена (t-PA, American Diagnostica). Образование сгустка индуцировали в присутствии или в отсутствие 30 нМ FXIII путем добавления 25 мкл NHP к 225 мкл 20 нМ Hepes, 150 мМ NaCl, 5 мМ CaCl2, рН 7,4, содержащему 50 нМ rFVIIa и 0,5 нМ рекомбинантного t-PA. Образование сгустка и последующий лизис сгустка, индуцированное t-PA-опосредованной активацией плазминогена, регистрировали с помощью Spectramax™ 340 при 600 нм как повышение ОП600 нм после реверсии следа до исходного уровня. На фиг.2 показано, что время лизиса сгустка в данных условиях достоверно увеличивалось присутствием FXIII.
Пример 3
Фактор VIIa в комбинации с фактором XIII повышает максимальную прочность сгустка и повышает устойчивость сгустка к фибринолизису
Измерения с помощью тромбоэластографии проводили на цитратной нормальной человеческой плазме с добавлением 6 нМ рекомбинантного активатора тканевого плазминогена (t-PA, American Diagnostica) и анализировали эффект добавления 1 нМ rFVIIa (Novo Nordisk A/S Bagsvaerd, Дания) в отдельности или в комбинации с различными концентрациями фактора XIII (FXIII, Haematologic Technologies, HCXIII-0160, лот №1212). Свертывание инициировали добавлением Innovin (конечная концентрация соответствует 2000-кратному разведению, Dade Behring # 526945) и кальция (конечная концентрация 15 мМ) в буфере 20 нМ Hepes, 150 мМ NaCl, рН 7,4.
Измерения с помощью тромбоэластографии использовали для анализа влияния rFVIIa и FXIII на максимальную прочность сгустка (MCF), а также на устойчивость сгустка к t-PA-опосредованному лизису. Перед добавлением rFVIIa и/или FXIII полученная MCF составляла 25 мм, а время, которое требовалось для лизиса половины сгустка, составляло 12,3 минуты (фиг.3). Добавление повышающихся концентраций FXIII (0-40 нМ) не изменяло MCF; однако наблюдалось дозозависимое пролонгирование лизиса половины сгустка, оптимальное при 30 нМ FXIII (время полулизиса сгустка: 14,3 мин, фиг.3). Подобно этому, добавление rFVIIa (1 нМ) приводило к защите сгустка от tPA-опосредованного фибринолиза (время полулизиса сгустка: 16,4 мин) при отсутствии какого бы то ни было влияния на MCF (фиг.3). Однако после добавления rFVIIa (1 нМ) вместе с FXIII (30 нМ) наблюдалось повышение MCF (29 мм), а также выраженная защита от фибринолиза (время полулизиса сгустка: 27,1 мин) (фиг.3). Вместе данные результаты показывают, что добавление к плазме rFVIIa и FXIII синергическим образом улучшают механическую прочность и резистентность сгустка к tPA-опосредованному фибринолизу.
Изобретение относится к области фармации. Сущность его заключается в разработке композиции для внутривенного введения при лечении или профилактике эпизодических кровотечений и нарушений свертываемости крови. Композиция содержит фактор VIIa и фактор XIII, композиция дополнительно может содержать ингибитор TFPI. Другими объектами настоящего изобретения являются набор, содержащий фактор VIIa и фактор XIII в дозированной форме и соответствующий фармацевтически приемлемый носитель; применение композиции; способ усиления образования фибринового сгустка; способ лечения эпизодического кровотечения. Технический результат - повышение эффективности терапии эпизодических кровотечений и нарушений свертываемости крови. 5 н. и 16 з.п. ф-лы, 3 ил., 1 табл.
а) эффективное количество фактора VIIa и фармацевтически приемлемый носитель в первой дозированной лекарственной форме;
b) эффективное количество фактора XIII и фармацевтически приемлемый носитель во второй дозированной лекарственной форме и
c) контейнер для размещения в нем указанных первой и второй дозированных лекарственных форм.
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Wlodaver et al, FEBS Letters, 1992, v.309, p.59-64. | |||
Авторы
Даты
2006-03-27—Публикация
2001-05-10—Подача