Область техники, к которой относится изобретение
Изобретение относится к биотехнологии, в частности к генетической инженерии, и может быть использовано в микробиологической промышленности для разработки экономичных и легко масштабируемых методов получения рекомбинантного гранулоцитарного колониестимулирующего фактора человека (G-CSF). Предлагаются:
- синтетический ген G-CSF, нуклеотидная последовательность которого оптимизирована для экспрессии в клетках Escherichia coli и характеризуется последовательностью SEQ ID №1;
- рекомбинантная плазмида pAS017, обеспечивающая высокий уровень экспрессии G-CSF в клетках Escherichia coli и содержащая ген G-CSF с последовательностью SEQ ID №1 под контролем промотора гена 10 бактериофага Т7 и терминатора Т7.
Уровень техники
Колониестимулирующие факторы - группа гематопоэтических белков, которые стимулируют пролиферацию и дифференцировку гемопоэтических клеток из плюрипотентных стволовых клеток. Специфичными для гранулоцитов и макрофагов являются факторы G-CSF, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и макрофагальный колониестимулирующий фактор (M-CSF). G-CSF специфично усиливает продукцию нейтрофилов, выполняющих защитную функцию организма в борьбе с бактериальными и грибными инфекциями. В качестве медицинского препарата G-CSF используется для реабилитации онкобольных с нейтропенией, вызванной химиотерапией и облучением. Ген G-CSF человека расположен на хромосоме 17 в локусе q21-q22, насчитывает 5 экзонов и 4 интрона [1]. Экспрессия гена G-CSF, которая увеличена в некоторых опухолевых линиях, за счет альтернативного сплайсинга приводит к образованию двух изоформ белка размером 207 и 204 аминокислоты. Первые 30 аминокислот обоих белков являются сигнальными последовательностями. Зрелый белок размером в 174 аминокислоты обладает более высокой биологической активностью, чем зрелый белок другой изоформы размером 177 аминокислот. Хотя природный G-CSF и О-гликозилирован по остатку Thr-133, эта модификация не влияет на биологическую активность и стабильность белка. Негликозилированный G-CSF, полученный в клетках Е. coli, так же активен, как белок из клеток млекопитающих [2-4].
Получение биологически активного рекомбинантного G-CSF в промышленно-значимых масштабах является сложной задачей и требует создания эффективных рекомбинантных штаммов и линий клеток-продуцентов этого белка. Целый ряд патентов описывают методы получения G-CSF в клетках дрожжей, млекопитающих, бактерий и способы очистки белка до гомогенного состояния [5-10].
Наиболее близкими аналогами данного изобретения могут считаться генетические конструкции, раскрытые в патенте РФ 2260049 [5] или патенте РФ 2321424 [9]. В первом приводятся данные по получению плазмиды и экспрессии в Е.сoli содержащейся в ней частично оптимизированной последовательности, кодирующей G-CSF, с выходом 20-30% целевого продукта (от общего клеточного белка). Однако указанный высокий выход белка характерен только для культур с низкой плотностью, поскольку используемый при селекции ампициллин при высокой плотности клеток быстро разрушается клеточными ферментами с нарушением селективных условий среды. В патенте [9] раскрыто получение рекомбинантного вектора для экспрессии ДНК G-CSF с частичной оптимизацией кодонов в E.coli, в котором используется триптофановый промотор, который также известен в уровне техники как в значительной мере ограничивающий процесс получения культур с высокими значениями оптической плотности (25-30 о.е. и более), которые представляют дополнительные возможности для повышения общего выхода целевого продукта.
Настоящее изобретение решает задачу конструирования рекомбинантной плазмиды, обеспечивающего возможность масштабирования процесса с повышением общего выхода целевого белка (технический результат) за счет использования SEQ ID NO:1 в комбинации с вектором-носителем, не содержащим элементов, которые ограничивали бы пригодность системы для работ с культурами высокой плотности. Достижение технического результата подтверждается тем, что при плотности 25-30 о.е. выход белка при использовании плазмиды по изобретению (см. пример 3) составляет 1,5 г/л культуры, что в 1,5-2 раза больше в сравнении с [9].
Раскрытие изобретения
Решение задачи получения вектора, направляющего синтез целевого белка в гетерологичной системе, включает следующие необходимые этапы:
а) дизайн конструкции гена целевого белка, предполагающий оптимальную для транскрипции и трансляции его кодирующую последовательность;
б) выбор клеток-хозяев и создание векторных конструкций для экспрессии гена целевого белка в избранной гетерологичной системе;
в) оптимизация условий продукции целевого белка.
Поставленная цель получить белок на основе G-CSF в клетках Е.coli с высоким выходом достигнута за счет того, что
1) методом олигонуклеотидного синтеза получен ген G-CSF;
2) сконструирована рекомбинантная ДНК плазмидная ДНК pAS017, содержащая ген G-CSF под контролем промотора фага Т7;
3) в результате трансформации экспрессирующей плазмидой pAS017 клеток штамма Е.coli BL21(DE3) получен рекомбинантный штамм Escherichia coli BL21(DE3)/pAS017, характеризующийся высоким уровнем индуцируемого синтеза и стабильной продукцией белка G-CSF.
Нуклеотидную последовательность, кодирующую вариант гена G-CSF с оптимизированным для экспрессии в клетках Е.coli кодоновым составом, получали методом олигонуклеотидного синтеза.
Для создания вектора экспрессии, направляющего в клетках Е.coli белка G-CSF, был использован вектор рЕТМ-50 [11].
Экспрессирующая рекомбинантная плазмида pAS017 была получена путем субклонирования кодирующей последовательности гена G-CSF в вектор рЕТМ-50 по сайтам рестрикции NdeI/BamHI (чертеж).
Путем трансформации клеток штамма Escherichia coli BL21(DE3) [12] сконструированной плазмидой pAS017, отбора и культивирования клонов трансформантов с высоким уровнем синтеза целевого белка был получен рекомбинантный штамм Escherichia coli BL21(DE3)/pAS017 - продуцент белка G-CSF. Синтез G-CSF в полученном рекомбинантном штамме осуществляется при культивировании на обычных селективных средах с добавлением индуктора изопропил-D-тиогалактозида (ИПТГ) или лактозы.
Таким образом, настоящее изобретение включает 2 объекта:
Первый объект - рекомбинантная ДНК, которая кодирует G-CSF и характеризуется нуклеотидной последовательностью SEQ ID №1.
Второй объект - рекомбинантная плазмида pAS017, обеспечивающая синтез белка G-CSF в клетках Escherichia coli и состоящая из фрагмента ДНК с последовательностью SEQ ID №1 и фрагмента плазмиды рЕТМ-50.
Краткое описание чертежа - Физическая и генетическая карты вектора pAS017
Обозначено положение гена G-CSF, других элементов вектора, уникальных сайтов рестрикции.
Осуществление изобретения
При осуществлении изобретения помимо методов, подробно раскрытых в нижеследующих примерах, использовали хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [13].
Пример 1. Дизайн и конструирование гена G-CSF
Дизайн варианта синтетического гена G-CSF, кодирующего зрелый полипептид размером 174 а.о. с дополнительным N-концевым остатком метионина, проводили при помощи программы GeneDesigner [14]. Данная программа позволяет на основании аминокислотной последовательности белка подобрать соответствующую кодирующую последовательность, оптимизированную для экспрессии в выбранном организме-хозяине с учетом характерной частоты встречаемости кодонов и другими характеристиками, способствующими эффективной гетерологичной экспрессии выбранного полипептида. Выведенную таким образом нуклеотидную последовательность гена G-CSF, оптимизированную для экспрессии в клетках Е.coli, разбивали на олигонуклеотиды длиной 40 н.п. с помощью программы DNAworks [15] для последующей сборки гена методом рекомбинантной ПЦР. При дизайне фланкирующих праймеров к их 5′-концевым последовательностям добавляли последовательности, содержащие сайты рестриктаз NdeI и BamHI, для последующего создания экспрессионной конструкции.
Сборку синтетического гена осуществляли в две стадии с использованием оптимизированного ПЦР метода получения синтетических генов [16] с использованием олигонуклеотидов, перечисленных в таблице 1.
На первой стадии проводят ПЦР на смеси праймеров №№1-24 с использованием Taq полимеразы в следующих условиях:
Смесь для ПЦР (100 мкл):
10 мкл 10-кратного ПЦР-буфера («Fermentas");
10 мкл 2,0 мМ dNTP каждого вида;
55 мкл деионизованной воды;
1 мкл ДНК полимеразы («Fermentas");
По 1 мкл каждого из праймеров №№1-24 с концентрацией 5 мкМ.
Условия проведения ПЦР: 94°, 5′ (денатурация), 94°C, 30′′; 50°C, 30′′; 72°C, 40′′ (амплификация), 25 циклов.
1 мкл полученной смеси используют для проведения повторной ПЦР с праймерами №1 и №24 в тех же условиях.
После повторной амплификации ПЦР смесь анализируют электрофорезом в 2% агарозном геле и выявляют гомогенный фрагмент размером около 550 н.п. Фрагмент выделяют из геля с помощью набора Wizard PCR Preps Kit (Promega, США) в соответствии с инструкцией производителя.
Пример 2. Конструирование вектора экспрессии pAS017
Полученный ПЦР фрагмент с геном G-CSF встраивают в состав вектора рЕТМ-50, содержащего промотор фага Т7, обеспечивающий высокий уровень экспрессии гетерологичных генов в штаммах Е.coli, синтезирующих Т7 полимеразу [14]. Для этого 100 нг ПЦР фрагмента, полученного как описано в примере 1, гидролизуют совместно рестриктазами NdeI/BamHI и встраивают с помощью Т4 ДНК лигазы в NdeI/BamHI вектор рЕТМ-50.
Полученной лигазной смесью трансформируют компетентные клетки штамма Escherichia coli XL1-Blue: recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F′proAB lacIqZΔM15::Tn10 (Tetr)] (Stratagene, США) и полученные канамицин-устойчивые трансформанты анализируют методом ПЦР-скрининга с праймерами №1 и №24 (Таблица 1) и отбирают «положительные» клоны, образующие ПЦР фрагменты размером 550 н.п. Несколько «положительных» клонов проверяют секвенированием с использованием этих же праймеров и отбирают клон с геном G-CSF без неспецифических ПЦР-мутаций, который обозначают как pAS017.
Пример 3. Определение продуктивности штамма-продуцента Escherichia coli BL21(DE3)/pAS017
Полученной рекомбинантной плазмидой pAS017 трансформируют штамм Е.coli BL21(DE3) [F-, ompT, hsdSB (rB-, mB-), dcm, gal (DE3)]. Затем трансформированную культуру высевают на твердую селективную питательную среду и инкубируют в течение 18 ч при 37°C. Выбор культуры Е.coli BL21(DE3) в качестве реципиента-штамма для продукции G-CSF обусловлен тем, что он синтезирует РНК-полимеразу фага Т7, а также обладает сниженной протеазной активностью, что способствует повышению выхода целевых белков.
Для определения продуктивности полученного штамма-продуцента Escherichia coli BL21(DE3)/pAS017 выросшими на твердой среде колониями инокулируют 50 мл среды ТВ, содержащей 50 мкг/мл канамицина, из расчета 1 колония на 1 мл и выращивают на орбитальной качалке с амплитудой вращения 50 мм при скорости вращения 300 об/мин и 37°C до оптической плотности А600 около 4,0 о.е., после чего вносят индуктор ИПТГ до конечной концентрации 0,4 мМ и продолжают культивирование до стационарной фазы роста (около 12 ч). Выход рекомбинантного белка оценивают методом электрофореза в ДСН-ПААГ. По данным электрофореза выход G-CSF составляет не менее 1500 мг/л при конечной оптической плотности 25-30 о.е.
Список цитированных источников
1. Avalos B.R. // Blood. 1996. V.88. P.761.
2. Welte К., Gabrilove J., Bronchud M.H., Platzer E., Morstyn G. // Blood. 1996. V.88. P.1907.
3. Lu H.S., Boone T.C, Souza L.M., Lai P.H. // Arch. Biochem. Biophys. 1989. V.268. P.81.
4. Asano S. // Am.J.Pediafr. Hematol. Oncol. 1991. V.13. P.400.
5. Габибов А.Г., Пономаренко Н.А., Воробьев И.И., Демин А.В., Мартьянов В.А., Шустер A.M., Баирамашвили Д.И., Мирошников А.И. РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PES3-7, КОДИРУЮЩАЯ ПОЛИПЕПТИД С ПОСЛЕДОВАТЕЛЬНОСТЬЮ ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА, И ШТАММ ESCHERICHIA COLI BL21(DE3)/PES3-7 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА. Патент на изобретение №2260049 от 24.07.2003.
6. Романов В.П., Назарикова Н.И., Жданов В.В., Афиногенова Г.Н., Гладченко Т.Н., Пустошилова Н.М., Масычева В.И., Синичкина С.А., Сандахчиев Л.С., Гольдберг Е.Д., Дыгай A.M., Поженько Н.С. СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА. Патент на изобретение №2201962 от 19.03.2001.
7 Петровская Л.Е., Крюкова Е.А., Шингарова Л.Н., Кирпичников М.П. РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pFGM17, КОДИРУЮЩАЯ ПОЛИПЕПТИД ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА, И ШТАММ БАКТЕРИЙ Escherichia coli BL21(DE3)/pFGM17 - ПРОДУЦЕНТ ПОЛИПЕПТИДА ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА. Патент на изобретение №2271392 от 15.11.2004.
8. Черновская Т.Е., Пустошилова Н.М., Руденко Е.Г., Денисов Л.А., Кленова А.В., Шоболов Д.Л. СПОСОБ ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ, ОЧИСТКИ И СТАБИЛИЗАЦИИ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА, ПРИГОДНОГО ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ, И ИММУНОБИОЛОГИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ. Патент на изобретение №2278870 от 30.08.2004.
9. Яроцкий С.В., Чувпило С.А., Скрыпин В.И., Могутов М.А., Яковенко А.Р. ПРЕПАРАТ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pSX70, КОДИРУЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ГРАНУЛОЦИТ-КОЛОНИЙСТИМУЛИРУЮЩЕГО ФАКТОРА (Г-КСФ), ШТАММ Escherichia coli SX70 - ПРОМЫШЛЕННЫЙ ШТАММ ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО Г-КСФ И СПОСОБ ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ Г-КСФ. Патент на изобретение №2321424 от 30.10.2006.
10. Ниссен Т.Л., Андерсен К.В., Хансен К.К., Миккельсен Я.М., Скамбюэ Х.Е.КОНЪЮГАТЫ G-CSF. Патент на изобретение №2290411 от 09.01.2001.
11. http://www.embl.de/pepcore/pepcore services/cloning/pdf/pETM-50.pdf
12. Studier, F.W. and Moffatt.B.A. (1986). Use of bacteriophage T7 RNA polymerase to direct selective high-level expression of cloned genes. J. Mol. Biol. 189, 113-130.
13. Ausubel F.M., Brent R.G., Kingston R.E., Moore D.D., Seidman J.G., Smith J.A., Struhl K.A. Current Protocols in Molecular Biology. Massachusets General Hospital and Harvard Medical School, John Willey&Sons Inc., 1994.
14. Villalobos A, Ness JE, Gustafsson C, Minshull J, Govindarajan S. (2006) Gene Designer: a synthetic biology tool for constructing artificial DNA segments. BMC Bioinformatics. 2006 Jun 6; 7:285.
15. Hoover DM, Lubkowski J (2002). DNAWorks: an automated method for designing oligonucleotides for PCR-based gene synthesis. Nucleic Acids Res.30(10)e43.
16. Dong В, Мао R, Li B, Liu Q, Xu P, Li G. (2007) An improved method of gene synthesis based on DNA works software and overlap extension PCR. Mol. Biotechnol. 37(3):195.
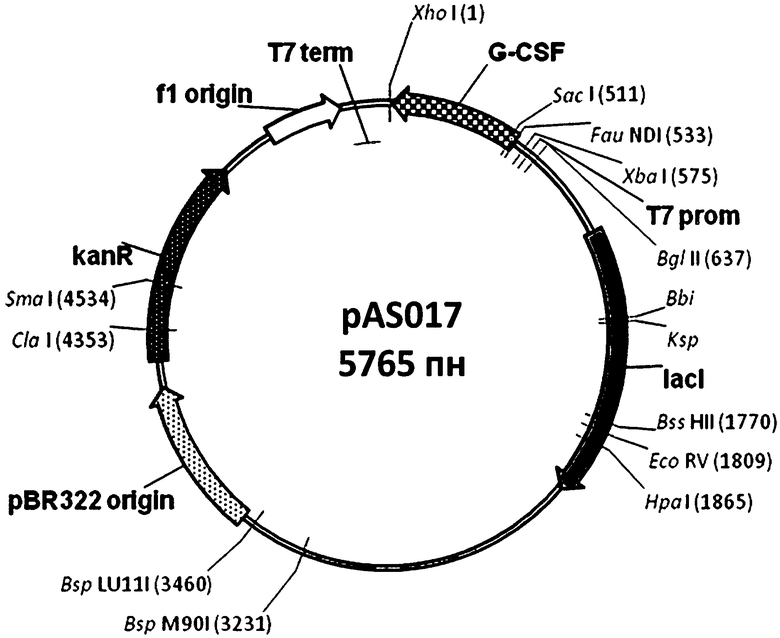


Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению G-CSF, и может быть использовано для продуцирования G-CSF в клетках Е.coli. Для эффективной продукции белка в клетках Е.coli оптимизируют последовательность ДНК, кодирующую G-CSF. На основе полученной оптимизированной последовательности ДНК конструируют плазмиду pAS017, которая включает также NdeI/BamHI-фрагмент ДНК вектора рЕТМ-50 и имеет физическую карту, представленную на чертеже. 2 н.п. ф-лы, 1 ил., 1 табл., 3 пр.
1. Рекомбинантная ДНК, кодирующая G-CSF, нуклеотидная последовательность которой оптимизирована для продукции белка в клетках Е.coli и характеризуется SEQ ID NO:1.
2. Рекомбинантная плазмида pAS017, предназначенная для экспрессии G-CSF в клетках E.coli, которая состоит из
NdeI/BamHI-фрагмента ДНК, содержащего рекомбинантную ДНК по п.1, и
NdeI/BamHI-фрагмента ДНК вектора рЕТМ-50, которые объединены между собой согласно схеме, представленной на фиг.1.
Авторы
Даты
2014-09-27—Публикация
2011-03-02—Подача