Изобретение относится к биотехнологии, в частности к генной и белковой инженерии, и может быть использовано для получения рекомбинантного интерферона β-1b человека.
Интерферон β человека (ИФН β, синоним: фибробластный интерферон) секретируется, главным образом, фибробластами. ИФН β человека представляет собой гликопротеин с молекулярной массой около 20 кДа. Пептидная часть ИФН β представлена 166 аминокислотными остатками и содержит три цистеиновых аминокислотных остатка и один внутримолекулярный дисульфидный мостик. ИФН β обладает иммуномодулирующей, антипролиферативной, антивирусной и антимикробной активностью. Существуют лекарственные формы на основе интерферона β-1а (ИФН β-1а), получаемого экспрессией природного гена интерферона β в клетках млекопитающих. ИФН β-1а гликозилирован и имеет природную аминокислотную последовательность, т.е. идентичен природному ИФН β. Так как гликозилирование не является обязательным для биологической активности ИФН β, становится привлекательным использование удобной и дешевой бактериальной экспресии взамен дорогостоящей экспрессии в клетках млекопитающих. Интерферон β-1b (ИФН β-1b) человека - искусственно созданная, адаптированная для экспрессии в бактериях, негликозилированная форма интерферона β, несущая замену цистеина в положении 17 на серин и делецию N-концевого метионина. Замена цистеина в положении 17 на серин устраняет причину образования димеров за счет дисульфидных связей. Интерферон β-1b сохраняет все биологические свойства природного интерферона β, но, благодаря внесенным изменениям, существенно упрощается технология получения лекарственных препаратов на его основе [Derynck R., Content J., DeClercq E., Volckaert G., Tavernier J., Devos R., Fiers, W. // Isolation and structure of a human fibroblast interferon gene. Nature, 1980, v.285, p.542-547. Lin L. // Betaseron. Dev. Biol. Stand. 1998, v.96, p.97-104. Пат. США №4737462, C 12 N 1/20, 1988].
ИФН β осуществляет свое действие через связывание со специфическим рецептором [Stark G.R., Kerr I.M., Williams B.R., Silverman R.H., Schreiber R.D.//How cells respond to interferons. Annual; Review of Biochemistry, 1998, v.67, p.227-264].
Лекарственная форма ИФН β-1b (Бетаферон (Шеринг АГ, Германия)) широко используется в медицине для терапии рассеянного склероза.
Известен способ получения рекомбинантного ИФН β-1а в клетках млекопитающих [пат. США №5795779, C 12 N 15/22, 1998]. Недостатками этого способа являются низкий выход (200-600 млн Ед с 1 л культуры клеток), длительное время экспрессии (4-6 суток) и высокая себестоимость.
Известен способ получения рекомбинантного ИФН β в дрожжевых клетках Pichia Pastoris [пат. РФ №2180687, C 12 N 1/19, 2002]. Недостатками этого способа являются низкий выход (120 млн Ед с 1 л культуры клеток) и длительное время экспрессии (6 суток).
Известен способ получения рекомбинантного ИФН β (не ИФН β-1b) в клетках Escherichia coli [SU 1703692, C 12 N 15/23, 1992]. В этом случае продукт будет отличаться от ИФН β-1b только одной аминокислотой в положении 17 (в ИФН β-цистеин, в ИФН β-1b - серин). Недостатком этого способа является олигомеризация полученного белка в процессе ренатурации, что сделало невозможным его дальнейшее использование для производства лекарственных препаратов.
Известен наиболее близкий к заявленному способ получения ИФН β-1b, заключающийся в биосинтезе клетками бактерий Escherichia coli рекомбинантного ИФН β-1b [пат. США №4737462, C 12 N 1/20, 1988]. Получение ИФН β-1b в этом изобретении достигается посредством конструирования плазмиды pSY2501 и продуцента, полученного трансформацией штамма Escherichia coli MM294 этой плазмидой. Плазмида pSY2501 несет под триптофановым промотором природный ген ИФН β с заменой Т→А для замены цистеина 17 на серин. Недостатками плазмиды pSY2501 и продуцента на ее основе являются мутированный природный ген ИФН β и триптофановый промотор. Природный ген содержит редко встречающиеся в генах Escherichia coli (минорные) кодоны, что приводит к снижению уровня биосинтеза белка, составляющего 600 млн Ед с 1 л культуры клеток (таблица 1, пример 4, пат. США №4737462). Использование триптофанового промотора ограничивает использование питательных сред для ферментации только средами, не содержащими триптофан, и значительно увеличивает время ферментации (до 15-25 часов).
Изобретение решает задачу конструирования плазмиды, детерминирующей синтез рекомбинантного белка, и создания высокопродуктивного бактериального штамма-продуцента, позволяющего получать рекомбинантный ИФН β-1b с высоким выходом (170-200 мг (5,3-6,4 млрд. Ед) с 1 л культуры клеток) и по упрощенной технологии за счет уменьшения общего времени ферментации до 8 часов.
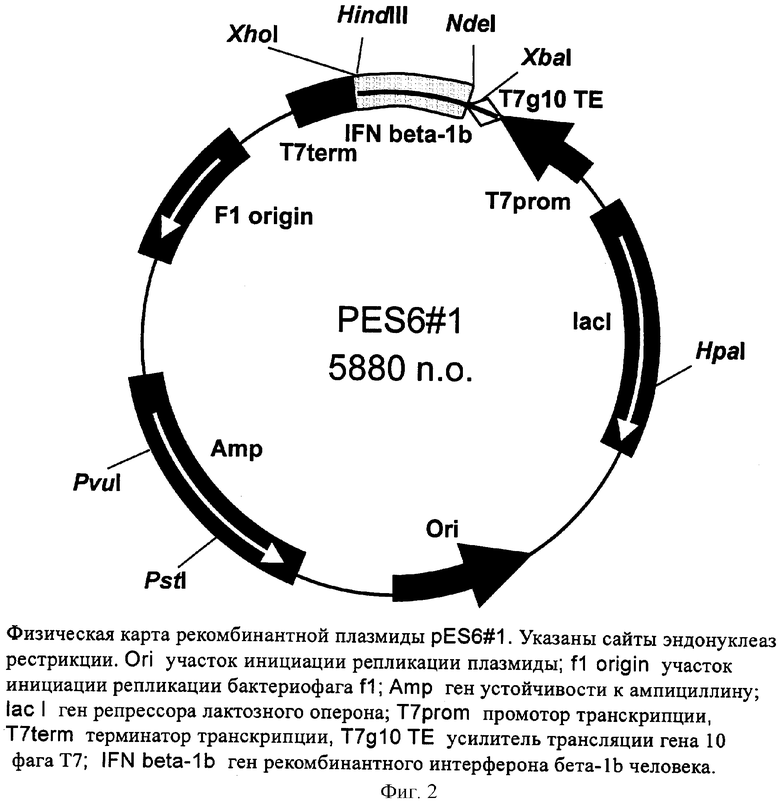
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pES6-1, кодирующей полипептид с последовательностью ИФН β-1b, имеющей молекулярную массу 3,61 МДа (5880 п.о.); состоящей из NdeI/HindIII-фрагмента ДНК плазмиды рЕТ22b(+), содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы и усилитель трансляции гена 10 фага Т7, и NdeI/HindIII-фрагмента ДНК, содержащего последовательность искусственного гена рекомбинантного ИФН β-1b; содержащей в качестве генетического маркера ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pES6-1 клеток Е.coli к ампициллину; содержащей уникальные сайты узнавания эндонуклеаз рестрикции, расположенные на следующем расстоянии вправо от сайта NdeI: XbaI - 38 п.о., HpaI - 1332 п.о., PstI - 4065 п.о., Pvul - 4190 п.о., XhoI - 5363 п.о., а также за счет штамма-продуцента Escherichia coli BDEES6, содержащего рекомбинантную плазмидную ДНК pES6-1 - продуцента рекомбинантного ИФН β-1b. Предлагаемый штамм обеспечивает синтез рекомбинантного ИФН β-1b в количестве 10-12% от суммарного содержания белка клеток.
Преимущества предлагаемого изобретения заключаются, во-первых, в использовании при химико-ферментативном синтезе гена ИФН β-1b максимально широкого набора кодонов, являющихся оптимальными для продукции белка в Escherichia coli; расположение которых в синтетическом гене устраняет возможность образования на синтезируемой мРНК протяженных "шпилек", потенциально ингибирующих трансляцию. На фиг.1 приведена аминокислотная последовательность ИФН β-1b и соответствующая ей нуклеотидная последовательность гена, а также аминокислотная и нуклеотидная последовательности природного гена ИФН β. Во-вторых, применение для биосинтеза рекомбинантного белка оптимальных регуляторных элементов, контролирующих его экспрессию: Т7-lac промотора для предотвращения базальной экспрессии гена до момента начала индукции и высокого уровня транскрипции соответствующей мРНК при индукции, высокоэффективного терминатора транскрипции Т7, и блока стоп-кодонов, исключающих биосинтез удлиненных вариантов рекомбинантного ИФН β-1b. Преимущества предлагаемого штамма Е.coli BL21(DE3) заключаются в использовании бактерий с фенотипом Lon OmpT, что исключает возможность протеолитического расщепления синтезируемого de novo рекомбинантного ИФН α-2b и загрязнения выделяемого белка наиболее активными протеазами Е.coli. Также BL21(DE3) несет ген Т7-РНК полимеразы, что при использовании Т7-lac промотора и Т7 терминатора в плазмиде pES4-4 приводит к быстрой и эффективной продукции белка клетками Е.coli и, в отличие от плазмиды pSS5, существенно расширяет выбор питательных сред для ферментации.
Конструирование нового гена, кодирующего ИФН β-1b человека, осуществляют на основе плазмиды рЕТ22b(+). Искусственный ген, кодирующий ИФН β-1b, фланкированный сайтами рестриктаз NdeI и HindIII, получают химико-ферментативным синтезом набора олигонуклеотидных фрагментов с последующей их сборкой и амплификацией при помощи полимеразной цепной реакции (ПЦР). Перед лигированием для генерации липких концов амплификат и векторную плазмиду обрабатывают рестриктазами NdeI и HindIII. Лигазную смесь используют для трансформации компетентных клеток Е.coli DH5α. Отбор положительных клонов проводят при помощи ПЦР с использованием специфических праймеров, с последующим рестриктным анализом выделенной плазмидной ДНК рестриктазами NdeI и HindIII. Структуру гена, кодирующего рекомбинантный ИФН β-1b, определяют секвенированием по методу Сенгера. Она должна полностью соответствовать нуклеотидной последовательности исходного искусственного гена ИФН β-1b (фиг.1).
Рекомбинантная плазмидная ДНК pES6-1, кодирующая полипептид ИФН β-1b, характеризуется следующими признаками:
- имеет молекулярную массу 3,61 МДа;
- кодирует полипептид ИФН β-1b;
- состоит из: NdeI/HindIII-фрагмента ДНК плазмиды рЕТ22b(+), содержащей промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы, и NdeI/HindIII-фрагмента ДНК, включающего искусственный ген ИФН β-1b;
- имеет уникальную совокупность признаков: промотор и терминатор транскрипции РНК-полимеразы бактериофага Т7, усилитель трансляции гена 10 бактериофага Т7; искусственный ген, кодирующий ИФН β-1b; ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pES6-1 клеток Е.coli к ампициллину; уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии вправо от сайта NdeI: XbaI - 38 п.о., HpaI - 1332 п.о., PstI - 4065 п.о., Pvul - 4190 п.о., XhoI - 5363 п.о.
Для получения штамма-продуцента рекомбинантного ИФН β-1b плазмидную ДНК pES6-1 используют для трансформации компетентных клеток Escherichia coli BL21(DE3) и проводят отбор клонов, сохраняющих уровень биосинтеза рекомбинантного полипептида не ниже 10-12% от суммарного клеточного белка в течение по крайней мере шести последовательных пассирований. Для этого клоны трансформированных плазмидой pES6-1 клеток Е.coli BL21(DE3) выращивают в богатой среде (YT-, LB-бульон и др.) с добавлением ампициллина до 100 мкг/мл и раствора глюкозы до 1% в течение 12-14 часов, инокулируют новую порцию питательной среды в соотношении 1:100, растят культуру до достижения оптической плотности 1 О.Е., индуцируют изопропилтио-β-D-галактозидом, и растят еще 3-6 часов. Получение из клеток продуцента рекомбинантного ИФН β-1b включает следующие стадии: отделение бактерий от культуральной среды, их разрушение одним из обычно применяемых способов; отмывку буферными растворами телец включения от водорастворимых компонентов клетки; солюбилизацию и восстановление целевого белка, его рефолдинг и окончательную очистку.
Полученный штамм-продуцент Escherichia coli BDEES6 характеризуется следующими признаками.
Морфологические признаки клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки: при росте на агаризованной среде LB колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или YT-бульоне) образуют интенсивную ровную муть.
Физико-биологические признаки: клетки растут при температуре от 4°С до 40°С при оптимуме рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам: клетки проявляют устойчивость к ампициллину (до 500 мкг/мл), обусловленную наличием в плазмиде гена β-лактамазы (bla).
Преимущества предлагаемого штамма-продуцента заключается в использовании бактерий с фенотипом Lon OmpT, что исключает возможность протеолитического расщепления синтезируемого de novo рекомбинантного ИФН β-1b и загрязнения выделяемого белка наиболее активными протеазами E.coli.
Клетки Е.coli BDEES6 являются суперпродуцентом. При индукции изопропилтио-β-D-галактозидом, происходит эффективный биосинтез рекомбинантного ИФН β-1b, который накапливается в клетках в количестве более 10% суммарного белка бактерий.
На фиг.1 представлена нуклеотидная последовательность и кодируемая ею аминокислотная последовательность NdeI/HindIII-фрагмента плазмиды pES6-1; на фиг.2 - физическая карта плазмиды pES6-1.
Изобретение иллюстрируют примеры.
Пример 1.
Конструирование рекомбинантной плазмидной ДНК pES6-1.
Нуклеотидную последовательность, соответствующую гену ИФН β-1b, получают химико-ферментативным синтезом. Для этого теоретически расчитанную последовательность ДНК разбивают на перекрывающиеся фрагменты размером 45-55 п.о. Химический синтез олигонуклеотидов, соответствующих этим фрагментам, выполняют твердофазным фосфоамидитным методом при помощи, например, ДНК-синтезатора ASM-102U (БИОССЕТ, Новосибирск) с наращиванием олигонуклеотидной цепи в направлении от 3'-конца к 5'-концу с помощью защищенных фосфамидитов - 5'-диметокситритил-N-ацил-2'-дезоксинуклеозид-3'-O-(β-цианэтилдиизопропиламино)-фосфитов, активированных тетразолом. Синтез проводят в масштабе 0,5-0,7 мкмоль, используя в качестве носителя пористое стекло (размер пор 500 Å), к которому через 3'-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 20-30 мкмоль/г). Полученные олигонуклеотиды подвергают 5'-концевому фосфорилированию с использованием Т4 полинуклеотидкиназы (Fermentas, Литва). Для этого олигонуклеотиды в количестве 20 пмоль смешивают с ферментом в количестве 10 ед. в буферном растворе, содержащем 50 мМ Tris-HCl (pH 7.6 при 25°С), 10 мМ MgCl2, 5 мМ дитиотреита, 1 мМ спермидина, 0.1 мМ АТФ и 0.1 мМ ЭДТА. Реакцию ведут 30 минут, полинуклеотидкиназу инактивируют нагреванием до 65°С в течение 10 мин.
Фосфорилированные олигонуклеотиды смешивают в эквимолярном соотношении в 50 мкл буфера, содержащего 20 мМ трис-HCl, pH 7,56, 10 мМ MgCl2, 0,2 мМ rATP, 10 мМ дитиотреита, прогревают до 65°С, медленно охлаждают до 37°С в течение часа и добавляют 10 ед.ак. Т4-ДНК-лигазы. Реакцию лигирования ДНК проводят 4 ч при 37°С. 0.1 мкл полученного раствора используют в качестве матрицы в полимеразной цепной реакции (ПЦР) в присутствии термостабильной ДНК-полимеразы Pfu и специфических праймеров:
5' ATAATATCATATGTCTTATAACCTGCTGGGTTTTCTGCAACGTTCTTCTAACTTTCAA 3' и 5' TATATTAAAGCTTTCATTAGTTACGCAGATAACCAGTCAGA 3'.
Проводят 25 циклов амплификации (95°С, 20 с; 62°C, 40 с; 72°С, 60 с) для синтеза полноразмерного фрагмента ДНК, содержащего последовательность гена ИФН β-1b, фланкированного сайтами узнавания рестриктаз NdeI и HindIII. Продукт амплификации гидролизуют рестриктазами NdeI и HindIII, очищают электрофорезом в 5% акриламидном геле, полосу ДНК величиной около 500 п.о. выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.
Для приготовления вектора ДНК плазмиды рЕТ-22b(+) (3 мкг, 1 пмоль) обрабатывают в 40 мкл буфера R (10 мМ трис-HCl, рН 8,5, 10 мМ MgCl2, 100 мМ KCl, 0,1 мг/мл BSA) рестриктазами NdeI (10 ед.акт.) и HindIII (10 ед.акт.) в течение 1 ч при 37°С. Полученный фрагмент ДНК величиной 5,4 т.п.о. после электрофоретического разделения в 1% агарозном геле выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.
1 мкг полученного векторного фрагмента лигируют с 2 пмоль NdeI/HindIII-фрагмента размером 500 п.о., содержащего синтетический ген рекомбинантного ИФН β-1b, в 10 мкл буфера (20 мМ трис-HCl, рН 7,56, 10 мМ MgCl2, 0,2 мМ гАТР, 10 мМ дитиотреита) с помощью 10 ед.акт.Т4-ДНК-лигазы в течение 12 ч при 10°С.
1 мкл полученной лигазной смеси используют для электротрансформации компетентных клеток Е.coli BL21(DE3), которую проводят, например, при помощи аппарата для электротрансформации ВТХ600 при зазоре между пластинами электропорационной кюветы 1 мм и напряжении разряда 1.4 кВ. После трансформации суспензию бактерий смешивают с питательной средой SOC, растят 1 час на +37°С и высевают на чашки Петри с LB-агаром, содержащим 50 мкг/мл ампициллина.
Первичный отбор клонов, содержащих нужную плазмиду, проводят методом "ПЦР с клонов" с использованием специфических праймеров:
5' ATAATATCATATGTCTTATAACCTGCTGGGTTTTCTGCAACGTTCTTCTAACTTTCAA 3' и 5' TATATTAAAGCTTTCATTAGTTACGCAGATAACCAGTCAGA 3'.
Проводят 25 циклов амплификации (95°С, 20 с; 62°С, 40 с; 72°С, 60 с) с последующим электрофоретическим анализом ПЦР продуктов в 1% агарозном геле на наличие ПЦР-продукта длиной около 500 п.н. Отобранные клоны используют для подроста в жидкой среде и выделения плазмидной ДНК плазмиды, которую анализируют на наличие вставки с помощью эндонуклеаз рестрикции NdeI и HindIII с последующим разделением продуктов гидролиза в 5% полиакриламидном геле. Окончательное строение плазмид, содержащих NdeI/HindIII-фрагмент около 500 п.о., подтверждают определением нуклеотидной последовательности методом секвенирования по Сенгеру. По данным секвенирования отбирают ту плазмиду, нуклеотидная и соответствующая ей аминокислотная последовательности NdeI/HindIII-фрагмента которой полностью идентичны первоначально запланированной (фиг.1). Проводят трансформацию клеток Е.coli BL21(DE3) выбранной плазмидой, как описано выше, петлей переносят 5-10 колоний в 5 мл жидкой среды 2xYT, содержащей 50 мкг/мл ампициллина, в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, отбирают аликвоту культуры для последующего анализа, прибавляют индуктор - изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают рост еще 2 ч. Равные аликвоты суспензии клеток, отобранных до внесения индуктора и после завершения роста центрифугируют, отделяют супернатант и анализируют осадок клеток электрофорезом в ПААГ, как описано в примере 2. Появление отчетливо видимой полосы белка в районе 20 кДа в образце пробы, отобранной после индукции, свидетельствует о способности штамма синтезировать рекомбинантный ИФН β-1b при индукции IPTG и полностью подтверждает корректность сборки плазмиды.
Пример 2.
Получение штамма-продуцента Е.coli BDEES6 с рекомбинантным ИФН β-1b и определение его продуктивности.
Штамм-продуцент Е.coli BL21(DE3)/pES6-1 получают трансформацией компетентных клеток Е.coli BL21(DE3) плазмидой pES6-1, как описано в примере 1.
Штамм продуцента Е.coli BDEES6 выращивают при 37°С в 100 мл YT-бульона (рН 7,0) с 50 мкг/мл ампициллина в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, прибавляют изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают процесс еще 6 ч. Таким образом, общее время ферментации составляет 8 ч. Каждый час отбирают пробу по 2 мл, определяют А550 и количество культуры, соответствующее 1 мл с А550 1,0, центрифугируют 5 мин при 6000 об/мин. Осажденные клетки в 100 мкл лизирующего буфера с красителем бромфеноловым синим обрабатывают 20 сек ультразвуком, нагревают 3 мин при 100°С и пробы по 1 мкл используют для электрофореза в 15% SDS-ПААГ. Гель прокрашивают кумасси R-250 по стандартной методике и сканируют для определения относительного количества белка в полосе целевого белка. По данным сканирования содержание рекомбинантного ИФН β-1b составляет 10-12% от всех клеточных белков, что позволяет получать 170-200 мг (5,3-6,4 млрд. Ед) интерферона d-1b человека с 1 л культуры клеток.

Изобретение относится к области биотехнологии, генной и белковой инженерии и может быть использовано в медицине и в фармацевтической промышленности. На основе плазмиды рЕТ22b(+) и фрагмента ДНК, содержащего последовательность искусственного гена интерферона β-1b человека, сконструирована плазмидная ДНК pES6-1, обеспечивающая экспрессию рекомбинантного интерферона β-1b человека. Получен штамм Escherichia coli BDEES6 (BL21(DE3)/pES6-1) - продуцент рекомбинантного интерферона β-1b человека. Применение изобретения позволяет увеличить выход рекомбинатного интерферона β-1b человека. 2 н.п. ф-лы, 2 ил.
NdeI/HindIII-фрагмента ДНК плазмиды рЕТ22b(+), содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы и усилитель трансляции гена 10 фага Т7,
NdeI/HindIII-фрагмента ДНК, содержащего последовательность искусственного рекомбинантного интерферона β-1b человека, приведенную на рис.1,
и содержащая ген β-лактамазы, детерминирующий устойчивость трансформированных плазмидой pES6-1 клеток Е. coli к ампицилину, в качестве генетического маркера.
Авторы
Даты
2005-10-10—Публикация
2004-01-15—Подача