Настоящее изобретение относится к новой соли ингибитора ренина, 2(S),4(S),5(S),7(S)-N-(3-амино-2,2-диметил-3-оксопропил)-2,7-ди(1-метилэтил)-4-гидрокси-5-амино-8-[4-метокси-3-(3-метоксипропокси)фенил]октанамида, формулы
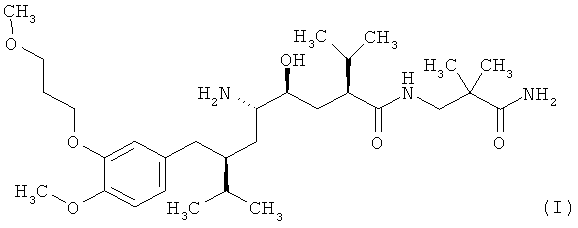
Международное непатентованное название указанного соединения - алискирен, как описано в EP 678503 A.
Активный ингредиент алискирен представляет собой свободное основание, которое более подробно описано в EP 678503 A и содержит одну основную группу, аминогруппу в положении 5. рKа указанной группы составляет 9,79. Таким образом, одна кислотная группа связывается с неподеленной парой азота в составе аминогруппы.
В EP 678503 A описан гидрохлорид (пример 137) и полуфумарат (пример 83) в качестве специфических солей алискирена. Однако не упоминаются специфические свойствах этих солей. В настоящее время активный ингредиент, алискирен, в форме полуфумарата находится на стадии разработки в качестве антигипертензивного агента. В отличие от свободного основания и гидрохлорида, полуфумарат в большей степени поддается переработке, он кристаллизуется, по крайней мере, частично, указанную соль получают простым способом. Более того, установлено, что сильные кислоты в отличие от слабых кислот не образуют устойчивых солей алискирена.
Температура плавления полуфумарата в открытом тигле составляет 96,6°С (скорость нагревания 10 К/мин), а энтальпия плавления составляет 28,9 Дж·г-1.
При переработке полуфумарата алискирена возникают значительные трудности. Обычно при получении галенового состава, содержащего полуфумарат алискирена, требуется добавлять значительные количества лекарственной субстанции (ЛС), свойства которой затрудняют переработку в таблетки.
Например, полуфумарат алискирена образует игольчатые кристаллы, которые отрицательно влияют на объемные свойства ЛС, например текучесть и объемную плотность. ЛС практически не поддается прессованию, что приводит к ослаблению связи между частицами и изменениям полиморфизма под давлением и/или аморфизации при сжатии. Полуфумарат алискирена характеризуется значительной эластичностью, что также приводит к ослаблению связи между частицами. В связи с высокой дозой (вплоть до 300 или 600 мг свободного основания в составе таблетки) требуется высокое содержание ЛС в таблетке приемлемого размера.
Качество ЛС в значительной степени изменяется и влияет на пригодность для переработки в таблетки, например распределение частиц по размерам, объемная плотность, текучесть, смачиваемость, площадь поверхности и склонность к слипанию. Более того, алискирен характеризуется высокой гигроскопичностью. При контакте с водой полиморфная структура ЛС изменяется на аморфную, при этом снижается стабильность по сравнению с кристаллическим состоянием. В связи с указанными недостатками при получении стандартной таблетки возникают значительные трудности.
Прямое прессование не пригодно для стандартного получения лекарственной формы из-за, например, высокой гигроскопичности, иглообразной структуры частиц, низкой текучести, в результате возникают проблемы при переработке и получении равномерного распределения ЛС в лекарственной форме. При ротационном сжатии наблюдается снижение высокой объемной плотности ЛС. Однако предварительное сжатие ЛС в процессе ротационного сжатия еще более усложняет дальнейшее прессование в таблетки, обладающие достаточной твердостью и низкой хрупкостью, без большого количества эксципиентов из-за низкой способности ЛС к сжатию. Было установлено, что таблетка, содержащая более приблизительно 35% алискирена, не удовлетворяет критериям стандартных таблеток (например, в отношении хрупкости, твердости) и такие таблетки нельзя получить стандартно воспроизводимым способом (например, в отношении слипания и извлечения из формы в процессе ротационного сжатия и таблетирования).
Как указано выше, низкая кристалличность, гигроскопичность и относительно низкая стабильность, прежде всего, в присутствии влаги значительно усложняют процесс получения, прежде всего, при получении конечного продукта. Как правило, продолжительность процессов, таких как фильтрация и сушка, значительно увеличивается в связи с указанными выше нежелательными свойствами полуфумарата алискирена. Полуфумарат алискирена также чувствителен к процессу грануляции.
Следовательно, несмотря на значительную эффективность алискирена в качестве ЛС, указанные нежелательные свойства значительно снижают экономичность процесса получения лекарственной формы алискирена. Следовательно, все еще существует необходимость в разработке стабильных, например кристаллических, форм алискирена, которые еще в большей степени поддаются переработке при сушке, фильтрации или грануляции после конечной стадии химического синтеза и на стадиях получения фармацевтических составов. Все предпринятые ранее попытки разработки улучшенных форм препарата в виде соли, по возможности с высокой кристалличностью, наряду с физической и химической стабильностью, оказались неудачными.
Было установлено, что получение солей алискирена с требуемыми предпочтительными свойствами является сложной задачей. В большинстве случаев, например, образуются аморфные соли с низкой стабильностью (такие как твердые пены, воски или масла). В результате подробных исследований было установлено, что соль алискирена по настоящему изобретению является наиболее предпочтительной по сравнению с полуфумаратом алискирена.
Настоящее изобретение относится к соли соединения формулы I
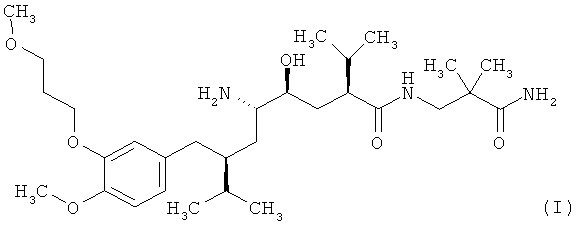
и оротовой кислоты или соответственно аморфной форме, сольвату, прежде всего гидрату, а также к их полиморфной форме.
Оротовая кислота, т.е. витамин В13, является известным химическим соединением, широко используемым в качестве пищевой добавки кроме других областей ее применения. По этой причине ее использование в качестве солеобразующего агента для алискирена не представляет никаких проблем в отношении токсичности и других аналогичных свойств. Напротив, оротат алискирена представляет собой безопасную и эффективную форму введения алискирена.
Предпочтительные соли выбирают, например, из
оротата
алискирена в аморфной форме или
оротата алискирена в кристаллической или частично кристаллической форме.
Соль по настоящему изобретению предпочтительно существует в очищенной и практически очищенной форме, например степень очистки составляет >95%, предпочтительно >98%, прежде всего >99%. Энантиомерная чистота солей по настоящему изобретению составляет более >98%, предпочтительно >99%.
По сравнению с полуфумаратом, соль по настоящему изобретению или ее аморфные формы, сольваты, такие как гидраты и их соответствующие полиморфные формы, характеризуются неожиданно улучшенными свойствами. В определенных условиях кристаллическая соль и кристаллический гидрат соли характеризуются четкой температурой плавления, которая связана со значительной эндотермической энтальпией плавления. Кристаллическая соль по настоящему изобретению является стабильной и характеризуется более высоким качеством по сравнению с полуфумаратом алискирена при хранении и транспортировке.
Кроме того, обе соли по настоящему изобретению являются не гигроскопичными. Таким образом, было установлено, что соль по настоящему изобретению характеризуется чрезвычайно высокой стабильностью. При различной относительной влажности при комнатной температуре а также при повышенной температуре соль по настоящему изобретению практически не абсорбирует воду, или не наблюдается потерь воды в широком диапазоне влажности в течение нескольких часов, например в течение 4 ч. Например, температура плавления солей по настоящему изобретению не изменяется в процессе хранения при различной относительной влажности.
Улучшенные физико-химические свойства указанных солей имеют огромное значение, как при их использовании для получения активной субстанции, так и при получении, хранении и применении в качестве галенового препарата. Таким образом, с учетом постоянства физических параметров, можно гарантировать даже более высокое качество составов. Высокая стабильность соли позволяет также повысить экономичность технологии, т.е. использовать более простые стадии обработки в процессе переработки. Предпочтительная высокая кристалличность соли позволяет использовать ряд аналитических методов, прежде всего различные рентгеновские методы, которые обеспечивают простой и четкий анализ высвобождения. Этот фактор также имеет большое значение в связи с качеством активной субстанции и ее галеновых форм при их получении, хранении и введении пациенту. Кроме того, можно исключить сложные стадии стабилизации активного ингредиента при получении галенового препарата.
В связи с этим в настоящем изобретении предлагаются кристаллические, а также частично кристаллические и аморфные соли алискирена.
Наряду с сольватами, такими как гидраты, в настоящем изобретении также предлагаются полиморфные формы солей.
Сольваты, а также гидраты солей по настоящему изобретению могут присутствовать, например, в виде полу-, моно-, ди-, три-, тетра-, пента-, гексасольватов или гидратов соответственно. Растворители, используемые для кристаллизации, такие как спирты, прежде всего метанол, этанол, альдегиды, кетоны, прежде всего ацетон, эфиры, например этилацетат, или алканы, прежде всего пентан, гексан, гептан или циклогексан, могут встраиваться в кристаллическую решетку. Содержание выбранного растворителя или воды в сольвате или гидрате, образующемся при кристаллизации и на последующих стадиях обработки свободного основания или образованном непосредственно, в основном нельзя предсказать заранее и зависит от комбинации условий обработки и различных типов взаимодействия алискирена и выбранного растворителя, прежде всего, воды. Относительную стабильность полученного кристаллического или аморфного твердого вещества в форме соли, сольвата или гидрата, а также соответствующего сольвата или гидрата соли следует определять экспериментальным методом. Таким образом, нельзя точно определить химический состав и стехиометрическое соотношение молекул в образующемся твердом веществе, так как в этом случае образуются различные кристаллических твердые вещества и различные аморфные твердые вещества.
Описание гидратов солей является более предпочтительным, так как молекулы воды в кристаллической структуре связаны сильными межмолекулярными силами и, таким образом, представляют важный элемент при образовании структуры указанных кристаллов, которые, в свою очередь, характеризуются чрезвычайно высокой стабильностью. Указанные гидраты значительно отличаются от полуфумарата, так как любые сольваты полуфумарата являются нестабильными. Однако молекулы воды, которые связаны достаточно слабыми связями, также присутствуют в определенных кристаллических решетках. Такие молекулы в большей или меньшей степени участвуют в образовании кристаллической структуры, но с более низким энергетическим эффектом. Содержание воды в аморфных твердых веществах, как и в кристаллических гидратах, можно в основном достаточно точно определить, но указанный параметр сильно зависит от окружающей среды и условий высушивания. В отличие от этого, в случае стабильных гидратов существуют четкие стехиометрические соотношения фармацевтически активной субстанции и воды. Во многих случаях эти соотношения не полностью соответствуют стехиометрическим значениям, обычно они меньше теоретического значения из-за определенных кристаллических дефектов. Соотношение органических молекул и молекул воды для слабосвязанной воды может изменяться в значительной степени, например образуются ди-, три- или тетрагидраты. С другой стороны, в аморфных твердых веществах классификация молекулярной структуры воды не является стехиометричной, однако случайно могут образовываться стехиометрические структуры.
В некоторых случаях невозможно точно определить стехиометрическое содержание молекул воды, так как при этом образуются слоистые структуры и тип встроенных молекул воды нельзя точно определить.
Для кристаллических твердых веществ с идентичным химическим составом образующиеся кристаллические решетки называются полиморфной формой.
В данном контексте любые ссылки на соли по настоящему изобретению означают также соответствующие сольваты, такие как гидраты, и полиморфные модификации, и также аморфные формы.
На диаграмме порошковой рентгеновской дифракции оротата наблюдается набор дискретных пиков, и практически отсутствуют признаки некристаллических или аморфных форм. Неожиданно было установлено, что оротат характеризуется высокой степенью кристалличности. Соответственно можно получить относительно крупные кристаллы, которые с точки зрения кристаллографии являются монокристаллами. Такие монокристаллы позволяют определить структуру твердого вещества с использованием компьютерной программы для расчета интенсивности пиков на рентгеновской дифрактограмме.
Указанный способ определения структуры кристалла позволяет в нормальных условиях, таких как высокая физическая, химическая и энантиомерная чистота исследуемых кристаллов, с высокой точностью определить структуру на молекулярном или атомном уровне, а именно симметрию и размер элементарных ячеек, положение атомов и температурные факторы, а с использованием определенного объема кристаллической ячейки можно получить изображение распределения электронной плотности с учетом молекулярной массы. И в то же время указанный рентгеноструктурный анализ позволяет более точно оценивать качество полученного материала.
Преимущества оротата в основном связаны с кристаллами, которые образуются из соли, включающей одну молекулу оротата на одну молекулу алискирена. Таким образом, образуется практически идеальная трехмерная кристаллическая решетка. Оротат характеризуется высокой температурой плавления и энтальпией плавления, которые значительно выше, по сравнению с аналогичными характеристиками полуфумарата. Свойства кристаллической решетки соли являются основным фактором, определяющим ее химическую и физическую стабильность.
Температура плавления оротата в закрытом тигле составляет 177±1°С, при скорости нагрева Tr 10 К·мин-1. Указанную температуру плавления можно измерить только в открытом тигле.
Эти две термодинамические характеристики свидетельствуют о преимуществе физических свойств по сравнению с полуфумаратом по двум соответствующим параметрам, а именно температуре плавления в открытом тигле 96,6°С (скорость нагрева 10 К/мин) и энтальпии плавления 28,9 Дж·г-1. Указанные термодинамические данные вместе с данными рентгеновского анализа объясняют чрезвычайно высокую физическую и химическую устойчивость оротата алискирена.
ИК-спектры с Фурье преобразованием для оротата алискирена измеряли в порошке бромида калия, значимые полосы поглощения выражали в см-1: 3426 (сл.), 3161 (ср., широкая), 3098 (сл.), 2962 (ср.), 2875 (с.), 2834 (с.), 1674 (с.), 1564 (ср.), 1517 (ср.), 1488 (сл.), 1422 (сл.), 1371 (ср.), 1261 (сл.), 1237 (сл.), 1188 (сл.), 1161 (сл.), 1140 (сл.), 1026 (ср.), 924 (сл.), 880 (сл.), 847 (сл.), 808 (сл.), 773 (ср.), 641 (сл., широкая) см-1, стандартное отклонение всех полос поглощения в ИК-спектре с Фурье преобразованием составляет ±2 см-1, интенсивности полос: (сл.) - слабая, (ср.) - средняя и (с.) - сильная интенсивность.
Настоящее изобретение относится к кристаллическому оротату, кристаллическому твердому веществу, которое характеризуется четкими данными и параметрами на основе порошковой рентгенограммы. Подробное описание теории методов порошковой рентгеновской дифракции и определение данных и параметров можно найти в книге Н.Р.Klug, L.E.Alexander: X-ray Diffraction Procedures for Polycrystalline & Amorphous Materials, J.Wiley & Sons, Inc., New York (1974).
SPP100 порошковые рентгенограммы оротата получали на порошковом дифрактометре Bruker D8 Advance в режиме отражения, источник излучения Cu-Kα (λ1=1,540596 Ǻ и λ2=1,544493 Ǻ) с позиционно-чувствительным детектором VANTEC-1 при комнатной температуре (25°С). Диапазон сканирования от 2 до 40° угла 2θ со скоростью сканирования 0,3 с/шаг. На рентгеновской дифрактограмме наблюдаются следующие наиболее значимые сигналы:
пики (° 2θ): 4,4 (с.), 8,7 (ср.), 10,5 (сл.), 14,4 (ср.), 17,7 (с.), 19,3 (ср.), 19,9 (сл.), 20,8 (сл.), 22,2 (ср.), 23,0 (ср.), 25,2 (сл.), 26,8 (ср.), стандартное отклонение для всех межплоскостных расстояний составляет ±0,2° 2θ, интенсивности полос: (сл.) слабая; (ср.) средняя и (с.) сильная.
Основной признак качества очищенной ЛС как с точки зрения физико-химической обработки, такой как высушивание, просеивание, измельчение, так и для переработки в смеси с фармацевтическими эксципиентами, а именно при смешивании, грануляции, сушки с распылением, таблетировании, заключается в зависимости абсорбции воды или потери воды в активной ЛС от температуры и относительной влажности окружающей среды. При получении определенных составов свободная и связанная вода попадает в состав вместе с наполнителями и/или вода попадает в обрабатываемую смесь в процессе соответствующей обработки. В этом случае фармацевтически активная ЛС подвергается действию свободной воды в течение длительного периода времени, в зависимости от температуры на различных стадиях обработки (парциальное давление пара).
Четкую характеристику такой зависимости проводили изотермическим анализом в течение предварительно установленных временных интервалов и предварительно установленной относительной влажности, методом динамической сорбции паров на приборе (DVS-1 фирмы Surface Measurement Systems LTD, Марлоу, Букингемпшир, Великобритания). В таблице 2 указана зависимость изменения массы, например абсорбции воды или потери воды, от относительной влажности при 25°С для образца оротата алискирена через 2 ч после уравновешивания при каждом из значений относительной влажности (изменение массы в течение цикла сорбции и десорбции).
Стандартное отклонение при термогравиметрическом анализе составляет приблизительно 0,1%. Полученные результаты свидетельствуют о том, что в указанных условиях, которые аналогичны условиям получения фармацевтических галеновых препаратов, наблюдается обратимая сорбция или потеря воды. Таким образом, образец характеризуется низкой гигроскопичностью, а поглощение влаги составляет приблизительно 0,4% при 80% относительной влажности. Такое свойство играет важную роль на заключительных стадиях химического синтеза, а также практически на всех стадиях получения галеновых препаратов и различных лекарственных форм. Такая исключительная стабильность также имеет значение для пациентов в связи с постоянной доступностью активного ингредиента.
Исключительную стабильность оротата алискирена в отношении воды можно также оценивать при испытании на стабильность. Полученные результаты свидетельствуют о том, что содержание воды в оротате алискирена остается постоянным как в открытом тигле, так и в запаянной ампуле в течение четырех недель при 40°С и 75% относительной влажности (OB). Такая стабильность значительно отличается от относительно слабой стабильности полуфумарата соли алискирена, как показано в таблице 3.
Благодаря высокой кристалличности оротат можно подвергать прямому прессованию и получать соответствующие составы для таблетирования.
В другом объекте настоящего изобретения предлагается получение соли по настоящему изобретению.
Соли по настоящему изобретению, включая их аморфные или кристаллические формы, можно получать по следующей методике.
Соль получают в системе растворителей, в которой два реагента, а именно алискирен в виде основания и соответствующая кислота, в достаточной степени растворимы. Для растворения необходимо нагреть смесь. Целесообразно использовать растворитель или смесь растворителей, в которой образующаяся соль слабо растворима или полностью не растворима, при этом происходит кристаллизация или выпадение осадка. В одном из вариантов получения соли по настоящему изобретению можно использовать растворитель, в котором указанная соль хорошо растворима, и затем в раствор добавить антирастворитель, то есть растворитель, в котором образующаяся соль лишь слабо растворима. Другой вариант кристаллизации соли включает и концентрирование солевого раствора, например при нагревании, при необходимости при пониженном давлении, или медленном упаривании растворителя, например, при комнатной температуре, или при кристаллизации с добавлением затравки, или при использовании активности воды, необходимой для образования гидрата. Предпочтительно, чтобы, по крайней мере, один из двух реагентов, а именно алискирен в виде основания и соответствующая кислота, растворялся в системе растворителей при нагревании, но лишь слабо растворялся или не растворялся при комнатной температуре.
Можно использовать растворители, например С3-С7алкилнитрилы, прежде всего ацетонитрил, С1-С5алканолы, предпочтительно этанол или изопропанол, а также С1-С5диалкилкетоны, такие как ацетон, и их смеси с водой, сложные эфиры, прежде всего С1-С5алкиловые эфиры С2-С7алканкарбоновых кислот, такие как этил- или изопропилацетат, ди(С1-С5алкиловые)эфиры, такие как трет-бутилметиловый эфир, а также тетрагидрофуран, С5-С8алканы, прежде всего пентан, гексан, циклогексан или гептан, и толуол. Наиболее предпочтительными являются С3-С7алкилнитрилы, прежде всего ацетонитрил.
Для получения гидратов прежде всего используют процессы растворения и кристаллизации или водно-равновесную кристаллизацию.
Способ получения соли заключается в том, что
1) алискирен в виде свободного основания и оротовую кислоту растворяют в органическом растворителе,
2) растворитель смешанного раствора концентрируют, например, при нагревании, если необходимо, при пониженном давлении, или при медленном упаривании, например, при комнатной температуре, до выпадения осадка,
3) суспензию фильтруют и высушивают, при этом получают соль.
На стадии растворения (1) используют органический растворитель, предпочтительно спирт, такой как этанол или изопропанол, или алкилнитрил, прежде всего ацетонитрил, вода, этилацетат, метилэтилкетон и 3-метил-1-бутанол. Наиболее предпочтительным органическим растворителем является С3-С7алкилнитрил, прежде всего ацетонитрил. Можно использовать органический растворитель любой пригодной квалификации, предпочтительно высокой степени чистоты, такой как >90%, более предпочтительно >95%, такой как «для ЖХВР». При необходимости, растворитель нагревают до повышенной температуры, например от 30 до 100°С, более предпочтительно от 40 до 80°С, например 65-75°С. При нагревании компоненты полностью растворяются. Алискирен в форме основания можно растворять непосредственно или можно использовать в предварительно растворенной форме. Предпочтительно для получения предварительно растворенной формы использовать алискирен в форме свободного основания. В качестве растворителя для предварительного растворения алискирена в форме свободного основания можно использовать любой растворитель, как указано выше, предпочтительно спирт, такой как этанол. Кислоту предпочтительно добавляют одновременно с алискиреном в форме свободного основания или позднее, более предпочтительно кислоту добавляют в смесь после добавления алискирена в форме свободного основания. Кислоту предпочтительно используют в форме водного раствора или в виде твердого вещества, более предпочтительно в виде твердого вещества. Предпочтительно использовать водный раствор оротовой кислоты в диапазоне концентраций от 0,5 до 20 н., более предпочтительно от 1 до 10 н., например 6 н. раствор.
На стадии обработки (2) смешанный раствор предпочтительно выдерживают для медленного упаривания растворителя, при этом образуется пересыщенный раствор и наблюдается выпадение осадка. Этот процесс предпочтительно проводят при повышенной температуре, например выше комнатной температуры, например в диапазоне от 30 до 100°С, более предпочтительно от 40 до 80°С, например 65-75°С. В другом варианте или дополнительно смешанный раствор выдерживают при комнатной температуре, например от 20 до 25°С. В другом варианте раствор охлаждают до температуры ниже комнатной, более предпочтительно в диапазоне от -10 до <20°С, еще более предпочтительно - от 5 до 10°С. Обычно раствор выдерживают до начала выпадения осадка в течение достаточного времени, например в течение от 30 мин до 24 ч, предпочтительно от 1 до 12 ч, наиболее предпочтительно от 1 до 8 ч. В некоторых случаях, прежде всего при получении соли в лабораторном масштабе, достаточно выдерживать раствор в течение от 30 мин до 3 ч. Более предпочтительно раствор концентрируют, выдерживая его при повышенной температуре, как описано выше, с последующим медленным охлаждением до комнатной температуры. Смесь охлаждают до комнатной температуры предпочтительно в течение от 20 мин до 3 ч, более предпочтительно в течение 1 ч.
Необязательно к остатку, полученному после упаривания на стадии (2), добавляют дополнительное количество органического растворителя, прежде всего, если образуется вязкая суспензия. Эту стадию предпочтительно включают для упрощения обработки образца при его фильтровании, в ином случае образуется остаток в форме вязкой суспензии, которую трудно обрабатывать.
На стадии обработки (3) высушивание предпочтительно проводят при повышенной температуре, более предпочтительно от 30 до 150°С, еще более предпочтительно от 35 до 100°С, наиболее предпочтительно от 40 до 60°С. В другом варианте или дополнительно высушивание можно проводить при пониженном давлении, предпочтительно в вакууме от 100 до 1 мбар, более предпочтительно от 50 до 3 мбар, например от 5 до 10 мбар. Высушивание обычно проводят до постоянной массы. Предпочтительно продукт высушивают в течение от 5 до 36 ч, предпочтительно от 10 до 24 ч, наиболее предпочтительно от 15 до 20 ч.
Способы образования солей также являются объектами настоящего изобретения.
В предпочтительном варианте кристаллизацию можно оптимизировать, например ускорить, при добавлении, по крайней мере, одного кристалла для затравки.
Соли по настоящему изобретению можно использовать, например, в форме фармацевтических препаратов, которые содержат активную ЛС, например, в терапевтически эффективном количестве, необязательно в смеси с фармацевтически приемлемым носителем, например с неорганическим или органическим, твердым или необязательно также жидким фармацевтически приемлемым носителем, который является пригодным для энтерального, например перорального, или парентерального введения.
В настоящем изобретении предлагается прежде всего фармацевтическая композиция, прежде всего в виде твердой лекарственной формы, предпочтительно для перорального введения, необязательно в смеси с фармацевтически приемлемым носителем.
Фармацевтические препараты указанного типа можно использовать, например, для профилактики и лечения заболеваний или состояний, которые поддаются лечению при ингибировании рецептора AT1, например,
заболевания или состояние выбирают из группы, включающей
а) гипертензию, застойную сердечную недостаточность, почечную недостаточность, прежде всего хроническую почечную недостаточность, рестеноз после чрескожной транслюминальной ангиопластики и рестеноз после аортокоронарного шунтирования,
б) атеросклероз, резистентность к инсулину и синдром X, сахарный диабет типа 2, ожирение, нефропатию, почечную недостаточность, например хроническую почечную недостаточность, гипертиреоз, ремиссию после инфаркта миокарда, коронарную болезнь сердца, гипертензию у пожилых людей, наследственную дислипидемическую гипертензию, повышенное образование коллагена, фиброз и гипертензию после ремоделирования сосудов (антипролиферативное действие комбинации), все указанные заболевания или состояния, связанные или не связанные с гипертензией,
в) эндотелиальную дисфункцию, связанную или не связанную с гипертензией,
г) гиперлипимию, гиперпротеинемию, атеросклероз и гиперхолестеринемию,
д) глаукому.
В основном указанные соли можно использовать для лечения высокого кровяного давления и застойной сердечной недостаточности, а также состояния после инфаркта миокарда.
Специалист в данной области техники может выбрать надежную и стандартную модель животных для оценки благоприятного действия указанных препаратов на заболевания, описанные в данном контексте.
Фармацевтическую активность при введении типичных солей по настоящему изобретению или комбинации активных агентов по настоящему изобретению можно оценивать, например, с использованием соответствующих фармакологических моделей, известных в предшествующем уровне техники. Специалист в данной области техники может выбрать пригодную модель животных для подтверждения указанных в данном контексте показаний и благоприятного действия.
Эффективность лекарственного средства оценивали с использованием различных моделей животных, включая гипертензию крыс, вызванную ацетатом дезоксикортикостерона (ДОКА), и спонтанную гипертензию крыс (SHR), которые получали нормальный солевой корм или корм с высоким содержанием соли (4-8% в корме крыс или 1% NaCl в качестве питьевой воды).
Модель ДОКА использовали при однократном или продолжительном введении. Протокол испытаний с однократным введением позволяет оценивать действие различных исследуемых веществ в течение 6 ч с использованием крыс, которым имплантировали катетеры в бедренную артерию и вену. Испытания при однократном введении позволяют оценивать исследуемые вещества по их способности снижать повышенное кровяное давление на сформировавшейся фазе гипертензии, вызванной ДОКА. И наоборот, испытания при продолжительном введении позволяют оценивать способность исследуемых веществ предотвратить или замедлить повышение кровяного давления на стадии развития гипертензии, вызванной ДОКА. Следовательно, при испытаниях с продолжительным введением можно регистрировать кровяное давление с помощью радиодатчика, который хирургическим способом имплантируют в брюшную аорту крыс до начала лечения гипертензии, индуцированной ДОКА, т.е. до индукции гипертензии. Кровяное давление регистрируют непрерывно в течение 6 недель (приблизительно за одну неделю до введения ДОКА и в течение 5 недель после введения).
Крыс анестезировали 2-3% изофлурана при ингаляции кислородом, затем амиталом натрия (амобарбитал) внутрибрюшинно в дозе 100 мг/кг массы тела. Степень анестезии регистрировали по уровню ритмичности дыхания.
Испытания при введении однократной дозы
Крысам проводили одностороннюю нефректомию во время имплантации ДОКА. Шерсть состригали с левого бока и с шеи со стороны спины, протирали (кожу) стерильными тампонами, пропитанными спиртом и смесью повидон/иод. Во время операции крыс помещали на подогреваемый матрас для поддерживания температуры тела 37°С.
Через кожу и прилежащую мышцу делали надрез размером 20 мм, чтобы извлечь левую почку. Почку очищали от окружающей ткани, извлекали и накладывали две прочные лигатуры вокруг почечной артерии и вены, проксимальных к месту ее соединения с аортой (шелк 3-0). Затем почечную артерию и вену отделяли и почку извлекали. Мышцы и кожу сшивали (шелк 4-0) и зажимали зажимами из нержавеющей стали соответственно. В то же время на шее со стороны спины делали надрез размером 15 мм и имплантировали подкожно пеллет с замедленным высвобождением в течение 3 недель (фирмы Innovative Research of America, Sarasota, Флорида), содержащий ацетат дезоксикортикостерона (100 мг/кг). Затем рану зажимали зажимом из нержавеющей стали и обе раны обрабатывали смесью повидон/иод, крысам после операции вводили внутримышечно прокаин пенициллина G (100000 ед.) и бупренофин (0,05-0,1 мг/кг) подкожно. Крысам немедленно обеспечивали доступ к питьевому раствору 1% NaCl+0,2% KCl. Указанное введение продолжали в течение по крайней мере 3 недель, в течение которых у животных развивалась гипертензия и их использовали для испытаний.
За 48 ч до испытаний животных анестезировали изофлураном и вводили катетеры в бедренную артерию и вену для измерения артериального давления, для отбора крови и введения исследуемых соединений. Для восстановления крыс выдерживали в течение 48 ч в фиксированном состоянии в клетке из оргстекла, которую также использовали для испытаний.
Испытания при продолжительном введении
Указанные испытания проводили аналогично тому, как описано выше, но крысам имплантировали радиодатчик за 7-10 сут до односторонней нефректомии и введения ДОКА и соли. Кроме того, крысам не вводили катетеры в бедренную артерию и вену. Радиодатчик имплантировали, как описано в статье М.K.Bazil, С.Krulan и R.L.Webb. J. Cardiovasc. Pharmacol. 22: 897-905 (1993).
Условия испытаний вводили в компьютер для анализа кровяного давления, сердечного ритма и т.п. в определенные периоды времени. Исходные данные собирали в различные периоды времени и через различные интервалы времени. Например, исходные данные или значения до введения дозы обычно включали средние величины по трем последовательным значениям, полученным через каждые 24 ч до введения лекарственного средства.
Кровяное давление, сердечный ритм и активность определяли в предварительно определенные периоды времени до, во время и после введения лекарственного средства. Все измерения проводили с использованием животных в бесстрессовом и спокойном состоянии. Максимальное время испытаний определялось сроком работы батареек и составляло девять месяцев. В указанный период крысам вводили носитель перорально (1-3 мл/кг) не более 2 раз в сутки или лекарственное средство в питьевой воде или в корме. Для более коротких испытаний в течение 8 недель лекарственные средства вводили подкожно из имплантированных осмотических мини-насосов. Скорость осмотических мини-насосов устанавливали в зависимости от необходимой скорости и времени доставки лекарственного средства. Доза алисрикена составляла от 1 до 10 мг/кг/сут.
Кроме того, для изучения действия алисрикена использовали крыс со спонтанной гипертензией (SHR), которую индуцировали при непрерывном введении соли для подавления системы ренин-ангиотензин (RAS) или при непрерывном отсутствии соли для активации RAS у крыс SHR. Указанные испытания проводили для более точной оценки действия различных исследуемых веществ. Эксперименты проводили с использованием крыс SHR, полученных в фирме Taconic Farms, Germantown, Нью-Йорк (Tac:N(SHR)fBR). Радиометрическое устройство (Data Sciences International, Inc., St. Paul, Миннесота) имплантировали в нижнюю брюшную аорту всем экспериментальным животным в возрасте от 14 до 16 недель. После операции всех крыс SHR выдерживали в течение по крайней мере 2 недель до начала испытаний для восстановления. Сердечно-сосудистые параметры непрерывно регистрировали с использованием радиодатчика и полученные сигналы преобразовывали в цифровые данные, которые сохраняли в компьютере. Кровяное давление (среднее артериальное, систолическое и диастолическое давление) и сердечный ритм регистрировали у крыс (SHR), которые находились в сознании и в бесстрессовом свободном состоянии в клетках. Артериальное кровяное давление и сердечный ритм измеряли каждые 10 мин в течение 10 сек и регистрировали. Данные, полученные для каждой крысы, представляли в виде средних значений, полученных в течение 24 ч, и собирали образцы каждый день (144-10 мин). Исходные значения кровяного давления и сердечного ритма представляли в виде средних величин по трем последующим значениям, полученным через каждые 24 ч, до начала лечения лекарственным средством. Всех крыс помещали отдельно в клетки с контролируемой температурой, влажностью и с циклом свет-темнота (12 ч/12 ч).
Кроме сердечно-сосудистых параметров для всех крыс также регистрировали массу тела один раз в неделю. Лекарственное средство вводили перорально в питьевой воде один раз в сут через желудочный зонд или с использованием осмотических мини-насосов, как указано выше. При введении с питьевой водой потребление воды регистрировали пять раз в неделю. Затем рассчитывали дозы алискирена (свободное основание) для каждой отдельной крысы по потреблению воды, концентрации лекарственного средства в питьевой воде и индивидуальной массы тела. Все свежие растворы лекарственного средства в питьевой воде готовили каждые три-четыре дня. Обычная доза алискирена в питьевой воде находится в интервале от 3 до 30 мг/кг/сут. Однако, если экспериментальной крысе вводили комбинацию лекарственных средств, использовали дозы, аналогичные дозам при монотерапии.
При введении лекарственного средства через желудочный зонд доза алискирена (свободное основание) находится в интервале от 1 до 50 мг/кг/сут.
После завершения испытаний при продолжительном введении крыс SHR или крыс ДОКА анестезировали и из тела быстро удаляли сердце. После отделения и удаления предсердий, левого желудочка и левого и правого желудочков (общая масса) их взвешивали и полученные результаты регистрировали. Массу левого желудочка и общую массу желудочков затем нормализовали по массе тела и регистрировали. Все значения, полученные для кровяного давления и сердечной массы, представляли в виде средних значений для группы ±СО.
Функцию и структуру сосудов оценивали после введения комбинации для оценки ее эффективности. Крыс SHR испытывали по методике, описанной в статье Intengan H.D., Thibault G., Li J.S., Schiffrin E.L. Circulation 100 (22): 2267-2275 (1999). Аналогичным образом, оценивали функцию сосудов у крыс ДОКА, как описано в статье Intengan H.D., Park J.B., Schiffrin E.L. Hypertension, 34 (4 Part 2): 907-913 (1999).
Фармацевтические препараты по настоящему изобретению, которые при необходимости могут дополнительно содержать фармакологически активные субстанции, получают известным способом, например при смешивании, грануляции, нанесении покрытия, растворении или лиофилизации, и полученные препараты содержат от приблизительно 0,1% до 100%, прежде всего, от приблизительно 1% до приблизительно 50% лиофилизата и вплоть до 100% активной субстанции.
Изобретение также относится к композициям, содержащим соли по изобретению.
Изобретение также относится к применению солей по изобретению, предпочтительно для получения фармацевтических препаратов, предназначенных, прежде всего, для профилактики и также для лечения заболеваний или состояний, которые поддаются лечению при ингибировании ренина. Прежде всего, указанные соли можно использовать для лечения высокого кровяного давления, почечной недостаточности, дисфункции левого желудочка и сердечной недостаточности.
Изобретение также относится к применению для профилактики и лечения заболеваний или состояний, которые поддаются лечению при ингибировании ренина, и указанное применение заключается в том, что пациенту, включая человека, нуждающемуся в таком лечении, вводят терапевтически эффективное количество соли по изобретению, необязательно в комбинации по крайней мере с одной композицией, предназначенной для лечения сердечно-сосудистых заболеваний и связанных с ними состояний и заболеваний, перечисленных в данном контексте.
Изобретение также относится к комбинациям, например фармацевтическим комбинациям, содержащим соль по настоящему изобретению, или в каждом случае фармацевтически приемлемую соль в комбинации по крайней мере с одной композицией, предназначенной для лечения сердечно-сосудистых заболеваний и связанных с ними состояний и заболеваний, перечисленных в данном контексте, или в каждом случае фармацевтически приемлемую соль указанных соединений. Комбинации с другими композициями для лечения сердечно-сосудистых заболеваний и связанных с ними состояний и заболеваний, перечисленных в данном контексте, или в каждом случае фармацевтически приемлемая соль указанных соединений также являются объектами настоящего изобретения.
Комбинацию получают, например, с использованием следующих композиций, которые выбирают из группы, включающей:
(1) ингибитор редуктазы HMG-Co-A или ее фармацевтически приемлемую соль,
(2) ингибитор ангиотензин-конвертирующего фермента (АКФ) или его фармацевтически приемлемую соль,
(3) блокатор кальциевых каналов (ССВ) или его фармацевтически приемлемую соль,
(4) ингибитор альдостеронсинтазы или его фармацевтически приемлемую соль,
(5) антагонист альдостерона или его фармацевтически приемлемую соль,
(6) двойной ингибитор ангиотензин-конвертирующего фермента/нейтральной эндопептидазы (АКФ/НЭП) или их фармацевтически приемлемую соль,
(7) антагонист эндотелина или его фармацевтически приемлемую соль,
(8) блокаторы рецептора ангиотензина II (ARB) или его фармацевтически приемлемую соль и
(9) диуретик или его фармацевтически приемлемую соль.
Ингибиторы редуктазы HMG-Co-A (так называемые ингибиторы β-гидрокси-β-метилглутарил-кофермент-А-редуктазы) означают активные агенты, которые используют для снижения уровней липидов, включая холестерин в крови.
Класс ингибиторов редуктазы HMG-Co-A включает соединения с различными структурными признаками. Например, следует отметить соединения, которые выбирают из группы, включающей аторвастатин, церивастатин, компактин, далвастатин, дигидрокомпактин, флуиндостатин, флувастатин, ловастатин, питавастатин, мевастатин, правастатин, ривастатин, симвастатин и велостатин или, в каждом случае, их фармацевтически приемлемые соли.
Предпочтительными ингибиторами редуктазы HMG-Co-A являются коммерческие препараты, наиболее предпочтительными являются флувастатин и питавастатин или, в каждом случае, их фармацевтически приемлемая соль.
Наиболее эффективным способом регуляции кровяного давления и, следовательно, лечения застойной сердечной недостаточности является подавление ферментативной деградации ангиотензина I до ангиотензина II под действием так называемых ингибиторов АКФ.
Класс ингибиторов АКФ включает соединения с различными структурными признаками. Например, следует отметить соединения, которые выбирают из группы, включающей алацеприл, беназеприл, беназеприлат, каптоприл, церонаприл, цилазаприл, делаприл, эналаприл, энаприлат, фозиноприл, имидаприл, лизиноприл, мовелтоприл, периндоприл, хинаприл, рамиприл, спираприл, темокаприл и трандолаприл или, в каждом случае, их фармацевтически приемлемую соль.
Предпочтительными ингибиторами АКФ являются коммерческие препараты, наиболее предпочтительны беназеприл и эналаприл.
Класс ССВ включает, прежде всего, дигидропиридины (ДГП) и не-ДГП, такие как ССВ типа дилтиазема и верапамила.
Класс ССВ, который используют в указанной комбинации, включает предпочтительно ДГП, выбранные из группы, включающей амлодипин, фелодипин, риозидин, исрадипин, лацидипин, никардипин, нифедипин, нигулдипин, нилудипин, нимодипин, низолдипин, нитрендипин и нивалдипин, и предпочтительно включает не-ДГП, выбранные из группы, включающей флунаризин, прениламин, дилтиазем, фендилин, галлопамил, мибефрадил, анипамил, тиапамил и верапамил и, в каждом случае, их фармацевтически приемлемую соль. Все указанные ССВ используют в медицине, например, в качестве антигипертензивных, антистенокардических или антиаритмических лекарственных средств. Предпочтительные ССВ включают амлодипин, дилтиазем, исрадипин, никардипин, нифедипин, нимодипин, низолдипин, нитрендипин и верапамил или, например, в зависимости от специфичности ССВ, их фармацевтически приемлемую соль. Прежде всего, предпочтительные ДГП включают амлодипин или его фармацевтически приемлемую соль, прежде всего, безилат. Наиболее предпочтительные не-ДГП включают верапамил или его фармацевтически приемлемую соль, прежде всего, гидрохлорид.
Ингибитор альдостеронсинтазы означает фермент, который превращает кортикостерон в альдостерон при гидроксилировании кортикостерона с образованием 18-ОН-кортикостерона, а затем 18-ОН-кортикостерон превращается в альдостерон. Известно, что класс ингибиторов альдостеронсинтаз, применяемых для лечения гипертензии и первичного альдостеронизма, включает как стероидные, так и нестероидные ингибиторы альдостеронсинтаз, при этом последние наиболее предпочтительны.
Предпочтительными являются коммерческие ингибиторы альдостеронсинтаз или ингибиторы альдостеронсинтаз, которые утверждены органами здравоохранения.
Класс ингибиторов альдостеронсинтаз включает соединения с различными структурными признаками. Например, следует отметить соединения, которые выбирают из группы, включающей нестероидные ингибиторы ароматазы, анастрозол и фадрозол (включая их (+)-энантиомеры), а также стероидный ингибитор ароматазы, эксеместан, или в каждом случае, если возможно, их фармацевтически приемлемую соль.
Наиболее предпочтительным нестероидным ингибитором альдостеронсинтазы является (+)-энантиомер гидрохлорида фадрозола (патенты US 4617307 и 4889861) формулы
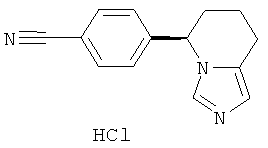 .
.
Предпочтительным стероидным антагонистом альдостерона является эплеренон формулы
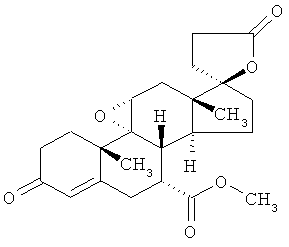
или
спиронолактон.
Предпочтительным двойным ингибитором ангиотензин-конвертирующего фермента/нейтральной эндопептидазы (АКФ/НЭП) является, например, омапатрилат (см. EP 629627), фазидотрил, или фазидотрилат, или соответственно их фармацевтически приемлемая соль.
Предпочтительным антагонистом эндотелина является, например, бозентан (см. EP 526708 А), или тезосентан (см. WO 96/19459), или, в каждом случае, их фармацевтически приемлемая соль.
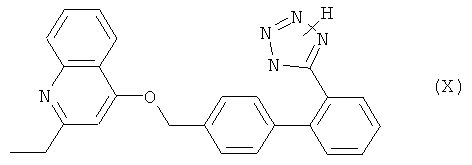
Приемлемые блокаторы рецептора ангиотензина II, которые используются в комбинации по настоящему изобретению, включают антагонисты рецептора AT1 с различными структурными признаками, предпочтительно непептидной природы. Например, следует отметить соединения, которые выбирают из группы, включающей валсартан (EP 443983), лосартан (EP 253310), кандесартан (EP 459136), эпросартан (EP 403159), ирбесартан (EP 454511), олмесартан (EP 503785), тазосартан (EP 539086), телмисартан (EP 522314), соединение Е-4177 формулы
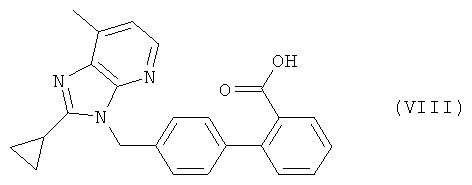
соединение SC-52458 формулы
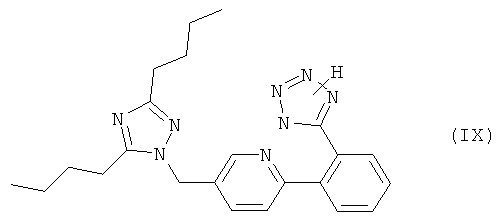
и соединение ZD-8731 формулы
или, в каждом случае, их фармацевтически приемлемую соль.
Предпочтительно антагонистами рецептора AT1 являются коммерческие препараты, более предпочтителен валсартан или его фармацевтически приемлемая соль.
Диуретиком является, например, тиазидпроизводное, выбранное из группы, включающей хлортиазид, гидрохлортиазид, метилхлортиазид и хлорталидон. Наиболее предпочтителен гидрохлортиазид.
Совместные терапевтически эффективные количества активных агентов в составе комбинации по настоящему изобретению предпочтительно вводят одновременно или последовательно в любом порядке, совместно, раздельно или в фиксированнной комбинации.
Структуру активных агентов можно определить по общим торговым названиям, которые указаны в текущем издании стандартного справочника "The Merck Index" или в базе данных, например, патентов Patents International (например, IMS World Publications). Их содержание включено в данное описание в качестве ссылок. Специалист в данной области техники с использованием указанных ссылок может идентифицировать активные агенты, а также получить их и провести испытания фармацевтических показаний и свойств стандартными методами анализа in vitro и in vivo.
Соответствующие активные ингредиенты или их фармацевтически приемлемые соли можно также использовать в форме сольвата, такого как гидрат, или сольвата с другими растворителями, использованными для кристаллизации.
Соединения в составе комбинаций можно использовать также в виде фармацевтически приемлемых солей. Если указанные соединения включают, например, по крайней мере один основный центр, они образуют кислотно-аддитивные соли. Соответствующие кислотно-аддитивные соли получают при необходимости, если присутствует дополнительный основный центр. Соединения, содержащие кислотную группу (например, СООН), образуют также основно-аддитивные соли.
Один из вариантов настоящего изобретения включает "набор компонентов", например, если соединения в составе комбинации по настоящему изобретению можно вводить независимо или в составе различных фиксированных комбинаций, содержащих определенное количество компонентов, т.е. одновременно или в различные периоды времени. Компоненты набора можно затем вводить, например, одновременно или поочередно, то есть в различные периоды времени и через равные или через различные интервалы времени для любого компонента набора. Временные интервалы предпочтительно выбирают таким образом, чтобы повысить эффективность лечения заболевания или состояния при комбинированном введении по сравнению с действием каждого компонента в отдельности.
Кроме того, изобретение относится к коммерческой упаковке, включающей комбинацию по настоящему изобретению и инструкцию для одновременного, раздельного или последовательного применения.
Доза алискирена (свободное основание) зависит от различных факторов, таких как способ введения, вид, возраст и/или индивидуальное состояние. Например, доза, предназначенная для введения теплокровному животному, включая человека, с массой тела приблизительно 75 кг, прежде всего доза, эффективная для ингибирования активности ренина, например, для снижения кровяного давления, составляет приблизительно от 3 мг до приблизительно 3 г, предпочтительно от приблизительно 10 мг до приблизительно 1 г, например от 20 до 200 мг/субъект/сут, предпочтительно разделенная на однократные дозы, от 1 до 4 доз, например на равные дозы. Обычно детям вводят приблизительно половину дозы взрослых. Для каждого субъекта подбирают индивидуальную дозу, например, при измерении концентрации активного ингредиента в сыворотке и повышают дозу до оптимальной величины. Одна доза включает, например, 75 мг, 150 мг или 300 мг для взрослого пациента (в расчете на свободное основание).
Изобретение иллюстрируется, прежде всего, примерами и относится к новым соединениям, описанным в примерах, к их применению и к способам их получения.
Следующие примеры представлены для иллюстрации изобретения и не ограничивают его объем.
Пример 1
Получение оротата (2(S),4(S),5(S),7(S)-N-(3-амино-2,2-диметил-3-оксопропил)-2,7-ди(1-метилэтил)-4-гидрокси-5-амино-8-[4-метокси-3-(3-метоксипропокси)фенил]октанамида
Суспензию 4,77 г (2(S),4(S),5(S),7(S)-N-(3-амино-2,2-диметил-3-оксопропил)-2,7-ди(1-метилэтил)-4-гидрокси-5-амино-8-[4-метокси-3-(3-метоксипропокси)фенил]октанамида в форме свободного основания и 1,28 г безводной оротовой кислоты в 90 мл ацетонитрила нагревали до 75°С. Полученный слегка опалесцирующий раствор перемешивали при приблизительно 75°С, при этом наблюдалась медленная кристаллизация через приблизительно 15 мин. Смесь охлаждали до 65°С и добавляли раствор 0,22 г (2(S),4(S),5(S),7(S)-N-(3-амино-2,2-диметил-3-оксопропил)-2,7-ди(1-метилэтил)-4-гидрокси-5-амино-8-[4-метокси-3-(3-метоксипропокси)фенил]октанамида в форме свободного основания в 1 мл ацетонитрила. Суспензию перемешивали при 65°С в течение 1 ч 45 мин и затем охлаждали до комнатной температуры в течение приблизительно 1 ч. Суспензию фильтровали. Кристаллы промывали 20 мл ацетонитрила и сушили при 60°С и приблизительно 8 мбар в течение ночи, при этом получали твердое вещество белого цвета.
Метод порошковой рентгеновской дифракции
Межплоскостные расстояния образца определяли по наиболее интенсивным пикам на порошковой дифрактограмме, полученной на порошковом дифрактометре Bruker D8 Advance. Получены следующие результаты:
пики (° 2Θ): 4,4 (с.), 8,7 (ср.), 10,5 (сл.), 14,4 (ср.), 17,7 (с.), 19,3 (ср.), 19,9 (сл.), 20,8 (сл.), 22,2 (с.), 23,0 (ср.), 25,2 (сл.), 26,8 (ср.).
Стандартное отклонение для всех межплоскостных расстояний составляло ±0,2° 2Θ. Интенсивность пиков: (сл.) слабая, (ср.) средняя и (с.) сильная.
Инфракрасная спектроскопия
Инфракрасные спектры поглощения образцов регистрировали на микроскопе для ИК-спектров с Фурье-преобразованием (Broker Vertex 70). Наблюдаются следующие пики при длине волны в см-1:
3426 (сл.), 3161 (ср., широкая), 3098 (сл.), 2962 (ср.), 2875 (сл.), 2834 (сл.), 1674 (с.), 1564 (ср.), 1517 (ср.), 1488 (сл.), 1422 (сл.), 1371 (ср.), 1261 (сл.), 1237 (сл.), 1188 (сл.), 1161 (сл.), 1140 (сл.), 1026 (ср.), 924 (сл.), 880 (сл.), 847 (сл.), 808 (сл.), 773 (ср.), 641 (сл., широкая).
Стандартное отклонение для всех пиков поглощения ИК-спектра составляло ±2 см-1. Интенсивность пиков: (сл.) слабая, (ср.) средняя и (с.) сильная.
Спектроскопия комбинационного рассеяния
Спектр комбинационного рассеяния образца регистрировали на дисперсионном спектрометре комбинационного рассеяния, снабженном лазерным источником возбуждения с длиной волны 1064 нм (Bruker RFS 100), наблюдаются следующие значимые полосы поглощения при длине волны в см-1:
3097 (сл.), 3077 (сл.), 2931 (ср., широкая), 1681 (с.), 1605 (сл.), 1463 (сл.), 1442 (сл.), 1373 (ср.), 1314 (сл.), 1226 (с.), 1132 (сл.), 1029 (сл.), 1012 (сл.), 898 (сл.), 819 (сл.), 774 (ср.), 744 (сл.), 593 (с.), 539 (сл.), 451 (сл.), 361 (ср.).
Стандартное отклонение для всех полос комбинационного рассеяния составляло ±2 см-1. Интенсивность: (сл.) = слабая, (ср.) = средняя и (с.) = сильная.
1Н-ЯМР
1Н-ЯМР-спектр регистрировали при 300 К на спектрометре Brucker DMX в ДМСО-D6 при 500 МГц.
Для расшифровки ЯМР-спектра использовали следующую нумерацию атомов:
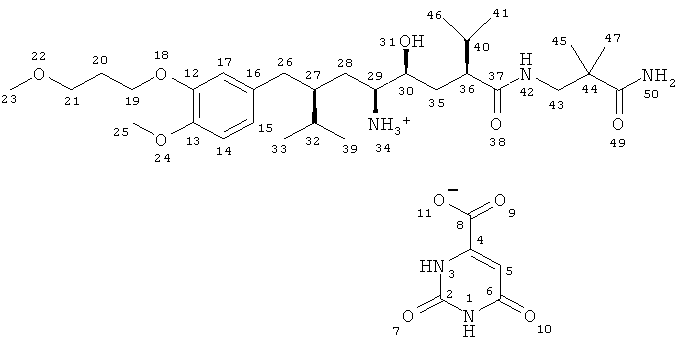
Отнесение полос спектра 1Н-ЯМР-спектр при 300 К в ДМСО-D6
Дифференциальная сканирующая калориметрия и термогравиметрический анализ
По данным дифференциально-сканирующей калориметрии (ДСК) на приборе Perkin-Elmer DSC7 температура начала плавления оротата, полученного как описано в примере 1, составляла 177°С.
По данным термогравиметрического анализа (ТГА) на приборе Mettler TGA850 при нагревании потери при высушивании образца составили 0,07% вплоть до 160°С.
При анализе ДСК скорость нагрева составляла 10 К/мин и при анализе ТГА скорость нагрева составляла 20 К/мин.
Энантиомерная чистота
Энантиомерную чистоту соли, полученной, как описано в примере 1, определяли методом стереоспецифической ЖХВР. Стереоспецифическое разделение проводили на хиральной колонке (Chiral AGP). Энантиомерная чистота е.е. составляла 100%.
Элементный анализ
Элементный анализ позволяет определить содержание элементов, присутствующих в оротате алискирена. Оценку содержания воды проводили при 130°С после обезвоживания. Данные элементного анализа соответствуют общей формуле оротата алискирена в пределах стандартного отклонения.
Пример 2
Альтернативный способ получения оротота (2(S),4(S),5(S),7(S)-N-(3-амино-2,2-диметил-3-оксопропил)-2,7-ди(1-метилэтил)-4-гидрокси-5-амино-8-[4-метокси-3-(3-метоксипропокси)фенил]октанамида
6,07 г (2(S),4(S),5(S),7(S)-N-(3-амино-2,2-диметил-3-оксопропил)-2,7-ди(1-метилэтил)-4-гидрокси-5-амино-8-[4-метокси-3-(3-метоксипропокси)фенил]октанамида в форме свободного основания растворяли в 75 мл ацетонитрила. После добавления 1,57 г безводной оротовой кислоты суспензию нагревали до 75°С. Полученный слегка опалесцирующий раствор перемешивали при приблизительно 75°С в течение 80 мин. (Наблюдалась медленная кристаллизация через приблизительно 15 мин при 75°С.) Суспензию охлаждали до комнатной температуры в течение приблизительно 1 ч и фильтровали. Кристаллы промывали 25 мл ацетонитрила и сушили при 40°С и приблизительно 8 мбар в течение ночи, при этом получали твердое вещество белого цвета.
Продукт характеризовали, как указано в примере 1.
Настоящее изобретение относится к новой соли алискирена с оротовой кислотой, ее получению и применению и фармацевтическим препаратам, содержащим указанную соль. Соль алискирена с оротовой кислотой применяют для получения лекарственного средства, предназначенного для профилактики или лечения заболеваний или состояний, которые поддаются лечению при ингибировании ренина. Способ получения соли алискирена с оротовой кислотой заключается в том, что (1) алискирен в виде свободного основания и оротовую кислоту растворяют в органическом растворителе, (2) растворитель смешанного раствора концентрируют при нагревании, при необходимости при пониженном давлении, и при медленном охлаждении до комнатной температуры упаривают с выделением осадка, (3) суспензию фильтруют и высушивают, при этом получают соль. Технический результат - новая соль алискирена с оротовой кислотой, обладающая высокой физической и химической стабильностью. 4 н. и 6 з.п. ф-лы, 3 табл., 2 пр.
1. Соль соединения формулы I
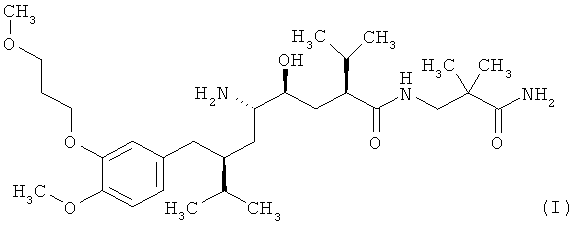
и оротовой кислоты.
2. Соль по п.1 в кристаллической, частично кристаллической или аморфной форме.
3. Соль по п.1, которая характеризуется
ИК-спектром, полосы при длине волны в см-1 (±2 см-1): 3426 (сл.), 3161 (ср., широкая), 3098 (сл.), 2962 (ср.), 2875 (сл.), 2834 (сл.), 1674 (с.), 1564 (ср.), 1517 (ср.), 1488 (сл.), 1422 (сл.), 1371 (ср.), 1261 (сл.), 1237 (сл.), 1188 (сл.), 1161 (сл.), 1140 (сл.), 1026 (ср.), 924 (сл.), 880 (сл.), 847 (сл.), 808 (сл.), 773 (ср.), 641 (сл., широкая) или
порошковой дифрактограммой, полученной на порошковом дифрактометре Bruker D8 Advance, пики (±0,2° 2Θ):
4,4 (с.), 8,7 (ср.), 10,5 (сл.), 14,4 (ср.), 17,7 (с.), 19,3 (ср.), 19,9 (сл.), 20,8 (сл.), 22,2 (с.), 23,0 (ср.), 25,2 (сл.), 26,8 (ср.).
4. Соль по п.1 в форме сольвата.
5. Соль по п.1 в форме гидрата.
6. Соль по п.1 в форме, выбранной из группы, включающей
(1) кристаллическую форму,
(2) частично кристаллическую форму,
(3) аморфную форму и
(4) полиморфную форму.
7. Фармацевтический препарат, ингибирующий ренин, содержащий терапевтически эффективное количество соединения по любому из пп.1-6 и фармацевтически приемлемый эксципиент или добавку.
8. Фармацевтический препарат по п.7, содержащий соль по любому из пп.1-6 в комбинации по крайней мере с одной композицией, которую выбирают из группы, включающей:
(1) ингибитор редуктазы HMG-Co-A или ее фармацевтически приемлемую соль,
(2) ингибитор ангиотензин-конвертирующего фермента (АКФ) или его фармацевтически приемлемую соль,
(3) блокатор кальциевых каналов (ССВ) или его фармацевтически приемлемую соль,
(4) ингибитор альдостеронсинтазы или его фармацевтически приемлемую соль,
(5) антагонист альдостерона или его фармацевтически приемлемую соль,
(6) двойной ингибитор ангиотензин-конвертирующего фермента/нейтральной эндопептидазы (АКФ/НЭП) или их фармацевтически приемлемую соль,
(7) антагонист эндотелина или его фармацевтически приемлемую соль,
(8) блокаторы рецептора ангиотензина II (ARB) или их фармацевтически приемлемые соли и
(9) диуретик или его фармацевтически приемлемую соль.
9. Применение соединения по любому из пп.1-6 для получения лекарственного средства, предназначенного для профилактики или лечения заболеваний или состояний, которые поддаются лечению при ингибировании ренина.
10. Способ получения соли по п.1, который заключается в том, что
1) алискирен в виде свободного основания и оротовую кислоту растворяют в органическом растворителе,
2) растворитель смешанного раствора концентрируют при нагревании, при необходимости при пониженном давлении, и при медленном охлаждении до комнатной температуры упаривают с выделением осадка,
3) суспензию фильтруют и высушивают, при этом получают соль.
| Устройство для генерации звука | 1977 |
|
SU678503A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| RU 2004137104 A, 10.09.2005. | |||
Авторы
Даты
2012-07-20—Публикация
2007-11-07—Подача