Изобретение относится к медицине, а именно к неонатологии, гематологии, педиатрии, и может применяться с целью оценки риска возникновения мультифакторной патологии у детей, рожденных с помощью применения вспомогательных репродуктивных технологий в семьях с синдромом потери плода и имеющих генетические полиморфизмы предрасположенности к тромбофилии, нарушениям фолатного цикла и эндотелиальной дисфункции для определения тактики диагностики, профилактики и лечения.
Повышение рождаемости является одной из составляющих сохранения и укрепления здоровья, особенно, с учетом высокого уровня потерь населения, снижения средней продолжительности жизни и сокращения детской популяции. Тем временем существующая частота бесплодных браков в РФ составляет более 20% среди супружеских пар, что по данным Всемирной организации здравоохранения (ВОЗ), является критическим уровнем. По мнению ВОЗ решением проблемы является использование вспомогательных репродуктивных технологий (ВРТ), как самого эффективного метода лечения бесплодия. Однако заключения систематических обзоров и мета-анализов (Cochrane database), посвященных качеству здоровья детей, рожденных с помощью применения ВРТ, варьируют, причем выводы во многом противоположные.
Несмотря на развитие репродуктивных методик, появление новых методов избирательной оценки эмбриона, культуральных сред, лабораторного и инструментального оборудования, частота наступления беременности не превышает от 40 до 50% в центрах ВРТ. При исключении хромосомных, инфекционных, эндокринных, анатомических и других причин бесплодия, этиологическими факторами у 71% пациенток с синдромом потери плода (СПП), структуру которого непосредственно составляют неудачи ВРТ, являются генетические полиморфизмы факторов системы гемостаза, клинически проявляющихся развитием тромбозов и эндотелиальной дисфункцией. Многие авторы, рассматривая бесплодие и невынашивание беременности с позиций единого патологического процесса нарушения функции деторождения и обусловленного индивидуальной поломкой тонких механизмов репродукции: гаметогенеза, оплодотворения, имплантации, эмбрионального развития, акцентируют внимание на генетических факторах предрасположенности к инфертильности.
Известны методические рекомендации лаборатории пренатальной диагностики НИИ АГ им. Д.О.Отта СЗО РАМН (зав. лабораторией, акад. Баранов В.А.), утвержденные главным педиатром Министерства обороны РФ, заведующим кафедрой детских болезней ВМА, профессором Н.П.Шабаловым Н.П., согласно которым, на основании балльной оценки возможно определять риск развития мультифакторной патологии у детей. Так, исходя из полученного количества баллов, ребенка относят к определенной группе риска развития мультифакторной патологии: низкого (от 0 до 2 баллов), среднего (от 2 до 4 баллов) и высокого риска (от 4 и выше баллов).
Однако при определении группы риска оцениваются клинико-анамнестические признаки течения и исходов только неонатального периода у младенцев, что снижает вероятность выявления риска развития мультифакторных заболеваний у детей, в частности, рожденных с помощью вспомогательных репродуктивных технологий в семьях с синдромом потери плода.
Авторами поставлена задача разработать способ прогнозирования развития мультифакторной патологии у детей, рожденных с помощью вспомогательных репродуктивных технологий в семьях с синдромом потери плода, что позволит отслеживать здоровье и качество жизни ребенка, учитывать и профилактировать младенческую заболеваемость, инвалидность и смертность.
Техническая задача - выявление детей с высоким риском развития мультифакторных заболеваний.
Решение поставленной задачи достигается тем, что в способе прогнозирования развития мультифакторной патологии у детей, рожденных с помощью вспомогательных репродуктивных технологий в семьях с бесплодием по клиническим и анамнестическим признакам с присвоением баллов, согласно изобретению, анамнестические и клинические признаки оценивают в анте-, интра- и неонатальные периоды жизни ребенка, причем в анте- и интранатальный периоды определяют: X1 - наличие у матери анемии во время беременности, X2 - наличие угрозы прерывания настоящей беременности, X3 - наличие хронической фето-плацентарной недостаточности, X4 - наличие гестоза, X5 - родоразрешение путем операции кесарева сечения; в неонатальный период жизни ребенка определяют: X6 - нахождение ребенка в палате интенсивной терапии или реанимации, X7 - перевод в лечебно-профилактическое учреждение, X8 - назначение антибактериальной терапии, X9 - отсроченность вакцинации, X10 - назначение инфузионной терапии, X11 - назначение парентерального питания, X12 - назначение препаратов крови, X13 - оценка состояния ребенка по шкале Апгар на 1 минуте жизни и рассчитывают значения дискриминантных функций Y1 и Y2 по формулам:
Y1=-136,805+11,123*X1+15,622*X2+16,737*X3+10,728*X4+8,285*X5+44,296*X6-15,549*X7+27,818*X8-16,443*X9+5,231*X10-28,815*X11+24,319*X12+23,134*X13;
Y2=-172,87+13,898*X1+22,385*X2+23,460*X3+15,047*X4+8,820*X5+35,859*X6-3,348*X7+19,418*X8-13,431*X9+18,444*X10-39,685*X11+28,512*X12+22,949*X13,
где Y1 - дискриминантная функция группы детей, имеющей низкую предрасположенность развития мультифакторной патологии,
Y2 - дискриминантная функция группы детей, имеющей высокий риск развития мультифакторной патологии,
X1, X2, …, X13 - значения клинико-анамнестических признаков, при этом признакам X1-X12 при наличии присваивают 2 балла, а при отсутствии - 1 балл; X13 - оценивается в баллах по шкале Апгар;
-136,805 и -172,87 - свободные члены,
и если значение функции Y2 больше значения функции Y1, ребенка относят к группе с высоким риском развития мультифакторной патологии и рекомендуют проведение молекулярно-генетического исследования для детекции неблагоприятных полиморфных генов.
Авторами установлено, что, несмотря на 25% вариант менделеевского наследования единичных нуклеотидных замен, дети, рожденные в семьях с бесплодием, достоверно чаще получают неблагоприятные варианты генов от своих родителей, ассоциированные с риском развития мультифакторных заболеваний, клинически проявляющиеся развитием тромбозов, приводящим к росту заболеваемости, инвалидности и смертности столь долгожданных детей (проведена оценка генетического статуса 82-х семей и 112 детей). Исследуемые дети, согласно методических рекомендаций лаборатории пренатальной диагностики НИИ АГ им. Д.О.Отта СЗО РАМН, авторами были разбиты на группы по клинико-анамнестическим признакам, факторам течения и исходам неонатального периода: группа детей, имеющих 4 балла и более (n=31), и группа детей с баллами от 0 до 3,99 (n=81). В этих группах исследовали анамнестические и клинические признаки ребенка в анте-, интра- и неонатальные периоды жизни: наличие у матери анемии, осложненное течение настоящей беременности - развитие гестоза, хронической фето-плацентарной недостаточности, неоднократная угроза прерывания и родоразрешение путем операции кесарева сечения, так и в оценке состояния здоровья новорожденных. Было выявлено, что на этапе раннего неонатального периода дети, относящиеся к группе высокого риска по развитию мультифакторной патологии, достоверно чаще на первой минуте жизни имели низкую оценку по шкале Апгар (менее 6 баллов). Младенцы группы высокого риска чаще были переведены на 2-ой этап выхаживания (в 6 раз) и находились в палате интенсивной терапии или реанимации (в 8 раз), с последующим назначением антибактериальной (в 4,8 раз) и инфузионной терапии (в 6,8 раз), парентерального питания (4,9 раз), препаратов крови (в 11,3 раз), а также имели отсроченность вакцинопрофилактики на более поздний период (в 9,6 раз).
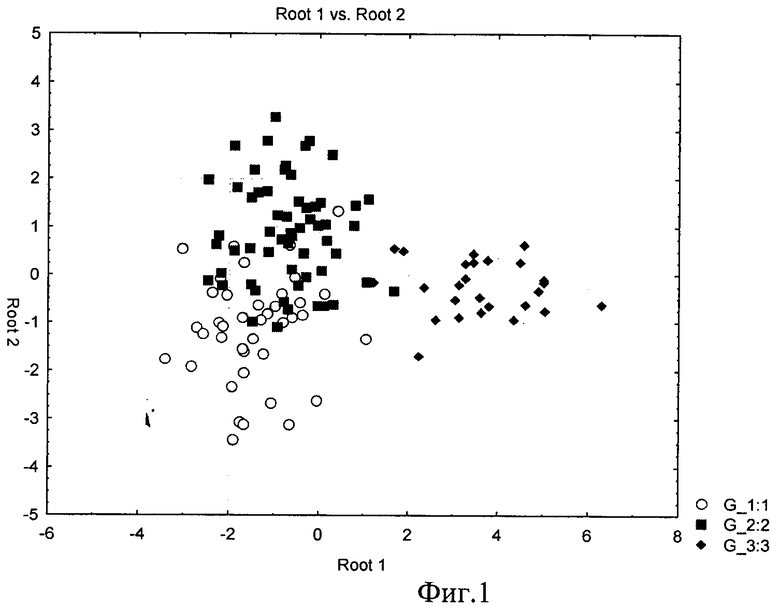
На основании информативных признаков, а также переменных, полученных в результате применения кластерного анализа к подгруппам клинических признаков в 1, 3, 6, 12 месяцев авторами, с целью определения риска развития мультифакторной патологии был проведен дискриминантный анализ. Полученные при однофакторном изучении признаки, количество которых составило 102, были обработаны в пакете прикладных статистических программ Statistica 6.1 (Серийный номер №AXXR802D900711FA). Обобщены и систематизированы достоверные анамнестические и клинические признаки, характерные для определенного класса детей с предрасположенностью к мультифакторной патологии. Графически разделение объектов в пространстве признаков представлено на Фиг.1. Согласно кластерному разделению объектов было выделено два класса: 1-ый класс объединяет группу детей с низким и средним риском развития мультифакторной патологии (от 0 до 3,99 баллов) и 2-ой класс характеризует детей, относящихся к группе высокого риска (4 балла и более) по реализации мультифакторной патологии. Иными словами, в группе младенцев, с высокой генетической предрасположенностью к развитию мультифакторной патологии, зарегистрирована отличительная от детей группы низкого риска совокупность анамнестических и клинических признаков. В результате были отобраны 13 наиболее информативных признаков, представленных в таблице 1.
Для формализации решающего правила была описана функция классификации, представляющая собой линейную комбинацию эффектов с коэффициентами. Число функций классификации равно количеству уровней зависимой переменной, то есть в данном случае двум.
Каждая функция классификации имеет следующий вид:

где fi - i-ая функция классификации, xj - j-ый эффект плана, aij - коэффициент i-ой функции классификации при j-ом эффекте плана, а0 - свободный член.
Авторами обосновано, что для каждого класса предрасположенности к развитию мультифакторной патологии характерен определенный комплекс признаков, характеризующих состояние ребенка в анте-, интра- и неонатальные периоды жизни. Выбранные признаки являются независимыми переменными. Признакам присваивали числовой код в баллах по шкале оценки признаков либо вносили его значение, если признак непрерывный. В таблице 1 представлены коэффициенты классифицирующих функций.
кий балл
Входные параметры обучающей выборки были обработаны в пакете прикладных статистических программ Statistica 6.1 (Серийный номер №AXXR802D900711FA) - блок дискриминантного анализа. Были получены следующие результаты: число переменных - 13, классифицирующий признак - класс предрасположенности к мультифакторной патологии, число классов (групп) - 2, Wilks' Lambda - 0,096.
Полученное значение параметра Wilks' Lambda, характеризующее силу дискриминации объектов, было равно 0,096, что свидетельствовало о сильном разделении совокупности объектов на 2 группы:
1 - низкий и средний риск развития мультифакторной патологии;
2 - высокая предрасположенность к реализации мультифакторной патологии.
Определено решающее правило:
Y1=-136,805+11,123*X1+15,622*X2+16,737*X3+10,728*X4+8,285*X5+44,296*X6-15,549*X7+27,818*X8-16,443*X9+5,231*X10-28,815*X11+24,319*X12+23,134*X13;
Y2=-172,87+13,898*X1+22,385*X2+23,460*X3+15,047*X4+8,820*X5+35,859*X6-3,348*X7+19,418*X8-13,431*X9+18,444*X10-39,685*X11+28,512*X12+22,949*X13,
где Y1, Y2 - значения координат объекта исследования в пространстве:
X1, X2, …, X13 - значения клинико-анамнестических признаков у детей, рожденных в семьях с бесплодием, в баллах.
Клинико-анамнестические признаки оценивают в баллах, согласно таблице 1, либо присваивают его значение, если признак непрерывный. Полученные данные математически обрабатывают. Для каждого конкретного наблюдения, которое должно быть классифицировано, вычисляются все функции классификации. Наблюдение относится к тому классу, для которого функция классификации примет наибольшее значение, так к 1-ой группе (Y1>Y2) относятся дети, имеющие низкую предрасположенность развития мультифакторной патологии, которые не нуждаются в проведении молекулярно-генетического исследования, к 2-ой группе (Y2<Y1) относятся дети, имеющие высокую предрасположенность к реализации мультифакторной патологии и требующие молекулярно-генетического исследования неблагоприятных полиморфных генов и гемостазиограммы для детекции фенотипических проявлений. Полученные решающие правила имеют высокую степень валидности, прежде всего за счет высокой чувствительности, что представлено в табл.2.
Высокая валидность решающего правила (96,6%) позволяет отнести ребенка к определенной группе риска и проводить динамическое наблюдение за данной категорией детей.
Предлагаемый способ осуществляется следующим образом.
При осмотре пациента врач проводит оценку его состояния по клинико-анамнестическим признакам в анте-, интра- и неонатальные периоды жизни, проставляет значение признака, если признак непрерывный (оценка по шкале Апгар) или присваивает признаку определенный балл: при наличии признака - 2 балла при отсутствии - 1 балл (Таблица 1). Выявленные данные подставляет в решающее правило и вычисляет значения Y1 и Y2 пациента. Математическую обработку и хранение данных возможно так же производить, используя компьютерную программу (программа для ЭВМ - Регистр детей, рожденных с помощью вспомогательных репродуктивных технологий, свидетельство №2010612465, Плаксина А.Н., ГОУ ВПО УГМА Росздрава, Екатеринбург, от 08.04.2010).
На основании полученных данных ребенка относят к той или иной группе риска и формулируют показания для проведения молекулярно-генетического исследования на наличие генетических полиморфизмов генов тромбофилии, нарушений фолатного цикла и эндотелиальной дисфункции. При Y1>Y2 устанавливают, что факт предрасположенности к мультифакторным заболеваниям отсутствует, и ребенка относят к 1-ой группе с низкой предрасположенностью развития мультифакторной патологии. Эти дети не нуждаются в проведении молекулярно-генетического исследования. Если Y2>Y1, ребенка относят ко 2-ой группе с высокой предрасположенностью к реализации мультифакторных заболеваний. В этом случае обязательно требуется проведение молекулярно-генетического исследования для детекции неблагоприятных полиморфных генов. Кроме того, рекомендуется диагностика гемостазиологического статуса, а именно его коагуляционного, тромбоцитарно-сосудистого звеньев, исследования концентрации гомоцистеина с целью типирования фенотипических проявлений данных полиморфизмов. Назначение терапии показано только при клинической картине тромботических осложнений.
Используя информацию об анамнестических и клинических признаках ребенка, рожденного при помощи вспомогательных репродуктивных технологий в семьях, имеющих синдром потери плода, врач в течение неонатального периода с 96,6% вероятностью может определить риск развития тромботических осложнений, обусловленных генетической предрасположенностью к мультифакторным заболеваниям на самых ранних этапах онтогенеза, когда, нередко, фенотипические признаки слабо выражены. Данные же генетического исследования демонстрируют наличие предрасположенности к той или иной мультифакторной патологии, и должны подкрепляться как лабораторными, так и/или клиническими проявлениями.
Таким образом, предлагаемый способ прогнозирования развития мультифакторной патологии у детей позволит учитывать и профилактировать младенческую заболеваемость, инвалидность и смертность.
Клинические примеры.
Пример 1. Семья К., в течение десяти лет наблюдалась в женской консультации по причине бесплодия. В анамнезе имела место регрессирующая беременность и одна неудачная попытка экстракорпорального оплодотворения (ЭКО). В результате второй попытки ЭКО, с положительным результатом, на фоне угрозы прерывания с ранних сроков беременности, фетоплацентарной недостаточности, анемии и гестоза средней степени тяжести, развивалась бихориальная биамниотическая двойня. Оперативное родоразрешение путем операции кесарево сечение было проведено в сроке 33 недель по причине преждевременного излития околоплодных вод и отсутствия эффекта от терапии, сохраняющей беременность. Масса тела при рождении первого ребенка 1670 г, длина тела 41 см, второго ребенка - 1721 г, длина тела 42 см. Оценка по Апгар на первой минуте жизни первого ребенка - 6 баллов, второго ребенка - 5 баллов, проведена санация верхних дыхательных путей, тактильная стимуляция. Дети до 9-х суток жизни находились в палате интенсивной терапии, затем были переведены на второй этап выхаживания в отделение патологии новорожденных. Второй мальчик с диагнозом: «Гипоксически-ишемическая энцефалопатия (ГИЭ), средней степени тяжести, перивентрикулярная ишемия 1-2 степени. Функциональная недостаточность ЖКТ. Анемия недоношенных, тяжелой степени. Двухсторонняя пирамидная недостаточность. Гипербилирубинемия. Кардиопатия» в течение 32 дней находился в отделении патологии недоношенных, где получал антибактериальную, инфузионную терапию, частичное парентеральное питание, однократную трансфузию препаратов крови (отмытая эритроцитарная взвесь), а также имел отложение сроков вакцинопрофилактики после выписки из ЛПУ. Первый же ребенок из двойни характеризовался более благоприятным клиническим течением позднего неонатального периода, без применения парентерального питания и препаратов крови.
В дальнейшем второй ребенок наблюдался на амбулаторно-поликлиническом участке врачом-педиатром и неврологом как реконвалесцент по ГИЭ. В возрасте восьми месяцев на относительно благополучном фоне развилась клиника правостороннего гемипареза. Ребенок был госпитализирован. При проведении компьютерной томографии, магнитно-резонансной томографии (МРТ) головного мозга с сосудистой программой диагностирован ишемический инсульт с геморрагическим пропитыванием в бассейне левой среднемозговой артерии. При обследовании коагуляционного звена, в гемостазиограмме были отмечены признаки диссеминированного внутрисосудистого свертывания крови (ДВС) с высокой концентрацией D-димеров, фактора Виллебранда, повышением агрегационной активности тромбоцитов, индуцированной аденозиндифосфатом (АДФ), ристомицином, коллагеном. На фоне проводимой терапии, коррегирующей гемостазиологические нарушения, отмечена положительная клинико-лабораторная динамика, нормализация неврологического статуса. Учитывая анамнестические данные (длительный стаж бесплодия, безрезультативная попытка ЭКО, регресс беременности), было заподозрено врожденное тромбофилическое состояние. С целью подтверждения данной нозологии семье было проведено молекулярно-генетическое исследование основных маркеров тромбофилии методом полимеразно-цепной реакции (ПЦР) в реальном времени на тест-системах и оборудовании научно-производственного объединения «ДНК-технология» (Москва). При обследовании были получены следующие данные. У ребенка с тромбозом средней мозговой артерии выявлены мутации по гетерозиготному типу в генах фибриногена (0 баллов), тромбоцитарного гликопротеина IIIa (0,5 балла), ингибитора активатора плазминогена (1 балл) и гомозиготное носительство точковых мутаций метилентетрагидрофолатредуктазы (3 балла), эндотелиальной NO-синтетазы (2 балла). При обследовании другого ребенка отмечено иное сочетание маркеров тромбофилии: гетерозиготный вариант мутации генов, кодирующих V фактор (Лейденская мутация) 506A/G (3 балла), ингибитор активатора плазминогена PAI-1 4G/5G (1 балл) и тромбоцитарный гликопротеин III ITGB3 1565 T>C (0,5 балла). У матери диагностировано гетерозиготное носительство мутантного гена фибриногена 455G/A, и ингибитора активатора плазминогена PAI-1 4G/5G. У отца выявлено гомозиготное носительство ингибитора активатора плазминогена PAI-1 4G/4G. Ребенок получал курс лечения в условиях неврологического отделения, и с положительной динамикой через 21 день был выписан на амбулаторный этап под наблюдение участкового педиатра и невролога.
Согласно предлагаемому способу у второго ребенка, перенесшего тромбоз средней мозговой артерии и имеющего 6,5 баллов степени риска развития мультифакторной патологии (2 класс), в анамнезе отмечалось патологическое течение беременности матери (анемия, угроза прерывания настоящей беременности, ХФПН, гестоз, родозразрешение путем операции кесарево сечение), нахождение ребенка, на этапе родильного дома, в палате интенсивной терапии с последующим переводом на второй этап выхаживания и назначением антибактериальной, инфузионной терапии, парентерального питания, препаратов крови, а также отложения сроков вакцинопрофилактики. Значения непрерывных признаков и баллы признаков, оцененных по шкале балльной оценки таблицы 1, подставили в формулу и вычислили значение дискриминантных функций. В результате расчетов получены следующие данные.
Y1=-136,805+11,123*2+15,622*2+16,737*2+10,728*2+8,285*2+44,296*2-15,549*2+27,818*2-16,443*2+5,231*2-28,815*2+24,319*2+23,134*5=185,569
Y2=-172,87+13,898*2+22,385*2+23,460*2+15,047*2+8,820*2+35,859*2-3,348*2+19,418*2-13,431*2+18,444*2-39,685*2+28,512*2+22,949*5=200,627
Соответственно Y2>Y1, следовательно, ребенок относится к группе высокого риска по развитию тромбофилического состояния и, с вероятностью 96,6%, может иметь неблагоприятные аллельные варианты полиморфных генов в сумме более 4-х баллов, что и подтвердилось результатами молекулярно-генетического типирования (6,5 баллов).
Первый ребенок из двойни согласно предлагаемому способу так же был классифицирован как группа высокого риска (Y1=102,704; Y2=245,922), несмотря на отсутствие применения парентерального питания и назначения трансфузионных сред. Тем не менее отнесение ребенка к группе высокого риска подтвердилось данными молекулярно-генетического анализа (4,5 балла). Клинической особенностью первого ребенка явилось наличие врожденного порока сердца (дефект межжелудочковой перегородки), по поводу чего мальчик был прооперирован в пятимесячном возрасте с целью его коррекции.
Пример 2. Девочка Б., рождена от третьей беременности, первых преждевременных родов. Первая беременность матери закончилась самопроизвольным выкидышем в 10 недель, вторая - регрессом. Настоящая беременность сопровождалась перманентной угрозой прерывания, прогрессированием фето-плацентарной недостаточности (с 20 недель гестации), с развитием прекэлампсии, острого нарушения маточно-плацентарного кровообращения в сроке 30 недель (по ультразвуковым данным визуализировался тромбоз артерий пуповины) и последующего экстренного оперативного родоразрешения. Масса тела при рождении 1400 гр., длина тела 41 см. Оценка по Апгар на первой минуте - 3 балла, проведена санация верхних дыхательных путей, интубация трахеи, начата ИВЛ, оценка по Апгар на 5 минуте жизни 5 баллов. В родовом зале эндотрахеально введен куросурф. Состояние девочки с рождения тяжелое, обусловленное течением респираторного дистресс-синдрома новорожденного и нарастанием отека головного мозга, а также развитием ишемии левой нижней конечности, клинически проявляющейся бледностью, похолоданием (градиент температуры по сравнению со здоровой конечностью составлял -8C°) и отсутствием пульсации на протяжении до левой подвздошной артерии. Через тридцать минут появился выраженный цианоз конечности и отмечалась разница в диаметре до 4 см по отношению к здоровой ноге. Учитывая тяжесть состояния, ребенок был перегоспитализирован в отделение реанимации и интенсивной терапии новорожденных Областной детской клинической больницы №1, переведен на аппаратное дыхание и поставлен предварительный диагноз «Тромбоз левой подвздошной артерии», начата инфузионная терапия гепарином 50 ЕД/кг веса болюсно, в последующем 30 ЕД/кг/ массы в час в сочетании со свежезамороженной плазмой. В гемостазиограмме зафиксировано значительное снижение уровня антитромбина AT-III до 7% (норма 75-122%). При допплеровском обследовании выявлены гемодинамически значимые нарушения кровотока в сосудах левой нижней конечности. На фоне проводимого лечения отмечалась положительная динамика по клинической и ультразвуковой картине - уменьшение отечности конечности и восстановление кровотока. При проведении молекулярно-генетического исследования у ребенка диагностировано гомозиготное носительство мутантных генов ингибитора активатора плазминогена PAI-1 4G/4G (2 балла), тромбоцитарного гликопротеина ITGA2 и ITGB3 (2 балла), генов эндотелиальной дисфункции MTHFR С677Т (2 балла), NOS3 C298T (2 балла). При обследовании семьи данного ребенка выявлено гетерозиготное носительство ингибитора активатора плазминогена PAI-1 4G/5G, тромбоцитарные гликопротеины ITGA2 807 C>T, ITGB3 1565 T>C, MTHFR C677T, NOS3 C298T, повышающих риск развития патологии гемостаза по сравнению с популяцией. У матери было выявлено гомозиготное носительство мутантного гена ингибитора активатора плазминогена PAI-1 4G/4G, что, возможно, явилось причиной развития хронического, а в последующем и острого нарушения маточно-плацентарного кровообращения и преждевременного родоразрешения. Идентичные гетерозиготные полиморфизмы были выявлены в генах тромбоцитарного гликопротеина ITGA2, MTHFR С677Т, NOS3 C298T. В анамнезе данной семьи имела место гибель деда ребенка со стороны матери от инфаркта миокарда в возрасте 33 лет.
Согласно предлагаемому способу, при оценке клинико-анамнестических данных ребенка, у матери отмечено наличие угрозы прерывания беременности, ХФПН, гестоза тяжелой степени, а также неблагоприятное течение неонатального периода ребенка (нахождение в реанимационном отделении, перевод на второй этап выхаживания, назначение антибактериальной, инфузионной терапии, парентерального питания, отложение вакцинопрофилактики). Используя значения баллов признаков, рассчитали значения дискриминантной функции:
Y1=-136,805+11,123*1+15,622*2+16,737*2+10,728*2+8,285*2+44,296*2-15,549*2+27,818*2-16,443*2+5,231*2-28,815*2+24,319*1+23,134*3=-11,129
Y2=-172,87+13.898*l+22,385*2+23,460*2+15,047*2+8,820*2+35,859*2-3,348*2+19,418*2-13,431*2+18,444*2-39,685*2+28,512*1+22,949*3=112,325
Пациентка Б. отнесена к группе высокого риска по развитию мультифакторной патологии, так как вторая функция Y2 имеет большее значение. Подтверждением данному факту являются данные молекулярно генетического исследования генетических полиморфизмов предрасположенности к тромбофилии, нарушениям фолатного цикла и эндотелиальной дисфункции общей суммой в 8 баллов.
Пример 3. Ребенок С. родился от III беременности, наступившей при помощи вспомогательных репродуктивных технологий, проведенных по причине синдрома потери плода в семье. Предыдущие две беременности матери закончились регрессом в 12 и в 14 недель гестации. Настоящая беременность характеризовалась угрозой прерывания, ХФПН, анемии матери, развитием преэклампсии и преждевременным оперативным родоразрешением в сроке 29 нед, по показаниям со стороны матери. Масса тела при рождении 1300 г, длина тела 40 см. Оценка по Апгар на первой минуте - 2 балла, проведена санация верхних дыхательных путей, интубация трахеи, эндотрахеально введен куросурф, инициирована ИВЛ. С рождения состояние ребенка оценивалось как тяжелое. Тяжесть состояния была обусловлена дыхательной и церебральной недостаточностью, вследствие чего ребенок получал продленную искусственную вентиляцию легких в течение 10 дней. Из родильного дома ребенок на третьи сутки жизни был переведен в отделение реанимации и интенсивной терапии новорожденных Областной детской клинической больницы с диагнозом: «Гипоксически-ишемическая энцефалопатия (ГИЭ), тяжелой степени, перивентрикулярная ишемия 1-2 степени. Острая церебральная недостаточность. Энтеральная недостаточность. Анемия средней степени тяжести. Недоношенность 29 недель». В течение 14 дней ребенок получал парентеральное питание, инфузионную и антибактериальную терапию, неоднократно (три раза) трансфузию препаратов крови. Для последующего выхаживания и реабилитации на 14 сутки жизни ребенок был переведен в отделение патологии недоношенных. Однако сохранялась клиника церебральной и энтеральной недостаточности, синдрома системного воспалительного ответа. По данным гемостазиограммы выявлялись фенотипические признаки как гипокоагуляции снижение протромбинового времени, так и дефицита фибринолитического звена гемостаза (снижение фибринолиза), нарастание продуктов деградации фибрина (D-димеры, РФМК), положительные ортофенантролиновый и этаноловый тесты, значительное снижение уровня антитромбина AT-III до 7% (норма 75-122%). Учитывая отягощенный акушерский анамнез матери, а также клинически признаки неонатального периода, согласно предложенного способа рассчитаны значения дискриминантных функций:
Y1=-136,805+11,123*2+15,622*2+16,737*2+10,728*2+8,285*2+44,296*2-15,549*2+27,818*2-16,443*2+5,231*2-28,815*2+24,319*2+23,134*2=116,167
Y2=-172,87+13,898*2+22,385*2+23,460*2+15,047*2+8,820*2+35,859*2-3,348*2+19,418*2-13,431*2+18,444*2-39,685*2+28,512*2+22,949*2=131,78
По превалированию второй функции классификации пациент был отнесен к высокой группе риска.
Проведен анализ полиморфных аллельных вариантов ДНК, выделенных из буккального эпителия, и диагностировано гомозиготное носительство мутантных генов ингибитора активатора плазминогена PAI-1 4G/4G (2 балла), генов эндотелиальной дисфункции e-NOS3 C298T (2 балла), фолатного цикла MTHFR C677T (3 балла), тромбоцитарного гликопротеина к коллагену ITGA2 (1балл). При диагностике генетических полиморфизмов у матери и отца ребенка выявлено гетерозиготное носительство ингибитора активатора плазминогена PAI-1 4G/5G, тромбоцитарных гликопротеинов, как к коллагену, так и к фибриногену ITGA2 807 C>T, ITGB3 1565 T>C, и гомозиготное носительство гена NOS3 C298T, MTHFR C677T.
Ребенок неоднократно был проконсультирован хирургами для исключения хирургической патологии. В возрасте 1 мес. 22 дней состояние резко ухудшилось за счет прогрессирования клиники пареза кишечника. По рекомендации хирургов ребенок был прооперирован с установкой микроирригатора в корень брыжейки кишки. Послеоперационный период протекал с осложнениями в виде тяжелой динамической кишечной непроходимости. Ребенку вновь была сделана релапаротомия с субтотальной резекцией тонкой кишки. Тем не менее через пять дней после повторной операции, вследствие гемодинамических нарушений и развития некупирующегося кровотечения ребенок умер. На патологоанатомическом вскрытии визуализировались множественные перфорации тонкой кишки, облитерирующая артериопатия брыжейки тонкой кишки. Патологоанатомический диагноз: Ишемическая гастроэнтеропатия, субтотальный некроз с очагами геморрагического пропитывания стенки тонкой кишки.
Пример 4. Мальчик Г., был зачат с помощью применения вспомогательных репродуктивных технологий, вследствие вторичного бесплодия трубно-перитонеального генеза (спаечный процесс как осложнение гнойного аппендицита). Беременность характеризовалась физиологическим протеканием: отсутствием анемии, патологических прибавок массы тела, угрозы прерывания, стабильным артериальным давлением. Родоразрешение было проведено через естественные родовые пути в доношенном сроке гестации 39 недель. Массо-ростовые показатели составили 3400 г, 51 см. Оценка по шкале Апгар на первой минуте жизни - 7 баллов. Ребенок с первых по 5-ые сутки на этапе родильного дома находился на совместном пребывании в палате «Мать и дитя». На 1-е сутки был вакцинирован против вируса гепатита B, на
5-е сутки - против туберкулеза и выписан на амбулаторно-поликлинический этап под наблюдение участкового педиатра. Дальнейшая вакцинопрофилактика проводилась согласно Региональному календарю прививок.
При оценке риска предрасположенности к мультифакторной патологии, предложенным способом были получены следующие значения функций:
Y1=-136,805+11,123*1+15,622*1+16,737*1+10,728*1+8,285*1+44,296*1-15,549*1+27,818*1-16,443*1+5,231*1-28,815*1+24,319*1+23,134*7=128,485
Y2=-172,87+13,898*l+22,385*l+23,460*l+15,047*l+8,820*1+35,859*1-3,348*1+19,418*1-13,431*1+18,444*1-39,685*1+28,512*1+22,949*7=117,152
По превалированию функции первого решающего правила классификации пациент относится к группе низкого риска по реализации мультифакторной патологии, что было подтверждено молекулярно-генетическим анализом. При детекции неблагоприятных полиморфных аллелей было выявлено только наличие тромбоцитарных гликопротеинов к коллагену (ITGA2 807 С>T) в гетерозиготном носительстве (0,5 балла).
Анализ полиморфизмов 8-ми генов, вовлеченных в регуляцию гемостаза, у детей, рожденных при помощи ВРТ, от бесплодных пар с СПП, продемонстрировал достоверную значимость исследуемых точковых мутаций в развитии как тромботических (клинические случаи тромбоза), так и нетромботических эффектов тромбофилии (критические состояния, синдромы дизадаптации) на анте - и постнатальных периодах жизни. При балльной оценке степени риска развития мультифакторных заболеваний необходимо акцентировать профилактические звенья именно на выявляемые этиопатогенетические аспекты. При выявлении высокой степени риска необходимо проведение дополнительных лабораторно-диагностических исследований для идентификации фенотипических проявлений существующих полиморфизмов. При госпитализации пациента необходимо информировать лечащего врача о существующей генетической предрасположенности для проведения профилактических мероприятий и предупреждения осложнений, связанных с проведением терапии и наличием основного заболевания.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВАРИАНТА ТЕЧЕНИЯ МИНИМАЛЬНОЙ МОЗГОВОЙ ДИСФУНКЦИИ | 2012 |
|
RU2489965C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ФОРМИРОВАНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА У ДЕТЕЙ | 2014 |
|
RU2568738C1 |
| Способ прогнозирования развития врожденной цитомегаловирусной инфекции у новорожденных | 2023 |
|
RU2822967C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РЕАЛИЗАЦИИ ПЕРИНАТАЛЬНОГО ПОРАЖЕНИЯ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ В НЕОНАТАЛЬНОМ ПЕРИОДЕ У ДОНОШЕННЫХ ДЕТЕЙ, РОДИВШИХСЯ В СОСТОЯНИИ АСФИКСИИ | 2011 |
|
RU2465595C1 |
| Способ прогнозирования пищевой аллергии к белку коровьего молока у детей | 2020 |
|
RU2750353C1 |
| Способ прогнозирования внутрижелудочковых кровоизлияний у недоношенных новорожденных гестационного возраста 28-36,6 недель в раннем неонатальном периоде | 2024 |
|
RU2836096C1 |
| Способ прогноза развития раннего неонатального сепсиса у новорожденных, матери которых перенесли COVID-19 во время беременности | 2023 |
|
RU2813809C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВНУТРИЖЕЛУДОЧКОВЫХ КРОВОИЗЛИЯНИЙ У ДОНОШЕННЫХ НОВОРОЖДЕННЫХ, РОДИВШИХСЯ ОТ МАТЕРЕЙ С АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ | 2012 |
|
RU2508541C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ МАССЫ ТЕЛА НОВОРОЖДЕННОГО | 2011 |
|
RU2472446C1 |
| Способ прогноза летальности у новорожденных, матери которых перенесли COVID-19 во время беременности | 2023 |
|
RU2800892C1 |
Способ относится к медицине, а именно к неонатологии, гематологии, педиатрии, и позволяет прогнозировать риск возникновения мультифакторной патологии у детей, рожденных с помощью применения вспомогательных репродуктивных технологий в семьях с синдромом потери плода. Исследуют анамнестические и клинические признаки и оценивают их в анте-, интра- и неонатальные периоды жизни ребенка, причем в анте- и интранатальный периоды определяют: X1 - наличие у матери анемии во время беременности, X2 - наличие угрозы прерывания настоящей беременности, X3 - наличие хронической фето-плацентарной недостаточности, X4 - наличие гестоза, X5 - родоразрешение путем операции кесарева сечения; в неонатальный период жизни ребенка определяют: X6 - нахождение ребенка в палате интенсивной терапии или реанимации, X7 - перевод в лечебно профилактическое учреждение, X8 - назначение антибактериальной терапии, X9 - отсроченность вакцинации, X10 - назначение инфузионной терапии, X11 - назначение парентерального питания, X12 - назначение препаратов крови, X13 - оценка состояния ребенка по шкале Апгар на 1 минуте жизни и рассчитывают значения дискриминантных функций Y1 и Y2 по формулам: Y1=-136,805+11,123*X1+15,622*X2+16,737*X3+10,728*X4+8,285*X5+44,296*X6-15,549*X7+27,818*X8-16,443*X9+5,231*X10-28,815*X11+24,319*X12+23,134*X13;
Y2=172,87+13,898*X1+22,385*X2+23,460*X3+15,047*X4+8,820*X5+35,859*X6-3,348*X7+19,418*X8-13,431*X9+18,444*X10-39,685*X11+28,512*X12+22,949*X13, где Y1 - дискриминантная функция группы детей, имеющей низкую предрасположенность развития мультифакторной патологии, Y2 - дискриминантная функция группы детей, имеющей высокий риск развития мультифакторной патологии, X1, X2, …, X13 - значения клинико-анамнестических признаков, при наличии признаков X1-X12 их оценивают в 2 балла, а при отсутствии - 1 балл; Х13 - оценка в баллах по шкале Апгар; -136,805 и -172,87 - свободные члены, и при значении функции Y2 больше значения функции Y1 ребенка относят к группе с высоким риском развития мультифакторной патологии и рекомендуют проведение молекулярно-генетического исследования для детекции неблагоприятных полиморфных генов. Способ позволяет учитывать и профилактировать младенческую заболеваемость, инвалидность и смертность. 1 ил., 4 прим., 2 табл.
Способ прогнозирования развития мультифакторной патологии у детей, рожденных с помощью вспомогательных репродуктивных технологий в семьях с бесплодием по клиническим и анамнестическим признакам с присвоением баллов, отличающийся тем, что анамнестические и клинические признаки оценивают в анте-, интра- и неонатальные периоды жизни ребенка, причем в анте- и интранатальный периоды определяют: X1 - наличие у матери анемии во время беременности, X2 -наличие угрозы прерывания настоящей беременности, X3 - наличие хронической фето-плацентарной недостаточности, X4 - наличие гестоза, X5 - родоразрешение путем операции кесарева сечения; в неонатальный период жизни ребенка определяют: X6 - нахождение ребенка в палате интенсивной терапии или реанимации, X7 - перевод в лечебно профилактическое учреждение, X8 - назначение антибактериальной терапии, X9 - отсроченность вакцинации, X10 - назначение инфузионной терапии, X11 - назначение парентерального питания, X12 - назначение препаратов крови, X13 - оценка состояния ребенка по шкале Апгар на 1 минуте жизни и рассчитывают значения дискриминантных функций Y1 и Y2 по формулам:
У1=-136,805+11,123·X1+15,622·X2+16,737·X3+10,728·X4+8,285·X5+44,296·X6-15,549·X7+27,818·Х8-16,443·X9+5,231·X10-28,815·X11+24,319·X12+23,134·X13;
Y2=-172,87+13,898·X1+22,385·X2+23,460·X3+15,047·X4+8,820·X5+35,859·X6-3,348·X7+19,418·X8-13,431·X9+18,444·X10-39,685·X11+28,512·X12+22,949·X13,
где Y1 - дискриминантная функция группы детей имеющей низкую предрасположенность развития мультифакторной патологии,
Y2 - дискриминантная функция группы детей имеющей высокий риск развития мультифакторной патологии, X1, X2, …, X13 - значения клинико-анамнестических признаков, при наличии признаков X1-X12 их оценивают в 2 балла, а при отсутствии - 1 балл; X13 - оценка в баллах по шкале Апгар; -136,805 и -172,87 - свободные члены, и при значении функции Y2 больше значения функции Y1 ребенка относят к группе с высоким риском развития мультифакторной патологии и рекомендуют проведение молекулярно-генетического исследования для детекции неблагоприятных полиморфных генов.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОТКЛОНЕНИЙ ФИЗИЧЕСКОГО РАЗВИТИЯ У ДЕТЕЙ РАННЕГО ВОЗРАСТА | 2005 |
|
RU2291444C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ АДАПТАЦИОННОГО ПЕРИОДА У НОВОРОЖДЕННЫХ | 1991 |
|
RU2009510C1 |
| АНДЕС В.Ф | |||
| Организация скрининга патологии беременности | |||
| Диагностический центр | |||
| Возможности современных методов диагностики, 1993, с.21-22 | |||
| КНЯЗЕВ Ю.А | |||
| Состояние здоровья детей, рожденных женщинами с различным генезом эндокринного бесплодия | |||
| Современные проблемы диагностики и лечения нарушений репродуктивного здоровья женщины, 1994, с.65. | |||
Авторы
Даты
2012-07-27—Публикация
2011-03-09—Подача