Изобретение относится к области органической химии, в частности к способу получения диамантана (пентацикло[7.3.1.14,12.02,7.06,11]тетрадекана).
Диамантан (1) является исходным сырьем для синтеза термостойких синтетических смазочных масел или их компонентов, а с учетом их хороших теплоизоляционных свойств и низкого индекса вязкости - в качестве кабельного масла; используется для получения медицинских препаратов, высокомолекулярных (полимерных) материалов, резин, устойчивых к растворителям (Е.И.Багрий. Адамантаны. М.: Наука, 1989, 256 с. [1]; S.Hala, M.Kuras, P.Zachar. Sb. VSCHT Praze D.S. v.33, p.305-321 (1976), РЖХим. 1977, 13П337 [2]; R.C.Fort. Adamantane: The chemistry of diamond molecules. N.Y.; Dekker, 1976, 385 p. [3]; M.A.McKervey. Tetrahedron, V.36, p.971-992 (1980) [4]).
Диамантан (1) получают скелетной изомеризацией термодинамически менее устойчивых пентациклических C14H20 углеводородов, в частности, он был синтезирован изомеризацией димера норборнена - пентацикло[8.2.1.14,70.2,9.03,8]тетрадекана по схеме:

Низкий выход диамантана (1%) обусловлен разрушением одного из циклов, что подтверждается образованием побочного продукта - тетрациклического углеводорода 1,2-бутаноадамантана (3) с выходом 40% (C.A.Cupas, P.R.Schleyer, D.J.Trecker. J. Amer. Chem. Soc, V.87, p.917-918 (1965) [5]).
Известны три стереоизомера пентациклического углеводорода (2). Изомеризация наименее напряженного экзо-транс-экзо-изомера (2а) приводит к наиболее лучшим результатам.
Так, при изомеризации соединения (2а) под действием катализатора AlBr3 выход диамантана (1) составил 11%. Основным продуктом реакции является 1,2-тетраметиленадамантан (3). Наиболее напряженный эндо-транс-экзо-изомер (26) в этих условиях селективно превращается в соединение (3) (V.Z.Williams, P.v.R.Schleyer, G.J.Gleicher, L.B.Rodewald. J. Amer. Chem. Soc., V.88, p.3862(1966) [6]).

Недостатки методов:
1. Низкий выход целевого диамантана (1).
2. Неселективность процесса и образование трудно разделяемой смеси продуктов.
Выход диамантана (1) решающим образом зависит от строения исходного углеводорода, природы катализатора и условий проведения реакции. Целый ряд полициклических мостиковых углеводородов состава C14H20, полученных на основе норборнена по реакции Дильса-Альдера с различными циклическими диенами, также способен перегруппировываться в диамантан (1).
Углеводороды (4) и (5) при контакте с AlBr3 образуют диамантан с выходом 20-25% (T.M.Gund, E.Osawa, V.Z.Williams, P.v.R.Schleyer. J. Org. Chem., V.39, №20, p.2979-2987 (1974) [7]).
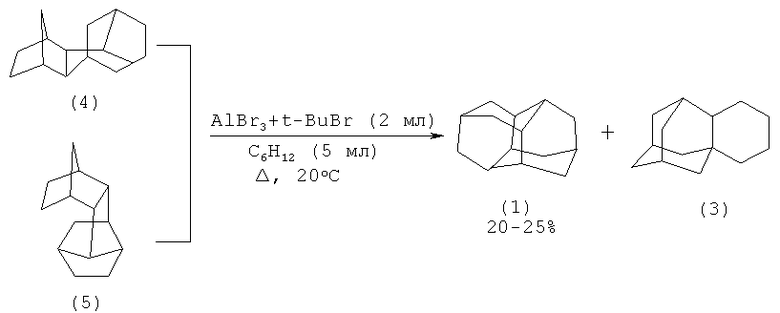
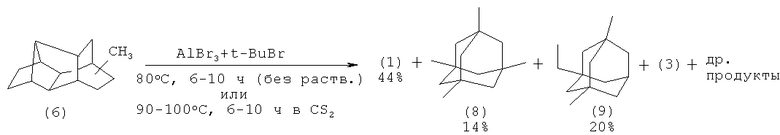
Изомеризация (6) и (7) в присутствии AlBr3 в среде третбутилбромида приводит к диамантану (1) с выходом 44 и 34% соответственно.

Недостатки методов:
1. Труднодоступность и многостадийность синтеза исходных углеводородов.
2. Низкий выход целевого продукта.
3. Сложности при выделении диамантана (1) из-за образования побочных продуктов.
Наиболее пригодным для препаративного получения диамантана (1) считается (4+4)-димер норборнадиена - гептацикло[8.4.0.02,12.03,8.04,6.05,9.011,13]тетрадекан (10), тривиальное название которого «бинор-S» (T.M.Gund, E.Osawa, V.Z.Williams, P.v.R.Schleyer. Tetrahedron Lett., №44, p.3877-3880 (1970) [8]; P.v.R.Schleyer. Hexacyclotetradecanes. Пат. США, №3673268 (27.06.1972), кл. 260-666 РУ, (C07С 13/28) [9]):

Гидрирование бинора-S (10) при 200°C и 305 атм H2 в присутствии Pt-катализатора или PtO2 в ледяной CH3COOH приводит к раскрытию циклопропановых колец и образованию тетрагидробинора-S (11) с практически количественным выходом.
Тетрагидробинор-S (11) медленно по каплям добавляют в CS2 или циклогексановый раствор хорошо высушенного AlBr3 (25% от веса C14H20). Реакция экзотермична. После добавления всего количества соединения (11) смесь кипятят 0.5-1 ч. Выход диамантана (1) составляет 65%.

Недостатки метода:
1. Умеренный выход целевого продукта.
2. Образованием побочных продуктов затрудняет выделение диамантана (1).
3. Использование значительного количества катализатора (25%).
4. Использование в качестве растворителя токсичного взрывоопасного сероуглерода.
В присутствии суперкислотных катализаторов: B(OSO2CF3)3 (A), CF3SO3H-SbF5 (1:1) (Б), CF3SO3H-B(OSO2CF3)3 (1:1) (В) - из тетрагидробинора-S (11) получают диамантан (1) с высокими выходами (O.Farooq, S.M.F.Farnia, M.Stephenson, G.A.Olah. J. Org. Chem., V.53, №12, p.2840-2843 (1988) [10]):

При обработке реакционной смеси ультразвуком время реакции уменьшается до 1.75 ч.
Недостатки метода:
1. Труднодоступность суперкислотных катализаторов.
2. Использование стехиометрических количеств суперкислот осложняет выделение целевого продукта.
3. При нейтрализации реакционной смеси образуется большое количество отходов и сточных вод.
4. Необходимость использования низких температур (0°C).
К хорошо перемешиваемой гетерогенной смеси бинора-S (7.6 ммоль) и NaBH4 (22.8 ммоль) (под аргоном или азотом) в сухом фреоне-113 (40 мл) при -30°C добавляют в течение 30 мин 12 мл CF3SO3H (137 ммоль) в токе сухого Ar или N2. Во время добавления кислоты из-за экзотермичности реакции смесь охлаждают до -78°C, смесь затем выдерживают при комнатной температуре в течение 3-5 часов. Выход диамантана (1) по данному методу достигает 99% (G.A.Olah, A.Wu, O.Farooq, G.K.S.Prakash. J. Org. Chem., V.54, №6, p.1450-1451 (1989) [11]).

Недостатки метода:
1. Труднодоступность и дороговизна реагентов (NaBH4, CF3SO3H).
2. Необходимость проведения реакции в токе сухого аргона или азота из-за использования пожаро- и взрывоопасного боргидрида натрия.
3. Необходимость охлаждения смеси до -78°C (экзотермичность реакции).
При гидрировании (давление водорода 1 атм) димера норборнадиена (12) («димер Катца») в уксусной кислоте в присутствии катализатора Адамса после гидрогенолиза циклопропанового кольца и восстановления олефиновой связи образуется тетрагидропроизводное (13) неустановленной структуры. При газофазной изомеризации углеводорода (13) с использованием гетерогенного катализатора - платины, нанесенной на хлорированный Al2O3, был получен диамантан (1) (T.Courtney, D.E.Johnston, М.А.McKervey, J.J.Rooney. J. Chem. Soc, Perkin Trans. I, №21, p.2691-2696 (1972) [12]):

Проведение изомеризации тетрагидробинора-S (11) в газовой фазе при 150°C в атмосфере HCl над хлорированным катализатором Pt-Al2O3 приводит к образованию диамантана (1).

На основании сходства по трем признакам (исходный реагент - тетрагидробинор-S, гетерогенный катализатор, образование в результате реакции диамантана (1)) за прототип взят метод изомеризации тетрагидробинора-S с использованием гетерогенного катализатора платины, нанесенной на хлорированный Al2O3 [12].
Прототип имеет следующие недостатки:
1. Использование дорогостоящего платинового катализатора.
2. Коррозия оборудования из-за использования в составе катализатора HCl.
Задачей настоящего изобретения является упрощение и удешевление технологии получения диамантана (1).
Авторами предлагается способ получения диамантана (1), не имеющий указанных недостатков.
Сущность способа заключается в изомеризации тетрагидробинора-S (11) в присутствии катализатора цеолита Y в NaH-форме со степенью ионного обмена 40-60%, предварительно подвергнутого термообработке при 450°C в течение 3-5 ч в атмосфере воздуха, в количестве 30-70 мас.% при температуре реакции 270-300°C в течение 15-30 часов.
В оптимальных условиях при 70% конверсии тетрагидробинора-S (11) единственным продуктом реакции является диамантан (1).

Существенные отличия предлагаемого способа от прототипа:
1. Для получения диамантана (1) из тетрагидробинора-S (11) используется гетерогенный катализатор цеолит Y в NaH-форме со степенью ионного обмена 40-60%, предварительно подвергнутый термообработке при 450°C.
Преимущества предлагаемого метода.
1. Доступность катализатора (цеолит Y в NaH-форме выпускается АО «Салаватнефтеоргсинтез»).
2. Отсутствие коррозии и простота аппаратурного оформления.
Предлагаемый способ поясняется примерами.
Общая методика.
В стеклянную ампулу помещали 30-70 мас.% цеолита Y в NaH-форме со степенью ионного обмена 40-60%, предварительно подвергнутого термообработке при 450°C, тетрагидробинор-S, циклогексан в качестве растворителя, ампулу запаивали, помещали в микроавтоклав, герметично закрывали и нагревали в течение 15-30 часов при 270-300°C. После окончания реакции микроавтоклав (ампулу) охлаждали до комнатной температуры, вскрывали, после отфильтровывания катализатора растворитель отгоняли, остаток кристаллизовали из гексана. Выход диамантана (1) составил 50-70%.
ПРИМЕР 1. В стеклянную ампулу (V=20 мл) помещали 5 ммолей тетрагидробинора-S, 0.66 г цеолита Y в NaH-форме со степенью ионного обмена 40%, предварительно подвергнутого термообработке при 450°C, 2 мл циклогексана, ампулу запаивали, помещали в микроавтоклав, герметично закрывали и нагревали при 300°C в течение 30 часов. После окончания реакции микроавтоклав (ампулу) охлаждали до комнатной температуры, вскрывали, после фильтрования катализатора, удаления растворителя и кристаллизации остатка из гексана был выделен диамантан (1) с выходом 70%.
Полученный диамантан (1) имел т.пл. 244-245°C (гексан). Ик-спектр (υ, см-1): 2926, 2907, 2880, 2850, 1445, 1305, 1230, 1179, 1072, 1039, 980. Спектр ЯМР 13С (CDCl3, δ, м.д.): 37.76 (С1, С2, С6, С7, C11, С12), 38.51 (С3, С5, С8, С10, С13, С14), 26.18 (С4, С9). Масс-спектр, m/z (J отн., %): 188 [M]+ (100), 160 (5), 159 (10), 145 (8), 131 (13), 130 (18), 120 (7), 105 (15), 91 (28), 79 (25), 67 (15). Найдено, %: C 88.75, H 11.25. C14H20. Вычислено, %: C 88.29, H 10.71.
Другие примеры, подтверждающие способ, приведены в табл.1.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения диамантана (пентацикло [7.3.1.1 .0 .0]тетрадекана) | 2020 |
|
RU2771230C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАМАНТАНА (ПЕНТАЦИКЛО[7.3.1.1.0.0]ТЕТРАДЕКАНА) | 2017 |
|
RU2645914C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИМЕТИЛАДАМАНТАНА | 2012 |
|
RU2504533C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕНТА- И ГЕКСАЦИКЛИЧЕСКИХ КАРКАСНЫХ УГЛЕВОДОРОДОВ | 1996 |
|
RU2151761C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРИАМАНТАНА | 2014 |
|
RU2559362C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТАНА, 1- И 4-ХЛОРДИАМАНТАНОВ | 2000 |
|
RU2185364C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕНТАЦИКЛО [8.2.1.1.0. 0] ТЕТРАДЕКАНДИОЛА-6,9 | 1998 |
|
RU2139847C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА ПАЛЬМИТИНОВОЙ КИСЛОТЫ (МЕТИЛПАЛЬМИТАТА) | 2016 |
|
RU2654055C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИБРОМАДАМАНТАНА | 2011 |
|
RU2455275C1 |
| СПОСОБ СЕЛЕКТИВНОГО ПОЛУЧЕНИЯ ДИМЕРОВ НОРБОРНЕНА | 2012 |
|
RU2505514C1 |
Предлагаемое изобретение относится к способу получения диамантана(пентацикло[7.3.1.14,12.02,7.06,11]тетрадекана) формулы (1)
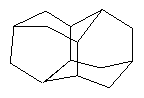
изомеризацией тетрагидробинора-S. Способ характеризуется тем, что реакцию проводят в присутствии катализатора цеолита Y в NaH-форме со степенью ионного обмена 40-60%, предварительно подвергнутого термообработке при 450°С в течение 3-5 ч в атмосфере воздуха, в количестве 30-70 мас.% при температуре реакции 270-300°С в течение 15-30 часов. Настоящий способ использует доступный катализатор и позволяет избежать коррозии и упростить аппаратурное оформление. 12 пр., 1 табл.
Способ получения диамантана (пентацикло[7.3.1.14,12.02,7.06,11]тетрадекана) формулы (1)
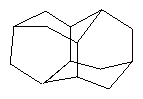
изомеризацией тетрагидробинора-S, отличающийся тем, что реакцию проводят в присутствии катализатора цеолита Y в NaH-форме со степенью ионного обмена 40-60%, предварительно подвергнутого термообработке при 450°С в течение 3-5 ч в атмосфере воздуха, в количестве 30-70 мас.% при температуре реакции 270-300°С в течение 15-30 ч.
| T.Courtney, D.E.Johnston, M.A.McKervey, J.J.Rooney | |||
| "The chemistry of diamantine | |||
| Part I | |||
| Synthesis and some functionalisation reactions" J | |||
| Chem | |||
| Soc, Perkin Trans | |||
| I, №21, p.2691-2696, 1972 | |||
| EP 0001905753 A1, 02.04.2008 | |||
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТАНА, 1- И 4-ХЛОРДИАМАНТАНОВ | 2000 |
|
RU2185364C1 |
Авторы
Даты
2012-08-27—Публикация
2011-05-04—Подача