Предлагаемое изобретение относится к области органической химии, а именно, к способу получения диамантана (1) (пентацикло [7.3.1.14,12.02,7.06,11]тетрадекана).
С развитием нанотехнологий большой интерес вызывают углеводороды алмазоподобного строения, в которых атомы углерода образуют тетраэдрическую пространственную решетку, точно такую же, как в алмазе. Поэтому полициклические каркасные алмазоподобные углеводороды -диамондоиды (адамандоиды), являются весьма перспективными для использования их в качестве наноматериалов.
Второй представитель гомологического ряда алмазоподобных углеводородов - диамантан является исходным сырьем для синтеза термостойких синтетических смазочных масел или их компонентов, в частности, кабельного масла ([1] Е.И. Багрий. - М.: Наука. 1989. С. 256;). Он используется для получения медицинских препаратов, полимерных материалов и резин, устойчивых к растворителям ([2] S. Hala, S. Landa, V. Harms. Angew. Chem., Int. Edit. 1967. V. 5. P. 1045-1046; [3] R.C. Fort. - N.Y.: Dekker 1976. P. 385; [4] M.A. McKervey. Tetrahedron 1980. V. 36. P. 971-992).
Известные методы синтеза диамантана (1) основаны на скелетной изомеризации каркасных, напряженных изосоставных C14H20 полициклических углеводородов под действием кислотных катализаторов, в качестве которых используются кислоты Льюиса (AlCl3, AlBr3) и суперкислоты (B(OSO2CF3)3, CF3SO3H).
В работе ([5] S. Stauss, K. Terashima. Pan Stanford Publishing Pte. Ltd. 2017. P. 81-106) синтез диамантана осуществлен в три стадии. Исходным сырьем для синтеза диамантана (1) является циклогептатриен (2), который под действием хлорида Ti (IV) и диэтилалюминийхлорида (ДЭАХ) превращается в димер (3); последующее гидрирование которого приводит к образованию насыщенного димера (4). Полученный С14Н20-углеводород (4) под действием AlCl3, превращается в диамантан (1), выход которого составляет 89%.

Авторы работы ([6] Р.И. Хуснутдинов, В.А. Докичев, Д.К. Галеев, Н.Ф. Асылгужина, С.З. Султанов, У.М. Джемилев. Изв. АН СССР Сер. Хим. 1988, 2152-2155) осуществили синтез диамантана (1) с использованием в качестве исходного соединения, спиро[2.4]гепта-4,6-диена (5). Однако выход диамантана (1) в двух реакциях по данному методу составил всего лишь 13% и 9%.

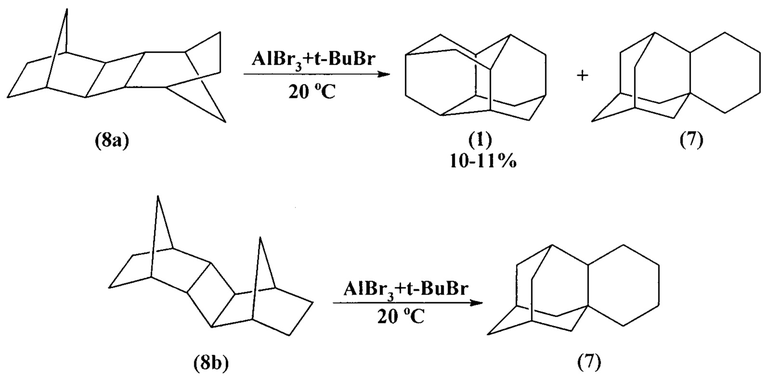
Синтез диамантана (1) осуществлен скелетной изомеризацией пентациклического углеводорода С14Н20 - димера норборнена - пентацикло[8.2.1.14,70.2.9.03,8]тетрадекана (6).

Данная реакция протекает с низким выходом диамантана (1) (1%). Это обусловлено разрывом С-С-связи одного из циклов, что и приводит к образованию достаточно большого количества побочного продукта -тетрациклического углеводорода 1,2-бутаноадамантана 7 (40%) ([7] С.А. Cupas, P.R. Schleyer, D.J. Trecker. J. Amer. Chem. Soc. 1965. V. 87. P. 917-918).
Как известно, при фотокатализе норборнена образуются три стереоизомерных пентациклических углеводорода: (8, 8а, 8b), проявляющих способность к скелетной перегруппировке. Наибольший выход диамантана (1) наблюдается при изомеризации менее напряженного экзо-транс-экзо-изомера (8а).
Под действием катализатора AlBr3 соединение (8а) изомеризуется в диамантан (1) с выходом 11%. В данной реакции основным продуктом является 1,2-бутаноадамантан (7). В аналогичных условиях более напряженный эндо-транс-экзо-изомер (8b) селективно превращается в 1,2-бутаноадамантан (7) ([8] V.Z. Williams, G.J. Gleicher, L.B. Rodewald. J. Amer. Chem. Soc. 1966. V. 88. P. 3862).
Недостатками данного метода являются: низкий выход диамантана (1), образование трудноразделимой смеси, поэтому вышеперечисленные методы в промышленности не применимы.
В работе ([9] J.J. Mrowca, T.J. Katz J. Amer. Chem. Soc. 1966. V. 88. P. 4012-4015) описано образование тетрагидропроизводного неустановленной структуры состава С14Н20 при гидрировании в уксусной кислоте гексациклического димера норборнадиена (9) под действием катализатора Адамса (PtO2). Превращение C14H20 (9а) углеводорода в диамантан (1) происходит в условиях газофазной изомеризации под действием гетерогенного катализатора - Pt-Cl-Al2O3.

Выход диамантана (1) в данной реакции зависит от многих факторов: строения исходного углеводорода, природы катализатора и условий реакции.
Так, углеводороды (10) и (11) (гидрированные димеры норборнадиена) при контакте с AlBr3 превращаются в диамантан (1) с выходом 20-25% ([10] Т.М. Gund, Е. Osawa, V.Z. Williams, P.V. Schleyer. J. Org. Chem. 1974. V. 39. P. 2979-2987).

Недостатки методов:
1. Низкий выход целевого диамантана (1).
2. Образование трудноразделяемой смеси продуктов, что создает большие сложности при выделении диамантана (1).
3. Труднодоступность и многостадийность синтеза исходных углеводородов, которые получают димеризацией норборнадиена, изомеризацией и гидрированием на родиевых и платиновых катализаторах.
Реакция Дильса-Альдера норборнена с различными циклическими диенами позволяет получить целый ряд полициклических мостиковых углеводородов состава C14H20, которые обладают способностью перегруппировываться в диамантан (1).
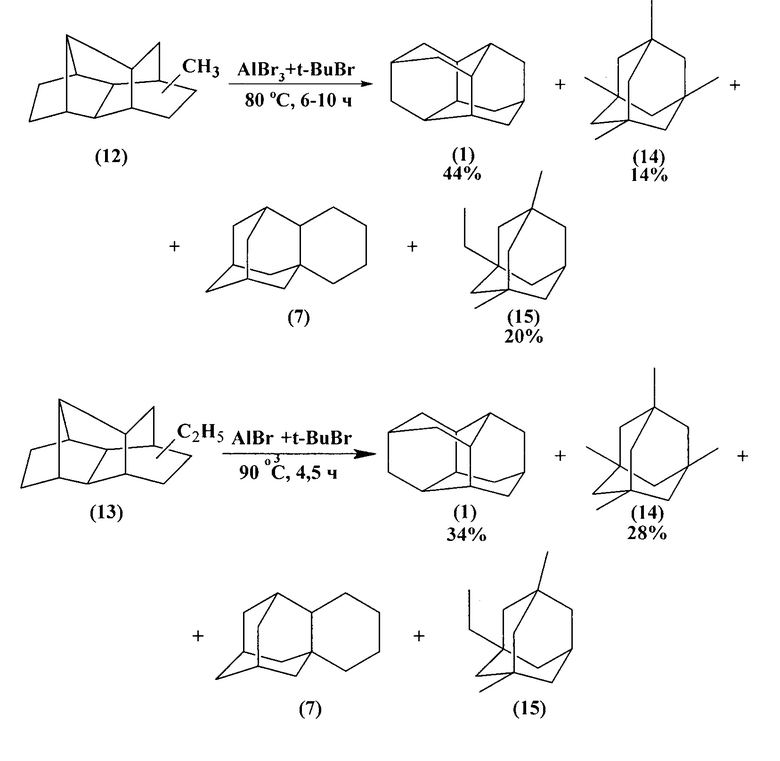
Одним из интересных способов получения диамантана (1) с более высоким выходом является изомеризация соединений (12) и (13) под действием AlBr3 в присутствии третбутилбромида. Реакции могут проводиться в растворе сероуглерода, циклогексана или в отсутствие растворителя. Выход диамантана (1) по нижеприведенным схемам составляет 44 и 34% соответственно.
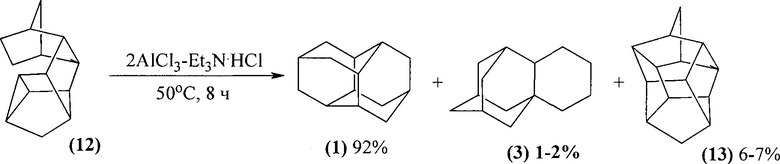
В патенте РФ ([11] У.М. Джемилев, Р.И. Хуснутдинов, Р.И. Аминов, М.С.Тажетдинов. Патент РФ №2645914 от 01.03.2018. Бюл. №7) диамантан (1) получен изомеризацией эндо-эндо-гексацикло[9.2.1.02,10.03,8.04,6.05,9]-тетрадекана (12) (полученного гидрированием димера НБД на палладиевом катализаторе) под действием ионной жидкости состава 2AlCl3-Et3N⋅HCl. В результате реакции образуется смесь, состоящая из диамантана (1), 1,2-бутаноадамантана (3) и гептацикло[6.6.0.02,12.03,7.04,11.05,9.00,14]тетрадекана (13). Максимальный выход диамантана (1) достигает 92%.
Недостатки метода:
1. Предварительное приготовление катализатора - ионной жидкости.
2. Образование побочных продуктов, что создает большие сложности при выделении диамантана.
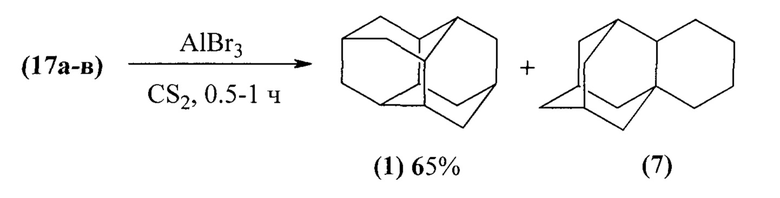
Наиболее пригодным исходным соединением для препаративного получения диамантана (1) является [4+4]-димер норборнадиена - эндо-эндо-гептацикло[8.4.0.02,12.03,8.04,6.05,9.011,13]тетрадекан (16), тривиальное название которого «бинор-S». Гидрирование бинора-S при 200°С и 305 атм Н2 в присутствии платинового катализатора (H2PtCl6 или PtO2) в ледяной уксусной кислоте приводит к раскрытию обоих циклопропановых колец и образованию тетрагидробинора-S в виде смеси трех изомеров (17а-в) с практически количественным выходом ([12] Т.М. Gund, Е. Osawa, V.Z. Williams, P.v.R. Schleyer. Tetrahedron Lett. 1970. 44. P. 3877; [13] У.М. Джемилев, Р.И. Хуснутдинов, З.С. Муслимов, М.Ф. Мазитов. Нефтехимия. 1996. Т. 36. С. 506).

Далее к раствору безводного AlBr3 (25% от веса тетрагидробинора-S) в сероуглероде или циклогексане, медленно добавляют тетрагидробинор-S (17а-в). После добавления всего количества смеси углеводородов (17а-в) смесь кипятят 0,5-1 ч. Реакция происходит с выделением тепла. Выход диамантана 1 составил 65%.
Недостатки метода:
1. Умеренный выход целевого продукта.
2. Образование побочного продукта - 1,2-бутаноадамантана (7) затрудняет выделение диамантана (1).
3. Использование значительного количества катализатора (25%).
4. Использование в качестве растворителя токсичного и взрывоопасного сероуглерода.
В патенте РФ ([14] У.М. Джемилев, Р.И. Хуснутдинов, Н.А. Щаднева, К.С. Кислицина, Б.И. Кутепов, А.Н. Хазипова, О.С.Травкина. Патент РФ №2459794 от 27.08.2012. Бюл. №24) разработан способ получения диамантана (1) изомеризацией тетрагидробинора-S (17а-в) с использованием катализатора - цеолита Y в NaH-форме со степенью ионного обмена 40-60%), предварительно подвергнутого термообработке при 450°С в течение 3-5 ч в атмосфере воздуха, в количестве 30-70 мас. % при температуре реакции 270-300°С в течение 15-30 часов. В этих условиях выход диамантана (1) составляет 98-99%.

Недостатки метода:
1. Высокая температура (300°С) и значительная продолжительность реакции (30 ч).
2. Большой расход катализатора.
Высокий выход диамантана (1), до 99%, наблюдается при изомеризации тетрагидробинора-S (17а-в) в присутствии суперкислотных катализаторов: B(OSO2CF3)3, CF3SO3H-SbF5 (1:1), CF3S03H-B(OSO2CF3)3 (1:1) ([15] О. Farooq, S.M.F. Farnia, M. Stephenson, G.A. Olah. J. Org. Chem. 1988. V. 53. P. 2840).
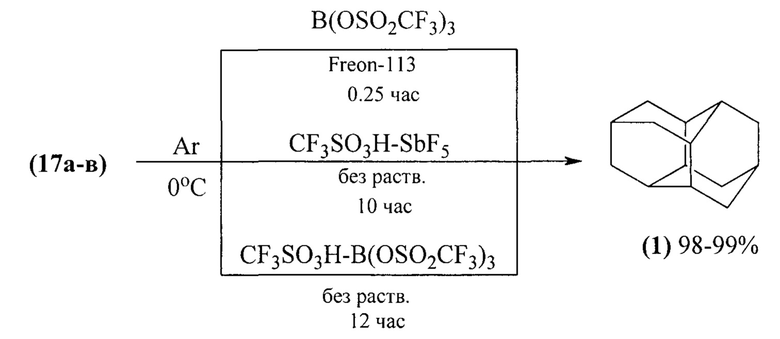
Недостатки метода:
1. Труднодоступность и дороговизна суперкислотных катализаторов.
2. Использование стехиометрических количеств агрессивных суперкислот, что осложняет выделение целевого продукта.
3. Сильная коррозия оборудования.
4. При нейтрализации реакционной смеси образуется большое количество отходов и сточных вод.
5. Необходимость использования низких температур (0°С).
В работе ([16] G.A. Olah, A. Wu, О. Farooq, G.K.S. Prakash. J. Org. Chem., 1989. V. 54. P. 1450) гидрирование бинора-S (16) (7,6 ммоль) и изомеризация в диамантан (1) осуществлены однореакторным способом с помощью большого избытка NaBFL, (22,8 ммоль), затем CF3SO3H (137 ммоль). В смесь углеводорода (16) и NaBH4 в фреоне-113 (40 мл) течение 30 минут в присутствии при температуре - 30°С в токе аргона (азота) добавляют 12 мл CF3SO3H (137 ммоль). Из-за экзотермичности реакции во время добавления кислоты смесь охлаждается до - 78°С, затем смесь выдерживается при комнатной температуре в течение 3-5 часов (Схема 16). По данному методу выход диамантана (1) достигает 99%.
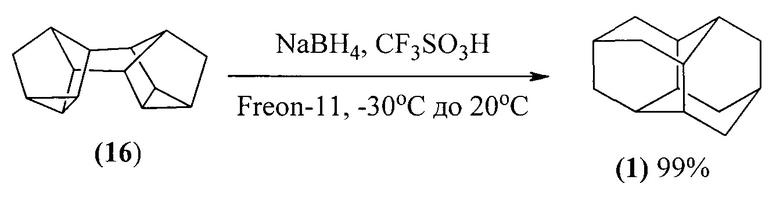
Недостатки метода:
1. Труднодоступность, дороговизна и большой расход реагентов (NaBH4, CF3SO3H).
2. Сильная коррозия оборудования под действием суперкислот.
3. Необходимость проведения реакции в токе сухого аргона или азота из-за использования пожаро- и взрывоопасного боргидрида натрия.
4. Необходимость охлаждения смеси до -78°С из-за экзотермичности реакции.
По сходству основных признаков (идентичное исходное соединение - бинор-S, одностадийность, использование кислоты в качестве катализатора) данный способ взят как прототип.
Задачей настоящего изобретения является удешевление себестоимости диамантана (1) за счет использования дешевого и доступного катализатора (H2SO4) вместо боргидрида натрия и трифторметансульфокислоты и упрощение технологии путем проведения реакции при температуре 20÷40°С.
Авторами предлагается новый, одностадийный метод синтеза диамантана (1), основанный на использовании в качестве катализатора гидроизомеризации бинора-S (16) концентрированной серной кислоты.
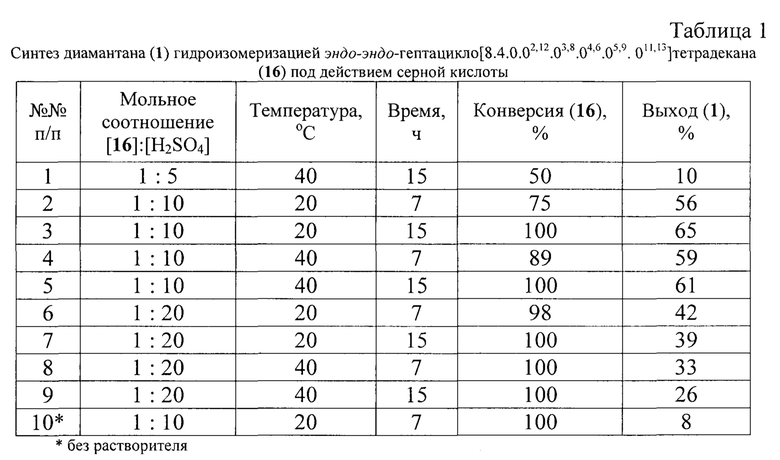
Сущность предлагаемого способа заключается в гидроизомеризации гептацикло[8.4.0.02,12.03,8.04,6.05,9.011,13]тетрадекана (16) под действием концентрированной серной кислоты. Реакция проходит в растворителе (циклогексан, сероуглерод), при 20÷40°С, за 7÷15 ч, при мольном соотношении реагентов и растворителя: [16]:[H2SO4]: [растворитель]=[1]:[10÷20]:[10]. В оптимальных условиях при полной конверсии углеводорода (16) выход диамантана (1) достигает 65%.
Преимущества предлагаемого метода:
1. Одностадийность.
2. Использование доступного и дешевого катализатора - H2SO4.
3. Мягкие условия реакции: 20÷40°С, 7÷15 ч.
3. Умеренный выход диамантана (65%).
Способ поясняется примерами.
ПРИМЕР 1. В стеклянный реактор (V=T00 мл) загружали 0.184 г (1 ммоль) гептацикло[8.4.0.02,12.03,8.04,6.05,9.011,13]тетрадекана (16) и растворитель. Затем при интенсивном перемешивании, порциями добавляли 0.98 г (10 ммоль) концентрированной (98%) серной кислоты. После добавления всего количества H2SO4 реакционную смесь перемешивали при 20÷40°С в течение 7÷15 ч. После завершения реакции к реакционной массе добавляли 10%-ный раствор NaOH, органическую часть отделяли и фильтровали через слой силикагеля (элюент - петролейный эфир).

Растворитель отгоняли, остаток перекристаллизовывали из смеси этилацетат : циклогексан = 1:1.
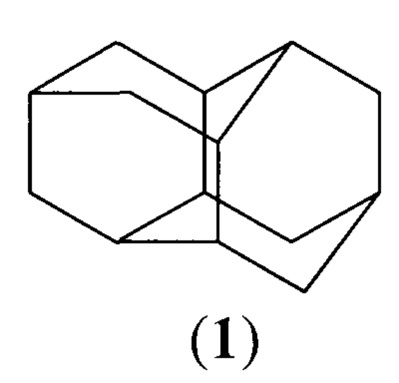 Выход диамантана (1) 65%, т.пл. 244-245°С.ИК спектр (υ, см-1): 2926, 2907, 2880, 2850, 1445, 1305, 1230, 1179, 1072, 1039, 980. Спектр ЯМР 13С (CDCl3, δ, м.д.): 37.76 (С1, С2, С6, С7, С11, С12), 38.51 (С3, С5, С8, С10, С13, С14), 26.18 (С4, С9). Масс-спектр, m/z (JoTH., %): 188 [М]+(100), 160(5), 159 (10), 145 (8), 131 (13), 130 (18), 120 (7), 105 (15), 91 (28), 79 (25), 67 (15). Найдено, %: С 88.75, Н 11.25. С14Н20. Вычислено, %: С 88.29, Н 10.71.
Выход диамантана (1) 65%, т.пл. 244-245°С.ИК спектр (υ, см-1): 2926, 2907, 2880, 2850, 1445, 1305, 1230, 1179, 1072, 1039, 980. Спектр ЯМР 13С (CDCl3, δ, м.д.): 37.76 (С1, С2, С6, С7, С11, С12), 38.51 (С3, С5, С8, С10, С13, С14), 26.18 (С4, С9). Масс-спектр, m/z (JoTH., %): 188 [М]+(100), 160(5), 159 (10), 145 (8), 131 (13), 130 (18), 120 (7), 105 (15), 91 (28), 79 (25), 67 (15). Найдено, %: С 88.75, Н 11.25. С14Н20. Вычислено, %: С 88.29, Н 10.71.
Другие примеры, подтверждающие способ, приведены в табл. 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИАМАНТАНА (ПЕНТАЦИКЛО[7.3.1.1.0.0]ТЕТРАДЕКАНА) | 2017 |
|
RU2645914C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАМАНТАНА (ПЕНТАЦИКЛО[7.3.1.1.0.0]ТЕТРАДЕКАН) | 2011 |
|
RU2459794C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕНТА- И ГЕКСАЦИКЛИЧЕСКИХ КАРКАСНЫХ УГЛЕВОДОРОДОВ | 1996 |
|
RU2151761C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРИАМАНТАНА | 2014 |
|
RU2559362C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТАНА, 1- И 4-ХЛОРДИАМАНТАНОВ | 2000 |
|
RU2185364C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДО-ЭНДО-ГЕКСАЦИКЛО[9.2.1.0.0.0.0]ТЕТРАДЕЦЕНА-12 | 2015 |
|
RU2640204C2 |
| СПОСОБ СЕЛЕКТИВНОГО ПОЛУЧЕНИЯ ДИМЕРОВ НОРБОРНЕНА | 2012 |
|
RU2505514C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕНТАЦИКЛО [8.2.1.1.0. 0] ТЕТРАДЕКАНДИОЛА-6,9 | 1998 |
|
RU2139847C1 |
| СПОСОБ ПОЛУЧЕНИЯ 10-ГИДРОКСИГЕКСАЦИКЛО[9.2.1.0.0.0.0] ТЕТРАДЕКАНА(ГЕКСАЦИКЛОТЕТРАДЕКАНОЛА-10) | 1998 |
|
RU2135455C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕНТАЦИКЛОТЕТРАДЕКАНА | 1991 |
|
RU2026278C1 |
Изобретение относится к способу получения диамантана (пентацикло[7.3.1.14,12.02,7.06,11]тетрадекана) каталитической гидроизомеризацией эндо-эндо-гептацикло[8.4.0.02,12.03,8.04,6.05,9.011,13]тетрадекана (бинора-S). Способ характеризуется тем, что в качестве катализатора используют концентрированную серную кислоту, реакцию проводят при мольном соотношении [бинор-S]:[H2SO4]:[растворитель]=[1]:[10÷20]:[10], при 20÷40°С в течение 7÷15 ч. Используется доступный катализатор, способ осуществляется в одну стадию при мягких условиях реакции, выход диамантана достигает 65%. 1 з.п. ф-лы, 1 табл., 1 пр.
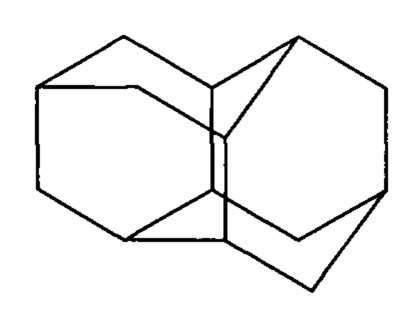
1. Способ получения диамантана (пентацикло[7.3.1.14,12.02,7.06,11]тетрадекана) формулы
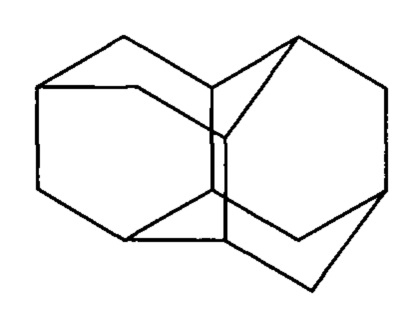
каталитической гидроизомеризацией эндо-эндо-гептацикло[8.4.0.02,12.03,8.04,6.05,9.011,13]тетрадекана (бинора-S), отличающийся тем, что в качестве катализатора используют концентрированную серную кислоту, реакцию проводят при мольном соотношении [бинор-S]:[H2SO4]:[растворитель]=[1]:[10÷20]:[10], при 20÷40°С в течение 7÷15 ч.
2. Способ получения диамантана по п. 1, отличающийся тем, что в качестве растворителя используют циклогексан или сероуглерод.
| СПОСОБ ПОЛУЧЕНИЯ ДИАМАНТАНА (ПЕНТАЦИКЛО[7.3.1.1.0.0]ТЕТРАДЕКАНА) | 2017 |
|
RU2645914C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАМАНТАНА (ПЕНТАЦИКЛО[7.3.1.1.0.0]ТЕТРАДЕКАН) | 2011 |
|
RU2459794C1 |
| GEORGE A | |||
| OLAH ET AL., Synthetic methods and reactions | |||
| Способ обделки поверхностей приборов отопления с целью увеличения теплоотдачи | 1919 |
|
SU135A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ORG | |||
| CHEM., 1989, 54, 6, 1450-1451. | |||
Авторы
Даты
2022-04-28—Публикация
2020-03-18—Подача