Область техники, к которой относится изобретение
Это изобретение относится к чувствительности молочнокислых бактерий к антибиотикам. В частности, оно относится к удалению генов устойчивости к тетрациклину у Bifidobacterium spp., и способу удаления или повреждения генов у Bifidobacterium spp.
Предшествующий уровень техники
В последние годы значительно возрос интерес к повышенной устойчивости бактерий к доступным антибиотикам. Хотя основной интерес связан с приобретенной устойчивостью, обусловленной, по меньшей мере, частично применением широкого спектра антибиотиков практикующими врачами, существуют также некоторые проблемы, имеющие отношение к устойчивости к антибиотикам, возникающей в результате использования бактерий для пищевых и сельскохозяйственных целей, которые приобрели гены чувствительности к антибиотикам. Например, присутствие и распределение генов устойчивости к тетрациклину является общим свойством микроорганизмов, выделяемых из окружающей среды, животных и людей, включая детей. В некоторых случаях устойчивость к антибиотикам может быть неотъемлемой чертой определенных видов, например, благодаря специфическим свойствам клеточных мембран. Устойчивость к антибиотикам также может быть приобретена из-за мутации бактериальных генов, и она может быть приобретена от резистентных бактерий, находящихся в окружающей среде, путем переноса генов.
Использование при обработке пищи или в сельскохозяйственном производстве любых бактерий, которые обладают или приобрели устойчивость к антибиотикам, представляет собой возможный гипотетический риск переноса генов, способствующих устойчивости, другим бактериям, находящимся в пище, желудочно-кишечном тракте (GIT) субъекта или животного после употребления пищи, или в окружающую среду, в некоторый момент времени до или после приема пищи. Примеры таких бактерий можно обнаружить среди Bifidobacterium spp., например, Bifidobacterium animalis, таких как Bifidobacterium animalis subsp. (подвид) lactis (также называемых Bifidobacterium animalis subsp. lactis subsp. nov., ранее называвшихся Bifidobacterium lactis и иногда называемых так в этом документе). Один такой штамм, В. animalis subsp. lactis NCC 2818, CNCM 1-3446, доступный в продаже, применяли в течение 20 лет в качестве добавки к пищевым продуктам и его традиционно считают безопасным. Недавно было обнаружено, что эта бактерия подобно некоторым другим грамотрицательным и грамположительным бактериям, живущим в человеке и животных, имеет в своем составе ген устойчивости к тетрациклину tetW. Хотя перенос устойчивости к тетрациклину теоретически возможен, до настоящего времени это было невозможно продемонстрировать даже в лабораторных условиях. Однако из экспериментов по клонированию известно, что tetW из этого штамма активен в грамположительных бактериях, но не в грамотрицательных бактериях.
Тем не менее, чтобы исключить любой риск непреднамеренного переноса этого гена, существует необходимость в способах его удаления из этого штамма. Также существует необходимость в варианте штамма со сниженной устойчивостью к тетрациклину.
Раскрытие изобретения
Отличительным признаком одного аспекта изобретения является клетка Bifidobacterium, включающая геном, который целенаправленно изменен таким образом, что в нем отсутствует активный функциональный ген. В определенных воплощениях клетка Bifidobacterium представляет собой клетку Bifidobacterium animalis и, в частности, клетку Bifidobacterium animalis subsp.lactis. В этом документе в качестве примера представлен штамм Bifidobacterium animalis subsp.lactis NCC 9034.
В определенных воплощениях функциональный ген обеспечивает устойчивость к антибиотикам; например, функциональный ген представляет собой tetW и обеспечивает устойчивость к тетрациклину. В различных воплощениях клетка Bifidobacterium, целенаправленно измененная таким образом, что в ней отсутствует активный ген tetW, по меньшей мере, в 5-10 раз более чувствительна к тетрациклину по сравнению с аналогичной клеткой, которая содержит активный ген tetW. В других воплощениях клетка чувствительна к концентрации тетрациклина, превышающей примерно 0,3 микрограмма на миллилитр, как было определено с помощью диско-диффузионного анализа. Пример воплощения изобретения в качестве отличительного признака включает штамм Bifidobacterium animalis subsp. lactis NCC 9034, депонированный как CNCM 1-3664. В целенаправленно измененной клетке Bifidobacterium может в значительной степени отсутствовать нуклеотидная последовательность гена tetW. В одном воплощении целенаправленно измененная клетка в значительной степени не изменена в оставшейся части своего генома.
Отличительным признаком другого аспекта изобретения является культура Bifidobacterium animalis, включающая описанные выше клетки.
Отличительным признаком другого аспекта изобретения является способ получения клетки Bifidobacterium, утратившей предварительно выбранный активный функциональный ген. Способ включает следующие стадии: (1) получение последовательности, расположенной перед предварительно выбранным функциональным геном, и последовательности, расположенной после предварительно выбранного функционального гена Bifidobacterium; (2) трансформацию популяции клеток Bifidobacterium с помощью плазмиды, которая не реплицируется в Bifidobacterium, плазмиды, включающей последовательности, которые фланкируют функциональный ген; и ген, кодирующий селектируемый маркер; (3) выращивание клеток Bifidobacterium в условиях, обеспечивающих рост клеток, содержащих ген, кодирующий селектируемый маркер в плазмиде, но не обеспечивающих рост клеток, не содержащих ген, кодирующий селектируемый маркер, благодаря чему происходит селекция трансформантов, содержащих встроенную плазмиду; (4) выращивание трансформантов в неселективных условиях, которые обеспечивают рост клеток, но допускают потерю встроенной плазмиды; (5) отбор клеток, которые утратили встроенную плазмиду путем переноса реплик колоний на чашки Петри в условиях селективного давления или при его отсутствии, и отбор тех колоний, которые чувствительны к селективному давлению; и (6) подтверждение того, что клетки, чувствительные к селективному давлению, больше не обладают функцией активного гена, и получение, таким образом, клетки Bifidobacterium, утратившей предварительно выбранный активный функциональный ген.
В определенных воплощениях удаляют предварительно выбранный функциональный ген. Функциональный ген может быть геном, который придает повышенную устойчивость к антибиотику; например, ген tetW придает устойчивость к тетрациклину.
В определенных воплощениях, описанных в этом документе, только функциональный ген, который удаляют или делают неактивным, представляет собой предварительно выбранный функциональный ген.
В различных воплощениях селективное давление представляет собой присутствие антибиотика, например, спектиномицина.
В определенных воплощениях плазмиду вводят в состав генома с помощью гомологичной рекомбинации. Встроенная плазмида может быть утрачена с помощью второй гомологичной рекомбинации.
В различных воплощениях указанного выше способа трансформанты выращивают в неселективных условиях на протяжении, по меньшей мере, примерно 100 генераций.
Указанный выше способ может быть применен на клетках Bifidobacterium вида В. animalis, в частности, В. animalis subsp. lactis, и еще более конкретно на клетках штамма В. animalis subsp. lactis NCC 2818. Клетки, которые получают с помощью этого способа из штамма NCC 2818, представляют собой приведенный в качестве примера штамм В. animalis subsp. lactis NCC 9034.
Указанный выше способ можно также применять на клетках Bifldobacterium вида В.longum.
Отличительным признаком другого аспекта изобретения является клетка Bifidobacterium animalis subsp. lactis, которая чувствительна к концентрации тетрациклина, превышающей примерно 0,3 микрограмма на миллилитр, как было определено с помощью диско-диффузионного анализа. В примере воплощения изобретения клетка В. animalis subsp. lactis представляет собой штамм NCC 9034.
Другие отличительные признаки и преимущества изобретения станут более понятными с помощью отсылки к детальному описанию изобретения, фигур и примеров, которые приведены ниже.
Краткое описание фигур
Фигура 1. Карта сайтов расщепления эндонуклеазами рестрикции плазмиды pMDY28, показывающая расположение маркеров устойчивости к спектиномицину (spec) и ампициллину (Amp). Фланкирующие последовательности tetW вставлены между сайтом Apal (основание 659) и HindIII при основании 6840. Плазмида не содержит активный функциональный ori для репликации в Bifidobacterium.
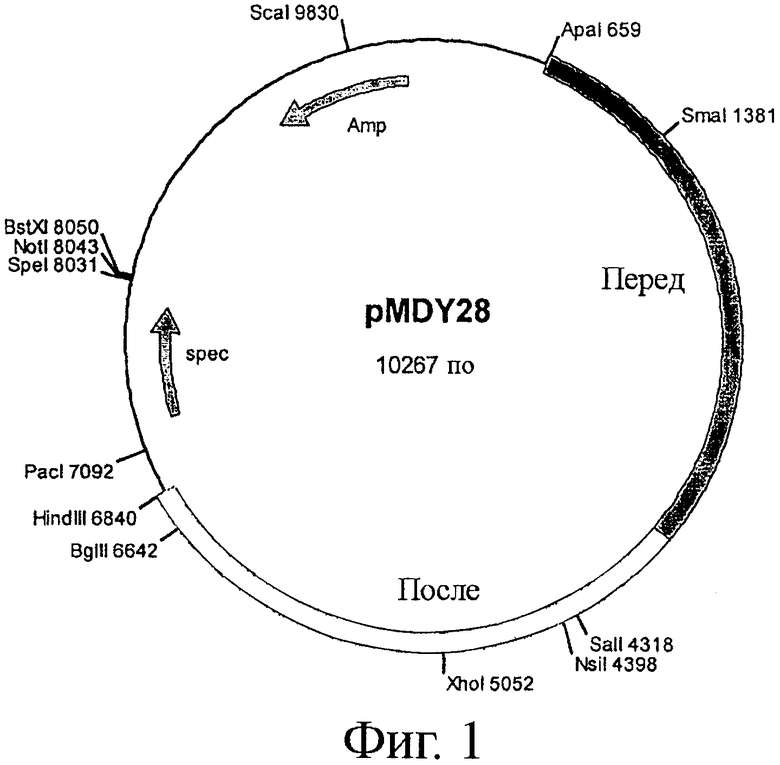
Фигура 2. Верхняя панель показывает результаты Саузерн-блот анализа фрагментов рестрикции ClaI, EcoRI, KpnI и NotI геномной ДНК, полученной из двух независимых мутантов (дорожки, обозначенные как А и В). Дорожка С содержит аналогичные фрагменты из штамма дикого типа (NCC 2818), использованного для создания мутантов. Нижняя панель показывает размеры фрагментов, наблюдаемых на Саузерн-блотах для мутантов (А и В), в сравнении с размерами фрагментов для штамма дикого типа.
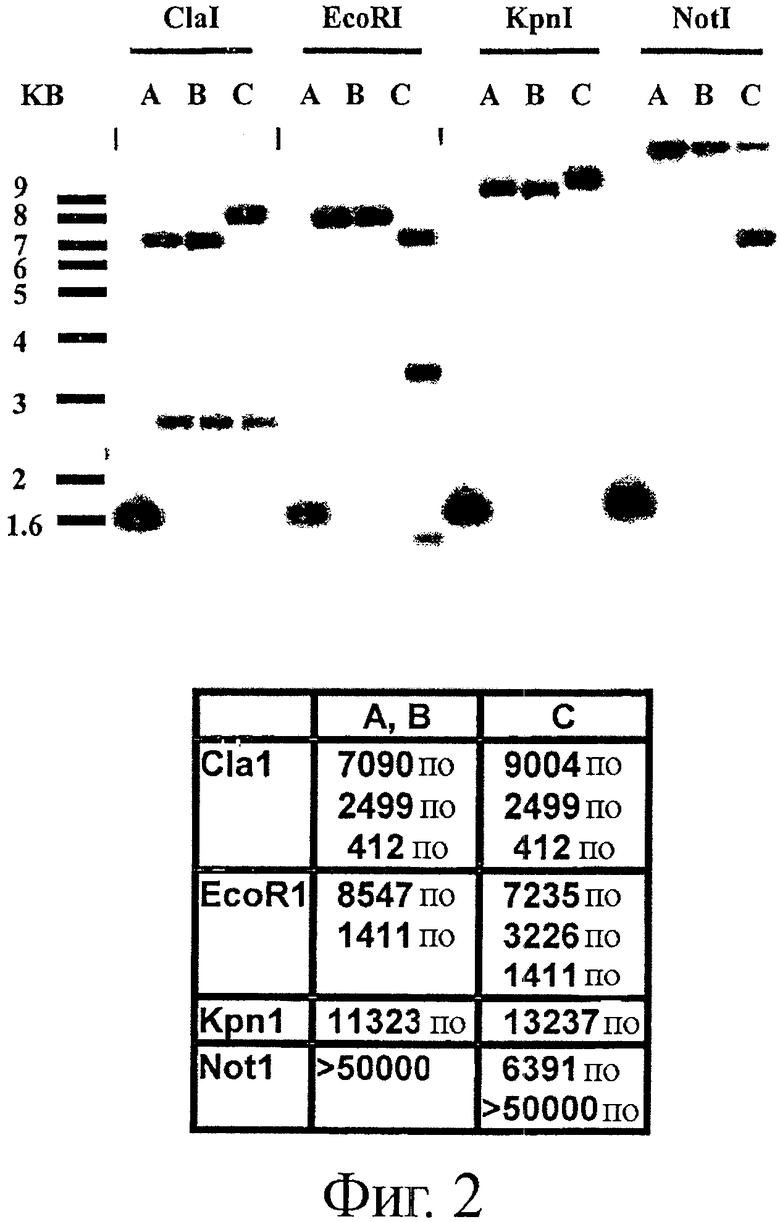
Фигура 3. Устойчивость штаммов Bifidobacterium animalis subsp. lactis NCC 362 (дикий тип) (левая панель, приблизительно 16 мкг/мл тетрациклина) и NCC 9034 (правая панель, приблизительно 0,3 мкг/мл тетрациклина) к антибиотику тетрациклину, как было установлено с помощью Е-теста для определения минимальной ингибирующей концентрации (MIC).
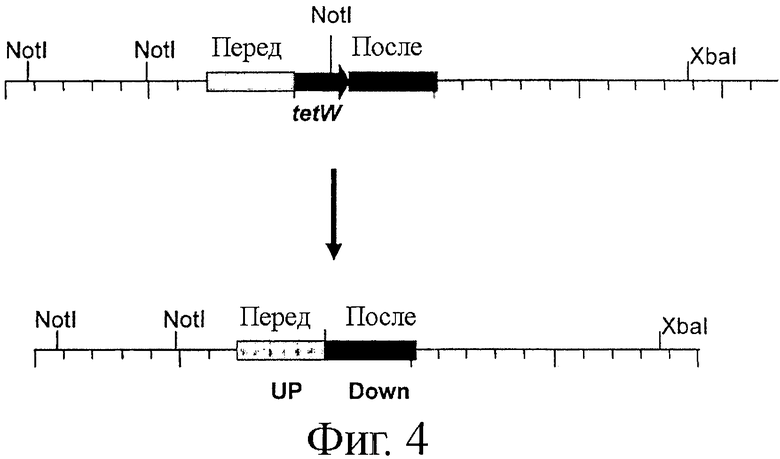
Фигура 4. Карта локуса tet для штаммов NCC 362 (верхняя панель) и NCC 9034 (нижняя панель), показывающая отсутствие гена tetW в последнем штамме. Последовательности, фланкирующие ген tetW, применяемые для создания нокаутного мутанта, показаны на обеих панелях в виде закрашенных полосок.
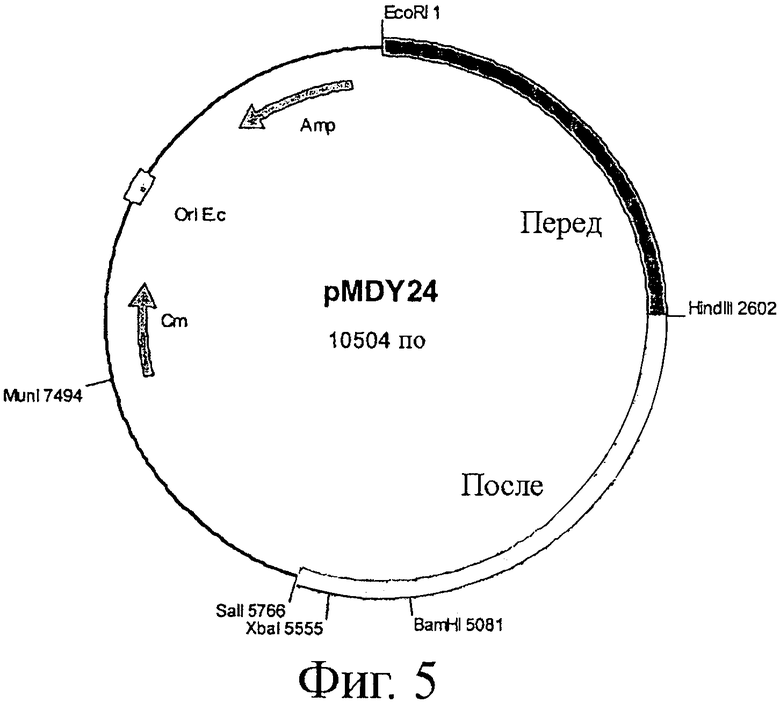
Фигура 5. Карта сайтов расщепления эндонуклеазами рестрикции плазмиды pMDY24, показывающая расположение маркеров устойчивости к хлорамфениколу (Cm) и ампициллину (Amp). Последовательности, фланкирующие ген В10108, вставлены между сайтом рестрикции EcoRI (основание 1) и SalI при основании 5766. Плазмида не содержит активный функциональный ori для репликации в Bifidobacterium.
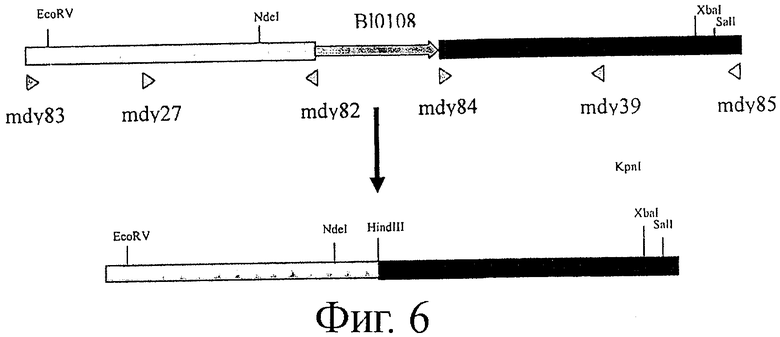
Фигура 6. Карта локуса В10108 для штаммов NCC 2705 (верхняя панель) и NCC 9035 (нижняя панель), показывающая отсутствие гена В10108 в последнем штамме. Последовательности, фланкирующие ген В10108, применяемые для создания нокаутного мутанта, показаны на обеих панелях в виде закрашенных полосок.
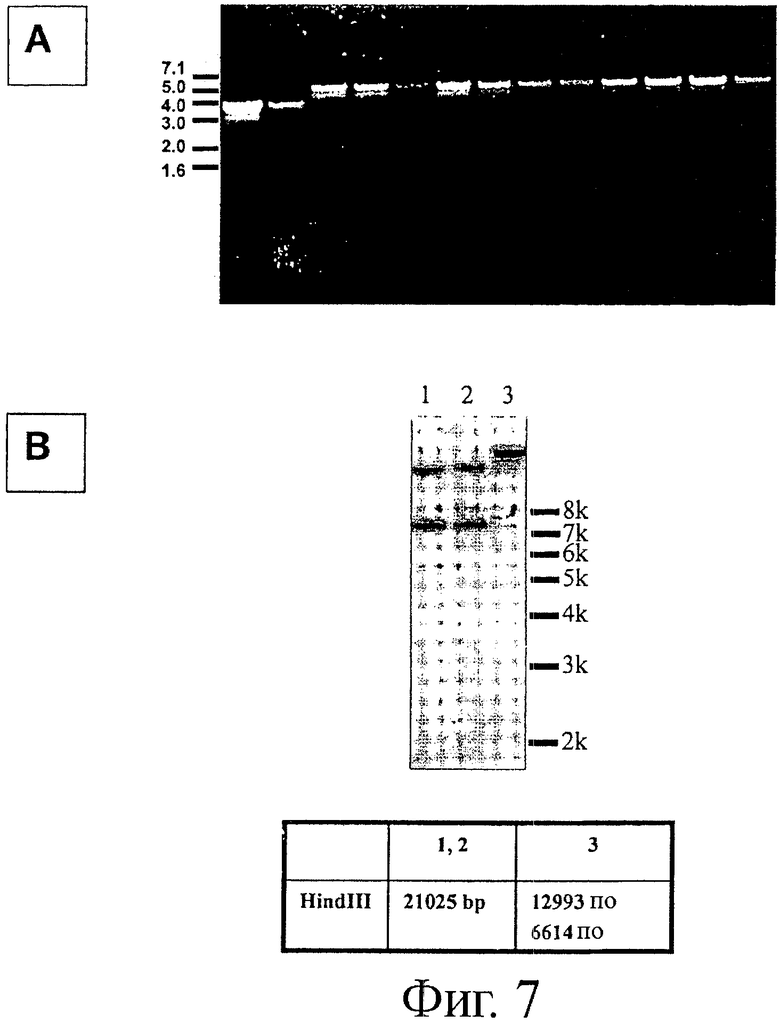
Фигура 7. Панель А показывает результаты анализа PCR колоний, чувствительных к хлорамфениколу, полученных после второго события рекомбинации и разрушения плазмиды на последней стадии процедуры удаления В10108. Размер PCR-фрагментов двух колоний (дорожки 1 и 2) указывает на делецию В10108 (3885 п.н.), тогда как размер PCR-фрагментов 10 других колоний указывает на конфигурацию дикого типа локуса В10108. Панель В показывает результаты Саузерн-блот анализа для фрагментов рестрикции HindIII геномной ДНК, полученной из двух независимых мутантов (дорожки 1 и 2). Дорожка 3 содержит аналогичные фрагменты, полученные из штамма дикого типа (NCC 2705), применяемого для создания мутантов. Нижняя панель показывает размеры фрагментов, наблюдаемых на Саузерн-блотах, полученных для мутантов (1 и 2) в сравнении с размерами фрагментов, полученных из штамма дикого типа (3).
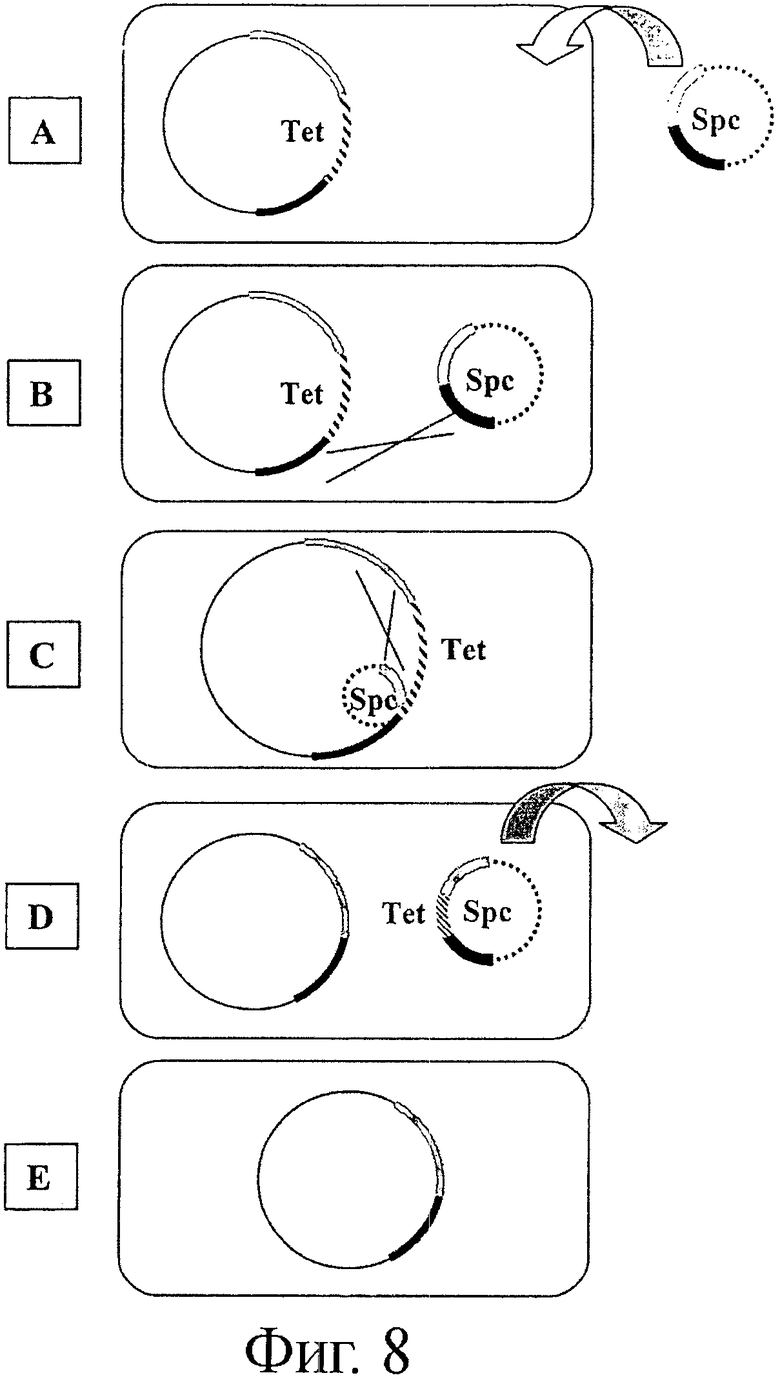
Фигура 8. Схема обобщенной стратегии удаления функционального гена из клетки Bifidobacterium. Эта стратегия представляет собой один из примеров методологий, применяемых в способах, описанных в этом документе и в примерах. Схематично, требуемую мутируемую область (в этом примере - мутируемый локус tetW) клонируют в плазмиду Е. coli (А) и трансформируют в клетки Bifidobacterium (В). Введение плазмиды в геном Bifidobacterium осуществляют с помощью гомологичной рекомбинации и селекции с помощью посева клеток в среду роста, содержащую подходящий антибиотик, в этом примере - спектиномицин (С). Клетки размножают в отсутствии селекции антибиотиками, чтобы обеспечить второе событие гомологичной репликации, которая приводит к разрушению плазмиды (D) и участка хромосомы, мутированного в той же конфигурации, что и у плазмиды, указанной на панели А. Плазмида, которая после обмена аллелями закрепляется в локусе дикого типа, не может реплицироваться в Bifidobacterium и удаляется во время репликации клеток, растущих на среде в отсутствие селекции антибиотиками (Е). Полученные мутантные клетки проверяют с помощью подходящих молекулярно-биологических методов, таких как PCR или Саузерн-блот анализ.
Осуществление иллюстративных воплощений изобретения
Клетки и культуры
В одном из своих воплощений изобретение обеспечивает клетки Bifidobacterium, такие как клетки В. animalis или В. longum, включающие геном, который целенаправленно изменен таким образом, что в нем утрачен или в значительной степени утрачен предварительно выбранный функциональный ген. Направленное разрушение или удаление какого-либо специфического гена в Bifidobacterium ранее не проводили.
В одном воплощении Bifidobacterium представляет собой клетку штамма, применяемого при обработке пищевых или кормовых продуктов или в пищевых или фармацевтических добавках. Пригодные штаммы Bifidobacterium включают, но не ограничиваются штаммами В. animalis и В. longum. Также пригодными являются другие Bifidobacteria, систематизированные или нет, которые специально добавляют в пищевые или кормовые продукты или которые обнаружены в пищевых или кормовых продуктах в больших количествах. Другие полезные виды Bifidobacterium включают любые клетки, которые прямо или косвенно высвобождаются в окружающую среду в результате изготовления или производства пищи или корма, или в результате других промышленных процессов, или в результате потребления таких продуктов людьми или животными. Виды Bifidobacterium также доступны в различных формах, предназначенных в качестве добавок как для людей, так и для животных, включая детей младшего возраста и детенышей животных, например, для лечения состояний желудочно-кишечного тракта, таких как диарея, или для того, чтобы способствовать поддержанию полезной микрофлоры в кишечнике. В одном воплощении клетка представляет собой клетку Bifidobacterium animalis subsp. lactis.
Хотя ген, который подлежит разрушению или удалению, может быть любым функциональным геном (например, любым геном, который кодирует клеточную функцию), в одном предпочтительном в настоящее время воплощении функциональный ген обеспечивает устойчивость к антибиотикам. В специфических воплощениях ген представляет собой приобретенный ген устойчивости к антибиотикам, т.е. ген, который не рассматривают как природный ген для клетки Bifidobacterium, в которой он обнаружен в настоящее время, но который скорее рассматривают как несвойственный ей ген, например, приобретенный из окружающей среды или от другого организма. В другом воплощении функциональный ген кодирует фермент или ингибитор фермента, например, ингибитор, который мог бы отрицательно воздействовать на технологию обработки пищевых продуктов или на другие желаемые свойства организмов (например, на поддержание полезной микрофлоры в кишечнике). Специалисту средней квалификации в этой области техники будет ясно, что разнообразие таких ингибиторов может кодироваться одним или несколькими генами. В одном воплощении ингибитор представляет собой ингибитор протеаз.
В специфическом воплощении генный продукт придает устойчивость к тетрациклину. В одном воплощении функциональный ген представляет собой tetW. Известно, что ген tetW относительно широко распространен. В одном воплощении для удаления гена tetW в настоящий момент предпочитают штамм Bifidobacterium animalis spp. lactis NCC 2818 в качестве источника клеток, содержащих этот ген. Последовательность локуса tetW изображена как SEQ ID NO.:1.
В определенных воплощениях клетка дикого типа устойчива к более высокой концентрации антибиотика по сравнению с клеткой настоящего изобретения, т.е. по сравнению с клеткой с удаленным геном. Чувствительность бактериальной клетки к определенному антибиотику можно измерить любым из множества способов. Одним из подходящих способов измерения чувствительности к антибиотику является применение диско-диффузионных анализов, например, Е-теста (производимого для продажи фирмой АВ BIODISK). Система Е-теста использует предварительно созданный градиент концентраций антибиотика на пластиковой полоске, и ее можно применять для определения точной минимальной ингибирующей концентрации (MIC) антибиотика для определенного организма.
В предпочтительном в настоящий момент воплощении клетка Bifidobacterium настоящего изобретения имеет разрушенный ген tetW, но при этом не утрачены другие функциональные гены, и клетка, по меньшей мере, в 5 раз более чувствительна к тетрациклину по сравнению с клеткой дикого типа, содержащей активный функциональный ген tetW. В другом воплощении клетка Bifidobacterium с неактивным геном tetW, по меньшей мере, в 10 раз более чувствительна к тетрациклину по сравнению с клеткой, которая содержит активный функциональный ген tetW.
В одном воплощении клетка Bifidobacterium с неактивным геном tetW чувствительна к концентрации тетрациклина, превышающей примерно 0,3 мкг на миллилитр, как было определено с помощью диско-диффузионного анализа.
Используемый в этом документе термин «целенаправленно измененный» в отношении генома указывает на то, что человек собственноручно воздействовал на геном или его модифицировал. В определенных воплощениях геном целенаправленно изменяют, удаляя полный локус определенного гена. В других целенаправленно измененных геномах делеции или мутации в регуляторных последовательностях могут обеспечить полную или, по меньшей мере, значительную потерю функциональности предварительно выбранного гена. В дополнение к тем геномам, на которые воздействуют, чтобы удалить полный локус, ген или даже кодирующую последовательность, целенаправленно измененные геномы включают геномы с очень небольшими изменениями (включающими вставки и делеции), такими как точечные мутации или мутации, смещающие рамку считывания, которые приводят к утрате или значительной потере функции активного гена.
Хотя предпочтительно, чтобы целенаправленное изменение приводило бы к полной потере функциональной активности, которую нельзя было бы легко восстановить, иногда будет полезной и не полная, но значительная потеря такой активности. Используемый в этом документе термин «значительная потеря» указывает на то, что утрачено более половины функциональной активности, т.е. клетка с целенаправленно измененным геномом обладает менее чем половиной функциональных параметров, приписываемых предварительно выбранному функциональному гену. Например, клетка с целенаправленно измененным геномом в отношении какого-либо фермента будет обладать менее чем 50% активности этого фермента по сравнению с родительской клеткой, из которой ее получили. Альтернативно, клетка с целенаправленно измененным геномом может продуцировать менее 50% генного продукта, ассоциированного с предварительно выбранным функциональным геном. Что касается определенных функциональных активностей, то специалисту в этой области техники будет ясно, что клетка, обладающая менее чем 50% генного продукта определенного функционального гена, не всегда может характеризоваться 50%-ной потерей измеряемой активности в клетке.
В целенаправленно измененном геноме предпочтительно существует, по меньшей мере, точечная мутация или мутация, приводящая к сдвигу рамки считывания в самой кодирующей последовательности, таким образом, чтобы не допустить перенос интактного функционального гена в другие клетки, находящиеся рядом или в окружении клетки с целенаправленно измененным геномом. Поэтому, используемый в этом документе термин «целенаправленно измененный» предусматривает воздействие на геном, в котором такое воздействие направлено на потерю или значительную потерю активности предварительно выбранного функционального гена.
Соответственно, в одном воплощении функциональный ген удаляют полностью или удаляют, по меньшей мере, в значительной степени. Это воплощение гарантирует, что функциональный ген устойчивости к антибиотикам не может быть самопроизвольно перенесен в окружающую среду, в другие бактерии кишечника или другие организмы в окружающей среде, и оно также гарантирует, что даже разрушенный ген не может быть перенесен, если только он не будет восстановлен в последующих событиях. Таким образом, в предпочтительном воплощении клетка Bifidobacterium в соответствии с этим аспектом изобретения в значительной степени лишена нуклеотидной последовательности гена tetW. В одном воплощении кодирующая последовательность удалена, по меньшей мере, в значительной степени. Альтернативно, также может быть удалена одна или несколько некодирующих последовательностей, имеющих отношение к предварительно выбранному функциональному гену. Например, можно удалить связывающие последовательности или регуляторные последовательности функционального гена, не несущие никакой другой функции в клетке. В других воплощениях клетка с целенаправленно измененным геномом имеет менее выраженное изменение, например, точечную мутацию или мутацию, приводящую к сдвигу рамки считывания, которые приводят к полной или значительной потере функциональности предварительно выбранного гена; например, геном, который был целенаправленно изменен, обладает сниженной активностью функционального гена.
Кроме того, в предпочтительном воплощении клетка Bifidobacterium в оставшейся части ее генома существенно не изменена. Другими словами, за исключением потери активности функционального гена и предпочтительно полного или, по меньшей мере, значительного удаления его из клетки, клетка Bifidobacterium идентична или практически идентична клетке, из которой она была получена (т.е. родительской клетке). Это особенно полезно, если штамм или культура адаптированы к тому, чтобы обеспечивать в течение долгого периода времени желаемые свойства, полезные, например, при переработке пищи, например, при ферментации скоропортящихся продуктов, таких как йогурт и т.п. Например, в одном воплощении, более детально описанном ниже, где В. animalis subsp. lactis NCC2818 является исходной (родительской) клеткой и tetW является предварительно выбранным функциональным геном, полученная в результате клетка является В. animalis subsp. lactis NCC 9034, целенаправленно измененный геном которой отличается от родительского только потерей предварительно выбранного гена tetW. Как и ожидалось, клетки по фенотипу также аналогичны родительским, за исключением повышенной чувствительности к тетрациклину, которую демонстрируют клетки NCC 9034. Упомянутые выше воплощения также полезны в случае штаммов, которые применяют для помощи при лечении клинических состояний, в частности, если эти штаммы отбирали или усовершенствовали для приобретения желаемых функций, таких как быстрое время генерации клеток или продолжительное время пребывания в кишечнике.
В другом из аспектов изобретение предоставляет культуру Bifidobacterium, включающую клетку с удаленным или, по меньшей мере, неактивным функциональным геном. Нет нужды детально обсуждать применение таких культур, так как оно понятно для специалистов в этой области техники. В одном воплощении культура включает клетку, полученную из известной культуры, для которой открыто или определено, что в ее геноме присутствует нежелательный функциональный ген. В одном воплощении ген является геном, приобретенным из внешней среды, таким как ген, кодирующий устойчивость к антибиотикам. В одном воплощении ген является геном устойчивости к тетрациклину. В специфическом воплощении ген является геном tetW, а в специальных воплощениях соответствующая гену tetW последовательность представлена SEQ ID NO.:1.
Способы получения клеток и культур
В другом аспекте изобретение предоставляет способы получения клетки Bifidobacterium, утратившей действующий предварительно выбранный функциональный ген. Способ включает следующие стадии:
получение последовательности, расположенной перед предварительно выбранным функциональным геном, и последовательности, расположенной после предварительно выбранного функционального гена Bifidobacterium;
трансформацию популяции клеток Bifidobacterium с помощью плазмиды, которая не реплицируется в Bifidobacterium и включающей последовательности, которые фланкируют функциональный ген; а также ген, кодирующий селектируемый маркер;
выращивание клеток Bifidobacterium в условиях, которые обеспечивают рост только тех клеток, которые содержат в плазмиде ген, кодирующий селектируемый маркер, таким образом, осуществляя отбор трансформантов, которые имеют в своем составе плазмиду, встроенную в хромосому в локусе функционального гена;
выращивание трансформантов в неселективных условиях, которые обеспечивают рост клеток, но допускают потерю встроенной плазмиды;
отбор клеток, которые утратили встроенную плазмиду, путем получения реплик колоний на чашках Петри в условиях селективного давления или в отсутствие селективного давления в отношении гена, кодирующего селектируемый маркер, и отбор тех колоний, которые чувствительны к селективному давлению;
подтверждение того, что клетки, чувствительные к селективному давлению, больше не содержат функции активного гена, таким образом, получают клетку Bifidobacterium, лишенную активного предварительно выбранного функционального гена.
Как и в случае клеток и культур, описанных выше, предпочтительно, чтобы клетка Bifidobacterium была клеткой штамма, применяемого при производстве пищевых и кормовых продуктов, такого как В. animalis или В. longum. В этом документе рассматривают возможность применения и других Bidifidobacteria таких, которые применяют в клиническом лечении людей и животных или применяют в профилактических целях. В одном воплощении клетка, применяемая в качестве исходной клетки, является Bifidobacterium animalis subsp. lactis. В определенных воплощениях, приведенных в этом документе в качестве примера, клетка В. animalis subsp. lactis является штаммом NCC 2818 (доступным в продаже как «ВВ12» от фирмы Chr.Hansen).
Ген, подлежащий удалению, может быть любым функциональным геном (например, любым геном, который кодирует клеточную функцию), в одном предпочтительном в настоящий момент воплощении функциональный ген обеспечивает устойчивость к антибиотикам. В определенных воплощениях ген является приобретенным геном устойчивости к антибиотикам, т.е. геном, который не рассматривают как ген, присущий клетке Bifidobacterium, в которой он в настоящее время обнаружен, а скорее считают его приобретенным извне, например, привнесенным из окружающей среды или от другого организма.
В одном воплощении ген, который переводят в неактивное состояние или удаляют, кодирует устойчивость к тетрациклину. В одном воплощении функциональный ген является геном tetW. В одном воплощении ген tetW имеет последовательность, определенную как SEQ ID NO.:1, которая представляет полный локус tetW в В. animalis subsp. lactis NCC 2818. В одном воплощении исходной клеткой является клетка штамма Bifidobacterium animalis subsp. lactis NCC 2818. Образцы этих клеток были депонированы в репозиторий патентов Института Пастера в соответствии с Будапештским договором. Если В. animalis subsp. lactis NCC2818 является исходной клеткой, а ген tetW является предварительно выбранным функциональным геном, то полученная клетка является В. animalis subsp. lactis NCC 9034, образцы которой также были депонированы в репозиторий патентов Института Пастера в соответствии с Будапештским договором.
В определенных воплощениях клетка дикого типа устойчива к более высокой концентрации антибиотика по сравнению с клеткой, которую получают с помощью предоставляемых способов. Диско-диффузионные анализы и тесты относительной чувствительности, такие как Е-тест (АВ BIODISK) являются предпочтительными способами измерения чувствительности клетки к антибиотику. Тем не менее, определенная минимальная ингибирующая концентрация (MIC) антибиотика для специфического организма представляет собой удобный способ сравнения относительных чувствительностей.
В предпочтительном в настоящий момент воплощении клетка Bifidobacterium настоящего изобретения имеет ген tetW, разрушенный или утраченный, но ее другие функциональные гены не утрачены или не разрушены в терминах их функции. В одном воплощении клетка, полученная с помощью способов, по меньшей мере, в 5 раз более чувствительна к тетрациклину по сравнению с клеткой дикого типа, содержащей активный ген tetW. В частности, полученная клетка Bifidobacterium, по меньшей мере, в 10 раз более чувствительна к тетрациклину по сравнению с клеткой дикого типа, которая содержит активный ген tetW. В других воплощениях клетка в 20, 30, 40 или даже 50 или в большее количество раз чувствительней, чем аналогичная клетка, которая сохраняет ген tetW. В специфическом воплощении полученная клетка Bifidobacterium чувствительна к концентрации тетрациклина, превышающей примерно 0,3 мкг на миллилитр, как было определено с помощью диско-диффузионного анализа или Е-теста.
Как было указано выше для клеток и культур, в одном воплощении функциональный ген удаляют полностью или удаляют в значительной степени, так чтобы функциональный ген устойчивости к антибиотикам не мог быть перенесен случайным образом в окружающую среду, в другую бактерию кишечника или в другие организмы в окружающей среде. Аналогично, даже разрушенный ген не способен к переносу, так как практически вся последовательность была удалена из организма. Поэтому, в таком воплощении полученная клетка Bifidobacterium, изготовленная в соответствии со способами изобретения, в значительной степени лишена нуклеотидной последовательности гена tetW. В различных воплощениях кодирующую последовательность удаляют, по меньшей мере, в значительной степени, и, кроме того, удаляют даже некодирующие последовательности, имеющие отношение к предварительно выбранному функциональному гену.
В предпочтительном в настоящий момент воплощении геном полученной клетки Bifidobacterium практически не изменен за исключением гена, который удаляют или переводят в неактивное состояние. Предпочтительно геном полученной клетки Bifidobacterium идентичен или практически идентичен геному клетки, из которой она происходит (т.е. родительской клетки), за исключением функционального гена, который переводят в неактивное состояние или удаляют. Таким образом, клетки, полученные с помощью способа изобретения, будут обладать практически такой же или даже точно такой же функциональностью и свойствами (такими как потребности в питательных веществах, профили ферментов, характеристики роста, выделение запаха и выделение кислоты), как и у родительской клетки дикого типа или штамма-прототипа, из которого они происходят. Поэтому, полученные таким способом клетки могут применяться для создания полезных культур Bifidobacterium, включающих клетку с удаленным или, по меньшей мере, неактивным функциональным геном. Это особенно справедливо, если клетку получают из известной культуры, если обнаружено, что известная культура содержит в своем геноме нежелательный функциональный ген, такой как приобретенный ген устойчивости к антибиотикам, например, ген устойчивости к тетрациклину, в частности, ген tetW.
В одном воплощении способа плазмида кодирует дополнительный селектируемый маркер. В определенных воплощениях селектируемый маркер придает устойчивость к антибиотикам. В таких воплощениях селективные условия для отбора трансформантов с встроенной плазмидой включают селективное давление в форме антибиотика, который соответствует маркеру устойчивости. В одном воплощении антибиотик представляет собой спектиномицин, в другом - это хлорамфеникол.
В определенных воплощениях плазмиду встраивают в геном с помощью гомологичной рекомбинации, предпочтительно на участке расположения последовательностей, фланкирующих ген с 5′- и 3′-конца; произошедшее событие кроссинговера обеспечивает встраивание кольцевой плазмиды в геном Bifidobacterium. В другом воплощении встроенная плазмида исчезает в результате второго события гомологичной рекомбинации, предпочтительно сопровождающейся утратой всего предварительно выбранного функционального гена или его значительной части, например, утратой локуса tetW или другого гена-мишени.
Как было указано выше, в предпочтительном воплощении предварительно выбранным функциональным геном является только тот функциональный ген, который удаляют или делают неактивным.
В одном воплощении трансформанты выращивают в неселективных условиях на протяжении достаточного количества генераций, чтобы обеспечить потерю ненужных последовательностей, включающих предварительно выбранный функциональный ген. В одном воплощении такую потерю обеспечивает, по меньшей мере, рост на протяжении примерно 100 генераций.
Ниже приведены примеры, которые дополнительно иллюстрируют эти и дополнительные аспекты изобретения и их не следует рассматривать как ограничение изобретения, которое они иллюстрируют.
Сведения, подтверждающие возможность осуществления изобретения
Конструирование нерепликативной плазмиды
Фрагменты ДНК размером примерно 3 т.н., фланкирующие tetW выше его инициирующего кодона и ниже его стоп-кодона, амплифицировали с помощью следующей пары праймеров:
mdy100: 5′-CGCACCGGGCCCCCTCACGCAAACTCTACG-3′ (SEQ ID NO.:2);
mdy98: 5′-TGTGGTGTATCACATGTGATTGTCCTCCCTTTA-3′ (SEQ ID NO.:3) и
mdy99: 5′-AGGACAATCACATGTGATACACCACAGCGAGG-3′ (SEQ ID NO.:4)
mdy89: 5′-CCGTCCAAGCTTTCTATCGCGAGATAATCAGC-3′) (SEQ ID NO.:5).
Полученные амплифицированные продукты применяли как матрицу при проведении PCR со слиянием с помощью праймеров mdy100 и mdy89, которая приводит к получению фрагмента ДНК, который содержит участки, расположенные перед геном tetW и после гена tetW, соединенные вместе через инициирующий кодон и стоп-кодон гена tetW.
Фрагменты ДНК расщепляли на концах с помощью HindIII и Apal и клонировали в pJL74 (Ledeaux and Grossman, J. Bacterial. 1995 Jan; 177(1): 166-75) между сайтами HindIII и Apal. Полученную плазмиду назвали pMDY28 (SEQ ID NO.:6). Подробная карта сайтов расщепления эндонуклеазами рестрикции изображена на фигуре 1. Последовательность фрагмента ДНК, вставленного в pJL74 для образования pMDY28, проверили и было показано, что она идентична последовательности хромосомы В. animalis subsp. lactis NCC 2818. Это указывает на то, что не было введено никаких мутаций ни в процессе опосредованной PCR амплификации ДНК ни во время последующих манипуляций с ДНК.
Трансформация В. animalis и обмен аллелями
Плазмиду pMDY28 трансформировали в клетки В. animalis с помощью метода, описанного Argnani et al. 1996 (Microbiology; 142:109-14.). Клетки помещали на чашки с MRS, содержащей 100 мг спектиномицина на литр. Полученные трансформанты specR селектировали анаэробно. Так как плазмида pMDY28 не может реплицироваться в В. animalis, колонии specR наиболее вероятно были получены в результате встраивания плазмиды в геном В. animalis с помощью гомологичной рекомбинации посредством простого кроссинговера. Успешная трансформация нерепликативной плазмиды в клетки Bifidobacterium ранее показана не была.
Трансформанты specR выращивали на протяжении примерно 100 генераций в питательной среде MRS в отсутствии селекции антибиотиком для обеспечения потери плазмиды, и единичные колонии помещали в чашки Петри с агаризованной средой MRS. Чтобы убедиться в том, что из генома В. animalis была удалена плазмида, единичные колонии тестировали на потерю устойчивости к спектиномицину с помощью реплик колоний на чашках с агаризованной средой MRS с добавленным спектиномицином или без него.
Из 750 протестированных колоний 163 колонии были чувствительны к спектиномицину (21%), что указывало на то, что плазмида была вырезана из хромосомы В. animalis в результате второго события кроссинговера.
Это второе событие могло бы привести к двум геномным конфигурациям:
i) реверсии к конфигурации дикого типа с локусом tetW, идентичным клеткам дикого типа, или
ii) делеции tetW.
Чтобы различить между этими двумя возможностями, 135 из 163 колоний, чувствительных к спектиномицину, которые были описаны выше, были проанализированы на потерю tetW с помощью прямой PCR колоний со следующей парой праймеров:
mdy94: 5′-GAGCATGTATTCGGTGTCG-3′ (SEQ ID NO.:7) и
mdy95: 5′-GATTTGCCCTATCGACTG-3′ (SEQ ID NO.:8).
В двух из 135 протестированных колоний было получено увеличение полосы ДНК размером 1034 п.н., что указывало на делецию tetW, тогда как в других колониях получали фрагменты PCR с более высокой молекулярной массой (2949), такой же, как в клетках дикого типа (смотри фигуру 2, панель В).
Саузерн-блот анализ мутантов с делецией гена tetW
Делецию гена tetW подтверждали с помощью PCR и Саузерн-блот анализа геномной ДНК, экстрагированной из двух подходящих мутантов, идентифицированных с помощью PCR-анализа (смотри фигуру 2, панели А и В). Образцы хромосомной ДНК расщепляли рестрикционными ферментами (ClaI, EcoRI или NotI). Саузерн-блоты гибридизовали с ДНК из pMDY28. Саузерн-блот анализ подтвердил, что ген tetW был удален из генома обоих подходящих мутантов (дорожки А и В). Был оставлен только один штамм; в дальнейшем его обозначили как NCC 9034.
Тестирование штамма В. animalis subsp. lactis NCC 9034 на чувствительность к антибиотику в сравнении со штаммом NCC 2818
Чувствительность штамма В. animalis subsp. lactis NCC 2818 дикого типа к тетрациклину сравнивали с чувствительностью полученного из него штамма NCC 9034, для которого было показано, что в нем существенно утрачен ген tetW. Доступный в продаже Е-тест (АВ BIODISK) применяли для определения MIC каждого штамма для тетрациклина.
Результаты показаны на фигуре 3. Если MIC для штамма NCC 2818 составляла 16 мкг/мл, штамм NCC 9034 был более чувствительным к тетрациклину, MIC для этого штамма составляла только примерно 0,3 мкг/мл. Таким образом, NCC 9034 был примерно в 50 раз более чувствительным к тетрациклину по сравнению с родительским штаммом NCC 2818 дикого типа. Этот чувствительный фенотип полностью соответствовал потере функциональности гена tetW. Как видно из результатов Саузерн-блот анализа, приведенных выше, это подтверждается анализом: генов.
Делеция гена (В10108) в В. longum, кодирующего белок-ингибитор протеаз
Конструирование нерепликативной плазмиды
Фрагменты ДНК размером примерно 3 т.н., фланкирующие В10108, амплифицировали с помощью следующих пар праймеров:
mdy82: 5′-CGACCCAAGCTTGGATCGGCTCGTGCATCATTGC-3′ (SEQ ID NO.:9);
mdy83: 5′-GCAAACCGTACCTCAATACC-3′ (SEQ ID NO.:10) и
mdy84: 5′-CGACCCAAGCTTGCAGTCCGTCAATTAGGGTG-3′ (SEQ ID NO.:11)
mdy85: 5′-CGTTGCTGACGTTGCGGTTC-3′)(SEQ ID NO.:12).
Полученные с помощью mdy82 и mdy83 PCR-продукты расщепляли с помощью EcoRI и HindIII. Полученные с помощью mdy84 и mdy85 PCR-продукты расщепляли с помощью HindIII и SalI.
Амплифицированные фрагменты ДНК соединяли вместе через их общие сайты рестрикции HindIII и клонировали в pJH101 (Ferrari, F.R. et al., J. Bacteriol. (1983) 154:1513-1515) между сайтами EcoRI и SalI с помощью трех способов лигирования. Полученную плазмиду назвали pMDY24 (SEQ ID NO.:13). Подробная карта сайтов расщепления эндонуклеазами рестрикции pMDY24 приведена на фигуре 5.
Трансформация В. longum и обмен аллелями
Плазмиду pMDY24 трансформировали в клетки В. longum NCC2705 в соответствии с методом, описанным Argnani et al. 1996 (Microbiology; 142:109-14), с тем лишь исключением, что из среды роста убирали сахарозу. Клетки распределяли по чашке Петри с MRS, содержащей 3,5 мг хлорамфеникола на литр. Полученные трансформанты cmR селектировали анаэробно. Так как плазмида pMDY24 не может реплицироваться в В. longum, колонии cmR наиболее вероятно были получены в результате встраивания плазмиды в геном В. longum с помощью гомологичной рекомбинации посредством простого кроссинговера.
Трансформанты cmR выращивали на протяжении примерно 100 генераций в отсутствие селекции антибиотиком, чтобы обеспечить потерю плазмиды до того, как единичные колонии помещали на чашки Петри с агаризованной средой MRS. Чтобы убедиться в том, что из генома В. longum была удалена плазмида, единичные колонии тестировали на потерю устойчивости к хлорамфениколу с помощью реплик колоний на чашках с агаризованной MRS с добавленным хлорамфениколом или без него.
Из 200 протестированных колоний 22 колонии были чувствительны к хлорамфениколу (11%), что указывало на то, что плазмида была вырезана из хромосомы В. longum в результате второго события кроссинговера.
Это второе событие кроссинговера могло бы привести к двум геномным конфигурациям:
i) реверсии к конфигурации дикого типа с локусом В10108, идентичным клеткам дикого типа, или
ii) делеции В10108.
Чтобы различить между этими двумя возможностями, хромосомную ДНК экстрагировали в 12 из 22 колоний, чувствительных к хлорамфениколу. Хромосомную ДНК тестировали на потерю В10108 с помощью PCR со следующей парой праймеров:
mdy27: 5′-TCGGAAGATCTCATGGTCAACGAGTTCGC-3′ (SEQ ID NO.:14) и
mdy39: 5′-TAGTACTAAGCTTCTTGAGCTCTTCCTTCTGC-3′ (SEQ ID NO.:15).
Две из двенадцати протестированных колоний демонстрировали фрагмент PCR размером 3885 п.н., что указывало на делецию В10108 (фигура 7, панель А, дорожки 1-2). Десять других протестированных колоний демонстрировали более высокомолекулярные фрагменты PCR размером 5311 п.н., сходные с теми, которые получали для клеток дикого типа (фигура 7, панель А, дорожки 3-12).
Саузерн-блот анализ мутантов с делецией гена В10108
Делецию гена В10108 подтверждали с помощью PCR и Саузерн-блот анализа геномной ДНК, экстрагированной из двух подходящих мутантов, идентифицированных с помощью PCR-анализа, как было описано выше и показано на фигуре 7. Образцы хромосомной ДНК расщепляли рестрикционными ферментами (EcoRI и HindIII). Саузерн-блоты гибридизовали с ДНК из pMDY24. Саузерн-блот анализ подтвердил, что ген В10108 был удален из генома обоих подходящих мутантов (фигура 7, дорожки А и В). Был оставлен только один штамм; в дальнейшем его обозначили как NCC 9035.


























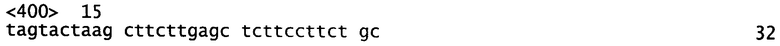
Изобретение относится к области молекулярной биологии и микробиологии. Предложен способ получения рекомбинантных клеток Bifidobacterium, лишенных функционально активного гена tetW, а также соответствующая ему клетка. Изобретение может быть использовано в пищевой промышленности и сельском хозяйстве при обработке пищи и при производстве бактерий. 2 н. и 11 з.п. ф-лы, 8 ил.
1. Способ получения рекомбинантных клеток Bifidobacterium, лишенных функционально активного гена tetW, включающий стадии:
получения последовательности, расположенной перед указанным геном, и последовательности, расположенной после указанного гена Bifidobacterium;
трансформацию популяции клеток Bifidobacterium плазмидой, которая не реплицируется в Bifidobacterium, включающей последовательности, которые фланкируют функциональный ген; а также ген, кодирующий селективный маркер;
выращивание клеток Bifidobacterium в условиях, обеспечивающих рост клеток, содержащих ген, кодирующий селектируемый маркер в плазмиде, но не обеспечивающих рост клеток, не содержащих ген, кодирующий селективный маркер, благодаря чему происходит селекция трансформантов, содержащих встроенную плазмиду;
выращивание трансформантов в неселективных условиях, которые обеспечивают рост клеток, но допускают потерю встроенной плазмиды;
отбор клеток, которые утратили встроенную плазмиду путем переноса реплик колоний на чашки Петри в условии селективного давления или при его отсутствии, и отбор тех колоний, которые чувствительны к селективному давлению; и
подтверждение того, что клетки, чувствительные к селективному давлению, больше не обладают функцией указанного гена, и получение таким образом клетки Bifidobacterium, утратившей указанный ген.
2. Способ по п.1, в котором удаляют указанный ген, где предпочтительно антибиотиком является тетрациклин.
3. Способ по п.1, в котором селективное давление представляет собой присутствие антибиотика, такого как спектиномицин.
4. Способ по п.1, в котором плазмида интегрирована в геном гомологичной рекомбинацией, где необязательно интегрированная плазмида теряется в результате второй гомологичной рекомбинации.
5. Способ по п.1, в котором только указанный ген, который удаляют или приводят в нефункциональное состояние, является указанным геном.
6. Способ по п.5, в котором трансформанты выращивают в неселективных условиях, по меньшей мере, на протяжении примерно 100 генераций.
7. Способ по п.1, в котором клетки Bifidobacterium являются клетками B.longum или B.animalis, например, клетками B.animalis subsp. lactis.
8. Способ по п.1, в котором клетки Bifidobacterium являются B.animalis subsp.lactis NCC 2818.
9. Рекомбинантная клетка Bifidobacterium, полученная способом по п.1, включающая геном, который целенаправленно изменен для утраты функционально активного гена tetW, где нуклеотидная последовательность гена tetW была удалена.
10. Клетка Bifidobacterium по п.9, которая представляет собой клетку Bifidobacterium animalis.
11. Клетка Bifidobacterium по п.9, которая представляет собой В.animalis subsp. Lactis NCC 9034.
12. Клетка Bifidobacterium по п.9, которая, по меньшей мере, в 5 раз более чувствительна к тетрациклину, чем сопоставимая клетка, которая содержит функционально активный ген tetW, предпочтительно, в 10 раз более чувствительна к тетрациклину, чем сопоставимая клетка, которая содержит активный ген tetW.
13. Клетка Bifidobacterium по п.12, которая чувствительна к концентрации тетрациклина, превышающей около 0,3 микрограммов на миллилитр, при определении с помощью диско-диффузионного анализа.
| MOUBAREC С.et al: "Antimicrobial susceptibility of bifidobacteria", Journal on antimicrobial chemotherapy, 2005, v.55, p.38-44 | |||
| MASCO L | |||
| et al.: "Antimicrobial susceptibility of Bifidobacterium strains from humans | |||
| Animals and probiotic products", Journal on antimicrobial chemotherapy, 2006, v.58, p.85-94 | |||
| US 4963487, 16.10.1990 | |||
| WO 2009119780, 16.11.2006. |
Авторы
Даты
2012-09-10—Публикация
2007-08-17—Подача