По данной заявке испрашивается приоритет по условной заявке США с серийным No. 60/787333, поданной 30 марта 2006 года, и условной заявке США с серийным No. 60/813085, поданной 12 июня 2006 года, описания которых включены в настоящий документ в качестве ссылок в полном объеме.
1. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к функциональным белкам, кодируемым последовательностями нуклеиновых кислот, содержащими нонсенс-мутацию. Также настоящее изобретение относится к способам получения функциональных белков, кодируемых последовательностями нуклеиновых кислот, содержащими нонсенс-мутацию, и к применению таких белков для профилактики, управления течением и/или лечения заболеваний, обусловленных нонсенс-мутацией(ями) в гене.
2. ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Экспрессия генов в клетках зависит от последовательных процессов транскрипции и трансляции. Совместно, эти процессы обеспечивают продукцию белка из нуклеотидной последовательности соответствующего ему гена.
Транскрипция вовлекает синтез РНК из ДНК РНК-полимеразой. Транскрипция начинается в промоторной области гена и продолжается до индукции терминации, например, посредством образования структуры стебель - петля в образующейся РНК или связывания продукта гена rho.
Затем с мРНК продуцируется белок посредством процесса трансляции, происходящей на рибосоме, с помощью тРНК, тРНК-синтетаз и различных других видов белков и РНК. Трансляция включает три фазы: инициации, элонгации и терминации. Трансляция инициируется образованием инициирующего комплекса, состоящего из белковых факторов, мРНК, тРНК, кофакторов и субъединиц рибосом, которые распознают сигналы на мРНК, которые направляют трансляционный аппарат на начало трансляции мРНК.
После образования инициирующего комплекса происходит рост полипептидной цепи посредством многократного добавления аминокислот вследствие активности пептидилтрансферазы рибосомы, а также тРНК и тРНК-синтетаз. Наличие одного из трех кодонов терминации (UAA, UAG, UGA) в A-участке рибосомы дает сигнал факторам высвобождения (RF) полипептидной цепи к связыванию и распознаванию сигнала терминации. После этого происходит гидролиз сложноэфирной связи между 3'-нуклеотидом тРНК, расположенной в P-участке рибосомы и образующейся полипептидной цепью. Завершенная полипептидная цепь высвобождается, и субъединицы рибосом повторно используются для другого раунда трансляции.
Мутации последовательности ДНК, при которых происходит изменение количества оснований, относят к инсерционным или делеционным мутациям (мутациям со сдвигом рамки считывания), и они могут приводить к значительным нарушениям в геноме. Мутации ДНК, которые заменяют одно основание на другое, называют миссенс-мутациями, и их подразделяют на классы транзиций (одного пурина на другой пурин или одного пиримидина на другой пиримидин) и трансверсий (пурина на пиримидин или пиримидина на пурин).
Мутации в виде инсерций, делеций, транзиций и трансверсий могут приводить к нонсенс-мутации, или мутации с терминацией цепи, в которой мутация основания со сдвигом рамки считывания или в пределах рамки считывания приводит к замене кодона аминокислоты на один из трех стоп-кодонов. Три преждевременных стоп-кодона могут приводить к аберрантным белкам в клетках в результате преждевременной терминации трансляции. Нонсенс-мутация в гене может приводить к ряду заболеваний, таких как злокачественные опухоли, лизосомальные нарушения накопления, мышечные дистрофии, кистозный фиброз и гемофилия, чтобы назвать немногие из них.
В бактериальных и эукариотических штаммах с нонсенс-мутациями может возникать супрессия нонсенс-мутации в результате мутации в одной из молекул тРНК, так что мутантная тРНК может распознавать нонсенс-кодон, в результате мутаций в белках, которые вовлечены в процесс трансляции, в результате мутаций в рибосоме (либо в рибосомальной РНК, либо в рибосомальных белках), или посредством добавления соединений, которые изменяют процесс трансляции. Результатом этого является то, что в полипептидную цепь включается аминокислота в участке нонсенс-мутации, и трансляция не терминируется преждевременно в нонсенс-кодоне. Встроенная аминокислота не обязательно будет идентична исходной аминокислоте белка дикого типа; однако множество аминокислотных замен не оказывают значительного эффекта на структуру или функцию белка. Таким образом, белок, продуцированный посредством супрессии нонсенс-мутации, вероятно, будет обладать активностью, сходной с белком дикого типа. Этот сценарий обеспечивает возможность лечения заболеваний, обусловленных нонсенс-мутациями, посредством избежания преждевременной терминации трансляции через супрессию нонсенс-мутации.
Остается необходимость в данной области в способах лечения, управления течением и/или профилактики заболевания, обусловленного нонсенс-мутацией(ями) в гене(ах) у субъекта-человека посредством введения соединения, которое осуществляет супрессию преждевременной терминации трансляции у человека (людей), опосредуя ошибочное считывание нонсенс-кодона и продуцируя белок (белки) не дикого типа in vivo в количестве, достаточном для лечения, управления течением и/или профилактики заболевания.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, частично, на открытии средств для супрессии нонсенс-кодонов, которые можно системно вводить субъекту (включая человека) для супрессии нонсенс-кодона в РНК, транскрибируемой с гена(ов), содержащего нонсенс-мутацию(и), обеспечивая прохождение считывания через нонсенс-кодон и встраивание аминокислоты в участке нонсенс-кодона. В определенных вариантах осуществления для продукции функционального белка с "прочитанным" терминатором встроенная аминокислота представляет собой аминокислоту, отличную от аминокислоты, которая встречается в соответствующей области в белке дикого типа. Функциональный белок с "прочитанным" терминатором, продуцированный посредством супрессии нонсенс-кодона в РНК, транскрибированной с гена(ов), содержащего нонсенс-мутацию, является пригодным для лечения, профилактики и/или управления течением заболевания, обусловленного нонсенс-мутацией(ями) в гене(ах).
Продукция функционального белка с "прочитанным" терминатором у субъекта (включая человека) посредством супрессии нонсенс-кодона в РНК, транскрибированной с гена(ов), содержащего нонсенс-мутацию, с использованием средства для супрессии нонсенс-кодона, обладает некоторыми преимуществами относительно других способов терапии, предусмотренных для профилактики, лечения и/или управления течением заболевания, обусловленного нонсенс-мутацией в гене(ах). Например, продукция функционального белка с "прочитанным" терминатором с использованием средства для супрессии нонсенс-кодона не вовлекает введение чужеродного генетического материала субъекту, как в случае генной терапии. Таким образом, устраняется риск встраивания чужеродного генетического материала в неправильную область хромосомной ДНК, риск сверхэкспрессии белка, кодируемого чужеродным генетическим материалом, введенным субъекту, и риск передачи вектора, такого как вирус, используемый для введения чужеродного материала субъекту, другим субъектам.
Настоящее изобретение относится к способам продукции у субъекта (предпочтительно, человека), нуждающегося в этом, эффективного количества функционального белка(ов) с "прочитанным" терминатором, кодируемого последовательностью нуклеиновой кислоты, содержащей нонсенс-мутацию, при этом способы включают ведение субъекту эффективного количества средства (средств) для супрессии нонсенс-кодона. В частности, настоящее изобретение относится к способам лечения, управления течением и/или профилактики заболевания, обусловленного нонсенс-мутацией в гене(ах), при этом способы включают введение субъекту (предпочтительно, человеку), нуждающемуся в этом, эффективного количества средства (средств) для супрессии нонсенс-кодона, где эффективное количество средства (средств) представляет собой количество, достаточное для продукции эффективного количества функционального белка(ов) с "прочитанным" терминатором, кодируемого геном, содержащим нонсенс-мутацию. Неограничивающие примеры заболеваний, обусловленных нонсенс-мутацией в гене(ах), которые можно подвергать лечению, управлению течением и/или профилактике, в соответствии со способами по этому изобретению, включают: амилоидоз, LINCL, гемофилию, болезнь Альцгеймера, атеросклероз, гигантизм, карликовость, гипотиреоз, гипертироидизм, кистозный фиброз, старение, ожирение, болезнь Паркинсона, болезнь Неймана-Пика, семейную гиперхолестеринемию, пигментный ретинит, мышечную дистрофию (например, мышечную дистрофию Дюшенна), спинальную мышечную атрофию и синдром Марфана.
В одном аспекте настоящее изобретение относится к средству для супрессии для нонсенс-кодона, которое можно перорально вводить субъекту (предпочтительно, человеку) для профилактики, лечения и/или управления течением заболевания, обусловленного нонсенс-мутацией в гене. Средства для супрессии нонсенс-кодонов, вводимые перорально, не оказывают никаких неблагоприятных побочных эффектов, или оказывают незначительные (при их наличии) неблагоприятные побочные эффекты в дозировке(ах), которая приводит к эффективному количеству функционального белка с "прочитанным" терминатором. В конкретном варианте осуществления средства для супрессии нонсенс-кодонов не приводят к почечной недостаточности и/или потере слуха при пероральном введении субъекту (предпочтительно, человеку) в дозировке(ах), которая приводит к эффективному количеству функционального белка с "прочитанным" терминатором. Таким образом, средства для супрессии нонсенс-кодонов можно длительно вводить системно (например, перорально) без токсичности, такой как почечная недостаточность и потеря слуха.
Пероральное введение средства для супрессии нонсенс-кодона позволяет субъекту принимать назначенную ему/ей дозировку средства для супрессии нонсенс-кодонов без необходимости в медицинских специалистах для введения средства. Это снижает медицинские затраты, обусловленные профилактикой, лечением и/или управлением течением заболевания, обусловленного нонсенс-мутацией в гене(ах), вследствие устранения затрат на введение средства медицинским специалистом. Пероральное введение средства для супрессии нонсенс-кодона также повышает качество жизни субъекта, поскольку субъект не ограничен и/или не обременен посещением медицинских специалистов для введения его/ее дозировки средства для супрессии нонсенс-кодона. Кроме того, пероральное введение средства для супрессии нонсенс-кодона позволяет доставку системного лекарственного средства во все пораженные заболеванием области органа.
В другом аспекте настоящее изобретение относится к средствам для супрессии нонсенс-кодонов, которые не проявляют значительную антибактериальную активность против грамотрицательного микроорганизма и/или грамположительного микроорганизма. В противоположность средствам для супрессии нонсенс-кодонов с антибактериальной активностью применение средств для супрессии нонсенс-кодонов, которые не проявляют значительную антибактериальную активность против грамотрицательного микроорганизма и/или грамположительного микроорганизма, не приводит к бактериальной устойчивости к лекарственным средствам с антибиотической активностью. Кроме того, применение средств для супрессии нонсенс-кодонов, которые не проявляют значительной антибактериальной активности против грамотрицательного микроорганизма и/или грамположительного организма, вероятно, не будет индуцировать осложнения, связанные с патологическим ростом нормальной микробной флоры, который может произойти в случае многих длительно вводимых антибиотиков.
Таким образом, настоящее изобретение относится к функциональным белкам с "прочитанным" терминатором, кодируемым последовательностями нуклеиновых кислот, содержащими нонсенс-мутацию, которую получают способами, включающими введение средства (средств) для супрессии нонсенс-кодона, которое является хорошо переносимым у субъектов и не обладает значительной антибактериальной активностью против грамотрицательного микроорганизма и/или грамположительного микроорганизма.
4. ОПИСАНИЕ РИСУНКОВ
ФИГ 1. Схема мРНК, образованной из люциферазных репортерных конструкций.
ФИГ. 2(A-E). мРНК, образованная из репортера люцифераза-CD40 в конструкциях мРНК.
ФИГ 3. Схема мРНК β-тубулина мыши.
5. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, частично, на открытии средств для супрессии нонсенс-кодонов, которые можно системно вводить субъекту (включая человека) для супрессии нонсенс-мутации в РНК, транскрибируемой с гена(ов), содержащего нонсенс-мутацию(и), обеспечивающих прохождение считывания через нонсенс-мутацию и встраивание аминокислоты в область нонсенс-кодона. В определенных вариантах осуществления для продукции функционального белка не дикого типа, встраиваемая аминокислота является аминокислотой, отличной от аминокислотного остатка, который встречается в соответствующей области белка дикого типа. Функциональный белок с "прочитанным" терминатором, полученный посредством супрессии нонсенс-кодона в РНК, транскрибируемой с гена(ов), содержащего нонсенс-мутацию, пригоден для лечения, профилактики и/или управления течением заболевания, обусловленного нонсенс-мутацией(ями) в гене(ах).
Настоящее изобретение относится к способам продукции у субъекта (предпочтительно, человека), нуждающегося в этом, эффективного количества функционального белка(ов) с "прочитанным" терминатором, кодируемого последовательностью нуклеиновой кислоты, содержащей нонсенс-мутацию, при этом способы включают ведение субъекту эффективного количества средства (средств) для супрессии нонсенс-кодона. В соответствии с этим изобретением функциональный белок (белки) с "прочитанным" терминатором обладает одной или несколькими функциями полноразмерного белка(ов) дикого типа. В конкретных вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором, продуцируемый способами по этому изобретению, представляет собой функциональный белок (белки) не дикого типа. В другом варианте осуществления функциональный белок не дикого типа является полноразмерным. В других вариантах осуществления функциональный белок (белки) не дикого типа является не полноразмерным. Продукцию функционального белка(ов) с "прочитанным" терминатором можно оценивать посредством анализа in vitro и/или в модели на животных. Например, для определения того, происходит ли продукция функционального белка(ов) с "прочитанным" терминатором, можно использовать репортерный анализ. Альтернативно для определения того, происходит ли продукция функционального белка(ов) с "прочитанным" терминатором, можно использовать модель на животных, таких как мышь mdx.
В определенных вариантах осуществления эффективное количество средства для супрессии нонсенс-кодона, вводимого субъекту, в соответствии с этим изобретением эквивалентно количеству, которое обеспечивает супрессию нонсенс-кодона в анализе с репортерным геном, включающем стадии: (a) контактирования средства с клеткой, обладающей последовательностью нуклеиновой кислоты, содержащей репортерный ген, где репортерный ген содержит преждевременный стоп-кодон; и (b) детекции экспрессии и/или активности функционального белка с "прочитанным" терминатором, кодируемого репортерным геном. В других вариантах осуществления эффективное количество средства для супрессии нонсенс-кодона эквивалентно количеству, которое обеспечивает супрессию нонсенс-кодона в анализе с репортерным геном, включающем стадии: (a) контактирования средства с клеточным лизатом и последовательностью нуклеиновой кислоты, содержащей репортерный ген, где репортерный ген содержит преждевременный стоп-кодон; и (b) детекции экспрессии и/или активности функционального белка с "прочитанным" терминатором, кодируемого репортерным геном. См. раздел 5,4 для более подробного описания этих анализов.
В одном аспекте настоящее изобретение относится к способам продукции у субъекта (предпочтительно, человека), нуждающегося в этом, эффективного количества функционального белка(ов) с "прочитанным" терминатором, кодируемого последовательностью нуклеиновой кислоты (кислот), содержащей нонсенс-мутацию, при этом способы включают пероральное введение субъекту эффективного количества средства (средств) для супрессии нонсенс-кодона. В определенных вариантах осуществления эффективное количество средства (средств) для супрессии нонсенс-кодона, вводимого перорально, составляет между 0,1 мг/кг и 500 мг/кг в сутки. В некоторых вариантах осуществления эффективное количество средства (средств) для супрессии нонсенс-кодона, вводимого перорально, составляет между 0,1 мг/кг и 500 мг/кг, которые вводят в качестве одной дозы, двух доз, трех доз, четырех доз или более. В конкретном варианте осуществления эффективное количество средства (средств) для супрессии нонсенс-кодона, вводимого перорально, составляет между 0,1 мг/кг и 500 мг/кг в сутки, которые разделены на три дозы, при этом первая и вторая дозы составляют по 25% от общего вводимого количества и третья доза составляет 50% от общего вводимого количества. В других вариантах осуществления эффективное количество средства (средств) для супрессии нонсенс-кодона, вводимого перорально человеку, составляет менее 35 мг/кг в сутки. В конкретных вариантах осуществления эффективное количество средства (средств) для супрессии нонсенс-кодона, вводимого перорально человеку, составляет между 0,1 мг/кг и 30 мг/кг в сутки. В другом аспекте настоящее изобретение относится к способам продукции у субъекта (предпочтительно, человека), нуждающегося в этом, эффективного количества функционального белка(ов) с "прочитанным" терминатором, кодируемого последовательностью(ями) нуклеиновой кислоты, содержащей нонсенс-мутацию, при этом способы включают ведение субъекту эффективного количества средства (средств) для супрессии нонсенс-кодона, где эффективное количество средства (средств) является достаточным для обеспечения концентрации в плазме от 0,5 мкг/мл до 500 мкг/мл средства (средств) в течение 2 часов, 2,5 часов, 3 часов или более. В определенных вариантах осуществления эффективное количество средства (средств) составляет между 0,1 мг/кг и 500 мг/кг в сутки. В конкретном варианте осуществления эффективное количество средства (средств) составляет между 0,1 мг/кг и 500 мг/кг в сутки, которые разделены на три дозы, при этом первая и вторая дозы составляют по 25% от общего вводимого количества и третья доза составляет 50% от общего вводимого количества. В некоторых вариантах осуществления средство(а) для супрессии нонсенс-кодона вводят субъекту перорально.
В другом аспекте настоящее изобретение относится к способам продукции у субъекта (предпочтительно, человека), нуждающегося в этом, эффективного количества функционального белка(ов) с "прочитанным" терминатором, кодируемого последовательностью(ями) нуклеиновой кислоты, содержащей нонсенс-мутацию, при этом способы включают ведение субъекту эффективного количества средства (средств) для супрессии нонсенс-кодона, где средство(а) для супрессии нонсенс-кодона не проявляет значительную антибактериальную активность против грамотрицательного микроорганизма и/или грамположительного микроорганизма. В некоторых вариантах осуществления средство(а) для супрессии нонсенс-кодона вводят перорально. В определенных вариантах осуществления эффективное количество средства (средств) для супрессии нонсенс-кодона составляет между 0,1 мг/кг и 500 мг/кг в сутки. В конкретных вариантах осуществления эффективное количество средства (средств) для супрессии нонсенс-кодона составляет между 0,1 мг/кг и 500 мг/кг в сутки, которые разделены на три дозы, при этом первая и вторая дозы составляют по 25% от общего вводимого количества и третья доза составляет 50% от общего вводимого количества. В некоторых других вариантах осуществления эффективное количество средства (средств) является достаточным для обеспечения концентрации в плазме от 0,1 мкг/мл до 500 мкг/мл средства (средств) в течение 2 часов, 2,5 часов, 3 часов или более.
Продукция функционального белка(ов) с "прочитанным" терминатором, кодируемого последовательностью нуклеиновой кислоты, содержащей нонсенс-мутацию, посредством введения средства (средств) для супрессии нонсенс-кодона субъекту, является пригодным для лечения, управления течением и/или профилактики заболевания, обусловленного нонсенс-мутацией в гене(ах). Неограничивающие примеры заболеваний, которые можно подвергать лечению, управлению течением и/или профилактике посредством продукции функционального белка(ов) с "прочитанным" терминатором, кодируемого геном(ами), содержащем нонсенс-мутацию(и), включают: амилоидоз, LINCL, гемофилию, болезнь Альцгеймера, атеросклероз, гигантизм, карликовость, гипотиреоз, гипертиреоидизм, кистозный фиброз, старение, ожирение, болезнь Паркинсона, болезнь Неймана-Пика, семейную гиперхолестеринемию, пигментный ретинит, мышечную дистрофию (например, мышечную дистрофию Дюшенна), спинальную мышечную атрофию и синдром Марфана.
В определенных вариантах осуществления заболевание, подвергаемое лечению, управлению течением и/или профилактике посредством продукции функционального белка с "прочитанным" терминатором, кодируемого геном(ами), содержащим нонсенс-мутацию(и), представляет собой не желудочно-кишечное нарушение. В других вариантах осуществления заболевание, подвергаемое лечению, управлению течением и/или профилактике посредством продукции функционального белка с "прочитанным" терминатором, кодируемого геном(ами), содержащим нонсенс-мутацию(и), представляет собой не кожное нарушение. В некоторых вариантах осуществления заболевание, подвергаемое лечению, управлению течением и/или профилактике посредством продукции функционального белка с "прочитанным" терминатором, кодируемого геном(ами), содержащим нонсенс-мутацию(и), представляет собой не один или более или все из следующих заболеваний: синдром базально-клеточного невуса (например, ген PTCH), спорадическая базально-клеточная карцинома (например, ген PTCH), меланома (например, ген CDKN2a), пограничный буллезный эпидермолиз (например, гены LAMB3, LAMC2, LAMA3), генерализованный атрофический доброкачественный буллезный эпидермолиз (например, ген COL17A1), дистрофический буллезный эпидермолиз (например, ген COL7A1), болезнь Хейли-Хейли (например, ген ATP2C1), болезнь Дарье (например, ген ATP2A2), чешуйчатый ихтиоз (например, ген TGM1), X-сцепленный ихтиоз (например, ген STS), пигментная ксеродерма (например, гены XPA, XPC, XPG), синдром Блума (например, ген BLM), полосатая ладонно-подошвенная кератодерма (например, гены DSP, DSG1), Синдром Кокейна (например, ген ERCC6), окулокутанный альбинизм (например, гены TYR, TYRP1), синдром Германски-Пудлака (например, гены HPS1, HPS4), атаксия-телеангиэктазия (например, ген ATM), синдром Грисцелли (например, гены RAB27A, MY05A) и эктодермальная дисплазия/слабость кожи (например, ген PKP1). В некоторых вариантах осуществления заболевание, подвергаемое лечению, управлению течением и/или профилактике посредством продукции функционального белка с "прочитанным" терминатором кодируемого геном(ами), содержащим нонсенс-мутацию(и), представляет собой не один или более или все из следующих заболеваний: спорадические злокачественные опухоли пищевода (ген p53) и толстого кишечника (APC, гены p53), пищевод Барретта (ген p53), наследственные синдромы со злокачественными опухолями, такие как аденоматозный полипоз толстого кишечника (ген APC), наследственный неполипозный рак толстого кишечника (гены MLH1, MSH2), синдром Пейтца-Турена (ген STK 11) и синдром Коудена (ген PTEN).
Настоящее изобретение относится к способам лечения, управления течением и/или профилактики заболевания, обусловленного нонсенс-мутацией в гене(ах), при этом способы включают введение субъекту (предпочтительно, человеку), нуждающемуся в этом, эффективного количества средства (средств) для супрессии нонсенс-кодона, где эффективное количество средства (средств) представляет собой количество, достаточное для продукции эффективного количества функционального белка(ов) с "прочитанным" терминатором, кодируемого геном, содержащим нонсенс-мутацию. В определенных вариантах осуществления эффективное количество функционального белка(ов) с "прочитанным" терминатором представляет собой количество белка(ов), необходимое для профилактики начала, развития и/или прогрессирования заболевания или его симптома. В других вариантах осуществления эффективное количество функционального белка(ов) с "прочитанным" терминатором представляет собой количество белка(ов), необходимое для снижения длительности и/или тяжести заболевания или его симптома. В определенных вариантах осуществления эффективное количество функционального белка с "прочитанным" терминатором эквивалентно количеству, продуцируемому в модели на животных для представляющего интерес заболевания. В других вариантах осуществления эффективное количество функционального белка(ов) с "прочитанным" терминатором представляет собой количество, которое продуцируется в модели заболевания на животных, обладающее терапевтической и/или профилактической пользой.
В определенных вариантах осуществления эффективное количество функционального белка с "прочитанным" терминатором эквивалентно количеству, продуцируемому в анализе с репортерным геном, включающем стадии: (a) контактирования средства для супрессии нонсенс-кодона с обладающей последовательностью нуклеиновой кислоты, содержащей репортерный ген, где репортерный ген содержит преждевременный стоп-кодон; и (b) определения продуцируемого количества функционального белка с "прочитанным" терминатором, кодируемого репортерным геном. В других вариантах осуществления эффективное количество функционального белка с "прочитанным" терминатором эквивалентно количеству, продуцируемому в анализе с репортерным геном, включающем стадии: (a) контактирования средства для супрессии нонсенс-кодона с клеточным лизатом и последовательностью нуклеиновой кислоты, содержащей репортерный ген, где репортерный ген содержит преждевременный стоп-кодон, и (b) определения продуцируемого количества функционального белка с "прочитанным" терминатором, кодируемого репортерным геном. Количество функционального белка с "прочитанным" терминатором можно определять измерением уровня экспрессии функционального белка с "прочитанным" терминатором с использованием, например, иммунологического анализа или посредством измерения активности функционального белка с "прочитанным" терминатором.
В определенных вариантах осуществления эффективное количество функционального белка с "прочитанным" терминатором представляет собой количество, продуцируемое клеткой, содержащей ген(ы), ассоциированный с заболеванием (т.е. ген(ы) содержит нонсенс-мутацию(и), ассоциированную с заболеванием). В некоторых вариантах осуществления количество, продуцируемое клеткой, составляет приблизительно 0,1%, приблизительно 1%, приблизительно 2%, приблизительно 5%, приблизительно 7% или приблизительно 10% (в других вариантах осуществления приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 75% или приблизительно 90% и в других вариантах осуществления 0,1-25%, 0,1-50%, 10-50%, 10-90%, 0,1-98%, 5-98% или 10-98%)
от количества, продуцируемого клеткой того же вида и типа, которая содержит нормальный ген(ы) (т.е. ген, который не содержит нонсенс-мутацию), кодирующий соответствующий белок (белки) дикого типа. Количество функционального белка(ов) с "прочитанным" терминатором и количество белка(ов) дикого типа можно определять с использованием любого анализа, известного специалисту в данной области, при условии, что способы, которые используют для измерения обоих белков, являются единообразными. В определенных вариантах осуществления количество функционального белка(ов) с "прочитанным" терминатором и количество белка(ов) дикого типа измеряют посредством иммунологического анализа (например, ELISA). В конкретном варианте осуществления создают клетку, чтобы она содержала ген(ы). В альтернативном варианте осуществления клетка естественным образом содержит ген(ы).
В определенных вариантах осуществления эффективное количество функционального белка(ов) с "прочитанным" терминатором представляет собой количество, продуцируемое клеткой от пациента с заболеванием, ассоциированным с геном(ами), содержащим нонсенс-мутацию(и). В некоторых вариантах осуществления количество, продуцируемое клеткой пациента составляет приблизительно 1%, приблизительно 2%, приблизительно 5%, приблизительно 7% или приблизительно 10% (в других вариантах осуществления приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 75%, приблизительно 90% и в других вариантах осуществления 0,1-25%, 0,1-50%, 0,1-90%, 10-90%, 5-25%, 5-90%, 10-98%, 0,1-98% или 5-98%) от количества, продуцируемого клеткой того же вида и типа от субъекта, который не имеет заболевания, при этом клетка содержит ген(ы), кодирующий соответствующий белок (белки) дикого типа. Количество функционального белка(ов) с "прочитанным" терминатором и количество белка(белков) дикого типа можно измерять с использованием любого анализа, известного специалисту в данной области, при условии, что способы, которые используют для измерения обоих белков, являются единообразными. В определенных вариантах осуществления количество функционального белка(ов) с "прочитанным" терминатором и количество белка(ов) дикого типа измеряют посредством иммунологического анализа (например, ELISA). В конкретном варианте осуществления клетка пациента представляет собой клетку от пациента, которому вводят или будут вводить дозы средства (средств) для супрессии нонсенс-кодона.
Это изобретение относится к способам лечения, управления течением и/или профилактики заболевания, обусловленного нонсенс-мутацией(ими) в гене(ах), при этом способы включают пероральное введение субъекту (предпочтительно человеку), нуждающемуся в этом, эффективного количества средства (средств) для супрессии нонсенс-кодона, где эффективное количество средства (средств) является достаточным для продукции эффективного количества функционального белка(ов) с "прочитанным" терминатором, кодируемого геном(ами), содержащим нонсенс-мутацию(и). В определенных вариантах осуществления эффективное количество средства (средств) составляет между 0,1 мг/кг и 500 мг/кг в сутки. В конкретном варианте осуществления эффективное количество средства (средств) для супрессии нонсенс-кодона составляет между 0,1 мг/кг и 500 мг/кг в сутки, которые разделены на три дозы, при этом первая и вторая дозы составляют по 25% от общего вводимого количества и третья доза составляет 50% от общего вводимого количества. В других вариантах осуществления эффективное количество средства (средств) представляет собой количество средства (средств), которое приводит к концентрации в плазме, составляющей 0,1 мкг/мл, 2 мкг/мл или более (в некоторых вариантах осуществления 5 мкг/мл, 10 мкг/мл, 15 мкг/мл, 20 мкг/мл, 25 мкг/мл, 30 мкг/мл, 35 мкг/мл, 40 мкг/мл, 45 мкг/мл, 50 мкг/мл, 75 мкг/мл, 100 мкг/мл, 125 мкг/мл, 150 мкг/мл, 175 мкг/мл, 200 мкг/мл, 225 мкг/мл, 250 мкг/мл, 275 мкг/мл, 300 мкг/мл, 325 мкг/мл, 375 мкг/мл, 400 мкг/мл, 425 мкг/мл, 450 мкг/мл, 475 мкг/мл или 500 мкг/мл) средства в течение, по меньшей мере, 2 часов, по меньшей мере, 2,5 часов, по меньшей мере, 3 часов или более. В определенных вариантах осуществления средство(а) для супрессии нонсенс-кодона не проявляет значительную антибактериальную активность против грамотрицательного микроорганизма и/или грамположительного микроорганизма. Это изобретение относится к способам лечения, управления течением и/или профилактики заболевания, обусловленного нонсенс-мутацией в гене(ах), при этом способы включают введение субъекту (предпочтительно человеку), нуждающемуся в этом, эффективного количества средства (средств) для супрессии нонсенс-кодона, где эффективное количество средства (средств) является достаточным для обеспечения концентрации в плазме от 0,1 мкг/мл до 500 мкг/мл средства (средств) в течение 2 часов, 2,5 часов, 3 часов или более. В определенных вариантах осуществления эффективное количество средства (средств) составляет между 0,1 мг/кг и 500 мг/кг в сутки. В конкретном варианте осуществления, эффективное количество средства (средств) составляет между 0,1 мг/кг и 500 мг/кг в сутки, которые разделены на три дозы, при этом первая и вторая дозы составляют по 25% от общего вводимого количества и третья доза составляет 50% от общего вводимого количества. В некоторых других вариантах осуществления средство(а) не обладает значительным антибактериальным эффектом против грамположительного микроорганизма и/или грамположительного микроорганизма.
Это изобретение относится к способам лечения, управления течением и/или профилактики заболевания, обусловленного нонсенс-кодоном в гене(ах), при этом способы включают введение субъекту (предпочтительно человеку), нуждающемуся в этом, эффективного количества средства для супрессии нонсенс-кодона, которое не проявляет значительную антибактериальную активность против грамотрицательного микроорганизма и/или грамположительного микроорганизма. В определенных вариантах осуществления эффективное количество средства (средств) составляет между 0,1 мг/кг и 500 мг/кг в сутки. В конкретном варианте осуществления эффективное количество средства (средств) составляет между 0,1 мг/кг и 500 мг/кг в сутки, которые разделены на три дозы при этом первая и вторая дозы составляют по 25% от общего вводимого количества и третья доза составляет 50% от общего вводимого количества.
Продукция функционального белка(ов) с "прочитанным" терминатором, кодируемого последовательностью нуклеиновой кислоты, содержащей нонсенс-мутацию, является пригодным: (i) у субъектов, у которых отсутствует экспрессия достаточного количества соответствующего белка(ов) дикого типа, и/или (ii) у субъектов, для которых экспрессия конкретного функционального белка(ов) с "прочитанным" терминатором является полезной. В одном аспекте это изобретение относится к способам продукции у субъекта (предпочтительно человека), нуждающегося в этом, функционального белка(ов) с "прочитанным" терминатором, кодируемого последовательностью нуклеиновой кислоты, содержащей нонсенс-мутацию(и), при этом способы включают ведение субъекту эффективного количества средства (средств) для супрессии нонсенс-кодона, где субъект был создан, чтобы он содержал последовательность нуклеиновой кислоты. В конкретном варианте осуществления функциональный белок (белки) с "прочитанным" терминатором соответствует белку дикого типа, который оказывает благоприятный эффект у субъекта. В определенных вариантах осуществления субъект, которому вводят средство(а), не продуцирует достаточное количество белка(ов) дикого типа, который соответствует функциональному белку(ам) с "прочитанным" терминатором. В конкретном варианте осуществления субъект, которому вводят средство(а), имеет заболевание, обусловленное недостаточной продукцией белка(ов) дикого типа, который соответствует функциональному белку с "прочитанным" терминатором. В некоторых вариантах осуществления этого изобретения субъекта, которому намереваются вводить средство(а) для супрессии нонсенс-кодона, подвергают скринингу перед введением средства (средств). В конкретном варианте осуществления субъекта подвергают скринингу для определения того, будет ли средство(а) приводить к продукции функционального белка(ов) с "прочитанным" терминатором. В другом варианте осуществления субъекта подвергают скринингу для определения эффективного количества средства (средств) для введения субъекту. В разделе 5.6, ниже, представлены способы скрининга субъектов. Это изобретение охватывает применение средства для супрессии нонсенс-кодона в целях продукции функционального белка с "прочитанным" терминатором с последовательности нуклеиновой кислоты, содержащей мутацию, которая приводит к отличающемуся стоп-кодону в РНК, транскрибируемой с последовательности нуклеиновой кислоты относительно стоп-кодона, находящегося в РНК, кодирующей соответствующий белок дикого типа. В частности, это изобретение относится к способу профилактики, управления течением и/или лечения заболевания, ассоциированного с геном, содержащим мутацию, которая приводит к отличающемуся стоп-кодону в РНК, транскрибируемой с гена, относительно стоп-кодона, находящегося в РНК, кодирующей соответствующий белок дикого типа, при этом способ включает введение субъекту (предпочтительно, человеку) нуждающемуся в этом, эффективного количества средства для супрессии нонсенс-кодона. В определенных вариантах осуществления эффективное количество средства для супрессии нонсенс-кодонов представляет собой количество, достаточное для продукции эффективного количества функционального белка с "прочитанным" терминатором, кодируемого геном. В некоторых вариантах осуществления эффективное количество средства для супрессии нонсенс-кодонов составляет между 0,1 мг/кг и 500 мг/кг в сутки. В некоторых других вариантах осуществления эффективное количество средства для супрессии нонсенс-кодонов представляет собой количество средства, которое приводит к концентрации в плазме между 0,1 мкг/мл и 500 мкг/мл.
В определенных вариантах осуществления средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, представляет собой не аминогликозид. Неограничивающие примеры аминогликозидов включают гентамицин, стрептомицин, амикацин, канамицин, тобрамицин, нетилмицин, неомицин, фрамицетин, негамицен, паромицен, сизомицин, G-418 и их производные и аналоги. В конкретных вариантах осуществления средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, представляет собой не одно, два, три или более из следующих: гентамицин, стрептомицин, амикацин, канамицин, тобрамицин, нетилмицин, неомицин фрамицетин, негамицен, паромицен, сизомицин, G-418 и/или их производные и аналоги. В других вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, представляет собой не хлорамфеникол и его производные или аналоги, которые сохраняют активность обеспечения прохождения считывания через преждевременный терминирующий кодон. В других вариантах осуществления средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, представляет собой не оксазолидинон. Неограничивающими примерами оксазолидинонов являются линезолид, эперзолид и их аналоги или производные. В определенных вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретение, продуцирует более высокое количество (в некоторых вариантах осуществления 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80% или более и в других вариантах осуществления 5-95%, 10%-95%, 25%-95%, или 10%-65% более) функционального белка с "прочитанным" терминатором, чем эквивалентная доза аминогликозида, оксазолидинона и/или хлорамфеникола в клеточном анализе, в анализе модели на животных или другом анализе супрессии нонсенс-кодона, описанном в настоящем документе или известном в данной области.
В определенных вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, представляет собой не соединение формулы I, формулы II, формулы III или формулы IV. В конкретных вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, представляет собой не соединение, представленное в таблице 1, таблице 2, таблице 3 или таблице 4. В других вариантах осуществления средство для супрессии нонсенс-кодона представляет собой не соединение формулы V, формулы VI, формулы VII, формулы VIII или формулы IX. В конкретных вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, представляет собой не соединение, представленное в таблице 5, таблице 6, таблице 7, таблице 8, таблице 9. Таблицы 1-9 приведены в конце описания.
В определенных вариантах осуществления средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, не проявляет значительную антибактериальную активность против грамотрицательного микроорганизма и/или грамположительного микроорганизма. В конкретном варианте осуществления средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, представляет собой соединение, описанное в разделе 5.2. В определенных вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, представляет собой соединение формулы I, формулы II, формулы III или формулы IV. В конкретных вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, представляет собой соединение, представленное в таблице 1, таблице 2, таблице 3 или таблице 4. В других вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, представляет собой соединение формулы V, формулы VI, формулы VII, формулы VIII или формулы XI. В конкретных вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, представляет собой соединение, представленное в таблице 5, таблице 6, таблице 7, таблице 8 или таблице 9.
В определенных вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, взаимодействует с рРНК 28S. В конкретном варианте осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, связывает определенные участки рРНК 28S. В других вариантах осуществления средство для супрессии нонсенс-кодона, применяемое в соответствии с этим изобретением, не взаимодействует с рРНК 18S.
Настоящее изобретение относится к функциональному белку(ам) с "прочитанным" терминатором, кодируемому последовательностью нуклеиновой кислоты, содержащей нонсенс-мутацию, при этом продукцию белка(ов) обеспечивают способами, описанными в настоящем документе. В определенных вариантах осуществления функциональный белок с "прочитанным" терминатором локализуется в клетке в той же области, что и соответствующий белок дикого типа. В некоторых вариантах осуществления функциональный белок с "прочитанным" терминатором представляет собой функциональный белок не дикого типа. В конкретных вариантах осуществления функциональный белок (белки) не дикого типа отличаются от соответствующего белка(ов) дикого типа только в аминокислотном остатке белка(ов) не дикого типа, который был встроен в положение, кодируемое преждевременным терминирующим кодоном. В других вариантах осуществления функциональный белок (белки) не дикого типа отличается от соответствующего белка(ов) дикого типа: (i) в аминокислотном остатке белка(ов) не дикого типа, который вставлен в положение, кодируемое преждевременным терминирующим кодоном; и (ii) в аминокислотном остатке(ах) в белке(ах) не дикого типа, отличном от аминокислотных остатков, кодируемых преждевременным терминирующим кодоном. В других вариантах осуществления белок не дикого типа является полноразмерным (т.е. обладает той же длиной, что и соответствующий белок дикого типа). Аминокислотную последовательность функционального белка(ов) с "прочитанным" терминатором, продуцируемого способами по этому изобретению, можно определять секвенированием белка(ов), продуцируемого клеткой, содержащей представляющую интерес последовательность нуклеиновой кислоты (т.е. последовательность нуклеиновой кислоты, содержащую представляющую интерес нонсенс-мутацию(и)). В определенных вариантах осуществления клетка естественным образом содержит последовательность нуклеиновой кислоты. В конкретном варианте осуществления клетка представляет собой клетку от пациента, которому вводят или будут вводить средство(а) для супрессии нонсенс-кодона. В других вариантах осуществления клетка создана, чтобы она содержала последовательность нуклеиновой кислоты. Таким образом, в настоящем документе описаны: иллюстративные структурно отличающиеся средства для супрессии нонсенс-кодонов; ссылки, указывающие на способы получения средств; способы анализа средств в отношении активности супрессии нонсенс-кодонов; способы введения и дозированные составы для введения средств для супрессии нонсенс-кодонов, включая предпочтительные схемы дозирования и фармакокинетические профили; заболевания, обусловленные нонсенс-мутациями, включая описание, касающееся связи между нонсенс-мутациями и заболеваниями, приведенными в настоящем документе; группы пациентов, подходящие для описанных способов лечения, управления течением и профилактики, включая способы скрининга пациента; и терапевтические результаты, пригодные для определения эффективности средств для супрессии нонсенс-кодонов.
5.1 ОПРЕДЕЛЕНИЯ
Как используют в настоящем документе, термин "преждевременная терминация трансляции" относится к результату мутации, которая приводит к замене кодона, соответствующего аминокислоте, стоп-кодоном. Как используют в настоящем документе, термин "опосредуемое нонсенс-мутацией разрушение мРНК" относится к любому механизму, который опосредует разрушение мРНК, содержащих преждевременный кодон терминации трансляции.
Как используют в настоящем документе, термины "преждевременный терминирующий кодон", "преждевременный стоп-кодон" и "нонсенс-кодон" относятся к нахождению стоп-кодона там, где должен быть кодон, соответствующий аминокислоте.
Как используют в настоящем документе, термин "нонсенс-мутация" относится к мутации, которая приводит к замене кодона, который кодирует аминокислоту, стоп-кодоном.
Как используют в настоящем документе, термины "супрессия нонсенс-кодона" и "осуществление супрессии нонсенс-кодона" относятся к ингибированию или супрессии преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК. В одном варианте осуществления ингибирование или супрессия преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК происходят in vivo. В другом варианте осуществления ингибирование или супрессия преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК происходят in vitro.
Как используют в настоящем документе, выражение "модулирование преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК" относится к регуляции экспрессии гена посредством изменения уровня супрессии нонсенс-кодона. Например, если является желательным повышение продукции функционального белка с "прочитанным" терминатором, кодируемого геном с преждевременным стоп-кодоном, т.е. обеспечение прохождения считывания через преждевременный стоп-кодон связанного с заболеванием гена, чтобы могла происходить трансляция РНК, тогда модулирование преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК вовлекает активацию супрессии нонсенс-кодона. Напротив, если является желательным обеспечение деградации мРНК с преждевременным стоп-кодоном, тогда модулирование преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК вовлекает ингибирование супрессии нонсенс-кодона.
Как используют в настоящем документе, термины "субъект" и "пациент" применяются в настоящем документе взаимозаменяемо для указания на животное (например, корову, лошадь, овцу, свинью, курицу, идейку, перепела, кошку, собаку, мышь, крысу, кролика, морскую свинку и т.д.), предпочтительно млекопитающее, такое как не примат и примат (например, обезьяна и человек), наиболее предпочтительно человек. В определенных вариантах осуществления пациентом является эмбрион, плод, новорожденный, детеныш, молодая особь или взрослая особь. В одном варианте осуществления посредством предварительного скрининга определено, что пациент обладает нонсенс-мутацией. В другом варианте осуществления посредством предварительного скрининга определено, какой нонсенс-мутацией обладает пациент (т.е. UAA, UGA или UAG). В другом варианте осуществления пациент инфицирован бактериальными клетками (например, Pseudomonas aeruginosa). В другом варианте осуществления клетки пациента инфицированы вирусом.
Как используют в настоящем документе, выражение "не проявляет значительную антибактериальную активность против грамотрицательного микроорганизма и/или грамположительного микроорганизма" относится к средству(ам) для супрессии нонсенс-кодонов, которое обладает минимальной ингибиторной концентрацией (MIC) 250 мкг/мл или более (в определенных вариантах осуществления 300 мкг/мл, 350 мкг/мл, 400 мкг/мл, 450 мкг/мл или 500 мкг/мл и в других вариантах осуществления от приблизительно 250 мкг/мл до приблизительно 1000 мкг/мл или от 250 мкг/мл до приблизительно 500 мкг/мл), при добавлении в культуральную среду для грамотрицательного микроорганизма и/или в культуральную среду для грамположительного микроорганизма. В конкретном варианте осуществления выражение относится к средству(ам) для супрессии нонсенс-кодонов, которое имеет MIC 250 мкг/мл или более (в определенных вариантах осуществления 300 мкг/мл, 350 мкг/мл, 400 мкг/мл, 450 мкг/мл или 500 мкг/мл и в других вариантах осуществления приблизительно от 250 мкг/мл до приблизительно 1000 мкг/мл или от 250 мкг/мл до приблизительно 500 мкг/мл) при добавлении в культуральную среду для E. coli BAS 849 (проницаемую), культуральную среду для P. aeruginosa 27853, культуральную среду для S. aureus 29213, культуральную среду для S. epidermidis 12228 (CNSA), культуральную среду для Enterococcus faecium 49624, и/или культуральную среду для Enterococcus faecalis 29212. Как используют в настоящем документе, если нет иных указаний, термин "молоко" включает стандартизованное, цельное, обладающее сниженным содержанием жиров (2%), обладающее низким содержанием жиров (1%), снятое, обезжиренное и не содержащее лактозу молоко. Также термин "молоко" включает молоко человека или домашнего животного (например, коровы, буйвола, козы, овцы или верблюда), а также соевое молоко и любой продукт на основе молока или содержащий молоко продукт.
Как используют в настоящем документе, если нет иных указаний, термин "замещенный" означает группу, замещенную от одного до четырех или более заместителями, такими как гало, трифторметил, трифторметокси, гидрокси, алкокси, циклоалкилокси, гетероциклоокси, оксо, алканоил, алкилкарбонил, циклоалкил, арил, арилокси, аралкил, алканоилокси, циано, азидо, амино, алкиламино, ариламино, аралкиламино, циклоалкиламино, гетероциклоамино, моно и дизамещенный амино, в котором два заместителя на аминогруппе выбраны из алкила, арила, аралкила, алканоиламино, ароиламино, аралканоиламино, замещенного алканоиламино, замещенного ариламино, замещенного аралканоиламино, тиола, алкилтио, арилтио, аралкилтио, циклоалкилтио, гетероциклотио, алкилтионо, арилтионо, аралкилтионо, алкилсульфонила, арилсульфонила, аралкилсульфонила, сульфонамидо (например, SO2NH2), замещенного сульфонамидо, нитро, карбокси, карбамила (например, CONH2), замещенного карбамила (например, CONH-алкил, CONH-арил, CONH-аралкил или случаи, где существуют два заместителя на азоте, выбранные из алкила, арила или аралкила), алкоксикарбонила, арила, замещенного арила, гуанидино и гетероцикло, такого как индолил, имидазолил, фурил, тиенил, тиазолил, пирролидил, пиридил, пиримидил и т.п. В случае когда, как указано выше, заместители далее сами замещены, такие дополнительные заместители выбраны из группы, состоящей из галогена, алкила, алкокси, арила и аралкила. В конкретном варианте осуществления термин замещенный не означает циано.
Как используют в настоящем документе, если нет иных указаний, термин "алкил" означает насыщенный неразветвленный или разветвленный нециклический углеводород, имеющий от 1 до 20 атомов углерода, предпочтительно 1-10 атомов углерода и наиболее предпочтительно 1-4 атомов углерода. Репрезентативные насыщенные неразветвленные алкилы включают -метил, -этил, -н-пропил, -н-бутил, -н-пентил, -н-гексил, -н-гептил, -н-октил, -н-нонил и -н-децил; в то время как насыщенные разветвленные алкилы включают -изопропил, -втор-бутил, -изобутил, -трет-бутил, -изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил, 2,3-диметилпентил, 2,4-диметилпентил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилпентил, 2,2-диметилгексил, 3,3-диметилпентил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилпентил, 3-этилпентил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, 2-метил-4-этилпентил, 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2-метил-4-этилгексил, 2,2-диэтилпентил, 3,3-диэтилгексил, 2,2-диэтилгексил, 3,3-диэтилгексил и т.п. Алкильная группа может быть незамещенной или замещенной. Ненасыщенные алкильные группы включают алкенильные группы и алкинильные группы, которые рассмотрены ниже.
Как используют в настоящем документе, если нет иных указаний, термин "алкенильная группа" означает неразветвленный или разветвленный нециклический углеводород, имеющий от 2 до 20 атомов углерода, более предпочтительно 2-10 атомов углерода, наиболее предпочтительно 2-6 атомов углерода, и включающий, по меньшей мере, одну двойную углерод-углеродную связь. Репрезентативные неразветвленные и разветвленные (C2-C10)алкенилы включают -винил, -аллил, -1-бутенил, -2-бутенил, -изобутиленил, -1-пентенил, -2-пентенил, -3-метил-1-бутенил, -2-метил-2-бутенил, -2,3-диметил-2-бутенил, -1-гексенил, -2-гексенил, -3-гексенил, -1-гептенил, -2-гептенил, -3-гептенил, -1-октенил, -2-октенил, -3-октенил, -1-ноненил, -2-ноненил, -3-ноненил, -1-деценил, -2-деценил, -3-деценил и т.п. Двойная связь алкенильной группы может быть неконъюгированной или конъюгированной с другой ненасыщенной группой. Алкенильная группа может быть незамещенной или замещенной.
Как используют в настоящем документе, если нет иных указаний, термин "алкинильная группа" означает неразветвленный или разветвленный нециклический углеводород, имеющий от 2 до 20 атомов углерода, более предпочтительно 2-10 атомов углерода, наиболее предпочтительно 2-6 атомов углерода, и включающий, по меньшей мере, одну тройную углерод-углеродную связь. Репрезентативные неразветвленные и разветвленные -(C2-C10)алкинилы включают -ацетиленил, -пропинил, -1-бутинил, -2-бутинил, -1-пентинил, -2-пентинил, -3-метил- 1-бутинил, -4-пентинил, -1-гексинил, -2-гексинил, -5-гексинил, -1-гептинил, -2-гептинил, -6-гептинил, -1-октинил, -2-октинил, -7-октинил, -1-нонинил, -2-нонинил, -8-нонинил, -1-децинил, -2-децинил, -9-децинил, и т.п. Тройная связь алкинильной группы может быть неконъюгированной или конъюгированной с другой ненасыщенной группой. Алкинильная группа может быть незамещенной или замещенной.
Как используют в настоящем документе, если нет иных указаний термин "галоген" или "гало" означает фтор, хлор, бром или йод.
Как используют в настоящем документе, если нет иных указаний, термин "галоалкил" означает алкильную группу, как описано в настоящем документе, замещенную одним или более атомами галогена.
Как используют в настоящем документе, если нет иных указаний, термин "галоалкокси" означает алкоксигруппу, как описано в настоящем документе, замещенную одним или более атомами галогена.
Как используют в настоящем документе, если нет иных указаний термин "алкилсульфонил" означает -алкил-SО3H или -SO3-алкил, где алкил определен, как указано выше, включая -SO2-CH3, -SO2-CH2CH3, -SO2-(CH2)2CH3, -SO2-(CH2)3CH3, -SO2-(CH2)4CH3, -SO2-(CH2)5CH3 и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "карбоксил" и "карбокси" означает -COOH.
Как используют в настоящем документе, если нет иных указаний, термин "алкокси" означает -O-(алкил), где алкил определен выше, включая -OCH3, -OCH2CH3, -O(CH2)2CH3, -O(CH2)3CH3, -O(CH2)4CH3, -O(CH2)5CH3 и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "алкоксикарбонил" означает -C(=O)O-(алкил), где алкил определен выше, включая -C(=O)O-CH3, -C(O)O-CH2CH3, -C(=O)O-(CH2)2CH3, -C(=O)O-(CH2)3CH3, -C(=O)O-(CH2)4CH3, -C(=O)O-(CH2)SCH3, и т.п. В предпочтительном варианте осуществления сложные эфиры являются биогидролизуемыми (т.е. сложный эфир гидролизуется до карбоновой кислоты in vitro или in vivo).
Как используют в настоящем документе, если нет иных указаний, термин "алкоксиалкил" означает -(алкилен)-O-(алкил), где каждый "алкил" независимо представляет собой алкильную группу, как определено выше, включая -CH2OCH3, -CH2OCH2CH3, -(CH2)2OCH2CH3, -(CH2)2O(CH2)2CH3 и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "арил" означает карбоциклическое ароматическое кольцо, содержащее от 5 до 14 атомов в кольце. Все атомы кольца карбоциклической арильной группы представляют собой атомы углерода. Структуры арильного кольца включают соединения, имеющие одну или более кольцевых структур, таких как моно-, би- или трициклические соединения, а также бензо-конденсированные карбоциклические группы, такие как 5,6,7,8-тетрагидронафтил и т.п. Предпочтительно арильная группа представляет собой моноциклическое кольцо или бициклическое кольцо. Репрезентативные арильные группы включают фенил, толил, антраценил, флуоренил, инденил, азуленил, фенантренил и нафтил. Карбоциклическая арильная группа может быть незамещенной или замещенной.
Как используют в настоящем документе, если нет иных указаний, термин "гетероарил" означает карбоциклическое ароматическое кольцо, содержащее от 5 до 14 атомов в кольце, и атомы кольца содержат, по меньшей мере, один гетероатом, предпочтительно от 1 до 3 гетероатомов, независимо выбранных из азота, кислорода или серы. Гетероарильные кольцевые структуры включают соединения, имеющие одну или более кольцевых структур, таких как моно-, би- или трициклические соединения, а также конденсированные гетероциклические группы. Репрезентативные гетероарилы представляют собой триазолил, тетразолил, оксадиазолил, пиридил, фурил, бензофуранил, тиофенил, бензотиофенил, бензоизоксазолил, бензоизотиазолил, хинолинил, пирролил, индолил, оксазолил, бензоксазолил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изоксазолил, пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, циннолинил, фталазинил, хиназолинил, бензохиназолинил, акридинил, пиримидил и оксазолил. Группа может быть незамещенной или замещенной.
Как используют в настоящем документе, если нет иных указаний термин "арилокси" означает -O-арильную группу, где арил является таким, как определено выше. Арилоксигруппа может быть незамещенной или замещенной.
Как используют в настоящем документе, если нет иных указаний, термин "арилалкил" означает -(алкил)-(арил), где алкил и арил определены выше, включая, но не ограничиваясь ими, -(CH2)фенил, -(CH2)2фенил, -(CH2)3фенил, -CH(фенил)2, -CH(фенил)3, -(CH2)толил, -(CH2)антраценил, -(CH2)флуоренил, -(CH2)инденил, -(CH2)азуленил, -(CH2)нафтил и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "гетероарилалкил" означает -(алкил)-(гетероарил), где алкил и гетероарил определены выше, включая, но не ограничиваясь ими - (CH2)пиридил, -(CH2)2пиридил, -(CH2)3пиридил, -CH(пиридил)2, -C(пиридил)3, -(CH2)триазолил, - (CH2)тетразолил, -(CH2)оксадиазолил, -(CH2)фурил, -(CH2)бензофуранил, -(CH2)тиофенил, -(CH2)бензотиофенил и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "арилалкилокси" означает -O-(алкил)-(арил), где алкил и арил определены выше, включая, но не ограничиваясь ими -O-(CH2)2фенил, -O-(CH2)3фенил, -O-CH(фенил)2, -O-CH(фенил)3, -O-(CH2)толил, -O-(CH2)антраценил, -O-(CH2)флуоренил, -O-(CH2)инденил, -O-(CH2)азуленил, -O-(CH2)нафтил и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "циклоалкил" означает моноциклическое или полициклическое насыщенное кольцо, содержащее атомы углерода и водорода и не имеющее кратных углерод-углеродных связей. Циклоалкильная группа может быть незамещенной или замещенной. Примеры циклоалкильных групп включают, но не ограничиваются ими, (C3-C7)циклоалкильные группы, включая циклопропил, циклобутил, циклопентил, циклогексил и циклогептил и насыщенные циклические и бициклические терпены. Циклоалкильная группа может быть незамещенной или замещенной. Предпочтительно циклоалкильная группа представляет собой моноциклическое кольцо или бициклическое кольцо.
Как используют в настоящем документе, если нет иных указаний, термин "гетероциклил" означает моноциклическое или полициклическое кольцо, содержащее атомы углерода и водорода, необязательно имеющее от 1 до 4 кратных связей, и атомы кольца содержат, по меньшей мере, один гетероатом, предпочтительно от 1 до 3 гетероатомов, независимо выбранных из азота, кислорода и серы. Гетероциклильные кольцевые структуры включают соединения, имеющие одну или более кольцевых структур, таких как моно, би- или трициклические соединения. Предпочтительно гетероциклильная группа представляет собой моноциклическое кольцо или бициклическое кольцо. Репрезентативные гетероциклы включают, но не ограничиваются ими, морфолинил, пирролидинонил, пирролидинил, пиперидинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и т.п. Гетероциклильное кольцо может быть незамещенным или замещенным.
Как используют в настоящем документе, если нет иных указаний, термин "циклоалкилокси" означает -O-(циклоалкил), где циклоалкил определен выше.
Как используют в настоящем документе, если нет иных указаний, термин "циклоалкилалкилокси" означает -O-(алкил)-(циклоалкил), где циклоалкил и алкил определены выше, включая, но не ограничиваясь ими, -O-циклопропил, -O-циклобутил, -O-циклопентил, -O-циклогексил, -O-циклогептил и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "аминоалкокси" означает -O-(алкил)-NH2, где алкил определен выше, включая, но не ограничиваясь ими -O-CH2-NH2, -O-(CH2)2-NH2, -O-(CH2)3-NH2, -O-(CH2)4-NH2, -O-(CH2)5-NH2 и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "алкиламино" означает -NH(алкил) или -N(алкил)(алкил), где алкил определен выше, включая, но не ограничиваясь ими, NHCH3, -NHCH2CH3, -NH(CH2)2CH3, -NH(CH2)3CH3, -NH(CH2)4CH3, - NH(CH2)5CH3, -N(CH3)2, -N(CH2CH3)2, -N((CH2)2CH3)2, -N(CH3)(CH2CH3) и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "ариламино" означает -NH(арил), где арил определен выше, включая, но не ограничиваясь ими, -NH(фенил), -NH(толил), -NH(антраценил), -NH(флуоренил), -NH(инденил), -NH(азуленил), -NH(пиридинил), -NH(нафтил) и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "арилалкиламино" означает -NH-(алкил)-(арил), где алкил и арил определены выше, включая -NH-CH2-(фенил), -NH-CH2-(толил), -NH-CH2-(антраценил), -NH-CH2-(флуоренил), -NH-CH2-(инденил), -NH-CH2-(азуленил), -NH-CH2-(пиридинил), -NH-CH2-(нафтил), -NH-(CH2)2-(фенил) и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "циклоалкиламино" означает -NH-(циклоалкил), где циклоалкил определен выше, включая -NH-циклопропил, -NH-циклобутил, -NH-циклопентил, -NH-циклогексил, -NH-циклогептил и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "аминоалкил" означает -(алкил)-NH2, где алкил определен выше, включая -CH2-NH2, -(CH2)2-NH2, -(CH2)3-NH2, -(CH2)4-NH2, -(CH2)5-NH2 и т.п.
Как используют в настоящем документе, если нет иных указаний, термин "алкиламиноалкил" означает -(алкил)-NH(алкил) или -(алкил)-N(алкил)(алкил), где каждый "алкил" независимо представляет собой алкильную группу, определенную выше, включая -CH2-NH-CH3, -CH2-NHCH2CH3, -CH2-NH(CH2)2CH3, -CH2-NH(CH2)3CH3, -CH2-NH(CH2)4CH3, -CH2-NH(CH2)5CH3, -(CH2)2-NH-CH3, -CH2-N(CH3)2, -CH2-N(CH2CH3)2, -CH2-N((CH2)2CH3)2, -CH2-N(CH3)(CH2CH3), -(CH2)2-N(CH3)2, и т.п.
Как используют в настоящем документе, термины "соединение, имеющее активность в отношении супрессии нонсенс-кодона", "средство для супрессии нонсенс-кодона" и "вещество, осуществляющее супрессию нонсенс-кодона", относятся к любому соединению или его фармацевтически приемлемой соли, пролекарству, сольвату, гидрату, полиморфу или энантиомеру, которые могут вызвать прохождение считывания через нонсенс-кодон in vitro или in vivo.
Как используют в настоящем документе, "терапевтический протокол" относится к схеме времени введения и дозирования одного или нескольких лекарственных средств.
Как используют в настоящем документе, "профилактический протокол" относится к схеме времени введения и дозирования одного или нескольких лекарственных средств.
Как используют в настоящем документе, "протокол" включает расписания дозирования и схемы дозирования.
Как используют в настоящем документе, "в сочетании" относится к применению более одного лекарственного средства. Применение термина "в сочетании" не ограничивает порядок, в котором лекарственные средства вводят субъекту с заболеванием. Первое лекарственное средство можно вводить до (например, на 1 минуту, 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель ранее), одновременно, или после (например, через 1 минуту, 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель) введения второго лекарственного средства субъекту, который имел, имеет заболевание или является к нему предрасположенным. Лекарственные средства вводят субъекту последовательно и в пределах промежутка времени, чтобы средство по этому изобретению могло действовать совместно с другой терапией для обеспечения большей пользы, чем в случае их введения иным образом. Неограничивающие примеры лекарственных средств, которые можно вводить в сочетании с другим веществом для супрессии кодонов, включают анальгетики, анестетики, противосудорожные средства, поддерживающие средства и любые лекарственные средства, приведенные в U.S. Pharmacopoeia и/или Physician's Desk Reference.
Как используют в настоящем документе, термины "управлять течением", "осуществление управления течением" и "управление течением" в контексте введения лекарственного средства субъекту относятся к благоприятным эффектам, которые субъект получает от лечения, не приводящим к излечению заболевания. В определенных вариантах осуществления субъекту вводят одно или более лекарственных средств для "управления течением" заболевания, чтобы предотвратить прогрессирование или ухудшение заболевания или его симптома.
Как используют в настоящем документе, термин "терапия" относится к любому протоколу, способу и/или средству, которые можно использовать для профилактики, управления течением и/или лечения нарушения или его симптома. В определенных вариантах осуществления термин "терапия" относится к биологической терапии, хирургической операции и/или поддерживающей терапии, пригодной для профилактики, управления течением и/или лечения нарушения или его симптома. В конкретном варианте осуществления средство для супрессии нонсенс-кодона является терапией.
Как используют в настоящем документе, термины "проводить профилактику", "проведение профилактики" и "профилактика" в контексте введения лекарственного средства субъекту относятся к предотвращению начала, развития, рецидива, распространения и/или ухудшения заболевания или его симптома у субъекта посредством введения лекарственного средства.
Как используют в настоящем документе, термины "лечить", "проведение лечения" и "лечение" в контексте введения лекарственного средства субъекту относятся к устранению или ослаблению заболевания или симптома, обусловленного заболеванием. В определенных вариантах осуществления такие термины относятся к минимизации распространения или ухудшения заболевания вследствие введения одного или нескольких лекарственных средств субъекту с таким заболеванием. В других вариантах осуществления такие термины относятся к снижению тяжести и/или длительности заболевания или симптома(ов), обусловленных заболеванием.
Как используют в настоящем документе, термин "полноразмерный" в контексте функционального белка с "прочитанным" терминатором относится к функциональному белку с "прочитанным" терминатором, который состоит из того же числа аминокислотных остатков, что и соответствующий белок дикого типа.
Как используют в настоящем документе, термин "белок не дикого типа" относится к белку, обладающему аминокислотной последовательностью, которая отличается от соответствующего белка дикого типа. В определенных вариантах осуществления белок не дикого типа отличается от соответствующего белка дикого типа только в аминокислотном остатке(ах) в белке не дикого типа, который вставлен в положение(я), кодируемое преждевременным терминирующим кодоном. В других вариантах осуществления белок не дикого типа отличается от соответствующего белка дикого типа: (i) в аминокислотном остатке(ах) в белке(ах) не дикого типа, который вставлен в положение, кодируемое преждевременным терминирующим кодоном; и (ii) в аминокислотном положении(ях) в белке не дикого типа, отличном от аминокислотных положений, кодируемых преждевременным терминирующим кодоном. Как используют в настоящем документе, термин "дикого типа" в контексте белка относится к белку, который встречается в природе (часто (но не обязательно) он является преобладающим белком) и его обозначают как стандартный или эталонный белок.
Как используют в настоящем документе, выражение "функциональный белок с "прочитанным" терминатором" относится к функциональному белку, продуцируемому в результате прохождения считывания через нонсенс-кодон в РНК (например, мРНК), транскрибируемой с гена. В конкретном варианте осуществления выражение "функциональный белок с "прочитанным" терминатором" относится к функциональному белку, продуцируемому в результате прохождения считывания через нонсенс-кодон в РНК, транскрибируемой с гена, содержащего нонсенс-мутацию. В определенных вариантах осуществления функциональный белок с "прочитанным" терминатором состоит из той же аминокислотной последовательности, что и соответствующий белок дикого типа, кодируемый геном без нонсенс-мутации. В других вариантах осуществления функциональный белок с "прочитанным" терминатором представляет собой функциональный белок не дикого типа.
Как используют в настоящем документе, термин "кожное нарушение" относится к нарушению кожи, в частности нарушению компонентов кожи, представляющих собой эпидерму или дерму, более конкретно эпидермис. "Эпидермис" включает: роговой слой, блестящий слой, зернистый слой, шиповатый слой и зародышевый слой (базальный слой, базально-клеточный слой). В конкретном варианте осуществления нарушение, подвергаемое лечению, профилактике и/или управлению течением в соответствии с этим изобретением, представляет собой не кожное нарушение.
Как используют в настоящем документе, термин "желудочно-кишечное нарушение" относится к нарушению желудочно-кишечного (GI) тракта, включая ротовую полость, глотку, пищевод, желудок и двенадцатиперстную кишку (например, тонкий кишечник, толстый кишечник (например, ободочную кишку)). В конкретном варианте осуществления нарушение, подвергаемое лечению, профилактике и/или управлению течением в соответствии с этим изобретением, представляет собой не желудочно-кишечное нарушение.
Как используют в настоящем документе, термины "заболевание" и "нарушение" используют взаимозаменяемо. Как используют в настоящем документе, выражения "заболевание, обусловленное нонсенс-мутацией в гене(ах)" и "нарушение, обусловленное нонсенс-мутацией в гене(ах)" используют взаимозаменяемо для обозначения заболевания, которое возникает вследствие, прямо или непрямо, нонсенс-мутации(й) в гене(ах), где нонсенс-мутация(и) предотвращают продукцию белка дикого типа в поврежденной клетке. Заболевания, обусловленные нонсенс-мутацией, охватывают заболевания, в которых один ген содержит одну, две, три или более нонсенс-мутаций, а также заболевания, в которых два, три или более (множество) генов содержат одну, две, три или более нонсенс-мутаций.
Как используют в настоящем документе, термин "функциональный" в контексте функционального белка с "прочитанным" терминатором относится к белку, который обладает достаточным количеством функций соответствующего белка дикого типа для оказания благоприятного эффекта на клетку или субъекта, которые не продуцируют или продуцируют недостаточные количества белка дикого типа в результате мутации (например, нонсенс-мутации) в последовательности нуклеиновой кислоты (например, гена), кодирующей белок.
Как используют в настоящем документе, термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных кислот или оснований, включая неорганические кислоты и основания и органические кислоты и основания. Пригодные фармацевтически приемлемые основно-аддитивные соли соединения по настоящему изобретению включают, но не ограничиваются ими, соли металлов, полученные из алюминия, кальция, лития, магния, калия, натрия и цинка, или органические соли, полученные из лизина, N,N'-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумина (N-метилглюкамина) и прокаина. Пригодные нетоксичные кислоты включают, но не ограничиваются ими, неорганические и органические кислоты, такие как уксусная, альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуранкарбоновая, галактуроновая, глюконовая, глюкуроновая, глутаминовая, гликолевая, бромистоводородная, хлористоводородная, изетионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, муциновая, азотная, памовая, пантотеновая, фенилуксусная, фосфорная, пропионовая, салициловая, стеариновая, янтарная, сульфаниловая, серная, виннокаменная кислота и п-толуолсульфоновая кислота.
Конкретные нетоксичные кислоты включают хлористоводороную, бромистоводородную, фосфорную, серную и метансульфоновую кислоты. Примеры определенных солей, таким образом, включают гидрохлориды и мезилаты. Другие примеры солей хорошо известны в данной области, см., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990).
Как используют в настоящем документе и если нет иных указаний, термин "пролекарство" означает производное соединения, которое может подвергаться гидролизу, окисляться или иным образом реагировать в биологических условиях (in vitro или in vivo) c образованием активного соединения, в частности соединения по этому изобретению. Примеры пролекарств включают, но не ограничиваются ими, производные и метаболиты соединения по этому изобретению, которые включают биогидролизуемые группы, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые аналоги фосфатов. Предпочтительно пролекарства соединений с карбоксильными функциональными группами представляют собой низшие алкильные сложные эфиры карбоновой кислоты. Карбоксилатные сложные эфиры удобно получать этерификацией любых групп карбоновых кислот, имеющихся в молекуле. Пролекарства, как правило, можно получать с использованием хорошо известных способов, таких как способы, описанные в Burger's Medicinal Chemistry and Drug Discovery 6th ed. (Donald J. Abraham ed., 2001, Wiley) и Design and Application of Prodrugs (H. Bundgaard ed., 1985, Harwood Academic Publishers Gmfh).
Как используют в настоящем документе и если нет иных указаний, термины "биогидролизуемый амид", "биогидролизуемый сложный эфир", "биогидролизуемый карбамат", "биогидролизуемый карбонат", "биогидролизуемый уреид", "биогидролизуемый фосфат" означают амид, сложный эфир, карбамат, карбонат, уреид или фосфат, соответственно, соединения, которое либо: 1) не препятствует биологической активности соединения, но может придавать этому соединению преимущественные свойства in vivo, такие как захват, длительность действия или начало действия; или 2) являются биологически неактивными, но превращаются in vivo в биологически активное соединение. Примеры биогидролизуемых сложных эфиров включают, но не ограничиваются ими, низшие алкильные сложные эфиры, сложные эфиры алкоксиацилокси, алкилациламиноалкильные сложные эфиры и сложные эфиры холина. Примеры биогидролизуемых амидов включают, но не ограничиваются ими, амиды низших алкилов, амиды α-аминокислот, алкоксиацильные амиды и алкиламиноалкилкарбонильные амиды. Примеры биогидролизуемых карбаматов включают, но не ограничиваются ими, низшие алкиламины, замещенные этилендиамины, аминокислоты, гидроксиалкиламины, гетероциклические и гетероароматические амины и амины полиэфиров.
Как используют в настоящем документе и если нет иных указаний, термин "оптически чистый" или "стереомерно чистый" означает, что стереоизомер соединения по существу не содержит другие стереоизомеры этого соединения. Например, стереомерно чистое соединение, имеющее один хиральный центр, по существу не будет содержать противоположный энантиомер соединения. Стереомерно чистое соединение, имеющее два хиральных центра, по существу не будет содержать другие диастереомеры соединения. Типичное стереомерно чистое соединение содержит более 80% по массе одного стереоизомера соединения и менее приблизительно 20% по массе других стереоизомеров соединения, более предпочтительно более приблизительно 90% по массе одного стереоизомера соединения и менее приблизительно 10% по массе других стереоизомеров соединения, еще более предпочтительно более приблизительно 95% по массе одного стереоизомера соединения и менее приблизительно 5% по массе других стереоизомеров соединения и наиболее предпочтительно более приблизительно 97% по массе одного стереоизомера соединения и менее приблизительно 3% по массе других стереоизомеров соединения.
Как используют в настоящем документе и если нет иных указаний, термин "энантиомерно чистый" означает стереомерно чистую композицию соединения, имеющую один хиральный центр.
Как используют в настоящем документе, термин "единичная дозированная форма(ы)" включает таблетки; жевательные таблетки; таблетки в форме капсул; капсулы, такие как мягкие эластичные желатиновые капсулы; саше; крахмальные капсулы; лепешки; пастилки; дисперсии; порошки; растворы; гели; жидкие дозированные формы, пригодные для перорального введения или введения на слизистую пациента, включая суспензии (например, водные или неводные жидкие суспензии), эмульсии (например, эмульсии типа "масло-в-воде", или жидкие эмульсии типа "вода-в-масле"), растворы и эликсиры; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), которые можно разбавлять для получения жидкой дозированной формы, пригодной для перорального или парентерального введения пациенту. Единичную дозированную форму не обязательно вводить в качестве однократной дозы.
Как используют в настоящем документе, термин "библиотека" в контексте соединений относится к множеству соединений. Библиотека может представлять собой комбинаторную библиотеку, например коллекцию соединений, синтезированных с использованием способов комбинаторной химии, или коллекцию уникальных химических веществ с низкой молекулярной массой (менее 1000 дальтон), каждое из которых занимает уникальное трехмерное пространство.
Как используют в настоящем документе, "репортерный ген" относится к гену, посредством которого определяют модулирование преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК.
В конкретном варианте осуществления экспрессию репортерного гена легко анализировать и он обладает активностью, которая в норме присутствует в организме, из которого получены или образованы клетки или экстракт для трансляции.
Как используют в настоящем документе, "опосредуемое нонсенс-кодоном разрушение мРНК" относится к какому-либо механизму, который опосредует разрушение мРНК, содержащих преждевременный кодон терминации трансляции.
Как используют в настоящем документе, термин "ранее определенный эталонный диапазон" относится к эталонному диапазону для получения данных в конкретном анализе. В конкретном варианте осуществления термин относится к эталонному диапазону для экспрессии репортерного гена и/или активности продукта репортерного гена конкретной клеткой или в конкретном бесклеточном экстракте. В некоторых вариантах осуществления каждая лаборатория устанавливает ее собственный эталонный диапазон для каждого конкретного анализа, каждого типа клеток и каждого бесклеточного экстракта. В предпочтительном варианте осуществления в каждую анализируемую партию соединений включены, по меньшей мере, один положительный контроль и, по меньшей мере, один отрицательный контроль.
Следует отметить, что если существуют отличия между изображенной структурой и названием, данным этой структуре, изображенной структуре следует придавать большее значение. Кроме того, если стереохимия структуры или часть структуры не указаны, например, жирным шрифтом или пунктирными линями, структуру или часть структуры следует интерпретировать как охватывающие все их стереоизомеры.
5.2 ИЛЛЮСТРАТИВНЫЕ СОЕДИНЕНИЯ С АКТИВНОСТЬЮ В ОТНОШЕНИИ СУПРЕССИИ НОНСЕНС-МУТАЦИИ
В одном варианте осуществления средство для супрессии нонсенс-кодона представляет собой соединение формулы I:
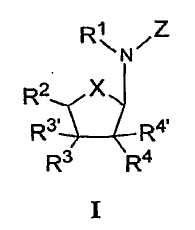
или его фармацевтически приемлемую соль, гидрат, сольват, клатрат, рацемат или стереоизомер, где:
Z представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероцикло, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарилалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арилкарбонил;
X представляет собой CH2, O, S или NH;
R1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероцикло, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарилалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный гетероциклоалкил;
R2 представляет собой замещенный или незамещенный алкил, карбокси, амидо, ацил, алкилкарбонил, галоген, биогидролизуемую группу, OP(O)3 2-, O[P(O)3]2 3-, O[P(O)3]3 4-, N3, CH2-NR6R7 или CH2-OR6;
R3, R3', R4 и R4' в каждом случае независимо представляют собой OR7, OR8, водород, галоген, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероцикло, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарилалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арилкарбонил, замещенный или незамещенный алкилкарбонил, биогидролизуемую группу, или R3 и R4, взятые вместе, образуют связь, или R3 и R4, взятые вместе с атомами, к которым они присоединены, образуют замещенный или незамещенный гетероцикло, или R3 и R3' и/или R4 и R4', взятые вместе с атомом углерода, к которому они присоединены, образуют CO=O); и
R6, R7 и R8 в каждом случае независимо представляют собой водород, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероцикло, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарилалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арилкарбонил, замещенный или незамещенный алкилкарбонил, биогидролизуемую группу, или R3 и R4, взятые вместе с атомами, к которым они присоединены, образуют замещенный или незамещенный гетероцикло.
Предпочтительные соединения формулы I указаны в таблице 1.
Соединения формулы I можно получать стандартными хорошо известными способами синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, and Structure, 4th ed., 1992. Исходные соединения, пригодные для получения соединений формулы I, и промежуточные соединения, таким образом, являются коммерчески доступными или их можно получить из коммерчески доступных материалов с использованием известных способов синтеза и реагентов.
Конкретные способы получения соединений формулы I описаны в US 2004-0067900, опубликованной 8 апреля 2004 года, включенной в настоящий документ в качестве ссылки в полном объеме.
В другом варианте осуществления средство для супрессии нонсенс-кодона представляет собой соединение формулы II:
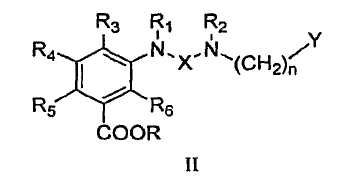
или его фармацевтически приемлемую соль, гидрат, клатрат, полиморф, пролекарство или стереоизомер, где:
X представляет собой C(=O), C(=S), S, S(-O) или S(O)2;
Y представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероцикло;
R представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероцикло, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарилалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный гетероциклоалкил;
n представляет собой число в диапазоне 0-4;
каждый из R1 и R2 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, -(CH2)m-W, карбоксиалкил, алкилкарбонил, алкилоксиалкил, алкилоксикарбонил, арилалкил, сульфонил, амид, или R1 и R2 совместно с атомами, к которым они присоединены, образуют необязательно замещенное 5-7-членное гетероциклическое, необязательно замещенное 5-7-членное гетероарильное кольцо, или R1 и R2 совместно образуют:
W в каждом случае независимо представляет собой водород, галоген, гидрокси, алкокси, карбокси, альдегид, NH2, NR14R14', нитро, циклоалкил, гетероарил, гетероарилалкил; где (i) каждый встречающийся R14 и R14' независимо выбран из водорода, замещенного или незамещенного алкила, замещенного или незамещенного алкенила, замещенного или незамещенного алкинила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила или CF3; или (ii) R14 и R14', совместно с атомом азота, с которым они связаны, соединены с образованием необязательно замещенного гетероциклического кольца, содержащего от 5 до 8 атомов кольца, от 1 до 3 из которых являются гетероатомами; m представляет собой число в диапазоне 1-4;
каждый из R3-R5 независимо представляет собой водород, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероцикло, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарилалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный гетероциклоалкил, алкиламино, аминоалкил, алкокси, арилокси, гетероарилокси, циклоалкокси, гетероциклоалкилокси, амид, галоалкил (например, CF3), галоалкокси (например, OCF3 или OCHF2), OH, CN, COOH, COOR15, SO2R15, NO2, NH2 или NR14R14', и R15 выбран из водорода, замещенного или незамещенного алкила, замещенного или незамещенного алкенила, замещенного или незамещенного алкинила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила или CF3. Предпочтительные соединения формулы II указаны в таблице 2.
Соединения формулы II можно получать стандартными хорошо известными способами синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, and Structure, 4th ed., 1992. Исходные материалы, пригодные для получения соединений формулы I, и промежуточные соединения, таким образом, являются коммерчески доступными или их можно получить из коммерчески доступных материалов с использованием известных способов синтеза и реагентов.
Конкретные способы получения соединений формулы II описаны в WO 2004/009558 A2, опубликованной 29 января 2004 года, включенной в настоящий документ в качестве ссылки в полном объеме.
В другом варианте осуществления средство для супрессии нонсенс-кодона представляет собой соединение формулы III:
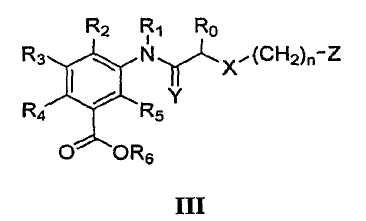
или его фармацевтически приемлемые соли, гидраты, клатраты, пролекарства, полиморфы, стереоизомеры, включая энантиомеры, диастереомеры, рацематы или смеси стереоизомеров, где:
X представляет собой кислород, серу, CO, SO или S(O)2;
Y представляет собой кислород или серу;
Z представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил;
n представляет число от 0 до 4;
R1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил; замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, SO2R7, CF3, CN, COOH, COR7 или COOR7;
R0 представляет собой водород или, взятый вместе с R1 и атомами, к которым они присоединены, образует необязательно замещенное 5-7-членное гетероциклическое или гетероарильное кольцо;
R2, R3, R4 и R5 независимо представляют собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил; замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, алкокси, арилокси, гетероарилокси, галоген, CF3, OCF3, OCHF2, CN, COOH, COOR7, SO2R7, NO2, NH2 или N(R7)2;
R6 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, или любую биогидролизуемую группу; и
каждый встречающийся R7 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил; замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, алкокси, арилокси, гетероарилокси, галоген или CF3;
при условии, что когда X представляет собой O, Y представляет собой O, n представляет собой 0 и R1 представляет собой водород, то Z представляет собой не 4-хлорфенил, 4-метилфенил, 3-хлорфенил или 2,4-дихлорфенил; и при условии, что когда X представляет собой O, Y представляет собой O, n представляет собой 0, R1 представляет собой водород, и Z представляет собой незамещенный фенил, то, по меньшей мере, один из R2-R5 представляет собой не водород; и при условии, что когда R3 представляет собой COOH, не все из R2, R4 и R5 представляют собой галоген.
Предпочтительные соединения формулы III указаны в таблице 3.
Соединения формулы III можно получать стандартными хорошо известными способами синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, and Structure, 4th ed., 1992. Исходные материалы, пригодные для получения соединений формулы I, и промежуточные соединения, таким образом, являются коммерчески доступными, или их можно получить из коммерчески доступных материалов с использованием известных способов синтеза и реагентов.
Конкретные способы получения соединений формулы III описаны в WO 2004/009533 A1, опубликованной 29 января 2004 года, включенной в настоящий документ в качестве ссылки в полном объеме.
В другом варианте осуществления средство для супрессии нонсенс-кодона представляет собой соединение формулы IV:
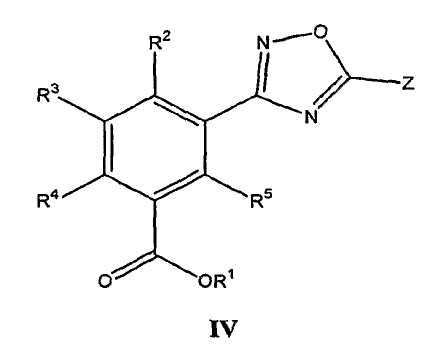
или их фармацевтически приемлемые соли, гидраты, клатраты, пролекарства, полиморфы, стереоизомеры, включая энантиомеры, диастереомеры, рацематы или смеси стереоизомеров, где:
Z представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный гетероцикл, замещенный или незамещенный арилалкил;
R1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -(CH2CH2O)nR6 или любую биогидролизуемую группу;
R2, R3, R4, R5 и R6 независимо представляют собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил; замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, алкокси, арилокси, гетероарилокси, галоген, CF3, OCF3, OCHF2, CN, COOH, COOR7, SO2R7, NO2, NH2 или N(R7)2;
каждый встречающийся R7 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил; замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, алкокси, арилокси, гетероарилокси; галоген или CF3; и
n представляет собой число от 1 до 7.
Предпочтительные соединения формулы IV указаны в таблице 4.
Соединения формулы IV можно получать стандартными хорошо известными способами синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, and Structure, 4th ed., 1992. Исходные материалы, пригодные для получения соединений формулы I, и промежуточные соединения, таким образом, являются коммерчески доступными, или их можно получить из коммерчески доступных материалов с использованием известных способов синтеза и реагентов.
Конкретные способы получения соединений формулы IV описаны в US 2004-0204461 A1, опубликованной 14 октября 2004 года, включенной в настоящий документ в качестве ссылки в полном объеме.
В другом варианте осуществления средство для супрессии нонсенс-кодона представляет собой соединение формулы V:
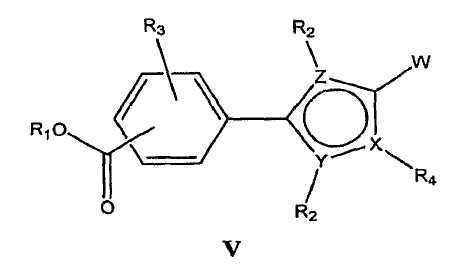
или его фармацевтически приемлемые соли, гидраты, клатраты, пролекарства, полиморфы, стереоизомеры, включая энантиомеры, диастереомеры, рацематы и смеси стереоизомеров, где:
X, Y, и Z независимо выбраны из N, S, O и C, где, по меньшей мере, один из X, Y или Z представляет собой гетероатом;
R1 представляет собой водород, C1-C6алкил или Na+, или Mg2+;
R2 независимо отсутствует; представляет собой водород; группу -CH=N-OH; цианогруппу; C1-C6алкил, который необязательно замещен гидроксигруппой; или карбонильную группу, которая необязательно замещена водородом, гидроксилом или C1-C4алкоксигруппой;
R3 независимо отсутствует, представляет собой галоген, гидрокси, C1-C6алкил, C1-C4алкокси или нитрогруппу;
R4 независимо отсутствует, представляет собой водород, C1-C6алкил, или, взятый вместе с W, R4 может представлять собой связь, и W и гетероцикл, к которому присоединены R4 и W, образуют гетеротрициклическую кольцевую структуру с от одиннадцати до тринадцати членами;
W выбран из:
(a) C2-C6алкинила, необязательно замещенного фенилом;
(b) неразветвленного или разветвленного C1-C8алкила, который необязательно замещен одной или более из следующих выбранных независимо групп: C1-C6алкил; галоген; -C(=O)-NH-фенил, при этом фенил необязательно замещен одним или более и независимо выбранными галогенами или C1-C4алкильными группами; от пяти- до шестичленный гетероцикл; C6-C8арил, который необязательно замещен одной или более группами, независимо выбранными из гидрокси, галогена, C1-C4алкильной группы, C1-C4галоалкильной группы, C1-C4алкоксигруппы или аминогруппы, которая необязательно замещена одной или более C1-C4алкильными группами; арилокси, который необязательно замещен одной или более из следующих независимо выбранных групп: гидрокси, галоген, C1-C4алкильная группа, C1-C4галоалкильная группа, C1-C4алкоксигруппа или аминогруппа, которая необязательно замещена одной или более C1-C4алкильными группами;
(c) от C2 до C8 алкенила;
(d) C3-C8циклоалкила, необязательно замещенного C1-C6алкилом;
(e) C6-C8арила, который необязательно замещен одной или более из следующих выбранных независимо групп: гидрокси; галоген; неразветвленный или разветвленный C1-C4алкил, который необязательно замещен одной или более независимо выбранными группами галогена или гидрокси; C1-C4алкокси, который необязательно замещен одной или более независимо выбранными группами галогена или фенила; C3-C8циклоалкил, который необязательно замещен одной или более независимо выбранными C1-C4алкильными группами; C6-C8арил, который необязательно замещен одной или более независимо выбранными C1-C4алкильными группами; арилокси, который необязательно замещен одной или более из следующих независимо выбранных групп: гидрокси, галоген, C1-C4алкильная группа, C1-C4галоалкильная группа, C1-C4алкоксигруппа или аминогруппа, которая необязательно замещена одной или более независимо выбранными C1-C4алкильными группами; от пяти- до шестичленный гетероцикл, который необязательно замещен одним или более независимо выбранными C1-C4алкилом, оксо или C6-C8арилом, который необязательно замещен одной или более из следующих независимо выбранных групп: гидрокси, галоген, C1-C4алкильная группа, C1-C4галоалкильная группа, C1-C4алкоксигруппа или аминогруппа, которая необязательно замещена одной или более независимо выбранными C1-C4алкильными группами; нафтильная группа, которая необязательно замещена амино или аминоалкильной или алкоксигруппой; группа -C(O)-NRxRy; группа -C(O)-Rx; группа изоиндол-1,3-диона; нитрогруппа; цианогруппа; группа -SO3H; алкилтиогруппа; алкилсульфонильная группа; группа -NRx-C(O)-Rz; группа -NRxRy; группа -NRx-SO2-Rz; группа -NRx-C(O)-NRxRy; группа -NRx-C(O)O-Rz;
(f) C10-C14арильной группы, необязательно замещенной одним или более независимо выбранными галогенами, аминогруппами или аминоалкильными группами или алкоксигруппами;
(g) группы -C(O)-NRxRy;
(h) пяти- или шестичленного гетероцикла, который необязательно замещен одной или более независимо выбранными оксогруппами; галогенами; C1-C4алкильными группами; C1-C4алкоксигруппами; C1-C4галоалкильными группами; C1-C4галоалкоксигруппами; арилоксигруппами; группами -NRxRy; алкилтиогруппами; группами -C(O)-Rx; или от C6 до C8 арильными группами, которые необязательно замещены одним или более независимо выбранными галогенами, C1-C4алкильными группами, C1-C4алкоксигруппами;
(i) группы гетероцикла, имеющей от двух до трех кольцевых структур, которые необязательно замещены одним или более независимо выбранными галогенами, оксогруппами, C1-C4алкильными группами, C1-C4галоалкильными группами, или C1-C4алкоксигруппами;
j) или W совместно с R4, включая случай, когда R4 представляет собой связь, и гетероцикл, к которому R4 и W присоединены, образуют гетеротрициклическую кольцевую структуру из от одиннадцати до тринадцати членов;
где Rx представляет собой водород, C1-C6алкильную группу, или Rx и Ry совместно с атомами, к которым они присоединены, образуют от четырех- до семичленного карбоцикла или гетероцикла;
Ry представляет собой водород, C1-C6алкильную группу; арильную группу, необязательно замещенную одной или более независимо выбранными C1-C4алкильными группами, или Rx и Ry совместно с атомами, к которым они присоединены, образуют от четырех- до семичленного карбоцикла или гетероцикла; и
Rz представляет собой C1-C6алкил, необязательно замещенный арилом или галогеном; или арил, необязательно замещенный галогеном, C1-C6алкил, или C1-C6алкокси.
Предпочтительные соединения формулы V указаны в таблице 5.
Соединения формулы V можно получать стандартными хорошо известными способами синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, and Structure, 4th ed., 1992. Исходные материалы, пригодные для получения соединений формулы I, и промежуточные соединения, таким образом, являются коммерчески доступными, или их можно получить из коммерчески доступных материалов с использованием известных способов синтеза и реагентов.
Конкретные способы получения соединений формулы V описаны в международной заявке No. PCT/US05/036673, поданной 13 октября 2005 года, включенной в настоящий документ в качестве ссылки в полном объеме.
В другом варианте осуществления средство для супрессии нонсенс-кодона представляет собой соединение формулы VI:
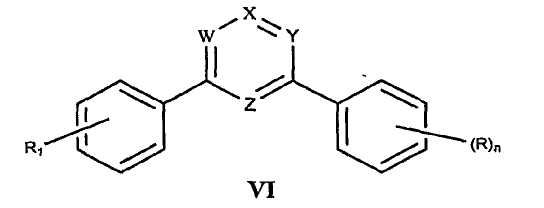
или его фармацевтически приемлемые соли, гидраты, клатраты, пролекарства, полиморфы, стереоизомеры, включая энантиомеры, диастереомеры, рацематы и смеси стереоизомеров, где:
W, X, Y и Z независимо выбраны из N или C-Ra, где Ra представляет собой водород или C1-C4алкильную группу, где по меньшей мере, один из W, X, Y или Z представляет собой N;
n представляет собой 0, 1, 2 или 3;
R1 представляет собой цианогруппу; карбамоил, который необязательно замещен одной или двумя C1-C4алкильными группами; или карбонильную группу, которая замещена гидрокси, C1-C4алкилом, или C1-C4алкоксигруппой;
R представляет собой гидроксигруппу; галоген; C1-C4алкил, который необязательно замещен одной или более независимо выбранными группами галогена или гидрокси; C1-C4алкокси, который необязательно замещен одной или более независимо выбранными группами галогена или фенила; C4-C8циклоалкил, который необязательно замещен одной или более независимо выбранными C1-C4алкильными группами; группу Rb; группу -O-Rb; от пяти- до шестичленный гетероцикл, который необязательно замещен одной или более независимо выбранными C1-C4алкильными группами, оксо или -Rb; от девяти- до десятичленный гетероцикл, имеющий две кольцевых структуры; карбонил, который замещен гидрокси, C1-C4алкилом или C1-C4алкоксигруппой; карбамоил, который необязательно замещен одной или двумя C1-C4алкильными группами; нитрогруппу; цианогруппу; тио, который необязательно замещен гидрокси, C1-C4алкилом или группой -Rb; сульфонил, который необязательно замещен гидрокси, C1-C4алкилом или группой -Rb; амино, который необязательно замещен одной или двумя независимо выбранными группами C1-C4алкила, сульфонила или карбонила, где аминосульфонильная группа необязательно замещена гидрокси, C1-C4алкилом или группой -Rb и где аминокарбонильная группа необязательно замещена C1-C4 алкилом, C1-C4галоалкилом, бензокси, или аминогруппой, которая необязательно замещена группой -Rb; или две группы R совместно с фенильным кольцом, к которому они присоединены, образуют бензо[1,3]диоксольную или 2,3-дигидро-бензо[1,4]диоксинильную группу, где -Rb представляет собой C6-C8арил, который необязательно замещен одним или более из следующих: гидрокси, галоген, C1-C4алкильная группа, C1-C4галоалкильная группа, C1-C4алкоксигруппа или аминогруппа, которая необязательно замещена одной или более C1-C4алкильными группами.
Предпочтительные соединения формулы VI указаны в таблице 6.
Соединения формулы VI можно получать стандартными хорошо известными способами синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, and Structure, 4th ed., 1992. Исходные материалы, пригодные для получения соединений формулы I, и промежуточные соединения, таким образом, являются коммерчески доступными, или их можно получить из коммерчески доступных материалов с использованием известных способов синтеза и реагентов.
Конкретные способы получения соединений формулы VI описаны в международной заявке No. PCT/US05/036764, поданной 13 октября 2005 года, включенной в настоящий документ в качестве ссылки в полном объеме.
В другом варианте осуществления средство для супрессии нонсенс-кодона представляет собой соединение формулы VII:
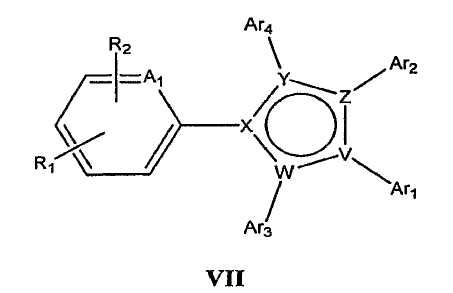
или его фармацевтически приемлемые соли, гидраты, клатраты, пролекарства, полиморфы, стереоизомеры, включая энантиомеры, диастереомеры, рацематы и смеси стереоизомеров, где:
A1 представляет собой C, CH или N;
V и X независимо выбраны из N или C;
W выбран из N, C или CH;
где, по меньшей мере, один из V, W или X представляет собой N, и где, если W представляет собой N, то, по меньшей мере, один из V или X также представляет собой N;
Y и Z независимо выбраны из N, C, C-Rс, C=O, C=S, где Rс представляет собой H, CH3, или NH2; при условии, что когда один из Y или Z представляет собой C=O или C=S, другой также может быть выбран из NH, S или O;
R1 представляет собой карбокси, циано или карбонильную группу, которая необязательно замещена C1-C4алкоксигруппой,
R2 отсутствует или представляет собой нитро;
Ar1 представляет собой от C1 до C4 алкил, который необязательно замещен группой R; от C6 до C10 арил, который необязательно замещен одной, двумя или тремя независимо выбранными группами R; от пяти- до десятичленный гетероцикл, который необязательно замещен одной, двумя или тремя независимо выбранными группами R; совместно с Ar2 и гетероциклом, к которому Ar1 и Ar2 присоединены, образует кольцевую структуру, выбранную из Ar1-2; или совместно с Ar3 и гетероциклом, к которому присоединены Ar1 и Ar3, образует кольцевую структуру Ar1-3;
Ar2 отсутствует или совместно с Ar1 и гетероциклом, к которому Ar1 и Ar2 присоединены, образует кольцевую структуру, выбранную из Ar1-2;
Ar3 отсутствует или совместно с Ar1 и гетероциклом, к которому Ar1 и Ar3 присоединены, образует кольцевую структуру, выбранную из Ar1-3;
Ar4 отсутствует; или представляет собой C1-C4алкил, C1-C4алкокси, или C1-C4тиоалкил, любой из которых совместно с A1 образует от четырех- до семичленный карбоцикл или гетероцикл;
R представляет собой водород; группу -Ra; или две группы R, где R также может включать оксигруппу, совместно с фенилом или гетероциклом, к которому они присоединены, образует кольцевую структуру, выбранную из RR;
где Ar1-2 и Ar1-3 выбраны из от одиннадцати до четырнадцатичленной гетеротрициклической кольцевой структуры, необязательно замещенной одним или более галогенами, C1-C4алкильными группами, C1-C4галоалкильными группами, C1-C4алкоксигруппами, необязательно замещенными галогеном или C1-C4алкоксигруппой, C1-C4галоалкоксигруппами, или аминогруппами, необязательно замещенными карбонильной группой, которая замещена C1-C4алкильной группой;
RR представляет собой от девяти- до десятичленную бициклическую кольцевую структуру, необязательно замещенную одним или более галогенами, C1-C4алкильными группами, C1-C4галоалкильными группами, C1-C4алкоксгруппами и, оксогруппами, или C1-C4галоалкоксигруппами;
Ra выбран из группы, состоящей из: гидроксигруппы; галогена; C1-C4алкила, который необязательно замещен одной или более независимо выбранными группами галогена или гидрокси; C1-C4алкокси, который необязательно замещен одной или более независимо выбранными группами галогена или фенила; C4-C8циклоалкила, который необязательно замещен одной или более независимо выбранными C1-C4алкильными группами; группы -Rb; группы -O-Rb; от четырех- до шестичленного гетероцикла, который необязательно замещен одной или более независимо выбранными C1-C4алкильными группами, оксо или -Rb; от девяти- до десятичленного гетероцикла, имеющего две кольцевые структуры; карбонила, который необязательно замещен гидрокси, C1-C4алкилом или C1-C4алкоксигруппой; карбамоила, который необязательно замещен одной или двумя C1-C4алкильными группами; нитрогруппы; цианогруппы; тио, который необязательно замещен гидрокси, C1-C4алкилом или группой -Rb; сульфонила, который необязательно замещен гидрокси, C1-C4алкилом или группой -Rb; или амино, который необязательно замещен одной или двумя независимо выбранными группами C1-C4алкила, сульфонила или карбонила, где аминосульфонильная группа необязательно замещена гидрокси, C1-C4 алкилом или группой -Rb и где аминокарбонильная группа необязательно замещена C1-C4алкилом, C1-C4галоалкилом, бензокси или аминогруппой, которая необязательно замещена группой -Rb; и
где -Rb представляет собой C6-C8арил, который необязательно замещен одной или более из следующих групп: гидрокси, галоген, C1-C4алкильная группа, C1-C4галоалкильная группа, C1-C4алкоксигруппа или аминогруппа, которая необязательно замещена одной или более C1-C4алкильными группами.
Предпочтительные соединения формулы VII указаны в таблице 7.
Соединения формулы VII можно получать стандартными хорошо известными способами синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, and Structure, 4th ed., 1992. Исходные материалы, пригодные для получения соединений формулы I, и промежуточные соединения, таким образом, являются коммерчески доступными, или их можно получить из коммерчески доступных материалов с использованием известных способов синтеза и реагентов.
Конкретные способы получения соединений формулы VII описаны в международной заявке No. PCT/US05/036761, поданной 13 октября 2005 года, включенной в настоящий документ в качестве ссылки в полном объеме.
В другом варианте осуществления средство для супрессии нонсенс-кодона представляет собой соединение формулы VIII:
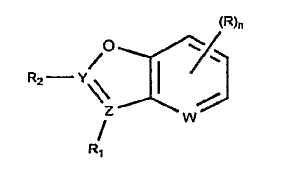
или его фармацевтически приемлемые соли, гидраты, клатраты, пролекарства, полиморфы, стереоизомеры, включая энантиомеры, диастереомеры, рацематы и смеси стереоизомеров, где:
Y и Z независимо выбраны из N или C;
W представляет собой N или CH;
n представляет собой 0, 1, 2 или 3;
R1 представляет собой водород, от C6 до C8 арил, который необязательно замещен карбоксигруппой, или R1 отсутствует, когда Z представляет собой N;
R2 представляет собой водород; от C6 до C8 арил, который необязательно замещен одной, двумя или тремя независимо выбранными группами Ra; от четырех- до семичленный гетероцикл, который необязательно замещен одной или более независимо выбранными C1-C6алкильными группами или от трех- до семичленным гетероциклом; или R2 отсутствует, когда Y представляет собой N;
R независимо выбран из галогена; карбоксигруппы; C1-C6алкильной группы, необязательно замещенной от четырех- до семичленным гетероциклом, C6-C8арилоксигруппой или аминогруппой, где от четырех- до семичленный гетероцикл, группа C6-C8арилокси и аминогруппа необязательно замещены одной или двумя независимо выбранными C1-C6алкильными или C6-C8арильнными группами, при этом C6-C8арильные группы необязательно и независимо замещены одной или более C1-C6алкильными группами; C1-C6алкокси; C6-C8арилокси; C6-C8арила, необязательно замещенного одной или более независимо выбранными группами галогена, C1-C4алкила, C1-C4галоалкила, окси, C1-C4алкокси или C1-C4галоалкокси группами; аминогруппы, необязательно замещенной одной или двумя независимо выбранными C6-C8арильными или C1-C6алкильными группами, которые необязательно замещены гидрокси, C6-C8арилом или от девяти- до десятичленным гетероциклом, имеющим две кольцевые структуры; карбонильной группы, замещенной от пяти- до шестичленной группой гетероцикла; от четырех- до семичленной группы гетероцикла, необязательно замещенной одной или более группами C1-C4алкила или оксо; от девяти- до десятичленного гетероцикла, имеющего две кольцевые структуры; или две группы R, где R также может включать оксигруппу, совместно с гетеробициклом, к которому они присоединены, образуют от двенадцати- до тринадцатичленный гетероцикл, имеющий три кольцевые структуры; и
где Ra представляет собой галоген; C1-C6алкил; C6-C8алкокси, который необязательно замещен одной или более независимо выбранными группами галогена; C6-C8арил; от четырех- до семичленный гетероцикл, который необязательно замещен одной или более независимо выбранными оксогруппами; карбонил, который необязательно замещен гидроксигруппой или C1-C6алкокси; карбамоил; амино, который необязательно замещен независимо выбранной C1-C6алкильной группой, где C1-C6алкильная группа необязательно замещена одним или более независимо выбранными галогенами или гидроксильными группами; или две группы Ra, где Ra также может включать оксигруппу, совместно с от C6 до C8арильной группой, к которой они присоединены, образуют от девяти- до десятичленный гетероцикл, имеющий две кольцевые структуры, где от девяти- до десятичленный гетероцикл, имеющий две кольцевые структуры, необязательно замещен одним или более независимо выбранными галогенами.
Предпочтительные соединения формулы VIII указаны в таблице 8.
Соединения формулы VIII можно получать стандартными хорошо известными способами синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, and Structure, 4th ed., 1992. Исходные материалы, пригодные для получения соединений формулы I, и промежуточные соединения, таким образом, являются коммерчески доступными, или их можно получить из коммерчески доступных материалов с использованием известных способов синтеза и реагентов.
Конкретные способы получения соединений формулы VIII описаны в международной заявке No. PCT/US05/036762, поданной 13 октября 2005 года, включенной в настоящий документ в качестве ссылки в полном объеме.
В другом варианте осуществления средство для супрессии нонсенс-кодона представляет собой соединение формулы IX:
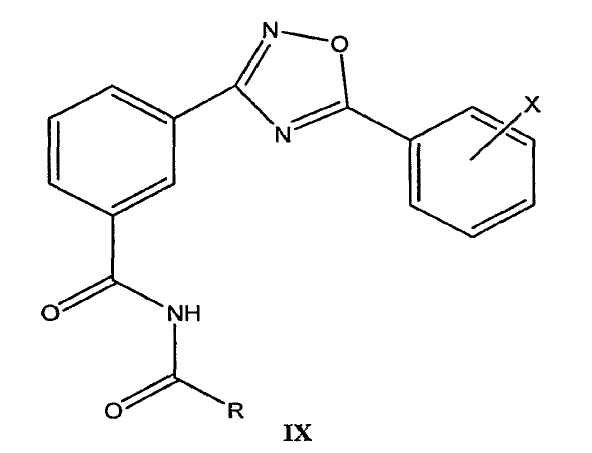
или его фармацевтически приемлемые соли, гидраты, клатраты, пролекарства, полиморфы, стереоизомеры, включая энантиомеры, диастереомеры, рацематы и смеси стереоизомеров, где:
X представляет собой галоген;
R представляет собой C1-C8алкильную группу; C1-C4галоалкильную группу; группу -OR1; или аминогруппу, которая необязательно замещена одной или двумя независимо выбранными группами R2;
R1 представляет собой C1-C8алкильную группу, которая необязательно замещена одной или более независимо выбранными группами Ra; группу -Rb; группу пирролидинила, которая необязательно замещена одной или более независимо выбранными группами C1-C4алкила или оксо; группу пиперидила, которая необязательно замещена одной или более независимо выбранными группами C1-C4алкила, бензильными группами или карбоксигруппами, необязательно замещенными одной или более C1-C4алкильными группами или C1-C4алкокси; тетрагидрофурильную группу; тетрагидропиранильную группу; тетрагидронафтильную группу; или инданильную группу;
R2 представляет собой водород, C1-C6алкильную группу; C1-C4галоалкильную группу; С1-C4алкоксигруппу; группу -Rb; пиримидинильную группу; пиридильную группу; сульфонильную группу, необязательно замещенную группой -Rb; или две группы R2, совместно с амино, к которому они присоединены, образуют морфолинильную группу, пирролидинильную группу, изоиндолинильную группу или пиперазинильную группу, которая необязательно замещена фенильной группой;
где Ra представляет собой галоген; C1-C4алкоксигруппу; карбамоильную группу, которая необязательно замещена одной или двумя независимо выбранными C1-C4алкильными или C1-C4алкоксигруппами; фосфиноильную группу, которая необязательно замещена одной или двумя независимо выбранными C1-C4алкильными или C1-C4алкоксигруппами; морфолинильную группу; пиридильную группу; или группу -Rb; и
где Rb представляет собой C6-C8арил, который необязательно замещен одной или более из следующих независимо выбранных групп: гидрокси, галоген, C1-C4алкильная группа, C1-C4галоалкильная группа, C1-C4алкоксигруппа или аминогруппа, которая необязательно замещена одной или более независимо выбранными C1-C4алкильными группами.
Предпочтительные соединения формулы IX указаны в таблице 9.
Соединения формулы IX можно получать стандартными хорошо известными способами синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, and Structure, 4th ed., 1992. Исходные материалы, пригодные для получения соединений формулы I, и промежуточные соединения, таким образом, являются коммерчески доступными, или их можно получить из коммерчески доступных материалов с использованием известных способов синтеза и реагентов.
Конкретные способы получения соединений формулы IX описаны в международной заявке No. PCT/US05/037052, поданной 13 октября 2005 года, включенной в настоящий документ в качестве ссылки в полном объеме.
Активность соединений в отношении супрессии нонсенс-кодона, описанных в настоящем документе, можно измерять с использованием репортерных анализов, описанных в разделе 5.4. В конкретном варианте осуществления активность соединений в отношении супрессии нонсенс-кодонов, описанных в настоящем документе, можно измерять с использованием клеточного анализа с люциферазным репортером, включающего люциферазную репортерную конструкцию, содержащую преждевременный терминирующий кодон UGA, которая стабильно трансфицирована в эмбриональные клетки почки человека 293T. Низкомолекулярное соединение, 3-[3-(4-изопропил-фенил)-2,5-диоксоимидазолидин-1-ил]бензойную кислоту, о которой известно, что она позволяет прохождение считывания через преждевременные терминирующие кодоны, можно использовать в качестве внутреннего стандарта. Измерения активности основаны на качественной взаимосвязи между минимальной концентрацией соединения, требуемой для продукции данного белка в клетке (действенность) и максимальным количеством белка, продуцируемого клеткой (эффективность).
Полагают, что соединения, имеющие менее чем значимую действенность или эффективность синтеза белка, или обе из них, в клеточном анализе с люциферазой, тем не менее, обладают пригодностью в способах in vivo по этому изобретению.
5.3 СИНТЕЗ И ПОЛУЧЕНИЕ ИЛЛЮСТРАТИВНЫХ СОЕДИНЕНИЙ
Иллюстративные соединения, описанные в настоящем документе, можно получать стандартными хорошо известными способами синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, and Structure, 4th ed., 1992. Исходные материалы, пригодные для получения иллюстративных соединений, описанных в настоящем документе, и промежуточные соединения, таким образом, являются коммерчески доступными, или их можно получить из коммерчески доступных материалов с использованием известных способов синтеза и реагентов.
Конкретные способы получения иллюстративных соединений, описанных в настоящем документе, описаны, по меньшей мере, в US 2004/0067900, опубликованной 8 апреля 2004 года, WO 2004/009558 A2, опубликованной 29 января 2004 года, WO 2004/009533 A1, опубликованной 29 января 2004 года, US 2004-0204461 A1, опубликованной 14 октября 2004 года, международной заявке No. PCT/US2005/036673, поданной 13 октября 2005 года, международной заявке No. PCT/US2005/037052, поданной 13 октября 2005 года, международной заявке No. PCT/US2005/036764, поданной 13 октября 2005 года, международной заявке No. PCT/US2005/036762, поданной 13 октября 2005 года, и международной заявке No. PCT/US2005/036761, поданной 13 октября 2005 года, все из которых включены в настоящий документ в качестве ссылки в полном объеме.
5.4 СПОСОБЫ ИДЕНТИФИКАЦИИ СРЕДСТВ ДЛЯ СУПРЕССИИ НОНСЕНС-КОДОНОВ
Соединения, которые осуществляют супрессию преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК, можно идентифицировать с использованием способов, известных специалистам в данной области. См., например, публикацию США No. 2005/0233327, опубликованную 20 октября 2005 года, под названием "Methods for Identifying Small Molecules that Modulate Premature Translation Termination and Nonsense Mediated mRNA Decay"; патент США No. 6458538 под названием "Methods of Assaying for Compounds that Inhibit Premature Translation Termination and Nonsense Mediated RNA Decay"; публикацию США No. 2003/0008317, опубликованную 9 января 2003 года, под названием "Methods of Assaying for Compounds that Inhibit Premature Translation Termination and Nonsense Mediated RNA Decay"; и публикацию международной заявки No. WO 2004/010106, под названием "Methods of Assaying for Compounds that Inhibit Premature Translation Termination and Nonsense Mediated RNA Decay", все из которых включены в настоящий документ в качестве ссылок в полном объеме. В частности, для идентификации соединения, которое обеспечивает супрессию преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК можно применять клеточные и бесклеточные анализы.
В одном варианте осуществления это изобретение относится к способу идентификации соединения, которое обеспечивает супрессию преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК, при этом указанный способ включает: (a) контактирование соединения или члена библиотеки соединений с клеткой, содержащей последовательность нуклеиновой кислоты, содержащей репортерный ген, где репортерный ген содержит преждевременный стоп-кодон; и (b) детекцию экспрессии указанного репортерного гена, где соединение, которое обеспечивает супрессию преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК, идентифицируют, если экспрессия и/или активность указанного репортерного гена в присутствии соединения повышается относительно ранее определенного контрольного диапазона, или экспрессии и/или активности указанного репортерного гена в отсутствие указанного соединения или в присутствии соответствующего контроля (например, отрицательного контроля). В другом варианте осуществления это изобретение относится к способу идентификации соединения, которое обеспечивает супрессию преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК, при этом указанный способ включает: (a) контактирование соединения или члена библиотеки соединений с бесклеточным экстрактом и последовательностью нуклеиновой кислоты, содержащей репортерный ген, где репортерный ген содержит преждевременный стоп-кодон; и (b) детекцию экспрессии указанного репортерного гена, где соединение, которое обеспечивает супрессию преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК, идентифицируют, если экспрессия и/или активность указанного репортерного гена в присутствии соединения повышается относительно ранее определенного контрольного диапазона, или экспрессии и/или активности указанного репортерного гена в отсутствие указанного соединения или в присутствии соответствующего контроля (например, отрицательного контроля). В соответствии с этим вариантом осуществления клеточный экстракт можно выделять из клеток, инкубированных при от приблизительно 0°C до приблизительно 10°C и/или он может представлять собой бесклеточный экстракт от S10 до S30.
В соответствии с этим изобретением стадию контактирования соединения с клеткой или бесклеточным экстрактом и последовательностью нуклеиновой кислоты в анализах на основе репортерного гена, описанных в настоящем документе, предпочтительно проводят в водном растворе, содержащем буфер и сочетание солей (таких как KCl, NaCl и/или MgCl2). Оптимальная концентрация каждой соли, используемой в водном растворе, зависит, например, от белка, полипептида или пептида, кодируемого последовательностью нуклеиновой кислоты (например, регуляторного белка) и используемого соединения, и ее можно определить с использованием общепринятого экспериментирования. В конкретном варианте осуществления, водный раствор соответствует физиологическим условиям или имитирует их. В другом конкретном варианте осуществления водный раствор далее содержит детергент или поверхностно-активное вещество.
Анализы по настоящему изобретению можно проводить с использованием различного времени инкубации. В клеточной системе клетку и соединение или член библиотеки соединений можно инкубировать вместе в течение, по меньшей мере, 0,2 часа, 0,25 часа, 0,5 часа, 1 часа, 2 часов, 3 часов, 4 часов, 5 часов, 6 часов, 8 часов, 10 часов, 12 часов, 18 часов, по меньшей мере, 1 суток, по меньшей мере, 2 суток или, по меньшей мере, 3 суток перед измерением экспрессии и/или активности репортерного гена. В бесклеточной системе бесклеточный экстракт и последовательность(и) нуклеиновой кислоты (например, репортерного гена) можно инкубировать вместе перед добавлением соединения или члена библиотеки соединений. В определенных вариантах осуществления бесклеточный экстракт инкубируют с последовательностью(ями) нуклеиновой кислоты (например, репортерного гена) перед добавлением соединения или члена библиотеки соединений в течение, по меньшей мере, 0,2 часа, 0,25 часа, 0,5 часа, 1 часа, 2 часов, 3 часов, 4 часов, 5 часов, 6 часов, 8 часов, 10 часов, 12 часов, 18 часов или, по меньшей мере, 1 суток. В других вариантах осуществления бесклеточный экстракт, или последовательность(и) нуклеиновой кислоты (например, репортерного гена) инкубируют с соединением или членом библиотеки соединений перед добавлением последовательности(ей) нуклеиновой кислоты (например, репортерного гена), или бесклеточного экстракта, соответственно. В определенных вариантах осуществления соединение или член библиотеки соединений инкубируют с последовательностью(ями) нуклеиновой кислоты (например, репортерным геном) или бесклеточным экстрактом перед добавлением оставшегося компонента, т.е. бесклеточного экстракта, или последовательности(ей) нуклеиновой кислоты (например, репортерного гена), соответственно, в течение, по меньшей мере, 0,2 часа, 0,25 часа, 0,5 часа, 1 часа, 2 часов, 3 часов, 4 часов, 5 часов, 6 часов, 8 часов, 10 часов, 12 часов, 18 часов, или, по меньшей мере, 1 суток. После того как реакционный сосуд содержит компоненты, т.е. соединение или член библиотеки соединений, бесклеточный экстракт и последовательность(и) нуклеиновой кислоты (например, репортерного гена), реакционную смесь можно далее инкубировать в течение, по меньшей мере, 0,2 часа, 0,25 часа, 0,5 часа, 1 часа, 2 часов, 3 часов, 4 часов, 5 часов, 6 часов, 8 часов, 10 часов, 12 часов, 18 часов или, по меньшей мере, 1 суток.
Ход реакции в анализах на основе репортерного гена можно анализировать непрерывно. Альтернативно в анализах на основе репортерного гена для мониторинга хода реакции можно выбирать моменты времени в различные периоды реакции.
Анализы на основе репортерного гена, описанные в настоящем документе, можно проводить в клетке, созданной способами генетической инженерии для экспрессии репортерного гена. Альтернативно анализы на основе репортерного гена, описанные в настоящем документе, можно проводить в клетке, естественным образом экспрессирующей репортерный ген, содержащий нонсенс-мутацию в кодирующей области гена. В способах по этому изобретению можно использовать любую клетку или клеточную линию любого вида, хорошо известные специалисту в данной области. Кроме того, бесклеточный экстракт можно получать из любой клетки или клеточной линии любого вида, хорошо известных специалисту в данной области. Примеры клеток и типов клеток включают, но не ограничиваются ими, клетки человека, культивируемые клетки мыши, культивируемые клетки крысы или клетки яичника китайского хомяка ("CHO").
Конструкции репортерного гена, используемые в анализах на основе репортерного гена, описанных в настоящем документе, могут содержать кодирующую область репортерного гена и преждевременный стоп-кодон, который приводит к преждевременной терминации трансляции и/или опосредуемому нонсенс-кодоном разрушению мРНК.
Предпочтительно преждевременный стоп-кодон находится со стороны N-конца относительно нативного стоп-кодона репортерного гена и расположен так, что супрессия преждевременного стоп-кодона легко поддается определению. В конкретном варианте осуществления конструкция репортерного гена, используемая в анализах на основе репортерного гена, описанных в настоящем документе, содержит кодирующую область репортерного гена, содержащую преждевременный стоп-кодон на расстоянии, по меньшей мере, 15 нуклеотидов, предпочтительно от 25 до 50 нуклеотидов, от 50 до 75 нуклеотидов, от 75 до 100 нуклеотидов, от 100 до 300 нуклеотидов, от 100 до 500 нуклеотидов, от 100 до 750 нуклеотидов или от 100 до 1000 нуклеотидов от инициирующего кодона в открытой рамке считывания репортерного гена. В другом варианте осуществления конструкция репортерного гена, используемая в анализах на основе репортерного гена, описанных в настоящем документе, содержит кодирующую область репортерного гена, содержащего преждевременный стоп-кодон на расстоянии, по меньшей мере, 15 нуклеотидов, предпочтительно от 25 до 50 нуклеотидов, от 50 до 75 нуклеотидов, от 75 до 100 нуклеотидов, от 100 до 150 нуклеотидов, от 150 до 300 нуклеотидов, от 300 до 500 нуклеотидов, от 500 до 750 нуклеотидов или от 500 до 1000 нуклеотидов от нативного стоп-кодона в открытой рамке считывания репортерного гена. В другом варианте осуществления конструкция репортерного гена, используемая в анализах на основе репортерного гена, описанных в настоящем документе, содержит кодирующую область репортерного гена, содержащую преждевременный стоп-кодон UAG и/или UGA. В другом варианте осуществления конструкция репортерного гена, используемая в анализах на основе репортерного гена, описанных в настоящем документе, содержит кодирующую область репортерного гена, содержащую преждевременный стоп-кодон в последовательности UGAA, UGAC, UGAG, UGAU, UAGA, UAGC, UAGG, UAGU, UAAA, UAAC, UAAG или UAAU.
В конструкциях репортерного гена, описанных в настоящем документе, можно использовать любой репортерный ген, хорошо известный специалисту в данной области. Репортерные гены можно получать и нуклеотидную последовательность элементов можно определять любым способом, хорошо известным специалисту в данной области. Нуклеотидную последовательность репортерного гена можно получить, например, из литературы или из базы данных, такой как GenBank. Альтернативно, полинуклеотид, кодирующий репортерный ген, можно получать из нуклеиновой кислоты из пригодного источника. После определения нуклеотидной последовательности репортерного гена нуклеотидную последовательность репортерного гена можно подвергать манипулированию с использованием способов манипулирования с нуклеотидными последовательностями, хорошо известных в данной области, например способов рекомбинантных ДНК, сайт-направленного мутагенеза, ПЦР и т.д. (см., например, способы, описанные в Sambrook et al., 1990, Molecular Cloning, A Laboratory Manual, 2d Ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, NY и Ausubel et al., eds., 1998, Current Protocols in Molecular Biology, John Wiley & Sons, NY, обе из которых включены в настоящий документ в качестве ссылок в полном объеме), для получения репортерных генов, имеющих отличающуюся аминокислотную последовательность, например, для внесения аминокислотных замен, делеций и/или вставок.
В конкретном варианте осуществления репортерный ген представляет собой любой встречающийся в природе ген с преждевременным стоп-кодоном. Гены с преждевременными стоп-кодонами, которые пригодны в настоящем изобретении, включают, но не ограничиваются ими, гены, описанные в настоящем документе. В альтернативном варианте осуществления репортерный ген представляет собой любой ген, о котором известно, что в природных условиях он содержит преждевременный стоп-кодон. Примеры репортерных генов включают, но не ограничиваются ими, ген, кодирующий люциферазу жука-светляка, ген, кодирующий люциферазу renilla, ген, кодирующий люциферазу жуков-щелкунов, ген, кодирующий зеленый флуоресцентный белок, ген, кодирующий желтый флуоресцентный белок, ген, кодирующий красный флуоресцентный белок, ген, кодирующий голубой флуоресцентный белок, ген, кодирующий синий флуоресцентный белок, ген, кодирующий бета-галактозидазу, ген, кодирующий бета-глюкуронидазу, ген, кодирующий бета-лактамазу, ген, кодирующий хлорамфениколацетилтрансферазу, и ген, кодирующий щелочную фосфатазу.
Соединения, используемые в способах анализа, описанных в настоящем документе, могут быть членами библиотеки соединений. В одном варианте осуществления соединение выбирают из комбинаторной библиотеки соединений, включающей пептоиды; случайные биоолигомеры; диверсомеры, такие как гидантоины, бензодиазепины и дипептиды; винилогические полипептиды; непептидные пептидомиметики; олигокарбаматы; пептидилфосфонаты; библиотеки пептидных нуклеиновых кислот; библиотеки антител; библиотеки углеводов и библиотеки низкомолекулярных органических соединений. В конкретном варианте осуществления библиотеки низкомолекулярных органических соединений представляют собой библиотеки бензодиазепинов, изопреноидов, тиазолидинонов, метатиазанонов, пирролидинов, морфолиносоединений или диазепиндионов.
В определенных вариантах осуществления соединения подвергают скринингу в пулах. После идентификации положительного пула отдельные соединения пула тестируют по отдельности. В определенных вариантах осуществления размер пула составляет, по меньшей мере, 2, по меньшей мере, 5, по меньшей мере, 10, по меньшей мере, 25, по меньшей мере, 50, по меньшей мере, 75, по меньшей мере, 100, по меньшей мере, 150, по меньшей мере, 200, по меньшей мере, 250 или, по меньшей мере, 500 соединений.
Для измерения экспрессии функционального белка с "прочитанным" терминатором, продуцированного в соответствии с этим изобретением, можно использовать любой способ измерения экспрессии белка, известный в данной области. Неограничивающие примеры таких способов включают иммунологические анализы, такие как вестерн-блот, иммунопреципитация с последующим электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE), иммуноцитохимия, радиоиммунные анализы, ELISA (твердофазный иммуноферментный анализ), "сэндвич"-иммунологические анализы, анализы иммунопреципитации, реакции с преципитином, реакции диффузии в геле с преципитином, анализы иммунодиффузии, анализы агглютинации, анализы фиксации комплемента, иммунорадиометрические анализы, флуоресцентные иммунологические анализы, иммунологические анализы с белком A и эпитопным маркером с использованием антитела, специфичного к полипептиду, кодируемому представляющий интерес ген. В конкретном варианте осуществления антитело, используемое в иммунологическом анализе, является специфичным к C-концевой части полипептида, используемого в иммунологического анализе. Такие анализы являются общепринятыми и хорошо известны в данной области (см., например, Ausubel et al., eds, 1994, Current Protocols in Molecular Biology, Vol. 1, John Wiley & Sons, Inc., New York, которая включена в настоящий документ в качестве ссылки в полном объеме). Иллюстративные иммунологические анализы кратко описаны ниже (но не предназначены для ограничения).
Протоколы иммунопреципитации, как правило, включают лизис популяции клеток в буфере для лизиса, таком как буфер RIPA (1% NP-40 или Triton X-100, 1% натрий дезоксихолат, 0,1% SDS, 0,15M NaCl, 0,01M фосфат натрия при pH 7,2, 1% тразилол), дополненный фосфатазой белков и/или ингибиторами протеаз (например, ЭДТА, PMSF, апротинином, ванадатом натрия), добавление к клеточному лизату антитела, которое распознает антиген, инкубацию в течение периода времени (например, от 1 до 4 часов) при 40°C, добавление к клеточному лизату гранул сефарозы с белком A и/или белком G, инкубацию в течение приблизительно часа или более при 40°C, промывание гранул в буфере для лизиса и ресуспендирование гранул в SDS/буфере для образцов. Способность антитела вызывать иммунопреципитацию конкретного антигена можно оценивать, например, вестерн-блот анализом. Специалист в данной области знаком с параметрами, которые можно модифицировать для повышения связывания антитела с антигеном и снижения фона (например, предварительная очистка клеточного лизата гранулами сефарозы). Для дальнейших сведений, касающихся протоколов иммунопреципитации, см., например, Ausubel et al., eds, 2003, Current Protocols in Molecular Biology, Vol. 1, John Wiley & Sons, Inc., New York, 10 глава.
Вестерн-блот анализ, как правило, включает получение образцов белка, электрофорез образцов белка в полиакриламидном геле (например, 8%-20% SDS-PAGE, в зависимости от молекулярной массы антигена), перенос образца белка из полиакриламидного геля на мембрану, такую как нитроцеллюлоза, PVDF или нейлон, блокирование мембраны в блокирующем растворе (например, PBS с 3% BSA или обезжиренным молоком), промывание мембраны в буфере для промывания (например, PBS-Tween 20), блокирование мембраны первичным антителом (антителом, которое распознает антиген), разбавленном в блокирующем буфере, промывание мембраны в буфере для промывания, блокирование мембраны вторичным антителом (которое распознает первичное антитело, например, антитело против антител человека), конъюгированным с субстратом фермента (например, пероксидазы хрена или щелочной фосфатазы) или радиоактивной молекулой (например, 32P или 125I), разбавленной в блокирующем буфере, промывание мембраны буфером для промывания, и детекцию наличия антигена. Специалист в данной области знаком с параметрами, которые можно модифицировать для повышения детектируемого сигнала и для снижения фоновых шумов. Для дальнейших сведений, касающихся протоколов вестерн-блот анализа, см., например, Ausubel et al., eds, 2003, Current Protocols in Molecular Biology, Vol. 1, John Wiley & Sons, Inc., New York, глава 10.
ELISA включает получение антигена, нанесение антигена на лунки 96-луночного микропланшета для титрования, добавление первичного антитела (которое распознает антиген), конъюгированного с поддающимся детекции соединением, таким как субстрат фермента (например, пероксидазы хрена или щелочной фосфатазы) в лунку и инкубацию в течение определенного периода времени, и детекцию наличия антигена. В ELISA, представляющее интерес антитело не должно быть конъюгировано с поддающимся детекции соединением; вместо этого, в лунку можно добавлять второе антитело (которое распознает первичное антитело), конъюгированное с поддающимся детекции соединением. Кроме того, вместо нанесения на лунку антигена, на лунку можно наносить антитело. В этом случае после добавления представляющего интерес соединения в покрытую лунку можно добавлять второе антитело, конъюгированное с поддающимся детекции соединением. Специалист в данной области знаком с параметрами, которые можно модифицировать для повышения детектируемого сигнала, а также с другими вариантами ELISA, известными в данной области. Для дальнейших сведений, касающихся ELISA, см., например, Ausubel et al., eds, 2003, Current Protocols in Molecular Biology, Vol. 1, John Wiley & Sons, Inc., New York.
Способы детекции активности функционального белка с "прочитанным" терминатором, кодируемого репортерным геном, содержащим нонсенс-мутацию, будут варьировать в зависимости от используемого репортерного гена. Анализы различных репортерных генов хорошо известны специалисту в данной области. Например, люцифераза, бета-галактозидаза ("beta-gal"), бета-глюкуронидаза ("GUS"), бета-лактамаза, хлорамфениколацетилтрансфераза ("CAT") и щелочная фосфатаза ("AP") являются ферментами, которые можно анализировать в присутствии субстрата и которые пригодны для высокопроизводительного скрининга. Например, продукты реакции люциферазы, бета-галактозидазы ("beta-gal") и щелочной фосфатазы ("AP") анализируют по изменениям при оптической визуализации (например, люцифераза), спектрофотометрического поглощения (например, beta-gal), или флуоресценции (например, AP). Анализы изменений выходного оптического сигнала, поглощения и/или флуоресценции легко адаптировать для высокопроизводительного скрининга. Например, активность beta-gal можно измерять с помощью устройства для считывания микропланшетов. Активность зеленого флуоресцентного белка ("GFP") можно измерять по изменениям флуоресценции. Например, в случае мутантных GFP, которые флюоресцируют при 488 нм, в целях разделения клеток на основе активности GFP можно использовать стандартное оборудование для активированной флуоресценцией сортировки клеток ("FACS").
Ниже описан конкретный пример клеточного анализа с репортерным геном: получают репортерную конструкцию, которая обеспечивает возможность количественной оценки уровня прохождения считывания в трансляции на основе опосредуемой люциферазой хемолюминесценции. Клетки (например, клетки HEK 293), выращенные в среде (например, среде, содержащей эмбриональную телячью сыворотку (FBS)), стабильно трансфицируют геном люциферазы североамериканского жука-светляка, содержащим преждевременный терминирующий кодон в аминокислотном положении 190. Вместо кодона треонина (аденозин-цитидин-аденозин (ACA)), в норме находящемся в этом участке, посредством сайт-направленного мутагенеза вносят каждый из 3 возможных нонсенс-кодонов (UAA, UAG, или UGA) и каждый из 4 возможных нуклеотидов (C, U, A, G) в контекстуально важном расположенном ниже положении +1 после нонсенс-кодона. На фигуре 1 представлена диаграмма нескольких типов мРНК люциферазы, включенной в эти конструкции. К клеткам добавляют различные концентрации представляющего интерес соединения, положительный контроль (например, гентамицин), или отрицательный контроль (например, растворитель отдельно (например, PBS, DMSO или воду)) и приблизительно через четыре часа определяют величину люминесценции. Люминесценцию определяют с использованием устройства для визуализации ViewLux CCD (Perkin-Elmer, Turku, Finland). Данные люминесценции нормализуют к данным, полученным с помощью растворителя отдельно, и вычисляют кратность супрессии по сравнению с фоном как соединениесветовые единицы/растворительсветовые единицы.
В контрольных клетках (обработанных только растворителем) трансляция гена люциферазы прекращается при наличии преждевременного стоп-кодона в мРНК люциферазы, и продуцируется укороченный нефункциональный функциональный белок люциферазы, который не может эффективно катализировать реакцию хемолюминесценции. Однако в присутствии соединений, которые способны индуцировать прохождение считывания в рибосомах через преждевременный терминирующий кодон, продуцируется полноразмерный белок люциферазы, и соответствующую люминесценцию относительно контроля можно количественно определить.
Ниже описан конкретный пример бесклеточного анализа с репортерным геном: получают мРНК люциферазы, обладающую преждевременным терминирующим кодоном в положении 190 (с +1A) с использованием набора для транскрипции с промотора T7 in vitro MegaScript (Ambion, Austin, TX). мРНК инкубируют с цитоплазматическим экстрактом, полученным из клеток (например, клеток HeLa), который содержит рибосомы и другие клеточные факторы, необходимые для трансляции. В реакционную смесь in vitro добавляют различные концентрации представляющего интерес соединения, положительный контроль (т.е. соединение с активностью в отношении супрессии нонсенс-кодона) или отрицательный контроль (например, растворитель отдельно (например, PBS, DMSO или воду)), и величину полученной люминесценции определяют приблизительно через 4 часа. Люминесценцию определяют с использованием устройства для визуализации ViewLux CCD (Perkin-Elmer, Turku, Finland). Данные люминесценции нормализуют к данным, полученным с помощью растворителя отдельно, и вычисляют кратность супрессии по сравнению с фоном как соединениесветовые единицы/растворительсветовые единицы.
В контрольных клетках (обработанных только растворителем), трансляция гена люциферазы прекращается при наличии преждевременного стоп-кодона в мРНК люциферазы, и продуцируется укороченный нефункциональный белок люциферазы, который не может эффективно катализировать реакцию хемолюминесценции. Однако в присутствии соединений, которые способны индуцировать прохождение считывание в рибосомах через преждевременный терминирующий кодон, продуцируется полноразмерный белок люциферазы, и соответствующую люминесценцию относительно контроля можно количественно определить. Соединение, которое способно индуцировать продукцию полноразмерного белка люциферазы в цитоплазматическом экстракте, который не содержит ядро, указывает на то, что активность соединения в отношения прохождения считывания через нонсенс-кодон возникает на уровне трансляции, а не транскрипции.
Активность соединения в отношении супрессии нонсенс-кодона можно оценивать в клетках от субъекта или из модели на животных, содержащих ген с нонсенс-мутацией, имеющей отношение к заболеванием у человека, например, таких как клетки из мышей mdx. Мыши mdx обладают нонсенс-мутацией в 23 экзоне гена дистрофина, которая приводит к преждевременному UAA (+1A) стоп-кодону в мРНК дистрофина (Sicinski et al., Science 244: 1578-1580 (1989)) и обеспечивают практически полную потерю продукции полноразмерного белка.
Ниже описан конкретный пример анализа с репортерным геном с использованием клеток из модели на животных, содержащих ген с нонсенс-мутацией, связанной с заболеванием человека: Первичные миобласты получают из новорожденных мышей mdx в возрасте 1 суток с использованием общепринятых способов (Neville et al., (eds), Methods in Cell Biology, volume 52, pages 85-116, San Diego, Academic Press (1998); и Barton-Davis et al., J. Clin. Invest. 104(4): 375-381 (1999)). После прикрепления к пластмассовым чашкам клеткам дают возможность дифференцироваться в мышечные трубки в содержащей сыворотку среде, в которую добавляют представляющее интерес соединение или положительный контроль (т.e. соединение, обладающее активностью в отношении супрессии нонсенс-кодона). Среду и соединение пополняют раз в двое суток и через 12 суток клетки анализируют в отношении дистрофина и миозина посредством иммунофлуоресценции. Соответствующие отрицательный и положительный контроли включали необработанные культуры первичных мышц мышей mdx и C57/B16 дикого типа. Степень окрашивания оценивали с использованием полуколичественной шкалы +1, +2, +3 и +4. Представляющее интерес соединение, которое обладает активностью в отношении супрессии нонсенс-кодона, приведет к продукции полноразмерного дистрофина.
Для подтверждения активности соединения, идентифицированного в анализе с репортером, в отношении супрессии нонсенс-кодона можно использовать модельную систему на животных. Например, активность соединения в отношении супрессии нонсенс-кодона можно оценивать у мышей mdx или в модели на мышах CFTR. См., например, международную публикацию No. WO 2004/001010, которая включена в качестве ссылки в полном объеме для других примеров модельных систем на животных для заболеваний человека.
В конкретном примере: мышам mdx вводят представляющее интерес соединение, положительный контроль (т.е. соединение с активностью в отношении супрессии нонсенс-кодона) или отрицательный контроль (например, носитель отдельно) в течение от 2 до 12 или более недель. Всех мышей кормят изотоничным жидким элементным рационом Peptamen® (Nestlé, активность CK в сыворотке оценивали с использованием коммерчески доступного NADH-связанного кинетического анализа (Diagnostic Chemicals Limited, Oxford, CT). Кровь для измерения креатинкиназы (CK) сыворотки собирают через различные промежутки времени. В конце периодов введения мышей умерщвляют. Для оценки уровней CK в сыворотке собирают кровь. Передние большеберцовые (TA) мышцы и длинные разгибающие мышцы стопы (EDL) извлекают для последующего анализа. TA быстро замораживают для флуоресцентого анализа включения дистрофина в поперечно-полосатые мышцы. EDL используют для функциональных тестов, включая силу и чувствительность к повреждению эксцентрическим сжатием.
Первичное антитело к дистрофину представляет собой коммерчески доступное поликлональное антитело кролика, полученное против синтетического пептида, соответствующего последовательности вблизи C-конца дистрофина человека (Abcam 15277). Антитело перекрестно реагирует с дистрофином мыши. Эпитоп расположен ниже (ближе к C-концу белка дистрофина), чем участок преждевременного стоп-кодона, кодируемый экзоном 23 гена дистрофина у мыши mdx. Изображения получают с использованием цифровой камеры, присоединенной к эпифлуоресцентному микроскопу, и анализируют с помощью программного обеспечения для анализа изображений.
Механику выделенной цельной мышцы анализируют на мышцах EDL (включая обе мышцы EDL у животных, из которых можно получить билатеральные препараты) с использованием устройства, разработанного для этой цели (Barton-Davis et al., PNAS USA 95(26): 15603-15607 (1998)). Анализируют удельную силу (силу на единицу площади поперечного среза) EDL. Оценивают защиту от механического повреждения, индуцируемого серией из 5 эксцентрических сокращений с 10% вытягиванием оптимальной длины; повреждение определяют как процентное снижение силы между первым и последним эксцентрическим сокращением.
Активность CK в сыворотке оценивают с использованием коммерчески доступного NADH-связанного кинетического анализа (Diagnostic Chemicals Ltd., Oxford, CT).
Мыши mdx, которым ввели соединение с активностью в отношении супрессии нонсенс-кодона, покажут значительное окрашивание дистрофина по сравнению с мышцами из мышей mdx, которым не проводили введение. Мыши mdx, которым ввели соединение с активностью в отношении супрессии нонсенс-кодона, также будут обладать повышенной средней удельной силой EDL относительно средней силы EDL мышей mdx, которым не проводили введение, или контрольных мышей mdx, которым вводили носитель. Мыши mdx, которым ввели соединение с активностью в отношении супрессии нонсенс-кодона, также будут защищены против повреждения экцентрическим сжатием. Кроме того, мыши mdx, которым ввели соединение с активностью в отношении супрессии нонсенс-кодона, будут обладать сниженным CK сыворотки относительно мышей mdx, которым не проводили введение, или контрольных мышей mdx, которым вводили носитель.
В другом конкретном примере: для оценки эффекта представляющего интерес соединения на супрессию нонсенс-кодона мышам cftr-/-FABP-hCFTR-G542X вводят в течение недели или более соединение, отрицательный контроль или положительный контроль. Группа отрицательного контроля включает мышей cftr-/-FABP-hCFTR-G542X, которым не проводили введение. Группа положительного контроля включает мышей cftr-/-FABP-HCFTR-G542X, которым вводили соединение, о котором известно, что оно обладает активностью в отношении супрессии нонсенс-кодона. Для того чтобы показать продукцию CFTR проводят CFTR-специфичное иммунофлуоресцентное окрашивание на срезах двенадцатиперстной кишки. Также можно оценивать функциональные эффекты представляющего интерес соединения на опосредуемое CFTR трансэпителиальное прохождение хлорида. Соединение с активностью в отношении супрессии нонсенс-кодона приведет к положительному по CFTR иммунофлуоресцентному окрашиванию, локализованному в апикальной области эпителия подслизистых желез двенадцатиперстной кишки. Также, соединение с активностью в отношении супрессии нонсенс-мутации приведет к значительному повышению трансэпителиального прохождения хлорида после добавления форсколина для повышения уровня циклического аденозинмонофосфата (cAMP).
После идентификации соединения, которое обеспечивает супрессию преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК, структуру соединения можно определить с использованием хорошо известных способов или с помощью предварительно определенного кода. Например, структуру соединения можно определить с помощью масс-спектроскопии, ЯМР, колебательной спектроскопии или рентгеновской кристаллографии.
Для оценки того, опосредуется ли часть эффекта соединения в анализе с репортером, описанном в настоящем документе, через изменения в уровнях мРНК репортерного гена, используют ПЦР с обратной транскрипцией с детекцией в реальном времени (Bustin, J. Mol. Endocrinol. 25(2): 169-193 (2000)). Клетки (например, клетки HEK 293), выращенные на среде (например, среде, содержащей FBS), обрабатывают высокой концентрацией представляющего интерес соединения в течение 48 часов. Также эксперимент включает клетки отрицательного контроля (обработанные только растворителем) и клетки положительного контроля (обработанные соединением, для которого было показано ранее, что оно стабилизирует содержащие нонсенс-мутацию мРНК). Из клеточных лизатов экстрагируют тотальную РНК. Количественную ПЦР с детекцией в реальном времени проводят с использованием праймеров для мРНК репортерного гена и для рибосомальной РНК (рРНК) 18S. Уровни мРНК репортерного гена для обработанных клеток относительно контрольных клеток вычисляют с использованием измерения рРНК 18S в качестве коэффициента нормализации по количеству исходного материала.
Химический футпринтинг можно использовать для картирования участков взаимодействия представляющего интерес соединения рРНК. В этих клетках рибосомы, полученные из клеток (например, клеток HeLa), инкубируют с контролями в виде носителя или представляющим интерес соединением, а затем обрабатывают 2 химическими модифицирующими средствами (либо диметилсульфатом, либо кетоксалем), которые изменяют структуру рРНК. После реакции химической модификации рРНК выделяют и проводят анализ удлинения праймера с использованием меченных на конце олигонуклеотидов, которые гибридизуются с различными участками 28S, 18S и 5,8S рРНК человека. Продукты удлинения праймеров разделяют на 6% полиакриламидных гелях. Доступность рРНК для химической модификации посредством диметилсульфата или кетоксаля визуализируют как появление, исчезновение или изменение интенсивности полос на геле; любое из этих событий считают признаком потенциального эффекта соединения в конкретных участках рРНК. Появление полосы на геле согласуется с вновь индуцируемой доступностью для химического модифицирующего средства (например, в результате взаимодействий соединений, которые вызывают конформационные изменения в рРНК). В противоположность этому, исчезновение полосы согласуется со вновь индуцированной недоступностью химического модифицирующего средства (например, вследствие защиты участка благодаря связыванию соединения или изменений в спаривании оснований в рРНК).
Специфичность представляющего интерес соединения в отношении его способности индуцировать специфичное рибосомальное прохождение считывания через преждевременный стоп-кодон и его неспособность индуцировать неспецифичное рибосомальное прохождение считывания через стоп-кодон можно оценивать in vitro. Например, люциферазный репортер можно связывать с дополнительным белком (например, белком CD40). CD40 представляет собой рецептор клеточной поверхности, экспрессируемый B-лимфоцитами и другими иммунными клетками; его мРНК обеспечивает пригодные 3'-UTR последовательности и белок обладает подходящим размером для детекции потенциальной элонгации белка посредством вестерн-блоттинга.
В этом анализе клетки (например, клетки HEK 293), выращенные в среде (например, среде, содержащей эмбриональную телячью сыворотку (FBS)), стабильно трансфицируют геном, кодирующим слитый белок люцифераза-CD40. Вместо кодона треонина (ACA), в норме присутствующего в положении 190 люциферазы, с помощью сайт-направленного мутагенеза вносят нонсенс-кодон UGA. Кроме того, 3'-UTR белка CD40 вносят ниже терминирующего кодона UAA люциферазы. Для каждой конструкции в целях упрощения очистки представляющих интерес белков из клеточных лизатов на 5'-конец гена люциферазы включают 6 аминокислот гистидина (6X-His). Кроме того, включают эпитопный маркер XpressTM для обеспечения выделения представляющих интерес белков во время вестерн-блот анализа.
Элементы мРНК, транскрибированной с этих конструкций, и ожидаемый выход при различных условиях и допущениях изображены на фигуре 2. В необработанных клетках должен наблюдаться только укороченный белок люциферазы (фигура 2A). В клетках, обработанных соединением с активностью в отношении супрессии нонсенс-кодона, которая включает специфичное прохождение считывания через нормальный стоп-кодон, должен образовываться как укороченный, так и полноразмерный белок люциферазы (фигура 2B). Если, однако, соединение обладает способностью индуцировать неспецифичное рибосомальное прохождение считывания через нормальный стоп-кодон, тогда можно ожидать прохождения считывания как через встроенный преждевременный стоп-кодон в положении 190, так и через нормальный стоп-кодон на конце ORF люциферазы. Это может привести к удлинению белка люциферазы на 84 аминокислоты, кодируемые 3'-UTR CD30, и посредством вестерн-блоттинга можно будет выявить увеличение молекулярной массы на 9 кДа (от 66 кДа до 75 кДа). Если это произошло, молекулярная масса конструкции будет повышена и будут продуцироваться все 3 белка (укороченный, люцифераза и люцифераза-CD40) (фигура 2C). В качестве маркеров получают дополнительные конструкции. Конструкция отрицательного контроля кодирует только мРНК полноразмерной люциферазы (фигура 2D). Конструкция отрицательного контроля кодирует только полноразмерную мРНК люциферазы (фигура 2D). Конструкция положительного контроля кодирует удлиненную мРНК люцифераза-CD40 и ее создают внесением смысловой (не стоп) мутации (CAA) на конце ORF люциферазы (фигура 2E).
Клетки обрабатывают представляющим интерес соединением в течение определенного периода времени (например, 72 часов), а затем получают клеточные лизаты. Клеточные лизаты смешивают с магнитными агарозными гранулами с заряженным никелем, разработанными для захвата маркированных посредством 6X-His белков. После стадии захвата белка белки разделяют на 12,5% полиакриламидном геле и проводят вестерн-блот анализ с использованием антитела против Xpress.
Более общий, но менее чувствительный и специфичный подход к теоретической проблеме неспецифичного прохождения через стоп-кодон можно проводить с использованием 2-мерного гель-электрофореза (O'Farrell, J. Biol. Chem. 250(10):4007-421 (1975)). Соединение, которое индуцирует рибосомальное прохождение считывания через нормальные стоп-кодоны, может приводить к аномально удлиненным белкам, с последующими сдвигами паттернов электрофоретической подвижности вследствие повышения молекулярной массы и/или изменений электрического заряда. В одном примере такого анализа дублированные образцы клеток (например, клеток HDEK 293), обладающих стоп-кодоном UGA (+1A) в 190 аминокислотном положении люциферазного репортера, обрабатывают представляющим интерес соединением или носителем в течение определенного периода времени (например, 48 часов). Аликвоты клеток оценивают в стандартном клеточном анализе с репортером для доказательства индуцируемого соединением рибосомального прохождения считывания люциферазы. Затем проводят 2-мерный электрофорез и компьютерный анализ с использованием программного обеспечения Phoretix.
Можно предпринимать более конкретный эксперимент, направленный на потенциал в отношении неспецифичного прохождения считывания через стоп-кодон в модели заболевания на животных, посредством оценки действия соединения на трансляцию единичной избыточной мРНК in vivo. Например, мышам mdx вводят каждые сутки в течение определенного периода времени (например, 28 суток) представляющее интерес соединение, положительный контроль или носитель, после чего от отдельных животных собирают мышечную ткань. Также анализируют мышцы из мышей C57/B10 дикого типа, которым не проводили введения. Также известно, что мРНК для β-тубулина (представленный в изобилии белок в мышцах мышей) имеет терминирующий кодон UAA (+1A) на конце ORF и второй находящийся в рамке считывания стоп-кодон UAA (+1A) ниже в ее 3'-UTR. Между этими 2 стоп-кодонами находится встроенная последовательность из 126 нуклеотидов, которая, теоретически, может кодировать удлинение из 42 аминокислот белка β-тубулина мыши. На фигуре 3 представлена схема мРНК β-тубулина. Если представляющее интерес соединение обладает способностью индуцировать неспецифичное рибосомальное прохождение считывания через стоп-кодоны, можно ожидать, что белок β-тубулина будет обладать увеличенным размером на ≥42 аминокислоты (~5 кДа) и что это изменение будет поддаваться детекции посредством вестерн-блоттинга.
Специфичность средства для супрессии нонсенс-кодона в отношении его способности индуцировать специфичное рибосомальное прохождение считывания через преждевременный стоп-кодон и его неспособность индуцировать неспецифичное прохождение считывания через нормальный стоп-кодон можно оценивать в биологических образцах от субъектов (в частности, людей), которым вводили средство для супрессии нонсенс-кодона. Например, можно получать образцы крови от субъектов (например, людей), которым вводили средство для супрессии нонсенс-кодона, непосредственно перед дозированием и в различные моменты времени (например, 2, 4, 6, 8, 12, 24, 48 и 72 часов) после дозирования. Образцы крови или образцы, полученные из образцов крови (например, PBMC и плазму, полученную от субъектов), можно объединять перед анализом. Например, образцы крови или образцы, полученные из образцов крови, субъекта одного пола в один момент времени можно перед анализом объединять. Альтернативно, образец крови или образец, полученный из образца крови, от каждого субъекта можно анализировать по отдельности.
Мононуклеарные клетки периферической крови (PBMC) и плазму разделяют, и, необязательно, перед применением их можно замораживать и хранить. PBMC и плазму наносят на полиакриламидные гели, оптимизированные для достижения максимального разделения между удлиненными прошедшими считывание белковыми продуктами, подвергают электрофорезу и переносят на нитроцеллюлозные мембраны (или другие соответствующие мембраны, например нейлоновые мембраны) для иммуноблоттинга. Белки, такие как C-реактивный белок (CRP), B2-микроглобулин и цистатин C, можно оценивать в отношении неспецифичного прохождения считывания через нормальные стоп-кодоны. В качестве контролей можно использовать белки дикого типа и соответствующие удлиненные белки. Иммуноблоттинг можно проводить с использованием первичного антитела, специфичного к оцениваемому белку, и вторичного антитела, специфичного к первичному антителу, содержащего конъюгаты пероксидазы хрена.
Субъекты, которым вводят средство для супрессии нонсенс-кодона, могут включать субъектов, о которых известно, что они обладают геном, содержащим нонсенс-мутацию, и в этих случаях продукцию функционального белка с "прочитанным" терминатором, кодируемого геном, можно использовать в качестве положительного контроля для специфичного прохождения считывания через нонсенс-кодоны. Субъекты, которым вводят средство для супрессии нонсенс-кодона, также могут включать субъектов, о которых не известно, что они имеют ген, содержащий нонсенс-мутацию. В этих случаях плазму от субъектов, которым ввели средство для супрессии нонсенс-кодона, можно добавлять в среды клеток (например, клеток HEK 293), стабильно трансфицированных репортерным геном, содержащим преждевременный стоп-кодон (например, репортерным геном жука-светляка, содержащим преждевременный стоп-кодон UGA в аминокислотном остатке 190), или инкубировать с клеточным экстрактом и репортерным геном, содержащим преждевременный стоп-кодон. Обработанные клетки, или обработанные клеточные экстракты, можно анализировать в отношении прохождения считывания через преждевременный стоп-кодон в качестве положительного контроля.
Токсичность и/или эффективность соединения, идентифицированного в соответствии с этим изобретением, можно определять стандартными фармацевтическими способами в клеточных культурах или у экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной в 50% популяции). Клетки и клеточные линии, которые можно использовать для оценки цитотоксичности соединения, идентифицированного в соответствии с этим изобретением, включают, но не ограничиваются ими, мононуклеарные клетки периферической крови (PBMC), клетки Caco-2 и клетки Huh7. Соотношение доз между токсическими и терапевтическими эффектами представляет собой терапевтический индекс и его можно выразить как соотношение LD50/ED50. Соединение, идентифицированное в соответствии с этим изобретением, которое обладает высокими терапевтическими индексами, является предпочтительным. Несмотря на то что можно использовать соединение, идентифицированное в соответствии с этим изобретением, которое обладает токсичными побочными эффектами, следует уделить внимание разработке системы для доставки, которая нацеливает такие средства в область пораженной ткани в целях минимизации потенциального повреждения неинфицированных клеток, и, таким образом, снижения побочных эффектов.
Данные, полученные из анализов клеточных культур и исследований на животных, можно использовать при изготовлении диапазона дозировок соединения, идентифицированного в соответствии с этим изобретением, для применения у человека. Дозировки таких средств предпочтительно находятся в диапазоне циркулирующих концентраций, которые включают ED50 с небольшой токсичностью или без нее. Дозировка может варьировать в этом диапазоне, в зависимости от используемой дозированной формы и применяемого способа введения. Для любого средства, используемого в способе по этому изобретению, терапевтически эффективную дозу можно первоначально оценивать из анализов в клеточных культурах. Дозу в моделях на животных можно изготавливать, чтобы она достигала диапазона концентраций в циркулирующей плазме, который включает IC50 (т.е. концентрацию соединения, которая обеспечивает половину максимального ингибирования симптомов), определенную в культуре клеток. Такую информацию можно использовать для более точного определения пригодных доз для человека. Уровни в плазме можно измерять, например, посредством высокоэффективной жидкостной хроматографии.
Конкретные примеры токсикологических анализов включают следующее.
Самцам и самкам мышей Sprague-Dawley вводят носитель или различные дозы идентифицированного соединения раз в сутки в течение определенного периода времени (например, 28 суток). Введение нескольким крысам/пол/группа прекращают через определенное количество суток (например, 28 суток), нескольким другим крысам/пол/группа введение продолжают в течение дополнительного периода восстановления (например, периода восстановления, составляющего 4 недели) после периода дозирования, и других крыс/пол/группа используют для токсикологической оценки, в течение нескольких часов и суток после введения дозы (например, сутки 1 и 28 через 0,5, 1,5, 4, 8, 12 и 24 ч после введения дозы).
Самцам и самкам собак породы бигль вводят носитель или различные дозы идентифицированного соединения в течение определенного периода времени (например, 28 суток). Нескольким собакам/пол/группа введение прекращают после периода дозирования. Другим собакам/пол/группа введение продолжают в течение дополнительного периода восстановления (например, периода восстановления, составляющего 4 недели), и для токсикокинетики образцы собирают в течение часов и суток после введения дозы (например, на 1 и 28 сутки через 1, 2, 4, 8, 12, 16 и 24 ч после введения дозы).
Анализ доз проводят посредством ВЭЖХ для подтверждения того, что животным ввели намеченные дозы. Наблюдения внутри клетки проводят два раза в сутки и детальные клинические наблюдения и массу тела записывают раз в неделю. Определяют потребление пищи в течение периода введения. Перед введением и на последние сутки периода введения проводят офтальмоскопию и электрокардиографию (только у собак). Параметры гематологии, коагуляции, клинической биохимии и анализов мочи оценивают на исходном уровне (только у собак) и на последние сутки периода введения (у всех животных) и в период восстановления для животных с периодом восстановления. В конце введения или восстановления процедуры включают полное макроскопическое обследование при некропсии, извлечение и взвешивание органов, и фиксацию формалином сохраненных тканей для микроскопического анализа. Для анализов плазмы в отношении концентраций соединения используют ВЭЖХ и способ тандемной масс-спектроскопии, валидированные для каждого вида животных. Для оценки фармакокинетических параметров используют некомпартментные способы. Массу тела, потребление пищи, клиническую патологию и массу органов анализируют 1-сторонним вариационным анализом (ANOVA), и попарные сравнения каждой дозы с контролем проводят с помощью критерия Даннета.
В предпочтительном варианте осуществления средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, индуцирует специфичное рибосомальное прохождение считывание через преждевременный стоп-кодон, но не индуцирует неспецифичное прохождение считывания через нормальный стоп-кодон. Для оценки специфичного рибосомального прохождения считывания через преждевременный стоп-кодон посредством представляющего интерес соединения можно проводить анализы, известные в данной области или описанные в настоящем документе.
Средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, может взаимодействовать с 28S рРНК, 18S рРНК и/или 5,8S рРНК. В определенных вариантах осуществления средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, связывается с 28S рРНК. В других вариантах осуществления средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, не связывается с 18S рРНК. В некоторых вариантах осуществления средство для супрессии нонсенс-кодона связывается с рРНК непрямо через взаимодействие с другим белком. В некоторых других вариантах осуществления средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, не проявляет значительную антибактериальную активность против грамотрицательного микроорганизма и/или грамположительного микроорганизма. В предпочтительном варианте осуществления средство для супрессии нонсенс-кодона, используемое в соответствии с этим изобретением, обладает небольшими (при их наличии) неблагоприятными или нежелательными побочными эффектами при системном введении (например, пероральном) субъекту (предпочтительно, человеку). В конкретном варианте осуществления средство для супрессии нонсенс-кодона не вызывает почечную недостаточность и/или проблемы со слухом (например, потерю слуха) при пероральном введении субъекту (предпочтительно человеку).
5.5 ФУНКЦИОНАЛЬНЫЕ БЕЛКИ С "ПРОЧИТАННЫМ" ТЕРМИНАТОРОМ
Настоящее изобретение относится к функциональному белку(ам) с "прочитанным" терминатором, кодируемому последовательностью нуклеиновой кислоты, содержащей нонсенс-мутацию, при этом белок (белки) продуцируют способами, описанными в настоящем документе. В определенных вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором представляет собой функциональный белок не дикого типа. В конкретных вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором представляет собой полноразмерный белок не дикого типа. В других вариантах осуществления функциональный белок с "прочитанным" терминатором состоит из той же аминокислотной последовательности, что и соответствующий белок дикого типа.
Настоящее изобретение относится функциональному белку(ам) с "прочитанным" терминатором, кодируемому последовательностью нуклеиновой кислоты, содержащей мутацию (например, делецию, вставку и/или замену), которая приводит к отличающемуся стоп-кодону в РНК, транскрибируемой с последовательности нуклеиновой кислоты, относительно стоп-кодона, находящегося в РНК, кодирующей соответствующий белок дикого типа. В определенных вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором представляет собой функциональный белок не дикого типа. В конкретных вариантах осуществления функциональный белок с "прочитанным" терминатором представляет собой полноразмерный белок не дикого типа.
В конкретном варианте осуществления настоящее изобретение относится к способам продукции функционального белка с "прочитанным" терминатором, кодируемого последовательностью нуклеиновой кислоты, содержащей мутацию (например, делецию, вставку и/или замену), которая приводит к отличающемуся стоп-кодону в РНК, транскрибируемой с последовательности нуклеиновой кислоты, относительно нормального стоп-кодона (т.е. стоп-кодона, находящегося в РНК, кодирующей соответствующий белок дикого типа), при этом способы включают контактирование клетки, содержащей последовательность нуклеиновой кислоты со средством для супрессии нонсенс-кодона. Альтернативно способы включают контактирование бесклеточного экстракта с нуклеиновой кислотой и средством для супрессии нонсенс-кодона. В другом варианте осуществления настоящее изобретение относится к способам продукции функционального белка с "прочитанным" терминатором, кодируемого геном, содержащим мутацию (например, делецию, вставку и/или замену), которая приводит к отличающемуся стоп-кодону в РНК, транскрибируемой с гена, относительно нормального стоп-кодона (т.е. стоп-кодона, находящегося в РНК, кодирующей соответствующий белок дикого типа), при этом способы включают введение субъекту (предпочтительно человеку), нуждающемуся в этом, эффективного количества средства для супрессии нонсенс-кодона. В соответствии с этими вариантами осуществления средство для супрессии нонсенс-кодона проходит считывание через отличающийся стоп-кодон до второго стоп-кодона с образованием функционального белка с "прочитанным" терминатором.
В конкретном варианте осуществления настоящее изобретение относится к способам продукции функционального белка с "прочитанным" терминатором, кодируемого геном(ами), содержащим нонсенс-мутацию в кодирующей области гена(ов), при этом способы включают контактирование клетки, содержащей ген(ы) со средством для супрессии нонсенс-кодона. В другом варианте осуществления настоящее изобретение относится к способам продукции функционального белка с "прочитанным" терминатором, кодируемого геном(ами), содержащим нонсенс-мутацию в кодирующей области гена(ов), при этом способы включают введение субъекту (предпочтительно человеку), нуждающемуся в этом, эффективного количества средства для супрессии нонсенс-кодона. В определенных вариантах осуществления субъект имеет заболевание, обусловленное нонсенс-мутацией в гене(ах), или является предрасположенным или восприимчивым к нему.
В определенных вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором, продуцируемый в соответствии со способами по этому изобретению, находится в той же области в клетке, в которой находится соответствующий белок дикого типа. Например, в определенных вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором и соответствующий белок дикого типа находятся на поверхности клетки. В других вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором находится в отличающейся области в клетке относительно области, в которой находится соответствующий белок дикого типа. В конкретном варианте осуществления функциональный белок (белки) с "прочитанным" терминатором, продуцируемый в соответствии со способами по этому изобретению находится в ядре клетки, в то время как соответствующий белок дикого типа находится в цитоплазме или на поверхности клетки. В другом варианте осуществления функциональный белок (белки) с "прочитанным" терминатором, продуцируемый в соответствии со способами по этому изобретению, находится в цитоплазме или на поверхности клетки, в то время как соответствующий белок дикого типа находится в ядре. Локализацию функционального белка(ов) с "прочитанным" терминатором в/на клетке(ах) можно определять/выявлять с использованием способов, известных специалисту в данной области. В конкретном варианте осуществления локализацию функционального белка(ов) с "прочитанным" терминатором в/на клетке можно определять/выявлять посредством иммунофлуоресценции. В определенных вариантах осуществления для определения/выявления локализации функционального белка(ов) с "прочитанным" терминатором в/на клетке(ах) используют с следующий протокол иммунофлуоресценции:
1. Клетки регидратируют посредством PBS (например, в течение 5 минут) в сосудах Коплина.
2. Клетки блокируют преиммунной сывороткой мышей в течение определенного периода времени (например, 20 минут).
3. Наносят первичное антитело в течение определенного периода времени.
4. Предметные стекла промывают 2-5 раз в PBS, а затем инкубируют со вторичным антителом в течение определенного периода времени.
5. Ядра идентифицируют окрашиванием, например окрашиванием DAPI.
6. Клетки визуализируют на цифровом конфокальном флуоресцентном микроскопе, и изображения фиксируют, например, с помощью программного обеспечения IPLab Spectrum.
7. Окрашивание классифицируют/оценивают как (0) отсутствует, (1) перинуклеарное, (2) периферическое и (3) поверхностное.
8. Изображения фиксируют, например, на инвертационном эпифлуоресцентном микроскопе Olympyus 1X170, оборудованном шаговым двигателем, набором дисков со светофильтрами (Ludl Electronics Products, Hawthorne, NY), и комплектом светофильтров 83000 (Chroma Technology, Brattleboro, VT) и охлажденной камерой высокого разрешения с зарядовой связью SenSys (Photometries, Tucson, Az).
9. Проводят частичную обратную свертку изображений, например, с использованием программного обеспечения IPLab (Scanalytics, Fairfax, VA).
В конкретном варианте осуществления функциональный белок (белки) с "прочитанным" терминатором, продуцируемый в соответствии со способами по этому изобретению, представляет собой функциональный белок (белки) с "прочитанным" терминатором CFTR. В определенных вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором CFTR находится перинуклеарно, на периферии и/или на поверхности назальных клеток, как определяют/выявляют способами, известными в данной области, например посредством иммунофлуоресценции. В предпочтительном варианте осуществления функциональный белок с "прочитанным" терминатором CFTR находится на поверхности назальных клеток, как определяют/выявляют посредством иммунофлуоресценции. В конкретном примере количество функционального белка с "прочитанным" терминатором CFTR перинуклеарно, на периферии и/или на поверхности определяют/выявляют с помощью следующего протокола иммунофлуоресценции:
1. Назальные клетки регидратируют посредством PBS (например, в течение 5 минут) в сосудах Коплина.
2. Клетки блокируют преиммунной сывороткой мышей в течение определенного периода времени (например, 20 минут).
3. Первичное антитело (например, моноклональные антитело мыши против CFTR 24-1, направленное на 4 C-концевых аминокислоты полноразмерного CFTR) наносят, например, в разведении 1:100 в течение определенного периода времени (например, в течение двух часов).
4. Предметные стекла промывают три раза в PBS, а затем инкубируют со вторичным антителом (например, IgG козы против антител мыши, AlexaFluor 596, Molecular Probes, Portland, Oregon) в течение определенного периода времени (например, одного часа).
5. Ядра идентифицируют окрашиванием посредством DAPI.
6. Клетки визуализируют на цифровом конфокальном флуоресцентном микроскопе, и изображения фиксируют, например, с помощью программного обеспечения IPLab Spectrum.
7. Окрашивание классифицируют/оценивают как (0) отсутствует, (1) перинуклеарное, (2) периферическое и (3) поверхностное. В конкретном варианте осуществления оценивают и присваивают баллы, по меньшей мере, 50 эпителиальным клеткам из случайных областей каждого предметного стекла.
8. Изображения фиксируют, например, на инвертационном эпифлуоресцентном микроскопе Olympyus 1X170, оборудованном шаговым двигателем, набором дисков со светофильтрами (Ludi Electronics Products, Hawthorne, NY), комплектом светофильтров 83000 (Chroma Technology, Brattleboro, VT) и охлажденной камерой высокого разрешения с зарядовой связью SenSys (Photometries, Tucson, Az).
9. Проводят частичную обратную свертку изображений, например, с использованием программного обеспечения IPLab (Scanalytics, Fairfax, VA).
В определенных вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором, продуцируемый в соответствии со способами по этому изобретению, отличается от соответствующего белка(ов) дикого типа только в аминокислотном остатке в функциональном белке(ах) с "прочитанным" терминатором, который вставлен в положение, кодируемое преждевременным терминирующим кодоном. В других вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором, продуцируемый в соответствии со способами по этому изобретению, отличается от соответствующего белка(ов) дикого типа (i) в аминокислотном остатке функционального белка(ов) с "прочитанным" терминатором, который вставлен в положение, кодируемое преждевременным терминирующим кодоном; и (ii) в аминокислотном остатке(ах) функционального белка(ов) с "прочитанным" терминатором, отличном от аминокислотных остатков, кодируемых преждевременным терминирующим кодоном.
Аминокислотную последовательность функционального белка(ов) с "прочитанным" терминатором, продуцируемого способами по этому изобретению, можно определять секвенированием белка(ов), продуцируемого клеткой, содержащей представляющую интерес последовательность нуклеиновой кислоты (т.е. последовательность нуклеиновой кислоты, содержащую представляющую интерес нонсенс-мутацию(и)). В определенных вариантах осуществления клетка естественным образом содержит последовательность нуклеиновой кислоты. В конкретном варианте осуществления клетка представляет собой клетку от пациента, которому вводят или будут вводить средство(а) для супрессии нонсенс-кодона. В других вариантах осуществления клетка создана, чтобы она содержала последовательность нуклеиновой кислоты.
В определенных вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором, продуцируемый в соответствии со способами по этому изобретению, содержит тирозин, цистеин или триптофан в положении, которое соответствует нонсенс-кодону в РНК, с которой транслируется белок. В конкретных вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором, продуцируемый в соответствии со способами по этому изобретению, содержит тирозин в положении, которое соответствует нонсенс-кодону UAA или UAG в РНК, с которой транслируется белок. В других вариантах осуществления функциональный белок (белки) с "прочитанным" терминатором, продуцируемый в соответствии со способами по этому изобретению, содержит цистеин или триптофан в положении, которое соответствует нонсенс-кодону UGA в РНК, с которой транслируется белок.
В таблице 10 (см. в конце описания) представлен список заболеваний, обусловленных нонсенс-мутацией в гене(ах). В таблице представлено название гена, ассоциированного с заболеванием, регистрационный номер GenBank нуклеиновой кислоты, по меньшей мере, кодирующей области гена, регистрационный номер GenBank белка, кодируемого геном, репрезентативные нонсенс-мутации, находящиеся в гене, который ассоциирован с заболеванием, и ссылка(и), касающаяся ассоциации заболевания с нонсенс-мутацией в гене. В определенных вариантах осуществления функциональный белок с "прочитанным" терминатором, продуцируемый в соответствии со способами по этому изобретению, содержит аминокислотную последовательность соответствующего белка дикого типа, за исключением положения аминокислотного остатка, идентифицированного в таблице 10, где нонсенс-мутация в гене ассоциирована с заболеванием. В соответствии с этим вариантом осуществления аминокислотный остаток в этом положении представляет собой не 1 аминокислотный остаток, находящийся в соответствующем белке дикого типа, и представляет собой любой из остальных 19 аминокислотных остатков. Таким образом, например, в случае синдрома 3-M функциональный белок с "прочитанным" терминатором в положении 1445 может содержать любой другой аминокислотный остаток, за исключением аргинина.
5.6 ПОПУЛЯЦИИ ПАЦИЕНТОВ
5.6.1 Предпочтительные мишени и генетические профили
Способы и композиции по этому изобретению пригодны для профилактики, лечения и/или управлением течения у пациентов (например, эмбрионов, плодов, новорожденных (у человека от новорожденного до 1 года), детей (у человека от 1 года до 18 лет), взрослых (у человека от 18 лет и старше), и пожилых (у человека от 65 лет и старше)), которые имеют заболевание, обусловленное нонсенс-мутацией в гене, такое как заболевания, описанные в настоящем документе, или которые являются предрасположенными или восприимчивыми (например, вследствие факторов окружающей среды и/или генетических факторов) к нему. В одном варианте осуществления пациентом является ребенок или подросток (у человека от 5 лет до 13 лет). В другом варианте осуществления пациентом является пациент мужского пола. В конкретном варианте осуществления пациентом является мальчик или юноша (у человека от 5 до 13 лет). В конкретном варианте осуществления пациентом является мальчик или юноша (у человека от 5 до 13 лет), имеющий мышечную дистрофию (например, мышечную дистрофию Дюшенна). В другом варианте осуществления пациентом является пациент женского пола. В конкретном варианте осуществления пациентом является девочка или девушка (у человека от 5 до 13 лет).
В конкретном варианте осуществления способы и композиции по этому изобретению пригодны для лечения, профилактики и/или управления течением у эмбриона или плода, которые имеют заболевание, обусловленное нонсенс-мутацией в гене, такое как заболевания, описанные в настоящем документе, или которые являются предрасположенными или восприимчивыми к нему. В соответствии с этим вариантом осуществления беременной самке вводят средство для супрессии нонсенс-кодона, которое проходит через плаценту к эмбриону или плоду.
В таблице 10, представленной выше, представлен перечень заболеваний, обусловленных нонсенс-мутацией в гене, а также репрезентативные примеры нонсенс-мутаций в гене. В определенных вариантах осуществления пациенты, которым вводят средство(а) для супрессии нонсенс-кодона, представляют собой пациентов с заболеванием, приведенным в таблице в таблице 10, которые имеют одну или более из репрезентативных нонсенс-мутаций в гене, ассоциированных с заболеванием.
В определенных вариантах осуществления пациентам, которым вводят средство(а) для супрессии нонсенс-кодона в соответствии с этим изобретением, не проводили другую терапию в пределах последних нескольких суток, недели, 2 недель, месяца, 3 месяцев, 6 месяцев или 1 года. В конкретном варианте осуществления пациентам, которым вводят средство(а) для супрессии нонсенс-кодона в соответствии с этим изобретением, никогда не проводили другую терапию. В других вариантах осуществления пациентам, которым вводят средство(а) для супрессии нонсенс-кодона в соответствии с этим изобретением, проводили другую терапию в пределах последних нескольких минут, нескольких часов или нескольких суток.
Настоящее изобретение относится к введению средства (средств) для супрессии нонсенс-кодона в сочетании с другим типом терапии, таким как поддерживающая терапия и/или противосудорожное средство. Для кистозного фиброза примеры поддерживающих терапевтических средств включают заместительную терапию ферментами поджелудочной железы (например, липазой), муколитиками (например, дорназой-альфа), бронходилятаторами, кортикостероидами и антибиотиками. В случае мышечной дистрофии Дюшенна примеры поддерживающих терапевтических средств включают кортикостероиды и антибиотики. В конкретном варианте осуществления пациентам не вводят аминогликозид, оксазолидинон и/или хлорамфеникол в качестве антибиотика в сочетании со средством(ами) для супрессии нонсенс-кодона. В соответствии с этим вариантом осуществления средство(а) для супрессии нонсенс-кодона представляет собой не аминогликозид, оксазолидинон и/или хлорамфеникол.
В определенных вариантах осуществления пациенты, которым вводят средство(а) для супрессии нонсенс-кодона в соответствии с этим изобретением, являются рефрактерными к активности аминогликозида, оксазолидинона и/или хлорамфеникола в отношении супрессии нонсенс-кодона. В соответствии с этим вариантом осуществления пациентов, которые являются рефрактерными к таким средствам, можно определить, например, посредством контактирования клеток от такого пациента с аминогликозидом, оксазолидиноном или хлорамфениколом и измерения активности и/или экспрессии гена, ассоциированного с заболеванием, который содержит нонсенс-мутацию.
Способы и композиции по этому изобретению также пригодны для профилактики, лечения и/или управления течением у пациентов (например, эмбрионов, плодов, новорожденных (у человека от новорожденного до 1 года), детей (у человека от 1 года до 18 лет), взрослых (у человека от 18 лет и старше), и пожилых (у человека от 65 лет и старше)), которые имеют заболевание, обусловленное мутацией в гене, которая приводит к отличающемуся стоп-кодону в РНК, транскрибируемой с гена, относительно стоп-кодона, находящегося в РНК, кодирующей соответствующий белок дикого типа, или которые являются предрасположенными или восприимчивыми (например, вследствие факторов окружающей среды и/или генетических факторов) к нему. Неограничивающие примеры таких заболеваний включают спинальную мышечную атрофию и кистозный фиброз (например, кистозный фиброз вследствие мутации 3849 + 10 т.п.н. C→T в гене CFTR, которая обеспечивает вставку 84 пар оснований, которая происходит из области интрона 19, распознаваемого как экзон, и, при трансляции, вставка из 84 пар оснований приводит к пептиду из 28 аминокислот, который обладает нонсенс-мутацией UAA (Highsmith et al., New England Journal of Medicine 331(1):974 (1994)).
Кроме того, способы и композиции по этому изобретению пригодны для профилактики, лечения и/или управления течением у пациентов (например, эмбрионов, плодов, новорожденных (у человека от новорожденного до 1 года), детей (у человека от 1 года до 18 лет), взрослых (у человека от 18 лет и старше), и пожилых (у человека от 65 лет и старше)), которые имеют заболевание, при котором у пациентов не экспрессируется достаточное количество белка(ов), и/или у которых экспрессия конкретного белка(ов) может оказаться полезной, или которые являются предрасположенными или восприимчивыми (например, вследствие факторов окружающей среды и/или генетических факторов) к нему. Этим пациентам вводят, в качестве генной терапии (см. раздел 5.11 для методов генной терапии), последовательность нуклеиновой кислоты, содержащую нонсенс-мутацию(и) в кодирующей области (в определенных вариантах осуществления нонсенс-мутация находится в 5'-участке кодирующей области (например, в пределах первых 50, 75, 100, 125, 150, 175, 200, 225, 250, 300 или 350 аминокислоты от N-конца)), и введение средства для супрессии нонсенс-кодона осуществляет супрессию нонсенс-кодон в РНК, транскрибируемой с последовательности нуклеиновой кислоты, так что продуцируется функциональный белок с "прочитанным" терминатором, кодируемый последовательностью нуклеиновой кислоты. Введение средства для супрессии нонсенс-кодона позволяет регулировать количество продуцируемого функционального белка с "прочитанным" терминатором. Иными словами, в отсутствии средства (средств) для супрессии нонсен-кодона продуцируется небольшое количество поддающегося измерению функционального белка с "прочитанным" терминатором, или он не продуцируется, при определении, например, посредством иммунологического анализа, такого как ELISA. Продуцируемый функциональный белок с "прочитанным" терминатором соответствует белку дикого типа, который не экспрессируется на достаточном уровне у пациента и/или который оказывает благоприятное действие на пациента. Неограничивающие примеры популяций пациентов, на которых такая терапия может оказать благоприятное действие, включают пациентов со следующими нарушениями:
Конкретные примеры злокачественных опухолей, которые можно подвергать профилактике, лечению и/или управлению течением посредством способов, охватываемых этим изобретением, включают, но не ограничиваются ими, злокачественную опухоль головы, шеи, глаза, полости рта, глотки, пищевода, грудной клетки, кости, легкого, толстого кишечника, прямой кишки, желудка, предстательной железы, молочной железы, яичника, почки, печени, поджелудочной железы и головного мозга. Дополнительные злокачественные опухоли включают, но не ограничиваются ими, следующие: лейкозы, такие как, но не ограничиваясь ими, острый лейкоз, острый лимфоцитарный лейкоз, острые миелоцитарные лейкозы, такие как миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный лейкозы, эритролейкоз и миелодиспластический синдром, хронические лейкозы, такие как, но не ограничиваясь ими, хронический миелоцитарный (гранулоцитарный) лейкоз, хронический лимфоцитарный лейкоз, волосатоклеточный лейкоз; истинная полицитемия; лимфомы, такие как, но не ограничиваясь ими, болезнь Ходжкина, неходжкинская лимфома; множественные миеломы, такие как, но не ограничиваясь ими, вялотекущая множественная миелома, несекреторная миелома, остеосклеротическая миелома, плазмацитарный лейкоз, изолированная плазмацитома и экстрамедуллярная плазмацитома; макроглобулинемию Вальденстрема; моноклональную гаммапатию неопределенного значения; доброкачественную моноклональную гаммапатию; болезнь тяжелых цепей; рак кости и саркомы соединительной ткани, такие как, но не ограничиваясь ими, саркома кости, миеломная болезнь костей, остеосаркома, хондросаркома, саркома Юинга, болезнь Педжета костей, злокачественная гигантоклеточная опухоль, фибросаркома кости, хордома, периостальная саркома, саркомы мягких тканей, ангиосаркома (гемангиосаркома), фибросаркома, саркома Капоши, лейомиосаркома, липосаркома, лимфангиосаркома, неврилеммома, рабдомиосаркома, синовиальная саркома; опухоли головного мозга, такие как, но не ограничиваясь ими, глиома, астроцитома, глиома ствола головного мозга, эпендимома, олигоденроглиома, неглиальная опухоль, невринома слухового нерва, краниофарингиома, медуллобластома, менингиома, пинеоцитома, пинеобластома, первичная лимфома головного мозга; рак молочной железы, включая, но не ограничиваясь ими аденокарциному, долевую (мелкоклеточную) карциному, внутрипротоковую карциному, медуллярный рак молочной железы, муцинозный рак молочной железы, тубулярный рак молочной железы, папиллярный рак молочной железы, болезнь Педжета (включая ювенильную болезнь Педжета), и воспалительный рак молочной железы; злокачественную опухоль надпочечников, такую как, но не ограничиваясь ими, феохромацитома и карцинома надпочечников; рак щитовидной железы, такой как но не ограничиваясь ими, папиллярный или фолликулярный рак щитовидной железы, медуллярный рак щитовидной железы и анапластический рак щитовидной железы; рак поджелудочной железы, такой как, но не ограничиваясь ими, инсулинома, гастринома, глюкагонома, випома, секретирующая соматостатин опухоль и карциноид или опухоль островковых клеток; злокачественные опухоли гипофиза, такие как, но на ограничиваясь ими, болезнь Кушинга, секретирующая пролактин опухоль, акромегалия и несахарный диабет; злокачественные опухоли глаза, такие как, но не ограничиваясь ими, меланома глаза, такая как меланома радужной оболочки, хориоидальная меланома и меланома ресничного тела, и ретинобластома; злокачественные опухоли влагалища, такие как плоскоклеточная карцинома, аденокарцинома и меланома; рак наружных половых органов, такой как плоскоклеточная карцинома, меланома, аденокарцинома, базально-клеточная карцинома, саркома и болезнь Педжета; злокачественные опухоли шейки матки, такие как, но не ограничиваясь ими, плоскоклеточная карцинома и аденокарцинома; злокачественные опухоли тела матки, такие как но не ограничиваясь ими, карцинома эндометрия и карцинома матки; злокачественные опухоли яичника, такие как, но не ограничиваясь ими, карцинома эпителия яичника, пограничная опухоль, опухоль из половых клеток и стромальная опухоль; злокачественные опухоли пищевода, такие как но не ограничиваясь ими, плоскоклеточный рак, аденокарцинома, аденоидная кистозная карцинома, мукоэпидермоидная карцинома, плоскоклеточная аденокарцинома, саркома, меланома, плазмацитома, бородавчатый рак и овсяно-клеточная (мелкоклеточная) карцинома; злокачественные опухоли желудка, такие как, но не ограничиваясь ими, аденокарцинома, гранулирующая (полипоидная), с изъязвлениями, поверхностно распространяющаяся, диффузно распространяющаяся, злокачественная лимфома, липосаркома, фибросаркома и карциносаркома; злокачественные опухоли толстого кишечника; злокачественные опухоли прямой кишки; злокачественные опухоли желудка, такие как аденокарцинома, плоскоклеточная карцинома, карциноид, лимфома, стромальные опухоли желудка, и нейроэндокринные опухоли; злокачественные опухоли печени, такие как, но не ограничиваясь ими, печеночно-клеточная карцинома и гепатобластома, злокачественные опухоли желчного пузыря, такие как аденокарцинома; холангиокарциномы, такие как, но не ограничиваясь ими, папиллярная, узелковая и диффузная; злокачественные опухоли легкого, такие как немелкоклеточный рак легкого, плоскоклеточная карцинома (эпидермоидная карцинома), аденокарцинома, крупноклеточная карцинома и мелкоклеточный рак легкого; злокачественные опухоли яичка, такие как, но не ограничиваясь ими, опухоль из половых клеток, семинома, анапластическая, классическая (типичная), сперматоцитарная, несеминома, эмбриональная карцинома, тератомная карцинома, хориокарцинома (опухоль желточного мешка), злокачественные опухоли предстательной железы, такие как, но не ограничиваясь ими, аденокарцинома, лейомиосаркома и рабдомиосаркома; злокачественные опухоли полового члена; злокачественные опухоли полости рта, такие как, но не ограничиваясь ими, плоскоклеточная карцинома; базальные злокачественные опухоли; злокачественные опухоли слюнных желез, такие как, но не ограничиваясь ими, аденокарцинома, мукоэпидермоидная карцинома и кистозная аденокарцинома; злокачественные опухоли глотки, такие как, но не ограничиваясь ими, плоскоклеточный рак и бородавчатый рак; злокачественные опухоли кожи, такие как, но не ограничиваясь ими, базально-клеточная карцинома, плоскоклеточная карцинома и меланома, меланома с поверхностным распространением, узелковая меланома, ограниченный предраковый меланоз, лентигиноз конечностей; злокачественные опухоли почек, такие как, но не ограничиваясь ими, почечно-клеточный рак, аденокарцинома, гипернефрома, фибросаркома, рак переходных клеток (почечная лоханка и/или уретра); опухоль Вильмса; злокачественные опухоли мочевого пузыря, такие как, но не ограничиваясь ими, карцинома переходных клеток, плоскоклеточный рак, аденокарцинома, карциносаркома. Кроме того, злокачественные опухоли включают миксосаркому, остеогенную саркому, эндотелиосаркому, лимфангиоэндотелиосаркому, мезотелиому, синовиому, геманиобластому, эпителиальную карциному, цистаденокарциному, бронхогенную карциному, карциному потовых желез, карциному сальных желез, папиллярную карциному и папиллярные аденокарциномы (для обзора таких нарушений, см. Fishman et al., 1985, Medicine, 2d Ed., J.B. Lippincott Co., Philadelphia and Murphy et al., 1997, Informed Decisions: The Complete Book of Cancer Diagnosis, Treatment, и Recovery, Viking Penguin, Penguin Books U.S.A., Inc., United States of America). Также подразумевается, что злокачественные опухоли, вызванные нарушениями апоптоза, также можно подвергать профилактике, лечению и/или управлению течением способами и композициями по этому изобретению. Такие злокачественные опухоли могут включать, но не ограничиваться ими, фолликулярные лимфомы, карциномы с мутациями p53, гормонально-зависимые опухоли молочной железы, предстательной железы и яичника, и предраковые повреждения, такие как семейный аденоматозный полипоз и миелодиспластические синдромы.
5.6.2 Скрининг пациентов и клеточные линии
В одном варианте осуществления посредством предварительного скрининга определено, что пациент или родственник пациента обладает нонсенс-мутацией (т.е. UAA, UGA или UAG) в гене, ассоциированном с генетическим заболеванием.
В определенных вариантах осуществления это изобретение относится к способам скрининга пациентов с целью идентификации пациентов, которые, вероятно, отвечают на терапию средством для супрессии нонсенс-кодона.
5.6.2.1 Кратковременная нагрузка лекарственным средством
Это изобретение относится к способам скрининга пациента с заболеванием, обусловленным нонсенс-мутацией в гене, в отношении вероятности ответа пациента на средство для супрессии нонсенс-кодона, при этом способы включают введение пациенту средства для супрессии нонсенс-кодона, с последующим определением одного или более фармакодинамических маркеров, обусловленных заболеванием, подлежащим профилактике, управлению течением и/или лечению. Если определение фармакодинамического маркера(ов) указывает на то, что пациент, вероятно, отвечает на средство для супрессии нонсенс-кодона, введение средства можно продолжить.
В конкретном варианте осуществления способ скрининга включает кратковременное введение средства для супрессии нонсенс-кодона пациенту, с последующим определением фармакодинамического маркера, ассоциированного с заболеванием, подлежащим профилактике, лечению и/или управлению течением, и необязательно, с последующим длительным введением средства для супрессии нонсенс-кодона. В определенных вариантах осуществления кратковременное введение средства для супрессии нонсенс-кодона продолжается приблизительно 5 суток, приблизительно 10 суток, приблизительно 14 суток, приблизительно 21 суток или приблизительно 28 суток. В других вариантах осуществления длительное введение средства для супрессии нонсенс-кодона продолжается в течение приблизительно 30 суток, приблизительно 45 суток, приблизительно 60 суток, приблизительно 80 суток, приблизительно 120 суток, приблизительно 240 суток, приблизительно 1 года или до того момента, когда терапевт определит, что терапию следует прекратить. В конкретном варианте осуществления существует период без лечения в течение приблизительно 1 суток, приблизительно 3 суток, приблизительно 5 суток, приблизительно 7 суток, приблизительно 10 суток, приблизительно 14 суток, приблизительно 21 суток или приблизительно 28 суток между кратковременным введением и длительным введением средства для супрессии нонсенс-кодона и оценкой TEPD и функции легких. В конкретном варианте осуществления введение средства для супрессии нонсенс-кодона является пероральным.
Любой фармакодинамический маркер, ассоциированный с заболеваниями, описанными в настоящем документе, известный специалисту можно использовать совместно со способами по настоящему изобретению (см., например, Politano, et al., Acta Myologica XXII:15-21 (2003), включенную в настоящий документ в качестве ссылки в полном объеме).
Иллюстративные фармакодинамические маркеры, ассоциированные с кистозным фиброзом, включают, но не ограничиваются ими, трансэпителиальная разность потенциалов в носу (см., например, Standaert, et al., Pediatric Pulmonology 57:385-392 (2004) и Du, et ah, J. Mol. Med. 50:595-604 (2002), все из которых включены в настоящий документ в полном объеме, и пример 13, ниже), окрашивание белка CFTR и определение в клетках, полученных из носа (см., например, Wilschanski, et al., N. Engl. J. Med. 349: 1433-1441 (2003), включенную в настоящий документ в качестве ссылки в полном объеме, и пример 14), изменение концентрации хлорида в поте (см., например, пример 16) и изменения функции легких (см., например, пример 15).
Иллюстративные фармакодинамические маркеры, ассоциированные с мышечной дистрофией Дюшенна, включают, но не ограничиваются ими, уровни креатинкиназы сыворотки (см., например, способы в примере 20, ниже, для измерения уровней креатинкиназы в сыворотке) и определение мышечного дистрофина посредством окрашивания (см., например, Politano, et al., Acta Myologica XXII: 15-21 (2003), включенную в настоящий документ в качестве ссылки в полном объеме, и пример 17).
Иллюстративные фармакодинамические маркеры, ассоциированные с амилоидозом, включают, но не ограничиваются ими: выведение белка амилоида-бета; повышение массы, скорость гломерулярной фильтрации, толщину перегородки, трансмуральное гистологическое распределение белка амилоида и сердечную нагрузку амилоидом, соотношение каппа/лямбда для иммуноглобулин-связанных свободных легких цепей (FLC) в сыворотке, и отсутствие сердечных тропонинов T и I (cTnT, cTnI).
Иллюстративные фармакодинамические маркеры, ассоциированные с гемофилией, включают, но не ограничиваются ими: активацию коагуляции, сниженное время лизиса сгустка при индуцируемом тканевым фактором образовании фибрина и опосредуемый tPA фибринолиз.
Иллюстративные фармакодинамические маркеры, ассоциированные с болезнью Альцгеймера, включают, но не ограничиваются ими, измененное соотношение в тромбоцитах изоформ белка-предшественника амилоида (APP); общие, когнитивные (как определяют с помощью психометрических тестов, например, посредством модифицированной минимальной оценки психического состояния (MMSE) или модифицированной ишемической шкалы Хачински), функциональные и характеризующие поведение показатели, включая каждодневную активность жизни и поведения, в частности возбуждение, сниженная потеря объема головного мозга (например, определенная с использованием MRI). См. также Caban-Holt et al., Geriatrics. 2005 Jun;Suppl:3-8.
Иллюстративные фармакодинамические маркеры, ассоциированные с болезнью Паркинсона, включают, но не ограничиваются ими, баллы унифицированной шкалы оценки болезни Паркинсона (UPDRS), MMSE, снижение Hamilton-17, NPI, тотальное ежедневное время до начала действия (TTON), двигательные тесты, показатели дискинезии, записи в дневниках пациентов, и прием (18)F-допы.
Иллюстративные фармакодинамические маркеры, ассоциированные с атеросклерозои и семейной гиперхолестеринемией, включают, но не ограничиваются ими, сниженные уровни холестерина, например сниженные уровни MDA-LDL и/или сниженный холестерин липопротеина высокой плотности; профиль жирных кислот в сыворотке, липопротеины сыворотки и маркеры воспаления сосудов, сниженные концентрации гомоцистеина в плазме, образование бляшек в атеросклеротических сосудах (посредством MRI или внутрисосудистого ультразвукового исследования (IVUS)), кальцификацию коронарной артерии (CAC), как измеряют, например, посредством электронно-лучевой копьютерной томографии, и сниженную блокаду артерий, например, при измерении по толщине интимы-медии (IMT) общей сонной артерии (CCA), внутренней сонной артерии (ICA) и луковичных сегментов сонных артерий.
Иллюстративные фармакодинамические маркеры, ассоциированные с карликовостью и гигантизмом, включают, но не ограничиваются ими, рост и уровни гормона роста и пролактина.
Иллюстративные фармакодинамические маркеры, ассоциированные с гипотиреозом и гипертиреоидизмом, включают, но не ограничиваются ими, сывороточные уровни TT3, TT4 и TSH и оценку морфологии и размера щитовидной железы, костный возраст, изменения роста и коэффициенты развития (DQ).
Иллюстративные фармакодинамические маркеры, ассоциированные с пигментным ретинитом, включают, но не ограничиваются ими, уровни докозагексаеновой кислоты (DHA), глазную функцию, при определении по чувствительности поля зрения с помощью анализатора поля зрения Humphrey, амплитуду электроретинограммы при 30 Гц и остроту зрения.
Иллюстративные фармакодинамические маркеры, ассоциированные с поздним детским нейрональным цероидным липофусцинозом, включают, но не ограничиваются ими, неврологическую оценку на основе клинической оценочной шкалы LINCL и оценку головного мозга посредством магнитно-резонансной томографии/магнитно-резонансной спектроскопии.
Иллюстративные фармакодинамические маркеры, ассоциированные со спинальной мышечной атрофией, включают, но не ограничиваются ими, мышечную силу, сумму двигательной функций и индекса осмотра (IFM), индекс паралича дыхательных мышц (IMR), и форсированную жизненную емкость в положении лежа на спине/теоретический индекс (ICV/CT), максимальное произвольное изометрическое сокращение с ручным миометром и вычисленный суммарный показатель для руки (суммирование показателей сгибание локтя, сжатие рукой и для щипка в трех точках), и суммарный показатель для ноги (суммирование показателей сгибания колена, разгибания голени и разгибания стопы), показатель больших моторных функций, тесты легочной функции, количественное тестирование мышц и качество жизни.
Иллюстративные фармакодинамические маркеры, ассоциированные с атаксией-телеангиэктазией, включают, но не ограничиваются ими: сниженный фетальный альфа-протеин, улучшенную иммунную функцию и улучшенную неврологическую функцию.
Иллюстративные фармакодинамические маркеры, ассоциированные с синдромом Барттера, включают, но не ограничиваются ими: повышенный уровень калия в крови, усиленный рост и улучшенные психические функции.
5.6.2.2 Воздействие на клетки культивируемых тканей in vitro
Настоящее изобретение относится к способам скрининга пациента с заболеванием, обусловленным нонсенс-мутацией в гене, в отношении вероятности ответа пациента на средство для супрессии нонсенс-кодона, при этом способы включают контактирование образца клеток от пациента со средством для супрессии нонсенс-кодона и определение экспрессии и/или активности продуцированного функционального белка с "прочитанным" терминатором, при индукции посредством средства для супрессии нонсенс-кодона прохождения считывания через нонсенс-мутацию в гене, ассоциированную с заболеванием. Неограничивающие примеры образцов клеток включают содержащие ядро клетки крови (например, лимфоциты периферической крови человека), клетки кожи (например, фибробласты кожи), нейрональные клетки, глиальные клетки и мышечные клетки. В определенных вариантах осуществления образец клеток представляет собой образец клеток, измененных вследствие наличия нонсенс-мутации в гене. Измеренная активность будет зависеть от функции белка дикого типа, кодируемого нормальным геном. См., например, анализы, описанные в разделе 5.5, выше.
В определенных вариантах осуществления это изобретение относится к способам скрининга пациента с заболеванием, обусловленным нонсенс-мутацией в гене, в отношении вероятности ответа пациента на средство для супрессии нонсенс-кодона, при этом способы включают контактирование образца клеток (например, образца клеток кожи, таких как фибробласты кожи) от пациента со средством для супрессии нонсенс-кодона в условиях, которые позволяют клеткам превращаться в представляющую интерес ткань (например, мышечные клетки), и определение ответа. Образец клеток от пациента, обладающего вероятностью ответа на средство для супрессии нонсенс-кодона, будет продуцировать функциональный белок с "прочитанным" терминатором в результате супрессии нонсенс-кодона в РНК, транскрибируемой с гена. В конкретном варианте осуществления используемые клетки представляют собой фибробласты, которые получены от пациентов. Такие клетки можно дифференцировать в мышечные клетки посредством трансфекции клеток вектором, который содержит ген MyoD.
Также настоящее изобретение относится к способам скрининга пациента с заболеванием, обусловленным нонсенс-мутацией в гене, в отношении вероятности ответа пациента на средство для супрессии нонсенс-кодона, при этом способы включают секвенирование гена, ассоциированного с заболеванием, контактирование образца клеток, содержащих ген, обладающий той же нонсенс-мутацией, со средством для супрессии нонсенс-кодона, и определение экспрессии и/или активности продуцируемого функционального белка с "прочитанным" терминатором, при индукции посредством средства для супрессии нонсенс-кодона прохождения считывания через нонсенс-кодон в РНК, транскрибируемой с гена, ассоциированного с заболеванием. В определенных вариантах осуществления используемый образец клеток представляет собой часть библиотеки образцов клеток, при этом каждый образец клеток содержит нонсенс-мутацию(и) в гене, ассоциированном с заболеванием. Например, библиотека образцов клеток при кистозном фиброзе содержит образцы клеток, например, с нонсенс-мутацией(ями), приведенными в таблице 10, в гене CFTR. Образцы клеток можно хранить при -70°C, пока они не потребуются, и тогда образцы клеток размораживают и культивируют в условиях, которые обеспечивают рост клеток.
5.6.2.3 Искусственная конструкция гена в анализе с люциферазой
Настоящее изобретение относится к способам скрининга пациента с заболеванием, обусловленным нонсенс-мутацией в гене, в отношении вероятности ответа пациента на средство для супрессии нонсенс-кодона, при этом способы включают секвенироавние гена, ассоциированного с заболеванием, контактирование средства для супрессии нонсенс-кодона с клеткой, созданной, чтобы она содержала репортерный ген, такой как ген люциферазы, содержащий участок гена, ассоциированного с заболеванием, содержащего нонсенс-мутацию, и определение экспрессии и/или активности функционального белка с "прочитанным" терминатором, продуцируемого при индукции средством для супрессии нонсенс-кодона прохождения через нонсенс-кодон в РНК, транскрибируемой с гена. В определенных вариантах осуществления репортерный ген содержит 6 нуклеотидов (в определенных вариантах осуществления 9, 12, 15, 21, 24, 27, 30 или 33 нуклеотидов) из участка, представляющего интерес гена, содержащего нонсенс-мутацию, включая нонсенс-мутацию. Репортерный ген конструируют, чтобы он содержал участок представляющего интерес гена, содержащего нонсенс-мутацию, так что открытая рамка считывания репортерного гена сохраняется, и белок, кодируемый репортерным геном, приводит к функциональному белку с "прочитанным" терминатором при индукции средством для супрессии нонсенс-кодона прохождения считывания через нонсенс-кодон в РНК, транскрибируемой с гена. Примеры репортерных генов представлены в разделе 5,5, выше. Способами инженерии можно получить любую клетку, содержащую репортерный ген. Неограничивающие примеры включают фибробласты, лимфоциты, клетки глии, нейроны, мышечные клетки и макрофаги. Можно использовать любые стандартные способы молекулярной и клеточной биологии для получения репортерного гена (включая сайт-направленный мутагенез) и для создания клетки, содержащей репортерный ген (включая осаждение фосфатом кальция, электропорацию и липосомы).
5.6.3 Заболевания
Заболевания, подвергаемые профилактике, лечению и/или управлению течением посредством супрессии преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК, включают, но не ограничиваются ими: генетическое заболевание, злокачественную опухоль, аутоиммунное заболевание, заболевание крови, связанное с коллагеном заболевание, диабет, нейродегенеративное заболевание, пролиферативное заболевание, сердечно-сосудистое заболевание, легочное заболевание, воспалительное заболевание и заболевание центральной нервной системы.
Конкретные генетические заболевания, находящиеся в объеме способов по этому изобретению, включают, но не ограничиваются ими, амилоидоз, гемофилию, болезнь Альцгеймера, болезнь Тея-Сакса, атеросклероз, гигантизм, карликовость, гипотиреоз, гипертиреоидизм, старение, ожирение, болезнь Паркинсона, болезнь Неймана-Пика, кистозный фиброз, мышечную дистрофию, заболевание сердца, почечные камни, атаксию-телеангиэктазию, семейную гиперхолестеринемию, пигментный ретинит, лизосомальные болезни накопления, туберозный склероз, мышечную дистрофию Дюшенна, спинальную мышечную атрофию и синдром Марфана. Как солидные опухоли, так и другие злокачественные опухоли включены в способы по этому изобретению.
В другом варианте осуществления генетическое заболевание представляет собой аутоиммунное заболевание. В предпочтительном варианте осуществления, аутоиммунное заболевание представляет собой ревматоидный артрит или реакцию "трансплантат против хозяина".
В другом варианте осуществления генетическое заболевание представляет собой заболевание крови. В предпочтительном варианте осуществления, заболевание крови представляет собой гемофилию, болезнь фон-Виллебранда, атаксию-телеангиэктазию, b-талассемию или почечные камни.
В другом варианте осуществления генетическое заболевание представляет собой связанное с коллагеном заболевание. В одном варианте осуществления, связанное с коллагеном заболевание представляет собой несовершенный остеогенез или цирроз.
В другом варианте осуществления генетическое заболевание представляет собой диабет.
В другом варианте осуществления генетическое заболевание представляет собой воспалительное заболевание. В предпочтительном варианте осуществления, воспалительное заболевание представляет собой артрит.
В другом варианте осуществления генетическое заболевание представляет собой заболевание центральной нервной системы. В одном варианте осуществления заболевание центральной нервной системы представляет собой нейродегенеративное заболевание. В предпочтительном варианте осуществления заболевание центральной нервной системы представляет собой рассеянный склероз, мышечную дистрофию, мышечную дистрофию Дюшенна, спинальную мышечную атрофию, болезнь Альцгеймера, болезнь Тея-Сакса, поздний детский нейрональный цероидный липофусциноз (LINCL) или болезнь Паркинсона.
В другом варианте осуществления генетическое заболевание представляет собой злокачественную опухоль. В предпочтительном варианте осуществления злокачественная опухоль представляет собой злокачественную опухоль головы и шеи, глаза, кожи, полости рта, глотки, пищевода, грудной клетки, кости, легкого, толстого кишечника, сигмовидной кишки, прямой кишки, желудка, предстательной железы, молочной железы, яичника, почки, печени, поджелудочной железы, головного мозга, тонкого кишечника, сердца или надпочечников.
В другом предпочтительном варианте осуществления злокачественная опухоль ассоциирована с генами опухолевой супрессии (см. например Garinis et al. 2002, Hum Gen 111:115-117; Meyers et al. 1998, Proc. Natl. Acad. Sci. USA, 95: 15587-15591; Kung et al. 2000, Nature Medicine 6(12): 1335-1340. Такие гены опухолевой супрессии включают, но не ограничиваются ими, APC, ATM, BRAC1, BRAC2, MSH1, pTEN, Rb и p53.
В особенно предпочтительном варианте осуществления ген опухолевой супрессии представляет собой ген p53. В гене p53 идентифицированы нонсенс-мутации и они вовлечены в злокачественную опухоль. В гене p53 идентифицировано несколько нонсенс-мутаций (см., например, Masuda et al., 2000, Tokai J Exp Clin Med. 25(2):69-77; Oh et al., 2000, Mol. Cells 10(3):275-80; Li et al., 2000, Lab Invest. 80(4):493-9; Yang et al., 1999, Zhonghua Zhong Liu Za Zhi 21(2):114-8; Finkelstein et al., 1998, MoI Diagn. 3(1):37-41; Kajiyama et al., 1998, Dis Esophagus. 11(4):279-83; Kawamura et al., 1999, Leuk Res. 23(2):115-26; Radig et al., 1998, Hum Pathol. 29(11):1310-6; Schuyer et al., 1998, Int J Cancer 76(3):299-303; Wang-Gohrke et al., 1998, Oncol Rep. 5(1):65-8; Fulop et al., 1998, J Reprod Med. 43(2):119-27; Ninomiya et al., 1997, J Dermatol Sci. 14(3):173-8; Hsieh et al., 1996, Cancer Lett. 100(1-2):107-13; Rail et al., 1996, Pancreas. 12(1):10-7; Fukutomi et al., 1995, Nippon Rinsho. 53(11):2764-8; Frebourg et al., 1995, Am J Hum Genet. 56(3):608-15; Dove et al., 1995, Cancer Surv. 25:335-55; Adamson et al., 1995, Br J Haematol. 89(1):61-6; Grayson et al., 1994, Am J Pediatr Hematol Oncol. 16(4):341-7; Lepelley et al., 1994, Лейкоз. 8(8): 1342-9; McIntyre et al., 1994, J Clin Oncol. 12(5):925-30; Horio et al., 1994, Oncogene. 9(4):1231-5; Nakamura et al., 1992, Jpn J Cancer Res. 83(12): 1293-8; Davidoff et al., 1992, Oncogene. 7(1):127-33; и Ishioka et al., 1991, Biochem Biophys Res Commun. 177(3):901-6; описания которых включены в настоящий документ в качестве ссылок в полном объеме). Любое заболевание, ассоциированное с геном p53, кодирующее кодон преждевременной терминации трансляции, включая, но не ограничиваясь ими, нонсенс-мутации, описанные в приведенных выше ссылках, можно подвергать лечению, управлению течением и/или профилактике способами по настоящему изобретению.
Дополнительные заболевания, подлежащие лечению, управлению течением и/или профилактике способами по настоящему изобретению, включают солидные опухоли, саркому, карциномы, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, хондрому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, карциному толстого кишечника, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, плоскоклеточную карциному, базально-клеточную карциному, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярные аденокарциномы, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечно-клеточный рак, гепатому, карциному желчных протоков, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, рак шейки матки, рак семенников, карциному легкого, мелкоклеточную карциному легкого, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, саркому Капоши, пинеалому, геманиобластому, невриному слухового нерва, олигоденроглиому, менингеому, меланому, нейробластому, ретинобластому, опухоль кроветворной системы, острый лимфобластный лейкоз, острый лимфобластный B-клеточный лейкоз, острый лимфобластный T-клеточный лейкоз, острый миелобластный лейкоз, острый промиелоцитарный лейкоз, острый монобластный лейкоз, острый эритролейкемический лейкоз, острый мегакариобластный лейкоз, острый миеломоноцитарный лейкоз, острый нелимфоцитарный лейкоз, острый недифференцированный лейкоз, хронический миелоцитарный лейкоз, хронический лимфоцитарный лейкоз, волосатоклеточный лейкоз или множественную миелому. См. например, Harrison's Principles of Internal Medicine, Eugene Braunwald et al., eds., pp. 491-762 (15th ed. 2001).
В некоторых вариантах осуществления заболевание, подлежащее лечению, управлению течением и/или профилактике посредством способов по этому изобретению, включают заболевания, приведенные в таблице 10, выше. В определенных вариантах осуществления заболевание, подлежащее профилактике, лечению и/или управлению течением представляет собой не желудочно-кишечное нарушение и/или не кожное нарушение. В некоторых вариантах осуществления заболевание, подлежащее профилактике, лечению и/или управлению течением представляет собой не одно из следующих заболеваний: синдром базально-клеточного невуса (например, ген PTCH), спорадическая базально-клеточная карцинома (например, ген PTCH), меланома (например, ген CDKN2a), пограничный буллезный эпидермолиз (например, гены LAMB3, LAMC2, LAMA3), генерализованный атрофический доброкачественный буллезный эпидермолиз (например, ген COL17A1), дистрофический буллезный эпидермолиз (например, ген COL7A1), Болезнь Хейли-Хейли (например, ген ATP2C1), Болезнь Дарье (например, ген ATP2A2), чешуйчатый ихтиоз (например, ген TGM1), X-сцепленный ихтиоз (например, ген STS), пигментная ксеродерма (например, гены XPA, XPC, XPG), синдром Блума (например, ген BLM), полосатая ладонно-подошвенная кератодерма (например, гены DSP, DSG1), синдром Кокейна (например, ген ERCC6), окулокутанный альбинизм (например, гены TYR, TYRP1), синдром Германски-Пудлака (например, гены HPS1, HPS4), атаксия-телеангиэктазия (например, ген ATM), синдром Грисцелли (например, гены RAB27A, MY05A), и эктодермальная дисплазия/слабость кожи (например, ген PKP1). В некоторых вариантах осуществления заболевание представляет собой не одно или более или все из следующих заболеваний: спорадические злокачественные опухоли пищевода (ген p53) и толстого кишечника (APC, гены p53), пищевод Барретта (ген p53), наследственные синдромы со злокачественными опухолями, такие как аденоматозный полипоз толстого кишечника (ген APC), наследственный неполипозный рак толстого кишечника (гены MLH1, MSH2), синдром Пейтца-Турена (ген STK 11), и синдром Коудена (ген PTEN).
5.7 СОСТАВЫ
Фармацевтические композиции и единичные дозированные формы, содержащие эффективное количество средства для супрессии нонсенс-кодона, можно применять в способах по настоящему изобретению. Отдельные дозированные формы могут быть пригодны для перорального, мукозального (включая сублингвальное, буккальное, ректальное, назальное или вагинальное) или парентерального (включая подкожное, внутримышечное, проводимое посредством болюсной инъекции, внутриартериальное или внутривенное) введения. Предпочтительные фармацевтические композиции и единичные дозированные формы пригодны для перорального введения. В одном варианте осуществления фармацевтическая композиция или единичные дозированные формы содержат эффективное количество одного или более средств для супрессии нонсенс-кодонов и одну или более примесей пути синтеза, используемого для получения средства (средств) для супрессии нонсенс-кодонов.
В одном варианте осуществления фармацевтическая композиция представляет собой твердую пероральную дозированную форму. В одном варианте осуществления фармацевтическая композиция представляет собой жидкую пероральную дозированную форму. В конкретном варианте осуществления способы по настоящему изобретению включают введение доз, единичных дозированных составов или фармацевтических композиций, где средство для супрессии нонсенс-кодона является прорально биодоступным. Преимущества перорального введения могут включать простоту введения, более высокое соблюдение пациентом схемы дозирования, клиническую эффективность, меньшие осложнения, более короткое пребывание в больнице и общее снижение затрат.
В другом варианте осуществления способы по настоящему изобретению включают введение единичных дозированных составов, которые содержат между приблизительно 35 мг и приблизительно 1400 мг, приблизительно 125 мг и приблизительно 1000 мг, приблизительно 250 мг и приблизительно 1000 мг, или приблизительно 500 мг и приблизительно 1000 мг средства для супрессии нонсенс-кодона. В одном варианте осуществления единичный дозированный состав содержит средство для супрессии нонсенс-кодона и один или более носителей или эксципиентов, пригодных для суспендирования в фармацевтически приемлемом растворителе (например, воде, молоке, газированном напитке, соке, яблочном соусе, продукте детского питании или смеси для детского питания) во флаконе.
В другом варианте осуществления способы по настоящему изобретению включают введение единичных дозированных составов, которые содержат 35 мг, 50 мг, 70 мг, 100 мг, 125 мг, 140 мг, 175 мг, 200 мг, 250 мг, 280 мг, 350 мг, 500 мг, 560 мг, 700 мг, 750 мг, 1000 мг или 1400 мг средства для супрессии нонсенс-кодона. Предпочтительные единичные дозированные составы содержат приблизительно 125 мг, приблизительно 250 мг или приблизительно 1000 мг средства для супрессии нонсенс-мутации. В одном варианте осуществления единичный дозированный состав содержит средство для супрессии нонсенс-кодона и один или более носителей или эксципиентов, пригодных для суспензии в фармацевтически приемлемом растворителе (например, воде, молоке, газированном напитке, соке, яблочном соусе, продукте детского питании или смеси для детского питания) во флаконе. Предпочтительными единичными дозированными составами являются порошки и саше.
Несмотря на то что рекомендуется, чтобы единичные дозированные составы, описанные в настоящем документе, хранились при температуре между приблизительно 2°C и приблизительно 8°C, единичные дозированные составы можно хранить при комнатной температуре в течение приблизительно 48 часов перед разбавлением. В одном варианте осуществления разбавление 250-мг единичного дозированного состава 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата проводят посредством добавления приблизительно 10 мл воды непосредственно во флакон, содержащий 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат для достижения концентрации приблизительно 25 мг/мл в общем объеме суспензии. Для 1000-мг единичного дозированного состава 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата, приблизительно 20 мл воды добавляют непосредственно во флакон, содержащий 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат для достижения концентрации приблизительно 50 мг/мл в общем объеме суспензии. Непосредственно после этого добавляют воду, флакон закрывают и встряхивают осторожно рукой в течение, по меньшей мере, приблизительно 30 секунд до получения гомогенной суспензии. Несмотря на то что разбавленная суспензия может оставаться в исходном пластмассовом флаконе в течение вплоть до 24 часов перед приемом, рекомендуется, чтобы лекарственное средство было принято через небольшой промежуток времени после разбавления. Если между разбавлением и дозированием существует промежуток более 15 минут, рекомендуется повторно встряхнуть флакон рукой в течение, по меньшей мере, приблизительно 30 секунд. Рекомендуется, чтобы суспензия была введена непосредственно из флакона. Кроме того, рекомендуется промыть флакон один раз водой и принять внутрь эту воду для промывания, чтобы убедиться, что во флаконе не осталось порошка.
Единичные дозированные формы для перорального введения пациенту включают, но не ограничиваются ими: саше; крахмальные капсулы; таблетки; жевательные таблетки; таблетки в форме капсул; капсулы, такие как мягкие эластические желатин капсулы; лепешки; пастилки; дисперсии; порошки; растворы; жидкие дозированные формы, включая суспензии (например, водные или неводные жидкие суспензии); эмульсии (например, эмульсии типа "масло-в-воде", или жидкие эмульсии типа "вода-в-масле"); и эликсиры. В одном варианте осуществления способы по настоящему изобретению включают введение коллоидного раствора или раствора с дополнительным активным веществом, в концентрации, превышающей насыщающую. Эти и другие направления, в которых конкретные дозированные формы, пригодные в способах по настоящему изобретению, будут отличаться друг от друга, будут легко понятны специалистам в данной области. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990).
Способы по настоящему изобретению далее включают введение безводных фармацевтических композиций и дозированных форм, содержащих средство для супрессии нонсенс-кодона. Безводные фармацевтические композиции и дозированные формы можно получать с использованием безводных или обладающих низким содержанием влаги ингредиентов и условий низкого увлажнения или низкого содержания влаги.
Типичные пероральные дозированные формы получают комбинированием соединения, обладающего активностью в отношении супрессии нонсенс-кодона, в однородную смесь, по меньшей мере, с одним носителем или эксципиентом в соответствии с общепринятыми фармацевтический способами смешивания. Эксципиенты могут принимать широкое множество форм, в зависимости от формы препарата, желательной для введения. Например, эксципиенты, пригодные для применения в пероральных жидких или аэрозольных дозированных формах, включают, но не ограничиваются ими, воду, гликоли, масла, спирты, вкусовые добавки (например, ванильный экстракт), консерванты и красители. Примеры эксципиентов, пригодных для применения в твердых пероральных дозированных формах (например, порошках, таблетках, жевательных таблетках, саше, капсулах и таблетках в форме капсул), включают, но не ограничиваются ими, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие средства, смазывающие вещества, связующие вещества и дезинтегрирующие вещества.
Особенно предпочтительными единичными дозированными составами являются порошковые составы, содержащие эффективное количество средства для супрессии нонсенс-кодона, которые пригодны для разбавления в фармацевтически приемлемом растворителе (например, воде, молоке, газированном напитке, соке, яблочном соусе, продукте детского питания или смеси для детского питания) и последующего перорального введения. В конкретном варианте осуществления порошок необязательно может содержать один или более носителей или эксципиентов в сочетании со средством для супрессии нонсенс-кодона. В другом варианте осуществления перед введением или разбавлением порошок можно хранить в герметичном контейнере. В другом варианте осуществления порошок можно инкапсулировать (например, в желатиновую капсулу).
Жидкие препараты для перорального введения могут принимать форму, например, растворов, сиропов или суспензий, или они могут быть представлены в качестве сухого продукта (например, порошка или гранул) для разбавления водой или другим пригодным носителем перед применением. Такие жидкие препараты можно изготавливать общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие вещества (например, сироп сорбита, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или гуммиарабик); неводные носители (например, миндальное масло, эфиры масел, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил или пропил-п-гидроксибензоаты или сорбиновая кислота). Также препараты могут содержать буферные соли, вкусовые добавки, красители и подсластители, в соответствующих случаях.
Примеры эксципиентов, которые можно применять в твердых пероральных дозированных формах, включают, но не ограничиваются ими, связующие вещества, наполнители, дезинтегрирующие вещества и смазывающие вещества. Связующие вещества, пригодные для применения фармацевтических композициях и дозированных формах, включают, но не ограничиваются ими, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как гуммиарабик, альгинат натрия, альгиновая кислота, другие альгинаты, порошковый трагакант, гуаровая камедь, целлюлоза и ее производные (например, этилцеллюлоза, ацетат целлюлозы, карбоксиметилцеллюлоза кальция, карбоксиметилцеллюлоза натрия), поливинилпирролидон, метилцеллюлоза, прежелатинизированный крахмал, гидроксипропилметилцеллюлоза (например, No. 2208, 2906, 2910), микрокристаллическая целлюлоза и их смеси.
Предпочтительные эксципиенты включают Litesse® Ultra (очищенная полидекстроза) маннит, поверхностно-активные вещества (полиэтиленгликоль 3350 и Lutrol® micro F127 (порошок полоксамера 407)), дезинтегрирующие вещества (кросповидон), cab-o-sil, Carbopol®, полиакриловую кислоту и другие эксципиенты (гидроксиэтилцеллюлозу, ванильный ароматизатор, стеарат магния (не бычий), и коллоидный диоксид кремния).
Примеры наполнителей, пригодных для применения в фармацевтических композициях и твердых дозированных формах, описанных в настоящем документе, включают, но не ограничиваются ими, лактозу, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошковую целлюлозу, декстраты, каолин, маннит, кремниевую кислоту, сорбит, крахмал, прежелатинизированный крахмал и их смеси. Связующее вещество или наполнитель в фармацевтических композициях по этому изобретению, как правило, находится в количестве от приблизительно 50 до приблизительно 99 массовых процентов фармацевтической композиции или дозированной формы.
Пригодные формы микрокристаллической целлюлозы включают, но не ограничиваются ими, материалы, продаваемые как AVICEL-PH-101, AVICEL-PH-103 AVICEL RC-581, AVICEL-PH-105 (доступные от FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA), и их смеси. Конкретным связующим веществом является смесь микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия, продаваемой в качестве AVICEL RC-581. Пригодные безводные или обладающие низким содержанием влаги эксципиенты или добавки включают AVICEL-PH-103TM и крахмал 1500 LM.
5.8 ДОЗИРОВАНИЕ И СХЕМЫ ДОЗИРОВАНИЯ
Без связи с теорией, способы по настоящему изобретению включают, частично, конкретные дозы и схемы дозирования средства для супрессии нонсенс-кодона, которые оптимизируют супрессию преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК.
Способы по этому изобретению включают лечение, профилактику и управление течением заболеваний, поддающихся лечению, профилактике и/или управлению течением посредством супрессии преждевременной терминации трансляции и/или опосредуемого нонсенс-кодоном разрушения мРНК или его симптомов, снижая или позволяя избегать неблагоприятные или нежелательные эффекты, например токсичность или побочные эффекты. Предпочтительным способом введения для доз и схем дозирования, описанных в настоящем документе, является пероральный способ (т.е. проглатывание раствора, коллоидного раствора или раствора с дополнительным активным веществом, с концентрацией активного вещества, превышающей насыщающую). В одном варианте осуществления способ введения для доз и схем дозирования, описанных в настоящем документе, представляет собой местное введение (например, кожное).
Полагают, что дозы и схемы дозирования, описанные в настоящем документе, пригодны вследствие их способности достигать и поддерживать желательные концентрации соединения, обладающего активностью в отношения супрессии нонсенс-кодона, в плазме. Без связи с теорией, полагают, что достижение и поддержание относительно постоянной концентрации средства для супрессии нонсенс-мутации в плазме, например, в течение 24 часов или более, обеспечивает благоприятный терапевтический эффект у пациента. Дозы и схемы дозирования, описанные в настоящем документе, пригодны для достижения и поддержания таких терапевтических концентраций соединения, обладающего активностью в отношении супрессии нонсенс-кодона, в плазме.
В одном варианте осуществления способы по настоящему изобретению включают введение средства для супрессии нонсенс-кодона, где соединение вводят пациенту, нуждающемуся в этом, один, два или три раза в течение 12- или 24-часового периода, где каждое введение предпочтительно отделено приблизительно на 4-14 часов. В конкретном варианте осуществления средство для супрессии нонсенс-кодона вводят один раз утром, один раз днем и один раз вечером. В другом варианте осуществления средство для супрессии нонсенс-кодона вводят один раз утром и один раз вечером. В другом варианте осуществления средство для супрессии нонсенс-кодона вводят один раз утром, один раз днем или один раз вечером. Предпочтительные интервалы между дозами включают 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14 часов.
В одном варианте осуществления дозу средства для супрессии нонсенс-кодона повышают в течение 24 часов. В конкретном варианте осуществления вторую вводимую дозу повышают (например, в два раза) относительно первой дозы. В другом варианте осуществления первую и вторую дозы сохраняют одинаковыми и третью вводимую дозу повышают (например, в два раза). Без связи с теорией, полагают, что существует суточное изменение при введении средства для супрессии нонсенс-кодона, где концентрация в плазме дозы, вводимой вечером, превышает концентрацию в плазме дозы, вводимой утром или днем. Без ограничения теорией, полагают, что удваивание дозы, вводимой вечером, относительно ранее вводимой дозы будет оптимально поддерживать намеченные концентрации в плазме при снижении общей экспозиции средства для супрессии нонсенс-кодона.
В конкретном варианте осуществления в течение 24 часов вводят три дозы в соответствии с формулой: 1X, 1X, 2X, где X представляет собой конкретную исходную дозу (например, 4 мг/кг, 7мг/кг или 10 мг/кг). В другом варианте осуществления средство для супрессии нонсенс-кодона вводят в пределах (т.е. до или после) приблизительно 10, 15, 30, 45 или 60 минут от приема пищи пациентом. В одном варианте осуществления эффективное количество средства для супрессии нонсенс-кодона высыпают на еду или смешивают с ней. В одном варианте осуществления еда, употребляемая до, одновременно, или после введения средства для супрессии нонсенс-кодона, представляет собой пищу с высоким содержанием жира и/или с высоким содержанием калорий и/или высоким содержанием белка.
В одном варианте осуществления, если в ходе курса лечения появляется побочное действие, которое считают лимитирующим дозу, вторую или третью вводимую дозу (например, вечернюю дозу) снижают приблизительно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или вообще не вводят, в течение остальной части курса лечения или до уменьшения побочного действия.
Особенно предпочтительной схемой дозирования является схема, где пациенту вводят средство для супрессии нонсенс-кодона в течение 30 минут после приема пищи приблизительно с 6-, 6- и 12-часовыми интервалами (например, в ~7:00 после завтрака, в ~13:00 после второго завтрака и в ~19:00 после ужина).
В другом варианте осуществления способы по настоящему изобретению включают введение средства для супрессии нонсенс-кодона в виде одной или разделенной (например, три раза в течение 24 часов) дозы между 0,1 мг/кг и 500 мг/кг, 1 мг/кг и 250 мг/кг, 1 мг/кг и 150 мг/кг, 1 мг/кг и 100 мг/кг, 1 мг/кг и 50 мг/кг, 1 мг/кг и 25 мг/кг, 1 мг/кг и 20 мг/кг, 1 мг/кг и 10 мг/кг или 2 мг/кг и 10 мг/кг пациенту, нуждающемуся в этом. В конкретном варианте осуществления средство для супрессии нонсенс-кодона вводят в дозе приблизительно 2-6 мг/кг, приблизительно 5-9 мг/кг, приблизительно 6-10 мг/кг, приблизительно 8-12 мг/кг, приблизительно 12-16 мг/кг или приблизительно 18-22 мг/кг. В конкретном варианте осуществления средство для супрессии нонсенс-кодона вводят в дозе приблизительно 3 мг/кг, приблизительно 4 мг/кг, приблизительно 6 мг/кг, приблизительно 7 мг/кг, приблизительно 8 мг/кг, приблизительно 10 мг/кг, приблизительно 14 мг/кг, приблизительно 20 мг/кг, приблизительно 30 мг/кг, приблизительно 50 мг/кг, приблизительно 100 мг/кг, приблизительно 200 мг/кг, или приблизительно 300 мг/кг. В другом варианте осуществления любую дозу средства для супрессии нонсенс-кодона, описанного в настоящем документе в предшествующем варианте осуществления, вводят один, два или три раза в течение 24 часов.
В другом варианте осуществления способы по настоящему изобретению включают длительную терапию, где средство для супрессии нонсенс-кодона вводят раз в сутки пациенту, нуждающемуся в этом, в течение определенного периода времени (например, 5, 7, 10, 14, 20, 24, 28, 60 или 120 суток или более). В одном варианте осуществления средство для супрессии нонсенс-кодона длительно вводят один, два или три раза в течение 24 часов. В другом варианте осуществления средство для супрессии нонсенс-кодона длительно вводят каждые сутки, каждую неделю, каждый месяц или каждый год. В конкретном варианте осуществления средство для супрессии нонсенс-кодона длительно вводят один, два или три раза в течение 24 часов в дозах приблизительно 4 мг/кг, приблизительно 4 мг/кг и приблизительно 8 мг/кг в течение суток, недель, месяцев или лет. В конкретном варианте осуществления средство для супрессии нонсенс-кодона длительно вводят три раза в течение 24 часов в дозах приблизительно 7 мг/кг, приблизительно 7 мг/кг и приблизительно 14 мг/кг в течение суток, недель, месяцев или лет. В конкретном варианте осуществления средство для супрессии нонсенс-кодона длительно вводят три раза в течение 24 часов в дозах приблизительно 10 мг/кг, приблизительно 10 мг/кг и приблизительно 20 мг/кг в течение суток, недель, месяцев или лет. В другом конкретном варианте осуществления средство для супрессии нонсенс-кодона длительно вводят два раза в течение 24 часов в дозах приблизительно 8 мг/кг в течение суток, недель, месяцев или лет.
В другом конкретном варианте осуществления средство для супрессии нонсенс-кодона длительно вводят в ходе первого курса три раза в течение 24 часов в дозах приблизительно 4 мг/кг, приблизительно 4 мг/кг и приблизительно 8 мг/кг в течение суток, недель, месяцев или лет с последующим длительным введением в ходе второго курса два раза в течение 24 часов в дозах приблизительно 8 мг/кг в течение суток, недель, месяцев или лет. В другом конкретном варианте осуществления средство для супрессии нонсенс-кодона длительно вводят в ходе первого курса два раза в течение 24 часов в дозах приблизительно 8 мг/кг в течение суток, недель, месяцев или лет с последующим длительным введением в ходе второго курса три раза в течение 24 часов в дозах приблизительно 4 мг/кг, приблизительно 4 мг/кг и приблизительно 8 мг/кг в течение суток, недель, месяцев или лет. В этих вариантах осуществления первый и второй курсы могут быть разделены или за ними может следовать период покоя, когда средство для супрессии нонсенс-кодона не вводят. Период покоя может длиться сутки, месяцы или годы.
В каждом 24-часовом периоде, когда вводят средство для супрессии нонсенс-кодона, его предпочтительно вводят три раза приблизительно с 6-, 6- и 12-часовыми интервалами (например, в ~7:00 после завтрака, в ~13:00 после второго завтрака и в ~19:00 после ужина).
Периоды введения для курса терапии могут охватывать одну неделю, две недели, три недели, четыре недели, пять недель, шесть недель, семь недель, восемь недель, девять недель, десять недель, одиннадцать недель, двенадцать недель, тринадцать недель, четырнадцать недель, четыре месяца, пять месяцев, шесть месяцев, семь месяцев, восемь месяцев, девять месяцев, десять месяцев, одиннадцать месяцев, один год, два года, три года, четыре года, пять лет или более. В конкретном варианте осуществления периоды введения для курса терапии охватывают жизнь субъекта. Периоды введения могут прерываться периодами покоя, которые могут охватывать сутки, одну неделю, две недели, три недели, четыре недели, пять недель, шесть недель, семь недель, восемь недель, девять недель, десять недель одиннадцать недель, двенадцать недель, тринадцать недель, четырнадцать недель, четыре месяца, пять месяцев, шесть месяцев, семь месяцев, восемь месяцев, девять месяцев, десять месяцев, одиннадцать месяцев, один год, два года, три года, четыре года, пять лет или более. Такое определение может проводить специалист в данной области (например, терапевт).
Будет понятно, что количества средства для супрессии нонсенс-кодона, вводимого пациенту, нуждающемуся в этом, вычисляют или их можно вычислить, на основе истинной массы рассматриваемого пациента или средней массы рассматриваемой популяции пациентов (например, белых мужчин, белых женщин, афроамериканских мужчин, афроамериканских женщин, азиатских мужчин или азиатских женщин, включая эмбрионы, плоды, новорожденных, детей, взрослых и пожилых).
5.9 КОНЦЕНТРАЦИИ В ПЛАЗМЕ
В одном варианте осуществления способы по настоящему изобретению включают поддержание в плазме концентрации средства для супрессии нонсенс-кодона от 0,1 мкг/мл до 500 мкг/мл, от 0,1 мкг/мл до 400 мкг/мл, от 0,1 мкг/мл до 300 мкг/мл, от 0,1 мкг/мл до 200 мкг/мл, от 0,1 мкг/мл до 100 мкг/мл, или от 2 мкг/мл до 10 мкг/мл у пациента в течение приблизительно от 1 до 72 часов, от 2 до 48 часов или от 2 до 24 часов, включающее введение эффективного количества средства для супрессии нонсенс-кодона пациенту, нуждающемуся в этом. В другом варианте осуществления способы по настоящему изобретению включают поддержание концентрации в плазме средства для супрессии нонсенс-кодона более чем: приблизительно 0,1 мкг/мл, приблизительно 1 мкг/мл, приблизительно 2 мкг/мл, приблизительно 5 мкг/мл, приблизительно 10 мкг/мл, приблизительно 15 мкг/мл, приблизительно 20 мкг/мл, приблизительно 25 мкг/мл, приблизительно 30 мкг/мл, приблизительно 40 мкг/мл, приблизительно 50 мкг/мл, приблизительно 75 мкг/мл, приблизительно 100 мкг/мл, приблизительно 125 мкг/мл, приблизительно 150 мкг/мл, приблизительно 175 мкг/мл, приблизительно 200 мкг/мл, приблизительно 225 мкг/мл, приблизительно 250 мкг/мл, приблизительно 275 мкг/мл, приблизительно 300 мкг/мл, приблизительно 325 мкг/мл, приблизительно 350 мкг/мл, приблизительно 375 мкг/мл или приблизительно 400 мкг/мл у пациента в течение, по меньшей мере, приблизительно 2, 4, 6, 8, 12, 24, 36 или 48 часов, включающее введение эффективного количества средства для супрессии нонсенс-кодона пациенту, нуждающемуся в этом. В конкретном варианте осуществления введение является пероральным.
В другом варианте осуществления способы по настоящему изобретению включают поддержание концентрации в плазме средства для супрессии нонсенс-мутации от приблизительно 0,1 мкг/мл до приблизительно 400 мкг/мл у пациента в течение, по меньшей мере, приблизительно 2, 4, 6, 8, 12 или 24 часов, включающее введение эффективного количества средства для супрессии нонсенс-мутации пациенту, нуждающемуся в этом, в течение вплоть до трех раз в сутки в одинаковых или в возрастающих дозах (например, 1X, 1X, 2X как описано в настоящем документе). В конкретном варианте осуществления введение является пероральным.
В конкретном варианте осуществления уровень средства для супрессии нонсенс-кодона в плазме пациента поддерживают выше от приблизительно 0,1 мкг/мл до приблизительно 400 мкг/мл в течение, по меньшей мере, приблизительно 2, 4, 6, 8, 12 или 24 часов посредством введения средства для супрессии нонсенс-кодона три раза в сутки пациенту, нуждающемуся в этом. В конкретном варианте осуществления введение является пероральным.
В одном варианте осуществления способы по настоящему изобретению включают введение средства для супрессии нонсенс-мутации, чтобы достигать Tmax для концентрации в плазме через от приблизительно 1 до приблизительно 3 часов или от приблизительно 2 до приблизительно 4 часов после введения.
В одном варианте осуществления способы по настоящему изобретению включают введение средства для супрессии нонсенс-мутации, чтобы t1/2 для концентрации в плазме составляло от приблизительно 2 до приблизительно 6 часов или от приблизительно 3 до приблизительно 6 часов.
В определенных вариантах осуществления способы по настоящему изобретению включают введение средства для супрессии нонсенс-кодона в количестве, эффективном для получения 1% или более, 2% или более, 3% или более, 4% или более, 5% или более, 7% или более, 10% или более, 12% или более, 15% или более, 17% или более, 20% или более, 22% или более, 25% или более, 27% или более, 30% или более, 32% или более, 35% или более, 40% или более, 45% или более, 50% или более, 55% или более, 60% или более, 65% или более, 70% или более, 75% или более или 80% или более функционального белка с "прочитанным" терминатором in vivo относительно количества, соответствующего белку дикого типа, продуцируемому у нормального субъекта(ов). В некоторых вариантах осуществления способы по настоящему изобретению включают введение средства для супрессии нонсенс-кодона в количестве, эффективном для продукции достаточного количества функционального белка с "прочитанным" терминатором, чтобы достигнуть приблизительно 1%, приблизительно 2%, приблизительно 3%, приблизительно 4%, приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60% или более от активности соответствующего белка дикого типа у нормального субъекта(ов).
В конкретном варианте осуществления способы по настоящему изобретению включают введение средства для супрессии нонсенс-кодона в количестве, эффективном для продукции, по меньшей мере, приблизительно 1% или более, 2% или более, 3% или более, 4% или более, 5% или более, 7% или более, 10% или более, 12% или более, 15% или более, 17% или более, 20% или более, 22% или более, 25% или более, 27% или более, 30% или более, 32% или более, 35% или более, 40% или более, 45% или более, 50% или более, 55% или более, 60% или более, 65% или более, 70% или более, 75% или более, или 80% функционального белка с "прочитанным" терминатором CFTR in vivo относительно количества белка CFTR, продуцируемого у нормального субъекта(ов).
В другом варианте осуществления способы по настоящему изобретению включают введение средства для супрессии нонсенс-кодона в количестве, эффективном для продукции 1% или более, 2% или более, 3% или более, 4% или более, 5% или более, 7% или более, 10% или более, 12% или более, 15% или более, 17% или более, 20% или более, 22% или более, 25% или более, 27% или более, 30% или более, 32% или более, 35% или более, 40% или более, 45% или более, 50% или более, 55% или более, 60% или более, 65% или более, 70% или более, 75% или более, или 80% функционального белка дистрофина с "прочитанным" терминатором in vivo относительно количества белка дистрофина, продуцируемого у нормального субъекта(ов).
5.10 ТЕРАПЕВТИЧЕСКИЕ РЕЗУЛЬТАТЫ
Любой терапевтический результат или исход заболеваний, описанных в настоящем документе, известный квалифицированному специалисту, можно использовать применительно к способам по настоящему изобретению (см., например, Politano, et al., 2003, Acta Myologica XXII:15-21, включенную в настоящий документ в качестве ссылки в полном объеме). Репрезентативные терапевтические результаты включают, но не ограничиваются ими, результаты, описанные в настоящем документе, включая результаты, указанные в примерах.
Резпрезентативные результаты для мышечной дистрофии Дюшенна включают, но не ограничиваются ими: продукцию дистрофина в мышце, которая в ином случае не способна продуцировать дистрофин (например, повторную экспрессию дистрофина в сарколемме клеток скелетных мышц); паттерн вовлечения MRI мышц и объем мышцы после лечения относительно противоположной мышцы без лечения; и мышечную силу и деятельность, включая индивидуальные показатели QMT сгибателей и разгибателей локтя и колена и сжатие рукой и показатели тестирования мышц вручную с использованием способа оценки мышечной сил Medical Research Council (MRC).
Мышечную силу можно количественно определять, например, с использованием системы Pediatric Quantitative Measurement System (PQMS). Основные маркеры силы включают показатели количественной миометрии (QMT) верхней и нижней конечностей, включающей парные группы сгибатель/разгибатель.
Репрезентативные результаты для кистозного фиброза включают, но не ограничиваются ими: активность CFTR, оцениваемая по трансэпителиальной разности потенциалов в носу (TEPD); побочные эффекты, наличие белка и мРНК CFTR, и функцию легких.
Репрезентативные результаты для амилоидоза включают, но не ограничиваются ими: выведение белка амилоида-бета; увеличение массы, скорость гломерулярной фильтрации, толщину перегородки, трансмуральное гистологическое распределение белка амилоида и сердечную нагрузку амилоидом, соотношение каппа/лямбда для иммуноглобулин-связанных свободных легких цепей (FLC) в сыворотке, и отсутствие сердечных тропонинов T и I (cTnT, cTnI).
Репрезентативные результаты для гемофилии включают, но не ограничиваются ими: активацию коагуляции, сниженное время лизиса сгустка при индуцируемом тканевым фактором образовании фибрина и опосредуемый tPA фибринолиз.
Репрезентативные результаты для болезни Альцгеймера включают, но не ограничиваются ими, измененное соотношение в тромбоцитах изоформ белка-предшйственника амилоида (APP); общие, когнитивные (как определяют с помощью психометрических тестов, например посредством модифицированной минимальной оценки психического состояния (MMSE) или модифицированной ишемической шкалы Хачински), функциональные и характеризующие поведение показатели, включая каждодневную активность жизни и поведения, в частности возбуждение, сниженная потеря объема головного мозга (например, определенная с использованием MRI). См. также Caban-Holt et al., Geriatrics. 2005 Jun; Suppl:3-8
Репрезентативные результаты для болезни Паркинсона, включают, но не ограничиваются ими, баллы унифицированной шкалы оценки болезни Паркинсона (UPDRS), MMSE, снижение Hamilton-17, NPI, тотальное ежедневное время до начала действия (TTON), двигательные тесты, показатели дискинезии, записи в дневниках пациентов, и прием (18)F-допы.
Репрезентативные результаты для атеросклероза и семейной гиперхолестеринемии включают, но не ограничиваются ими, сниженные уровни холестерина, например сниженные уровни MDA-LDL и/или сниженный холестерин липопротеина высокой плотности; профиль жирных кислот в сыворотке, липопротеины сыворотки и маркеры воспаления сосудов, сниженные концентрации гомоцистеина в плазме, образование бляшек в атеросклеротических сосудах (посредством MRI или внутрисосудистого ультразвукового исследования (IVUS)), кальцификацию коронарной артерии (CAC), как измеряют, например, посредством электронно-лучевой копьютерной томографии, и сниженную блокаду артерий, например, при измерении по толщине интимы-медии (IMT) общей сонной артерии (CCA), внутренней сонной артерии (ICA), и луковичных сегментов сонных артерий.
Репрезентативные результаты для карликовости и гигантизма включают, но не ограничиваются ими, рост и уровни гормона роста и пролактина.
Репрезентативные результаты для гипотиреоза и гипертиреоидизма включают, но не ограничиваются ими, сывороточные уровни TT3, TT4 и TSH и оценку морфологии и размера щитовидной железы, костный возраст, изменения роста и коэффициенты развития (DQ).
Репрезентативные результаты для пигментного ретинита включают, но не ограничиваются ими, уровни докозагексаеновой кислоты (DHA), глазную функцию, при определении по чувствительности поля зрения с помощью анализатора поля зрения Humphrey, амплитуду электроретинограммы при 30-Гц и остроту зрения.
Репрезентативные результаты для позднего детского нейрональныого цероидного липофусциноза, включают, но не ограничиваются ими, неврологическую оценку на основе клинической оценочной шкалы LINCL и оценку головного мозга посредством магнитно-резонансной томографии/магнитно-резонансной спектроскопии.
Репрезентативные результаты для спинальной мышечной атрофии, включают, но не ограничиваются ими, мышечную силу, сумму двигательной функций и индекса осмотра (IFM), индекс паралича дыхательных мышц (IMR) и форсированную жизненную емкость в положении лежа на спине/теоретический индекс (ICV/CT), максимальное произвольное изометрическое сокращение с ручным миометром и вычисленный суммарный показатель для руки (суммирование показателей сгибание локтя, сжатие рукой и для щипка в трех точках), и суммарный показатель для ноги (суммирование показателей сгибания колена, разгибания голени и разгибания стопы), показатель двигательной функции больших моторных функций, тесты легочной функции, количественное тестирование мышц и качество жизни.
Репрезентативные результаты для атаксии-телеангиэктазии, включают, но не ограничиваются ими: сниженный фетальный альфа-протеин, улучшенную иммунную функцию и улучшенную неврологическую функцию.
Репрезентативные результаты для синдрома Барттера, включают, но не ограничиваются ими: повышенный уровень калия в крови, усиленный рост и улучшенные психические функции.
5.11 ГЕННАЯ ТЕРАПИЯ
Генная терапия относится к терапии, проводимой посредством введения субъекту экспрессированной или экспрессируемой последовательности нуклеиновой кислоты. В соответствии с настоящим изобретением можно использовать любые способы генной терапии, доступные в данной области. Иллюстративные способы описаны ниже.
Для общих обзоров способов генной терапии, см. Goldspiel et al., 1993, Clinical Pharmacy 12:488-505; Wu and Wu, 1991, Biotherapy 3:87-95; Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol. 32:573-596; Mulligan, Science 260:926-932 (1993); и Morgan and Anderson, 1993, Ann. Rev. Biochem. 62:191-217; May, 1993, TIBTECH 11(5):155-215. Способы, широко известные в области технологии рекомбинантных ДНК, которые можно использовать, описаны в Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); и Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990).
В одном аспекте последовательность нуклеиновой кислоты является частью экспрессирующего вектора, который экспрессирует последовательность нуклеиновой кислоты в пригодном хозяине. В частности, такая последовательность нуклеиновой кислоты содержит промотор (включая гетерологичные промоторы), функционально связанный с кодирующей областью белка, при этом указанный промотор является индуцибельным или конститутивным, и, необязательно, тканеспецифичным. В другом конкретном варианте осуществления используют последовательность нуклеиновой кислоты, в которой кодирующая белок последовательность и любые другие требуемые последовательности фланкируются областями, которые запускают гомологичную рекомбинацию в требуемой области генома, таким образом, обеспечивая внутрихромосомную экспрессию кодирующей белок последовательности нуклеиновой кислоты (Кoller and Smithies, 1989, Proc. Natl. Acad. Sci. USA 86:8932-8935; Zijlstra et al., 1989, Nature 342:435-438).
Доставка последовательностей нуклеиновых кислот субъекту может быть либо прямой, при которой субъекта непосредственно подвергают воздействию последовательности нуклеиновой кислоты или несущих последовательности нуклеиновой кислоты векторов, или непрямой, в случае которой клетки сначала трансформируют нуклеиновыми кислотами in vitro, а затем трансплантируют субъекту. Эти два подхода известны, соответственно, как генная терапия in vivo или ex vivo.
В конкретном варианте осуществления последовательности нуклеиновых кислот непосредственно вводят in vivo, где они подлежат экспрессии с образованием кодируемого продукта. Это можно проводить любым из множества способов, известных в данной области, например посредством конструирования их в качестве части соответствующего экспрессирующего нуклеиновую кислоту вектора и введения, чтобы он стал внутриклеточным, например, посредством инфекции с использованием дефектных или аттенуированных ретровирусов или других вирусных векторов (см. патент США No. 4980286), или посредством прямой инъекции «голой» ДНК, или посредством применения бомбардировки микрочастицами (например, генная пушка; Biolistic, Dupont), или посредством матрикса с подложкой in situ, в которой находится последовательность нуклеиновой кислоты (см., например, европейский патент No. EP 0 741 785 B1 и патент США No. 5962427), или покрытие липидами или рецепторами клеточной поверхности или средствами для трансфекции, инкапсулирование в липосомы, микрочастицы или микрокапсулы, или посредством введения их в связанной форме с пептидом, о котором известно, что он проникает в ядро, посредством введения его в связанной форме с лигандом, подвергающимся рецептор-опосредуемому эндоцитозу (см., например, Wu and Wu, 1987, J. Biol. Chem. 262:4429-4432) (которое можно использовать для нацеливания на типы клеток, специфично экспрессирующие рецепторы), и т.д. В другом варианте осуществления могут быть образованы комплексы нуклеиновая кислота-лиганд, в которых лиганд содержит фузогенный вирусный пептид для разрушения эндосом, позволяя нуклеиновой кислоте избегать лизосомальной деградации. В другом варианте осуществления последовательность нуклеиновой кислоты можно нацеливать in vivo на клеточно-специфичный захват и экспрессию посредством нацеливания на специфичный рецептор (см., например, публикации PCT WO 92/06180; WO 92/22635; W092/203 16; W093/14188, WO 93/20221). Альтернативно последовательность нуклеиновой кислоты можно вводить внутриклеточно и встраивать в ДНК клетки-хозяина для экспрессии, посредством гомологичной рекомбинации (Koller and Smithies, 1989, Proc. Natl. Acad. Sci. USA 86:8932-8935; и Zijlstra et al., 1989, Nature 342:435-438).
В конкретном варианте осуществления используют вирусные векторы, которые содержат последовательности нуклеиновых кислот, кодирующие профилактическое или лекарственное средство. Например, можно использовать ретровирусный вектор (см. Miller et al., 1993, Meth. Enzymol. 217:581-599). Эти ретровирусные векторы содержат компоненты, необходимые для правильной упаковки вирусного генома и встраивания в ДНК клетки-хозяина. Последовательности нуклеиновой кислоты, подлежащие применению в генной терапии, клонируют в один или более векторов, которые упрощают доставку гена субъекту. Более подробные сведения, касающиеся ретровирусных векторов, могут быть найдены в Boesen et al., 1994, Biotherapy 6:291-302, где описано применение ретровирусного вектора для доставки гена mdr 1 в гемопоэтические стволовые клетки в целях получения стволовых клеток, более устойчивых к химиотерапии. Другими источниками литературы, иллюстрирующими применение ретровирусных векторов в генной терапии, являются: Clowes et al., 1994, J. Clin. Invest. 93:644-651; Klein et al., 1994, Blood 83:1467-1473; Salmons and Gunzberg, 1993, Human Gene Therapy 4:129-141; и Grossman and Wilson, 1993, Curr. Opin. in Genetics and Devel. 3:110-114.
Аденовирусы представляют собой другие вирусные векторы, которые можно применять в генной терапии. Аденовирусы являются особенно привлекательными носителями для доставки генов в респираторный эпителий. Аденовирусы в природе инфицируют респираторный эпителий, где они вызывают мягкое заболевание. Другие мишени для аденовирусных систем для доставки представляют собой печень, центральную нервную систему, эндотелиальные клетки и мышцу. Аденовирусы обладают тем преимуществом, что они способны инфицировать неделящиеся клетки. Kozarsky and Wilson, 1993, Current Opinion in Genetics и Development 3:499-503, где представлен обзор аденовирусной генной терапии. Bout et al., 1994, Human Gene Therapy 5:3-10, где показано применение аденовирусных векторов для переноса генов в респираторный эпителий макак-резус. Другие случаи применения аденовирусов в генной терапии можно найти в Rosenfeld et al., 1991, Science 252:431-434; Rosenfeld et al., 1992, Cell 68:143-155; Mastrangeli et al., 1993, J. Clin. Invest. 91:225-234; PCT Publication W094/12649; и Wang et al., 1995, Gene Therapy 2:775-783. В предпочтительном варианте осуществления, используют аденовирусные векторы.
Аденоассоциированный вирус (AAV) также был предложен для применения в генной терапии (Walsh et al., 1993, Proc. Soc. Exp. Biol. Med. 204:289-300; и патент США No. 5436146).
Другой подход к генной терапии вовлекает перенос гена в клетки в тканевой культуре такими способами, как электропорация, липофекция, опосредуемая фосфатом кальция трансфекция или вирусная инфекция. Как правило, способ переноса включает перенос селективного маркера в клетки. Затем проводят селекцию клеток для выделения тех клеток, которые захватили и экспрессируют перенесенный ген. Затем эти клетки доставляют субъекту.
В этом варианте осуществления нуклеиновую кислоту вводят в клетку, а затем полученную рекомбинантную клетку вводят in vivo. Такое введение можно проводить любым способом, известным в данной области, включая, но не ограничиваясь ими трансфекцию, электропорацию, микроинъекцию, инфекцию вектором на основе вируса или бактериофага, содержащим последовательности нуклеиновой кислоты, слияние клеток, опосредуемый хромосомой перенос генов, опосредованный микроклетками перенос генов, слияние сферопластов, и т.д. Для введения чужеродных генов в клетки в данной области известно множество способов (см., например, Loeffler and Behr, 1993, Meth. Enzymol. 217:599-618; Cohen et al., 1993, Meth. Enzymol. 217:618-644; Clin. Pharma. Ther. 29:69-92 (1985)) и их можно использовать в соответствии с настоящим изобретением при условии, что необходимые связанные с развитием и физиологические функции реципиентных клеток не нарушаются. Способ должен обеспечить стабильный перенос нуклеиновой кислоты в клетку, чтобы нуклеиновая кислота экспрессировалась клеткой и, предпочтительно, была наследуемой и экспрессировалась ее клетками-потомками.
Полученные рекомбинантные клетки можно доставлять субъекту различными способами, известными в данной области. Рекомбинантные клетки крови (например, гемопоэтические стволовые клетки или клетки-предшественники) предпочтительно вводят внутривенно. Предполагаемое для применения количество клеток зависит от требуемого эффекта, состояния пациента, и т.д., и его может определить специалист в данной области.
Клетки, в которые можно вводить нуклеиновую кислоту в целях генной терапии, охватывают любой желательный, доступный тип клеток, и включают, но не ограничиваются ими, эпителиальные клетки, эндотелиальные клетки, кератиноциты, фибробласты, мышечные клетки, гепатоциты; клетки крови, такие как T-лимфоциты, B-лимфоциты, естественные киллерные (NK) клетки, моноциты, макрофаги, нейтрофилы, эозинофилы, мегакариоциты, гранулоциты; различные стволовые клетки или клетки-предшественники, в частности гемопоэические стволовые или клетки-предшественники, например, получаемые из костного мозга, пуповинной крови, периферической крови, эмбриональной печени, и т.д.
В предпочтительном варианте осуществления клетка, используемая для генной терапии, является аутологичной для субъекта.
В варианте осуществления, в котором для генной терапии используют рекомбинантные клетки, последовательности нуклеиновых кислот, кодирующие белок, вносят в клетки, чтобы они экспрессировались клетками и их потомками, а затем рекомбинантные клетки вводят in vivo для профилактического или терапевтического эффекта. В конкретном варианте осуществления используют стволовые клетки или клетки-предшественники. Любые стволовые клетки и/или клетки-предшественники, которые можно выделять и поддерживать in vitro, потенциально можно использовать в соответствии с этим вариантом осуществления настоящего изобретения (см. например, публикацию PCT WO 94/08598; Stemple and Anderson, 1992, Cell 7 1:973-985; Rheinwald, 1980, Meth. Cell Bio. 21A:229; и Pittelkow and Scott, 1986, Mayo Clinic Proc. 61:771).
В конкретном варианте осуществления нуклеиновая кислота, подлежащая введению в целях генной терапии, содержит конститутивный или тканеспецифичный промотор, функционально связанный с кодирующей областью.
6. ПРИМЕРЫ
В следующих примерах используются способы, которые можно применять для идентификации соединений, обладающих активностью в отношении супрессии нонсенс-мутации.
6.1 ПРИМЕР 1: ИДЕНТИФИКАЦИЯ И ОХАРАКТЕРИЗАИЯ СОЕДИНЕНИЙ, КОТОРЫЕ ОБЕСПЕЧИВАЮТ СУПРЕССИЮ НОНСЕНС-МУТАЦИИ И/ИЛИ МОДУЛИРУЮТ ТЕРМИНАЦИЮ ТРАНСЛЯЦИИ.
Соединения, которые модулируют преждевременную терминацию трансляции и/или опосредуемое нонсенс-кодоном разрушение мРНК можно идентифицировать рядом способов. Например, способы скрининга соединений, которые модулируют посттранскрипционную экспрессию любого гена с преждевременным стоп-кодоном трансляции, описаны в международной публикации патента No. WO 01/44516 A2, включенной в настоящий документ в качестве ссылки в полном объеме. В одном примере, мРНК с преждевременным терминирующим кодоном транслируют in vitro и используют для скрининга библиотеки тестируемых соединений. В другом примере мРНК с преждевременным терминирующим кодоном представляет собой репортерный ген с преждевременным терминирующим кодоном.
Было разработано два анализа для применения в высокопроизводительных скринингах с целью идентификации низкомолекулярных соединений, которые обеспечивают супрессию нонсенс-мутации. В каждом анализе используется люцифераза, поскольку они представляют собой анализы с функциональным репортерным геном (свет образуется, только если белок является функциональным) и они являются крайне чувствительными (интенсивность света пропорциональна концентрации люциферазы в нМ-диапазоне). Первый анализ представляет собой клеточный анализ с люциферазным репортером и второй анализ представляет собой биохимический анализ, состоящий из лизата ретикулоцитов кролика и мРНК люциферазного репортера, содержащего нонсенс-кодон. В клеточном анализе конструкцию люциферазного репортера, содержащую преждевременный терминирующий кодон UGA стабильно трансфицируют в эмбриональные клетки почки человека 293T. В биохимическом анализе мРНК, содержащую преждевременный терминирующий кодон UGA используют в качестве репортера в реакции трансляции in vitro с использованием лизата ретикулоцитов кролика, дополненного тРНК, гемином, креатинкиназой, аминокислотами, KOAc, Mg(OAc)2, и креатинфосфатом. Трансляция мРНК начинается в лидерной последовательности вирусного происхождения. Синтетическую мРНК получают in vitro с использованием промотора T7 и набора для трансляции in vitro MegaScript (Ambion). Как в биохимических, так и клеточных анализах, в качестве внутреннего стандарта используют низкомолекулярное соединение, о котором известно, что они обеспечивает прохождение считывания через преждевременные терминирующие кодоны, 3-[3-(4-изопропилфенил)-2,5-диоксоимидазолидин-1-ил]бензойную кислоту.
6.2 ПРИМЕР 2: ОХАРАКТЕРИЗАЦИЯ СОЕДИНЕНИЙ, КОТОРЫЕ ПОВЫШАЮТ ПОДАЛЕВНИЕ НОНСЕНС-МУТАЦИИ И ПРИВОДЯТ К ПРОДУКЦИИ ФУНКЦИОНАЛЬНОГО БЕЛКА.
Для определения активности in vivo, стабильную клеточную линию, обладающую геном люциферазы, содержащим нонсенс-мутацию UGA, обрабатывают тестируемыми соединениями. Клетки выращивают в стандартной среде, дополненной 1% пенициллином-стрептомицином (P/S) и 10% эмбриональной телячьей сывороткой (FBS) до 70% смыкания монослоя и разводят 1:1 за сутки до обработки. На следующие сутки, клетки трипсинизируют и 40000 клеток добавляют в каждую лунку 96-луночной чашки для культивирования тканей. Проводят серийные разведения каждого соединения для получения кривой доза-эффект из шести точек, охватывающей 2 порядка (от 300 мкм до 0,3 мкМ). Конечная концентрация растворителя DMSO остается постоянной на уровне 1% в каждой лунке. Клетки, обработанные 1% DMSO, служат в качестве стандарта фона, и клетки, обработанные гентамицином, служат в качестве положительного контроля.
6.3 ПРИМЕР 3: ВЕЩЕСТВА, ОСУЩЕСТВЛЯЮЩИЕ СУПРЕССИЮ НОНСЕНС-КОДОНА, ИЗМЕНЯЮТ ДОСТУПНОСТЬ ХИМИЧЕСКИХ МОДИФИЦИРУЮЩИХ ВЕЩЕСТВ К СПЕЦИФИЧНЫМ НУКЛЕОТИДАМ В 28S РРНК.
Предшествующие исследования показали, что гентамицин и другие члены семейства аминогликозидов, которые снижают точность трансляции, связываются с A-участком 16S рРНК. Посредством химического футпринтинга, поперечного сшивания под действием УФ-излучения и ЯМР, было показано, что гентамицин связывает A-участок (состоящий из нуклеотидов 1400-1410 и 1490-1500, нумерация по E. coli) рРНК в нуклеотидах 1406, 1407, 1494 и 1496 (Moazed & Noller, 1987, Nature 327(6121):389-394; Woodcock et al., 1991, EMBO J. 10(10):3099-3103; и Schroeder et al., 2000, EMBOJ. 19:1-9.
Рибосомы, полученные из клеток HeLa, инкубируют с тестируемым соединением (в концентрации 100 мкМ), с последующей обработкой химическими модифицирующими средствами (диметилсульфат [DMS] и кетоксаль [KE]). После химической модификации рРНК экстрагируют фенол-хлороформом, этанол осаждают, анализируют в реакциях удлинения праймеров с использованием меченных на конце олигонуклеотидов, гибридизующихся с различными участками трех рРНК, и разделяют на 6% полиакриламидных гелях. Зонды, используемые для удлинения праймеров, охватывают все 18S (7 олигонуклеотидных праймеров), 28S (24 олигонуклеотидных праймеров) и 5S (один праймер) рРНК. Контроли в этих экспериментах включают DMSO (контроль для изменений в доступности рРНК, индуцируемых DMSO), паромомицин (маркер связывания 18S рРНК) и анизомицин (маркер связывания 28S рРНК).
6.4 ПРИМЕР 4: ПРОХОЖДЕНИЕ СЧИТЫВАНИЯ ЧЕРЕЗ ПРЕЖДЕВРЕМЕННЫЕ ТЕРМИНИРУЮЩИЕ КОДОНЫ В КЛЕТОЧНЫХ МОДЕЛЯХ ЗАБОЛЕВАНИЙ.
Для исследования эффектов, осуществляющих супрессию нонсенс-кодона соединений на мРНК, измененные в конкретных наследственных заболеваниях, клеточную линию бронхиальных клеток, обладающую нонсенс-кодоном в аминокислоте 1282 (W1282X), обрабатывают тестируемым соединением (20 мкМ) и функцию CFTR подвергают мониторингу в качестве cAMP-активируемого канала для хлоридов с использованием анализа SPQ (Yang et al., 1993, Hum Mol. Genet. 2(8): 1253-1261 и Howard et al., 1996, Nat Med. 2(4):467-469). Эти эксперименты демонстрируют, что обработка этих клеток посредством cAMP приводит к повышению флуоресценции SPQ, что согласуется со стимуляцией опосредуемого CFTR выхода галогенидов. Повышение флуоресценции не наблюдают, когда клетки не обрабатывают тестируемым соединением или если клетки не стимулируют посредством cAMP. Эти результаты показывают, что полноразмерный CFTR, экспрессируемый с этого содержащего нонсенс-кодон аллеля, после обработки тестируемым соединением также функционирует как стимулируемый cAMP анионный канал, таким образом, показывая, что в клеточных линиях кистозного фиброза повышается активность каналов для хлоридов при обработке тестируемым соединением.
6.5 ПРИМЕР 5: ПЕРВИЧНЫЕ КЛЕТКИ ИЗ СОДЕРЖАЩИХ НОНСЕНС-КОДОН МЫШЕЙ MDX ЭКСПРЕССИРУЮТ ПОЛНОРАЗМЕРНЫЙ БЕЛОК ДИСТРОФИНА ПОСЛЕ ОБРАБОТКИ ВЕЩЕСТВОМ, ОСУЩЕСТВЛЯЮЩИМ СУПРЕССИЮ НОНСЕНС-КОДОНА
Было показано, что мутация у мышей mdx, которая вызывает преждевременную терминацию полипептида дистрофина массой 427 кДа, представляет собой транзицию C на T в положении 3185 экзона 23 (Sicinski et al., 1989, Science 244(4912):1578-1580). Культуры первичных мышечных клеток мыши, полученные из мышей mdx в возрасте 1 суток, создают, как описано ранее (Barton-Davis et al., 1999, J Clin Invest. 104(4):375-381). Клетки культивируют в течение 10 суток в присутствии тестируемого соединения (20 мкМ). Культуральную среду заменяют каждые четверо суток и наличие дистрофина в культурах миобластов выявляют посредством иммунного окрашивания, как описано ранее (Barton-Davis et al., 1999, J Clin Invest. 104(4):375-381). Первичное моноклональные антитело к C-концу белка дистрофина (F19A12) используют без разведения и родамин, конъюгированный с противомышиными IgG, используют в качестве вторичного антитела. Антитело F19A12 будет выявлять полноразмерный белок, продуцируемый посредством супрессии нонсенс-кодона. Окрашивание визуализируют с использованием микроскопа Leica DMR, цифровой камеры и прилагаемого к ней визуализирующего программного обеспечения в University of Pennsylvania.
6.6 ПРИМЕР 6: ПРОХОЖДЕНИЕ СЧИТЫВАНИя ЧЕРЕЗ ПРЕЖДЕВРЕМЕННЫЕ ТЕРМИНИРУЮЩИЕ КОДОНЫ У МЫШЕЙ MDX
Как описано ранее (Barton-Davis et al., 1999, J Clin Invest. 104(4):375-381), тестируемое соединение доставляют посредством осмотических насосов Alzet, имплантированных под кожу мышей после анестезии. Вводят две дозы тестируемого соединения. Гентамицин служит в качестве положительного контроля и дозаторы, заполненные только растворителем, служат в качестве отрицательного контроля. В дозаторы помещают соответствующее соединение, чтобы вычисленные дозы, воздействию которых подвергают ткань, составляли 10 мкМ и 20 мкМ. Вычисляют концентрацию гентамицина для достижения воздействия на ткани приблизительно 200 мкМ. В исходном эксперименте мышам проводят введение в течение 14 суток, после чего животным проводят анестезию кетамином и обескровливают. Затем переднюю большеберцовую (TA) мышцу из экспериментальных животных вырезают, замораживают и используют для иммунофлуоресцентного анализа включения дистрофина в поперечно-полосатую мышцу. Наличие дистрофина в TA мышцах выявляют иммунным окрашиванием, как описано ранее (Barton-Davis et al., 1999, J Clin Invest. 104(4):375-381).
6.7 ПРИМЕР 7: ПОЛУЧЕНИЕ 3-[5-(2-ФТОРФЕНИЛ)-[1,2,4]ОКСАДИАЗОЛ-3-ИЛ]БЕНЗОЙНОЙ КИСЛОТЫ
К раствору 3-цианобензойной кислоты (44,14 г, 300 ммоль) в DMF (0,6 л) добавляли K2CO3 (62,19 г, 450 ммоль), а затем перемешивали в течение 30 мин при комнатной температуре. К суспензии добавляли метилйодид (28 мл, 450 ммоль) в течение 20 мин, и реакционную смесь перемешивали далее 4 ч при комнатной температуре. Реакционную смесь выливали в 1,2 л ледяной воды и перемешивали в течение 30 мин, и осадок отфильтровывали. Белый осадок растворяли в метаноле (70 мл), а затем повторно осаждали в холодной воде. Требуемый продукт получали в виде белого порошка с 79% выходом (38 г, 99% чистота при LC/UV). 1H-ЯМР (CDCl3) δ 8,85 (2H), 8,28 (1H), 8,02 (1H), 4,17 (3H).
К раствору метилового эфира 3-цианобензойной кислоты (50 г, 310 ммоль) в этаноле (500 мл) добавляли 50% водный гидроксиламин (41 мл, 620 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 1 ч при 100°C и растворители удаляли при пониженном давлении. Масляный осадок растворяли в смеси 20/80 этанол/толуол (50 мл × 2), а затем снова концентрировали. Требуемый сложный эфир (61 г, количественный выход) получали в виде белого порошка с 98% чистотой (LC/UV). 1H-ЯМР (CDCl3) δ 9,76 (1H), 8,24 (1H), 7,82 (2H), 7,51 (1H), 5,92 (2H), 3,82 (3H).
К раствору метилового эфира 3-(N-гидроксикарбамимидоил)бензойной кислоты (60 г, 310 ммоль) в безводном THF (200 мл) добавляли диизопропилэтиламин (75 мл, 434 ммоль) при 5°C, а затем к смеси добавляли 2-фторбензоилхлорид (48,1 мл, 403 ммоль) в течение 20 мин. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Осадок отфильтровывали и фильтрат концентрировали при пониженном давлении. Осадок растворяли в этилацетате (400 мл), а затем промывали водой (200 мл×2). Растворитель удаляли при пониженном давлении и требуемый продукт кристаллизовывали в 60% этилацетате в гексане с получением требуемого продукта (82 г, выход 83%) в виде белого твердого вещества. 1H-ЯМР (CDCl3) δ 8,18 (1H), 8,03 (3H), 7,48 (2H), 7,18 (2H), 5,61 (2H), 3,82 (3H).
44 г метилового эфира 3-(N-2-фторбензоилкарбамимидоил)бензойной кислоты в толуоле (500 мл) кипятили с обратным холодильником в течение 4 ч при 130°C с использованием устройства Dean-Stark. Реакционную смесь перемешивали при 5°C в течение 18 ч. Белый осадок отфильтровывали и фильтрат концентрировали, кристаллизовывали снова в толуоле. Требуемый оксадиазол (38 г, выход 92%) получали в виде белого твердого вещества с 99% чистотой (LC/UV). 1H-ЯМР (CDCl3) δ 8,91 (1H), 8,38 (1H), 8,15 (2H), 7,62 (2H), 7,35 (2H), 3,95 (3H).
К раствору метилового эфира 3-[5-(2-Фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты (3,3 г, 11 ммоль) в THF (40 мл) добавляли 1,5M водный NaOH (10 мл, 14 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 2 ч при 100°C. Органический растворитель удаляли и водный раствор разбавляли водой (50 мл), а затем подкисляли водным раствором HCl. Белый осадок отфильтровывали и белый осадок промывали холодной водой, а затем сушили с использованием лиофилизатора. Требуемая кислота (3,0 г, выход 96%) была получена в виде белого порошка с 98% чистотой (LC/UV). Температура плавления 242°C; IR □ 3000 (ароматический C-H), 1710 (C=O); 1H-ЯМР (D6-DMSO) δ 8,31 (1H), 8,18 (2H), 8,08 (1H), 7,88 (2H), 7,51 (2H); 13C-ЯМР (D6-DMSO) δ 172,71, 167,38, 166,48, 161,25, 135,80, 132,24, 131,79, 131,79, 131,08, 130,91, 129,81, 127,76, 125,48, 117,38, 111,70; 19F-ЯМР (D6-DMSO) δ 109,7.
Фармацевтически приемлемые соли 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты можно получать с использованием способов, известных специалистам в данной области. Соль с натрием можно получать следующим образом. К раствору метилового эфира 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты (33 г, 111 моль) в THF (400 мл) добавляли 1,5M водный NaOH (100 мл, 144 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 2 ч при 100°C. Органический растворитель удаляли при пониженном давлении и водный раствор перемешивали в течение 2 ч при 5°C. Белый осадок отфильтровывали и фильтрат концентрировали и снова осаждали в воде. Белый осадок промывали холодной водой, а затем сушили с использованием лиофилизатора. Требуемую соль (33 г, выход 96%) получили в виде белого порошка с 98,6% чистотой (LC/UV).
6.8 ПРИМЕР 8: ПЕРОРАЛЬНОЕ ЛЕЧЕНИЕ ОПОСРЕДУЕМОГО НОНСЕНС-МУТАЦИЕЙ КИСТОЗНОГО ФИБРОЗА
В данном примере представлена иллюстративная схема дозирования, пригодная для лечения опосредуемого нонсенс-мутацией кистозного фиброза.
3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат, предоставляют в виде ароматизированного ванилью порошка для суспендирования. Лекарственное средство изготавливают согласно текущим условиям Good Manufacturing Practice (cGMP). Состав может включать связующие и суспендирующие вещества, поверхностно-активные вещества, и различные второстепенные эксципиенты, которые способствуют процессу изготовления. Смесь можно упаковывать в 40-мл пластмассовые (полиэтилен с высокой плотностью [HDPE]) флаконы, закрытые слоем фольги и белой пластмассовой крышкой с защитой от детей. Каждый флакон может содержать 125, 250 или 1000 мг лекарственного вещества, которое составляет 25,0% от общей массы состава. Альтернативно смесь может быть предоставлена в составе для саше, таком как указано в примере 12. Эксципиенты (и их доли от общей массы состава) включают суспендирующее вещество (Litesse® Ultra [очищенная полидекстроза] - 25,7%), связующее вещество, которое также может скрывать вкус (маннит - 25,0%), поверхностно-активные вещества (полиэтиленгликоль 3350 - 12,8% и Lutrol® micro F 127 [порошок полоксамера 407] - 3,7%), дезинтегрирующее вещество (кросповидон - 5,0%), и могут присутствовать другие эксципиенты, доля каждого из которых составляет менее 2% (гидроксиэтилцеллюлоза, ванильный ароматизатор, стеарат магния [не бычий], и коллоидный диоксид кремния). На ярлыках на флаконе указано название лекарственного вещества, номер партии, количество лекарственного вещества, и условия хранения (например, комнатная температура или охлаждение до от 5° до 8°C).
Дозирование лекарственного вещества основано на миллиграммах лекарственного средства на килограмм массы тела пациента. Дозу лекарственного вещества можно округлять, чтобы она согласовывалась с доступным размером флакона. Схема дозирования обеспечивает, чтобы общая истинная вводимая доза никогда не составляла на <50 мг менее или на >250 мг более намеченной дозы (т.е. всегда находилась в пределах 5 мг/кг от назначенного уровня дозы). Например, для пациента массой 40 кг, которого лечат дозой 4 мг/кг, вычисленная доза будет составлять 160 мг. Этому пациенту будут давать один 250-мг флакон (всего 250 мг) или 6,25 мг/кг/доза. Для того же пациента, когда его лечат дозой 8 мг/кг вечером, вычисленная доза будет составлять 320 мг и он будет получать два 250 мг флакона (всего 500 мг) или 12,5 мг/кг. Для того же пациента, когда его лечат дозой 10 мг/кг/доза, вычисленная доза будет составлять 400 мг, и он будет получать два 250-мг флакона (всего 500 мг) или 12,5 мг/кг. Для того же пациента, когда его лечат дозой 20 мг/кг вечером, вычисленная доза будет составлять 800 мг, и он будет получать один 1000-мг флакон (всего 1000 мг) или 25 мг/кг.
Разбавление и дозирование лекарственного продукта проводят при комнатной температуре. Нет необходимости в специальном нагревании лекарственного продукта перед разбавлением. Лекарственный продукт можно разбавлять любым фармацевтически приемлемым растворителем (например, водой, молоком, газированным напитком, соком, яблочным соусом, детским питанием или смесью для детского питания). В случае каждого предоставленного 250-мг флакона, добавляют ~10 мл воды или другого фармацевтически приемлемого растворителя для достижения концентрации приблизительно 25 мг/мл в общем объеме суспензии. В случае каждого предоставленного 1000-мг флакона, добавляют ~20 мл воды или другого фармацевтически приемлемого растворителя для достижения концентрации приблизительно 50 мг/мл в общем объеме суспензии. Также можно получать суспензии приблизительно 150 мг/мл. Непосредственно после добавления воды или другого фармацевтически приемлемого растворителя к сухому исследуемому лекарственному средству флакон(ы) закрывают и энергично встряхивают рукой в течение приблизительно 60 секунд для достижения гомогенности суспензии. Несмотря на то что суспензия может сохраняться в исходном пластмассовом флаконе вплоть до 24 часов перед приемом, рекомендуется, чтобы лекарственное средство принимали вскоре после разбавления. Если существует промежуток более 15 минут между разбавлением и дозированием, флакон следует повторно встряхнуть энергично рукой в течение приблизительно 60 секунд.
Лекарственное средство вводят непрерывно настолько длительно, насколько это необходимо, пациенту, имеющему кистозный фиброз, или предрасположенному к нему. В таблице 11 указаны иллюстративные ежесуточные схемы дозирования для 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата, где введение происходит три раза в сутки с интервалами 6-, 6-, и 12-часов (например, ~7:00, ~13:00 и ~19:00) с пищей. В конкретном варианте осуществления, пациенту вводят 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат, как указано в таблице 11 непрерывно в течение 14 суток, с последующими 14 сутками без лечения, с последующими дополнительными 14 сутками введения, с последующими дополнительными 14 сутками без лечения. В другом конкретном варианте осуществления пациенту вводят 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат, как указано в таблице 11, непрерывно в течение 14 суток с тремя ежесуточными дозами 4 мг/кг, 4 мг/кг и 8 мг/кг, с последующими 14 сутками без лечения, с последующими дополнительными 14 сутками введения по три ежесуточных дозы 10 мг/кг, 10 мг/кг и 20 мг/кг, с последующими 14 сутками без лечения. В определенных вариантах осуществления следуют одной ежесуточной схеме дозирования, указанной в таблице 11, каждый день. В других вариантах осуществления, можно следовать различным схемам дозирования, указанным в таблице 11, в различные дни.
Схема дозирования
Пациенты предпочтительно принимают лекарственное средство в течение 30 минут после приема пищи; в идеальном случае, лекарственное средство будут принимать приблизительно с 6-, 6 и 12-часовыми интервалами (например, в ~7:00 после завтрака, в ~13:00 после второго завтрака и в ~19:00 после ужина). Пациенты принимают лекарственное средство наполнением каждого флакона требуемым количеством воды или другого фармацевтически приемлемого растворителя, закрыванием и встряхиванием каждого флакона в течение приблизительно 60 секунд, с последующим приемом содержимого требуемого количества и размера флаконов на дозу. Полная доза разбавленного лекарственного средства подлежит применению за один раз. После приема каждый флакон для дозы заполняют наполовину водой или другим фармацевтически приемлемым растворителем, закрывают и встряхивают, и эту воду или другой фармацевтически приемлемый растворитель из флакона пациент принимает. Этот процесс промывания проводят один раз. В определенных вариантах осуществления лекарственное средство предоставлено в форме саше. В этих вариантах осуществления, соответствующее количество лекарственного средства можно взвешивать или отмерять и комбинировать с соответствующим фармацевтически приемлемым растворителем перед введением.
6.9 ПРИМЕР 9: ПЕРОРАЛЬНОЕ ЛЕЧЕНИЕ ОПОСРЕДУЕМОЙ НОНСЕНС-МУТАЦИЕЙ МЫШЕЧНОЙ ДИСТРОФИИ ДЮШЕННА
В данном примере указана иллюстративная схема дозирования для лечения опосредуемой нонсенс-кодоном мышечной дистрофии Дюшенна.
3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат, предоставляют в виде ароматизированного ванилью порошка для суспендирования. Лекарственное средство изготавливают согласно текущим условиям Good Manufacturing Practice (cGMP). Состав может включать связующие и суспендирующие вещества, поверхностно-активные вещества и различные второстепенные эксципиенты, которые способствуют процессу изготовления. Смесь можно упаковывать в 40-мл пластмассовые (полиэтилен с высокой плотностью [HDPE]) флаконы, закрытые слоем фольги и белой пластмассовой крышкой с защитой от детей. Каждый флакон может содержать 125, 250 или 1000 мг лекарственного вещества, которое составляет 25,0% от общей массы состава. Альтернативно смесь может быть предоставлена в составе для саше, таком как указано в примере 12. Эксципиенты (и их доли от общей массы состава) включают суспендирующее вещество (Litesse® Ultra [очищенная полидекстроза] - 25,7%), связующее вещество, которое также может скрывать вкус (маннит - 25,0%), поверхностно-активные вещества (полиэтиленгликоль 3350 - 12,8% и Lutrol® micro F 127 [порошок полоксамера 407] - 3,7%), дезинтегрирующее вещество (кросповидон - 5,0%), и могут присутствовать другие эксципиенты, доля каждого из которых составляет менее 2% (гидроксиэтилцеллюлоза, ванильный ароматизатор, стеарат магния [не бычий] и коллоидный диоксид кремния). На ярлыках на флаконе указано название лекарственного вещества, номер партии, количество лекарственного вещества и условия хранения (например, комнатная температура или охлаждение до от 5° до 8°C).
Дозирование лекарственного средства основано на миллиграммах лекарственного средства на килограмм массы тела пациента. Необходимо вычислять общую величину, соответствующую общему количеству в миллиграммах лекарственного средства, подлежащего введению пациенту. Например, пациенту массой 30 кг надлежит вводить 4 мг/кг, тогда доставляемая доза будет составлять 30×4=120 мг. Этому пациенту следует проводить дозирование с использованием флакона с дозой 250 мг. Поскольку каждый мл суспензии во флаконе с дозой 250 мг содержит 250/10=25 мг лекарственного средства, этому пациенту следует принимать 120/25=~5 мл суспензии для каждой дозы 4 мг/кг). Для того же пациента, когда ему вводят дозу 8 мг/кг вечером, вычисленная доза будет составлять 240 мг, и он будет получать один 250-мг флакон (10 мл суспензии). Эти объемы суспензий для соответствующих доз следует отбирать из флакона с лекарственным средством с использованием пластмассового шприца для перорального дозирования. Для переноса фракционных объемов <10 (для флакона с 250 мг) или <20 мл (для флакона с 1000 мг), требуемое количество следует отбирать из исследуемого флакона с лекарственным средством дозирующим шприцом соответствующего типа и размера (например, Baxa, Exacta-Med, калиброванном, не содержащим латекса, пластмассовым пероральным дозирующим шприцом) и дозировать с использованием того же шприца. В ходе тех же 24 часов после разбавления, из того же флакона с суспензией можно принимать >1 дозы; однако разбавленное лекарственное средство не следует хранить более 24 часов с намерением применения этого материла снова для многократных доз у того же пациента. Если общее количество лекарственного средства, подлежащее приему в течение 1 суток, превышает 10 мл (для флакона с 250 мг) или 20 мл (для флакона с 1000 мг) разбавленного лекарственного средства, тогда для каждого дозирования следует использовать новый флакон лекарственного средства.
Для схемы дозирования с TID можно следовать следующему округлению дозы лекарственного средства:
(4 мг/кг)
(4 мг/кг)
[3-6 мг/кг]
[3-6 мг/кг]
[7-10 мг/кг]
Для схемы дозирования с ВID, можно следовать следующему округлению дозы лекарственного средства:
(8 мг/кг)
(8 мг/кг)
[Диапазон]
[7-10 мг/кг]
[7-10 мг/кг]
Разбавление и дозирование лекарственного продукта проводят при комнатной температуре. Нет необходимости в специальном нагревании лекарственного продукта перед разбавлением. Лекарственный продукт можно разбавлять любым фармацевтически приемлемым растворителем (например, водой, молоком, газированным напитком, соком, яблочным соусом, детским питанием или смесью для детского питания). В случае каждого предоставленного 250-мг флакона, добавляют ~10 мл воды или другого фармацевтически приемлемого растворителя для достижения концентрации приблизительно 25 мг/мл в общем объеме суспензии. В случае каждого предоставленного 1000-мг флакона, добавляют ~20 мл воды или другого фармацевтически приемлемого растворителя для достижения концентрации приблизительно 50 мг/мл в общем объеме суспензии. Непосредственно после добавления воды или другого фармацевтически приемлемого растворителя к сухому исследуемому лекарственному средству флакон(ы) закрывают и энергично встряхивают рукой в течение приблизительно 60 секунд для достижения гомогенности суспензии. Несмотря на то что суспензия может сохраняться в исходном пластмассовом флаконе вплоть до 24 часов перед приемом, рекомендуется, чтобы лекарственное средство принимали вскоре после разбавления. Если существует промежуток более 15 минут между разбавлением и дозированием, флакон следует повторно встряхнуть энергично рукой в течение приблизительно 60 секунд.
Лекарственное средство вводят непрерывно настолько длительно, насколько это необходимо, пациенту, имеющему мышечную дистрофию Дюшенна, или предрасположенному к нему. В таблице 12 указаны иллюстративные ежесуточные схемы дозирования для 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата, где введение проводят два раза в сутки с интервалом в 12 часов (например, ~7:00 и ~19:00) или три раза в сутки с интервалами 6-, 6-, и 12-часов (например, ~7:00, ~13:00 и ~19:00) с пищей. В конкретном варианте осуществления, пациенту вводят 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат, как указано в таблице 12 непрерывно в течение от 14 до 28 суток. В определенных вариантах осуществления следуют одной ежесуточной схеме дозирования, указанной в таблице 12, каждый день. В других вариантах осуществления, можно следовать различным схемам дозирования, указанным в таблице 12, в различные дни.
Схема дозирования
ВID, дозирование с едой
TID, дозирование с едой
TID, дозирование с едой
TID, дозирование с едой
Пациенты предпочтительно принимают лекарственное средство в течение 30 минут после приема пищи; в идеальном случае, лекарственное средство будут принимать приблизительно с 6-, 6 и 12-часовыми интервалами (например, в ~7:00 после завтрака, в ~13:00 после второго завтрака и в ~19:00 после ужина). Пациенты принимают лекарственное средство наполнением каждого флакона требуемым количеством воды или другого фармацевтически приемлемого растворителя, закрыванием и встряхиванием каждого флакона в течение приблизительно 60 секунд, с последующим приемом содержимого требуемого количества и размера флаконов на дозу. Полная доза разбавленного лекарственного средства подлежит применению за один раз. После приема каждый флакон для дозы заполняют наполовину водой или другим фармацевтически приемлемым растворителем, закрывают и встряхивают, и эту воду или другой фармацевтически приемлемый растворитель из флакона пациент принимает. Этот процесс промывания проводят один раз. В определенных вариантах осуществления, лекарственное средство предоставлено в форме саше. В этих вариантах осуществления, соответствующее количество лекарственного средства можно взвешивать или отмерять и комбинировать с соответствующим фармацевтически приемлемым растворителем перед введением.
Эффективность лечения можно определять посредством изменения относительно исходных показателей уровней дистрофина в биоптате короткого разгибателя пальцев стопы (EDB).
6.10 ПРИМЕР 10: ПОЛУЧЕНИЕ НЕАРОМАТИЗИРОВАННЫХ ДОЗИРОВОК 3-[5-(2-ФТОРФЕНИЛ)-[1,2,4]ОКСАДИАЗОЛ-3-ИЛ]БЕНЗОЙНОЙ КИСЛОТЫ ИЛИ ЕЕ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМОЙ СОЛИ, СОЛЬВАТА ИЛИ ГИДРАТА
3-[5-(2-Фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат предоставлены в качестве порошка для суспендирования. Лекарственное средство изготавливают согласно текущим условиям Good Manufacturing Practice (cGMP). Лекарственное средство можно гомогенно смешивать со связующими и суспендирующими веществами, поверхностно-активными веществами и различными второстепенными эксципиентами, которые способствуют процессу изготовления. Смесь упаковывают в 40-мл пластмассовые (полиэтилен с высокой плотностью [HDPE]) флаконы, закрытые слоем фольги и белой пластмассовой крышкой с защитой от детей. Каждый флакон может содержать 35 мг, приблизительно 70 мг, приблизительно 125 мг, приблизительно 140 мг, приблизительно 175 мг, приблизительно 250 мг, приблизительно 280 мг, приблизительно 350 мг, приблизительно 560 мг, приблизительно 700 мг, приблизительно 1000 мг или приблизительно 1400 мг 3-[5-(2-Фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата. Эксципиенты (и их доли от общей массы состава) включают суспендирующее вещество (Litesse® Ultra [очищенная полидекстроза] - 25,7%), связующее вещество, которое также может скрывать вкус (маннит - 25,0%), поверхностно-активные вещества (полиэтиленгликоль 3350 - 12,8% и Lutrol® micro F 127 [порошок полоксамера 407] - 3,7%), дезинтегрирующее вещество (кросповидон - 5,0%), и могут присутствовать другие эксципиенты, доля каждого из которых составляет менее 2% (cab-o-sil, гидроксиэтилцеллюлоза, ванильный ароматизатор, стеарат магния [не бычий] и коллоидный диоксид кремния). На ярлыках на флаконе указано название лекарственного вещества, номер партии, количество лекарственного вещества, и условия хранения (например, охлаждение до от 5° до 8°C). Перед введением лекарственный продукт разбавляют соответствующим объемом фармацевтически приемлемого растворителя (например, воды, молока, газированного напитка, сока, яблочного соуса, детского питания или смеси для детского питания).
6.11 ПРИМЕР 11: ПОЛУЧЕНИЕ АРОМАТИЗИРОВАННЫХ ДОЗИРОВОК 3-[5-(2-ФТОРФЕНИЛ)-[1,2,4]ОКСАДИАЗОЛ-3-ИЛ]БЕНЗОЙНОЙ КИСЛОТЫ ИЛИ ЕЕ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМОЙ СОЛИ, СОЛЬВАТА ИЛИ ГИДРАТА
3-[5-(2-Фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат предоставляют в качестве порошка для суспендирования со вкусом ванили (например, посредством добавления экстракта ванили). Лекарственное средство изготавливают согласно текущим условиям Good Manufacturing Practice (cGMP). Лекарственное средство можно гомогенно смешивать со связующими и суспендирующими веществами, поверхностно-активными веществами и различными второстепенными эксципиентами, которые способствуют процессу изготовления. Смесь упаковывают в 40-мл пластмассовые (полиэтилен с высокой плотностью [HDPE]) флаконы, закрытые слоем фольги и белой пластмассовой крышкой с защитой от детей. Каждый флакон может содержать 35 мг, приблизительно 70 мг, приблизительно 125 мг, приблизительно 140 мг, приблизительно 175 мг, приблизительно 250 мг, приблизительно 280 мг, приблизительно 350 мг, приблизительно 560 мг, приблизительно 700 мг, приблизительно 1000 мг или приблизительно 1400 мг 3-[5-(2-Фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата. Эксципиенты (и их доли от общей массы состава) включают суспендирующее вещество (Litesse® Ultra [очищенная полидекстроза] - 25,7%), связующее вещество, которое также может скрывать вкус (маннит - 25,0%), поверхностно-активные вещества (полиэтиленгликоль 3350 - 12,8% и Lutrol® micro F 127 [порошок полоксамера 407] - 3,7%), дезинтегрирующее вещество (кросповидон - 5,0%), и могут присутствовать другие эксципиенты, доля каждого из которых составляет менее 2% (cab-o-sil, гидроксиэтилцеллюлоза, ванильный ароматизатор, стеарат магния [не бычий], и коллоидный диоксид кремния). На ярлыках на флаконе указано название лекарственного вещества, номер партии, количество лекарственного вещества, и условия хранения (например, охлаждение до от 5° до 8°C). Перед введением лекарственный продукт разбавляют соответствующим объемом фармацевтически приемлемого растворителя (например, воды, молока, газированного напитка, сока, яблочного соуса, детского питания или смеси для детского питания).
6.12 ПРИМЕР 12: СОСТАВ 3-[5-(2-ФТОРФЕНИЛ)-[1,2,4]ОКСАДИАЗОЛ-3-ИЛ]БЕНЗОЙНОЙ КИСЛОТЫ ИЛИ ЕЕ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМОЙ СОЛИ, СОЛЬВАТА ИЛИ ГИДРАТА ДЛЯ САШЕ
Смесь упаковывают с использованием мешочка или саше, который состоит из нескольких наслоенных слоев, которые могут включать бумажный слой, слой алюминиевой фольги и слой сурлина. Каждый саше может содержать приблизительно 125 мг, приблизительно 250 мг, приблизительно 500 мг или приблизительно 1000 мг 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата. Эксципиенты (и их соотношения относительно общей массы состава) необязательно включают любой из следующих эксципиентов, как указано в таблице 13 и таблице 14.
Состав
Состав
Затем на саше прикрепляют ярлык, указывающий название лекарственного вещества, номер партии, количество лекарственного вещества, и условия хранения (например, охлаждение до от 5° до 8°C). Перед введением лекарственный продукт разбавляют соответствующим объемом фармацевтически приемлемого растворителя (например, воды, молока, газированного напитка, сока, яблочного соуса, детского питания или смеси для детского питания).
6.13 ПРИМЕР 13: АНАЛИЗ ТРАНСЭПИТЕЛИАЛЬНОЙ РАЗНОСТИ ПОТЕНЦИАЛОВ (TEPD)
Определение трансэпителиальной разности потенциалов (TEPD), также известной как разность потенциалов в носу, обеспечивает чувствительную оценку транспорта натрия и хлорида непосредственно в секреторных эпителиальных клетках через оценку трансэпителиальных биоэлектрических свойств (Knowles et al., 1981, N. Engl. J. Med. 305(25): 1489-95; Knowles et al., 1995, Hum. Gene Then 5:445). TEPD проводят в каждой ноздре с использованием стандартных способов (Standaert et al., 2004, Ped Pulm. 57:385-92). В этом способе небольшой пластмассовый катетер используют для оценки электрической разности потенциала на наружной клеточной мембране клеток слизистой оболочки носа в ноздре. Значения TEPD выражают в милливольтах, или mV. Проводимость хлоридов, равную или более электрически отрицательную, чем -5,0 мВ, как правило, считают относящейся к нормальному диапазону. Оценку TEPD проводят на клетках эпителия носа, выстилающих нижнюю носовую раковину, поскольку доступ к этим клеткам легче, чем к респираторным эпителиальным клеткам, выстилающим нижние дыхательные пути, и было показано, что они обладают такими же характеристиками транспорта ионов (Knowles et al., 1981, Am. Rev. Respir. Dis. 124(4):484-90). Оценку TEPD также можно проводить на эпителиальных клетках прямой кишки и эпителиальных клетках нижних дыхательных путей. Вследствие роли белка CFTR в транспорте ионов хлорида через клеточные мембраны, и вследствие отсутствия этого белка пациенты с кистозным фиброзом обладают нарушенной TEPD для проводимости хлоридов. В качестве результата, TEPD обладает тем преимуществом, что он может выявлять изменения транспорта хлорида, которые являются количественным суммарным показателем наличия, функциональной активности и апикального расположения CFTR в клетках дыхательных путей. Более того, он является прямым показателем активности CFTR, которая, вероятно, не изменяется посредством поддерживающих или паллиативных лекарственных средств от CF (с возможным исключением системно вводимых аминогликозидных антибиотиков). Важными являются данные, что величины TEPD могут коррелировать со степенью легочной дисфункции и радиографическими нарушениями (Ho et al., 1997, Eur. Respir. J. 10(9):2018-22; Fajac et al., 1998, Eur. Respir. J. 12(6):1295-300; Sermet-Gaudelus et al., 2005, Am. J. Respit. Crit. Care Med. 171(9):1026-1031). В частности, оценка TEPD для индуцируемой изопротеренолом активности CFTR в отношении хлорида показала лучшую предсказательную ценность, чем генотип, при определении FEV1 и радиологического показателя (Ho et al., 1997, Eur Respir J. 10(9):2018-22). В исходных условиях очень маловероятно, что оцененная посредством TEPD активность хлоридных каналов нормализуется спонтанно у пациентов с CF; ожидают, что любые выявленные улучшения оцененной посредством TEPD активности хлоридных каналов конкретно указывают на фармакологическую активность корректирующих CFTR лекарственных средств. Таким образом, он стал основным результатом фармакологических исследований и исследований с генным замещением фаз 1-2, нацеленных на коррекцию дисфункции CFTR (Peckham et al., 1995, AJ. Clin Sci (London). 89(3):277-84; Wilschanski et al., 2003, N. Engl. J. Med. 349(15):1433-41).
6.14 ПРИМЕР 14: ИММУНОФЛУОРЕСЦЕНЦИЯ CFTR
Сбор и обработку соскоба слизистой оболочки носа из каждой ноздри пациента для определения белка CFTR посредством иммунофлуоресценции и количественного определения мРНК CFTR проводят с использованием стандартизованных способов (Clancy et al., 2001, Am. J. Respir. Crit. Care Med. 163(7):1683-92; Amaral et al., 2004, J. Cyst. Fibros. 3 Suppl 2:17-23). Иммунофлуоресцентное окрашивание нормальных эпителиальных клеток (например, из соскобов слизистой оболочки носа) выявляет наличие большей части белка CFTR на апикальной поверхности. В моделях на животных опосредуемого нонсенс-кодоном CF или у пациентов с опосредуемым нонсенс-кодоном CF, окрашивание CFTR отсутствует (например, у пациентов, гомозиготных по мутации с преждевременной терминацией) или, главным образом, выявляется в перинуклеарной области (например, у пациентов с мутацией ∆F508, которая препятствует нормальному внутриклеточному транспорту CFTR). Успешная продукция функционального белка CFTR дикого типа и не дикого типа в обеих моделях на животных ассоциирована с повторным возникновением белка CFTR в апикальном эпителии, при оценке посредством иммунофлуоресценции (Clancy et al., 2001, Am. J. Respir. Crit. Care Med. 163(7):1683-92; Wilschanski et al., 2003, N. Engl. J. Med. 349(75): 1433-41).
6.15 ПРИМЕР 15: ТЕСТЫ ЛЕГОЧНОЙ ФУНКЦИИ
Тесты легочной функции, включая FEV1, FVC и MEF25-75, проводят с использованием стандартных способов спирометрии. Оценка легочной функции (включая MEF25-75, FVC, и, в частности, FEV1) известна в качестве характерных клинических результатов у пациентов с CF (Food and Drug Administration, 62nd Anti-Infective Drugs Advisory Committee. Discussion of NDA for tobramycin solution for inhalation (Tobi®) for the management of cystic fibrosis patients. November, 1997; Tiddens, 2002, Pediatr. Pulmonol 34(3): 228-31). Было показано, что FEV1 и показатели других тестов легочной функции коррелируют с тяжестью заболевания, предсказывают заболеваемость с точки зрения использования медицинских ресурсов и применения внутривенных антибиотиков, и указывают на риск связанной с CF смертности (Food and Drug Administration, 62nd Anti-Infective Drugs Advisory Committee. Discussion of NDA for tobramycin solution for inhalation (Tobi®) for the management of cystic fibrosis patients. November, 1997). Тестирование легочной функции просто проводить (даже у пациентов в возрасте до 7 лет), и для них используют стандартное оборудование и способы, которые широко доступны. Интерпретацию проводят с использованием общепринятых стандартных уравнений, которые учитывают возраст пациента, рост и пол. Улучшение FEV1 признано количественно демонстрирующим значительную клиническую пользу при CF, и оно служит в качестве основы для разрешения контролирующего органа дорназы альфа и ингалируемого тобрамицина (Food and Drug Administration, 62nd Anti-Infective Drugs Advisory Committee. Discussion of NDA for tobramycin solution for inhalation (Tobi®) for the management of cystic fibrosis patients. November, 1997).
6.16 ПРИМЕР 16: ИССЛЕДОВАНИЕ 2 ФАЗЫ 3-[5-(2-ФТОРФЕНИЛ)-[1,2,4]ОКСАДИАЗОЛ-3-ИЛ]БЕНЗОЙНОЙ КИСЛОТЫ В КАЧЕСТВЕ ПЕРОРАЛЬНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ ОПОСРЕДУЕМОГО НОНСЕНС-МУТАЦИЕЙ КИСТОЗНОГО ФИБРОЗА
Для того чтобы пациенты могли быть выбранными для включения в исследование, они должны удовлетворять всем из следующих условий:
1. Диагноз CF на основе документированных данных о безусловно аномальной потовой пробе (хлорид пота >60 мэкв./литр посредством ионтофореза пилокарпина (LeGrys, Sweat testing:Sample collection and quantitative analysis: Approved guidelines - Second edition. National Committee for Clinical Laboratory Standards 2000; Vol 20:14)).
2. Аномальная секреция хлорида при измерении посредством TEPD (оценка секреции хлорида посредством TEPD более положительная, чем -5 мВ с помощью не содержащего хлорида амилорида и изопротеренола).
3. Наличие нонсенс-мутации в одном из аллелей гена cftr.
4. Документация о том, что проведено секвенирование гена cftr.
5. Возраст ≥18 лет.
6. Масса тела ≥40 кг.
7. FEV1≥40% от предсказанного по возрасту, полу и росту (стандарты Knudson) (Knudson, 1983, Am. Rev. Respir Dis. 127: 725-734).
8. Насыщение кислородом (при измерении пульсовой оксиметрией) ≥92% при комнатном воздухе.
9. Готовность пациентов-мужчин и пациентов-женщин, если они не являются стерильными посредством хирургических способов, к воздержанию от половых актов или к применению барьерного или медицинского способа контрацепции в ходе введения лекарственного средства и периодов наблюдения в исследовании.
10. Отрицательный тест на беременность (для женщин со способностью к деторождению).
11. Готовность и способность соблюдать посещения по расписанию, план введения лекарственного средства, способы исследования (включая измерение TEPD, клинические лабораторные тесты и забор образцов для PK sampling) и ограничения исследования.
12. Способность предоставить письменное информированное согласие; и
13. Подтверждение о лично подписанном и датированном документе об информированном согласии, указывающем на то, что пациент проинформирован обо всех аспектах, имеющих отношение к испытанию.
Наличие любого из следующих состояний исключало включение пациента в исследование.
1. Предшествующее или продолжающееся медицинское состояние (например, сопутствующее недомогание, психиатрическое состояние, алкоголизм, зависимость от лекарственных средств), медицинский анамнез, данные физического обследования, данные ЭКГ, или лабораторные нарушения, которые, по мнению исследователя, могут оказать неблагоприятное влияние на безопасность пациента, делают маловероятным, что курс лечения или наблюдения будет завершен или могут нарушить оценку результатов исследования.
2. Текущее острое заболевание, включающее острые респираторные инфекции верхних и нижних дыхательных путей в пределах 2 недель до начала исследуемого лечения.
3. Анамнез серьезных осложнений заболевания легкого (включая недавнее массивное кровохаркание или пневмоторакс) в пределах 2 месяцев перед началом исследуемого лечения.
4. Нарушения при скрининговой рентгенографии грудной клетки, подтверждающие клинически значимое активное легочное заболевание, отличное от CF, или новые значительные нарушения, такие как ателектаз или плевральный выпот, которые могут указывать на клинически значимое активное легочное вовлечение, вторичное для CF.
5. Положительный поверхностный антиген вируса гепатита B, тест на антитела к вирусу гепатита C, или тест на вирус иммунодефицита человека (HIV).
6. Гемоглобин <10 г/дл.
7. Сывороточный альбумин <2,5 г/дл.
8. Нарушение функции печени (общий сывороточный билирубин >верхней границы нормы, или ALT, AST или GGT сыворотки >2,0 раза превышают верхнюю границу нормы).
9. Нарушение функции почек (креатинин сыворотки >1,5 раз превышает верхнюю границу нормы).
10. Беременность или грудное вскармливание.
11. Трансплантация солидного органа или гематологическая трансплантация в анамнезе.
12. Воздействие другого находящегося на исследовании лекарственного средства в пределах 14 суток перед началом исследуемого лечения.
13. Продолжающееся участие в любом другом терапевтическом клиническом испытании.
14. Продолжающееся применение агонистов рецептора, активируемого пероксисомальным пролифератором (PPAR γ) на основе тиазолидиндиона, например, розиглитазона (Avandia® или его эквивалента) или пиоглитазона (Actos® или его эквивалента).
15. Смена интраназальных лекарственных средств (включая применение кортикостероидов, кромолина, ипратропиума бромида, фенилэфрина или оксиметазолина) в пределах 14 суток перед началом исследуемого лечения.
16. Смена лечения системными или ингалируемыми кортикостероидами в пределах 14 суток перед началом исследуемого лечения.
17. Применение или потребность в ингалируемом гентамицине или амикацине в пределах 14 суток перед началом исследуемого лечения или в ходе исследуемого лечения; или
18. Потребность в системных аминогликозидных антибиотиках в пределах 14 суток перед началом исследуемого лечения.
3-[5-(2-Фторфенил)-[1,2,4]оксадиазол-3-ил]бензойная кислота была предоставлена в составе, описанном в настоящем документе. 15 пациентам (12 из испытания 2 фазы, проводимого в Израиле и 3 из испытания 2 фазы, проводимого в США; семь пациентов были мужчинами и 8 пациентов были женщинами; средний возраст пациентов составлял 22 года; и все пациенты имели несколько признаков и симптомов кистозного фиброза, включая некоторую степень дисфункции легких) перорально вводили 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту в соответствии со следующей схемой в течение 56 суток: введение 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты три раза в сутки (TID) в дозе 4 мг/кг, 4 мг/кг и 8 мг/кг в течение 14 суток, с последующим отсутствием введения в течение 14 суток (курс 1, состоящий из 28 суток), с последующим введением 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты три раза в сутки (TID) в количестве 10 мг/кг, 10 мг/кг и 20 мг/кг в течение 14 суток, с последующим отсутствием введения в течение 14 суток (курс 2, состоящий из 28 суток).
Клинические результаты оценивали с использованием способов, указанных выше. Измерение TEPD проводили перед лечением и на 14 и 28 сутки курса 1 и курса 2.
Перед лечением и на 14 и 28 сутки курса 1 и курса 2 проводили сбор соскобов слизистой оболочки носа из каждой ноздри каждого пациента. Легочные тесты, включая FEV1, FVC и MEF25-75, проводили перед лечением, на 1 сутки курса 2, на 13 или 14 сутки курса 1 и 13 или 14 сутки курса 2 в исследовании, проводимом в Израиле, и те же параметры определяли перед лечением и на 13 или 14 сутки курса 2 в исследовании, проводимом в США.
Среднее изменение проводимости хлорида посредством TEPD. Это представляет собой среднее значение изменений от начала до конца периода введения в проводимости хлорида посредством TEPD у каждого участника исследований. Например, если изменение проводимости хлорида посредством TEPD у каждого из трех участников составляло -7,0 мВ, -2,0 мВ и -9,0 мВ, то среднее изменение проводимости хлорида посредством TEPD среди этих участников составляет -6,0 мВ.
Процентное количество пациентов с ответом в проводимости хлорида. Оно представляет собой процентное количество пациентов, у которых был показан ответ в проводимости хлорида посредством TEPD в конце лечения 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой. Для целей испытаний ответ по проводимости хлорида определяют как улучшение проводимости хлорида посредством TEPD, составляющее, по меньшей мере, -5 мВ. Например, у пациента с величиной проводимости хлорида посредством TEPD +1,0 мВ на исходном уровне и величиной проводимости хлорида посредством TEPD -6,0 мВ в конце лечения, улучшение проводимости хлорида посредством TEPD составляет -7,0 мВ, что соответствует ответу по проводимости хлорида.
Процентное количество пациентов с улучшениями величин проводимости хлорида посредством TEPD до нормального диапазона. Как указано выше, проводимость хлорида, равную или более электрически отрицательную, чем -5,0 мВ, как правило, считают находящейся в нормальном диапазоне. Таким образом, пациента с величиной проводимости хлорида посредством TEPD +1,0 мВ на исходном уровне считают имеющим нарушенную величину, поскольку эта величина является более электрически положительной, чем -5,0 мВ. Если, после лечения, эта величина проводимости хлорида посредством TEPD у пациента улучшается до -6,0 мВ, это будет соответствовать улучшению до нормального диапазона, поскольку улучшенная величина является более электрически отрицательной, чем -5,0 мВ.
Исходя из пола, возраста и роста пациента, среднее значение FEV1 в начале исследования составляло 66% от нормального, и среднее значение FVC в начале исследования составляло 80% от нормального. У четырнадцати из 15 пациентов, включенных в анализ, дыхательные пути были колонизированы Pseudomonas aeruginosa, распространенной бактериальной инфекцией у пациентов с кистозным фиброзом, которая может привести к тяжелой пневмонии. Четырнадцать из 15 пациентов также имели недостаточность поджелудочной железы, и им требовалось хроническая заместительная терапия ферментами поджелудочной железы. Пациенты имели низкую массу тела, со средней массой тела 58,3 кг при включении в исследование.
В таблице 15 представлены результаты TEPD для 15 пациентов. Для каждого показателя результаты представлены, исходя из наилучшего значения из ноздрей и среднего значения для обеих ноздрей. Исторически, результаты тестов TEPD, как правило, предоставляют, исходя из лучшего значения для ноздрей. Однако последние в последних руководствах, созданных Cystic Fibrosis Therapeutics Development Network, рекомендуется, чтобы результаты TEPD были предоставлены на основании обоих значений. Было отмечено улучшение проводимости хлорида посредством TEPD у пациентов с различными типами нонсенс-мутаций в гене CFTR.
Эффекты лечения на нижнем и верхнем уровнях дозы 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты были статистически не значимыми, подтверждая, что последующее повышение дозы может быть необязательным и что даже более низкие дозы 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты могут быть эффективными в отношении улучшения проводимости хлорида посредством TEPD. Также были выявлены статистически значимые результаты и положительные тенденции для вторичных результатов. В частности, несмотря на то что испытания не были мощными для детекции статистически значимых изменений вторичных результатов, к концу курса лечения были выявлены статистически значимые улучшения более высокой дозой в средних значениях FEV1, FVC и массы тела пациентов относительно включения в исследование. В таблице 16 представлены результаты. Для изменений легочной функции один пациент не был включен, поскольку этому пациенту не проводили определение функции легких в конце курса лечения более высокой дозой.
Промежуточные параметры PK для 3-[5-(2-фторфенил)-[l,2,4]оксадиазол-3-ил]бензойной кислоты у этих 15 пациентов описаны в таблице 17. Не выявлено отличий в параметрах PK по полу.
Кроме того, несмотря на то что изменения симптомов у пациента не были формально определены с использованием анкеты о качестве жизни, исследователям в испытании было предложено спрашивать об изменениях симптомов кистозного фиброза у пациентов. Из 15 пациентов, включенных в промежуточный анализ, 6 сообщили об общем улучшении состояния здоровья, 6 сообщили о снижении кашля и 10 сообщили о снижении вязкости слизи и более легком отделении слизи.
Протокол исследования второй фазы 2 для применения 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты в качестве перорального лечения опосредуемого нонсенс-мутацией кистозного фиброза представлен ниже.
Лечение будут проводить посредством двух курсов по 28 суток. Каждый курс будет включать 14 суток непрерывного ежесуточного введения 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты, с последующими планируемыми 14 сутками без исследуемого лекарственного средства, если необходимо, введение во 2 курсе можно начинать уже через 10 суток или не позднее чем через 28 суток после последней дозы 3-[5-(2-фторфенил)-[l,2,4]оксадиазол-3-ил]бензойной кислоты в курсе 1.
Пациентам в группе 1 будут вводить 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту TID в дозах 4 мг/кг, 4 мг/кг и 8 мг/кг с промежутками 6, 6, и 12 часов (± ~30 минут) в курсе 1, соответственно. В идеальном случае, каждую дозу следует принимать в пределах ~30 минут после приема пищи (например, в ~7:00 после завтрака, ~13:00 после второго завтрака и в ~19:00 после обеда). Планируемое изменение схемы дозирования будут проводить во втором курсе, так что пациент в этой группе будет получать 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту в дозах 8 мг/кг BID в курсе 2. В идеальном случае, каждую дозу следует принимать в пределах ~30 минут после приема пищи (например, в ~7:00 после завтрака и в ~19:00 после обеда).
Пациентам в группе 2 будут вводить 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту BID в дозах 8 мг/кг с интервалами 12 часов (±~30 минут) в курсе 1. В идеальном случае, каждую дозу следует принимать в пределах ~30 минут после приема пищи (например, в ~7:00 после завтрака и в ~19:00 после обеда). Планируемое изменение схемы дозирования будут проводить во втором курсе, так что каждый пациент в этой группе будет получать 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту в дозах 4 мг/кг, 4 мг/кг и 8 мг/кг TID в курсе 2. В идеальном случае, каждую дозу следует принимать в пределах ~30 минут после приема пищи (например, ~7:00 после завтрака, в ~13:00 после второго завтрака и в ~19:00 после обеда).
6.17 ПРИМЕР 17: ЭКСПРЕСИЯ ДИСТРОФИНА, САРКОГЛИКАНА И ДИСТРОГЛИКАНА ПОСЕРДСТВОМ ИММУНОФЛУОРЕСЦЕНЦИИ И ВЕСТЕРН-БЛОТТИНГА
Биопсию мышцы EDB и расположенной над ней кожи одной стопы проводят под местной анестезией и при седативном воздействии на сознание (в некоторых случаях, может требоваться общая анестезия) перед лечением, и из другой стопы на последние сутки лечения. Процесс биопсии проводят с использованием стандартных способов (Stedman, 2000, Human Gene Therapy 11:777-90). В этом процессе извлекают целое мышечное брюшко (когда это возможно). В момент сбора биоптата перед лечением образец мышцы разделяют, по меньшей мере, на 3 фрагмента, и образец биоптата, полученный на последние сутки лечения, разделяют, по меньшей мере, на 2 фрагмента. Образец биоптата помещают на марлевый тампон telfa, смоченный солевым раствором Рингера. Образец биоптата рассматривают при низком увеличении под стереоскопическим препаровальным микроскопом для определения ориентации волокон. Затем мышцу пересекают поперечно с использованием острого скальпеля (перпендикулярно ориентации волокон), когда это возможно, и оставляют в течение 2 минут для обеспечения прекращения спазма. Затем образец замораживают в охлажденном жидким азотом изопентане, переносят в резервуар с жидким азотом и держат на 1 дюйм выше поверхности раздела жидкость/пар в течение 2 минут при медленном охлаждении и выпаривании изопентана, затем погружают в жидкий азот и заворачивают в предварительно охлажденную (в жидком азоте и посредством держания на сухом льду) фольгу, на которой указан номер исследования, номер участка, номер пациента, дата, инициалы пациента и сторона стопы (правая стопа или левая стопа).
Все контейнеры с образцами отчетливо маркируют с указанием субъекта и даты сбора образцов. Ярлыки фиксируют к контейнерам с образцами таким образом, чтобы предотвратить отклеивание ярлыка. Сразу после этого процесса образцы транспортируют для анализа/культивирования/основного исследования. Для детекции дистрофина используют 3 коммерчески доступных антитела, которые распознают C-конец, N-конец и стержневой домен белка. Для детекции комплекса саркогликана и дистрогликана, используют коммерчески доступные антитела против α-, β-, γ- и δ-саркогликана и β-дистрогликана, когда это возможно. В анализе используют эпифлуоресцентную микроскопию; изображения фиксируют посредством камеры CCD после нормализации интенсивности флуоресценции относительно нормального образца мышцы. Изображения хранят в цифровом виде и сохраняют для последующего осмотра и конечной оценки при завершении исследования. Также ткани обрабатывают для детекции дистрофина, саркогликанов и β-дистрогликана посредством вестерн-блоттинга с использованием тех же антител. Микроскопические изображения фиксируют и сохраняют для последующего осмотра и для конечной оценки при завершении исследования. Остальные образцы мышечной ткани сохраняют для подтверждающих анализов мРНК и белков, вовлеченных в DMD. Для детекции белка используют иммунное окрашивание и вестерн-блоттинг.
Биопсию мышц обычно проводят у субъектов DMD в качестве компонента диагностики и при измерении терапевтического эффекта в контексте научных исследований. EDB была выбрана, поскольку она не является необходимой мышцей для каждодневной активности и, таким образом, забор образцов этой мышцы не оказывает неблагоприятных функциональных последствий для субъекта. Поскольку она используется мало, маловероятно, что мышца EDB покажет значительное фиброзное замещение мышцы, и, таким образом, обеспечит пригодную ткань для детекции продукции дистрофина. Забор образцов мышцы EDB обеспечивает дополнительные практические преимущества, поскольку ее легко идентифицировать, ее можно отсекать под местной анестезией, и она обеспечивает достаточные количества ткани для проведения требуемых анализов. Иммунофлуоресценция и вестерн-блоттинг являются общепринятыми тестами, проводимыми на биоптатах мышц для подтверждения наличия или отсутствия полноразмерного дистрофина. Отсутствие дистрофина считают подтверждением диагноза DMD. Восстановление дистрофина с локализацией в мышечной мембране, считают прямым признаком доклинической и клинической фармакодинамической активности (Barton-Davis, 1999, J. Clin. Invest.104(4):375-81; Politano, 2003, Acta Myol. 22(1):15-21).
6.18 ПРИМЕР 18: МИОМЕТРИЯ ВЕРХНИХ И НИЖНИХ КОНЕЧНОСТЕЙ
Миометрию верхней и нижней конечностей проводят с использованием ручного миометра стандартными способами (Beenakker, 2001, Neuromuscul. Disord. 11(5):441-6; Hyde, 2001, Neuromuscul. Disord. 11(2):165-70). Рекомендуется (в зависимости от исходного функционального состояния субъекта), чтобы оцениваемые группы мышц включали отводящие мышцы бедра, разгибатели колена, сгибатели и разгибатели локтя, и сжатие рукой. Можно проводить билатеральную оценку, и от каждой группы мышц можно записывать по три показателя с каждой стороны. Эти параметры подвергают мониторингу перед лечением, от вторых до последних суток лечения, и в ходе периода наблюдения после лечения. В ходе периодов до лечения и лечения, перед биопсией мышц проводят миометрию.
Миометрическая оценка с использованием ручного динамометра представляет собой чувствительный и воспроизводимый показатель мышечной силы у амбулаторных и неамбулаторных субъектов (Beenakker, 2001, Neuromuscul. Disord. 11(5):441-6; Hyde, 2001, Neuromuscul. Disord. 11(2):165-70). Надежность оценок экспертов для субъектов с мышечной дистрофией является высокой (Stuberg, 1988, Phis. Ther. 1988 68(6):977-82; Hyde, 2001, Neuromuscul. Disord. 11(2):165-70). По сравнению с ручным тестированием мышечной силы миометрия является более чувствительным и менее комплексным показателем функции мышц (McDonald, 1995, Am. J. Phys. Med. Rehabil. (5 Suppl):S70-92). Тест может быть легко проведен оценивающим лицом (например, терапевтом или физиотерапевтом).
6 19 ПРИМЕР 19: ТЕСТЫ НА СКОРОСТЬ ФУНКЦИОНИРОВАНИЯ
Тесты на скорость функционирования включают время, требующееся для того, чтобы встать из положения лежа на спине, время, требующееся для того, чтобы пройти 10 метров, и время, требующееся для того, чтобы забраться на 4 ступени стандартных размеров (Mendell, 1989, N. Engl. J. Med. 320(24):1592-7; Griggs, 1991, Arch. Neurol. 48(4):383-8). Эти параметры подвергают мониторингу перед лечением, от вторых до последних суток лечения, и в ходе периода наблюдения после лечения. В ходе периодов до лечения и лечения тесты на скорость функционирования проводят перед биопсией мышц.
Эти тесты (время, требующееся для того, чтобы встать из положения лежа на спине, время, требующееся для того, чтобы пройти 10 метров, и время, требующееся для того, чтобы забраться на 4 ступени стандартных размеров) обеспечивают дополнительный показатель функциональной способности у амбулаторных субъектов. Тесты являются воспроизводимыми, широко применяемыми, простыми для проведения, и имеется документированный их ответ на терапевтическое вмешательство посредством стероидов (Mendell, 1989, N. Engl. J. Med. 320(24):1592-7; Griggs, 1991, Arch. Neurol. 48(4):383-8).
6.20 ПРИМЕР 20: УРОВНИ CK В СЫВОРОТКЕ
Активность CK в сыворотке оценивают с использованием коммерчески доступного связанного с NADH кинетического анализа (Diagnostic Chemicals Ltd., Oxford, CT). Уровни CK в сыворотке определяют перед лечением, на 1 сутки (перед первой дозой), на 7 сутки, 14 сутки, 21 сутки и 27 сутки в ходе периода лечения и на 42 сутки и 56 сутки после лечения. Уровни CK в сыворотке повышаются при мышечной дистрофии Дюшенна и, таким образом, являются поддающимися легкому измерению диагностическим маркером заболевания и могут служить в качестве потенциального биомаркера фармакологической активности лекарственного средства (Mendell et al., 1989, New Eng. J. Med. 320(24):1592-l597).
CK в сыворотке обеспечивает показатель целостности целой мышцы. Концентрации этого фермента в сыворотке возрастают от 50 до 100 раз у субъектов с DMD и показатели его уровней используют в ранней диагностике заболевания (Worton, The muscular dystrophies, In: Scriver CR., Beaudet A.L., Sly W.S., Valle D, eds. The metabolic и molecular basis of inherited disease. 8th ed. Vol. 4. New York: McGraw-Hill, 2001:5493-523). Уровни CK в сыворотке измеряют для мониторинга хода заболевания и служат в качестве маркера повреждения мышц. Несмотря на то что индуцируемые физическими упражнениями изменения обеспечивают вариабельность (Politano, 2003, Acta. Myol. 22(1):15-21), маркер обладает преимуществами, поскольку его можно легко, многократно и часто оценивать с помощью широко доступного и надежного анализа. Предшествующие клинические исследования показали снижение CK в сыворотке, соответствующее повышению мышечной силы в ходе лечения стероидами (Reitter, 1995, Brain Dev. 17 Suppl:39-43).
6.21 ПРИМЕР 21: КУЛЬТУРА ФИБРОБЛАСТОВ ДЕРМЫ И МЫШЕЧНЫХ КЛЕТОК
Исследования проводят на мышечной ткани и коже от пациентов для определения того, соответствует ли продукция дистрофина в первичных культурах мышц от пациентов продукции дистрофина in vivo. Эти эксперименты оценивают, демонстрируют ли фибробласты кожи от пациентов, при дифференцировке в мышечные клетки in vitro посредством трансфекции продуцирующей Myo-D экспрессирующей конструкцией (Wang, 2001, Development 128: 4623-33), продукцию дистрофина в ответ на лечение. Корреляции ответа клеток кожи с клинической активностью могут обеспечить простой для проведения предсказательный тест при выборе последующих пациентов для терапии или для скрининга новых средств для лечения DMD. Клетки культивируют следующим образом. Материал биопсии хранят при транспортировке в пролиферативной среде для клеток человека (или PBS), и на льду в течение более длительных периодов времени, если это необходимо. Если ткань не обрабатывают в течение 24 часов, материал можно замораживать в пролиферативной среде для клеток человека, содержащей 10% DMSO, и хранить в жидком азоте (или сухом льду). Когда ткань подлежит обработке для получения культуры миобластов, материал биопсии промывают в PBS. В культуральную чашку добавляют количество PBS, достаточное для поддержания влажности ткани. Материал биопсии измельчают тщательно посредством лезвий бритвы до практически гомогенной суспензии. Добавляют приблизительно 2 мл раствора коллагеназы/диспазы/CaCl2 на грамм ткани и измельчение продолжают в течение нескольких минут (например для биоптата мышц 5×5×5 мм используют 1 мл раствора фермента). Суспензию переносят в стерильную пробирку и инкубируют при 37°C на водяной бане до превращения смеси в мелкозернистую массу (например, приблизительно от 20 до 30 минут). Далее суспензию гомогенизируют пипетированием вверх и вниз несколько раз в ходе инкубации. Если необходимо, можно проводить дополнительные циклы ресуспендирования посредством пипетирования вверх и вниз шприцом. К суспензии добавляют восемь мл пролиферативной среды для клеток человека и перемешивают. Смесь центрифугируют в течение 10 минут при 1200 об/мин. Клеточный осадок ресуспендируют в 3 мл пролиферативной среды для клеток человека. Клетки высевают в одну лунку покрытого коллагеном 6-луночного планшета, или, в зависимости от количества материала, в покрытый коллагеном флакон T25. Клетки культивируют в течение 48 ч при 37°C и 5% CO2. Неприкрепленные клетки удаляют и переносят в другую покрытую коллагеном лунку (в качестве запасных). В первую лунку добавляют свежую пролиферативную среду (3 мл). Клетки культивируют из первой лунки до смыкания монослоя и до получения двух флаконов T75 со смыканием монослоя. Для хранения клетки можно замораживать из одного флакона T75 в 4 криопробирках с 1 мл замораживающей среды. Содержание миогенных клеток в культуре определяют посредством проведения окрашивания десмина. Если процентное количество положительных по десмину клеток является слишком низким, требуется предварительный посев культур.
6.22 ПРИМЕР 22: ИССЛЕДОВАНИЕ 2 ФАЗЫ 3-[5-(2-ФТОРФЕНИЛ)-[1,2,4]ОКСАДИАЗОЛ-3-ИЛ]БЕНЗОЙНОЙ КИСЛОТЫ В КАЧЕСТВЕ ПЕРОРАЛЬНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА ОТ МЫШЕЧНОЙ ДИСТРОФИИ ДЮШЕННА
Для возможности включения в исследование субъекты должны удовлетворять следующим условиям:
1. Диагноз мышечной дистрофии Дюшенна (DMD), исходя из клинического фенотипа, имеющийся к 5 годам, с повышенным CK в сыворотке и отсутствием дистрофина в биоптате мышц (отрицательное окрашивание на сарколеммы посредством антитела к C-концевой части белка дистрофина).
2. Наличие нонсенс-мутации в гене дистрофина.
3. Документация о проведении секвенирования гена дистрофина или, если секвенирование еще не проведено, то о том, что кровь была отослана для подтверждающего секвенирования гена дистрофина.
4. Данные физического обследования или радиографической визуализации на обеих ступнях.
5. Способность к передвижению.
6. Мужской пол.
7. Возраст ≥5 лет.
8. Готовность к воздержанию от половых актов или к применению барьерного или медицинского способа контрацепции в ходе введения лекарственного средства и периодов наблюдения в исследовании у субъектов, с известной половой активностью.
9. Готовность и способность соблюдать посещения по расписанию, план введения лекарственного средства, лабораторные тесты, ограничения исследования и процедуры исследования (включая биоптаты мышц, миометрию и забор образцов PK).
10. Способность предоставить письменное информированное согласие, если возраст ≥18 лет, или письменное информированное разрешение (с согласием родителей/опекунов) если возраст ≥7 лет. Если возраст субъекта составляет <7 лет, будет получено согласие родителя/опекуна отдельно; и
11. Данные о лично подписанном и датированном документе об информированном согласии (также для детей в возрасте ≥7 требуется разрешение), указывающем на то, что субъект/родитель/опекун проинформированы обо всех надлежащих аспектах испытания, которым они должны следовать.
Наличие любого из следующих состояний исключало включение пациента в исследование.
1. Предшествующее или продолжающееся медицинское состояние (например, сопутствующее недомогание, психиатрическое состояние, алкоголизм, зависимость от лекарственных средств), медицинский анамнез, данные физикального обследования, данные ЭКГ, или лабораторные нарушения, которые, по мнению исследователя, могут оказать неблагоприятное влияние на безопасность пациента, делают маловероятным, что курс лечения или наблюдения будет завершен, или могут нарушить оценку результатов исследования.
2. Клинические симптомы и признаки застойной сердечной недостаточности (стадия C или стадия D American College of Cardiology/American Heart Association) (Hunt, 2001, J. Am. Coll. Cardiol. 35:2101-13).
3. Положительный поверхностный антиген вируса гепатита B, тест на антитела к вирусу гепатита C, или тест на вирус иммунодефицита человека (HIV).
4. Гемоглобин <10 г/дл;
5. Сывороточный альбумин <2,5 г/дл.
6. Аномальный GGT или общий билирубин (>лабораторной верхней границы нормы).
7. Нарушение функции почек (креатинин сыворотки >1,5 раз превышает лабораторную верхнюю границу нормы).
8. Трансплантация солидного органа или гематологическая трансплантация в анамнезе.
9. Продолжающаяся иммунодепресивная терапия (отличная от кортикостероидов).
10. Воздействие другого находящегося на исследовании лекарственного средства в пределах 28 суток перед началом исследуемого лечения.
11. Продолжающееся участие в любом другом терапевтическом клиническом испытании.
12. Продолжающееся применение агонистов рецептора, активируемого пероксисомальным пролифератором (PPAR γ) на основе тиазолидиндиона, например розиглитазона (Avandia® или его эквивалента) или пиоглитазона (Actos® или его эквивалента).
13. Смена системной кортикостероидной терапии (напимер, начало лечения; прекращение лечения; смена дозы, схемы или типа стероида) в пределах 3 месяцев перед началом исследуемого лечения; или
14. Лечение системными аминогликозидными антибиотиками в предлах 3 месяцев перед началом исследуемого лечения.
3-[5-(2-Фторфенил)-[1,2,4]оксадиазол-3-ил]бензойная кислота предоставлена в составе, описанном в настоящем документе. Лечение проводят в течение 28 суток для каждой группы по введению. В исходной группе пациентов введение 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты проводят каждые сутки в течение 28 суток на данном уровне дозы (например, 4-, 4- и 8-мг/кг) TID. Если первые пациенты переносят лекарственное средство, тогда во второй группе пациентов вводят 3-[5-(2-фторфенил)-[l,2,4]оксадиазол-3-ил]бензойную кислоту на более высоком уровне дозы (например, 10, 10 и 20 мг/кг) TID. Таким образом, каждый пациент получает всего 84 дозы 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты. После завершения лечения в течение 28 суток для каждого пациента следуют 28 дополнительных суток без лечения.
При каждом уровне дозы рекомендуется, чтобы 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту принимали TID с интервалами 6, 6 и 12 часов (± ~30 минут). В идеальном случае, каждую дозу принимают в пределах ~30 минут после приема пищи (например, в ~7:00 после завтрака, в ~13:00 после второго завтрака и в ~19:00 после обеда). Несмотря на то что могут происходить отклонения в схеме дозирования в амбулаторных условиях, рекомендуется, чтобы назначенная схема точно соблюдалась (включая промежутки между дозированием и соотношение дозирования и приема пищи) в дни забора образцов для PK. Клинические результаты оценивают с использованием способов, указанных выше.
Шести пациентам вводили 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту TID в схеме, состоящей из 4 мг/кг за завтраком, 4 мг/кг за вторым завтраком и 8 мг/кг с ужином, в с общей суточной дозой 16 мг/кг. Все пациенты были амбулаторными, однако они обладали характерными признаками и симптомами DMD,
включая некоторую степень дисфункции мышц и повышенные концентрации CK в сыворотке. Не было описано тяжелых связанных с лекарственным средством неблагоприятных эффектов. Предварительные результаты позволяют предположить, что тяжесть всех потенциальных связанных с лекарственным средством неблагоприятных действий была мягкой. Эти неблагоприятные эффекты включали диарею у 1 пациента; боль в области живота у 1 пациента; и вздутие живота у 2 пациентов. При физикальном осмотре пациентов, определении основных показателей состояния организма и на электрокардиограммах не было выявлено проблем с безопасностью. Не было выявлено клинически значимого подъема ферментов печени, билирубина, креатинина или азота мочевины крови. Соблюдение схемы лечения было хорошим, при этом пациентам проведено >95% от намеченного общего лечения лекарственным средством в течение 28 суток на более низком уровне дозы. Не было пациентов, прекративших лечение вследствие неблагоприятных эффектов.
Промежуточные параметры PK 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты у этих 6 пациентов описаны в таблице 18. Отсутствовали данные как о накоплении лекарственного средства, так и о сниженных уровнях лекарственного средства вследствие индукции метаболизма в ходе промежутка между периодами забора образцов при лечении в течение 27 суток в исследовании DMD 2 фазы.
(4,4,8 мг/кг)
Дополнительное исследование 2 фазы проводили следующим образом для оценки безопасности, соблюдения схемы лечения, PK, эффектов на экспрессию полноразмерного белка дистрофина мышц и клинической активности посредством 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты, у пациентов с опосредуемой нонсенс-мутацией DMD.
3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту вводили перорально в течение 28 суток на уровнях доз 4, 4, 8 мг/кг (низкая доза); 10, 10, 20 мг/кг (средняя доза); и 20, 20, 40 мг/кг (высокая доза) после завтрака, второго завтрака и обеда, соответственно. 26 Мальчиков (возраст: 5-13 лет; стоп-кодоны: 15 UGA, 6 UAG, 5 UAA;
исходный CK в сыворотке: 8645-49500 МЕ; применение стероидов: 19/26) завершили курс 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты при низком (n=6) или среднем (n=20) уровнях доз. Все неблагоприятные эффекты и лабораторные нарушения были мягкими-умеренными без зависимых от дозы изменений частоты или тяжести. Соблюдение схемы составляло >98% для обоих уровней доз. PK на 1 сутки и 28 сутки указывает на стабильную экспозицию с течением времени; однако экспозиция была ниже, чем у здоровых добровольцев или пациентов с кистозным фиброзом, которым вводили 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойную кислоту. Культуры мышечных трубок из биоптатов мышц до лечения показали зависимое от дозы повышение экспрессии дистрофина при обработке 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой in vitro у 24/24 (100%) оцениваемых пациентов. Относительно исходного уровня, повышение экспрессии дистрофина после введения in vivo произошло у 4/6 (67%) (90% CI 27-94%) и 10/20 (50%) (90% CI 30-70%) мальчиков с низкой и средней дозами, соответственно. Уровни CK в сыворотке значимо снизились в ходе введения 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты. В пределах 28 суток лечения изменения мышечной силы и функционирование на скорость были небольшими и не значимыми.
3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойная кислота безопасно индуцирует экспрессию полноразмерного дистрофина in vitro и in vivo и снижает уровни CK с сыворотке у мальчиков с опосредуемой нонсенс-мутацией DMD. Несмотря на то, что низкий и средний уровни доз 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты были активными, они не достигли экспозиций в плазме, ассоциированных с максимальной доклинической активностью. Оценка на уровне высокой дозы у 12 других мальчиков продолжается.
7. ЭКВИВАЛЕНТЫ
Специалисты в данной области поймут, или будут способны узнать с использованием не более чем общепринятого экспериментирования, множество эквивалентов конкретных вариантов осуществления этого изобретения, описанных в настоящем документе. Подразумевается, что такие эквиваленты охватываются представленной ниже формулой изобретения. Все публикации, патенты и патентные заявки, упомянутые в этом описании, включены в качестве ссылок в описание в той же степени, как если бы для каждой отдельной публикации, патента или патентной заявки было конкретно и отдельно указано, что они включены в настоящий документ в качестве ссылок.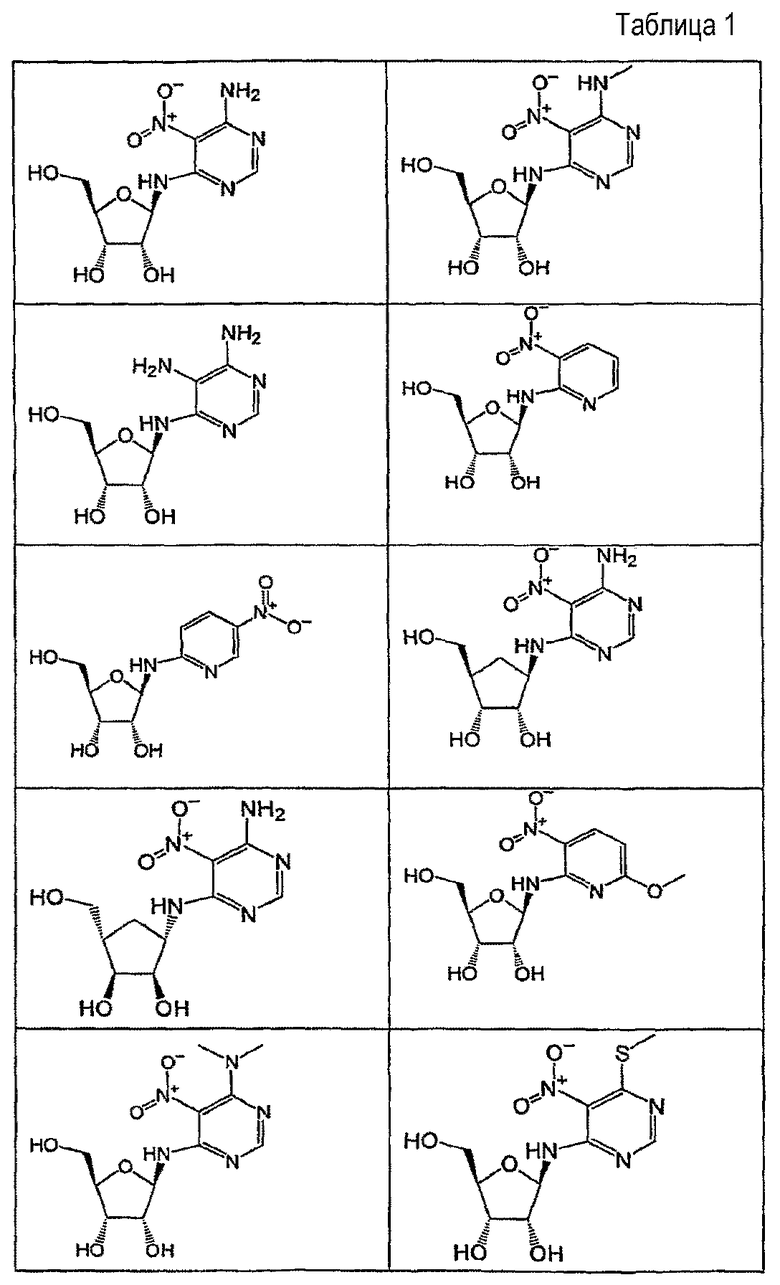
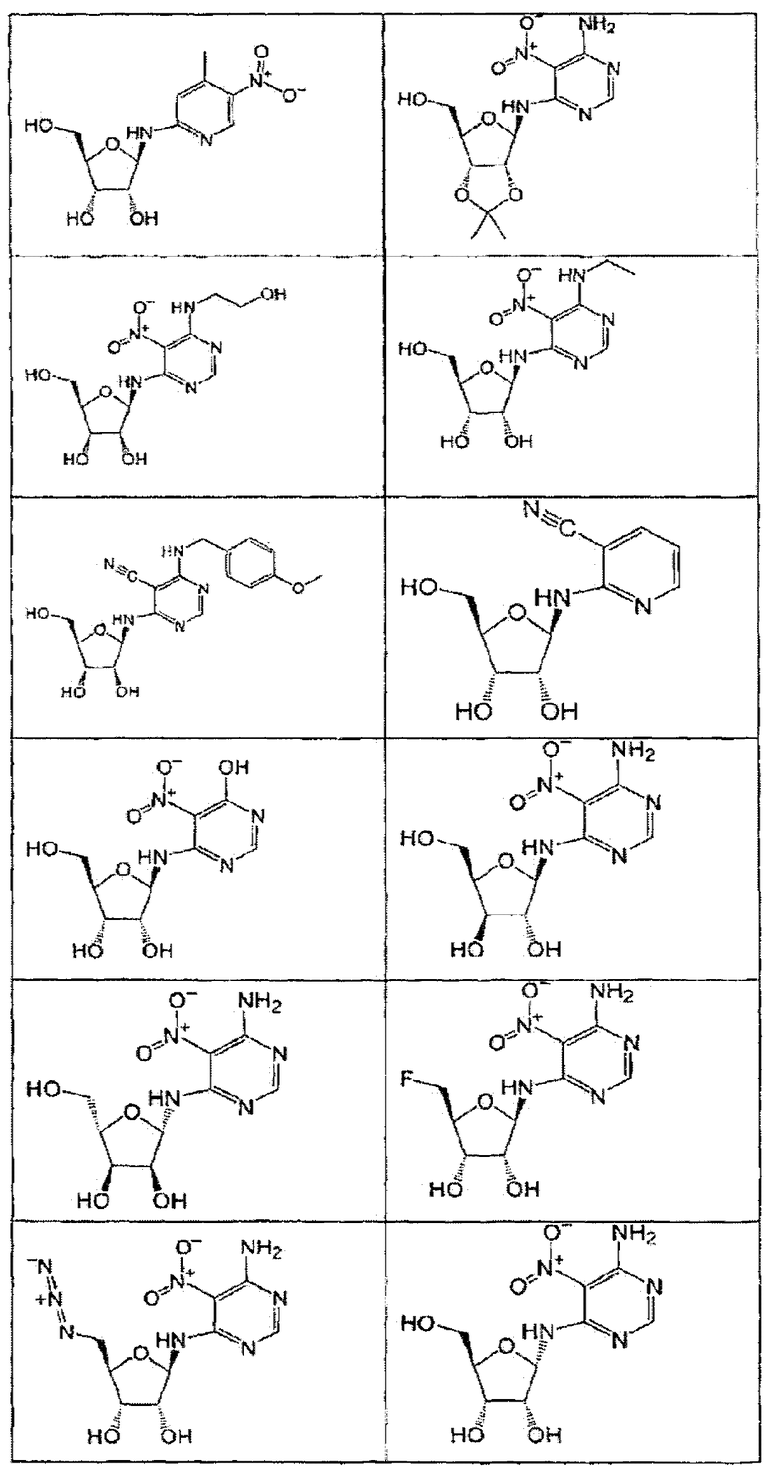
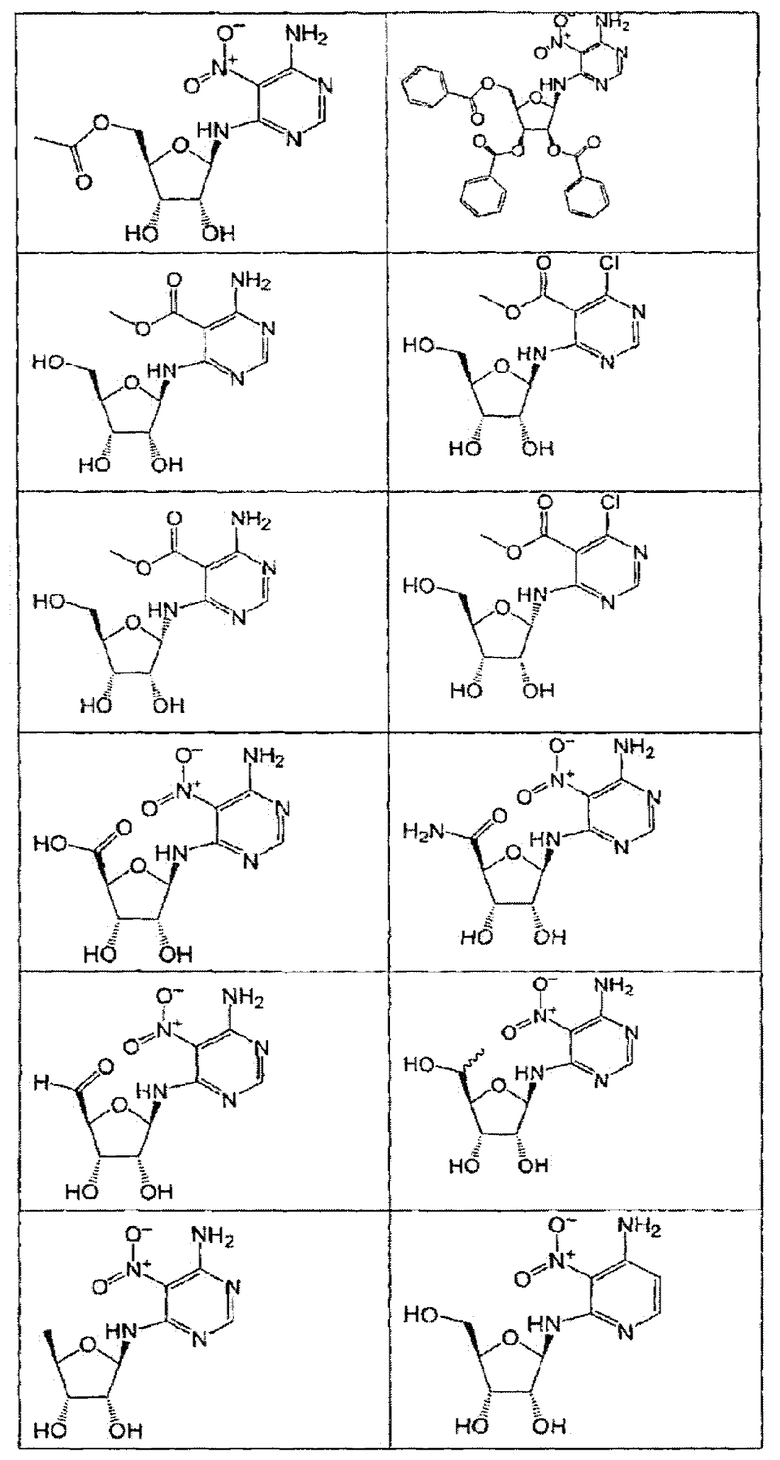
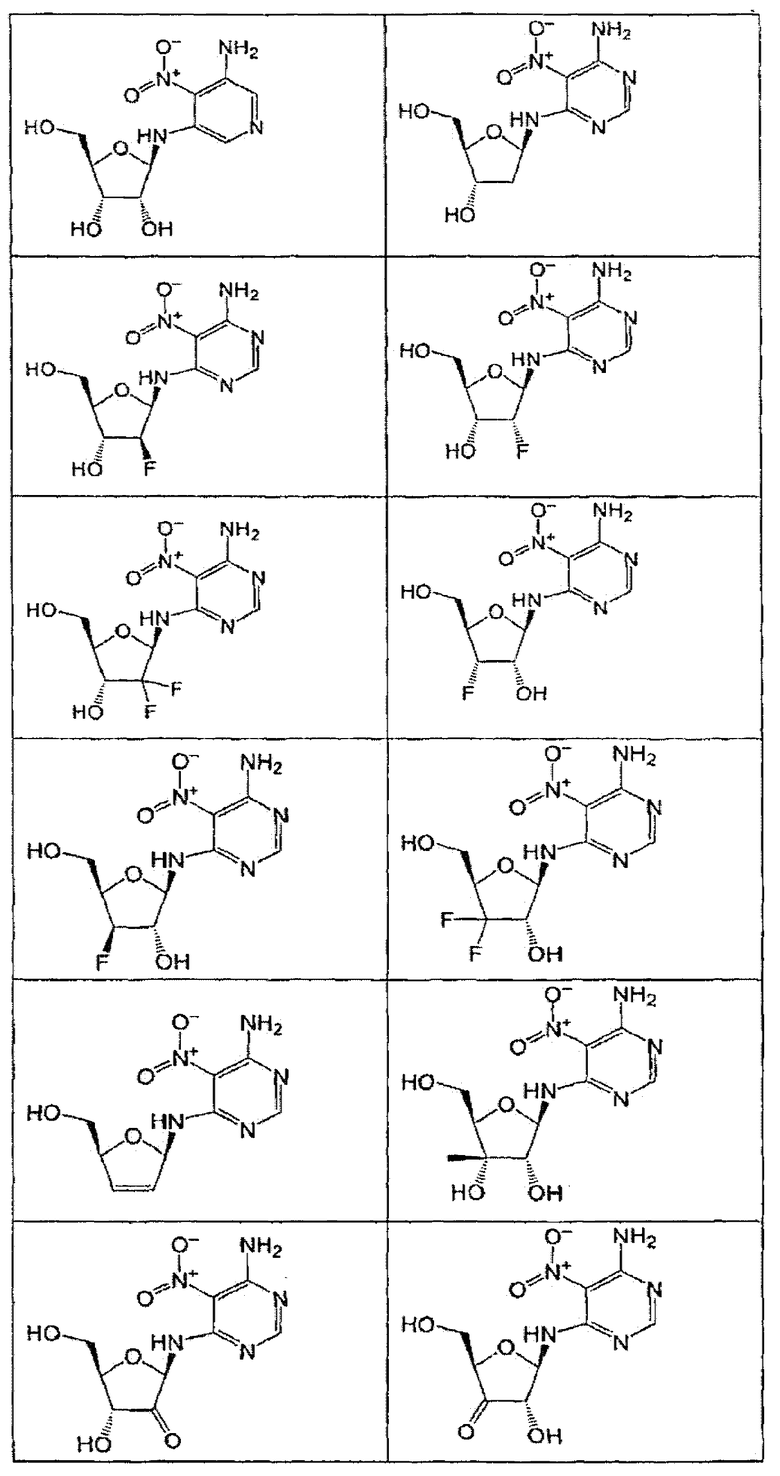
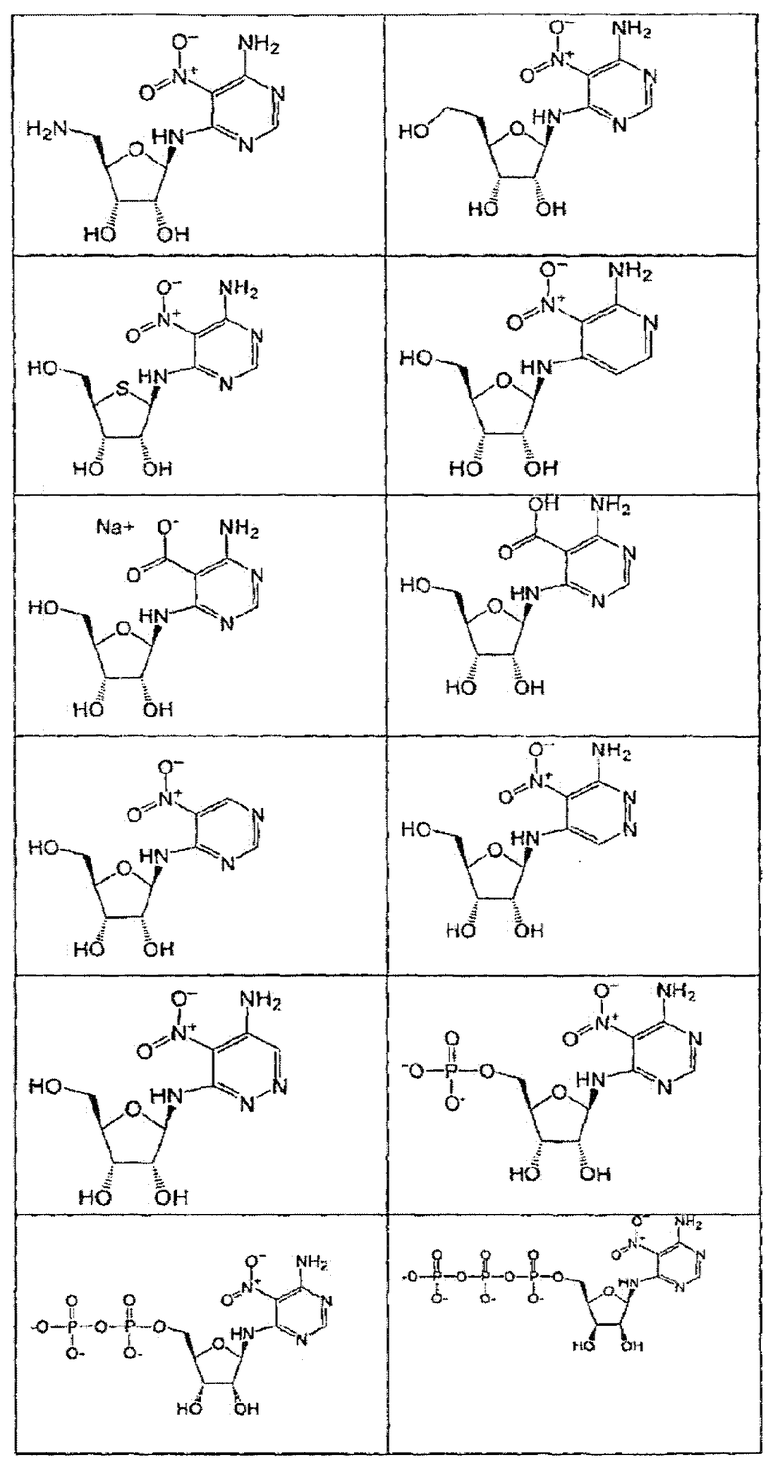
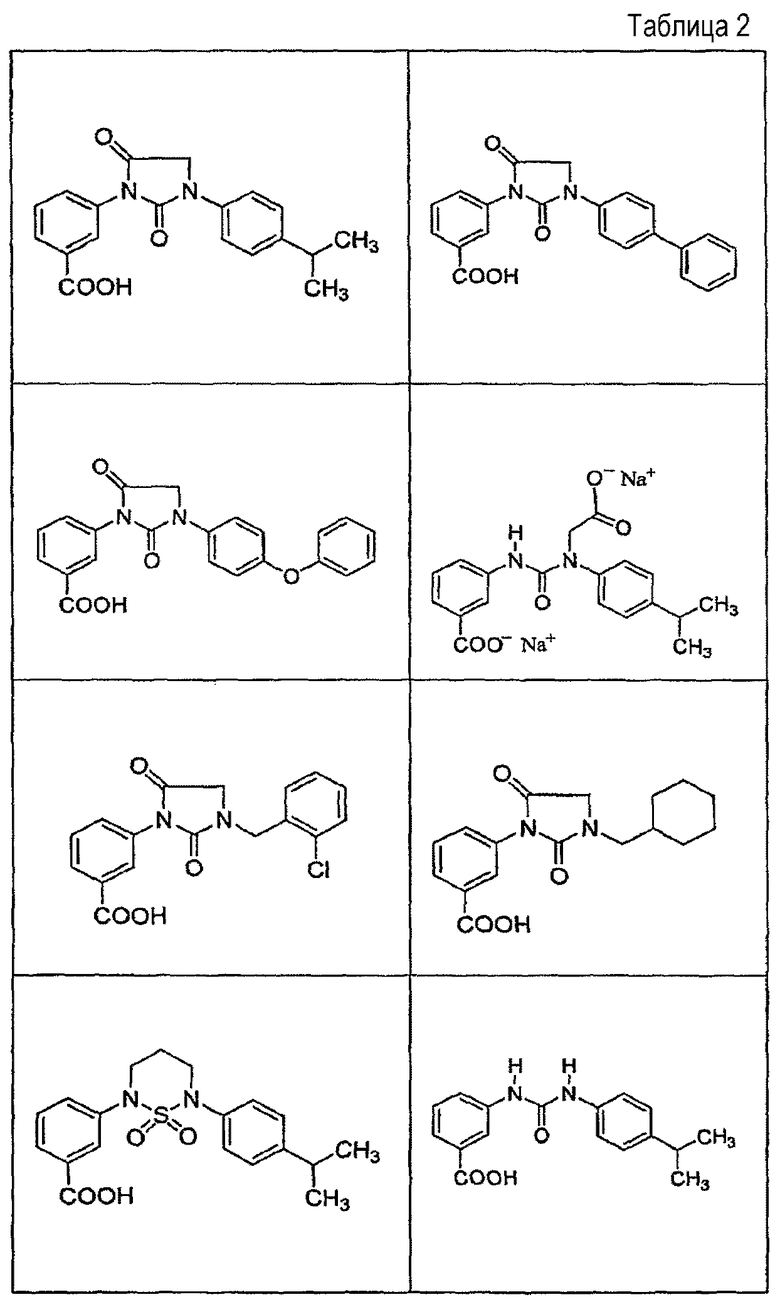
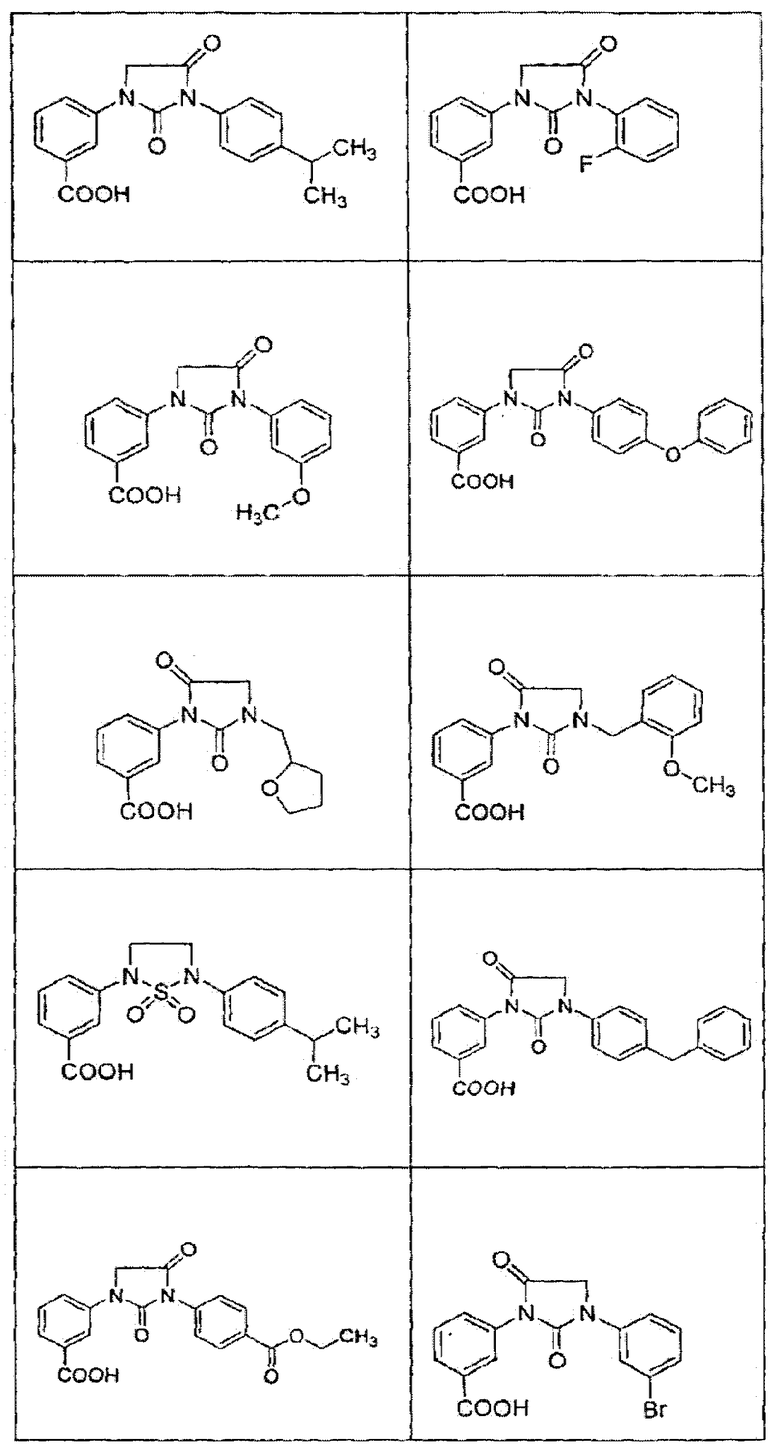
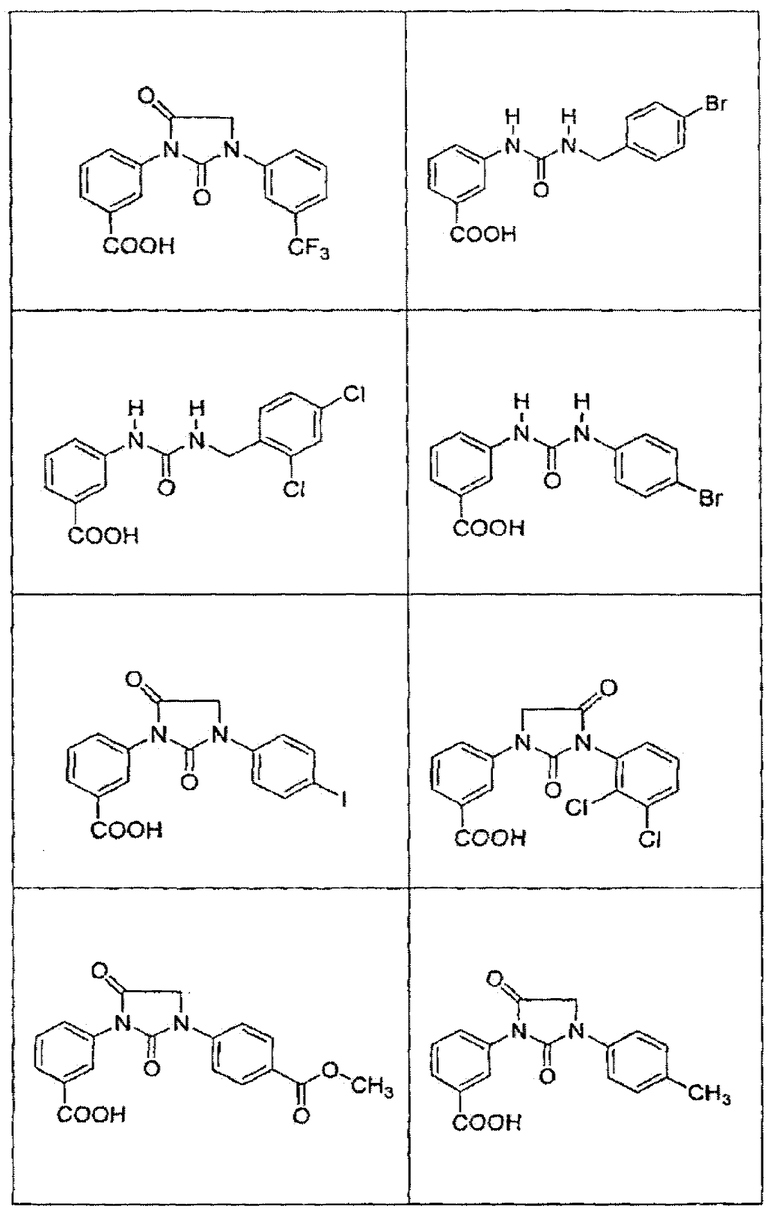
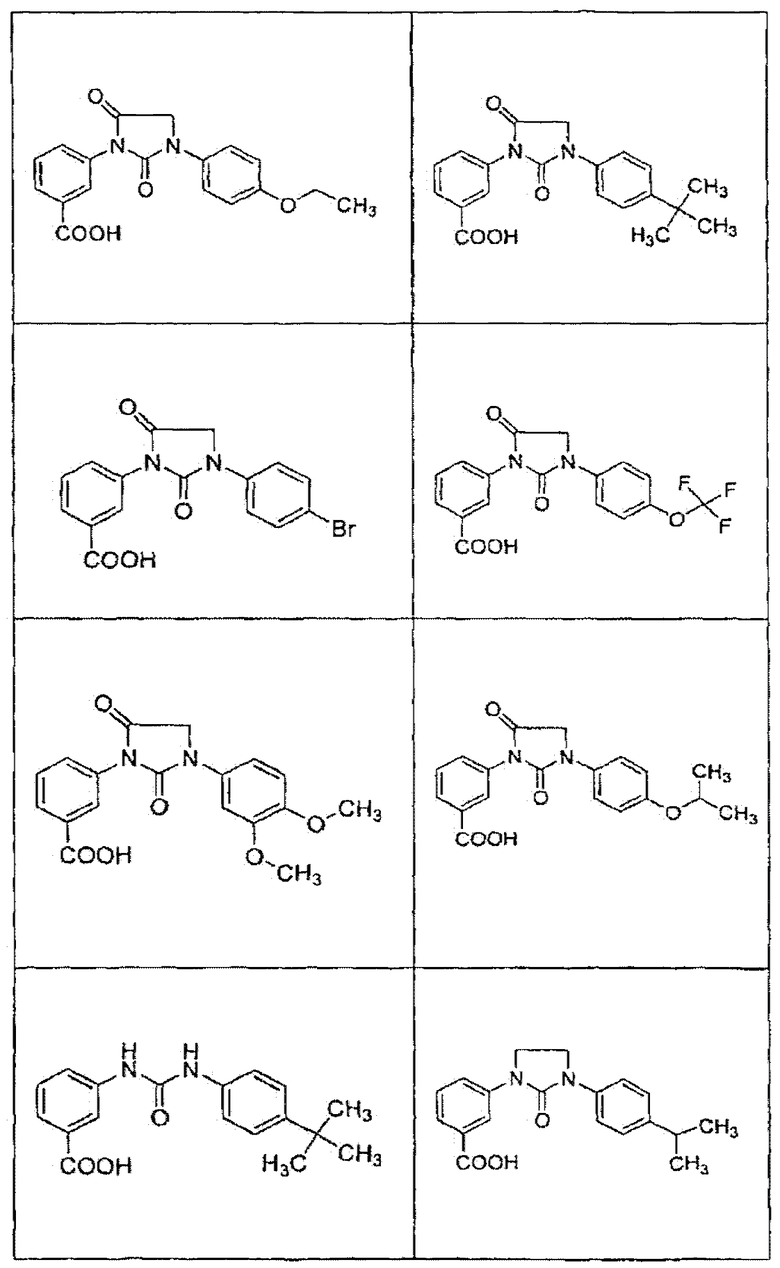
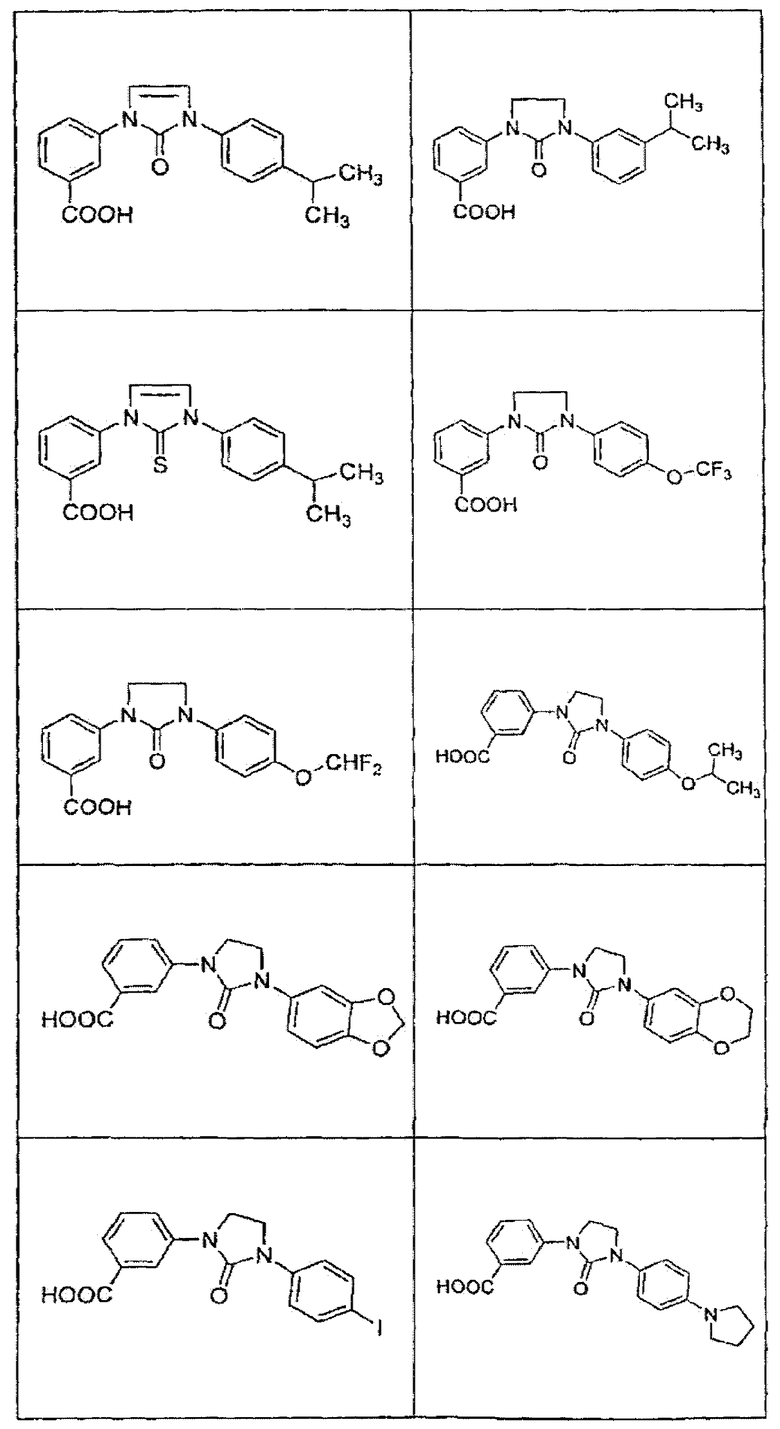
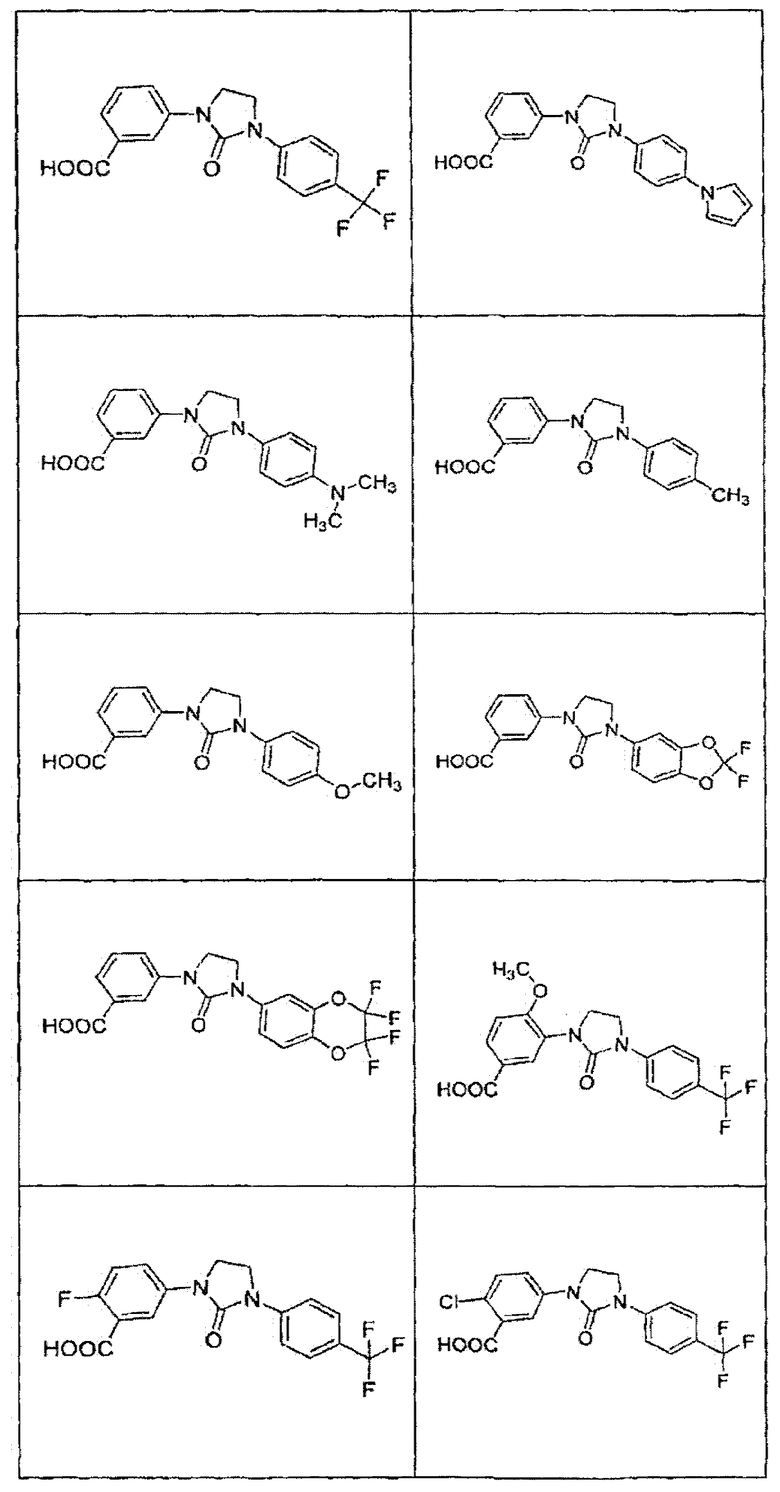
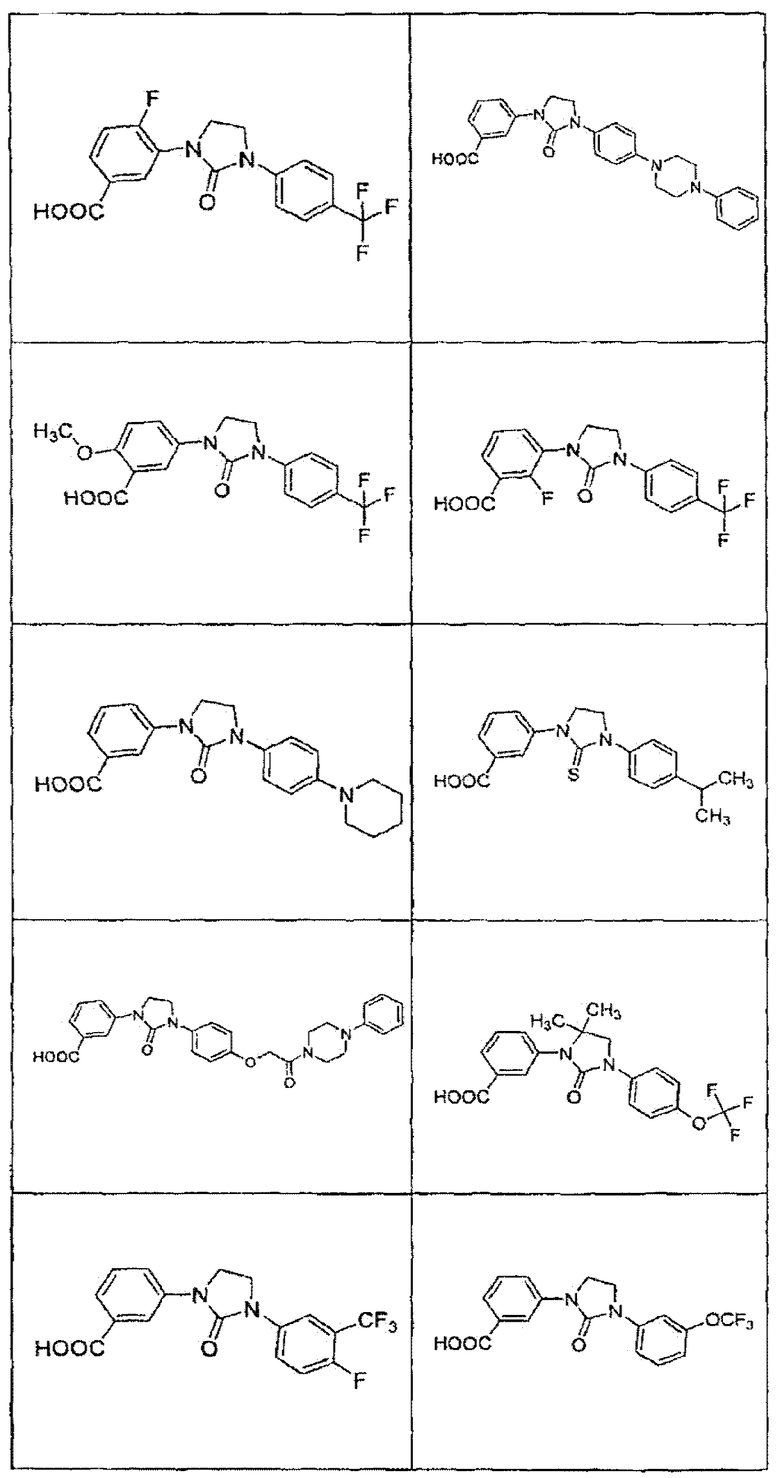
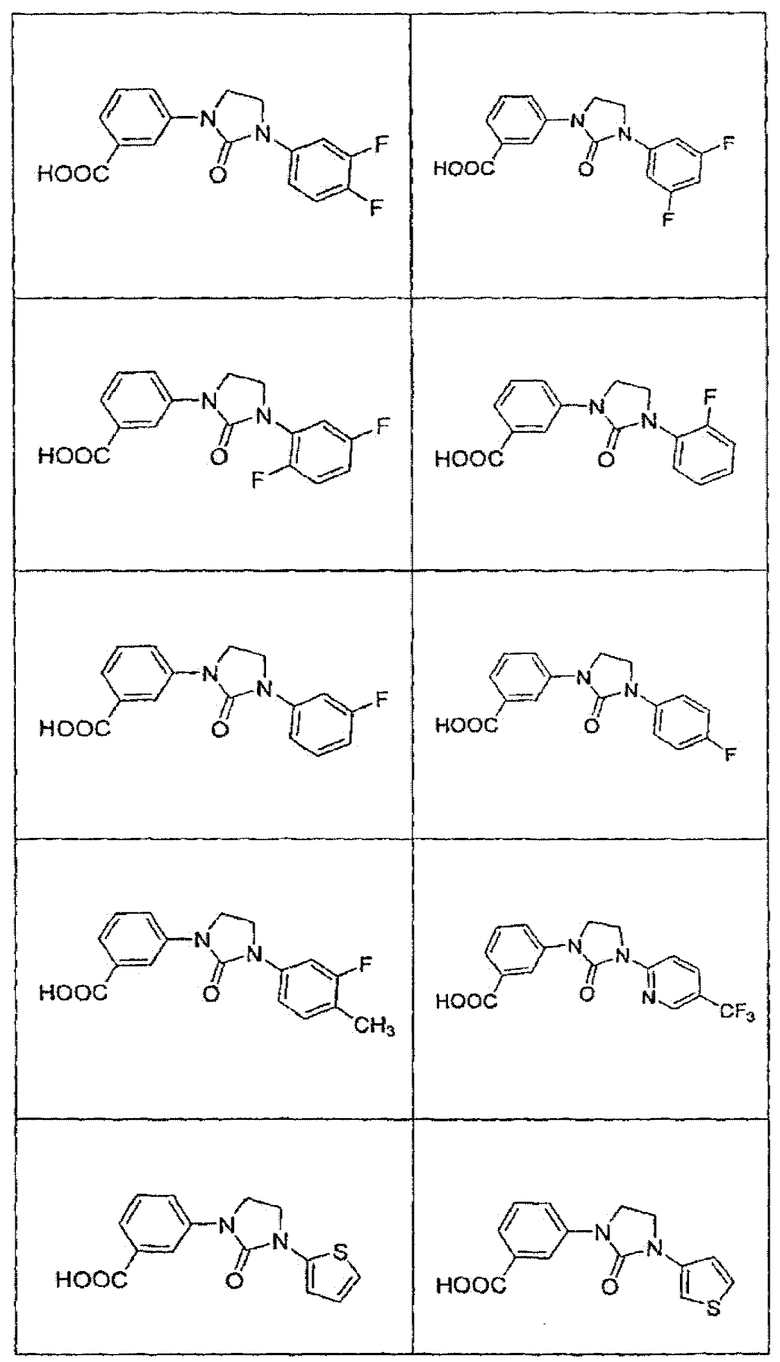
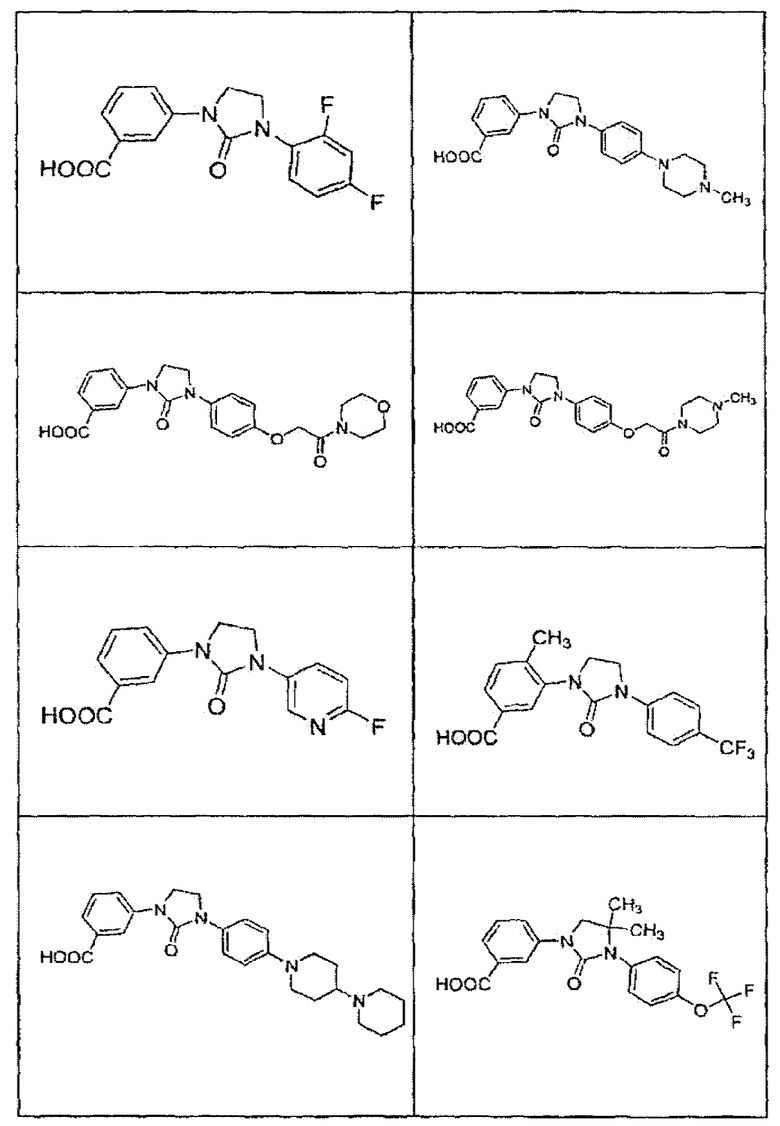
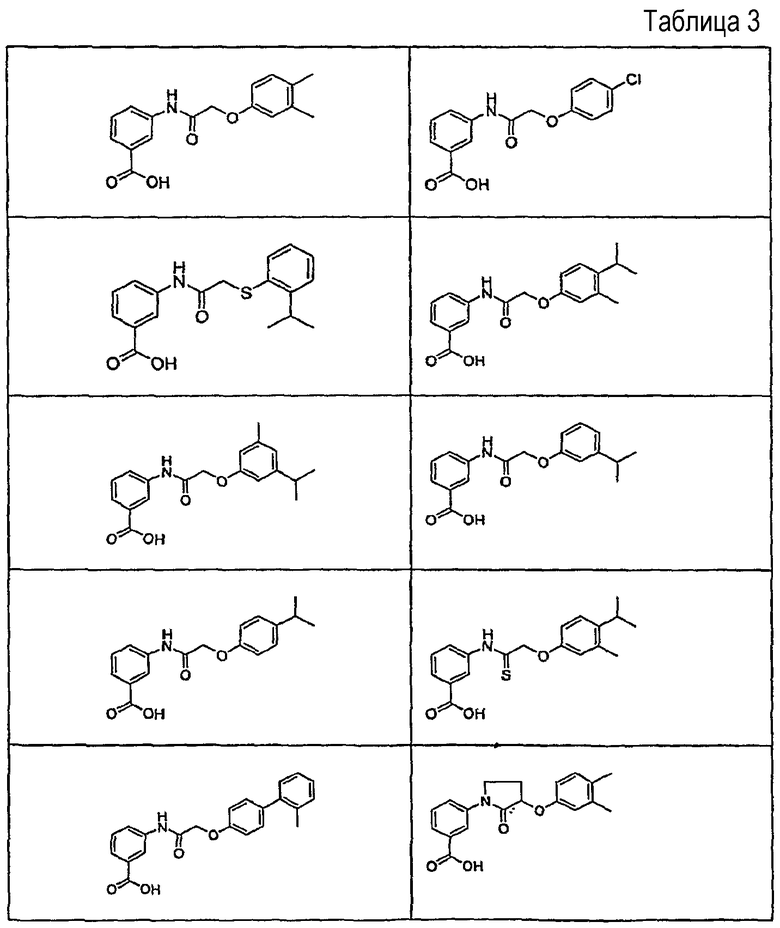
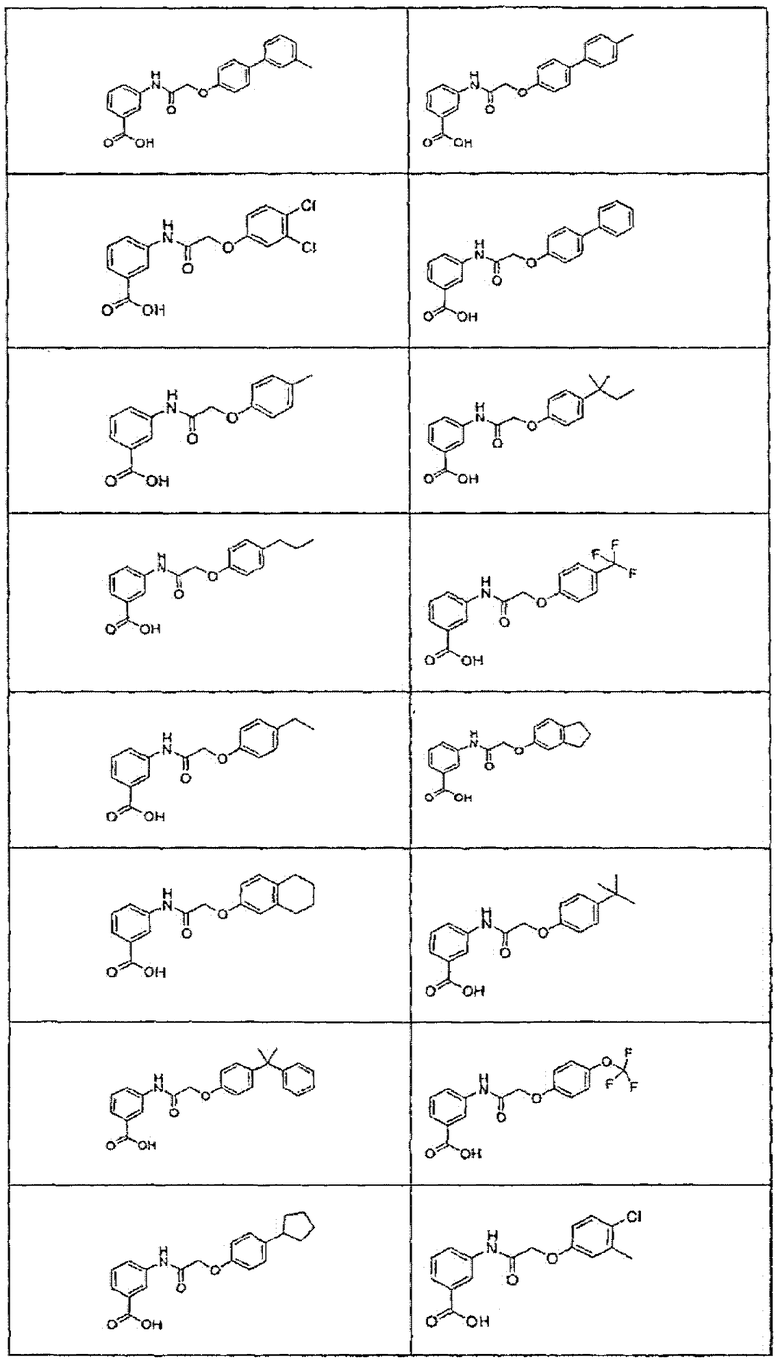
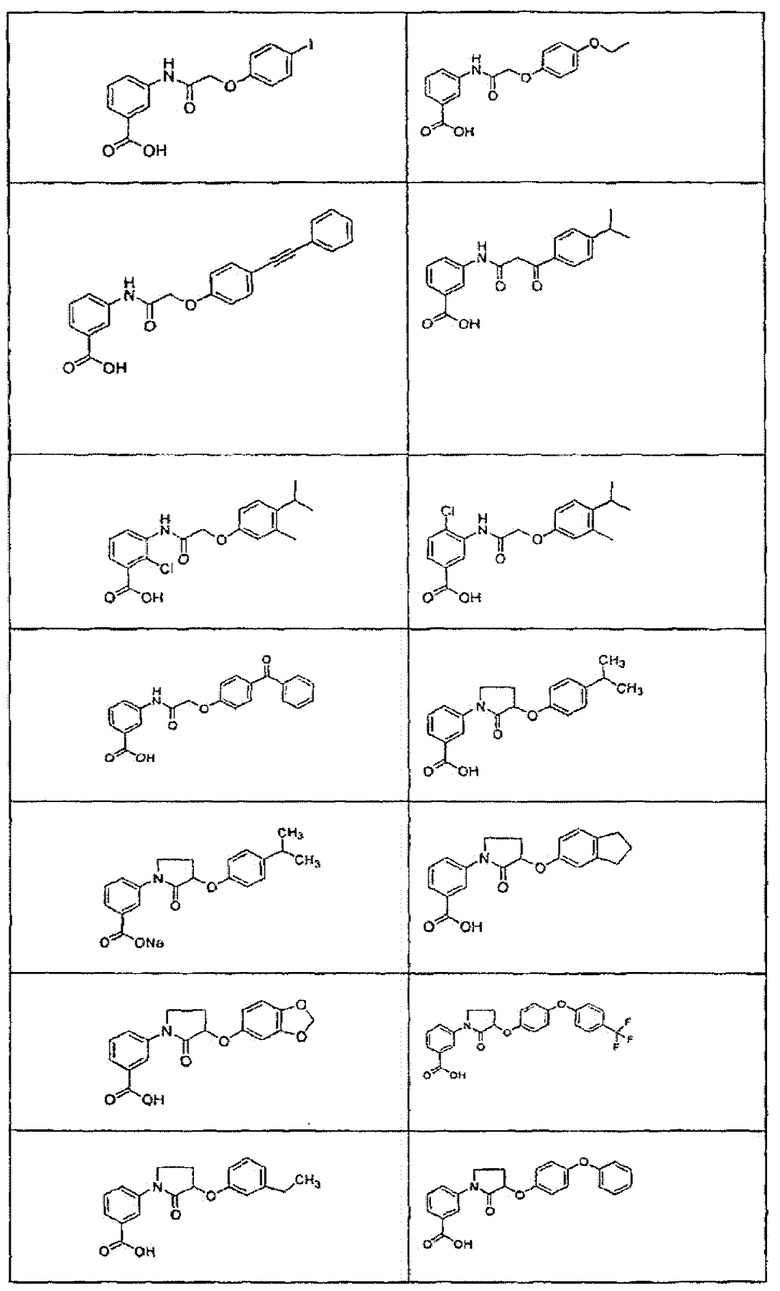
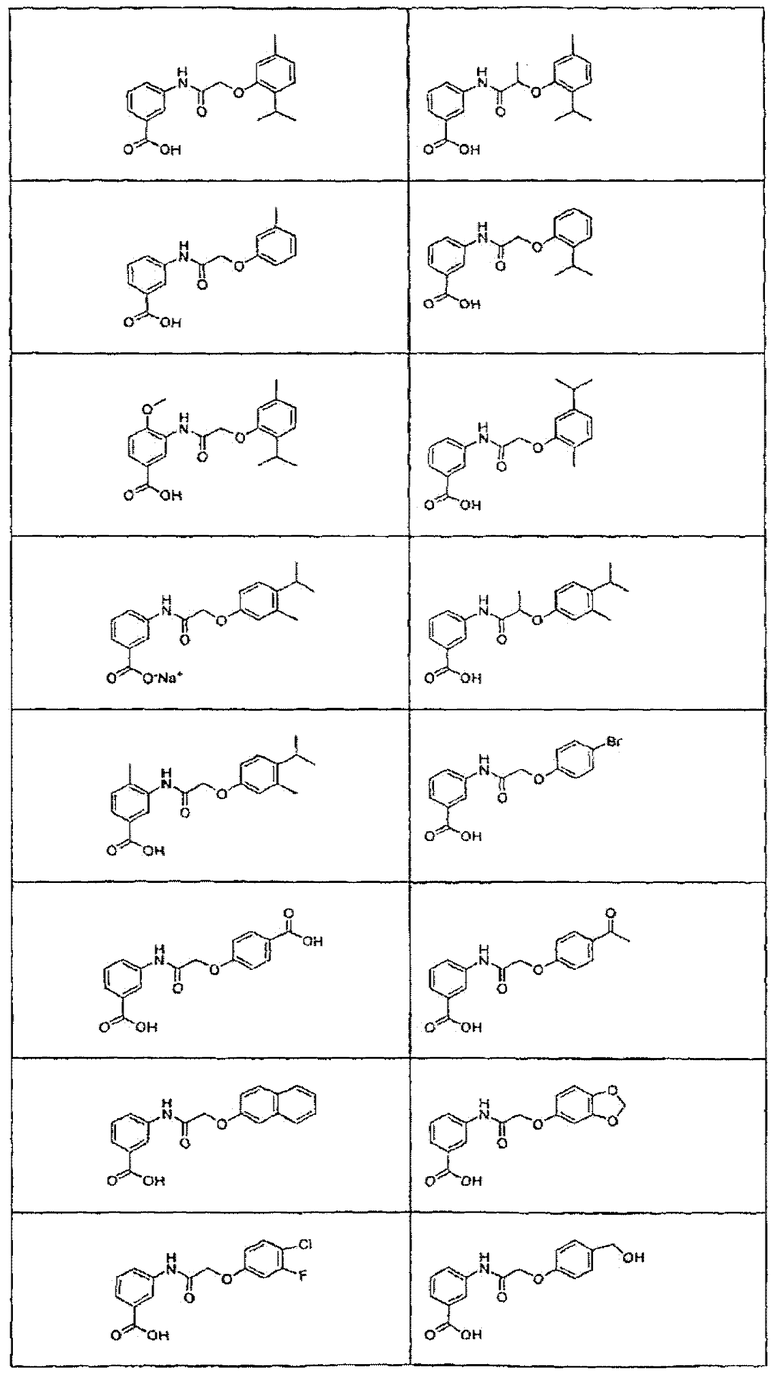
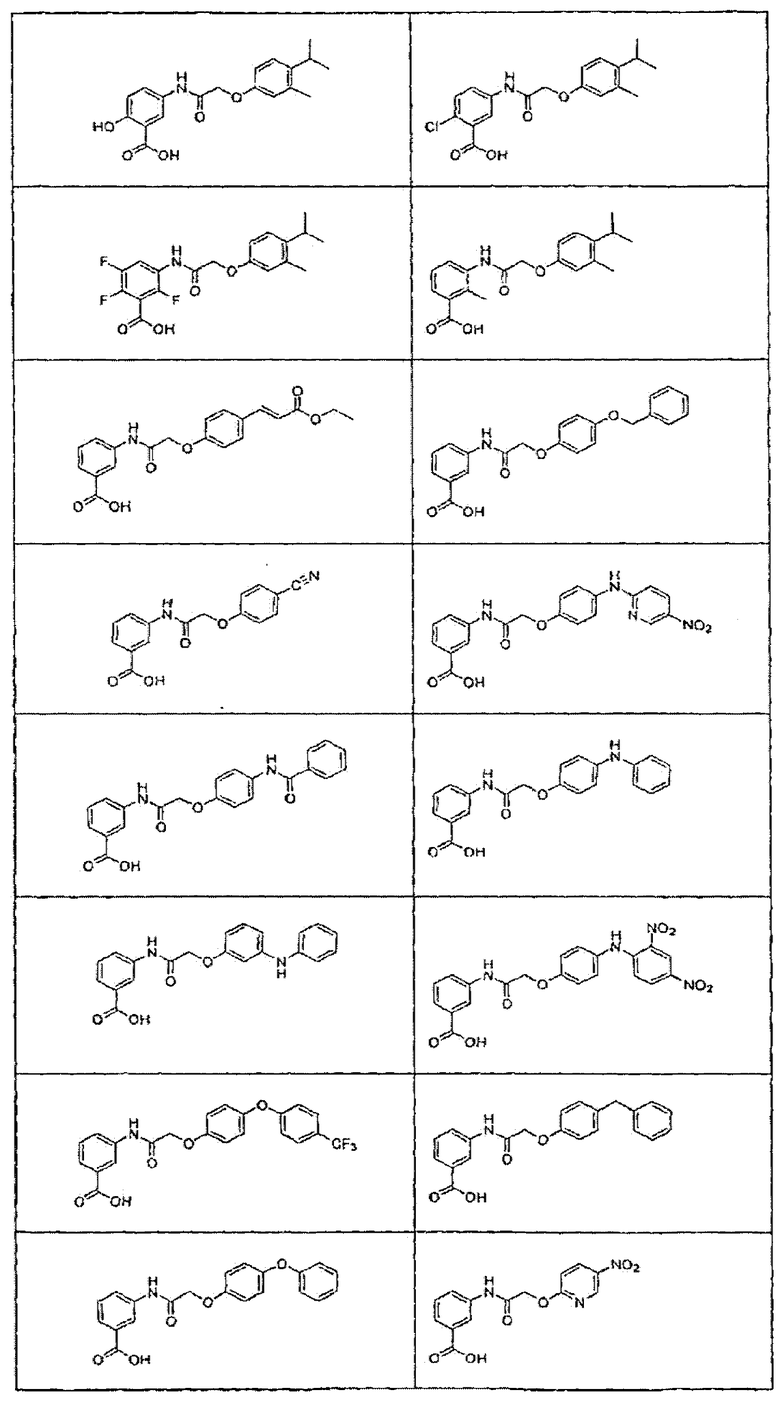
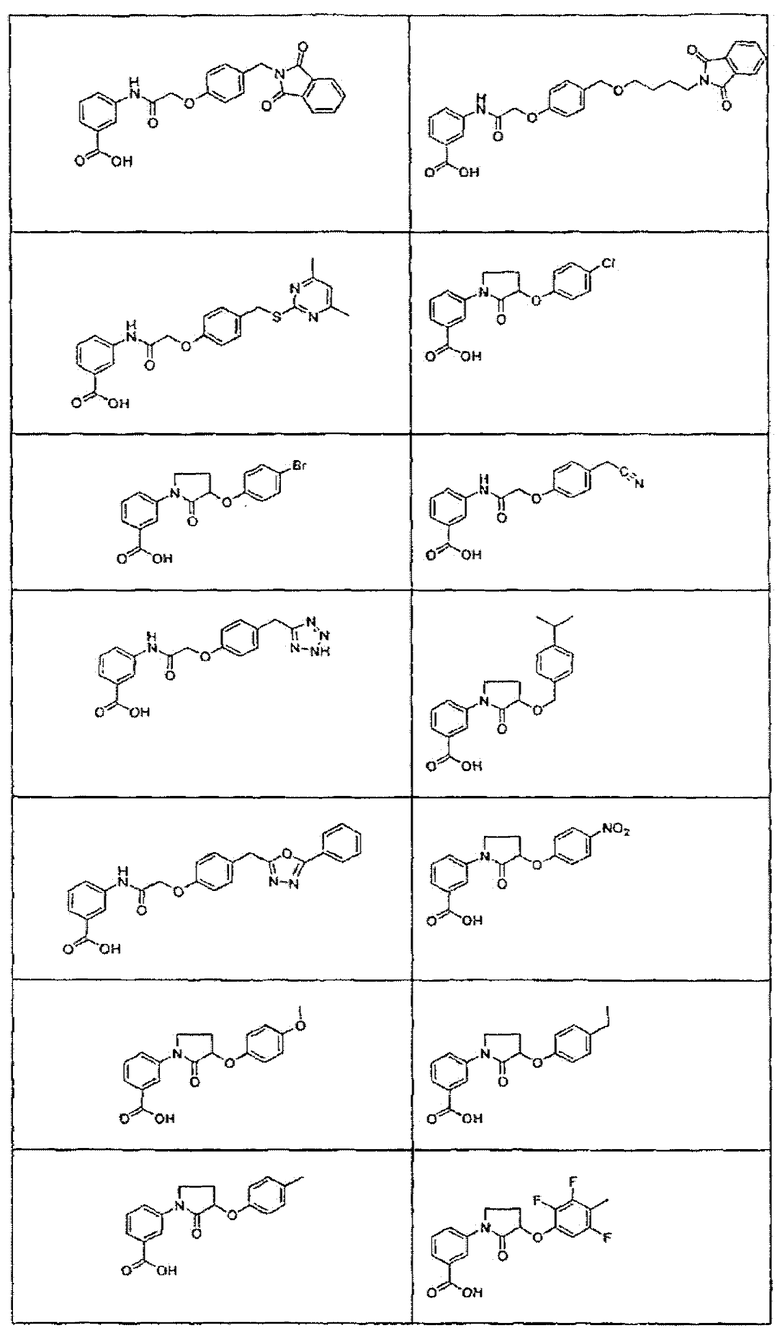
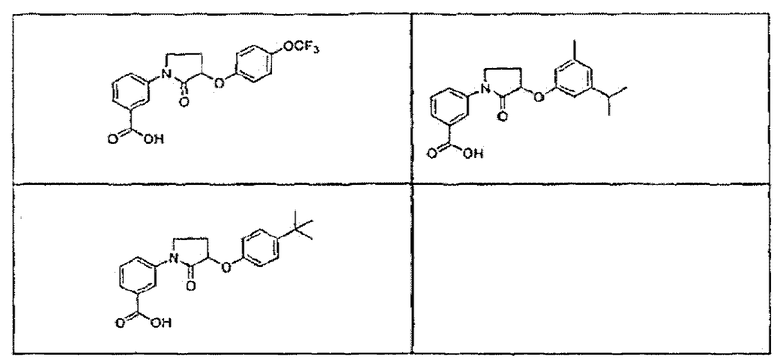
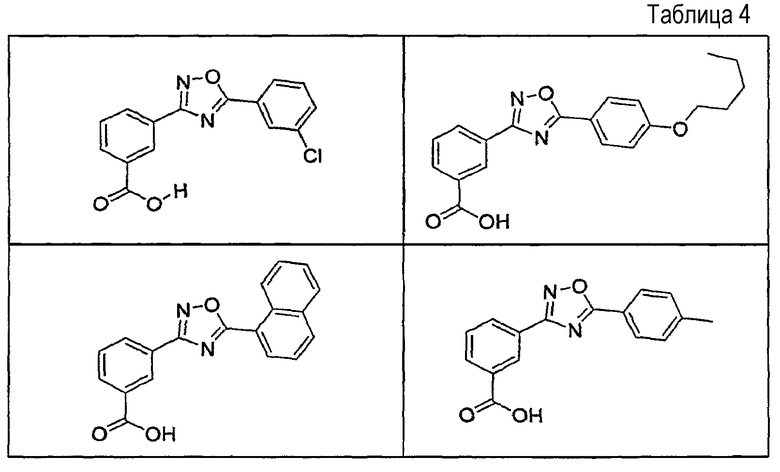
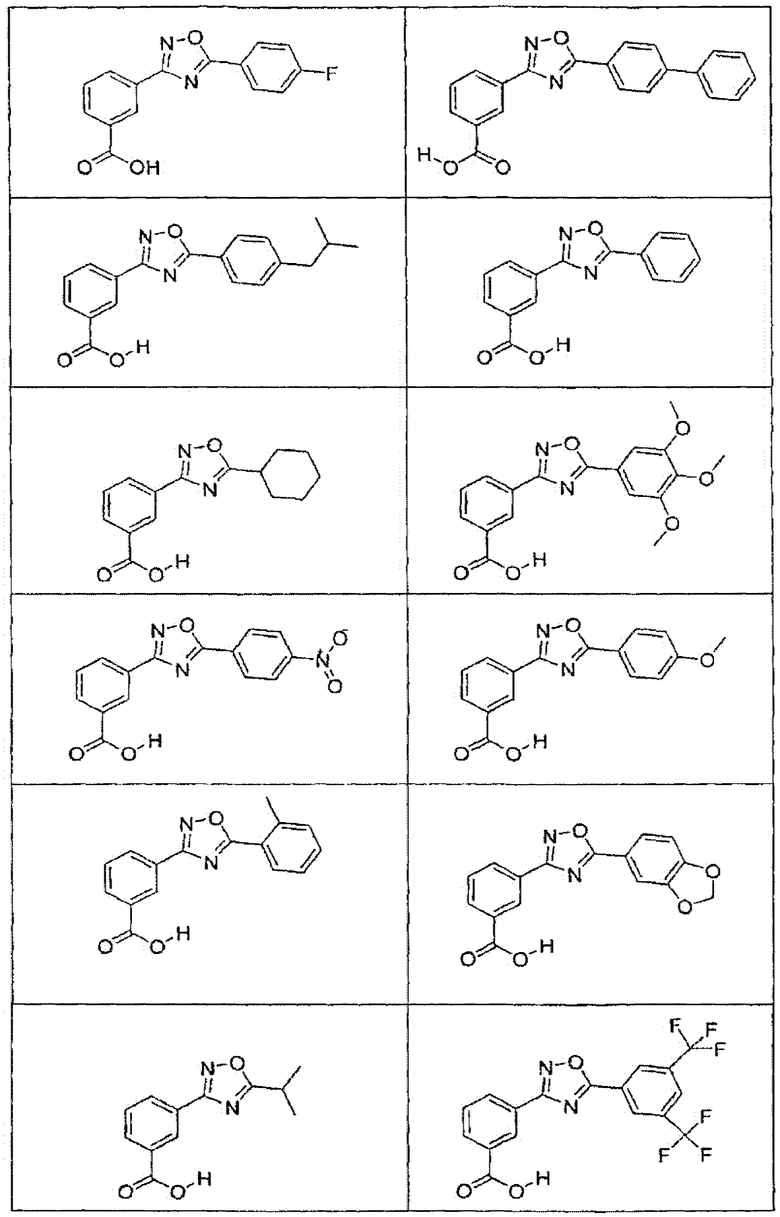
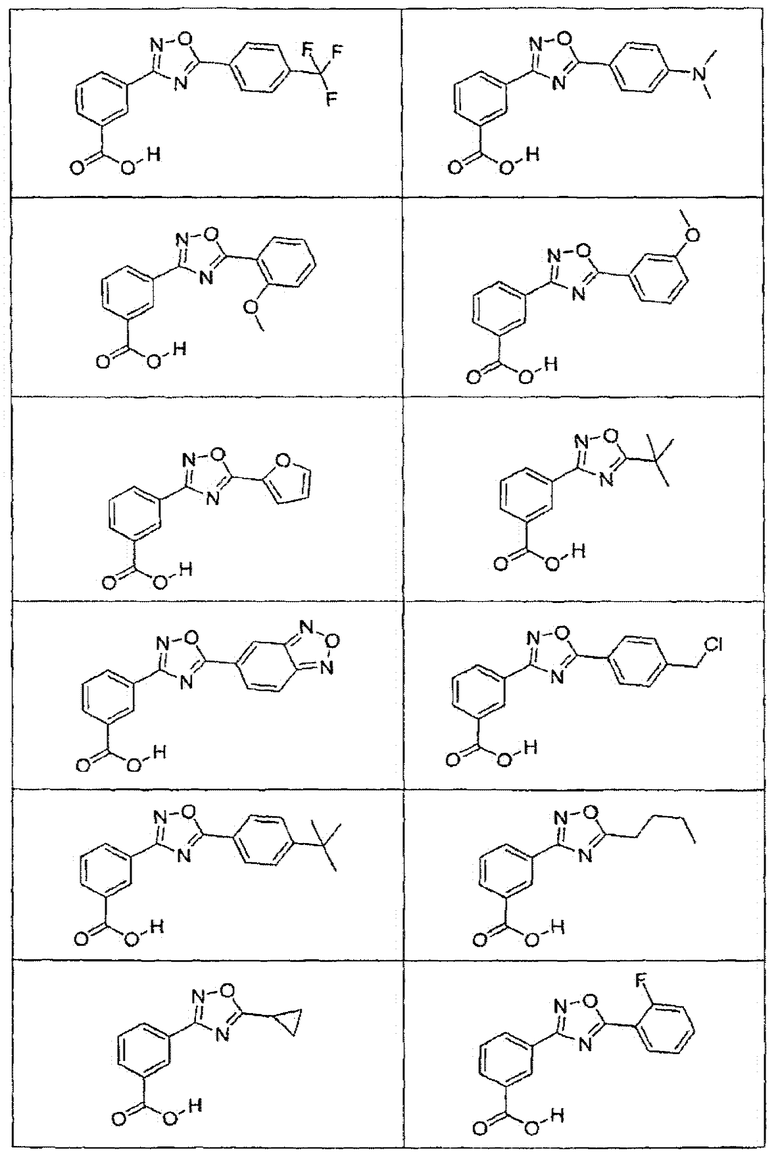
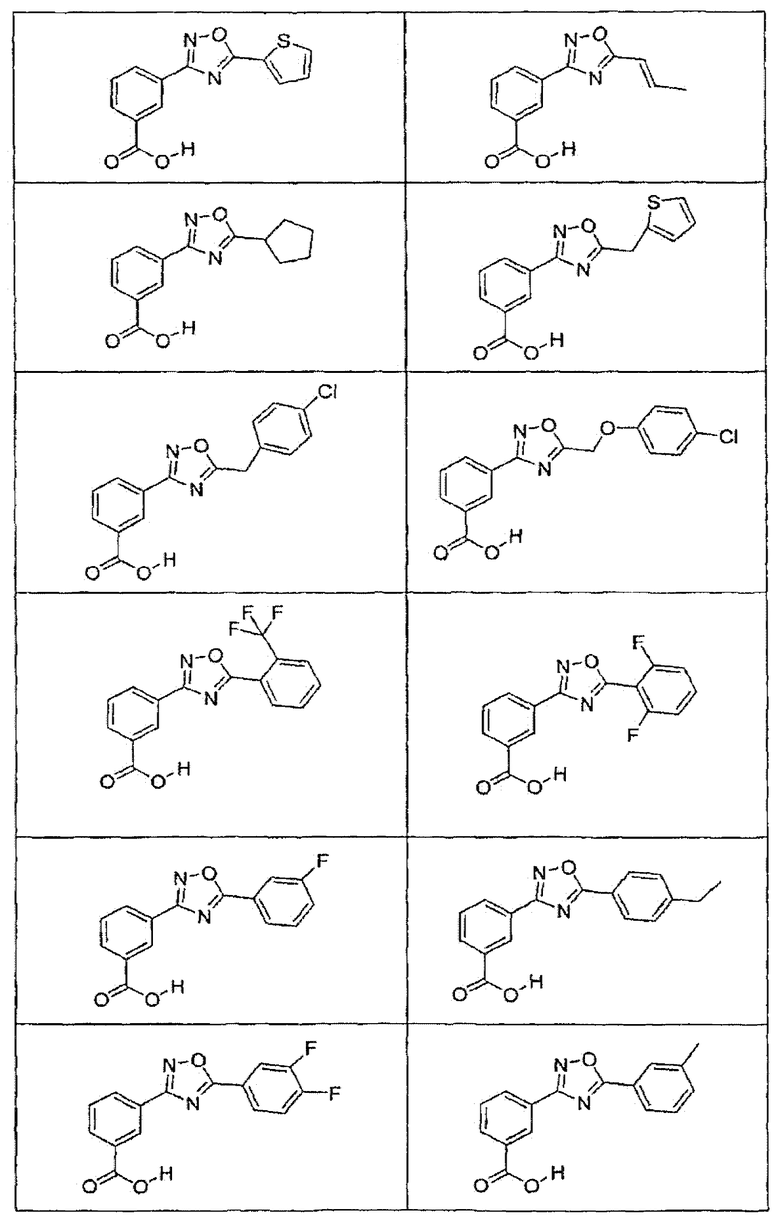
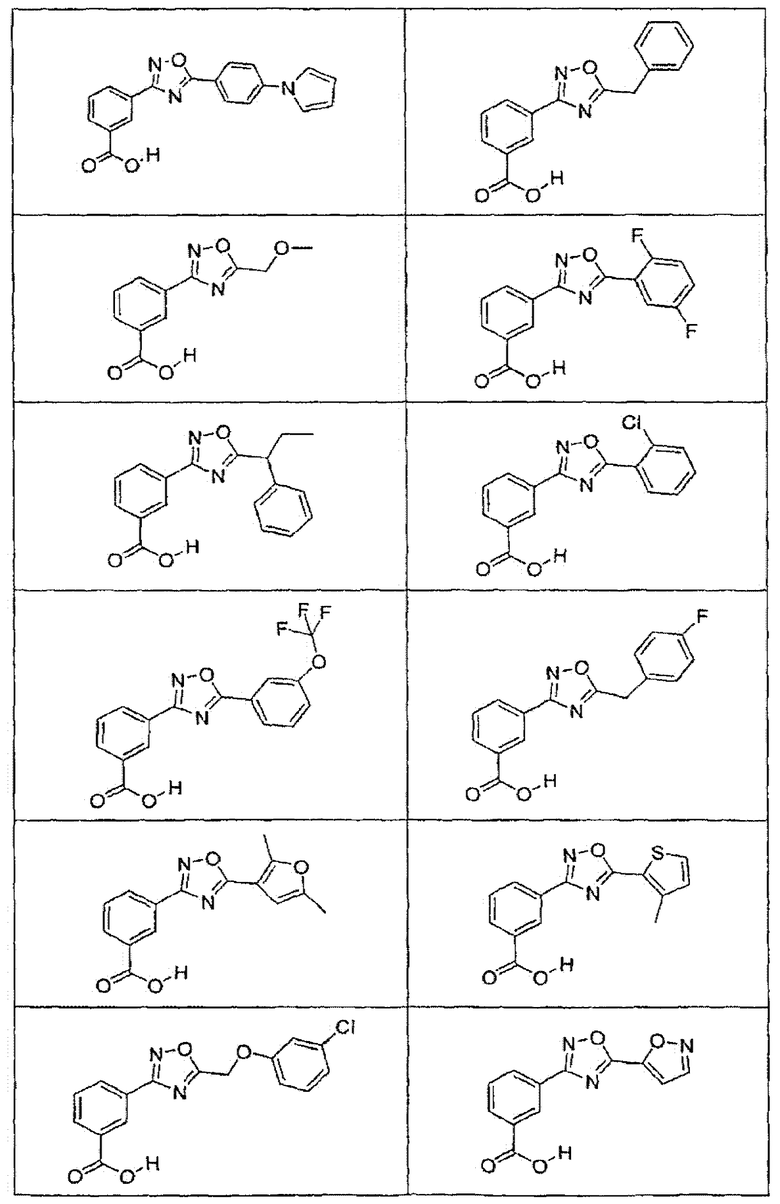
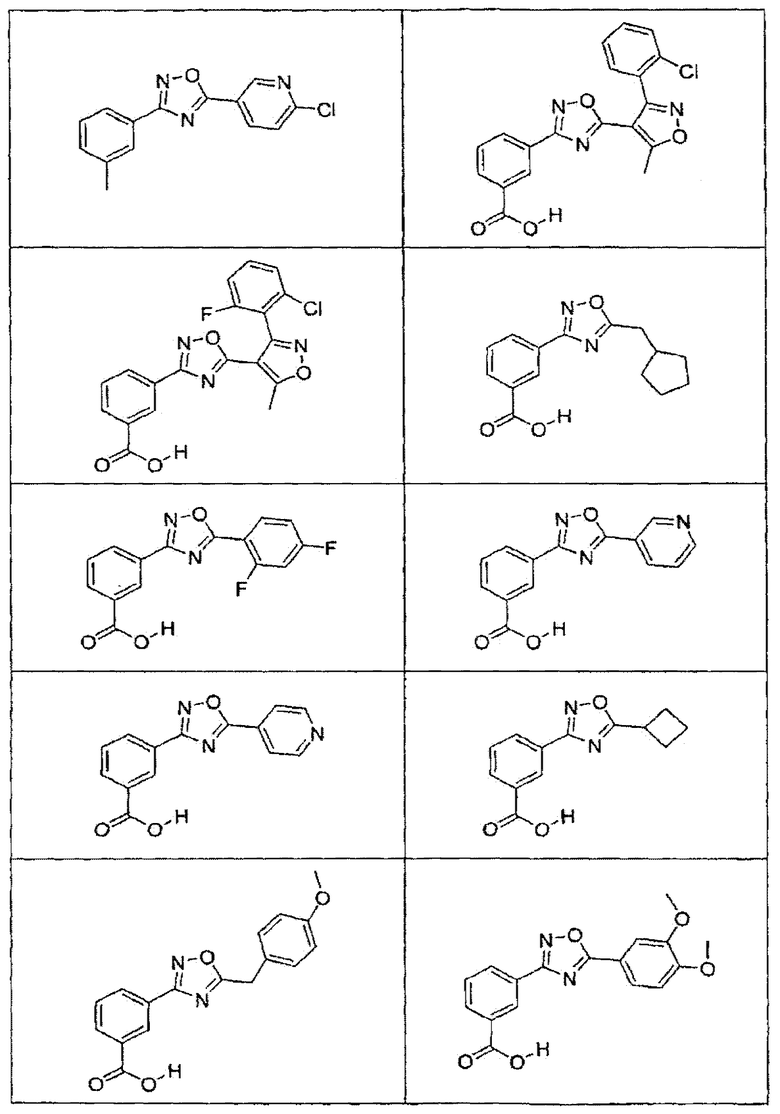
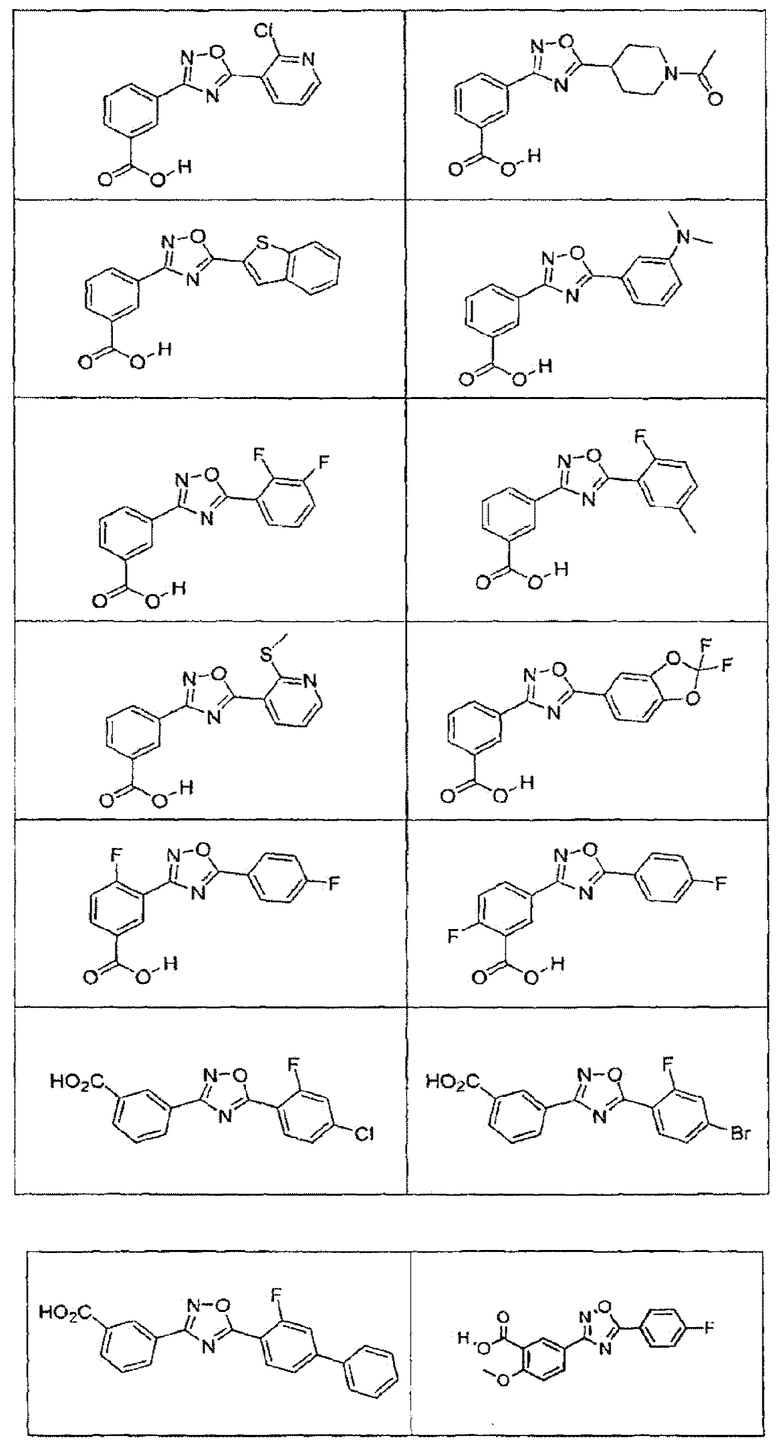
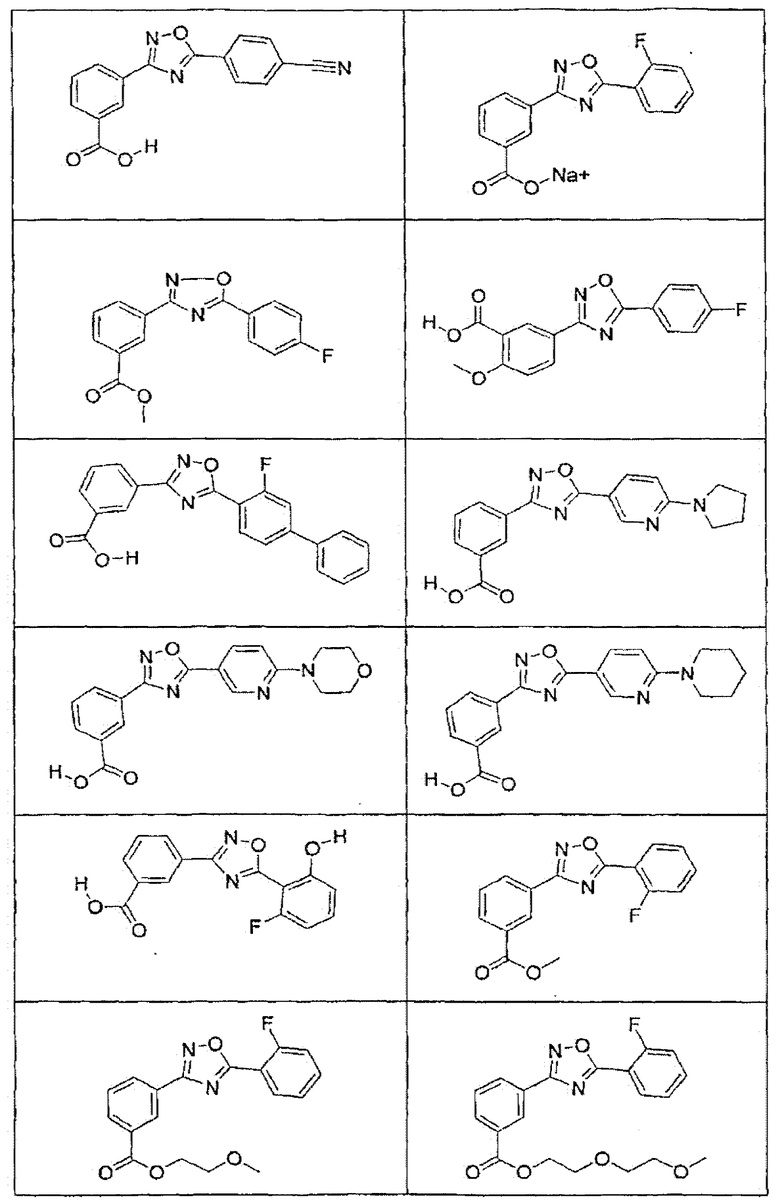
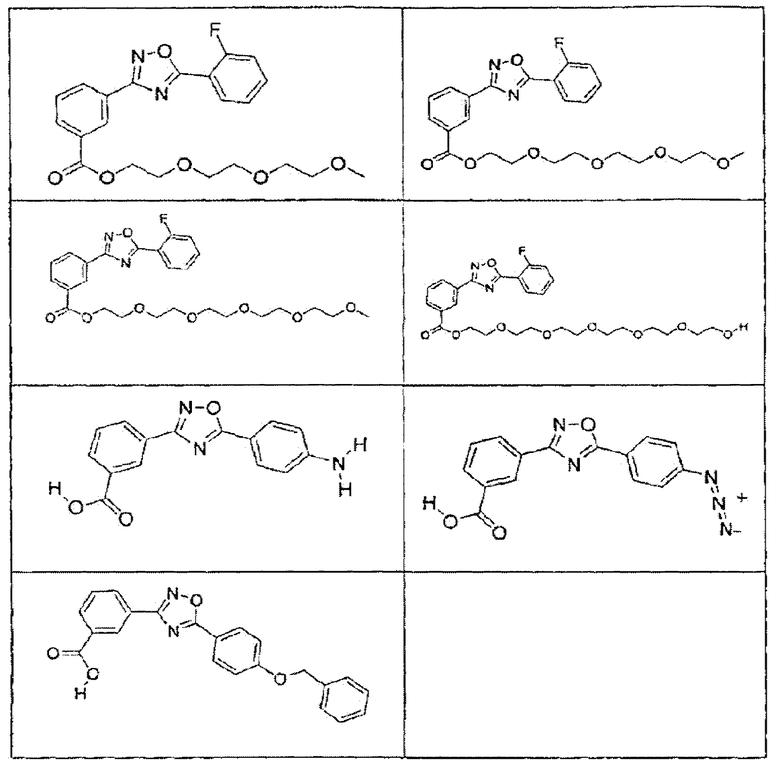
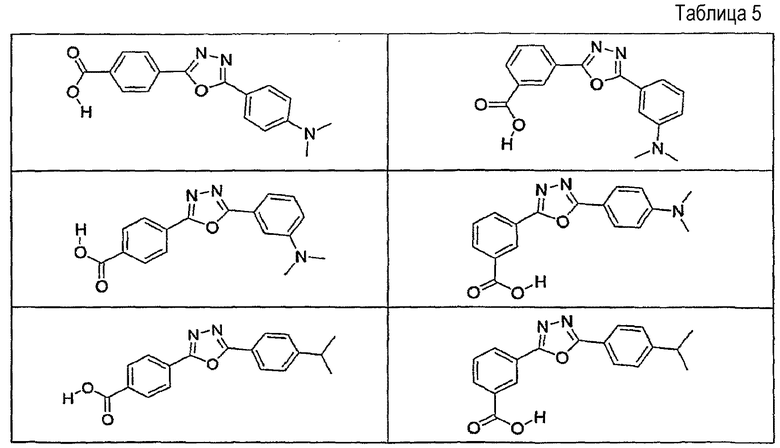
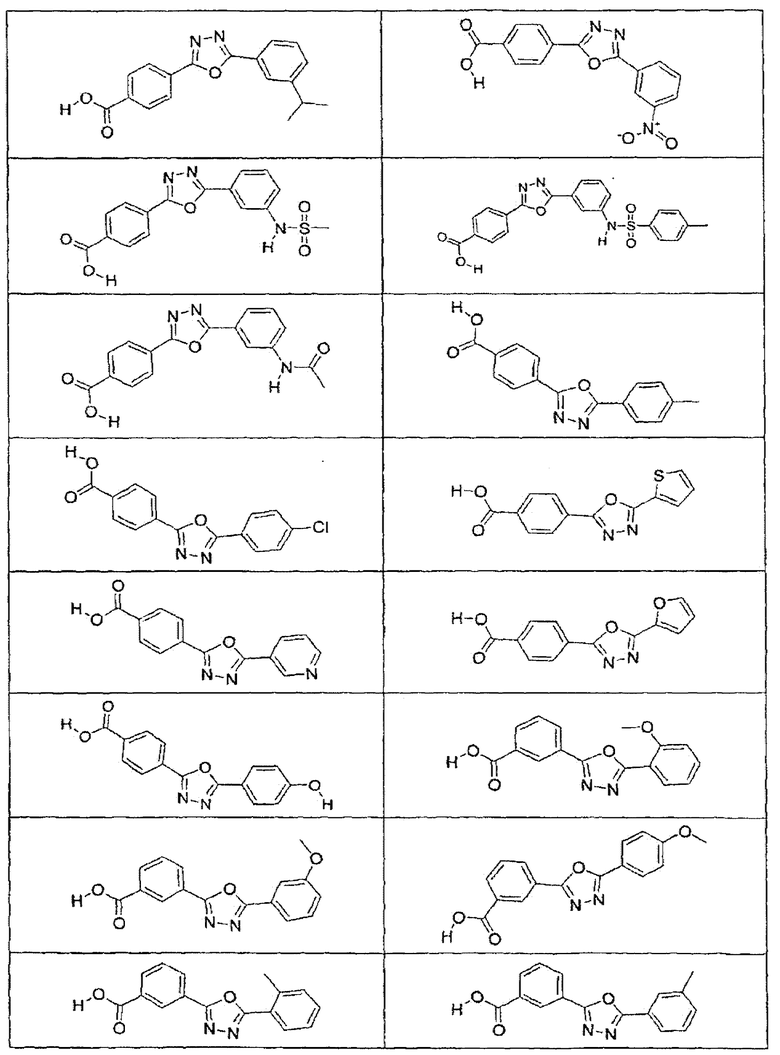
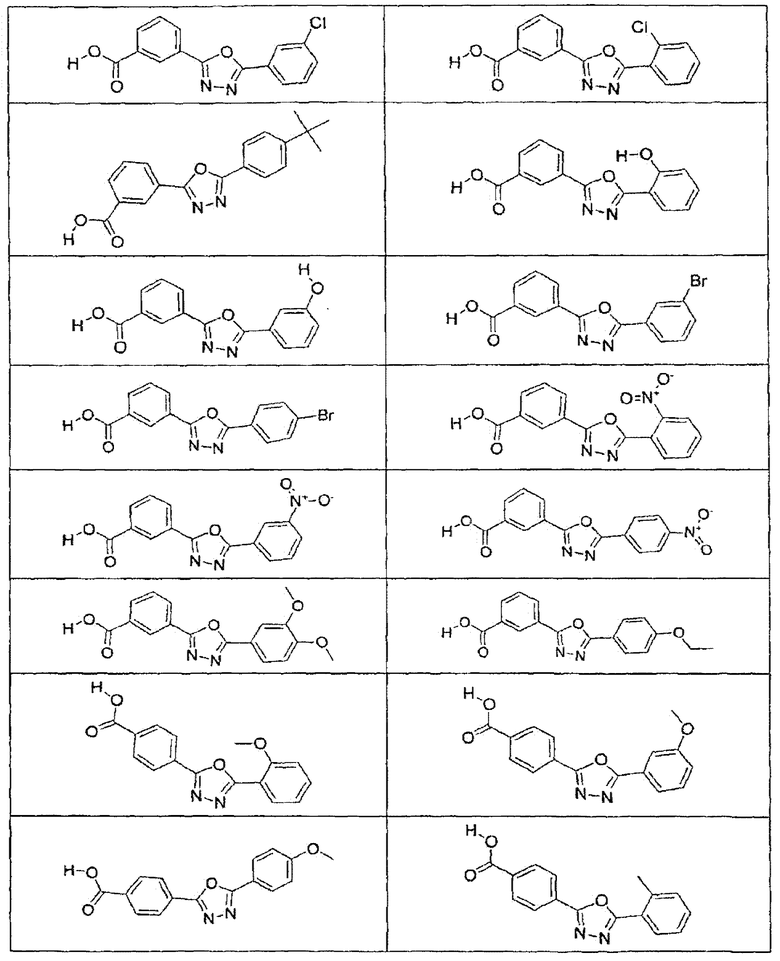
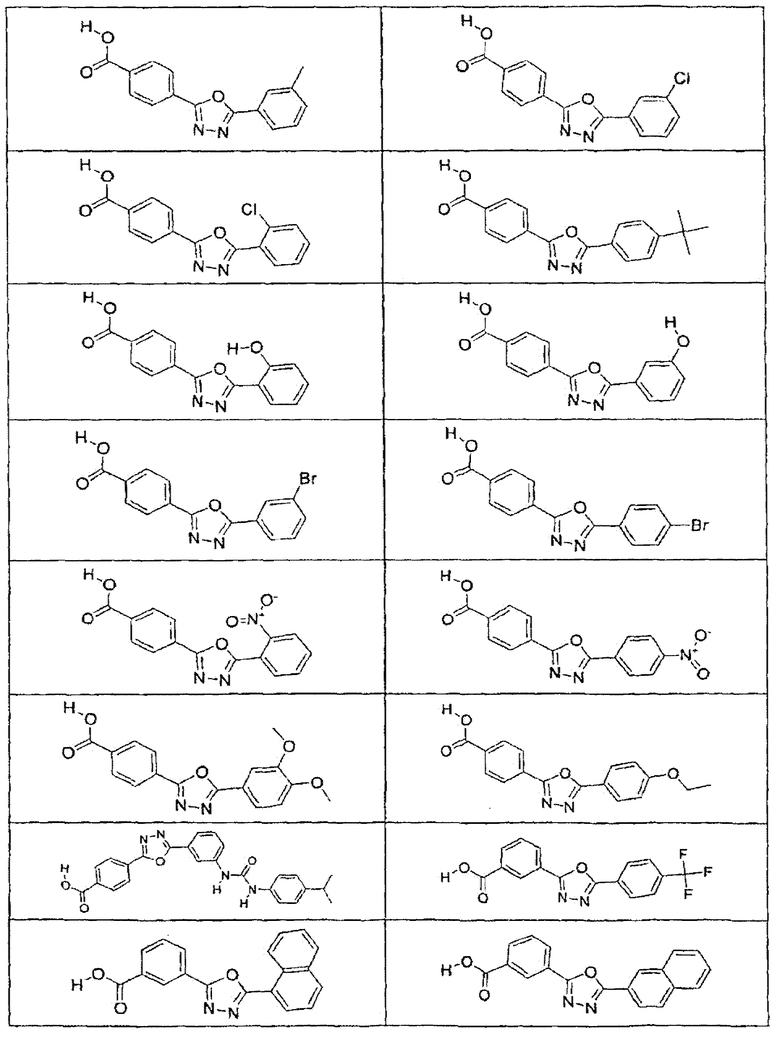
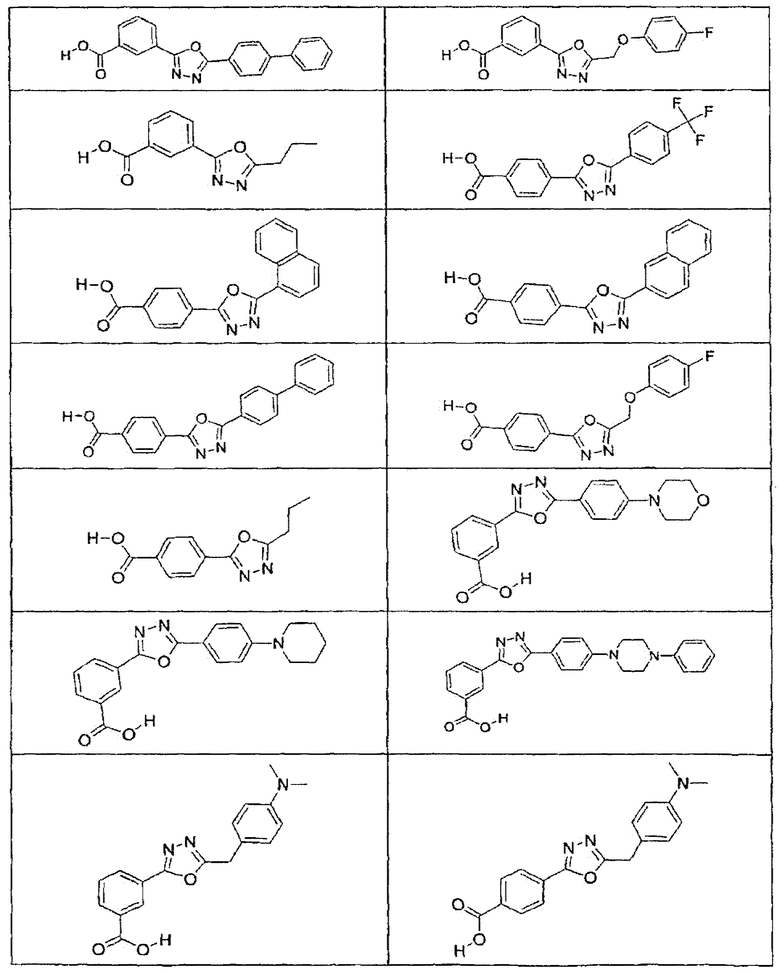
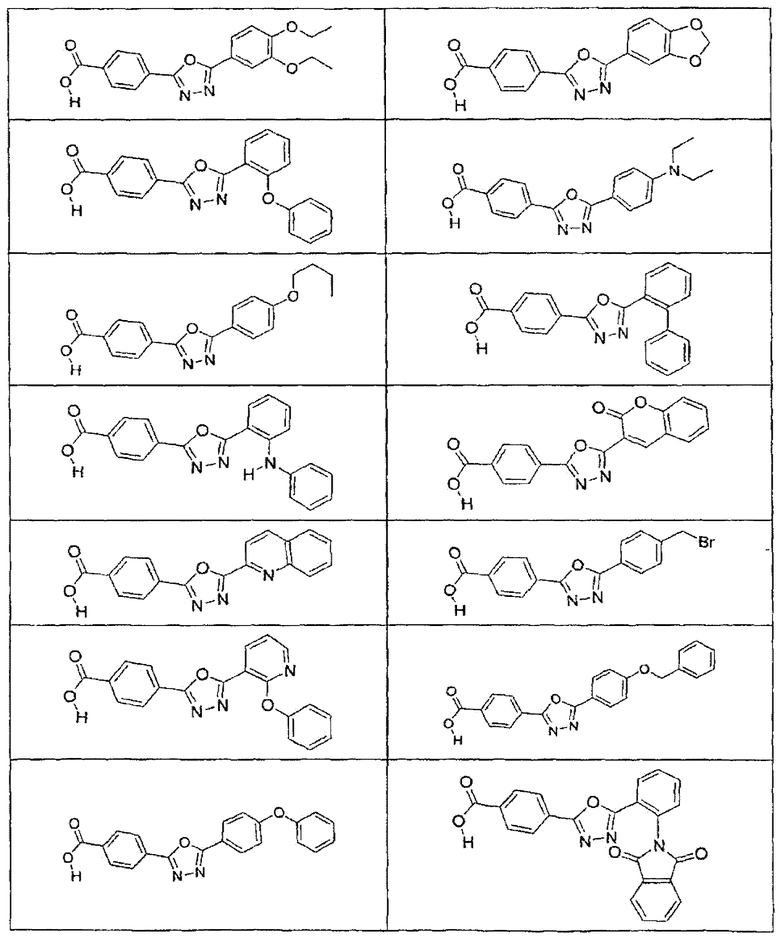
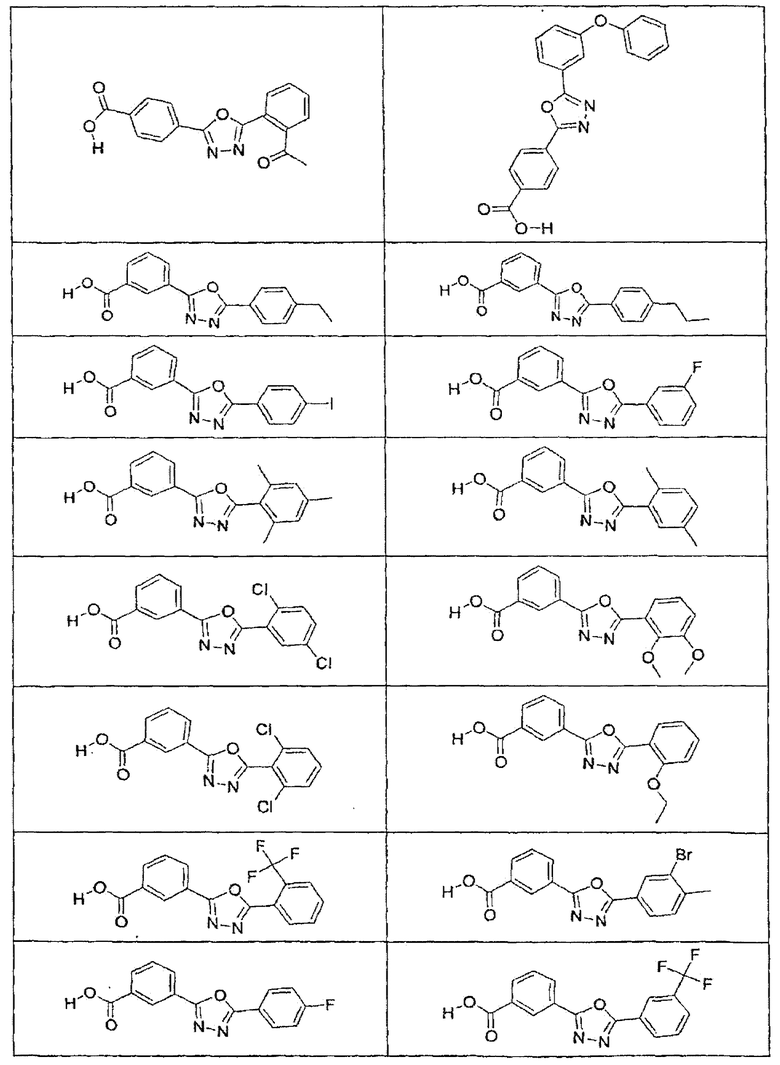
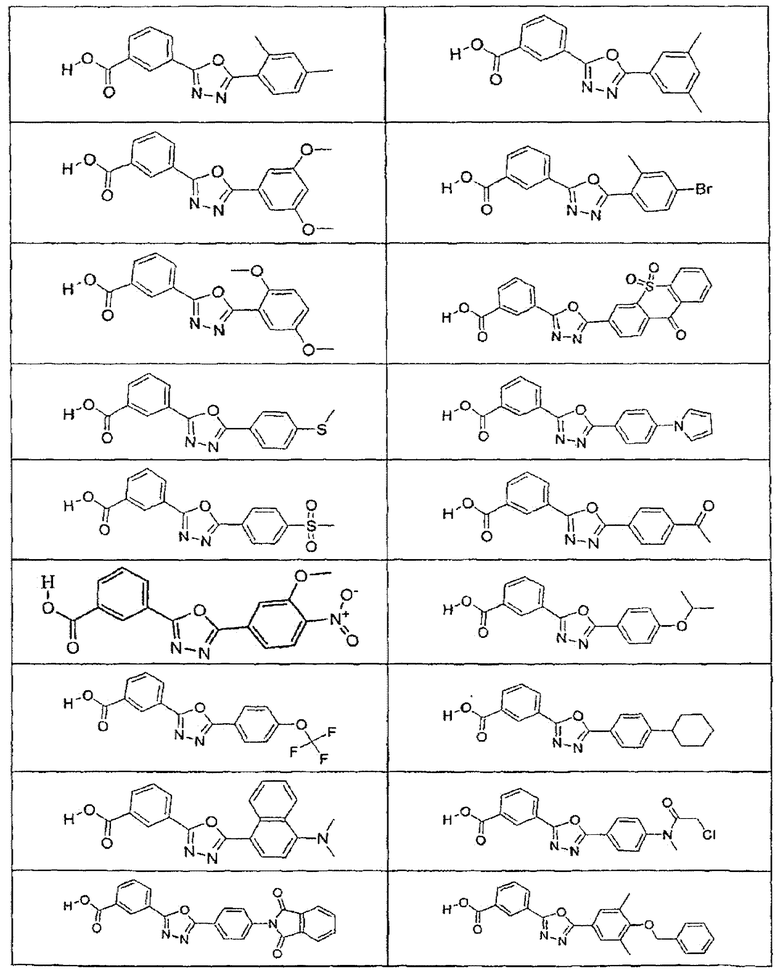
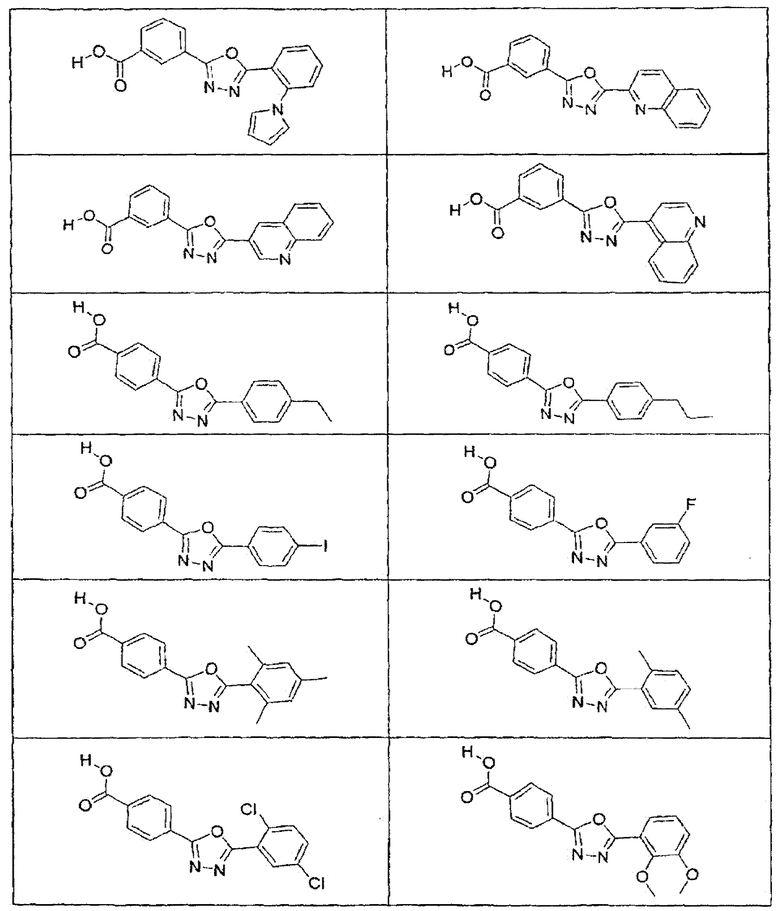
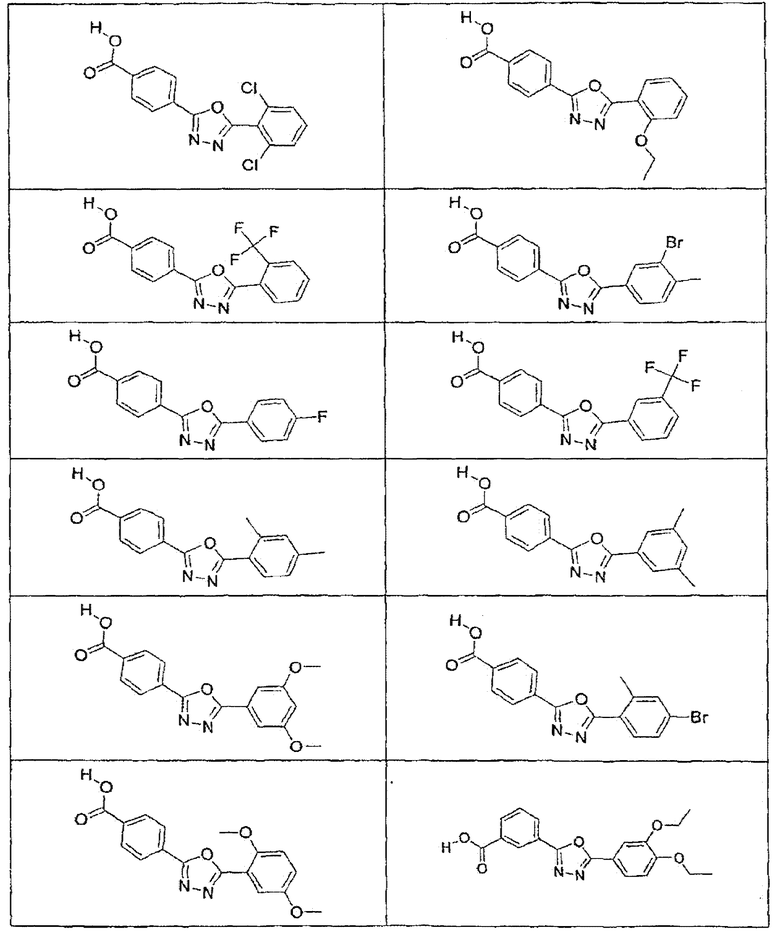
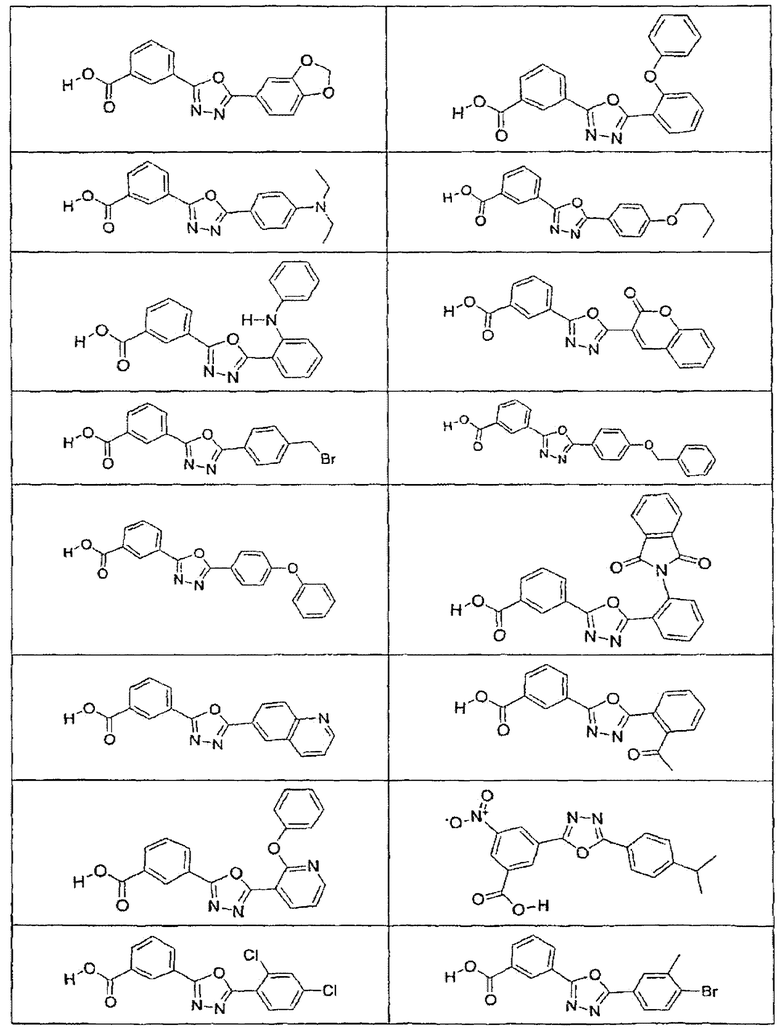
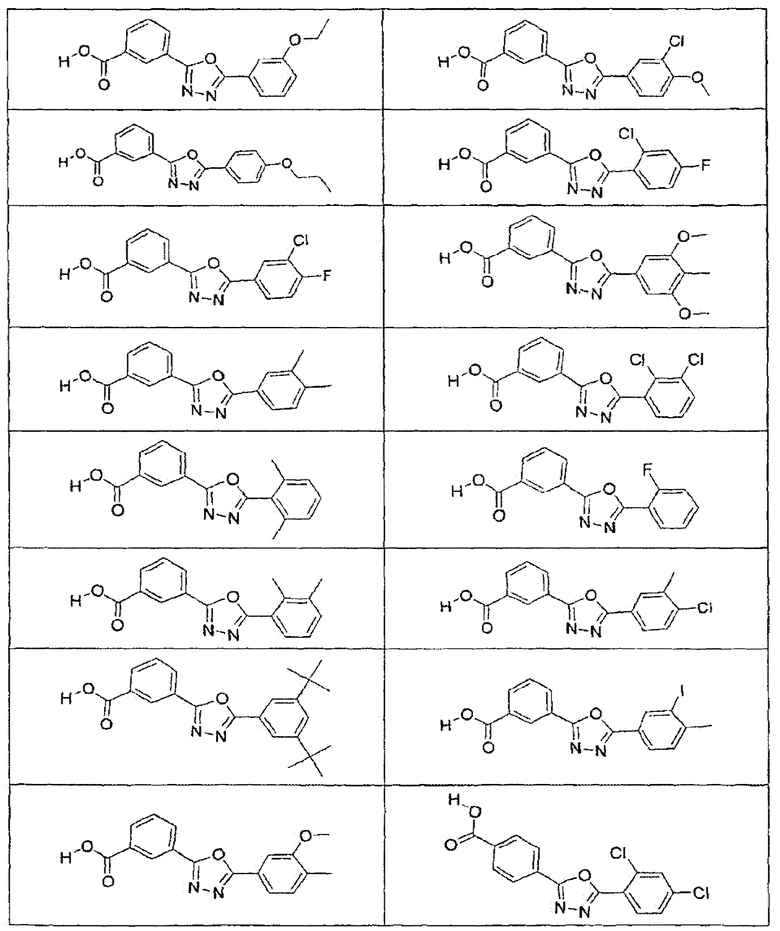
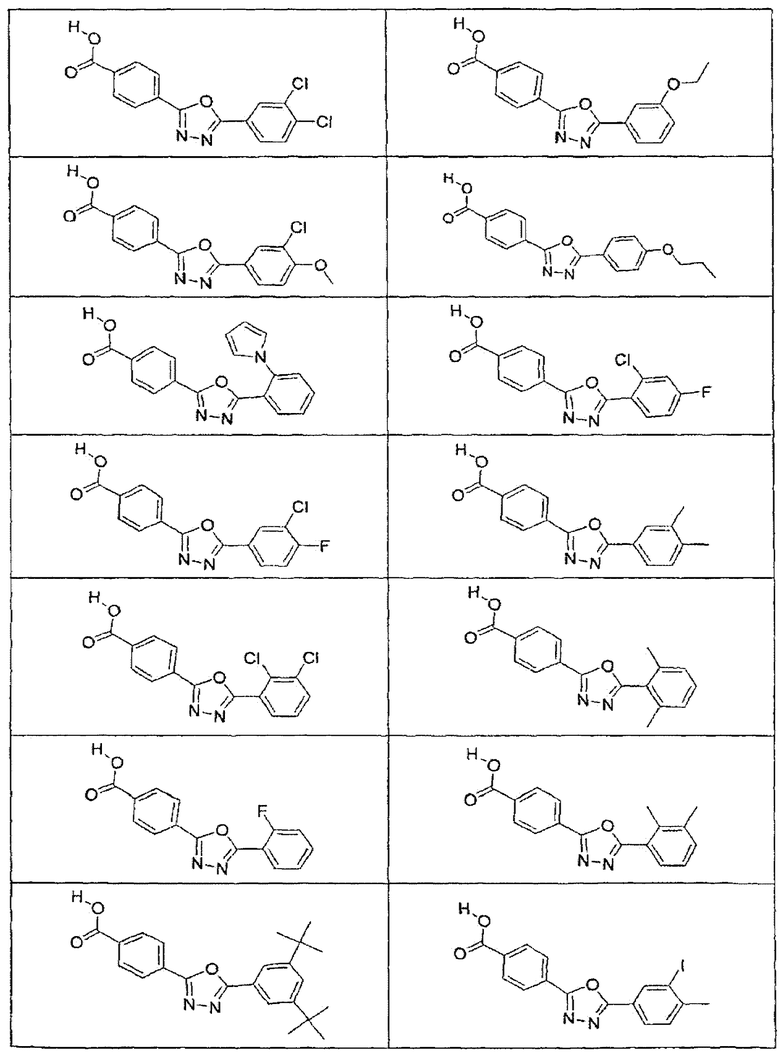
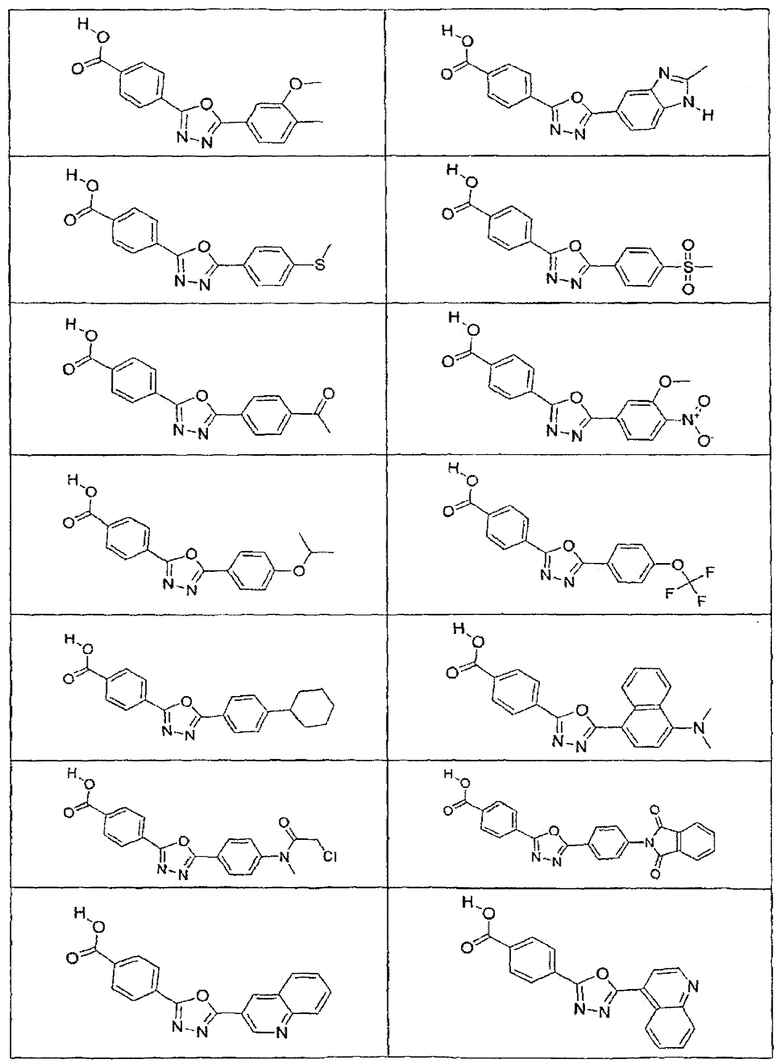
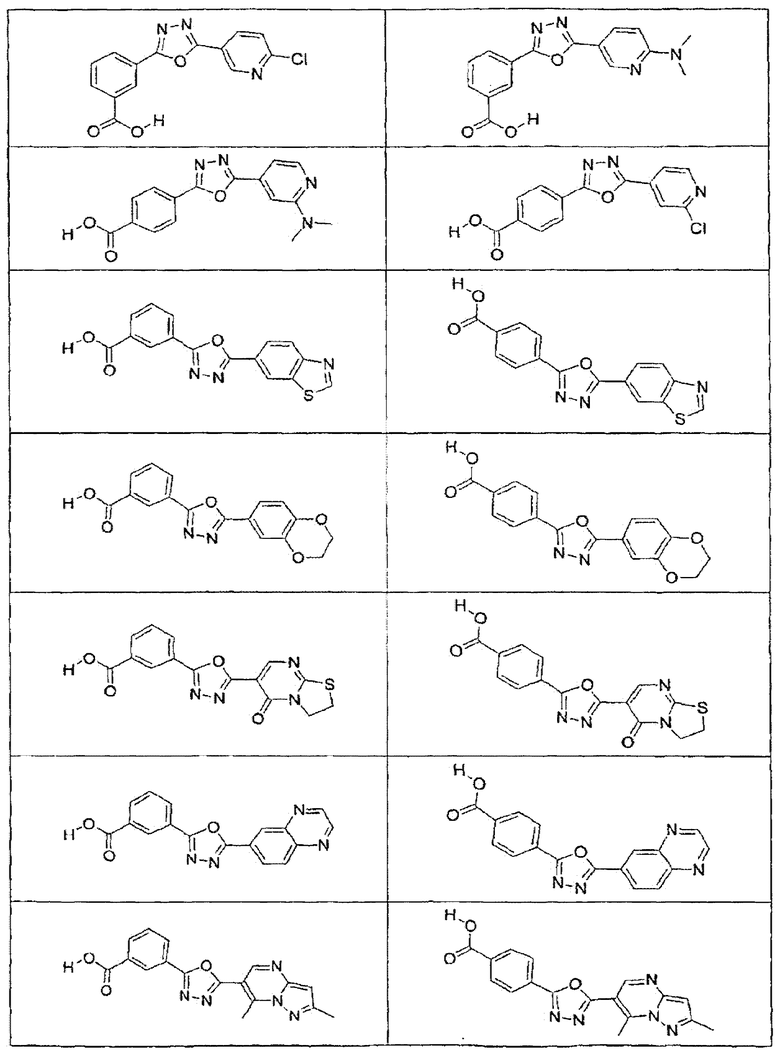
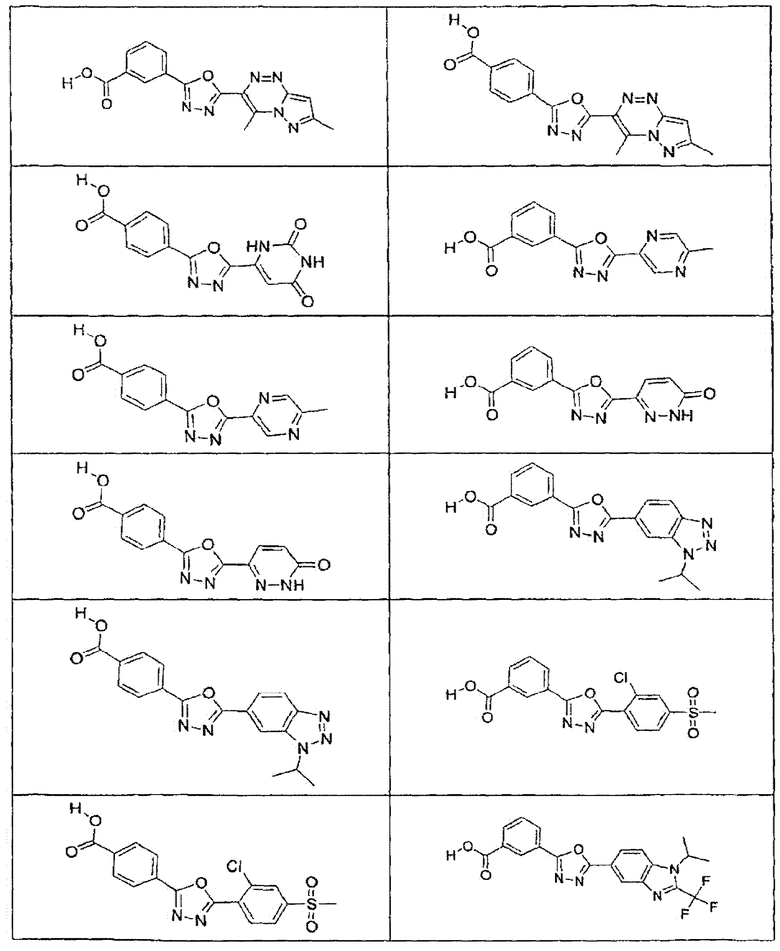
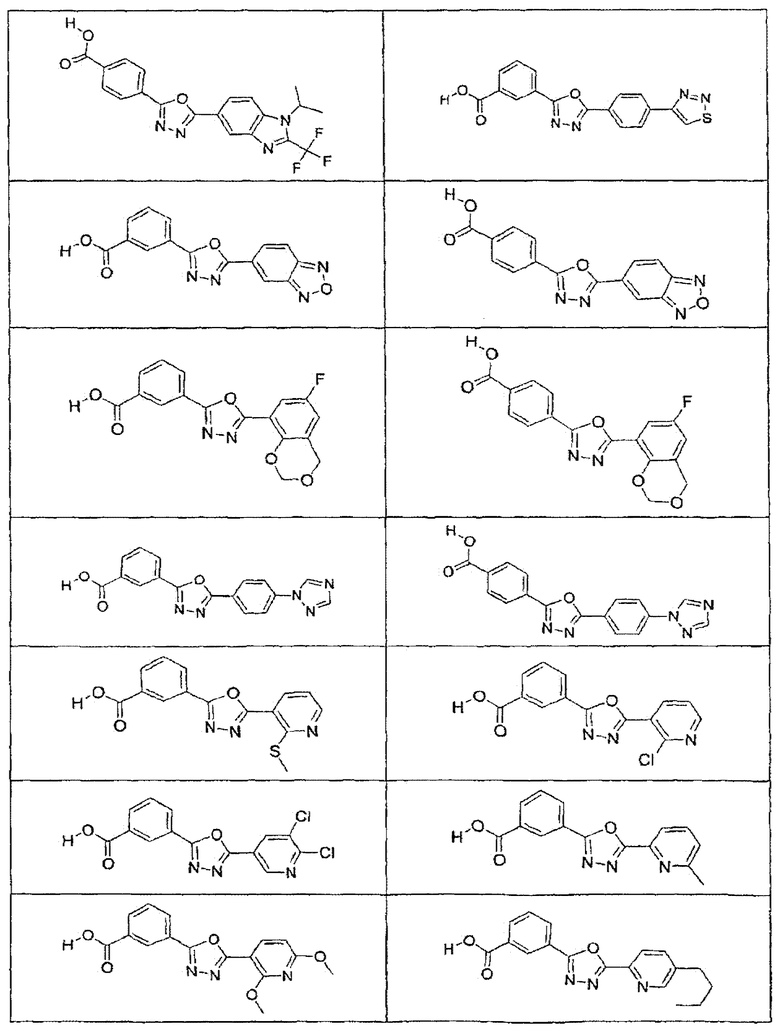
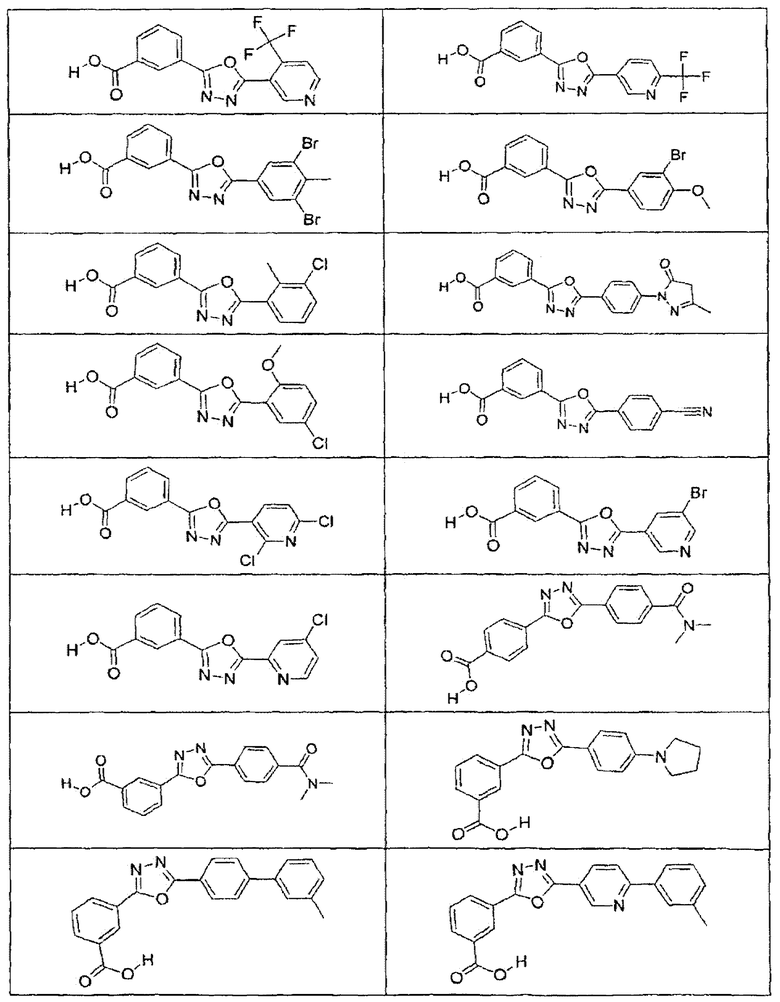
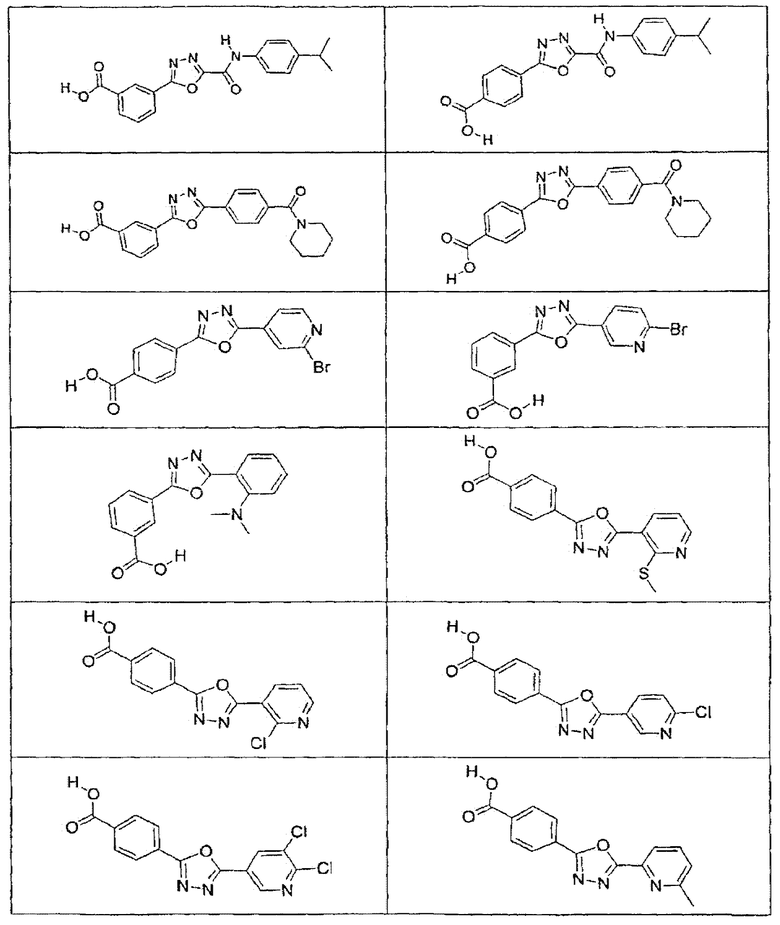
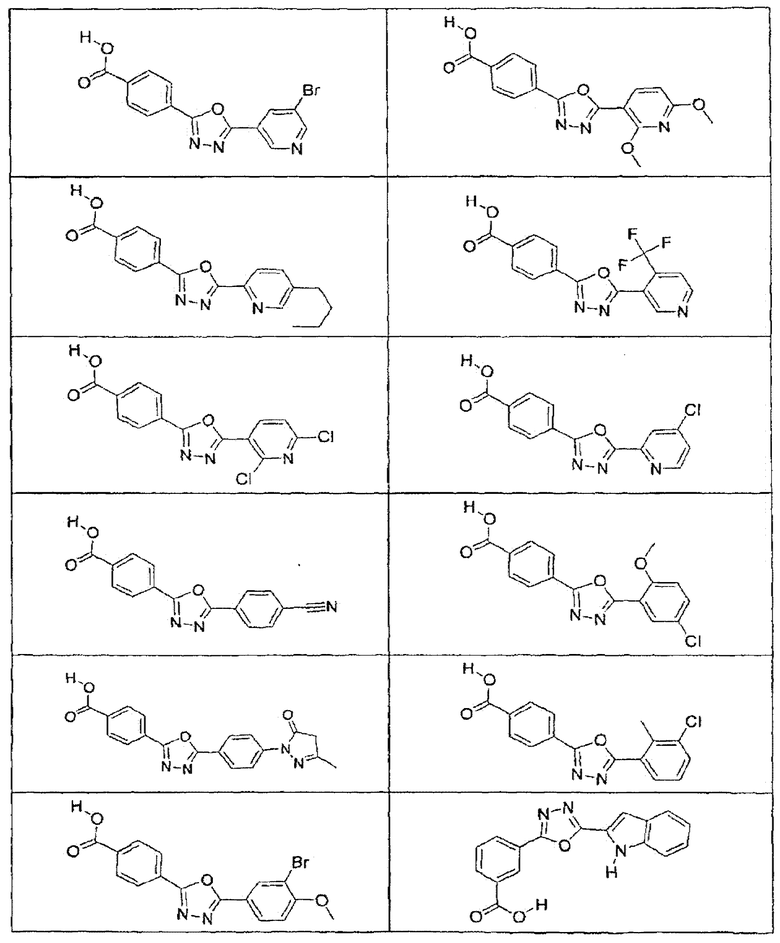
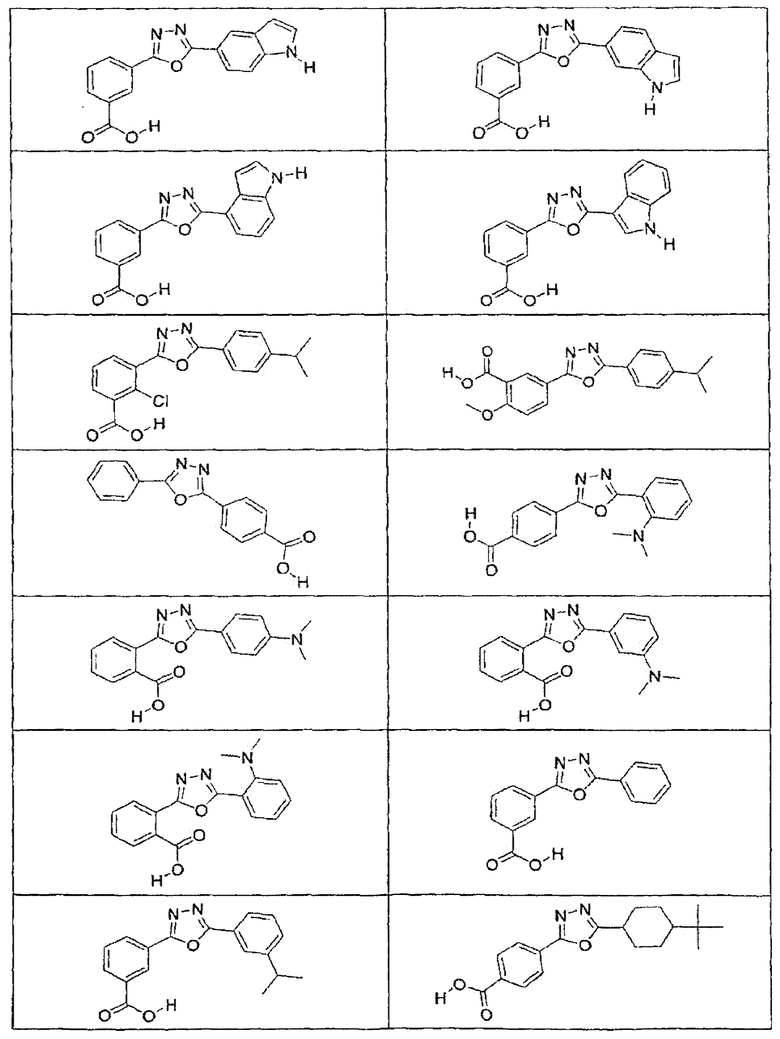
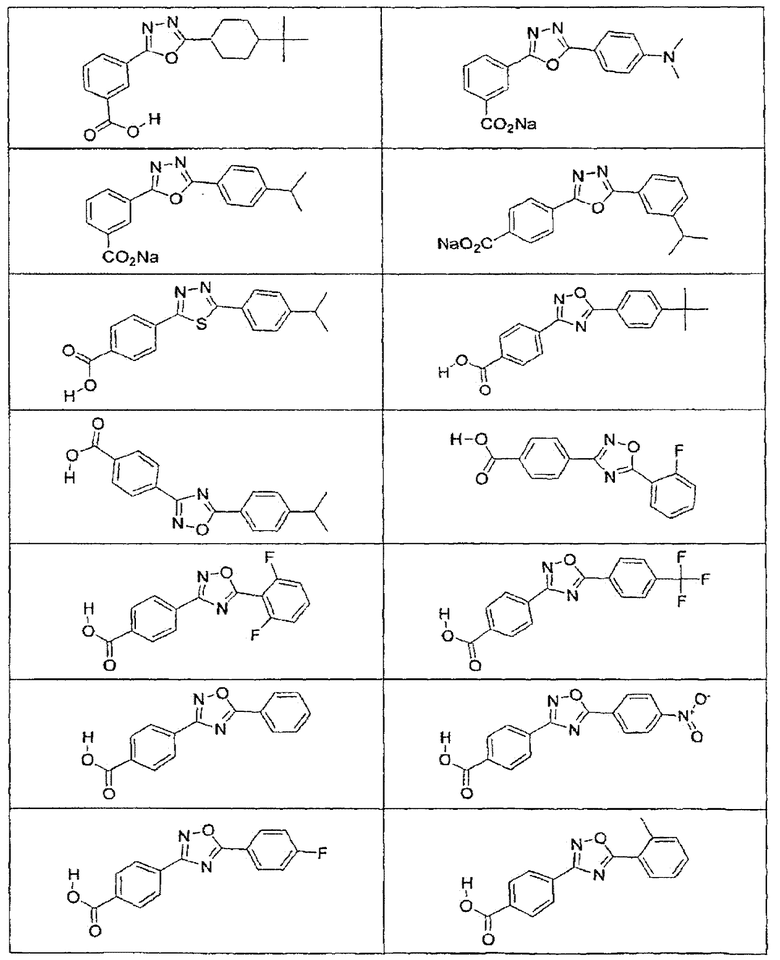
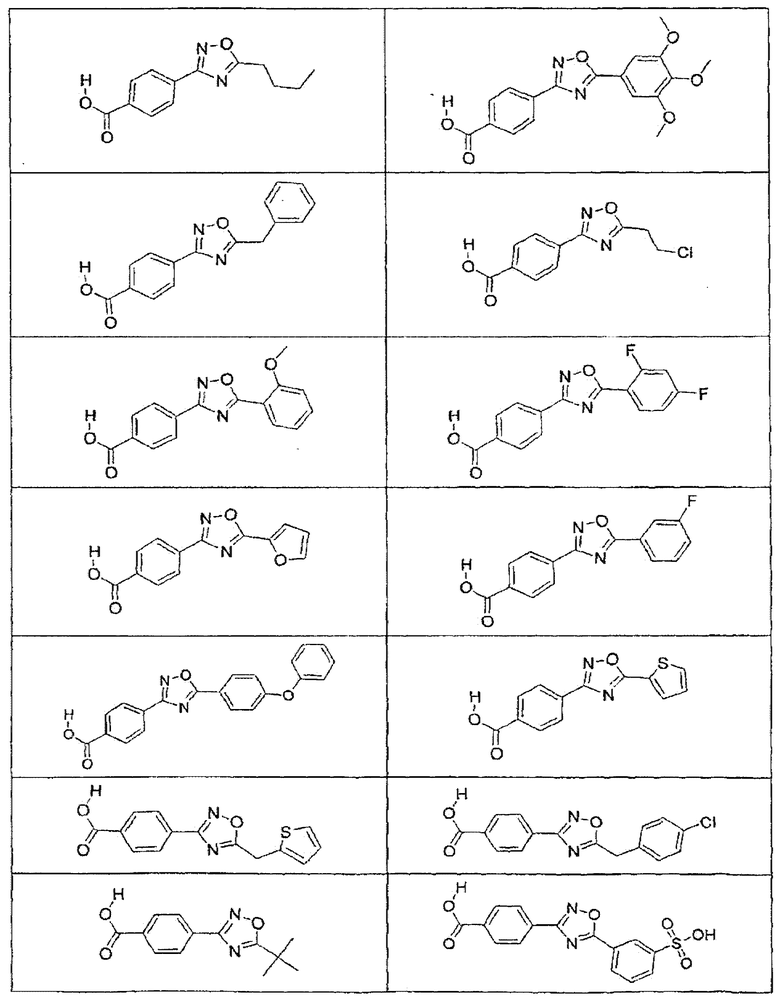
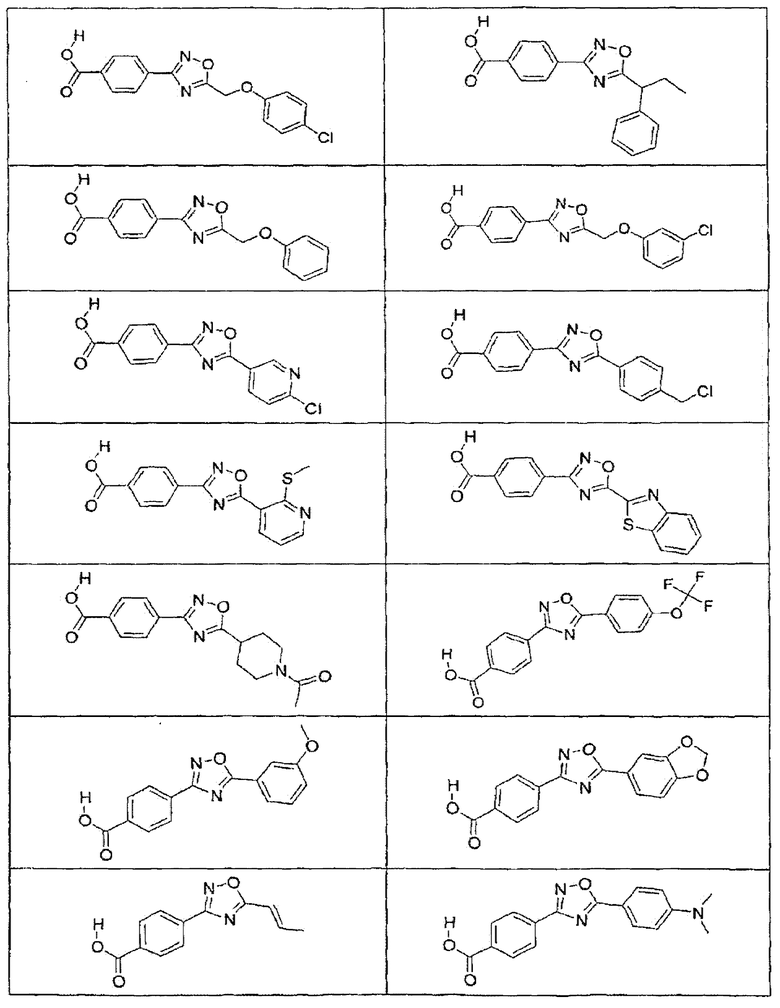
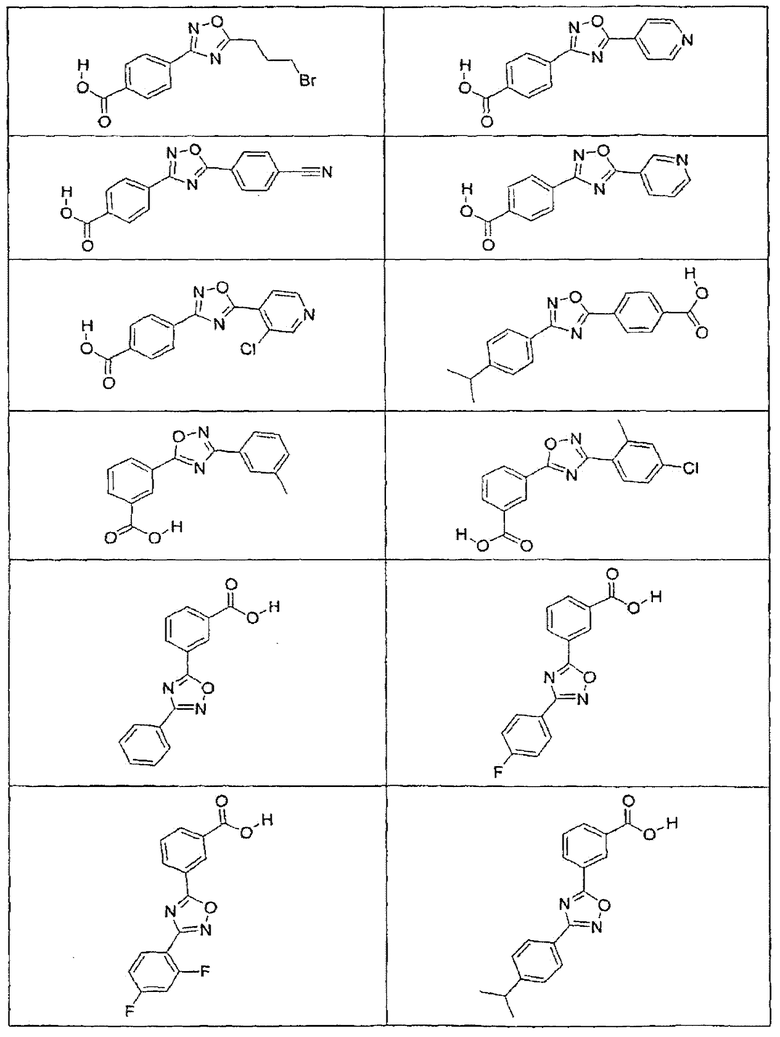
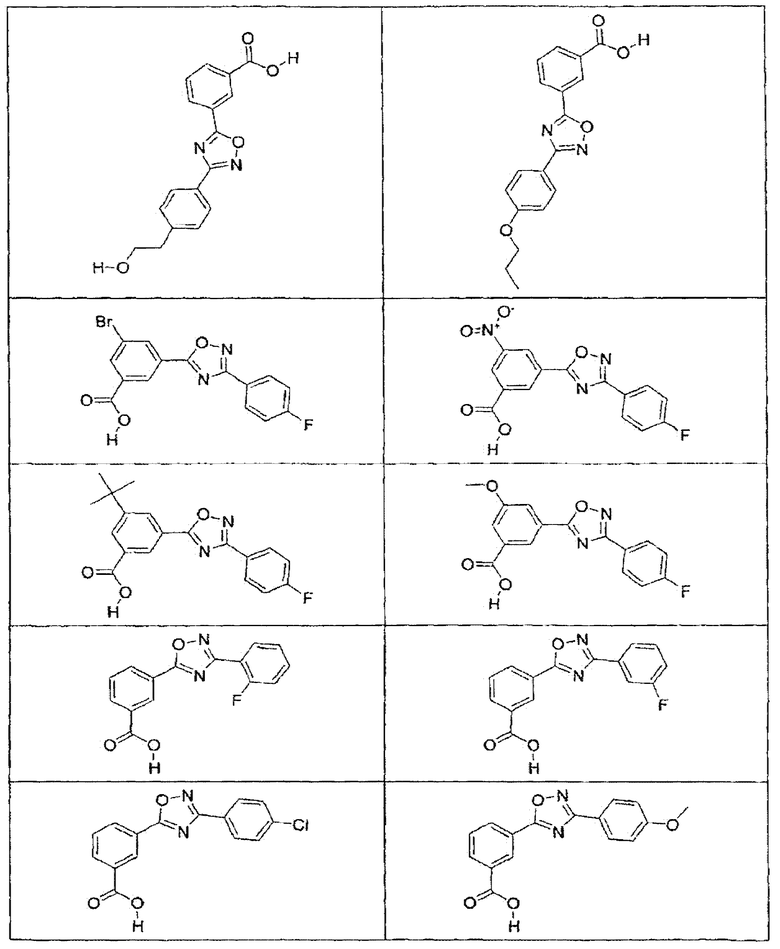
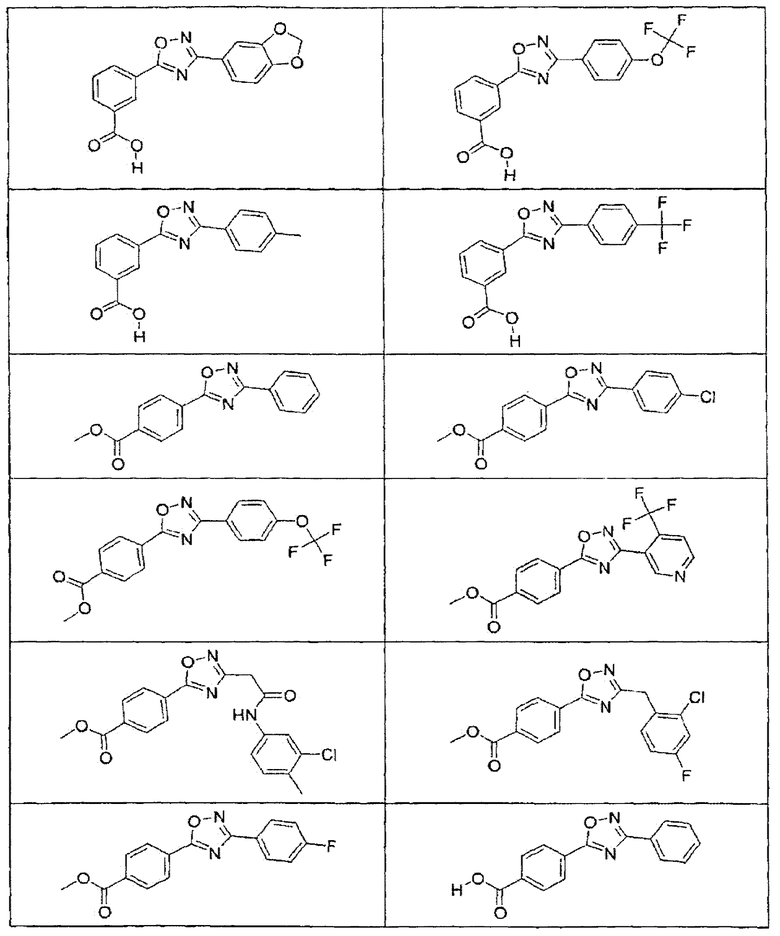
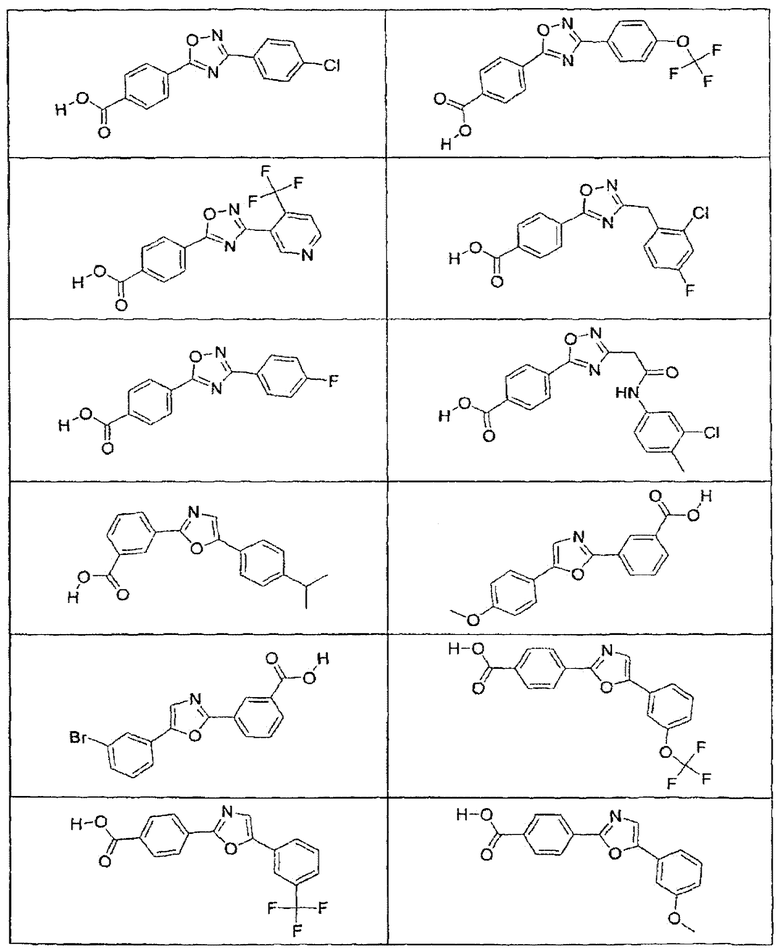
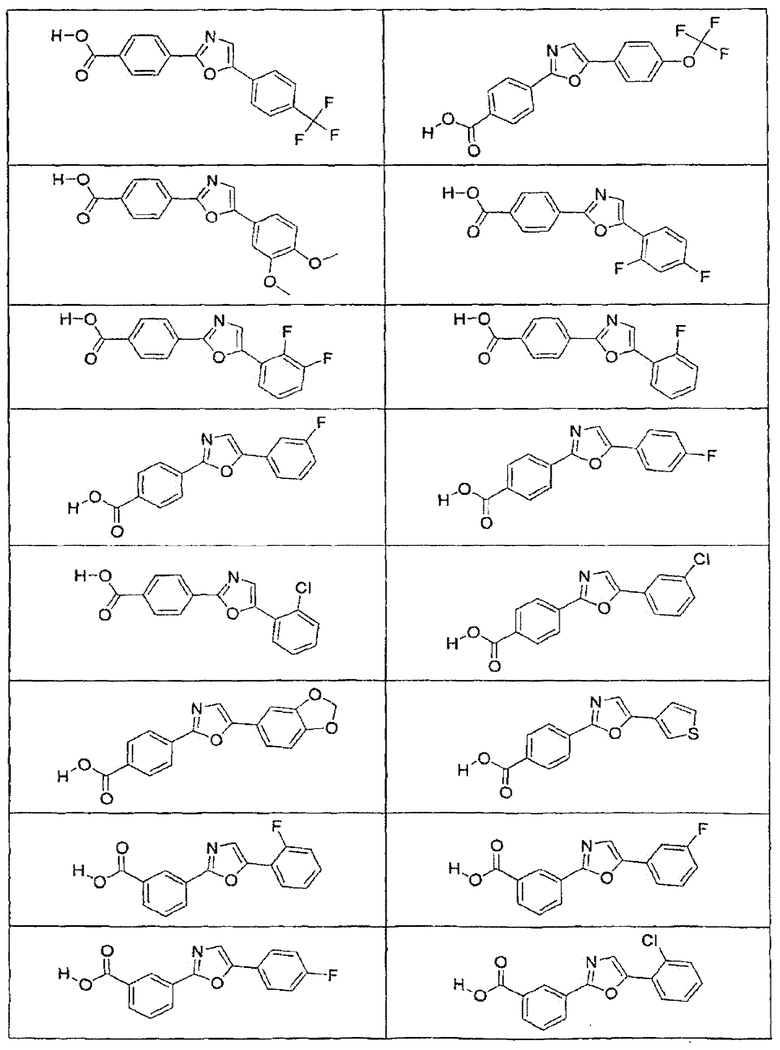
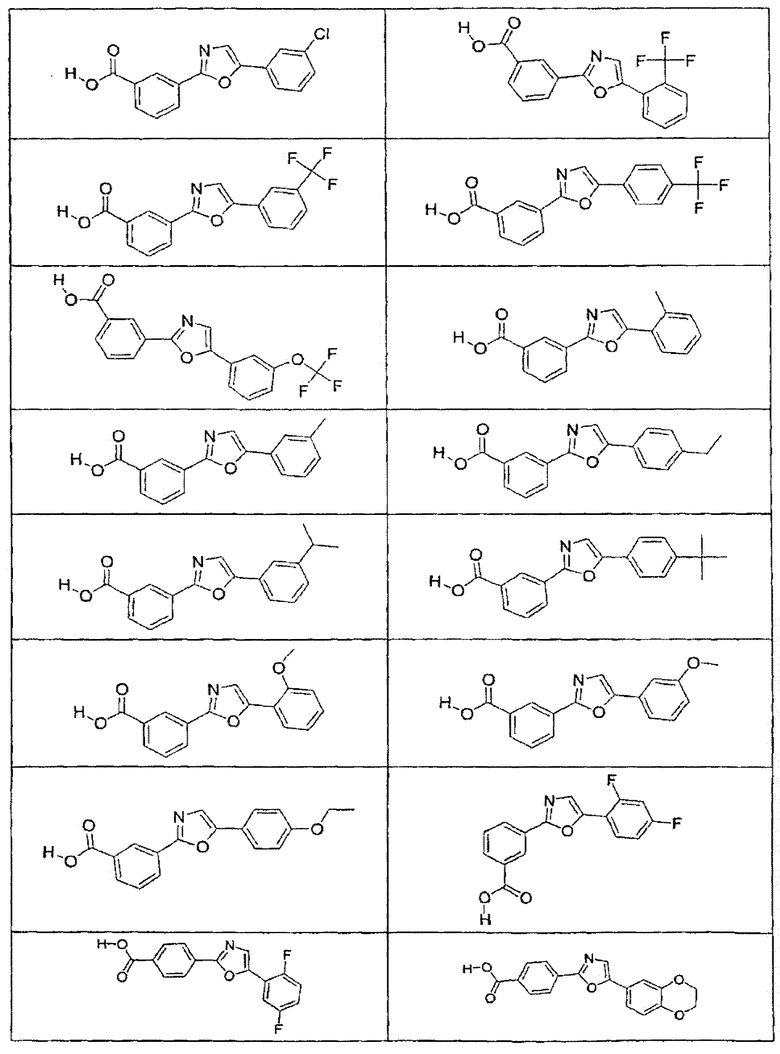
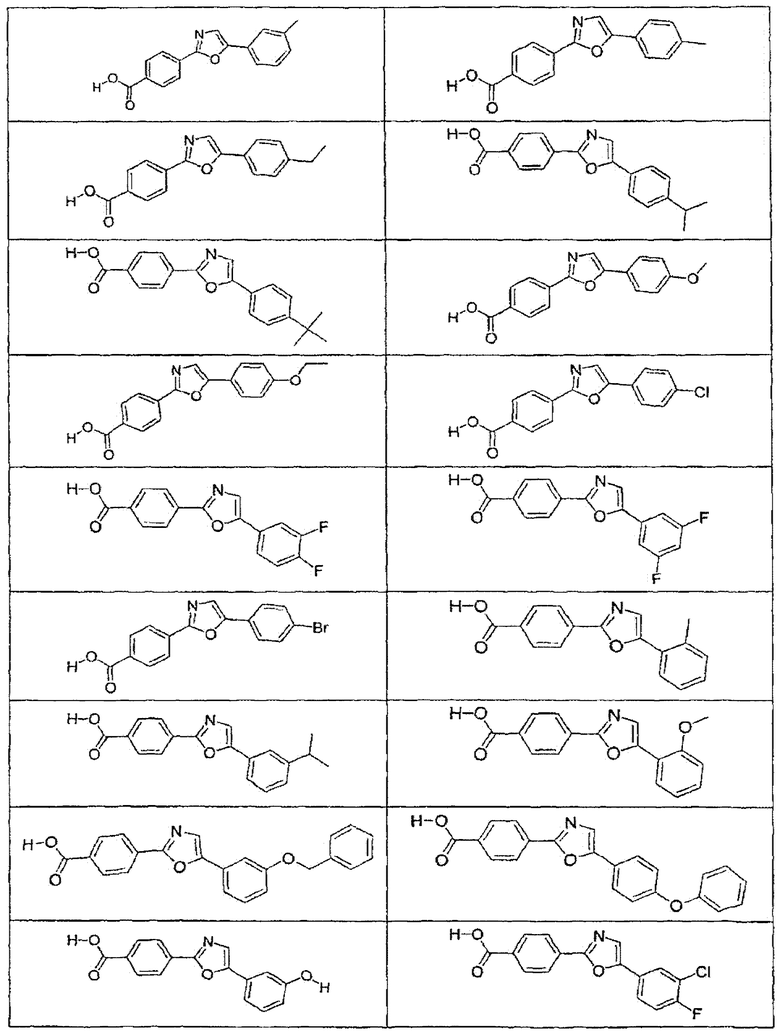
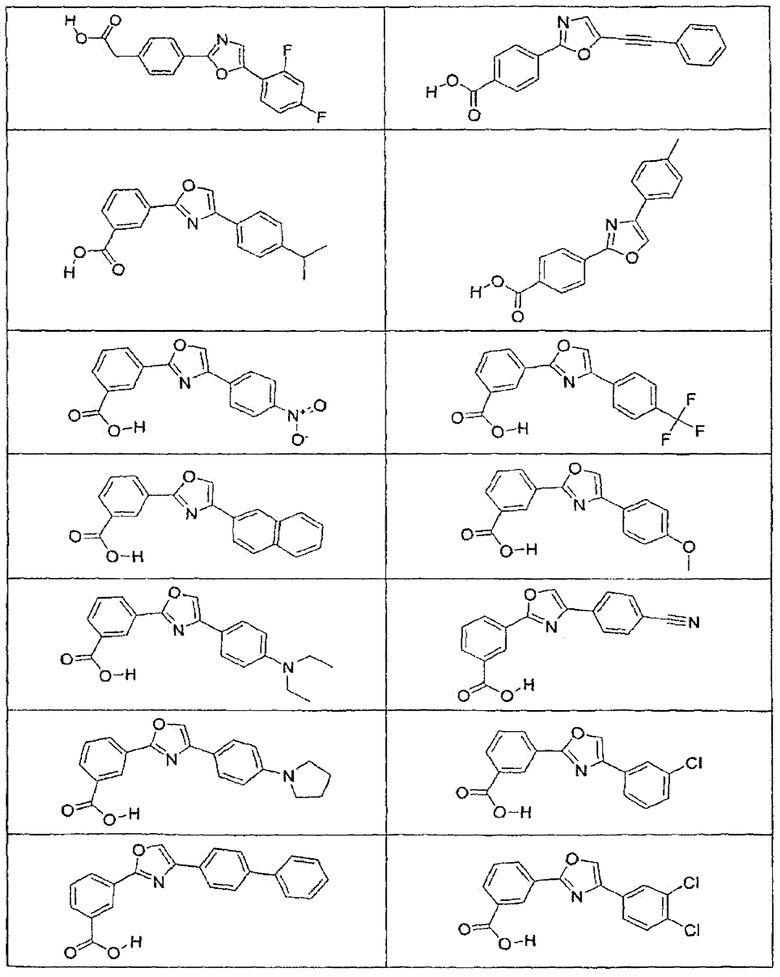
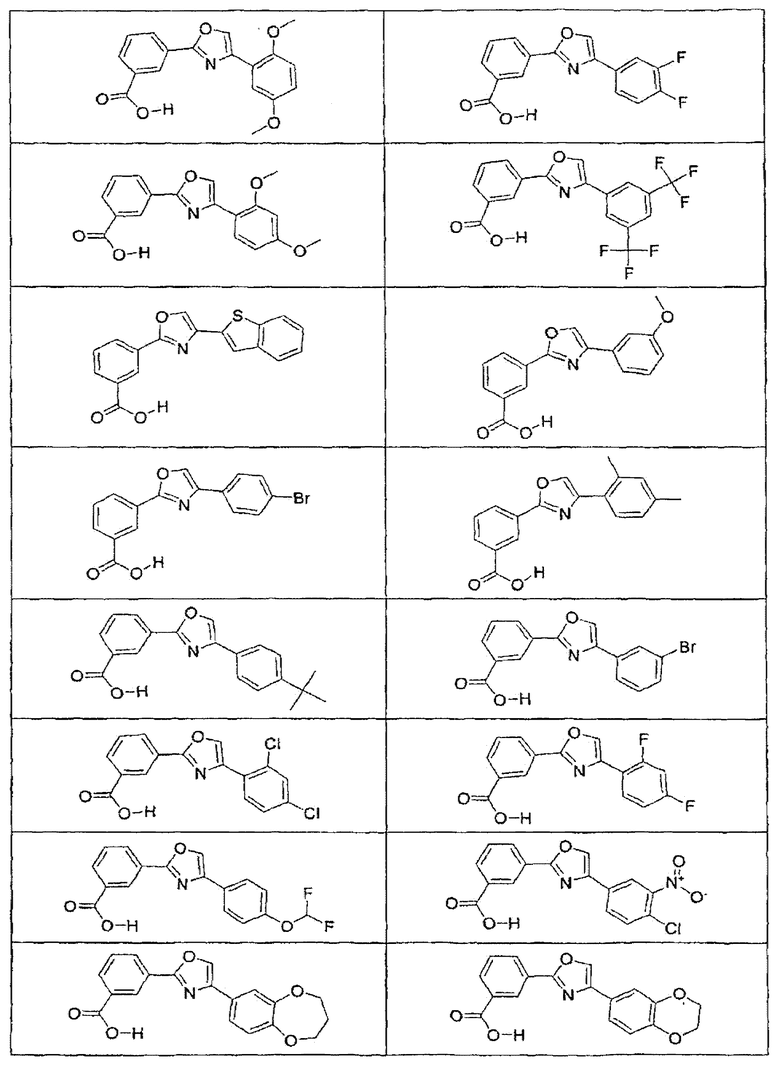
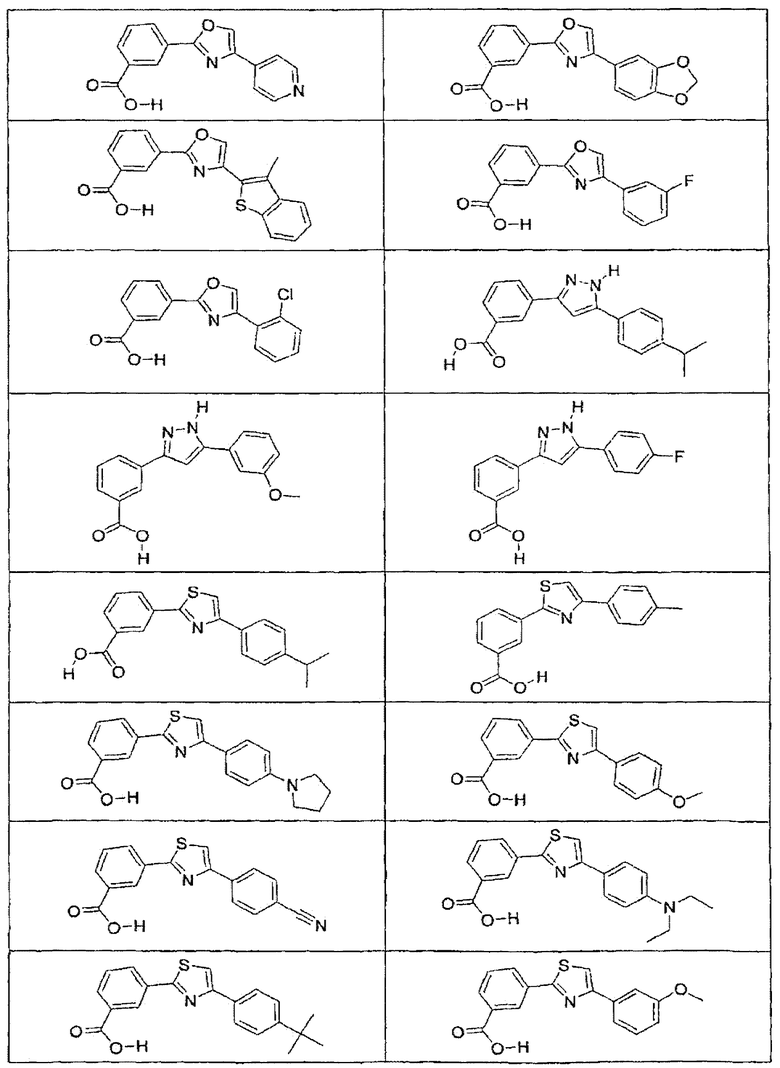
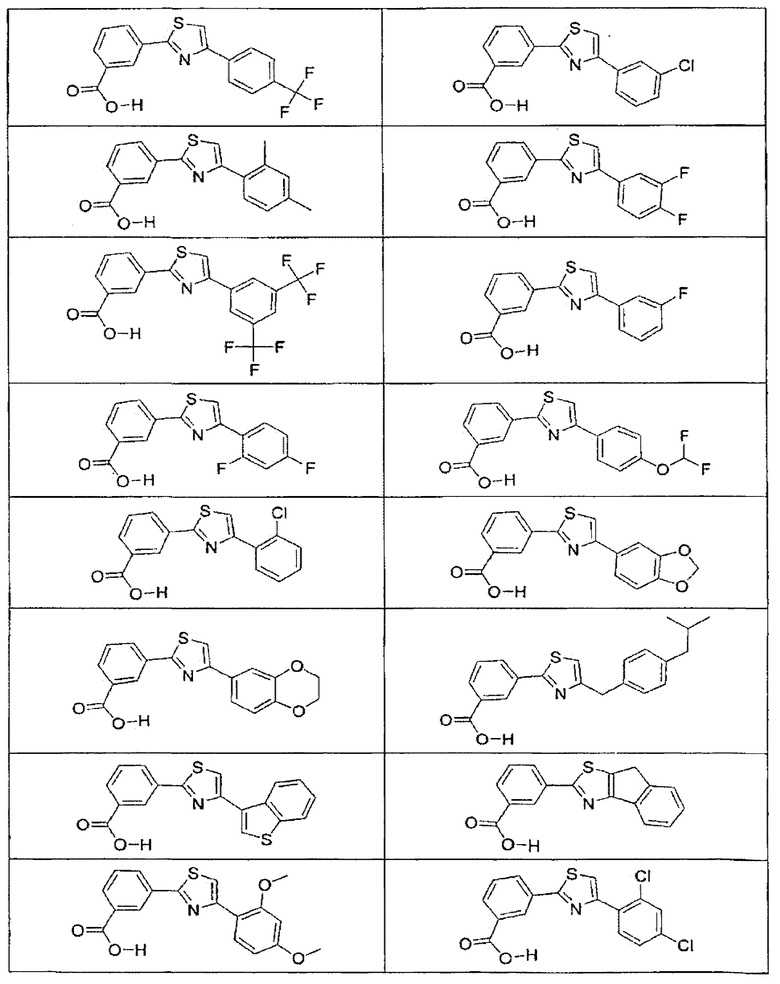
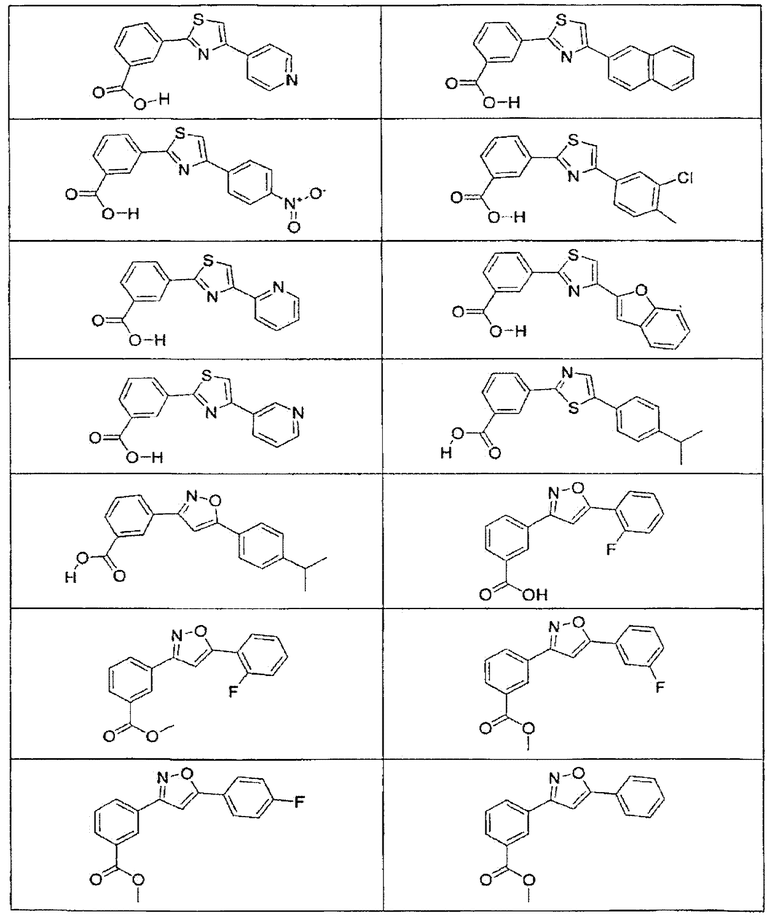
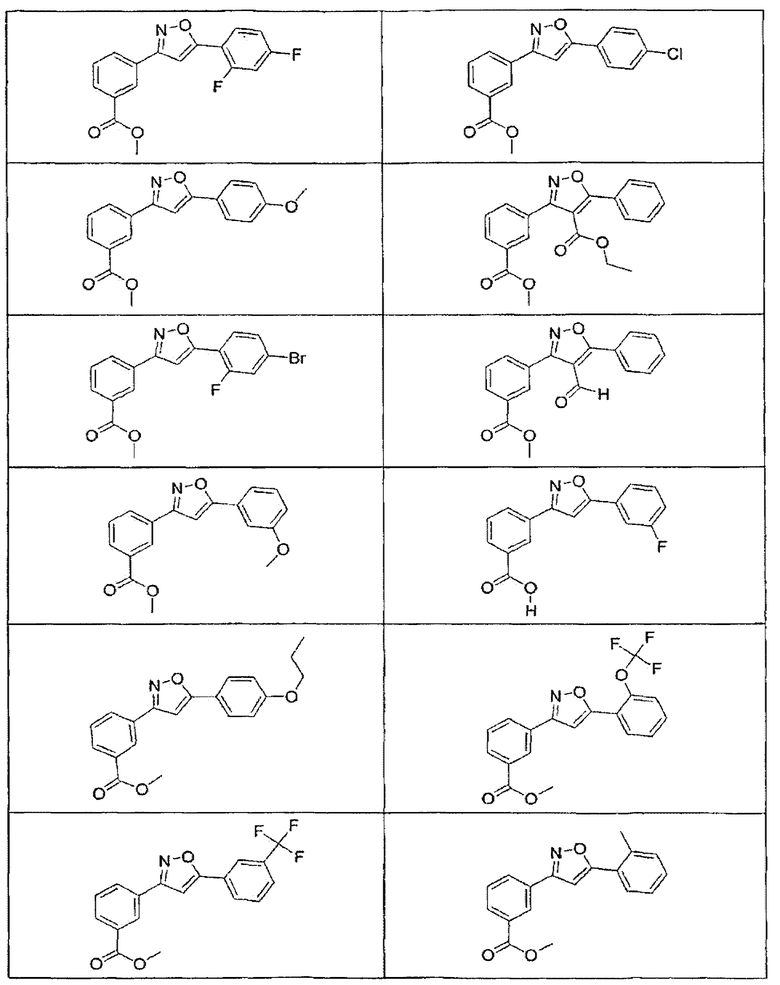
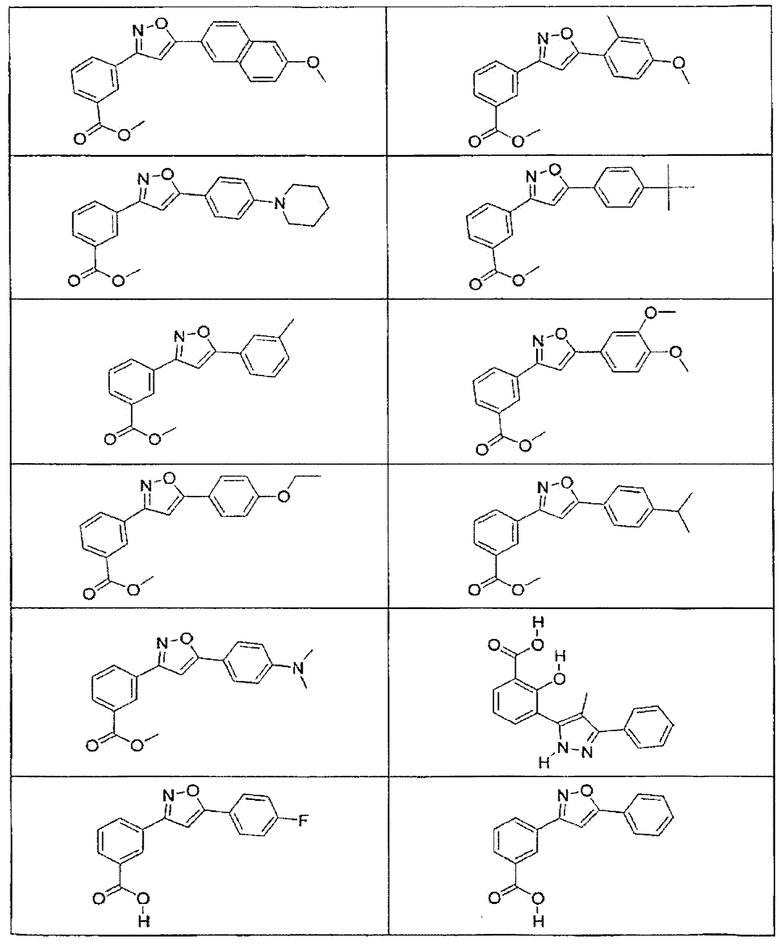
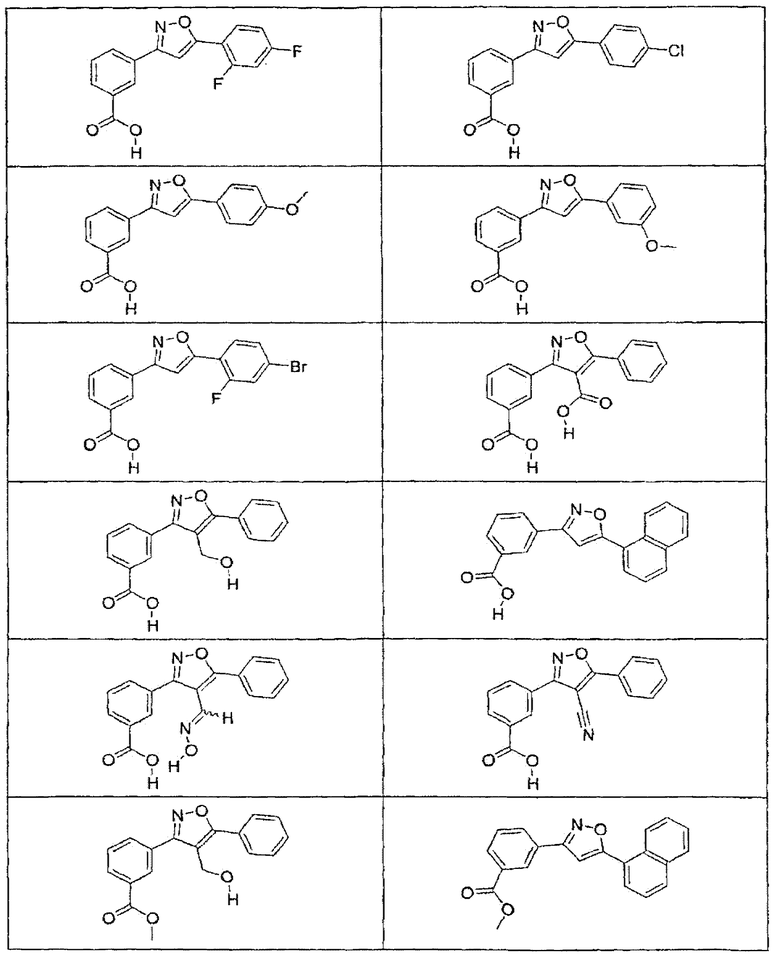
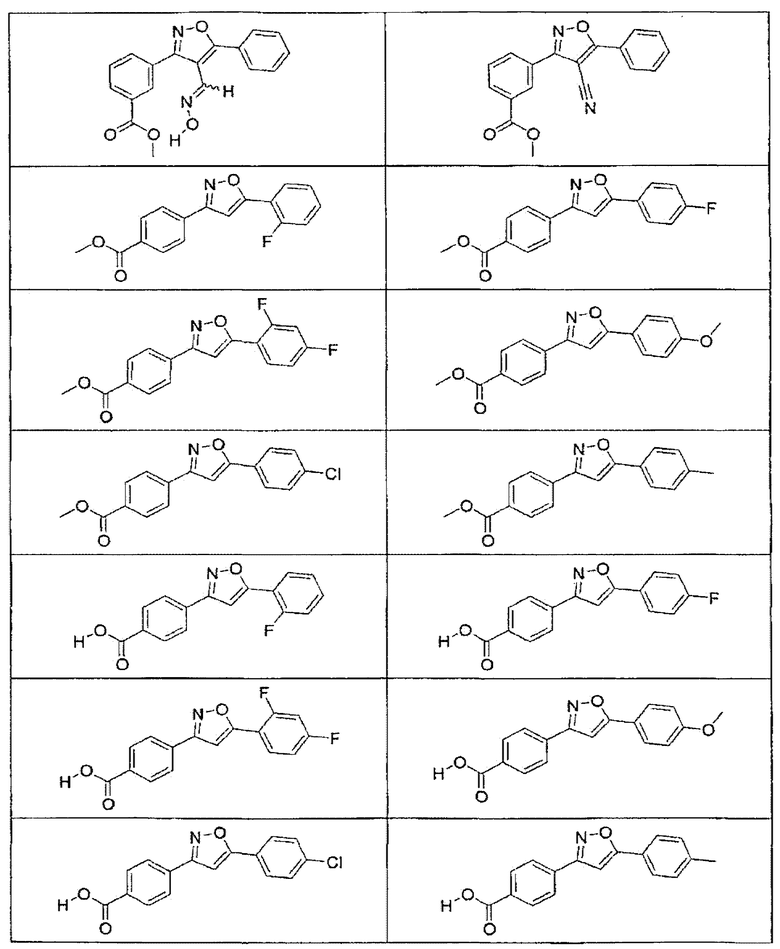
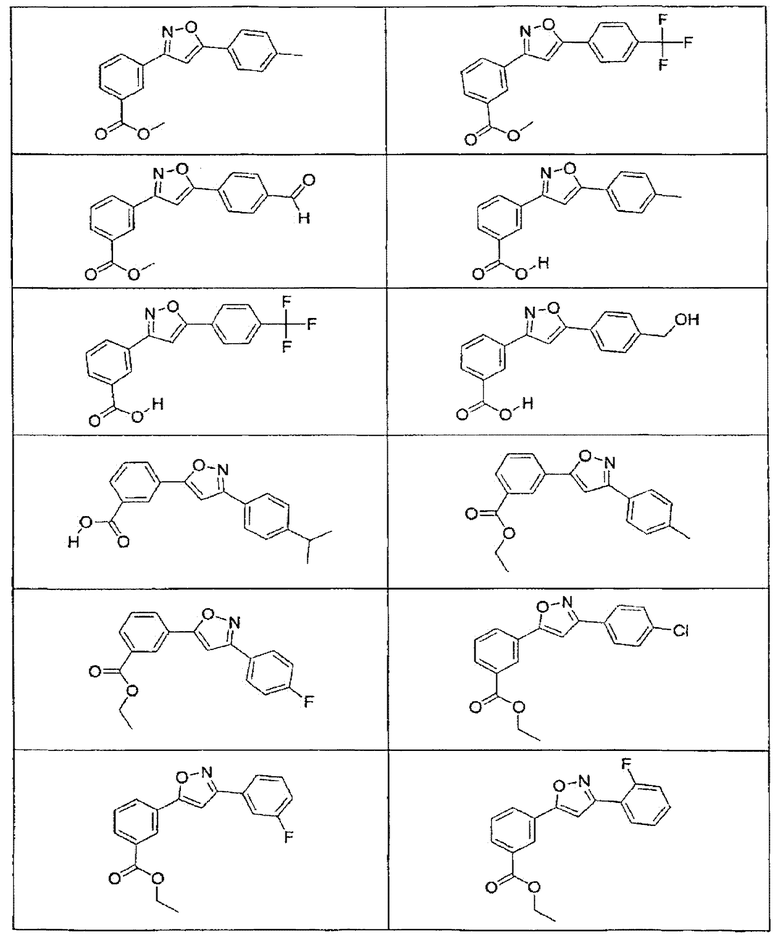
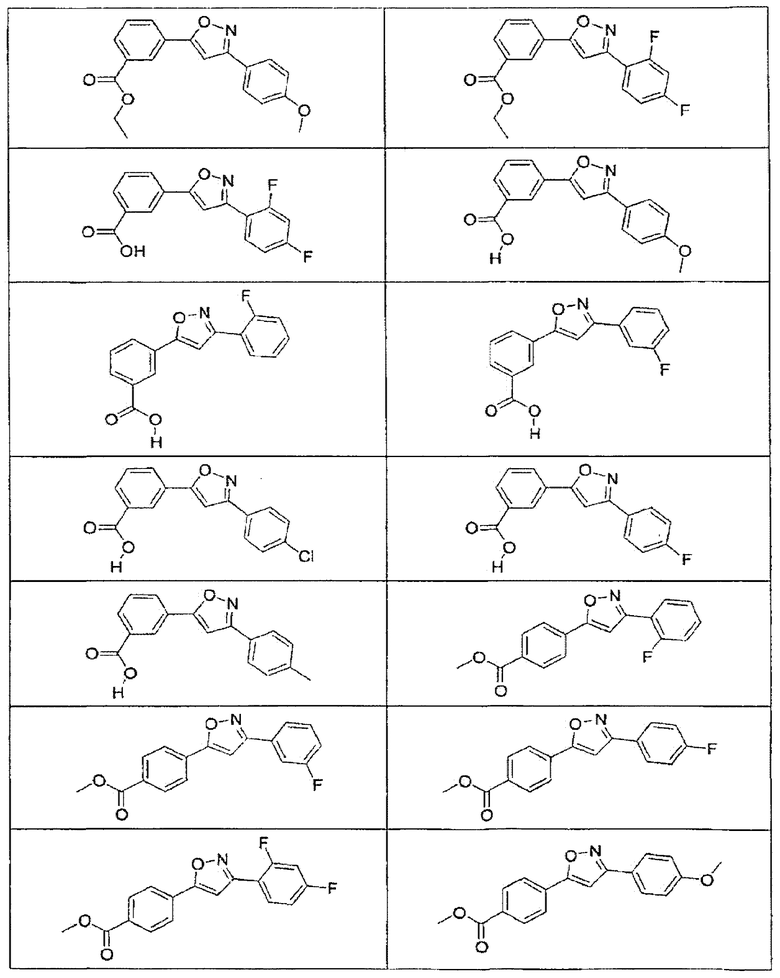
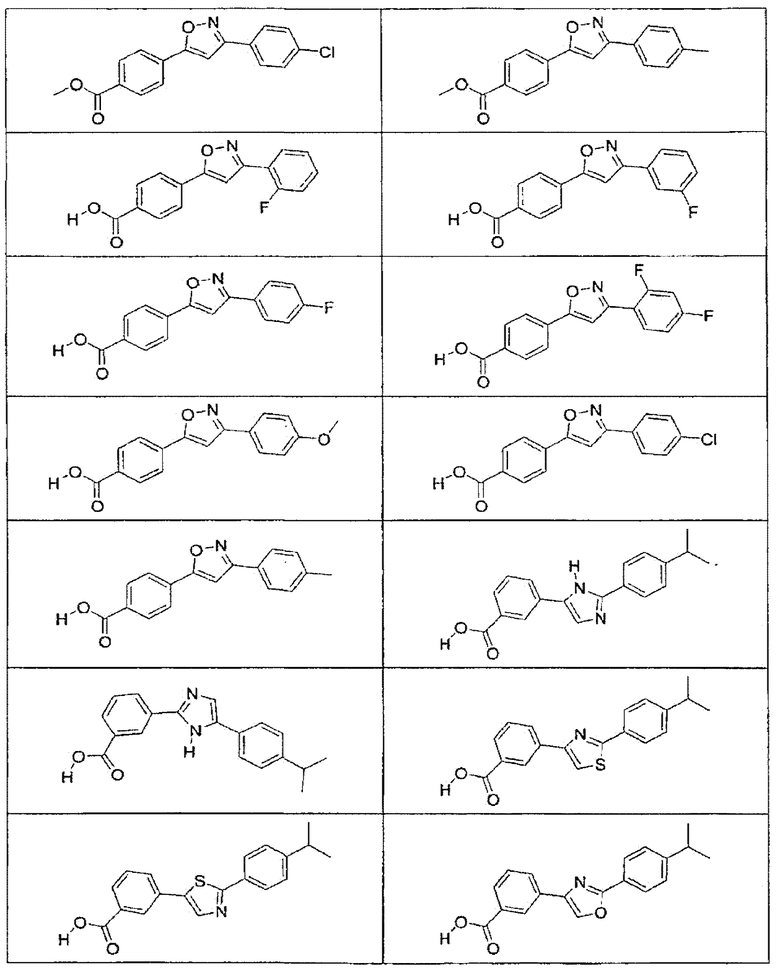
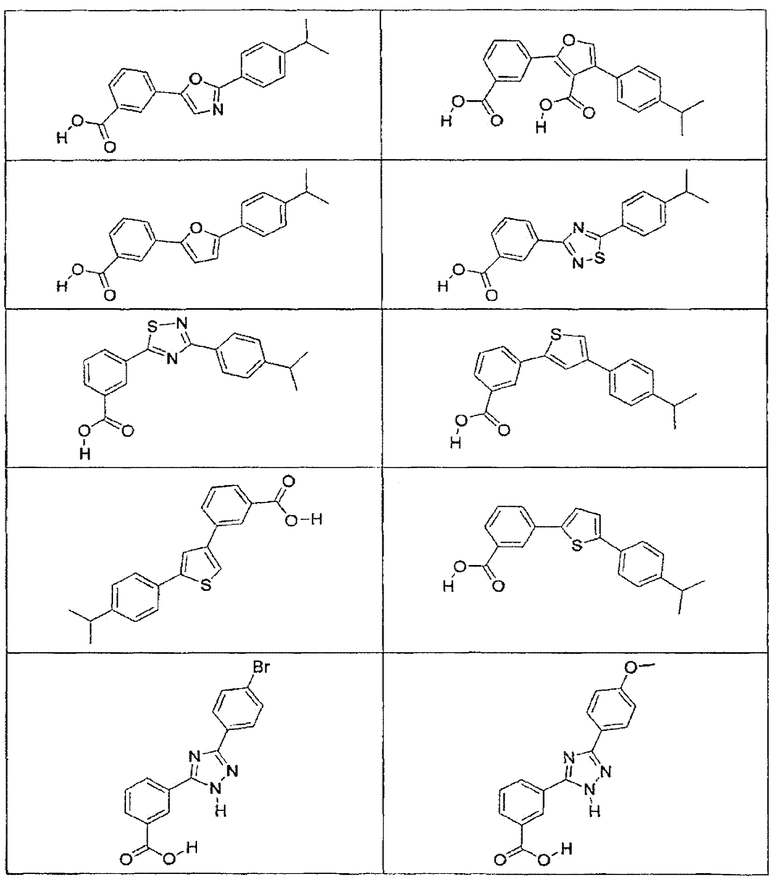
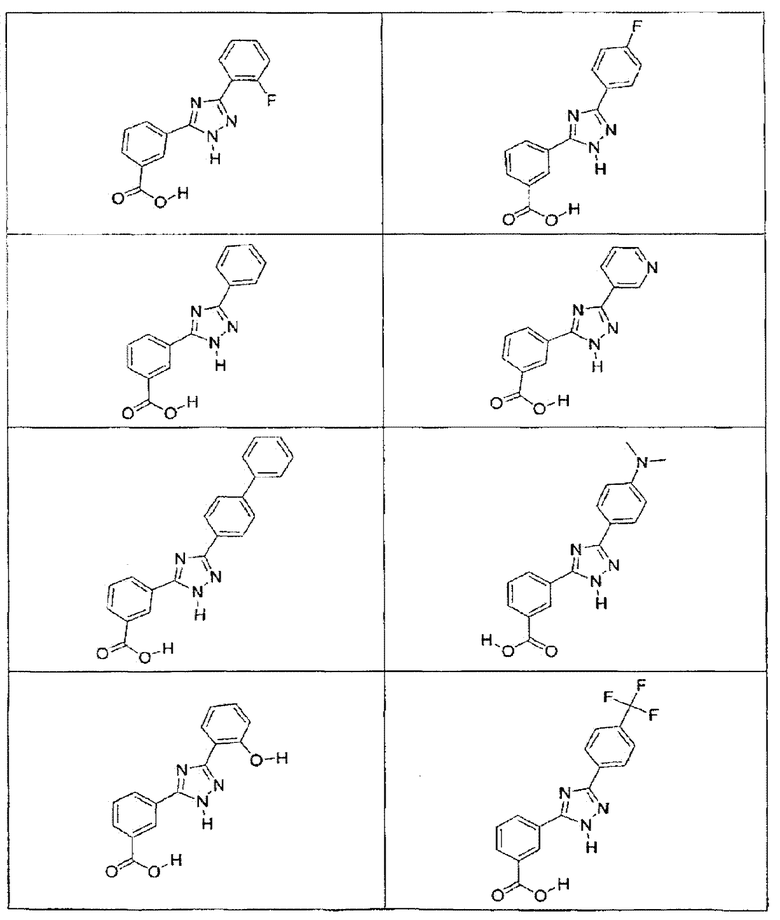
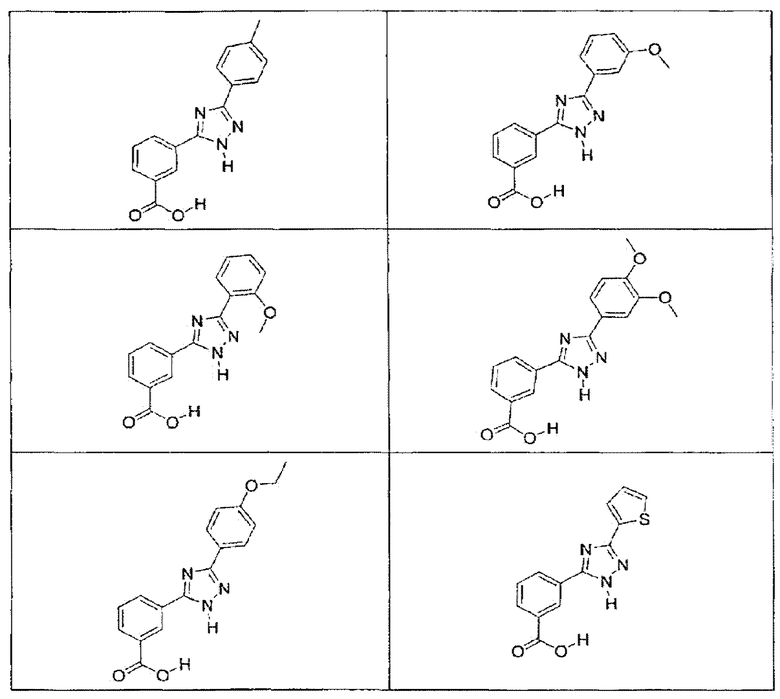
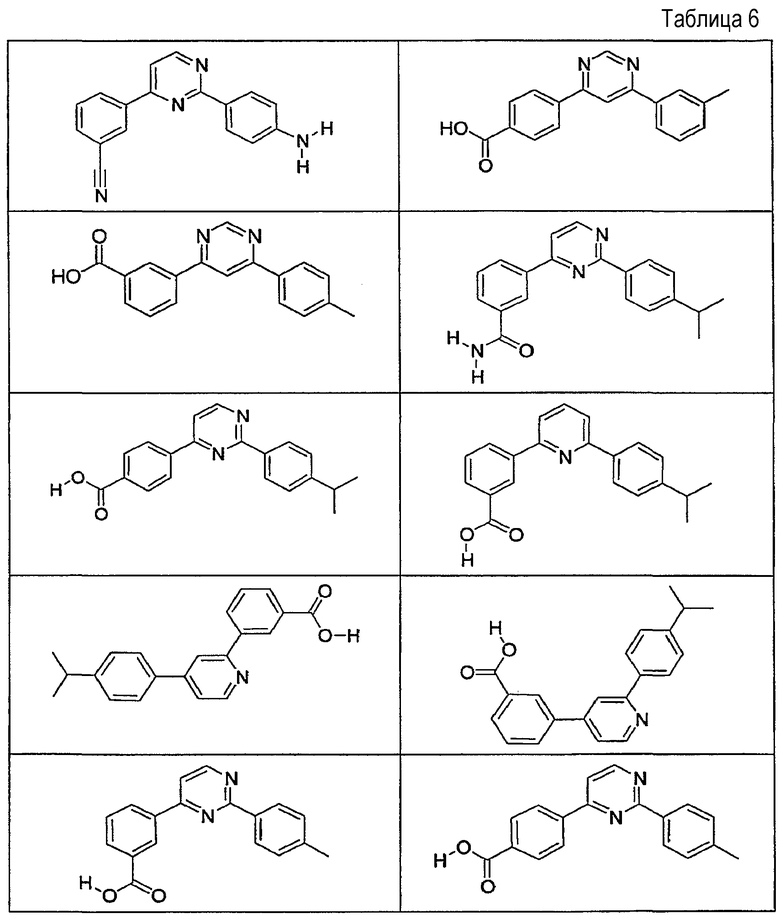
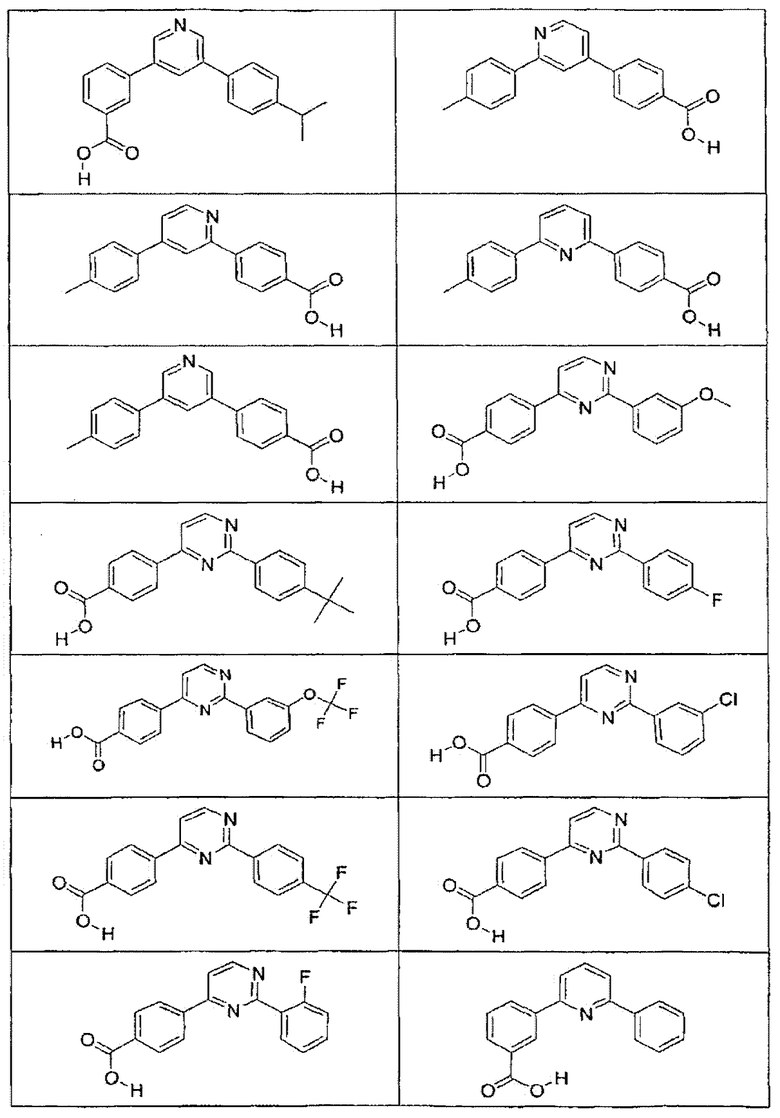
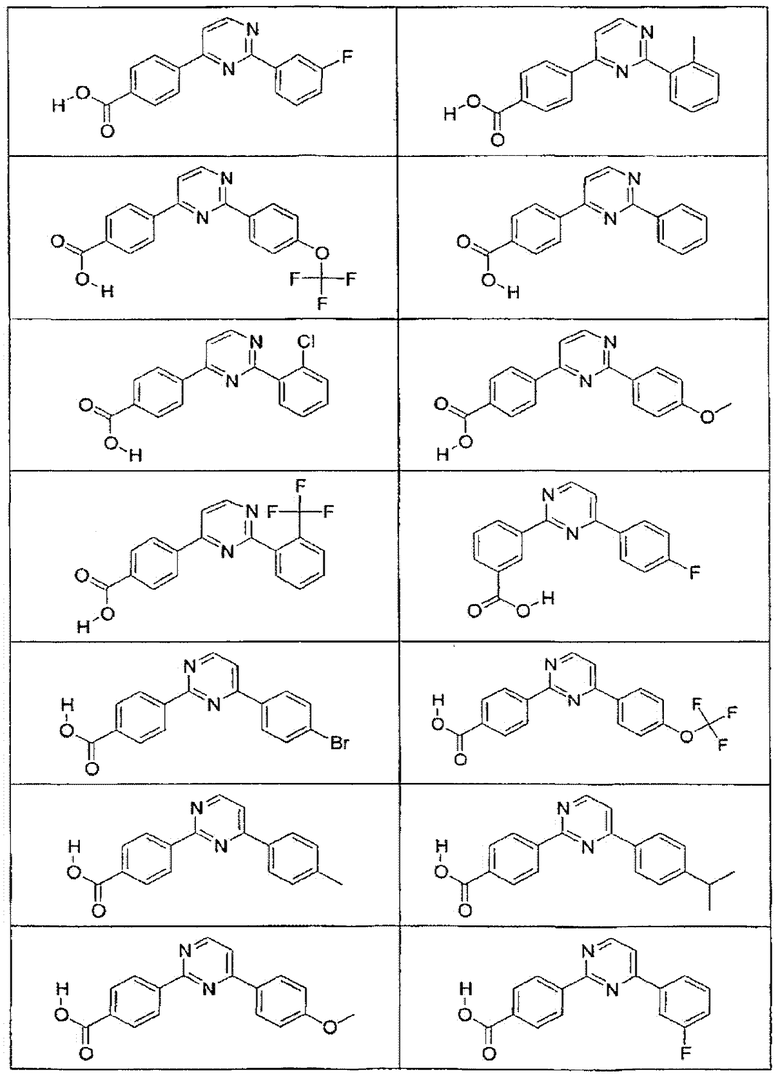
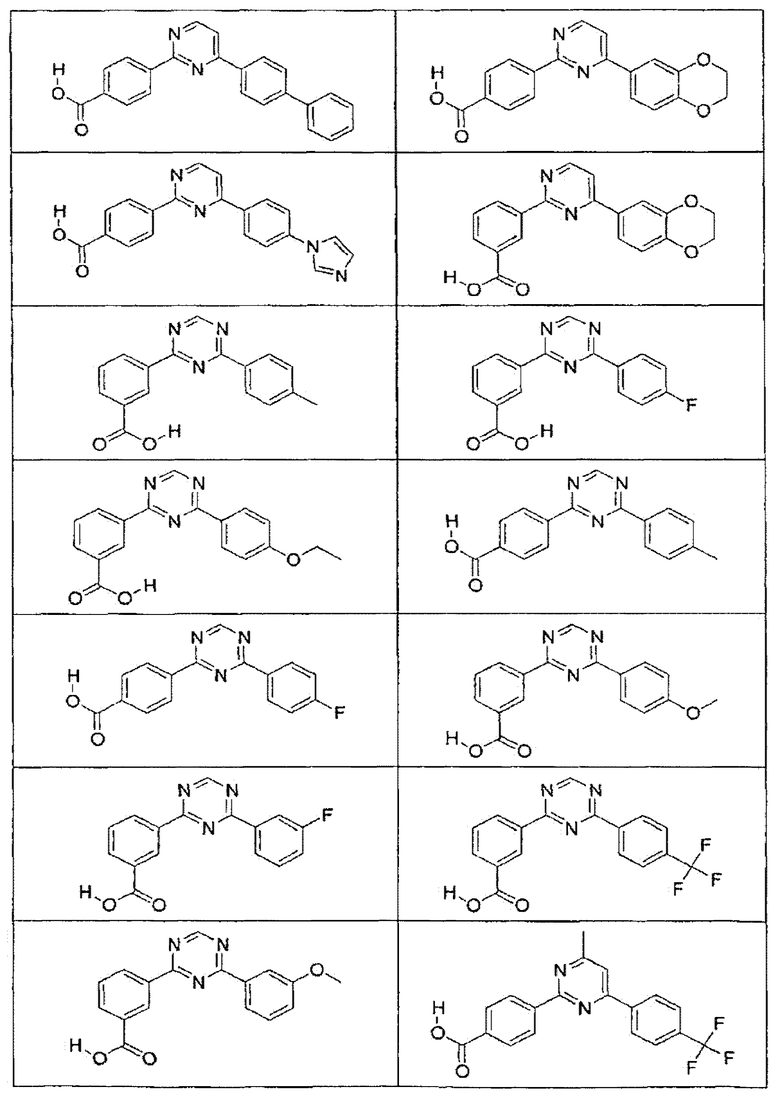
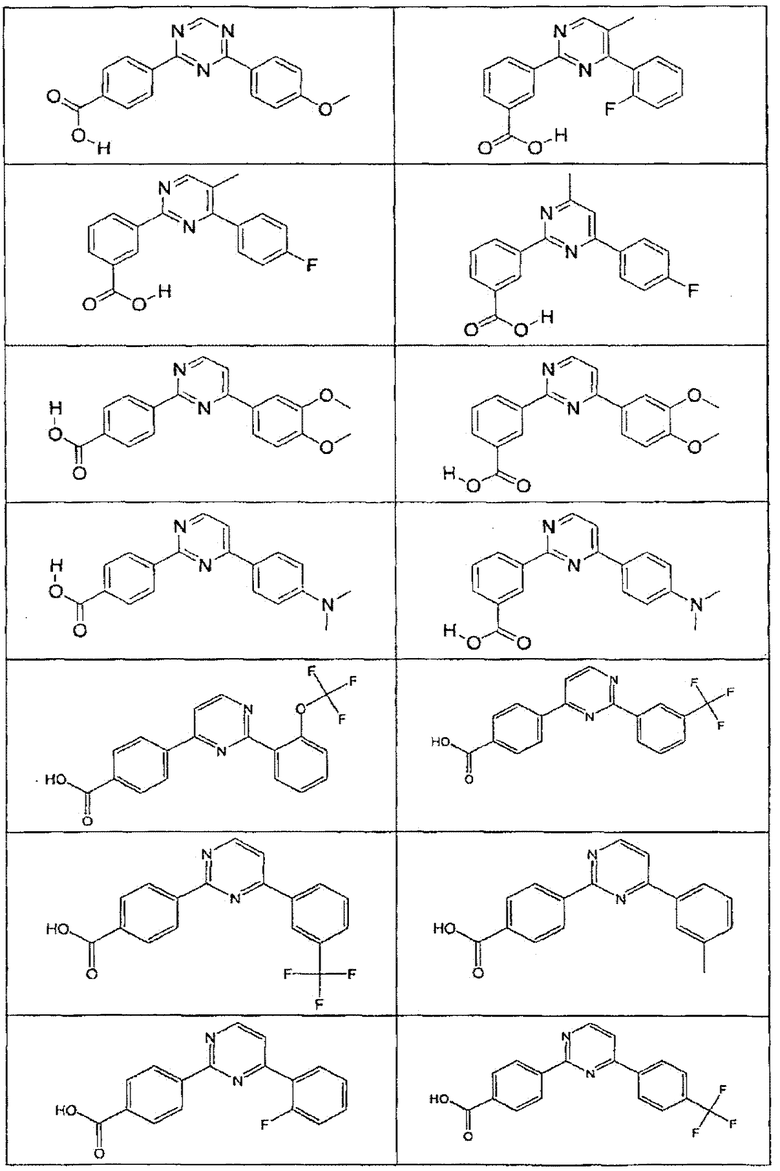
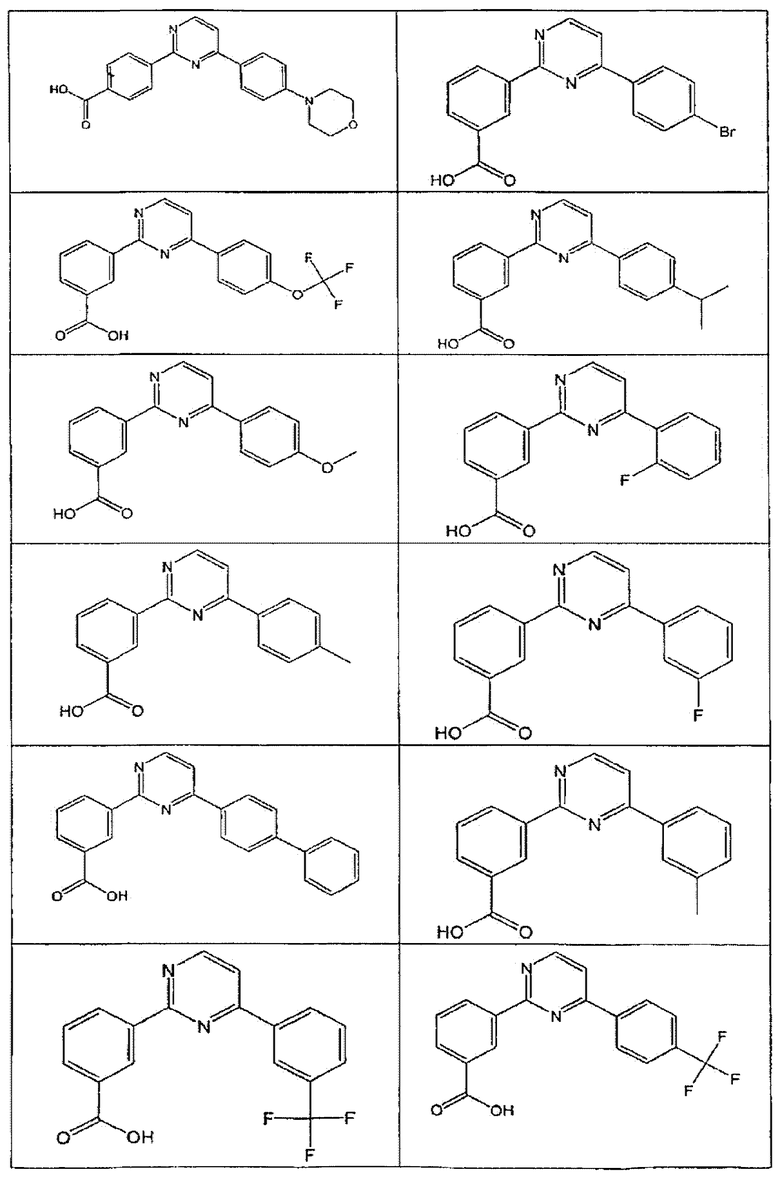
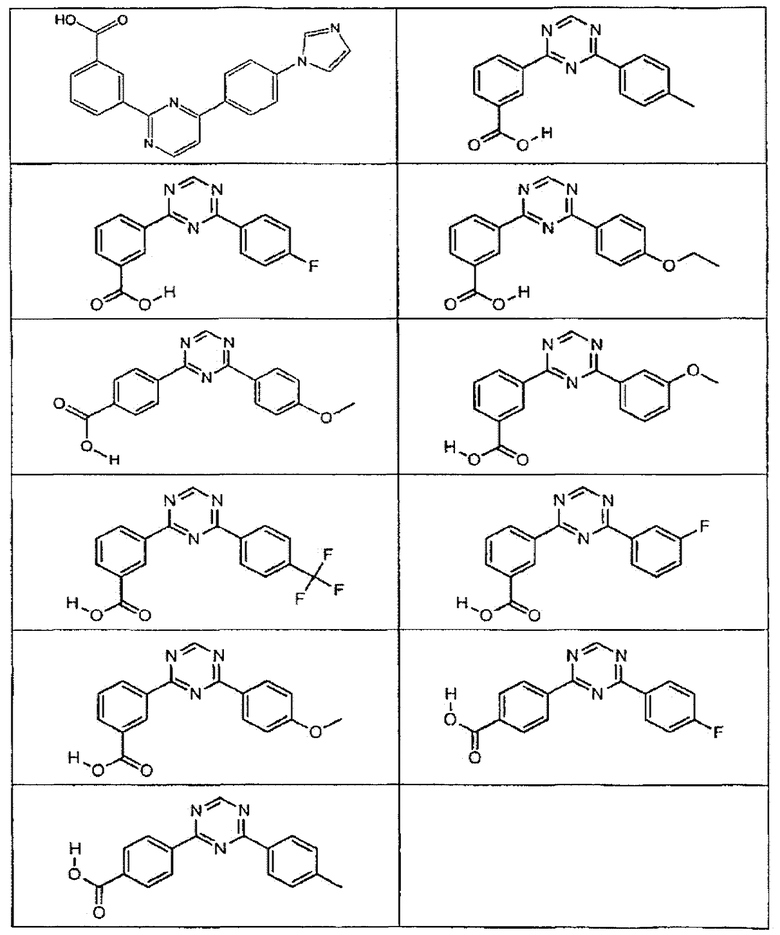
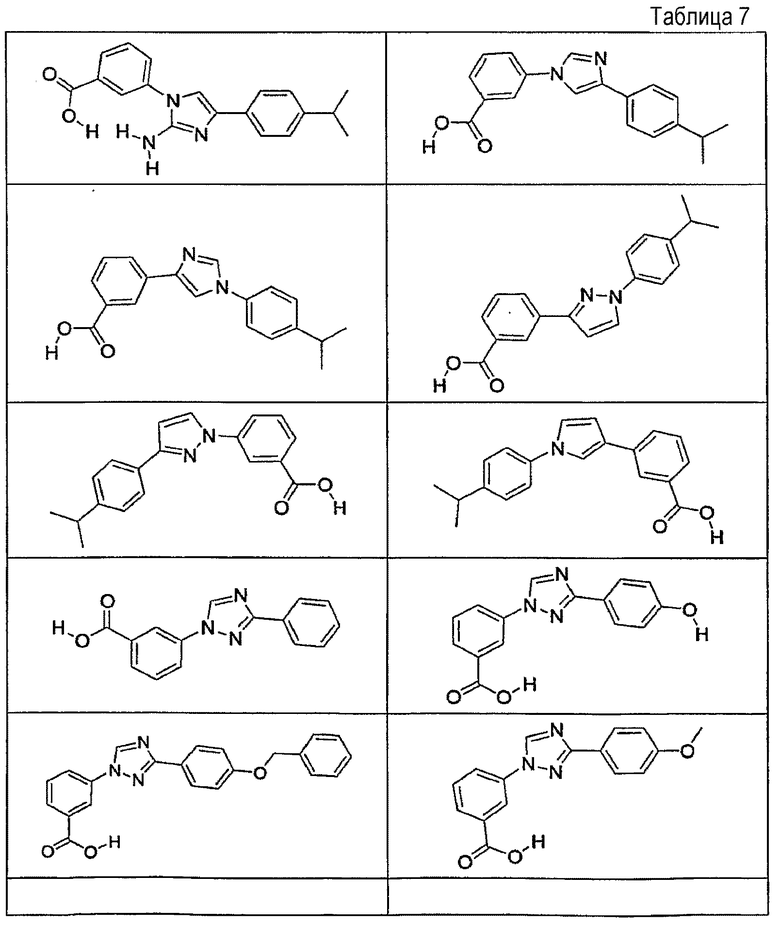
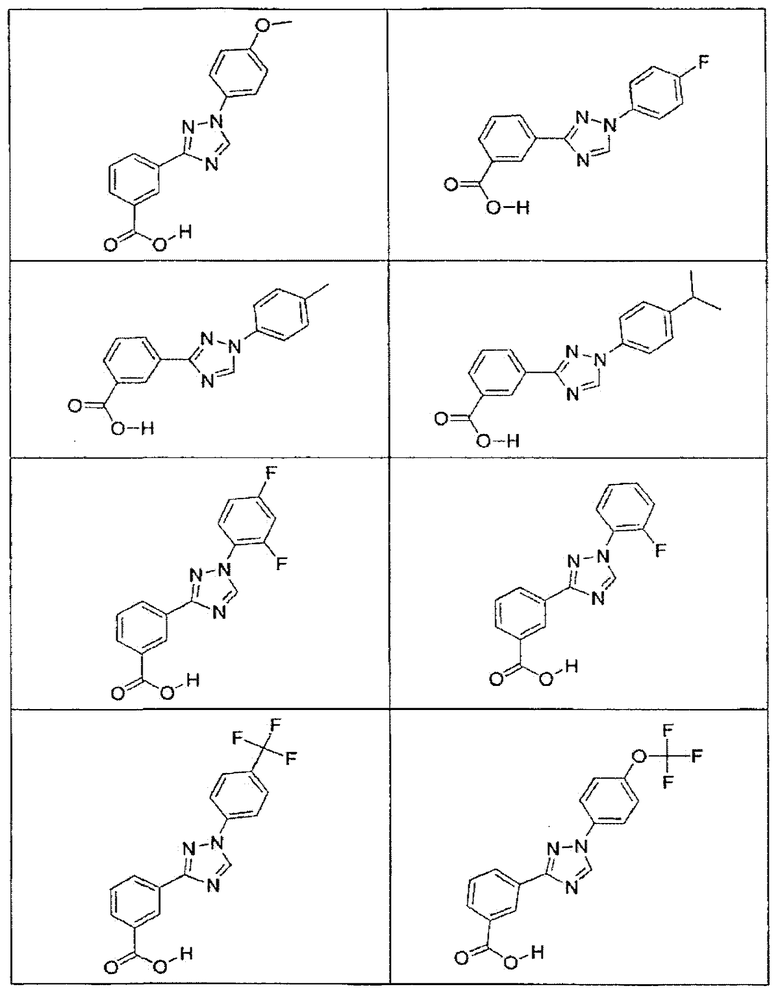
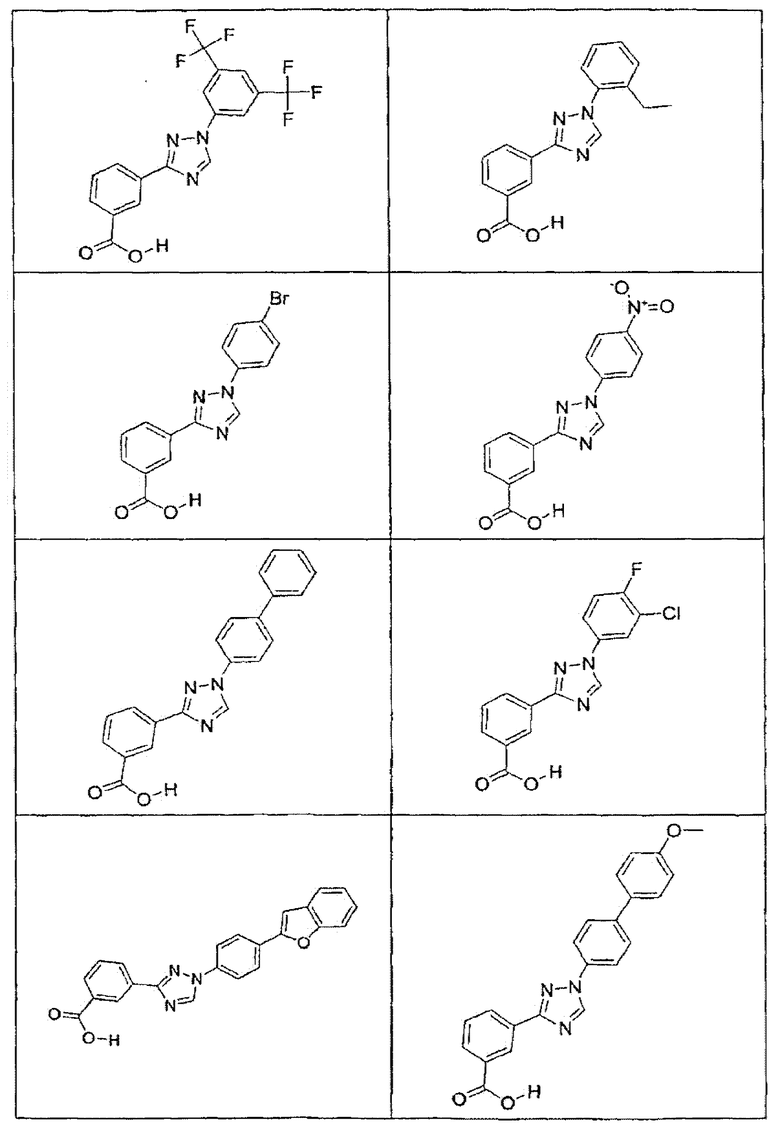
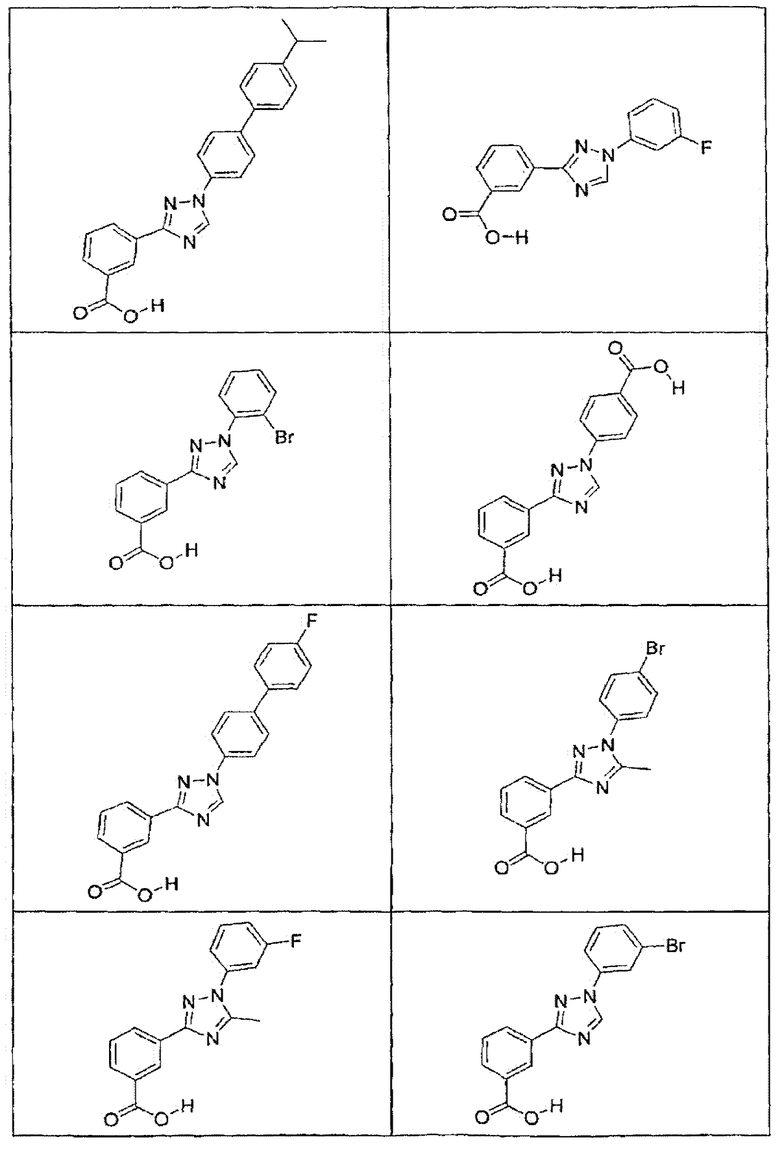
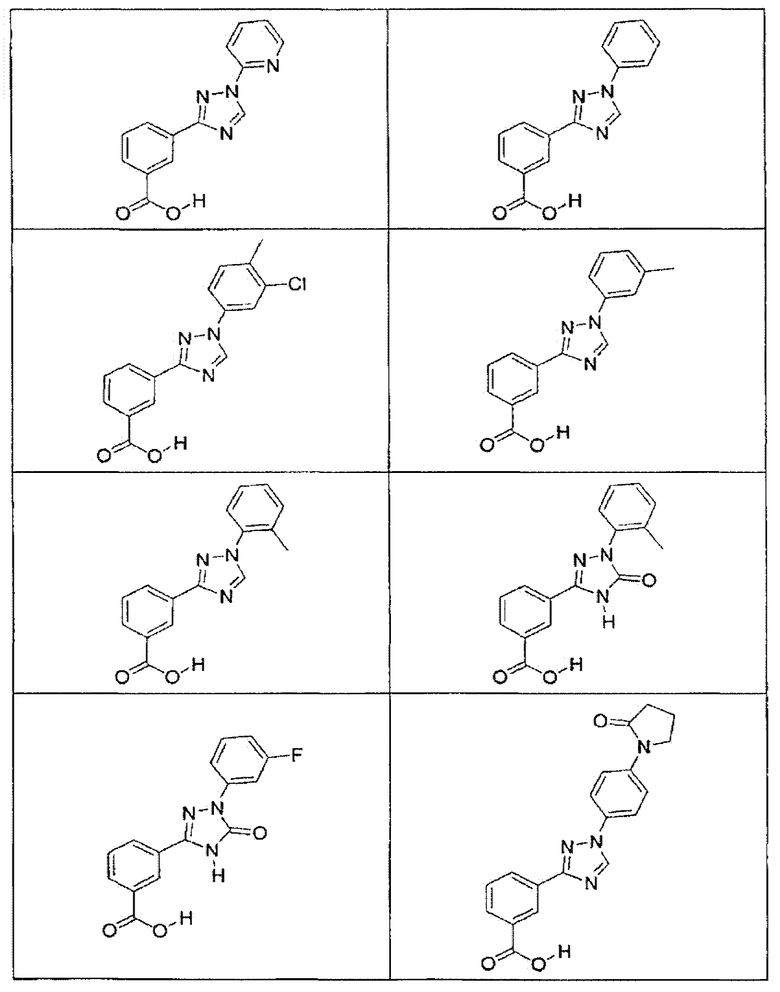
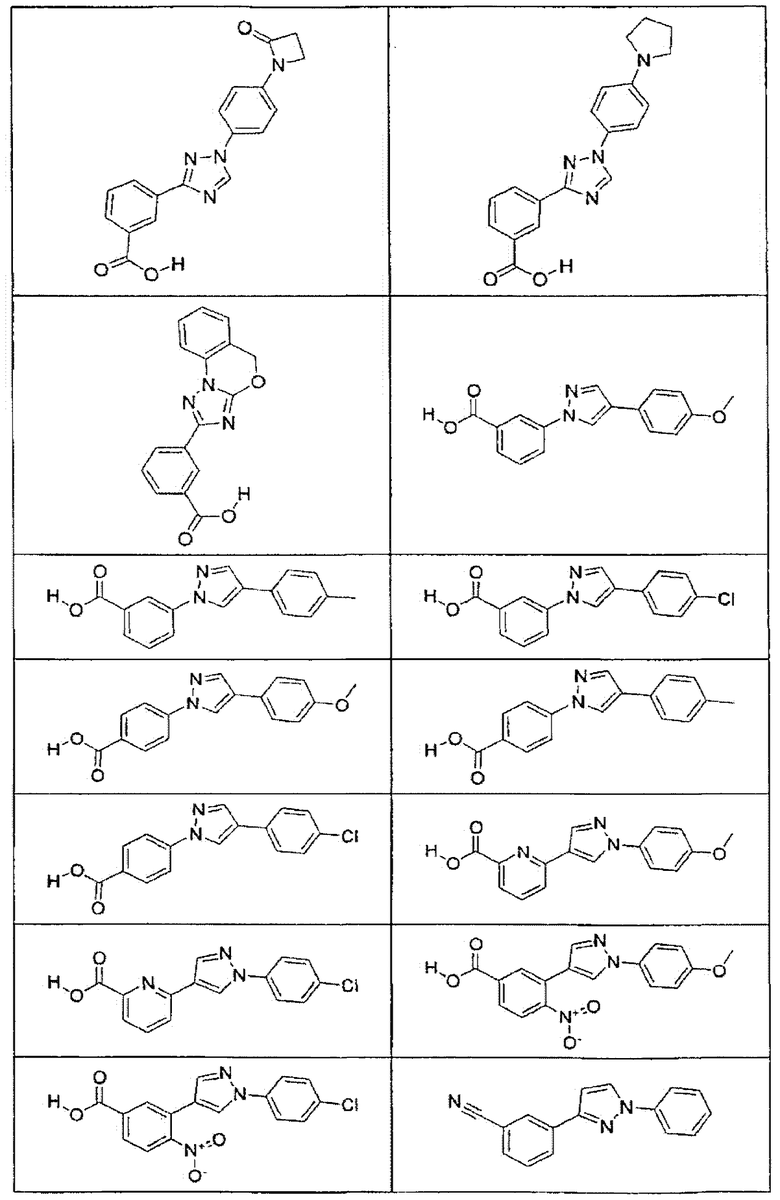
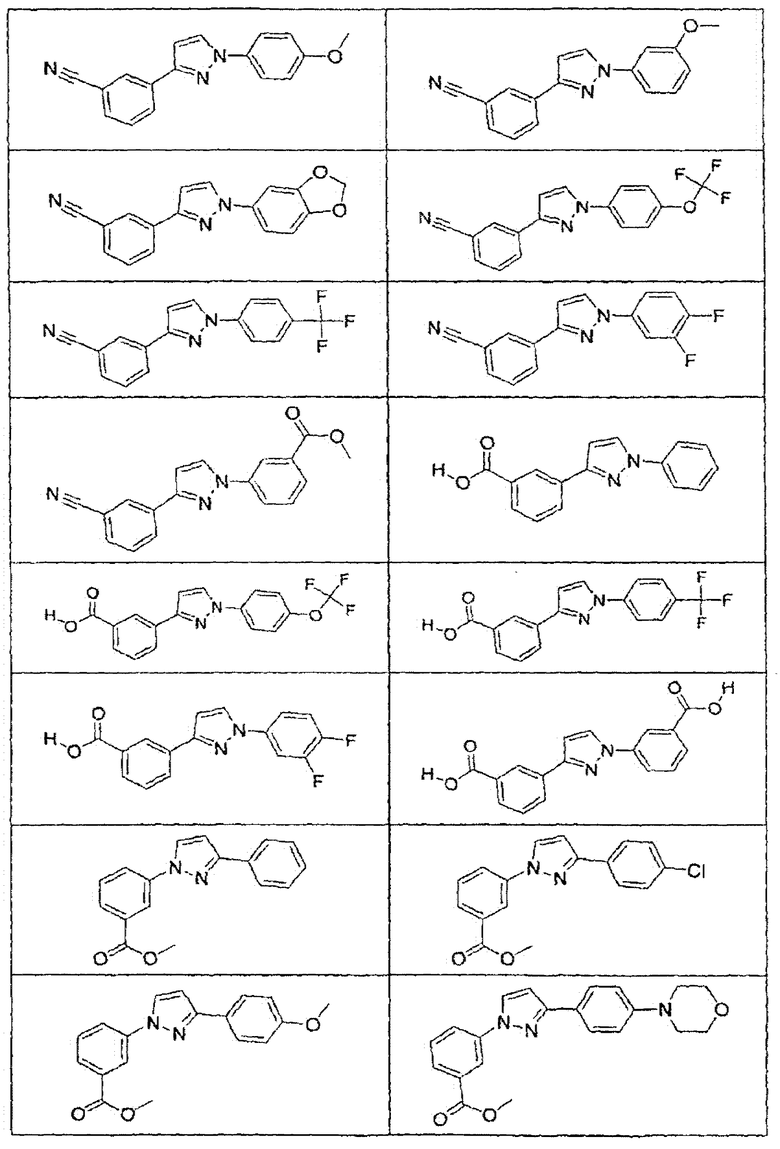
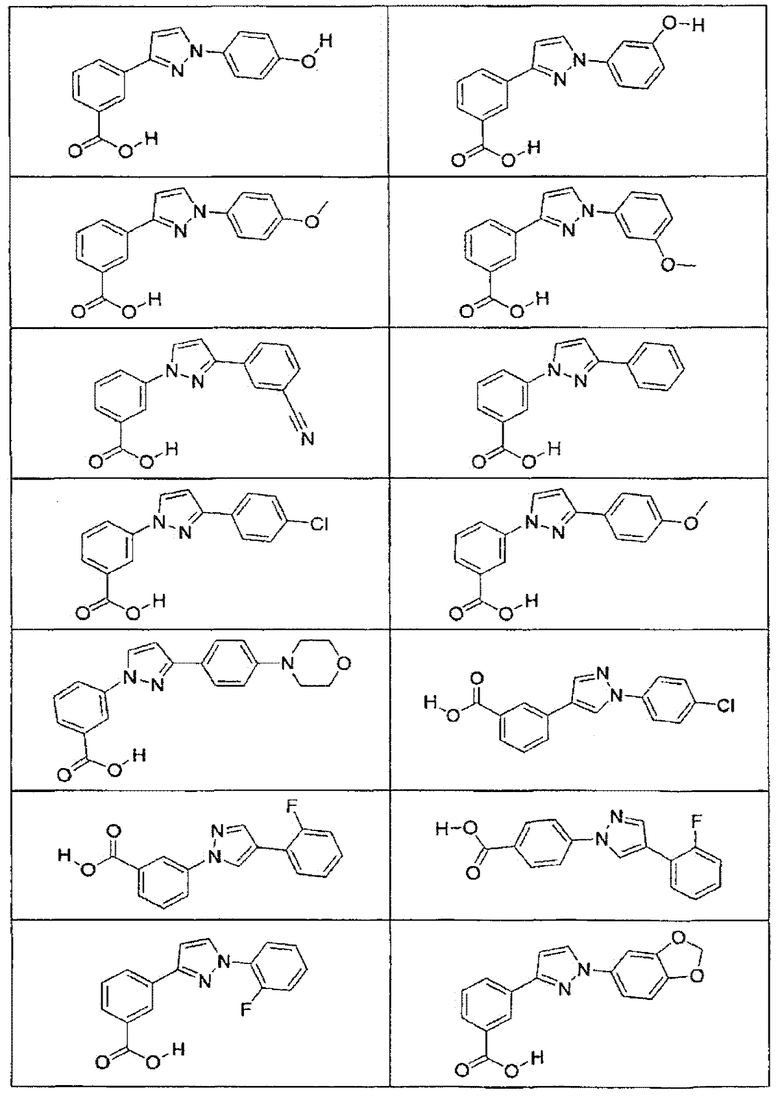
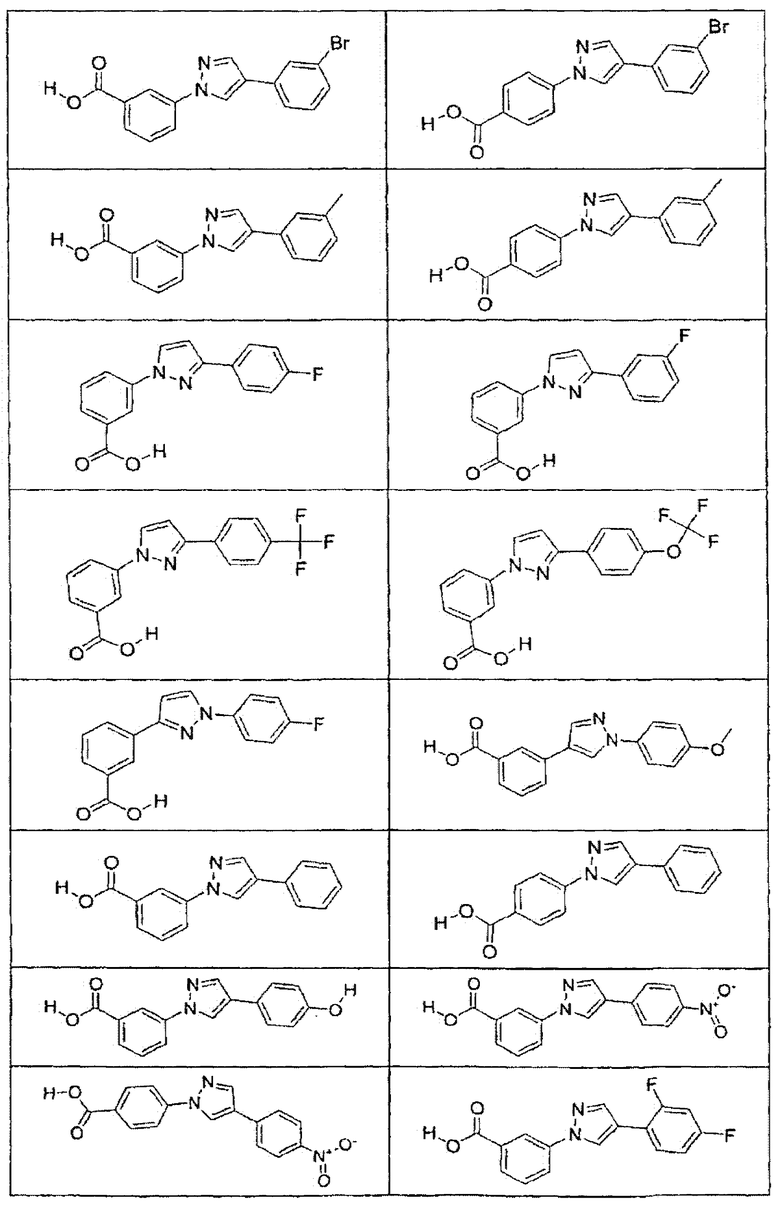
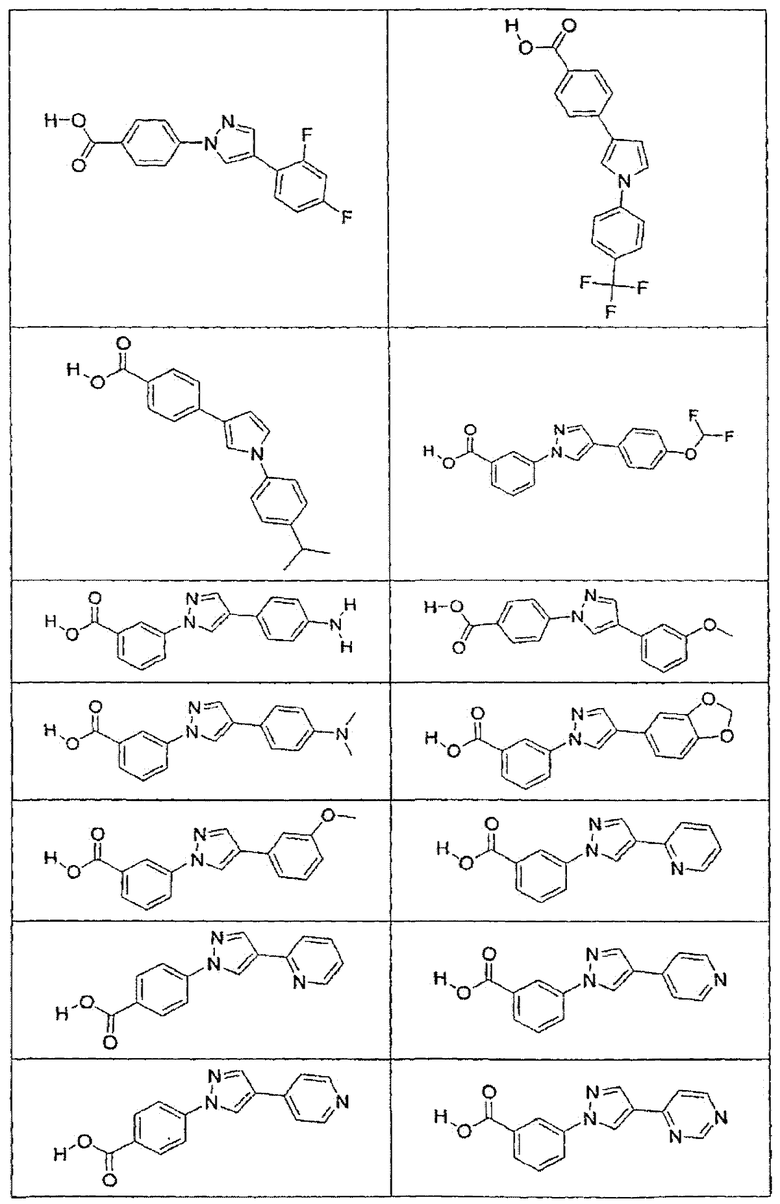
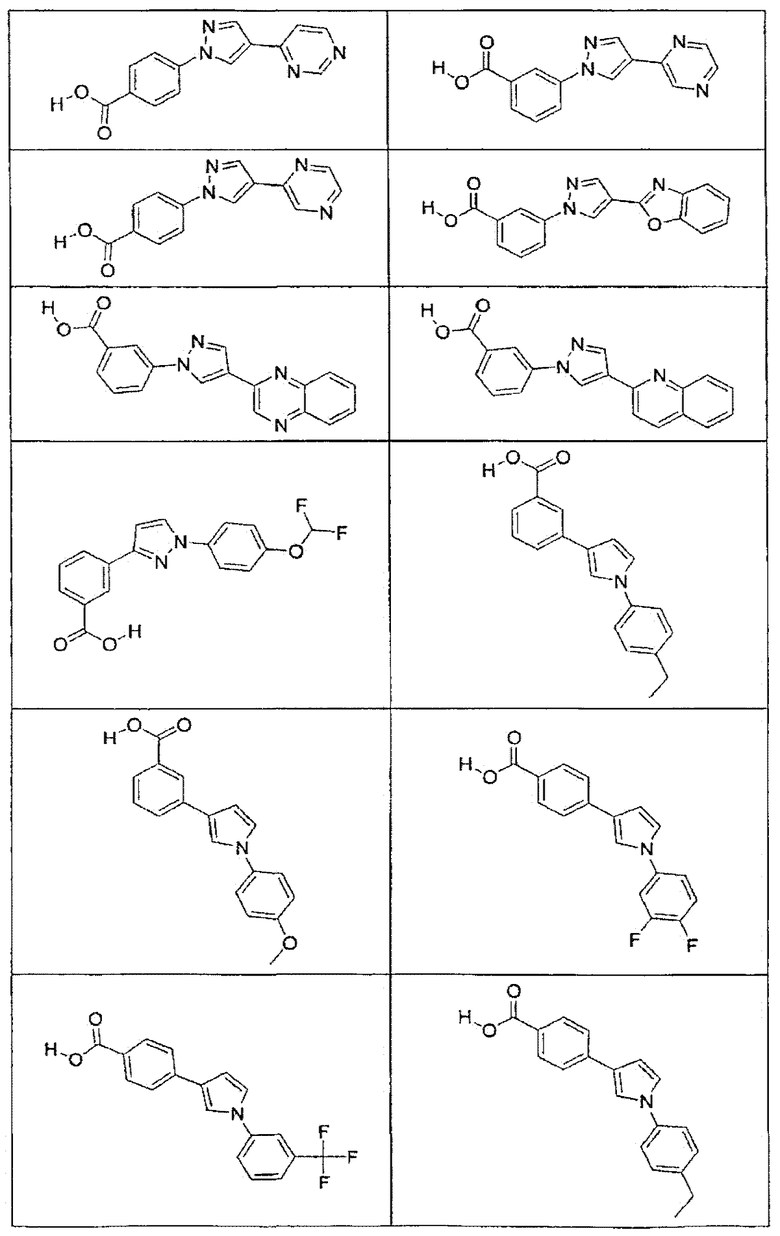
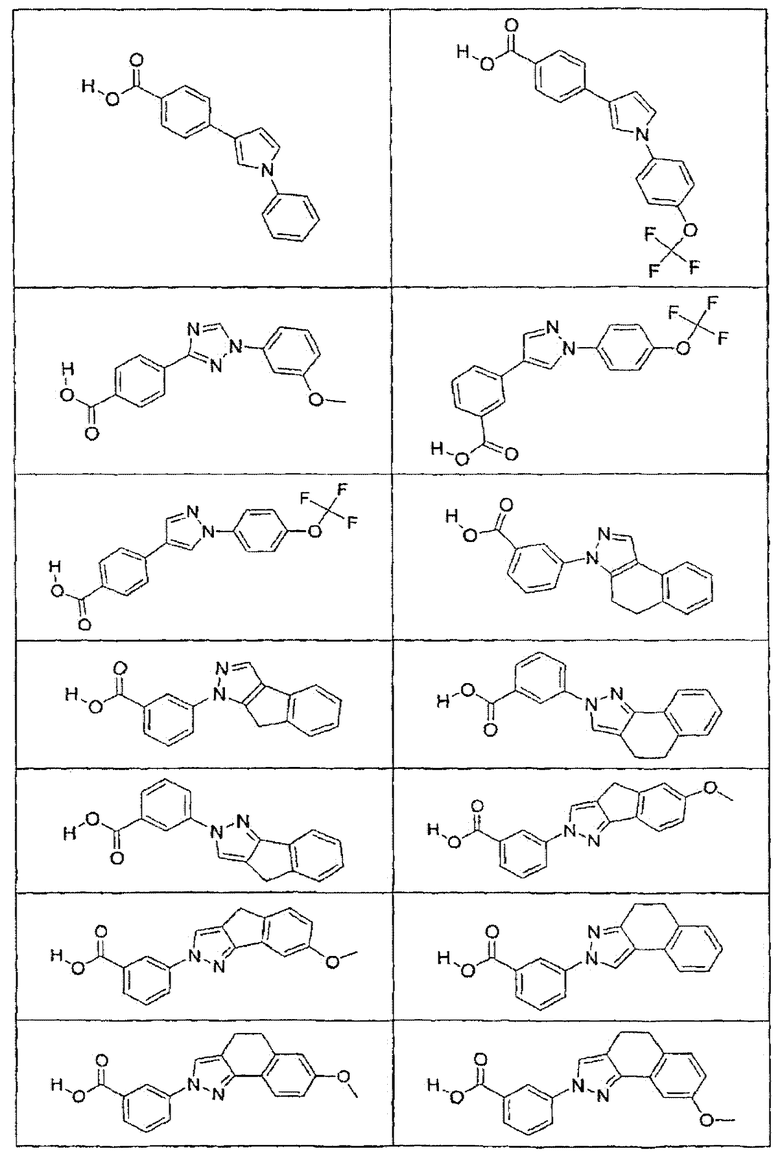
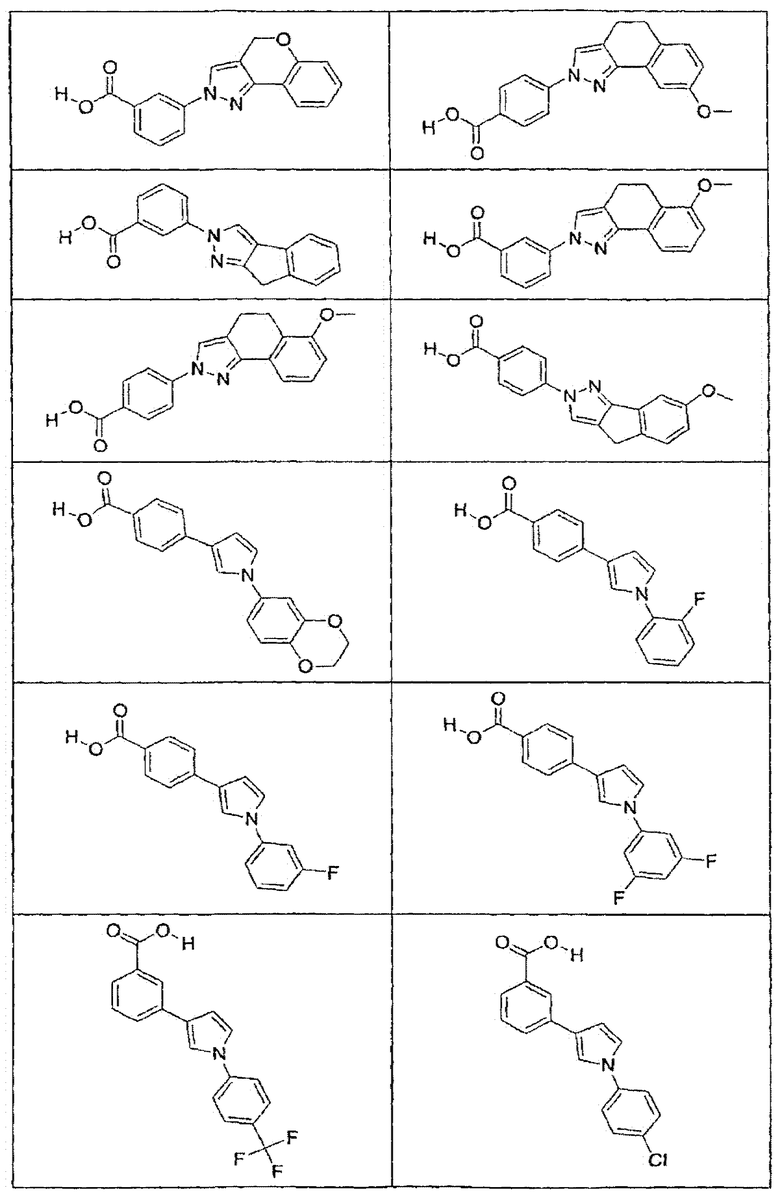
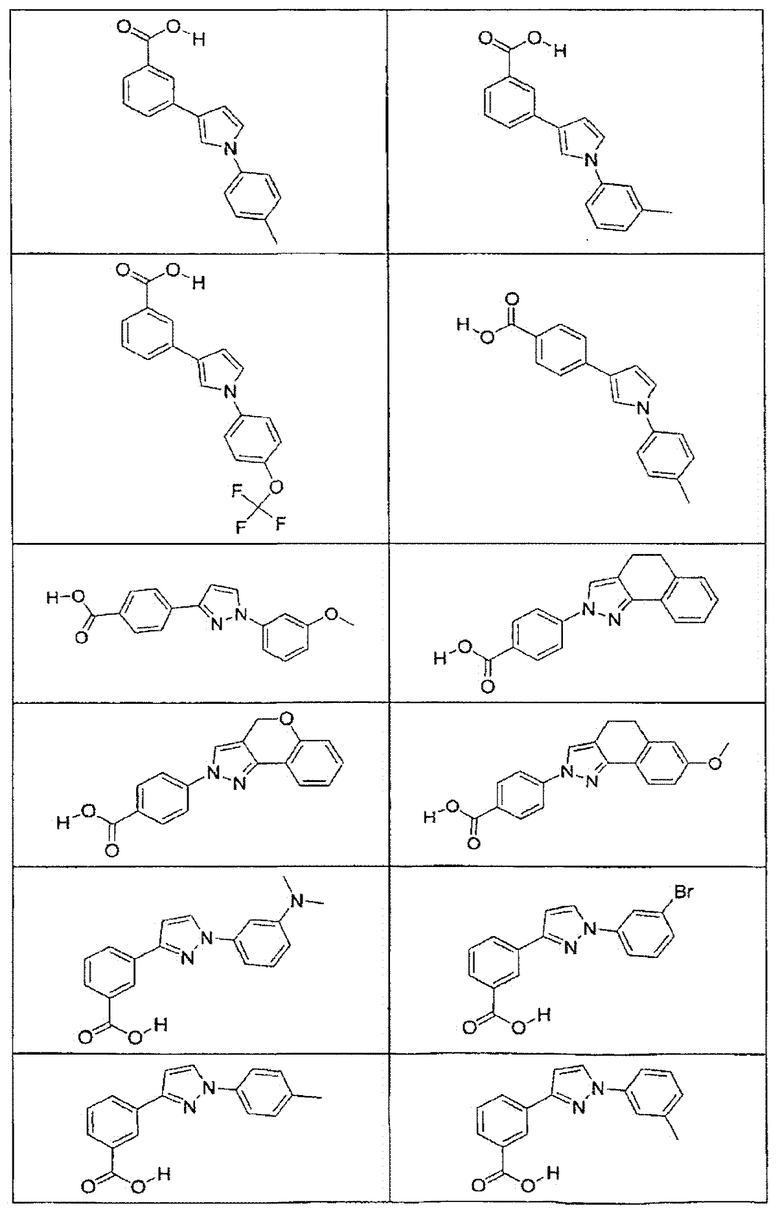
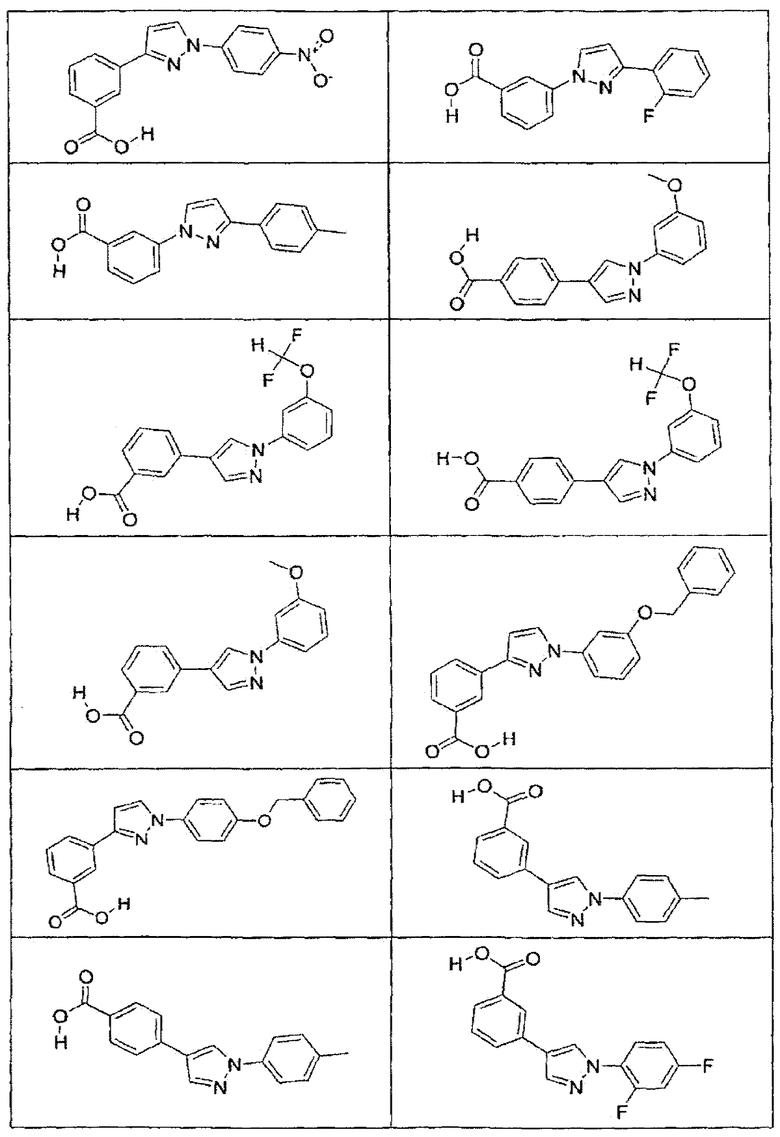
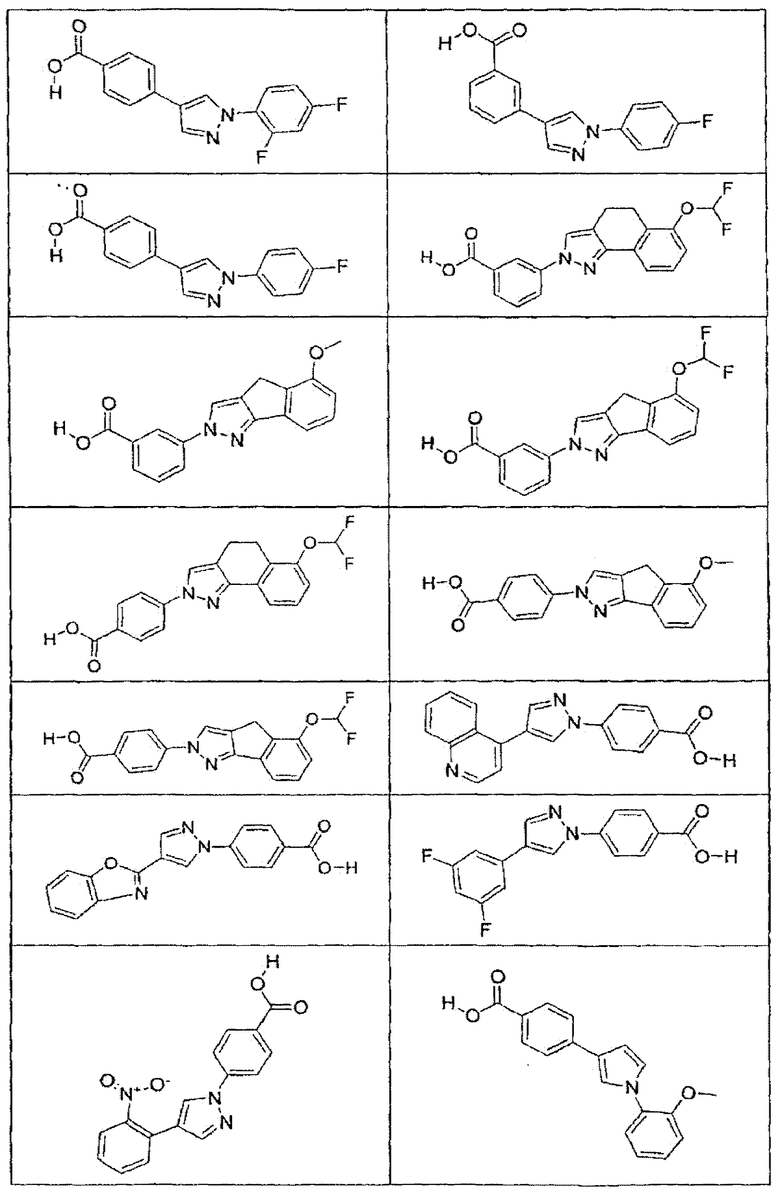
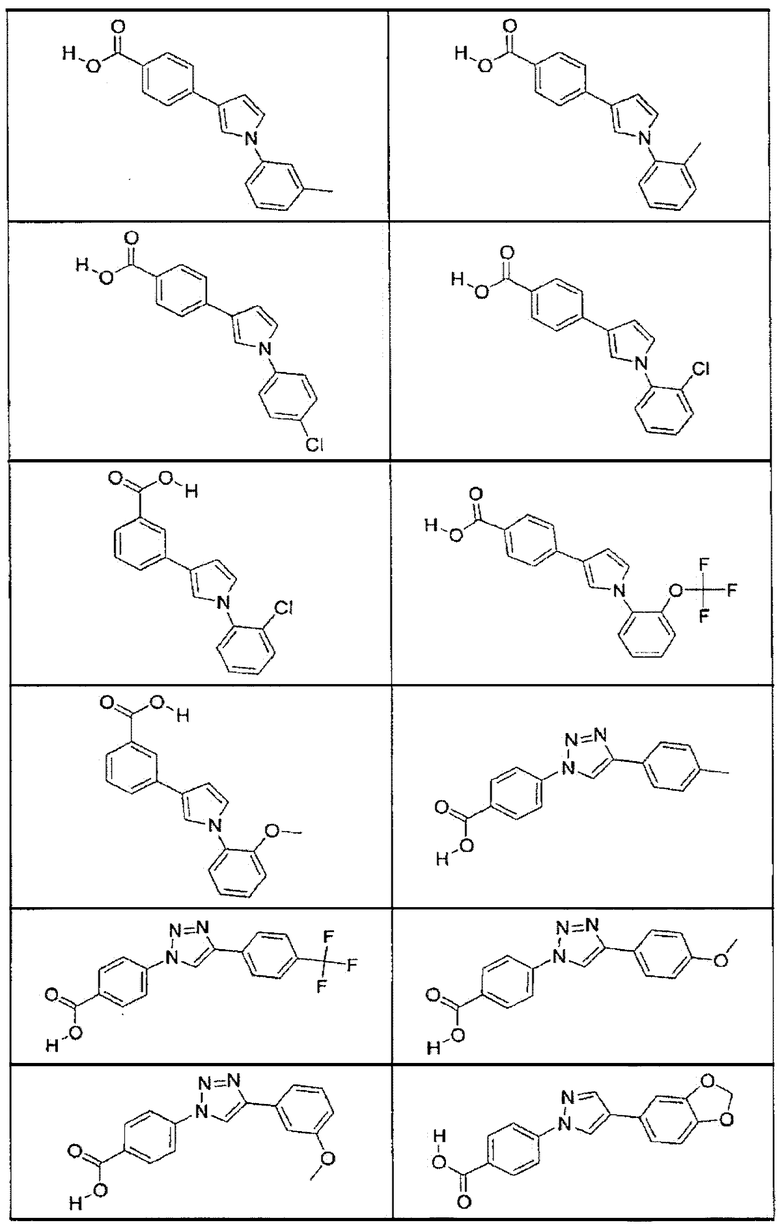
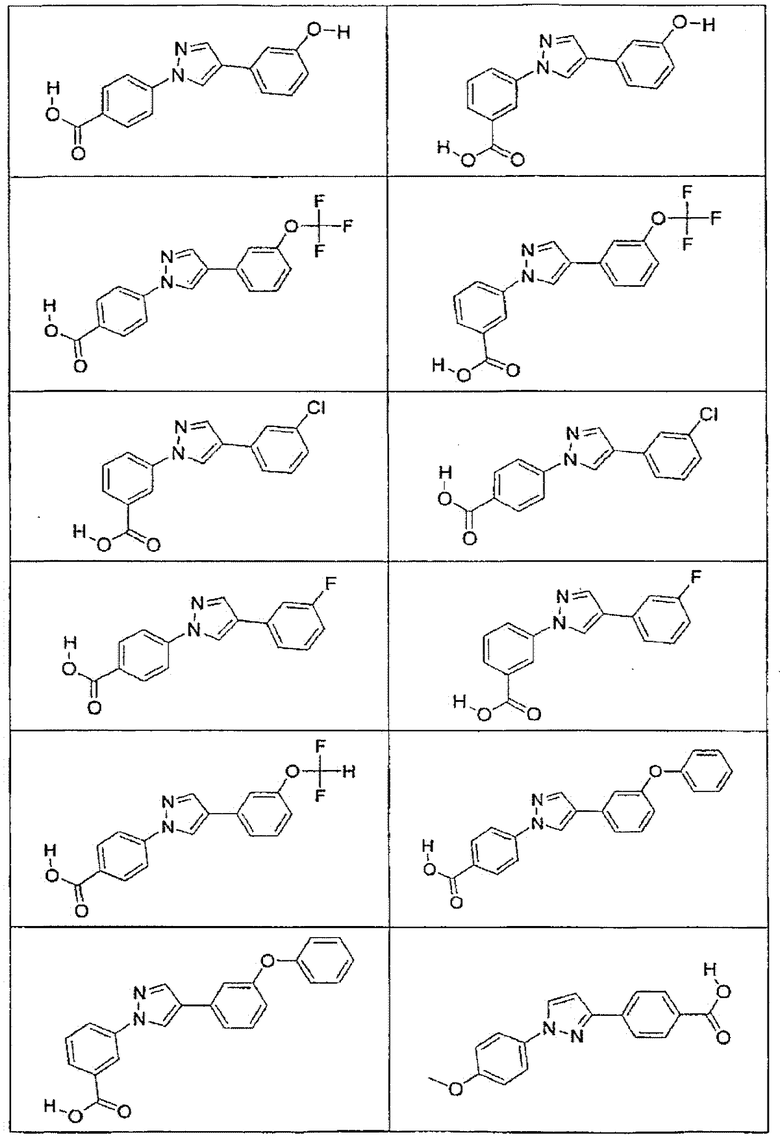
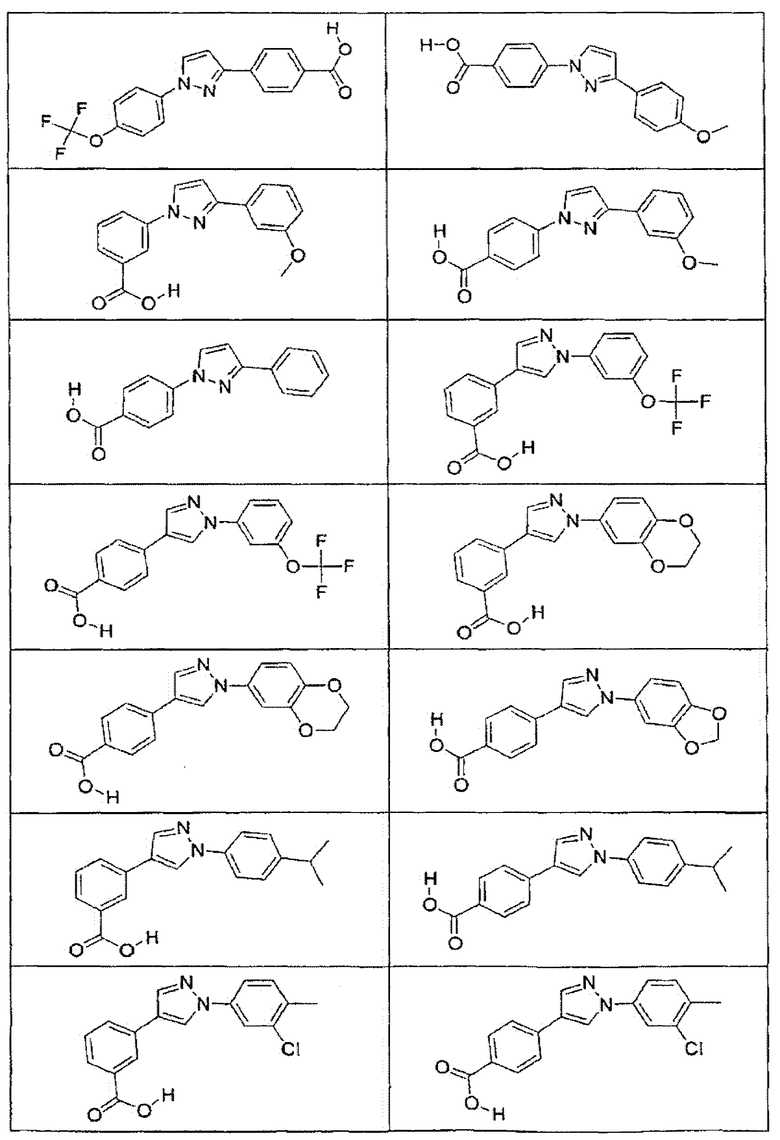
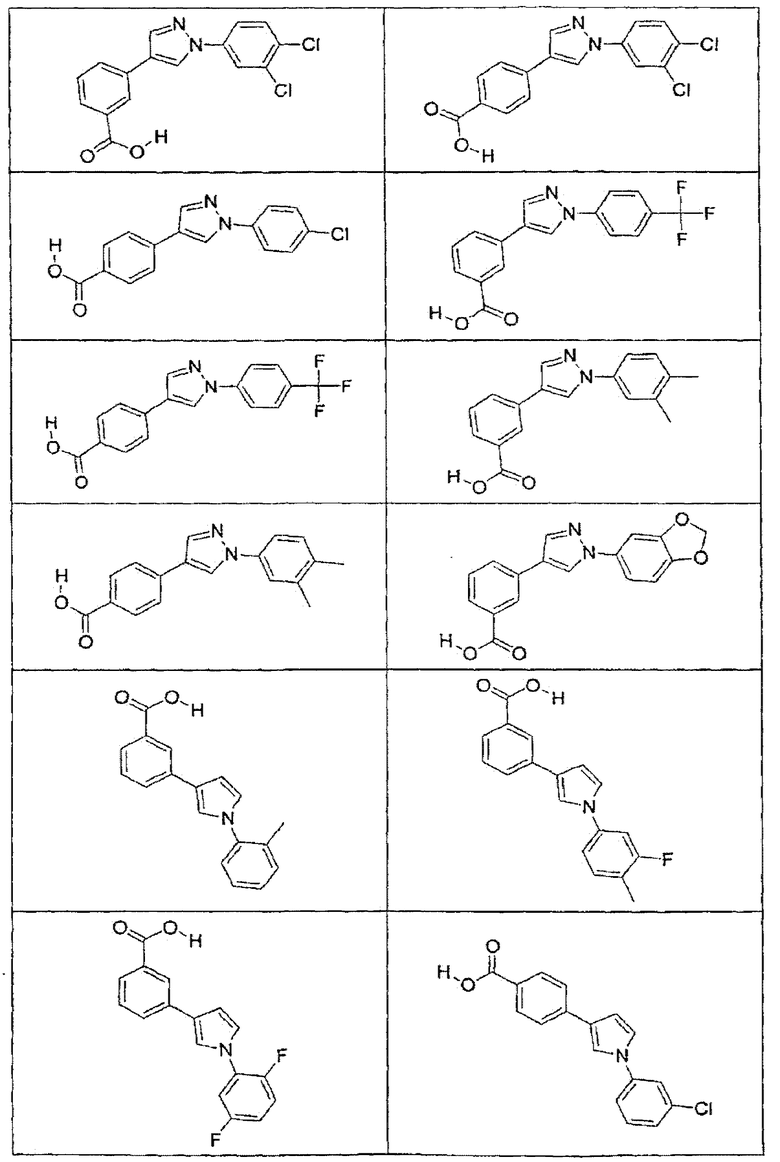
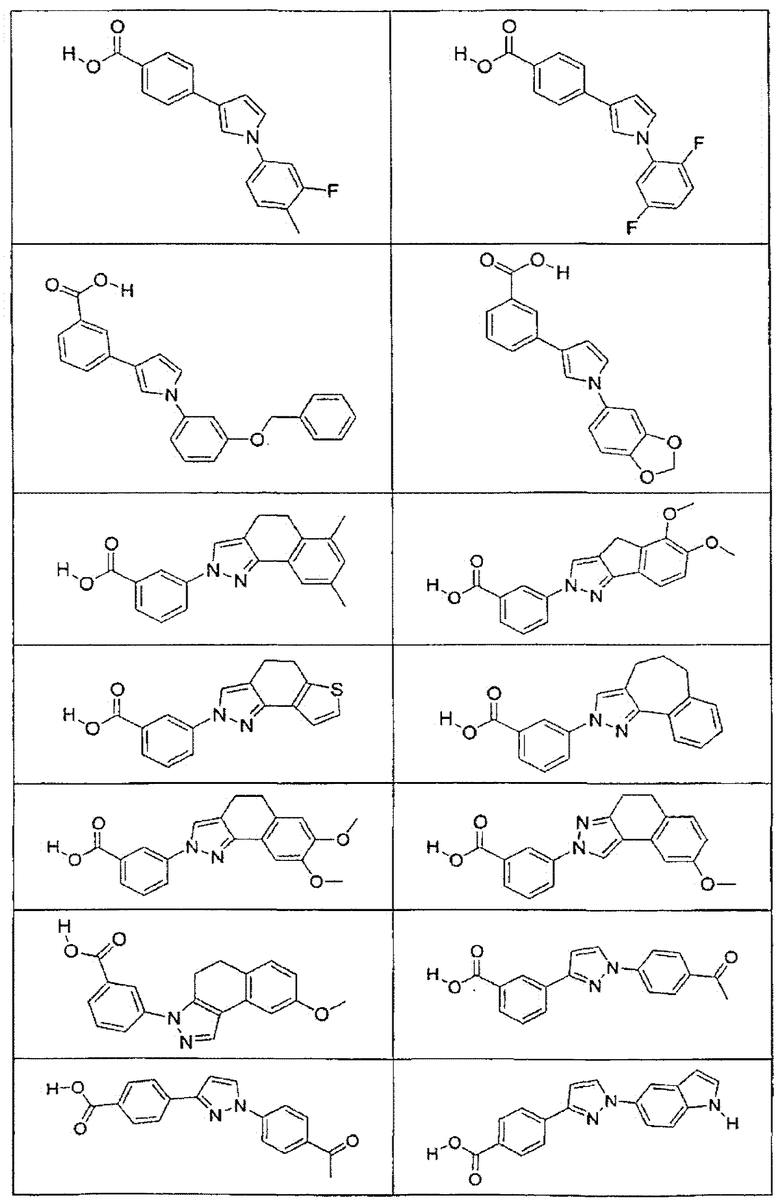
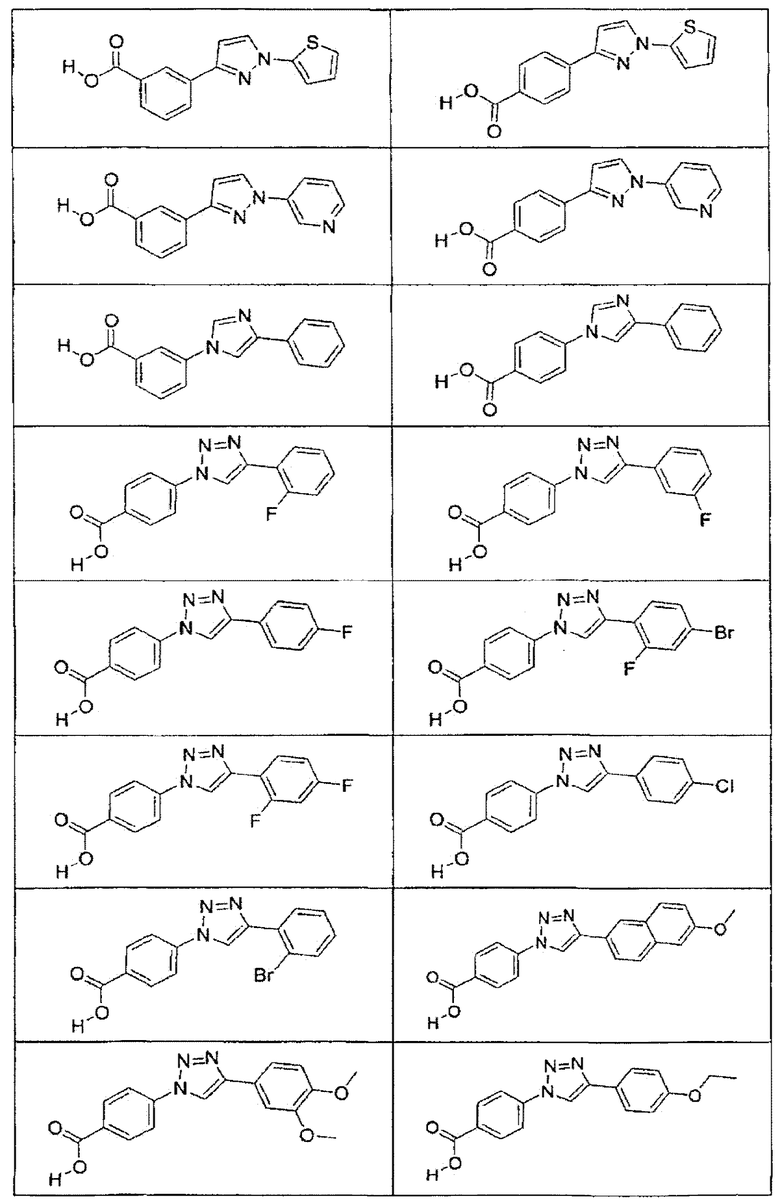
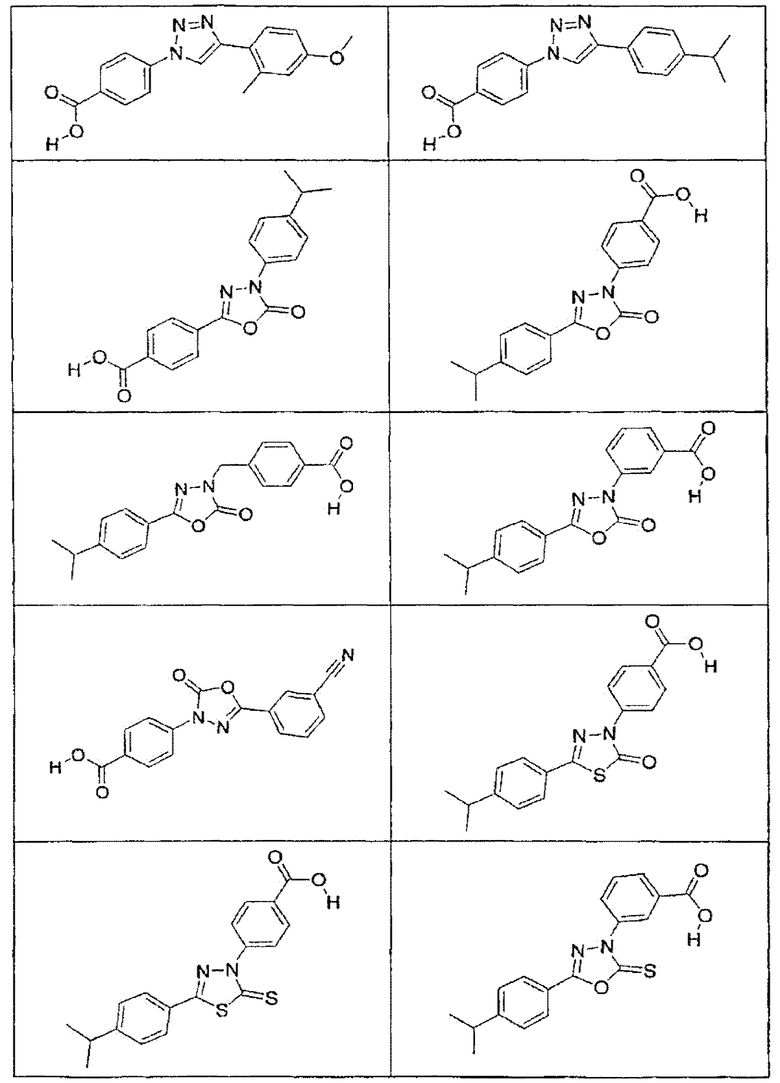
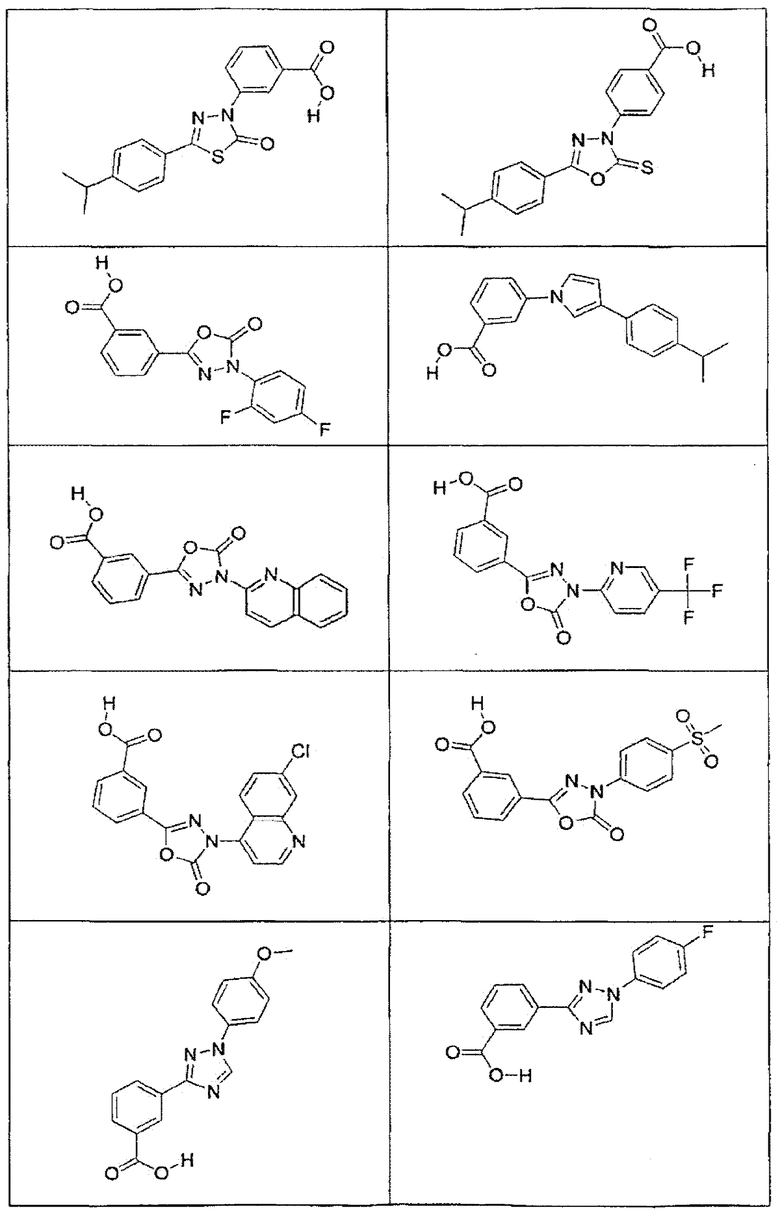
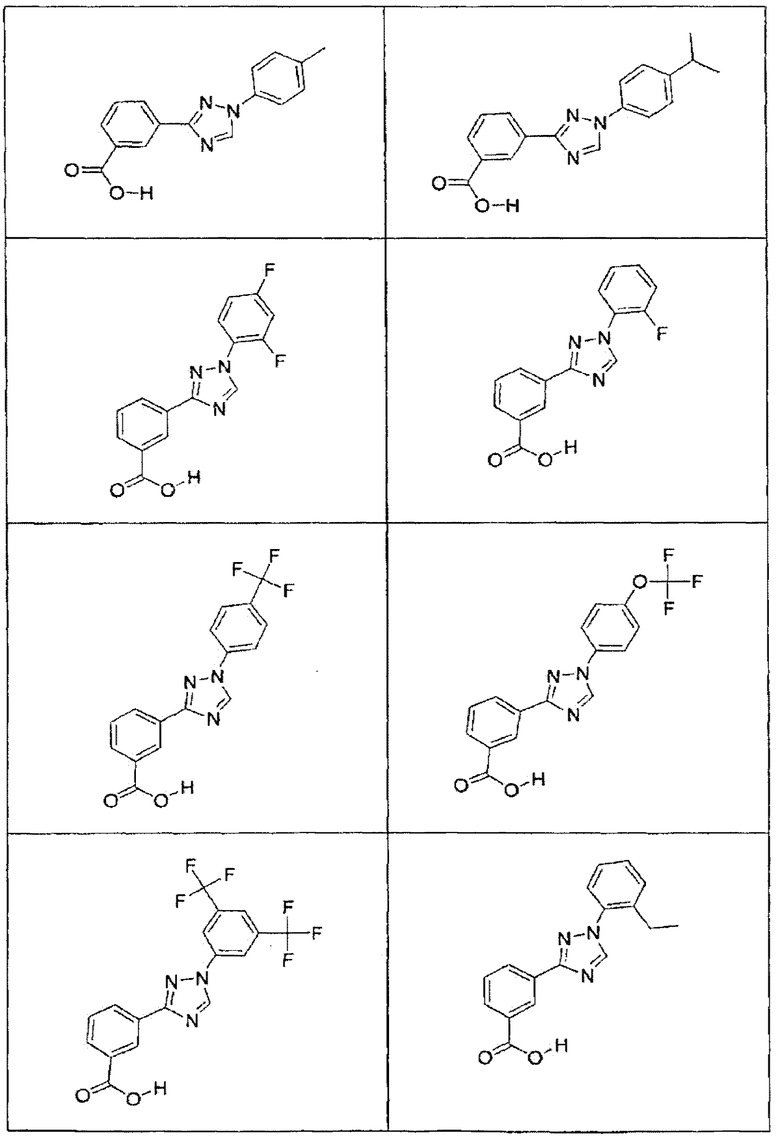
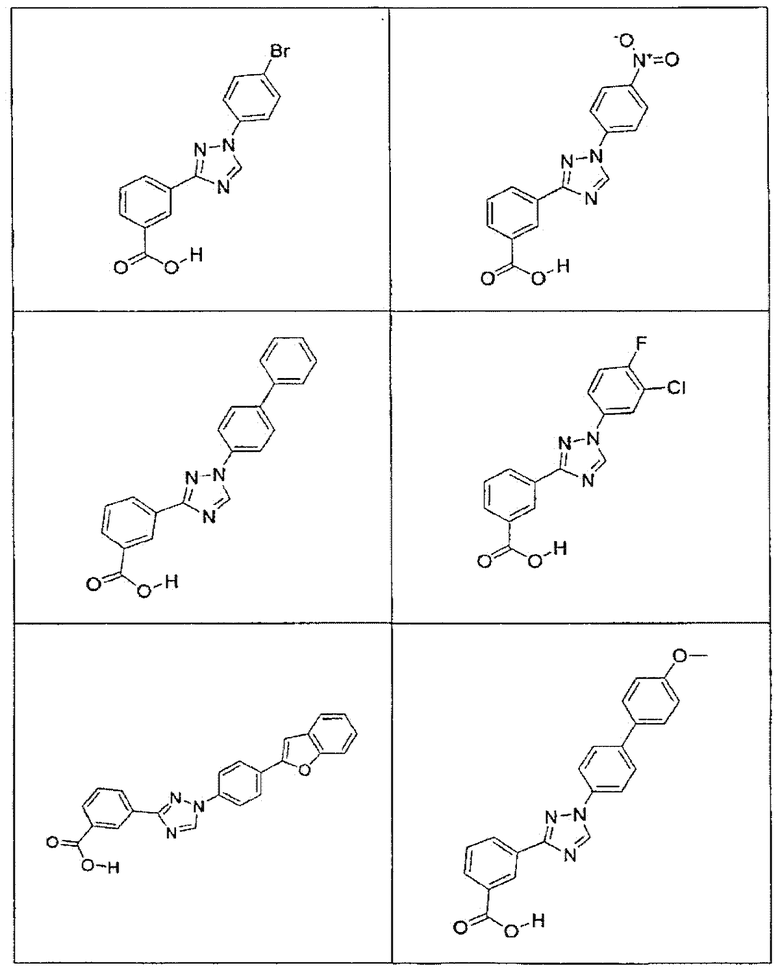
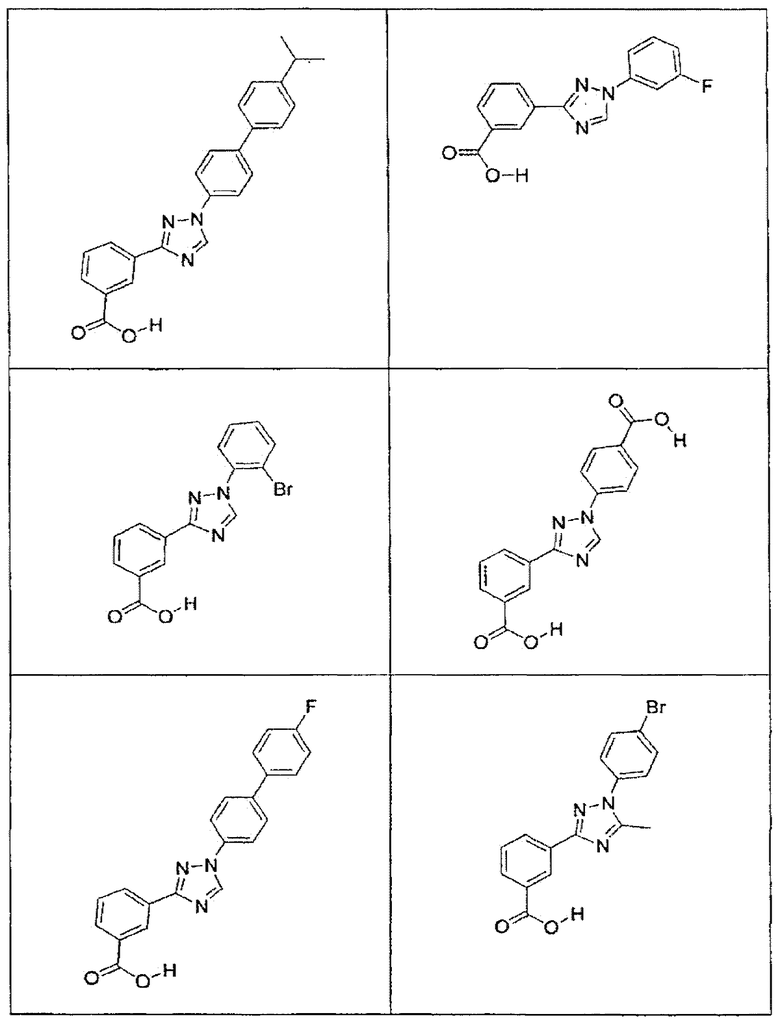
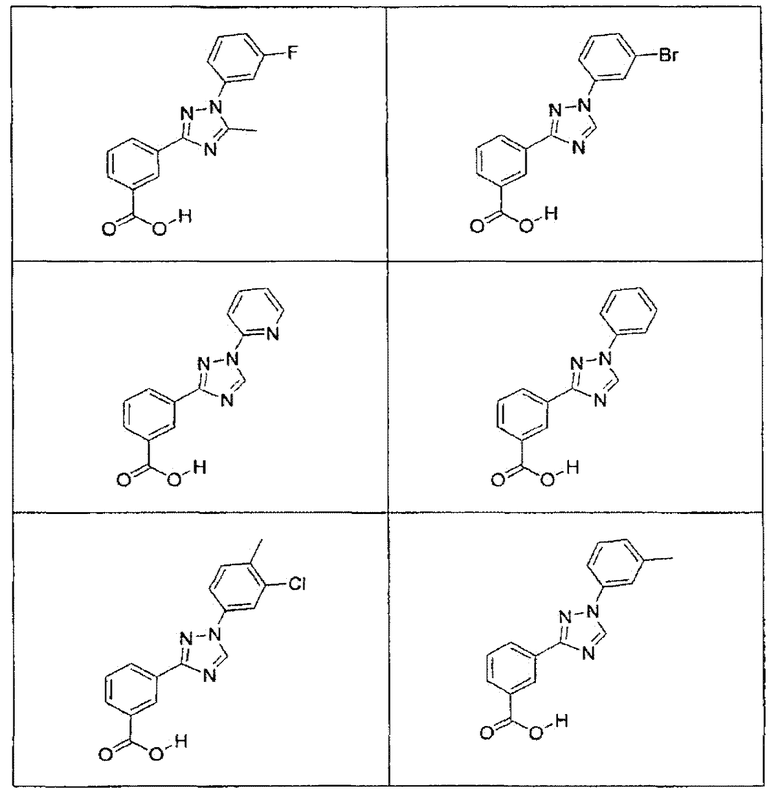
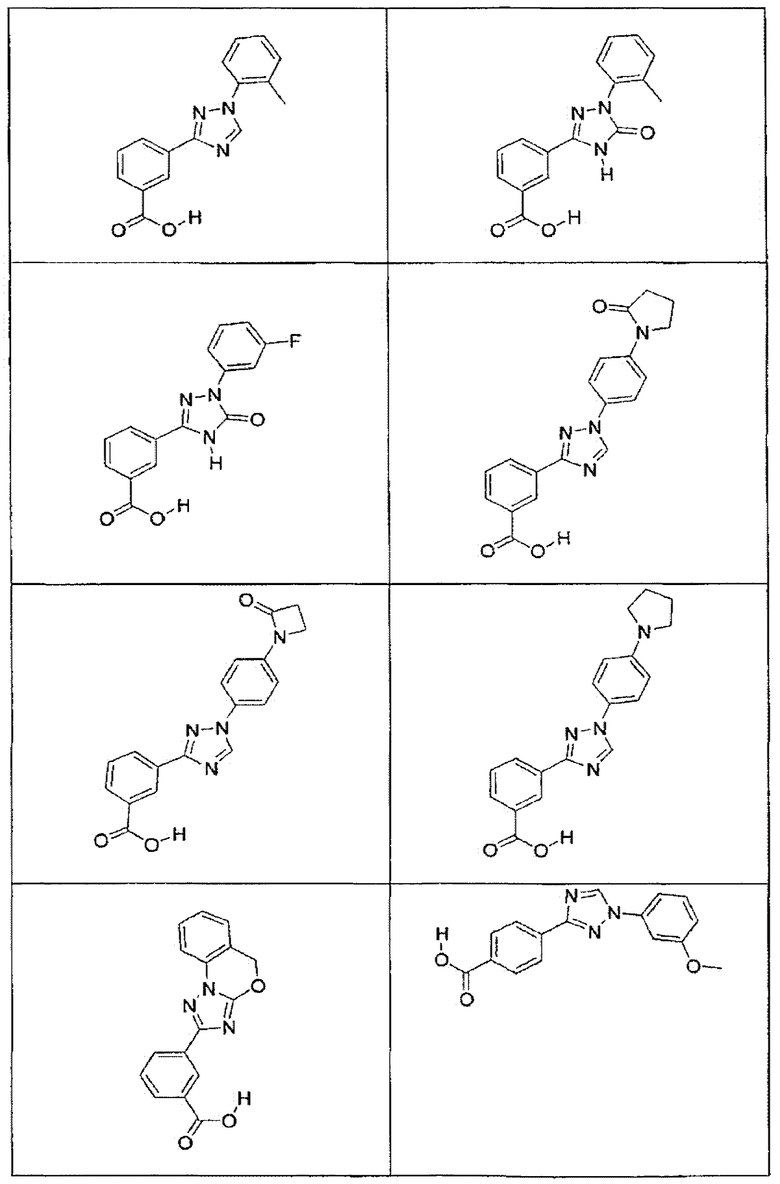
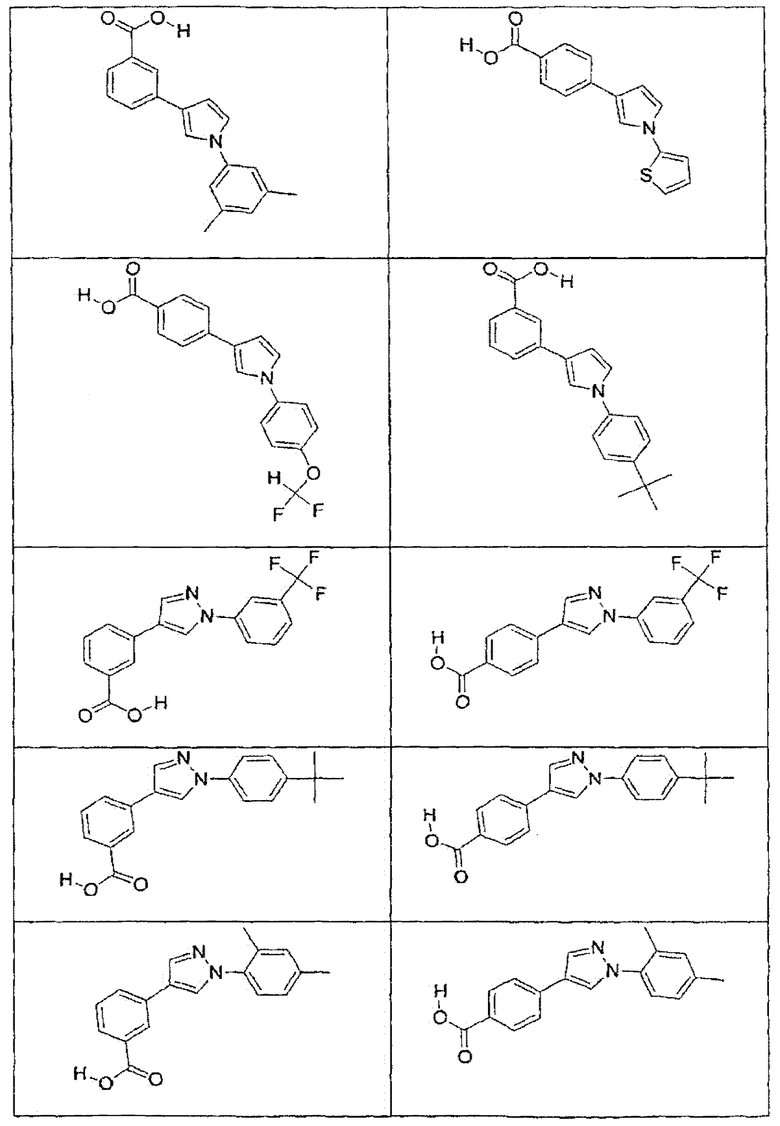
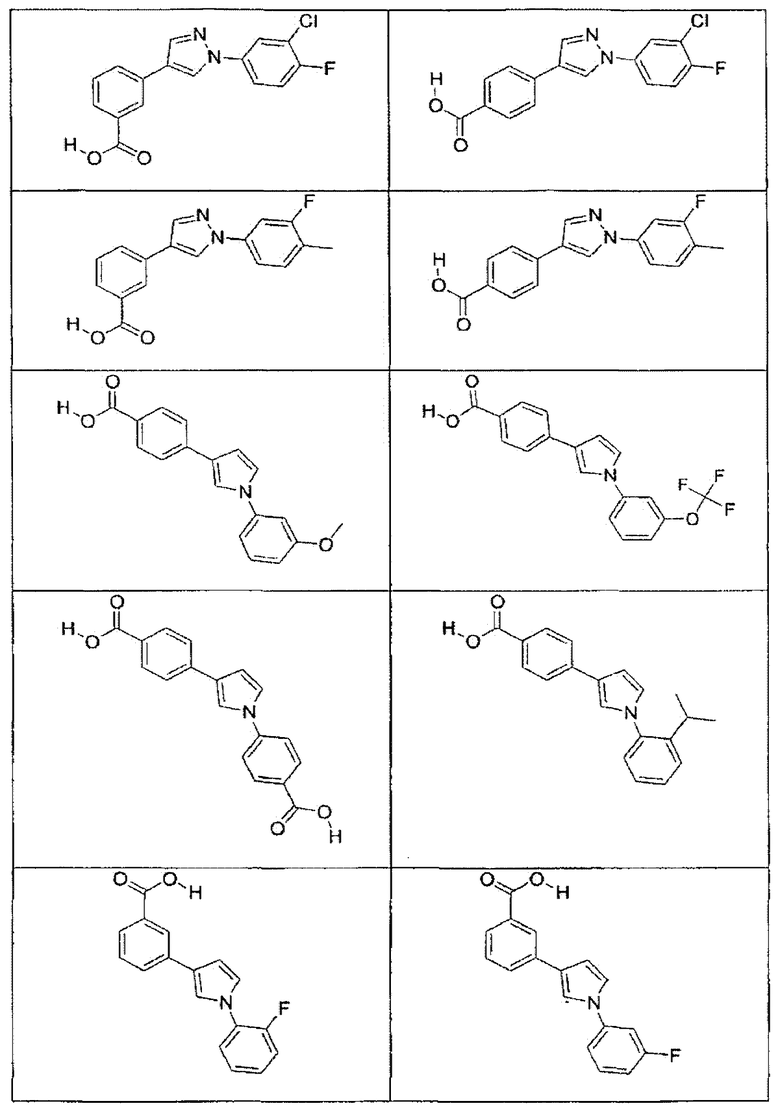
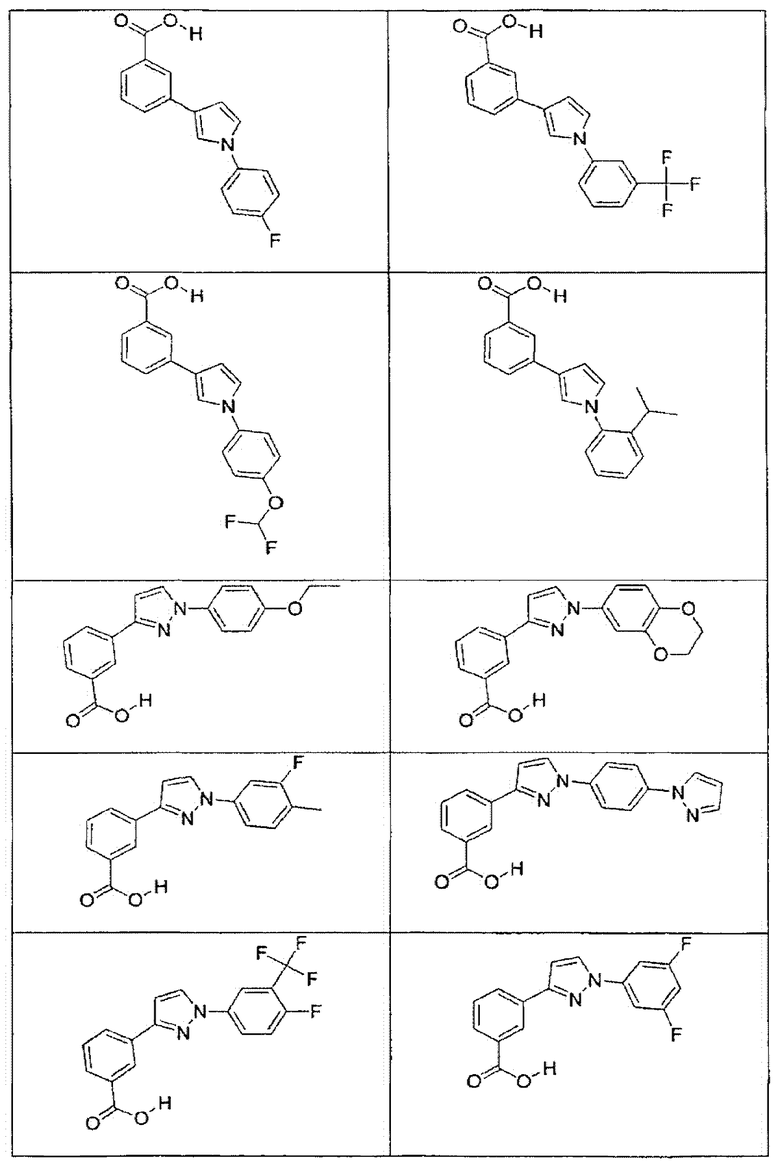
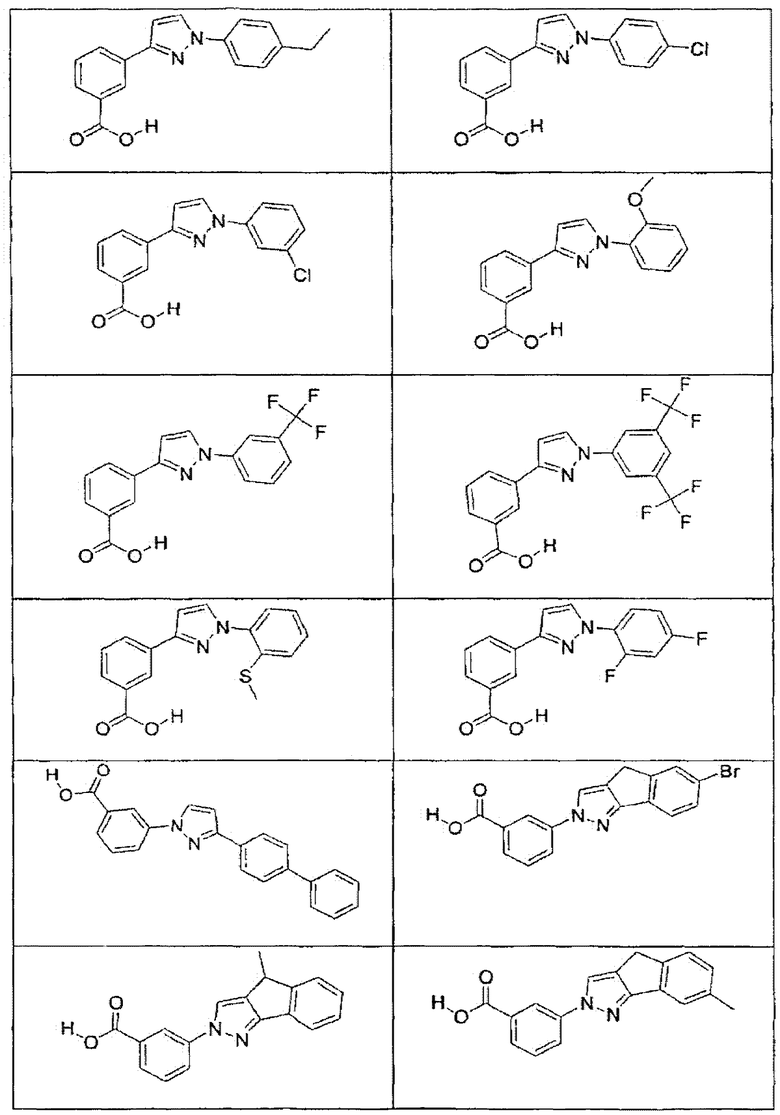
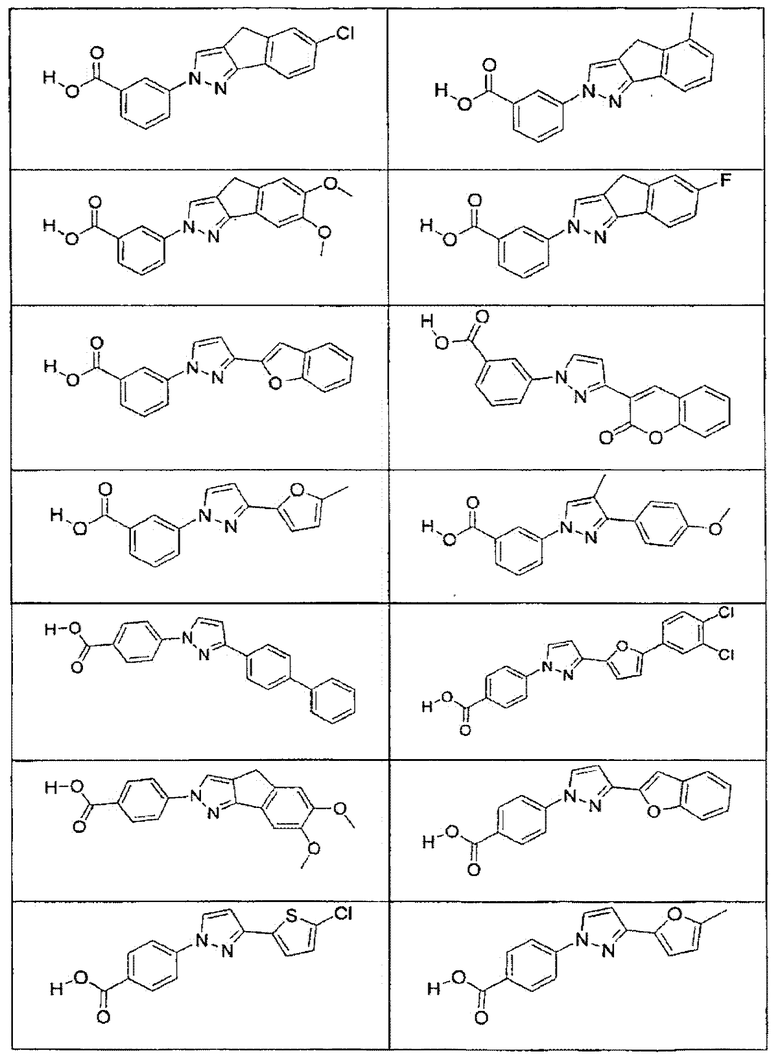
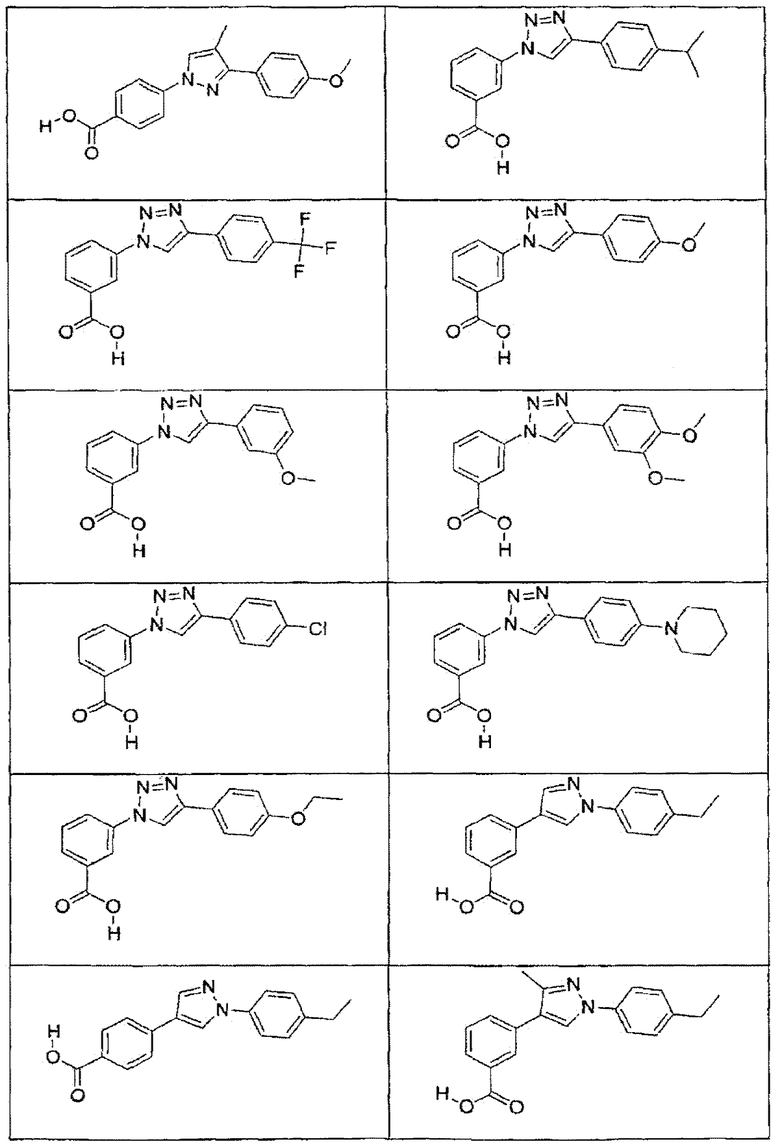
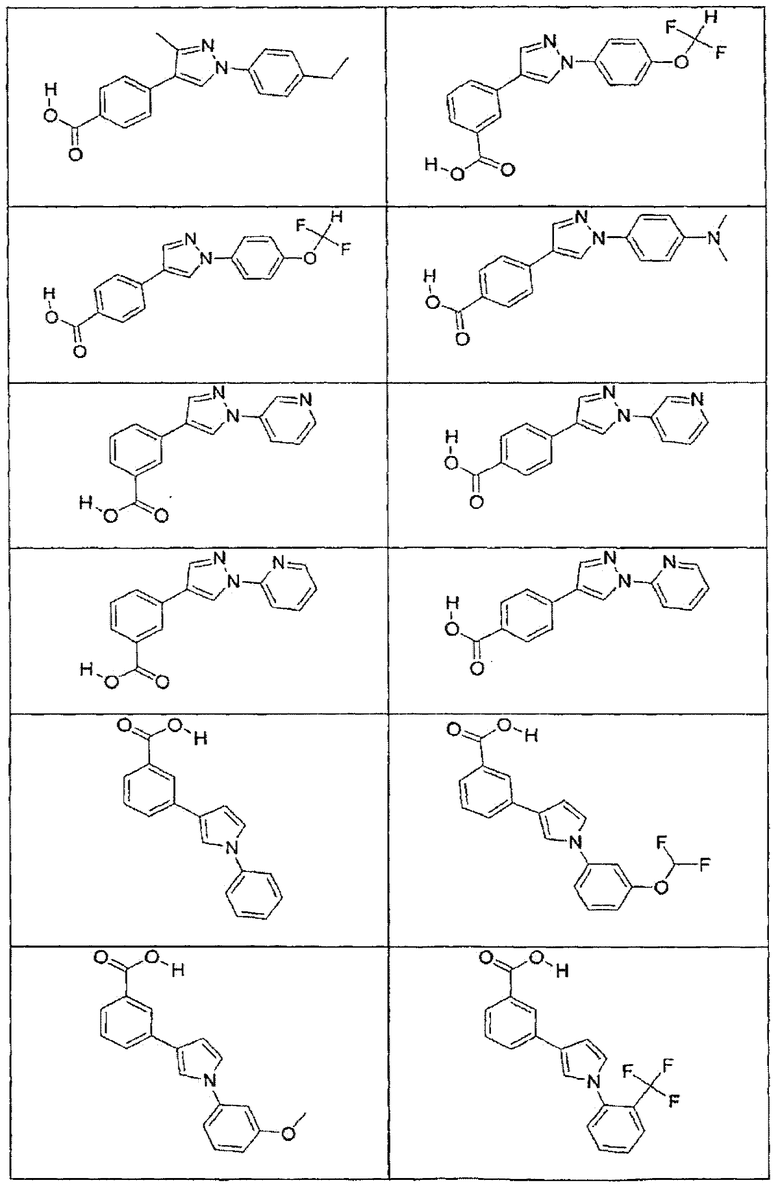
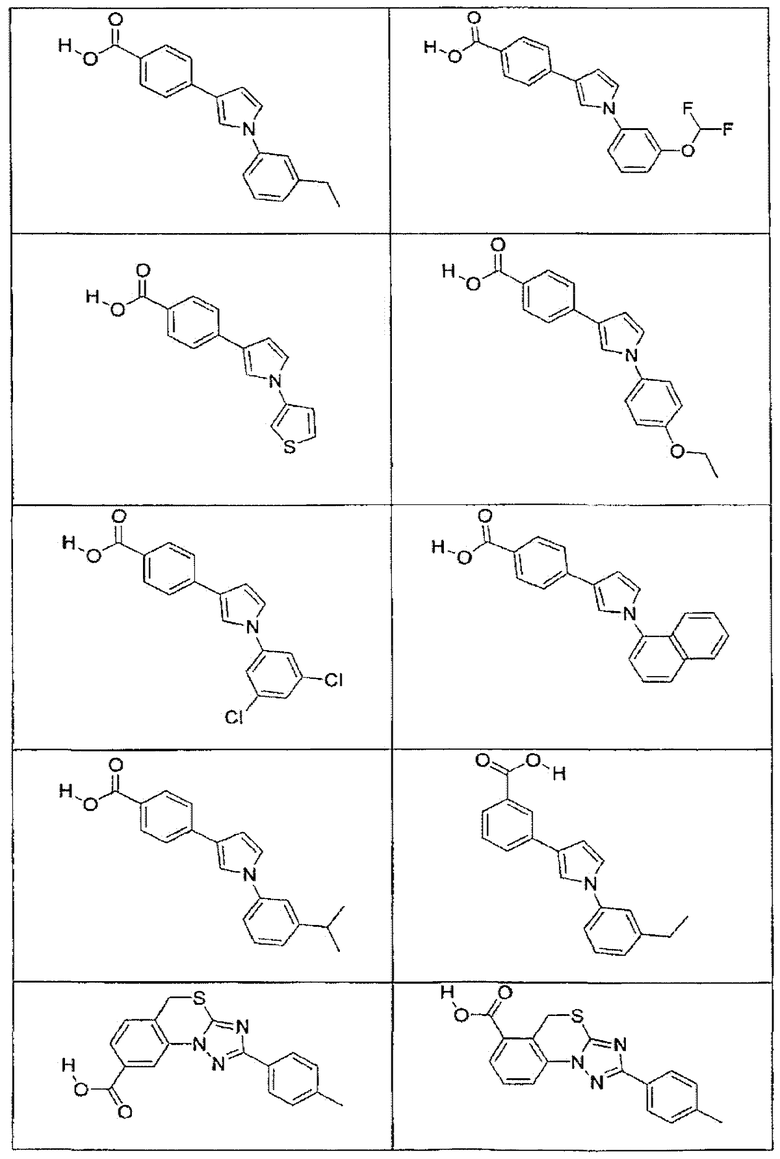
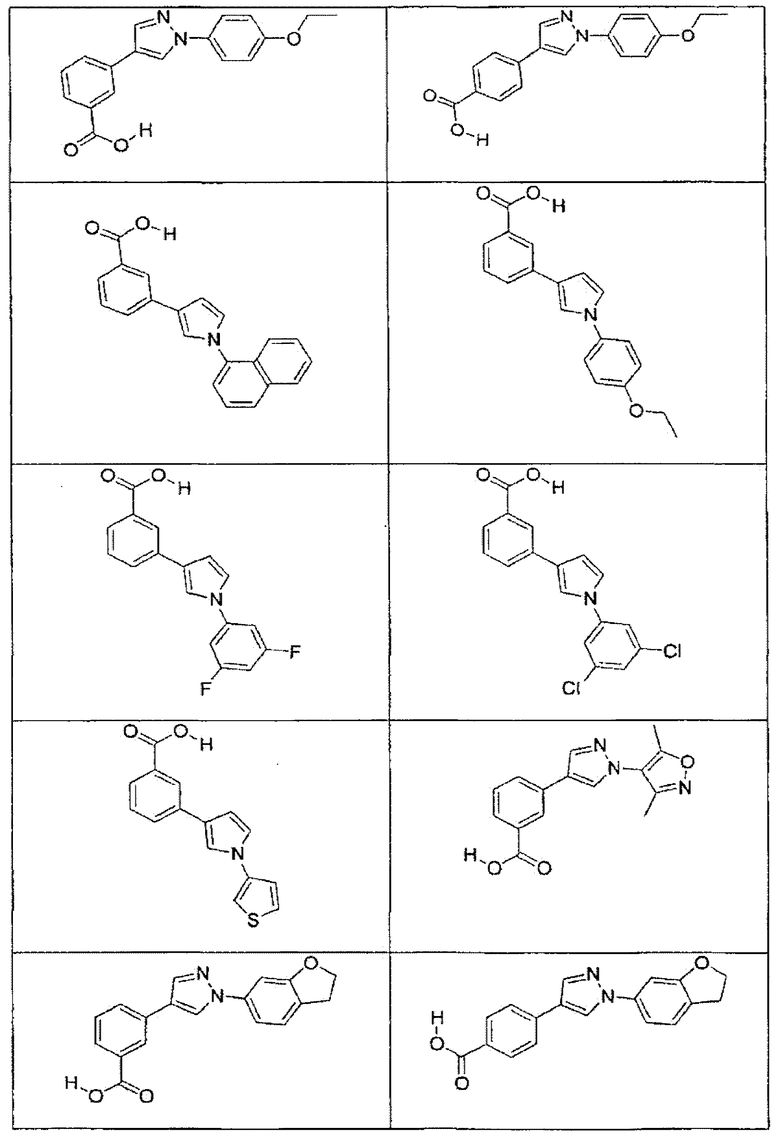
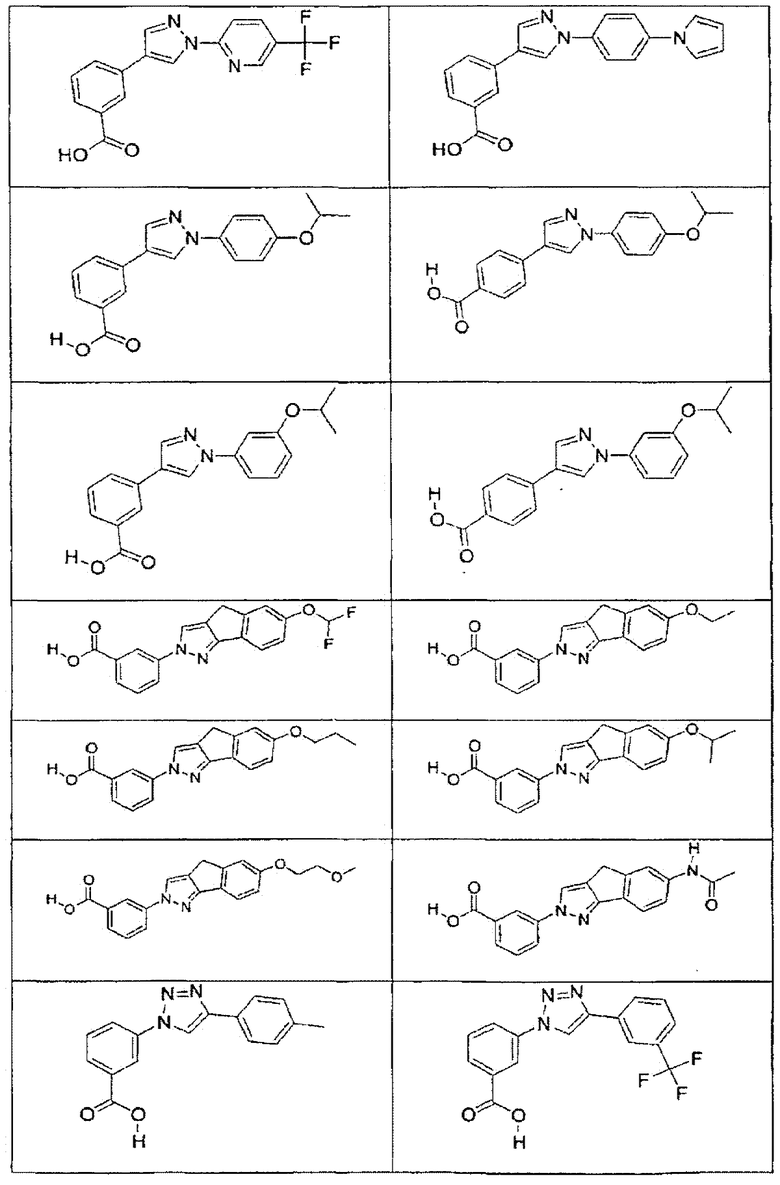
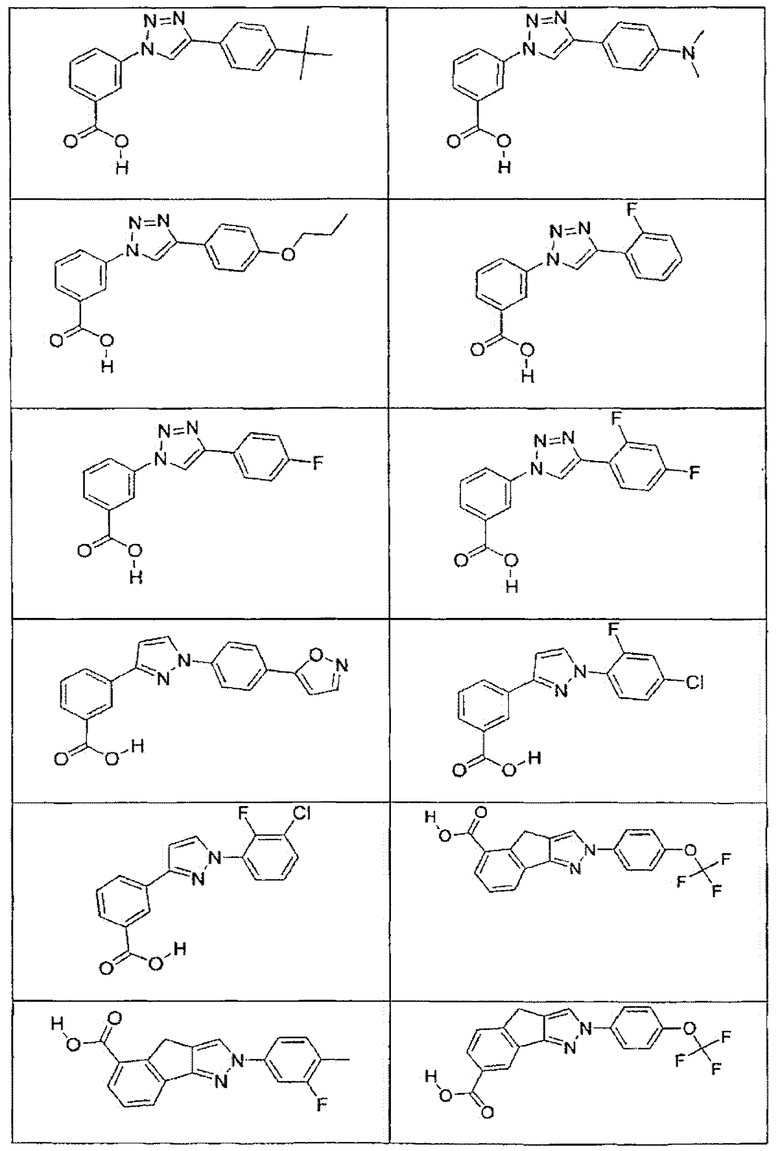
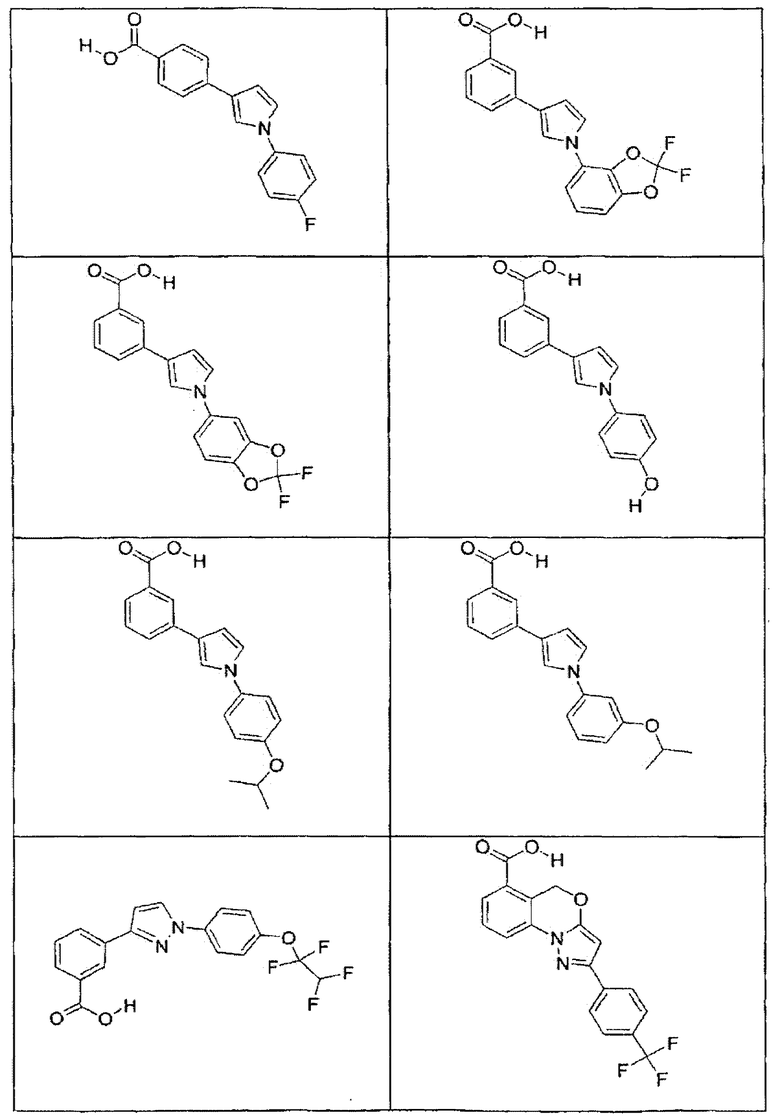
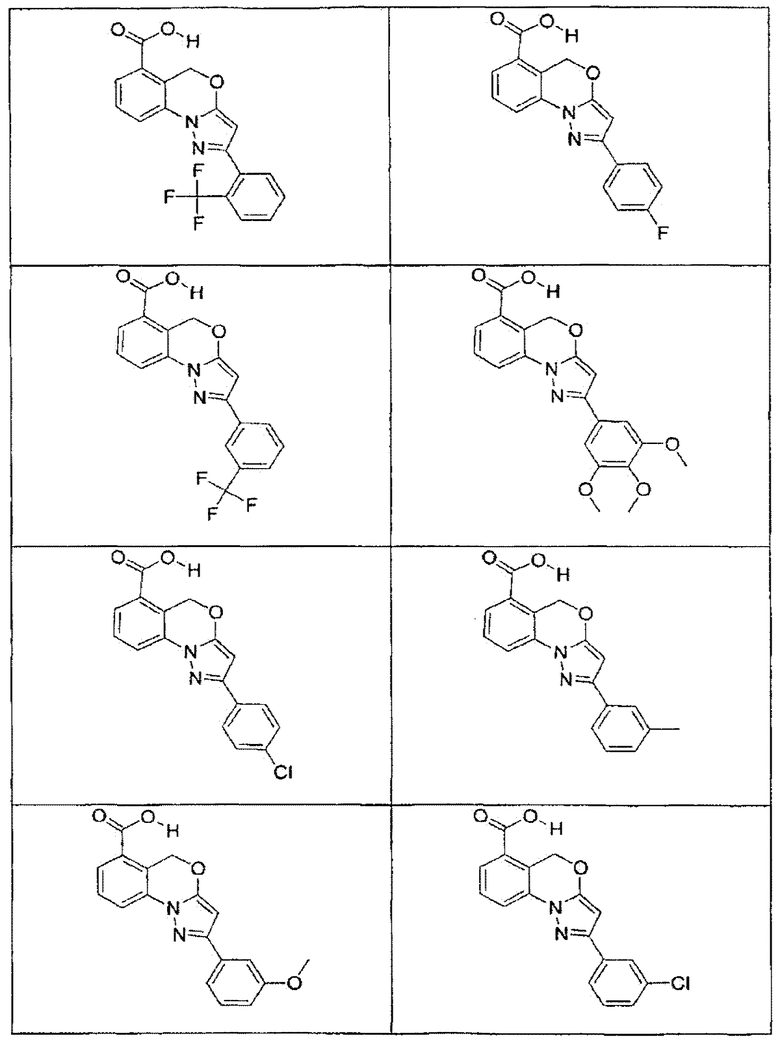
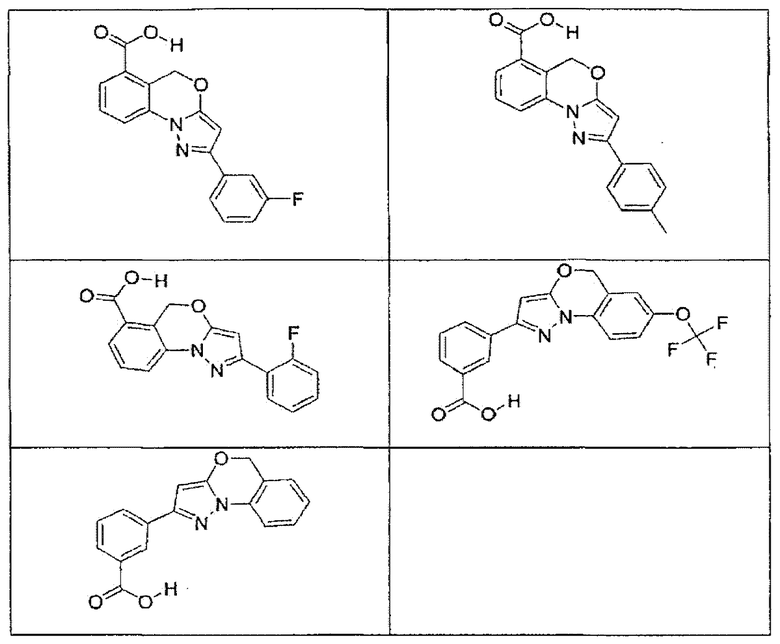
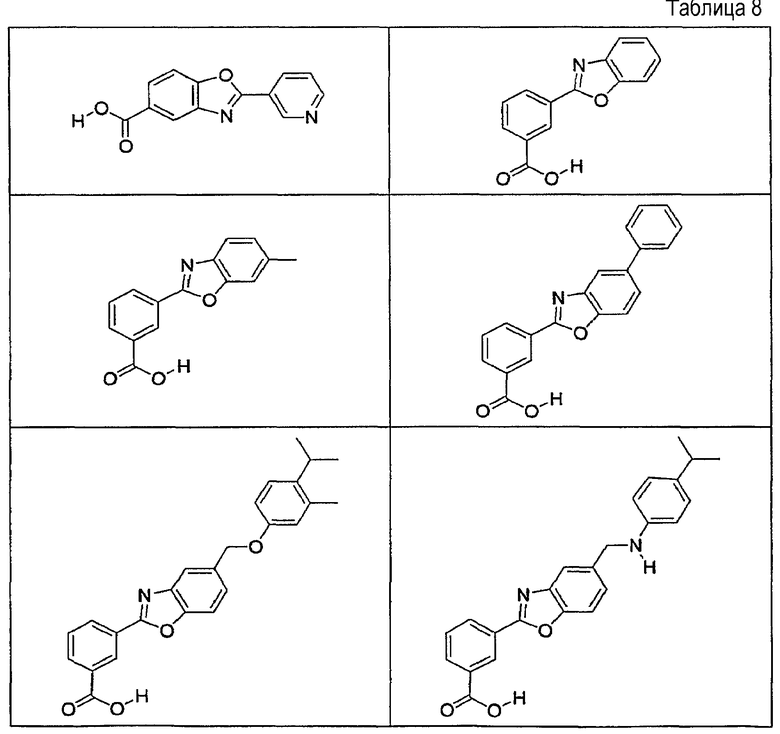
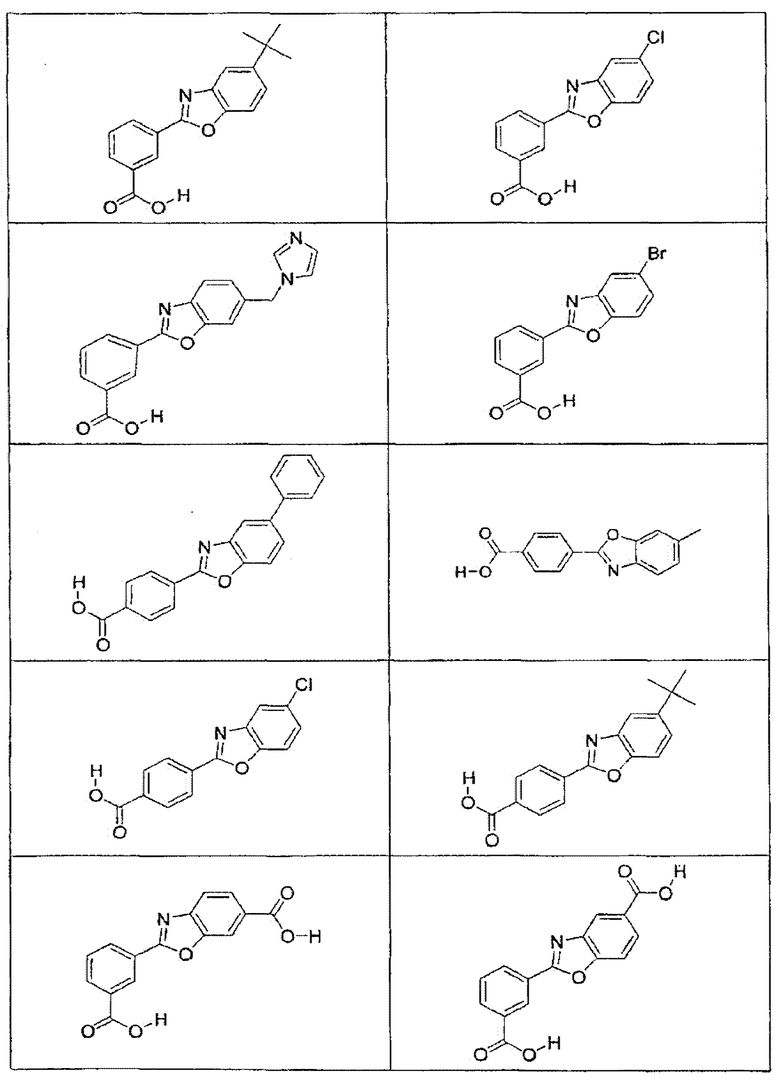
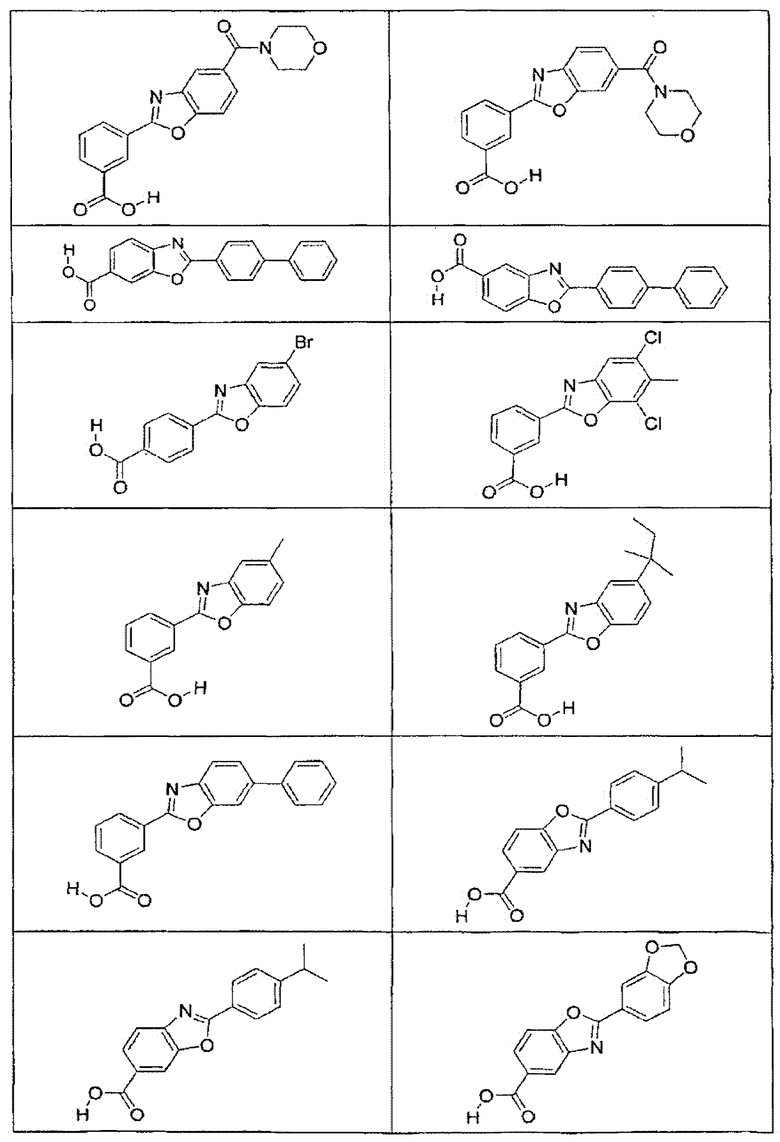
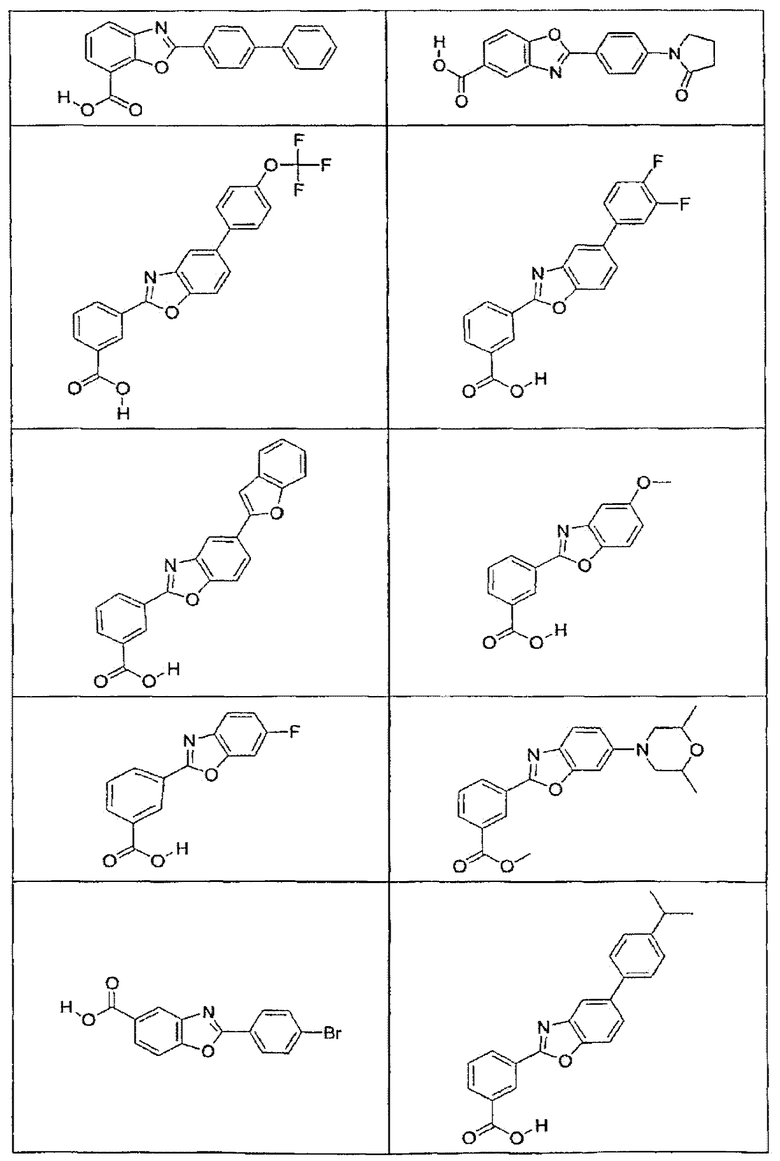
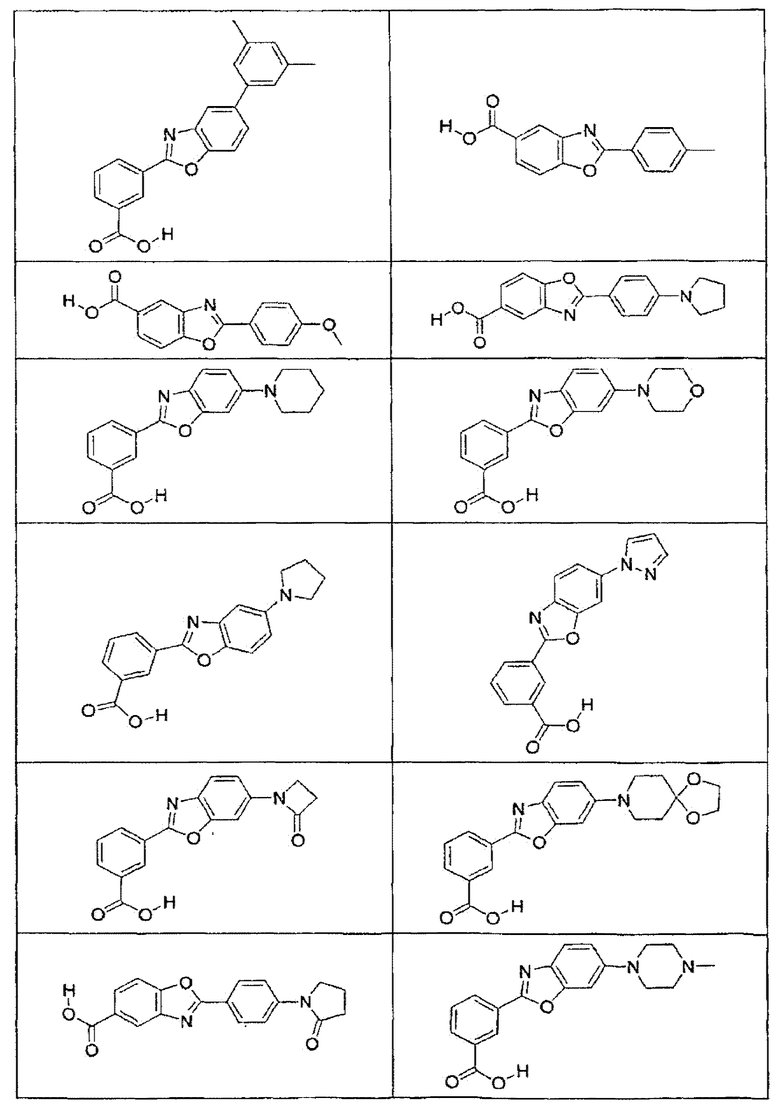
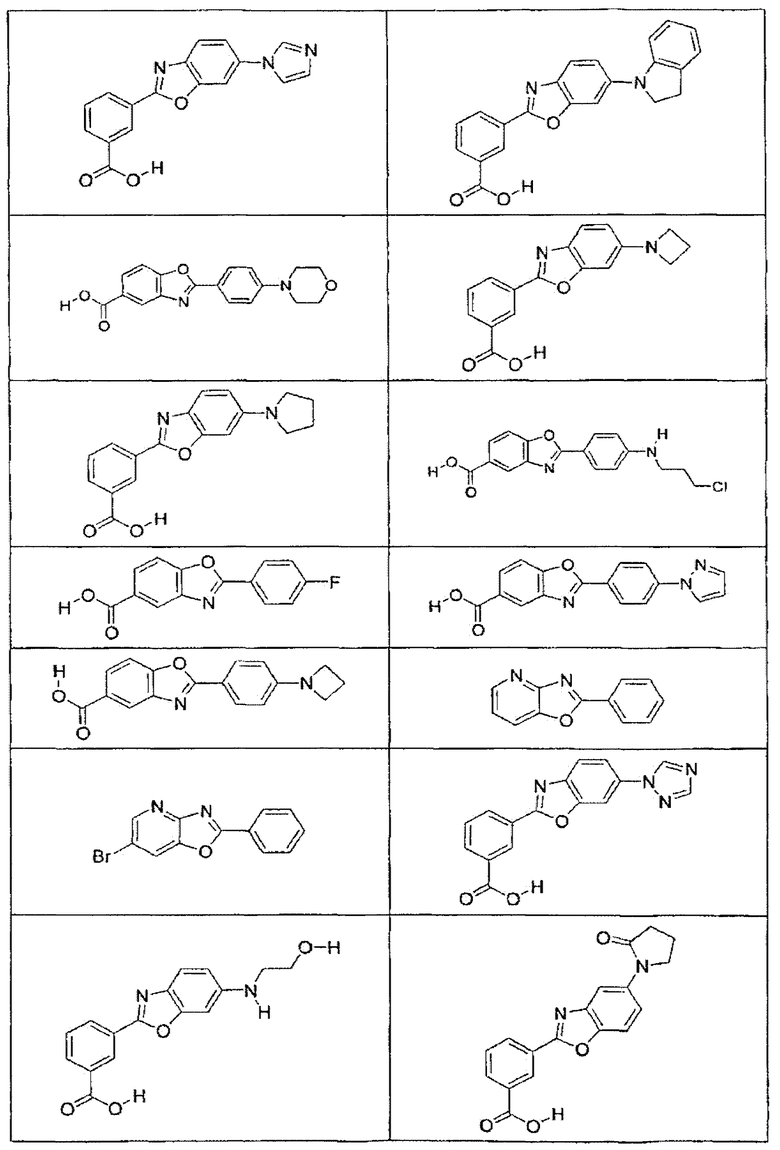
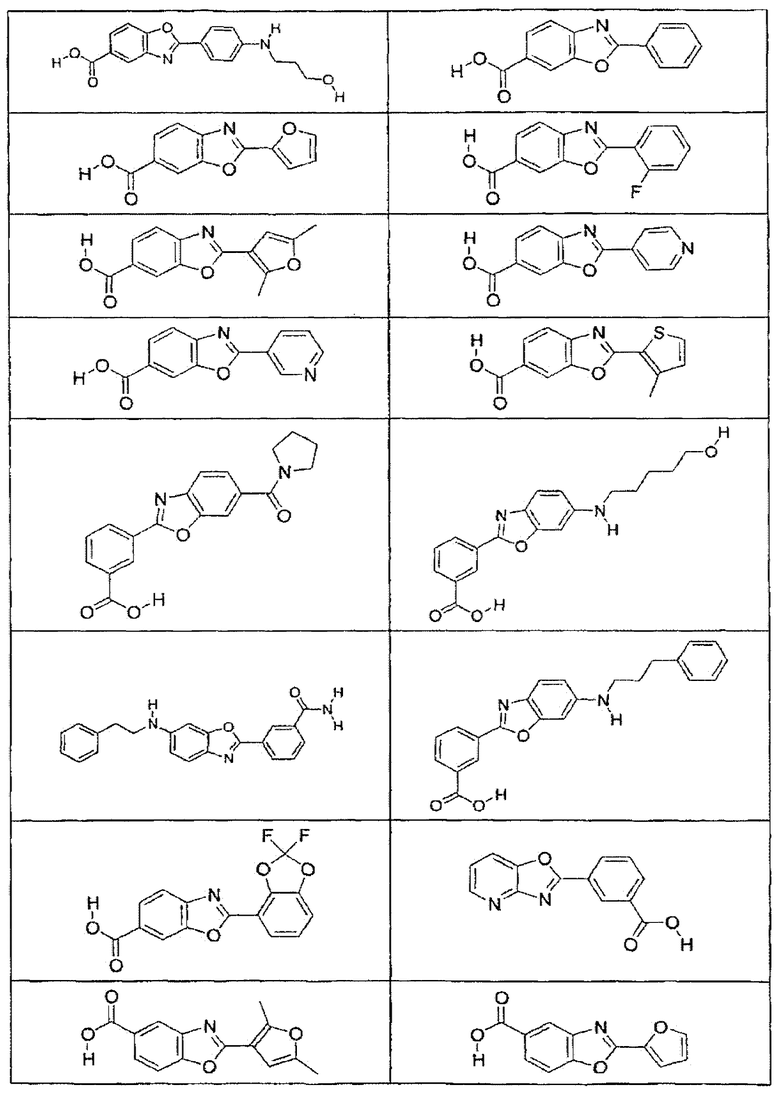
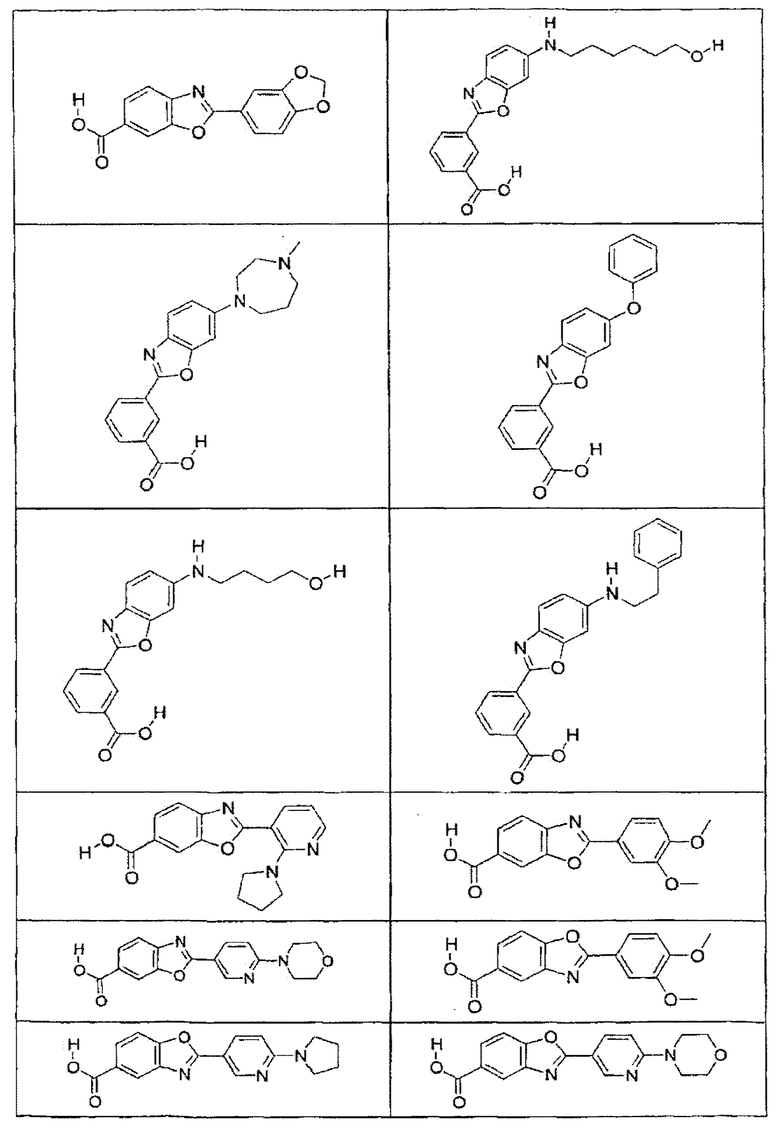
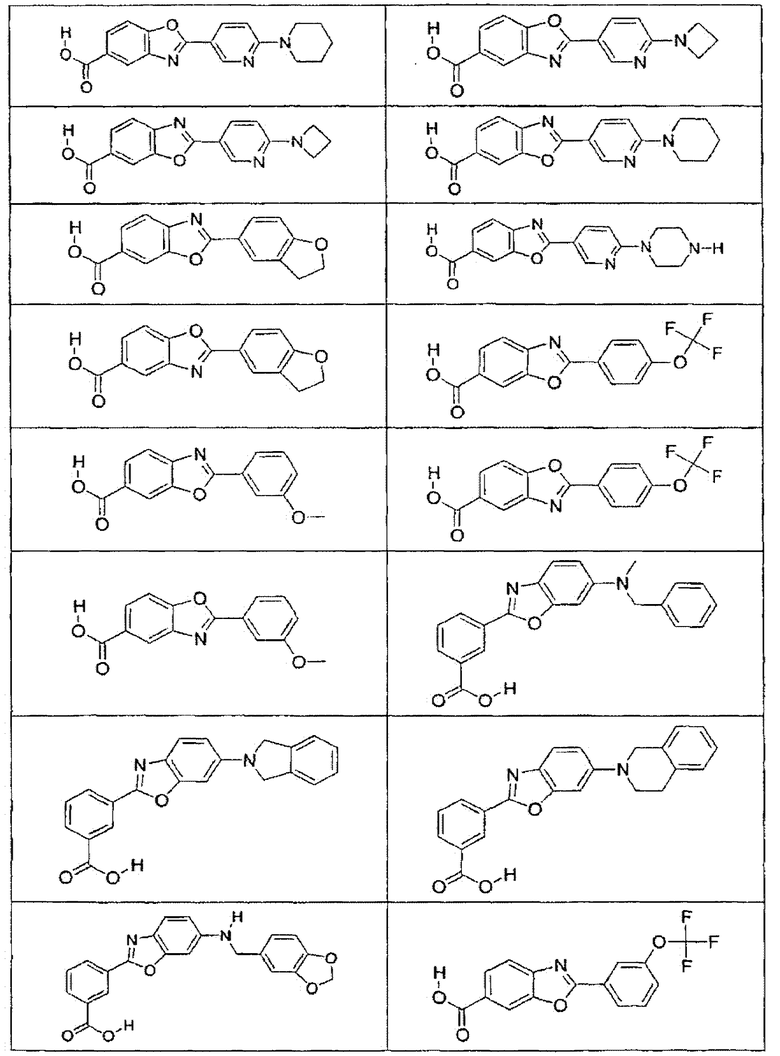
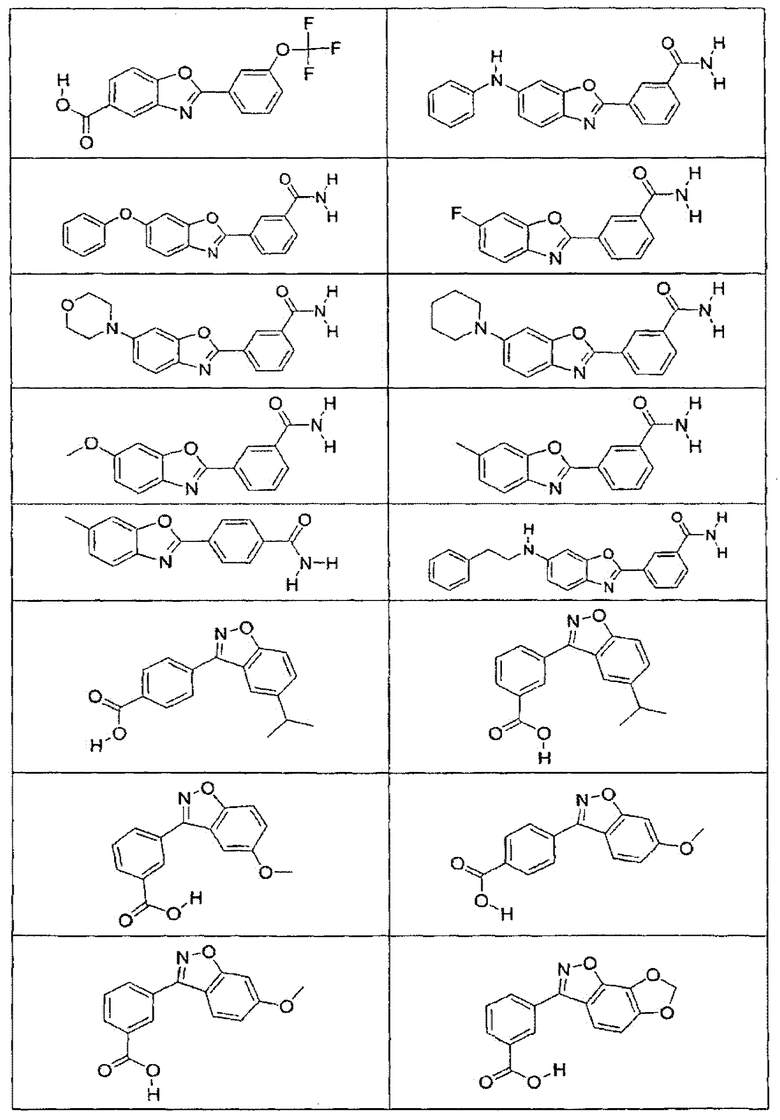
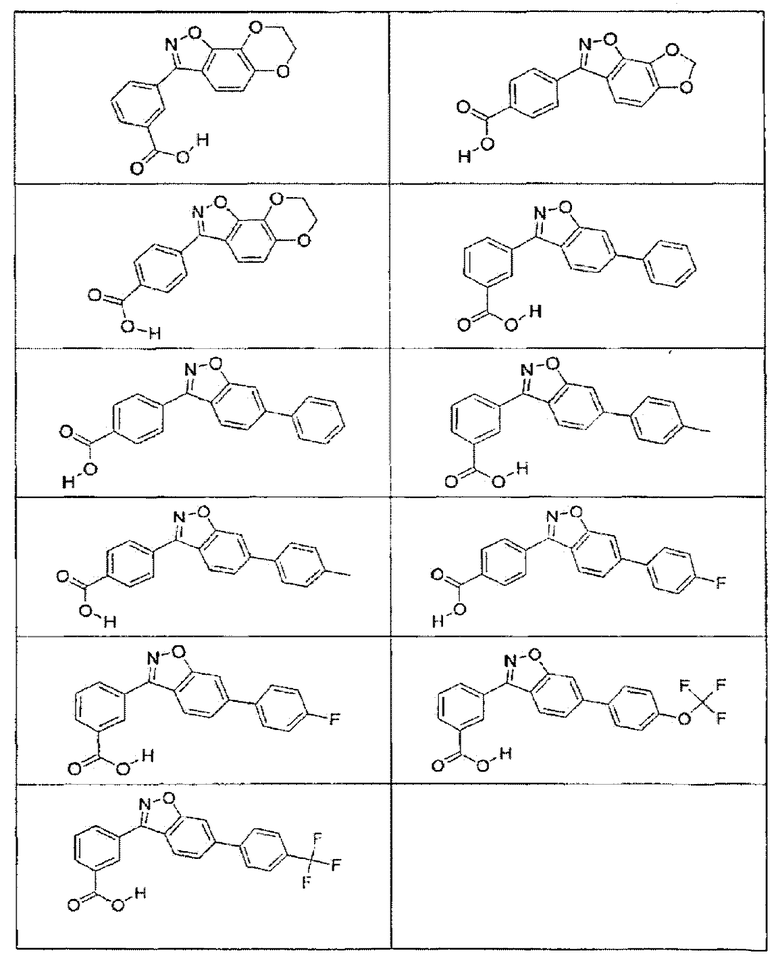
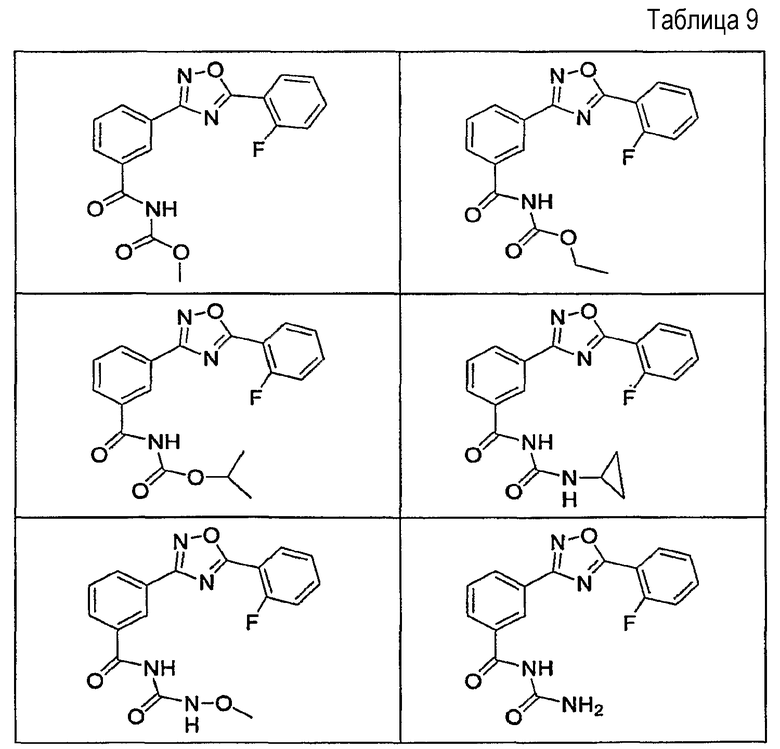
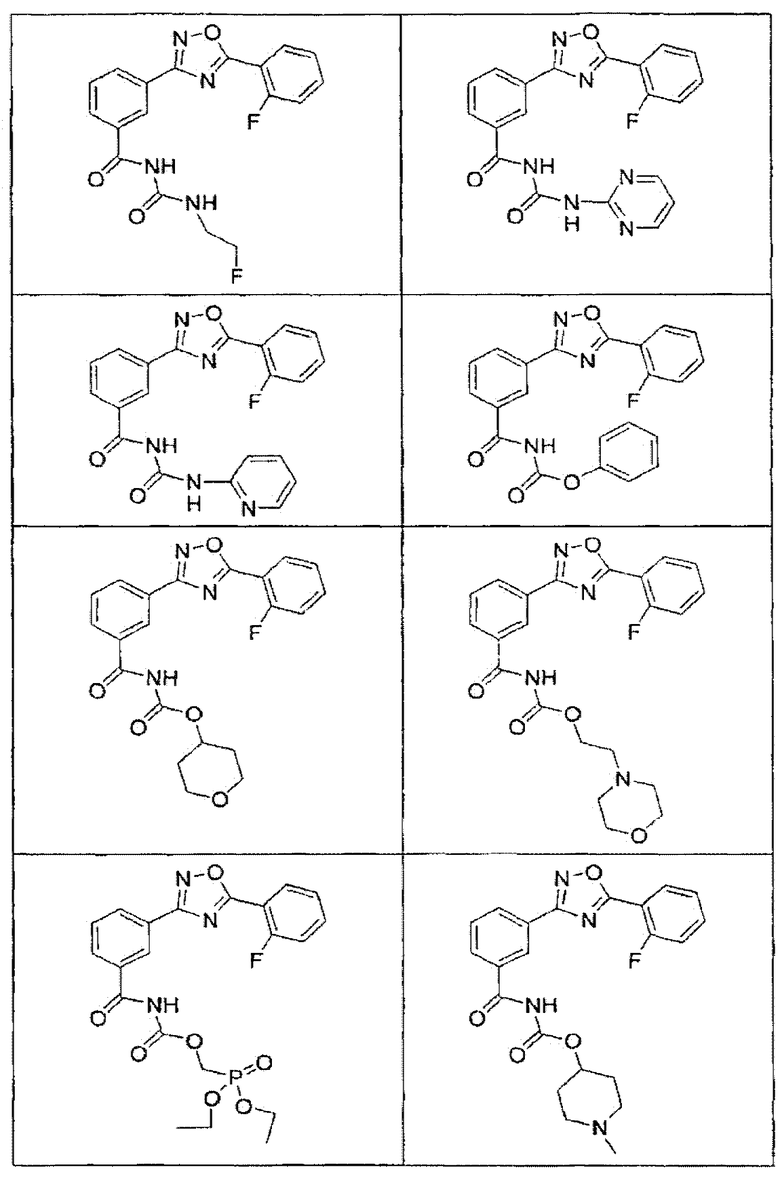
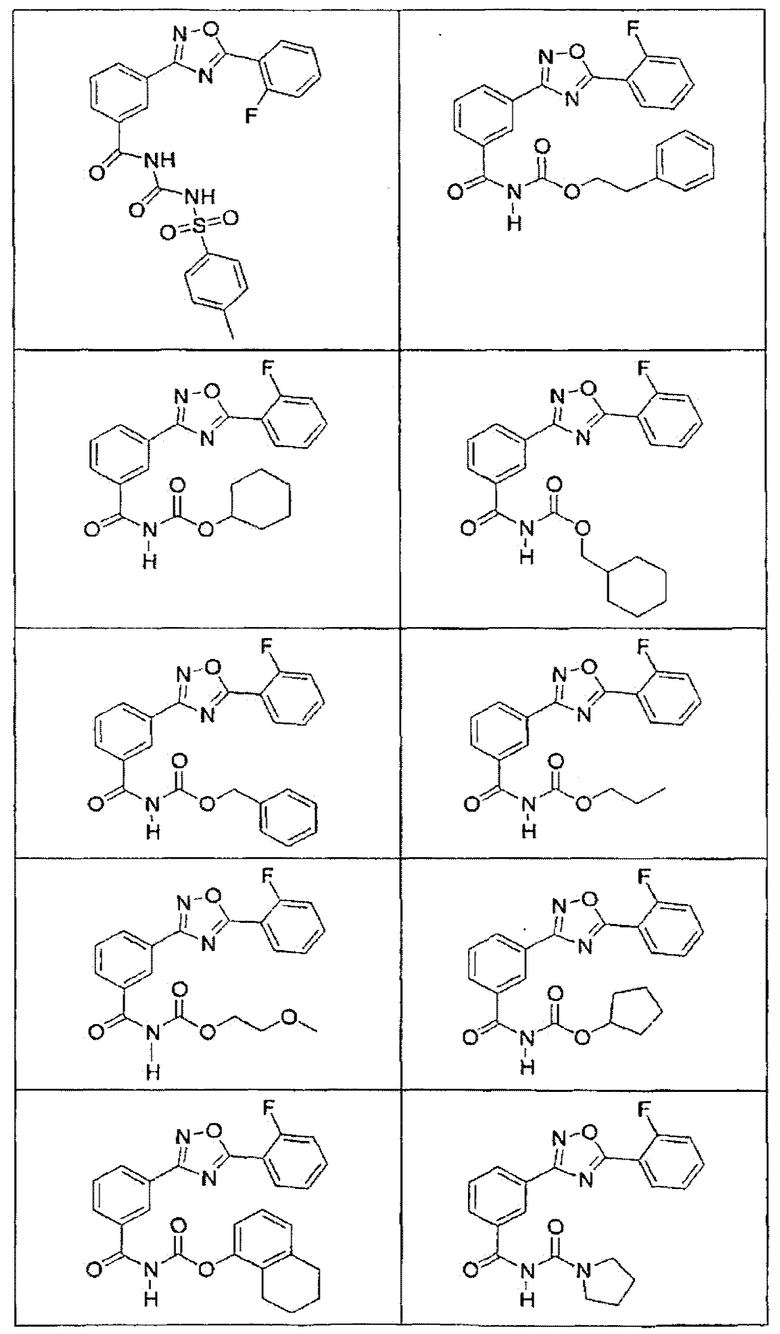
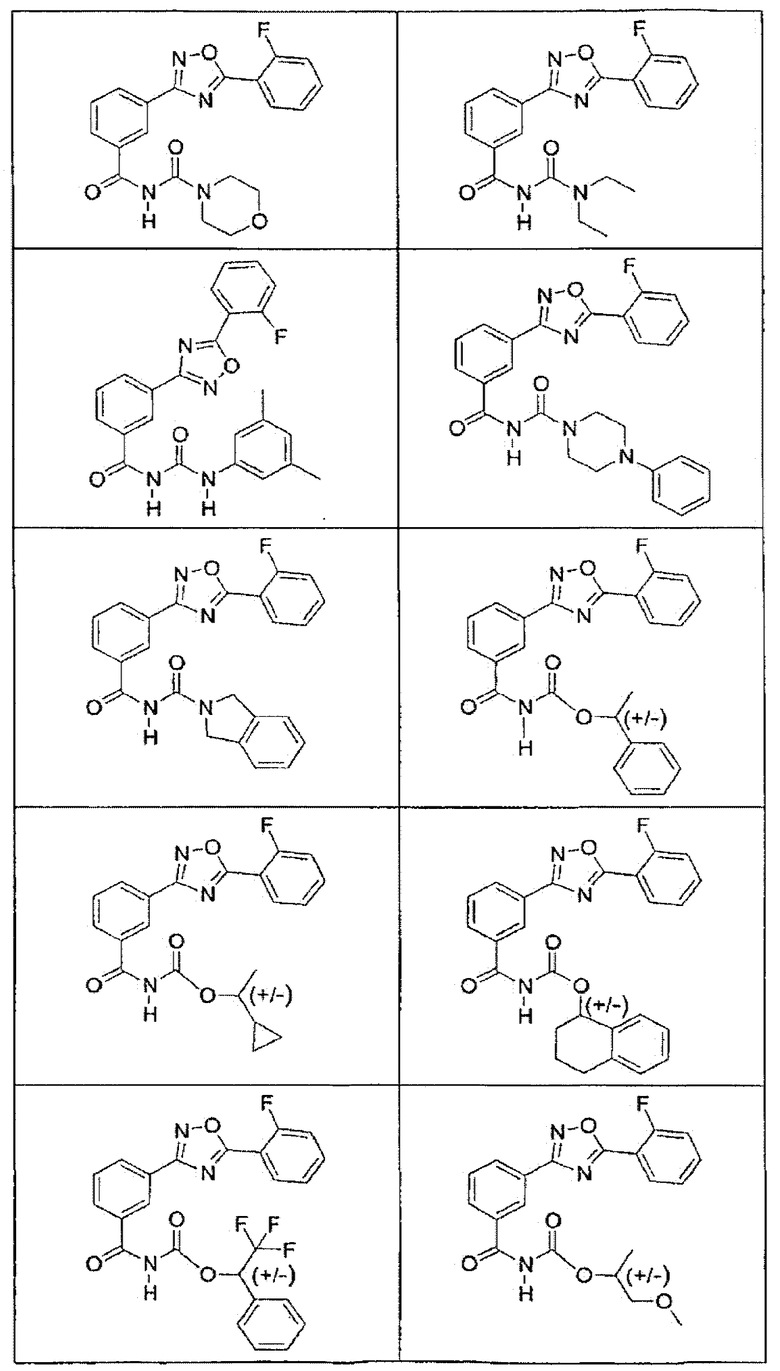
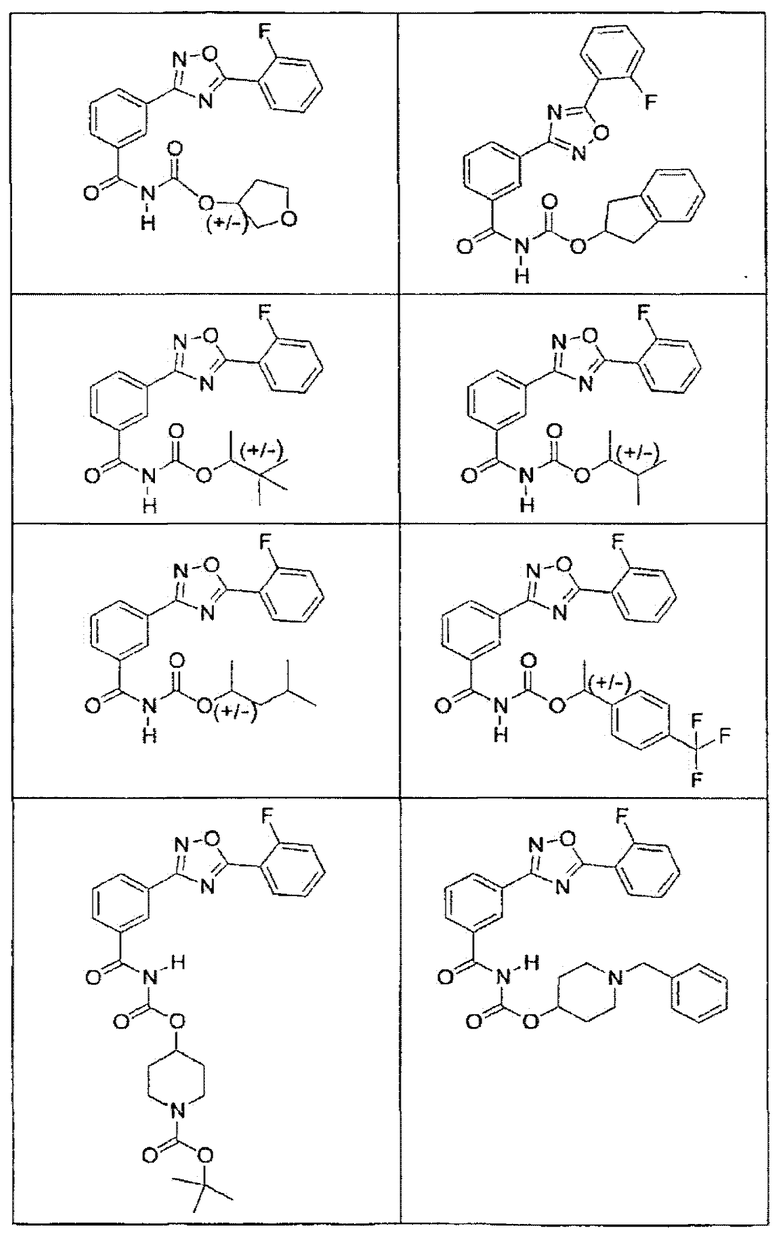
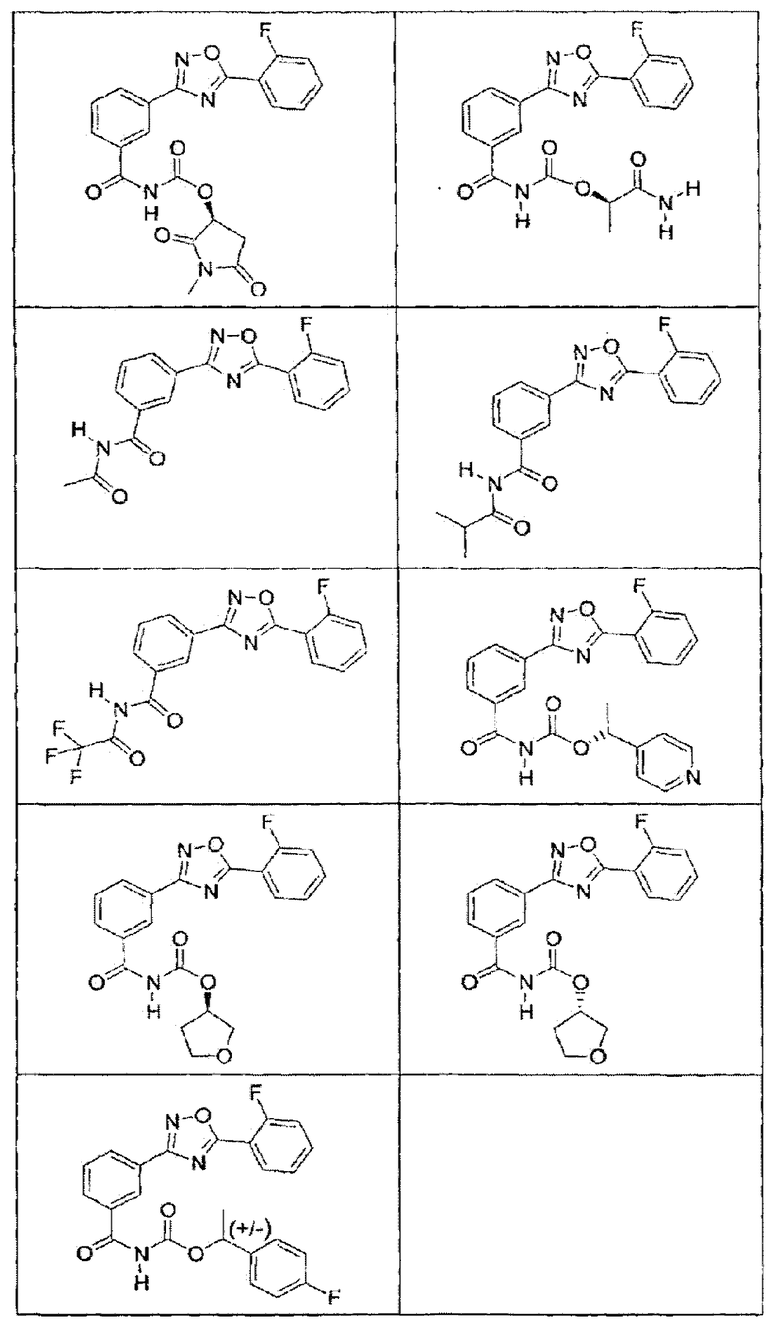
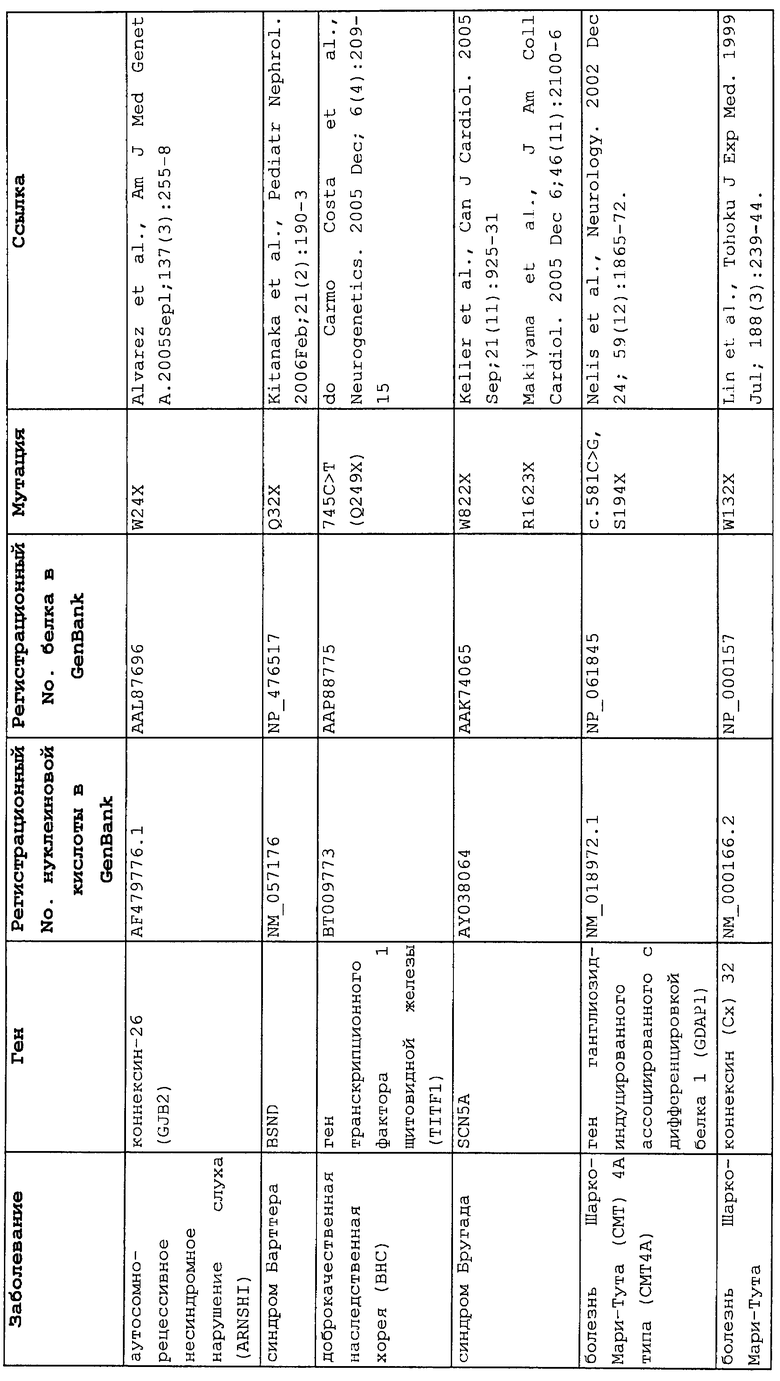
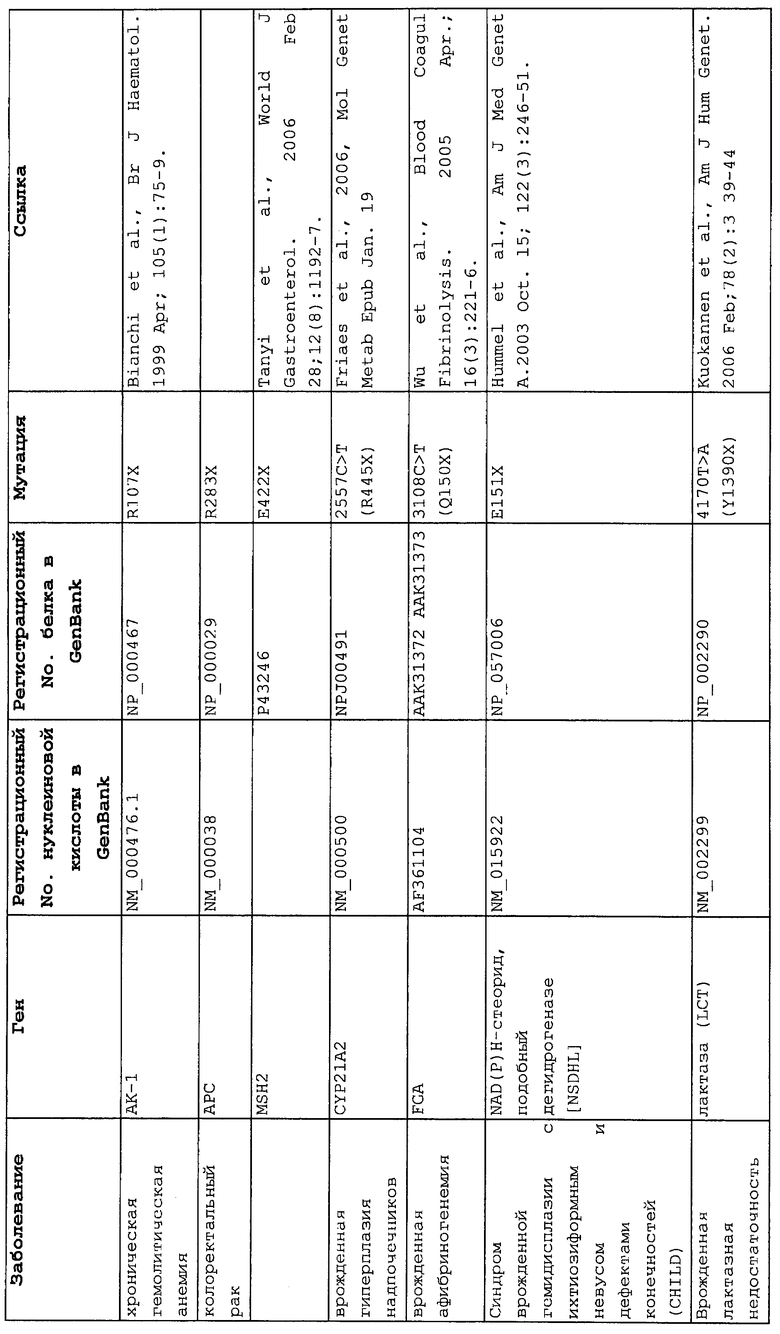
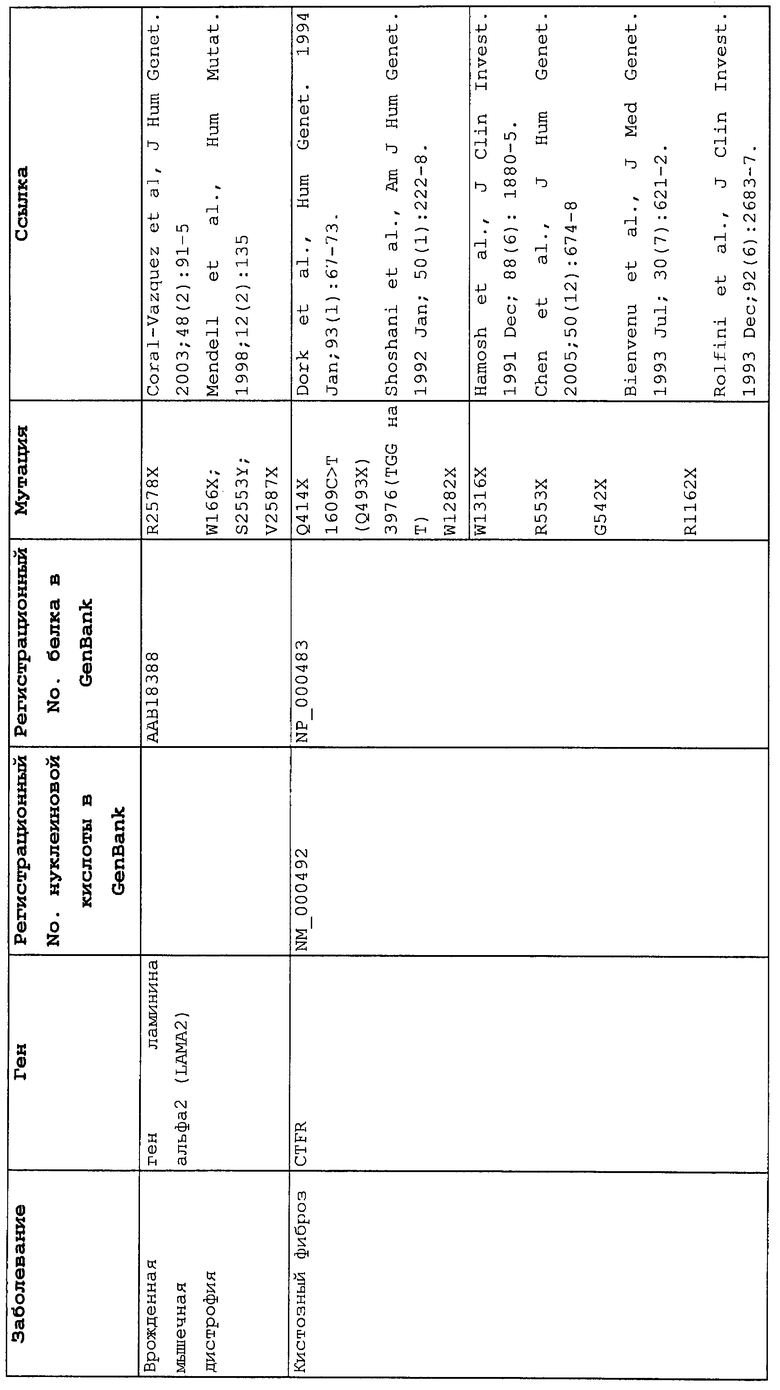
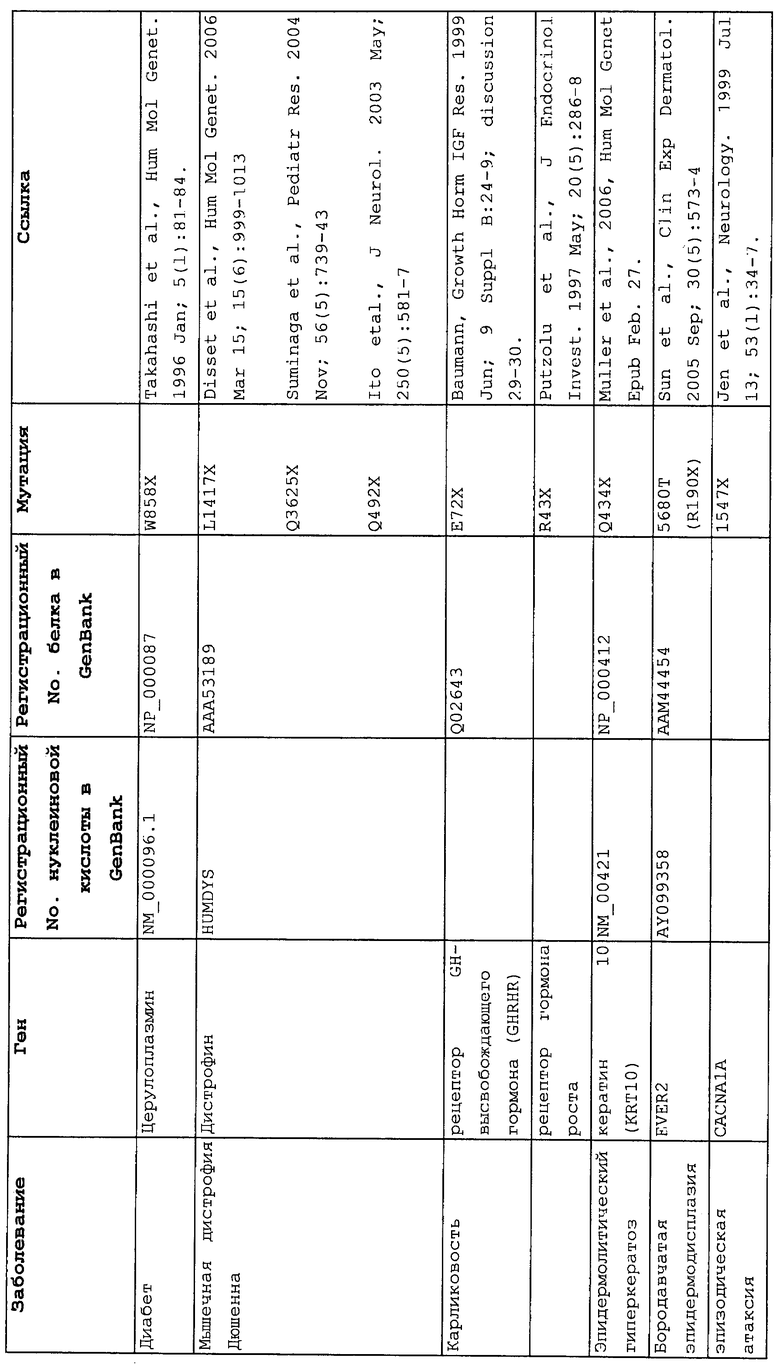
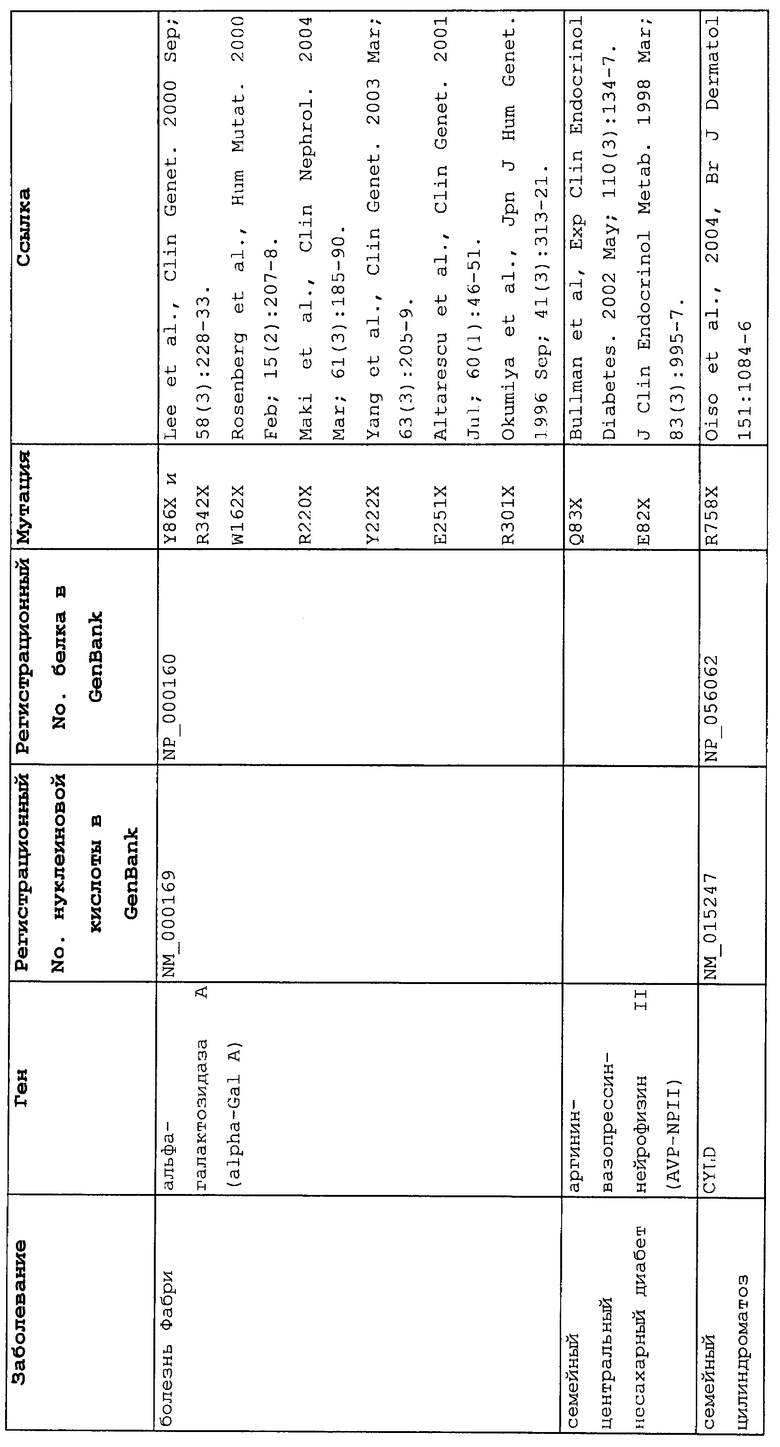
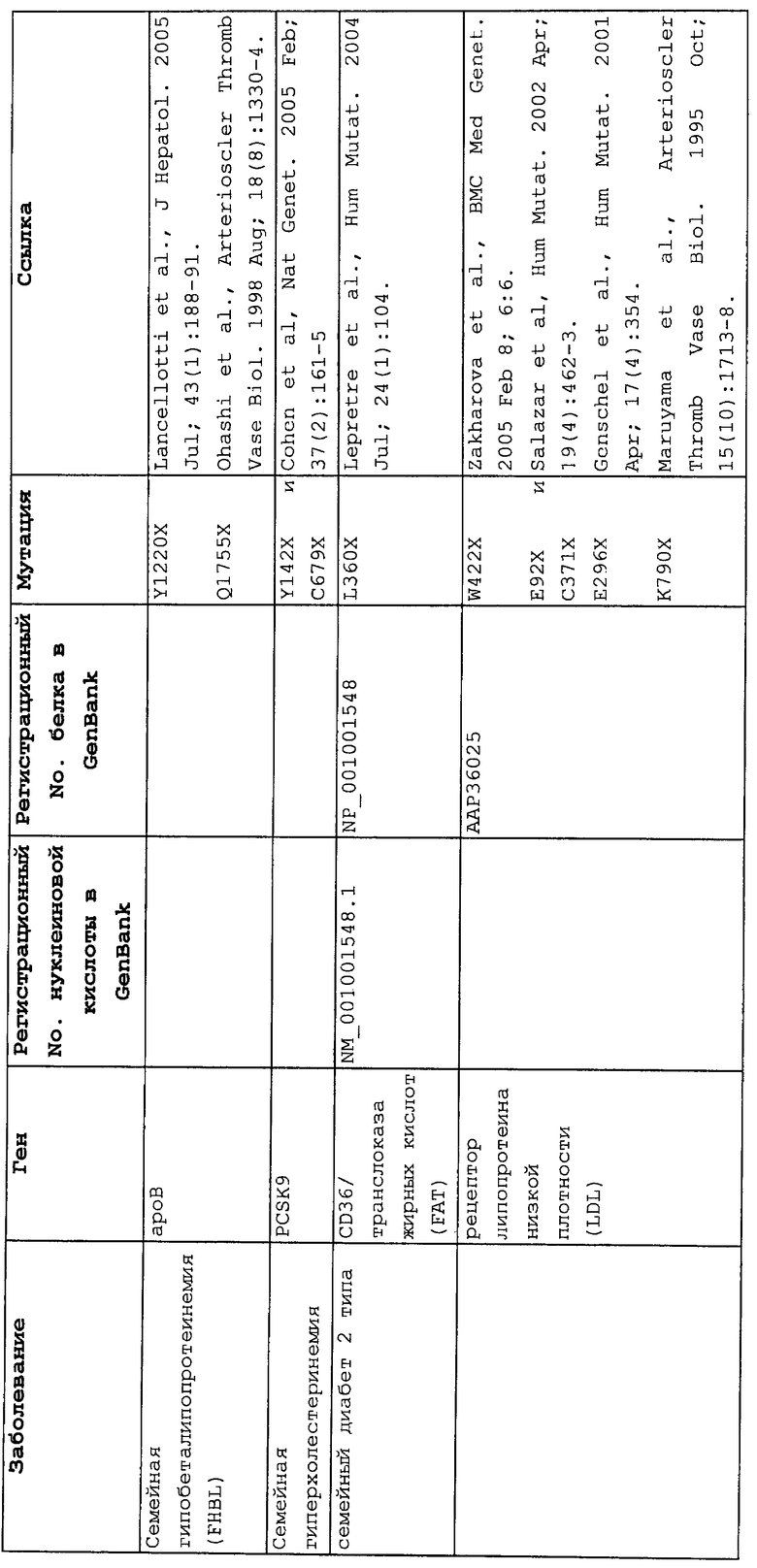
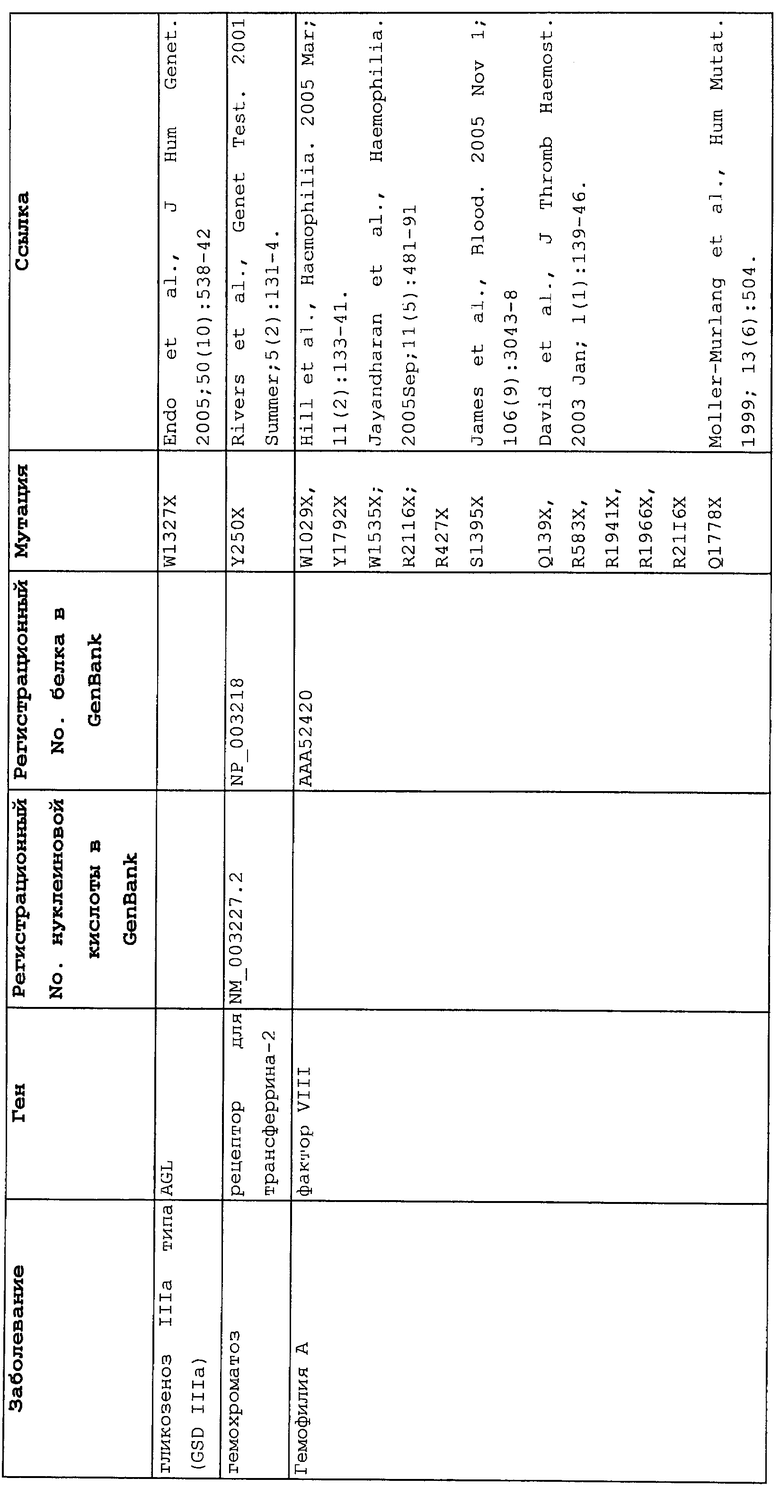
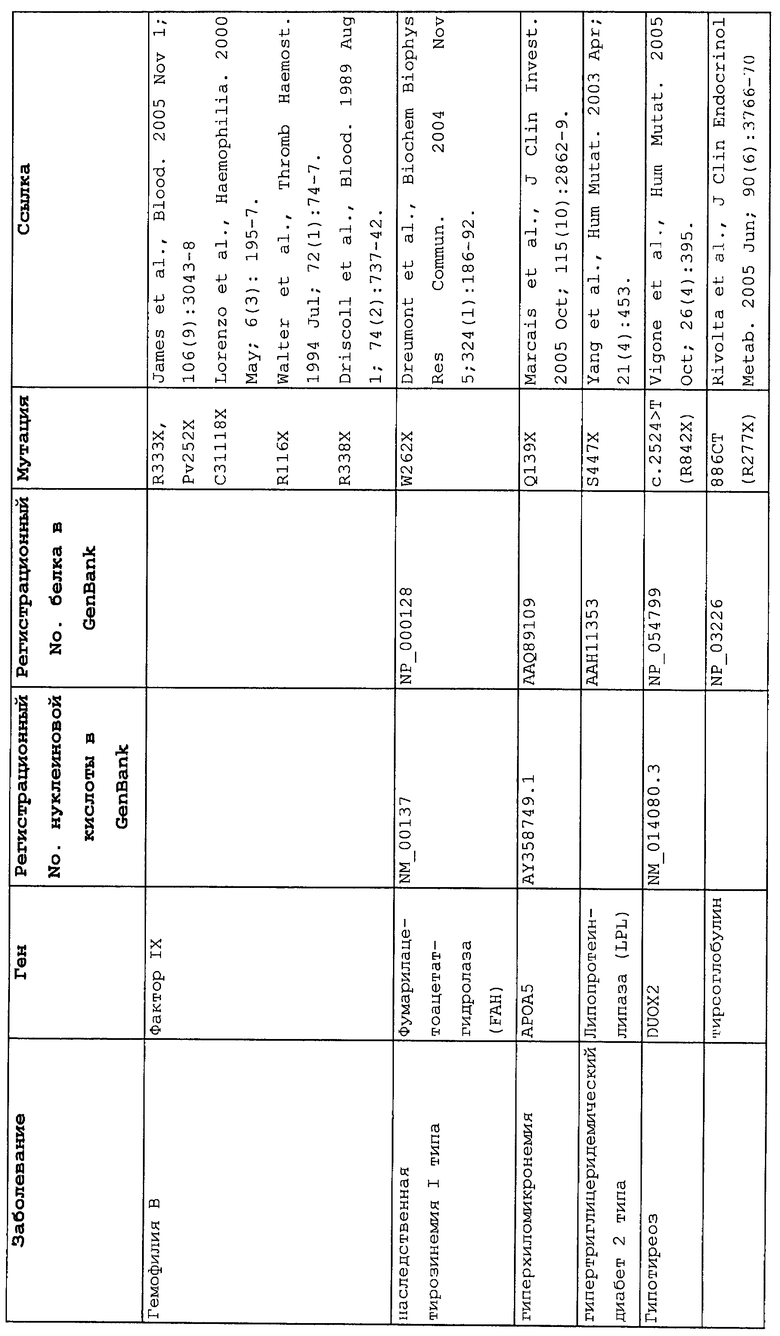
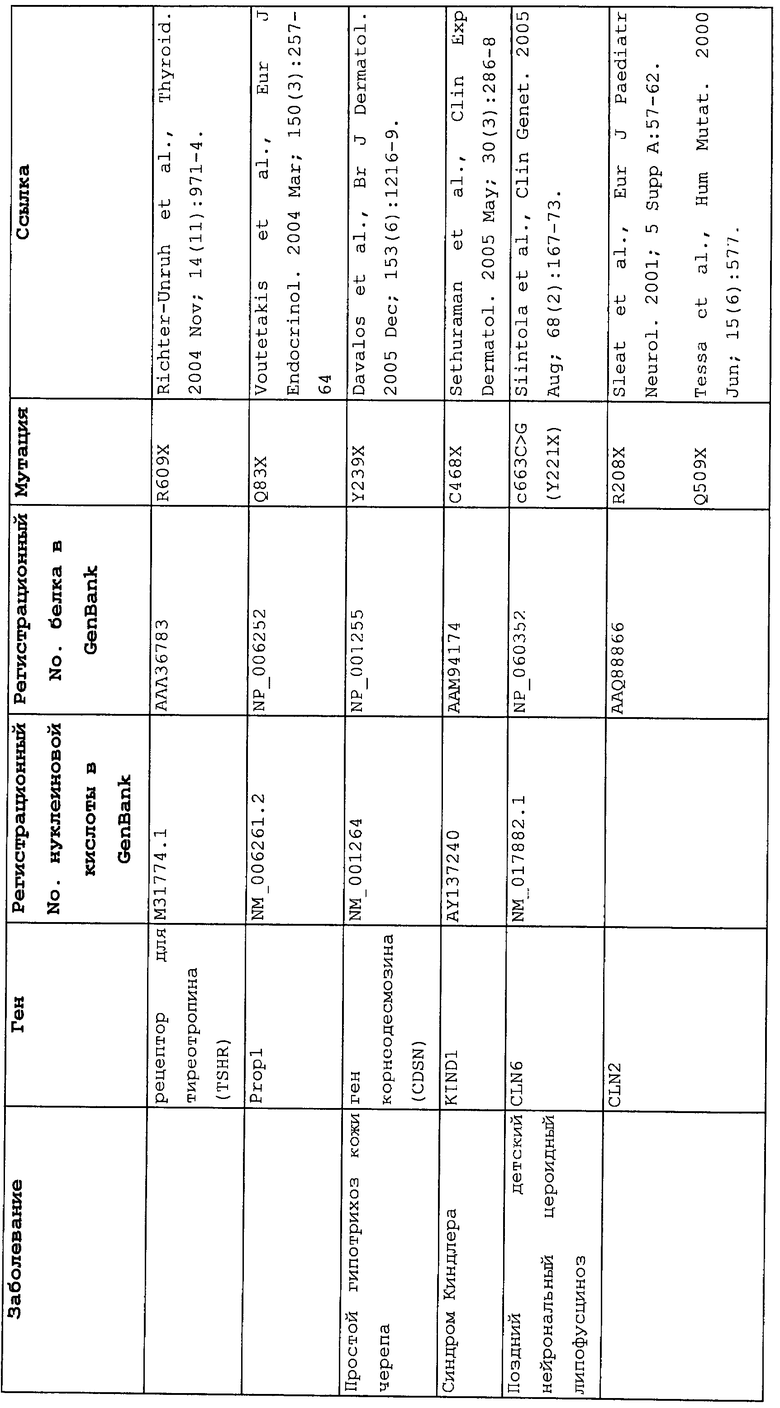
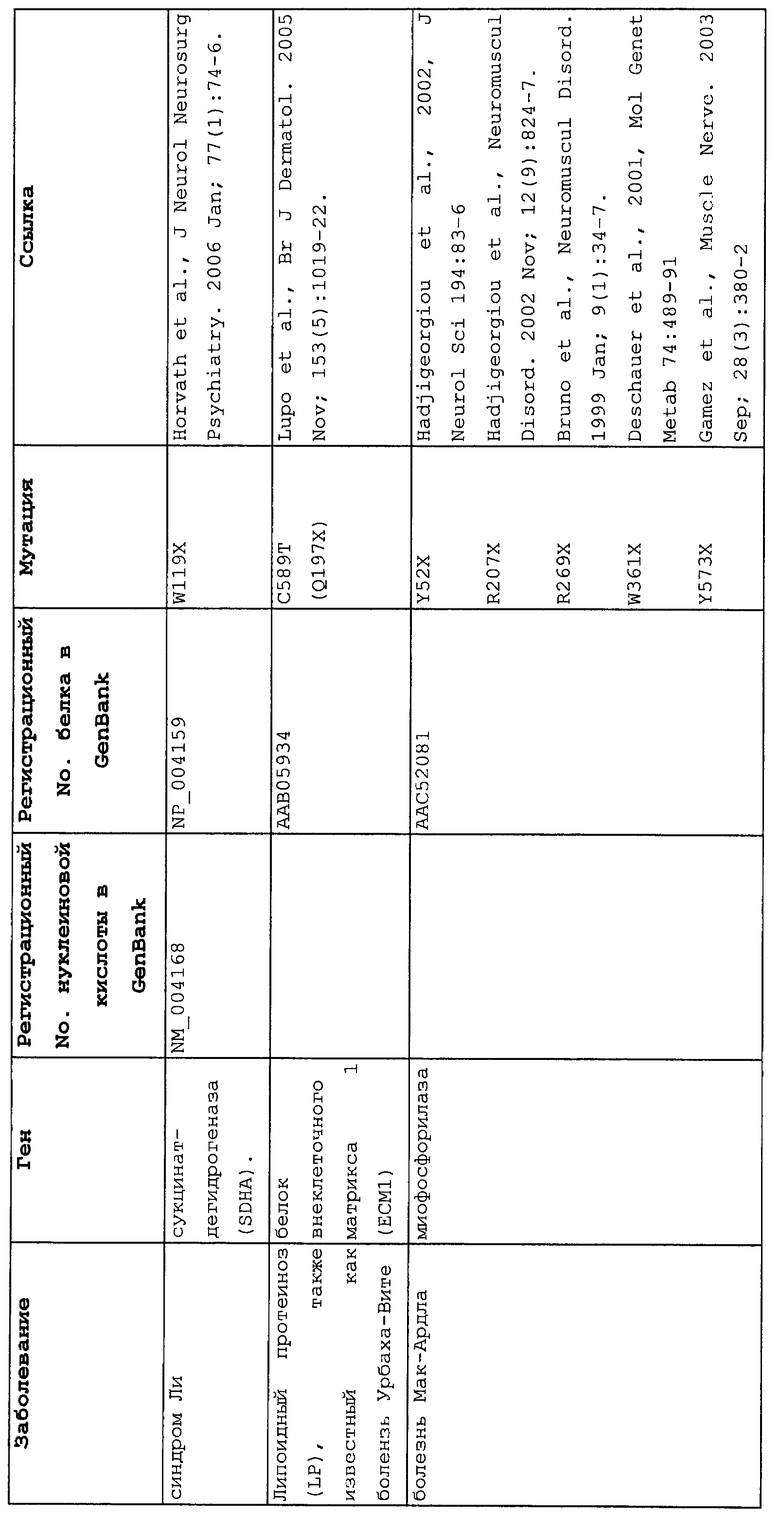
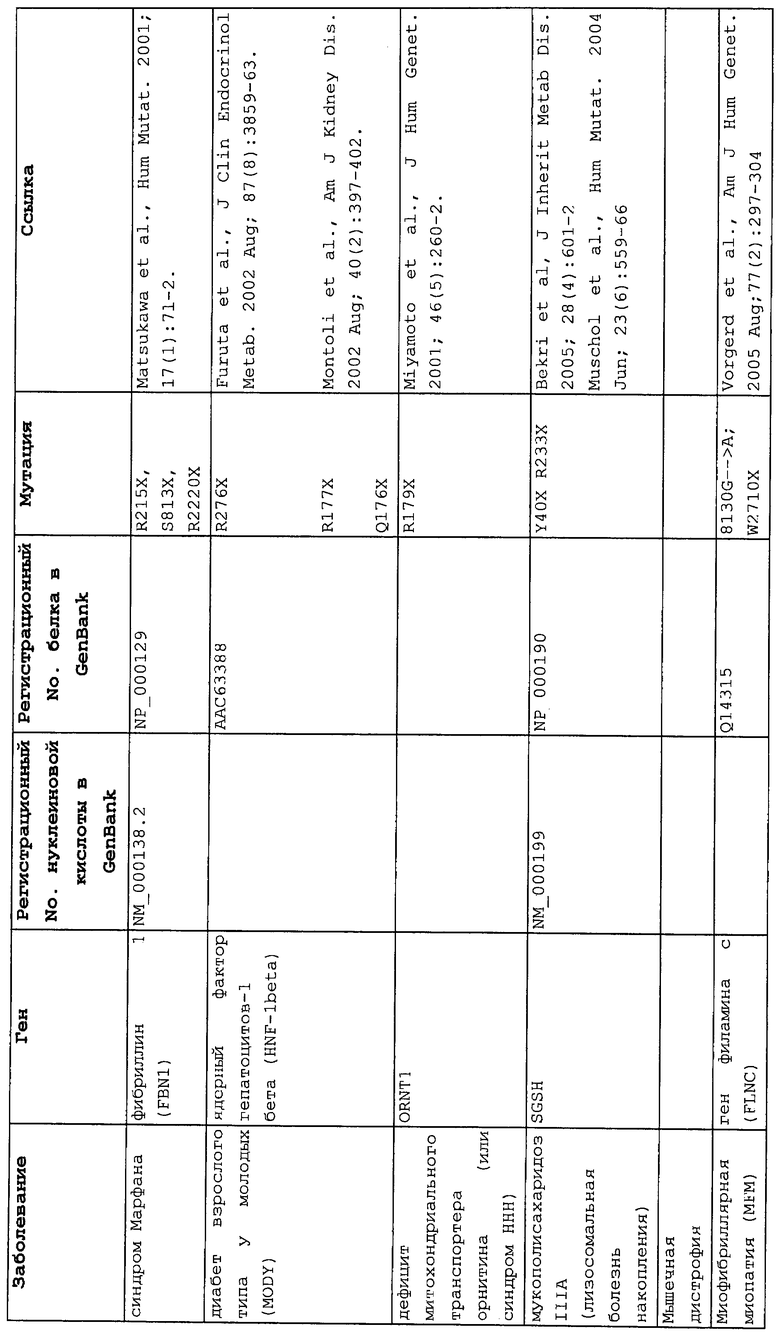
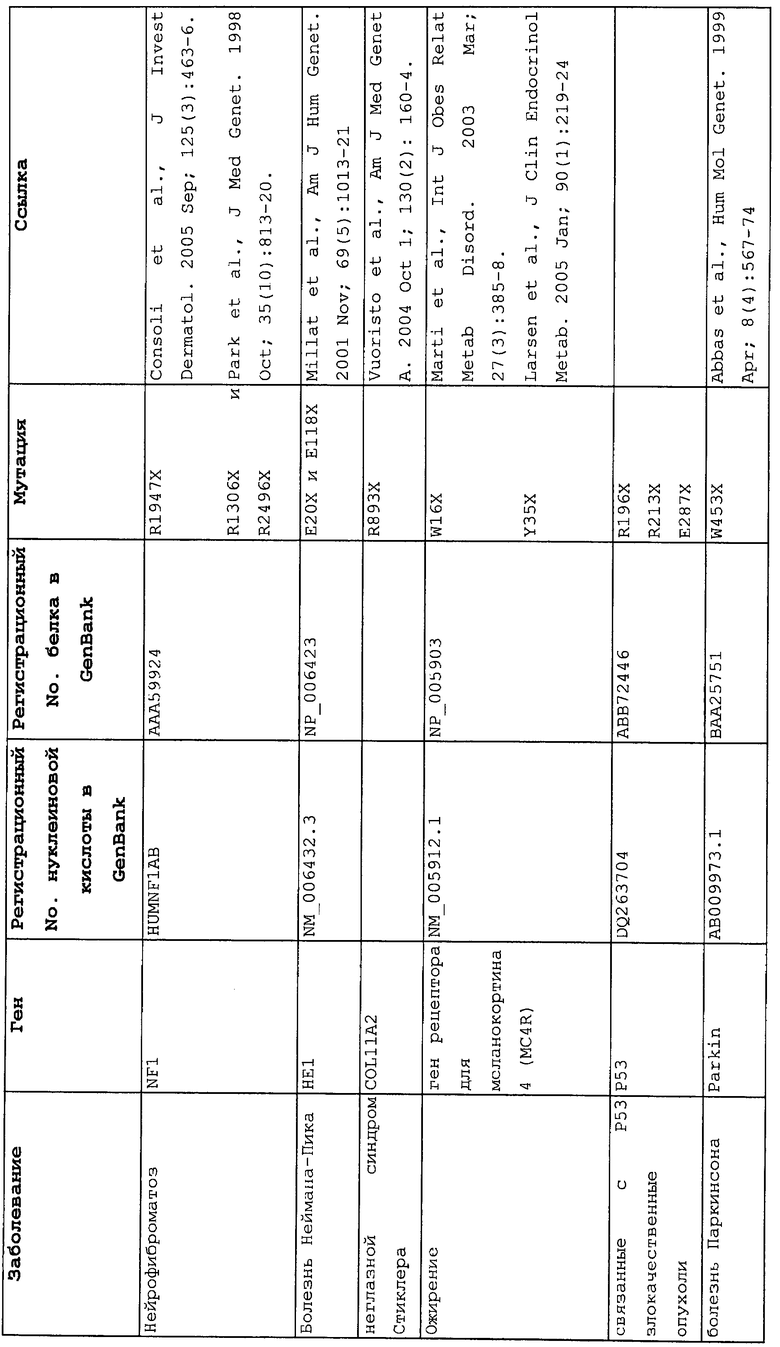
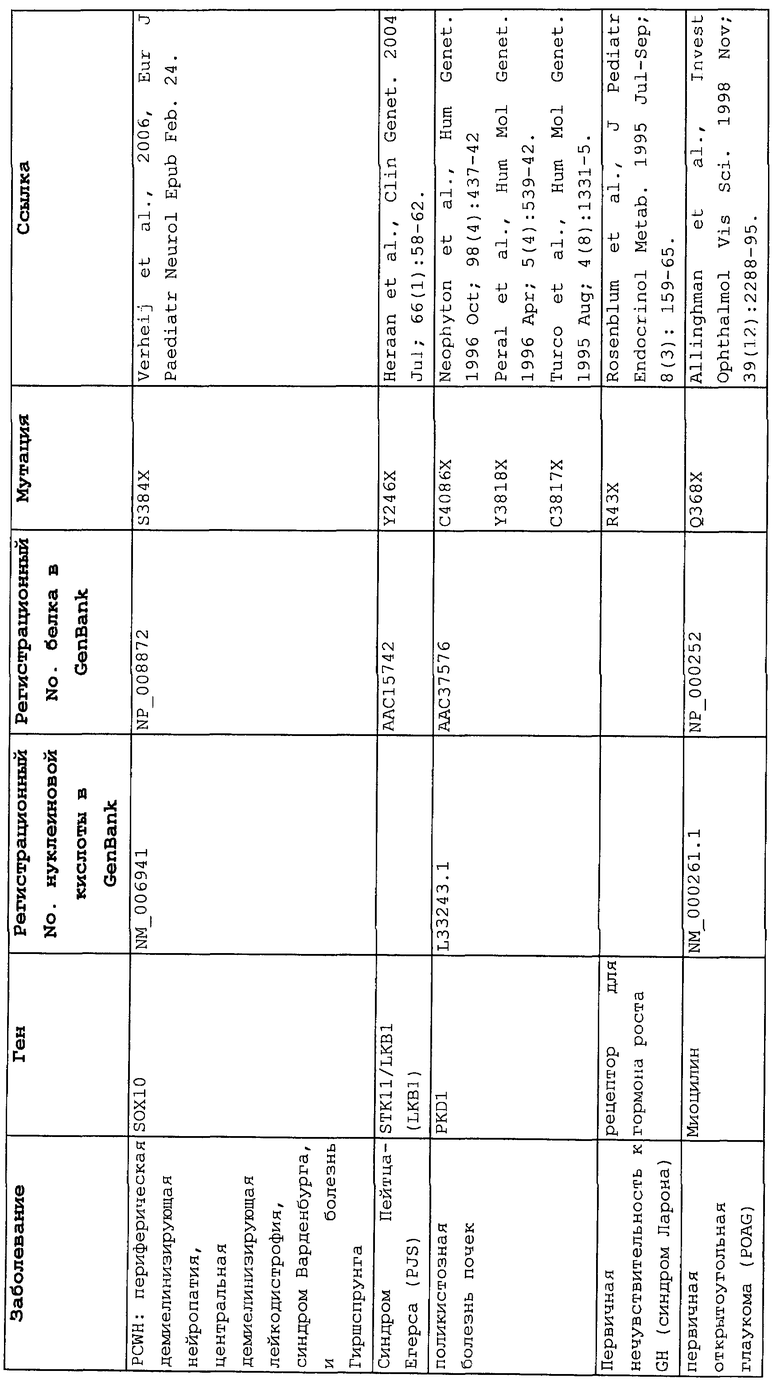
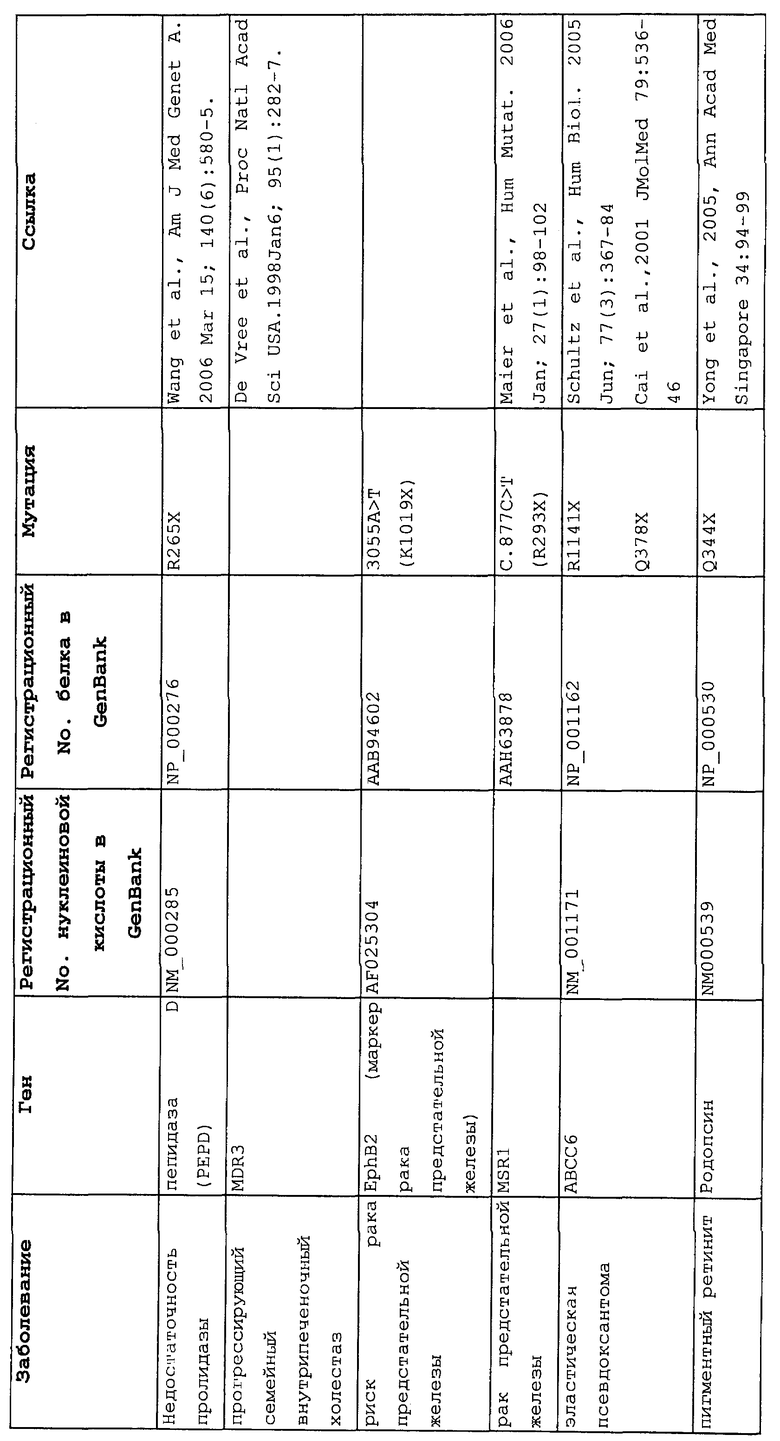
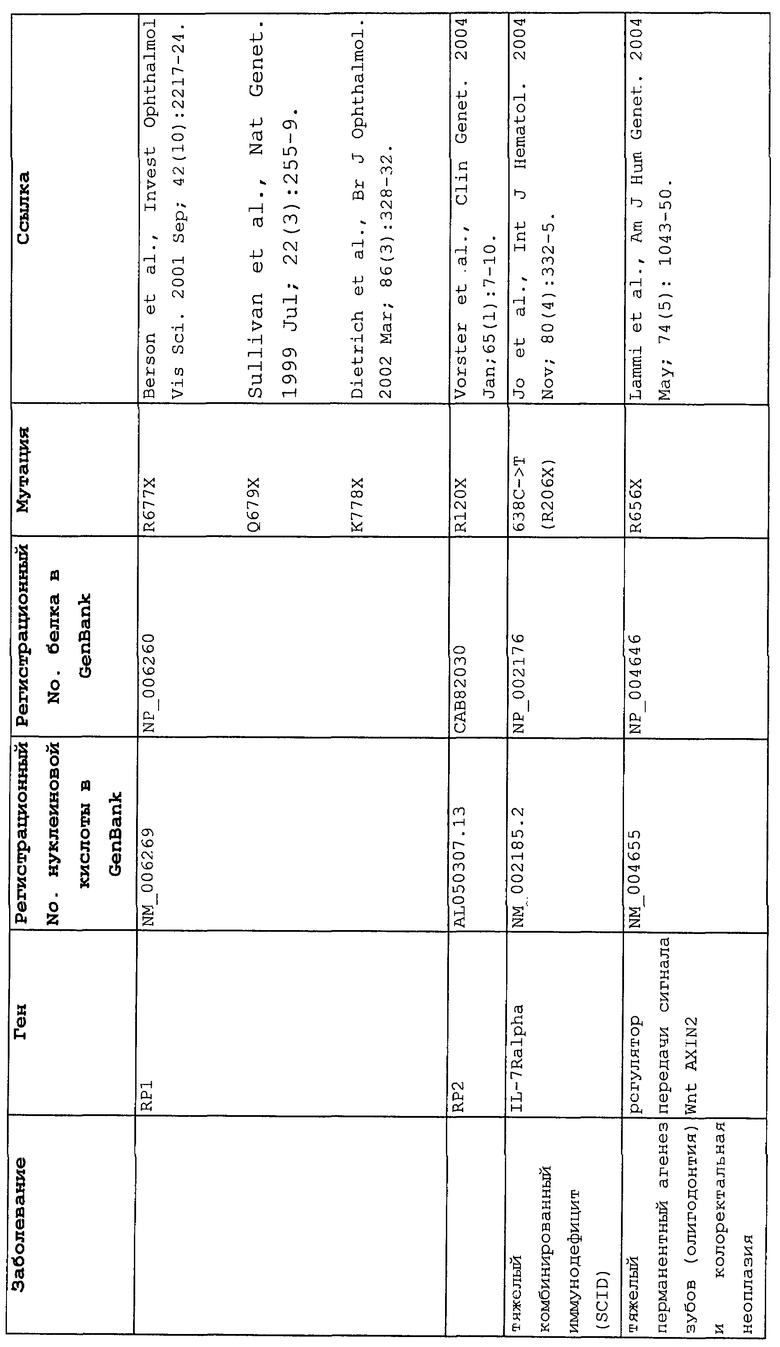

| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ МАЛЫЕ МОЛЕКУЛЫ ДЛЯ ЦЕЛЕНАПРАВЛЕННОГО РАСЩЕПЛЕНИЯ НЕ ПОДДАЮЩЕГОСЯ ЦЕЛЕНАПРАВЛЕННОМУ ВОЗДЕЙСТВИЮ KRAS В ТЕРАПИИ РАКА | 2021 |
|
RU2839932C1 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2677276C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ МОДУЛЯТОРОВ ИЗОФОРМ PIЗ-КИНАЗЫ | 2014 |
|
RU2705204C2 |
| РЕПРОГРАММИРОВАНИЕ ЭФФЕКТОРНЫХ БЕЛКОВЫХ ВЗАИМОДЕЙСТВИЙ ДЛЯ ИСПРАВЛЕНИЯ ЭПИГЕНЕТИЧЕСКИХ ДЕФЕКТОВ В ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2013 |
|
RU2637441C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ МОДУЛЯТОРОВ ИЗОФОРМ PI3-КИНАЗЫ | 2013 |
|
RU2702908C2 |
| ИНДУКТОР СЧИТЫВАНИЯ И ТЕРАПЕВТИЧЕСКИЙ АГЕНТ ДЛЯ ГЕНЕТИЧЕСКИХ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ МУТАЦИЯМИ ТИПА НОНСЕНС-МУТАЦИЙ | 2011 |
|
RU2571060C2 |
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ CXCR4 | 2012 |
|
RU2638802C2 |
| СПОСОБЫ ПОВЫШЕНИЯ РОСТА ПАЦИЕНТОВ ДЕТСКОГО ВОЗРАСТА С ХОЛЕСТАТИЧЕСКИМ ЗАБОЛЕВАНИЕМ ПЕЧЕНИ | 2020 |
|
RU2822484C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ХОЛЕСТАЗА | 2020 |
|
RU2829466C2 |
| ПРИМЕНЕНИЕ СТАБИЛИЗАТОРОВ HIF-АЛЬФА ДЛЯ УСИЛЕНИЯ ЭРИТРОПОЭЗА | 2004 |
|
RU2414214C2 |
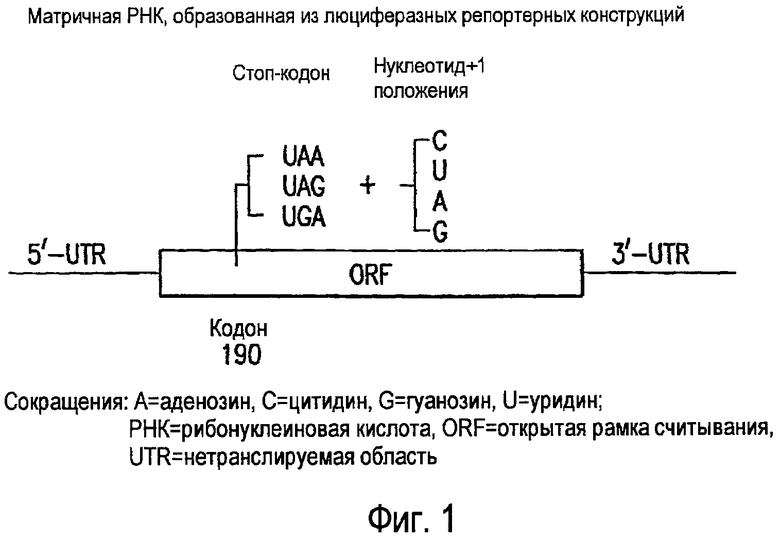
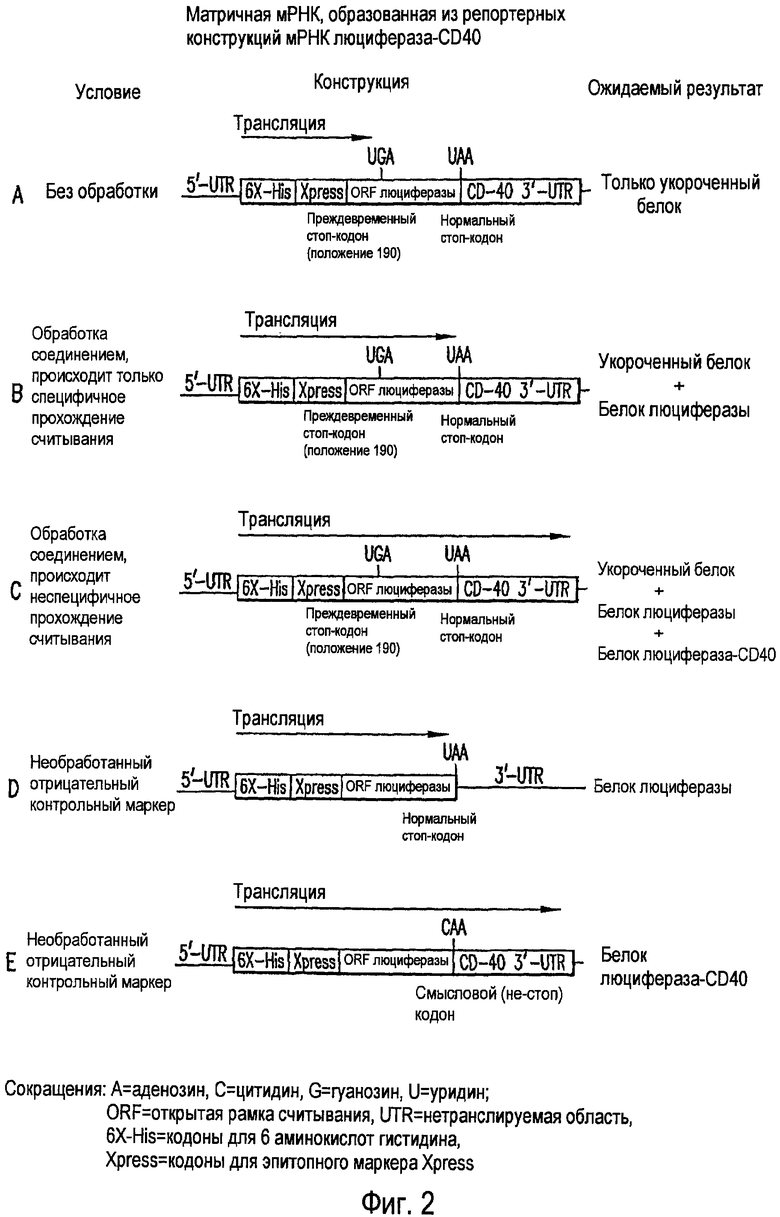
Группа изобретений относится к медицине и касается лечения заболеваний, обусловленных нонсенс-мутацией(ями): мышечной дистрофии Дюшенна и кистозного фиброза. Предложено применение 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата в приготовлении лекарственного средства для лечения мышечной дистрофии Дюшенна, обусловленной нонсенс-мутацией в положении 1417, 3625 или 492 дистрофина; и кистозного фиброза, обусловленного нонсенс-мутацией в положении 414, 493, 1316, 553, 542, 1162, 122, 1455, 822, 60, 764, 1291, 849, 434, 88, 1158 или 6542 CTFR. Также предложено применение 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата в приготовлении лекарственного средства для продуцирования функционального белка с "прочитанным" терминатором у субъекта, имеющего мышечную дистрофию Дюшенна или кистозный фиброз. Применение 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты обеспечивает супрессию преждевременной терминации трансляции у субъекта, опосредуя считывание нонсенс-кодона и продуцируя функциональный белок в количестве, достаточном для лечения заболевания. 2 н. и 1 з.п. ф-лы, 3 ил., 18 табл., 16 пр.
1. Применение 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата в приготовлении лекарственного средства для применения в отношении субъекта для лечения:
а. мышечной дистрофии Дюшенна, где субъект имеет нонсенс-мутацию в положении 1417, 3625 или 492 дистрофина; или
b. кистозного фиброза, где субъект имеет нонсенс-мутацию в положении 414, 493, 1316, 553, 542, 1162, 122, 1455, 822, 60, 764, 1291, 849, 434, 88, 1158 или 6542 CTFR.
2. Применение 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты или ее фармацевтически приемлемой соли, сольвата или гидрата в приготовлении лекарственного средства для продуцирования функционального белка с "прочитанным" терминатором у субъекта, имеющего мышечную дистрофию или кистозный фиброз, где
а. функциональный белок с "прочитанным" терминатором у субъекта, имеющего мышечную дистрофию, обладает любым аминокислотным остатком в положении 1417 дистрофина за исключением лейцина, любым аминокислотным остатком в положении 3625 дистрофина за исключением глутамина, или любым аминокислотным остатком в положении 492 дистрофина за исключением глутамина;
b. функциональный белок с "прочитанным" терминатором у субъекта, имеющего кистозный фиброз, обладает любым аминокислотным остатком в положении 414 CFTR, за исключением глутамина, любым аминокислотным остатком в положении 493 CFTR за исключением глутамина, любым аминокислотным остатком в положении 1316 CFTR за исключением триптофана, любым аминокислотным остатком в положении 553 CFTR за исключением аргинина, любым аминокислотным остатком в положении 542 CFTR за исключением глицина, любым аминокислотным остатком в положении 1162 CFTR за исключением аргинина, любым аминокислотным остатком в положении 122 CFTR за исключением тирозина, любым аминокислотным остатком в положении 1455 CFTR за исключением серина, любым аминокислотным остатком в положении 822 CFTR за исключением глутаминовой кислоты, любым аминокислотным остатком в положении 60 CFTR за исключением глутаминовой кислоты, любым аминокислотным остатком в положении 764 CFTR за исключением аргинина, любым аминокислотным остатком в положении 1291 CFTR за исключением глутамина, любым аминокислотным остатком в положении 849 CFTR за исключением тирозина, любым аминокислотным остатком в положении 434 CFTR за исключением серина, любым аминокислотным остатком в положении 88 CFTR за исключением лейцина, любым аминокислотным остатком в положении 1158 CFTR за исключением аргинина или любым аминокислотным остатком в положении 6542 CFTR за исключением глицина.
3. Применение по п.1 или 2, где соединение присутствует в эффективном количестве, и где эффективное количество составляет между 0,1 мг/кг и 500 мг/кг в сутки, которые разделены на три дозы, где первая и вторая дозы составляют по 25% от общего вводимого количества каждая, а третья доза составляет 50% от общего вводимого количества.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| 6,9-ДИЗАМЕЩЕННЫЕ 2-[ТРАНС-(-4-АМИНОЦИКЛОГЕКСИЛ)АМИНО]ПУРИНЫ | 1999 |
|
RU2191777C2 |
| ГЕН MTS, МУТАЦИИ ДАННОГО ГЕНА И СПОСОБЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ ПОСЛЕДОВАТЕЛЬНОСТИ ГЕНА MTS | 1995 |
|
RU2164419C2 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| KULYTÉ A | |||
| et al | |||
| Gene selective suppression of nonsense termination using antisense agents // Biochim Biophys Acta | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2012-09-27—Публикация
2007-03-29—Подача