Область техники, к которой относится изобретение
Настоящее изобретение относится к водной фармацевтической суспензии, содержащей ребамипид, которая может быть получена с помощью простого способа и может поддерживать состояние ребамипида в виде дисперсии мелкодисперсных частиц стабильным; и способ ее получения.
Уровень техники
Ребамипид обладает противовоспалительным и противоязвенным действием в желудочно-кишечном тракте и сейчас используется в качестве фармацевтического препарата. В дополнение к этому ребамипид имеет увеличивающее плотность бокаловидных клеток в роговице и конъюнктиве глаз действие, которое увеличивает выход муцина, являющегося ингредиентом слизи, и секрецию слизи и слезной жидкости. При этом роговица и конъюнктива могут защищаться или стабилизироваться. По этой причине ребамипид, как известно, является эффективным для профилактики и лечения заболевания глаз, вызываемого сухостью роговицы, которое упоминается как сухие глаза (JP-A-9-301866).
Однако ребамипид не имеет достаточной и долговременной стабильной растворимости в физиологически нейтральном диапазоне pH, где раздражающее и дисфункциональное отрицательное воздействие на глаза или ткань слизистой является низким, и по этой причине является невозможным получение препарата ребамипида как водного раствора, поскольку ребамипид представляет собой кислотное соединение. Альтернативно, является возможным получение водного раствора ребамипида с использованием поверхностно-активного вещества, такого как ионное поверхностно-активное вещество и неионное поверхностно-активное вещество, или солюбилизатора, такого как производное циклодекстрина. При введении препарата, однако, такое поверхностно-активное вещество или такой солюбилизатор может иметь биологический ингредиент в слизистой, растворенный в растворе, и может отрицательно влиять на активность ребамипида, которая представляет собой действие стабилизации и защиты слизистой оболочки.
В противоположность этому при использовании водной фармацевтической суспензии, содержащей диспергированный ребамипид, рассмотренное выше отрицательное свойство относительно низкой растворимости ребамипида преодолевается и по этой причине становится возможным получение препарата ребамипида. Ребамипид обычно существует в форме порошка, получаемого посредством агглютинации игольчатых кристаллов ребамипида (первичная частица, средний размер частицы: короткая измеряемая длина 0,1-0,5 мкм, длинная измеряемая длина 0,2-4 мкм), с формированием его вторичных частиц (средний размер частиц: примерно 10-50 мкм), и поэтому считается трудным получение суспензии ребамипида из мелкодисперсных частиц ребамипида. В литературе по этой причине для однородного диспергирования мелкодисперсных частиц агглютинированного ребамипида, который представляет собой вторичные частицы, является неизбежным добавление производного целлюлозы, которое представляет собой водорастворимый полимер, известный как суспендирующий агент поверхностно-активного вещества и тому подобное, к смеси, содержащей ребамипид, и интенсивное перемешивание смеси с использованием специального диспергирующего/суспендирующего устройства, такого как гомогенизатор высокого давления, коллоидная мельница, перемешивающее устройство турбинного типа, высокосдвиговое перемешивающее устройство и ультразвуковой диспергатор.
Кроме того, даже если является возможным диспергирование ребамипида как мелкодисперсных частиц в водном растворе, имеются некоторые проблемы при современном уровне техники, а именно мелкодисперсные частицы ребамипида будут повторно агглютинировать, когда пройдет время, необходимое для повторного формирования вторичных частиц или для увеличения кристаллической частицы, а преципитировавшие в суспензии частицы не диспергируются затем с легкостью обратно, как мелкодисперсные частицы.
При таком современном уровне техники является желательной разработка водной фармацевтической суспензии, содержащей ребамипид, так что ребамипид может стабильно диспергироваться как мелкодисперсные частицы с использованием простого способа, и мелкодисперсные частицы не могут агглютинировать обратно.
Описание изобретения
Проблема, которая должна решаться с помощью настоящего изобретения
Настоящее изобретение обеспечивает преодоление рассмотренных выше проблем, известных из уровня техники. Настоящее изобретение предусматривает водную фармацевтическую суспензию, содержащую ребамипид, которая может быть получена с помощью простого способа и может поддерживать диспергированное состояние мелкодисперсных частиц ребамипида стабильно, без агглютинации мелкодисперсных частиц. Это является целью настоящего изобретения.
Средства для решения проблемы
Авторы настоящего изобретения провели исследования для достижения указанной выше цели и обнаружили, что добавление поливинилового спирта вместе с ребамипидом к водному раствору обеспечивает мелкодисперсные частицы ребамипида, равномерно диспергированные в водном растворе, без использования конкретного диспергирующего или суспендирующего устройства, и полученная суспензия может храниться в стабильном суспендированном состоянии без повторной агглютинации мелкодисперсных частиц ребамипида. Настоящее изобретение осуществляется на основании новых данных и дальнейших дополнительных усовершенствований.
Настоящее изобретение предусматривает водную фармацевтическую суспензию, содержащую ребамипид, и способ ее получения, как рассматривается ниже.
[1] Водная суспензия, содержащая ребамипид и поливиниловый спирт.
[2] Водная суспензия по [1], дополнительно содержащая соединение соли натрия.
[3] Водная суспензия по [1] или [2], где ребамипид составляет 0,1-30% масс/объем и поливиниловый спирт составляет 0,1-4% масс/объем.
[4] Водная суспензия по любому из [1]-[3], которая представляет собой офтальмологическую композицию.
[5] Способ получения водной суспензии, содержащей ребамипид, который включает в себя
(1) первую стадию: смешивание воды и поливинилового спирта с получением водного раствора, содержащего поливиниловый спирт, и
(2) вторую стадию: добавление ребамипида к водному раствору, содержащему поливиниловый спирт, полученному на первой стадии, и перемешивание смеси с получением водной суспензии, содержащей ребамипид.
Сущность изобретения
Согласно водной фармацевтической суспензии по настоящему изобретению ребамипид однородно диспергируется до состояния с мелкодисперсными частицами и полученная суспензия может храниться в стабильно диспергированном состоянии без повторной агглютинации мелкодисперсных частиц ребамипида и увеличения кристаллических частиц, даже если хранить ее в течение длительного времени. Даже когда ребамипид преципитирует, является возможным, чтобы равномерно диспергированное состояние мелкодисперсных кристаллических частиц легко восстанавливалось посредством встряхивания вручную.
В дополнение к этому водная фармацевтическая суспензия по настоящему изобретению содержит поливиниловый спирт и по этой причине не является необходимым использование диспергирующего/суспендирующего устройства для интенсивного перемешивания, такого как гомогенизатор, коллоидная мельница, перемешивающее устройство турбинного типа, высокосдвиговое перемешивающее устройство и ультразвуковой диспергатор, а достаточно использовать обычное перемешивание, то есть простое перемешивание для диспергирования ребамипида, который агглютинировал с формированием вторичных частиц, в состояние мелкодисперсных частиц. По этой причине водная фармацевтическая суспензия по настоящему изобретению также имеет целью композицию, полученную с помощью простого способа.
Краткое описание чертежей
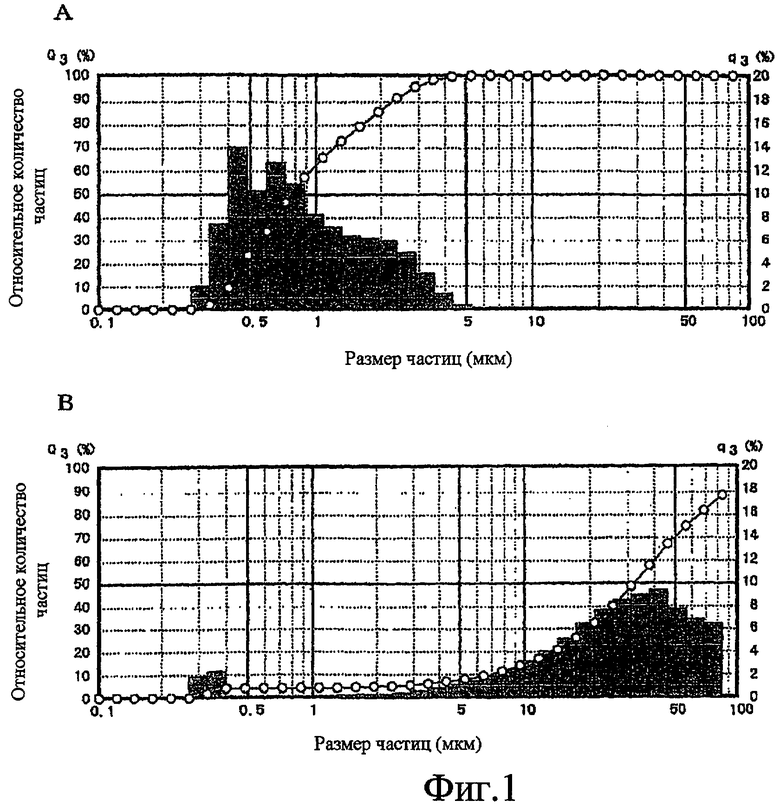
Фиг.1 показывает результаты, когда распределение частиц ребамипида измеряется в Эксперименте 2 (Q3: кумулятивное распределение (%), линейный график; q3: частотное распределение (%), столбчатая диаграмма). На фиг.1 "A" показывает распределение частиц суспензии ребамипида в Примере 12 и "B" показывает распределение частиц суспензии ребамипида в Сравнительном примере 1.
Подробное описание предпочтительных вариантов осуществления
Водная фармацевтическая суспензия по настоящему изобретению содержит ребамипид в качестве фармацевтически активного ингредиента.
Порошок активного ингредиента ребамипида, используемый в настоящем изобретении, как правило, существует в состоянии вторичных частиц (средний размер частиц: примерно 10-50 мкм), который формируется посредством агглютинации первичных частиц ребамипида (игольчатый кристалл, средний размер частиц: короткая измеряемая длина 0,1-0,5 мкм, длинная измеряемая длина 0,2-4 мкм). В водной фармацевтической суспензии по настоящему изобретению наличие поливинилового спирта позволяет ребамипиду сохраняться в стабильном диспергированном состоянии, при котором ребамипид диспергируется до мелкодисперсных частиц, у которых средний размер частиц составляет 0,1-10 мкм, предпочтительно, 0,2-5 мкм. Здесь средний размер частиц (мкм) может вычисляться в соответствии со следующим способом. То есть с использованием данных о распределении частиц, которое измеряется с помощью лазерного дифракционного рассеивания, диапазон размеров частиц (максимальный размер частиц: x1, минимальный размер частиц: xn+1) делят на "n", его вычисляют в соответствии со следующей формулой с получением его среднего значения. Это значение определяется как "средний размер частиц".
Среднее значение = 10μ,
где 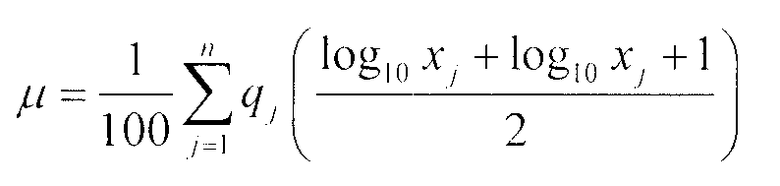
xj: размер частиц,
qj: % различия (частотное распределение).
Количество ребамипида, содержащееся в водной фармацевтической суспензии по настоящему изобретению, может устанавливаться соответствующим образом в зависимости от части тела, которая подлежит лечению, способа введения и так далее; например, предпочтительно, 0,1-30% масс/объем, более предпочтительно, 0,3-10% масс/объем.
Кроме того, водная фармацевтическая суспензия по настоящему изобретению содержит поливиниловый спирт для получения указанного выше стабильно диспергированного ребамипида в состоянии мелкодисперсных частиц.
Степень омыления поливинилового спирта, используемого в настоящем изобретении, не ограничивается и может использоваться частично омыленный или полностью омыленный поливиниловый спирт, и частично омыленный поливиниловый спирт является предпочтительным, поскольку частично омыленный спирт увеличивает диспергируемость ребамипида гораздо сильнее. Поливиниловый спирт, используемый в настоящем изобретении, включает в себя частично омыленный поливиниловый спирт, предпочтительно имеющий среднюю степень омыления 70-94% (моль), наиболее предпочтительно, 85-90%(моль). Средняя степень омыления получается с помощью измерения в соответствии с JIS K 6726 3.5.
Вязкость водорастворимого поливинилового спирта, используемого в настоящем изобретении (20°C, концентрация: 4% масс/масс, вязкость водного раствора, далее упоминается как "вязкость при 4%/20°C), составляет, но, не ограничиваясь этим, предпочтительно, 3-110 мПа·сек, в частности, 20-60 мПа·сек. Вязкость при 4%/20°C, рассмотренная здесь, представляет собой измеряемое значение в соответствии с определением вязкости, описанной в Фармакопее Японии XIV (общие исследования, определение вязкости, способ I измерения вязкости с помощью капиллярного трубчатого вискозиметра). Практический способ показан следующим образом: (1) получение 4% масс/масс поливинилового спирта в воде, который загружается в капиллярный трубчатый вискозиметр (вискозиметр типа Уббелоде) с поддержанием его на водяной бане с постоянной температурой 20°C (±0,1°C) в течение 20 минут, (2) регистрация времени, t(сек), необходимого для падения мениска образца раствора от верхней отмеченной линии капиллярного трубчатого вискозиметра до нижней, и (3) вычисление вязкости при 4%/20°C с использованием следующей формулы, с помощью измеренного значения.
Кинематическая вязкость ν = K (константа вискозиметра, мм2/сек2) × t (время измерения, сек)
Вязкость η (вязкость при 4%/20°C) = ν (кинематическая вязкость) × ρ (плотность образца жидкости, г/мл)
= K (константа вискозиметра, мм2/сек2) × t (время измерения, сек) × ρ (плотность образца жидкости, г/мл)
Отношение смешивания поливинилового спирта в водной фармацевтической суспензии по настоящему изобретению может соответствующим образом изменяться в зависимости от отношения смешивания ребамипида или от вида используемого поливинилового спирта, и, например, оно составляет предпочтительно, 0,1-4% масс/объем, более предпочтительно, 0,3-2% масс/объем.
Для того чтобы гомогенно и стабильно диспергировать ребамипид до состояния мелкодисперсных частиц, водная фармацевтическая суспензия по настоящему изобретению, в которой отношение смешивания между ребамипидом и поливиниловым спиртом относится к рассмотренному выше отношению смешивания, и в дополнение к этому, отношение смешивания поливинилового спирта составляет 2-4000 по массе, предпочтительно, 10-1000 по массе по отношению к 100 массовым частям ребамипида, представляет предпочтительный вариант осуществления.
В водной фармацевтической суспензии по настоящему изобретению повторная агглютинация ребамипида, который находится в состоянии первичных частиц, может предотвращаться гораздо более эффективно, когда суспензия содержит, в дополнение к ребамипиду и поливиниловому спирту, соединение соли металла и/или соединение Трис соли, которые являются растворимыми в водном растворе.
Здесь соединение соли металла, которое растворимо в водном растворе, не ограничивается до тех пор, пока оно является фармацевтически приемлемым, включая, например, соединение соли натрия, такое как хлорид натрия, фосфат натрия, дигидрофосфат натрия, сукцинат натрия, тартрат натрия, гидроксид натрия, ацетат натрия, карбонат натрия и цитрат натрия; соединение соли калия, такое как хлорид калия, фосфат калия, дигидрофосфат калия, сукцинат калия, тартрат калия, гидроксид калия, ацетат калия, карбонат калия и цитрат калия; соединение соли кальция, такое как хлорид кальция, гидроксид кальция, карбонат кальция и цитрат кальция; и соединение соли магния, такие как хлорид магния, гидроксид магния, карбонат магния и цитрат магния. Также соединение Трис соли, которое является растворимым в водном растворе, не ограничивается до тех пор, пока оно является фармацевтически приемлемым, включая, например, трис(2-амино-2-гидроксиметил-1,3-пропандиол).
Среди соединений солей металлов и/или соединений Трис солей соединение соли натрия, в частности хлорид натрия, предпочтительно используется в препарате водной суспензии по настоящему изобретению, поскольку оно имеет сильное действие предотвращения повторной агглютинации диспергированного ребамипида в состоянии мелкодисперсных частиц.
Препарат водной суспензии по настоящему изобретению может содержать один вид соединения соли металла и/или соединения Трис соли; или 2 или более видов соединений солей металлов и/или соединений Трис солей.
В случае, когда соединение соли металла и/или соединение Трис соли добавляют к суспензии, концентрация указанного соединения соли металла и/или соединения Трис соли в препарате водной суспензии не является ограниченной и включает в себя, например, 0,01-3% масс/объем, предпочтительно, 0,1-2% масс/объем, в целом.
Осмотическое давление препарата водной суспензии по настоящему изобретению не ограничивается до тех пор, пока оно является физиологически приемлемым. Например, в случае, когда препарат водной суспензии по настоящему изобретению используется в офтальмологическом препарате, осмотическое давление используемого препарата, как правило, равно 150-600 мОсм/кг, предпочтительно 200-400 мОсм/кг, более предпочтительно, 245-365 мОсм/кг. Осмотическое давление может устанавливаться способом, известным в данной области, с помощью рассмотренного выше соединения соли металла и/или соединения Трис соли; или сахара, сахарного спирта, многоатомного спирта и тому подобное.
pH препарата водной суспензии по настоящему изобретению не ограничивается до тех пор, пока он является фармацевтически приемлемым, и включает в себя, например, 3,0-9,0, предпочтительно, 5,0-7,0. pH может устанавливаться способом, известным в данной области, с помощью регулятора pH, такого как лимонная кислота, фосфорная кислота, уксусная кислота, ее соль, хлористоводородная кислота и гидроксид натрия.
Композиция водной суспензии по настоящему изобретению может содержать другие активные фармацевтические ингредиенты, консервант, охлаждающее средство, поверхностно-активное вещество, ароматизатор, красящий агент, хелатирующий агент, буфер, загуститель и тому подобное, в дополнение к рассмотренным выше ингредиентам, до тех пор, пока они не влияют отрицательно на эффект настоящего изобретения. Примеры консерванта, приемлемого в препарате водной суспензии по настоящему изобретению, включают в себя парабены, такие как метилпарабен, этилпарабен и бутилпарабен; соединения четвертичного аммония, такие как бензалконийхлорид, и бензетонийхлорид; гуанидиновые гермициды, такие как хлоргексидин глюконат; эдетат натрия; и тому подобное.
Композиция водной суспензии по настоящему изобретению предпочтительно адаптируется как препарат для слизистой, такой как офтальмологический препарат, назальный спрей и препарат для ингаляций, который представляет собой распыляемый препарат для пульмонарного введения, распыляемый с помощью распылительного устройства для ингаляции, а также как пероральный препарат, препарат для инъекций, и тому подобное. Препарат водной суспензии по настоящему изобретению, более предпочтительно, используется как офтальмологический препарат.
Кроме того, желатинизирующий агент, загуститель, основа мази и тому подобное могут добавляться к препарату водной суспензии по настоящему изобретению для получения требуемой формы геля или мази.
Композиция водной суспензии по настоящему изобретению может быть получена посредством смешивания заранее заданного количества ребамипида, поливинилового спирта и необязательных других ингредиентов с фармацевтически приемлемой водой (предпочтительно, очищенной водой или водой для инъекций). В качестве предпочтительного способа получения препарата водной суспензии по настоящему изобретению представлен следующий способ, включающий в себя первую стадию и вторую стадию:
(1) первая стадия: смешивание воды и поливинилового спирта с получением водного раствора, содержащего поливиниловый спирт, и
(2) вторая стадия: добавление ребамипида к водному раствору, содержащему поливиниловый спирт, полученному на первой стадии, и перемешивание смеси с получением водной фармацевтической суспензии, содержащей ребамипид.
Ингредиенты иные, чем ребамипид и поливиниловый спирт, могут добавляться либо на первой стадии, либо на второй стадии. На второй стадии является возможным равномерное диспергирование ребамипида в состоянии мелкодисперсных частиц просто с помощью слабого перемешивания с использованием лопастной мешалки общего назначения (необязательно использовать специальное сильное перемешивание), поскольку порошкообразный ребамипид в агглютинированном состоянии, который формирует его вторичные частицы, очень хорошо диспергируется как мелкодисперсные частицы под действием поливинилового спирта.
Пример
Далее, настоящее изобретение дополнительно иллюстрируется с помощью следующих далее примеров, которые не должны рассматриваться как ограничивающие изобретение. Поливиниловый спирт, используемый в следующих далее Примерах 1-4 и 7-12, представляет собой "Poval 224C™" (KURARAY CO., LTD.) (степень омыления:86-89%(моль), вязкость при 4%/20°C:20-48 мПа·сек). Кроме того, поливиниловый спирт, используемый в следующих далее Примерах 5-6, представляет собой "Polyvinylalcohol USP™" (Spectrum Quality Product, USA) (степень омыления: 86-89% (моль), вязкость при 4%/20°C: 20-48 мПа·сек).
Пример 1: Офтальмологический препарат
Все указанные выше ингредиенты, за исключением ребамипида, растворяют в очищенной воде при нагревании, полученный раствор фильтруют через асептический фильтр, а затем ребамипид, стерилизованный с помощью асептических манипуляций, добавляют к фильтрату, а затем смесь перемешивают с помощью магнитной мешалки с получением водной фармацевтической суспензии. Водную фармацевтическую суспензию асептически распределяют в 5-15 мл пластиковые емкости с получением офтальмологического препарата.
Пример 2: Офтальмологический препарат
Все указанные выше ингредиенты, за исключением ребамипида, растворяют в очищенной воде при нагревании, полученный раствор фильтруют через асептический фильтр, а затем ребамипид, стерилизованный с помощью асептических манипуляций, добавляют к фильтрату, а затем смесь перемешивают с помощью магнитной мешалки с получением водной фармацевтической суспензии. Водную фармацевтическую суспензию асептически распределяют в 5-15-мл пластиковые емкости с получением офтальмологического препарата.
Пример 3: Офтальмологический препарат:
Все указанные выше ингредиенты, за исключением ребамипида, растворяют в очищенной воде при нагревании, полученный раствор фильтруют через асептический фильтр, а затем ребамипид, стерилизованный с помощью асептических манипуляций, добавляют к фильтрату. Затем смесь перемешивают с помощью магнитной мешалки с получением водной фармацевтической суспензии. Водную фармацевтическую суспензию асептически распределяют в 0,3-1-мл пластиковые емкости для однократного дозирования с получением офтальмологического препарата.
Пример 4: Офтальмологический препарат
Все указанные выше ингредиенты, за исключением ребамипида, растворяют в очищенной воде при нагревании, полученный раствор фильтруют через асептический фильтр, а затем ребамипид, стерилизованный с помощью асептических манипуляций, добавляют к фильтрату. Затем смесь перемешивают с помощью магнитной мешалки с получением водной фармацевтической суспензии. Водную фармацевтическую суспензию асептически распределяют в 0,3-1-мл пластиковые емкости для однократного дозирования с получением офтальмологического препарата.
Пример 5: Офтальмологический препарат
Все указанные выше ингредиенты, за исключением ребамипида, растворяют в очищенной воде при нагревании, полученный раствор фильтруют через асептический фильтр, а затем ребамипид, стерилизованный с помощью асептических манипуляций, добавляют к фильтрату и затем смесь перемешивают с помощью магнитной мешалки с получением водной фармацевтической суспензии. Водную фармацевтическую суспензию асептически распределяют в 0,3-1-мл пластиковые емкости для однократного дозирования с получением офтальмологического препарата.
Пример 6 : Офтальмологический препарат
Все указанные выше ингредиенты, за исключением ребамипида, растворяют в очищенной воде при нагревании, полученный раствор фильтруют через асептический фильтр, а затем ребамипид, стерилизованный с помощью асептических манипуляций, добавляют к фильтрату и затем смесь перемешивают с помощью магнитной мешалки, с получением водной фармацевтической суспензии. Полученную таким образом водную фармацевтическую суспензию асептически распределяют в 0,3-1-мл пластиковые емкости для однократного дозирования с получением офтальмологического препарата.
Пример 7: Препарат для ингаляций
Все указанные выше ингредиенты, за исключением ребамипида, растворяют в очищенной воде при нагревании, полученный раствор фильтруют через асептический фильтр, а затем ребамипид, стерилизованный с помощью асептических манипуляций, добавляют к фильтрату и затем смесь перемешивают с помощью магнитной мешалки с получением водной фармацевтической суспензии. Водную фармацевтическую суспензию асептически распределяют в 10-50-мл пластиковые или стеклянные емкости с получением препарата для ингаляций. В случае использования препарата для ингаляций 2-3 мл препарата для ингаляций инжектируется в распылитель с помощью пипетки, распыляется, а затем вдыхается пациентом при введении.
Пример 8 : Препарат для ингаляций
Все указанные выше ингредиенты, за исключением ребамипида, растворяют в очищенной воде при нагревании, полученный раствор фильтруют через асептический фильтр, а затем ребамипид, стерилизованный с помощью асептических манипуляций, добавляют к фильтрату, а затем смесь перемешивают с помощью магнитной мешалки с получением водной фармацевтической суспензии. Водную фармацевтическую суспензию асептически распределяют в 0,3-5-мл пластиковые емкости для однократного дозирования с получением препарата для ингаляций. В случае использования препарата для ингаляций все количество препарата для ингаляций инжектируется в распылитель, необязательно разбавляется другим препаратом для ингаляций или физиологическим раствором, распыляется, а затем вдыхается пациентом при введении.
Пример 9 : Препарат в виде геля
Поливиниловый спирт растворяют в половине заранее заданного количества очищенной воды, к нему добавляют ребамипид и смесь перемешивают с помощью магнитной мешалки с получением водной фармацевтической суспензии. Отдельно карбоксивиниловый полимер растворяют в оставшейся очищенной воде, а затем к раствору добавляют другие ингредиенты с получением раствора, содержащего карбоксивиниловый полимер. Указанную выше водную фармацевтическую суспензию и указанный выше раствор, содержащий карбоксивиниловый полимер, смешивают, при этом устанавливают pH, и смесь образует гель, с получением препарата геля. Препарат геля, полученный выше, заполняют в 3-20-мл пластиковые или алюминиевые тюбики.
Пример 10 : Препарат геля
Поливиниловый спирт растворяют в половине заранее заданного количества очищенной воды, к нему добавляют ребамипид, и смесь перемешивают с помощью магнитной мешалки с получением водной фармацевтической суспензии. Отдельно, карбоксивиниловый полимер растворяют в оставшейся очищенной воде, а затем к раствору добавляют другие ингредиенты с получением раствора, содержащего карбоксивиниловый полимер. Рассмотренную выше водную фармацевтическую суспензию и рассмотренный выше раствор, содержащий карбоксивиниловый полимер, смешивают, при этом устанавливают pH, смесь желатинизируют с получением препарата в виде геля. Препарат в виде геля, полученный выше, переносят, в 3-20-мл пластиковые или алюминиевые тюбики.
Пример 11 : Препарат в виде мази
Поливиниловый спирт и хлорид натрия растворяют в очищенной воде. К ним добавляют ребамипид и смесь перемешивают с помощью магнитной мешалки с получением водной фармацевтической суспензии. Альтернативно, белый вазелин нагревают до плавления и в нем растворяют метилпарабен и пропилпарабен. После необязательного охлаждения водную фармацевтическую суспензию, полученную выше, добавляют к смеси. Смесь гомогенизируют с получением препарата в виде мази. Препарат мази, полученный выше, переносят в 3-20-мл пластиковые или алюминиевые тюбики для мази.
Эксперимент 1: Исследование долговременной стабильности
Офтальмологические препараты из Примеров 5 и 6, полученные выше, хранят при условиях 25°C/60% RH (относительной влажности) в течение 36 месяцев и последовательно измеряют процент оставшегося ребамипида, осмотическое давление, pH и средний размер частиц ребамипида. Измерение размера частиц ребамипида осуществляют с использованием лазерного дифрактометра (Shimadzu SALD-3000J).
В результате во всех временных точках измерения (то есть до хранения и после хранения, 12, 24 и 36 месяцев) все результаты по проценту оставшегося ребамипида, осмотическому давлению, pH и среднему размеру частиц удовлетворяют критериям (процент оставшегося ребамипида составляет 90% или выше, осмотическое давление составляет 245-325 мОсм, pH равен 5-7 и средний размер частиц равен 0,5-5 мкм). Соответственно, подтверждается, что ребамипид в состоянии мелкодисперсных частиц может храниться как стабильная суспензия мелкодисперсных частиц ребамипида без осаждения или агглютинации при исследованиях долговременной стабильности.
Эксперимент 2: Измерение среднего размера частиц
Суспензии (Пример 12 и Сравнительный пример 1,) показанные в Таблице 1, получают в соответствии со следующей методикой. Прежде всего, ингредиенты отличные от ребамипида, нагреваются для растворения в очищенной воде. Затем к раствору добавляют ребамипид, и смесь перемешивают при комнатной температуре в течение 1 часа с помощью магнитной мешалки (мешалка Teflon™ 30 мм, примерно 500 об/мин), с получением его суспензии. Размер частиц ребамипида в полученной суспензии измеряют с использованием лазерного дифрактометра (Shimadzu SALD-3000J).
для препарата
пример 1
Результаты показаны на фиг. 1. "A" на фиг. 1 показывает распределение частиц суспензии ребамипида в Примере 12, и "B" показывает распределение частиц суспензии ребамипида в Сравнительном примере 1. С помощью этих результатов подтверждается, что ребамипид диспергируется при размере частиц 1 мкм или меньше, когда его перемешивают с помощью магнитной мешалки в присутствии поливинилового спирта, а затем ребамипид в суспензии диспергируется как состояние мелкодисперсных частиц (смотри таблицу 1, A). В противоположность этому подтверждается, что ребамипид диспергируется при размере частиц 30 мкм или больше, когда его перемешивают с помощью магнитной мешалки без поливинилового спирта, и тогда ребамипид в суспензии находится в агглютинированном состоянии с образованием его вторичных частиц (смотри таблицу 1, B).
В соответствии с рассмотренными выше результатами ясно, что ребамипид может диспергироваться до состояния мелкодисперсных частиц без использования специального диспергирующего/суспендирующего устройства для сильного перемешивания, когда используют поливиниловый спирт.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2538694C2 |
| ВОДНАЯ ОФТАЛЬМОЛОГИЧЕСКАЯ СУСПЕНЗИЯ КРИСТАЛЛИЧЕСКОГО РЕБАМИПИДА | 2005 |
|
RU2398585C2 |
| НОВАЯ ОФТАЛЬМОЛОГИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ РЕБАМИПИД, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2016 |
|
RU2706353C1 |
| ВОДНАЯ СУСПЕНЗИЯ, СОДЕРЖАЩАЯ НАНОЧАСТИЦЫ ГЛЮКОКОРТИКОСТЕРОИДА | 2016 |
|
RU2747803C2 |
| Фармацевтическая композиция на основе трамадола для офтальмологического применения | 2016 |
|
RU2744570C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ИБУПРОФЕНА И ТРАМАДОЛА ДЛЯ ОФТАЛЬМОЛОГИЧЕСКОГО ПРИМЕНЕНИЯ | 2014 |
|
RU2694369C2 |
| СУСПЕНЗИИ НАНОЧАСТИЦ, СОДЕРЖАЩИЕ КАРБОКСИВИНИЛОВЫЙ ПОЛИМЕР | 2010 |
|
RU2571078C2 |
| ОФТАЛЬМОЛОГИЧЕСКИЙ ПРЕПАРАТ В ВИДЕ ГЛАЗНЫХ КАПЕЛЬ, СОДЕРЖАЩИЙ РАЗВЕТВЛЕННЫЕ ПОЛИГЕКСАМЕТИЛЕНГУАНИДИНЫ | 2012 |
|
RU2510264C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ВОДНОЙ СУСПЕНЗИИ И ВОДНЫЙ ГЛАЗНОЙ ПРЕПАРАТ | 1992 |
|
RU2098094C1 |
| СТАБИЛЬНЫЙ ВОДНЫЙ РАСТВОР | 2014 |
|
RU2665639C2 |
Изобретение относится к водной фармацевтической суспензии, которая содержит мелкодисперсный ребамипид с размером частиц 0,2-5 мкм и поливиниловый спирт. Изобретение также относится к способу получения указанной суспензии ребамипида, который включает смешивание воды и поливинилового спирта с получением водного раствора, добавление мелкодисперсных частиц ребамипида к указанному раствору и перемешивание с получением водной суспензии ребамипида. Изобретение обеспечивает получение суспензии, в которой ребамипид может стабильно диспергироваться как мелкодисперсные частицы без их агглютинации, что позволяет хранить суспензию в течение длительного времени. 2 н. и 4 з.п. ф-лы, 1 ил., 1 табл., 13 пр.
1. Фармацевтическая водная суспензия, содержащая мелкодисперсные частицы ребамипида, у которых средний размер частиц составляет 0,2-5 мкм, и поливиниловый спирт.
2. Водная суспензия по п.1, дополнительно содержащая соединение соли натрия.
3. Водная суспензия по п.1 или 2, в которой ребамипид составляет 0,1-30% мас./об. и поливиниловый спирт составляет 0,1-4% мас./об.
4. Водная суспензия по любому из пп.1 или 2, которая представляет собой офтальмологическую композицию.
5. Водная суспензия по п.3, которая представляет собой офтальмологическую композицию.
6. Способ получения фармацевтической водной суспензии, содержащей ребамипид, который включает в себя
(1) первую стадию: смешивание воды и поливинилового спирта с получением водного раствора, содержащего поливиниловый спирт, и
(2) вторую стадию: добавление мелкодисперсных частиц ребамипида, у которых средний размер частиц составляет 0,2-5 мкм, к водному раствору, содержащему поливиниловый спирт, полученному на первой стадии, и перемешивание смеси, с получением водной суспензии, содержащей ребамипид.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
Авторы
Даты
2012-11-27—Публикация
2007-10-24—Подача